PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
GESHA YULIANI NATTASYA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
PENGARUH SEDIMEN BERMINYAK TERHADAP PERTUMBUHAN MIKROALGA Isochrysis sp.
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 10 Agustus 2009
RINGKASAN
GESHA YULIANI NATTASYA. C54050104. PENGARUH SEDIMEN
BERMINYAK TERHADAP PERTUMBUHAN MIKROALGA Isochrysis
sp. Dibimbing oleh : RICHARDUS F. KASWADJI dan DWI HINDARTI.
Pencemaran laut menurut UU No.23 Tahun 1997 adalah masuknya atau dimasukkannya makhluk hidup, zat, energi, dan atau komponen lain ke dalam lingkungan oleh kegiatan manusia sehingga kualitasnya turun hingga tingkat tertentu yang menyebabkan lingkungan tersebut tidak dapat berfungsi sesuai peruntukannya. Dari semua polutan yang mencemari laut, polutan yang berasal dari hidrokarbon memperoleh perhatian yang sangat besar, karena dapat
menurunkan kualitas laut, baik secara langsung maupun tidak langsung. Dampak tersebut antara lain adalah lingkungan laut (pantai) akan menjadi kotor akibat tertutup lapisan minyak atau gumpalan ter di permukaan dan berpengaruh terhadap kelangsungan hidup biota dalam lingkungan ekologi. Salah satu cara untuk mengurangi dampak tersebut adalah bioremediasi, namun hasil
bioremediasi tersebut dapat menghasilkan hasil akhir yang bersifat racun (toxic). Pengujian pengaruh toksisitas dari bahan pencemar dapat dilakukan dengan cara mengambil sampel biota dari daerah yang tercemar atau mengujikan bahan pencemar tersebut terhadap biota dalam skala yang lebih kecil (laboratorium). Biota yang diujikan adalah biota yang digunakan adalah biota bentik atau biota yang memegang peranan penting dalam jaring-jaring makanan, seperti
fitoplankton.
Penelitian ini merupakan kerja sama antara Laboratorium Ekotoksikologi Pusat Penelitian Oseanografi (P2O) LIPI dengan Laboratorium Mikrobiologi P2O LIPI serta National Institute of Technology and Evaluation (NITE), sebuah organisasi penelitian yang berasal dari Jepang. Tujuan dari penelitian ini adalah pengujian lapisan sedimen, pengujian perlakuan selama bioremediasi serta pengujian Total Petroleum Hydrocarbon residu terhadap jumlah sel selama waktu uji.
Pada penelitian ini, sedimen yang digunakan adalah sedimen bioremediasi dengan menggunakan minyak dan pupuk selama 125 hari di Perairan Pulau Pari, Kepulauan Seribu, DKI Jakarta. Sedimen yang telah terkontaminasi ini
kemudian diujikan dalam laboratorium untuk melihat pengaruhnya terhadap pertumbuhan fitoplankton, khususnya Isochrysis sp. Prosedur yang digunakan adalah prosedur Asean Canada Cooperative Programme on Marine Science
(1995) dengan lama uji 96 jam. Biota uji yang digunakan adalah Isochrysis sp.
yang berperan penting dalam rantai makanan sebagai produsen dalam lingkungan akuatik dan sensitif terhadap perubahan lingkungan.
mengetahui konsentrasi terendah dan tertinggi (NOEC dan LOEC) dari perlakuan yang berpengaruh terhadap pertumbuhan mikroalga Isochrysis sp.
Pengukuran kualitas air diperoleh kisaran DO sebesar 0.49-5.36 mg/l, kisaran pH sebesar 8.01-8.43 dan suhu berkisar 25.8-26.9 0C dengan salinitas sebesar 32 %o. Pengukuran toksiksitas sedimen yang terkontaminasi minyak
menghasilkan IC50 sebesar 30.4 g TPH residu yang diekstrak dari sedimen
bioremediasi dan NOEC serta LOEC yang berada pada lapisan atas dengan perlakuan dengan penambahan osmocot sebesar 200 g (C6) dan penambahan
osmocot sebesar 2 g (C3). Nilai NOEC dan LOEC hanya berada pada lapisan atas karena pada lapisan ini memiliki pengaruh yang signifikan dari jumlah sel mikroalga jika dibandingkan dengan lapisan lain. Penghambatan pertumbuhan sel mikroalga Isochrysis sp. pada masing- masing perlakuan dipengaruhi oleh konsentrasi crude oil dan osmocot yang diberikan pada proses bioremediasi di lapangan. Hasil dari proses bioremediasi di lapangan selama 125 hari akan menghasilkan konsentrasi TPH (Total Petroleum Hydrocarbon) dalam sedimen dan akan terlarut dalam larutan uji untuk pertumbuhan mikroalga. Semakin tinggi konsentrasi TPH dalam sedimen maka semakin berpengaruh terhadap penghambatan mikroalga dan hal tersebut dapat dilihat dari nilai
penghambatannya. Hasil pengujian toksisitas ini menunjukan perlakuan untuk proses bioremediasi yang tidak memberikan pengaruh toksik bagi biota
© Hak cipta milik Gesha Yuliani Nattasya, tahun 2009
Hak cipta dilindungi
PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
GESHA YULIANI NATTASYA C54050104
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
Nama : GESHA YULIANI NATTASYA
NRP : C54050104
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir Richardus Kaswadji, MSc Ir. Dwi Hindarti, M.Sc NIP. 19450405 197301 1 001 NIP. 19610501 198603 2 003
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP.19610410 198601 1 002
KATA PENGANTAR
Puji syukur kepada ALLAH SWT karena dengan rahmat dan karuniaNya kepada penulis hingga dapat melewati segala cobaan dan mampu menyelesaikan penelitian ini dengan sebaik-baiknya.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih sebesar-besarnya kepada : Dr. Ir Richardus Kaswadji M. Sc dan Ir. Dwi Hindarti M.Sc selaku dosen pembimbing yang telah memberikan pengarahan dan motivasi kepada penulis selama penelitian dan penulisan ilmiah, Dr. Ir. Tri Prartono, M.Sc sebagai penguji tamu, Dr. Ir Henry M. Manik, M.T sebagai Koordinator Program Pendidikan S1 Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Dr. Ir. Neviaty P. Zamani sebagai
pembimbing akademik, Laboratorium Ekotoksikologi dan Laboratorium Mikrobiologi, Pusat Penelitian Oseanografi (P2O) LIPI atas kesempatan yang diberikan kepada penulis untuk dapat ikut serta dalam proyek penelitian, Triyoni Purbonegoro, S.Si, Rachma Puspitasari, S.Si, Suratno Kisworo, S.Si, Bapak Rozak. Amd, Bapak Eston. Amd, Ir. Yeti Darmayati, M.Sc dan Sdr. Dahlia Ristiyani yang telah membantu penulis dalam pengolahan data, dan kedua orangtua beserta keluarga besar yang turut memotivasi penulis selama penelitian.
Akhir kata, semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, 10 Agustus 2009
viii
DAFTAR ISI
Halaman
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 3
2. TINJAUAN PUSTAKA ... 4
2.1. Kondisi Umum Lokasi ... 4
2.2. Karakteristik dan Komposisi Sedimen ... 5
2.3. Minyak ... 6
2.3.1. Sumber Pencemaran Minyak ... 7
2.3.2. Karakteristik Minyak ... 7
2.3.3. Toksiksitas Minyak ... 8
2.3.4. Pengaruh Minyak terhadap Biota Akuatik ... 10
2.3.5. Interaksi Minyak dan Sedimen ... 11
2.4. Uji Toksisitas Sedimen ... 12
2.4.1. Uji Toksisitas ... 12
2.4.2. Mikroalga sebagai Biota Uji Toksiksitas ... 14
2.5. Biota Uji ... 16
3. METODOLOGI PENELITIAN ... 19
3.1. Waktu dan tempat penelitian ... 19
3.2. Alat dan bahan ... 19
3.2.1. Alat Pemeliharaan Kultur Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH)... .... 19
3.2.2. Bahan Pemeliharaan Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH) ... 20
3.3. Cara Kerja ... 20
3.3.1. Pengambilan Contoh Sedimen ... 20
3.3.2. Pencucian dan Sterilisasi Peralatan ... 24
3.3.3. Pemeliharaan Kultur. ... 24
3.3.4. Uji Toksiksitas Sedimen ... 27
3.3.5. Pengukuran Kualitas Air ... 28
3.3.6. Pengukuran Total Petroleum Hydrocarbon (TPH) ... 28
3.3.7. Analisis Data ... 29
4. HASIL DAN PEMBAHASAN... ... 34
PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
GESHA YULIANI NATTASYA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
PENGARUH SEDIMEN BERMINYAK TERHADAP PERTUMBUHAN MIKROALGA Isochrysis sp.
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 10 Agustus 2009
RINGKASAN
GESHA YULIANI NATTASYA. C54050104. PENGARUH SEDIMEN
BERMINYAK TERHADAP PERTUMBUHAN MIKROALGA Isochrysis
sp. Dibimbing oleh : RICHARDUS F. KASWADJI dan DWI HINDARTI.
Pencemaran laut menurut UU No.23 Tahun 1997 adalah masuknya atau dimasukkannya makhluk hidup, zat, energi, dan atau komponen lain ke dalam lingkungan oleh kegiatan manusia sehingga kualitasnya turun hingga tingkat tertentu yang menyebabkan lingkungan tersebut tidak dapat berfungsi sesuai peruntukannya. Dari semua polutan yang mencemari laut, polutan yang berasal dari hidrokarbon memperoleh perhatian yang sangat besar, karena dapat
menurunkan kualitas laut, baik secara langsung maupun tidak langsung. Dampak tersebut antara lain adalah lingkungan laut (pantai) akan menjadi kotor akibat tertutup lapisan minyak atau gumpalan ter di permukaan dan berpengaruh terhadap kelangsungan hidup biota dalam lingkungan ekologi. Salah satu cara untuk mengurangi dampak tersebut adalah bioremediasi, namun hasil
bioremediasi tersebut dapat menghasilkan hasil akhir yang bersifat racun (toxic). Pengujian pengaruh toksisitas dari bahan pencemar dapat dilakukan dengan cara mengambil sampel biota dari daerah yang tercemar atau mengujikan bahan pencemar tersebut terhadap biota dalam skala yang lebih kecil (laboratorium). Biota yang diujikan adalah biota yang digunakan adalah biota bentik atau biota yang memegang peranan penting dalam jaring-jaring makanan, seperti
fitoplankton.
Penelitian ini merupakan kerja sama antara Laboratorium Ekotoksikologi Pusat Penelitian Oseanografi (P2O) LIPI dengan Laboratorium Mikrobiologi P2O LIPI serta National Institute of Technology and Evaluation (NITE), sebuah organisasi penelitian yang berasal dari Jepang. Tujuan dari penelitian ini adalah pengujian lapisan sedimen, pengujian perlakuan selama bioremediasi serta pengujian Total Petroleum Hydrocarbon residu terhadap jumlah sel selama waktu uji.
Pada penelitian ini, sedimen yang digunakan adalah sedimen bioremediasi dengan menggunakan minyak dan pupuk selama 125 hari di Perairan Pulau Pari, Kepulauan Seribu, DKI Jakarta. Sedimen yang telah terkontaminasi ini
kemudian diujikan dalam laboratorium untuk melihat pengaruhnya terhadap pertumbuhan fitoplankton, khususnya Isochrysis sp. Prosedur yang digunakan adalah prosedur Asean Canada Cooperative Programme on Marine Science
(1995) dengan lama uji 96 jam. Biota uji yang digunakan adalah Isochrysis sp.
yang berperan penting dalam rantai makanan sebagai produsen dalam lingkungan akuatik dan sensitif terhadap perubahan lingkungan.
mengetahui konsentrasi terendah dan tertinggi (NOEC dan LOEC) dari perlakuan yang berpengaruh terhadap pertumbuhan mikroalga Isochrysis sp.
Pengukuran kualitas air diperoleh kisaran DO sebesar 0.49-5.36 mg/l, kisaran pH sebesar 8.01-8.43 dan suhu berkisar 25.8-26.9 0C dengan salinitas sebesar 32 %o. Pengukuran toksiksitas sedimen yang terkontaminasi minyak
menghasilkan IC50 sebesar 30.4 g TPH residu yang diekstrak dari sedimen
bioremediasi dan NOEC serta LOEC yang berada pada lapisan atas dengan perlakuan dengan penambahan osmocot sebesar 200 g (C6) dan penambahan
osmocot sebesar 2 g (C3). Nilai NOEC dan LOEC hanya berada pada lapisan atas karena pada lapisan ini memiliki pengaruh yang signifikan dari jumlah sel mikroalga jika dibandingkan dengan lapisan lain. Penghambatan pertumbuhan sel mikroalga Isochrysis sp. pada masing- masing perlakuan dipengaruhi oleh konsentrasi crude oil dan osmocot yang diberikan pada proses bioremediasi di lapangan. Hasil dari proses bioremediasi di lapangan selama 125 hari akan menghasilkan konsentrasi TPH (Total Petroleum Hydrocarbon) dalam sedimen dan akan terlarut dalam larutan uji untuk pertumbuhan mikroalga. Semakin tinggi konsentrasi TPH dalam sedimen maka semakin berpengaruh terhadap penghambatan mikroalga dan hal tersebut dapat dilihat dari nilai
penghambatannya. Hasil pengujian toksisitas ini menunjukan perlakuan untuk proses bioremediasi yang tidak memberikan pengaruh toksik bagi biota
© Hak cipta milik Gesha Yuliani Nattasya, tahun 2009
Hak cipta dilindungi
PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
GESHA YULIANI NATTASYA C54050104
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : PENGARUH SEDIMEN BERMINYAK TERHADAP
PERTUMBUHAN MIKROALGA Isochrysis sp.
Nama : GESHA YULIANI NATTASYA
NRP : C54050104
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir Richardus Kaswadji, MSc Ir. Dwi Hindarti, M.Sc NIP. 19450405 197301 1 001 NIP. 19610501 198603 2 003
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP.19610410 198601 1 002
KATA PENGANTAR
Puji syukur kepada ALLAH SWT karena dengan rahmat dan karuniaNya kepada penulis hingga dapat melewati segala cobaan dan mampu menyelesaikan penelitian ini dengan sebaik-baiknya.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih sebesar-besarnya kepada : Dr. Ir Richardus Kaswadji M. Sc dan Ir. Dwi Hindarti M.Sc selaku dosen pembimbing yang telah memberikan pengarahan dan motivasi kepada penulis selama penelitian dan penulisan ilmiah, Dr. Ir. Tri Prartono, M.Sc sebagai penguji tamu, Dr. Ir Henry M. Manik, M.T sebagai Koordinator Program Pendidikan S1 Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Dr. Ir. Neviaty P. Zamani sebagai
pembimbing akademik, Laboratorium Ekotoksikologi dan Laboratorium Mikrobiologi, Pusat Penelitian Oseanografi (P2O) LIPI atas kesempatan yang diberikan kepada penulis untuk dapat ikut serta dalam proyek penelitian, Triyoni Purbonegoro, S.Si, Rachma Puspitasari, S.Si, Suratno Kisworo, S.Si, Bapak Rozak. Amd, Bapak Eston. Amd, Ir. Yeti Darmayati, M.Sc dan Sdr. Dahlia Ristiyani yang telah membantu penulis dalam pengolahan data, dan kedua orangtua beserta keluarga besar yang turut memotivasi penulis selama penelitian.
Akhir kata, semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, 10 Agustus 2009
viii
DAFTAR ISI
Halaman
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 3
2. TINJAUAN PUSTAKA ... 4
2.1. Kondisi Umum Lokasi ... 4
2.2. Karakteristik dan Komposisi Sedimen ... 5
2.3. Minyak ... 6
2.3.1. Sumber Pencemaran Minyak ... 7
2.3.2. Karakteristik Minyak ... 7
2.3.3. Toksiksitas Minyak ... 8
2.3.4. Pengaruh Minyak terhadap Biota Akuatik ... 10
2.3.5. Interaksi Minyak dan Sedimen ... 11
2.4. Uji Toksisitas Sedimen ... 12
2.4.1. Uji Toksisitas ... 12
2.4.2. Mikroalga sebagai Biota Uji Toksiksitas ... 14
2.5. Biota Uji ... 16
3. METODOLOGI PENELITIAN ... 19
3.1. Waktu dan tempat penelitian ... 19
3.2. Alat dan bahan ... 19
3.2.1. Alat Pemeliharaan Kultur Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH)... .... 19
3.2.2. Bahan Pemeliharaan Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH) ... 20
3.3. Cara Kerja ... 20
3.3.1. Pengambilan Contoh Sedimen ... 20
3.3.2. Pencucian dan Sterilisasi Peralatan ... 24
3.3.3. Pemeliharaan Kultur. ... 24
3.3.4. Uji Toksiksitas Sedimen ... 27
3.3.5. Pengukuran Kualitas Air ... 28
3.3.6. Pengukuran Total Petroleum Hydrocarbon (TPH) ... 28
3.3.7. Analisis Data ... 29
4. HASIL DAN PEMBAHASAN... ... 34
ix
4.2. Kualitas Air... 35
4.3. Uji Toksisitas Sedimen ... 37
4.4. Uji Toksisitas Sedimen antar perlakuan... 40
4.5. Total Petroleum Hydrocarbon (TPH) residu... 44
5. KESIMPULAN DAN SARAN... 49
5.1. Kesimpulan... 49
5.2. Saran... 50
DAFTAR PUSTAKA ... 51
LAMPIRAN... 55
x
DAFTAR TABEL
Halaman
1. Sensitivitas biota akuatik terhadap pemaparan hidrokarbon dan
turunannya.………. ... 9 2. Perkiraan dampak minyak dan tingkat pemulihannya terhadap tipe Komunitas dan Populasi Laut... 10 3. Berbagai perlakuan pada masing-masing tabung... 22 4. Susunan bagiansedimen dalam satu tabung... 23 5. Komposisi bahan-bahan media walne bagi pemeliharaan
Isochrysis sp. ... 26 6. Hasil analisis kualitas air pada berbagai lapisan
menurut perlakuan ………... 36 7. Persentase penghambatan pertumbuhan rata-rata pada setiap lapisan
sedimen... 39 8. Kandungan Total Petroleum Hydrocarbon (gram) tersisa dalam setiap
lapisan dan perlakuan ... 44
xi
DAFTAR GAMBAR
Halaman
1. Berbagai proses perubahan fisik dan kimia dari minyak... 12 2. Kurva pertumbuhan mikroalga dalam sistem tertutup... 16 3. Berbagai bentuk Isochrysis sp. ... 17 4. Peta Lokasi Pengambilan sampel Sedimen di Pulau Pari,
Kepulauan Seribu DKI Jakarta... 21 5. Langkah-langkah penelitian dalam analisis data statistik... 33 6. Kurva pertumbuhan Mikroalga Isochrysis sp. dalam tiga kali kultur... 34 7. Jumlah sel Isochrysis sp (sel/ml) pada kontrol dan 3 lapisan
sedimen yang diujikan... 38 8. Pertumbuhan sel Isochrysis sp. (sel/ml) selama 48, 72 dan
96 jam dalam lapisan uji yang berbeda... 39 9. Jumlah sel Isochrysis sp. (sel/ml) berdasarkan perlakuan
di lapisan atas... 41 10. Pertumbuhan sel Isochrysis sp. (sel/ml) selama 48, 72 dan 96 jam
pengamatan di lapisan atas dengan perlakuan yang berbeda... 43 11. Respon jumlah sel mikroalga Isochrysis sp. (sel/ml) terhadap konsentrasi residu Total Petroleum Hydrocarbon (TPH)... 45 12. Respon penghambatan mikroalga Isochrysis sp. (%) terhadap konsentrasi residu Total Petroleum Hydrocarbon (TPH)... 47
xii
DAFTAR LAMPIRAN
Halaman
1. Alat dan Bahan Penelitian ………... 56 2. Skema tabung perlakuan dalam proses bioremediasi skala mesoskom di perairan pulau Pari... 57 3. Penempatan sumur buatan di perairan pulau Pari, DKI Jakarta... 58 4. Perhitungan jumlah sel Isochrysis sp. menggunakan haemocytometer ... 59 5. Contoh Overlying Water Sedimen Contaminant yang digunakan ……… 60 6. Langkah Kerja ekstraksi kandungan TPH (Total Petroleum Hydrocarbon) dengan menggunakan TPH Analyzer………. 61
1
1.
PENDAHULUAN
1.1. Latar belakang
Pencemaran memiliki definisi yang berbeda-beda, Miller (2004) mengatakan bahwa pencemaran adalah sebarang penambahan pada udara, air dan tanah atau makanan yang membahayakan kesehatan, ketahanan atau kegiatan manusia atau organisme lainnya. Berdasarkan Undang Undang No. 23 Tahun 1997 (Redaksi, 2000), pencemaran adalah masuknya atau dimasukkannya makhluk hidup, zat, energi, dan atau komponen lain ke dalam lingkungan oleh kegiatan manusia sehingga kualitasnya menurun sampai tingkat tertentu yang menyebabkan lingkungan tersebut tidak dapat berfungsi sesuai peruntukannya.
Secara lebih spesifik, Kantor Kementrian Lingkungan Hidup (KLH, 1991) mendefinisikan pencemaran laut adalah masuknya zat atau energi secara langsung maupun tidak langsung oleh kegiatan manusia kedalam lingkungan laut termasuk daerah pesisir pantai, sehingga dapat menimbulkan akibat merugikan baik terhadap kegiatan di laut, termasuk perikanan dan penggunaan lain-lain yang dapat menyebabkan penurunan tingkat kualitas air laut. Bahan pencemar yang masuk kedalam lingkungan laut ini dapat berupa limbah yang berasal dari kegiatan industri, pertambangan, pengembangan kota maupun pengalihan fungsi dari wilayah pesisir. Bahan pencemar ini akan menjadi sumber masalah bagi kehidupan manusia jika terekspos baik secara langsung atau tidak langsung,
2 pengaruh terhadap perubahan lingkungan. Biota yang dapat diujikan adalah biota bentik atau biota yang memegang peranan penting dalam jaring-jaring makanan, seperti fitoplankton.
Penelitian toksisitas sedimen hasil proses bioremediasi terhadap fitoplankton merupakan penelitian yang belum banyak dilakukan. Penelitian serupa yang sudah pernah dilakukan adalah pendekatan studi mesoskom polusi minyak yang dilakukan oleh Zhu et. al (1991). Studi ini mampu menunjukkan adanya pengaruh terhadap kehidupan ekosistem laut pelagik di kawasan estuari Changjiang, China. Hal ini diindikasikan dengan perubahan produktivitas primer sebagai respon keberadaan polusi minyak yang diujikan dalam wadah mesoskom. Bahan tercemar ini juga mempengaruhi pertumbuhan nanophytoplankton (2-20µm) dan produktivitas bakteri.
3
Asean Canada Cooperative Programe on Marine Science (ACCPMS) (1995) dengan lama uji 96 jam. Pemilihan biota uji ini ddasarkan pada peran pentingnya dalam rantai makanan sebagai produsen dalam lingkungan akuatik dan sensitif terhadap perubahan lingkungan.
1.2. Tujuan
Tujuan dari penelitian ini adalah :
1. Menguji lapisan dan perlakuan yang berpengaruh terhadap pertumbuhan dengan melihat nilai NOEC dan LOEC.
2. Menguji konsentrasi Total Petroleum Hydrocarbon (TPH) residu dari sedimen bioremediasi yang berpengaruh terhadap penghambatan pertumbuhan sebesar 50% dari populasi awal (IC50).
4
2.
TINJAUAN PUSTAKA
2.1. Kondisi Umum Lokasi
Redaksi (2009) mendeskripsikan bahwa gugusan Pulau Pari terletak pada bagian selatan pulau-pulau di Kepulauan Seribu, DKI Jakarta. Gugusan ini terletak sekitar 40 km barat laut Jakarta dengan batas-batas yang terletak
05046’15” LS-05059’30” LS dan 106026’00” BT-106034’22” BT. Gugusan Pulau Pari merupakan sekumpulan pulau-pulau yang terdiri dari Pulau Tikus, Pulau Burung, Pulau Kongsi, Pulau Tengah, dan Pulau Pari. Terdapat delapan goba yang mengelilingi gugusan antara lain Goba Soa Besar, Goba Kuanji, Goba Lapangan Pasir, Goba Ciaris, Goba Besar 1, Goba Besar II, Goba Kurungan, dan Goba Buntu. Pulau Pari merupakan pulau terbesar dari lima pulau penyusun gugusan pulau Pari. Pulau Pari memiliki panjang sekitar 2.5 km dengan lebar bagian terpendek sekitar 60 m dan lebar bagian terpanjang adalah 400 m.
Rahman (2008) menyatakan komposisi fraksi sedimen di Pulau Pari didominasi oleh fraksi pasir dan hal tersebut tidak terlepas dari kondisi lingkungan sekitar yang membantu pembentukan sedimen. Pulau Pari secara geologi termasuk wilayah yang terdiri dari campuran pembentukan pulau karang timbul dan pulau karang atol yang dipengaruhi oleh gerakan permukaan dasar laut. Terumbu karang ini berkembang dengan baik di bawah laut dan suatu saat terangkat ke permukaan karena gerakan dasar laut. Setelah berada di permukaan terumbu karang akan mati dan menyisakan ruang yang pada akhirnya membentuk pulau karang timbul
5 Pulau Pari. Rumah karang yang tertinggal berupa pecahan-pecahan karang yang secara perlahan akan terendapkan. Sumbangan lain yang mendukung adalah proses abrasi atau erosi yang terjadi. Proses ini akan melepas materi tanah yang didominasi pasir ke arah pantai yang diakibatkan oleh arus, pasut dan gelombang. Ukuran partikel sedimen yang kasar akan mudah terendapkan ketika terbawa arus menjauhi pantai
2.2. Karakteristik dan Komposisi sedimen.
Kata sedimen berasal dari bahasa Latin sedimentum yang artinya endapan. Selama susunan lapisan belum berubah atau terbalik maka lapisan termuda berada pada lapisan atas dan lapisan tertua berada pada lapisan bawah. Prinsip tersebut dikenal sebagai prinsip superposition. Susunan lapisan tersebut adalah dasar dari skala waktu stratigrafi atau skala waktu pengendapan (Blott dan Kenneth, 2001). Sedimen merupakan pecahan material yang melayang layang dalam udara, air, maupun dikumpulkan di dasar sungai atau laut oleh pembawa atau perantara alami lainnya (Shirley, 1987). Sedimen yang ditemukan di daerah pesisir atau perairan dangkal, terutama dihasilkan melalui proses pelapukan dan erosi batuan di daratan. Ukuran butir sedimen memberikan informasi mengenai gaya yang dialami sedimen hingga butiran tersebut terlepas atau bergerak. Besaran butiran juga mengindikasikan sifat kohesif dan non kohesif dari suatu sedimen (Pethick, 1984).
6 1. Transformasi adalah perubahan bahan pencemar dari segi konsentrasi atau
perubahan sifat kimia- fisik bahan pencemar atau fenomena fisik yang terjadi secara biotis (akibat aktivitas mikroorganisme) dan abiotis. Proses transformasi ini terjadi pada bidang kontak partikel tanah dengan bahan pencemar.
2. Transfer massa adalah mekanisme yang terjadi karena adanya mekanisme transfer massa atau perubahan massa bahan pencemar akibat proses fisik. Mekanisme ini melibatkan proses difusi, adveksi dan volatilisasi.
Notodarmodjo (2005) juga menyatakan bahwa pada transformasi biologis seperti proses bioremediasi, partikel sedimen berperan sebagai media
mikroorganisme menempel dan membantu memberikan efek katalis sedangkan mikroorganisme berperan dalam aktivitas biotransformasi. Pada kasus
pencemaran dengan bahan organik, mikroorganisme menggunakan oksigen sebagai proses oksidasi awal hingga selanjutnya menggunakan nitrat dalam proses anaerob.
2.3. Minyak
7 sifat dan bahan kimiawi minyak yang tumpah serta kepekaan ekosistem terhadap tumpahan minyak tersebut.
2.3.1. Sumber pencemaran minyak
Petroleum hydrocarbon masuk ke lingkungan perairan dengan beberapa cara yakni rembesan alam (natural seeps), kecelakaan tanker (tanker accident), operasi normal tanker (normal operation of tanker), kebocoran dan semburan dari
poduksi dan eksplorasi lepas pantai, kilang minyak di darat, limbah kota dan jatuhan dari atmosfer. Sumber hidrokarbon alami terbesar di dunia adalah dari alam. Sekarang telah teridentifikasi sebanyak 190 lokasi rembesan dari dasar laut, terutama di daerah perairan dalam dan area aktivitas tektonik (Mukhtasor, 2008). 2.3.2. Karakteristik minyak
Minyak bumi terbentuk sebagai hasil dari penguraian bahan-bahan organik yang tertimbun selama berjuta-juta tahun lalu di kerak bumi baik di bagian daratan atau lepas pantai. Minyak bumi mentah (crude oil) yang baru keluar dari sumur eksplorasi mengandung ribuan macam zat kimia yang berbeda baik dalam bentuk gas, cair atau padatan. Senyawa utama yang terdapat dalam minyak bumi adalah alifatik (paraffinic hydrocarbon), alisiklik (napthenic hydrocarbon) dan
aromatic (Supriharyono, 2002).
8 beracun dan tidak dapat diuraikan secara biologis oleh mikroba (Mukhtasor, 2008).
Komponen alisiklik atau napthene berbentuk cincin yang tersusun dari 5-6 atom karbon dan sangat stabil dan tahan terhadap oksidasi. Cyclopentene dan
cyclohexane adalah bicyclic dan polysiclic napthene yang tahan (resistance) dan sulit dihancurkan oleh mikroba. Jumlah senyawa ini umumnya dominan dalam minyak bumi yaitu sekitar 30-40% (Mukhtasor, 2008).
Komponen hidrokarbon aromatik jumlahnya relatif lebih kecil jika dibandingkan dengan senyawa hidrokarbon lainnya yaitu hanya sekitar 2-4%. Senyawa aromatik paling sederhana adalah benzene yang berbentuk cincin dengan enam cincin benzene yang terjalin bersama. Secara umum komponen aromatic lebih beracun dan sangat mudah berubah menjadi uap (Supriharyono, 2002).
Selain hidrokarbon, minyak bumi juga mengandung senyawa lain yakni nitrogen (0-0.09%), belerang (0-1%) dan oksigen (0-2%) dan komponen logam yang mencapai 40 %. Umumnya komponen logam yang paling dominan adalah nikel dan vanadium (Mukhtasor, 2008).
2.3.3. Toksisitas minyak
Semua minyak mentah dan beberapa produk kilang minyak lainnya dalam konsentrasi tertentu, beracun terhadap organisme laut. Fraksi minyak bumi yang tidak dapat larut sangat merusak, karena minyak tersebut akan melapisi organisme dan mengakibatkan mati lemas. Minyak juga dapat menyebabkan
9 Hidrokarbon aromatik pada titik didih rendah merupakan fraksi yang paling toksik dan penyebab utama kematian organisme. Termasuk didalamnya adalah
[image:33.612.129.513.239.631.2]benzene, toluene, cylene, dan naphthalene. Pada konsentrasi tinggi hidrokarbon ini dapat menyebabkan kerusakan dan kematian sel, khususnya pada tingkat larva (Tabel 1).
Tabel 1. Sensitivitas biota akuatik terhadap pemaparan hidrokarbon dan turunannya.
Secara umum, sensitivitas terhadap minyak meningkat dari avertebrata yang lebih rendah ke avertebrata yang lebih tinggi kemudian berakhir pada ikan.
Biota IC50 atau EC50 Referensi Keterangan
Chlorococcum hypnosporum
(mikroalga)
>10% Chung et al (2007) Napthalene
Chlorococcum meneghini
(mikroalga)
>10% Chung et al (2007) Napthalene
Selenastrum capricornutum
(mikroalga)
>10% Chung et al (2007) Napthalene
Clarias gariepinus
(African catfish)
15.5 % Zabbey et. al
(2006)
Water Soluble Fraction (WSF) Larva Echinodermata 23 % Fernandez et al
(2005) Aromatik hidrokarbon Allorchestes compressa (amphipod)
34.5 % Terrens and Tait (1994)
Pengeboran minyak
Mysidopsis bahia 7.1 % Moffitt et al.
(1992)
Pengeboran minyak
Skeletonema costatum
27.6 % Brendehaug et al.
(1992)
Pengeboran minyak
Isochrysis sp. 10% Ansari et al (1997) Water Soluble Fraction (WSF)
10 Tahapan larva merupakan tahapan yang paling sensitif jika dibandingkan seluruh daur hidupnya (Bishop, 1983).
2.3.4. Pengaruh minyak terhadap biota akuatik
Minyak memiliki beberapa efek yang dapat dirasakan secara langsung maupun tidak langsung oleh biota akuatik. Efek yang memberikan pengaruh tidak nampak dan memiliki periode yang panjang (sublethal) akan mampu memberikan
[image:34.612.128.511.368.532.2]pengaruh yang lebih berbahaya karena mampu merubah karakteristik populasi spesies laut dan struktur ekologi komunitas laut. Efek dari tumpahan minyak untuk organisme tertentu memiliki tingkat pemulihan yang bervariasi tergantung tingkat dampak awal yang terjadi (Tabel 2)
Tabel 2. Perkiraan dampak minyak dan tingkat pemulihannya terhadap tipe Komunitas dan Populasi Laut (Bishop, 1983)
Komponen hidrokarbon yang bersifat toksik berpengaruh pada reproduksi, perkembangan, pertumbuhan dan perilaku biota laut terutama plankton. Selain itu, tumpahan minyak dapat mempengaruhi tingkat fotosintesis yang terjadi
(Mukhtasor, 2008). Komponen minyak umumnya mencegah pertumbuhan bakteri laut. Tidak hanya beberapa unsur pokok minyak toksik terhadap populasi
mikroba, tetapi juga karena produk yang terbentuk oleh degradasi hidrokarbon Tipe Komunitas/
Populasi
Perkiraan dampak awal Perkiraan tingkat pemulihan
Plankton Ringan - Sedang Cepat – Sedang
Komunitas Bentik
Pada Pasut Bebatuan Ringan - Sedang Cepat – Sedang Pada Pasut Berlumpur
atau Berpasir
Sedang Sedang
Pada Daerah Subtidal atau Offshore
Berat Lambat
Ikan Ringan - Sedang Cepat – Sedang
Burung Berat Lambat
11 bersifat lebih toksik dibandingkan dengan hidrokarbon aslinya (Bartha dan Atlas, 1977 in Mukhtasor, 2008). Dampak besar dari pencemaran minyak adalah terhadap organisme bentik karena minyak terakumulasi di lapisan dasar dan umumnya beberapa organisme bentik tidak bergerak dan tidak dapat menghindari pencemaran tersebut (Mukhtasor, 2008).
2.3.5. Interaksi antara minyak dan sedimen
Ketika minyak masuk ke lingkungan laut, maka minyak akan mengalami beberapa perubahan secara fisik dan kimia. Diantara perubahan tersebut adalah terbentuknya lapisan (slick formation), menyebar (dissolution), menguap (evaporation), polimerisasi (polymerization), emulsifikasi (emulsification), air dalam emulsi minyak (water in oil emultion), minyak dalam emulsi air (oil in water emultion), foto oksidasi (photooxidation), biodegradasi mikroba
(biodegradation), sedimentasi (sedimentation), dicerna oleh plankton (ingestion) dan bentuk gumpalan ter (ter lump formation). Semua proses itu disebut dengan
weathering of oil (Gambar 1).
12
Gambar 1. Berbagai proses perubahan fisik dan kimia dari minyak (Mukhtasor, 2008)
2.4. Uji Toksisitas sedimen
2.4.1. Uji toksisitas
Uji toksisitas merupakan pengujian dari substansi dalam kondisi tertentu sehingga pengaruhnya terhadap biota uji dapat diketahui (Panggabean, 1994). Metode baku yang sering digunakan adalah American Society for Testing and Material (1992) dan Asean Canada Cooperative Programe on Marine Science
13 Pengujian akut adalah pengujian yang diharapkan tingkat kematian dari suatu biota uji atau sering disebut sebagai uji lethal dan umumnya berlangsung secara singkat yaitu sekitar 2-4 hari. Uji kronik meliputi seluruh daur hidupnya atau sebagian dari daur hidupnya yang paling peka misalnya perkembangan embrio dan larva (Panggabean, 1994).
Ukuran toksisitas atau efek yang dapat dilihat adalah kematian (mortalitas), susunan jaringan (hispatologis), kegagalan reproduksi, perubahan fisiologi, enzim, tingkah laku, perubahan gen (mutagenik), pertumbuhan dan lain lain
(Panggabean, 1994). Dalam uji toksisitas ini yang akan diamati adalah mengenai efek dalam hal pertumbuhan dari suatu biota.
Uji toksisitas berguna untuk berbagai macam tujuan, antara lain untuk mengetahui (Hindarti, 1997) :
1. Kondisi lingkungan yang sesuai untuk kehidupan biota
2. Faktor lingkungan yang diinginkan atau tidak diinginkan seperti DO, pH, suhu, salinitas, dan turbiditas
3. Pengaruh faktor lingkungan terhadap toksisitas bahan pencemar 4. Toksisitas bahan pencemar dengan biota uji
5. Sensitivitas relatif dari biota uji terhadap toksikan.
6. Jumlah atau tipe penanganan limbah yang memenuhi persyaratan pengendalian pencemaran air
7. Efektifitas metode penanganan limbah
8. Laju buangan limbah yang diperbolehkan masuk ke dalam lingkungan perairan
14 Uji toksisitas perairan dapat dikategorikan menurut lama pemaparan, keadaan uji, kriteria pengaruh yang dievaluasi dan biota yang diuji. Beberapa uji toksisitas yang sering digunakan adalah uji toksisitas akut,uji toksisitas kronik, uji toksisitas tingkat hidup awal dan uji toksisitas sublethal lainnya (Hindarti, 1997).
2.4.2. Mikroalga sebagai biota uji toksisitas
Mikroalga merupakan komponen dasar dalam rantai makanan dalam lingkungan laut. Organisme ini menyimpan energi selama fotosintesis dan berguna sebagai produsen dalam jaring-jaring makanan. Kelimpahan mikroalga dipengaruhi oleh konsentrasi DO, pH, alkalinitas, kekeruhan, dan keadaan di permukaan air (Rand dan Petrocelli, 1985).
Beberapa syarat dalam pemilihan biota dalam uji toksisitas menurut Asean Canada Cooperative Programme on Marine Science (1995) adalah :
1. Penting secara ekonomi
2. Mewakili kelompok penting dalam ekologinya
3. Tersedia secara luas dengan penyebaran yang luas juga 4. Mudah dipelihara dan toleran terhadap penanganan
5. Mempunyai siklus hidup yang mudah untuk dibudidayakan 6. Dapat tersedia secara berkesinambungan
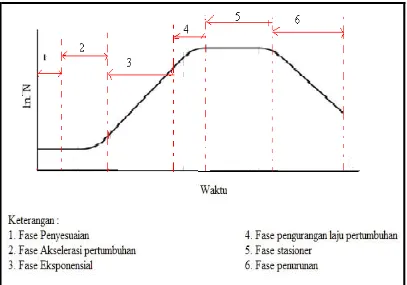
15 Pertumbuhan mikroalga sendiri dapat diamati dalam bentuk kurva laju
pertumbuhan. Dalam kultur yang tertutup yaitu tidak terdapat suplai makanan yang masuk maupun keluar, mikroalga dapat mengalami beberapa fase pertumbuhan (Rand dan Petrocelli, 1985). Kurva pertumbuhan pada masing-masing fase terdapat pada Gambar 2 yaitu :
1. Fase penyesuaian atau fase adaptasi (lag phase); fase saat inokulasi pada media kultur.
2. Fase akselerasi pertumbuhan; fase saat terjadi penambahan populasi secara tajam.
3. Fase eksponensial; fase dimana terjadi penambahan populasi yang terjadi secara konstan; pada fase ini, mikroalga tidak sensitif terhadap lingkungan dan terjadi kondisi optimum untuk pertumbuhan.
4. Fase pengurangan laju pertumbuhan; fase dimana penambahan populasi akan mengalami perlambatan dan terjadi persaingan antar individu karena nutrien yang tersedia semakin sedikit.
5. Fase stasioner; fase dimana tidak terjadi pertambahan mikroalga karena nutrien yang tersedia berada di bawah ambang batas nutrien yang diperlukan mikroalga.
16
Gambar 2. Kurva pertumbuhan mikroalga dalam sistem tertutup (Rand dan Petrocelli, 1985)
2.5. Biota Uji
Biota uji yang digunakan dalam percobaan ini adalah Isochrysis sp. yang merupakan salah satu jenis mikroalga yang terdapat di perairan laut. Mikroalga ini terdapat dalam marga Isochrysis dan termasuk dalam divisi Haptophyta. Haptophyta sendiri memiliki ciri-ciri sebagai mikroalga unisel berflagel yang memiliki organel bernama haptonema yang digunakan sebagai alat gerak dan alat penempelan pada substrat. Namun pada Isochrysis sp. haptonema ini tereduksi sehingga sering dianggap tidak ada (Purbonegoro, 2005).
17 Cocolithoporales. Ordo Isochrysidales memilik empat marga utama yakni
Imantonia, Chrysotila, Isochrysis dan Dictrateria.
Taksonomi Isochrysis sp. menurut Parke (1971) adalah sebagai berikut:
Divisi : Haptophyta
Kelas : Prymnesiophyceae Bangsa : Isochrysidales Suku : Isochrysidaceae Marga : Isochrysis
Jenis : Isochrysis sp.
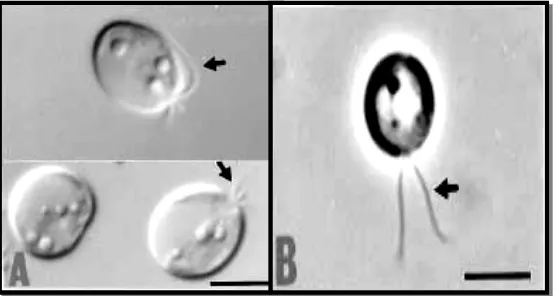
[image:41.612.171.449.492.640.2]Kelas Prymnesiophyceae mempunyai pigmen α carotene, β carotene, fluxoxanthin, diatoxanthin, dan diadinoxanthin sehingga mikroalga ini berwarna kekuningan (Rusyani, 2001). Isochrysis sp. berbentuk unisel, bersifat motil, memiliki panjang 5-6 µm dan lebar 2-4 µm dengan bentuk yang elips. Organisme ini memiliki 2 flagela dengan panjang yang sama atau lebih panjang yaitu sekitar 7 µm serta memiliki plastid tunggal dengan pyrenoid yang berwarna kuning kecokelatan (Gambar 3).
18
Isochrysis sp. memiliki pergerakan yang cepat di air dan berputar-putar pada saat berenang. Kloroplasnya berbentuk mangkuk dan terlihat mengisi 2/3 bagian selnya, sedangkan ruangan sisanya terlihat kosong. Reproduksi dilakukan melalui pembelahan sederhana dimana sel induk membelah diri menjadi dua sel anak betina. Isochrysis juga dikenal sebagai pakan rotifer, kerang, tiram, dan larva udang karena bentuknya yang kecil (Liu dan Lin, 2001).
Isochrysis sp. memiliki kandungan protein 46,69 %; karbohidrat 24,15 % dan lemak 17,07 % serta kaya dengan DHA. Kandungan asam lemak (fatty acid) dari
19
3. METODOLOGI PENELITIAN
2.3. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Februari sampai dengan bulan April 2009 di Laboratorium Ekotoksikologi, Pusat Penelitian Oseanografi Lembaga Ilmu Pengetahuan Indonesia (P2O-LIPI), Ancol, Jakarta Utara. Sampel yang digunakan adalah sedimen yang berasal dari Pulau Pari. Proses pengambilan sedimen dilakukan oleh tim yang berasal dari Puslit Oseanografi LIPI Laboratorium Mikrobiologi. Penelitian ini merupakan penelitian kerjasama antara Laboratorium Ekotoksikologi dan Laboratorium Mikrobiologi P2O-LIPI serta
NITE (National Institute of Technology and Evaluation), sebuah organisasi penelitian dari Jepang.
Sampel sedimen yang digunakan merupakan sedimen berumur 125 hari (4 bulan) yang ditempatkan di sekitar laguna Pulau Pari bagian selatan. Sampel sedimen ini telah ditempatkan dalam suatu sumur dan diberikan perlakuan tertentu untuk keperluan bioremediasi hidrokarbon. Peta lokasi penempatan sampel sedimen dapat dilihat pada Gambar 4.
3.2. Alat dan Bahan
3.2.1. Alat Pemeliharaan Kultur Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH)
20 autoklaf, labu Erlenmeyer (1000 ml dan 250 ml), gelas ukur (1000 ml), gelas beaker (1000 ml), batang pengaduk, timbangan Sartorius, aluminium foil,
micropipet dan tip, mikroskop dan haemocytometer, botol sampel kecil (2 ml), pipet pasteur, alat hitung (counter), TPH Analyzer serta cuvet (Lampiran 1) 3.2.2. Bahan Pemeliharaan Isochrysis sp., uji toksisitas sedimen dan pengukuran Total Petroleum Hydrocarbon (TPH).
Bahan pemeliharaan (kultur) Isochrysis sp., uji toksisitas sedimen, dan uji kandungan minyak (oil content) sedimen berminyak antara lain kultur Isochrysis sp. yang berasal dari Laboratorium Kelompok Penelitian Marikultur P20 LIPI, media pertumbuhan Walne, sedimen Pulau Pari, aseton, asam nitrat 10%, akuades, air laut yang telah disaring dan disterilkan, lugol sebagai pengawet serta solvent H-977 (Lampiran 1).
3.3. Cara Kerja
3.3.1. Pengambilan contoh sedimen
21
22 Tahap persiapan dari perlakuan sedimen untuk uji coba bioremediasi di lapangan adalah sebagai berikut :
1. Sedimen pantai dikeruk dengan menggunakan ember
2. Sedimen tersebut disaring dengan menggunakan ayakan bertingkat sebanyak 2 kali yaitu dengan ukuran partikel 4 mm dan 1 mm sehingga didapatkan hasil sedimen dengan fraksi very coarse sand (pasir sangat kasar).
3. Fraksi ini kemudian dimasukkan kedalam bagian tabung mesokosm yang memiliki tinggi sekitar 150 cm. Pasir yang dimasukkan kemudian dipadatkan dengan menggunakan air, sehingga tabung terisi pasir mulai dari bagian bawah hingga bagian atas (Lampiran 2)
4. Tabung-tabung ini ditempatkan pada stasiun pengamatan (sumur buatan) dan masing-masing sumur terdiri dari 7 tabung.
[image:46.612.129.512.506.616.2]Pada masing-masing tabung ini diberikan beberapa perlakuan dengan menggunakan minyak dan pupuk (Tabel 3). Tujuan dari pemberian pupuk (osmocot) adalah untuk dapat menstimulasi mikroba yang berada dalam sedimen sehingga dapat mendegradasi minyak secara cepat.
Tabel 3. Berbagai perlakuan pada masing-masing tabung
Tabung Perlakuan
C1 Tanpa minyak dan pupuk
C2 Tanpa pupuk tetapi dengan penambahan ALCO 200 gr C3 ALCO 200gr + osmocot 2 gr
C4 ALCO 200gr + osmocot 5 gr C5 ALCO 200gr + osmocot 30 gr C6 ALCO 200gr + osmocot 60 gr
23 pada lapisan atas (lapisan 5) dan bagian sedimen tertua berada pada lapisan bawah (lapisan 1) (Tabel 4). Dasar dari pelapisan sedimen ini adalah sedimen yang pertama kali dimasukkan dalam tabung merupakan lapisan tertua dan sesuai dengan teori superposition dalam sedimen. Pada tabung C3, C4, C5 dan C6,
osmocot masing-masing diberikan pada lapisan teratas.
[image:47.612.128.514.458.543.2]Di stasiun pengamatan terdapat 6 sumur buatan (chamber) dan masing-masing sumur diisi oleh tujuh tabung (1 tabung untuk pemantauan porewater dan 6 tabung perlakuan). Dalam sumur buatan diberikan dasar berupa coral dan pasir yang berfungsi untuk menyaring air yang masuk ke dalam tabung serta untuk menyamakan porositas sedimen tabung dengan luar tabung. Tinggi sumur buatan tersebut adalah 100 cm dari permukaan laut dan memiliki diameter sebesar 80 cm. Masing-masing sumur ini terletak sejauh 10 m dari ujung selatan Pulau Pari dengan jarak masing-masing sumur adalah 1 meter dan sejajar antar sumur (Lampiran 3).
Tabel 4. Susunan bagiansedimen dalam satu tabung
Bagian Keterangan
Lapisan 1 Lapisan paling bawah (80-100 cm)
Lapisan 2 Lapisan 20 cm diatas lapisan 1 (60-80 cm) Lapisan 3 Lapisan tengah (40-60 cm)
Lapisan 4 Lapisan 20 cm diatas lapisan 3 (20-40 cm) Lapisan 5 Lapisan paling atas (0-20 cm)
24 sedimen disimpan dalam lemari pendingin di laboratorium dalam suhu 4 0C sesuai dengan ACCPMS II (1995) mengenai preparasi sedimen.
3.3.2. Pencucian dan sterilisasi peralatan
Prosedur yang digunakan dalam pencucian dan sterilisasi peralatan untuk uji toksisitas sedimen terhadap pertumbuhan mikroalga adalah prosedur standar ACCPMS II (1995) seperti berikut :
• Peralatan dicuci dengan detergen non phospat/ teepol kemudian dibilas
dengan air ledeng sampai bersih
• Peralatan dicuci dengan asam nitrat (HNO3) 10% untuk menghilangkan
logam berat yang masih ada lalu dibilas dengan aquades sebanyak 3 kali hingga bersih.
• Peralatan dicuci dengan aseton pekat untuk menghilangkan bahan organik
yang masih ada lalu dibilas dengan akuades sebanyak 3 kali hingga bersih. Peralatan ini kemudian dikeringkan dan ditutup dengan aluminium foil, disterilisasi dengan autoclave selama 15 menit pada suhu 1210C dan dengan oven selama 1 jam.
3.3.3. Pemeliharaan Kultur
Tahapan persiapan kultur Isochrysis sp. dimulai dengan mempersiapkan air laut steril. Penggunaan air laut steril ini dimaksudkan agar tidak terdapat mikroba lain dalam media kultur. Adapun tahap persiapan air laut steril menurut
ACCPMS II (1995) adalah sebagai berikut :
25 2. Air laut yang telah disaring ini, kemudian disterilkan menggunakan
autoclave selama 15 menit dengan suhu 121 0C dengan tujuan membunuh mikroba-mikroba yang masih ada dalam air laut. 3. Air laut yang telah steril ini, kemudian dimasukkan kedalam wadah
atau jerigen sebagai tempat penyimpanan air laut steril sebelum digunakan sebagai media kultur atau sebagai stok air laut steril. 4. Satu liter air laut steril tersebut dimasukkan kedalam Erlenmeyer (1 lt)
dan ditambahkan 1 ml media Walne + EDTA dan simpan di bawah cahaya 400 ft-c (foot candle) sebagai stok solution
Pemeliharaan kultur Isochrysis sp dilanjutkan dengan pembuatan media Walne sebagai media kultur. Pembuatan Walne meliputi penambahan trace metal, vitamin dan nutrien ke dalam air laut yang steril. Susunan dari komponen media Walne ditunjukkan pada Tabel 5.
Pembuatan media Walne yaitu dengan mencampurkan stok 1 ke dalam akuades. Setelah terlihat jernih, 10 ml stok vitamin primer ditambahkan hingga terlarut dengan baik. Kemudian campuran tersebut ditambahkan 0.1 ml trace metal dan akuades hingga volume larutan mencapai 100 ml. Media Walne ini selanjutnya ditempatkan dalam botol gelap dan disimpan dalam lemari pendingin. Mikroalga dikultur secara normal menggunakan media Walne dengan penambahan EDTA, tetapi pada uji toksisitas media kulturnya menggunakan media Walne tanpa penambahan EDTA.
26 untuk adsorpsi nutrien oleh mikroalga (Sanusi, 2006). Sehingga dalam uji toksisitas penggunaan media walne non EDTA adalah agar adsorpsi yang dilakukan oleh mikroalga merupakan adsorpsi terhadap bahan pencemar.
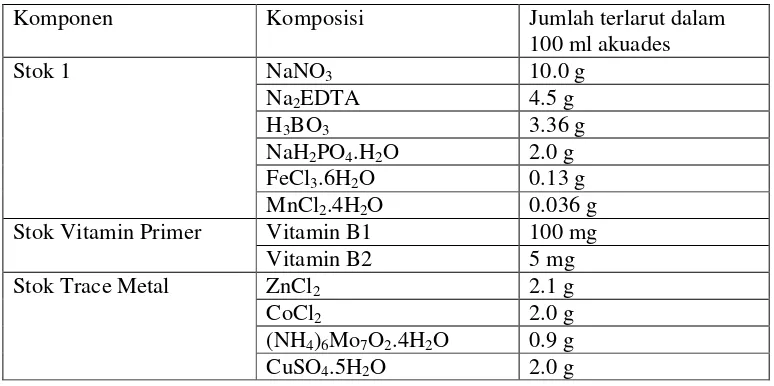
Tabel 5. Komposisi bahan-bahan media walne bagi pemeliharaan Isochrysis sp. (Asean Canada CPMS-II,1995)
Kultur Isochrysis sp. dimulai dengan pengambilan 100 ml stock solution ke dalam erlenmeyer 250 ml dan ditambahkan 1ml strainIsochrysis sp. Erlenmeyer tersebut kemudian ditutup dengan kapas yang bertujuan untuk menghindari masuknya benda asing ke dalam wadah, setelah itu di aerasi dan pencahayaan sebesar 400 ft-c serta diberikan label yang mencantumkan keterangan mengenai species dan tanggal dimulai kultur.
Perhitungan jumlah sel Isochrysis sp. pertama (jam ke- 0) dimulai saat pemberian strain mikroalga dalam wadah kultur. Perhitungan jumlah sel ini menggunakan haemocytometer di bawah mikroskop (Lampiran 4). Jumlah sel dihitung dengan menggunakan formula sebagai berikut :
Kepadatan (sel/ml) 0.00025 1000 ) 400 /
(x x
= ...(1)
Komponen Komposisi Jumlah terlarut dalam
100 ml akuades
Stok 1 NaNO3 10.0 g
Na2EDTA 4.5 g
H3BO3 3.36 g
NaH2PO4.H2O 2.0 g
FeCl3.6H2O 0.13 g
MnCl2.4H2O 0.036 g
Stok Vitamin Primer Vitamin B1 100 mg
Vitamin B2 5 mg
Stok Trace Metal ZnCl2 2.1 g
CoCl2 2.0 g
(NH4)6Mo7O2.4H2O 0.9 g
27 dimana x : jumlah sel yang terukur dalam gridhaemocytometer
Kepadatan Isochrysis sp. diharapkan mencapai 1 x 106 sel/ml dalam 4-7 hari. Mikroalga yang tidak dapat tumbuh secepat ini tidak dapat digunakan untuk uji pertumbuhan 96 jam.
3.3.4. Uji toksisitas sedimen
Uji toksisitas sedimen dilakukan untuk mengetahui kualitas sedimen yang mempengaruhi pertumbuhan Isochrysis sp. Pelaksanaan uji ini mengacu pada
American Society of Testing and Material (1992) sedangkan untuk persiapan sedimen dilakukan dengan metode PSEP (1995) sebagai berikut :
1. Sedimen ditimbang sebanyak 18 gr untuk sampel sedimen kemudian dilarutkan dengan 900 ml air laut steril pada gelas beaker 1000 ml lalu ditutup.
2. Kemudian diaduk dengan batang pengaduk hingga tercampur rata dan didiamkan selama 4 jam agar sedimen mengendap sempurna (Lampiran 5) 3. Setelah 4 jam, air pada lapisan atas (overlying water) diambil sebanyak 100 ml
dan dimasukkan ke dalam labu Erlenmeyer. Dilakukan pengulangan sebanyak 3 kali pada masing- masing sampel.
4. Kemudian ditambahkan 1 ml media Walne non EDTA ke dalam erlenmeyer
dan ditambahkan kultur Isochrysis sp. yang telah diencerkan dengan kepadatan 1x 106 sel/ml.
5. Masing-masing erlenmeyer ditutup dengan menggunakan aluminium foil dan diatur secara acak diatas meja dengan pencahayaan kontinu dengan intensitas 400 ft-c.
28 7. Setelah 96 jam, sebanyak 0.9 ml larutan hasil pengujian diambil dan dimasukkan ke dalam botol sampel kecil dan ditambahkan lugol sebanyak 0.1 ml untuk kemudian dilakukan pengamatan di bawah mikroskop dengan menggunakan haemocytometer.
3.3.5. Pengukuran kualitas air
Kualitas air larutan uji merupakan hal yang penting dalam penelitian ini, dimana hal ini menentukan bahwa hanya hidrokarbon yang berpengaruh terhadap pertumbuhan Isochrysis sp. maka kondisi kualitas air pada larutan uji diusahakan optimum. Pengujian kualitas air ini meliputi pengukuran suhu, oksigen terlarut, konsentrasi salinitas dan pengukuran pH dari larutan uji dan kontrol.
Pengukuran kualitas air yang dilakukan pertama adalah pengukuran salinitas dengan menggunakan refraktometer. Dasar penggunaan alat ini adalah besarnya konsentrasi salinitas yang terbaca dalam kaca refraktometer. Nilai konsentrasi yang terbaca ini merupakan hasil refraksi antara molekul air terhadap kaca dengan prinsip refraksi cahaya.
Pengukuran suhu dan pH dilakukan bersamaan dengan menggunakan pH meter. Dasar penggunaan alat ini adalah konduktivitas yang berada dalam larutan uji kemudian diterjemahkan oleh probe dalam pH meter menjadi satuan suhu dan pH. Pengukuran oksigen terlarut menggunakan DO meter yang memiliki prinsip kerja sama seperti pH meter.
3.3.6. Pengukuran Total Petroleum Hydrocarbon (TPH)
29 pertumbuhan mikroalga. Pengukuran TPH ini terbagi menjadi 2 tahap yakni preparasi sedimen dan tahap pengukuran dengan TPH Analyzer menggunakan
Solvent H-997.
Tahapan preparasi sedimen adalah sebagai berikut :
1. Sampel (sedimen) yang akan diukur ditimbang sebanyak 1 mg dan ditempatkan pada wadah (tube 50 ml).
2. Sampel sedimen tersebut ditambahkan NaSO4 secukupnya hingga sampel
menjadi kering.
3. Sampel sedimen yang telah kering kemudian ditambahkan Solvent H-997
sebanyak 25 ml.
4. Homogenisasi ekstrak tersebut menggunakan shacker selama 40 menit dengan kecepatan 125 rpm pada suhu 28ºC hingga berupa larutan.
5. Larutan yang terbentuk disaring menggunakan filter 0,50 m dan dimasukkan ke dalam wadah lain (tube 15 ml).
6. Larutan hasil penyaringan siap untuk diukur menggunakan TPH Analyzer. Jika kandungan air terlalu tinggi maka dilakukan pengenceran.
Pada pengukuran dengan menggunakan TPH Analyzer, larutan hasil penyaringan ini akan menunjukan angka sebagai kandungan minyak dalam sampel setelah sebelumnya dilakukan kalibrasi alat dengan menggunakan Solvent H-997. Metode penggunaan alat TPH Analyzer pada Lampiran 6.
3.3.7. Analisis Data
Data Isochrysis sp. selama 96 jam kemudian dilakukan perhitungan persentase penghambatan (inhibition) atau perangsangan (stimulation) jumlah sel jika
30
% 100
% x
C T C
I = − ...(2)
% 100
% x
C C T
S = − ...(3)
Keterangan :
I : persentase penghambatan (inhibition)
C : rata-rata jumlah sel dalam larutan kontrol
T : rata-rata jumlah sel dalam perlakuan
S : persentase perangsangan (stimulation)
Perhitungan persentase penghambatan ini bertujuan untuk melihat secara manual sampel sedimen yang menghambat pertumbuhan sebesar 50 % dari populasi awal atau sampel sedimen yang merangsang pertumbuhan Isochrysis sp.
(Lampiran 7). Analisis data untuk jumlah sel diperoleh dengan menggunakan dua macam program yaitu TOXSTAT untuk menganalisis NOEC (No Observed Effect Concentration) yaitu konsentrasi tertinggi dari bahan pencemar yang secara statistik tidak berpengaruh nyata dan LOEC (Lowest Observed Effect Concentration) yaitu konsentrasi terendah dari bahan pencemar yang secara statistik berpengaruh nyata terhadap biota uji dan ICPIN (Inhibition
Concentration Program) untuk menghitung ICn sebagai konsentrasi bahan pencemar yang menghambat pertumbuhan mikroalga sebesar n% dibandingkan dengan kontrol (Rand and Petrocelli, 1985).
31 berpengaruh signifikan. Pengujian statistik ini menggunakan program TOXSTAT
untuk dapat menentukan signifikasi dari tahapan yang diberikan (Lampiran 8). Untuk menggunakan program TOXSTAT, data jumlah sel harus diubah dalam bentuk log10, kemudian sebelum menganalisis NOEC dan LOEC data harus diuji
normalitasnya dengan menggunakan uji Shapirowilks dan keseragaman dengan menggunakan uji Bartlet’s. Jika uji tersebut telah dilakukan dan data menyebar normal serta seragam, kemudian dilakukan uji statistik dengan uji t-dunnett’s dan Rancangan Acak Lengkap dengan persamaan matematis sebagai berikut :
Yij = µ + αi + βj + (α + β)ij +εik....(4) dimana:
Yij : Jumlah sel akibat perlakuan : rataan umum
αi : Pengaruh perlakuan ke-i
βj : Pengaruh ulangan ke-j
εik : galat akibat pengaruh perlakuan.
Jika uji tersebut telah dilakukan dan data menyebar normal serta seragam, kemudian dilakukan uji statistik dengan uji parametrik seperti Dunnets,
Bonferroni atau Tukeys. Tetapi apabila data tersebut tidak menyebar normal maupun seragam maka dilakukan uji non parametrik dengan menggunakan Steels
Many-one rank, Wilcoxon atau Kruskal- Wallis Test.
32 menghitung nilai IC50digunakan metode interpolasi linier dengan persamaan matematis sebagai berikut :
) ( ) ) 100 1 ( ( 1 1 j j j j j j p M M C C x M p Mi C IC − − − − + = + + ......(5) dimana :
Cj : Konsentrasi rata-rata respon yang diamati lebih besar daripada Mi(1-p/100)
Cj+1: Konsentrasi rata-rata respon yang diamati lebih kecil daripada Mi (1-p/100)
Mi : Rata-rata respon kontrol
Mj : Rata-rata respon konsentrasi j
Mj+1: Rata-rata respon konsentrasi j+1
p : Persentase penghambatan respon perlakuan terhadap respon kontrol
ICp : Konsentrasi dimana pertumbuhan terhambat sebesar p% dibanding dengan rata-rata respon kontrol.
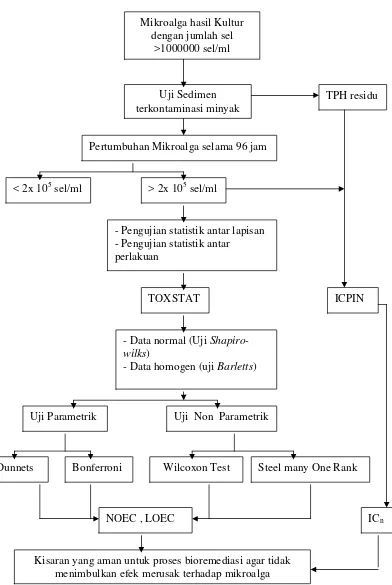
Pengujian statistik ini akan menghasilkan informasi mengenai lapisan yang berpengaruh secara signifikan terhadap pertumbuhan yang diindikasikan dengan jumlah sel pada lapisan yang paling sedikit, jenis perlakuan yang berpengaruh signifikan baik konsentrasi terendah yang berpengaruh terhadap pertumbuhan dan konsentrasi yang tidak berpengaruh terhadap pertumbuhan serta konsentrasi dari
Total Petroleum Hydrocarbon (TPH) residu dalam sedimen setelah proses bioremediasi yang menghambat pertumbuhan Isochrysis sp. sebesar 50%. Informasi mengenai konsentrasi terendah dan tertinggi dari perlakuan dapat dijadikan landasan dalam pengujian bioremediasi selanjutnya dan dapat pula dijadikan acuan batas aman proses bioremediasi agar tidak merugikan biota akuatik lainnya. Untuk dapat memahami langkah penelitian ini dapat dilihat pada Gambar 5.
33
< 2x 105 sel/ml > 2x 105 sel/ml
ICPIN - Pengujian statistik antar lapisan
- Pengujian statistik antar perlakuan
- Data normal (Uji Shapiro-wilks)
- Data homogen (uji Barletts) TOXSTAT
Uji Parametrik Uji Non Parametrik
Dunnets Bonferroni Wilcoxon Test Steel many One Rank
NOEC , LOEC ICn
[image:57.612.135.527.89.674.2]Kisaran yang aman untuk proses bioremediasi agar tidak menimbulkan efek merusak terhadap mikroalga
Gambar 5. Langkah-langkah penelitian dalam analisis data statistik Mikroalga hasil Kultur
dengan jumlah sel >1000000 sel/ml
Uji Sedimen terkontaminasi minyak
Pertumbuhan Mikroalga selama 96 jam
34
4. HASIL DAN PEMBAHASAN
4.1. Pertumbuhan Mikroalga Isochrysis sp.
Pertumbuhan adalah bertambahnya substansi sebagai akibat dari biosintesis dari metabolisme biota tersebut. Untuk organisme bersel satu (unisel),
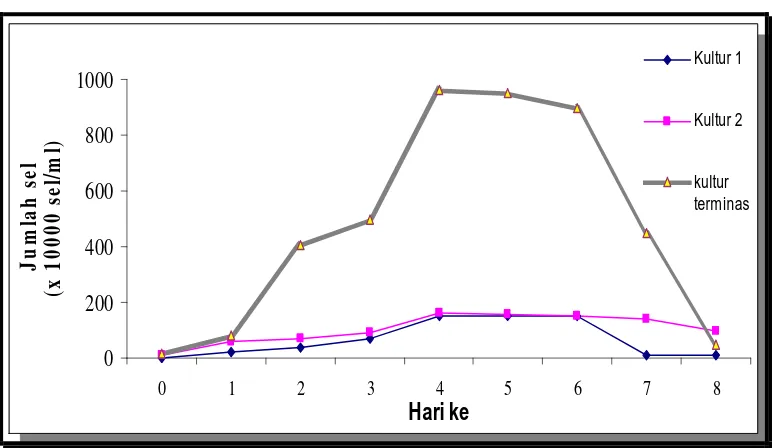
pertumbuhan diartikan sebagai pertambahan jumlah sel (Dwidjoseputro, 1986). Laju pertumbuhan untuk organisme bersel satu adalah jumlah sel per satuan waktu. Laju pertumbuhan mikroalga akan membentuk kurva pertumbuhan dan pertumbuhan mikroalga secara maksimum terjadi pada hari ke-4 setelah kultur. Kurva pertumbuhan dalam penelitian ini dapat dilihat pada Gambar 6.
0
200
400
600
800
1000
0 1 2 3 4 5 6 7 8
Hari ke
J
u
m
la
h
s
el
(x
1
0
0
0
0
s
el
/m
l)
Kultur 1 Kultur 2 kultur terminas0
200
400
600
800
1000
0 1 2 3 4 5 6 7 8
[image:58.612.135.521.327.551.2]Hari ke
J
u
m
la
h
s
el
(x
1
0
0
0
0
s
el
/m
l)
Kultur 1 Kultur 2 kultur terminasGambar 6. Kurva pertumbuhan Mikroalga Isochrysis sp. dalam tiga kali kultur. Pertumbuhan Isochrysis sp. dalam tiga kali kultur mengalami laju
35 kedua kultur pendahuluan ini, hal ini dikarenakan mikroalga tersebut mulai beradaptasi kembali terhadap proses kulturasi.
Pada kultur untuk memulai percobaan, pertumbuhan maksimum Isochrysis sp.
berada pada hari ke- 4 yaitu sebesar 9.6 x 106 sel/ml. Kultur ini merupakan kultur ke- 7 sejak pertama kali dilakukan kultur. Jumlah sel tersebut cukup untuk mulai dilakukan uji toksiksitas karena jumlah sel minimal yang dapat digunakan adalah 1 x 106 sel/ml.
Terdapat berbagai faktor yang mempengaruhi pertumbuhan mikroalga, antara lain adalah suhu dan unsur hara (nutrient). Suhu optimum untuk pertumbuhan mikroalga adalah 27 0C, namun dalam penelitian ini suhu tidak berpengaruh langsung terhadap pertumbuhan karena suhu dalam laboratorium telah diusahakan optimum. Unsur hara adalah unsur kimia lingkungan yang diperlukan oleh biota untuk tumbuh selama masa kultur. Kultur dalam penelitian ini merupakan kultur dengan media tertutup, maka nutrien yang masuk berasal dari media Walne. Media pertumbuhan ini memiliki unsur- unsur makro dan mikro yang dibutuhkan oleh mikroalga untuk tumbuh. Unsur makro dominan yang terdapat dalam Walne antara lain N yang berfungsi dalam pembentukan lipid dari mikroalga dan unsur Mg yang berperan dalam pembentukan klorofil. Unsur mikro dalam media Walne yang berperan penting adalah Mn yang berperan dalam pembentukan oksigen untuk proses fotosintesis (Graham dan Wilcox, 2000).
4.2. Kualitas Air
36 diperoleh kisaran DO sebesar 0.49-5.36 mg/l, kisaran pH sebesar 8.01-8.43, dan suhu berkisar 25.8-26.9 0C dengan salinitas sebesar 32 ‰ (Tabel 6).
Tabel 6. Hasil analisis kualitas air pada berbagai lapisan menurut perlakuan. Kode
Perlakuan Perlakuan Lapisan
DO (mg/l) pH
Suhu ( 0C)
Salinitas (‰)
Kontrol Kontrol - 5.74 8.02 25.9 32
C1
Tanpa Penambahan
ALCO dan
Osmocot
1 (bawah) 4.89 8.01 26.4 32
3 (tengah) 5.25 8.12 26.4 32
5 (atas) 5.31 8.33 26.2 32
C2
Tanpa pupuk tetapi dengan penambahan ALCO 200 gr
1 (bawah) 5.18 8.33 26.2 32
3 (tengah) 4.93 8.36 26.5 32
5 (atas) 4.33 8.35 26.1 32
C3
ALCO 200 gr + osmocot 2 gr
1 (bawah) 5.36 8.31 26 32
3 (tengah) 5.08 8.3 25.8 32
5 (atas) 3.08 8.29 26.4 32
C4
ALCO 200 gr + osmocot 5 gr
1 (bawah) 4.7 8.33 26.5 32
3 (tengah) 4.5 8.37 26.5 32
5 (atas) 2.52 8.35 26.5 32
C5
ALCO 200 gr + osmocot 30 gr
1 (bawah) 4.65 8.42 26.2 32
3 (tengah) 4.79 8.42 26.8 32
5 (atas) 0.49 8.36 26.6 32
C6
ALCO 200gr +
osmocot 60 gr
1 (bawah) 4.71 8.43 26.9 32
3 (tengah) 4.49 8.29 26.6 32
5 (atas) 4.95 8.42 26.4 32
Pada pengukuran oksigen terlarut (dissolved oxygen), nilai DO paling rendah yaitu 0.49 mg/l pada perlakuan dengan penambahan ALCO sebanyak 200 g dan
37 Konsentrasi oksigen terlarut yang rendah juga dapat dipengaruhi oleh aktivitas penguraian hidrokarbon yang telah terjadi yaitu penggunaan oksigen dalam proses bioremediasi ini untuk degradasi secara aerob. Degradasi secara aerob ini
berlangsung secara cepat jika dibandingkan dengan degradasi secara anaerob (Rittmann and McCarty, 2001), sehingga kadar oksigen dalam sedimen rendah pada saat pengukuran kualitas air.
Kualitas air yang diukur ini masih dalam batas toleransi mikroalga untuk dapat tumbuh. ACCPMS (1995) menyatakan kisaran suhu yang normal untuk uji toksiksitas mikroalga adalah sebesar 27 ± 1 0C dengan pH ideal sebesar 8.0 hingga 8.2 dan salinitas yang optimal adalah 20-35 ‰.
Kualitas air yang terukur ini tidak akan mempengaruhi pertumbuhan dan metabolisme dari mikroalga tersebut, sehingga pertumbuhan lebih dipengaruhi oleh paparan dari toksikan. Konsentrasi oksigen terlarut yang rendah (0.49 mg/l) tidak akan mempengaruhi proses metabolisme mikroalga karena mikroalga dapat memproduksi sendiri kebutuhan oksigennya dengan proses fotosintesis selama diberikan perlakuan.
4.3. Uji Toksiksitas Sedimen
38 Jumlah sel pada tiap lapisan menunjukan hasil yang berbeda- beda. Pada lapisan bawah, jumlah sel cenderung sama dengan kontrol (Gambar 7). Pada lapisan atas jumlah sel yang mikroalga yang telah diujikan menunjukkan jumlah yang paling kecil jika dibandingkan dengan kontrol.
0 20 40 60 80 100 Kontrol Lapisan ba
wah
Lapisan te ngah
Lapisan at as LAPISAN SEDIMEN J u m la h s e l (x 1 0 0 0 0 s e l/ m l) 0 20 40 60 80 100 Kontrol
Lapisan ba wah
Lapisan te ngah
[image:62.612.135.522.184.401.2]Lapisan at as LAPISAN SEDIMEN J u m la h s e l (x 1 0 0 0 0 s e l/ m l)
Gambar 7. Jumlah sel Isochrysis sp (sel/ml) pada kontrol dan 3 lapisan sedimen yang diujikan
Perubahan yang yang signifikan dalam jumlah sel antar lapisan ini
menunjukkan bahan pencemar berpengaruh pada lapisan atas dan belum mencapai pada lapisan tengah dan bawah setelah 125 hari proses bioremediasi. Perubahan yang signifikan ini dapat pula dilihat dari laju pertumbuhan yang diindikasikan dengan perubahan jumlah sel mikroalga selama waktu uji (Gambar 8).
39 Pada lapisan atas, laju pertumbuhan yang dibentuk paling lambat selama waktu uji jika dibandingkan dengan kontrol maupun lapisan lain. Hingga jam ke-72 terjadi penurunan dalam jumlah sel tetapi meningkat kembali dengan lambat hingga jam ke-96 (Gambar 8).
0 10 20 30 40 50 60
48 72 96
[image:63.612.133.519.185.405.2]Jam ke-P e ru b a h a n j u m la h s e l (x 1 0 0 0 0 s e l/ m l) kontrol lapisan bawah lapisan tengah lapisan atas
Gambar 8. Pertumbuhan Isochrysis sp.(sel/ml)selama 48, 72 dan 96 jam dalam lapisan uji yang berbeda
Perubahan yang signifikan dapat pula dilihat dari persentase penghambatan pada masing-masing lapisan. Persentase penghambatan ini dihitung dengan membandingkannya terhadap jumlah sel dalam kontrol terhadap kontaminan. Persentase penghambatan paling besar terjadi pada lapisan atas dengan persentase penghambatan sebesar 53.12 % (Tabel 7).
Tabel 7. Persentase penghambatan pertumbuhan rata-rata pada setiap lapisan sedimen
Lapisan sedimen Persentase penghambatan (I%)
Lapisan bawah 5.96
Lapisan tengah 7.87
[image:63.612.125.512.619.675.2]40 Persentase penghambatan tertingi terjadi pada lapisan atas kar