BERDASARKAN PEROKSIDASI LIPID
AGUS TRI YOMES
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2
Hidup selalu optimis, penuh perjuangan, kesabaran dan raih ilmu
untuk cita-cita yang gemilang
ABSTRAK
AGUS TRI YOMES. Sifat Prooksidan dan Antioksidan Vitamin C dan Teh Hijau
pada Sel Khamir
Candida
sp. Y390 Berdasarkan Peroksidasi Lipid. Dibimbing
oleh NORMAN R. AZWAR dan HEDDY JULISTIONO.
Khamir
Candida
sp. dapat digunakan sebagai alat yang handal untuk
penelitian sifat zat prooksidan dan antioksidan di tingkat sel karena pekerjaannya
mudah, sederhana, dan hasilnya cepat diperoleh. Peroksidasi lipid adalah proses
penguraian lipid pada sel yang membentuk molekul lebih sederhana dan stabil.
Proses tersebut diakibatkan oleh serangan radikal bebas seperti radikal hidroksil,
alkoksil, peroksil dan lain-lain. Peroksidasi lipid pada sel khamir dapat dihambat
dengan penambahan antioksidan seperti vitamin C dan teh hijau. Meskipun kedua
senyawa ini dikenal sebagai antioksidan, namun dapat memiliki sifat prooksidan
dan yang berefek negatif terhadap sel sehat. Penelitian ini dilakukan untuk
mempelajari sifat pro- dan antioksidan pada sel khamir dengan mengukur jumlah
malondialdehida (MDA) sebagai hasil dari proses penguraian lipid. Sifat
prooksidan atau antioksidan dari suatu zat berturut-turut ditandai dengan
peningkatan atau penghambatan dari jumlah MDA pada sel.
4
ABSTRACT
AGUS TRI YOMES. Prooxidant and Antioxidant Properties of Vitamin C and
Green tea in
Candida
sp. Y390 Based on Lipid Peroxidation. Under the direction
of NORMAN R. AZWAR and HEDDY JULISTIONO.
Yeast
Candida
sp. can be used as a powerful tool to investigate prooxidant
and antioxidant properties of substance in cell level, since its manipulation is easy,
simple, and rapid. Lipid peroxidation is lipid-decomposing process in cells to
produce stable and simple molecules. This is triggerd by free radicals such as:
hydroxyl radicals, alkoxyl, peroxyl, etc. Lipid peroxidation in yeast cell can be
inhibited by antioxidant addition such as: vitamin C and green tea. However, these
antioxidants may have prooxidant properties and possible negative effects on
healthy cell. This research had been done to study pro- and antioxidant properties
of vitamin C and green tea based on lipid peroxidation in yeast cell by measuring
malondialdehyde (MDA) as product of lipid-decomposing process. Prooxidant or
antioxidant property of a substance was marked by augmentation or inhibition of
MDA production in the cell respectively.
SIFAT PROOKSIDAN DAN ANTIOKSIDAN VITAMIN C DAN
TEH HIJAU PADA SEL KHAMIR
Candida
sp
.
BERDASARKAN PEROKSIDASI LIPID
AGUS TRI YOMES
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
6
Judul Skripsi : Sifat Prooksidan dan Antioksidan Vitamin C dan Teh Hijau pada
Sel Khamir
Candida
sp
.
Berdasarkan Peroksidasi Lipid
Nama
: Agus Tri Yomes
NIM
:
G08400027
Disetujui
Komisi Pembimbing
Prof. Dr. drh. H. Norman R. Azwar Dr. Heddy Julistiono
Ketua Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP. 131473999
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat
ALLAH
S.W.T.
karena hanya dengan izin, karunia, nikmat dan rahmat-Nya penulis dapat
menyelesaikan penelitian dan penulisan karya ilmiah ini. Karya ilmiah ini
mempelajari tentang sifat prooksidan dan antioksidan vitamin C dan teh hijau
pada sel khamir C
andida
sp
.
berdasarkan
peroksidasi lipid.
Karya ilmiah ini berdasarkan hasil penelitian yang dilakukan di
Laboratorium Biosistematika dan Genetika Mikroba, Balai Penelitian dan
Pengembangan Bidang Mikrobiologi, Puslit Biologi LIPI, Bogor dan diajukan
sebagai salah satu syarat untuk memperoleh gelar sarjana sains pada program
studi Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut
Pertanian Bogor.
Cukup panjang perjalanan yang harus dilalui penulis dalam penelitian dan
penyusunan karya ilmiah ini dan tak mungkin berhasil tanpa bantuan berbagai
pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih yang
sebesar-besarnya kepada Prof. Dr. drh. H. Norman R. Azwar (Departemen Biokimia) dan
Dr. Heddy Julistiono (Mikrobiologi, LIPI) selaku pembimbing, atas saran dan
bimbingannya selama penelitian sampai penulisan karya ilmiah ini selesai.
Ucapan terima kasih penulis sampaikan kepada Ibu Nery, Ibu Erna, Pak Indarto,
serta seluruh staf Balitbang Bidang Mikrobiologi LIPI atas segala bantuannya.
Penulis juga ingin mengucapkan terima kasih dan penghargaan yang
sebesar-besarnya kepada Mama, Papa, Tetah dan Uda atas segala bantuan dan
doanya dalam penelitian dan penulisan karya ilmiah ini. Terima kasih kepada
teman-teman Biokimia ’37 terutama Yayu dan Khamda serta Teh Ratih, Mela,
Dian dan Fatkur atas segala bantuannya selama ini.
Penulis menyadari bahwa karya ilmiah ini sangat sederhana dan belum
sempurna. Oleh karena itu penulis mengharapkan kritik dan saran. Semoga karya
ilmiah ini bermanfaat bagi dunia ilmu pengetahuan dan pihak-pihak yang
berkepentingan. Amin.
Bogor, April 2006
8
RIWAYAT HIDUP
Penulis adalah putra dari keluarga Bapak Usman dan Ibu Murtina dilahirkan
di Jakarta pada tanggal 28 Agustus 1982. Penulis merupakan anak ketiga dari tiga
bersaudara.
Riwayat pendidikan penulis diawali di SDN 04 Petang Makasar Jakarta dan
lulus pada tahun 1994. Pada tahun itu pula penulis melanjutkan ke SMPN 214
Halim Perdana Kusuma Jakarta dan lulus pada tahun 1997. Pada tahun 2000
penulis tamat dari SMU Islam Panglima Besar Jenderal Sudirman Jakarta dan
melanjutkan studi ke Institut Pertanian Bogor melalui jalur USMI (Undangan
Saringan Masuk IPB) dengan mengambil program studi Biokimia.
Selama mengikuti perkuliahan penulis pernah menjadi asisten praktikum
Biologi Dasar tahun ajaran 2003/2004. Penulis juga telah mengikuti praktek kerja
lapang yang dilaksanakan di Laboratorium Direktorat Pengawasan dan
Pengendalian Mutu Barang Departemen Perindustrian dan Perdagangan sebagai
tenaga pengawas kualitas bahan pangan pada tepung terigu untuk ekspor dan
impor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Khamir
(
Candida
sp.) ... 1
Stres
Oksidatif
...
2
Dampak Stres Oksidatif ... 3
Malondialdehida
(MDA)
...
3
Prooksidan dan Antioksidan ... 4
Vitamin C (Asam Askorbat) ... 5
Teh Hijau (
Camellia
sinensis
) ... 5
BAHAN DAN METODE
Bahan
dan
Alat
...
5
Metode
Penelitian
...
6
HASIL DAN PEMBAHASAN
Penentuan Konsentrasi Etanol dan Vitamin C terhadap Peroksidasi
Lipid pada Pelet ... 8
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi
Lipid pada Pelet Sel ... 8
Penentuan Konsentrasi Vitamin C, Teh Hijau dan Etanol terhadap
Peroksidasi Lipid pada Suspensi Sel ... 9
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi
Lipid pada Supernatan Sel ... 10
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi
Lipid pada Suspensi Sel ... 11
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Viabilitas Sel ... 12
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 13
10
DAFTAR TABEL
Halaman
1 Metabolisme senyawa-senyawa radikal bebas ... 2
2 Sasaran kerusakan radikal bebas ... 3
3 Komposisi standar MDA ... 6
4 Efek vitamin C terhadap peroksidasi lipid pada pelet sel khamir
Candida
sp. ... 9
5 Efek teh hijau terhadap peroksidasi lipid pada pelet sel khamir
Candida
sp. ... 9
6 Efek vitamin C terhadap peroksidasi lipid pada supernatan sel khamir
Candida
sp. ... 11
7 Efek teh hijau terhadap peroksidasi lipid pada supernatan sel khamir
Candida
sp. ... 11
8 Efek vitamin C terhadap peroksidasi lipid pada suspensi sel khamir
Candida
sp. ... 12
9 Efek teh hijau terhadap peroksidasi lipid pada suspensi sel khamir
Candida
sp. ... 12
10 Efek vitamin C terhadap viabilitas sel khamir Candida sp. yang
diinkubasi etanol ... 12
11 Efek teh hijau terhadap viabilitas sel khamir
Candida
sp.
DAFTAR GAMBAR
Halaman
1 Sel Khamir
Candida
sp. ... 2
2 Struktur kimia malondialdehida ... 4
3 Struktur kimia kompleks MDA-TBA ... 4
4 Struktur kimia vitamin C ... 5
5 Struktur kimia flavonoid ... 5
6 Efek konsentrasi etanol terhadap peroksidasi lipid pada pelet sel khamir
Candida
sp. ... 8
7 Efek konsentrasi vitamin C terhadap peroksidasi lipid pada pelet sel
khamir
Candida
sp. ... 8
8 Efek konsentrasi vitamin C terhadap peroksidasi lipid pada suspensi sel
khamir Candida sp... 10
9 Efek konsentrasi teh hijau terhadap peroksidasi lipid pada suspensi sel
khamir
Candida
sp. ... 10
12
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 17
2 Populasi rerata biakan sel khamir
Candida
sp. ... 18
3 Kurva standar malondialdehida... 18
4 Pengukuran peroksidasi lipid pada pelet sel terhadap konsentrasi etanol... 18
5 Pengukuran peroksidasi lipid pada pelet sel terhadap konsentrasi
vitamin C ... 19
6 Pengukuran peroksidasi lipid pada pelet sel terhadap penambahan
vitamin C dan/atau etanol yang diinkubasi selama 1 jam ... 19
7 Pengukuran peroksidasi lipid pada pelet sel terhadap penambahan
teh hijau dan/atau etanol yang diinkubasi selama 1 jam ... 19
8 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
etanol ... 20
9 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
vitamin C ... 20
10 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
teh hijau ... 20
11 Pengukuran peroksidasi lipid pada supernatan sel terhadap penambahan
vitamin C dan/atau etanol yang diinkubasi selama 1 jam ... 21
12 Pengukuran peroksidasi lipid pada supernatan sel terhadap penambahan
teh hijau dan/atau etanol yang diinkubasi selama 1 jam ... 21
13 Pengukuran peroksidasi lipid pada suspensi sel terhadap penambahan
vitamin C dan/atau etanol yang diinkubasi selama 1 jam ... 21
14 Pengukuran peroksidasi lipid pada suspensi sel terhadap penambahan teh
hijau dan/atau etanol yang diinkubasi selama 1 jam ... 22
15 Hasil pengolahan data peroksidasi lipid pada pelet sel yang diberi
vitamin C dan/atau etanol dengan metode ANOVA ... 22
16 Hasil pengolahan data peroksidasi lipid pada pelet sel yang diberi teh hijau
dan/atau etanol dengan metode ANOVA ... 22
17 Hasil pengolahan data peroksidasi lipid pada supernatan sel yang diberi
vitamin C dan/atau etanol dengan metode ANOVA ... 23
18 Hasil pengolahan data peroksidasi lipid pada supernatan sel yang diberi
teh hijau dan/atau etanol dengan metode ANOVA ... 23
20 Hasil pengolahan data peroksidasi lipid pada suspensi sel yang diberi
teh hijau dan/atau etanol dengan metode ANOVA ... 24
21 Viabilitas sel khamir
Candida
sp.yang diberi vitamin C dan/atau etanol
yang diinkubasi selama 1 jam ... 25
22 Hasil pengolahan data viabilitas sel khamir
Candida
sp. yang diberi
vitamin C dan/atau etanol dengan metode ANOVA ... 25
23 Viabilitas sel khamir
Candida
sp. yang diberi teh hijau dan/atau
etanol yang diinkubasi selama 1 jam ... 26
24 Hasil pengolahan data viabilitas sel khamir
Candida
sp. yang diberi
teh hijau dan/atau etanol dengan metode ANOVA ... 26
PENDAHULUAN
Prooksidan dan antioksidan merupakan dua sifat zat tertentu di dalam sel. Keduanya memiliki peran dan fungsi yang berbeda. Prooksidan merupakan sifat senyawa yang dapat mendorong oksidasi pada komponen sel yang melibatkan senyawa radikal bebas dan berujung terjadinya reaksi rantai sedangkan antioksidan merupakan sifat senyawa yang dapat melindungi sel dari efek berbahaya radikal bebas oksigen reaktif.
Menurut Connors et al. (1992), radikal bebas adalah senyawa kimia yang memiliki elektron tidak berpasangan dan bersifat sangat reaktif sehingga mengakibatkan kerusakan struktur sel. Sumber spesies oksigen reaktif (ROS, Reactive Oxygen Species) atau radikal bebas dibagi dua yaitu dari dalam tubuh dan luar tubuh. Sumber dalam tubuh biasanya merupakan produk samping metabolisme seperti radikal anion superoksida (O2•־),
hidrogen peroksida (H2O2), radikal hidroksil
(OH•־), radikal alkoksil (RO•־), radikal peroksil (ROO•־), dan radikal oksida nitrit (NO•־) sedangkan sumber luar tubuh yaitu berasal pencemaran lingkungan. Senyawa-senyawa tersebut dapat bereaksi dengan molekul-molekul hayati terutama pada sel dan pada jaringan yang luka atau rusak.
Etanol merupakan senyawa prooksidan. Metabolisme etanol secara nyata berefek sangat bahaya karena menimbulkan radikal bebas yang mendorong peroksidasi lipid sel (Skrzdlewska et al. 2004). Radikal bebas ini dapat mengubah struktur dan fungsi sel sehingga mengubah peranan dan mekanisme sel tersebut, dan akhirnya dapat meningkatkan kerusakan oksidatif (Kato et al. 1990 dan Nordmann 1994).
Indonesia memiliki kekayaan tumbuhan obat yang melimpah dan digunakan secara turun-temurun di kalangan masyarakat. Salah satu di antaranya, penggunaan teh hijau untuk minuman yang berkhasiat sebagai antioksidan. Selain itu, penggunaan vitamin seperti vitamin C sebagai pencegahan penyakit telah lama digunakan dan saat ini vitamin C telah diproduksi secara sintetis dalam skala industri.
Untuk melihat sifat antioksidan atau prooksidan suatu senyawa maka perlu penelitian di tingkat sel. Penggunaan sel khamir sebagai model dapat menjelaskan beberapa tipe kematian sel, seperti peroksidasi lipid (Manon 2004). Sedangkan menurut Costa et al. (1997) bahwa sel khamir dapat menjelaskan mekanisme antioksidan secara
enzimatik yang disebabkan oleh stres oksidatif etanol. Selain itu, penggunaan sel khamir sebagai model karena memiliki keuntungan yaitu mudah didapat dan diisolasi serta biaya penelitian yang murah dan cepat. Berdasarkan hasil penelitian sebelumnya, Lisnawati (2004) menjelaskan bahwa penambahan vitamin C dan teh hijau pada sel khamir dapat menurunkan viabilitas sel bila tidak dikenai stres etanol dan meningkatkan viabilitas sel ketika diberi stres etanol.
Penelitian ini bertujuan untuk mengetahui sifat prooksidan dan antioksidan senyawa vitamin C dan teh hijau terhadap sel khamir
Candida sp. berdasarkan peroksidasi lipid sel yang dikenai stres etanol atau tidak. Hipotesis yang dikemukakan yaitu vitamin C dan teh hijau dapat bersifat prooksidan, yakni meningkatkan jumlah malondialdehida pada peroksidasi lipid sel yang tidak dikenai cekaman oksidatif, namun dapat juga bersifat antioksidan yakni menurunkan jumlah malondialdehida pada peroksidasi lipid sel yang mengalami cekaman oksidatif oleh etanol
.
Manfaat yang diharapkan yaitu meningkatnya kemungkinan penggunaan sel khamir Candida sp. sebagai model sederhana untuk pengujian peroksidasi lipid sel serta pengujian khasiat obat-obatan tradisional maupun sintetis yang berkhasiat sebagai antioksidan secara murah dan cepat.TINJAUAN PUSTAKA
Khamir (Candida sp.)
Khamir termasuk kelompok jamur yang banyak dimanfaatkan oleh manusia saat ini terutama dalam pembuatan bir, anggur, dan berbagai jenis produk fermentasi lainnya. Karakteristik khamir secara luas dipisahkan oleh habitat alaminya. Umumnya ditemukan pada daun dan bunga tumbuhan, tanah dan air laut. Khamir juga dapat ditemukan pada permukaan kulit dan saluran usus hewan-hewan berdarah panas yang hidup sebagai parasit atau bersimbiosis (Inge 1987).
Organel lainnya adalah sitoplasma yang mempunyai badan golgi, inti sel, mitokondria dan vakuola yang bertindak sebagai tempat persediaan nutrisi (Berry 1966).
Menurut Barnett et al. (1982) khamir ini (Gambar 1) mempunyai klasifikasi sebagai berikut:
Kingdom : Fungi
Filum : Ascomycota Kelas : Hemiascomycetes Ordo : Sacharomycetales Famili : Cadidaceae Genus : Candida
Spesies : Candida sp.
Gambar 1 Sel khamir Candida sp.
Stres Oksidatif
Istilah stres oksidatif digunakan untuk menyatakan keadaan ketidakseimbangan antara oksidasi dan antioksidasi di dalam tubuh. Kondisi ini terjadi apabila pertahanan antioksidan di dalam tubuh tidak betul-betul efektif sehingga meningkatkan pembentukan radikal bebas, misalnya kerusakan jaringan oleh senyawa radikal melalui reaksi rantai. Aktivitas radikal bebas inilah yang merupakan penyebab atau mendasari keadaan patologis (Kartikawati 1999).
Radikal bebas, oksidan adalah molekul yang mempunyai satu atau lebih elektron yang tidak berpasangan pada orbital luarnya yang bersifat reaktif (Connors etal. 1992). Elektron ini cenderung untuk berpasangan dengan menarik elektron dari senyawa lainnya sehingga membentuk radikal baru. Bila reaksi ini terus berlanjut, maka terjadi reaksi rantai sampai radikal bebas dihilangkan oleh radikal bebas lainnya atau sistem antioksidan tubuh (Ruxton 1994).
X - H + •O - H → H - O - H + X• Radikal hidroksil Radikal baru
Senyawa radikal bebas berasal dari berbagai sumber di antaranya dari dalam
tubuh yaitu reaksi redoks biokimia yang melibatkan senyawa oksigen. Reaksi ini terjadi pada sebagian besar proses metabolisme sel tubuh normal tetapi oleh suatu sebab senyawa tersebut terbentuk dalam jumlah berlebihan. Senyawa yang dihasilkan dari reaksi redoks ini disebut senyawa oksigen reaktif yang sebagian berbentuk radikal (hidroksil, peroksil dan superoksida) dan sebagian lainnya berbentuk non radikal (asam hipoklorit dan H2O2). Senyawa oksigen reaktif
dibentuk dari hasil reduksi senyawa oksigen yang merupakan suatu senyawa yang diperlukan oleh semua organisme aerobik untuk menghasilkan ATP. Pada proses tersebut terjadi reduksi O2 menjadi H2O yang
secara sederhana dapat dinyatakan sebagai berikut:
O2 + 4H+ + 4e- → H2O
(pada mitokondria)
Dari reaksi di atas terlihat bahwa reaksi reduksi oksigen memerlukan pengalihan empat elektron secara bertahap. Setiap tahap hanya melibatkan satu elektron. Proses pengalihan elektron yang berjalan kurang sempurna menghasilkan senyawa-senyawa oksigen reaktif atau radikal yang dapat merusak sel (Tabel 1). Selain itu, proses fagositosis yang berperan dalam reaksi inflamatori terkontrol pada jaringan yang luka. Proses fagositosis ini menghasilkan sejumlah besar superoksida (O2-) yang bertujuan untuk membunuh mikroganisme asing.
Tabel 1 Metabolisme senyawa-senyawa radikal bebas (Miller et al. 1993) Reaksi Produk
O2 + e-→ O2- Superoksida
2O2
+ 2H+ → O2 +
H2O2
Hidrogen peroksida 2O2 + 2Fe+ → 2FeO +
O2
Besi teroksidasi
H2O2 +Fe 2+ →
Fe3+ + O2
+ OH•
Radikal hidroksil OH• + RH atau LH →
H2O + R• atau L•
Asam lemak atau molekul organik teroksidasi R• + LH → RH + L• Asam lemak
Teroksidasi L• atau R• + O2→ LO2•
atau RO2
• Radikal peroksidasi
LO2• + LH → LHO2 Lipid
3
Sedangkan dari luar tubuh yakni sebagai respon terhadap radiasi (matahari/UV dan radiasi ionisasi), senyawa pencemar (logam berat, pestisida, dan toksin), obat-obatan seperti penisilamin, aktivitas yang berlebihan, merokok, stres dan hiperoksia (Connors etal. 1992).
Dampak Stres Oksidatif
Komponen terpenting membran sel adalah fosfolipid, glikolipid, kolesterol dan protein. Dua komponen pertama mengandung asam lemak tak jenuh ganda (linoleat, linolenat, dan arakhidonat) yang peka terhadap serangan radikal bebas, terutama radikal bebas hidroksil (Suryohudoyo 1995). Radikal hidroksil dapat menimbulkan reaksi rantai yang dikenal dengan peroksidasi lipid.
Peningkatan stres oksidatif menyebabkan rusaknya komponen sel seperti asam lemak tak jenuh ganda pada membran sel, protein seperti enzim dan pengangkut ion membran DNA (Halliwell et al. 1992). Berikut ini ditunjukkan pada Tabel 2 beberapa sasaran kerusakan yang ditimbulkan oleh radikal bebas.
Tabel 2 Sasaran kerusakan radikal bebas (Rice-Evan et al. 1991)
Target Kerusakan Akibat DNA atau RNA Protein Asam lemak tak jenuh Pemotongan rantai deoksiribosa; kerusakan basa, pemutusan rantai. Penggabungan dan ikatan silang, fragmentasi dan pematahan, modifikasi gugus tiol. Kehilangan ketidakjenuhan; formasi dari metabolit reaktif (Malondi-aldehida, 4- hidroksi-nonenal) Mutasi; kesalahan translasi, penghambatan sintesis protein. Modifikasi transpor ion; meningkatkan pemasukan kalsium, memodifikasi enzim. Mengubah fluiditas lipid; mengubah permeabilitas membran, mempengaruhi enzim yang terikat pada membran.
Hasil akhir reaksi ini adalah terputusnya rantai asam lemak menjadi senyawa yang bersifat toksik terhadap sel dan jaringan, antara lain: malondialdehida, 9-hidroksi-nonenal serta berbagai hidrokarbon seperti etana dan pentana (Halliwell et al. 1992).
Radikal hidroksil dapat menimbulkan berbagai perubahan formasi DNA, antara lain hidroksilasi pada basa timin dan sitosin, pembukaan inti purin dan pirimidin serta terputusnya rantai fosfodiester DNA. Namun bila kerusakan ini terlalu parah, misalnya terputusnya rantai DNA di berbagai tempat, maka replikasi gen terganggu dan perbaikan DNA dapat menimbulkan mutasi. Keadaan ini disebabkan oleh enzim DNA polimerase kehilangan ketelitiannya dalam mereplikasi DNA sehingga sistem perbaikan DNA cenderung membuat kesalahan. Bila hal itu terjadi, maka dapat menimbulkan sel kanker atau disebut proto onkogen (Aruoma 1998).
Kerusakan protein terjadi pada kondisi stres oksidatif karena senyawa radikal bebas bereaksi dengan asam-asam amino penyusun protein (oksidasi protein). Di antara asam amino penyusun protein yang paling lemah ikatannya adalah sistein yang mengandung gugus sulfihidril:
R-SH + OH• → R-S• + H2O
Ikatan disulfida menimbulkan ikatan intra atau antar molekul protein sehingga protein kehilangan fungsi fisiologisnya. Kerusakan oksidatif pada protein in vivo mengganggu fungsi reseptor sel, enzim, protein transpor dan dimungkinkan dapat menghasilkan antigen baru yang menimbulkan respon imun (Aruoma 1998). Stres oksidatif mempunyai implikasi luas terhadap berbagai macam proses penurunan penyakit di antaranya: arterosklerosis, penyakit Parkinson, penyakit Alzheimer dan kerusakan otak atau hati (Cotelle 2001).
Malondialdehida (MDA)
produk penguraian jaringan lain dengan membentuk pigmen terlarut dan terakumulasi di dalam jaringan yang sudah tua (Vishwanath 2003). Menurut Pryor et al. (1976) MDA (Gambar 2) adalah senyawa dialdehida atau berkarbon tiga yang reaktif merupakan produk final peroksidasi lipid di dalam membran sel. MDA dalam material hayati terdapat dalam bentuk bebas atau membentuk ikatan kompleks dengan unsur lainnya di dalam jaringan. Menurut Bird dan Draper (1984) sumber utama peroksidasi lipid yaitu asam lemak yang memiliki tiga atau banyak ikatan ganda dalam suatu rantai asam lemak.
Analisis MDA dapat dilakukan dengan metode uji Thiobarbituric Acid Reaction atau TBA (Rice-Evans et al. 1991). MDA dapat bereaksi melalui penambahan nukleofilik dengan TBA membentuk senyawa kompleks MDA-TBA (Gambar 3) berwarna pink dan diukur dengan spektrofotometer pada panjang gelombang 532 nm.
CH2 C
O H C
O
H
Gambar 2 Struktur kimia malondialdehida.
Gambar 3 Struktur kimia kompleks MDA-TBA.
Prooksidan dan Antioksidan
Prooksidan adalah senyawa yang dapat mengoksidasi senyawa seperti lipid secara berlebih pada membran sel. Produknya menimbulkan beberapa penyakit degeneratif (Cotelle 2001). Senyawa radikal dapat mengoksidasi lipid melalui tiga tahap reaksi rantai yakni diawali dengan inisiasi yaitu tahap pembentukan awal radikal-radikal bebas. Energi untuk reaksi ini diberikan oleh cahaya ultraviolet.
RH + O2 → R•+ OH•
R• + O
2 → • + ROO•
Propagasi adalah tahap penambahan radikal-radikal baru dalam suatu reaksi rantai.
ROO•+ RH → R• + ROOH
ROOH → ROO• + HO•
Terminasi adalah tahap pengubahan radikal bebas menjadi senyawa stabil dan tidak reaktif sehingga dapat mengakhiri daur propagasi radikal bebas.
R• + R• → RR
R• + ROO• → ROOR
ROO• + ROO• → ROOR + O
2
(Murray et al. 2003)
Menurut Krinsky (1992) dan Ruxton (1994), tubuh manusia dalam kondisi normal mempunyai sistem antioksidan yang dapat menangkal aksi radikal bebas, yaitu sistem enzimatis dan non enzimatis. Sistem enzimatis mencakup glutation peroksidase, superoksida dismutase (SOD) dan katalase, sedangkan sistem non enzimatis meliputi antioksidan larut lemak (α-tokoferol, -karoten, kuinon) dan antioksidan larut air (vitamin C dan urat). Menurut Lazar (1994), pengertian antioksidan secara kimia adalah senyawa-senyawa pendonor elektron. Dalam pengertian klasik istilah antioksidan menunjukkan senyawa yang memiliki berat molekul rendah dan dapat menginaktivasi reaksi rantai dari peroksidasi lipid dengan jalan mencegah terbentuknya radikal peroksilipid.
Antioksidan bereaksi melalui pembersihan senyawa oksigen reaktif atau penurunan konsentrasinya secara lokal, pembersihan ion logam katalitik, pembersihan radikal bebas yang berfungsi sebagai inisiator seperti hidroksil, peroksil, alkoksil, pemutus rangkai reaksi yang diinisiasi oleh radikal bebas dan peredam reaksi serta pembersih singlet oksigen (Berry 1966; Halliwell et al. 1992).
Berdasarkan mekanisme kerjanya, antioksidan dapat digolongkan menjadi tiga bagian yaitu antioksidan primer terdiri atas SOD dan katalase yang berfungsi mengurangi pembentukan radikal bebas baru dengan memutus reaksi rantai dan mengubahnya menjadi produk-produk yang lebih stabil; antioksidan sekunder terdiri atas -karoten, urat, bilirubin, albumin, vitamin C, E dan teh hijau yang berfungsi sebagai pengikat radikal bebas, merombak H2O2 menjadi spesies non
5
sulfoksida reduktase yang berfungsi sebagai mekanisme perbaikan biomolekular.
Vitamin C (Asam Askorbat)
Vitamin C merupakan zat antioksidan sekunder yang banyak terdapat pada sayuran dan buah-buahan seperti jeruk, tomat, selada, dan brokoli. Vitamin C (C6H8O6) merupakan
antioksidan larut air dan menjadi bagian pertahanan pertama terhadap spesies oksigen reaktif dalam plasma dan sel (Zakaria 1996). Dalam keadaan murni, vitamin C berbentuk kristal putih, mudah larut air, stabil dalam bentuk kering, dan mudah teroksidasi terhadap logam-logam seperti Cu dan Fe serta pemanasan langsung (Casmir & David 2002). Secara reversibel asam askorbat dapat membentuk asam dehidro askorbat yang kehilangan dua atom hidrogen. Struktur vitamin C yang disajikan pada Gambar 4, menyerupai struktur monosakarida tetapi mengandung gugus enadiol (Muchtadi 1993). Di dalam tubuh, bentuk asam askorbat dan asam dehidro askorbat timbul bersama-sama berada dalam keseimbangan tetapi bentuk dehidro memiliki aktivitas kurang stabil (Hardesty 1993).
Gambar 4 Struktur kimia vitamin C.
Teh Hijau (Camellia sinensis)
Teh hijau merupakan minuman kesehatan yang dibuat dari daun teh Camellia sinensis. Jenisnya dibedakan berdasarkan proses pengolahan yaitu teh hijau (teh non fermentasi), teh oolong (teh semi fermentasi) dan teh hitam (teh fermentasi) (Ensminger et al. 1994).
Struktur kimia flavonoid yang disajikan pada Gambar 5 merupakan turunan benzo -pyrone dan terdiri atas cincin benzena (cincin A) dihubungkan dengan cincin karbon hetero siklik (cincin C) dan karbon C-2 yang membawa gugus fenil (cincin B) sebagai subtitusi (Cotelle 2001). Antioksidan flavonoid berfungsi sebagai pencegahan radikal bebas dengan mendonorkan atom
hidrogen (Rajalakshmi & Narasimhan 1996). 3’,4’-dihidroksi pada cincin B merupakan target radikal bebas yang bermanfaat sebagai antioksidan. Ikatan ganda karbon C-2 dan C-3 berkonjugasi dengan gugus 4-keto yang responsibel untuk perpindahan elektron pada cincin B dan meningkatkan kapasitas pencegahan radikal. Sedangkan 7,8-dihidroksi pada cincin A akan menurunkan aktivitas radikal bebas.
Ekstrak teh hijau mengandung senyawa flavonoid merupakan hasil metabolisme sekunder polifenol. Flavonoid dikelompokkan ke dalam 6 sub kelas yaitu flavanol, flavanone, flavonol, flavone, antocianidin dan fenil propanoid (Amic etal. 2003 & Cotelle 2001). Kelompok flavanol merupakan kelompok terbesar dalam ekstrak teh hijau (Middleton 1998). Kelompok ini sangat kuat melawan radikal bebas atau spesies oksigen reaktif (Groot 1994 & Halliwell 1995).
Flavonoid dapat menghambat aktivitas biologi di antaranya anti alergi, anti virus, dan anti peradangan. Sedangkan efek farmakologi, telah dihubungkan dengan sifat antioksidan molekul ini, yaitu dapat menekan bentuk spesies oksigen reaktif dengan menghambat enzim, mencegah spesies radikal khususnya spesies oksigen reaktif dan melindungi sel dari antioksidan yang bersifat radikal (Cotelle 2001). Konsumsi teh telah dihubungkan dengan penurunan resiko penyebab penyakit utama seperti penyakit jantung koroner, stroke, dan kanker (Benzie & Szeto 1999).
Gambar 5 Struktur kimia flavonoid.
BAHAN DAN METODE
Bahan dan Alat
Tengah yang terkontaminasi dengan limbah bahan bakar minyak (Saono & Gandjar 1974), teh hijau cap Kepala Djenggot, vitamin C dari Kimia Farma, bakto pepton, ekstrak khamir, bakto agar, KH2PO4
.
3H2O, K2HPO4
. 3H2O,
MgSO4.7H2O, ZnSO4.7H2O, MnSO4.H2O,
CuSO4, glukosa, gliserol, etanol, akuades
steril, asam trikloroasetat (TCA), asam-2-tiobarbiturat (TBA), MDA (1,1,3,3-tetraetoksi propana).
Alat-alat yang digunakan adalah alat-alat gelas, colony counter, shaker, autoklaf,
laminar air flow hood, vortex, spatula segi tiga, inkubator, penangas air, termometer, kertas saring milipore 0,1 m, pompa vakum, mikro pipet, neraca analitik, neraca kasar, sentrifus, tabung sentrifus, kuvet, dan spektrofotometer GENESYS 20.
MetodePenelitian Pembuatan Media
Media cair gliserol dibuat dalam gelas piala 1000 mL dengan komposisi 2,4 mL gliserol, 1,3 g K2HPO4
.
3H2O, 0,15 g
MgSO4.7H2O, 3,0 g ekstrak khamir, 4,0 g
bakto pepton, dan 10 mL larutan X (5,0 g ZnSO4.7H2O, 3,0 g MnSO4.H2O, 2,8 g CuSO4,
dan 250 mL akuades), dilarutkan ke dalam 1 L akuades. Kemudian media dipindahkan ke dalam erlenmeyer 250 mL sebanyak 100 mL, dan disterilisasi dengan autoklaf pada suhu 121 °C dan tekanan 1 atm selama 15 menit.
Media agar yang digunakan untuk menumbuhan sel khamir Candida sp. dalam cawan petri yaitu YEA (Yeast Extract Agar). Ke dalam erlenmeyer 1 L dimasukkan 3,0 g ekstrak khamir, 50,0 g bakto pepton, 20,0 g bakto agar, 10,0 g glukosa, 0,5 g MgSO4.7H2O, 1,0 g K2HPO4.3H2O kemudian
dilarutkan dengan akuades tepat 1 L lalu dipanaskan untuk mempercepat kelarutan. Selanjutnya media disterilisasi selama 15 menit pada suhu 121 °C, 1 atm. Dalam keadaan cukup hangat, sekitar 10-15 mL media dituang ke dalam cawan petri steril secara aseptis.
Pembuatan Stok Kultur Sel Khamir
Sel Khamir Candida sp. yang telah ditumbuhkan dalam media agar (stok isolat) diinokulasikan secara aseptis ke media gliserol sebanyak 2 ose kemudian diinkubasi selama dua hari dengan penggojokan 100 rpm.
Setelah itu, untuk peremajaan setiap dua hari sekali biakan diambil 1 mL dan dimasukkan ke dalam media cair gliserol yang baru.
Standardisasi Malondialdehida (MDA)
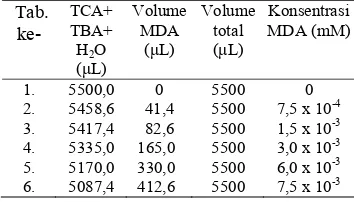
Dalam penentuan kurva standar MDA, disediakan larutan induk 2 mL MDA 0,1 mМ. Sebanyak 10,4 mL TCA 75% (b/v) ditambahkan ke dalam 41,6 mL akuades dan 19,5 mL TBA 0,67% (b/v) dalam sebuah gelas piala lalu diaduk sampai homogen. Kemudian disediakan 6 buah tabung reaksi dengan komposisi pengisian seperti pada Tabel 3 lalu dipanaskan dalam penangas air bersuhu 95 °C selama 1 jam. Setelah itu, didinginkan dalam suhu ruang dan diukur absorbannya dengan spektrofotometer pada maksimum 532 nm.
Tabel 3 Komposisi standar MDA Tab.
ke-TCA+ TBA+ H2O ( L) Volume MDA ( L) Volume total ( L) Konsentrasi MDA (mM) 1. 2. 3. 4. 5. 6. 5500,0 5458,6 5417,4 5335,0 5170,0 5087,4 0 41,4 82,6 165,0 330,0 412,6 5500 5500 5500 5500 5500 5500 0 7,5 x 10-4 1,5 x 10-3 3,0 x 10-3 6,0 x 10-3 7,5 x 10-3
Pengukuran Peroksidasi Lipid Sel Khamir
Pengukuran peroksidasi lipid sel dilakukan dengan mengukur konsentrasi MDA yang terbentuk mengacu metode Ray et al. (2002) yang telah dimodifikasi. Pengukuran MDA pada sel khamir Candida sp. dilakukan dengan dua cara yakni pengukuran konsentrasi MDA pada pelet dan larutan suspensi sel. Pengukuran pada pelet, perlakuan langsung ditambahkan ke dalam biakan gliserol berumur dua hari setelah diinkubasi dengan penggojokan 100 rpm selama 1 jam lalu pelet dianalisis. Sedangkan pada pengukuran larutan suspensi sel, biakan yang berumur 2 hari disentrifus. Kemudian pelet dilarutkan dalam akuades dan diberi perlakuan. Setelah diinkubasi dengan penggojokan 100 rpm selama 1 jam lalu dianalisis supernatan dan larutan suspensinya.
7
mL biakan sel khamir ditambah 7,5 mL akuades; untuk perlakuan vitamin C, 12,5 mL biakan sel ditambah 3,5 mL akuades dan 4 mL vitamin C 6 mg/mL sehingga konsentrasi dilarutan sebesar 1,2 mg/ml; untuk perlakuan etanol, 12,5 mL biakan ditambah 4 mL akuades dan 3,5 mL etanol absolut sehingga konsentrasinya menjadi 17,5%; untuk perlakuan vitamin C dan etanol, 12,5 mL biakan ditambah 4 mL vitamin C dan 3,5 mL etanol absolut. Kemudian semua tabung diinkubasi dengan penggojokan 100 rpm selama 1 jam. Setelah itu, disentrifus 4440 G selama 5 menit lalu pelet dibilas dengan akuades dan disentrifus kembali. Kemudian pelet ditambah TCA 25% (b/v) hingga tepat 2 mL dan dikocok. Setelah itu, larutan dimasukkan ke dalam tabung reaksi yang telah dimasukkan 1,5 mL TBA 0,67% (b/v), dikocok dan ditutup rapat. Kemudian dipanaskan dalam penangas air bersuhu 95 °C selama 1 jam lalu dinginkan dalam suhu ruang. Selanjutnya disentrifus 4440 G selama 15 menit kemudian supernatan diukur absorbannya pada 532 nm. Sedangkan untuk sampel teh hijau, dibuat ekstrak teh hijau dengan menyeduh 1 g teh hijau ke dalam 100 ml akuades bersuhu 90 °C selama 10 menit sambil diaduk kemudian disaring. Setelah dingin, ekstrak teh dilakukan dengan cara yang sama seperti di atas sehingga konsentrasi teh dilarutan sebesar 2 mg/mL. Untuk blanko, dimasukkan dalam tabung reaksi 0,5 mL akuades ditambah 1,5 mL TCA 25% (b/v) dan 1,5 mL TBA 0,67% (b/v) dan dikocok, selanjutnya dilakukan dengan cara yang sama seperti di atas. Konsentrasi MDA ditentukan dengan membandingkan besar absorban pengukuran dengan kurva standar dan hasilnya dinyatakan dalam satuan konsentrasi nM MDA/106colonyformingunit (CFU).
Pengukuran MDA Supernatan dan Suspensi Sel Khamir yang Diberi Vitamin C, Teh Hijau dan/atau Etanol Selama 1 Jam. Sebanyak 200 mL biakan sel khamir dalam media cair gliserol yang berumur dua hari disentrifus dengan kecepatan 4440 G selama 5 menit lalu diambil bagian peletnya dan dibilas. Setelah itu, ditepatkan 25 mL dengan akuades. Ke dalam tabung reaksi dimasukkan, untuk kontrol, 2 mL suspensi sel khamir ditambah 1,2 mL akuades; untuk perlakuan vitamin C, 2 mL suspensi sel ditambah 0,56 mL akuades dan 0,64 mL vitamin C 0,1 mg/mL sehingga konsentrasi akhir dalam larutan sebesar 0,02 mg/mL; untuk perlakuan etanol, 2 mL suspensi sel ditambah 0,64 mL akuades ditambah 0,56 mL
etanol 5,71% (v/v) sehingga konsentrasi dilarutan sebesar 1% (v/v); untuk perlakuan vitamin C dan etanol, 2 mL suspensi sel ditambah 0,64 mL vitamin C dan 0,56 mL etanol absolut. Kemudian semua tabung reaksi ditutup rapat dan diinkubasi dengan penggojogan 100 rpm selama 1 jam. Setelah itu, disentrifus selama 5 menit 4440 G dan diambil supernatannya lalu ditepatkan menjadi 4 mL dengan akuades. Kemudian ditambah 0,8 mL TCA 75% (b/v) dan 1,5 mL TBA 0,67% (b/v) lalu dipanaskan dalam penangas air bersuhu 95 °C selama 1 jam dan didinginkan dalam suhu ruang. Setelah dingin, semua larutan disentrifus 12400 G selama 5 menit kemudian masing-masing larutan tersebut diukur absorbannya pada 532 nm. Sedangkan untuk pengukuran peroksidasi lipid pada suspensi sel, setelah diinkubasi selama 1 jam kemudian larutan ditambahkan TCA dan TBA seperti di atas lalu dikerjakan dengan cara yang sama. Untuk sampel teh hijau, disiapkan ekstrak teh hijau 7 mg/mL dengan pengerjaan dan komposisi volume yang sama seperti pada penambahan vitamin C sehingga konsentrasi dalam larutan sebesar 1,4 mg/mL. Untuk blanko, dimasukkan 3,2 mL akuades, 0,8 mL TCA 75% (b/v) dan 1,5 mL TBA 0,67% (b/v) ke dalam tabung reaksi dan selanjutnya dilakukan dengan cara yang sama seperti di atas.
Pengaruh Penambahan Vitamin C, Teh Hijau dan/atau terhadap Viabilitas Sel Khamir
biakan sel ditambah ditambah 4 mL vitamin C dan 3,5 mL etanol; untuk perlakuan vitamin C dan etanol, 12,5 mL biakan sel ditambah 4 mL vitamin C steril 6 mg/mL dan 3,5 mL etanol absolut; untuk perlakuan teh hijau dan etanol, 12,5 mL biakan sel ditambah 4 mL teh hijau steril 10 mg/mL dan 3,5 mL etanol absolut. Kemudian semua campuran dalam tabung tersebut diinkubasi dengan penggojokan 100 rpm selama 1 jam. Setelah itu, diambil sebanyak 100 L lalu ditanam ke dalam media YEA dengan metode cawan sebar (pour plate). Setelah itu, diinkubasi pada suhu 30 °C selama 2 hari dan dihitung jumlah koloni yang tumbuh. Jumlah koloni yang tumbuh dinyatakan dalam satuan CFU/mL.
Analisis Statistik
Data dianalisis menggunakan analisis statistik ANOVA untuk mengetahui berbeda nyata atau tidak pada taraf uji 5%.
HASIL DAN PEMBAHASAN
Penentuan Konsentrasi Etanol dan Vitamin C terhadap Peroksidasi Lipid pada Pelet
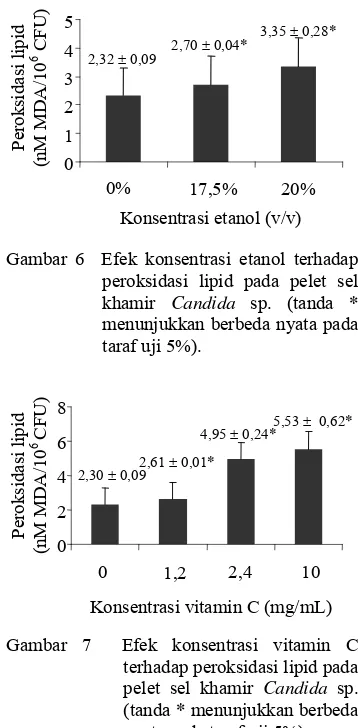
Penentuan konsentrasi etanol pada pelet sel dilakukan untuk menentukan besaran konsentrasi etanol minimum yang diberikan pada biakan agar sel mengalami cekaman oksidatif tanpa disertai dengan peningkatan kematian sel. Senyawa etanol mencerminkan sifat prooksidan dengan menunjukkan peningkatan jumlah peroksidasi lipid pada pelet sel seiring dengan peningkatan penambahan konsentrasi etanol ke dalam biakan (Gambar 6). Penambahan etanol 20% lebih toksik terhadap sel Candida sp. dibandingkan penambahan etanol 17,5%. Kondisi ini ditunjukkan dengan peningkatan jumlah peroksidasi lipid pada pelet sel setelah penambahan etanol 20% sebesar 3,35 ± 0,28 nM MDA/106 CFU. Indikasinya setelah 1 jam
inkubasi, yaitu terjadinya kerusakan pada membran lipid sehingga menyebabkan perubahan tekanan osmotik di dalam sel yang mendorong ke arah kematian sel (Nijveldt et al 2001). Sedangkan penambahan etanol 17,5%, juga terjadi peroksidasi lipid pada sel dengan jumlah konsentrasi MDA sedikit lebih tinggi dari kontrol sehingga diperkirakan jumlah kematian sel tidak terlalu signifikan.
Gambar 6 Efek konsentrasi etanol terhadap peroksidasi lipid pada pelet sel khamir Candida sp. (tanda *
menunjukkan berbeda nyata pada taraf uji 5%).
Gambar 7 Efek konsentrasi vitamin C terhadap peroksidasi lipid pada pelet sel khamir Candida sp. (tanda * menunjukkan berbeda nyata pada taraf uji 5%).
Sifat prooksidan yang rendah terlihat pada penggunaan konsentrasi vitamin C 1,2 mg/mL setelah sel khamir diinkubasi selama 1 jam sebesar 2,61 ± 0,01 nM MDA/106 CFU, sedikit lebih tinggi dari kontrol sebesar 2,30 ± 0,09 nM MDA/106 CFU. Pada konsentrasi ini, diharapkan mekanisme antioksidan lebih dominan bekerja daripada sifat prooksidan terhadap sel khamir Candida sp..
Khusus teh hijau, tidak dilakukan pengukuran untuk penentuan konsentrasi. Konsentrasi teh hijau yang digunakan untuk perlakuan merujuk pada petunjuk pemakaian yang tertera dalam kemasan teh hijau.
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi Lipid Pelet Sel
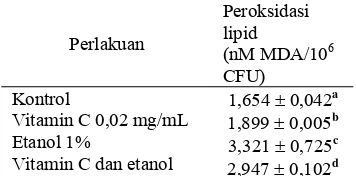
Tabel 4 menampilkan data produk peroksidasi lipid pelet sel khamir Candida sp. (malondialdehida).
2,30 ± 0,092,61 ± 0,01* 4,95 ± 0,24*
5,53 ± 0,62*
0 2 4 6 8
0 1,2 2,4 10
Pe roksida si l ip id (nM MDA/ 10
6 CFU
)
Konsentrasi vitamin C (mg/mL)
2,32 ± 0,09 2,70 ± 0,04*
3,35 ± 0,28*
0 1 2 3 4 5
0% 17,5% 20%
Pe roksi d as i lip id (n M MDA/1 0
6 CFU)
9
Tabel 4 Efek vitamin C terhadap peroksidasi lipid pada pelet sel khamir Candida
sp.
Perlakuan
Peroksidasi Lipid
(nM MDA/106 CFU)
Kontrol
Vitamin C 1,2 mg/mL Etanol 17,5% Vitamin C dan etanol
2,12 ± 0,07a 2,50 ± 0,12b 2,71 ± 0,05c 1,83 ±0,12d
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Setelah 1 jam inkubasi, terjadi peningkatan jumlah peroksidasi lipid pelet sel pada kelompok penambahan etanol 17,5% dan kelompok vitamin C 1,2 mg/mL sebesar 2,71 ± 0,05 nM MDA/106 CFU dan 2,50 ± 0,12 nM MDA/106 CFU. Sebaliknya kelompok
penambahan etanol dan vitamin C pada biakan sel khamir Candida sp. menghasilkan jumlah peroksidasi lipid pada pelet sebesar 1,83 ± 0,12 nM MDA/106 CFU lebih rendah dibandingkan dengan kontrol.
Penyebabnya, mungkin penambahan konsentrasi vitamin C 1,2 mg/mL mampu menangkal serangan spesies oksigen reaktif dan menghentikan reaksi rantai radikal bebas sekaligus melindungi membran sel dari serangan radikal bebas, baik dari dalam sel yang merupakan hasil metabolisme atau dari luar sel. Indikasi lainnya adalah senyawa MDA yang terbentuk, telah dikeluarkan sebagian oleh khamir keluar sel dan larut dalam media cair gliserol. Kemudian terbuang pada saat pencucian sel sehingga hasil pengukuran MDA, absorban yang terbaca di spektrofotometer bukan yang sebenarnya. Oleh karena itu, perlu dilakukan pengukuran konsentrasi senyawa MDA terhadap supernatan selnya.
Tabel 5 menyajikan pengaruh teh hijau yang diinkubasi selama satu jam terhadap peroksidasi lipid pada pelet sel. Pada kelompok penambahan teh hijau dan etanol terjadi peningkatan peroksidasi lipid yang ditandai dengan konsentrasi MDA yang cukup signifikan sebesar 2,23 ± 0,03 nM MDA/106 CFU, lebih tinggi dari kelompok etanol. Hal ini menandakan bahwa teh hijau tidak mampu bekerja sebagai antioksidan dalam melindungi sel dari serangan radikal bebas walaupun dalam penambahan teh hijau 2 mg/mL ke dalam biakan tidak berefek prooksidan secara signifikan. Indikasi lainnya, jumlah radikal bebas yang menyerang sel lebih banyak
daripada jumlah flavonoid dalam menangkal dan melindungi sel dari serangan tersebut.
Uji nilai tengah menunjukkan berbeda nyata pada masing-masing kelompok terhadap penambahan vitamin C dan juga kelompok teh hijau 2 mg/mL dan kelompok teh hijau dan etanol terhadap kontrol, artinya ada pengaruh penambahan vitamin C dan teh hijau terhadap peroksidasi lipid pada pelet sel. Sedangkan penambahan etanol 17,5% (v/v) pada Tabel 5, tidak berbeda nyata terhadap kontrol artinya penambahan etanol 17,5% (v/v) tidak berpengaruh pada jumlah peroksidasi lipid pada pelet sel. Kondisi ini terjadi setelah 1 jam inkubasi, terjadi penguraian lipid sel yang disebabkan oleh radikal bebas dengan cepat dikeluarkan sel ke larutan gliserol sehingga pada pengukuran peroksidasi lipid pada pelet sel merupakan hasil pengukuran yang tidak sebenarnya.
Tabel 5 Efek teh hijau terhadap peroksidasi lipid pada pelet sel khamir Candida
sp.
Perlakuan
Peroksidasi lipid
(nM MDA/10-6 CFU)
Kontrol
Teh hijau 2 mg/mL Etanol 17,5% Teh hijau dan etanol
2,00 ± 0,07a 2,09 ± 0,05b 1,95 ± 0,14a 2,23 ± 0,03c
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Penentuan Konsentrasi Vitamin C, Teh Hijau dan Etanol terhadap Peroksidasi
Lipid pada Suspensi Sel
Pada dasarnya penentuan konsentrasi vitamin C, teh hijau dan etanol dilakukan karena jumlah volume larutan biakan sel
Pengukuran beberapa konsentrasi vitamin C telah menunjukkan sifat prooksidan senyawa tersebut terhadap sel khamir Candida
sp.. Penggunaan konsentrasi vitamin C sebesar 0,02 mg/mL memiliki sifat prooksidan yang rendah terhadap sel. Hal ini ditunjukkan dengan jumlah MDA yang dikeluarkan oleh sel khamir sedikit lebih tinggi dari kontrol sehingga penggunaan konsentrasi vitamin C tersebut lebih bersifat antioksidan terhadap sel (Gambar 8).
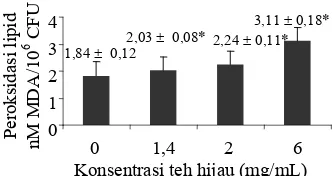
Teh hijau ternyata bersifat prooksidan terhadap sel setelah dilakukan pengukuran pada beberapa jumlah konsentrasi teh yang ditambahkan dalam larutan suspensi sel seperti yang ditunjukkan pada Gambar 9. Teh hijau 1,4 mg/mL mempunyai sifat prooksidan yang rendah. Pada konsentrasi ini diharapkan teh hijau lebih berperan sebagai antioksidan. Oleh karena itu, pada konsentrasi tersebut digunakan untuk pengukuran selanjutnya.
Gambar 10 menyajikan beberapa pengaruh konsentrasi etanol terhadap jumlah peroksidasi lipid pada larutan suspensi sel. Dari gambar tersebut, menunjukkan terjadinya peningkatan jumlah peroksidasi lipid sel yang ditandai pengeluaran hasil penguraian lipid pada membran sel di antaranya senyawa MDA. Hal ini membuktikan bahwa senyawa etanol bersifat prooksidan yang jumlahnya meningkat sebanding dengan peningkatan konsentrasi etanol dalam larutan. Data tersebut memperkuat hasil penelitian Costa et al. (1997) yang menggunakan senyawa etanol sebagai prooksidan untuk menginduksi
Saccharomycescerevisiae dalam mempelajari mekanisme antioksidan enzim SOD pada sel.
Gambar 8 Efek konsentrasi vitamin C terhadap peroksidasi lipid pada suspensi sel khamir Candida
sp. (tanda * menunjukkan berbeda nyata pada taraf uji 5%).
Gambar 9 Efek konsentrasi teh hijau terhadap peroksidasi lipid pada suspensi sel khamir Candida sp. (tanda *
menunjukkan berbeda nyata pada taraf uji 5%).
Gambar 10 Efek konsentrasi etanol terhadap peroksidasi lipid pada suspensi sel khamir Candida sp. (tanda *
menunjukkan berbeda nyata pada taraf uji 5%).
Konsentrasi etanol 1% dipilih sebagai stres oksidatif maksimum yang digunakan pada suspensi sel khamir karena jumlah MDA yang dikeluarkan lebih dari 2 kali lipat terhadap kontrol yaitu 4,20 ± 0,13 nM MDA/106 CFU dan kontrol sebesar 2,16 ± 0,12 nM MDA/106 CFU. Konsentrasi tersebut cukup ideal ditambahkan ke dalam suspensi sel khamir karena mampu memberikan stres oksidatif yang tidak berlebih terhadap sel khamir.
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi Lipid pada
Supernatan Sel
Untuk memperkuat data pengukuran peroksidasi lipid pada pelet sel maka dilakukan pengukuran peroksidasi lipid pada supernatan sel yang ditambahkan vitamin C atau teh hijau yang diberi stres etanol selama 1 jam (Tabel 6).
2,16 ±0,12 4,20 ±0,13*
5,60 ± 0,12* 6,23 ± 1,34*
0 2 4 6 8 10 12 14
0 1% 2% 5% 10%
Konsentrasi etanol (v/v)
P eroksi d as i li p id n M MDA/ 10
6 CF
U
10,07 ± 0,61* 1,84 ± 0,12
2,03± 0,08* 2,24 ±0,11* 3,11 ± 0,18*
0 1 2 3 4
0 1,4 2 6
Konsentrasi teh hijau (mg/mL)
P eroksi d as i li pid n M MDA/ 10
6 CFU
1,77 ± 0,05 2,09 ± 0,01* 2,23 ± 0,03*
0 0,5 1 1,5 2 2,5 3 3,5
0 0,02 0,1 0,2
Per oksi d as i li p id n M MDA/ 10
6 CF
U
Konsentrasi vitamin C (mg/mL)
11
Tabel 6 Efek vitamin C terhadap peroksidasi lipid pada supernatan sel khamir
Candida sp.
Perlakuan
Peroksidasi lipid
(nM MDA/106 CFU)
Kontrol
Vitamin C 0,02 mg/mL Etanol 1%
Vitamin C dan etanol
0,55 ± 0,05a 0,77 ± 0,05b 3,03 ± 0,18c 2,90 ±0,08d
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Peningkatan peroksidasi lipid pada supernatan sel terjadi pada kelompok penambahan vitamin C dan/atau etanol 1%. Hasilnya menunjukkan adanya peningkatan kerusakan sel setelah penambahan etanol sebesar 3,03 ± 0,18 nM MDA/106 CFU.
Penambahan kelompok vitamin C dan etanol pada supernatan sel dapat menurunkan peroksidasi lipid sel akibat stres etanol selama 1 jam sebesar 2,90 ± 0,08 nM MDA/106 CFU. Data tersebut membuktikan bahwa sebagian produk peroksidasi lipid sel telah disekresikan.
Tabel 7 mengambarkan kerusakan lipid juga terjadi setelah penambahan teh hijau dan/atau etanol selama satu jam. Peningkatan kerusakan lipid yang disekresikan keluar sel setelah sel mengalami stres etanol selama 1 jam sebesar 2,637 ± 0,355 nM MDA/106 CFU. Hasil tersebut menggambarkan etanol yang ditambahkan ke larutan suspensi sel secara cepat dimetabolisme oleh sel. Oksidasi etanol oleh enzim alkohol dehidrogenase yang terjadi di dalam sel akan menurunkan NADH dan produk spesies oksigen reaktif atau ROS bergantung pada NADH bebas yang dihasilkan oleh bermacam-macam organel setelah pemberian etanol pada sel (Kukielka et al. 1994).
Tabel 7 Efek teh hijau terhadap peroksidasi lipid pada supernatan sel khamir
Candida sp.
Perlakuan
Peroksidasi lipid (nM MDA/106 CFU) Kontrol
Teh hijau 1,4 mg/mL Etanol 1%
Teh hijau dan etanol
0,517 ± 0,005a 0,698 ± 0,035a 2,637 ± 0,355b 2,420 ± 0,112c
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Konsumsi teh hijau dan etanol secara bersama-sama dapat menurunkan peroksidasi lipid pada supernatan larutan suspensi sel khamir menjadi 2,420 ± 0,112 nM MDA/106 CFU. Walaupun sifat pencegahan teh hijau dari serangan radikal bebas cukup kecil tetapi terbukti mampu melindungi sel dari serangan radikal hidroksil. Pengukuran peroksidasi lipid supernatan sel pada penambahan teh hijau 1,4 mg/mL menunjukkan sifat tidak prooksidan terhadap sel bila dibandingkan dengan kontrol.
Uji nilai tengah dari hasil pengukuran peroksidasi lipid pada supernatan sel khamir setelah penambahan vitamin C dan/atau etanol 1% menunjukkan beda nyata pada taraf uji 5%, artinya masing-masing perlakuan memiliki pengaruh terhadap konsentrasi MDA dalam supernatan sel suspensi khamir. Sedangkan hasil uji nilai tengah peroksidasi lipid pada supernatan sel khamir yang diberi teh hijau menunjukkan berbeda nyata pada kelompok penambahan etanol pada taraf uji 5% tetapi tidak terjadi pada kelompok teh hijau 1,4 mg/mL. Walaupun demikian, kelompok teh hijau dan etanol berbeda nyata terhadap kontrol. Terbukti terjadinya penurunan konsentrasi MDA yang diukur cukup signifikan jika dibandingkan dengan kelompok etanol.
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Peroksidasi Lipid pada
Suspensi Sel
Pengukuran MDA pada suspensi sel dapat menggambarkan sebagian mekanisme reaksi peroksidasi lipid yang terjadi di dalam tubuh. Beberapa kekurangan pada pengukuran peroksidasi lipid sebelumnya dapat diatasi, seperti hilangnya senyawa MDA pada saat pembilasan pelet yang dapat mengurangi hasil pengukuran konsentrasi MDA.
Tabel 8 Efek vitamin C terhadap peroksidasi lipid pada suspensi sel khamir
Candida sp.
Perlakuan
Peroksidasi lipid
(nM MDA/106 CFU)
Kontrol
Vitamin C 0,02 mg/mL Etanol 1%
Vitamin C dan etanol
1,654 ± 0,042a 1,899 ± 0,005b 3,321 ± 0,725c 2,947 ±0,102d
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Penambahan teh hijau 1,4 mg/mL ke dalam suspensi sel dapat meningkatkan konsentrasi MDA sebesar 2,07 ± 0,04 nM MDA/106 CFU jika dibandingkan dengan kelompok kontrol yaitu 1,75 ± 0,03, hal ini menandakan teh hijau bersifat prooksidan (Tabel 9). Sifat prooksidan dari senyawa flavonoid juga ditunjukkan pada tanaman obat baicalin yang biasa digunakan untuk pengobatan herbal tradisional pada penyakit hepatitis kronis di Jepang maupun Cina. Dari hasil penelitian Ueda et al. (2002), tanaman obat baicalin dapat bersifat toksik terhadap sel T leukemia melalui proses apoptosis sehingga tanaman ini dapat bermanfaat sebagai anti kanker.
Sifat prooksidan teh hijau tidak terlalu berbahaya jika dibandingkan dengan vitamin C karena sifat senyawa flavonoid pada teh hijau cenderung menstabilkan radikal aroksil yang terbentuk ketika memberikan atom hidrogen kepada radikal bebas membentuk senyawa stabil (Cotelle 2001). Peningkatan peroksidasi lipid sel juga terjadi pada penambahan etanol 1%, lebih tinggi dari MDA sel pada kelompok penambahan teh hijau dan etanol. Hal ini membuktikan teh hijau bersifat mencegah terjadinya peroksidasi lipid yang disebabkan oleh etanol.
Tabel 9 Efek teh hijau terhadap peroksidasi lipid pada suspensi sel khamir
Candida sp.
Perlakuan
Peroksidasi lipid (nM MDA/106 CFU) Kontrol
Teh hijau 1,4 mg/mL Etanol 1%
Teh hijau dan etanol
1,75 ± 0,03a 2,07 ± 0,04b 3,60 ± 0,13c 3,16 ±0,18d
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
Uji nilai tengah pada penambahan vitamin C terhadap peroksidasi lipid suspensi sel menunjukkan berbeda nyata pada taraf uji 5%. Artinya pemberian vitamin C 0,02 mg/mL, etanol 1% dan gabungan keduanya berpengaruh terhadap peroksidasi lipid pada sel khamir. Sedangkan pada penambahan teh hijau, hasil uji nilai tengah menunjukkan kelompok penambahan teh 1,4 mg/mL dan/atau etanol 1% berbeda nyata pada taraf uji 5%. Artinya perlakuan berpengaruh terhadap jumlah peroksidasi lipid yang dihasilkan oleh sel khamir Candida sp..
Pengaruh Vitamin C, Teh Hijau dan/atau Etanol terhadap Viabilitas Sel
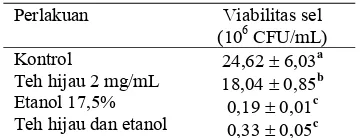
Tabel 10 memperlihatkan hasil uji nilai tengah viabilitas sel yang tidak berbeda nyata terjadi pada kelompok penambahan etanol 17,5% dan kelompok penambahan vitamin C dan etanol, artinya penambahan vitamin C tidak berpengaruh terhadap viabilitas sel khamir Candida sp. yang mengalami stres etanol.
Penambahan etanol 17,5% bersifat sangat toksik terhadap viabilitas sel. Data menunjukkan setelah penambahan etanol 17,5% selama 1 jam tingkat kematian sel sangat tinggi sehingga jumlah koloni yang hidup dalam media agar sebesar 0,19 ± 0,01 106 CFU/mL. Penambahan vitamin C 1,2 mg/mL ke dalam biakan mengakibatkan penurunan viabilitas sel khamir Candida sp. hampir separuh viabilitas sel pada kontrol yaitu dari 24,62 ± 6.03 106 CFU/mL menjadi
12,34 ± 1,65 106 CFU/mL. Hal ini menandakan bahwa vitamin C pada konsentrasi tersebut bersifat toksik dan tidak melindungi sel dari stres etanol yang menyebabkan sel mengalami banyak kematian.
Tabel 10 Efek vitamin C terhadap viabilitas sel khamir Candida sp. yang diinkubasi etanol
Perlakuan Viabilitas sel (106 CFU/mL) Kontrol
Vitamin C 1,2 mg/mL Etanol 17,5% Vitamin C dan etanol
24,62 ± 6,03a 12,34 ± 1,65b 0,19 ± 0,01c 0,18 ± 0,02c
13
Hasil menunjukkan pada penambahan teh hijau 2 mg/mL (Tabel 11) bersifat toksik terhadap viabilitas sel khamir Candida sp. dengan jumlah sel yang hidup mencapai 18,04 ± 0,85 106 CFU/mL, lebih dari separuh jumlah sel yang hidup pada kontrol yaitu 24,62 ± 6,03 106 CFU/mL. Penambahan etanol 17,5% bersifat sangat toksik terhadap sel karena hampir semua sel khamir Candida sp. mengalami kematian. Penambahan teh hijau 2 mg/mL ke dalam biakan sel khamir yang diinkubasi etanol 17,5% secara bersama-sama selama 1 jam, sedikit melindungi membran sel dari serangan radikal bebas yang ditimbulkan selama metabolisme sel berlangsung. Kondisi ini dapat dilihat dari peningkatan daya tahan hidup (viabilitas) sel khamir pada kelompok penambahan teh hijau dan etanol yang dibandingkan dengan kelompok penambahan etanol 17,5%. Walaupun dalam uji statistik menunjukkan nilai viabilitas pada kelompok penambahan etanol 17,5% dan kelompok penambahan teh dan etanol tidak berbeda nyata pada taraf uji 5%.
Tabel 11 Efek teh hijau terhadap viabilitas sel khamir Candida sp. yang diinkubasi etanol
Perlakuan Viabilitas sel
(106 CFU/mL) Kontrol
Teh hijau 2 mg/mL Etanol 17,5% Teh hijau dan etanol
24,62 ± 6,03a 18,04 ± 0,85b 0,19 ± 0,01c 0,33 ± 0,05c
Inkubasi selama 1 jam. Huruf dibelakang angka yang tidak sama menunjukkan berbeda nyata pada taraf uji 5%.
SIMPULAN DAN SARAN Simpulan
Kerusakan oleh stres oksidatif dapat dilihat dengan mengukur produk peroksidasi lipid, salah satunya adalah mengukur jumlah senyawa malondialdehida yang dibentuk oleh sel khamir Candida sp.. Pengukuran senyawa MDA pada sel Candida sp. meliputi pelet, supernatan dan larutan suspensi. Pengukuran konsentrasi MDA pada supernatan sel suspensi menandakan bahwa sebagian MDA disekresikan keluar sel. Dari ketiga pengukuran tersebut, metodologi pengukuran MDA pada larutan suspensi sel lebih akurat dan menunjukkan vitamin C dan teh hijau bisa bersifat prooksidan terhadap sel khamir
Candida sp. ketika sel tidak mengalami stres oksidatif tetapi bisa juga bersifat antioksidan
pada sel khamir Candida sp. apabila sel mengalami cekaman oksidatif oleh senyawa prooksidan, seperti etanol.
Saran
Berdasarkan analisis tersebut maka perlu dilakukan analisis dari produk peroksidasi lipid lainnya seperti 4-hidroksinonenal, dan glutation peroksidase dengan menggunakan HPLC sehingga data yang dihasilkan lebih akurat. Selain itu, kerusakan oksidatif pada sel perlu juga dilakukan analisis di tingkat protein dan DNA. Pada pengukuran teh hijau sebaiknya digunakan pembanding dari senyawa murni flavonoid teh yaitu epigalat catechin galat yang merupakan komponen terbesar pada teh hijau.
DAFTAR PUSTAKA
Amic D, Davinovic-Amic D, Baslo D, Trinajstic N. 2003. Structure radical scavenging activity relationship of flavonoids. Croat Chem. Acta 1: 55-61.
Aruoma OI. 1998. Free radicals, oxidative stress and antioxidants human health and disease. J AOCS 2: 199-212.
Barnet JA, Payne RW, Yarrow D. 1982.
Yeast: Characteristic and Identification. Ed. Ke-3. Cambridge: United Kingdom at University.
Benzie IFF, Szeto YT. 1999. Total antioxidant capacity of teas by the ferric reducing antioxidant power assay. J Agricl and Food Chem 47: 633-636.
Berry DR. 1966. The Biology of Yeast.
Studies in Biology 140:1-50.
Birds RP, Draper HH. 1984. Limiting light-induced lipid peroxidation and vitamin loss in infant parenteral nutrition by adding multivitamin preparations to intralipid. Methods inEnzymol. 105: 299-305.
Casmir CA, David BM. 2002. Chemistry, Nutrition, and Biotechnology. Ed. ke-2. New York: Marcel Dekker.
Connors KA, Amidon GL, Stella VJ. 1992.
Stabilitas Kimiawi Sediaan Farmasi. Didik G, penerjemah. Jilid 1. Ed. ke-2. Semarang: IKIP Semarang Press.
Costa V, Amorim MA, Reis E, Quitanilha A, Moradas-Ferrira P. 1997. Mitochondrial superoxide dismutase is essential of ethanol tolerance of Sacharomyces cerevisiae in the post-diauxic phase.
Microbiolology 143: 1649-1656.
Cotelle N. 2001. Role of flavonoids in oxidative stress. Current Topics in Med Chem 1: 569-590.
Ensminger AH, JE Konlade, JRK Robson. 1994. Food and Nutrition Encyclopedia. Vol. 2. Ed. ke-2. Boka Raton, Florida: 2097-2100.
Groot H de, Raven U. 1998. Tissue injury by reactive oxygen species and the protective effects of flavonoids. Fundam Clin Pharmacol. 12: 249-255.
Halliwell B, JMC Gutteridge EC Cross. 1992. Free radicals antioxidants and human disease; where are we now? J Lab Clin Med 119: 598-613.
Halliwell B. 1995. How to characterize an antioxidant; an up date. Biochem Soc Symp. 61: 73-101.
Hardesty D. 1993. Biochemical properties of vitamin C. J Biochem.
Inge R. 1987. Yeast-The Primary Industrial Microorganism. Biological Research on Industrial Yeast. CRC Press Inc. Boca Raton, Florida 1: 130-153.
Kartikawati D. 1999. Studi efek protektif vitamin C dan E terhadap respon imun dan enzim antioksidan pada mencit yang dipapar paraquat [tesis]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Kato S, Kawase T, Alderman J, Inatomi N, Lieber CS. 1990. Role of xanthine oxidase in ethanol induced lipid peroxidation in rats. Gastroenterology 98:203-210.
Krinsky NI. 1992. Mechanism of action biological antioxidants. Proc Soc Exp Bio Med 200: 248-254.
Kukielka E, Dicker E, Cederbaum AI. 1994. Increase production of reactive oxygen species by rad liver mitochondria after cronic etanol. Arch Biochem Bio Phys.
309: 377-386.
Lazar I. 1994. Peranan Antioksidan Dalam Mencegah Kanker. Jakarta: RS Kanker Darmais.
Lisnawati Y. 2004. Aktivitas antioksidan vitamin C dan teh hijau berdasarkan resistensi etanol pada khamir Candida sp. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor,
Manon S. 2004. Utilization of yeast to investigate the role of lipid oxidation in cell death. Antiox redox signal 6: 259-267.
Middleton EJ. 1998. Effect of plant flavonoids on immune and inflamatory cell function.
Adv Exp Med Biol 439: 175-182.
Miller JK, Slebodzinska B, Madson FC. 1993. Oxidative stress, antioxidant and animal function. J Dairy Sci 76: 2812-2823.
Muchtadi D. 1993. Aspek biokimia dan gizi dalam keamanan pangan. PAU. IPB: Bogor.
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Ed ke-25. Andry H, penerjemah; Anna PB, Tiara MNS; editor. Jakarta: EGC. Terjemahan dari Harper’s Biochemistry.
Nijveidt RJ, van Nood E, van Hoorn DEC, Boelens PG, van Norren K, van Leeuwen PAM. 2001. Flavonoids: a review of probable mechanisms of action and potential applications. Am J Clin Nutr 74: 418-425.
Nordmann R. 1994. Alcohol and antioxidant system. Alcohol-Alcohol 29:513-522.
15
Rajalakshmi D, Narasimhan S. 1996. Food Antioxidants: Sources and Methods of Evaluation in Food Antioxidants: Technological, Toxicological, and Health Perspectives. New York: Marcel Dekker.
Ray A, Chaudhuri SR, Majumdar B, Bandyopadhyay SK. 2002. Antioxidant activity of etanol extract of rhizome of Picrorhiza Kurroa on indomethacin induced gastric ulcer during healing.
Indian J Clin Biochem. 17: 44-51.
Reed G, Nagadowithana TW. 1991. Yeast Technology. New York: Van Nostrand Reinhold.
Rice-Evans CA, Diplock AA, Symon CRM. 1991. Techniques in Free Radical Research. Amsterdam: Elsevier.
Ruxton C. 1994. Antioxidant nutrients-do they have protective role? Food Chem Toxic
33(10): 995-1005.
Saono S, Gandjar I. 1974. Hydrocarbon-utilizing soil yeasts from oil fields in Tjepu region (Central Java), Indonesia.
AnnalesBogorienses V: 123-129.
Skrzydlewska E, Ostrowska J, Luczaj W, Kasacka I, Rozanski A. 2004. Green tea against ethanol-induced lipid peroksidasi in rat organs. Alcohol Clin Med 32:25-32.
Suryohudoyo P. 1995. Oksidan, antioksidan dan radikal bebas. Dalam Kongres Nasional IV. Himpunan Kimia Klinik Indonesia, Surabaya.
Ueda S, Nakamura H. Masutani H. Sasada T, Takabayashi A, Yamaoka Y, Yodoi J. 2002. Baicalin induces apoptosis via mitochondrial pathway as prooxidant. Mol Immunol. 38: 781-791.
Vishwanath MS. 2003. Introduction to Clinical Nutrition. Ed ke-2. New York: Marcel Dekker.
17
Lampiran 1 Tahapan penelitian
Pembuatan Stok Kultur Khamir
Pengukuran Peroksidasi Lipid (MDA) pada Pelet, Supernatan dan Suspensi Sel Khamir dengan Sampel Vitamin
C dan/atau Etanol, dan Kontrol
Pengukuran Peroksidasi Lipid (MDA) pada Pelet, Supernatan dan Suspensi Sel Khamir dengan Sampel Teh Hijau,
dan/atau Teh Hijau, dan Kontrol
Pengukuran Viabilitas Sel Khamir dengan Sampel Teh Hijau dan/atau
Etanol, dan Kontrol Pengukuran Viabilitas Sel Khamir
dengan Sampel Vitamin C dan/atau Etanol, dan Kontrol
Lampiran 2 Populasi rerata biakan sel khamir
Candida
sp.
Tabung ke- Jumlah koloni Viabilitas sel 106 (CFU/mL)
1
384 459 446 327
38,4 45,9 44,6 32,7
2
542 560 443 560
54,2 56,0 44,3 56,0
3
570 547 558 531
57,0 54,7 55,8 53,1
Rerata total kepadatan sel: 49,4
Keterangan: pengenceran 10000x
Lampiran 3 Kurva standar malondialdehida
Konsentrasi
MDA (mM) 0 0,00075 0,0015 0,003 0,006 0,0075 Absorban 1 0 0,132 0,215 0,374 0,730 0,879 Absorban 2 0 0,103 0,227 0,386 0,620 0,909
[image:31.612.122.503.550.674.2]Rata-rata 0 0,1175 0,221 0,380 0,675 0,894
Gambar 5 Kurva standar MDA.
Lampiran 4 Pengukuran peroksidasi lipid pada pelet sel terhadap konsentrasi
etanol
Perlakuan Absorban Konsentrasi MDA ( M) Peroksidasi lipid (nM MDA/106 CFU)
Kontrol 0,175 0,172
0,161
1,47879 1,45344 1,36049
2,39480 2,35375 2,20322 Etanol 17,5% 0,194
0,197 0,201
1,63934 1,66470 1,69850
2,65481 2,69586 2,75060 Etanol 20% 0,272
0,231 0,231
2,29846 1,95200 1,95200
3,72221 3,16114 3,16114
y = 118,34x
R2 = 0,9922
0 0,2 0,4 0,6 0,8 1
0 0,002 0,004 0,006 0,008
Konsentrasi MDA (mM)
Ab
so
rb
19
Lampiran 5 Pengukuran peroksidasi lipid pada pelet sel terhadap konsentrasi
vitamin C
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) Kontrol 0,159 0,172 0,173 1,34359 1,45344 1,46189 2,17585 2,35375 2,36743 Vitamin C 1,2 mg/mL 0,190
0,191 0,192 1,60554 1,61399 1,62244 2,60007 2,61376 2,62745 Vitamin C 2,4 mg/mL 0,353
0,385 0,347 2,98293 3,25333 2,93222 4,83066 5,26856 4,74855 Vitamin C 10 mg/mL 0,436
0,433 0,344 3,68430 3,65895 2,90688 5,96648 5,92542 4,70750
Lampiran 6 Pengukuran peroksidasi lipid pada pelet sel.terhadap penambahan
vitamin C dan/atau etanol yang diinkubasi selama 1 jam
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) Kontrol 0,154 0,149 0,161 1,30134 1,25908 1,36049 2,10743 2,03900 2,20322 Vitamin C 1,2 mg/mL 0,175
0,179 0,194 1,47879 1,51259 1,63934 2,39480 2,,44954 2,65481 EtOH 17,5% 0,194
0,203 0,197 1,63934 1,71540 1,66470 2,65481 2,77797 2,69586 Vitamin C dan EtOH 0,140
0,140 0,122 1,18303 1,18303 1,03093 1,91584 1,91584 1,66952
Lampiran 7 Pengukuran peroksidasi lipid pada pelet sel terhadap penambahan teh
hijau dan/atau etanol yang diinkubasi selama 1 jam
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) Kontrol 0,140 0,150 0,149 1,18303 1,26753 1,25908 1,91548 2,05269 2,03900 Teh hijau 2 mg/mL 0,149
0,157 0,152 1,25908 1,32669 1,28443 2,03900 2,14848 2,08006 EtOH 17,5% 0,135
0,156 0,137 1,14078 1,31824 1,15768 1,84742 2,13479 1,87479 Teh hijau dan EtOH 0,165
Lampiran 8 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
etanol
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) Kontrol 0,164 0,144 0,159 1,38584 1,21683 1,34359 2,27933 2,00137 2,20985 Etanol 1% 0,300
0,314 0,292 2,53507 2,65337 2,46847 4,16952 4,36410 4,05833 Etanol 2% 0,391
0,411 0,409 3,30404 3,47304 3,43079 5,43428 5,71224 5,64275 Etanol 5% 0,510
0,515 0,320 4,30962 4,35187 2,70407 7,08818 7,15768 4,44749 Etanol 10% 0,752
0,755 0,666 6,35457 6,37992 5,62785 10,45160 10,49329 9,25634 Volume (pelet+akuades): 32,5 mL
Lampiran 9 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
vitamin C
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) kontrol 0,151 0,145 0,155 1,27598 1,22528 1,30979 1,77579 1,70523 1,82283 Vitamin C 0,02 mg/mL 0,178
0,177 0,178 1,50414 1,49569 1,50414 2,09331 2,08155 2,09331 Vitamin C 0,1 mg/mL 0,191
0,191 0,186 1,61399 1,61399 1,57174 2,24620 2,24620 2,18740 Vitamin C 0,2 mg/mL 0,225
0,189 0,207 1,90130 1,59709 1,74920 2,64604 2,22268 2,43436 Volume (pelet+akuades): 27,5 mL
Lampiran 10 Pengukuran peroksidasi lipid pada suspensi sel terhadap konsentrasi
teh hijau
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU) Kontrol 0,163 0,162 0,143 1,37739 1,36894 1,20838 1,91690 1,90515 1,68171 Teh hijau 1,4 mg/mL 0,177
0,164 0,177 1,49569 1,38584 1,49569 2,08155 1,92867 2,08155 Teh hijau 2 mg/mL 0,210
0,198 0,220 1,77455 1,67314 1,85905 2,46964 2,32852 2,58724 Teh hijau 6 mg/mL 0,259
21
Lampiran 11 Pengukuran peroksidasi lipid pada supernatan sel terhadap
penambahan vitamin C dan/atau etanol yang diinkubasi selama 1
jam
Perlakuan Absorban Konsentrasi MDA ( M)
Peroksidasi lipid (nM MDA/106 CFU)
Kontrol 0,042 0,035 0,036 0,35491 0,29576 0,30421 0,61067 0,50890 0,52344 Vitamin C 0,02 mg/mL 0,057
0,052 0,049 0,48166 0,43941 0,41406 0,82877 0,75607 0,71245
EtOH 1% 0,192
0,220 0,213 1,62244 1,85905 1,79989 2,79165 3,19877 3,09699 Vitamin C dan EtOH 0,205
0,200 0,193 1,73230 1,69005 1,63089 2,98067 2,90797 2,80619 Volume