STUDI PERBANDINGAN KANDUNGAN C, N, C/N, P, DAN K DI DALAM KOMPOS KEMBANG BULAN (Tithonia diversifolia) DAN DAUN NIPPON (Euphatorium odoratum L.) DENGAN VARIASI
WAKTU PENGOMPOSAN
SKRIPSI
AMOS P. SIANTURI 050802010
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Kategori : SKRIPSI
Judul : STUDI PERBANDINGAN KANDUNGAN C, N, C/N, P, DAN K DI DALAM KOMPOS KEMBANG BULAN (Tithoni diversifolia DAN DAUN NIPPON (Euphatorium odoratum L.) DENGAN VARIASI WAKTU PENGOMPOSAN.
Nama : AMOS PETRUS SIANTURI
NIM : 050802010
Program Studi : SARJANA ( S1 ) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui,
Medan, Juli 2011
Komisi Pembimbing :
Dosen Pembimbing II Dosen Pembimbing I
Drs. Firman Sebayang, MS Jamahir Gultom, PhD
NIP. 195607261985031001 NIP. 195209251977031001
Diketahui / Disetujui oleh Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PERBANDINGAN KANDUNGAN C, N, C/N, P, DAN K DI DALAM KOMPOS KEMBANG BULAN ( Tithoni diversifolia) DAN DAUN NIPPON (Euphatoriumodoratum L.) DENGAN VARIASI WAKTU PENGOMPOSAN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing- masing disebutkan sumbernya.
Medan , juli 2011
AMOS P. SIANTURI
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa, berkat kasih karunia-Nya dalam bimbingannya setiap saat. Dalam masa-masa tersulit maupun masa-masa gembira Tuhan tetap teguhkan hati ini hingga akhirnya penulis dapat menyelesaikan penelitian dan menyusun skripsi ini.
ABSTRAK
Telah dilakukan penelitian tentang studi perband ingan kandungan C, N, C/N, P, dan K di dalam kompos Kembang Bulan (tithoni diversifolia) dan Daun Nippon (euphatorium odoratum L.) dengan variasi waktu pengomposan. Pengambilan sampel dilakukan secara acak dari Kabupaten Karo, Kabupaten Dairi, dan, Kabupaten Humbang Hasudungan, dirajang lalu dicampur dengan perbandingan berat yang sama. Sampel terlebih dahulu dikeringkan sebelum proses pengomposan dengan penambahan kotoran babi dan dedak serta menggunakan EM4 sebagai starter dengan interval waktu pengomposan 0, 3, 6, 9, 12, dan 15 hari. Penentuan C - organik dilakukan dengan metode Walkey Black, N itrogen (N) Total dengan metode Kjehldahl, Posfor (P) sebagai P-Total dengan menggunakan metode Spektrofotometri, dan Kalium dengan Spektrofotometer Serapan Atom (SSA). Prosedur yang sama dilakukan terhadap kedua sampel Kembang Bulan dan Daun N ippon sebelum dan sesudah pengomposan. Dari hasil penelitian menunjukkan bahwa pengomposan yang optimum yaitu hari ke-15 diperoleh C/N Kembang Bulan 10,08 dan Daun Nippon sebesar 10,48 yang telah mendekati C/N yang baik yaitu 10 – 20. Untuk Kembang Bulan C – organik diperoleh sebesar 25,50 %, nitrogen - total 2,53 %, C/N sebesar 10,08, posfor-total sebagai P2O5 sebesar 0,7688 % dan K sebagai K2O sebesar 4,169 %. Sedangkan untuk Daun Nippon kadar C – organik diperoleh sebesar 25,01 %, nitrogen-total 2,39 %, posfor-total sebagai P2O5 sebesar 0,7377 % dan K sebagai K2O sebesar 3,372 %. Dapat disimpulkan bahwa Kembang Bulan (tithoni
ABSTRACT
DAFTAR ISI
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 3
1.6. Lokasi Penelitian 3
1.7. Metode Penelitian 4
Bab 2. TINJAUAN PUSTAKA 5
2.1. Tumbuhan Kembang Bulan 5
2.2. Tumbuhan Daun Nippon 5
2.3. Kompos 6
2.3.1. Syarat Pembuatan Kompos 7
2.3.2. Parameter yang Dapat Diamati Sebagai Petunjuk
Sempurnanya Proses Pengomposan 7
2.3.3. Proses Pengomposan 7
2.4. EM4 Sebagai Bakteri 8
2.5. Meningkatkan Kesuburan Tanah 10
2.6. Pupuk Kandang 12 2.12. Keunggulan Penggunaan Pupuk Organik Dibanding dengan
Pupuk Anorganik 17
2.13. Penentuan Kadar C – Organik 17
2.14. Penentuan Nitrogen dengan Metode Kjehdahl 18 2.15. Penentuan Posfat19
Serapan Atom (SSA) 19 2.16.1. Instrumentasi Spektrofotometer Serapan Atom 20 2.16.2. Keuntungan Spektrofotometer Serapan Atom 21
Bab 3. BAHAN DAN METODOLOGI PENELITIAN 22
3.1. Alat – alat 22
3.2. Bahan 23
3.3. Prosedur Penelitian 24
3.3.1. Penyediaan Sampel Kembang Bulan 24
3.3.2. Penyediaan Sampel Daun Nippon 24
3.3.8. Pembuatan Pereaksi dan Larutan Standar 25 3.3.8.1. Pembuatan Pereaksi dan Larutan Standar untuk 25
3.3.8.4. Pembuatan Pereaksi Untuk Penentuan Kalium
dengan Spektrofotometer Serapan Atom (SSA) 29 3.3.9. Penentuan P dengan Metode spektrofometri 30
3.3.9.1. Preparasi Sampel 30
3.3.9.2. Pembuatan Kurva Kalibrasi untuk P 30 3.3.9.3. Penentuan Kadar Posfor pada Sampel 30 3.3.10. Penentuan kadar C –Organik dengan metode Walkey Black 30 3.3.11. Penentuan Nitrogen Total Metode Kjehldahl 31 3.3.12. Pembuatan Kurva Kalibrasi untuk K 31 3.3.13. Penentuan Kalium Dengan Spektrofotometer Serapan
Atom (SSA) 32
3.4. Bagan Penelitian 33
3.4.1. Pembuatan Kompos 33
3.4.1.1. Kompos Tumbuhan kembang Bulan 33
3.4.2. Pembuatan C – Organik 34
3.4.3. Penentuan Posfor dengan Metode Spektrofotometri 35
3.4.3.1. Pengekstrakan Kembang Bulan 35
3.4.3.2. Pengukuran absorbansi dari Larutan Standar P untuk Kurva Kalibrasi Untuk Larutan standar P 2 ppm 35 3.4.3.3. Pengukuran Absorbansi P didalam Ekstrak
Kembang Bulan 36
3.4.4. Penentuan Nitrogen – Total didalam Serbuk/Kompos
Kembang Bulan ( Metode Kjehldahl ) 37
untuk K urva Kalibrasi untuk Larutan standar K 0,5 ppm 38 3.4.6. Penentuan Kalium dengan Metode Spektrofotometer
Serapan Atom ( SSA ) 39
Bab 4. HASIL DAN PEMBAHASAN 40
4.1. Hasil dan Pengolahan Data 40
4.1.1. Hasil Penenlitian40
4.1.2. Penentuan C – Organik (%) 47
4.1.3. Penentuan Nitrogen – Total (%) 49
4.1.4. Penentuan Rasio C/N50
4.1.5. Penentuan Posfor sebagai P- Total 51
4.1.5.1. Penurunan Persamaan Garis Regresi 51 4.1.5.2. Perhitungan Koefisien Korelasi 52
4.1.5.3. Perhitungan Standar Deviasi 53
4.1.5.4. Penentuan Batas Deteksi 53
4.1.5.5. Penentuan P – Total (%) sampel 54
4.1.6. Penentuan Kalium (K) Sampel 56
4.1.6.1. Penurunan Persamaan Garis Regresi 56 4.1.6.2. Perhitungan koefisien Korelasi 57
4.1.6.3. Penentuan Batas Deteksi 57
4.1.6.4. Penentuan Kandungan K pada Sampel 58
4.2. Pembahasan 59
Bab 5. KESIMPULAN DAN SARAN 66
5.1. Kesimpulan 66
5.2. Saran 66
DAFTAR PUSTAKA 67
DAFTAR TABEL
Halaman
Tabel 2.1. Komposisi kimia kompos 11
Tabel 4.1. Data Titrasi pada penentuan C- Organik didalam Bahan dan Kompos
Kembang Bulan dengan Metode Walkey Black 40
Tabel 4.2. Data Titrasi pada penentuan C- Organik didalam Bahan dan Kompos
Daun Nippon dengan Metode Walkey Black 41
Table 4.3. Data Titrasi pada Penentuan Nitrogen didalam Bahan dan kompos
Kembang Bulan dengan Metode Kjehldahl 42
Tabel 4.4. Data Titrasi pada Penentuan Nitrogen didalam Bahan dan kompos
Daun Nippon dengan Metode Kjehldahl 43
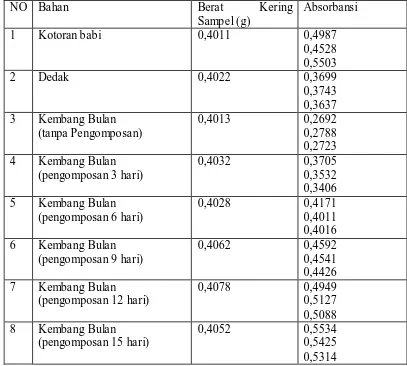
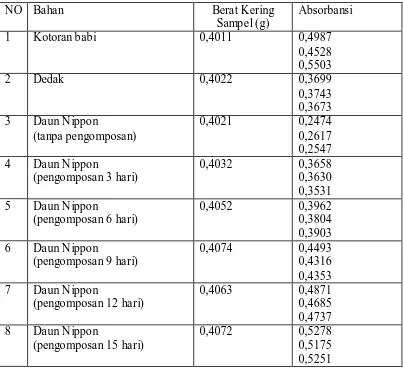
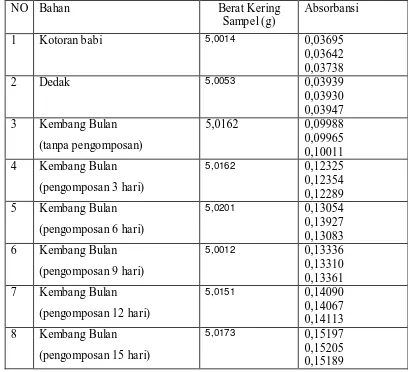
Tabel 4.5. Data Absorbansi pada Penentuan Posfor didalam Bahan dan Kompos Kembang Bulan dengan Metode Spektrofotometri (maks = 710 nm) 44 Tabel 4.6. Data Absorbansi pada Penentuan Posfor didalam Bahan dan Kompos
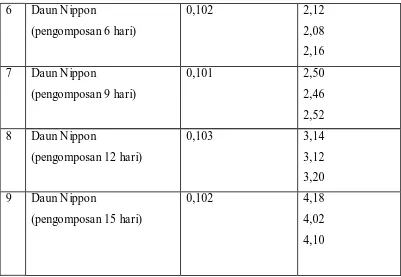
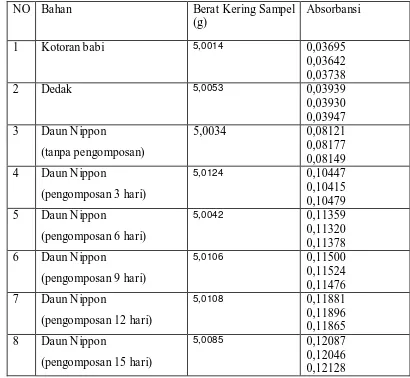
Daun Nippon dengan Metode Spektrofotometri ( maks = 710 nm) 45 Tabel 4.7. Data Absorbansi pada Penentuan Kalium didalam Bahan dan Kompos
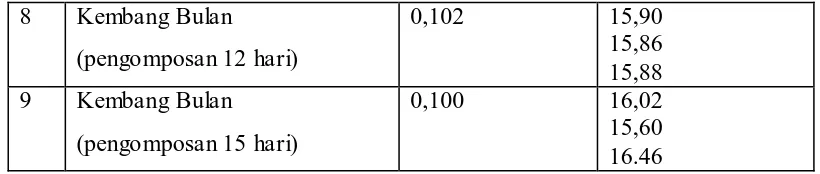
Kembang Bulan dengan Spektrofotometer Serapan Atom
(= 766,5 nm) 46
Tabel 4.8. Data Absorbansi pada Penentuan Kalium didalam Bahan dan Kompos Daun Nippon dengan Spektrofotometer Serapan Atom
( = 766,5 nm) 47
Tabel 4.9. Penurunan Persamaan Garis Regresi dengan Metode Least Square
pada Penentuan posfor 51
Tabel 4.10. Nilai Y baru dari nilai kosentrasi larutan standar (Xi) 53 Tabel 4.11. Penurunan Persamaan Garis Regresi dengan Metode Least Square
DAFTAR GAMBAR
Halaman
Gambar 2.7. Sistematis alat ringkas dari SSA 20
Gambar 4.2.1. Kurva Perubahan C-Organik terhadap waktu pengomposan Kembang Bulan 60 Gambar 4.2.2. Kurva Perubahan C-Organik terhadap waktu pengomposan Daun
Nippon 61
Gambar 4.2.3. Kurva Perubahan Nitrogen terhadap Waktu Pengomposan
Kembang Bulan 62
Gambar 4.2.4. Kurva Perubahan Nitrogen terhadap Waktu Pengomposan
Daun Nippon 62
Gambar 4.2.5. Kurva Perubahan P terhadap waktu pengomposan Kembang
Bulan 63 Gambar 4.2.2. Kurva Perubahan P terhadap waktu pengomposan Daun Nippon 63 Gambar 4.2.3. Kurva Perubahan K terhadap Waktu Pengomposan Kembang
Bulan 64
Gambar 4.2.4. Kurva Perubahan K terhadap Waktu Pengomposan Daun Nippon 64 Gambar 4.2.3. Kurva Perubahan C/N terhadap Waktu Pengomposan Kembang
Bulan 64
Gambar 4.2.4. Kurva Perubahan C/N terhadap Waktu Pengomposan Daun
DAFTAR LAMPIRAN TABEL
Halaman
Lampiran 1. Tabel Data Penentuan C – Organik didalam Bahan dan Kompos
Kembang Bulan dan Daun Nippon dengan Metode Walkey Black 70 Lampiran 2. Tabel Data Penentuan Kandungan Nitrogen didalam Bahan dan
Kompos Kembang Bulan dan Daun Nippon dengan Metode
Kjehldahl 71
Lampiran 3. Tabel Data Rasio C/N didalam Bahan pada Kompos Kembang Bulan
Dan Daun Nippon 72
Lampiran 4. Tabel Data Penentuan Posfor (P) didalam Bahan pada Kompos
Kembang dan Daun Nippon dengan Metode Spektrofotometri 73 Lampiran 5. Data Penentuan Kalium (K) didalam Bahan pada Kompos Kembang
Bulan dan Daun Nippon dengan Spektrofotometer Serapan Atom 74 Lampiran 6. Tabel 11. Data Kandungan C, N, P sebagai P2O5, K sebagai K2O dan
C/N kompos Kembang Bulan dan Daun Nippon setelah
Pengomposan 15 Hari 75
Lampiran 7. Data Penentuan Panjang Gelombang Maksimum dari Larutan
Standar P 0,2 mg/L 75
DAFTAR LAMPIRAN GAMBAR
Halaman
Lampiran 11. Gambar Kurva Penentuan Panjang Gelombang Maksimum Larutan
Standar P 0,2 mg/L 78
Lampiran 12. Gambar Kurva Kalibrasi Larutan Standar Posfor (P) 78 Lampiran 13. Gambar Kurva Kalibrasi Larutan Standar Kalium (K) 79 Lampiran 14. Gambar Kompos Kembang Bulan Pada hari ke-15 dalam Tahap
Pengeringan 79
Lampiran 15. Gambar Kompos Daun Nippon Pada hari ke-15 dalam Tahap
Pengeringan 80
Lampiran 16. Gambar Tumbuhan Kembang Bulan 80
ABSTRAK
Telah dilakukan penelitian tentang studi perband ingan kandungan C, N, C/N, P, dan K di dalam kompos Kembang Bulan (tithoni diversifolia) dan Daun Nippon (euphatorium odoratum L.) dengan variasi waktu pengomposan. Pengambilan sampel dilakukan secara acak dari Kabupaten Karo, Kabupaten Dairi, dan, Kabupaten Humbang Hasudungan, dirajang lalu dicampur dengan perbandingan berat yang sama. Sampel terlebih dahulu dikeringkan sebelum proses pengomposan dengan penambahan kotoran babi dan dedak serta menggunakan EM4 sebagai starter dengan interval waktu pengomposan 0, 3, 6, 9, 12, dan 15 hari. Penentuan C - organik dilakukan dengan metode Walkey Black, N itrogen (N) Total dengan metode Kjehldahl, Posfor (P) sebagai P-Total dengan menggunakan metode Spektrofotometri, dan Kalium dengan Spektrofotometer Serapan Atom (SSA). Prosedur yang sama dilakukan terhadap kedua sampel Kembang Bulan dan Daun N ippon sebelum dan sesudah pengomposan. Dari hasil penelitian menunjukkan bahwa pengomposan yang optimum yaitu hari ke-15 diperoleh C/N Kembang Bulan 10,08 dan Daun Nippon sebesar 10,48 yang telah mendekati C/N yang baik yaitu 10 – 20. Untuk Kembang Bulan C – organik diperoleh sebesar 25,50 %, nitrogen - total 2,53 %, C/N sebesar 10,08, posfor-total sebagai P2O5 sebesar 0,7688 % dan K sebagai K2O sebesar 4,169 %. Sedangkan untuk Daun Nippon kadar C – organik diperoleh sebesar 25,01 %, nitrogen-total 2,39 %, posfor-total sebagai P2O5 sebesar 0,7377 % dan K sebagai K2O sebesar 3,372 %. Dapat disimpulkan bahwa Kembang Bulan (tithoni
ABSTRACT
BAB I
PENDAHULUAN
1.1 Latar Belakang
Peningkatan populasi manusia menyebabkan permintaan pangan selalu
bertambah. Disamping itu, kompleksnya kebutuhan dan peningkatan pola hidup
masyarakat memacu perkembangan berbagai industri, termasuk pertanian. Salah
satu perkembangan industri bidang pertanian adalah pabrik pembuatan pupuk,
dimana pupuk digunakan untuk kebutuhan nutrisi pada tanaman untuk
meningkatkan hasil panen bagi masyarakat (Willyan Djaja, 2008).
Dahulu para petani menggunakan pupuk kandang/organik untuk
mengatasi kondisi tanah yang tidak subur. Namun, setelah diperkenalkan pupuk
kimia, para petani berubah haluan meninggalkan pupuk organiknya, berganti
menggunakan pupuk kimia. Dalam kurun waktu tertentu, hasil panen yang lebih
banyak memang dapat dirasakan dan meningkat cukup tajam. Pemberian pupuk
kimia secara berlebihan jelas kurang bijaksana karena justru akan memperburuk
kondisi fisik tanah. Tanpa diimbangi dengan pemberian humus ataupun kompos,
efisiensi dan efektivitas penyerapan unsur hara oleh tanaman juga tidak akan
optimal. Oleh karena itu, ketersediaan kompos sangat membantu upaya pemulihan
kesuburan tanah (Dipo Yuwono, 2006).
Dewasa ini sebagian besar petani Indonesia ternyata masih cenderung
mengandalkan pupuk anorganik, (Urea, TSP, dan KCl) untuk budidaya tanaman.
Alasan mereka didasarkan pada penggunaannya yang praktis dan hasil panen
yang memuaskan. Dalam kenyataannya, tanah yang sering diberi pupuk
anorganik, lama – kelamaan akan menjadi keras. Keadaan ini akan menyebabkan beberapa kesulitan, diantaranya tanah jadi sukar diolah (mengeras)
dan pertumbuhan tanaman terganggu. Permasalahan tersebut sebenarnya tidak
akan terjadi, jika kita memperlakukan tanah dengan baik. Kesuburan tanah dan
sebagai pendamping pupuk anorganik, salah satunya kompos. Pemakaian kompos
sangat dianjurkan karena dapat memperbaiki produktivitas tanah, baik secara
fisik, kimia, maupun biologi tanah. Secara fisik, kompos bisa menggemburkan
tanah, memperbaiki aerasi dan drainasi, meningkatkan pengikatan antar partikel
dan kapasitas mengikat air. Secara kimia, kompos dapat meningkatkan kapsitas
tukar kation (KTK), ketersediaan unsur hara, dan ketersediaan asam humat.
Secara biologi, kompos merupakan bahan organik yang menjadi sumber makanan
bagi mikroorganisme tanah. Dengan adanya kompos, fungi, bakteri, serta
mikroorganisme yang menguntungkan akan berkembang secara cepat. Banyaknya
mikroorganisme tanah yang menguntungkan dapat menambah kesuburan tanah.
(Suhut Simamora, 2006).
Dari hasil penelitian yang dilakukan oleh Sondang Sitorus (Skripsi,
Jurusan Kimia FMIPA USU, 2001) bahwa kadar unsur kalium dari bobot kering
tumbuhan daun Nippon adalah 4,62%, di dalam batang Nippon 3,86% dan untuk
daun kembang bulan adalah 5,43%, dan didalam batang kembang bulan adalah
4,06%. Jadi tumbuhan Daun Nippon dan Kembang Bulan dapat digunakan
sebagai sumber unsur kalium di dalam pemupukan.
Kedua tumbuhan tersebut diatas di daerah Sumatera Utara khususnya
sekitar daerah Kabupaten Karo, Dairi, Simalungun, Samosir, Humbahas dan
beberapa Kabupaten di Tapanuli, tumbuh sangat berlimpah di sepanjang pinggir
jalan bahkan ada yang tumbuh membentuk semak di lahan tidur terutama
dilereng bukit dan gunung. Oleh karena itu, penulis merasa tertarik untuk
melakukan penelitian terhadap kedua tumbuhan di atas untuk melakukan
penelitian dengan menggunakan kedua jenis tumbuhan diatas sebagai bahan baku
kompos dengan harapan memperoleh pupuk kompos yang kaya akan kandungan
1.2 Permasalahan
- Apakah kandungan C - Organik, Nitrogen, C/N, Posfor, dan Kalium pada
tumbuhan kembang bulan (Thitonia diversifolia) dan tumbuhan Daun Nippon (Euphatorium odoratum L.) sebelum dan sesudah pengomposan dengan penambahan kotoran babi dan dedak mempunyai perbedaan yang signifikan ?
- Berapa lama waktu optimum yang dibutuhkan untuk pengomposan tumbuhan
kembang bulan dan daun Nippon dengan penambahan kotoran babi dan dedak
dengan menggunakan EM4.
- Apakah tumbuhan kembang bulan dan daun Nippon dapat digunakan sebagai
bahan baku pupuk organik berdasarkan kandungan C – Organik, N, C/N, P, dan K ?
1.3 Pembatasan Pe rmasalahan
Penelitian ini dibatasi pada penentuan C- Organik, Nitrogen, C/N, Posfor, dan
Kalium pada tumbuhan kembang bulan (Thitonia diversifolia) dan daun Nippon (Euphatorium odoratum L.) sebelum pengomposan dan sesudah pengomposan dengan penambahan kotoran babi dan dedak dengan menggunakan EM4 sebagai
starter.
1.4 Tujuan Penelitian
Untuk mengetahui kadar C- Organik, Nitrogen, C/N, Posfor, dan Kalium yang
ada pada tumbuhan Kembang Bulan dan Daun Nippon sebelum pengomposan dan
sesudah pengomposan sehingga kemungkinan penggunaannya sebagai bahan
baku pupuk organik dapat diperhitungkan.
1.5Manfaat Penelitian
Hasil penelitan ini diharapkan dapat digunakan oleh masyarakat petani yang
bermukim di daerah Kabupaten Karo, Dairi, Simalungun, Humbahas, Samosir,
dan beberapa Kabupaten di Wilayah Tapanuli untuk memanfaatkan tumbuhan
Kembang Bulan dan Daun Nippon tidak lagi sebagai tumbuhan yang tak berguna
dan mengganggu terutama di pinggir jalan.
1.6Lokasi Penelitian
Penelitian dilakukan di Laboratorium Pusat Penelitian (PUSLIT) dan
Laboratorium Sentral Fakultas Pertanian Universitas Sumatera Utara.
1.7Metode Penelitian
- Penelitian ini bersifat purposif.
- Sampel Kembang Bulan (Tithonia diversifolia) dan Daun Nippon (Euphatorium odoratum L.) diambil secara acak di daerah Kabupaten Karo, Dairi, dan Kabupaten Humbahas kemudian dirajang, dikeringkan, selanjutnya
dicampur dengan perbandingan berat yang sama.
- Pengomposan sampel dilakukan dengan penambahan kotoran babi dan dedak
dengan menggunakan EM4 sebagai starter didalam kontainer PVC tertutup
(masing – masing untuk Kembang Bulan dan Daun Nippon secara terpisah)
- Penentuan C – Organik, N – total, P – total, dan K ditentukan sebelum dan
sesudah pengomposan (interval waktu penentuan parameter – parameter diatas selama pengomposan adalah 3, 6, 9, 12, dan 15 hari).
- Penentuan C - Organik dilakukan dengan menggunakan metode Walkey
Black.
- Penentuan kandungan Nitrogen Total dilakukan dengan metode Kjehldahl.
- Penentuan kandungan Posfor (P) sebagai P-total dilakukan dengan menggunakan
metode Spektrofotometri.
- Penentuan kandungan Kalium (K) dilakukan dengan menggunakan
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan kembang bulan
Secara umum tumbuhan kembang bulan mempunyai ketinggian sekitar 1 – 3m, perdu yang tegak, tunas menjalar dalam tanah. Batangnya bulat dengan empelur
putih. Daunnnya bertangkai, berangsur runcing hingga pangkal, bergerigi taju
runcing tajam. Bongkol berdiri sendiri, bertangkai panjang, tangkai mendukung
beberapa daun pelindung. Pembalut bentuk lonceng, dasar bunga bersama bentuk
kerucut lebar, tabung berambut panjang, rapat pendek helaian bentuk lenset,
bergigi 2 – 3, kuning keemasan. Bunga cakram sangat banyak berwarna kuning. Tabung kepala sari coklat tua, cabang tangkai putih dua, melengkung kembali,
kuning dimahkotai dengan alat tambahan kuning, berambut. (Steenis Van,
1988)
Seiring merebaknya gaya hidup kembali ke alam, pupuk organik jadi
populer kembali. Pupuk jenis ini memang memiliki berbagai keunggulan
dibanding dengan kimia, diantaranya dapat mengatur sifat tanah dan dapat
berperan sebagai penyangga persediaan unsur hara bagi tanaman sehingga pupuk
ini dapat mengembalikan kesuburan tanah. Pupuk organik dapat dibuat dari
berbagai bahan organik yang ada di alam, misalnya sampahba tanaman (serasah)
ataupun sisa – sisa tanaman yang telah mati. Sumber bahan organik lainnya adalah hewan ternak, unggas, dan lain sebagainya. Limbah atau kotoran hewan
merupakan bahan organik yang bermanfaat bagi tanah pertanian. Bahan tersebut
diproses dengan cara yang rumit oleh jasad renik dalam tanah dan dirombak
2.2. Tumbuhan Daun Nippon
Tumbuhan Daun Nippon atau disebut Bandotan adalah sejenis gulma
anggota suku Asteraceae yang berasal dari Amerika tropis, khususnya Brazil.
Dengan masuknya ke Indonesia begitu lama yang dinamakan dengan Babadotan,
dengan klasifikasinya yaitu terna berbau keras, berbatang tegak atau berbaring,
berakar pada bagian yang menyentuh tanah. Batang giling dan berambut panjang,
sering bercabang – cabang dengan satu atau banyak kuntum bunga majemuk yang terletak diujung hingga 120 cm, daun bertangkai 0,5 – 5 cm, terletak berseling atau berhadapan yang berada dibagian bawah. Bunganya berwarna putih , diujung
tangkai yang berambut dengan 2-3 lingkaran daun pembalut yang lonjong seperti
sudip yang meruncing.
Tumbuhan ini menyebar diseluruh wilayah tropika, bahkan hingga subtropika
yang menyebar luas di Indonesia. Babadotan ditemukan sebagai tumbuhan
pengganggu disawah – sawah yang kering, ladang, pekarangan, tepi jalan, dan wilayah bersemak belukar.
Tumbuhan ini merupakan herba menahun, tegak dengan ketinggian 30 – 80 cm dan mempunyai daya adaptasi yang tinggi, sehingga mudah tumbuh dimana –
mana dan sering menjadi gulma yang merugikan para petani. Namun dibalik itu
tumbuhan Daun Nippon ini dapat digunakan sebagai obat, pestisida, dan
herbisida, bahkan untuk pupuk yang dapat meningkatkan hasil produksi tanaman
seperti padi. Hal tersebut diduga bahwa daunnya dapat meningkatkan kandungan
nitrogen dalam tanah yang sangat diperlukan bagi tanaman. Melimpahnya
tanaman ini dapat menjadi sumber pupuk kompos yang baik bagi tanaman,
apalagi semakin mahalnya harga pupuk bagi petani. (Http:// Fharmacy.
Blogspot.com babadotan-conyzoides.html.
2.3. Kompos
Kompos merupakan hasil akhir suatu proses fermentasi tumpukan sampah,
serasah tanaman ataupun bangkai binatang. Ciri – ciri kompos yang baik adalah
berwarna coklat, berstruktur remah, berkonsistensi gembur dan berbau daun
lapuk. Tumpukan bahan mentah (serasah, sisa tanaman, sampah dapur dan lain
Dengan kata lain terjadi perubahan dari sifat fisik yang baru. Perubahan itu
sebagian besar muncul oleh karena adanya kegiatan jasad renik sehubungan
dengan kebutuhan hidup organisme itu. Apa yang diikat oleh jasad renik demi
mencukupi kebutuhan hidupnya, kelak akan dikembalikan lagi apabila jasad renik
itu mati. Terjadi proses penguraian, pengikatan dan pembebasan berbagai zat atau
unsur hara selama berlangsungnya proses pembentukan kompos. Penjelasan
lengkap mengenai proses yang terjadi adalah sebagai berikut :
a. Hidrat arang (selulosa, hemiselulosa, dan lain - lain) diurai menjadi CO2 dan air
atau CH4 dan H2.
b. Zat putih telur diurai menjadi amida, asam amino, amoniak, CO2 dan air.
c. Berbagai jenis unsur hara, terutama N, disamping P, K dan yang lain sebagai
hasil penguraian, akan terikat dalam tubuh jasad renik. Sebagain yang tidak terikat
akan menjadi persediaan di dalam tanah. Yang terikat dalam tubuh jasad renik
tersebut kelak akan dikembalikan dalam tanah setelah jasad renik itu mati.
d. Ada juga unsur hara dari senyawa organik yang akan terbebas menjadi senyawa
an- organik sehingga menjadi persediaan di dalam tanah bagi keperluan
pertumbuhan dan perkembangan tanaman.
e. Lemak dan lilin akan terurai menjadi CO2 dan air.
Selama berlangsungnya proses tersebut akan terjadi perubahan berat dan
isi dari bahan – bahan pembuatanya. Terjadi pengurangan berat karena adanya penguapan dan pencucian. Sebagian besar senyawa hidrat arang akan hilang ke
udara selama penguapan.
2.3.1. Syarat Pe mbuatan Kompos
a. Campuran kompos harus homogen agar kadar N dan kecepatan fermentasi
dapat merata dan tetap. Oleh karena itu bahan mentah perlu dipotong – potong hingga menjadi bagian – bagian kecil.
b. Temperatur awal harus tinggi untuk membunuh bakteri pathogen, biji rumput – rumputan, lalat dan telurnya, serta larva hama lain beserta penyakit
2.3.2. Parameter yang dapat diamati sebagai petunjuk sempurnanya proses pengomposan sebagai berikut :
1. Selama proses pengomposan, dari hari pertama temperatur akan meningkat
secara bertahap. Proses pengomposan dianggap selesai apabila temperatur
kompos turun mendekati temperatur awal. Pengamatan ini dapat dilakukan
setiap hari menggunakan termometer kaca.
2. Pengamatan terhadap penyusutan tumpukan kompos dilakukan pada akhir
pengomposan (untuk bahan lunak) dan setiap minggu (untuk bahan keras).
2.3.3 Proses pengomposan
Campuran bahan bahan yang sudah ditambah bioaktivator difermentasi dengan
cara menutupnya menggunakan terval dan membiarkannya selama 5 – 7 hari.
Pada hari kedua atau ketiga, temperatur bahan kompos akan meningkat menjadi
40 – 60oC. Jika temperatur meningkat, tumpukan bahan tersebut harus dibalik, kemudian ditutup lagi. Tiga hari kemudian temperatur akan turun kembali dan
berangsur – angsur stabil. Jika temperatur sudah stabil, bahan tersebut sudah menjadi kompos dan siap dikemas atau digunakan. (Sofian, 2006)
2.4. EM4 Sebagai Mikroorganisme yang Efektif
Effective Microorganisme 4 (EM4) merupakan kultur campuran dari
mikroorganisme yang menguntungkan, berasal dari alam Indonesia asli,
bermanfaat bagi kesuburan tanah maupun pertumbuhan dan produksi tanaman,
serta ramah lingkungan. Mikroorganisme yang ditambahkan akan membantu
memperbaiki kondisi biologis tanah dan dapat membantu penyerapan unsur hara.
EM4 mengandung mikroorganisme fermentasi dan sintetik yang terdiri dari
bakteri asam laktat (Lactobacillus sp), bakteri fotosintetik (Rhodopseudomonas sp), Actinomycetes sp. Streptomuces sp, dan ragi (yeast).
Efek EM4 bagi tanaman tidak terjadi secara langsung. Hal ini yang
terkadang tidak disadari oleh para pemakai. Penggunaan EM4 akan lebih efisien
bila telah lebih dulu ditambahkan bahan organik yang berupa pupuk organik
sehingga unsur hara yang terkandung akan cepat terserap dan tersedia bagi
tanaman.
Satu hal yang menjadi pembatas dalam aplikasi EM4 adalah jangka hidup
dan mikroorganisme yang terkandung di dalamnya. Dalam kondisi Norman di
kemasan EM4 dapat disimpan selama 1 tahun.
Dosis semprot EM4 ke tanaman biasanya 3-10 ml/liter air. Selang
pemberian yang baik adalah satu minggu sekali dan bila tanah cukup kaya bahan
organik dapat diberikan dua minggu sekali. Larutan EM4 disiramkan ke daerah
perakaran dan permukaan areal tanam. Penggunaan pupuk organik sangat
dianjurkan guna memperkaya bahan makanan bagi tanaman.
Kandungan komposisi pupuk organik yang terdapat dalam kompos dan
pupuk kandang membentuk orgasol yang mengandung bahan kimia tambahan
untuk meningkatkan konsentrasi unsur kimia dalam pupuk. Komposisinya terdiri
dari N 8%, P 9%, K5,8%, zat organik 31%, dan air 45%. (Marsono Paulus Sigit,
2001)
Sumber bahan organik tanah adalah jaringan tana man baik yang berupa
serasah atau sisa tanaman yang berupa batang, akar daun yang kemudian
dirombak oleh mikroorganisme tanah, atau sisa hewan yang berupa kotoran
maupun bangkai hewan. Secara kimiawi bahan organik tanah tersususn atas
karbohidrat, protein lignin dan sejumlah senyawa kecil seperti lemak, lilin dan
sebagainya, salah satu hasil perombakan bahan organik adalah humus, yang
mempunyai kapasitas pengikatan unsur hara dan air yang sangat tinggi, memiliki
kekhususan koloidal dan mampu mengikat air 80-90% dari berat keringnya,
bandingkan dengan tanah liat yang hanya mampu mengikat air 15-20% saja.
Humus memberi warna tanah menjadi agak kehitaman dan sangat bermanfaat bagi
pertanian karena mempengaruhi struktur tanah.
Bahan organik dalam tanah sangat berhubungan dengan kecepatan
pelapukan tanah. Bahan organik yang mempunyai C/N rasio yang rendah akan
lebih cepat melapuk dibanding bahan organik yang mempunyai C/N rasio yang
tinggi. Untuk cepat lapuk maka perlu penambahan nitrogen tanah yaitu dengan
menambahkan bahan organik yang cepat lapuk. Walaupun demikian peran
oksigen juga berpengaruh pada aktivitas mikroorganisme dalam penguraian. Ini
berkaitan dengan ketersediaan unsur hara dari bahan organik yang bisa diserap
tanaman. (M, Isnaini, 2006)
Reaksi - reaksi yang terjadi pada proses pengomposan yaitu :
Reduksi sulfat :
CH3CHOHCOOH + SO42- 2CH3COOH + H2S + 2OH - 4H2 + SO42- 2H2O + H2S + 2OH-
Reduksi karbon organik secara anaerobik :
CH3COOH CH4 + CO2
4CH3OH 3CH4 + CO2 + 2H2O C6H12O6 ba kteri 3CH3COOH
C6H12O6 ka pang 2CH3CH2OH + 2CO2
Reduksi karbon dioksida :
2CH3CH2OH + 2CO2 2CH3COOH + CH4 4H2 + CO2 CH4 + 2H2O 4H2 + 2CO2 CH3COOH + 2H2O
Reduksi oksidasi sempurna :
CH3COOH + 2O2 CO2 + 2H2O 2H2 + O2 2H2O
CH4 + 2O2 CO2 + 2H2O
( M. Judoamidjojo, A.A. Darwis dan E.G. Said ).
Reaksi aminasi :
P rotein proses enzima tik senyawa asam amino komplek + O2 + amina
R NH2 + H2O hidrolisa enzim R OH + NH3 + energi
Reaksi amonifikasi :
2NH3 + H2CO3 (NH4)2CO3 2NH4+ + CO3
2-Reaksi nitrifikasi :
2NO2- + O2 2NO3- + Energi
( Mul Yulyani Sutedjo, 2002 )
2.5. Meningkatkan Kesuburan Tanah
Produksi tanaman akan terhalang jika unsur hara yang terkandung di dalam tanah
kurang atau tidak seimbang, terutama di daerah yang kadar unsur haranya buruk
atau tanahnya terlalu asam atau basa. Meningkatkan jumlah produksi komoditas
pertanian di Indonesia dapat dilakukan dengan cara meningkatkan kualitas tanah
yang sudah mulai menurun kesuburannya.
Upaya yang dapat dilakukan untuk membatasi hilangnya unsur hara dan
mengembalikan kesuburan tanah dilakukan dengan cara mendaur ulang limbah
organik, seperti limbah dari kandang peternakan, kotoran manusia, sisa tanaman
atau sisa pengolahan tanaman. Hasil daur ulang limbah organik tersebut
dikembalikan ke lahan baik secara langsung ataupun setelah diolah menjadi
kompos atau difermentasikan. dengan memanfaatkan pupuk organik tersebut,
unsur hara dalam tanah akan bisa diperbaiki. Sehingga kehilangan unsur hara
akibat terbawa air hujan/leaching dapat diatasi.
Pemupukan menggunakan kompos mengakibatkan tanah yang strukturnya
ringan (berpasir atau ringan) menjadi lebih baik, daya ikat air menjadi lebih
tinggi. Sementara itu, tanah yang berat (tanah liat) menjadi lebih optimal dalam
mengikat air. Kompos dapat meningkatkan kapasitas tukar kation (KTK) tanah
dan dapat meningkatkan penyerapan unsur hara. Unsur hara yang dibutuhkan
tanaman tersedia di dalam tanah dan pupuk, serta akan diserap dengan rambut
akar dalam bentuk ion. Tanah yang memiliki kapasitas tukar kation (KTK) rendah
hanya memiliki sedikit unsur hara di dalamnya yang dapat diserap tanaman.
Unsur hara yang dibutuhkan tanaman dibagi menjadi dua yaitu unsur hara makro
dan unsur hara mikro. Unsur hara makro antara lain Nitrogen (N), Fosfor (P),
Kalium (K), Kalsium (Ca), Magnesium (Mg), dan Sulfur (S). Sedangkan unsur
Komponen kompos yang semakin berpengaruh terhadap sifat kimia tanah
adalah kandungan humusnya. Humus dalam kompos mengandung unsur hara
yang dibutuhkan tanaman. Humus yang menjadi asam humat dapat melarutkan zat
besi dan aluminium sehingga fosfat yang terikat besi dan alminium akan lepas dan
dapat diserap oleh tanaman. Selain itu humus merupakan penyangga kation yang
dapat mempertahankan unsur hara sebagai bahan makanan untuk tanaman.
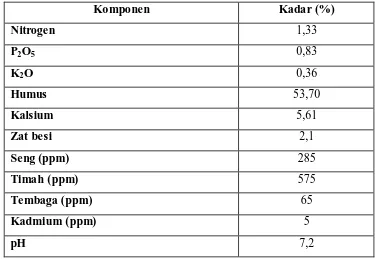
Kandungan kimia kompos terlihat pada table di bawah ini :
Tabel 2.1. Komposisi Kimia Kompos (. Sumber : (http:// www.kompos.go.id/
htmt.)
Komponen Kadar (%)
Nitrogen 1,33
P2O5 0,83
K2O 0,36
Humus 53,70
Kalsium 5,61
Zat besi 2,1
Seng (ppm) 285
Timah (ppm) 575
Tembaga (ppm) 65
Kadmium (ppm) 5
pH 7,2
Kompos juga berfungsi sebagai pemasok makanan bagi organisme di dalam tanah
seperti kapang, bakteri, actinomycetes, dan protozoa sehingga dapat
meningkatkan dan mempercepat proses dekomposisi bahan organik.
2.6. Pupuk Kandang
Pupuk kandang adalah pupuk yang bahan dasarnya berasal dari kotoran dan urin
ternak. Umumnya, hampir semua kotoran hewan dapat digunaka n sebagai pupuk
kandang. Namun, kotoran hewan seperti kambing, domba, sapi, dan ayam
Pupuk kandang tidak hanya membantu pertumbuhan, tetapi juga dapat membantu
menetralkan racun logam berat di dalam tanah, memperbaiki struktur tanah,
membantu penyerapan hara, dan mempertahankan suhu tanah.
Ciri pupuk kandang yang telah siap digunakan adalah dingin, remah, wujud
aslinya sudah tidak tampak, dan baunya telah jauh berkurang. Jika belum
memiliki ciri – ciri tersebut, pupuk kandang belum bisa digunakan. Para petani
biasanya menggunakan pupuk kandang dengan cara disebar dan dibenamkan.
Namun, penggunaan yang paling baik adalah dengan cara dibenamkan. Dengan
cara ini penguapan unsur hara akibat proses kimia dalam tanah dapat dikurangi.
(Sukamto Hadisuwito, 2007)
2.7. Humus
Humus adalah sisa tumbuhan berupa daun, akar cabang, dan batang yang sudah
membusuk secara alami lewat bantuan mikroorganisme (di dalam tanah) dan
cuaca (di atas tanah). Lapisan tanah dihutan banyak terbentuk humus.
a. Ciri khas Humus
Ciri khas humus adalah berwarna hitam sampai cokelat tua. Sifatnya tidak
berbeda dari kompos, yaitu mudah mengikat dan merembeskan air, dan gembur.
Itulah sebabnya humus sangat berguna untuk memperbaik i keadaan tanah yang
sudah rusak tekstur tanahnya. Sayangnya humus sangat susah dicari. Satu –
satunya cara yang biasa dilakukan untuk menambahkan humus dalam tanah ialah
menanam pupuk hijau dilahan. Dengan membenamkan pupuk hijau di dalam
tanah maka akan terjadi pembusukan sehingga membentuk humus.
Kalau diamati memang sulit membedakan antara kompos dengan humus.
Perbedan hanya bahan dan cara terjadinya. Kalau kompos dibuat dari berbagai
bahan dan dilapukkan dengan bantuan manusia maka humus terjdi dari bagaian
tanaman yang membusuk atau melapuk sendirinya.
b. Menggunakan Humus
Dewasa ini, humus sudah menjadi barang dagangan, banyak diperjualbelikan
itu, dapat dimaklukmi kalau orang hanya mempergunakannya untuk tanaman – tanaman tertentu saja. Di kota humus biasanya dipakai untuk mengisi media
tanaman dalam pot dan untuk keperluan mencangkok. (Pinus Lingga, Marsono,
2005)
2.8. Kandungan Nutrisi Tanaman
Fungsi utama nutrisi adalah sebagai sumber energi, bahan pembentuk sel, dan
aseptor elektron di dalam aksi yang menghasilkan energi. Nutrisi yang diperlukan
oleh mikroba meliputi air, sumber energi, sumber karbon, sumber nitrogen,
sumber aseptor nitrogen, sumber mineral dan faktor tumbuh.
a. Air
Air sangat penting (esensial) untuk pertumbuhan dan kehidupan semua mikroba,
karena air merupakan bagain terbesar dari sel mikroba yaitu sebesar 70 – 80%. Air berfungsi sebagai pelarut, alat pengangkut dan biokimia di dalam sel.
b. Sumber Energi
Mikroba memperoleh energi dari dua jenis sumber yaitu mikroba yang mendapat
energi dari reaksi oksidasi bahan kimia (organik atau anorganik) disebut mikroba
khemotrof, sedangkan mikroba fototrof mendapatkan energi dari sinar matahari
melalui proses potosintesis.
c. Sumber Karbon
Karbon merupakan bagaian dari sitoplasma, enzim, dinding sel, dan termasuk
bahan cadangan di dalam sel makhluk hidup. Hasil oksidasi dari senyawa karbon
juga digunakan sebagai sumber energi. Yang menjadi sumber karbon adalah
karbohidrat, yaitu monosakarida (glukosa, fruktosa, galaktosa), disakarida
(maltosa, laktosa, sukrosa), trisakarida (rafinosa), dan polisakarida (pati, dekstrin,
pectin, selulosa). Sumber karbon lain berasal dari asam – asam organik (asam
sitrat, asam malat, asam suksianat), garam – garam organik, dan polialkohol. d. Sumber Nitrogen
Untuk aktivitas mikroba membutuhkan nitrogen yang umumnya diperoleh dari
bahan anorganik, misalnya amonium (NH4+), nitrat (NO3) atau bahan organik,
Rhizobium sp) dapat secara langsung menggunakan gas N2 sebagai suumber nitrogen. Peristiwa ini disebut fiksasi N2 udara. (Nurwantoro, 1997)
2.9.Nitrogen ( N )
Nitrogen dibutuhkan untuk menyusun 1- 4% bahan kering ( bagian keras )
tanaman, seperti batang, kulit , dan biji. Nitrogen diambil dari tanah dalam bentuk
nitrat (NO3-) atau amonium (NH4+), atau kombinasi dengan senyawa metabolisme
karbohidrat di dalam tanaman dalam bentuk asam amino dan protein. Nitrogen
juga tersedia pada kompos dan pupuk kandang dalam jumlah sedikit.
Pupuk non - organik (buatan) yang banyak digunakan petani adalah urea.
Urea mengandung nitrogen 46%. Apabila urea ditebarkan di permukaan tanah
tanpa dimasukkan ke dalam tanah, kandungan nitrogennya akan me nguap 20 –
30%, sehingga penggunaannya harus dilakukan dengan cara pencampuran dengan
tanah. Apabila bercampur dengan tanah, urea akan berubah menjadi bentuk
amonium karbohidrat, kemudian akan berubah menjadi NH3 dan karbondioksida.
Kekurangan nitrogen pada tanaman menunjukkan gejala sebagai berikut :
- kondisi tanaman buruk dan menjadi sangat kerdil.
- daun tanaman kecil, berwarna pucat, dan berwarna hijau kekuningan.
- daun pada bagian paling bawah seperti terbakar dan mati sebelum masanya,
sementara daun pada tajuk atas tanaman masih hijau.
- produksi tanaman rendah. (Redaksi Agromedia, 2007)
2.10. Posfor (P)
Posfor diserap tanaman lebih banyak dalam bentuk anion H2PO4- daripada bentuk
anion HPO4-. Posfor dalam tanah terikat oleh bahan organik sehingga tidak
tersedia bagi tanaman. Sedangkan dalam bahan anorganik, posfor berasal dari
batuan induk dalam bentuk kalsium, besi aluminium posfat.
Posfor sangat vital bagi tanaman karena merupakan sumber energi untuk
pertumbuhan tanaman. Posfor berbentuk adenosin triposfat (ATP) merupakan
senyawa posfor yang mengandung energi tinggi. Selain itu posfor merupakan
Kekurangan posfor pada tanaman akan dapat mempengaruhi terhambatnya
proses metabolisme pada tubuh tanaman. Gejala – gejala kekurangan posfor pada
tanaman dapat dilihat dengan ciri – ciri yaitu pertumbuhan tanaman akan terhambat, daun tua akan cepat rontok, daun berwarna hijau gelap dan kadang –
kadang bergelombang. Di samping itu juga akan terjadi pengendapan karbohidrat
yang dapat mendorong terbentuknya antosianin sehingga daun dan batang
berwarna kemerahan atau ungu.
Tidak seperti halnya nitrogen yang terdapat dalam jumlah banyak, kadar
posfor sangat terbatas. Dengan demikian sangat tergantung jenis tanah serta
penambahan pupuk Posfat dari luar. Posfor anorganik di dalam tanah terdapat
dalam dua bentuk, yaitu terikat dengan kalsium (Ca) dan dengan besi atau
aluminum.
2.11. Kalium (K)
Kadar Kalium (K) di dalam tanah cukup tinggi, dan merupakan salah satu unsur
yang esensial bagi tanaman. Namun demikian, fungsi unsur K ini di dalam
tanaman masih belum jelas. Fungsi unsur ini yang telah diketahui adalah sebagi
pembantu penyelenggara fotosintesis tanaman, translokasi gula, dan mengaktifkan
kerja enzim. Pada akhir – akhir ini terdapat dugaan bahwa kalium berperan
mengatur tekanan potensi air dalam sel penjaga (guasd cell), sehingga menentukan membuka dan menutupnya stomata.
Seperti halnya pada nitrogen dan posfor, kalium adalah bersifat mobil di
dalam tanaman, oleh karena itu gejala pertama dari kekurangan K ini terlihat pada
daun tua. Daun tua menjadi klorosis kemudian nekrosis pada ujung dan tepi helai
daun. Reaksi yang berpengaruh adalah terjadinya pengendapan karbohidrat dan
nitrogen terlarut, sehingga menghambat sintesis protein.
Penggunaan pupuk K dalam jumlah banyak tidak menimbulkan bahaya, tidak
sebagaimana dengan nitrogen, karena unsur K mudah tercuci. Tanaman menyerap
K dalam proporsinya dan sesuai dengan ketersediannya. Apabila penggunaan K
berlebih pada musim tanam, maka untuk musim tanam berikutnya pemberian K
tidak perlu. Kelebihan K didalam tanah dapat menyebabkan kekurangan Mg pada
2.11.1. Peranan Kalium Didalam Pertumbuhan Tanaman
Peranan kalium didalam tanaman adalah sebagai pengatur berbagai proses
fisiologi tanaman seperti merawat kondisi air di dalam sel dan jaringan, mengatur
turgor atau tegangan sel, membuka dan menutup stomata, serta mengatur
akumulasi dan translokasi karbohidrat yang baru terbentuk. Dengan baiknya
pengaturan ini maka pertumbuhan tanaman menjadi merata dan pesat serta
ketahanan penyakit meningkat.
2.11.2. Defisiensi Unsur Hara Kalium
Defisiensi unsur K menyebabkan tanaman tampak kerdil, jarak antar – ruas memendek, ujung dan tepi daun menjadi hitam dan seperti hangus (Scorch), tepi
daun melekuk kebawah yang dimulai dari daun terbawah, tanaman mudah rebah
dan rentan terhadap serangan penyakit, serta produksi buah menurun yang diikuti
dengan penurunan kualitas. Selain itu, tanaman menjadi rentan terhadap kelebihan
amonium dengan gejala klorosis atau berbintik hitam yang tersebar di permukaan
daun, khususnya pada tanaman dikotil, sedangkan pada tanaman monokotil, ujung
dan tepi daun mengering.
2.11.3. Kelebihan Unsur Hara Kalium Bagi Tanaman
Bila unsur K berkelebihan maka akan tampak gejala yang bertentangan
(antagonis) dengan Mg atau terjadi defisiensi Mg. Sering juga terjadi anta gonis
dengan Ca sehingga menunjukkan gejala defisisnesi Ca. Selain itu, ada
kemungkinan terjadi antagonis dengan unsur Fe, Mn dan Zn. Sebenarnya tanaman
tidak akan menyerap unsur K secara berlebihan. Namun, kelebihan terjadi akibat
unsur K yang berlebih di larutan air dalam tanah. Oleh karena itu dianjurkan
digunakan kadar K yang cukup, tetapi sesuai dengan kebutuhan tanaman sehingga
tidak menyebabkan antagonis.
2.12. Keunggulan Penggunaaan Pupuk Organik Dibanding dengan Pupuk Anorganik
Pada dasarnya, tanaman yang diberikan pupuk organik adalah lebih berkualitas.
Tanaman sayuran yang diberi pupuk organik akan lebih segar dan rasanya enak,
serta dapat disimpan lebih lama. Misalnya, wortel organik bisa disimpan selama 3
sampai
4 minggu, sedangkan wortel non – organik hanya tahan disimpan 1 sampai 2 minggu. Kelebihan pupuk organik dibandingkan dengan pupuk anorganik dapat
dilihat sebagai berikut :
- mengandung unsur hara makro dan mikro lengkap, tetapi jumlahnya sedikit.
- dapat memperbaiki struktur tanah, sehingga tanah menjadi gembur.
- memiliki daya simpan air (water holding capacity) yang tinggi.
- beberapa tanaman yang dipupuk dengan pupuk organik lebih tahan terhadap
serangan penyakit.
- meningkatkan aktivitas mikroorganisme tanah yang menguntungkan.
- memiliki residual effect yang positif, sehingga tanaman yang ditanaman pada
musim berikutnya tetap bagus pertumbuhan dan produktivitasnya.
Sedangkan pupuk anorganik dapat dilihat sebagai berikut :
- hanya mengandung satu atau beberapa unsur hara, tetapi dalam jumlah banyak.
- tidak dapat memperbaiki struktur tanah, justru penggunaannya dalam jangka
waktu
lama menyebabkan fisik tanah menjadi keras.
- dapat membuat tanaman rentan terhadap penyakit.
- pupuk anorganik mudah menguap dan tercuci terkecuali jenis pupuk seperti
TSP, SP36 dan pupuk posfat lainnya. Oleh karena itu, penggunaan yang tidak
tepat akan tidak berarti karena unsur hara yang ada hilang akibat menguap atau
tercuci air. (Sukamto, 2007)
2.13. Penentuan Kadar C - Organik
Bahan – bahan/material organik tanah merupakan sisa tumbuhan, hewan dan organisme tanah, baik yang telah maupun yang sedang mengalami dekomposisi.
menjadi hitam dan bersifat koloidal.pengukuran kandungan bahan organik tanah
berdasarkan jumlah organik yang mudah teroksidasi akan mereduksi Cr2O72- yang
diberikan secara berlebihan. Terjadinya reaksi ini karena adanya energi yang
dihasilkam oleh reaksi H2SO4 pekat dan K2Cr2O7. Keadaan ini menyebabkan Cr6+
(Nurdin Muhammad Suin,2002).
Teknik penetapan C-organik yang paling standar adalah oksidasi bahan
orgaik oleh dikromat yang mana metode ini lebih sering disebut metode Walkley
dan Black. Dalam prosedurnya kalium dikromat dan asam sulfat pekat
ditambahkan ke dalam bahan organik, dimana larutan tersebut harus didinginkan
terlebih dahulu sebelum ditambahkan dengan air. Penambahan asam posfat ke
dalam larutan tersebut berguna untuk mengurangi interferensi dari Fe3+ yang
mungkin sering terjadi.
Persamaan reaksinya adalah sebagai berikut :
2 Cr2O72- + 3 C + 16 H+ 4 Cr3+ + 3 CO2 + 8 H2O
Prosedur dari Walkley dan Black ini sangat luas digunakan karena
sederhana, cepat dan tidak memerlukan peralatan yang mahal, akan tetapi
prosedur ini hasil oksidasi tidak dapat mencapai hasil yang optimal, yang mana
prosedur tersebut hanya mampu mengoksidasi bahan organik antara 60 % - 75 %.
(Zimmerman, 1997).
2.14. Penentuan Nitrogen dengan Metode Kjehdahl
Metode ini sangat penting dalam penentuan kadar protein. Pada dasarnya, bahan
dioksidasi dengan asam sulfat pekat panas hingga hancur. Tahap ini disebut tahap
digestion atau pencernaan. Disini nitrogen diubah menjadi ion amonium. Pada
tahap berikutnya, larutan ditambah ba sa kuat sehingga bereaksi basa lalu
didestilasi. Hasil destilasi ditampung dengan HCl baku yang tertentu jumlahnya
untuk mengikat NH3. Destilat kemudian dititrasi dengan NaOH baku untuk
menentukan kelebihan asam.
Selisih HCl yang ditambahkan dengan yang d ititrasi merupakan jumlah
Reaksi – reaksi yang terjadi sebagai berikut :
Protein + oksidator NH4+ + CO2 + H2O + lain – lain (digestion)
NH4+ + OH- NH3 + H2O (destilasi)
NH3 + HCl berlebih NH4Cl (penampungan)
HCl sisa + NaOH NaCl + H2O (titrasi)
(W. Harjadi, 1993)
2.15. Penentuan Posfat
Kelarutan posfor dalam zat pembawanya berbeda – beda. Pupuk posfat yang larut dalam air tak selalu merupakan kategori yang paling baik untuk mengartikan
ketersediaan unsurnya bagi tanaman, meskipun posfat yang larut dalam air salah
satu pengertian yang baik.
Metode kimia telah dikembangkan diman pertimbangan yang
diperhatikan yaitu larut dalam,ketersediaan,dan kandungan tota l posfat.
Istilah yang paling sering digunakan dalam menggambarkan kandungan posfor
dengan menentukan kelarutannya dalam air, kelarutannya dalam sitrat, tidak larut
dalam sitrat, ketersediaannya, dan total posfornya(sebagai P2O5).
Sejumlah kecil sampel diambil dari bahan untuk dianalisa, pertama –
tama diekstraksi dengan air. Endapan disaring dan jumlah posfat yang dikandung
didalam filtrat ditentukan. Hasilnya dinyatakan dalam persen per berat sampel,
fraksi ini mewakili fraksi yang larut dalam air.
Posfor yang larut dalam asam sitrat, residu diekstraksi dengan
ammonium sitrat 1N. Posfor yang tersedia adalah jumlah posfor yang larut dalam
air dan larut dalam sitrat mewakili taksiran yang tersedia untuk tanaman.
(Samuel L.Trigdale,1975)
Prosedur penentuan posfat didasarkan pada reaksi :
H3PO4 + 12H2MoO4 H3P(Mo12O40) + 12 H2O
Mo (IV) Mo (V)
Posfat dengan molibdat membentuk suatu poliheteroasam dimana
dengan asam askorbat sehingga membentuk kompleks biru yang dapat diukur
secara metode scpektrofotometri pada panjang gelombang 660 nm. (J.Ruzieka,
E.H.Hansen, 1981)
2.16. Penentuan Kalium Secara Spektrofotometer Serapan Atom (SSA)
Kalium adalah salah satu unsur logam alkali yang mempunyai rumus atom K
berat atom 39.102, nomor atom 19, titik lebur 63,38o C, dan titik didihnya 759o C.
Kadar kalium ditetapkan dengan Spektrofotometer Serapan Atom (SSA).
Spektofotometri serapan atom yang disingkat dengan SSA adalah suatu tekn ik
atau metode analisa kimia bagi penentuan kadar unsur-unsur logam dan semi logam
yang terdapat didalam sampel (terutama pada kadar yang rendah yaitu ppm dan ppb),
dengan dasar analisis absorbsi energi radiasi elektromagnetik oleh atom.
Di dalam suatu nyala, atom yang terbanyak lebih berada dalam keadaan
elektronik dasar daripada dalam keadaan tereksitasi. Jumlah atom yang tereksitasi
berkisar secara eksponensial dengan suhu sedangkan dengan demikian banyak
atom yang tereksitasi. Atom-atom gas terionisasikan dan benturan ion-ion
berenergi dengan permukaan katoda mengusir atom-atom logam yang telah
tereksitasikan. Hal ini mengakibatkan terjadinya spek trum garis logam yang
menampakkan diri sebagai suatu bara di dalam ruangan pada katoda cekung.
Suatu garis yang cocok di dalam spektrum emisi dari sumbernya dipilih untuk
dianalisa. Garis ini yang disebut garis resonansi, menunjukkan suatu perpindahan
dari suatu keadaan bereksitasi suatu atom ke keadaan dasar dan dengan demikian
menunjukkan frekuensi yang tepat bagi absorbsi oleh atom-atom di dalam nyala
yang ada pada keadaan dasar.
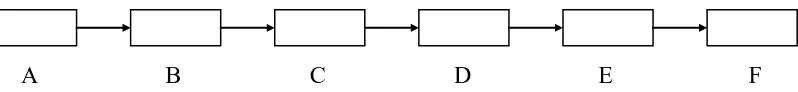
2.16.1. Instrumentasi Spektrofotometer Serapan Atom :
A B C D E F
A. Lampu katoda berongga
Lampu katoda berongga merupakan sumber sinar yang
memancarkan spektrum dari unsur logam yang akan dianalisa (setiap logam
yang memiliki lampu khusus untuk logam tersebut).
B. Chopper
Mengatur sinar yang dipancarkan.
C. Tungku
Tempat pembakaran (untuk memecahkan larutan sampel pada tetesan
halus dan meleburkannya ke dalam nyala untuk diatomkan).
D. Monokromator
Mendispersi sinar yang ditransmisikan oleh atom.
E. Detektor
Mengukur sinar yang ditransmisikan dan memberikan signal sebagai
respon terhadap sinar yang diterima.
F. Rekorder
Untuk membaca nilai absorbansi. (Khopkar, S.M. 2002)
2.16.2. Keuntungan Spektrofotometer Serapan Atom :
1. Karena absorpsi bergantung pada populasi keadaan dasar, maka
kepekaan
mungkin lebih tinggi khususnya untuk unsur-unsur yang sukar
dieksitasikan (misalnya seng yang dapat ditentukan kurang dari 0,5 ppm,
sedang batas terendah pada emisi mungkin sama dengan 500 ppm).
2. Populasi keadaan dasar jauh kurang peka terhadap suhu nyala daripada
3. Interferensi dari garis-garis spektrum dari unsur-unsur lain dan emisi latar
BAB 3
BAHAN DAN METODE PENELITIAN
3.1Alat – alat
- Labu Kjehldahl Pyrex
- Hot Plate Stirer PMC
- Gelas Beaker Pyrex
- Buret Pyrex
- Gelas Ukur Pyrex
- Corong Pyrex
- Gelas Piala Pyrex
- Labu Takar Pyrex
- Pipet Volume Pyrex
- Tabung Reaksi Pyrex
- Spatula
- Gelas Timbangan Pyrex
- Termometer Pyson
- Oven Galamerican
- Container PVC 10 Liter
- Mikro Pipet Pyrex
- Klemp
- Statif
- Timbangan Elektrik Mettler PM 400
- Spektrofotometer Sinar Tampak ST 300
- Kertas saring Whatman no. 40
- Kuvet
- pH meter
3.2. Bahan – bahan
- Tumbuhan Kembang Bulan
- Tumbuhan Daun Nippon
- Kotoran babi
- Dedak
- EM4
- Gula Merah
- Akuades
- H2SO4 (P) p.a. E. Merck
- HCl (p) p.a. E. Merck
- H3PO4 (P) p.a. E. Merck
- FeSO4 . 7H2O p.a. E. Merck
- KCl p.a. E. Merck
- K2CrO7 p.a. E. Merck
- H2C2O4 p.a. E. Merck
- NaOH p.a. E. Merck
- H3BO3 p.a. E. Merck
- Asam Askorbat p.a. E. Merck
- Kalium Antimonil Tartarat p.a. E. Merck
- Amonium Molibdat p.a. E. Merck
- Fenolftalein p.a. E. Merck
- Metil Merah p.a. E. Merck
- Metil Biru p.a. E. Merck
- Bromtimol Biru p.a. E. Merck
- Alkohol 96% Teknis
- KH2PO4 p.a. E. Merck
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel Ke mbang Bulan
Tumbuhan kembang bulan segar dirajang menjadi potonga n- potongan kecil,
kemudian dikeringkan dibawah sinar matahari selama 3 hari.
3.3.2. Penyediaan Sampel Daun Nippon
Tumbuhan daun Nippon segar dirajang menjadi potongan – potongan kecil, kemudian dikeringkan dibawah sinar matahari selama 3 hari.
3.3.3. Penyediaan kotoran babi
Kotoran babi segar dikeringkan sebanyak 1,5 kg dibawah sinar matahari selama 3
hari.
3.3.4. Penyediaan Dedak
Dedak dikeringkan sebanyak 3 kg dibawah sinar matahari selama 3 hari.
3.3.5. Pembuatan Larutan Gula
Ditimbang sebanyak 500 g gula merah atau sesuai dengan yang dibutuhkan dan
dilarutkan dengan air sebanyak 1 L
3.3.6. Pembuatan Larutan Starter EM4
Dimasukkan EM4 sebanyak 10 ml ke dalam labu takar 1000 ml, ditambahkan
larutan gula merah 10 ml, kemudian ditambahkan akuades hingga garis tanda.
Larutan dihomogenkan kemudian didiamkan selama 18 jam.
3.3.7. Pembuatan Kompos
3.3.7.1. Kompos Kembang Bulan
Ditimbang sebanyak 2 kg sampel Kembang Bulan dimasukkan kedalam container
PVC tertutup ukuran 10 liter, ditambahkan sebanyak 400 g kotoran babi dan
telah diencerkan. Pencampuran dilakukan perlahan – lahan dan merata hingga kandungan air 30 – 40%, kandungan air yang diinginkan diuji dengan tidak
menetesnya air bila bahan digenggam dan dapat dikepal - kepal. Campuran
dihomogenkan, ditutup dan disimpan pada tempat yang aman, dibiarkan hingga
pengomposan berlangsung selama 15 hari (penentuan kandungan C – Organik, N – total, P – total, dan K dilakukan sekali dalam 3 hari).
3.3.7.2. Kompos Daun Nippon
Ditimbang sebanyak 2 kg sampel Daun Nippon dimasukkan kedalam Container
PVC tertutup ukuran 10 liter, ditambahkan sebanyak 400 g kotoran babi dan
dedak 1252 g yang telah dikeringkan, kemudian ditambahkan starter EM4 yang
telah diencerkan. Pencampuran dilakukan perlahan – lahan dan merata hingga
kandungan air 30 – 40%, kandungan air yang diinginkan diuji dengan tidak menetesnya air bila bahan digemgam dan dapat dikepal - kepal. Campuran
dihomogenkan, ditutup dan disimpan pada tempat yang aman, dibiarkan hingga
pengomposan berlangsung selama 15 hari (penentuan kandungan C – Organik, N – total, P – total, dan K dilakukan sekali dalam 3 hari). Dengan catatan bahwa perbedaan berat dedak pada sampel Kembang Bulan dan Daun Nippon dibuat
melalui perhitungan C/N, yang terlebih dahulu diketahui berat dan C/N sampel
(Kembang Bulan dan Daun Nippon) dan kotoran babi dengan perhitungan sebagai
berikut :
C/N
=Bera tsa mpelAxC/N.ABera tsa mpelBxC/N.BBera tsa mpelCxC/N.C= 30 : 1
Dimana : Sampel A = Sampel Kembang Bulan dan daun Nippon
Sampel B = Dedak
Sampel C = Kotoran Babi
3.3.8. Pembuatan Pereaksi dan Larutan Standar
3.3.8.1. Pe mbuatan Pereaksi dan Larutan standar untuk penentuan Posfor sebagai P-Total dengan Metode Spektrofotometri
a. Larutan HCl 25%
Dipipet 173,6 ml larutan HCl (p), dimasukkan ke dalam labu takar 250 ml,
diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
b. Larutan Standar P 100 ppm
Ditimbang 0,2195 g kristal KH2PO4 secara kuantitatif, dimasukkan ke dalam gelas
piala 250 ml, dilarutkan dengan akuades secukupnya, dimasukkan kedalam labu
takar 500 ml, diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
c. Larutan Amonium Molibdat 4%
Ditimbang 1,883 g kristal (NH4)6Mo7O24 . 4H2O, dimasukkan ke dalam gelas
piala 50 ml, dilarutkan dengan akuades secukupnya, d imasukkan kedalam labu
takar 50 ml, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
d. Larutan Asam Askorbat 0,1 M
Ditimbang 0,880 g kristal C6H8O6, dimasukkan ke dalam gelas piala 50 ml,
dilarutkan dengan akuades secukupnya, dimasukkan kedalam labu takar 50 ml,
diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
e. Larutan Kalium Antimonil Tartarat 1mg Sb/ml
Ditimbang 0,105 g kristal KSbOC4H4O6 . 1/2 H2O, dimasukkan ke dalam gelas
piala 50 ml, dilarutkan dengan akuades secukupnya, dimasukkan kedalam
labu takar 50 ml, diencerkan dengan akuades hingga garis tanda, dan
dihomogenkan.
f. Larutan Standar P 2, 4, 6, 8, dan 10 ppm
Disediakan sebanyak 5 buah labu takar yang kering dan bersih, masing – masing
labu takar dipipet sebanyak 2 ml, 4 ml, 6 ml, 8 ml, dan 10 ml larutan standar P
100 ppm, kemudia setiap labu takar ditambahkan 20 ml akuades dan 11,7 ml HCl
g. Larutan H2SO4 5 N
Dipipet 13,72 ml H2SO4 (p), dimasukkan ke dalam labu takar 100 ml yang telah
berisi 20 ml akuades, diencerkan dengan akuades hingga garis tanda, didinginkan
dan dihomogenkan.
h. Pembuatan Reagen Campuran Pengkompleks
Dipipet 25 ml H2SO4 5 N ke dalam labu takar 50 ml, ditambahkan 7,5 ml larutan
amonium molibdat 4%, ditambahkan 15 ml larutan asam askorbat 0,1 M,
ditambahkan 2,5 ml larutan kalium antimonil tartarat 0,1 M, dan
dihomogenkan.
3.3.8.2. Pembuatan Pereaksi untuk Penentuan C – Organik
a. Larutan K2Cr2O7 1 N
Ditimbang secara kuantitatif kristal K2Cr2O7 sebanyak 12,257 g, dimasukkan ke
dalam gelas piala 250 ml, dilarutkan dengan akuades secukupnya, dimasukkan
kedalam labu takar 250 ml, diencerkan hingga garis tanda, dan dihomogenkan.
b. Larutan FeSO4 1 N
Ditimbang secara kuantitatif kristal FeSO4 . 7H2O sebanyak 69,505 g, dimasukkan
ke dalam gelas piala 250 ml, dilarutkan dengan akuades secukupnya, ditambahkan
37,5 ml H2SO4 pekat secara perlahan – lahan, diaduk hingga larut, dimasukkan kedalam labu takar 250 ml, ditambahkan akuades hingga garis tanda, didinginkan
dan dihomogenkan.
c. Larutan Difenilamin ( (C6H5)2NH4 ).
Ditimbang 0,5 g kristal difenilamin, dilarutkan dengan akuades dalam gelas piala
250 ml, ditambahkan dengan 100 ml H2SO4 pekat secara perlahan – lahan dengan
3.3.8.3. Pembuatan Pereaksi untuk Penentuan Nitrogen Total (Metode Kjehldahl)
a. Larutan NaOH 40%
Ditimbang sebanyak 40 g kristal NaOH, dimasukkan kedalam gelas piala 250 ml,
kemudian dilarutkan dengan akuades, dimasukkan kedalam labu takar 100 ml,
diencerkan hingga garis tanda dan dihomogenkan.
b. Larutan Indikator Fenolftalein
Ditimbang kristal fenolftalein sebanyak 1 g kemudian dilarutkan dengan alkohol
96%, dimasukkan kedalam labu takar 100 ml, diencerkan hingga garis tanda, dan
dihomogenkan.
c. Larutan H3BO3 3%
Ditimbang H3BO3 sebanyak 3 g, dimasukkan kedalam gelas piala 250 ml,
dilarutkan dengan akuades, dimsukkan kedalam labu takar 100 ml, diencerkan
hingga garis tanda dan dihomogenkan.
d. Larutan Indikator Campuran
Sebanyak 2 ml larutan indikator metil biru 0,1% (b/v ) didalam alkohol,
dicampurkan dengan 1 ml larutan indikator metil merah 0,2% (b/v) kemudian
dihomogenkan.
e. Larutan H2C2O4 0,01 N
Ditimbang kristal H2C2O4 . 2H2O secara kuantitatif sebanyak 0,63 g, dimasukkan
kedalam gelas piala 250 ml, dilarutkan dengan akuades, dimasukkan ke dalam
labu takar 1000 ml, diencerkan hingga garis tanda, dan dihomogenkan.
f. Larutan NaOH 0,01 N
Ditimbang secara kuantitatif kristal NaOH sebanyak 0,4 g, dimasukkan ke dalam
gelas piala 250 ml, dilarutkan dengan akuades, dimasukkan ke dalam labu takar
g. Larutan HCl 0,01 N
Sebanyak 0,83 ml HCl 37% dipipet ke dalam labu takar 1000 ml, diencerkan
hingga garis tanda dengan akuades, dan dihomogenkan.
h. Standarisasi Larutan NaOH 0,01 N
- Dipipet 10 ml larutan H2C2O4 0,01 N dimasukkan ke dalam gelas piala 125 ml
- ditambahkan 3 tetes indikator Fenolftalein
- dititrasi dengan NaOH hingga terjadi perubahan warna menjadi merah
lembayung
- dilakukan hal yang sama sebanyak 3 kali.
i. Standarisasi HCl 0,01 N
- Dipipet 10 ml larutan HCl 0,01 N dimasukkan ke dalam gelas piala 125 ml
- ditambahkan 3 tetes indikator bromtimol biru
- dititrasi dengan NaOH yang telah distandarisasi hingga terjadi perubahan
warna biru menjadi hijau kekuningan
- dilakukan hal yang sama sebanyak 3 kali.
j. Standarisasi FeSO4 1 N
- Dipipet 10 ml larutan FeSO4 1 N dimasukkan ke dalam gelas piala 125 ml
- ditambahkan sebanyak 5 ml H2SO4 (p)
- ditambahkan sebanyak 20 ml akuades
- ditambahkan 1 tetes larutan indikator difenilamin
- dititrasi dengan K2Cr2O7 1 N sampai terjadi perubahan warna menjadi Hijau
- dilakukan hal yang sama sebanyak 3 kali.
3.3.8.4. Pembuatan Pe reaksi Untuk Penentuan Kalium Dengan Spektrofotometer Serapan Atom (SSA)
a. Larutan HCl 25%
Dipipet 173,6 ml HCl (p), dimasukkan ke dalam labu takar 250 ml, diencerkan
b. Larutan Kalium 1000 ppm
Dilarutkan 1,907 g KCl p.a. dengan akuades dalam labu takar 1000 ml hingga
garis tanda. Larutan ini mengandung 1000 mg K/L.
c. Larutan Standar Kalium 100 ppm
Sebanyak 10 ml larutan standar kalium 1000 ppm diencerkan dengan akuades
dalam labu takar 100 ml hingga garis tanda.
d. Larutan Standard Kalium 0,5; 1,0; 1,5 dan 2,0 ppm
Dari larutan standar 100 ppm kalium masing – masing dipipet 0,5; 1,0; 1,5 dan 2,0 ml, kemudian masing- masing diencerkan dengan akuades dalam labu takar 100
ml hingga garis tanda. Masing – masing larutan adalah 0,5; 1,0; 1,5 dan 2,0 ppm K.
3.3.9. Penentuan P dengan Metode spektrofometri 3.3.9.1. Preparasi Sampel
Ditimbang 1 g sampel Kembang Bulan yang kering, dimasukkan ke dalam gelas
piala 250 ml, ditambahkan 12,5 ml HCl 25%, diaduk diatas hot plate stirer
dengan magnetik stirer selama 2 jam, disaring dengan kertas saring Whatman no.
40, filtratnya dimasukkan ke dalam labu takar 100 ml, diencerkan dengan akuades
hingga garis tanda, dan dihomogenkan. Prosedur yang sama dilakukan untuk
sampel Daun Nippon.
3.3.9.2. Pembuatan Kurva Kalibrasi untuk P
Dipipet sebanyak 1 ml larutan standar P 2 ppm ke dalam tabung reaksi yang
bersih dan kering, ditambahkan 5 ml akuades, ditambahkan 1 ml reagen campuran
pengkompleks, didiamkan selama 15 menit, diukur absorbansinya dengan
Spektrofotometer sinar tampak, pada = 710 nm. Prosedur yang sama dilakukan
untuk larutan standar P 4, 6, 8, dan 10 ppm . (kurva kalibrasi dicamtumkan pada
gambar ).
3.3.9.3. Penentuan Kadar Posfor pada Sampel
Filtrat yang diperoleh dari prosedur 3.3.9.1 dimasukkan ke dalam tabung reaksi,
didiamkan selama 15 menit, diukur absorbansinya dengan spektrofotometer sinar
tampak pada = 710 nm.
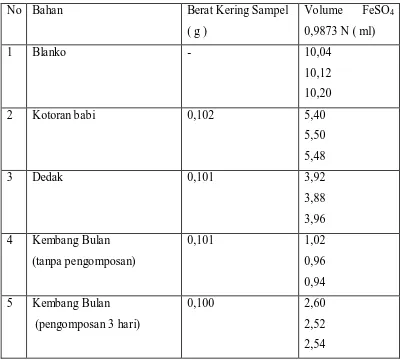
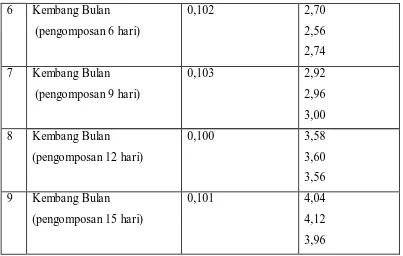
3.3.10. Penentuan Kadar C -Organik dengan metode Walkey Black
- Ditimbang secara kuantitatif sebanyak 0,1 g sampel yang telah dihaluskan
dan kering udara dimasukkan ke dalam gelas piala 500 ml
- ditambahkan 10 ml larutan K2Cr2O7 1 N
- ditambahkan 5 ml H2SO4 pekat secara perlahan
- diaduk selama 1 menit
- dididamkan selama 30 menit
- ditambahkan 200 ml akuades
- ditambahkan 5 ml H3PO4 pekat ( 85% ) dan 1 ml larutan difenilamin
- dititrasi dengan larutan FeSO4 0,9873 N hingga terjadi perubahan warna dari
ungu menjadi hijau
- dicatat volume FeSO4 0,9873 N yang terpakai
- dilakukan hal yang sama sebanyak 3 kali.
3.3.11. Penentuan Nitrogen Total Metode Kjehldahl
- Ditimbang secara kuantitatif sebanyak 0,1 g sampel dimasukkan kedalam
labu Kjehldahl
- ditambahkan 0,3 g selenium dan 25 ml H2SO4 pekat
- didekstruksi sampel hingga sampel berubah menjadi larutan coklat
kehitaman
- dipindahkan ke dalam labu destilasi dan ditambahkan 50 ml akuades
- ditambahkan 3 tetes indikator Fenolftalein dan NaOH 40% sehingga
berwarna merah lembayung
- disediakan penampung untuk hasil destilat berupa gelas piala 125 ml yang
berisi
50 ml H3BO3 3% dan 3 tetes indikator campuran
- dipasang tabung destilasi pada alat destilasi, kemudian diletakkan pada
tempatnya