SKRIPSI
MUHARDIANSAH
DEPARTEMEN TEKNOLOGI PERTANIAN
FAKULTAS PERTANIAN
DETEKSI IKAN KEMBUNG YANG DIFORMALIN SECARA
VISUAL, ORGANOLEPTIK, KIMIAWI, DAN FISIK
SKRIPSI
OLEH:
MUHARDIANSAH
040305006 / TEKNOLOGI HASIL PERTANIAN
DEPARTEMEN TEKNOLOGI PERTANIAN
FAKULTAS PERTANIAN
DETEKSI IKAN KEMBUNG YANG DIFORMALIN SECARA
VISUAL, ORGANOLEPTIK, KIMIAWI, DAN FISIK
SKRIPSI
OLEH:
MUHARDIANSAH
040305006 / TEKNOLOGI HASIL PERTANIAN
Skripsi Sebagai Salah Satu Syarat untuk Dapat Memperoleh Gelar Sarjana Teknologi Penelitian di Fakultas Pertanian
Universitas Sumatera Utara
DEPARTEMEN TEKNOLOGI PERTANIAN
FAKULTAS PERTANIAN
Judul Skripsi : Deteksi Ikan Kembung yang Diformalin Secara Visual, Organoleptik, Kimiawi, dan Fisik
Nama : Muhardiansah
Nim : 040305006
Departemen : Teknologi Pertanian Program Studi : Teknologi Hasil Pertanian
Disetujui Oleh: Komisi Pembimbing
Ir. Abdul Halim Sulaiman, M.Sc Prof. Dr. Ir. Zulkifli Lubis, M.App.Sc
Ketua Anggota
Mengetahui:
Ir. Saipul Bahri Daulay, M.Si Ketua Departemen
ABSTRACT
DETECTION OF FORMALIN IN MACKEREL USING VISUAL, ORGANOLEPTIC, CHEMICAL AND PHYSICAL METHODS
The aim of this research was to find how to detect formalin in mackerel using visual, organoleptic, chemical and physical methods. The research had been performed using non factorial completely randomized design (CRD) with treatment, formalin concentration (K) (0, 10, 100, 1000, 10000 and 100000 ppm) that was injected into the flesh of the fish. Parameters analysed were storage time, visual value (with picture), sensory values of fish quality (eye, mucous in surface, smell fish, and hardness), chemical test, physical test (water content and weight loss), and formalin smell. The result showed that formalin concentration had highly significant effect on storage time, early hardness value (0 day), hardness value when almost decomposed, eye value when almost decomposed, smell value when almost decomposed, and smell of formalin, had significant effect on water content when almost decomposed, and weight loss and had no siginificant effect on early eye value (0 day), early mucous in surface value (0 day), mucous in surface value when almost decomposed, early smell value (0 day), and early water content (0 day). In chemical test with reagents, the most effective reagent to detect formalin in mackerel was Schiff reagent. Direct in testing methods
ABSTRAK
DETEKSI IKAN KEMBUNG YANG DIFORMALIN SECARA VISUAL, ORGANOLEPTIK, KIMIAWI, DAN FISIK
Penelitian ini bertujuan untuk mengetahui cara mendeteksi ikan kembung yang diformalin secara visual, organoleptik, kimiawi dan fisik. Penelitian ini menggunakan rancangan acak lengkap (RAL) non faktorial dengan perlakuan yaitu: konsentrasi formalin (K) (0, 10, 100, 1000, 10000 dan 100000 ppm) yang disuntikkan ke tubuh ikan kembung. Parameter yang dianalisis adalah masa simpan ikan kembung, penilaian visual ikan (dengan gambar), penilaian sensori kualitas ikan (mata, lendir di permukaan tubuh, bau ikan dan tekstur), pengujian secara kimiawi, pengujian secara fisik (kadar air dan susut bobot) dan pengujian bau formalin. Hasil penelitian menunjukkan bahwa konsentrasi formalin memberikan pengaruh yang berbeda sangat nyata terhadap masa simpan ikan kembung, nilai sensori tekstur awal (0 hari), nilai sensori tekstur sesaat sebelum busuk, nilai sensori mata sesaat sebelum busuk, bau ikan sesaat sebelum busuk, dan nilai pengujian bau formalin. Memberikan pengaruh yang berbeda nyata terhadap kadar air sesaat sebelum busuk dan susut bobot. Memberikan pengaruh yang berbeda tidak nyata terhadap nilai sensori mata awal (0 hari), nilai sensori lendir di permukaan kulit awal (0 hari) dan sesaat sebelum busuk, nilai sensori bau ikan awal (0 hari), dan kadar air awal (0 hari). Pada pengujian secara kimiawi yang terbaik digunakan adalah pereaksi Schiff pada penetesan di daging ikan. Untuk menguji ada tidaknya formalin secara langsung di dalam ikan kembung adalah dengan melihat mata ikan yang berwarna merah, meraba tekstur ikan yang kenyal, dan dengan menggunakan indikator kimia pereaksi Schiff.
Muhardiansah September, 2008
Tanggal
RINGKASAN
Muhardiansah, Deteksi Ikan Kembung yang Diformalin Secara Visual, Organoleptik, Kimiawi dan Fisik dibimbing oleh Ir. Abdul Halim Sulaiman, M.Sc selaku ketua komisi pembimbing dan Prof. Dr. Ir. Zulkifli Lubis, M.App.Sc selaku anggota komisi pembimbing.
Penelitian ini bertujuan untuk mengetahui cara mendeteksi ikan kembung yang diformalin secara visual, organoleptik, kimiawi dan fisik.
Perlakuan penelitian ini terdiri atas satu faktor: Konsentrasi Formalin (K) yang terdiri dari 6 taraf yaitu: K1 (0 ppm), K2 (10 ppm), K3 (100 ppm), K4
(1000 ppm), K5 (10000 ppm), dan K6 (100000 ppm). Hasil penelitian yang
dianalisa secara statistika menghasilkan kesimpulan sebagai berikut: 1. Masa Simpan
Konsentrasi formalin memberikan pengaruh yang berbeda sangat nyata (P<0.01) terhadap masa simpan ikan kembung. Masa simpan tertinggi diperoleh pada perlakuan K6 (100000 ppm ) selama 75.5 jam dan terendah pada perlakuan
K1(0 ppm) selama 25.5 jam.
2. Penilaian Sensori Kualitas Ikan
Konsentrasi formalin pada 0 hari memberikan pengaruh yang berbeda tidak nyata (P>0.05) terhadap nilai sensori mata, nilai sensori lendir di permukaan kulit dan nilai sensori bau ikan dan memberikan pengaruh yang berbeda sangat nyata (P<0.01) terhadap nilai sensori tekstur ikan dimana nilai sensori tekstur tertinggi diperoleh pada perlakuan K6(100000 ppm) sebesar 10 dan terendah pada
sebelum busuk memberikan pengaruh yang berbeda sangat nyata (P<0.01) terhadap nilai sensori mata dimana tertinggi diperoleh pada perlakuan K1(0 ppm)
sebesar 7 dan terendah pada perlakuan K6 (100000 ppm) sebesar 4, nilai sensori
bau ikan dimana tertinggi pada perlakuan K6 (100000 ppm) sebesar 7 dan
terendah pada perlakuan K1 (0 ppm) sebesar 4, dan nilai sensori tekstur dimana
tertinggi diperoleh pada perlakuan K6(100000 ppm) sebesar 10 dan terendah pada
perlakuan K1 (0 ppm) sebesar 4 dan memberikan pengaruh yang berbeda tidak
nyata terhadap nilai sensori lendir di permukaan (P>0.05). 3. Pengujian Secara Fisik (Kadar Air dan Susut Bobot)
Konsentrasi formalin terhadap pengujian kadar air awal ikan kembung (0 hari) memberikan pengaruh yang berbeda tidak nyata (P>0.05) sedangkan pada saat sebelum busuk memberikan pengaruh yang berbeda nyata (P<0.05) dimana nilai tertinggi diperoleh pada perlakuan K6 (100000) sebesar 71.45 % dan
terendah pada perlakuan K1 (0 ppm) sebesar 64.75%. Pada susut bobot,
konsentrasi formalin memberikan pengaruh yang berbeda nyata (P<0.05) dimana nilai tertinggi diperoleh pada perlakuan K1 (0 ppm) sebesar 15.975 gram dan
terendah pada perlakuan K6(100000 ppm) sebesar 12 gram.
4. Pengujian Bau Formalin (Organoleptik)
Konsentrasi formalin terhadap nilai rataan pengujian bau formalin dari awal hingga sesaat sebelum busuk memberikan pengaruh yang berbeda sangat nyata (P<0.01) dimana nilai tertinggi diperoleh pada perlakuan K6 (100000 ppm)
5. Pengujian Secara Kimiawi
Dari hasil penelitian uji efektivitas indikator kimia formalin yang dilakukan tanpa pemanasan pada 0 hari, pereaksi Schiff untuk penetesan ekstrak cairan daging ikan hanya efektif pada perlakuan K4 (1000 ppm) hingga K6
(100000 ppm) dan untuk penetesan daging efektif pada perlakuan K2 (10 ppm)
hingga K6 (100000 ppm), untuk larutan Fehling yang dilakukan tanpa pemanasan
tidak efektif sama sekali untuk semua perlakuan penetesan pada ekstrak cairan ikan maupun pada daging ikan, untuk reagen Tollens pada penetesan ekstrak cairan ikan efektif pada perlakuan K5 (10000 ppm) hingga K6 (100000 ppm) dan
penetesan pada daging ikan efektif pada perlakuan K2 (10 ppm) hingga K6
(100000 ppm), untuk larutan KMnO4 0.1 N pada penetesan ekstrak cairan ikan
efektif pada perlakuan K5 (10000 ppm) hingga K6 (100000 ppm) dan pada
penetesan daging ikan tidak efektif untuk semua perlakuan, untuk larutan KMnO4
+ NaHSO3 0.1 N pada penetesan ekstrak cairan ikan efektif pada perlakuan
K5 (10000 ppm) hingga K6 (100000 ppm) dan pada penetesan daging ikan tidak
efektif untuk semua perlakuan.
Pada saat sesaat sebelum busuk uji efektivitas pengujian formalin yang dilakukan tanpa pemanasan, untuk pereaksi Schiff pada penetesan ekstrak cairan tidak efektif untuk semua perlakuan dan penetesan pada daging ikan efektif pada perlakuan K2 (10 ppm) hingga K6 (100000 ppm), untuk larutan Fehling tidak
efektif untuk semua perlakuan pada penetesan ekstrak cairan dan pada daging ikan, untuk reagen Tollens penetesan pada ekstrak cairan ikan efektif pada perlakuan K6 (100000 ppm) dan penetesan pada daging ikan tidak efektif untuk
efektif pada perlakuan K6 (100000 ppm) dan pada penetesan di daging ikan tidak
efektif untuk semua perlakuan, untuk larutan KMnO4 + NaHSO3 0.1 N tidak
RIWAYAT HIDUP
Muhardiansah, dilahirkan di Pangkalan Susu Kabupaten Langkat pada tanggal 10 Oktober 1986 anak kelima dari 6 bersaudara dari ayahanda Mazman Wisnum, BA dan ibunda Suarni Chaniago.
Pada tahun 1998 menyelesaikan pendidikan SD Negeri 057235 Pangkalan Susu, pada tahun 2001 menyelesaikan pendidikan MTs.S.Al-Ikhlas di Pangkalan Susu kemudian tahun 2004 menyelesaikan pendidikan SMU Negeri 1 Pangkalan Susu dan pada tahun yang sama memasuki Fakultas Pertanian Departemen Teknologi Pertanian Program Studi Teknologi Hasil Pertanian melalui jalur SPMB.
Selama masa kuliah penulis aktif menjadi pengurus BKM Al-Mukhlisin (Badan Kenaziran Mushalla) FP USU tahun 2004 2006, aktif menjadi pengurus IMTHP (Ikatan Mahasiswa Teknologi Hasil Pertanian) FP USU periode 2006 2007, aktif menjadi pengurus ATM (Agriculture Technology Moslem) FP USU periode 2005 2007 dan menjadi Asisten Laboratorium Biokimia tahun 2006 2007.
KATA PENGANTAR
Segala puji dan syukur kepada Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul Deteksi Ikan Kembung yang Diformalin Secara Visual, Organoleptik, Kimiawi, dan Fisik .
Pada kesempatan ini penulis sampaikan ucapan terima kasih kepada Bapak Ir.Abdul Halim Sulaiman, M.Sc selaku Ketua Komisi Pembimbing dan Dosen Penanggung Jawab Laboratorium Biokimia, kepada Bapak Prof.Dr.Ir.Zulkifli Lubis, M.App.Sc selaku Anggota Komisi Pembimbing dan Penasehat Akademik penulis keduanya telah memberikan saran, kritik dan arahannya dari awal penelitian hingga terselesaikannya skripsi ini.
Terima kasih juga penulis ucapkan kepada kedua orangtua tercinta ayahanda Mazman Wisnum, BA dan ibunda Suarni Chaniago atas kasih sayang, do a dan pengorbanan yang telah diberikan selama ini. Kepada saudara-saudara saya tercinta abangnda Zulkifli,ST dan Zainuddin A.Md, kakanda Mardiani, ST dan Nurhayati, A.Md serta adinda Yusrina atas do a dan dukungan selama ini baik materil maupun non-materil. Kepada Sadri, Rudi, Eka, Rahman, Yamin, Teddy, Ary, Arif, Kornel dan teman-teman 2004 serta teman-teman di BKM yang tidak bisa disebutkan satu persatu, terima kasih atas bantuannya dan kebersamaan kita selama ini, juga kepada teman-teman Asisten Laboratorium Biokimia Adi, Isam, Yuni, Erwin, Inun, Syaril atas bantuan dan kerjasamanya.
DAFTAR ISI
Proses Perubahan Setelah Ikan Mati ... 7
Aldehid dan Keton ... 10
Sifat Sifat Aldehid dan Keton 11
Formalin .. 12
Sifat Fisik dan Kimia Dari Formalin . 12
Kegunaan Formalin ... 14
Reaksi Formalin dengan Protein ... 16
Bahaya Penggunaan Formalin .. 17
Ciri Ciri Makanan yang Berformalin .. 19
Metode Pengujian Formalin Pada Makanan 20
Hasil Penelitian Sebelumnya 21
BAHAN DAN METODOLOGI PENELITIAN 23
Bahan Kimia . 23
Alat 23
Metode Penelitian 24
Model Rancangan 25
Pelaksanaan Penelitian ... 25
Penyiapan Indikator Kimia Pendeteksi . 25
Penyiapan Ikan Kembung yang Diformalin .. 27
Pengamatan dan Pengumpulan Data 28
Penentuan Masa Simpan Ikan 28
Penilaian Visual Ikan (Dengan Gambar) .. 29
Penilaian Sensori Kualitas Ikan . 29
Pengujian Secara Kimiawi .. 30
Pengujian Secara Fisik 32
Pengujian Bau Formalin 32
SKEMA PENELITIAN ... 34
HASIL DAN PEMBAHASAN 35
Pengaruh Konsentrasi Formalin terhadap Parameter yang
diamati 35
Pengaruh Konsentrasi Formalin terhadap Masa Simpan
(Jam) 37
Pengaruh Kosentrasi Formalin terhadap Penilaian Sensori
Kualitas Ikan .. 40
Di Permukaan Kulit (0 hari)(numerik) . 40
Pengaruh Konsentrasi Formalin terhadap Lendir Di Permukaan Kulit (sesaat sebelum busuk)
(numerik) 41
Pengaruh Konsentrasi Formalin terhadap Bau
Ikan (0 hari) (numerik) . 41
Pengaruh Konsentrasi Formalin terhadap Bau
Ikan (sesaat sebelum busuk) (numerik) .. 41 Pengaruh Konsentrasi Formalin terhadap Tekstur
Ikan (0 hari) (numerik) . 43
Pengaruh Konsentrasi Formalin terhadap Tekstur
Ikan (sesaat sebelum busuk) (numerik) . 45 Pengaruh Konsentrasi Formalin terhadap Pengujian Secara
Fisik Ikan .. 48
Pengaruh Konsentrasi Formalin terhadap Kadar
Air Ikan (0 hari) (% bb) .. 48
Pengaruh Konsentrasi Formalin terhadap Kadar
Air Ikan (sesaat sebelum busuk) (% bb) 48
Bobot Ikan kembung (gram) . 49 Pengaruh Konsentrasi Formalin terhadap Rataan Pengujian
Bau Formalin Pada Ikan Kembung (Numerik) 52
Pengujian Secara Kimiawi (Indikator Kimia) Formalin . 54
KESIMPULAN DAN SARAN . 58
Kesimpulan ... 58
Saran . 59
DAFTAR PUSTAKA 60
DAFTAR TABEL
Halaman
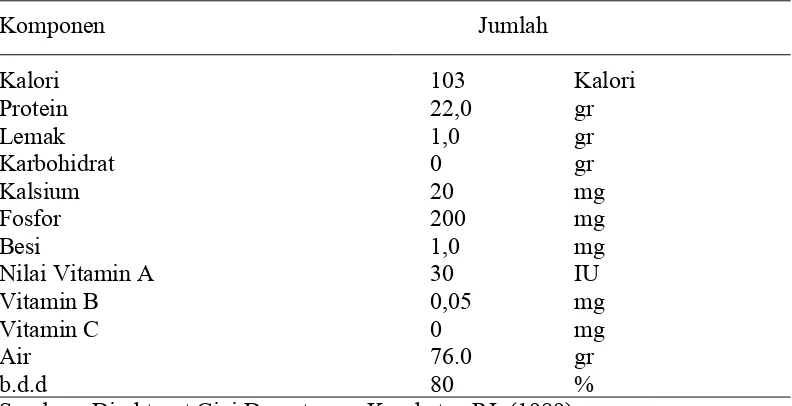
1. Komposisi Ikan Kembung dalam 100 gram Bahan .. 6
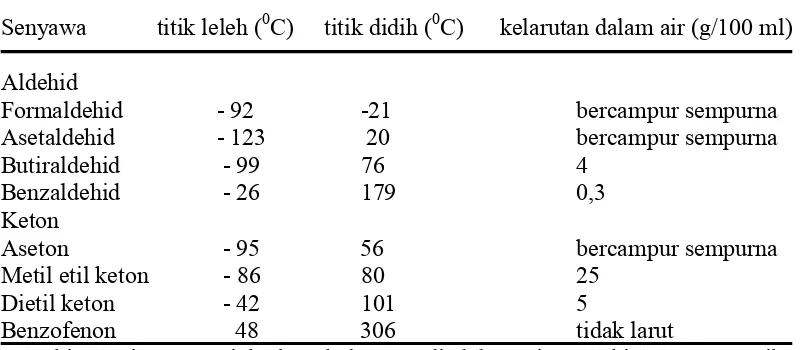
2. Tetapan Fisis Beberapa Aldehid dan Keton . 12
3. Ciri Ciri Ikan Segar dan Busuk .. 28
4. Penilaian Sensori Kualitas Ikan 29
5. Pengujian Indikator Kimia . 31
6. Uji Organoleptik Penentuan Uji Bau Formalin 33
7. Hasil Analisis Pengaruh Konsentrasi Formalin Terhadap
Parameter yang Diamati (0 hari) 35
8. Hasil Analisis Pengaruh Konsentrasi Formalin terhadap
Parameter yang Diamati (Sesaat Sebelum Busuk) 36
9. Hasil Analisis Pengaruh Konsentrasi Formalin terhadap
Parameter yang Diamati (Sesaat Sebelum Busuk) 36
10. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap
Masa Simpan Ikan Kembung (Jam) 37
11. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap Nilai Sensori Mata Ikan Kembung Sesaat Sebelum Busuk 39 12. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap
Nilai Sensori Bau Ikan Sesaat Sebelum Busuk . 42
13. Uji Jarak Duncan Pengaruh Konsentrasi Formalin terhadap
Nilai Sensori Tekstur Ikan Kembung (0 Hari) . 44
14. Uji Jarak Duncan Pengaruh Konsentrasi Formalin terhadap
Nilai Sensori Tekstur Ikan Sesaat Sebelum Busuk 46 15. Uji Jarak Duncan Pengaruh Konsentrasi Formalin terhadap
Kadar Air Sesaat Sebelum Busuk Ikan Kembung (%bb) ... 48 16. Uji Jarak Duncan Pengaruh Konsentrasi Formalin terhadap
17. Uji Jarak Duncan Pengaruh Konsentrasi Formalin terhadap
Nilai Rataan Bau Formalin (Numerik) Pada Ikan Kembung .. 52 18. Efektivitas Indikator Bahan Kimia Uji Formalin Pada Ikan
Setelah disuntikkan Formalin (0 Hari) .. 54
19. Efektivitas Indikator Bahan Kimia Uji Formalin Pada
DAFTAR GAMBAR
Halaman
1. Reaksi Formalin Dengan Asam Amino 17
2. Skema Deteksi Ikan Kembung yang Diformalin . 34
3. Grafik Hubungan Antara Konsentrasi Formalin dengan
Masa Simpan Ikan Kembung (Jam) . 38
4. Grafik Hubungan Antara Konsentrasi Formalin dengan Nilai
Sensori Mata (Numerik) . 40
5. Grafik Hubungan Konsentrasi Formalin Dengan Nilai Sensori
Bau Ikan Sesaat Sebelum Busuk . 43
6. Grafik Hubungan Konsentrasi Formalin dengan Nilai Sensori
Tekstur Ikan Kembung (0 Hari) .. 45
7. Grafik Hubungan Konsentrasi Formalin dengan Nilai Sensori
Tesktur Sesaat Sebelum Busuk 47
8. Grafik Hubungan Konsentrasi Formalin dengan Kadar Air
Sesaat Sebelum Busuk (% bb) . 49
9. Grafik Hubungan Konsentrasi Formalin dengan Susut Bobot
(gram) ... 51
10. Grafik Hubungan Konsentrasi Formalin dengan Nilai
Rata-RataUji Organoleptik Bau Formalin 53
11. Ikan Kembung Segar (0 hari) .. ... 63
12. Ikan Kembung Sesaat Sebelum Busuk . . 66
13. Efektivitas Bahan Kimia Indikator Uji Formalin
DAFTAR LAMPIRAN
Halaman
1. Data Pengamatan Masa Simpan Ikan Kembung (Jam) 71
2. Data Pengamatan Nilai Sensori Mata (Numerik) (0 Hari) 72 3. Data Pengamatan Nilai Sensori Lendir di Permukaan Kulit
(Numerik) (0 Hari) . 74
4. Data Pengamatan Nilai Sensori Bau (Numerik) (0 Hari) ... 76 5. Data Pengamatan Nilai Sensori Tekstur (Numerik) (0 Hari) 78 6. Data Pengamatan Nilai Sensori Mata (Numerik)
(Sesaat Sebelum Busuk) 80
7. Data Pengamatan Nilai Sensori Lendir di Permukaan Kulit
(Numerik) Sesaat Sebelum Busuk 82
8. Data Pengamatan Nilai Sensori Bau (Numerik)
(Sesaat Sebelum Busuk) 84
9. Data Pengamatan Nilai Sensori Tekstur (Numerik)
(Sesaat Sebelum Busuk) . 86
10. Data Pengamatan Kadar Air (% Basis Basah) (0 Hari) . 88 11. Data Pengamatan Kadar Air Sesaat Sebelum Busuk
(% Basis Basah) .. 89
12. Data Pengamatan Susut Bobot (gram) . 90
13. Data Pengamatan Nilai Rataan Uji Organoleptik Bau
ABSTRACT
DETECTION OF FORMALIN IN MACKEREL USING VISUAL, ORGANOLEPTIC, CHEMICAL AND PHYSICAL METHODS
The aim of this research was to find how to detect formalin in mackerel using visual, organoleptic, chemical and physical methods. The research had been performed using non factorial completely randomized design (CRD) with treatment, formalin concentration (K) (0, 10, 100, 1000, 10000 and 100000 ppm) that was injected into the flesh of the fish. Parameters analysed were storage time, visual value (with picture), sensory values of fish quality (eye, mucous in surface, smell fish, and hardness), chemical test, physical test (water content and weight loss), and formalin smell. The result showed that formalin concentration had highly significant effect on storage time, early hardness value (0 day), hardness value when almost decomposed, eye value when almost decomposed, smell value when almost decomposed, and smell of formalin, had significant effect on water content when almost decomposed, and weight loss and had no siginificant effect on early eye value (0 day), early mucous in surface value (0 day), mucous in surface value when almost decomposed, early smell value (0 day), and early water content (0 day). In chemical test with reagents, the most effective reagent to detect formalin in mackerel was Schiff reagent. Direct in testing methods
ABSTRAK
DETEKSI IKAN KEMBUNG YANG DIFORMALIN SECARA VISUAL, ORGANOLEPTIK, KIMIAWI, DAN FISIK
Penelitian ini bertujuan untuk mengetahui cara mendeteksi ikan kembung yang diformalin secara visual, organoleptik, kimiawi dan fisik. Penelitian ini menggunakan rancangan acak lengkap (RAL) non faktorial dengan perlakuan yaitu: konsentrasi formalin (K) (0, 10, 100, 1000, 10000 dan 100000 ppm) yang disuntikkan ke tubuh ikan kembung. Parameter yang dianalisis adalah masa simpan ikan kembung, penilaian visual ikan (dengan gambar), penilaian sensori kualitas ikan (mata, lendir di permukaan tubuh, bau ikan dan tekstur), pengujian secara kimiawi, pengujian secara fisik (kadar air dan susut bobot) dan pengujian bau formalin. Hasil penelitian menunjukkan bahwa konsentrasi formalin memberikan pengaruh yang berbeda sangat nyata terhadap masa simpan ikan kembung, nilai sensori tekstur awal (0 hari), nilai sensori tekstur sesaat sebelum busuk, nilai sensori mata sesaat sebelum busuk, bau ikan sesaat sebelum busuk, dan nilai pengujian bau formalin. Memberikan pengaruh yang berbeda nyata terhadap kadar air sesaat sebelum busuk dan susut bobot. Memberikan pengaruh yang berbeda tidak nyata terhadap nilai sensori mata awal (0 hari), nilai sensori lendir di permukaan kulit awal (0 hari) dan sesaat sebelum busuk, nilai sensori bau ikan awal (0 hari), dan kadar air awal (0 hari). Pada pengujian secara kimiawi yang terbaik digunakan adalah pereaksi Schiff pada penetesan di daging ikan. Untuk menguji ada tidaknya formalin secara langsung di dalam ikan kembung adalah dengan melihat mata ikan yang berwarna merah, meraba tekstur ikan yang kenyal, dan dengan menggunakan indikator kimia pereaksi Schiff.
Muhardiansah September, 2008
Tanggal
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara kepulauan yang memiliki wilayah perairan laut yang luas. Potensi ini memberikan hasil laut yang diperkirakan sebesar 6,4 juta ton per tahun yang tersebar di wilayah perairan Indonesia dan Zona Ekonomi Ekslusif. Produksi perikanan ini sangat besar tetapi tidak diimbangi dengan pasar. Hal ini disebabkan karena masyarakat Indonesia pada umumnya merupakan masyarakat pra sejahtera, sehingga hasil perikanan hanya pada masyarakat tertentu saja.
Ikan merupakan salah satu produk perikanan yang kaya akan protein. Protein ini diperlukan oleh manusia karena mengandung asam amino esensial, tetapi ikan sangat mudah mengalami kerusakan karena disamping kandungan proteinnya kandungan airnya juga cukup tinggi. Hal ini menyebabkan ikan cepat menjadi busuk dan mengalami penurunan mutu, kesegaran dan nilai gizi dari ikan. Penanganan ikan setelah penangkapan atau pemanenan memegang peranan penting untuk memperoleh nilai jual ikan yang maksimal. Salah satu faktor yang menentukan nilai jual ikan dan hasil perikanan lain adalah tingkat kesegarannya. Ikan dikatakan memiliki kesegaran yang maksimal apabila sifat-sifatnya masih sama dengan ikan hidup, baik rupa, bau, cita rasa, maupun tekstur. Apabila penanganan ikan kurang baik maka mutu dan kualitasnya akan menurun. Kesegaran ikan tidak dapat ditingkatkan, tetapi hanya dapat dipertahankan.
mayat) baik dengan merendam ikan tersebut pada larutan formalin atau dengan menyuntikkannya. Dengan penambahan formalin ini tekstur ikan menjadi lebih kenyal sehingga disukai konsumen dan daya tahan ikanpun menjadi lebih panjang. Penggunaan formalin telah dilarang oleh pemerintah melalui Peraturan Menteri Kesehatan Nomor 472 Tahun 1996 tentang Pengamanan Bahan Berbahaya bagi Kesehatan, dan Keputusan Menteri Perindustrian dan Perdagangan Nomor 254 Tahun 2000 tentang Tata Niaga Impor dan Peredaran Bahan Berbahaya Tertentu. Formalin dan rodamin termasuk dalam kategori bahan berbahaya tersebut yang penggunaannya harus diawasi secara ketat. Pelarangan ini disebabkan karena formalin sangat berbahaya bagi tubuh, menyebabkan gangguan saluran pernafasan, pencernaan dan konsumsi dalam jangka panjang bahan dapat menyebabkan karsinogenik, tetapi karena ulah pedagang masih saja ditemui makanan yang berformalin.
Perumusan Masalah
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui cara mendeteksi ikan kembung yang diformalin secara visual, organoleptik, kimiawi dan fisik.
Kegunaan Penelitian
- Sebagai sumber data dalam penyusunan skripsi di Departemen Teknologi Pertanian Fakultas Pertanian Universitas Sumatera Utara, Medan.
- Sebagai sumber informasi bagaimana mengetahui ikan kembung yang diformalin.
Hipotesis Penelitian
TINJAUAN PUSTAKA
Ikan Kembung
Ikan kembung adalah ikan yang umum digemari, karena di samping harganya ekonomis, juga relatif sederhana dalam pengolahannya, yaitu cukup digoreng. Ada pula yang suka dibalado atau dipepes. Ada banyak macam ikan kembung namun yang umumnya terdapat di pasar pelelangan ikan adalah ikan kembung banjar, ikan kembung puket dan ikan kembung como (Bahar, 2006)
Ikan kembung banjar memiliki fisik tubuh yang lebar dan agak bulat sedangkan ikan kembung puket memiliki fisik tubuh yang lebih gepeng (ramping). Keduanya disukai oleh konsumen. Hanya saja, biasanya konsumen lebih menyukai ukuran ikan kembung banjar atau ikan kembung puket yang relatif kecil karena bisa mendapatkan banyak ikan dalam 1 Kg (Bahar, 2006).
Sistematika dari ikan kembung adalah :
Phylum : Chordata
Sub phylum : Tunicata (Urochordata) Class : Osteichthyes
Sub class : Sarcopterygii Ordo : Perciformes Sub ordo : Scombroidei Family : Scombridae Genus : Scomber
Species : Scomber kanangurta
Ikan kembung termasuk ikan bentopelagik, yang kadang-kadang hidup bentik (hidup di dasar daerah tepian landasan benua bawah air, antara jurang selasar benua dan tepi pantai), dan kadang-kadang hidup dekat permukaan laut bergantung kepada musim, seringkali ikan ini berkumpul bergerombolan dan banyak sekali ke permukaan pada musim tertentu, hingga mudah ditangkap secara besar-besaran denganpursesseine(Soeseno, 1982).
Tanda-tanda ikan kembung segar bermutu tinggi:
a. Penampilan dan bentuknya. Ikan kembung segar memiliki penampilan yang bagus, bersih, tidak terkelupas kulitnya, tidak terpotong-potong. Apabila ditekan dengan jari kulitnya tidak mudah terkelupas.
b. Aromanya. Ikan kembung segar tidak memiliki aroma selain bau khusus yang biasa tercium dari ikan.
c. Daging. Tubuh ikan kembung segar saling terikat satu sama lain, kulitnya melekat erat dengan daging dan daging dengan tulang.
d. Warna insang. Ikan kembung segar memiliki insang berwarna merah terang, bersih dan meiliki bau wajar.
e. Sinar pada kedua matanya. Ikan kembung segar memiliki dua mata yang bercahaya, sedangkan yang sudah lama terlihat kedua matanya cekung dan layu.
Komposisi Ikan Kembung
Komposisi dari Ikan Kembung segar dapat dilihat pada Tabel 1. Tabel 1. Komposisi ikan kembung dalam 100 gram bahan.
Komponen Jumlah
Sumber : Direktorat Gizi Departemen Kesehatan RI, (1989)
Protein ikan menyediakan lebih kurang 2/3 dari kebutuhan hewani yang diperlukan oleh manusia. Kandungan protein ikan relatif besar yaitu antara 15 25 %/100gr daging ikan. Selain itu protein ikan terdiri dari asam-asam amino yang hampir semuanya diperlukan oleh tubuh manusia (Junianto, 2003)
Protein ini tidak dapat diekstrak dengan air, larutan asam, larutan alkali, atau larutan garam pada konsentrasi 0,01 0,1 M. Stroma terdiri dari kolagen dan elastin. Keduanya merupakan protein yang terdapat di bagian luar sel otot (Junianto, 2003).
Lemak ikan banyak mengandung asam lemak tidak jenuh. Jenis asam lemak tidak jenuh yang paling banyak terdapat adalah asam linoleat, linolenat dan arakidonat. Ketiga jenis asam lemak tidak jenuh tersebut merupakan asam lemak esensial. Omega 3 yang diyakini dapat mencegah terjadinya penyakit jantung koroner pada dasarnya berasal dari sintesis asam lemak linoleat dan linolenat (Bahar, 2006).
Daging ikan merupakan sumber vitamin B, dan daging ikan yang berlemak mengandung vitamin A dan D. Daging ikan juga merupakan sumber penting mineral kalsium dan fosfor, juga mineral besi, tembaga, dan selenium serta mengandung iodium (Junianto, 2003).
Proses Perubahan Setelah Ikan Mati
Saat ikan mati, terjadi perubahan fisik dan kimiawi yang disebabkan karena aktivitas enzim dan mikroorganisme. Bila perubahan ini terus berlanjut, maka hasilnya adalah pembusukan, perubahan fisik dan kimiawi post mortem berlangsung dalam beberapa fase, yaitu:
- Pembentukan lendir di permukaan ikan (prarigormortis)
- Kejang otot (rigormortis)
- Aktivitas enzimatis menguraikan jaringan otot
- Serangan mikroorganisme
Lamanya tiap fase bersifat tidak tetap dan proses fase dapat terjadi bersamaan tergantung pada kondisi penyimpanan, terutama temperatur yang berperan utama dalam tiap proses fase (Bahar, 2006).
1. Perubahan Prarigormortis
Perubahan prarigormortis merupakan peristiwa terlepasnya lendir dari kelenjar di bawah permukaan kulit. Lendir yang dikeluarkan ini sebagian besar terdiri dari glukoprotein dan musin yang merupakan media ideal bagi pertumbuhan bakteri.
2. Perubahan Rigormortis
ini,pH ikan naik dengan perlahan-lahan dan dengan semakin banyak senyawa basa yang terbentuk akan semakin mempercepat kanaikan pH ikan.
3. Aktivitas enzim menguraikan otot.
Setelah ikan mati, enzim masih mempunyai kemampuan untuk bekerja secara aktif. Namun, sistem kerja enzim menjadi tak terkontrol karena organ pengontrol tidak berfungsi lagi. Akibatnya, enzim dapat merusak organ tubuh ikan. Peristiwa ini disebut autolisis dan berlangsung setelah ikan melewati fase rigormortis. Ciri terjadinya perubahan secara autolisis ini adalah dengan dihasilkannya amoniak sebagai hasil akhir. Penguraian protein dan lemak dalam autolisis meyebabkan perubahan rasa, tekstur, dan penampakan ikan.
4. Perubahan karena aktivitas mikroba
Selama ikan hidup, bakteri yang terdapat dalam saluran pencernaan, insang, saluran darah, dan permukaan kulit tidak dapat merusak atau menyerang bagian tubuh ikan. Hal ini disebabkan karena bagian tubuh ikan tersebut mempunyai batas pencegah (barrier) terhadap serangan bakteri. Setelah ikan mati, kemampuan barrier tadi hilang sehingga bakteri segera masuk ke dalam daging ikan melalui tempat-tempat tadi dari permukaan jaringan ke tubuh bagian dalam.
5. Perubahan karena oksidasi
Proses perubahan pada ikan dapat juga terjadi karena proses oksidasi lemak sehingga timbul aroma tengik yang tidak diinginkan dan perubahan rupa serta warna daging kearah coklat kusam (Junianto, 2003).
ukuran, jenis ikan, keadaan lapar/kenyang dan aktivitas enzim serta faktor luar yaitu kondisi lingkungan, perlakuan fisik dan jumlah jasad renik
(Tranggono dan Sutardi, 1990).
Ikan cepat mengalami pembusukan disebabkan beberapa kelemahan seperti :
1. Tubuh ikan mempunyai kadar air yang tinggi (80%) dan pH tubuh mendekati netral sehingga merupakan media yang baik untuk pertumbuhan bakteri pembusuk maupun mikroorganisme lain. Dengan demikian, ikan merupakan komoditi yang cepat membusuk bahkan lebih cepat dibandingkan dengan sumber protein hewani lain.
2. Daging ikan mengandung sedikit sekali tenunan pengikat (tendon), sehingga sangat mudah dicerna oleh enzim autolisis. Hasil pencernaan ini menyebabkan daging menjadi sangat lunak sehingga merupakan media yang cocok untuk pertumbuhan mikroorganisme.
3. Daging ikan banyak mengandung asam lemak tidak jenuh yang sifatnya sangat mudah mengalami proses oksidasi. Oleh karena itu sering timbul bau tengik pada tubuh ikan, terutama pada hasil olahan maupun awetan yang disimpan tanpa menggunakan antioksidan
(Afrianto dan Liviawaty, 1989). Aldehid dan Keton
Aldehid dan keton memiliki bentuk umum: R C H R C R
O O
Aldehid dan keton memiliki gugus karbonil ( C = O). Gugus ini memberikan karakteristik pada aldehid dan keton. Tata nama IUPAC memberikan akhiran al untuk aldehid dan on untuk keton (Norman and Waddington, 1983). Aldehid dan keton merupakan senyawa yang bersifat netral. Senyawa yang memiliki atom C kurang dari 4 sangat larut di dalam air dan pelarut organik lainnya sedangkan senyawa yang memiliki atom C lebih dari 4 sukar larut di dalam air. Atom C yang rendah biasanya memiliki bau yang tajam seperti formaldehid dan asetaldehid, tetapi senyawa yang memiliki 8 sampai 12 atom karbon di dalam suatu larutan memiliki wangi bunga dan selalu ditambahkan ke dalam parfum (English, et al., 1971).
Sifat Sifat Aldehid dan Keton Titik Didih
Aldehid dan keton tidak dapat membentuk ikatan hidrogen antar molekul karena tidak memiliki gugus hidroksil ( OH ). Akibatnya memiliki titik didih yang rendah. Aldehid dan keton dapat menarik interaksi polar-polar dari gugus karbonilnya sehingga titik didihnya lebih rendah daripada sebagian alkana (Wilbraham and Matta., 1986)
Kelarutan
Tabel 2. Tetapan fisis beberapa aldehid dan keton
Senyawa titik leleh (0C) titik didih (0C) kelarutan dalam air (g/100 ml)
Aldehid
Formaldehid - 92 -21 bercampur sempurna
Asetaldehid - 123 20 bercampur sempurna
Butiraldehid - 99 76 4
Benzaldehid - 26 179 0,3
Keton
Aseton - 95 56 bercampur sempurna
Metil etil keton - 86 80 25
Dietil keton - 42 101 5
Benzofenon 48 306 tidak larut
Semakin panjang rantai karbon kelarutan di dalam air semakin menurun. Jika rantai karbon melebihi lima atau enam karbon, kelarutan aldehid dan keton dalam air sangat rendah (Wilbraham and Matta, 1986).
Formalin
Sifat Fisik dan Kimia Formalin
Formaldehid atau metanal adalah suatu senyawa karbon dengan rumus molekul HCHO ditemukan oleh ahli kimia Jerman Wilhelm von Hofmann pada tahun 1867. Ia menemukan sendiri senyawa ini dengan mengoksidasi metil alkohol dengan menggunakan katalis. Pada suhu ruangan berwujud gas, sangat larut dalam air. Pada konsentrasi 40 % dalam pelarut air dengan metil alkohol sebagai campuran disebut sebagai formol (formalin) yang merupakan cairan tidak berwarna, berbau tajam dan bertitik didih 210C. Namanya menurut tatanama
Rumus molekul : CH2O [HCHO]
Rumus Bangun : O
II H C H
Formaldehid (formalin) adalah larutan tidak berwarna, reaktif, dan dapat membentuk polimer pada suhu normal pada saat berwujud gas. Kalor pembakaran untuk gas formalin 4,47 Kcal / gram. Daya bakar dilaporkan pada rentang volume 12,5 80% di udara. Campuran 65 70 % formaldehid di dalam udara sangat mudah terbakar. Formaldehid dapat terdekomposisi menjadi metanol dan karbonmonooksida pada suhu 150oC dan pada suhu 300oC jika dekomposisi tidak
menggunakan katalis. Pada tekanan atmosfer formaldehid mudah mengalami foto-oksidasi menjadi karbondioksida (WAAC Newsletter, 2007).
Larutan formaldehid atau larutan formalin mempunyai nama dagang formalin, formol atau mikrobisida dengan rumus molekul CH2O mengandung
37 % gas formaldehid dalam air. Biasanya ditambahkan 10 15% metanol untuk menghindari polimerisasi. Larutan ini sangat kuat dan dikenal dengan larutan formalin 40% yang mengandung 40 gram formaldehid dalam 100 ml pelarut (Cahyadi, 2006).
Formalin merupakan cairan jernih yang tidak berwarna dengan bau menusuk, uapnya merangsang selaput lendir hidung dan tenggorokan dan rasa membakar. Bobot tiap mililiter adalah 1,08 gram. Dapat bercampur dengan air dan alkohol, tetapi tidak bercampur dengan kloroform dan eter (Norman and Waddington, 1983).
diencerkan, yaitu dengan kadar formaldehidnya 40, 30, 20 dan 10 persen serta dalam bentuk tablet yang beratnya masing-masing sekitar 5 gram (Berita Bumi, 2007)
Kegunaan Formalin
Formalin adalah larutan yang tidak berwarna dan baunya sangat menusuk. Di dalam formalin terkandung sekitar 37 % formaldehid dalam air, biasanya ditambah metanol hingga 15 persen sebagai pengawet. Formalin dikenal sebagai bahan pembunuh hama (disinfektan) dan banyak digunakan dalam industri. Penggunaan formalin diantaranya adalah sebagai berikut:
a. Pembunuh kuman sehingga digunakan sebagai pembersih lantai, gudang, pakaian dan kapal.
b. Pembasmi lalat dan serangga.
c. Bahan pembuat sutra bahan, zat pewarna, cermin kaca dan bahan peledak. d. Dalam dunia fotografi digunakan sebagai pengeras lapisan gelatin dan
kertas.
e. Bahan pembentuk pupuk berupa urea. f. Bahan pembuatan produk parfum. g. Pencegah korosi untuk sumur minyak. h. Bahan untuk isolasi busa.
i. Bahan perekat untuk produk kayu lapis (plywood) (Oke, 2008).
mikroorganisme. Efek sporosidnya meningkat, yang meningkat tajam dengan adanya kenaikan suhu. Larutan 0,5 % formaldehid dalam waktu 6 12 jam dapat membunuh bakteri dan dalam waktu 2 4 hari dapat membunuh spora, sedangkan larutan 8% dapat membunuh spora dalam waktu 18 jam. Formaldehid memiliki daya antimicrobial yang luas yaitu terhadap Staphylococcus aureus, Escherichia coli, Klebsiella pneumonia, Pseudomonas aerogenosa, Pseudomonas florescens, Candida albicans, Aspergillus niger, atau Penicillium notatum. Mekanisme formaldehid sebagai pengawet diduga bergabung dengan asam amino bebas dari protoplasma sel atau mengkoagulasikan protein (Cahyadi, 2006).
Sifat antimikrobial dari formaldehid merupakan hasil dari kemampuannya menginaktivasi protein dengan cara mengkondensasi dengan asam amino bebas dalam protein menjadi campuran lain. Kemampuan dari formaldehid meningkat seiring dengan peningkatan suhu (Lund, 1994).
Formaldehid membunuh bakteri dengan membuat jaringan dalam bakteri dehidrasi (kekurangan air) sehingga sel bakteri akan kering dan membentuk lapisan baru di permukaan. Artinya formalin tidak saja membunuh bakteri, tetapi juga membentuk lapisan baru yang melindungi lapisan di bawahnya supaya tahan terhadap serangan bakteri lain. Bila desinfektan lainnya mendeaktifasikan serangan bakteri dengan cara membunuh maka formalin akan bereaksi secara kimiawi dan tetap ada di dalam materi tersebut untuk melindungi dari serangan berikutnya (Cipta Pangan, 2006)
(Herdiantini, 2003).
Sifat penetrasi formalin cukup baik, tetapi gerakan penetrasinya lambat sehingga walaupun formaldehid dapat digunakan untuk mengawetkan sel-sel tetapi tidak dapat melindungi secara sempurna, kecuali jika diberikan dalam waktu lama sehingga jaringan menjadi keras (Herdiantini, 2003).
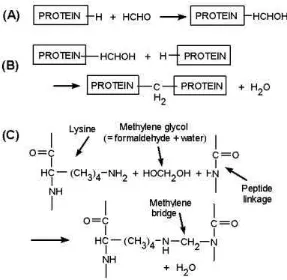
Reaksi Formalin dengan Protein
Formaldehid dapat merusak bakteri karena bakteri adalah protein. Pada reaksi formaldehid dengan protein, yang pertama kali diserang adalah gugus amina pada posisi lisin diantara gugus-gugus polar dari peptide. Formaldehid selain mengikat gugus
-NH2 dari lisin juga menyerang residu tirosin danhistidin. Pengikatan formaldehid pada gugus
-NH2 dari lisin berjalan lambatmerupakan reaksi yang searah, sedangkan ikatannya dengan gugus amino bebas berjalan cepat dan merupakan reaksi bolak-balik. Ikatan formaldehid dengan gugus amino dalam reaksi ini tidak dapat dihilangkan dengan dianalisis sehingga ikatan ini turut menyokong kestabilan struktur molekul (Cahyadi, 2006).
Gambar 1. Reaksi Formalin Dengan Asam Amino (Iskandar., 2003)
Bahaya Penggunaan Formalin
Penggunaan formalin untuk mengawetkan makanan sesungguhnya telah dilarang sejak tahun 1982. Pemerintah juga telah mengeluarkan dua peraturan untuk mengatur penggunaan bahan kimia ini. Yaitu Peraturan Menteri Kesehatan Nomor 472 Tahun 1996 tentang Pengamanan Bahan Berbahaya bagi Kesehatan, dan Keputusan Menteri Perindustrian dan Perdagangan Nomor 254 Tahun 2000 tentang Tata Niaga Impor dan Peredaran Bahan Berbahaya Tertentu. Formalin dan rodamin termasuk dalam kategori bahan berbahaya tersebut yang penggunaannya harus diawasi secara ketat (Suara Merdeka, 2007).
menyebabkan kematian sel. Selain itu kandungan formalin yang tinggi dalam tubuh juga menyebabkan iritasi lambung, alergi, bersifat karsinogenik (menyebabkan kanker) dan bersifat mutagen (perubahan fungsi sel) serta orang yang mengkonsumsinya akan muntah, diare bercampur darah, kencing bercampur darah, dan kematian yang disebabkan adanya kegagalan peredaran darah (Cahyadi, 2006).
Pemaparan formaldehid terhadap kulit menyebabkan kulit mengeras, menimbulkan kontak dermatitis dan reaksi sensitivitas, sedangkan pada sistem reproduksi wanita akan menimbulkan gangguan menstruasi, toksemia, dan anemia pada kehamilan, peningkatan aborsi spontan serta penurunan berat badan bayi yang baru lahir. Uap dari larutan formaldehid menyebabkan iritasi membran mukosa hidung, mata, dan tenggorokan apabila terhisap dalam bentuk gas pada konsentrasi 0,03 4 bpj selama 35 menit. Dapat terjadi iritasi pernafasan parah seperti batuk, disfagia, spasmus laring, bronchitis, pneumonia, asma, dan udem pulmonary(Smith, 1991).
Ciri-Ciri Makanan yang Berformalin
Bagi masyarakat awam, untuk dapat membedakan makanan yang mengandung formalin tentu sangat sulit. Karena hal itu secara akurat hanya dapat dilakukan di laboratorium dengan menggunakan pereaksi kimia. Namun, BPOM menyebutkan ciri-ciri umum beberapa makanan yang diduga mengandung formalin:
a. Untuk jenis mie basah, kita bisa mengenali ciri-ciri sebagai berikut : Pertama, mie basah tersebut tidak rusak sampai dua hari pada suhu kamar ( 250C), dan
bertahan lebih dari 15 hari pada suhu lemari es ( 100C). Kedua, bau mie agak
menyengat, yakni bau khas formalin. Ketiga, mie basah ini tidak lengket lebih mengkilap dibanding mie secara umumnya.
b. Untuk tahu yang mengandung formalin memiliki ciri-ciri umum pertama, tahu tidak rusak hingga tiga hari pada suhu kamar dan bertahan lebih dari 15 hari pada suhu lemari es. Kedua, tahu keras namun tidak padat. Ketiga, bau agak menyengat khas bau formalin.
c. Untuk baso yang mengandung formalin, kita bisa mengenali ciri-ciri secara umum. Pertama, tidak rusak sampai lima hari pada suhu kamar. Kedua, memiliki tekstur yang sangat kenyal.
d. Untuk ciri-ciri ikan segar yang mengandung formalin, biasanya tidak rusak sampai tiga hari pada suhu kamar. Warna insang pada ikan merah tua dan tidak cemerlang, dengan warna daging putih bersih, warna mata merah, tubuh ikan tampak bersih cemerlang, dijauhi lalat dan memiliki bau menyengat khas bau formalin.
sampai lebih dari satu bulan pada suhu kamar. Warna ikan asin bersih cerah, namun tidak berbau khas ikan asin.
Ciri-ciri di atas memang hanya bersifat umum, namun setidaknya dapat memberikan sedikit gambaran kepada kita tentang ciri makanan yang diduga mengandung formalin. Karena bagaimanapun juga, harus tetap diwaspadai, jangan sampai makanan yang kita konsumsi malah menuai penyakit, padahal seharusnya makanan menjadi sumber kesehatan bagi tubuh (Republika Online, 2007).
Metode Pengujian Formalin Pada Makanan
Di bawah ini akan dipaparkan beberapa cara metode pengujian formalin yang telah dilakukan secara kualitatif:
a. Penggunaan asam kromatropat pada ikan, tahu, dan produk lainnya yang diduga mengandung formalin (Hardjito dan Salamah, 2006).
Bahan yang akan diuji ditimbang sebanyak 5 gram, kemudian tambahkan aquadest mendidih sebanyak 50 ml dan dibiarkan dingin. Setelah dingin kemudian tambahkan asam kromatropat sebanyak 5 ml. Produk yang diduga mengandung formalin akan ditunjukkan dengan berubahnya warna air dari bening menjadi merah muda hingga ungu. Semakin tinggi kadar formalin, maka akan semakin ungu. Pengujian ini tidak tampak pada bahan yang mengandung formalin kurang dari 8 ppm.
b. Larutan KMnO4 0,1 N untuk cairan (Sains, 2007).
Cairan dari bahan pangan yang diduga mengandung formalin diambil sebanyak 10 ml, kemudian ditetesi dengan 1 tetes larutan KMnO4 0,1 N. Jika
tidak mengandung formalin. Hasil palsu dapat saja terjadi jika dalam bahan pangan mengandung reduktor lain yang bereaksi dengan KMnO4 seperti asam
oksalat dll, tetapi bahan pangan yang berprotein tinggi (ikan basah, baso dan tahu) sangat kecil kemungkinan mengandung asam oksalat secara alami.
c. Larutan Fuchsin + HCl (Schiff Test) (Mahdi., 2007)
Bahan yang diduga mengandung formalin dipotong kecil kecil, kemudian dihancurkan. Hancuran kemudian ditambahkan aquadest dan disaring airnya. Air saringannya ini kemudian ditetesi dengan Kit Tes formalin (campuran Fuchsin dan HCl), jika terjadi perubahan warna menjadi merah muda / merah maka bahan mengandung formalin. Uji ini memerlukan waktu 10 menit.
d. Larutan Fehling (Kimia Indonesia, 2007)
Bahan yang diduga mengandung formalin diambil cairannya kemudian ditetesi dengan larutan fehling (A + B). Formalin akan teroksidasi membentuk asam formiat (sebagai ion), dan endapan berwarna merah yang merupakan Cu2O.
Hasil ini kurang akurat jika pada bahan juga mengandung karbohidrat (gula pereduksi).
O O
H - C H + 2Cu+2 + 5 OH- H C O-+ Cu2O + 3 H2O
Hasil Penelitian Sebelumnya
ppm) dan ikan kembung (0,1100). Penelitian ini dilakukan di Laboratorium Kimia Analitik Fakultas MIPA USU, secara kualitatif dengan menggunakan reagen Benedict untuk melihat ada tidaknya kandungan formalin kemudian dilanjutkan dengan pengujian secara kuantitatif untuk mengukur konsentrasi formalin jika mengandung formalin dengan menggunakan Spektrofotometer 2D. Ikan asin dihaluskan terlebih dahulu kemudian ditambahkan aquadest lalu dicampur hingga homogen, kemudian disaring dan diambil filtratnya lalu didestilasi, setelah itu hasil destilasi diambil 1 ml dan ditambahkan reagen Benedict 1 ml kemudian dipanaskan dalam water bath dan terbentuk endapan merah bata jika diketahui berformalin lalu dilanjutkan dengan uji kuantitatif dengan menggunakan spektrofotometer untuk mengukur konsentrasi dari formalin tersebut.
BAHAN DAN METODOLOGI PENELITIAN
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah ikan kembung yang dipilih dalam keadaan segar dan bebas formalin yang diperoleh dari Pasar Sore Kelurahan Padang Bulan Medan.
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Mei 2008 hingga selesai di Laboratorium Analisa Kimia Bahan Pangan dan Laboratorium Mikrobiologi Departemen Teknologi Pertanian Fakultas Pertanian Universitas Sumatera Utara, Medan.
Bahan Kimia
- Formalin (HCHO) teknis (40%) - H2SO4pekat
- Aquadest - HCl 37 %
- NH30,25 % - CuSO45 H2O
- AgNO3 0,1 N - KNaC4H4O64 H2O
- NaOH - NaHSO3
- KMnO40,1 N - Fuchsin
Alat
- Jarum suntik - Aluminium foil
- Oven - Plastik polietilen
- Timbangan digital -Styrofoam
- Beaker glass - Pipet tetes
- Mortar dan lumpang porselin - Masker - Termometer
- Kamera digitalCannon Ixus 7.0 mega pixels
Metode Penelitian
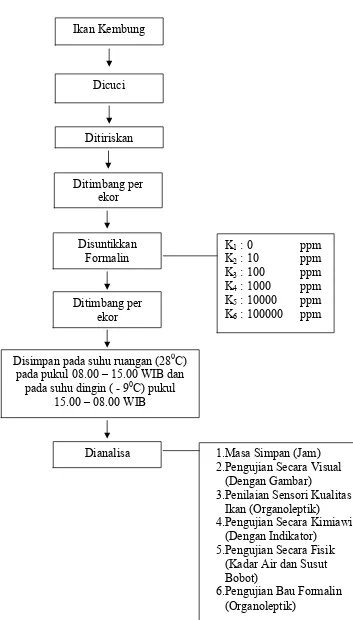
Penelitian ini menggunakan Metode Rancangan Acak Lengkap (RAL) non faktorial yaitu:
Konsentrasi Formalin (HCHO) yang disuntikkan ke dalam ikan (K)
K1 : 0 ppm
K2 : 10 ppm
K3 : 100 ppm
K4 : 1000 ppm
K5 : 10000 ppm
K6 : 100000 ppm
Banyaknya perlakuan (T) adalah 6 x 1 = 6, maka jumlah ulangan (n) adalah: T (n 1) > 15
6 ( n 1 ) > 15
6n 6 > 15
6 n > 21
Model Rancangan (Sastrosupadi, 2000)
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan model:
Yij= + Ti+ ij
Dimana:
Yij : Hasil pengamatan dari faktor K dari taraf ke i dan ulangan ke j.
: Efek nilai tengah
Ti : Efek dari faktor K pada taraf ke i.
ij : Efek error dari faktor K pada taraf ke i dan ulangan ke j.
Jika diperoleh hasil yang nyata atau sangat nyata kemudian dilanjutkan dengan Uji Jarak Duncan (UJD) untuk membandingkan perbedaan sepasang nilai tengah dengan rumus:
UJD = Ra (p : db error)x UlanganKTError
R = tergantung dari banyaknya perlakuan yang di bandingkan (dengan melihat tabel Duncan)
Pelaksanaan Penelitian
Penyiapan Indikator Kimia Pendeteksi. A. Pereaksi Schiff untuk Aldehid (Ham, 2006)
B. Larutan Fehling (Ham, 2006)
a. Alirkan secara perlahan 5 ml H2SO4pekat ke dalam gelas kimia berisi 100
ml aquadest sambil sesekali diaduk. Kemudian masukkan CuSO4 5 H2O
34, 66 gram lalu diaduk. Setelah melarut encerkan dengan aquadest sampai volume larutan menjadi 500 ml dan pindahkan ke dalam botol reagen (disebut larutan fehling A (berwarna biru)).
b. Siapkan 250 ml aqudest di dalam gelas kimia 600 ml. Timbang NaOH 50 gram dan segera dilarutkan ke dalam aquadest. Kemudian tambahkan KNaC4H4O64 H2O 173 gram ke dalam larutan NaOH di atas dan encerkan
dengan aquadest hingga volume larutan menjadi 500 ml (disebut larutan Fehling B)
Campurkan larutan fehling A dan larutan fehling B dengan volume yang sama pada saat akan digunakan.
C. Reagen Tollens (perak amoniakal) (Norman and Waddington, 1983).
Dibuat larutan AgNO3 0,1 N dalam 200 ml aquadest. Kemudian
ditambahkan 100 ml NaOH 0,1 N hingga terbentuk warna coklat. Larutan ini kemudian ditambahkan larutan amoniak encer (0,25%) sedikit demi sedikit hingga warna coklat yang terbentuk menghilang dan menandakan terjadi pembentukan Ag (NH3)2+.
D. Larutan KMnO40,1 N (Norman and Waddington, 1983)
Dibuat larutan KMnO4 0,1 N dalam 100 ml aquadest kemudian
ditambahkan 500 ml H2SO40,1 N diaduk dan disimpan dalam botol tidak tembus
E. Larutan KMnO40,1 N + NaHSO30,1 N
Dibuat larutan KMnO4 0,1 N dalam 100 ml aquadest kemudian
ditambahkan ke dalamnya 200 ml larutan NaHSO3 0,1 N dan diaduk, kemudian
disaring menggunakan kertas saring dan disimpan dalam botol tidak tembus cahaya.
Penyiapan ikan kembung yang diformalin.
Dipilih ikan kembung yang masih segar, lalu dicuci dan ditiriskan kemudian diambil 1 ekor per perlakuan dengan berat rata-rata 100 gr. Disuntikkan formalin ke dalam ikan dengan berbagai perlakuan 0 ppm, 10 ppm, 100 ppm, 1000 ppm, 10000 ppm dan 100000 ppm secara merata ke seluruh tubuh ikan dengan rincian 10 ml formalin untuk setiap 100 gr. Didiamkan selama 30 menit. Disimpan dalam plastik polietilen tertutup pada suhu ruangan (280C) pada pukul
08.00 15.00 wib, kemudian pukul 15.00 08.00 wib disimpan pada suhu dingin pada suhu (- 90C) dengan menggunakan es balok yang ditambahkan garam 20 %
dari berat es. Dilakukan analisa pada 0 hari dan sesaat sebelum ikan menjadi busuk.
Pengamatan dan Pengumpulan Data
Pengamatan dan pengumpulan data dilakukan berdasarkan analisa meliputi parameter sebagai berikut:
1. Penentuan Masa Simpan Ikan 4. Pengujian Secara Kimiawi 2. Penilaian Visual Ikan (dengan gambar) 5. Pengujian Secara Fisik 3. Penilaian Sensori Kualitas Ikan 6. Pengujian Bau Formalin
Penentuan Masa Simpan Ikan
Setelah diberi perlakuan formalin selanjutnya ikan ditentukan masa simpannya dimulai dari hari pertama hingga ikan membusuk. Penentuan masa simpan dihentikan jika ikan telah memberikan tanda-tanda pembusukan berdasarkan ciri-ciri sebagai berikut:
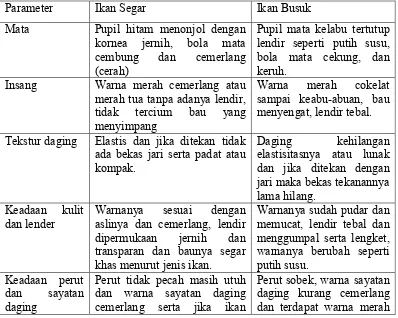
Tabel 3. Ciri-ciri ikan segar dan busuk
Parameter Ikan Segar Ikan Busuk
Mata Pupil hitam menonjol dengan kornea jernih, bola mata cembung dan cemerlang (cerah)
Pupil mata kelabu tertutup lendir seperti putih susu, bola mata cekung, dan keruh.
Insang Warna merah cemerlang atau merah tua tanpa adanya lendir, Tekstur daging Elastis dan jika ditekan tidak
ada bekas jari serta padat atau kompak.
dan lender Warnanya sesuai denganaslinya dan cemerlang, lendir dipermukaan jernih dan transparan dan baunya segar khas menurut jenis ikan.
Warnanya sudah pudar dan memucat, lendir tebal dan menggumpal serta lengket, dan warna sayatan daging cemerlang serta jika ikan
dibelah daging melekat kuat
pada tulang terutama rusuknya. sepanjang tulang belakangserta jika dibelah daging mudah lepas.
Bau Spesifik menurut jenisnya dan segar seperti bau rumput laut. Pupil mata kelabu tertutup lendir seperti putih susu, bola mata cekung dan keruh.
Bau menusuk seperti asam asetat dan lama kelamaan berubah menjadi bau busuk yang menusuk hidung. Sumber : Junianto., (2003)
Penilaian Visual Ikan (dengan gambar)
Ikan yang telah diberi perlakuan selanjutnya di dokumentasikan dengan menggunakan kamera digital Cannon Ixus 7.0 Mega Pixels pada 0 hari dan pada saat sesaat sebelum busuk. Setelah itu dicetak dalam bentuk formatJPEG Image/
GIF Image(314 x 235 pixels)
Penilaian Sensori Kualitas Ikan (mata, lendir di permukaan kulit, bau, dan tekstur) (Soekarto, 1990)
Uji ini dilakukan dengan menggunakan Panelis sebanyak 10 orang. Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala numerik. Pengujian dilakukan pada 0 hari dengan penilaian sensori kualitas ikan dan pada saat sesaat sebelum busuk.
Tabel 4. Penilaian sensori kualitas ikan
Parameter Kriteria Mutu dan Deskripsi Nilai
Mata Bola mata menonjol, pupil hitam cerah mengkilat,
kornea selaput mata jernih 10
Bola mata agak cekung, warna pupil berubah
keabu-abuan, kornea agak keruh 7
Bola mata agak cekung, pupil putih susu, kornea
keruh, mata berwarna merah 4
Bola mata dan bagian hitamnya tenggelam,
tampak lendir kuning yang tebal 1
Lendir di
keruh, agak putih susu, kecerahan mulai suram Lendir tebal tidak merata, terjadi penggumpalan, mulai timbul berbagai penyimpangan warna 4 Lendir berwarna kekuningan sampai coklat dan tebal tidak merata, kecerahan hilang, pemutihan nyata, terjadi pengeringan lendir karena penguapan.
1
Bau Segar, bau laut, bau spesifik menurut jenis ikan 10 Segar, bau laut mulai menghilang 9
Tidak berbau (netral) 8
Bau susu, belum ada bau asam, ada bau ikan asin,
atau bau cold storage 7
Bau susu asam, bau susu kental 6
Bau kentang rebus atau logam 5
Bau asam asetat, bau rumput atau bau sabun 4
Bau ammonia mulai tercium 3
Bau ammonia kuat, ada bau H2S 1
Bau busuk, bau indol 0
Tekstur Padat, kenyal, sulit menyobek dari tulang belakang, kadang-kadang agak lunak sesuai jenis ikan
Daging sangat lunak, bekas jari tidak mau hilang, sisik banyak yang hilang, mudah disobek dari tulang belakang
1
Pengujian Secara Kimiawi (dengan indikator)
KMnO4 0,1 N + NaHSO3 0,1 N untuk masing-masing perlakuan. Sedangkan
untuk daging ikan ditetesi dengan masing-masing indikator Pereaksi Schiff. Pereaksi Tollens, Larutan Fehling, Larutan KMnO4 0,1 N, dan Larutan KMnO4
0,1 N + NaHSO3 0,1 N pada masing-masing perlakuan. Semua uji dilakukan
tanpa pemanasan setelah diberikan indikator kimia. Hasil ini merupakan uji kualitatif yang ditandai dengan terjadinya perubahan warna dari masing-masing indikator.
Tabel 5. Perubahan warna dari masing-masing indikator
Bahan Kimia Indikator (+ ) Formalin ( - ) Formalin
Pereaksi Schiff Terjadi perubahan
Larutan KMnO40,1 N Terjadi perubahan
Pengujian Secara Fisik
a. Kadar Air (Sudarmadji, et al.,1984).
Penentuan kadar air dilakukan pada saat setelah diberi perlakuan formalin dan pada saat ikan sesaat sebelum menjadi busuk setelah disimpan.
- Ditimbang bahan sebanyak 2 gram dalam aluminium foil yang telah diketahui berat kosongnya.
- Kemudian dikeringkan dalam oven dengan suhu 1050C selama 3 jam
lalu didinginkan dalam desikator selama 15 menit dan ditimbang. - Selanjutnya dipanaskan lagi di dalam oven selama 30 menit, lalu
didinginkan dalam desikator dan ditimbang. Perlakuan ini diulang sampai didapat berat yang konstan.
- Pengurangan berat merupakan banyaknya air yang diuapkan dari bahan dengan perhitungan:
Kadar air (% Basis Basah) = berat awal berat akhir x 100 % berat awal
b. Susut Bobot
Setelah diberikan perlakuan formalin dan disimpan, selanjutnya ikan kemudian ditimbang beratnya untuk mengetahui susut bobot pada saat ikan sesaat sebelum menjadi busuk
Susut Bobot = berat awal berat akhir
Pengujian Bau Formalin
dilakukan dengan uji organoleptik terhadap 10 panelis. Hasil penentuan bau formalin dapat dilihat dari tabel di bawah ini:
Tabel 6. Uji organoleptik penentuan uji bau formalin
Deskripsi Skala Numerik
Sangat jelas bau formalin 4
(masih tercium jelas bau formalin)
Jelas bau formalin 3
Agak jelas bau formalin 2
SKEMA PENELITIAN
Disimpan pada suhu ruangan (280C)
pada pukul 08.00 15.00 WIB dan pada suhu dingin ( - 90C) pukul
HASIL DAN PEMBAHASAN
Pengaruh Konsentrasi Formalin (K) Terhadap Parameter yang Diamati Dari hasil penelitian dan analisis statistika yang telah dilakukan diperoleh bahwa konsentrasi formalin memberikan pengaruh terhadap masa simpan ikan, penilaian sensori kualitas ikan (mata, lendir di permukaan, bau, tekstur), pengujian fisik ikan (kadar air dan susut bobot), dan pengujian terhadap bau formalin.
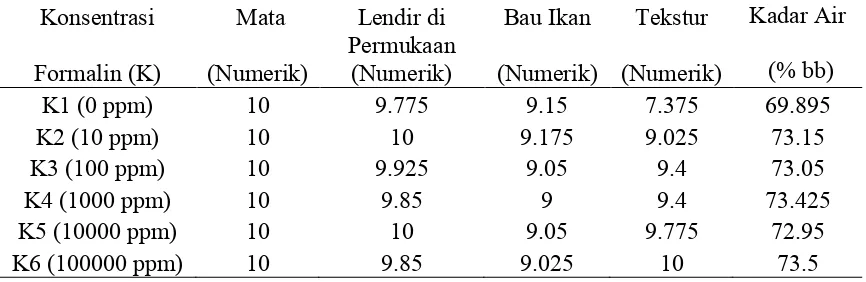
Tabel 7 di bawah ini menunjukkan pengaruh konsentrasi formalin (K) pada 0 hari terhadap nilai sensori mata, lendir di permukaan, bau, tekstur dan kadar air ikan kembung. Dari Tabel 7 pada 0 hari konsentrasi formalin memberikan pengaruh yang sama terhadap nilai sensori mata, nilai sensori lendir di permukaan kulit, nilai sensori bau ikan dan kadar air dan memberikan pengaruh yang sangat nyata terhadap keadaan tekstur ikan kembung. Nilai sensori tekstur tertinggi diperoleh pada perlakuan K6 (105 ppm) sebesar 10 dan terendah pada
perlakuan K1(0 ppm) sebesar 7.375
Tabel 7. Hasil Analisis Pengaruh Konsentrasi Formalin Terhadap Parameter yang Diamati (0 hari)
Konsentrasi Mata Lendir di Bau Ikan Tekstur Kadar Air (% bb) Formalin (K) (Numerik) Permukaan(Numerik) (Numerik) (Numerik)
K1 (0 ppm) 10 9.775 9.15 7.375 69.895
K2 (10 ppm) 10 10 9.175 9.025 73.15
K3 (100 ppm) 10 9.925 9.05 9.4 73.05
K4 (1000 ppm) 10 9.85 9 9.4 73.425
K5 (10000 ppm) 10 10 9.05 9.775 72.95
Dari hasil penelitian dan analisis statistika yang telah dilakukan pada saat sesaat sebelum busuk menunjukkan bahwa konsentrasi formalin berpengaruh terhadap masa simpan ikan kembung, nilai sensori mata, nilai sensori tekstur, nilai sensori bau ikan, kadar air akhir, susut bobot dan pengujian bau formalin secara organoleptik seperti terlihat pada Tabel 8 dan 9 berikut ini:
Tabel 8. Hasil Analisis Pengaruh Konsentrasi Formalin terhadap Parameter yang Diamati (Sesaat Sebelum Busuk)
Konsentrasi Masa Simpan Mata Lendir di Bau Ikan Formalin (K) (Jam) (Numerik) Permukaan(Numerik) (Numerik)
K1 (0 ppm) 25.5 7 1 4
Tabel 9. Hasil Analisis Pengaruh Konsentrasi Formalin terhadap Parameter yang Diamati (Sesaat Sebelum Busuk)
K2 (10 ppm) 6.325 70.25 13.425 1.1
K3 (100 ppm) 6.7 70.525 12.35 1.2625
K4 (1000 ppm) 7 70.875 12.2 1.4875
K5 (10000 ppm) 9.175 67.85 12.125 2.08
K6 (100000 ppm) 10 71.45 12 2.49375
pada susut bobot semakin tinggi konsentrasi formalin semakin rendah susut bobot. Masa simpan tertinggi diperoleh pada perlakuan K6(105 ppm) sebesar 75.5 jam
sedangkan yang terendah pada perlakuan K1 (0 ppm) sebesar 25.5 jam. Nilai
sensori tekstur sesaat sebelum busuk tertinggi diperoleh pada perlakuan K6 (105
ppm) sebesar 10 dan terendah pada perlakuan K1 (0 ppm) sebesar 4. Kadar air
sesaat sebelum busuk tertinggi diperoleh pada perlakuan K6 (105 ppm) sebesar
71.45 % sedangkan yang terendah pada konsentrasi K1 (0 ppm) sebesar 64.75%.
Nilai rataan uji organoleptik bau formalin tertinggi pada perlakuan K6 (105 ppm)
sebesar 2.49375 sedangkan yang terendah pada perlakuan K1 (0 ppm) sebesar 1.
Susut bobot tertinggi diperoleh pada perlakuan K1 (0 ppm) sebesar 15.975 gram
dan terendah pada perlakuan K6(105ppm) sebesar 12 gram.
1. Pengaruh Konsentrasi Formalin terhadap Masa Simpan
Dari daftar analisa sidik ragam pada Lampiran 1 dapat dilihat bahwa konsentrasi formalin memberikan pengaruh yang berbeda sangat nyata (P<0.01) terhadap masa simpan ikan kembung.
Hasil pengujian Uji Jarak Duncan menunjukkan pengaruh konsentrasi formalin terhadap masa simpan ikan kembung dapat dilihat pada Tabel 10 berikut: Tabel 10. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap
Masa Simpan Ikan Kembung (Jam)
Jarak UJD Konsentrasi Rataan Notasi
0.05 0.01 Formalin 0.05 0.01
- - - K1 (0 ppm) 25.5 f F
2 0.83931 1.15017 K2 (10 ppm) 30.5 e E
3 0.8817 1.20669 K3 (100 ppm) 49.75 d D
4 0.90714 1.20952 K4 (1000 ppm) 51.5 c C
5 0.92409 1.26038 K5 (10000 ppm) 53.5 b B
6 0.93822 1.28016 K6 (100000 ppm) 75.5 a A
Tabel 10 menunjukkan bahwa perlakuan K1 berbeda sangat nyata dengan
K2, K3, K4, K5, K6. Perlakuan K2 berbeda sangat nyata dengan K3, K4, K5, K6.
Perlakuan K3 berbeda sangat nyata dengan K4, K5, K6. Perlakuan K4 berbeda
sangat nyata dengan K5 dan K6. Serta perlakuan K5 memberikan pengaruh yang
berbeda sangat nyata dengan K6. Masa simpan tertinggi diperoleh pada perlakuan
K6 (105 ppm) dengan lama simpan 75.5 jam sedangkan yang terendah pada
perlakuan K1(0 ppm) sebesar 25.5 jam.
Hubungan antara konsentrasi formalin dengan masa simpan dapat dilihat pada Gambar 3 berikut:
Gambar 3. Grafik Hubungan Konsentrasi Formalin dengan Masa Simpan Ikan Kembung
Dari Gambar 3 dapat dilihat bahwa semakin tinggi konsentrasi formalin maka masa simpan ikan semakin tinggi. Hal ini disebabkan karena menurut Cahyadi (2006), formalin bereaksi dengan protein dan mengurangi aktivitas mikroorganisme menggunakan protein, sehingga masa simpan ikan menjadi semakin lama dengan meningkatnya konsentrasi formalin, dan juga formalin
membunuh bakteri dengan membuat jaringan dalam bakteri dehidrasi (kekurangan air) sehingga sel bakteri akan kering, jika sel bakteri kering maka penguraian protein oleh bakteri menjadi lambat atau tidak ada sama sekali sehingga ikan menjadi awet.
2. Pengaruh Konsentrasi Formalin terhadap Penilaian Sensori Kualitas Ikan Mata (0 Hari)
Dari daftar analisa sidik ragam pada Lampiran 2 dapat dilihat bahwa pemberian formalin memberikan pengaruh yang berbeda tidak nyata (P>0.05) terhadap nilai sensori mata ikan kembung sehingga Uji Jarak Duncan tidak dilanjutkan.
Mata (Sesaat Sebelum Busuk)
Dari daftar analisa sidik ragam pada Lampiran 6 dapat dilihat bahwa penilaian sensori untuk mata ikan kembung yang telah diberi perlakuan formalin pada saat sebelum busuk memberikan pengaruh yang sangat nyata (P<0.01).
Hasil pengujian dengan Uji Jarak Duncan menunjukkan pengaruh konsentrasi formalin terhadap nilai sensori mata dapat dilihat pada Tabel 11 berikut:
Tabel 11. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap Nilai Sensori Mata Ikan Kembung Sesaat Sebelum Busuk
Jarak UJD Konsentrasi Rataan Notasi
0.05 0.01 Formalin (K) 0.05 0.01
- - - K1 (0 ppm) 7 a A
2 0.45469 0.62309 K2 (10 ppm) 4.375 b B
3 0.47765 0.65371 K3 (100 ppm) 4 b B
4 0.49143 0.65524 K4 (1000 ppm) 4 b B
5 0.50061 0.6828 K5 (10000 ppm) 4 b B
6 0.50827 0.69351 K6 (100000 ppm) 4 b B
Tabel 11 menunjukkan bahwa perlakuan K1 berbeda sangat nyata dengan
K2, K3, K4, K5, K6. Sedangkan K2, K3, K4, K5, K6 berbeda tidak nyata. Nilai
tertinggi diperoleh pada perlakuan K1(0 ppm) sebesar 7 sedangkan terendah pada
perlakuan K6(105ppm) sebesar 4.
Hubungan antara konsentrasi formalin dengan nilai sensori mata (numerik) dapat dilihat pada Gambar 4 berikut:
Gambar 4. Grafik Hubungan Konsentrasi Formalin dengan Nilai Sensori Mata (Numerik)
Dari Gambar 4 dapat dilihat bahwa semakin tinggi konsentrasi formalin memberikan nilai sensori mata ikan (numerik) yang sama. Hal ini disebabkan karena menurut Republika Online (2007) ikan yang telah diberi perlakuan formalin memberikan perubahan warna mata menjadi merah.
Lendir di permukaan kulit (0 hari)
Dari tabel analisa sidik ragam pada Lampiran 3 dapat dilihat bahwa perlakuan formalin pada 0 hari memberikan pengaruh yang berbeda tidak nyata
(P>0.05) terhadap lendir dipermukaan ikan sehingga Uji Jarak Duncan tidak dilanjutkan.
Lendir di permukaan kulit (sesaat sebelum busuk)
Dari tabel analisa sidik ragam pada Lampiran 7 dapat dilihat bahwa perlakuan formalin pada saat sebelum busuk memberikan pengaruh yang berbeda tidak nyata (P>0.05) terhadap sensori lendir di permukaan ikan (numerik) sehingga Uji Jarak Duncan tidak dilanjutkan.
Bau (0 Hari)
Dari daftar analisa sidik ragam pada Lampiran 4 perlakuan formalin memberikan pengaruh yang tidak nyata (P>0.05) terhadap bau dari ikan kembung sehingga Uji Jarak Duncan tidak dilanjutkan.
Bau (Sesaat Sebelum Busuk)
Dari daftar analisa sidik ragam pada Lampiran 8 perlakuan formalin terhadap nilai sensori bau sesaat sebelum busuk memberikan pengaruh yang sangat nyata (P<0.01).
Tabel 12. Uji Jarak Duncan Pengaruh Konsentrasi Formalin Terhadap Nilai Sensori Bau Ikan Sesaat Sebelum Busuk
Jarak 0.05UJD0.01 Formalin (K)Konsentrasi Rataan 0.05Notasi0.01
- - - K1 (0 ppm) 4 c C
2 0.17413 0.2386 K2 (10 ppm) 4 c C
3 0.18293 0.2504 K3 (100 ppm) 4 c C
4 0.1882 0.2509 K4 (1000 ppm) 4 c C
5 0.19172 0.2615 K5 (10000 ppm) 6.025 b B
6 0.19465 0.2656 K6 (100000 ppm) 7 a A
Keterangan: Notasi huruf yang berbeda menunjukkan berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar)
Dari Tabel 12 dapat dilihat bahwa perlakuan K1 berbeda tidak nyata
dengan K2, K3, dan K4, dan berbeda sangat nyata dengan perlakuan K5 dan K6.
Perlakuan K2 berbeda tidak nyata dengan K3 dan K4, berbeda sangat nyata
dengan K5 dan K6. Perlakuan K3 berbeda tidak nyata dengan K4 dan berbeda
sangat nyata dengan K5dan K6. Perlakuan K4berbeda sangat nyata dengan K5dan
K6. Perlakuan K5berbeda sangat nyata dengan K6. Nilai sensori bau ikan tertinggi
pada perlakuan K6 (105 ppm) sebesar 7 dan terendah pada perlakuan K1 (0 ppm)
Hubungan antara konsentrasi formalin terhadap nilai sensori bau ikan sesaat sebelum busuk dapat dilihat pada Gambar 5 berikut ini:
Gambar 5. Grafik Hubungan Konsentrasi Formalin Dengan Nilai Sensori Bau Ikan Sesaat Sebelum Busuk
Dari Gambar 5 dapat dilihat bahwa nilai sensori bau ikan sesaat sebelum busuk diperoleh pada perlakuan K6 (105 ppm) sebesar 7 dan terendah pada
perlakuan K1 (0 ppm) sebesar 4. Hal ini disebabkan karena pada konsentrasi
formalin tertinggi (105 ppm) pada saat sebelum busuk ikan kembung
menimbulkan bau ikan asin sedangkan pada konsentrasi formalin 0 ppm sampai 1000 ppm memberikan aroma asam.
Tekstur (0 hari)