ISOLASI ZAT WARNA HIJAU DAUN KATUK (Sauropus androgynus Merr.) SEBAGAI PEWARNA TABLET
SKRIPSI
OLEH :
JON FRIKSON LUMBAN GAOL NIM : 060804055
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2011
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH :
JON FRIKSON LUMBAN GAOL NIM : 060804055
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2011
LEMBAR PENGESAHAN
OLEH:
JON FRIKSON LUMBAN GAOL NIM : 060804055
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : Januari 2011
Pembimbing I Panitia Penguji
Drs. Awaluddin Saragih M.Si, Apt. Dra. Juanita Tanuwijaya, Apt. NIP. 195008221974121002 NIP. 130672239
Pembimbing II Drs. Awaluddin Saragih M.Si, Apt. NIP. 195008221974121002
Drs. Agusmal Dalimunthe, MS.,Apt. Dra. Fat Aminah M.Sc., Apt. NIP. 195406081983031005 NIP. 195011171980022001
Dra. Herawaty Ginting M.Si., Apt. NIP. 195112231980032002
Disahkan Oleh : Dekan
Prof. Dr. Sumadio Hadisahputra, Apt.
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat
kasih dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi ini yang
berjudul ”Isolasi Zat Warna Hijau Daun Katuk (Sauropus androgynus Merr.)
Sebagai Pewarna Tablet”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera
Utara.
Terimakasih dan penghargaan yang tulus kepada Ayahanda dan Ibunda
tercinta, T. Lumban Gaol dan L. br Silaban yang tiada pernah ada hentinya
berkorban dengan tulus ikhlas bagi kesuksesan penulis, juga kepada kakakku
(Herna) dan adik-adikku ( Hariono, Jesika, Renti, Junardi dan Suwardi ) yang
selalu setia memberi doa, dorongan dan semangat.
Pada kesempatan ini penulis juga mengucapkan terima kasih yang tulus
dan ikhlas kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi
USU Medan yang telah memberikan fasilitas sehingga penulis dapat
menyelesaikan pendidikan.
2. Bapak Drs. Awaluddin Saragih, M.Si, Apt. dan Bapak Drs. Agusmal
Dalimunthe, M.S, Apt. selaku pembimbing yang telah memberikan waktu,
bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan
skripsi ini.
3. Ibu Dra. Juanita Tanuwijaya, Apt., Ibu Dra. Fat Aminah, M.Sc, Apt. dan Ibu
memberikan kritik, saran, dan arahan kepada penulis dalam menyelesaikan
skripsi ini.
4. Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang telah mendidik
selama perkuliahan dan Bapak Drs. Suryadi Achmad, M.Sc, Apt selaku
penasehat akademis yang telah memberikan bimbingan kepada penulis selama
ini.
5. Bapak kepala Laboratorium Farmakognosi dan Bapak kepala Laboratorium
Obat Tradisional Fakultas Farmasi USU yang telah memberikan bantuan dan
fasilitas selama penulis melakukan penelitian.
6. Sahabat-sahabatku Panal 09, Imagodei dan kak Juliyanti yang memberi
bantuan, dukungan, dan motivasi. Rekan-rekan farmasi stambuk 2006,
kakak/abang senior (terkhusus Bang Andi dkk) dan junior mahasiswa fakultas
farmasi, para asisten laboratorium serta kawan-kawan yang tidak dapat
disebutkan satu persatu.
7. Yusna dkk yang tidak dapat saya sebutkan satu persatu atas partisipasinya
sebagai panelis dalam penelitian ini.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna.
Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk
penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu
pengetahuan kefarmasian.
Medan, 20 Januari 2011
Penulis
ISOLASI ZAT WARNA HIJAU DAUN KATUK (Sauropus androgynus Merr.) SEBAGAI PEWARNA TABLET
Abstrak
Pewarna alami adalah zat warna alami (pigmen) yang diperoleh dari tumbuhan, hewan, atau dari sumber-sumber mineral. Zat warna ini telah digunakan sejak dulu dan umumnya dianggap lebih aman daripada zat warna sintetis, seperti annato sebagai sumber warna kuning alamiah bagi berbagai jenis makanan begitu juga karoten dan klorofil. Klorofil menghasilkan warna hijau yang diperoleh dari daun dan banyak digunakan untuk makanan. Saat ini mulai digunakan pada berbagai produk kesehatan. Pigmen klorofil banyak terdapat pada dedaunan, misalnya daun suji,daun pandan, daun katuk dan sebagainya.
Isolasi zat warna hijau dari daun katuk (Sauropus androgynus Merr.) dilakukan dengan metode perendaman menggunakan etanol 96 %. Kemudian ekstrak etanol difraksinasi dengan etil asetat. Zat warna hijau daun katuk diformulasi menjadi pewarna sediaan tablet dengan metode granulasi basah yang dibuat dengan empat konsentrasi yaitu 0,5%, 1%, 1,25%, 1,5%. Selanjutnya dilakukan uji organoleptik untuk analisis warna dengan metode Hedonik menggunakan 20 panelis.
Hasil uji organoleptik dengan metode Hedonik diperoleh nilai warna untuk F1 (0,5%) = 1,75, F2 (1%) = 4,45, F3 (1,25%) = 2,75 dan F4 (1,5%) = 2,30. Berdasarkan nilai warna yang diperoleh, F2 (1%) paling disukai panelis dan dinyatakan sebagai konsentrasi yang paling baik untuk pewarna tablet.
ISOLATION of GREEN COLOR SUBSTANCE of SWEET LEAF (Sauropus androgynus Merr.) as TABLETS DYE
Abstract
Natural dyes are natural colorants (pigments) obtained from plant, animal or mineral sources. The dye has been used since old times and are generally considered safer than synthetic dyes, such as annato as a source of natural yellow color for a variety of foods as well as carotene and chlorophyll. Chlorophyll produces the green color, obtained from the leaves, widely used for food. Currently, began to be used in a variety of health products. Chlorophyll pigment are numerous in leaves, e.g. suji leaf, pandanus leaf, sweet leaf and so forth.
Isolation of green color substances of sweet leaf (Sauropus androgynus Merr.) done by means of immersion method using 96% ethanol. Then the ethanol extract was fractionated with ethyl acetate. Green color substance of sweet leafs formulated as a dyes of tablets preparation by wet granulation method that made with four concentrations of 0.5%, 1%, 1.25%, 1.5%. Furthermore organoleptic test for color analysis were done by Hedonic method using 20 panelists.
The organoleptic test results by Hedonic method were obtained color values for F1 (0.5%) = 1.75, F2 (1%) = 4.45, F3 (1.25%) = 2.75, and F4 (1.5% ) = 2.30. Based on the color values obtained, F2 (1%) was the most preferred by panelists and expressed as the best concentration for tablets dye.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesa ... 3
1.4 Tujuan Penelitian... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Morfologi Tumbuhan ... 5
2.1.1 Sistematika Tumbuhan ... 5
2.1.2 Sinonim Tumbuhan ... 6
2.1.3.Nama Daerah ... 6
2.1.4 Kandungan Kimia ... 6
2.1.6 Pewarna Alami ... 7
2.1.7 Klorofil ... 8
2.1.8 Ekstraksi ... 8
2.2 Uraian Sediaan Tablet ... 10
2.3 Uji Penilaian Organoleptik ... 16
2.3.1 Uji Kesukaan ... 16
2.3.2 Panel ... 16
BAB III METODOLOGI PENELITIAN... 18
3.1 Alat-Alat Yang Digunakan ... 18
3.2 Bahan-Bahan Yang Digunakan ... 18
3.3 Pengumpulan dan Pengolahan Sampel ... 18
3.3.1 Pengumpulan Sampel ... 18
3.3.2 Pengolahan Sampel ... 19
3.3.3 Determinasi Sampel ... 19
3.4 Pemeriksaan Sampel ... 19
3.4.1 Pemeriksaan Makroskopik ... 19
3.4.2 Pemeriksaan Mikroskopik ... 19
3.5 Isolasi Zat Warna Hijau dari Daun Katuk ... 20
3.6 Pembuatan Tablet... 21
3.6.1 Formula Plasebo ... 21
3.6.2 Pembuatan Tablet Plasebo dari Zat Warna Hijau Daun Katuk ... 21
3.8 Formula Bahan Obat ... 24
3.8.1 Pembuatan Tablet Antasida dari Zat Warna Hijau Daun Katuk ... 24
3.9 Uji Preformulasi ... 26
3.9.1 Sudut Diam Granul ... 26
3.9.2 Penentuan Waktu Alir Granul ... 26
3.9.3 Penentuan Indeks Tap ... 27
3.10 Proses Pencetakan Tablet ... 27
3.11 Evaluasi Tablet ... 27
3.11.1 Keseragaman Bobot ... 27
3.11.2 Kekerasan Tablet ... 28
3.11.3 Friabilitas ... 28
3.11.4 Waktu Hancur ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
BAB V KESIMPULAN DAN SARAN... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 43
DAFTAR TABEL
Tabel Halaman
1. Formula tablet plasebo ... 22
2. Skala uji hedonik untuk penentuan organoleptik Warna ... 23
3. Perlakuan konsentrasi warna ... 23
4. Formula tablet dengan bahan obat ... 25
5. Persyaratan keseragaman bobot ... 28
6. Uji preformulasi formula plasebo ... 31
7. Hasil uji preformulasi granul plasebo ... 47
8. Hasil uji preformulasi granul antasida ... 47
9. Hasil keseragaman bobot tablet plasebo ... 48
10. Hasil keseragaman bobot tablet antasida ... 48
11. Hasil evaluasi tablet plasebo ... 48
12. Hasil evaluasi tablet antasida ... 48
13. Hasil pengamatan warna ... 51
14. Daftar analisis sidik ragam uji warna ... 53
15. Harga nisbah f terendah untuk menyatakan beda nyata pada tingkat 5% ... 54
DAFTAR GAMBAR
Gambar Halaman
1. Histogram perlakuan terhadap nilai kesukaan warna ... 31
2. Histogram waktu alir massa granul ... 33
3. Histogram sudut diam massa granul ... 33
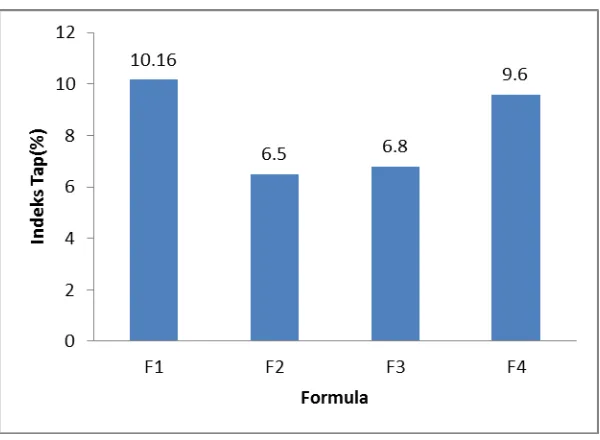
4. Histogram indeks tap massa granul ... 34
5. Histogram kekerasan tablet plasebo ... 35
6. Histogram friabilitas tablet plasebo... 35
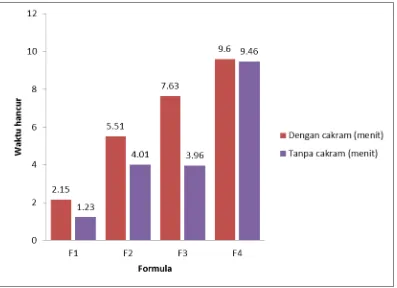
7. Histogram waktu hancur tablet plasebo ... 36
8. Histogram uji preformulasi granul antasida ... 37
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Determinasi Tumbuhan ... 43
2. Karakterisasi Tumbuhan ... 44
3. Sediaan Tablet Plasebo ... 46
4. Sediaan Tablet Antasida ... 47
5. Hasil Uji Preformulasi ... 47
6. Evaluasi Tablet ... 48
7. Contoh Perhitungan Bahan Tablet ... 49
ISOLASI ZAT WARNA HIJAU DAUN KATUK (Sauropus androgynus Merr.) SEBAGAI PEWARNA TABLET
Abstrak
Pewarna alami adalah zat warna alami (pigmen) yang diperoleh dari tumbuhan, hewan, atau dari sumber-sumber mineral. Zat warna ini telah digunakan sejak dulu dan umumnya dianggap lebih aman daripada zat warna sintetis, seperti annato sebagai sumber warna kuning alamiah bagi berbagai jenis makanan begitu juga karoten dan klorofil. Klorofil menghasilkan warna hijau yang diperoleh dari daun dan banyak digunakan untuk makanan. Saat ini mulai digunakan pada berbagai produk kesehatan. Pigmen klorofil banyak terdapat pada dedaunan, misalnya daun suji,daun pandan, daun katuk dan sebagainya.
Isolasi zat warna hijau dari daun katuk (Sauropus androgynus Merr.) dilakukan dengan metode perendaman menggunakan etanol 96 %. Kemudian ekstrak etanol difraksinasi dengan etil asetat. Zat warna hijau daun katuk diformulasi menjadi pewarna sediaan tablet dengan metode granulasi basah yang dibuat dengan empat konsentrasi yaitu 0,5%, 1%, 1,25%, 1,5%. Selanjutnya dilakukan uji organoleptik untuk analisis warna dengan metode Hedonik menggunakan 20 panelis.
Hasil uji organoleptik dengan metode Hedonik diperoleh nilai warna untuk F1 (0,5%) = 1,75, F2 (1%) = 4,45, F3 (1,25%) = 2,75 dan F4 (1,5%) = 2,30. Berdasarkan nilai warna yang diperoleh, F2 (1%) paling disukai panelis dan dinyatakan sebagai konsentrasi yang paling baik untuk pewarna tablet.
ISOLATION of GREEN COLOR SUBSTANCE of SWEET LEAF (Sauropus androgynus Merr.) as TABLETS DYE
Abstract
Natural dyes are natural colorants (pigments) obtained from plant, animal or mineral sources. The dye has been used since old times and are generally considered safer than synthetic dyes, such as annato as a source of natural yellow color for a variety of foods as well as carotene and chlorophyll. Chlorophyll produces the green color, obtained from the leaves, widely used for food. Currently, began to be used in a variety of health products. Chlorophyll pigment are numerous in leaves, e.g. suji leaf, pandanus leaf, sweet leaf and so forth.
Isolation of green color substances of sweet leaf (Sauropus androgynus Merr.) done by means of immersion method using 96% ethanol. Then the ethanol extract was fractionated with ethyl acetate. Green color substance of sweet leafs formulated as a dyes of tablets preparation by wet granulation method that made with four concentrations of 0.5%, 1%, 1.25%, 1.5%. Furthermore organoleptic test for color analysis were done by Hedonic method using 20 panelists.
The organoleptic test results by Hedonic method were obtained color values for F1 (0.5%) = 1.75, F2 (1%) = 4.45, F3 (1.25%) = 2.75, and F4 (1.5% ) = 2.30. Based on the color values obtained, F2 (1%) was the most preferred by panelists and expressed as the best concentration for tablets dye.
BAB I PENDAHULUAN
1.1Latar Belakang
Pewarna alami adalah zat warna alami (pigmen) yang diperoleh dari
tumbuhan, hewan, atau dari sumber-sumber mineral. Zat warna ini telah
digunakan sejak dahulu dan umumnya dianggap lebih aman daripada zat warna
sintetis, seperti annato sebagai sumber warna kuning alamiah bagi berbagai jenis
makanan begitu juga karoten dan klorofil. Pada daftar FDA, pewarna alami dan
pewarna identik alami tergolong dalam uncertified color additives karena tidak
memerlukan sertifikat kemurnian kimiawi. Klorofil memberikan warna hijau,
diperoleh dari daun dan banyak digunakan untuk makanan. Klorofil saat ini mulai
digunakan pada berbagai produk kesehatan. Pigmen klorofil banyak terdapat pada
dedaunan, misalnya daun suji, daun pandan, daun katuk dan sebagainya.
Dedaunan tersebut merupakan penghasil warna hijau untuk berbagai jenis kue
jajanan pasar. Selain menghasilkan warna hijau yang cantik, juga memiliki aroma
yang khas
Daun katuk (Sauropus androgynus Merr.) digunakan sebagai pewarna
alami yang dapat memberi warna hijau tanpa menimbulkan residu. Daun
tanaman katuk merupakan daun tunggal, karena hanya merupakan helaian dan
tangkai daun saja, mudah didapat dan sudah digunakan berbagai bahan makanan
antara lain pewarna hijau pada ketan dan lain-lain. Pemanfaatannya dengan
diekstrak atau ditumbuk dengan menambahkan air, kemudian filtratnya digunakan
untuk pewarna hijau pangan (Hardjanti, S., 2008) ).
Kebutuhan akan pewarna hijau selama ini terpenuhi dengan penggunan
pewarna sintetis. Pewarna sintetis seperti fast green FCF memiliki harga yang
mahal, sehingga perlu dilakukan penelitian terhadap bahan pewarna alami dari
bahan alam yang memiliki harga yang lebih murah dan pembuatannya sangat
mudah. Selain itu bahan pewarna alami juga dapat meningkatkan kesehatan
(Saati, E.A. dan Hidayat, N., 2006).
Sesuai dengan yang terdapat pada KOTRANAS bahwa sumber daya alam
bahan obat dan obat tradisional merupakan aset nasional yang perlu terus digali,
diteliti, dikembangkan dan dioptimalkan pemanfaatannya. Negara kita merupakan
suatu negara dengan wilayah yang mempunyai tingkat keanekaragaman hayati
yang tinggi, potensi sumber daya tumbuhan yang ada merupakan suatu aset
dengan nilai keunggulan komparatif dan sebagai modal dasar utama dalam upaya
pemanfaatan dan pengembangannya untuk menjadi komoditi yang kompetitif.
Daun katuk sangat mudah diperoleh karena tersedia dalam jumlah banyak,
sehingga pemanfaatan zat warna hijau katuk sebagai pewarna alami dapat
meningkatkan daya manfaat dari daun katuk. Pemanfaatan daun katuk ini sebagai
pewarna alami juga mendukung salah satu tujuan dari KOTRANAS yaitu
menjamin pengelolaan potensi alam Indonesia agar mempunyai daya saing tinggi
sebagai sumber ekonomi masyarakat dan devisa negara yang berkelanjutan karena
kita tidak lagi perlu mengimpor pewarna sintetis seperti fast green FCF (Menkes
RI, 2007).
Sediaan tablet merupakan jenis sediaan yang paling banyak diproduksi dan
juga banyak mengalami perkembangan dalam formulasinya. Beberapa
pengemasannya dan penggunaannya lebih praktis dibanding sediaan yang lain
(Lachman, dkk., 1994).
Pewarna dimasukkan dalam tablet pada umumnya untuk satu atau lebih
dari tiga tujuan. Pertama, pewarna dapat digunakan untuk memberi identitas pada
produk sehingga memudahkan identifikasi produk. Kedua, warna dapat membantu
meminimalkan kemungkinan kesimpangsiuran selama pembuatan. Ketiga,
penambahan pewarna pada tablet untuk nilai estetik atau nilai pemasarannya
(Siregar, C.J.P. dan Wikarsa, S., 2010).
Berdasarkan latar belakang di atas maka peneliti tertarik melakukan
penelitian terhadap zat warna hijau daun katuk (Sauropus androgynus Merr.)
sebagai pewarna tablet.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan masalah
dalam penelitian ini adalah :
1. Apakah hasil isolasi zat warna hijau dari daun katuk (Sauropus androgynus
Merr.
2. Berapa konsentrasi zat warna hijau dari daun katuk ( ) dapat digunakan sebagai pewarna sediaan tablet.
Sauropus androgynus
Merr.
1.3Hipotesis
) yang disukai untuk pewarna tablet.
1. Zat warna hijau yang diisolasi dari daun katuk (Sauropus androgynus
Merr.
2. Konsentrasi zat warna hijau yang diisolasi dari daun katuk ( ) dapat digunakan sebagai pewarna sediaan tablet.
1.4 Tujuan Penelitian
Tujuan penelitian adalah :
1. Untuk mengisolasi zat warna hijau daun katuk (Sauropus androgynus
Merr.
2. Untuk mengetahui konsentrasi zat warna hijau daun katuk ( ) yang dapat digunakan sebagai pewarna tablet.
Sauropus andogynus Merr.
1.5 Manfaat Penelitian
) yang disukai untuk pewarna tablet.
Manfaat penelitian adalah :
1. Diperoleh cara isolasi zat warna hijau daun katuk (Sauropus androgynus
Merr.
2. Diperoleh konsentrasi zat warna hijau daun katuk ( ).
Sauropus androgynus
BAB II
TINJAUAN PUSTAKA 2.1 Morfologi Tumbuhan
Tanaman katuk memiliki karakteristik antara lain : bentuk tanaman seperti
semak kecil dan bisa mencapai tinggi 3 m, batang muda berwarna hijau dan yang
tua berwarna coklat, daun tersusun selang-seling pada satu tangkai, seolah-olah
terdiri dari daun majemuk. Bentuk helaian daun lonjong sampai bundar,
kadang-kadang permukaan atasnya berwarna hijau gelap. Bunganya tunggal atau terdapat
diantara satu daun dengan daun lainnya. Bunga sempurna mempunyai helaian
kelopak berbentuk bulat telur sungsang atau bundar, berwarna merah gelap atau
merah dengan bintik-bintik kuning. Cabang dari tangkai putik berwarna merah,
tepi kelopak bunga berombak atau berkuncup enam, berbunga sepanjang tahun.
Buah bertangkai (Ditjen POM, 1989).
2.1.1 Sistematika Tumbuhan
Dalam taksonomi tumbuhan, katuk diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Sauropus
Spesies : Sauropus androgynus Merr. (Badan Penelitian dan Pengembangan
2.1.2 Sinonim Tumbuhan
Sauropus albicus Bl., S. indicus Wight., S. sumatranus Miq. ( Badan
Penelitian dan Pengembangan Kesehatan, 2001).
2.1.3 Nama Daerah
Memata (bahasa Melayu), katuk (Sunda), kebing dan katukan (Jawa),
karekur (Madura), simani (Minangkabau) (Azis,S. dan Muktiningsih S.R., 2006).
2.1.4 Kandungan Kimia
Daun katuk mengandung vitamin K, vitamin A, vitami B dan vitamin C.
Mineral yang dikandungnya adalah kalsium (hingga 2,8%), besi, kalium, fosfor
dan magnesium. Warna daunnya hijau gelap karena kadar klorofil yang tinggi
(Anonim 2, 2010).
Daun katuk juga mengandung protein, lemak, tanin, saponin flavonoid, dan
alkaloid (Anonim 3,2007).
2.1.5 Indikasi
Daun katuk dapat dimanfaatkan untuk memperbanyak air susu ibu, obat
jerawat, juga berkhasiat sebagai obat demam, obat bisul dan obat borok (Badan
Penelitian dan Pengembangan Kesehatan, 2001).
Daun katuk bisa juga dipakai sebagai pewarna alami pengganti pewarna
yang mengandung zat kimia. Contohnya pada industri tape ketan yang berwarna
hijau. Caranya, cuci bersih daun katuk, tambahkan sedikit air, lalu peras. Hasilnya
adalah sari daun katuk. Campur atau larutkan sari daun katuk bersama beras ketan
2.1.6 Pewarna Alami
Pewarna telah lama digunakan pada makanan untuk meningkatkan cita
rasanya. Pada mulanya zat warna yang digunakan adalah zat warna alami dari
tumbuhan dan hewan. Pewarna alami sebenarnya tidak semahal yang diperkirakan
masyarakat dan pembuatannya juga sangat mudah. Bahan-bahan yang dapat
digunakan sebagai pewarna ditumbuk, dapat pula menggunakan blender atau
penumbuk biasa dengan sedikit ditambah air, lalu diperas dan disaring dengan alat
penyaring (Saati, E.A. dan Hidayat, N., 2006).
Menurut Saati, E.A. dan Hidayat, N. (2006) beberapa contoh zat pewarna
alami yang biasa digunakan untuk mewarnai makanan yaitu :
Karoten, memberikan warna jingga sampai merah. Dapat diperoleh dari wortel,
papaya dan sebagainya.
Biksin, memberikan warna kuning seperti mentega. Biksin diperoleh dari biji
pohon Bixa orellana yang terdapat di daerah tropis.
Karamel, memberikan coklat gelap dan merupakan hasil dari hidrolisis
pemecahan karbohidrat, gula pasir, laktosa dan sirup malt.
Klorofil, memberikan warna hijau dan diperoleh dari daun. Banyak digunakan
untuk makanan dan saat ini mulai digunakan pada berbagai produk kesehatan.
Pigmen klorofil banyak terdapat pada dedaunan seperti daun suji, daun pandan,
daun katuk dan sebagainya. Dedaunan tersebut sebagai penghasil warna hijau
untuk berbagai jenis kue jajanan pasar. Selain menghasilkan warna hijau yang
cantik, juga memiliki aroma yang khas.
Antosianin, memberikan warna merah, oranye, ungu dan biru. Banyak
sepatu, bunga tasbih, anggur, buah apel, stroberi, buah manggis dan lain-lain.
Kurkumin, berasal dari kunyit sebagai salah satu bumbu dapur dan
memberikan warna kuning.
2.1.7 Klorofil
Klorofil adalah katalisator fotosintetis yang penting dan terdapat di alam
semesta sebagai pigmen hijau dalam semua jaringan tumbuhan berfotosintetis.
Zat ini terdapat dalam kloroplas dalam jumlah nisbi banyak, sering terikat longgar
dengan protein, tetapi mudah diekstraksi ke dalam pelarut lipid seperti aseton dan
eter. Di dalam tumbuhan terdapat sekurang-kurangnya lima klorofil. Klorofil a
dan klorofil b terdapat dalam tumbuhan tinggi, paku-pakuan dan lumut, klorofil c
sampai klorofil e hanya ditemukan dalam alga, sedangkan klorofil lain secara khas
hanya pada bakteri tertentu (Harbone, J.B., 1987)
2.1.8 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia
yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang
tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain.
Menurut Ditjen POM (2000), ada beberapa metode ekstraksi yang sering
digunakan dalam berbagai penelitian antara lain yaitu:
A. Cara dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
kinetik sedangkan yang dilakukan pengulangan panambahan pelarut setelah
dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru
sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
kamar. Proses perkolasi terdiri dari tahap pelembaman bahan, tahap perendaman
antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak)
terus-menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan.
B. Cara panas 1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50°C.
3. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
selalu baru, dilakukan dengan menggunakan alat soklet sehingga menjadi
4. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.2 Uraian Sediaan Tablet
Defenisi tablet menurut Farmakope Indonesia edisi III adalah sediaan
padat kompak, dibuat secara kempa cetak, dalam bentuk tabung pipih atau
sirkuler, kedua permukaannya rata atau cembung, mengandung satu jenis obat
atau lebih, dengan atau tanpa bahan tambahan. Bahan tambahan yang dapat
berfungsi sebagai bahan pengisi, bahan pengembang, bahan pengikat, bahan
pelicin, bahan pembasah atau bahan lain yang cocok.
Tablet merupakan jenis sediaan yang banyak digunakan sampai sekarang
karena memberikan dosis yang tepat pada pemakainnya, mudah pemakaiannya,
mudah pengemasannya, stabilitas kimia dan aktivitas fisiologi dari bahan-bahan
obat cukup baik (Banker G.S dan Anderson N.R., 1994).
Menurut Banker G.S dan Anderson N.R. (1994), tablet yang dinyatakan
baik harus memenuhi syarat, yaitu:
Memiliki kemampuan atau daya tahan terhadap pengaruh mekanis selama
proses produksi, pengemasan dan distribusi.
Bebas dari kerusakan seperti pecah pada permukaan dan sisi-sisi tablet.
Dapat menjamin kestabilan fisik maupun kimia dari zat berkhasiat yang
Dapat membebaskan zat berkhasiat dengan baik sehingga memberikan efek
pengobatan seperti yang dikehendaki
Tablet dapat didefenisikan sebagai bentuk sediaan solid yang mengandung
satu atau lebih zat aktif dengan atau tanpa berbagai eksipien (yang meningkatkan
mutu sediaan tablet, kelancaran sifat aliran bebas, sifat kohesivitas, kecepatan
disintegrasi, dan sifat antilekat) dan dibuat dengan mengempa campuran serbuk
dalam mesin tablet. Defenisi lain tablet kempa adalah unit bentuk sediaan solid
dibuat dengan mengempa suatu campuran serbuk yang mengandung zat aktif
dengan atau tanpa bahan tambahan atau bahan tertentu yang dipilih guna
membantu dalam proses pembuatan dan untuk menciptakan sifat-sifat sediaan
tablet yang dikehendaki (Siregar, C.J.P. dan Wikarsa, S., 2010).
Bentuk Tablet
Tablet terdapat dalam berbagai ragam bentuk, ukuran, bobot, kekerasan,
ketebalan, sifat disolusi dan disintegrasi dan dalam aspek lain, tergantung pada
penggunaan yang dimaksudkan dan metode penggunannya. Tablet biasanya
berbentuk bundar dengan permukaan datar, atau konveks. Bentuk khusus seperti
kaplet, segitiga, lonjong, empat segi dan segi enam (heksagonal) dikembangkan
oleh beberapa pabrik untuk membedakan produknya terhadap produk pabrik
lainnya. Tablet dapat dihasilkan dalam berbagai bentuk, dengan membuat punch
dan lubang kempa (lesung tablet) cetakan yang didesain secara khusus. Misalnya
jika punch kurang konkaf makin datar tablet yang dihasilkannya. Sebaliknya
Tablet dapat diberi monogram pada salah satu atau pada kedua permukaan
tablet tergantung keberadaan monogram pada punch bawah dan/atau punch atas
yang menghasilkan monogram.
Tablet adalah sediaan solid mengandung zat aktif yang dapat diberikan
secara oral dan ditelan, tablet yang hanya ditempatkan di dalam rongga mulut
tanpa ditelan, tablet oral yang dikunyah dulu lalu ditelan, atau hanya
dikulum/diisap (Siregar, C.J.P. dan Wikarsa, S., 2010).
Bahan Pewarna Obat
Pada dasarnya jenis bahan pewarna yang digunakan pada produk obat
adalah sama dengan jenis bahan pewarna yang digunakan pada makanan. Dengan
demikian semua jenis bahan pewarna yang diizinkan digunakan pada makanan,
diizinkan pula untuk digunakan dalam produk obat pada umumnya digunakan
untuk sediaan-sediaan sirup, tablet dan tablet salut.
Penggunaan bahan pewarna dalam obat konsentrasinya relatif sangat kecil
apabila dibandingkan penggunaannya dalam makanan. Di lain pihak penggunaan
obat itu sendiri mempunyai dosis dan aturan pakai yang tepat. Dengan demikian
bahan pewarna dalam obat yang dikonsumsi oleh manusia jumlahnya sangat kecil
dan hampir tidak berarti. Yang perlu diperhatikan adalah bahwa penggunaan
bahan pewarna harus dilakukan secara tepat, baik ditinjau dari aspek proses
teknologi produksi maupun dampak farmakologisnya (Anonim 4, 1984).
Zat warna ditambahkan dalam sediaan tablet untuk memperindah tablet,
membedakan dosis, spesifikasi dari pabrik, untuk memudahkan pengawasan
Zat warna yang dipakai harus memenuhi persyaratan Dirjen Pengawasan Obat dan
Makanan Departemen Kesehatan Republik Indonesia.
Ada 2 cara penambahan zat warna yaitu:
Cara Basah
Bahan warna dilarutkan dalam larutan bahan pengikat kemudian
ditambahkan ke dalam serbuk yang akan digranulasi.
Cara Kering
Bahan warna dicampurkan dalam keadaan kering ke dalam campuran
serbuk kemudian baru ditambahkan larutan bahan pengikat. Konsentrasi zat warna
yang biasa dipakai 0.33 % (Soekemi, R.A.dkk, 1987).
Metode Pembuatan Sediaan Tablet
Metode pembuatan tablet didasarkan pada sifat fisika kimia dari bahan
obat, seperti stabilitas dari bahan aktif dalam panas atau terhadap air, bentuk
partikel bahan aktif dan sebagainya.
Metode pembuatan sediaan tablet yaitu :
Cetak Langsung
Cetak langsung adalah pencetakan bahan obat atau campuran bahan obat
bahan pembantu tanpa proses pengolahan awal. Cara ini hanya dilakukan untuk
bahan-bahan tertentu saja yang berbentuk kristal/ butir-butir granul yang
mempunyai sifat-sifat yang diperlukan untuk membuat tablet yang baik.
Keuntungan utama dari cetak langsung ini adalah untuk bahan obat yang
peka lembab dan panas, dimana stabilitasnya terganggu akibat pekerjaan
granulasi, tetapi dapat dibuat menjadi tablet. Meskipun demikian hanya sedikit
ammonium klorida, kalium bromida, kalium klorida, natrium bromida, natrium
klorida dan heksamin (Voigt, R., 1995).
Granulasi Kering
Granulasi kering disebut juga slugging atau prekompresi. Cara ini sangat
tepat untuk tabletasi zat-zat yang peka suhu atau bahan obat yang tidak stabil
dengan adanya air.
Obat dan bahan pembantu pada mulanya dicetak dulu, artinya mula-mula
dibuat tablet yang cukup besar, yang massanya tidak tertentu. Selanjutnya terjadi
penghancuran tablet yang dilakukan dalam mesin penggranul kering, atau dalam
hal yang sederhana dilakukan di atas sebuah ayakan. Granulat yang dihasilkan
kemudian dicetak dengan takaran yang dikehendaki (Voigt, R., 1995).
Granulasi Basah
Pada teknik ini juga memerlukan langkah-langkah pengayakan,
penyampuran dan pengeringan. Pada granulasi basah, granul dibantuk dengan
suatu bahan pengikat. Teknik ini membutuhkan larutan, suspensi atau bubur yang
mengandung pengikat yang biasanya ditambahkan ke campuran serbuk.
Cara penambahan bahan pengikat tergantung pada kelarutannya dan
tergantung pada komponen campuran. Karena massa hanya sampai konsistensi
lembab bukan basah seperti pasta, maka bahan pengikat yang ditambahkan tidak
boleh berlebihan (Banker, G.S dan Anderson, N.R., 1994).
Pada proses pengayakan, mengubah massa lembab menjadi kasar,
gumpalan-gumpalan granul dengan melewatkan massa pada ayakan. Tujuannya
agar granul lebih kompak, meningkatkan luas permukaan untuk memudahkan
Proses pengeringan diperlukan oleh seluruh cara granulasi basah untuk
menghilangkan pelarut yang dipakai pada pembentukan gumpalan-gumpalan
granul dan untuk mengurangi kelembaban sampai pada tingkat yang optimum
(Banker, G.S dan Anderson, N.R., 1994).
2.3 Uji Penilaian Organoleptik 2.3.1 Uji Kesukaan
Uji kesukaan juga disebut uji hedonik. Dalam uji hedonik panelis
dimintakan tanggapan pribadinya tentang kesukaan atau sebaliknya
ketidaksukaan. Disamping panelis mengemukakan tanggapan senang, suka atau
kebalikannya, mereka juga mengemukakan tingkat kesukaannya.
Tingkat-tingkat kesukaan ini disebut skala hedonik. Misalnya dalam hal
“suka”, dapat mempunyai skala hedonik seperti: amat sangat, sangat suka, suka,
agak suka. Sebaliknya jika tanggapan itu “tidak suka”, dapat mempunyai skala
hedonik seperti: amat tidak suka, sangat tidak suka, tidak suka, agak tidak suka.
Skala hedonik dapat direntangkan atau diciutkan menurut rentangan skala yang
dikehendaki.
Dalam penganalisaan, skala hedonik ditransformasikan menjadi skala
numerik dengan angka menaik menurut tingkat kesukaan. Dengan data numerik
ini dapat dilakukan analisa-analisa statistik (Soekarto, 1985).
2.3.2 Panel
Untuk melaksanakan suatu penilaian organoleptik diperlukan panel yang
bertindak sebagai instrumen atau alat. Panel adalah satu atau kelompok orang
yang bertugas untuk menilai sifat atau mutu benda berdasarkan kesan subjektif.
Dalam penilaian organoleptik dikenal ada macam-macam jenis panel.
Penggunaan panel-panel ini dapat berbeda tergantung dari tujuan (Soekarto,
1985).
Menurut Soekarto (1985) ada 6 macam panel yang biasa digunakan dalam
1. penilaian organoleptik yaitu:
2. panel pencicip perorangan (individual expert panel)
3. panel pencicip terbatas (small expert panel)
4. panel terlatih (trained panel)
5. panel agak terlatih
6. panel tak terlatih (untrained panel)
BAB III
METODE PENELITIAN
Jenis penelitian ini adalah penelitian eksperimental. Metode penelitian ini
meliputi pengumpulan dan pengolahan sampel, pemeriksaan mikroskopik dan
makroskopik, determinasi tumbuhan, isolasi zat warna, pembuatan sediaan tablet.
Penelitian ini dilakukan di Laboratorium Obat Tradisional dan Laboratorium
Teknologi Sediaan Solid Fakultas Farmasi USU Medan.
3.1 Alat-Alat Yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah blender, oven, neraca
kasar, neraca analitik, corong pisah, cawan porselen berdasar rata, desikator,
mesin cetak tablet single punch, Strong cobb hardness tester (Erweka), Roche
friabilator (Erweka), stopwatch, termometer, mortir, stamper, lemari pengering, hair dryer, ayakan, cawan porselen, lampu spiritus dan beaker glass.
3.2 Bahan-Bahan Yang Digunakan
Bahan-bahan yang digunakan pada penelitian ini adalah daun katuk, etil
asetat, akuades, amilum manihot, talkum, Mg stearat, laktosa, gelatin, Aluminium
hidroksida dan Magnesium oksida.
3.3 Pengumpulan dan Pengolahan Sampel 3.3.1 Pengumpulan Sampel
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa
membandingkan dengan daerah lain. Bahan penelitian ini adalah daun katuk yang
tua (Sauropus androgynus Merr. ). Lokasi pengambilan sampel yaitu Jln. Setia
3.3.2 Pengolahan Sampel
Daun katuk (Sauropus androgynus Merr.) yang digunakan adalah daun
yang sudah tua dan segar, dicuci, ditiriskan, disortasi dan ditimbang.
3.3.3 Determinasi Tumbuhan
Determinasi dilakukan di Herbarium Bogoriense, Bidang Botani Pusat
Penelitian Biologi-LIPI. Hasil dapat dilihat pada lampiran 1 di halaman 43.
3.4 Pemeriksaan Sampel
Pemeriksaan sampel meliputi pemeriksaan makroskopik dan mikroskopik.
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati morfologi daun
katuk segar (Sauropus androgynus Merr.) dengan cara memperhatikan warna,
bentuk, ukuran, dan tekstur daun katuk segar.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap penampang melintang daun
katuk segar, masing-masing diletakkan di atas kaca objek yang telah ditetesi
dengan larutan kloralhidrat, dipanaskan di atas lampu spiritus, kemudian ditutup
3.5 Isolasi Zat Warna dari Daun Datuk
Pelarut yang digunakan untuk isolasi zat warna daun katuk adalah etanol
96%. Cara: sebanyak 2,8 kg daun katuk segar, dirajang halus, kemudian ditumbuk
sampai halus dengan alu dan lumpang. Sampel dimasukkan ke dalam stoples kaca.
Ditambahkan etanol 96% sebanyak 7,5 liter sehingga semua sampel terendam.
Disimpan di tempat yang terlindung cahaya selama 5 hari sambil sekali-sekali
diaduk. Kemudian disaring dengan kertas saring, filtrat ditampung. diperoleh
ekstrak etanol sebanyak 7 liter. Kemudian ekstrak etanol difraksinasi dengan etil
asetat dengan perbandingan 1 : 1, yaitu dengan cara sebanyak 100 ml ekstrak
etanol dimasukkan ke dalam corong pisah 500 ml, ditambah 200 ml akuades,
kemudian ditambah 100 ml etil asetat ekstrak etanol dimasukkan ke dalam corong
pisah, dikocok, terbentuk dua lapisan yaitu lapisan etil asetat dan lapisan
air-etanol. Lapisan air-etanol dibuang, kemudian lapisan etil asetat ditampung ke
dalam botol. Fraksi etil asetat dimasukkan ke dalam cawan penguap, kemudian
dikeringkan menggunakan hair dryer sampai kental. Ditimbang zat warna yang
3.6 Pembuatan Tablet 3.6.1 Formula Plasebo
Formula plasebo terdiri dari:
R/ Zat warna daun katuk x
Gelatin 10 % q.s
Amilum manihot 5 %
Talkum 1 %
Mg stearat 1 %
Laktosa q.s ad 300 mg
m.f tab dtd No C
Keterangan : x = 0,5%; 1%; 1,25%; 1,5%
3.6.2 Pembuatan Tablet Plasebo dari Zat Warna Daun Katuk
Pembuatan tablet plasebo dari zat warna daun katuk dilakukan dengan
cara:
1. Sebanyak 150 mg zat warna daun katuk dilarutkan dalam etanol
secukupnya, kemudian digerus bersama dengan laktosa dan setengah
bagian amilum manihot sampai warna homogen, terbentuk massa basah.
Dibiarkan sampai massa basah kering (Massa 1).
2. Pembuatan gelatin 10 % yaitu:
Cawan porselen dan batang pengaduk ditara, gelatin digerus dan diayak
dengan ayakan mesh 200, ditimbang berat gelatin sebanyak 600 mg, lalu
disuspensikan dengan sedikit akuades, selanjutnya dipanaskan pada api
langsung sambil diaduk-aduk hingga diperoleh massa transparan
akuades panas sedangkan kelebihan berat diuapkan kembali dan ditimbang
lagi beratnya hingga diperoleh massa gelatin sebanyak 6 g (Massa 2).
3. Massa 2 ditambahkan sedikit demi sedikit dengan massa 1, sambil digerus
hingga diperoleh massa yang kompak, lalu digranulasi dengan ayakan
mesh 12.
4. Granulat dikeringkan pada suhu 40-60 °C pada lemari pengering.
5. Setelah kering, granulat diayak lagi dengan ayakan mesh 14 dan dicek
kembali beratnya.
6. Dihitung, ditimbang dan ditambahkan magnesium stearat, talkum, dan
bahan pengembang luar.
7. Massa granul diuji preformulasi dan dicetak menjadi tablet dengan
[image:36.595.113.510.443.691.2]diameter 11 mm.
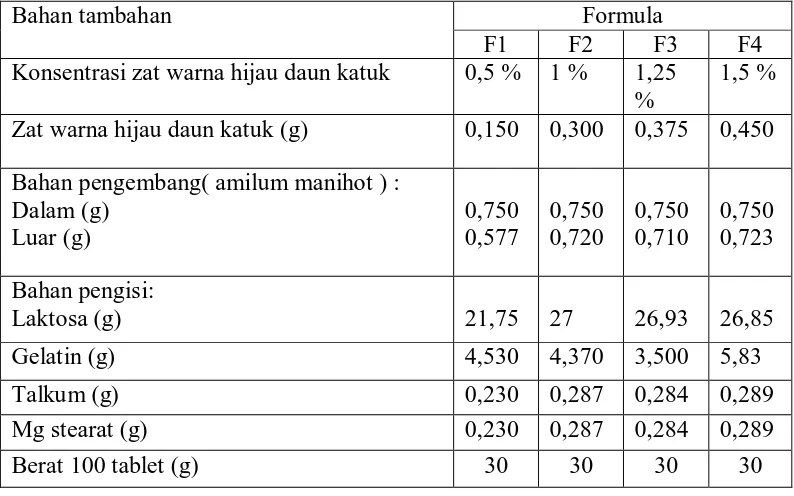
Tabel 1. Formula tablet plasebo
Bahan tambahan Formula
F1 F2 F3 F4
Konsentrasi zat warna hijau daun katuk 0,5 % 1 % 1,25 %
1,5 %
Zat warna hijau daun katuk (g) 0,150 0,300 0,375 0,450
Bahan pengembang( amilum manihot ) : Dalam (g) Luar (g) 0,750 0,577 0,750 0,720 0,750 0,710 0,750 0,723 Bahan pengisi:
Laktosa (g) 21,75 27 26,93 26,85
Gelatin (g) 4,530 4,370 3,500 5,83
Talkum (g) 0,230 0,287 0,284 0,289
Mg stearat (g) 0,230 0,287 0,284 0,289
3.7 Uji Organoleptik Warna
Uji organoleptik warna dilakukan dengan metode Hedonik (Soekarto,
1985), yaitu dengan melakukan analisis menurut uji kesukaan (warna)
menggunakan 20 orang panelis yang disuguhi contoh tablet placebo dengan 4
macam konsentrasi untuk diamati warnanya. Untuk melihat tingkat perbandingan
[image:37.595.112.514.277.474.2]warna, dilakukan skorsing pada tabel.
Tabel 2. Skala uji Hedonik untuk penentuan organoleptik warna
Skala Hedonik Skala numerik
Amat suka
Sangat suka
Agak suka
Netral
Agak tidak suka
Sangat tidak suka
5 4 3 2 1 0
Tabel 3. Perlakuan konsentrasi zat warna
Perlakuan Konsentrasi zat warna (%)
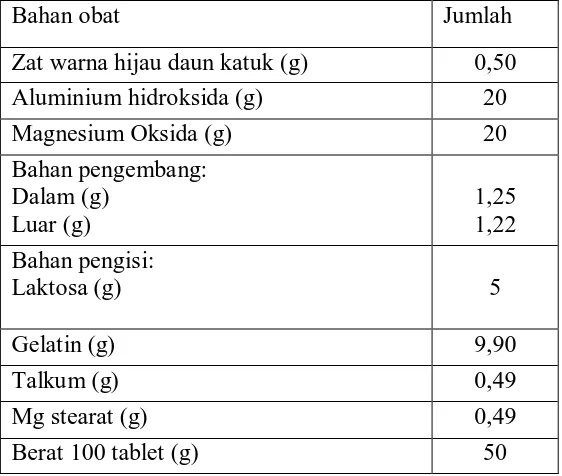
[image:37.595.115.509.527.668.2]3.8 Formula Bahan Obat
R/ Zat warna daun katuk 1 %
Magnesium oksida 200 mg
Aluminium hidroksida 200 mg
Gelatin 10% q.s
Amilum manihot 5 %
Talkum 1 %
Mg stearat 1 %
Laktosa q.s ad 500 mg
m.f. tab dtd No C
Pada penelitian ini digunakan dua bahan obat berkhasiat yaitu Magnesium oksida
dan Aluminium hidroksida.
3.8.1 Pembuatan Tablet Antasida dari Zat Warna Daun Katuk
Pembuatan tablet dari zat warna daun katuk dilakukan dengan cara:
1. 500 mg zat warna daun katuk dilarutkan dalam etanol secukupnya,
kemudian digerus bersama dengan laktosa dan setengah bagian amilum
manihot sampai warna homogen, terbentuk massa basah. Dibiarkan sampai
massa basah kering (Massa 1).
2. Pembuatan gelatin 10 % yaitu:
Cawan porselen dan batang pengaduk ditara, gelatin digerus dan diayak
dengan ayakan mesh 200, ditimbang berat gelatin digerus dan diayak
dengan ayakan mesh 200, ditimbang berat gelatin sebanyak 1 g, lalu
disuspensikan dengan sedikit akuades, selanjutnya dipanaskan pada api
langsung sambil diaduk-aduk hingga diperoleh massa transparan
ditambahkan akuades panas sedangkan kelebihan berat diuapkan kembali
dan ditimbang lagi beratnya hingga diperoleh massa gelatin sebanyak 10 g
(Massa 2).
3. Massa 2 ditambahkan sedikit demi sedikit dengan massa 1, sambil digerus
hingga diperoleh massa yang kompak, lalu digranulasi dengan ayakan mesh
12.
4. Granulat dikeringkan pada suhu 40-60 °C pada lemari pengering.
5. Setelah kering, granulat diayak lagi dengan ayakan mesh 14 dan dicek
kembali beratnya.
6. Dihitung, ditimbang dan ditambahkan magnesium stearat, talkum, dan
bahan pengembang luar.
7. Massa granul diuji preformulasi dan dicetak menjadi tablet dengan
[image:39.595.113.394.471.709.2]diameter 11 mm.
Tabel 4. Formula tablet dengan bahan obat
Bahan obat Jumlah
Zat warna hijau daun katuk (g) 0,50
Aluminium hidroksida (g) 20
Magnesium Oksida (g) 20
Bahan pengembang: Dalam (g)
Luar (g)
1,25 1,22 Bahan pengisi:
Laktosa (g) 5
Gelatin (g) 9,90
Talkum (g) 0,49
Mg stearat (g) 0,49
3.9 Uji Preformulasi
Uji preformulasi yang dilakukan adalah penentuan sudut diam granul,
penentuan waktu alir granul, penentuan indeks tap.
3.9.1 Sudut Diam Granul
Penentuan sudut diam granul dilakukan dengan cara:
Ditimbang 100 g granul kemudian dimasukkan ke dalam corong alir yang
telah dirangkai, permukaan granul diratakan, lalu penutup corong dibuka,
sehingga granul mengalir sampai habis. Tinggi tumpukan granul yang terbentuk
diukur. Sudut diam dapat dihitung dengan menggunakan rumus:
Tg θ = D
H 2
θ = sudut diam
H = tinggi tumpukan granul (cm)
D = diameter tumpukan granul (cm)
Granul yang mempunyai daya alir bebas akan mempunyai sudut diam antara 30°
sampai 40°. (Banker G.S dan Anderson N.R., 1994).
3.9.2 Penentuan Waktu Alir Granul
Penentuan waktu granul dilakukan dengan cara:
Ditimbang 100 g granul, kemudian dimasukkan ke dalam corong yang
telah dirangkai kemudian permukaanya diratakan. Penutup bawah dibuka
bersamaan dengan dihidupkan stopwatch. Stopwatch dihentikan tepat pada saat
garnul habis melewati corong dan dicatat waktu alirnya. Syarat waktu alir granul
3.9.3 Penentuan Indeks Tap
Penentuan indeks tap dilakukan dengan cara:
Dimasukkan granul ke dalam gelas ukur sampai garis tanda dan
dinyatakan sebagai volume awalnya (V1), kemudian gelas ukur dihentakkan
sebanyak 20 kali dengan alat yang dimodifikasi sehingga diperoleh volume akhir
(V2
Indeks Tap
). Indeks tap dapat dihitung dengan rumus:
x 100%
Syarat indeks tap lebih kecil dari 20 % (Voigt, 1995).
3.10 Proses Pencetakan Tablet
Proses pencetakan tablet yaitu massa granul dicetak menjadi tablet dengan
diameter penampang 11 mm dan 13 mm.
3.11 Evaluasi Tablet
Evaluasi tablet yang dilakukan adalah keseragaman bobot, kekerasan
tablet, friabilitas, dan waktu hancur.
3.11.1 Keseragaman Bobot
Penetapan keseragaman bobot dilakukan dengan cara:
Ditimbang 20 tablet, hitung bobot rata-rata tiap tablet, lalu ditimbang
tablet satu per satu.
Deviasi x 100%
Tabel 5. Persyaratan keseragaman bobot
Bobot rata-rata Penyimpangan terhadap bobot rata-rata
A B
151 mg sampai 300 mg Lebih dari 300 mg
7,5% 5%
15 % 10 %
Persyaratan tidak boleh lebih dari 2 tablet yang masing-masing bobotnya
menyimpang dari bobot rata-rata dari harga yang ditetapkan pada kolom A dan
tidak boleh 1 tablet yang menyimpang dari bobot rata-rata dari harga yang
ditetapkan pada kolom B (Ditjen POM, 1979).
3.11.2 Kekerasan Tablet
Penetapan kekerasan tablet menggunakan alat Strong cobb hardness tester.
Cara: sebuah tablet diletakkan antara anvil dan punch tegak lurus, tablet dijepit
dengan cara memutar skrup pemutar sampai lampu stop menyala. Knop ditekan,
dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet pecah.
Percobaan ini dilakukan untuk 5 tablet. Syarat kekerasan tablet 4 kg – 8 kg
(Parrott, 1971).
3.11.3 Friabilitas
Penetapan friabilitas tablet menggunakan alat Roche friabilator. Cara:
ditimbang 20 tablet yang telah dibersihkan dari debu (A) dimasukkan ke dalam
alat dan diputar selama 4 menit. Tablet dikeluarkan dan dibersihkan dari debu
kemudian ditimbang (B), kehilangan bobot tidak lebih dari 0,8 % (Banker G.S
dan Anderson N.R., 1994).Friabilitas dapat dihitung dengan rumus:
Friabilitas = x 100%
3.11.4 Waktu Hancur
Penetapan waktu hancur tablet menggunakan alat Disintegration tester.
Alat ini terdiri dari suatu rangkaian keranjang, gelas piala berukuran 1000 ml
thermostat dengan suhu 36-38°C dan alat untuk menaik turunkan keranjang
dengan frekuensi 30 kali per menit.
Cara : Masukkan 5 tablet ke dalam keranjang , turun naikkan keranjang secara
teratur 30 kali tiap menit. Tablet dinyatakan hancur jika tidak ada bagian tablet
yang tertinggal di atas kasa. Waktu yang diperlukan untuk menghancurkan kelima
tablet tidak lebih dari 15 menit. Jika tablet tidak memenuhi syarat ini, ulangi
pengujian menggunakan tablet satu persatu kemudian ulangi percobaan
menggunakan 5 tablet dengan cakram penuntun. Dengan cara ini harus dipenuhi
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi Pusat Penelitian Biologi-LIPI terhadap sampel yang
diteliti adalah jenis Sauropus androgynus Merr.
Hasil pemeriksaan makroskopik daun segar diperoleh identitas daun
tunggal, bertangkai, ujung dan pangkal daun meruncing, pinggir daun rata;
permukaan atas dan bawah rata, licin,warna hijau sampai hijau kecoklatan, tidak
berambut; tulang daun jelas menonjol pada permukaan bawah.
Hasil pemeriksaan mikroskopik pada penampang melintang melalui tulang
daun, tampak epidermis atas terdiri dari satu lapis sel yang berbentuk segi empat,
dinding tipis, kutikula tipis; sel epidermis bawah serupa dengan sel epidermis
atas, terdapat banyak stomata pada epidermis bawah. Terdapat kristal oksalat
berbentuk roset, jaringan bunga karang dan berkas pembuluh.
Pemeriksaan mikroskopik serbuk tidak dilakukan karena yang digunakan dalam
penelitian adalah daun katuk segar.
Hasil penyarian 2,8 kg daun katuk segar dengan menggunakan pelarut etil
asetat diperoleh zat warna hijau sebanyak 5,3 g dengan rendemen 0,19 %.
Berdasarkan orientasi yang dilakukan diperoleh hasil bahwa penyarian
dengan etanol 96% menghasilkan ekstrak yang lebih pekat, perendaman selama 5
hari memberikan hasil yang paling baik karena zat warna tersari dengan maksimal
dan pengeringan dilakukan dengan menggunakan hair dryer karena fraksi etil
kuning kecoklatan ketika diuapkan dengan penangas air ataupun dengan rotary
evaporator, sehingga dipilih pengeringan dengan menggunakan hair dryer.
Pada proses formulasi sediaan tablet plasebo dari zat warna hijau daun
katuk yang berasal dari bahan alam digunakan empat konsentrasi yaitu 0,5%, 1%,
1,25% dan 1,5%. Konsentrasi dipilih sampai konsentrasi 1,5% karena pada
konsentrasi 1,5%, warna tablet sudah cukup pekat dan melebihi warna tablet hijau
di pasaran. Sedangkan bahan pengisi yang digunakan adalah laktosa. Metode yang
digunakan adalah metode granulasi basah. Penambahan zat warna dilakukan
secara kering karena distribusi warna homogen.
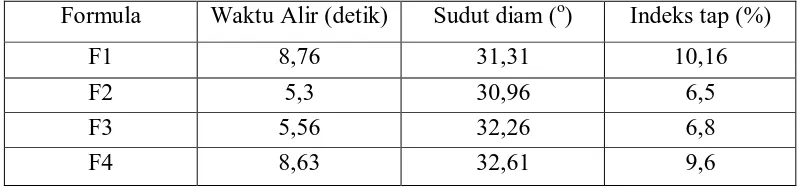
Hasil uji preformulasi keempat formula plasebo dengan konsentrasi
berbeda yaitu waktu alir, indeks tap, sudut diam memenuhi persyaratan. Hasil
[image:45.595.111.513.443.538.2]waktu alir, indeks tap, sudut diam dapat dilihat pada tabel berikut.
Tabel 6. Uji preformulasi formula plasebo
Formula Waktu Alir (detik) Sudut diam (o) Indeks tap (%)
F1 8,76 31,31 10,16
F2 5,3 30,96 6,5
F3 5,56 32,26 6,8
F4 8,63 32,61 9,6
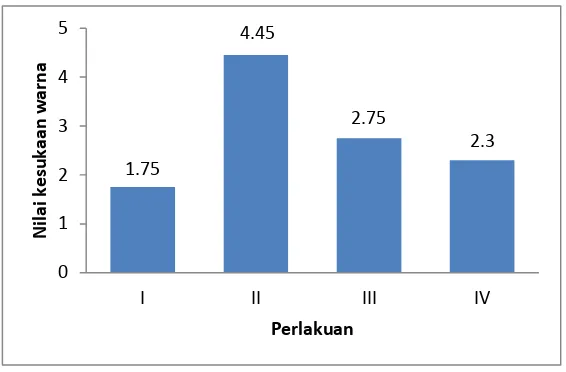
Data tentang nilai kesukaan warna terhadap keempat perlakuan dapat
1.75 4.45 2.75 2.3 0 1 2 3 4 5
I II III IV
[image:46.595.171.454.86.272.2]N il a i k e s u k a a n w a r n a Perlakuan
Gambar 1. Histogram perlakuan terhadap nilai kesukaan warna
Dari gambar di atas dapat dilihat bahwa nilai kesukaan warna yang paling
tinggi terdapat pada yaitu pada F2 (konsentrasi 1%) dibandingkan dengan F1
(konsentrasi 0,5%), F2 (konsentrasi 1,25%) dan F3 (konsentrasi 1,5%). Hal ini
menunjukkan bahwa F2 (konsentrasi 1%) menghasilkan warna yang lebih baik
dan disukai panelis. Data lengkap dapat dilihat pada lampiran 8 pada halaman 63.
Hasil analisis statistik dari data uji organoleptik terhadap warna tablet
plasebo secara umum menunjukkan perbedaan yang nyata (signifikan) menurut analisis sidik ragam pada taraf α = 0,05, dimana nilai F hitung = 44,55 lebih besar
dari F tabel = 2,75 , sehingga nilai Ho ditolak. Selanjutnya dilakukan uji beda nyata terkecil (BNT) pada taraf α = 0,05. Nilai BNT 0,05 yang diperoleh 0,0859.
Dari data tersebut disimpulkan bahwa F2 (konsentrasi 1%) merupakan
konsentrasi pewarna yang memberikan warna yang paling baik dan paling disukai
panelis, sehingga konsentrasi ini dipilih sebagai pewarna tablet antasida.
Hasil uji preformulasi keempat formula dengan pewarna daun katuk dapat
Gambar 2. Histogram waktu alir massa granul
Dari gambar 2 dapat dilihat bahwa keempat formula memenuhi
persyaratan waktu alir. F2 memiliki waktu alir yang paling baik diantara keempat
formula.
Gambar 3. Histogram sudut diam massa granul
Pada gambar 3 dapat dilihat sudut diam dari ketiga formula tersebut
memenuhi persyaratan sudut diam. Banker G. S dan Anderson N. R (1994)
menyatakan bila sudut diam lebih kecil sama dengan 30o biasanya bahwa bahan
dapat mengalir bebas, bila sudut lebih besar atau sama dengan 40o biasanya daya
[image:47.595.157.466.378.562.2]Gambar 4. Histogram indeks tap massa granul
Semakin kecil nilai dari indeks tap granul maka penyusutan volume yang
terjadi akan tinggi. Dari gambar 4 diperoleh nilai indeks tap yang bervariasi, tetapi
masih memenuhi persyaratan indeks tap yaitu lebih kecil dari 20% (Voight, 1995).
Hal ini disebabkan jumlah bahan pengikat yang digunakan pada tiap formula
berbeda sehingga menghasilkan konsistensi granul basah yang berbeda, sehingga
diperoleh granul yang berbeda pada keempat formula.
Evaluasi tablet meliputi keseragaman bobot, kekerasan tablet, friabilitas
tablet dan waktu hancur tablet. Data dapat dilihat pada histogram di bawah ini
evaluasi keempat tablet plasebo tersebut dapat dilihat pada histogram di bawah
Gambar 5. Histogram kekerasan tablet plasebo
Keempat formula tablet plasebo ini mempunyai kekerasan yang berbeda
tetapi masih memenuhi persyaratan yaitu 4-8 kg. Menurut Siregar(2010)
kekerasan tergantung pada bobot bahan dan celah antara pons atas dan pons
bawah pada waktu pengempaan. Jika volume bahan atau jarak antara pons
bervariasi, kekerasan juga bervariasi.
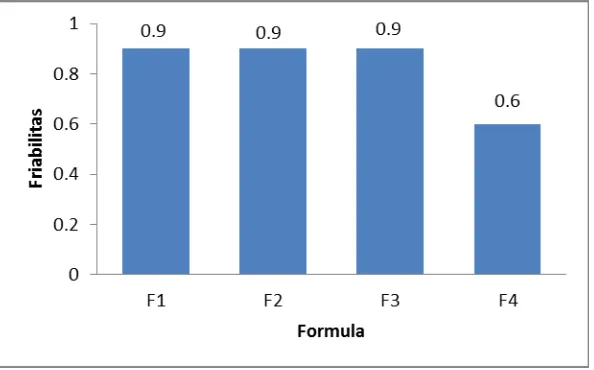
[image:49.595.165.462.490.675.2]Pada gambar 6 terlihat bahwa hasil friabilitas tidak memenuhi persyaratan
yaitu 0,9 %. Hal ini disebabkan oleh karena tablet mudah mengalami sumbing dan
retak. Penyebab dari sumbing dan retak dapat disebabkan oleh kerusakan pada
punch dan die. Menurut Siregar (2010) menjelaskan bahwa persyaratan friabilitas
yaitu maksimal 1% untuk tablet konvensional.
Keseragaman bobot ketiga formula ini memenuhi persyaratan Farmakope
Indonesia. Dimana tidak lebih dari 2 tablet yang masing-masing bobotnya
menyimpang dari bobot rata-rata dari harga yang ditetapkan pada kolom A (5%)
dan tidak ada 1 tablet yang menyimpang dari bobot rata-rata dari harga yang
[image:50.595.115.512.386.674.2]ditetapkan pada kolom B (10%).
Dari histogram di atas dapat dilihat bahwa keempat formula memenuhi
persyaratan waktu hancur pada Farmakope Indonesia yaitu tidak lebih dari 15
menit untuk tablet dengan cakram dan tidak lebih dari 30 menit untuk tablet tanpa
cakram.
Hasil preformulasi untuk tablet antasida yaitu sudut diam, waktu alir dan
[image:51.595.167.462.249.399.2]indeks tap dapat dilihat pada histogram berikut.
Gambar 8. Histogram uji preformulasi granul antasida
Dari histogram di atas dapat dilihat bahwa waktu alir granul antasida
memenuhi persyaratan yaitu < 10 detik. Sudut diam granul antasida juga
memenuhi persyaratan. Menurut Banker G. S dan Anderson N. R (1994)
menyatakan granul yang mempunyai daya alir bebas akan mempunyai sudut diam
antara 30° sampai 40°. Begitu juga dengan indeks tap memenuhi persyaratan yaitu
lebih kecil dari 20% (Voight, 1995).
Hasil uji evaluasi tablet yaitu keseragaman bobot, kekerasan, waktu
hancur, dan friabilitas. Keseragaman bobot ketiga formula ini memenuhi
persyaratan Farmakope Indonesia Edisi III, dimana tidak lebih dari 2 tablet yang
ditetapkan pada kolom A (5%) dan tidak ada 1 tablet yang menyimpang dari
bobot rata-rata dari harga yang ditetapkan pada kolom B (10%).
Dari evaluasi tablet diperoleh bahwa kekerasan tablet antasida memenuhi
persyaratan yaitu antara 4-8 kg. Menurut Siregar (2010) untuk tablet kunyah
hendaknya cukup keras agar tahan terhadap pengemasan dan pengiriman, tetapi
tidak terlalu keras sehingga menimbulkan kesulitan yang tidak semestinya pada
waktu dikunyah.
Sedangkan friabilitas dari tablet antasida tidak memenuhi persyaratan yaitu lebih
kecil dari 0,8%. Menurut Siregar (2010) bahwa untuk tablet kunyah nilai
friabilitas tablet sampai 4% dapat diterima.
Untuk evaluasi waktu hancur tablet antasida dilihat pada histogram di
[image:52.595.188.435.413.622.2]bawah ini.
Dari histogram di atas dapat dilihat bahwa tablet antasida tidak memenuhi
persyaratan waktu hancur menurut Farmakope Indonesia Ed.III yaitu tidak lebih
dari 15 menit untuk tablet dengan cakram dan tidak lebih dari 30 menit untuk
tablet tanpa cakram.
Hal ini disebabkan oleh karena sifat dari bahan obat yaitu Magnesium oksida dan
Aluminium hidroksida yang praktis tidak larut dalam air, sehingga air sukar
masuk ke dalam tablet.
Menurut Siregar (2010) pengujian waktu hancur tidak tepat untuk tablet kunyah
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Zat warna hijau daun katuk (Sauropus androgynus Merr.) yang diisolasi dapat
digunakan sebagai pewarna tablet.
2. Konsentrasi zat warna hijau daun katuk (Sauropus androgynus Merr.) yang
disukai sebagai pewarna tablet adalah konsentrasi 1%.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk menguji stabilitas warna
tablet sehingga dapat dilihat stabilitas zat warna hijau daun katuk sebagai pewarna
DAFTAR PUSTAKA
Anonim 1. (2009). Pewarna Alami dan Sintetis. Tanggal diakses : 2 April 2010. http ://apertiwi. blogspot.com/2009/05/ pewarna-alami.html
Anonim 2. (2010). Katuk. Tanggal diakses : 2 April
.
Anonim 3 . (2007). Tanaman Katuk Gampang Ditanam Banyak Gunanya. Tanggal diakses : 2 April 2010
Anonim 4. (1984). Bahan Pewarna, Bahan Pengawet, dan Bahan Tambahan
dalam Makanan, Obat dan Kosmetika. Publishing Sains dan Teknologi
Lembaga Penelitian USU. Medan. Hal. 32.
Azis, S. dan Muktiningsih, S.R. (2006). Studi Manfaat Daun Katuk (Sauropus
androgynus). Cermin Dunia Kedokteran No. 151. hal. 48.
Badan Penelitian dan Pengembangan Kesehatan, (2001). Inventaris Tanaman
Obat Indonesia. Jilid II. Depkes dan Kesejahteraan RI. hal. 303.
Banker, G. S dan Anderson N. R. (1994). Tablet. Editor: Lahman, L. Teori dan Praktek Farmasi Industri. Edisi III. Jilid II. Penerjemah : Suyatmi,S.UI-Press. Jakarta. hal. 643-703.
Ditjen POM, (1979). Farmakope Indonesia. Edisi Ketiga. Departemen Kesehatan RI. Jakarta. hal. 6-7.
Ditjen POM, (1989). Vademekum Bahan Obat Alam . Depatemen Kesehatan RI. Jakarta.
Ditjen POM, (1989). Materia Medika Indonesia. Jilid V. Departemen Kesehatan RI. Jakarta. hal. 513-522, 538-540.
Ditjen POM, (2000). Parameter Standar Umum Ekstrak Tanaman. Cetakan Pertama. Departemen Kesehatan RI. Jakarta. hal. 1, 9-12.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa
Tumbuhan. Terjemahan K. Padmawinata. Edisi II. Bandung: ITB Press.
hal. 259-260.
Hardjanti, S. (2008). Potensi Daun Katuk sebagai Sumber Zat Pewarna Alami
Lachman, L., Lieberman, H.A., Kanig, J.L. (1994). Teori dan Praktek Farmasi
Industri. Edisi Ketiga. Jakarta: UI Press. hal. 654.
Menkes RI, (2007). Kebijakan Obat Tradisional Nasional. Departemen Kesehatan RI. Jakarta. hal. 2-4.
Parrot, L. (1971). Pharmaceutical Technology. Burges Publishing Company. United Stated of America. Page 82.
Saati, E.A. dan Hidayat, N., (2006). Membuat Pewarna Alami. Cetakan I. Trubus Agrisana. hal. 5-10.
Siregar, Charles J.P. dan Wikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet
Dasar-Dasar Praktis. Cetakan II. Penerbit Buku Kedokteran EGC.
Jakarta. Hal. 1-2, 8, 416- 418.
Soekarto, Soewarna, T. (1985). Penilaian Organoleptik untuk Industri Pangan
dan Hasil Pertanian. Bhatara Aksara. Jakarta. Hal. 57.
Soekemi, R. A. Yuanita, T. Fat Aminah, Salim Usman. (1987). Tablet. Mayang Kencana. Hal. 18-19.
Lampiran 2. Morfologi Daun , Makroskopik dan Mikroskopik Tumbuhan
[image:58.595.162.460.164.415.2]Gambar Tumbuhan Daun Katuk (Sauropus androgynus Merr.)
Gambar Mikroskopik Penampang Melintang Daun Katuk (Sauropus androgynus Merr.) Perbesaran 10 x 10
1
2
3
4
5
6
7
8
9
Keterangan:
1. Kutikula
2. Epidermis atas
3. Palisade
4. Jaringan bunga karang
5. Stomata
6. Berkas pembuluh
7. Serabut
8. Hablur kalsium oksalat
Lampiran 4. Sediaan Tablet Antasida dengan Zat Warna Hijau Daun Katuk (Sauropus androgynus Merr.) Konsentrasi 1%
Keterangan:
A = tablet antasida
B = contoh tablet dalam pasaran (tablet antasida doen)
Lampiran 5. Hasil Uji Preformulasi
Tabel 7. Hasil uji preformulasi granul plasebo
Formula Waktu Alir (detik) Sudut diam (o) Indeks tap (%)
F1 8,76 31,31 10,16
F2 5,3 30,96 6,5
F3 5,56 32,26 6,8
[image:61.595.243.381.127.229.2]F4 8,63 32,61 9,6
Tabel 8. Hasil uji preformulasi granul antasida
Keterangan Waktu alir (detik) Sudut diam (o) Indeks tap (%)
Lampiran 6. Hasil Evaluasi Tablet
Tabel 9. Hasil keseragaman bobot tablet plasebo
Keterangan F1 F2 F3 F4
Bobot rata-rata (mg) 301 313,5 309,5 293,5
A1 (%) 2,31 2,38 3,07 1,92
A2 (%) 2,09 1,37 1,09 1,56
[image:62.595.113.385.295.386.2]B1 (%) 2,31 2,38 3,07 1,91
Tabel 10. Hasil keseragaman bobot tablet antasida
Keterangan Formula antasida
Bobot rata-rata (mg) 508,5
A1 (%) 1,1
A2 (%) 0,7
B1 (%) 1,1
Tabel 11. Hasil evaluasi tablet plasebo
Keterangan F1 F2 F3 F4
Waktu hancur : Dengan cakram (menit)
Tanpa cakram (menit)
2,15 1,23 5,51 4,01 7,63 3,96 9,60 9,46
Kekerasan (kg) 6,8 5,9 4,5 5,26
Friabilitas (%) 0,9 0,9 0,9 0,6
Tabel 12. Hasil evaluasi tablet antasida
Keterangan Formula antasida
Waktu hancur:
Dengan cakram (menit) Tanpa cakram (menit)
14,73 92,40
Kekerasan (kg) 5,80
[image:62.595.114.513.428.539.2]Lampiran 7. Contoh Perhitungan Bahan Tablet
R/ Zat warna hijau daun katuk 1 %
Aluminium hidroksida 200 mg
Magnesium oksida 200 mg
Amilum manihot 5 %
Gelatin 10 % q.s
Talkum 1 %
Mg-Stearat 1 %
Laktosa q.s ad 500 mg
m. f. tab. dtd No. C
I. Rencana kerja
1. Berat 1 tablet = 500 mg 2. Diameter tablet = 11 mm
3. Metode = granulasi basah 4. Bentuk tablet = bulat pipih II. Perhitungan bahan
1. Aluminium hidroksida = 200 mg x 100 = 20 g 2. Magnesium oksida = 200 mg x 100 = 20 g 3. Zat warna hijau daun katuk = 1/100 x 50 g = 0,5 g 4. Amilum manihot
• Pengembang dalam = 2,5/100 x 50 g = 1,25 g
• Pengembang luar = 2,5/100 x 50 g = 1,25 g
7. Gelatin
Misalnya gelatin terpakai 20 % dari berat total maka:
20/100 x 50 g = 10 g mengandung gelatin sebanyak
10/100 x 10 = 1 g
8. Bahan pengisi
Laktosa = 50g – (20g + 20g + 1,25g + 1,25g + 0,5g + 0,5g + 1g +
0,75g)
Lampiran 8. Hasil Pengamatan Warna
Tabel 13. Hasil pengamatan warna
Panelis I(0.5%) II(1%) III(1.25%) IV(1.5%) Total
1 3 5 3 2 13
2 3 4 3 3 13
3 2 4 3 1 10
4 2 5 2 3 12
5 3 5 4 3 15
6 0 5 2 3 10
7 1 5 3 3 12
8 3 5 2 2 12
9 1 4 3 2 10
10 1 4 3 3 11
11 3 5 3 2 13
12 1 2 3 2 8
13 2 4 1 1 8
14 1 4 2 2 9
15 1 5 3 2 11
16 2 4 2 3 11
17 2 4 3 3 12
18 2 5 4 3 14
19 1 5 3 1 10
20 1 5 3 2 11
Total 35 89 55 46 225
Rata-rata 1,75 4,45 2,75 2,3 2,81
Keterangan:
[image:67.595.109.454.420.509.2]FK = faktor koreksi JTK = jumlah total kuadrat JKT = jumlah kuadrat total KT = kuadrat tengah Db = derajat bebas KK = koefisien koreksi
Tabel 14. Daftar analisis sidik ragam uji warna
SK Db JK KT F Hitung F 0.05
Perlakuan 3 81,54 27,18 44,55 2.75
Galat 76 46,65 0,61
Total 79 128,19
Kesimpulan:
F Hitung > F Tabel 5% : beda nyata (signifikan)
a. Uji Beda Nyata Terkecil (BNT) atau Least Sheet Difference (LSD)
Perlakuan Rataan Notasi
I 1,75
IV 2,30 0,55 a
III 2,75 1,00 0,45 a B
[image:68.595.117.469.84.165.2]II 4,45 2,70 2,15 1,70 a B c
Tabel 16. Titik persentase distribusi t (df = 41 – 80) Distribusi
t(df=41-80)
0.25 0.1 0.05 0.025 0.01 0.005 0.001
Df 0.5 0.2 0.1 0.05 0.02 0.01 0.002
41 0.68052 1.30254 1.68288 2.01954 2.4208 2.70118 3.30127
42 0.68038 1.30204 1.68195 2.01808 2.41847 2.69807 3.29595
43 0.68024 1.30155 1.68107 2.01669 2.41625 2.6951 3.29089
44 0.68011 1.30109 1.68023 2.01537 2.41413 2.69228 3.28607
45 0.67998 1.30065 1.67943 2.0141 2.41212 2.68959 3.28148
46 0.67986 1.30023 1.67866 2.0129 2.41019 2.68701 3.2771
47 0.67975 1.29982 1.67793 2.01174 2.40835 2.68456 3.27291
48 0.67964 1.29944 1.67722 2.01063 2.40658 2.6822 3.26891
49 0.67953 1.29907 1.67655 2.00958 2.40489 2.67995 3.26508
50 0.67943 1.29871 1.67591 2.00856 2.40327 2.67779 3.26141
51 0.67933 1.29837 1.67528 2.00758 2.40172 2.67572 3.25789
52 0.67924 1.29805 1.67469 2.00665 2.40022 2.67373 3.25451
53 0.67915 1.29773 1.67412 2.00575 2.39879 2.67182 3.25127
54 0.67906 1.29743 1.67356 2.00488 2.39741 2.66998 3.24815
55 0.6789