DENGAN SPONS ASAL PERAIRAN
PULAU PANGGANG, KEPULAUAN SERIBU
TATI NURHAYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi yang berjudul Pemilahan dan
Karakterisasi Inhibitor Protease dari Bakteri yang Berasosiasi dengan Spons Asal Perairan Pulau Panggang, Kepulauan Seribu adalah benar merupakan hasil karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.Bogor, Agustus 2006
Tati Nurhayati
Bacteria-Associated with Sponge, from Pulau Panggang Waters, Seribu Islans. Supervised by MAGGY T. SUHARTONO, LILIS NURAIDA, and SRI BUDIARTI POERWANTO.
The important causing cause foodborne diseases are Staphylococcus aureus, Escherichia coli, Listeria spp. and Pseudomonas aeruginosa. Protease produced by these bacteria are involved in the molecular mechanisms of the diseases. Therefore, there has been rapidly increase concern on proteases as medical target for bacterium diseases. Various sponges has been reported to produce protease inhibitor which could inhibit protease activity of pathogenic bacteria. The previous research showed that bacteria-associated with sponge could
produce bioactive compound similar with their host. Therefore, there is a possibility that the bacteria also produce protease inhibitor. The purposes of this research were to screen potential microbes-associated with sponge as producer of protease inhibitor, to optimize conditions for the inhibitor production, to purify protease inhibitor from the selected microbe and to study the characteristics of the protease inhibitor. Among the isolates, Chromohalobacter sp. 6A3 was identified as the most potential protease inhibitor producer. Identification of the isolate was based on biochemical characteristics of the isolate and sequence of the gene encoding 16S rRNA. The optimum medium for producing protease inhibitor consisted of special peptone 0.5 % (w/v), yeast extract 0.1 % (w/v), trace element 0.2 % (v/v), NaCl 2 % (w/v), glucose 0.05 % (w/v), and incubation was conducted at 30 oC for 12 hours at 150 rpm. The protein was extracted by 30 % (v/v) acetone, purified by gel filtration (Sephadex G-75) and finally, purified by anion exchanger (Sephadex A-50). The molecular weight of the purified protease inhibitor after gel filtration was estimated as 21,31 kDa and 17,05 kDa, but anion exchanger gave protein with estimated molecular weight of 21,31 kDa The optimum temperature and pH were 30 oC and 5 respectively. The protease inhibitor could resist heating at 40 oC for 10 minutes (crude extract and acetone precipitated), and 30 oC for 10 minutes (purified). The inhibitor incubated at 30 oC, pH 5, was still active until 8 hours (crude extract), 6 hours (acetone precipitated), and 3 hours (purified). The purified enzyme inhibitor was still active when incubated at pH from 5 to 6 for 1 hour. The most susceptible substrate (enzyme) for the inhibitor was protease from P. aeruginosa. The protease inhibitor was inhibited by metal ions except Na+ 1mM. The inhibitor was activated 2 fold by SDS 5 mM. IC 50 of the protease inhibitor was 24.2 nM (crude extract) and 3.48 nM (purified) . The protease inhibitor inhibited the enzyme uncompetitively.
ABSTRAK
TATI NURHAYATI. Pemilahan dan Karakterisasi Inhibitor Protease dari Bakteri yang Berasosiasi dengan Spons, asal Perairan Pulau Panggang, Kepulauan Seribu. Dibimbing oleh MAGGY T. SUHARTONO, LILIS NURAIDA, DAN SRI BUDIARTI POERWANTO.
Staphylococcus aureus, Escherichia coli, Listeria sp., dan Pseudomonas aeruginosa merupakan bakteri patogen yang penting sebagai penyebab foodborne disease. Bakteri ini menghasilkan protease yang terlibat dalam mekanisme molekular penyebab penyakit. Oleh karena itu, saat ini protease menjadi mendapat perhatian penting sebagai target pengobatan penyakit yang disebabkan oleh bakteri. Berbagai spons telah dilaporkan menghasilkan inhibitor protease yang dihasilkan oleh bakteri patogen. Penelitian sebelumnya menunjukkan bahwa bakteri yang berasosiasi dengan spons dapat menghasilkan komponen bioaktif yang mirip dengan inangnya. Oleh karena itu, diduga bakteri yang berasosiasi dengan spons juga menghasilkan inhibitor protease. Tujuan penelitian ini adalah memilah bakteri yang berasosiasi dengan spons sebagai penghasil inhibitor protease yang potensial, mengoptimasi kondisi produksi inhibitor protease, memurnikan inhbitor protease asal bakteri yang terpilih, serta mempelajari karakteristik inhibitor protease. Diantara isolat yang positif menghasilkan inhibitor protease berdasarkan hasil pemilahan, Chromohalobacter sp. 6A3 merupakan bakteri yang paling potensial sebagai penghasil inhibitor protease. Isolat tersebut diidentifikasi melalui karakteristik biokimiawi dan sekuens gen yang mengkodekan 16S rRNA. Medium yang optimum untuk menghasilkan inhibitor protease terdiri atas special peptone 0,5 % (w/v), yeast extract 0,1 % (w/v), trace element 0,2 % (v/v), NaCl 2 % (w/v), glukosa 0,05 % (w/v), dan inkubasi dilakukan pada suhu 30 oC selama 12 jam pada kecepatan 150 rpm. Protein tersebut diekstrak menggunakan aseton 30 % (v/v), dimurnikan dengan filtrasi gel (Sephadex G-75), dan terakhir dimurnikan menggunakan penukar ion (Sephadex A-50). Berat molekul inhibitor protease setelah dimurnikan dengan filtrasi gel, yaitu 21,31 kDa dan 17,05 kDa, namun setelah dimurnikan dengan penukar ion, sekitar 21,31 kDa. Suhu dan pH optimum inhibitor protease adalah 30 oC dan 5. Inhibitor protease stabil pada inkubasi 40 oC selama 10 menit (ekstrak kasar dan hasil pengendapan aseton), dan 30 oC selama 10 menit (murni). Inhibitor protease yang diikubasi pada kondisi optimum (suhu 30 oC, pH 5) masih stabil selama 8 jam (ekstrak kasar), 6 jam (hasil pengendapan aseton), dan 3 jam (murni). Inhibitor murni masih aktif ketika diinkubasi pada pH 5-6 selama 1 jam. Substrat yang paling cocok untuk inhibitor protease tersebut adalah protease dari Pseudomonas aeruginosa. Inhibitor protease dihambat oleh ion-ion logam kecuali Na+ 1 mM, ditingkatkan aktivitasnya oleh SDS hinga 2 kali lipat. IC50 inhibitor protease adalah 24,2 nM (ekstrak kasar) dan 3,48 mM (murni). Pola penghambatan inhibitor tersebut adalah uncompetitive.
© Hak cipta milik Institut Pertanian Bogor tahun 2006
Hak cipta dilindungi
PEMILAHAN DAN KARAKTERISASI INHIBITOR
PROTEASE DARI BAKTERI YANG BERASOSIASI
DENGAN SPONS ASAL PERAIRAN
PULAU PANGGANG, KEPULAUAN SERIBU
TATI NURHAYATI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : F 226010011
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Maggy Thenawidjaja Suhartono Ketua
Dr. Ir. Lilis Nuraida Dr.dr. Sri Budiarti Poerwanto
Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Segala puji bagi Allah swt yang telah melimpahkan rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan disertasi yang berjudul Pemilahan dan Karakterisasi Inhibitor Protease dari Bakteri yang Berasosiasi dengan Spons Asal Perairan Pulau Panggang, Kepulauan Seribu. Disertasi ini dibuat sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Pangan,
Program Pascasarjana, Institut Pertanian Bogor.
Selama menjalani perkuliahan hingga terselesaikannya Disertasi ini,
tentunya banyak pihak yang telah membantu penulis. Oleh karena itu dengan
segala ketulusan hati penulis mengucapkan terima kasih yang sebesar-besarnya
kepada:
Prof. Dr. Ir. Maggy T. Suhartono selaku ketua komisi pembimbing yang
telah memberikan ilmu, arahan dan masukan selama penulis melaksanakan kuliah,
penelitian, hingga terselesaikannya disertasi ini. Beliau pulalah yang telah
membuka wawasan penulis dan akhirnya mengarahkan penulis untuk membuat
proposal penelitian Hibah Bersaing XI untuk keperluan penyelesaian program S3.
Beliau juga telah mengijinkan penulis untuk melakukan penelitian di Laboratorium
Mikrobiologi dan Biokimia, Pusat Penelitian Bioteknologi dan Biologi, IPB.
Dr. Ir. Lilis Nuraida selaku anggota komisi pembimbing yang telah banyak
mengarahkan penulis selama penelitian dan penyusunan disertasi.
Dr. dr. Sri Budiarti Poerwanto selaku anggota komisi pembimbing yang
telah banyak mengarahkan penulis selama penelitian dan penulisan disertasi.
Beliau juga telah mengijinkan penulis untuk penelitian di Laboratorium Bioteknologi
Hewan dan Biomedis, Pusat Penelitian Bioteknologi dan Biologi, IPB. Berkat
rekomendasi beliau penulis memperoleh isolat bakteri patogen dari Rumah Sakit
Pusat Pertamina. Beliau juga selalu memberikan semangat kepada penulis saat
penulis sedang ragu untuk melangkah.
Dr. Ir. Sugiono, MAppSc yang telah menyediakan waktu untuk menguji
penulis saat ujian Preliminary. Prof. Dr. Ir. Suminar Setiati Achmadi yang telah bersedia menguji penulis pada Sidang Tertutup. Dr. Ir. Linawati Hardjito dan
Debbie S. Retnoningrum, Ph.D selaku Penguji Luar Komisi pada Sidang Terbuka.
Dr. Ir. Dahrul Syah, M.Sc selaku Ketua Departemen Ilmu dan Teknologi Pangan
yang telah hadir pada Sidang Tertutup dan Sidang Terbuka.
Dr. Ir. Mita Wahyuni selaku kolega di Departemen Teknologi Hasil
untuk melanjutkan S3 di IPB. Saat itu beliau menjabat sebagai Ketua Jurusan
Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, IPB.
Dekan Fakultas Perikanan dan Ilmu Kelautan, saat itu dijabat oleh Dr. Ir.
Enang Harris, MS; juga kepada Rektor IPB yang saat itu dijabat oleh Prof. Dr. Ir.
Aman Wirahadikusuma, MSc yang telah memberikan kesempatan kepada penulis
untuk melanjutkan program S3.
Seluruh staf pengajar Program Studi Ilmu Pangan yang telah banyak
memberikan ilmu kepada penulis selama menjalani perkuliahan.
Dikti, yang telah memberikan Beasiswa Program Pascasarjana (BPPS),
juga memberikan dana penelitian melalui program Hibah Bersaing XI.
Adikku tercinta, Fazria Amalia, S.Si, yang selalu setia membantu penulis
melaksanakan penelitian hingga akhir.
Semua laboran di Pusat Penelitian Sumberdaya Hayati dan Bioteknologi,
serta laboran di Seafast Center yang telah membantu penulis selama melaksanakan penelitian.
Suamiku tercinta Ir. Muryanto MP dan juga ananda Nurma Murti Hapsari
atas kasih sayang dan doa, serta keikhlasannya untuk selalu mendorong dan
memberi semangat kepada penulis untuk menyelesaikan kuliah S3.
Kedua orang tua penulis (Bapak Abdul Syahri dan Sutarsih (Alm)) beserta
keluarga besar Abd. Syahri, dan keluarga besar Daromi Nanto Miharjo yang
senantiasa memberikan doa dan dukungan kepada penulis
Dr. Ir. Linawati Hardjito, MSc selaku Ketua Departemen THP yang
senantiasa mendorong penulis untuk menyelesaikan kuliah dan juga rekan-rekan
staf Departemen THP atas kerjasamanya selama ini sehingga penulis dapat
menyelesaikan kuliah S3.
Semua rekan-rekan di IPN, khususnya Bu Asriani dan Bu Rifda, atas
kerjasamanya selama ini.
Akhir kata penulis mohon maaf atas segala kekurangan, semoga disertasi
ini bermaanfat bagi pembaca dan memberikan ide bagi pembaca untuk melanjutkan
penelitian ini, sehingga akan didapatkan hasil yang lebih sempurna.
Bogor, Agustus 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, 7 Agustus 1970 sebagai anak keempat dari
tujuh bersaudara dengan ayah bernama Abdul Syahri dan ibu bernama Sutarsih
(Alm). Pada tahun 1998 penulis menikah dengan Ir. Muryanto MP dan dikarunia
seorang anak yang bernama Nurma Murti Hapsari (1999). Sejak tahun 1996
penulis bekerja sebagai staf pengajar pada Jurusan Pengolahan Hasil Perikanan,
yang sekarang namanya berganti menjadi Departemen Teknologi Hasil Perairan.
Sejak Bulan Oktober 2005 penulis mendapat amanah untuk menjadi Sekretaris
pada Departemen Teknologi Hasil Perairan.
Penulis menyelesaikan program Sarjana pada Jurusan Pengolahan Hasil
Perikanan, Fakultas Perikanan tahun 1995. Dua tahun kemudian penulis
melanjutkan pendidikan pada Program Pascasarjana (S2) Institut Pertanian Bogor,
Program Studi Ilmu Pangan dan lulus tahun 2000. Pada tahun 2001 penulis
melanjutkan ke Program Doktor pada Program Studi yang sama, dengan Sub
Program Studi Bioteknologi Pangan, di Institut Pertanian Bogor. Beasiswa
diperoleh penulis dari Beasiswa Program Pascasarjana (BPPS) dari tahun
2001-2004. Dana Penelitian diperoleh dari Dikti, Depdiknas, melalui Hibah Bersaing XI
tahun 2003-2004.
Selama mengikuti pendidikan S3, penulis aktif sebagai angota
Perhimpunan Mikrobiologi Indonesia (PERMI) dan sebagai dewan redaksi Buletin
Teknologi Hasil Perikanan. Penulis telah menyajikan makalah yang merupakan
bagian dari disertasi dalam beberapa kegiatan ilmiah, seperti pada Seminar
Nasional Permi tahun 2003, Seminar Nasional dan Kongres PATPI tahun 2004,
Seminar Nasional Hibah IX tahun 2004, Asean Food Conference tahun 2005, serta
International Seminar and Workshop Marine Biodiversity and their Potential for Developing Bio-Pharmaceutical Industry in Indonesia tahun 2006. Selain itu telah mempublikasikan artikel yang juga merupakan bagian Disertasi dalam Buletin
Teknologi Hasil Perikanan Volume VII tahun 2004 dan Volume VIII tahun 2005,
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Luaran ... 3
TINJAUAN PUSTAKA ... 4
Keterlibatan protease dalam Mekanisme Patogenisitas ... 4
Inhibitor dari Spons ... 5
Inhibitor Protease dari Mikroorganisme... 7
Hubungan antara Spons dan Bakteri yang Bersimbiosis ... 9
Mikroorganisme yang Bersimbiose dengan Spons ... 10
Penggolongan Inhibitor Enzim ... 12
Penggolongan inhibitor enzim berdasarkan mekanisme kerjanya... 12
Penggolongan inhibitor enzim berdasarkan spesifisitas kerjanya... 13
Pemurnian Inhibitor Enzim ... 14
Ekstraksi inhibitor enzim... 15
Fraksinasi menggunakan kolom kromatografi ... 15
METODOLOGI ... 17
Waktu dan Tempat Penelitian ... 17
Bahan dan Alat... 17
Metode Penelitian... 18
Penelitian tahap I isolasi dan identifikasi bakteri serta pemilahan bakteri yang berasosiasi dengan spons sebagai penghasil inhibitor protease ... 20
Penelitian tahap II optimasi media yang digunakan untuk produksi inhibitor protease ... 24
Penelitian tahap III pemurnian inhibitor protease ... 25
Penelitian tahap IV karakterisasi inhibitor protease... 26
Analisis... ... 29
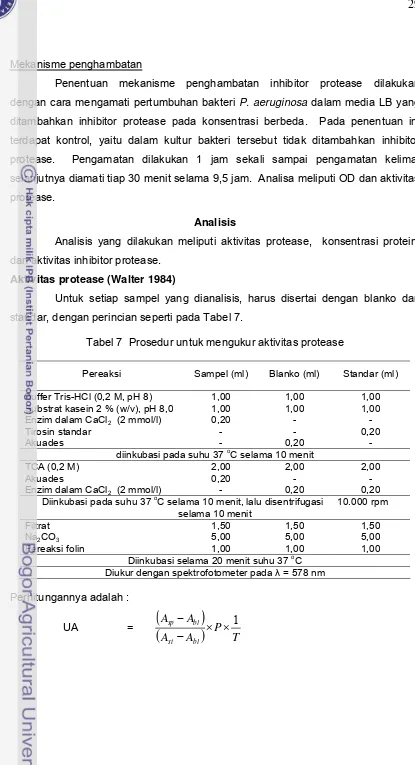
Aktivitas protease (Walter 1984) ... 29
Konsentrasi protein (Metode Bradford dalam Hammond dan Kruger 1988) ... 29
Analisis inhibitor protease (Imada et al. 1985c)... 30
Analisis Data ... 31
HASIL DAN PEMBAHASAN ... 32
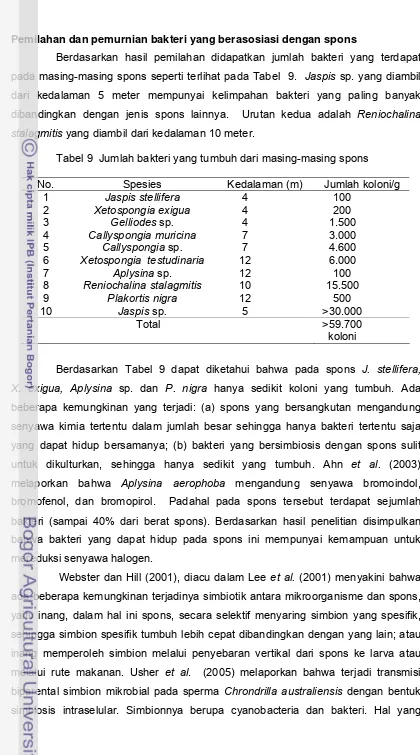
Penelitian Tahap I Isolasi dan Identifikasi Bakteri serta Pemilahan Bakteri yang Berasosiasi dengan Spons sebagai Penghasil Inhibitor Protease ... 32
Halaman
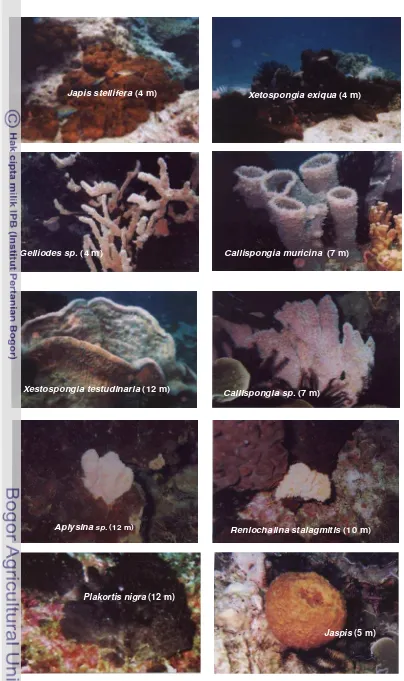
Pengumpulan spons... 32
Pemilahan dan pemurnian bakteri yang berasosiasi dengan spons ... 34
Pemilahan bakteri penghasil inhibitor protease... 36
Karakterisasi bakteri penghasil inhibitor protease... 38
Penentuan bakteri penghasil inhibitor protease tertinggi dalam media marine broth... 41
Identifikasi bakteri penghasil inhibitor protease tertinggi ... 46
Penelitian Tahap II Optimasi Media yang Digunakan untuk Produksi Inhibitor Protease ... 49
Penelitian Tahap III Pemurnian Inhibitor Protease……….. 59
Ekstraksi inhibitor protease ……… 59
Dialisis dan pengeringan beku... 61
Pemurnian inhibitor protease dengan kolom kromatografi ... 62
Produksi inhibitor protease ... 63
Penelitian Tahap IV Karakterisasi Inhibitor Protease ... 64
Penentuan suhu optimum inhibitor protease ... 65
Penentuan pH optimum... 66
Stabilitas terhadap panas ... 67
Stabilitas terhadap panas pada kondisi optimum ... 69
Stabilitas terhadap pH ... 70
Pengaruh berbagai substrat terhadap aktivitas inhibitor protease ... 70
Pengaruh ion logam ... 71
Pengaruh SDS, mercaptoetanol, dan inhibitor ... 72
Penentuan IC50... 74
Penentuan bobot molekul... 77
Zimogram ... 80
Model penghambatan... 82
Mekanisme penghambatan ... 83
KESIMPULAN DAN SARAN ... 87
Kesimpulan ... 87
Saran ... 88
DAFTAR PUSTAKA ... 89
LAMPIRAN ... 95
1. Spons dan inhibitor enzim yang dihasilkan ... 6
2. Sponge dan mikroorganisme simbion penghasil produk alami ... 12
3. Metode kromatografi untuk fraksinasi protein ... 15
4. Metode ekstraksi dan pemurnian inhibitor enzim dari mikroorganisme ... 16
5. Tahapan penelitian... 18
6. Jenis dan nomor aksesbakteri yang digunakan untuk pembuatan pohon filogenetik ... 24
7. Prosedur untuk mengukur aktivitas protease ... 29
8. Prosedur pengukuran aktivitas inhibitor protease ... 31
9. Jumlah bakteri yang tumbuh dari masing-masing spons ... 34
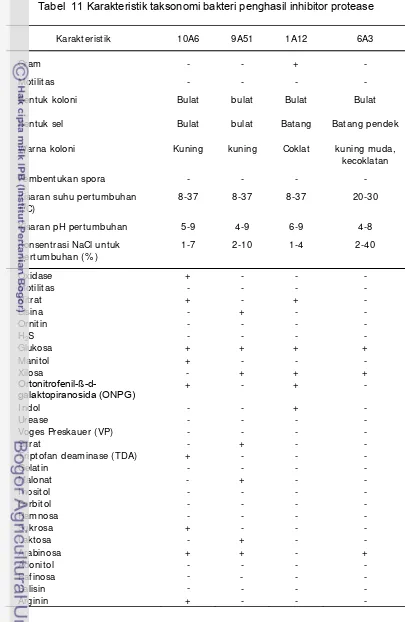
10. Hasil pemilahanbakteri yang potensial sebagai penghasil inhibitor protease 38 11. Karakteristik taksonomi bakteri penghasil inhibitor protease ... 39
12. Waktu produksi optimum isolat penghasil inhibitor protease pada media marine broth ... 42
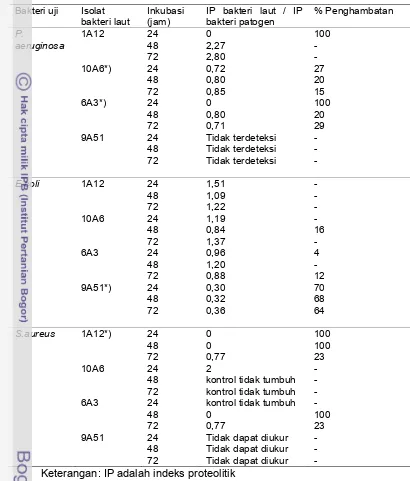
13. Aktivitas protease dari bakteri patogen ... 42
14. Aktivitas inhibitor protease (U/ml) maksimum pada konsentrasi NaCl yang berbeda ... 46
15. Data sepuluh organisme yang memiliki kemiripan terdekat dengan isolate 6A3 yang dihasilkan oleh program BLAST. No akses merupakan kode untuk mengakses data urutan nukelotida dari mikroorganisme pada situs www.ncbi.nlm.nih.gov. ... 47
16. Perbandingan karakteristik isolat 6A3 dengan genus Chromohalobacter yang lain ... 48
17. Aktivitas inhibitor protease maksimum pada perlakuan yeast extract (YE) dan pH berbeda, dibandingkan dengan marine broth... 54
18. Aktivitas inhibitor maksimum pada media dengan glukosa 0,05% dan yeast extract 0,1-0,4%... 57
19. Pengendapan dengan ammonim sulfat... 60
20. Pengendapan dengan aseton ... 60
21. Peningkatan aktivitas inhibitor protease pada berbagai tahapan pemurnian 64 22. Karakteristik inhibitor protease isolat 6A3 dan beberapa inhibitor protease lainnya ... 74
23. Perbandingan aktivitas inhibitor protease dari isolat 6A3 dengan PMSF dan EDTA... 74
24. Penentuan IC50 inhibitor protease ekstrak kasar ... 75
25. Bobot molekul inhibitor protease pada setiap tahap pemurnian ... 79
26. Pengamatan tingkat penghambatan pertumbuhan P. aeruginosa inhibitor protease ... 84
DAFTAR GAMBAR
Halaman
1. Diagram hubungan simbiotik antara sponge dan mikroorganisme
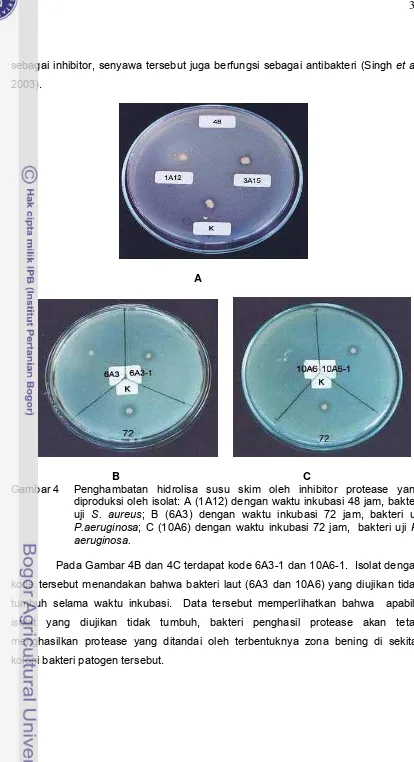
(Lee et al. 2001) ... 10 2. Protease dan inhibitornya yang ber-BM rendah (Aoyagi dan Takeuchi 1989) 14 3. Jenis spongs yang digunakan untuk pemilahan inhibitor protease ... 33 4. Penghambatan hidrolisa susu skim oleh inhibitor protease yang
diproduksi oleh isolat: A (1A12) dengan waktu inkubasi 48 jam, bakteri uji
S. aureus; B (6A3) dengan waktu inkubasi 72 jam, bakteri uji P. aeruginosa;
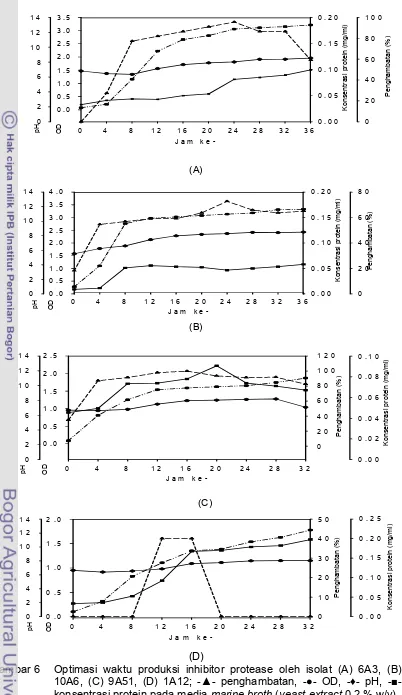
C (10A6) dengan waktu inkubasi 72 jam, bakteri uji P. aeruginosa ... 37 5. Isolat 6A3 menggunakan mikroskop elektron (10.000x) ... 40 6. Optimasi waktu produksi inhibitor protease oleh isolate (A) 6A3, (B) 10A6, (C) 9A51, (D) 1A12; -▲- penghambatan, -●- OD, -♦- pH, -■- konsentrasi
protein pada media marine broth (yeast extract 0,2 % w/v)……… 43 7. Pengaruh konsentrasi NaCl terhadap pertumbuhan bakteri penghasil
inhibitor protease... 45 8. Pengaruh konsentrasi NaCl terhadap aktivitas inhibitor protease... 45 9. Hasil amplifikasi dan gen penyandi 16S rRNA dari isolat 6A3 (+ 1,5 kb).... 46 10. Pohon filogenetik bakteri isolat 6A3 dari spons Xetospongia testudinaria
hasil analisis pengurutan DNA parsial 16S rRNA. Angka pada percabangan adalah nilai bootstrap dengan 100 kali replikasi... 47 11. Aktivitas inhibitor protease (U/mg), protein, pH pada media glukosa 0,1% (w/v)
special peptone 0,5 %(w/v); yeast extract 1,0 %(w/v); trace element 0,2 %(v/v) (A) pH awal 7 (G01-172); (B) pH awal 8 (G01-182) ; -▲- penghambatan,
-●- OD, ♦- pH, -■- konsentrasi protein ... 50 12. Aktivitas inhibitor protease (U/mg), protein, pH pada media glukosa
0,1 %(w/v); special peptone 0,5 %(w/v); yeast extract 0,5 %(w/v);
trace element 0,2 %(v/v) (A) pH awal 7 (G01-272 (YE0,5)); (B) pH awal 8 (G01-282 (YE0,5)) -▲- penghambatan, -●- OD, -♦- pH,
-■- konsentrasi protein………. ... 51 13. Aktivitas inhibitor protease (U/mg), protein, pH pada media glukosa
0,1 %(w/v); special peptone 0,5 %(w/v); yeast extract 0,1 %(w/v); trace element 0,2 %(v/v) (A) pH awal 7 (G01-272); (B) pH awal 8
(G01-282; -▲- penghambatan, -●- OD; -♦- pH, -■- konsentrasi protein.... 53 14. Aktivitas inhibitor protease (U/mg), protein, pH pada media (MB) (glukosa 0,05 %(w/v); special peptone 0,5 %(w/v); yeast extract 0,2 %(w/v);
NaCl 2 %(w/v), trace element 0,2%(v/v); -▲- penghambatan, -●- OD;
-♦- pH, -■- konsentrasi protein... 54 15. Aktivitas inhibitor protease (U/mg) dan optical density (OD), pH awal media 7 (yeast extract 1 % (A); 0,5 % (B); 0,1 % (C)), pada pH awal media 8
(yeast extract 1 % (A); 0,5 % (B); 0,1 % (C)), dan MB+glukosa 0,05%,
-■- OD, ♦- aktivitas inhibitor protease (U/mg) ... 56
pH 7, yeastextract (A) 0,1%w/v, (B) 0,2%w/v, (C) 0,3%w/v, (D) 0,4%w/v;
-▲- penghambatan, -●- OD; -♦- pH, -■- konsentrasi protein... 58
17. (A) Konsentrasi protein setelah pengendapan dengan ammonium sulfat; (B) Aktivitas inhibitor protease setelah pengendapan ammonium sulfat... 60
18. (A) Konsentrasi protein setelah pengendapan denganaseton; (B) Aktivitas inhibitor protease setelah pengendapan aseton ... 60
19. Aktivitas spesifik inhibitor pada berbagai bentuk... 61
20. Pemurnian inhibitor protease menggunakan filtrasi gel ... 62
21. Pemurnian inhibitor protease menggunakan ion exchange ▲ OD 280 nm; ● aktivitas inhibitor; ♦ gradien NaCl………. 62
22. Pengaruh suhu terhadap aktivitas inhibitor protease (A) ekstrak kasar; (B) hasil pengendapan dengan aseton; (C) hasil filtrasi gel ... 65
23. Pengaruh pH terhadap aktivitas inhibitor protease (A) ekstrak kasar, (B) hasil pengendapan aseton, (C) hasil filtrasi gel ... 67
24. Stabilitas panas inhibitor protease (A) ekstrak kasar, (B) hasil pengendapan aseton, (C) hasil filtrasi gel ... 68
25. Stabilitas panas inhibitor protease pada 30 oC(A) ekstrak kasar, (B) hasil pengendapan aseton, (C) hasil filtrasi gel ... 69
26. Stabilitas terhadap pH inhibitor protease hasil filtrasi gel ... 70
27. Variasi substrat inhibitor enzim hasil filtrasi gel ... 71
28. Pengaruh jenis ion logam terhadap aktivitas inhibitor ... 72
29. Pengaruh SDS dan β-mercaptoetanol terhadap aktivitas inhibitor protease 73 30. Penentuan IC50: (A) konsentrasi ekstrak inhibitor 500 µl; (B) konsentrasi ekstrak inhibitor 1000, 1500, dan 2000 µl; (C) konsentrasi ekstrak inhibitor 2500 µl... 76
31. Pengaruh konsentrasi protein terhadap aktivitas inhibitor protease... 76
32. Penentuan IC50 inhibitor protease murni ... 76
33. Elektroforesis I: (M) Marker, (1) ekstrak aksar, (2) pengendapan aseton; (3) freeze drying, (4,5,6) filtrasi gel... 78
34. Elektroforesis III: (M) Marker, (1-4) pengendapan aseton, (5-7) freeze drying 78 35. Elektroforesis III: (M) Marker, (1-2) filtrasi gel, (3-7) penukar ion ... 78
36. Zimogram inhibitor dengan waktu inkubasi 30 menit ... 81
37. Zimogram inhibitor dengan waktu inkubasi 1 jam ... 81
38. Zimogram inhibitor dengan waktu inkubasi 1,5 jam ... 81
39. Model penghambatan inhibitor protease ... 82
40. Pengamatan OD P. aeruginosa yang diberi inhibitor protease
dengan konsentrasi yang berbeda -■- kontrol, -●- perlakuan inhibitor 1,01
µg/ml, -▲- perlakuan inhibitor 1,285 µg/ml ... 83 41. Pengamatan kecepatan pertumbuhan sel P. aeruginosa yang diberi inhibitor
protease dengan konsentrasi yang berbeda berbeda -■- kontrol,
-●- perlakuan inhibitor 1,01µg/ml, -▲- perlakuan inhibitor 1,285 µg/ml ... 84 42. Pengamatan kecepatan pertumbuhan sel P. aeruginosa yang diberi inhibitor
protease dengan konsentrasi yang berbeda -■- kontrol, -●- perlakuan
inhibitor 1,01µg/ml, -▲- perlakuan inhibitor 1,285 µg/ml... 84 43. Aktivitas protease P. aeruginosa yang diberi inhibitor protease selama
kultivasi berbeda -■- kontrol, -●- perlakuan inhibitor 1,01µg/ml,
-▲- perlakuan inhibitor 1,285 µg/ml ... 85
Halaman
1. Komposisi media yang digunakan... 95
2. Bahan-bahan untuk pengukuran aktivitas protease dan inhibitor protease 95 3. Peta lokasi pengambilan sampel spons ... 97
4. Komposisi gel dan pereaksi untuk elektroforesis, pereaksi yang digunakan untuk pewarnaan silver dan kurva standar berat molekul penanda (marker) untuk elektroforesis ... 98
5. Kurva standar penentuan protein menurut metode Bradford (1976)... 100
6. Optimasi assay... 101
7. Isolat bakteri laut yang digunakan untuk pemilahan... 102
8. Sekuen dan hasil blast isolat 6A3 ... 103
9. Contoh publikasi... 113
PENDAHULUAN
Latar Belakang
Spons yang hidup di laut mempunyai metabolit sekunder yang aktif secara
hayati. Di antara organisme yang hidup di laut, spons mengandung komponen
bioaktif terbesar (Mayer dan Lehmann 2000). Beberapa komponen bioaktif yang
ada pada spons meliputi inhibitor enzim, inhibitor pembelahan sel, antiviral,
antifungi, antiimflamatori, antitumor, dan sitotoksik (Lee et al. 2001). Hasil penelitian menunjukkan bahwa bakteri yang berasosiasi dengan spons juga
menghasilkan komponen bioaktif (Webster et al. 2001). Hal ini mungkin karena jumlah koloni bakteri dan cyanobacteria yang ada di spons, terutama Aplysina aerophoba, dapat mencapai 40% dari biomasa spons (Ahn et al. 2003). Mikroorganisme tersebut membentuk suatu simbiotik dengan spons baik di dalam
inti sel (simbiosis intranukleus), di dalam sitoplasama sel tubuh spons (simbiosis
intraseluler), di sisi dalam tubuh spons (endosimbiosis ekstraseluler), dan di bagian
luar tubuh spons (eksosimbiosis ekstraseluler). Hubungan simbiotik ini bisa terjadi
mengingat spons merupakan hewan yang memakan makanan dengan cara filter feeder, dalam hal ini mikroorganisme dapat menjadi nutrisi bagi spons. Metabolit yang dihasilkan oleh spons merupakan hasil biosintesis simbionnya sehingga dapat
dimungkinkan bahwa spons mengandung komponen bioaktif yang sama dengan
simbionnya (Lee et al. 2001). Sebagai contoh Micrococcus sp. menghasilkan komponen diketopiperazin, yang sebelumnya telah dilaporkan dihasilkan oleh spons
inangnya yaitu Tedania ignis. Simbion bakteri yang lain, yaitu Vibrio sp. memproduksi bifenil eter bromina, yang juga dihasilkan oleh inangnya yaitu Dysidea
sp. Simbiotik Vibrio sp. menghasilkan komponen bioaktif berupa peptida anti
Bacillus yang juga dihasilkan oleh inangnya yaitu ekstrak spons Hyatella sp. (Stierle
et al. 1988; Elyakov et al. 1991; Oclarit et al. 1994, diacu dalam Lee et al. 2001). Flowers et al. (1998) melaporkan bahwa simbion spons Oscillatoria spongeliae, mengandung senyawa diketopiperazin klorina yang juga dihasilkan oleh inangnya
yaitu Dysidea herbacea .
Foodborne disease yang diperantarai oleh mikroorganisme patogen atau toksin mikroba merupakan masalah kesehatan masyarakat yang penting. Penyakit ini oleh WHO didefinisikan sebagai penyakit infeksi atau keracunan toksin alami
yang disebabkan oleh konsumsi makanan atau minuman. Di Amerika, telah
anak-anak dibawah 5 tahun. Penyebabnya adalah makanan yang dikonsumsi
terkontaminasi oleh bakteri patogen dan toksin yang dihasilkan oleh bakteri
patogen (WHO 1997, diacu dalam Johnson 2003). Penyakit tersebut
diklasifikasi-kan menjadi 2 golongan, yaitu infeksi dalam saluran pencernaan dan keracunan
akibat mengkonsumsi racun yang dihasilkan mikroba patogen dalam makanan.
Bakteri patogen dalam menjalankan aksinya menggunakan beberapa
cara, yang dikenal dengan istilah faktor virulensi, di antaranya dengan
mensekresikan protease ke dalam inangnya. Mengingat pentingnya protease dalam
mekanisme terjadinya penyakit maka dalam dasawarsa terakhir ini perhatian
terhadap protease sebagai target senyawa obat bagi penyakit asal bakteri (seperti
pneumonia, kolera, tifus, gonorrhoe), virus (seperti influenza dan HIV), dan malaria serta kanker, bahkan penyakit degeneratif seperti Alzheimer meningkat pesat
(Suhartono 2000). Saat ini obat-obatan yang beberapa di antaranya mempunyai
mekanisme inhibitor protease telah tersedia luas di pasaran, seperti Elafin (inhibitor
elastase dari kulit manusia), antileuko protease, inhibitor serum ayam, dan inhibitor
protease alkalin dari Streptomyces.
Indonesia mempunyai biodiversitas dan keanekaragaman hayati yang
tinggi, salah satunya adalah spons. Hampir di tiap wilayah perairan Indonesia
memiliki spons dengan tingkat penutupan dan keragaman yang berbeda. Pulau
Panggang di Kepulauan Seribu, merupakan salah satu pulau yang perairannya
masih cukup baik. Hal ini ditandai dengan penutupan karangnya yang termasuk
kategori sedang sampai baik (34,72-62,86 %) dan indeks keanekaragaman yang
rendah hingga tinggi yaitu berkisar 0,2-2,81 (Mahaza 2003). Oleh karena itu dari
perairan ini, diharapkan akan didapatkan suatu senyawa yang dapat menghambat
aktivitas protease dari bakteri patogen.
Data di atas menunjukkan menunjukkan bahwa sudah cukup banyak
simbion yang teridentifikasi positif menghasilkan komponen bioaktif yang sama
dengan inangnya, namun belum pernah dilaporkan tentang inhibitor protease dari
simbion spons yang berupa protein, meskipun telah dilaporkan bahwa spons
menghasilkan inhibitor protease. Dengan demikian penelitian ini dilakukan untuk
mencari simbion spons yang potensial sebagai penghasil inhibitor terhadap
protease bakteri patogen, sehingga diharapkan akan dapat memutus salah satu
3
Tujuan
Tujuan penelitian ini meliputi :
(1). memilah mikroba yang berasosiasi dengan spons sebagai penghasil inhibitor
protease;
(2). mengoptimasi kondisi produksi inhibitor protease;
(3). memurnikan inhibitor protease dari mikroba yang berasosiasi dengan spons;
(4). mengkarakterisasi inhibitor protease yang dihasilkan.
Luaran
Luaran penelitian ini adalah mendapatkan mikroba yang berasosiasi dengan
spons sebagai penghasil inhibitor protease, kondisi produksi yang tepat untuk
menghasilkan inhibitor protease, metode yang tepat untuk memurnikan inhibitor
protease, dan juga informasi mengenai karakteristik inhibitor enzim yang
Protease yang dihasilkan oleh mikroorganisme terlibat baik langsung maupun tidak langsung dalam mekanisme patogenesis baik pada manusia, hewan, maupun tanaman. Beberapa bakteri yang menghasilkan protease penyebab penyakit, diantaranya Clostridium, Staphylococcus spp, Strepcoccus spp. dan
Listeria spp. Clostridium memproduksi protease penyebab penyakit.
C. befermetans menghasilkan protease logam ekstraseluler bersifat toksin dan merupakan faktor virulensi (Hase dan Finklestein 1993). C. perfringens
menghasilkan lambda toksin sebagai penyebab penyakit enteritis (Fu Jin et al.
1996). Staphylococcus menghasilkan protease ekstraseluler jenis protease logam yang bersifat toksin. Streptococcus sanguis, Ureaplasma urealyticum, Haemophillus influenza, Streptococcus pneumonia memproduksi IgA ekstraseluler yang digolongkan protease logam. Listeria monocytogenes sebagai penyebab penyakit listeriosis juga menghasilkan protease ekstraseluler (Hase dan Finklestein 1993, Johannson et al. 1999, Killian et al. 1979, Stenberg et al. 1996).
Streptococcus pyogenes menghasilkan protease sistein (streptococcal pyrogenic exotoxin B, SpeB) yang merupakan faktor virulensi (Gubba et al. 2000).
Bakteri gram negatif yang menghasilkan protease adalah Pseudomonas
spp. dan Legionella spp. (Hase dan Finklestein 1993). P. aeruginosa bersifat patogen, yaitu menginfeksi inang dengan dengan memproduksi elastase (A dan B) yang dikarakteristik sebagai eksoenzim. Elastase merupakan protease logam yang mengandung zink, mempunyai kemampuan mendegradasi substansi hayati penting elastin, lamiarin, fibrin, kolagen manusia dan immunoglobulin. Selain itu juga terdapat protease alkalin dan elastase yang dihasilkan dalam paru-paru pasien dengan cystic fibrosis dan menyebabkan kerusakan epitel respirasi. P. aeruginosa
juga menghasilkan protease IV yang merupakan faktor virulensi di kornea (Engel
et al . 1998). Protease IV merupakan endoprotease (PrpL) (Wilderman et al. 2001).
L. pneumophila merupakan bakteri fakultatif penyebab pneumonitis dengan mensekresikan protease logam zink netral (Hase dan Finklestein 1993).
5
selain dapat mendegradasi musin, juga mampu mendegradasi laktoferin yang telah dipotong terlebih dahulu oleh tripsin (Suhardi 2004). Bakteri lain yang menghasilkan protease sebagai toksin adalah V. cholera (menghasilkan protease logam yang membutuhkan zink sebagai kofaktor dan kalsium), Aeromonas hydrophylla (protease logam), Serratia spp. (menghasilkan protease logam zink ekstraseluler yang berfungsi sebagai antiinflamatori), dan Erwinia spp. (protease logam) (Hase dan Finklestein 1993).
Parasit Toxoplasma gondii menghasilkan protease logam netral yang tergantung ion kalsium. Protease ini berperan dalam degradasi membran sel inang (Song dan Nam 2003). Sementara itu Entamoeba hystolytica menghasilkan proteinase sistein yang terlibat dalam pembentukan abses pada hati (Susanto dan Supali 1999).
Inhibitor dari Spons
Carrol et al. (2002) menemukan dynosin A dari spons Australia yang termasuk famili Dysideideae. Komponen tersebut berperan untuk menghambat faktor kaskade VIIa dan merupakan inhibitor protease serin trombin. Inhibitor tersebut menghambat faktor VIIa dengan konstanta penghambatan (Ki) 10 8 nM dan trombin dengan konstanta penghambatan (Ki) 452 nM.
Spons dari New Zealand, Tethya ingalii, mengandung protein yang aktif secara hayati yaitu inhibitor protease tethya (Tethya Protease Inhibitor, TPI), bersifat toksik terhadap sel terutama sel tumor tertentu, dengan cara melisis sel darah merah. Komponen tersebut diekstrak dengan menggunakan air (O’Keefe
et al. 1997). Pada tahun 1998 peneliti yang sama menemukan protein yang berfungsi sebagai inhibitor HIV, yaitu adociavirin, yang diekstrak dengan menggunakan air (O’Keefe et al. 1998). Komponen tersebut diekstrak dari spons
Adocia sp. Mekanismenya yaitu mempunyai aktivitas antisitopatik dalam sel CEM-SS yang diinfeksi oleh HIV-1 dan 2 dengan nilai EC50 0,4 mM sampai > 400 nM. Potensi HIV ini tergantung pada tipe sel inang, bersifat sangat sensitif terhadap kultur makrofag dan sangat resisten terhadap sel darah putih.
spons yang hidup di laut. Inhibitor tersebut menghambat kontraksi yang diinduksi oleh ion Ca2+ di otot halus yang permiabel. Komponen spons laut, genus Stelletta, yaitu stellettamida-A, dilaporkan mempunyai kemampuan menghambat kontraksi yang diinduksi ion K+ dalam otot halus dengan nilai IC50 88 µM (Abe et al. 1997).
Tabel 1 Spons dan inhibitor enzim yang dihasilkan
Jenis sponge Jenis komponen Aktivitas biologis Referensi
Batzella sp. Diskorhabdin Sitotoksik, inhibitor
enzim
Gunasekera et al.
(1999), diacu dalam Lee et al. (2001)
Halichondria okadai Asam okadaic Inhibitor fosfatase Bialojan dan Takai
(1988)
Haliclona asiris Osirisin Inhibitor ATPase Shin et al. (1998a),
diacu dalam Lee et
al. (2001)
Cacospongia linteiformis
Siklolinteinon, Sesterpen
Inhibitor NO sintase D’acquisto et al.
(2000)
Petrosia sp. Petrosiasetilen Inhibitor ATPase Seo et al. (1998),
diacu dalam Lee et
al. (2001)
Plakinastrella sp. Asam elenat Inhibitor
topoisomerase II
Juagdan et al.
(1995), diacu dalam Lee et al. (2001)
Coscinoderma mathewsi
Suvanin Inhibitor protease
serin
Kimura et al.
(1998), diacu dalam
Mayer dan Lehmann (2000)
Anthoigmella cf. raromicrosclera
Piridin1 Inhibitor proteinase
sistein
Matsunaga et al.
(1998), diacu dalam
Mayer dan Lehmann (2000)
Spongosorites sp. Indol Inhibitor fosfatase Capon et al.
(1998b), diacu dalam Mayer dan Lehmann (2000)
Reniera sarai Polimer alkilpiridinium Antikolinesterase Sepcic et al. (1997)
Irchinia sp. Heksaprenilhidrokuinon Inhibitor HIV reverse
transkriptase
Loya et al. (1997)
Theonella sp. Peptida Inhibitor protease
serin
Nakao et al. (1998),
diacu dalam Mayer
dan Lehmann (2000)
Xetospongia exigua Poliketida
halenakuinon
Inhibitor tirosin kinase
Haefner (2003)
Luffariella variabilis Sesterpen Manoalida
Inhibitor fosfolipase Haefner (2003)
Tsukamoto et al. (2005) melaporkan bahwa spons laut dari genus Mycale
7
proteasom mempunyai aktivitas antitumor pada berbagai sel tumor yang resisten terhadap kemoterapi konvensional. Inhibitor enzim dari jenis spons lain disajikan pada Tabel 1.
Inhibitor Protease dari Mikroorganisme
Serratia marcescens menghasilkan protein inhibitor protease logam yang dikenal dengan nama SmaPI. Inhibitor tersebut dihasilkan dalam jumlah kecil menunjukkan penghambatan terhadap protease logam S. marcescens yang mempunyai bobot molekul 50 kDa. Protein tersebut berlokasi di bagian periplasma sel dalam suhu pertumbuhan sel 25 oC. Rekombinan S. marcescens yang membawa plasmid PSP2 yang mengkodekan SMP dan SmaPI menghasilkan SmaPI pada suhu pertumbuhan sel 25 oC. Namun pada suhu pertumbuhan 37 oC SmaPI justru dihasilkan secara ekstraseluler. SmaPI tersebut mempunyai pI sekitar 10,0, dan merupakan protein monomer dengan bobot molekul 10.000 Dalton. SmaPI stabil dalam air rebusan selama 30 menit dan mempunyai penghambatan yang spesifik terhadap protease logam yang berasal dari S. marcescens (Kim et al.
1995).
Inhibitor protease juga dihasilkan oleh Gliocladium sp. yang disebut dengan inhibitor proteinase sistein, TMC-52A-D. Berdasarkan hasil analisis spektrofotometer dan degradasi kimia menunjukkan bahwa TMC-52A-D merupakan peptida epoksisuksinil. Inhibitor tersebut kuat menghambat protease sistein, terutama katepsin L dengan IC50 pada konsentrasi 13 nM, 10 nM, dan 6 nM (Isshiki
et al. 1998).
Saruno et al. (1980) menemukan inhibitor nuklease dari Monascus purpureus. Adapun aktivitasnya mereduksi nuklease monascus dan nuklease P1 dengan substrat RNA atau DNA yang didenaturasi. Model aksi inhibitor itu adalah penghambatan non kompetitif sehingga dinamakan inhibitor NMP. Murao et al. (1982) melakukan isolasi inhibitor proteinase logam yang dihasilkan oleh mikroba yaitu Streptomyces rishiriensis. Inhibitor tersebut dikenal dengan nama Fungal Metallo-Proteinase Inhibitor (FMPI). Inhibitor tersebut menunjukkan aktivitas yang baik pada proteinase logam dari Aspergillus oryzae dan mempunyai aktivitas sedang terhadap mikroba lainnya. FMPI mempunyai bobot molekul yang rendah dan stabil pada pH alkali (pH > 11).
aerob, mempunyai flagella, gram negatif, mempunyai kandungan G+C yang rendah pada DNA-nya. Mikroba tersebut membutuhkan NaCl untuk pertumbuhannya. Seluruh strain menghidrolisis kasein, DNA, gelatin, dan pati. Berdasarkan hasil identifikasi menunjukkan bahwa mikroba tersebut adalah Alteromonas sp.. Strain B-10-31 adalah untuk membedakan dari 2 strain lainnya (Imada et al, 1985a; Imada, 2000).
Imada et al. (1985b) dan Imada (2000) menemukan marinostatin, suatu inhibitor yang dihasilkan dari Alteromonas sp. B-10-31. Inhibitor tersebut dihasilkan secara optimal bila bakteri penghasilnya ditumbuhkan dalam medium yang optimum. Sumber nitrogen dan karbon yang optimum untuk tujuan tersebut adalah 0,6 % polipepton dan 0,05 % glukosa. Produksi maksimum dihasilkan pada pH 6 dalam air laut, suhu 20 oC dan digoyang 24–33 jam. Jenis inhibitor lain yang dihasilkan oleh Alteromonas sp. adalah jenis monostatin yang mempunyai bobot molekul tinggi yaitu 20.000 Dalton. Inhibitor tersebut termasuk glikoprotein, stabil pada suhu sampai 100 oC selama inkubasi 30 menit dengan kehilangan aktivitas 20 %, juga stabil pada pH 2–12. Aktivitasnya dihambat oleh ion Cu2+ dan Fe2+ hingga tidak ada aktivitasnya. Monostatin mempunyai aktivitas penghambatan terhadap protein tiol, seperti papain dan Ficin (Imada et al. 1985c). Kobayashi et al. (2003) melaporkan Pseudoalteromonas sagamiensis menghasilkan inhibitor protease yaitu marinostatin, monostatin, dan leupeptin. Perbedaan ketiga nama menunjukkan perbedaan dalam struktur dan sifat-sifatnya.
Inhibitor protease, microviridin J, yang dihasilkan oleh cyanobacter
Microcystis strain UWOCC, mempunyai kemampuan untuk menyebabkan lethal molting disruptions pada Daphnia pulicaria. Inhibitor tersebut menghambat enzim trypsin-like daphnia. Jadi ketika microviridin J ditambahkan ke kultur daphnia maka akan terjadi pencernaan yang tidak sempurna sehingga akan menyebabkan berkurangnya asam amino esensial (Rohrlack et al. 2004).
Pseudomonas aeruginosa menghasilkan protease alkalin (serralisin) inhibitor yang mempunyai afinitas yang tinggi terhadap protease zink yang dihasilkan oleh beberapa bakteri gram negatif. Inhibitor tersebut memiliki bobot molekul 11,5 kDa. Fungsi dari inhibitor ini adalah untuk melindungi bakteri dari proteolisis selama sekresi serralisin. Senyawa itu diproduksi sebagai prekursor dengan 125 asam amino dengan urutan signal N-terminal. Sekuen ini akan dihilangkan sebanyak 103-106 residu ketika terjadi maturasi inhibitor (Feltzer et al. 2000). Morris et al. (2002) melaporkan pula inhibitor protease yang dihasilkan oleh
9
mempunyai bobot molekul 43 dan 41 kDa dengan nama TgPI-1 dan termasuk ke dalam golongan/famili SERPIN, Kunitz dan Kazal.
Streptomyces sp. menghasilkan berbagai inhibitor enzim seperti inhibitor α-amilase, peptide dan protein protease inhibitor. Komponen-komponen tersebut mempunyai bobot molekul kurang dari 10 kDa seperti tentamistat, sampai lebih dari 100 kDa seperti ß-galaktosidase. Streptomyces lividans dan Streptomyces longisporus mensekresikan protein dengan bobot molekul sekitar 10 kDa. Inhibitor ini bersifat spesifik terhadap trypsin-like enzyme (Strickler et al. 1992).
YM-254890 merupakan dipeptida siklik yang diisolasi dari
Chromohalobacter sp., merupakan inhibitor yang potensial terhadap agregasi platelet dengan nilai IC50 dibawah 0,4 µM. Inhibitor tersebut juga mempunyai sifat antitrombotik dan trombilisis. Adapun mekanismenya adalah memblok Gαq/11-yang merupakan pasangan dari reseptor ADP P2Y1 yang diperantarai oleh mobilisasi Ca2+ (Takasaki et al. 2004).
Hubungan antara Spons dan Bakteri yang Bersimbiosis
Interaksi antara organisme yang hidup di lingkungan akuatik sangat beragam. Peran penting pada interaksi tersebut dimainkan oleh mikroorganisme. Mikroorganisme banyak ditemukan tumbuh secara komensal di permukaan juga di dalam berbagai binatang akuatik, beberapa diantaranya terdapat di organ pencernaannya dimana sering terdapat sejumlah bakteri (Rheinhemer 1991).
Mikroorganisme dimakan dan digunakan sebagai makanan oleh sejumlah hewan yang hidup, baik di sedimen maupun di perairan sehingga merupakan faktor nutrisi. Beberapa hewan dapat hidup dengan sejumlah tertentu bakteri maupun fungi. Sebagai contoh, lubang berpori pada spons mengandung sejumlah bakteri (Bertrand, Vacelet 1971, diacu dalam Reinhemer 1991). Adapun jumlah mikroorganisme simbion pada spons sangat bervariasi tergantung jenis sponsnya, pada spons tertentu jumlahnya bisa mencapai 60% dari biomasa spons (Wilkinson 1978c, diacu dalam Lee et al. 2001). Spons Mediterania Aplysina aerophoba
Disisi lain banyak invertebrata yang merupakan filter feeder dan mengkonsumsi mikroorganisme melalui fagositosis Hubungan antara invertebrata dan mikroorganisme laut yaitu menyediakan makanan atau yang hidup baik sementara maupun permanen merupakan hal yang kompleks ( Wilkinson 1992; Steinert et al. 2000; Hentschel et al. 2000, diacu dalam Proksch et al. 2002). Mikroorganisme tidak hanya ada sebagai makanan tetapi juga terlibat dalam biosintesis produk alami pada spons. Sebagai contoh spons Halichondria sp. seperti H. okadai dan H. melanodocia menghasilkan asam okadoat. Ternyata senyawa ini dihasilkan oleh dinoflagellata dari genus Prorocentrum (Murakami et al. 1982, diacu dalam Proksch et al. 2002).
Keberadaan simbion pada spons berbeda-beda, ada yang bagian luar tubuh spons disebut dengan eksosimbiosis ekstraseluler, diluar sel tetapi ada disisi dalam spons disebut dengan endosimbiosis ekstraseluler, di dalam sitoplasma sel tubuh spons disebut dengan simbiosis intraseluler, dan ada pula yang di dalam inti sel disebut dengan simbiosis intranukleus(Lee et al. 2001). Lokasi simbion pada spons dapat dilihat pada Gambar 1.
amubosit
mikroorganisme mikroorgan
isme
mikroorga nisme
nukleus
pori
choanosit
spikula mesohil
Eksosimbiosis ekstraseluler
Endosimbiosis ekstraseluler
Simbiosis intraseluler
Simbiosis intranukleus
Gambar 1 Diagram hubungan simbiotik antara spons dan mikroorganisme
(Lee et al. 2001).
Mikroorganisme yang Bersimbiose dengan Spons
11
menghasilkan komponen diketopiperazin (Stierle et al. 1988, diacu dalam Webster
et al. 2001). Informasi terbaru bahwa δ-proteobacterial yang merupakan simbion
Theonella swinhoei menghasilkan peptida yang bersifat sebagai antifungal yaitu theopaluamida (Schmidt 2000, diacu dalam Webster et al. 2001). Webster et al. (2001) menemukan bakteri yang bersimbiose dengan spons adalah actinobacteria, sub divisi β dan protobacteria, cytophaga/flavobacterium, green sulfur bacteria, green nonsulfur bacteria, danplanktomisetes.
Keterlibatan mikroorganisme dalam sintesis produk alami baru-baru ini ditunjukkan oleh spons Dysidea herbacea dan Theonella swinhoei. Spesimen dari
Dysidea herbacea mengandung seskuiterpen spirodisin dan herbadisidolida (Unson dan Faulkner 1993, diacu dalam Proksch et al. 2002). Jaringan spons tersebut diisi dengan cyanobacteria Oscillatoria spongeliae (Berthold et al. 1982, diacu dalam Proksch et al. 2002) hingga mencapai 50% dari volume sel (Bewley dan Faulkner 1998, diacu dalam Proksch et al. 2002). Pekerjaan yang dilakukan untuk membuktikan bahwa simbion terlibat dalam sintesis produk alami di spons yaitu pertama-tama jaringan spons dihancurkan dan dilakukan fiksasi terhadap sel yang terpisah menggunakan formadehida dan glutaraldehida. Sel cyanobacteria dipisahkan dari sel lainnya dengan alat penyaring sel menggunakan fluorescens klorofil sebagai pendeteksi. Hasilnya didapatkan komponen utamanya adalah turunan 13-demetilisodisidenin. Sementara itu yang tidak berfluorescens terdiri atas spons dan bakteri, mengandung spirodisin dan herbadisidolida (Unson dan Faulkner 1993, diacu dalam Proksch et al. 2002).
Spons A. aerophoba kaya akan bakteri. Berdasarkan hasil analisis, 40% biomasa spons merupakan bakteri dan cyanobacteria. Namun kurang dari 1% yang dapat dikultur. Bakteri pada spons tersebut bersifat stabil. Hal ini dibuktikan ketika spons tersebut ditransplantasi, ternyata komunitas bakteri yang ada sangat mirip dengan asalnya (Fridrich et al. 2001, diacu dalam Proksch et al. 2002). Kemiripan komunitas bakteri antara A. aerophoba dan A. cavernicola berkorelasi dengan bromina kemiripan dalam profil produk alami yang dihasilkan keduanya, yaitu alkaloid sebagai komponen utamanya (Ebel et al. 1997, diacu dalam Proksch et al.
Tabel 2 Spons dan mikroorganisme simbion penghasil produk alami
Spons Mikroorganisme simbion Produk alami
Dysidea sp. Vibrio sp. Bifenil eter bromina
Halicondria okadai Alteromonas sp. Alteramida A
Halicondria panicea Antarticum vesiculatum Senyawa neuroaktif
Halicondria panicea Psychroserpens burtonensis Senyawa neuroaktif
Homophymia sp. Pseudomonas sp. Senyawa antimikroba
Subere creba Pseudomonas sp. Kuinolon
Tedania ignis Microccus sp. Diketopiperazin
Xetospongia sp. Microccus luteus Senyawa antimikroba
Sumber: Lee et al. (2001)
Penggolongan Inhibitor Enzim
Inhibitor enzim dapat digolongkan berdasarkan mekanisme kerjanya dan spesifisitas kerjanya.
Penggolongan inhibitor enzim berdasarkan mekanisme kerjanya
Berdasarkan mekanisme kerjanya inhibitor enzim dibagi atas inhibitor kompetitif, non kompetitif, unkompetitif dan penghambatan oleh substrat. Inhibitor kompetitif akan menyebabkan berubahnya nilai Km, yang nilainya menjadi lebih besar dari semula, namun tidak mengubah nilai kecepatan maksimumnya (Vmaks). Nilai Km merupakan nilai yang menunjukkan penggunaan substrat untuk mencapai setengah kecepatan maksimum. Jenis inhibitor ini mempunyai struktur yang serupa dengan substrat, sehingga pengaruh aktivitas ini dapat dikurangi dengan cara meningkatkan konsentrasi substrat. Biasanya inhibitor ini berikatan pada bagian aktif enzim. Ikatan yang terjadi meliputi ikatan kovalen, elektrostatik, ikatan hidrogen, vander walls, atau interaksi hidrofobik.
Inhibitor non kompetitif akan menyebabkan turunnya nilai kecepatan maksimum (Vmaks), namun tidak mengubah nilai Km. Inhibitor jenis ini tidak mempunyai struktur yang sama dengan substrat sehingga tidak akan dapat diturunkan aktivitasnya melalui peningkatan konsentrasi substrat. Pengikatan terhadap enzim terjadi di luar sisi aktifnya.
13
Pada beberapa enzim, sering terjadi penghambatan unkompetitif, yaitu inhibitornya adalah substrat pada tingkat konsentrasi yang tinggi. Pada keadaan ini, molekul substrat berinteraksi dengan senyawa komplek ES membentuk ESS yang bersifat tidak produktif, artinya tidak dapat membentuk produk yang dikehendaki.
Penggolongan inhibitor enzim berdasarkan spesifisitas kerjanya
Berdasarkan spesifisitas kerjanya, inhibitor enzim dibagi atas inhibitor enzim non spesifik dan spesifik. Inhibitor non spesifik meliputi α-macroglobulin dan peptida aldehida, sedangkan yang spesifik meliputi inhibitor protease serin, protease sistein, protease logam, dan protease aspartat.
Inhibitor non spesifik
α-macroglobulin mempunyai bobot molekul yang tinggi dan dapat menghambat kebanyakan protease. Inhibitor ini mempunyai kemampuan menghambat enzim dengan cara memerangkap proteinase secara fisik. Bersifat irreversibel. Mempunyai kemampuan menghambat substrat berukuran kecil, namun kebanyakan menghambat protein dengan ukuran > 30 kDa. Inhibitor jenis peptida aldehida terdiri atas leupeptin dan antipain, merupakan di-, tri-, atau tetrapeptida yang mengandung aldehida, dan merupakan inhibitor reversibel.
Inhibitor spesifik
Inhibitor protease serin meliputi organofosfat, fenil metil sulfonil fluorida (PMSF), dan kumarin. Ketiganya bersifat irreversibel. Organofosfat merupakan komponen yang toksik karena menginaktifkan asetilkolin esterase. PMSF bersifat kurang selektif, sehingga dapat digunakan secara umum untuk protease serin, dengan beberapa protease sistein bersifat reversibel. Komponen penyusun kumarin adalah heterosiklik, bersifat nontoksik, mempunyai reaktifitas yang baik dengan kebanyakan protease serin, mempunyai kecepatan reaksi yang lebih cepat dibandingkan dengan DFP atau PMSF sehingga merupakan inhibitor yang paling banyak direkomendasikan. Inhibitor protease serin lainnya seperti avian ovomucoid, kunitz-trypsin inhibitor dan inhibitor tripsin soybean bersifat reversibel, namun mekanismenya belum seluruhnya dipelajari.
Penghambatan yang dilakukan oleh inhibitor pengkelat logam terhadap protease logam adalah melalui pembentukan zink monohidroksida yang menjembatani katalitik ion zink terhadap rantai samping dalam sisi aktif enzim sehingga bersifat kompetitif terhadap substrat.
Senyawa yang termasuk dalam inhibitor protease aspartat adalah pepstatin A. Inhibitor ini menghambat pepsin, kimosin, katepsin D. Inhibitor tersebut menyerupai pentapeptida yang mengandung dua residu dari ß-amino acid statine [(3S, 4S)-4-amino-3-hydroxy-6-methylheptanoic acid.
Aoyagi dan Takeuchi (1989) menggolongkan inhibitor protease berdasarkan spesifisitas kerjanya seperti disajikan pada Gambar 2.
Inhibitor Peptidase Proteinase
Protease serin Leupeptin, antipain,
kimostatin, elastatinal, Ac-leu-Argal, Z-diprotin
Endo Aspartat Pestatin, pepstanon, hidroksipeptatin,
Logam fosforamidon, steffimisin
Protease
Peptidase
Amino Amastatin, aktinonin,
bestatin, arfamenin A dan B. formestin, probestin
Exo Dipeptidilamino Ac-leu-argal, antipain, leupeptin, diprotin A dan B Carboksi- (S)-α asam benzilmalat ,
histargin
Dipeptidilkarboksi- EDDS, foroksimitin, histargin
Gambar 2 Protease dan inhibitornya yang ber-BM rendah (Aoyagi dan Takeuchi 1989).
Pemurnian Inhibitor Enzim
15
tujuannya. Tujuan pemurnian inhibitor enzim adalah agar menjadi murni yang ditunjukkan oleh aktivitasnya yang jauh lebih tinggi. Untuk mempelajari struktur molekul, diperlukan tingkat kemurnian yang sempurna (100 %), namun tidak demikian halnya bila tujuannya hanya untuk mempelajari sifat hayati dari inhibitor enzim yang merupakan protein. Oleh karena itu, pelaksanaan pemurnian harus mempertimbangkan hal-hal tertentu guna mempertahankan fungsi hayati inhibitor enzim dengan cara mencegah terjadinya denaturasi sehingga aktivitas inhibitor enzim menjadi turun bahkan tidak aktif sama sekali.
Ekstraksi inhibitor enzim
Metode ekstraksi dapat dilakukan dengan pengendapan menggunakan amonium sulfat atau pelarut organik, seperti aseton. Amonium sulfat digunakan karena bersifat larut air, tidak bersifat toksik dan kadang-kadang menstabilkan protein (Richardson dan Hyslop 1985). Pengendapan dapat juga dilakukan dengan pelarut organik, seperti alkohol dan aseton. Bila menggunakan aseton untuk mengekstraksi protein, harus digunakan suhu di bawah 4 oC guna mencegah denaturasi. Guna menyempurnakan proses ekstraksi, protein dibiarkan semalam pada suhu di bawah 4 oC (Bollag dan Edelstein 1991).
Fraksinasi menggunakan kolom kromatografi
Fraksinasi inhibitor enzim merupakan suatu proses pemurnian untuk memisahkan protein inhibitor dengan protein lainnya yang terdapat pada ekstrak kasar inhibitor enzim. Kromatografi kolom merupakan teknik yang efisien dalam pemisahan protein ekstrak hayati. Metode fraksinasi dengan kolom kromatografi berbeda-beda tergantung pada tujuan karakter fraksi protein yang difraksinasi sebagaimana disajikan pada Tabel 3.
Tabel 3 Metode kromatografi untuk fraksinasi protein
Sifat protein Jenis kromatografi
Ukuran dan bentuk Filtrasi gel
Muatan neto dan distribusi grup bermuatan Penukar ion
Titik isoelektrik Kromatofokusing
Hidrofobisitas Interaksi hidrofobik dan fase balik
Pengikatan logam Afinitas ion logam terimobilisasi
Kandungan thiol yang terbuka Kovalen
Afinitas biospesifik terhadap ligan, inhibitor, reseptor, antibody, dan lain-lain
Afinitas
Beberapa peneliti telah melakukan pemurnian inhbitor enzim yang dihasilkan oleh mikroorganisme. Pemilihan jenis proses pemurnian inhibitor enzim tergantung pada jenis inhibitor enzim yang dimurnikan. Tabel 4 menyajikan jenis inhibitor enzim yang telah dimurnikan dan metode ekstraksi dan pemurnian yang digunakan.
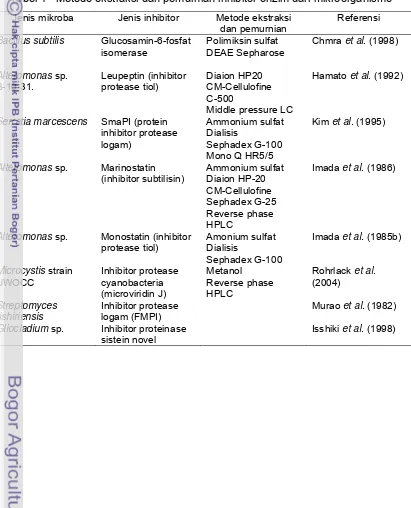
Tabel 4 Metode ekstraksi dan pemurnian inhibitor enzim dari mikroorganisme
Jenis mikroba Jenis inhibitor Metode ekstraksi
dan pemurnian
Referensi
Bacillus subtilis Glucosamin-6-fosfat
isomerase
Polimiksin sulfat DEAE Sepharose
Chmra et al. (1998)
Alteromonas sp. B-10-31.
Leupeptin (inhibitor protease tiol)
Diaion HP20 CM-Cellulofine C-500
Middle pressure LC
Hamato et al. (1992)
Serratia marcescens SmaPI (protein
inhibitor protease logam)
Ammonium sulfat Dialisis
Sephadex G-100 Mono Q HR5/5
Kim et al. (1995)
Alteromonas sp. Marinostatin
(inhibitor subtilisin)
Ammonium sulfat Diaion HP-20 CM-Cellulofine Sephadex G-25 Reverse phase HPLC
Imada et al. (1986)
Alteromonas sp. Monostatin (inhibitor
protease tiol)
Amonium sulfat Dialisis
Sephadex G-100
Imada et al. (1985b)
Microcystis strain UWOCC
Inhibitor protease cyanobacteria (microviridin J)
Metanol Reverse phase HPLC
Rohrlack et al.
(2004)
Streptomyces rishiriensis
Inhibitor protease logam (FMPI)
Murao et al. (1982)
Gliocladium sp. Inhibitor proteinase
sistein novel
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai tahun 2003 sampai akhir tahun 2005, bertempat di Laboratorium Bioteknologi Hewan dan Biomedis, juga Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi bakteri patogen penghasil protease, yaitu Pseudomonas aeruginosa, Escherichia coli,
Staphylococcus epidermidis, Aeromonas hydrophilla, dan Staphylococcus aureus
yang diisolasi dari pasien Rumah Sakit Pusat Pertamina, Jakarta; spons yang diambil dari Pulau Panggang, Kepulauan Seribu sebagai sumber isolat bakteri penghasil inhibitor. Medium yang digunakan untuk eksplorasi, pertumbuhan, dan produksi protease seperti Luria Bertani Agar {Trypton(Oxoid), yeast extract (Oxoid), NaCl (Merck), bactoagar (Difco)}, dan susu skim. Media yang digunakan untuk eksplorasi, pertumbuhan dan produksi inhibitor dari bakteri asal spons yaitu marine agar {special peptone (Oxoid), yeast extract (Oxoid), NaCl (Merck), trace element,
glucose monohidrat (Merck)} dan susu skim. Komposisi media yang digunakan untuk pertumbuhan bakteri patogen dan bakteri laut dapat dilihat pada Lampiran 1.
Bahan-bahan untuk ektraksi dan pemurnian inhibitor protease yaitu amonium sulfat (NH4)2SO4, Sephadex G75, dan Sephadex A-50, serta bufer TrisHCl. Bahan kimia yang digunakan untuk analisis aktivitas protease, konsentrasi protein dan aktivitas inhibitor protease meliputi Trisbase, kasein, asam trikloro asetat (TCA), tirosin, Na2CO3, folin dan pereaksi Bradford. Logam-logam yang digunakan untuk karakterisasi inhibitor protease adalah NaCl, KCl, CaCl2, ZnCl2, MgCl2, FeCl3.6H2O. Pembuatan pereaksi yang digunakan untuk analisis protease dan inhibitor protease disajikan pada Lampiran 2.
Metode Penelitian
Metode penelitian terdiri dari empat tahap, yaitu tahap I isolasi dan identifikasi bakteri serta pemilahan bakteri yang berasosiasi dengan spons sebagai penghasil inhibitor protease; tahap II optimasi media yang digunakan untuk produksi inhibitor protease; dan tahap III pemurnian inhibitor protease dan tahap IV karakterisasi inhibitor protease. Tahapan penelitian disajikan pada Tabel 5.
Tabel 5 Tahapan penelitian
No. Tahapan penelitian Parameter yang diukur
Tahap I isolasi dan identifikasi bakteri serta pemilahan bakteri yang berasosiasi dengan spons sebagai penghasil inhibitor protease
1. Pengumpulan sampel (spons)
2. Pemilahan dan pemurnian bakteri yang berasosiasi
dengan spons
3. Pemilahan bakteri penghasil inhibitor protease
dengan metode skim 2 lapisan; sebagai bakteri uji:
E. coli, S. aureus, dan P. aeruginosa asal Rumah
Sakit Pusat Pertamina
Isolat yang positif menghasilkan inhibitor protease, dilanjutkan ke tahap berikutnya
4. Karakterisasi bakteri penghasil inhibitor protease - pewarnaan gram
- pewarnaan spora - motilitas
- uji biokimia (Microbact 12 A dan 12 B)
5. Pemilahan bakteri penghasil inhibitor protease
berdasarkan aktivitas inhibitor protease tertinggi Sebagai substrat digunakan protease dari bakteri
E. coli, S. aureus, dan P. aeruginosa
- OD - pH
- konsentrasi protein - aktivitas inhibitor protease
Isolat yang mempunyai aktivitas inhibitor protease tertinggi dilanjutkan ke tahap berikutnya
6. Identifikasi molekular bakteri penghasil inhibitor
protease tertinggi
Analisa 16S rRNA
Tahap II optimasi media yang digunakan untuk produksi inhibitor protease
7. Optimasi media produksi inhibitor protease
Variasi komposisi media: glukosa 0,1% (w/v) dan
yeast extract (1%; 0,5%; 0,1% w/v), dengan
pembanding media marine broth yang ditambah
glukosa 0,05 % (w/v)
Substrat: protease P. aeruginosa
- OD - pH
19
Tabel 5 Lanjutan
No. Tahapan penelitian Parameter yang diukur
8. Optimasi media produksi inhibitor protease
Variasi komposisi media: glukosa 0,05 % (w/v) dan
yeast extract 0,1 %; 0,2 %; 0,3 %; 0,4 % (w/v)
Substrat: protease P. aeruginosa
- OD - pH
- konsentrasi protein - aktivitas inhibitor protease
Media terbaik (menghasilkan inhibitor protease dengan aktivitas tertinggi) digunakan untuk tahap selanjutnya
Tahap III pemurnian inhibitor protease
9. Ekstraksi dengan amonium sulfat dan aseton - aktivitas inhibitor protease
- konsentrasi protein
Metode ekstraksi terbaik digunakan untuk tahap selanjutnya
10. Dialisis dan pengeringan beku
11. Pemurnian inhibitor protease dengan filtrasi gel
12. Pemurnian inhibitor protease dengan penukar ion
13. Produksi inhibitor protease dengan metode terbaik
untuk setiap tahapnya
- aktivitas inhibitor protease - konsentrasi protein
Tahap IV karakterisasi inhibitor protease
13. Ekstrak kasar - penentuan suhu dan pH
optimum
- kestabilan panas - kestabilan panas pada kondisi optimum
- IC50
- mekanisme penghambatan - penentuan bobot molekul protein
14. Hasil pengendapan dengan aseton - penentuan suhu dan pH
optimum
- kestabilan panas - kestabilan panas pada kondisi optimum - penentuan bobot molekul protein
15. Hasil pemurnian dengan filtrasi gel - penentuan suhu dan pH
optimum
- kestabilan panas - kestabilan panas pada kondisi optimum
- IC50
- pola penghambatan - penentuan bobot molekul protein
16. Hasil pemurnian dengan penukar ion - penentuan bobot molekul
Penelitian tahap I isolasi dan identifikasi bakteri serta pemilahan bakteri yang berasosiasi dengan spons sebagai penghasil inhibitor protease
Tahap I meliputi pengumpulan sampel, pemilahan dan pemurnian bakteri yang berasosiasi dengan spons, karakterisasi bakteri penghasil inhibitor protease, penentuan bakteri penghasilkan inhibitor protease dalam media marine broth
dengan aktivitas tertinggi dan identifikasi bakteri penghasil inhibitor protease. Pengumpulan sampel
Sampel spons diambil dari Perairan Pulau Panggang, Kepulauan Seribu sebanyak 10 jenis dan diambil pada kedalaman berbeda (4-12 m). Sampel disimpan dalam media marine broth : gliserol = 1 : 1. Lokasi pengambilan sampel spons disajikan pada Lampiran 3.
Pemilahan dan pemurnian bakteri yang berasosiasi dengan spons.
Masing-masing spons (1 gram) dihancurkan menggunakan mortar, lalu diencerkan 10 kali. Supernatan sebanyak 200 µl disebar pada marine agar dan diinkubasi pada suhu 30 oC selama 5 hari. Pemurnian dilakukan dengan cara menggoresnya berulang kali, sampai didapatkan koloni tunggal yang murni.
Pemilahan bakteri penghasil inhibitor protease yang berasosiasi dengan spons (Modifikasi Imada 1986)
Pemilahan dilakukan dengan menggunakan metode plate agar dua lapis. Lapisan bawah terdiri dari marine agar (MA), sedangkan lapisan atas terdiri dari luria bertani agar (LA) yang diberi skim 1,5 % (w/v). Isolat bakteri laut yang akan dipilah, ditusukkan pada lapisan bawah (MA), lalu diinkubasi 24, 48, dan 72 jam pada suhu 30 oC. Isolat yang tumbuh dibuang, kemudian diberi lapisan atas. Isolat bakteri patogen ditusukkan pada bagian atas lalu diinkubasi 24 jam pada suhu 37 oC. Isolat yang positif menghasilkan inhibitor protease menunjukkan tidak adanya zona bening di sekitar koloni bakteri patogen atau bakteri patogen tidak tumbuh.
Karakterisasi bakteri penghasil inhibitor protease
Isolat yang potensial menghasilkan inhibitor protease dikarakterisasi fisiologis (gram, spora, motilitas) dan biokimiawi.
Pewarnaan gram (Cappucino dan Shermna 1983).
21
dengan safranin selama 30 detik, dibilas dengan akuades, dan ditiriskan. Kelebihan air diserap menggunakan kertas tisu. Pengamatan dilakukan dengan mikroskop. Bila sel bakteri bakteri berwarna merah berarti bakteri tersebut termasuk golongan bakteri gram negatif, dan sebaliknya jika berwarna biru termasuk golongan bakteri gram positif.
Motilitas (Jenie dan Fardiaz 1989)
Uji ini dilakukan dengan menusukkan satu ose dalam media SIM 0.5 % (w/v), diinkubasi pada suhu 30oC selama 24 jam. Bila koloni menyebar berarti bakteri mempunyai motilitas positif.
Morfologi sel (JEOL 1995)
Metode ini dilakukan menggunakan mikroskop elektron dan diperuntukkan khusus untuk isolat 6A3. Tahapannya adalah sebagai berikut: isolat 6A3 ditumbuhkan pada media marine broth hingga mencapai fase logaritmik (OD 0,8). Pelet diperoleh dengan cara memisahkannya dari media melalui sentrifugasi dengan kecepatan 8000 rpm selama 15 menit. Pelet difiksasi dengan glutaraldehida 2,5 % (v/v) dalam 0,1 M bufer sodium cacodilat pH 7,2, dibiarkan selama 1,5 jam, dicuci dua kali dengan bufer cacodilat 0,05 M, pH 7,2 masing-masing selama 20 menit. Selanjutnya difiksasi dengan osmium tetraoksida 1 % (w/v) dalam bufer cacodilat 0,05 % (w/v), pH 7,2 selama 1-2 menit, lalu dicuci dengan akuabides sebanyak tiga kali, masing-masing selama 2 menit. Pelet yang sudah difiksasi dikeringkan dengan etanol pada berbagai konsentrasi secara bertahap, dimulai dari 25, 50, 75 kemudian 100 % (v/v) sebanyak tiga kali, masing-masing selama 10 menit. Pelet diambil dan dilewatkan melalui membran 0,2 µm untuk selanjutnya direkatkan pada stub aluminium dan dilapisi dengan emas melalui proses vakum (6-7 Pa) selama 20 menit, kemudian sampel diamati dibawah
scanning electron microscope (SEM) tipe JEOL 5310.
Pewarnaan spora (Lay 1994)
mikroskop. Warna merah merah menunjukkan sel vegetatif dan warna hijau menunjukkan adanya spora.
Penentuan kisaran suhu, pH, dan konsentrasi NaCl (%) pertumbuhan bakteri (isolat 6A3)
Kisaran suhu pertumbuhan ditentukan dengan cara menumbuhkan bakteri
pada suhu 10-40 oC. Kisaran pH pertumbuhan ditentukan dengan cara
menumbuhkan bakteri pada pH 3-10. Sedangkan kisaran pH pertumbuhan ditentukan dengan menumbuhkan bakteri pada konsentrasi NaCl 1-50 % (w/v). Semua uji tersebut dilakukan dalam media marine broth.
Uji biokimia (MVD)
Pengujian biokimiawi dilakukan menggunakan kit Microbact 12A dan 12B. Adapun yang diamati adalah lisina, ornitin, H2S, glukosa, manitol, xilosa, ortonitrofenil-ß-d-galaktopiranosida (ONPG), indol, urease, Voges Preskauer (VP), sitrat, dan triptofan deaminase (TDA) (Microbact Kit 12A), serta gelatin, malonat, inositol, sorbitol, ramnosa, sukrosa, laktosa, arabinosa, adonitol, rafinosa, salisina, dan arginina (Microbact Kit 12B).
Penentuan bakteri penghasil inhibitor protease tertinggi dalam media marine broth Media yang digunakan adalah marine broth. Tahap propagasi dilakukan pada suhu 30 oC dengan kecepatan 150 rpm hingga mencapai fase logaritmik. Setelah itu dilakukan kultivasi selama 52 jam pada kondisi yang sama. Pengamatan pada penentuan optimasi waktu produksi dilakukan tiap 4 jam sekali. Ekstrak kasar didapatkan dengan cara melakukan sentrifugasi terhadap sampel yang diambil pada kecepatan 8.000 rpm selama 15 menit. Analisis meliputi pH, OD (λ=660 nm), dan konsentrasi protein (metode Bradford), dan aktivitas inhibitor protease (Imada
et al. 1985c). Sebagai substrat digunakan protease dari E. coli, P. aeruginosa, dan
S. aureus yang diproduksi dengan metoda Baehaki (2004). Disamping itu juga dilakukan penentuan konsentrasi NaCl yang tepat untuk pertumbuhan isolat 6A3 dan produksi inhibitor protease dalam media fermentasi dengan perlakuan konsentrasi NaCl 1–4 % (w/v). Pertumbuhan terbaik isolat 6A3 ditentukan dengan rancangan acak lengkap (RAL) sederhana 1 faktor, sedangkan uji lanjutnya menggunakan Uji Duncan (Steel dan Torrie 1980).
Identifikasi bakteri pengha