PERBEDAAN UKURAN DAN
SUHU LINGKUNGAN
RHESA AGUNG MAULANA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Mas (Cyprinus carpio L.) akibat Pengaruh Perbedaan Ukuran dan Suhu Lingkungan. Dibimbing oleh RUDDY SUWANDI dan RONI NUGRAHA.
Ikan mas merupakan ikan air tawar yang biasa dijual dalam keadaan hidup. Teknik transportasi ikan hidup yang dapat menjamin ikan tetap hidup hingga ke tangan konsumen sangat dibutuhkan. Upaya meningkatkan kepadatan ikan dengan mengurangi jumlah air telah dilakukan. Upaya tersebut masih belum diikuti dengan upaya peningkatan ketahanan hidup ikan dan kajian fisiologis ikan sehingga, masih banyak masalah yang dihadapi. Suhu merupakan salah satu faktor fisik yang berpengaruh terhadap proses fisiologis ikan. Informasi dasar tentang sifat fisiologis ikan mas pada suhu berbeda yaitu suhu dingin, suhu ruang, dan
suhu hangat sangat diperlukan terutama mengeanai metabolismenya (tingkat konsumsi oksigen dan produksi metabolit). Tujuan penelitian ini adalah
mendapatkan informasi mengenai perubahan kondisi fisiologis ikan mas (C. carpio L.) serta perubahan kualitas air pada perlakuan perbedaan ukuran dan perbedaan suhu lingkungan.
Penelitian ini terdiri dari dua tahap yaitu penelitian pendahuluan dan penelitian utama. Tujuan penelitian pendahuluan adalah untuk memilih size ikan mas ukuran konsumsi (size 4, size 5, dan size 6) yang memiliki daya tahan terbaik terhadap perubahan lingkungan (kepadatan). Penelitian utama dilakukan untuk mendapatkan informasi mengenai perubahan kondisi fisiologis ikan mas dibawah kondisi suhu lingkungan yang berbeda. Rancangan percobaaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial dengan satu faktor, yaitu faktor pemberian ukuran untuk penelitian pendahuluan dan faktor pemberian suhu untuk penelitian utama dengan taraf suhu dingin, suhu ruang, dan suhu hangat. Apabila hasil perhitungan menunjukkan pengaruh yang berbeda nyata, maka dilakuan uji lanjut Duncan.
Hasil penelitian menunjukkan bahwa ikan mas dengan size 4 memiliki SR yang paling tinggi yaitu 62,5 %, diikuti oleh size 5 sebesar 60 %, dan size 6 sebesar 50 %. Penurunan kualitas air pada perlakuan size 4 relatif lebih lambat dibandingkan dengan size 5 dan size 6. Rata-rata jumlah bukaan mulut yang paling banyak didapatkan oleh ikan size 6 yaitu sebesar 1643, sedangkan rata-rata terkecil didapatkan oleh ikan size 4 yaitu sebesar 1131. Tingkat konsumsi oksigen tetinggi pada perlakuan perbedaan suhu didapatkan pada perlakuan suhu hangat menit ke-30 yaitu sebesar 23,40 ± 0,42 mgO2/kg/jam, sedangkan tingkat konsumsi
oksigen terendah didapatkan pada perlakuan suhu ruang menit ke-90 yaitu sebesar 0,14 ± 0,02 mgO2/kg/jam. Perhitungan kualitas air pada perlakuan perbedaan suhu
untuk parameter DO, CO2, TAN, dan pH yang terbaik didapatkan oleh perlakuan
PERBEDAAN UKURAN DAN
SUHU LINGKUNGAN
RHESA AGUNG MAULANA C34080089
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama Mahasiswa : Rhesa Agung Maulana
NRP : C34080089
Program Studi : Teknologi Hasil Perairan
Menyetujui
Pembimbing I Pembimbing II
Dr. Ir. Ruddy Suwandi, MS. MPhil Roni Nugraha, S.Si, M.Sc NIP : 1958 0511 1985 03 1 002 NIP : 1983 0421 2009 12 1 003
Mengetahui
Ketua Departemen Teknologi Hasil Perairan.
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 1958 0511 1985 03 1 002
Dengan ini saya menyatakan bahwa skripsi dengan judul “Perubahan Kondisi Fisiologis Ikan Mas (Cyprinus carpio L.) akibat Pengaruh Perbedaan Ukuran dan Suhu Lingkungan” adalah benar karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya
yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam
daftar pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Rhesa Agung Maulana
anugerahNya sehingga penulis dapat menyelesaikan skripsi dengan cukup baik
dan lancar. Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar
Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi
hasil penelitian ini berjudul “Perubahan Kondisi Fisiologis Ikan Mas
(Cyprinus carpio L.) akibat Pengaruh Perbedaan Ukuran dan Suhu Lingkungan”.
Penulisan skripsi ini tidak lepas dari bimbingan, dukungan, dan bantuan
dari berbagai pihak. Penulis sangat berterima kasih pada:
1. Dr. Ir. Ruddy Suwandi, M.S, M.Phil dan Roni Nugraha, S.Si, M.Sc
sebagai Dosen Pembimbing yang telah membimbing dan memberikan
arahan dengan penuh kesabaran.
2. Dr. Ir. Nurjanah, M.S, sebagai Dosen Penguji atas saran yang telah
diberikan.
3. Ibu Etty Lisnawati, Bapak Sumardi Sumamiharja, Yuska Etika Mardiana,
Dwi Prima Nurani, dan Irfan Widya Permana atas perhatian dan
dukungannya.
4. Yunita Puspa Dewi atas saran, semangat, dan bantuannya.
5. Teman-teman THP 45 atas kenangan indah yang telah terukir.
6. Kakak-kakak kelas THP 44, 43, dan 42 atas saran yang sangat membantu.
Penulis menyadari penulisan skrpsi ini masih belum sempurna. Penulis
sangat terbuka atas saran maupun kritik yang membangun. Semoga skripsi ini
dapat bermanfaat bagi semua pihak yang memerlukan.
Bogor, September 2012
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal
27 Juni 1989 sebagai anak ketiga dari lima bersaudara dari
pasangan Sumardi Sumamiharja dan Etty Lisnawati. Pada
tahun 2008, penulis lulus dari SMA Kornita, Bogor dan pada
tahun yang sama, penulis diterima di Institut Pertanian Bogor
(IPB) melalui jalur SPMB (Seleksi Penerimaan Mahasiwa Baru).
Selama pendidikan, Penulis pernah menjadi asisten mata kuliah Teknologi
Penanganan dan Transportasi Biota Hasil perairan pada tahun 2010-2011, asisten
mata kuliah Fisiologi, Formasi, dan Degradasi Metabolit Hasil Perairan pada
tahun 2011, serta asisten mata kuliah Biotoksikologi Hasil Perairan pada
tahun 2011.
Penulis pernah menjadi anggota Divisi Informasi dan Komunikasi,
Himpunan Mahasiswa Teknologi Hasil Perairan (HIMASILKAN, 2009-2011),
dan anggota Baraccuda Music Club (BMC, 2009-2010). Penulis melakukan
penelitian dengan judul “Perubahan Kondisi Fisilogis Ikan Mas (Cyprinus carpio L.) akibat Pengaruh Perbedaan Ukuran dan Suhu Lingkungan” sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dibimbing oleh
viii
3.3.2 Penelitian pendahuluan ... 11
3.4.3 Penelitian utama ... 12
3.5 Rancangan Percobaan... 12
4 HASIL DAN PEMBAHASAN ... 4.1 Sifat Fisiologis Ikan Mas (C. carpio L.) ... 13
4.2 Tingkat Konsumsi Oksigen Ikan Mas (C. carpio L.) ... 18
ix
DAFTAR TABEL
Nomor Halaman
1 Parameter kualitas air, alat, dan cara pengukurannya ... 10
2 Jumlah bukaan mulut ikan saat mengambil oksigen ke permukaan 14
3 Nilai perhitungan SR perlakuan perbedaan ukuran ... 14
4 Tingkat konsumsi oksigen ikan mas selama simulasi... 18
5 Pengamatan fisik tingkah laku ikan pada suhu dingin, ruang, dan hangat ... 25
6 Uji kadar glukosa darah pada beberapa suhu di awal dan akhir
x
DAFTAR GAMBAR
Nomor Halaman
1 Ikan mas (Cyprinus carpio L.) ... 3
2 Diagram alir tahapan pengujian fisiologis ikan mas ... 13
3 Grafik nilai DO pada perlakuan perbedaan ukuran ... 13
4 Grafik nilai CO2 pada perlakuan perbedaan ukuran ... 15
5 Grafik nilai TAN pada perlakuan perbedaan ukuran ... 16
6 Grafik nilai pH pada perlakuan perbedaan ukuran ... 17
7 Diagram batang nilai rata-rata parameter DO ... 19
8 Diagram batang nilai rata-rata parameter CO2 ... 20
9 Diagram batang nilai rata-rata parameter TAN ... 21
xi
DAFTAR LAMPIRAN
Nomor Halaman
1 Data kualitas air perbedaan ukuran ikan mas ... 34
2 Data pengamatan tingkah laku ikan pada perlakuan perbedaan ukuran ... 35
3 Data kualitas air perbedaan suhu lingkungan ... 38
4 Data pengamatan tingkah laku ikan pada perlakuan perbedaan suhu lingkungan ... 39
5 Tabel ANOVA perlakuan perbedaan ukuran ... 42
6 Tabel ANOVA perlakuan perbedaan suhu ... 45
7 Tabel uji lanjut Duncan perlakuan perbedaan ukuran ... 48
8 Tabel uji lanjut Duncan perlakuan perbedaan suhu ... 50
1 PENDAHULUAN
1.1 Latar Belakang
Transportasi biota hasil perairan berfungsi menghubungkan produsen
produk perikanan dengan konsumen. Permintaan konsumen terhadap komoditas
perikanan dalam bentuk hidup semakin besar dan berkembang, karena ikan
hidup memiliki kesegaran yang masih prima. Perdagangan ikan dalam bentuk
hidup selain menguntungkan konsumen, juga dapat menguntungkan pedagang
karena harganya bisa mencapai tiga hingga empat kali harga ikan mati
(Suparno et al. 1994). Imanto (2008) menyatakan pula bahwa transportasi ikan
hidup sangat penting bagi perdagangan ikan karena dapat meningkatkan nilai jual
yang lebih tinggi dan meningkatkan nilai hasil usaha.
Ikan mas (Cyprinus carpio L.) tergolong ikan ekonomis penting karena
ikan ini digemari oleh masyarakat. Produksi ikan mas ditargetkan akan meningkat
dari 280.000 ton (2011) menjadi 380.000 ton di tahun 2012 (KKP 2012).
Optimisme peningkatan produksi ikan mas ini dikarenakan telah ditemukannya
vaksin bagi virus KHV yang menyerang ikan mas. Nugroho & Wahyudi (1991)
menyatakan pula bahwa ikan mas merupakan salah satu dari 10 jenis ikan
budidaya air tawar penting yang dapat dibudidayakan di Indonesia.
Ikan mas merupakan ikan air tawar yang biasa dijual dalam keadaan
hidup. Teknik transportasi ikan hidup yang dapat menjamin ikan sampai kepada
konsumen dalam keadaan tetap hidup sangat dibutuhkan. Teknik transportasi ikan
mas hidup yang biasa digunakan masyarakat adalah sistem basah tertutup dengan
kantong plastik dan sistem basah terbuka dengan drum plastik atau wadah blong.
Upaya meningkatkan kepadatan ikan dengan mengurangi jumlah air telah
dilakukan. Upaya tersebut masih belum diikuti dengan upaya peningkatan
ketahanan hidup ikan dan kajian fisiologis ikan sehingga masih banyak masalah
yang dihadapi. Suhu merupakan salah satu faktor fisik yang berpengaruh terhadap
proses fisiologis ikan. Rachmawati et al. (2010) melaporkan bahwa suhu
merupakan salah satu sumber stres yang dapat mempengaruhi perubahan
fisiologis tubuh ikan. Ketidaksesuaian suhu tempat ikan hidup (lingkungan) akan
Kajian ini dilakukan untuk mengetahui pengaruh suhu lingkungan
terhadap fisiologis ikan mas. Informasi dasar tentang sifat fisiologis ikan mas
pada suhu berbeda yaitu suhu dingin, ruang, dan hangat sangat diperlukan
terutama mengeanai metabolismenya (tingkat konsumsi oksigen dan produksi
metabolit). Sulmartini et al. (2009) menyatakan bahwa salah satu kendala dalam
transportasi ikan mas adalah sifat ikan mas yang memiliki metabolisme yang
tinggi. Perhitungan respon stres (kadar glukosa darah), serta aktivitas gerak fisik
ikan mas juga perlu dilakukan.
1.2 Tujuan
Mendapatkan informasi mengenai perubahan kondisi fisiologis ikan mas
(C. carpio L.) serta perubahan kualitas air pada perlakuan perbedaan ukuran dan
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Mas (C. carpio L.)
Ikan mas atau common carp termasuk Ordo Cypriniformes, Familia
Cyprinidae. Ikan mas (C. carpio L.) mempunyai empat buah sungut dan bagian
belakang jari-jari terakhir sirip dubur pada ikan mas mengeras dan bergerigi. Ikan
mas berasal dari Jepang, China, dan diintroduksi ke seluruh dunia sebagai
ikan konsumsi. Ikan mas merupakan ikan budidaya tertua yang dapat tumbuh
mencapai ukuran panjang 120 cm dengan berat 37,3 kg. Sifat ikan mas
adalah omnivora atau pemakan segala, mencari hewan dasar dengan cara
mengauk dasar kolam yang menyebabkan air menjadi keruh
(Tim Peneliti BRPPU 2008). Menurut Saanin (1984), klasifikasi ikan mas
(C. carpio L.) adalah sebagai berikut:
Filum : Chordata
Kelas : Pisces
Ordo : Ostariophysi
Famili : Cyprinidae
Genus : Cyprinus
Spesies : Cyprinus carpio (Linnaeus 1758), morfologi ikan mas (C. carpio L.)
disajikan pada Gambar 1.
Gambar 1 Ikan mas (C. carpio L.)
2.2 Suhu
Ikan merupakan hewan berdarah dingin (poikilothermal) yang
metabolisme tubuhnya dipengaruhi oleh suhu lingkungan (Neuman et al. 1997).
Engelsma et al. (2003) menyatakan bahwa suhu juga berpengaruh terhadap
ataupun suhu rendah yang mendadak dapat meningkatkan jumlah sel darah putih
pada ikan mas. Proses fisiologis dalam ikan yaitu tingkat respirasi, makan,
metabolisme, pertumbuhan, perilaku, reproduksi dan tingkat detoksifikasi dan
bioakumulasi dipengaruhi oleh suhu (Fadhil et al. 2011).
Setiap ikan memiliki rentang suhu yang optimal bagi pertumbuhannya. Ikan
yang hidup di lingkungan lebih hangat memiliki tingkat pertumbuhan yang lebih
cepat tetapi cenderung memiliki jangka hidup yang lebih pendek daripada ikan
pada lingkungan air dingin. Suhu air yang tinggi dapat meningkatkan
sistem metabolisme tubuh ikan sehingga konsumsi pakan meningkat
(Kausar & Salim 2006). Meningkatnya suhu dapat meningkatkan aktivitas enzim
pencernaan yang dapat mempercepat pencernaan nutrisi sehingga dapat
meningkatkan hasil buangan (Shcherbina & Kazlauskene 1971).
2.3 Derajat Keasaman (pH)
Derajat keasaman atau pH merupakan salah satu parameter kimia perairan
yang memiliki pengaruh besar terhadap organisme yang hidup di dalamnya. Nilai
pH akan mempengaruhi pertumbuhan ikan. Kisaran pH yang cocok untuk
kehidupan ikan adalah 6,5-9. Batas terendah yang menyebabkan kematian ikan
adalah pH 4 dan tertinggi pada pH 11 (Boyd 1990). Perairan dengan kisaran pH
4-6 mengakibatkan pertumbuhan lambat bagi ikan budidaya (Boyd 1990). Nilai
pH suatu perairan dapat mempengaruhi fungsi fisiologis normal organisme air,
termasuk pertukaran ion dengan air dan respirasi (EIFAC 1969).
2.4 Oksigen Terlarut (DO)
Jumlah oksigen yang dibutuhkan untuk pernafasan biota budidaya
tergantung ukuran, suhu dan tingkat aktivitasnya dengan batas minimum adalah
3 ppm. Kandungan oksigen di dalam air dianggap optimum bagi budidaya biota
air adalah 4-10 ppm, tergantung jenisnya. Laju respirasi terlihat tetap pada batas
kelarutan oksigen antara 3-4 ppm pada suhu 20-30 oC (Ghufran & Kordi 2007).
Ernest (2000) ikan mas dapat bertahan hidup pada konsentrasi DO minimum
sebesar 2 mg/L. Doudoroff dan Shumway (1970) menyatakan bahwa kebutuhan
menjelaskan juga bahwa kandungan DO kurang dari 1 mg/L dapat menyebabkan
lethal atau menyebabkan kematian dalam beberapa jam.
2.5 Karbondioksida (CO2)
Sumber utama CO2 dalam perairan dapat berasal dari hasil respirasi
organisme perairan. Lamanya waktu transportasi berbanding lurus dengan
tingginya eksresi CO2 yang dihasilkan. Kepadatan yang tinggi juga akan
menghasilkan eksresi CO2 yang lebih tinggi. Karbondioksida bereaksi dengan air
akan menghasilkan asam karbonat (H2CO3) (Suryaningrum et al. 2006). Berikut
ini adalah reaksi terbentuknya asam karbonat menurut William & Robert (1992) :
H2O + CO2 = H2CO3 = H+ + HCO3
-Tingkat aktivitas dan stres ikan juga mempengaruhi kadar CO2 dalam air
terkait tingkat respirasinya. Hal tersebut dikarenakan CO2 dihasilkan sebagai
oksidasi senyawa organik yang berasal dari makanan selama proses respirasi
(Suryaningrum et al. 2006). Ketika ikan ditebar sangat banyak atau pada
kepadatan tinggi, konsentrasi CO2 dapat menjadi tinggi sebagai hasil dari
respirasi. CO2 bebas yang dilepaskan selama respirasi akan berekasi dengan air
sehingga menghasilkan asam karbonat (H2CO3) yang dapat menurunkan pH air
(William & Robert 1992).
2.6 Total Amonia Nitrogen (TAN)
Amonia (NH3) dan garam-garamnya bersifat mudah larut dalam air. Ion
amonium adalah bentuk transisi dari amonia. Sumber amonia pada wadah
transportasi berasal dari hasil metabolisme ikan yang dikeluarkan oleh insang.
Tinja dari biota akuatik yang merupakan limbah aktivitas metabolisme juga
banyak mengeluarkan amonia (Effendi 2003). Metode penghitungan amonia yang
ada sekarang ini sebenarnya melakukan perhitungan terhadap amonia total atau
total amonia nitrogen (TAN) yang terdiri dari NH3 dan NH4+ (Hargreaves dan
Tucker 2004). Berikut merupakan kesetimbangan reaksinya:
Proporsi relatif dari kedua bentuk amonia tersebut di dalam perairan
ditentukan oleh derajat keasaman atau pH. Bentuk toksik dari amonia adalah saat
menjadi NH3 dan umumnya dominan saat pH tinggi. Ion amonium relatif tidak
toksik dan mendominasi saat pH rendah (Hargreaves dan Tucker 2004).
Konsentrasi amonia dalam suatu perairan harus diatur secara hati-hati karena
amonia yang tidak terionisasi (NH3) dapat menjadi sangat beracun bagi hewan
budidaya. Persentase amonia bebas meningkat dengan meningkatnya nilai pH dan
suhu perairan. Sebagian besar amonia akan mengalami ionisasi Pada pH 7 atau
kurang. Amonia tidak terionisasi pada pH lebih besar dari 7 dan akan bersifat
toksik jika jumlahnya banyak. Toksisitas amonia terhadap organisme akuatik akan
meningkat jika terjadi penurunan kadar oksigen terlarut, pH, dan suhu
(Effendi 2003).
Ikan tidak dapat bertoleransi terhadap kadar amonia bebas yang terlalu
tinggi karena dapat mengganggu proses pengikatan oksigen oleh darah dan pada
akhirnya dapat mengakibatkan sufokasi (Effendi 2003). Kadar amonia pada
perairan alami biasanya kurang dari 0,1 mg/L, sedangkan kadar amonia bebas
yang tidak terionisasi (NH3) pada perairan tawar sebaiknya tidak lebih dari
0,2 mg/L. Kadar amonia bebas lebih dari 0,2 mg/L, perairan toksik bagi beberapa
jenis ikan (Effendi 2003).
Pada tingkat toksik, NH3 dapat menyebabkan peningkatan pH pada darah,
gangguan osmoregulasi, dan kesulitan bernafas. Akumulasi NH3 pada
kolam-kolam budidaya dapat bersifat toksik pada konsentrasi yang tinggi dan
dapat menyebabkan kematian hewan budidaya. Akumulasi NH3 pada
kolam-kolam budidaya biasanya hanya sampai pada level yang menyebabkan
efek-efek subletal (Hargreaves dan Tucker 2004).
2.7 Glukosa Darah
Respon sekunder terjadi karena adanya pengaktifan hormon stres yang
menyebabkan perubahan kimia darah dan jaringan (Begg & Pankhurst 2004),
misalnya peningkatan glukosa dalam plasma darah (Porchas et al. 1990). Glukosa
darah kebanyakan diproduksi akibat adanya aksi hormon kortisol yang dapat
(Porchas et al. 1990). Keberhasilan pasokan glukosa ke dalam sel ditentukan oleh
kinerja insulin. Sedangkan selama stres terjadi inaktivasi insulin sehingga
menutup penggunaan glukosa oleh sel (Brown 1993 dalam Hastuti et al. 2003).
Pengujian glukosa darah merupakan salah satu parameter yang digunakan
untuk mengevaluasi tingkat stres pada ikan (Kucukgul & Sahan 2008). Barton &
Iwama (1991) menyatakan bahwa konsentrasi kortisol dan glukosa merupakan
indikator stres yang paling penting pada ikan. Kebutuhan energi dari glukosa
untuk menangani stres dapat dipenuhi apabila glukosa dalam darah dapat segera
masuk ke dalam sel target. Keberhasilan pasokan glukosa ke dalam sel ditentukan
oleh kinerja insulin. Inaktivasi insulin terjadi selama stres sehingga menutup
penggunaan glukosa oleh sel (Hastuti et al. 2003).
Mekanisme terjadinya perubahan performa glukosa darah selama stres
adalah sebagai berikut: Adanya perlakuan shock suhu (perubahan suhu)
lingkungan akan diterima oleh organ reseptor. lnformasi tersebut disampaikan ke
otak bagian hipotalamus melalui sistem syaraf, dan selanjutnya sel kromaffin
menerima perintah melalui serabut syaraf symphatik untuk mensekresikan
hormon katekolamin. Hormon ini akan mengaktivasi enzim-enzim yang terlibat
dalam katabolisme simpanan glikogen hati dan otot serta menekan sekresi hormon
insulin, sehingga glukosa darah mengalami peningkatan. Pada saat yang
bersamaan hipothalamus otak mensekresikan CRF (corticoid releasing factor)
yang meregulasi kelenjar pituitary untuk mensekresikan ACTH
(adrenocorticotropik hormone), MSH (melanocyte stimulating hormone) dan
B-End (B-endorphin). Hormon tersebut akan meregulasi sekresi hormon kortisol
dari sel. Kortisol selanjutnya akan menggertak enzim-enzim yang terlibat dalam
glukoneogenesis yang menghasilkan peningkatan glukosa darah yang bersumber
dari non karbohidrat. Penurunan glukosa darah terjadi akibat adanya katabolisme
protein untuk membentuk glukosa, katabolisme protein ini juga menghasilkan
asam amino, sehingga asam amino dalam darah diduga meningkat. Meningkatnya
asam amino dalam darah akan mengaktivasi insulin kembali sehingga mampu
melakukan transport glukosa, sehingga glukosa dalam darah akan menurun
Insulin adalah suatu hormon yang dihasilkan oleh sel beta pulau lengerhan
pada jaringan epithelium pankreas yang mengatur tingkat kenormalan gula darah
yang relatif konstan dibawah kondisi normal. Hormon ini berpengaruh terhadap
metabolisme karbohidrat, protein, dan lemak (Suptijah 1996). Insulin adalah
protein yang mempunyai struktur primer spesifik dan merupakan polipeptida
besar dengan berat molekul kira-kira 6000. Polipeptida ini terdiri dari 51 asam
amino tersusun dalam 2 rantai: rantai A yang terdiri dari 21 asam amino dan rantai
B terdiri dari 30 asam amino. Antara rantai A dan rantai B terdapat
2 jembatan disulfida yaitu antara A-7 dengan B-7 dan N-19 dengan A-20.
Jembatan disulfida juga terdapat antara asam amino ke-6 dan ke-11 pada rantai A
(Suharto & Handoko 1987 dalam Suptijah 1996).
Insulin memiliki fungsi yang luas dan rumit. Efek akhir dari hormon ini
adalah penyimpanan karbohidrat, protein dan lemak sehingga insulin dapat
disebut sebagai hormone of abudance (Nurtanio & Wangko 2007). Insulin
memiliki dua fungsi penting dalam menjaga homeostasis metabolisme dalam
tubuh. Mengusahakan tetap tersedianya sumber energi yang cukup
untuk kebutuhan tubuh dalam masa perkembangan, pertumbuhan, dan
reproduksi adalah fungsi pertama. Fungsi kedua adalah mengatur
konsentrasi glukosa plasma. Pengaturan pelepasan insulin ini dikendalikan
oleh sistem saraf pusat dan dipengaruhi oleh jumlah sel lemak dan glukosa plasma
3 METODOLOGI
3.1 Waktu dan Tempat Pelaksanaan
Penelitian dilakukan pada bulan Februari sampai Juli 2012. Adapun
tempat penelitiannya yaitu di Laboratorium Karakteristik Bahan Baku Hasil
Perairan, Departemen Teknologi Hasil Perairan, dan Laboratorium Lingkungan
Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini adalah ikan mas
(C. carpio) ukuran 4 ekor/kg atau ukuran konsumsi yang diperoleh dari
kolam ikan di Dramaga-Bogor. Bahan pembantu yang dipakai adalah air, aquades,
es batu, indikator pp, NaOH, NH4Cl, MnSO4, hipoklorit , dan fenat.
Peralatan yang digunakan adalah timbangan, akuarium berukuran 5 liter,
pengukur waktu, gelas ukur, beaker glass, erlenmeyer, pipet mikro, GlucoDR,
serta peralatan untuk pengukuran kualitas air, yaitu multimeter dan
spektrofotometer.
3.3 Tahap Penelitian
Penelitian dilakukan melalui dua tahap, yaitu penelitian pendahuluan dan
penelitian utama. Sebelum penelitian, dilakukan persiapan antara lain:
(a) media air, dan (b) ikan uji.
3.3.1 Persiapan penelitian
a). Media air
Media air yang digunakan diuji kualitasnya, meliputi pengukuran suhu,
kadar oksigen terlarut (DO), CO2, pH, dan amoniak terhadap media air
laboratorium yang diendapkan selama 1 hari. Alat dan cara pengukuran disajikan
Tabel 1 Parameter kualitas air, alat, dan cara pengukurannya
Parameter Alat Cara Pengukuran
Suhu Air Multimeter Pembacaan skala
DO Multimeter Pembacaan skala
CO2 Alat gelas Titrasi
pH Multimeter Pembacaan skala
TAN Spektrofotometer Pembacaan skala
Glukosa Darah GlucoDR Pembacaan skala
1) CO2 (Dye 1958 dalam Franson 1975)
Langkah-langkah yang dilakukan dalam pengukuran CO2, yang pertama
yaitu air sampel sebanyak 25 mL diambil menggunakan gelas ukur, lalu
dimasukkan ke dalam erlenmeyer. Setelah itu, air sampel yang tadi ditambahkan
indikator pp sebanyak 3-4 tetes kemudian dilihat dan diamati reaksi yang terjadi,
jika air sampel berubah warna menjadi pink berarti dalam air sampel tersebut
tidak terkandung CO2, namun jika air sampel tidak berubah warna, berarti dalam
air sampel tersebut terkandung CO2, maka langkah berikutnya yang dilakukan
pada air sampel yang tidak berwarna tadi adalah proses titrasi dengan Na2CO3
atau NaOH hingga berubah menjadi warna pink. Langkah terakhir jumlah titran
dicatat dan dihitung dengan rumus:
2) Pengukuran TAN (Weatherburn 1967 dalam Rand et al. 1975)
Pengukuran amoniak dilakukan pada sampel air laboratorium yang telah
diendapkan selama 1 hari menggunakan metode spektrofotometer. Sampel air
sebanyak 25 mL dipipet dan dimasukkan ke dalam beaker glass 100 mL.
selanjutnya, larutan NH4Cl disiapkan sebanyak 25 mL sebagai larutan standar
amoniak dan larutan aquades sebanyak 25 mL sebagai larutan blanko. Larutan
MnSO4 sebanyak 1 tetes, chlorox 0,5 mL, dan reagen fenat 0,6 mL ditambahkan
ke dalam larutan standar sampai berwarna biru kehijauan, serta ke dalam sampel
air dan blanko, kemudian ketiga larutan tersebut dibiarkan sampai 15 menit.
pada absorbansi 0,000, kemudian dilakukan pengukuran sampel dan
larutan standar. Nilai pengukuran tersebut kemudian dihitung menggunakan
rumus:
TAN (mg/L) =
Keterangan :
Cst = konsentrasi larutan standar (0,3 ppm) As = Nilai Absorban sampel
Ast = Nilai absorban standar
3) Penghitungan tingkat konsumsi oksigen ( Pavlovskii 1964 dalam Budiarti
et al. 2005)
Keterangan :
TKO = tingkat konsumsi oksigen (mgO2/g/jam)
DO0 = konsentrasi oksigen terlarut pada awal pengamatan (mg/L)
DOt = konsentrasi oksigen terlarut pada waktu t (mg/L)
V = volume air dalam wadah (L) W = biomassa ikan uji (g) t0 = waktu pada jam ke-0 (awal) t1 = waktu pada jam ke-1 (akhir)
b) Ikan uji
Ikan mas berukuran konsumsi yang baru dibeli dalam keadaan hidup dari
kolam dipindahkan pada akuarium untuk dilakukan adaptasi kemudian dipuasakan
selama 1 hari. Pada saat ikan dipindahkan pada akuarium, ikan tidak boleh diberi
pakan terlebih dahulu, karena ikan baru berada dalam lingkungan baru sehingga
perlu penyesuaian diri terhadap lingkungan baru.
3.3.2 Penelitian pendahuluan
Tujuan penelitian pendahuluan adalah untuk memilih size ikan mas ukuran
konsumsi (size 4, 5, dan 6) yang memiliki daya tahan terbaik terhadap perubahan
lingkungan. Sebanyak 3 buah akuarium yang berisi air 3 liter masing-masing
diberi ikan sebanyak 4 ekor (size 4), 5 ekor (size 5), dan 6 ekor (size 6). Ikan
diamati setiap 30 menit selama dua jam. Prosedur penelitian tersebut dilakukan
respon fisiologis gerak ikan, serta kualitas air yaitu DO, CO2, TAN dan pH. Size
ikan yang terbaik kemudian dipilih untuk dijadikan bahan uji pada penelitian
utama.
3.3.3 Penelitian utama
Tujuan penelitian utama adalah untuk mendapatkan informasi mengenai
perubahan kondisi fisiologis ikan mas dibawah kondisi suhu lingkungan yang
berbeda. Sebanyak 6 buah akuarium berukuran 5 liter diisi air yang telah
diendapkan selama 1 hari masing-masing 3 liter. Kemudian akuarium tersebut
diberi ikan sebanyak 4 ekor (size 4) dengan perlakuan berbeda-beda. Perlakuan
tersebut diantaranya kontrol atau pemberian suhu ruang (27 oC), pemberian suhu
dingin (15 oC), dan pemberian suhu hangat (35 oC). Perlakuan perbedaaan suhu
ini dilakukan secara bertahap dengan perubahan suhu ± 2 oC setiap 5 menit hingga
mencapai suhu target. Perubahan suhu pada perlakuan suhu dingin dimulai dari
suhu 25 oC hingga mencapai suhu 15 oC yang tercapai pada menit ke-20.
Perubahan suhu pada perlakuan suhu hangat dimulai dari suhu 29 oC hingga
mencapai suhu 35 oC yang tercapai pada menit ke-15. Ikan diamati setiap 30
menit sekali hingga dua jam. Pengamatan tersebut meliputi respon fisiologis gerak
ikan, pengukuran kualitas air yaitu pengukuran suhu, DO, CO2, TAN, dan pH.
Pengukuran glukosa darah diawal dan diakhir juga dilakukan selama simulasi.
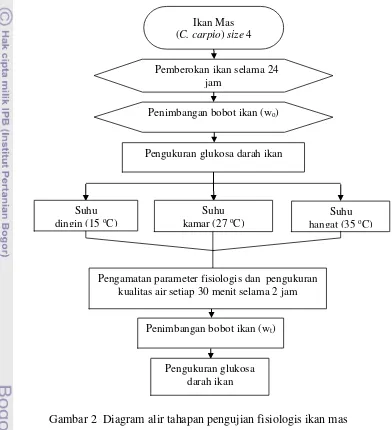
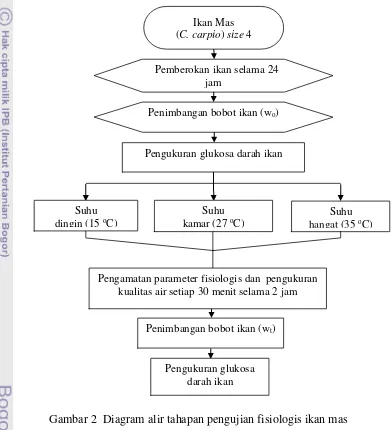
Rangkaian prosedur penelitian disajikan pada Gambar 2.
3.4 Rancangan Percobaan
Rancangan percobaaan yang digunakan adalah rancangan acak lengkap
(RAL) faktorial dengan satu faktor, yaitu faktor pemberian ukuran (size 4, size 5,
dan size 6) untuk penelitian pendahuluan dan faktor pemberian suhu untuk
penelitian utama dengan taraf suhu dingin, suhu ruang, dan suhu hangat. Model
matematika RAL factorial adalah sebagai berikut:
Y
ij=
μ
+
τ
i +
ε
ijKeterangan :
Yij = Nilai pengamatan pada taraf ke-i dan ulangan ke-j (j=1,2)
τi = Pengaruh perbedaan suhu lingkungan pada taraf ke-i (i=1,2,3) εij = Galat atau sisa pengamatan taraf ke-i dengan ulangan ke-j
Apabila hasil perhitungan menunjukkan pengaruh yang berbeda nyata,
maka dilakuan uji lanjut Duncan. Pengolahan data statistik ini menggunakan
program SPSS 13.0 for Windows.
Gambar 2 Diagram alir tahapan pengujian fisiologis ikan mas
Ikan Mas (C. carpio) size 4
Penimbangan bobot ikan (wo)
Pemberokan ikan selama 24 jam
Pengukuran glukosa darah ikan
Suhu kamar (27 oC)
Suhu dingin (15 oC)
Suhu hangat (35 oC)
Penimbangan bobot ikan (wt)
Pengukuran glukosa darah ikan
4 HASIL DAN PEMBAHASAN
4.1 Sifat Fisiologis Ikan Mas (C. carpio L.)
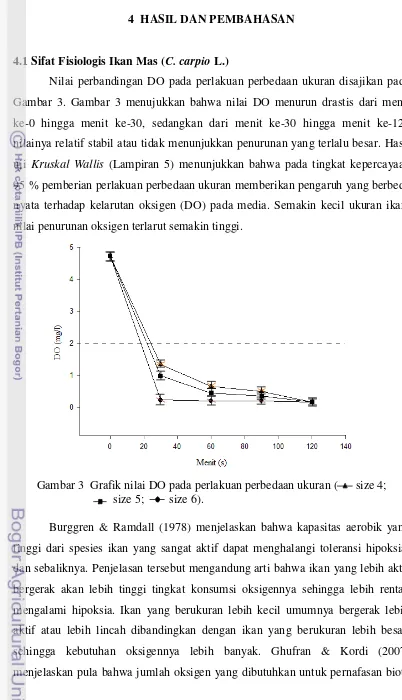
Nilai perbandingan DO pada perlakuan perbedaan ukuran disajikan pada
Gambar 3. Gambar 3 menujukkan bahwa nilai DO menurun drastis dari menit
ke-0 hingga menit ke-30, sedangkan dari menit ke-30 hingga menit ke-120
nilainya relatif stabil atau tidak menunjukkan penurunan yang terlalu besar. Hasil
uji Kruskal Wallis (Lampiran 5) menunjukkan bahwa pada tingkat kepercayaan
95 % pemberian perlakuan perbedaan ukuran memberikan pengaruh yang berbeda
nyata terhadap kelarutan oksigen (DO) pada media. Semakin kecil ukuran ikan,
nilai penurunan oksigen terlarut semakin tinggi.
Gambar 3 Grafik nilai DO pada perlakuan perbedaan ukuran ( size 4; size 5; size 6).
Burggren & Ramdall (1978) menjelaskan bahwa kapasitas aerobik yang
tinggi dari spesies ikan yang sangat aktif dapat menghalangi toleransi hipoksia,
dan sebaliknya. Penjelasan tersebut mengandung arti bahwa ikan yang lebih aktif
bergerak akan lebih tinggi tingkat konsumsi oksigennya sehingga lebih rentan
mengalami hipoksia. Ikan yang berukuran lebih kecil umumnya bergerak lebih
aktif atau lebih lincah dibandingkan dengan ikan yang berukuran lebih besar,
sehingga kebutuhan oksigennya lebih banyak. Ghufran & Kordi (2007)
budidaya tergantung ukuran, suhu dan tingkat aktifitasnya. Gambar 3
menunjukkan bahwa kelarutan oksigen (DO) pada perlakuan perbedaan ukuran
menurun drastis hingga di bawah 2 mg/L pada selang waktu 30 menit sehingga
ikan mengalami hipoksia dan beberapa ikan tidak mampu bertahan di menit-menit
selanjutnya. Ernest (2000) menjelaskan bahwa ikan mas dapat bertahan hidup
pada konsentrasi DO minimum sebesar 2 mg/L. Ikan pun kemudian merespon DO
minimum tersebut dengan cara melakukan pemompaan air yang lebih cepat ke
permukaan air sehingga beberapa ikan masih bisa bertahan hidup. Odum (1971)
menjelaskan bahwa kecepatan difusi oksigen dari udara dipengaruhi oleh suhu,
salinitas, kekeruhan, pergerakan udara, massa air, dan gelombang. Upaya ikan
memompa air lebih cepat ke permukaan akan menyebabkan terbentuknya riak air
atau gelombang sehingga akan mempercepat difusi oksigen pada permukaan air.
Hasil perhitungan jumlah bukaan mulut ikan saat mengambil oksigen ke
permukaan disajikan pada Tabel 2.
Tabel 2 Jumlah bukaan mulut ikan saat mengambil oksigen ke permukaan
Size Menit (s)
5` 30` 60` 90` 120`
4 ± 3,20 194 854 1712 1426 1468
5 ± 3,68 295 2120 2814 1847 702
6 ± 3,58 285 2334 3483 1631 481
Jumlah bukaan mulut ikan ketika mengambil oksigen ke permukaan
berbeda-beda tiap size (Tabel 2). Venberg & Venberg (1972) menyatakan bahwa
jika ikan berada pada medium yang tekanan parsial oksigennya lebih rendah dari
lingkungan, maka untuk memenuhi kebutuhan oksigennya ikan akan melakukan
pemompaan air yang lebih besar melalui peningkatan frekuensi pergerakan
operkulum. Tabel 2 menunjukkan bahwa ikan mas dengan size 4 memiliki
rata-rata jumlah bukaan mulut yang paling kecil. Jumlah bukaan mulut terbanyak
pada saat simulasi dihasilkan oleh ikan mas size 6. Ikan mas size 6 memiliki
kepadatan yang lebih tinggi secara kuantitas dibandingkan dengan ikan mas size
4 dan size 5, sehingga kelarutan oksigennya lebih cepat menurun. Docan et al.
(2010) melaporkan bahwa ketika ikan berada pada kepadatan yang tinggi
kebutuhan oksigen akan meningkat, sehingga oksigen terlarut dalam air lebih
berbedanya jumlah bukaan mulut. Semakin tinggi kepadatan, maka kualitas air
lebih cepat menurun sehingga ikan akan lebih cepat mati (Docan et al. 2010).
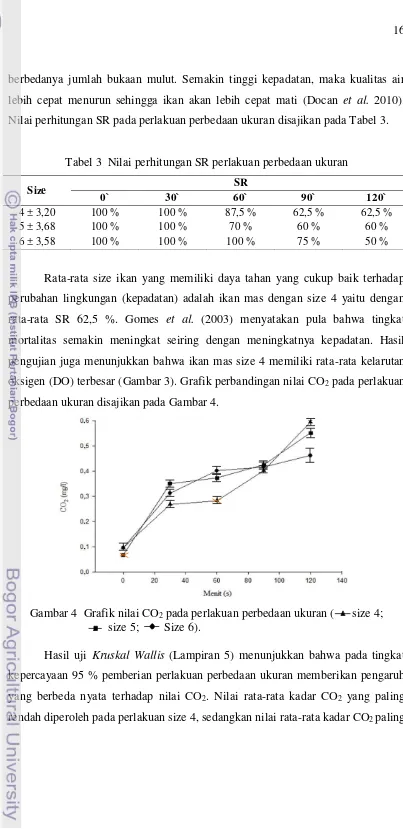
Nilai perhitungan SR pada perlakuan perbedaan ukuran disajikan pada Tabel 3.
Tabel 3 Nilai perhitungan SR perlakuan perbedaan ukuran
Size SR
0` 30` 60` 90` 120`
4 ± 3,20 100 % 100 % 87,5 % 62,5 % 62,5 %
5 ± 3,68 100 % 100 % 70 % 60 % 60 %
6 ± 3,58 100 % 100 % 100 % 75 % 50 %
Rata-rata size ikan yang memiliki daya tahan yang cukup baik terhadap
perubahan lingkungan (kepadatan) adalah ikan mas dengan size 4 yaitu dengan
rata-rata SR 62,5 %. Gomes et al. (2003) menyatakan pula bahwa tingkat
mortalitas semakin meningkat seiring dengan meningkatnya kepadatan. Hasil
pengujian juga menunjukkan bahwa ikan mas size 4 memiliki rata-rata kelarutan
oksigen (DO) terbesar (Gambar 3). Grafik perbandingan nilai CO2 pada perlakuan
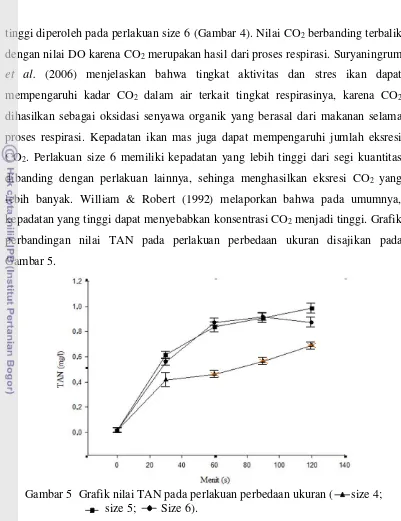
perbedaan ukuran disajikan pada Gambar 4.
Gambar 4 Grafik nilai CO2 pada perlakuan perbedaan ukuran ( size 4;
size 5; Size 6).
Hasil uji Kruskal Wallis (Lampiran 5) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian perlakuan perbedaan ukuran memberikan pengaruh
yang berbeda nyata terhadap nilai CO2. Nilai rata-rata kadar CO2 yang paling
tinggi diperoleh pada perlakuan size 6 (Gambar 4). Nilai CO2 berbanding terbalik
dengan nilai DO karena CO2 merupakan hasil dari proses respirasi. Suryaningrum
et al. (2006) menjelaskan bahwa tingkat aktivitas dan stres ikan dapat
mempengaruhi kadar CO2 dalam air terkait tingkat respirasinya, karena CO2
dihasilkan sebagai oksidasi senyawa organik yang berasal dari makanan selama
proses respirasi. Kepadatan ikan mas juga dapat mempengaruhi jumlah eksresi
CO2. Perlakuan size 6 memiliki kepadatan yang lebih tinggi dari segi kuantitas
dibanding dengan perlakuan lainnya, sehinga menghasilkan eksresi CO2 yang
lebih banyak. William & Robert (1992) melaporkan bahwa pada umumnya,
kepadatan yang tinggi dapat menyebabkan konsentrasi CO2 menjadi tinggi. Grafik
perbandingan nilai TAN pada perlakuan perbedaan ukuran disajikan pada
Gambar 5.
Gambar 5 Grafik nilai TAN pada perlakuan perbedaan ukuran ( size 4; size 5; Size 6).
Hasil uji Kruskal Wallis (Lampiran 5) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian perlakuan perbedaan ukuran memberikan pengaruh
yang berbeda nyata terhadap nilai TAN. Gambar 5 menunjukkan bahwa rata-rata
nilai TAN tertinggi didapatkan oleh size 6, sedangkan nilai rata-rata terendah
didapatkan oleh perlakuan size 4. Nilai TAN hasil penelitian berkisar antara 0,016
hingga 0,917 mg/L. Kisaran ini masih tergolong sangat kecil bagi kehidupan ikan
sehingga tidak akan menghambat proses transportasi. Chervinsky (1982) dalam
baik untuk kehidupan ikan adalah kurang dari 2,4 mg/L. TAN merupakan salah
satu sumber amonia dari hasil metabolit ikan yang dikeluarkan melalui insang dan
tinja (Effendi 2003). Tingginya metabolisme ikan mas pada kepadatan yang lebih
tinggi (Size 6) menghasilkan buangan amonia yang lebih banyak dibandingkan
dengan size 4 dan size 5, sehingga kepadatan yang tinggi harus dihindarkan
selama proses transportasi. Meningkatnya kepadatan ikan yang diangkut akan
meningkatkan tingkat metabolisme ikan dan dapat mengakibatkan tingginya
tingkat stres yang dialami oleh ikan karena menurunya kualitas air
(Supriyono et al. 2010). Grafik perbandingan nilai pH pada perlakuan perbedaan
ukuran disajikan pada Gambar 6.
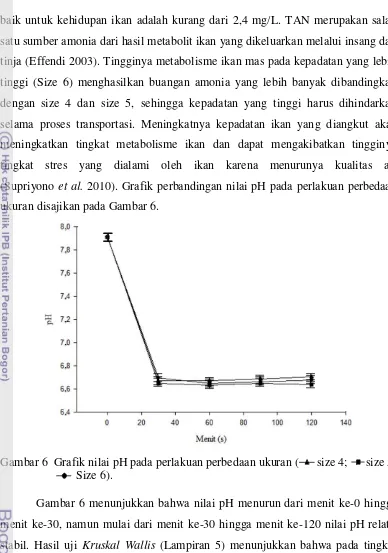
Gambar 6 Grafik nilai pH pada perlakuan perbedaan ukuran ( size 4; size 5; Size 6).
Gambar 6 menunjukkan bahwa nilai pH menurun dari menit ke-0 hingga
menit ke-30, namun mulai dari menit ke-30 hingga menit ke-120 nilai pH relatif
stabil. Hasil uji Kruskal Wallis (Lampiran 5) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian perlakuan perbedaan ukuran tidak memberikan
pengaruh yang berbeda nyata terhadap pH air. Nilai pH masih tergolong baik
dimana kisaran pH berada pada nilai 6,635 hingga 7,91. Sofarini (2009)
menyatakan bahwa nilai baku mutu pH air untuk ikan dapat hidup dengan baik
adalah berkisar antara 6 hingga 9. Nilai CO2 yang meningkat drastis pada menit
menit tersebut. Karbondioksida bereaksi dengan air akan menghasilkan asam
karbonat (H2CO3)sehingga pH air menjadi turun (Suryaningrum et al. 2006).
Hasil pengujian kualitas air menunjukkan bahwa secara umum, ikan size 4
memiliki rata-rata nilai kelarutan oksigen (DO) yang paling tinggi dan paling
sedikit menghasilkan buangan sisa metabolit (CO2 dan TAN) disbanding dengan
ikan size 5 dan size 6. Ikan mas size 4 juga menghasilkan SR yang terbesar yaitu
62,5 %. Ikan dengan size terbaik yaitu size 4, selanjutnya digunakan sebagai
bahan percobaan pada penelitian utama.
4.2 Tingkat Konsumsi Oksigen Ikan Mas (C. carpio L.)
Respirasi menyebabkan penurunan kadar oksigen terlarut dan peningkatan
karbon dioksida pada media transportasi. Peningkatan konsentrasi karbon
dioksida menyebabkan pH air menurun. Meningkatnya respirasi juga dapat
meningkatkan eksresi ammonia (Dobsikova et al. 2006). Tabel tingkat konsumsi
ikan mas disajikan pada Tabel 4.
Tabel 4 Tingkat konsumsi oksigen ikan mas selama simulasi
Suhu (oC) Tingkat Konsumsi Oksigen (mgO2/kg/jam)
30` 60` 90` 120`
Dingin (25-15 ± 0,25) 21,89 ± 1,42 0,89 ± 0,23 0,56 ± 0,06 0,21 ± 0,04 Ruang (27 ± 0,24) 23,31 ± 0,59 0,47 ± 0,11 0,14 ± 0,02 0,24 ± 0,17
Hangat (29-35 ± 0,21) 23,40 ± 0,42 0,35 ± 0,23 0,46 ± 0,03 -
Tabel 4 menunjukkan bahwa nilai rata-rata tingkat konsumsi oksigen
terbesar terdapat pada perlakuan suhu hangat menit ke-30 yaitu sebesar
23,40 ± 0,42 mgO2/kg/jam. Nilai tingkat konsumsi oksigen terkecil terdapat pada
perlakuan suhu ruang menit ke-90 yaitu sebesar 0,14 ± 0,02 mgO2/kg/jam.
Matinya seluruh ikan pada perlakuan suhu hangat menit ke-120 menyebabkan
nilai konsumsi oksigen tidak ada. Kematian ini diakibatkan oleh meningkatnya
metabolisme tubuh ikan pada suhu hangat yang menyebabkan ikan bergerak lebih
agresif dibandingan dengan perlakuan suhu dingin dan suhu ruang, sehingga
kandunngan oksigen terlarut pun lebih cepat menipis dan ikan pun mati lemas
(hipoksia). Adanya perbedaan suhu lingkungan akan menyebabkan tingkat
aktivitas tersebut menyebabkan perbedaan dalam kebutuhan energi dan akibatnya
terdapat perbedaan dalam konsumsi oksigen. Davis & Parker (1990) melaporkan
bahwa semakin tinggi suhu maka metabolisme tubuh ikan akan semakin
meningkat. Sulmartini et al. (2009) menyatakan pula bahwa peningkatan
metabolisme dapat menyebabkan hipoksia pada ikan. Laju pengambilan oksigen
ikan akan menurun jika kandungan oksigen dalam air berkurang. Proses fisiologis
dalam ikan seperti tingkat respirasi, makan, metabolisme, pertumbuhan, perilaku,
reproduksi, tingkat detoksifikasi, dan bioakumulasi dipengaruhi oleh suhu
(Fadhil et al. 2011).
4.3 Pengaruh Suhu Lingkungan terhadap Kualitas Air dan Tingkah Laku Ikan Mas (C. carpio L.)
Diagram batang uji kualitas air untuk nilai DO disajikan pada Gambar 7.
Hasil uji Kruskal Wallis (Lampiran 6) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian suhu berbeda memberikan pengaruh yang berbeda
nyata terhadap kelarutan oksigen (DO) pada media. Hasil uji lanjut Duncan
(Lampiran 8) menunjukkan bahwa pada menit ke-30, nilai DO suhu ruang
berbeda nyata dengan nilai DO suhu hangat dan dingin.
Di menit ke-90, nilai DO suhu dingin berbeda nyata dengan nilai DO suhu
ruang dan hangat. Nilai DO ketiga suhu saling berbeda nyata satu sama lain pada
menit ke-60 dan ke-120. Gambar 7 menunjukkan bahwa nilai DO berada pada
kisaran 0,14 ± 0,02 mg/L hingga 4,19 ± 0,09 mg/L. Nilai DO awal air sudah
memenuhi Nilai Baku Air (NBA) untuk perikanan, namun setelah menit ke-30
nilai DO menurun drastis. Nilai DO yang merosot ini diakibatkan oleh tingginya
nilai kulaitas air awal. Menurunnya nilai DO juga diakibatkan oleh tidak adanya
aerasi. Nilai DO tertinggi pada menit ke-30 hingga menit ke-120 diperoleh pada
perlakuan suhu dingin yaitu sebesar 0,48 ± 0,04 mg/L. Lesmana (2002) menyatakan bahwa pengaruh suhu rendah terhadap ikan adalah rendahnya
kemampuan mengambil oksigen (hypoxia). Rendahnya kemampuan pengambilan
oksigen ini menyebakan nilai kelarutan oksigen lebih lambat menurun pada
perlakuan suhu dingin. Diagram batang uji kualitas air untuk CO2 disajikan pada
Gambar 8.
Gambar 8 Diagram batang nilai rata-rata parameter CO2 ( suhu dingin ;
suhu ruang ; suhu hangat) ; huruf berbeda menunjukkan hasil perlakuan yang berbeda nyata (p<0,05).
Hasil uji Kruskal Wallis (Lampiran 6) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian suhu berbeda memberikan pengaruh yang berbeda
nyata terhadap kandungan CO2 pada media. Hasil uji lanjut Duncan (Lampiran 8)
menunjukkan bahwa pada menit ke-0, nilai CO2 suhu hangat berbeda nyata
nilai CO2 suhu ruang berbeda nyata dengan CO2 suhu dingin dan suhu hangat.
Gambar 8 menunjukkan bahwa nilai rata-rata CO2 pada suhu ruanglebih tinggi
dibandingkan dengan suhu dingin dan suhu ruang. Metabolisme tubuh ikan
menurun pada suhu dingin sehingga tingkat konsumsi oksigen kecil dan nilai CO2
yang dihasilkan pun juga menjadi kecil, sedangkan pada suhu hangat kelarutan
gas lebih kecil dibandingan pada suhu dingin dan suhu ruang sehingga nilai CO2
pun lebih kecil. Ghosal & Freeman (1994) menyatakan bahwa semakin tinggi
suhu maka kelarutan gas pada perairan akan semakin menurun. Nilai CO2 pada
Gambar 8 menunjukkan bahwa nilainya masih tergolong rendah yaitu berkisar
antara 0,14 ± 0,00 hingga 1,56 ± 0,44. Nilai CO2 yang tinggi tidak akan menjadi
masalah selama nilai oksigen tinggi. Hasil studi Tahe (2008) menunjukkan bahwa
nilai CO2 yang tinggi (36,45-70,45 mg/L) masih dapat ditoleransi oleh ikan
asalkan kadar oksigen tinggi (3,9-4,3 mg/L). Diagram batang uji kualitas air untuk
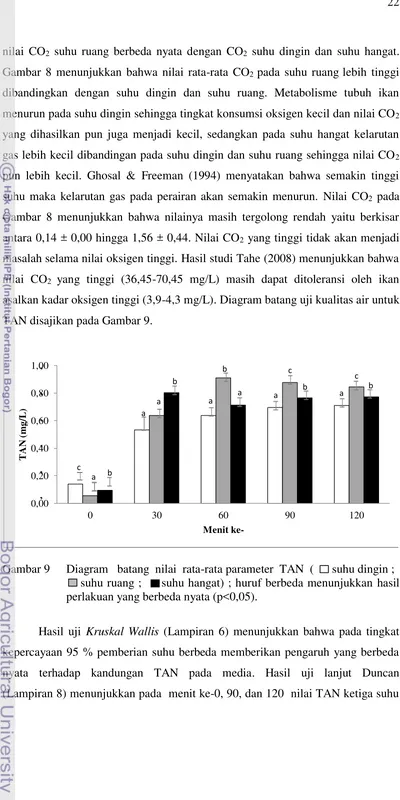
TAN disajikan pada Gambar 9.
kepercayaan 95 % pemberian suhu berbeda memberikan pengaruh yang berbeda
nyata terhadap kandungan TAN pada media. Hasil uji lanjut Duncan
(Lampiran 8) menunjukkan pada menit ke-0, 90, dan 120 nilai TAN ketiga suhu
saling berbeda nyata satu sama lain. Di menit ke-30, nilai TAN suhu hangat
berbeda nyata dengan nilai TAN suhu ruang dan dingin, sedangkan di menit
ke-60, nilai TAN suhu ruang berbeda nyata dengan nilai TAN suhu dingin dan
hangat. Gambar 9 menunjukkan bahwa kisaran nilai TAN berada pada 0,06 ± 0,01
hingga 0,91 ± 0,01 mg/L.
Nilai TAN awal air untuk ketiga suhu sudah cukup memenuhi Baku Mutu
Air (BMA) untuk perikanan, namun setelah menit ke-30 nilai TAN melonjak
naik. Sofarini (2009) melaporkan bahwa nilai Baku Mutu Air (BMA) untuk
amonia adalah kurang dari 0,1 mg/L. Nilai TAN tertinggi saat simulasi pada menit
ke-60 didapat pada perlakuan dengan suhu ruang yaitu sebesar 0,91 ± 0,01 mg/L (Gambar 9). Boyd (1990) menyatakan bahwa laju proses biokimia sesuai dengan
hukum van hoff akan meningkat dua kalinya setiap peningkatan suhu 10 oC.
Meningkatnya reaksi di dalam cairan media dan cairan tubuh ikan menyebabkan
adanya peningkatan reaksi kimia di dalam air dimana NH3 bereaksi dengan H2O
menghasilkan NH4+sehingga pH perairan menjadi naik. Pada tingkat toksik, NH3
dapat menyebabkan peningkatan pH pada darah, gangguan osmoregulasi, dan
kesulitan bernafas (Hargreaves dan Tucker 2004). Diagram batang uji kualitas air
untuk pH disajikan pada Gambar 10.
Hasil uji Kruskal Wallis (Lampiran 6) menunjukkan bahwa pada tingkat
kepercayaan 95 % pemberian suhu berbeda memberikan pengaruh yang berbeda
nyata terhadap derajat keasaman (pH) pada media. Hasil uji lanjut Duncan
(Lampiran 8) menunjukkan bahwa pada menit ke-30 dan 60, nilai pH suhu hangat
berbeda nyata dengan nilai pH suhu ruang dan dingin, sedangkan di menit ke-90
dan ke-120, nilai pH ketiga suhu tidak berbeda nyata. Gambar 10 menunjukkan
bahwa kisaran pH berada pada kisaran 5,75 ± 0,22 hingga 6,93 ± 0,01. Pada
awalnya nilai pH awal air untuk ketiga suhu sudah memenuhi Baku Mutu Air
(BMA) untuk perikanan, namun pada menit ke-30 dan menit ke-60 nilai pH pada
suhu hangat masing-masing menurun menjadi 5,96 ± 0,04 dan 5,75 ± 0,22.
Sofarini (2009) melaporkan bahwa nilai baku mutu pH air untuk ikan
dapat hidup dengan baik adalah berkisar antara 6 hingga 9. Penurunan pH pada
suhu hangat diakibatkan oleh meningkatnya metabolisme tubuh ikan pada suhu
hangat sehingga tingkat konsumsi oksigen meningkat. Proses konsumsi oksigen
ini kemudian akan menghasilkan CO2. William & Robert (1992) melaporkan
bahwa konsentrasi CO2 dapat menjadi tinggi sebagai hasil dari respirasi.
Karbondioksidabebas yang dilepaskan selama respirasi akan berekasi dengan air
sehingga menghasilkan asam karbonat (H2CO3) yang dapat menurunkan pH air.
Akibat penurunan pH tersebut menyebabkan 12,5 % ikan mati di menit ke-30 dan
37,5 % mati di menit ke-60 pada suhu hangat. Zooneveled et al. (1991)
menyatakan bahwa ketika insang berada pada pH rendah, peningkatan lendir akan
terlihat pada permukaan insang dan meyebabkan penurunan difusi oksigen pada
lamela insang. Rata-rata nilai pH tertinggi dihasilkan oleh perlakuan suhu dingin.
Metabolisme tubuh ikan cenderung lebih kecil pada suhu rendah dibandingkan
dengan pada suhu tinggi sehingga buangan hasil metabolisme seperti CO2 lebih
sedikit akibatnya pH relatif stabil. Davis & Parker (1990) melaporkan bahwa
semakin tinggi suhu maka metabolisme tubuh ikan akan semakin meningkat.
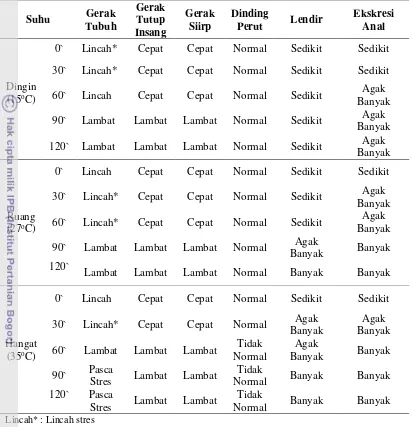
Pengamatan tingkah laku fisik ikan mas dalam berbagai suhu disajikan pada
Tabel 5 Pengamatan fisik tingkah laku ikan pada suhu dingin, ruang, dan hangat
Lincah* : Lincah stres
Pengujian perlakuan suhu hangat menunjukkan bahwa pada awalnya ikan
bergerak lincah normal, namun ketika suhu air mulai naik perlahan-lahan dan ikan
pun mulai stres dan melambat pada menit ke-60. SR ikan berkurang menjadi 75 %
pada menit ke-30. Pada menit ke-90 dan ke-120 ikan berada pada fase pasca stres
ditandai dengan terjadinya disorentasi pada ikan, bahkan diantaranya mati
sehingga SR menjadi 50 % pada menit 90 dan 0 % pada menit 120. Ikan mas yang
diberi perlakuan suhu dingin secara umum memberikan perlakuan yang lebih baik
daripada perlakuan suhu ruang dan hangat. Ikan dengan perlakuan suhu dingin
terlihat lebih tenang dan menghasilkan sisa metabolit lebih sedikit. Ikan dengan
Suhu Gerak
Lambat Lambat Lambat Normal Banyak Banyak
perlakuan suhu dingin juga menghasilkan SR 100 % atau tidak ada ikan yang
mengalami kematian pada saat simulasi.
Pada suhu yang turun mendadak akan terjadi degenerasi sel darah merah
sehingga proses respirasi terganggu. Pemberian suhu rendah juga dapat
menyebabkan ikan tidak aktif, bergerombol seperti tidak mau berenang dan
makan sehingga imunitasnya terhadap penyakit berkurang. Perubahan suhu yang
melebihi 3-4 oC dalam waktu yang relatif singkat dan mengakibatkan kejutan suhu
dan kematian ikan (Boyd 1990). Pada suhu dingin ikan terlihat lincah stres pada
menit awal, namun pada menit berikutnya ikan terlihat tenang. Karnila & Edison
(2001) menyatakan bahwa untuk pembiusan bertahap sampai suhu 15 oC selama
15 menit kondisi ikan sudah melewati fase panik dan tidak meronta saat dilakukan
pengemasan, sehingga proses pengemasan sanga mudah dilakukan.
4.3 Pengaruh Suhu terhadap Glukosa Darah (C. carpio L.)
Glukosa darah merupakan sumber pasokan bahan bakar utama dan subtrat
esensial untuk metabolisme sel. Pengujian glukosa darah ikan dilakukan di awal
dan di akhir simulasi. Pengukuran dilakukan dengan cara mengambil darah ikan
pada vena caudal (ekor) ikan dengan cara menggunakan jarum suntik berukuran
3 ml. Data hasil uji kadar glukosa darah disajikan pada Tabel 6.
Tabel 6 Uji kadar glukosa darah pada beberapa suhu di awal dan akhir simulasi
Kadar Glukosa Darah (mg/L)
Suhu Dingin (15 oC) Suhu Ruang (27 oC) Suhu Hangat (35 oC)
Awal Akhir Awal Akhir Awal Akhir
12,9 ± 0,1 15,0 ± 0,3 12,2 ± 0,3 14,0 ± 1,1 11,7 ± 2,2 6,3 ± 0,8
Tabel 6 menunjukkan bahwa terjadi peningkatan nilai glukosa darah untuk
suhu dingin dan suhu ruang. Nilai glukosa darah tertinggi didapat pada suhu
dingin yaitu sebesar 15,0 ± 0,3 mg/L. Hasil studi Hastuti et al. (2003) menunjukkan bahwa kadar glukosa darah ikan yang diberi stres perubahan suhu
dingin secara mendadak akan mengalami peningkatan. Pada perlakuan suhu
Penurunan nilai kadar glukosa ini dikarenakan semakin tinggi suhu maka
metabolisme tubuh ikan menjadi tinggi dan ikan akan lebih aktif bergerak sampai
cadangan glikogen habis, sehingga kadar glukosa dalam darah menurun.
Kucukgul & Sahan (2008) menyatakan bahwa semakin meningkat suhu, maka
nilai glukosa darah akan semakin menurun. Hastuti et al. (2003) menyatakan
bahwa hormon kortisol dan katekolamin akan diproduksi ketika ikan stres.
Hormon kortisol dan katekolamin selanjutnya akan mengaktivasi proses
5 KESIMPULAN DAN SARAN
5.1 Kesimpulan
Ikan yang memiliki daya tahan cukup baik terhadap stres perubahan
lingkungan (kepadatan) adalah ikan mas size 4 dengan rata-rata SR 63 %.
Rata-rata tingkat konsumsi oksigen tertinggi pada perlakuan perbedaan suhu
didapatkan pada perlakuan suhu hangat yaitu sebesar 8,07 mgO2/kg/jam,
sedangkan rata-rata tingkat konsumsi oksigen terendah didapatkan pada perlakuan
suhu dingin yaitu sebesar 5,89 mgO2/kg/jam. Ikan mas yang diberi perlakuan suhu
dingin memberikan hasil yang lebih baik daripada perlakuan suhu ruang dan
hangat. Ikan dengan perlakuan suhu dingin gerakan fisik tubuhnya lebih lambat
dan menghasilkan sisa metabolit yang lebih sedikit. Ikan dengan perlakuan suhu
dingin juga menghasilkan SR 100 % atau tidak ada ikan yang mati pada saat
simulasi.
5.2 Saran
Transportasi ikan mas sebaiknya dilakukan pada suhu dingin atau pada
waktu pagi hari, dan hindari pengangkutan ikan mas dengan kepadatan yang
DAFTAR PUSTAKA
Barton BA, Iwama GK. 1991. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids.
Annual Review of Fish Diseases 1: 3-26.
Begg K, Pankhurst NW. 2004. Endocrine and metabolic responses to stress in a laboratory population of the tropical damselfish Acanthochromis polyacanthus. J. Fish Biology 64: 133–145.
Boyd CE. 1990. Water Quality in Ponds for Aquqculture. Alabama: Birmingham Publishing Co.Birmingham.
Budiarti T, Batara T, Wahjuningrum D. 2005. Tingkat konsumsi oksigen udang vaname (Litopenaeus vannamei) dan model pengelolaan oksigen pada tambak intensif. J. Akuakultur Indonesia 4(1): 89-96.
Burggren WW, Randall DJ. 1978. Oxygen uptake and transport during hypoxic exposure in the sturgeon Acipenser transmontanus. J. Respiratory Physiology 34: 171-183.
Davis KB, Parker NC. 1990. Physiological stress striped bass: Effects of acclimation temperature J.Aquaculture. 91: 349-358.
Dobsikova R, Svobodova Z, Blahova J, Modra H, Velisek J. 2006. Stress response to long distance transportation of common carp (Cyprinus carpio L.).
J. Acta Veterina Brno 75: 437-448.
Docan A, Cristea V, Grecu I, Dediu L. 2010. Hematological response of the European catfish, Silurus glanis reared at different densities in ”flow
-through” production system. Archiva Zootechnica. 13(2): 63-70.
Doudoroff P, Shumway DL. 1970. Dissolved Oxygen Requirements of Freshwater Fishes. Rome : Food and Agriculture Organization of the United Nations.
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelolahan Sumber Daya dan Lingkungan Perairan. Yogyakarta: Kanisius.
[EIFAC] European Inland Fisheries Advisory Commission. 1969. Water quality criteria for European freshwater fish: Report on extreme pH values and inland fisheries. Prepared by EIFAC Working Party on Water Quality Criteria for European Freshwater Fish. J. Water Research 3(8): 593–611.
Ernest DH. 2000. Performance engineering. Di dalam: Stickney RR. Encyclopedia of Aquaqulture. New York: John Wiley & Sons. Hal 629-644.
Fadhil R, Endan J, Taip FS, Salih M. 2011. Kualitas air dalam sistem resirkulasi untuk budidaya ikan lele/keli (Clarias Batrachus). J. Aceh Depelovment International Conference 1:1-10.
Franson MA. 1975. Standard Methods for Examination of Water and Wastewater.
14th Ed. New York: American Public Health Association.
Ghosal K, Freeman BD. 1994. Gas separation using polymer membranes. Polym. Adv. Technol 5: 673-697.
Ghufran HM, Kordi K, Andi BT. 2007. Pengelolaan Kualitas Air dalam Budidaya Perairan. Jakarta: Rineka Cipta.
Gomes LC, Araujo LCARM, Roubach R, Gomes CAR, Lopes NP, Urbinati EC. 2003. Effect of fish density during transportation on stress and mortality of juvenile tambaqui colossoma macropomum. J. World Aquaculture Society
34(1):76–84.
Hargreaves JA, Tucker CS. 2004. Managing ammonia in fish ponds. J. South Region Aquaqulture Center Publication 4603: 1-7.
Hastuti S, Supriyono E, Mokoginta I, Subandiyono. 2003. Respon glukosa darah ikan gurami (Osphronemus gouramy, LAC.) terhadap stres perubahan suhu lingkungan. J. Akuakultur Indonesia 2(2): 73-77.
Imanto PT. 2008. Beberapa teknik transportasi ikan laut hidup dan fasilitasnya pada perdagangan ikan laut di Belitung. J. Media Akuakultur 3(2): 181-188.
Karnila R, Edison. 2001. Pengaruh suhu dan waktu pembiusan bertahap terhadap ketahanan hidup ikan jambal siam (Pangasius sutchi F) dalam transportasi sistem kering. J. Natur Indonesia 3(2): 151-167.
Kausar R, Salim M. 2006. Effect of water temperature on the growth performance and feed conversion ratio of Labeo rohita. J. Pakistan Veteterina 26(3):
Neuman E, Sandstrom O, Thoresson G. 1997. Gudlines for Coastal Fish Monitoring. Sweden: National Board of Fisheries.
Nugroho E, Wahyudi NA. 1991. Seleksi berbagai ras ikan mas koleksi dari
berbagai daerah di Indonesia dengan menggunakan “Skor-Z”, Buletin
Penelitian Perikanan Darat 10(2): 49-54.
Nurtanio N, Wangko S. 2007. Resistensi insulin pada obesitas sentral. J. Bik Biomed 3(3): 89-96.
Odum EP. 1971. Fundamental Ecology 3. London-Toronto: W.B Sounders Company.
Porchas MM, Cordova LRF, Enriquez RR. 2009. Cortisol and glucose: reliable indicators of fish stress?. Pan-American Journal of Aquatic Sciences
(2009), 4(2): 158-178.
Praseno O, Krettiawan H, Asih S, Sudrajat A. 2010. Uji ketahanan salinitas beberapa strain ikan mas yang dipelihara di akuarium. Prosiding Forum Inovasi Teknologi Akuakultur : 93-100.
Rachmawati FR, Susilo U, Sistina Y. 2010. Respon fisiologis ikan nila,
Oreochromis niloticus, yang distimulasi dengan daur pemuasaan dan pemberian pakan kembali. J. Seminar Nasional Biologi 7: 492-499.
Rand MC, Greenberg AE, Taras MJ. 1975. Standard methods for the examination of water and wastewater. 14th Ed. Washington DC: APHA.
Rudiyanti S, Ekasari AD. 2009. Pertumbuhan dan survival rate ikan mas (Cyprinus carpio Linn) pada berbagai konsentrasi pestisida regent 0,3 G.
J. Saintek Perikanan. 5(1): 39-47.
Saanin H. 1984. Taksonomi dan Kunci Identifikasi. Bandung: Binacipta.
Shcherbina MA, Kazlauskene OP. 1971. Water temperature and digestibility of nutrient substances by carp. J. Hydrobiologia. 9: 40-44.
Sofarini D. 2009. Analisa kualitas air (fisik,kimia) sebagai indikator kehidupan induk ikan nila (Oreochromis niloticus) di loka budidaya air tawar mandiangin. J. Bumi lestari 9(1): 77-81.
Suparno, Basmal J, Muljanah I, Wibowo S. 1994. Pengaruh suhu dan waktu pembiusan dengn pendinginan bertahap terhadap ketahanan hidup dan windu tambak (Penaeus monodon Fab.) dalam transportasi sistem kering.
J. Penelitian Pasca Panen Perikanan (79): 73-78.
Supriyono E, Budiyanti, Bdiarti T. 2010. Respon fisiologis benih ikan kerapu macan Epinepelus fuscoguttatus terhadap penggunaan minyak sereh dalam
transportasi tertutup dengan kepadatan tinggi. J. Ilmu Kelautan
15(2): 103-112.
Suptijah P. 1996. Ekstrak insulin dari ikan dan uji kemurniannya. Buletin Teknologi Hasil Perikanan 2(2): 103-121.
Suryaningrum TD, Ikasari D, Syamdidi. 2006. Pengaruh kepadatan dan waktu transportasi sistem kering terhadao sintasan hidup lobster air tawar (Cherax quadricarinatus). J. Penanganan Pasca Panen Perikanan 79(3): 37-55.
Tahe S. 2008. Penggunaan phenoxy ethanol, suhu dingin, dan kombinasi suhu dingin dengan phenoxy dalam pembiusan bandeng umpan. J. Media Akuakultur 3(2): 133-136.
Tim Peneliti BRPPU. 2008. Ikan Mas (Cyprinus carpio). Jakarta: Badan Riset Kelautan dan Perikanan.
Venberg WB, Venberg FJ. 1972. Enviromental Phisiology Of Marine Animal Springer, verlag. Berlin: Heidenberg. 294p.
William AW, Robert MD. 1992. Interaction of pH, carbon dioxide, alkalinity and hardnes in fish ponds. J. SRAC Publication 464: 1-4.
Zonneveld N, Huisman EA, Boon JN. 1991. Prinsip-prinsip Budidaya Ikan.
f. TAN menit ke-60
Size
N Subset for alpha = .05
1 2 1
Size 6 4 ,460750
Size 5 4 ,837750
Size 4 4 ,872250
Sig. 1,000 ,671
g. TAN menit ke-90
Size
N Subset for alpha = .05
1 2 1
Size 6 4 ,564000
Size 5 4 ,908500
Size 4 4 ,916750
Sig. 1,000 ,906
h. TAN menit ke-120
Size
N Subset for alpha = .05
1 2 1
Size 6 4 ,691750
Size 4 4 ,870750
Size 5 4 ,988000
Lampiran 9 Faktor perhitungan konsentrasi CO2 dalam air dengan diketahui pH
dan temperatur
pH Suhu (
oC)
5 10 15 20 25 30 35
6,0 2,915 2,539 2,315 2,112 1,970 1,882 1,839 6,2 1,839 1,602 1,460 1,333 1,244 1,187 1,160 6,4 1,160 1,010 0,921 0,841 0,784 0,749 0,732 6,6 0,732 0,637 0,582 0,531 0,495 0,473 0,462 6,8 0,462 0,402 0,367 0,335 0,313 0,298 0,291 7,0 0,291 0,254 0,232 0,211 0,197 0,188 0,184 7,2 0,184 0.160 0,146 0,133 0,124 0,119 0,116 7,4 0,116 0,101 0,092 0,084 0,078 0,075 0,073 7,6 0,073 0,064 0,058 0,053 0,050 0,047 0,046 7,8 0,046 0,040 0,037 0,034 0,031 0,030 0,030 8,0 0,029 0,025 0,023 0,021 0,020 0,019 0,018 8,2 0,018 0,016 0,015 0,013 0,012 0,012 0,011 8,4 0,012 0,010 0,009 0,008 0,008 0,008 0,007