POTENSI EKSTRAK DAUN TIN (
Ficus carica L.
) SEBAGAI
ANTIOKSIDAN DAN AKTIVITAS HAMBATANNYA
TERHADAP PROLIFERASI SEL KANKER HeLa
REDOYAN REFLI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
REDOYAN REFLI. Potensi Ekstrak Daun Tin (
Ficus carica L.
) sebagai
Antioksidan dan Aktivitas Hambatannya terhadap Proliferasi Sel Kanker HeLa.
Dibimbing oleh LATIFAH K. DARUSMAN dan WULAN TRI WAHYUNI.
Buah tin (
Ficus carica
L.) secara empiris dan berdasarkan penelitian
ilmiah dilaporkan memiliki sifat antioksidan dan antikanker. Namun, penelitian
ilmiah tentang pemanfaatan daun tin sebagai antikanker belum pernah dilaporkan.
Penelitian ini mengkaji potensi antioksidan dan antikanker ekstrak daun tin.
Berdasarkan uji fitokimia, simplisia daun tin mengandung flavonoid, tanin, steroid
dan alkaloid. Flavonoid, tanin, steroid daun tin masing-masing diekstraksi dengan
teknik maserasi menggunakan pelarut yang sesuai. Ekstrak yang diperoleh diuji
antioksidan dengan metode 1,1-difenil-2-pikrilhidrazil dan diuji toksisitas dengan
metode letalitas larva udang. Ekstrak flavonoid menunjukkan aktivitas
antioksidan terbaik dengan IC
50150 mg/L, sementara uji toksisitas menunjukkan
nilai LC
50-nya sebesar 191.43 ppm. Ekstrak flavonoid daun tin kemudian
difraksinasi menggunakan kromatografi lapis tipis preparatif dan dihasilkan tujuh
fraksi. Uji hambatan proliferasi sel kanker HeLa dengan metode
3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolium bromida menunjukkan fraksi teraktif
ialah fraksi F
7yang dapat menghambat proliferasi sel kanker HeLa sebesar
57.18% pada konsentrasi 800 ppm. Berdasarkan identifikasi menggunakan
spektrofotometer ultraviolet dan inframerah transformasi fourier, fraksi F
7diduga
mengandung senyawa isoflavon atau flavon.
ABSTRACT
REDOYAN REFLI. The Potency of Fig Leaf Extract (
Ficus carica
L.) as an
Antioxidants and it’s Inhibitory Activity
against HeLa Cancer Cell Proliferation.
Supervised by LATIFAH K. DARUSMAN and WULAN TRI WAHYUNI.
POTENSI EKSTRAK DAUN TIN (
Ficus carica L.
) SEBAGAI
ANTIOKSIDAN DAN AKTIVITAS HAMBATANNYA
TERHADAP PROLIFERASI SEL KANKER HeLa
REDOYAN REFLI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Ekstrak Daun Tin (
Ficus carica L.
) sebagai Antioksidan
dan Aktivitas Hambatannya terhadap Proliferasi Sel Kanker HeLa
Nama
: Redoyan Refli
NIM
: G44052579
Disetujui
Pembimbing I
Prof Dr Ir Latifah K. Darusman, MS
NIP. 19530824 197603 2 001
Pembimbing II
Wulan Tri Wahyuni, SSi, MSi
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP. 19501227 197603 2 002
PRAKATA
Alhamdulillahirobbil’alamin
. Puji syukur ke hadirat Allah SWT, Tuhan yang
menjadi sutradara kehidupan yang menetapkan skenario terbaik bagi
hamba-hamba-Nya. Atas nikmat, hidayah, dan ridho-Nya penulis dapat menyelesaikan
karya tulis ini dengan judul “
Potensi Ekstrak Daun Tin (
Ficus carica
L.) sebagai
Antioksidan dan Aktivitas Hambatannya terha
dap Proliferasi Sel Kanker HeLa”
yang dilaksanakan sejak bulan September 2011 di Laboratorium Kimia Analitik
Departemen Kimia Institut Pertanian Bogor (IPB), Pusat Studi Biofarmaka (PSB),
dan Pusat Studi Satwa Primata (PSSP).
Penulis mengucapkan banyak terima kasih kepada Ibu Prof Dr Ir Latifah K.
Darusman, MS, dan Ibu Wulan Tri Wahyuni, SSi, MSi selaku dosen pembimbing
yang telah banyak memberi bimbingan dan arahan kepada penulis. Terima kasih
juga penulis ucapkan kepada Bapak Dr Ir H Achmad, MS yang banyak
mengarahkan dan memotivasi penulis, Kak Budi Arifin, SSi, MSi selaku komisi
pendidikan dan dosen penguji, Bapak M. Khattib, SSi, MSi selaku dosen penguji,
Bapak Eman, Ibu Nunung, Ibu Silmi, Ibu Salina, dan rekan-rekan (Akbar, Arjun,
Ichsan, Wina, Pita, Fitria, Zurida, dan Diah) serta sahabat-sahabat seperjuangan di
Masjid Al-Hurriyyah yang telah banyak membantu dalam menyelesaikan karya
ilmiah ini.
Do’a terbaik penulis persembahkan bagi
semua pihak yang telah
banyak membantu, semoga Allah membalas semua kebaikan yeng telah
dilakukan, senantiasa menuntun kita dalam kebaikan dan memudahkan kita dalam
mencapai impian dan cita-cita kita. Amin.
Terkhusus penulis persembahkan dan banyak terima kasih penulis sampaikan
kepada kedua Orang Tua, Adik, Kakek, Nenek, dan pihak keluarga lainnya. Atas
restu,
semangat, dan do’a dari mereka
, penulis dapat menyelesaikan karya ilmiah
ini. Semoga karya ilmiah ini bermanfaat bagi khalayak umum.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis bernama lengkap Redoyan Refli, dilahirkan di Kota Bekasi pada
tanggal 1 Januari 1988 dari Ayah bernama
Refrizal Riva’i
dan Ibu bernama Lili
Magdalena, SPd. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan formal menengah penulis selesaikan di Pesantren Modern
Terpadu Prof Dr HAMKA, Kabupaten Padang Pariaman, lulus tahun 2002, dan di
Madrasah Aliyah Negeri (MAN) 2 Padang, lulus tahun 2005. Penulis masuk
Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) pada
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut
Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... VII
DAFTAR GAMBAR ... VII
DAFTAR LAMPIRAN ... VII
PENDAHULUAN... 1
TINJAUAN PUSTAKA
Tanaman Tin (
Ficus carica
L
.
) ... 1
Flavonoid ... 2
Tanin ... 2
Triterpenoid/Steroid ... 3
Ekstraksi ... 3
Uji Antioksidan Metode DPPH dan Antioksidan... 3
Uji Toksisitas Metode BSLT ... 4
Kanker dan Uji Proliferasi Sel Kanker Metode MTT ... 4
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN
Kadar Air ... 7
Uji Fitokimia ... 8
Ekstraksi ... 8
Uji Antioksidan Metode DPPH ... 9
Uji Toksisitas Metode BSLT ... 9
Penentuan Eluen Terbaik dengan KLT ... 10
Fraksionasi dengan KLT Preparatif ... 10
Uji Proliferasi Sel Kanker ... 11
Analisis Spektrum UV-Tampak ... 11
Analisis Spektrum FTIR ... 11
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Hasil uji fitokimia ... 8
2 Aktivitas antioksidan ... 9
3
Rentang serapan spektrum UV-tampak senyawa flavonoid ... 11
4 Absorpsi FTIR gugus-gugus fungsi fraksi F
7... 11
DAFTAR GAMBAR
Halaman
1 Tanaman tin (
Ficus carica
L.). ... 2
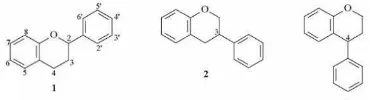
2 Struktur flavonoid (1), isoflavonoid (2), dan neoflavonoid (3). ... 2
3 Mekanisme reaksi metode DPPH... 4
4 Mekanisme reaksi MTT menjadi MTT formazan. ... 4
5 Rendemen ekstrak daun tin. ... 9
6 Aktivitas toksisitas ekstak daun tin. ... 10
7 Hasil pemisahan ekstrak flavonoid menggunakan eluen metanol:etil asetat:air
(1.5:8:0.5) dengan 3 kali ulangan ... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2 Identifikasi tanaman tin (
Ficus carica
L.)... 17
3 Ekstraksi flavonoid... 18
4 Ekstraksi steroid ... 19
5 Ekstraksi tanin ... 20
6 Kadar air simplisia daun tin ... 21
7 Hasil uji aktivitas antioksidan metode DPPH ... 22
8 Hasil uji aktivitas toksisitas metode BSLT ... 24
9 Hasil uji
T
nilai LC
50... 25
10 Hasil fraksionasi ekstrak flavonoid menggunakan KLT preparatif ... 25
11 Uji proliferasi sel kanker HeLa ... 26
PENDAHULUAN
Setiap organisme mempunyai sistem pertahanan alami untuk menjinakkan radikal bebas. Terbentuknya radikal bebas yang bersifat prooksidan (pemacu oksidasi) diimbangi oleh tubuh dengan membentuk antioksidan (penangkal oksidasi). Sejumlah enzim dalam tubuh bertindak sebagai penangkal radikal bebas, seperti glutation, superoksida dismutase (SOD), katalase, dan glutation peroksidase. Dalam keadaan sehat, jumlah antioksidan di dalam tubuh dapat mengimbangi radikal bebas. Namun, dalam keadaan tertentu seperti sakit, stres, pekerja keras yang melebihi takaran biasanya, perokok berat, peminum alkohol, dan kondisi lingkungan yang tidak sehat dan tercemar oleh polusi dapat mengganggu pertahanan tubuh terhadap radikal bebas. Keadaan ini disebut dengan stres oksidatif. Keadaan ini mendasari terjadinya berbagai penyakit yang disebabkan oleh radikal bebas seperti penyakit kanker, jantung koroner, dan penyakit degeneratif lainnya (Astawan 2009). Untuk meminimumkan efek buruk dari stres oksidatif dibutuhkan suplemen antioksidan dari luar tubuh.
Kanker merupakan salah satu penyakit yang disebabkan oleh radikal bebas dan telah menjadi penyakit yang sangat ditakuti saat ini. Kanker merupakan salah satu penyakit tidak menular yang menjadi masalah kesehatan masyarakat di dunia maupun di Indonesia. Di dunia, 12% kematian disebabkan oleh kanker dan menjadi pembunuh nomor 2 setelah penyakit kardiovaskular (Kemenkes 2012). Berdasarkan data dari survei kesehatan rumah tangga (SKRT) tahun 2002, kanker menjadi penyakit penyebab kematian keenam di Indonesia. Sekitar 70 persen penderita kanker mulut rahim (serviks) baru menyadari terkena kanker dan berobat ke rumah sakit dalam kondisi kanker stadium lanjut (Soehartati 2012).
Akhir-akhir ini, berbagai metode terapi penyakit kanker telah banyak dilakukan, salah satu di antaranya ialah kemoterapi. Kemoterapi menghambat pertumbuhan kanker dengan menghambat proliferasi atau membunuh sel kanker tersebut. Namun, metode ini tidak efektif. Ketidakefektifan metode ini disebabkan oleh kesulitan dalam mendesain senyawa kemoterapi yang mempunyai aktivitas antikanker tinggi, tetapi efek sampingnya rendah terhadap sel normal (Gibbs 2000). Kesulitan ini menyebabkan penelitian antikanker dari bahan alam banyak
dilakukan. Obat dari bahan alam menjadi solusi terbaik dalam mencegah dan mengobati kanker karena lebih aman dan menimbulkan efek samping yang lebih kecil bila dibandingkan dengan kemoterapi (Djadjanegara & Wahyudi 2010).
Secara empiris, bagian buah tanaman tin (Ficus carica L.) telah digunakan sebagai antioksidan dan antikanker. Buah tin merupakan sumber penting komponen bioaktif seperti fenol, benzaldehida, terpenoid, flavonoid, dan alkaloid yang memiliki sifat antioksidan dan telah menunjukan efek hambat in vitro terhadap proliferasi berbagai sel kanker (Joseph & Raj 2011). Daun tin mengandung flavonoid, steroid/triterpenoid, alkaloid, dan tanin (Sirisha et al. 2010; Krishna et al. 2007). Menurut Sidi (2010), daun tin digunakan untuk mengobati penyakit batu ginjal karena mengandung alkaloid dan saponin yang bermanfaat sebagai diuretik.
Belum ada laporan ilmiah pemanfaatan ekstrak daun tin sebagai obat antikanker, hanya sebatas sebagai obat antikanker yang digunakan sebagai obat luar dan dijelaskan dalam kitab klasik karangan Ibnu Sina (Lanskya et al. 2008). Penelitian ini bertujuan menentukan aktivitas antioksidan dan aktivitas hambat proliferasi sel kanker HeLa dari fraksi ekstrak teraktif daun tin.
TINJAUAN PUSTAKA
Tanaman Tin (Ficus carica L.)
2
Gambar 1 Tanaman tin (Ficus carica L.).
Kandungan fitokimia tanaman ini terutama buahnya sudah banyak diteliti oleh para peneliti di beberapa negara Timur Tengah, Eropa, dan Amerika Serikat. Buah tin merupakan sumber penting komponen bioaktif seperti fenol, benzaldehida, terpenoid, flavonoid, dan alkaloid yang memiliki sifat antioksidan. Sementara daun tin mengandung alkaloid, saponin, flavonoid, dan polifenol. Menurut Joseph & Raj (2011), tanaman tin diklasifikasikan sebagai berikut:
Kerajaan : Plantae Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Rosales Famili : Moraceae Genus : Ficus Spesies : Ficus carica
Flavonoid
Flavonoid adalah kelompok penting polifenol. Senyawa ini umumnya terdapat pada tanaman dan merupakan pigmen pada tanaman tingkat tinggi (Singh 2002). Senyawa ini terdapat pada seluruh bagian tanaman, termasuk pada buah, tepung sari, dan akar (Sirait 2007). Flavonoid banyak ditemukan di alam karena sekitar 2% karbon yang disintesis tumbuhan diubah menjadi flavonoid (Markham 1988).
Struktur kimia flavonoid didasarkan pada kerangka C15, terdiri atas 2 cincin benzena
yang dihubungkan dengan rantai 3 karbon, yaitu C6-C3-C6 (Pengelly 2004). Kerangka ini
dapat memiliki 3 macam bentuk struktur, yaitu flavonoid, isoflavonoid, dan neoflavonoid. Perbedaan struktur ketiganya ialah pada letak gugus fenil rantai propana (C3), yaitu berturut-turut 2-, 3-, dan 4-fenil
benzopiran (Marais et.al. 2006).
Gambar 2 Struktur flavonoid (1), isoflavonoid (2), dan neoflavonoid (3) (Marais et al. 2006).
Flavonoid merupakan senyawa polar karena memiliki gugus hidroksil yang tidak tersubstitusi. Oleh karena itu, pelarut yang mengekstraksi flavonoid juga merupakan senyawa polar seperti etanol, metanol, n-butanol, aseton, dimetilsulfoksida, dimetilformamida, dan air (Markham 1988).
Flavonoid berperan pada berbagai aktivitas biologis. Menurut para peneliti kanker di UCLA, perokok yang mengonsumsi makanan yang mengandung flavonoid dapat mengurangi risiko penyakit kanker paru-paru (Irwin 2008). Flavonoid tidak hanya dapat menghambat dan membunuh sel-sel kanker, tetapi juga menghambat invasi tumor (Stauth 2007). Menurut Miller (1996), sejumlah tanaman obat yang mengandung flavonoid memiliki aktivitas antioksidan, antibakteri, antivirus, antiradang, dan antialergi. Menurut Pietta et al. (2003), flavonoid memiliki aktivitasantiradang.
Tanin
Tanin merupakan senyawa polifenol yang tersebar luas dalam tumbuhan terutama dalam tumbuhan berpembuluh (Harborne 1987). Senyawa tanin memiliki bobot molekul 500−3000 dan dapat mengendapkan protein dalam larutan. Tanin terbagi dalam 2 kelompok, yaitu tanin terhidrolisis dan tanin terkondensasi. Tanin terhidrolisis mudah dihidrolisis secara kimiawi dan enzimatis. Tanin jenis ini terdapat di beberapa legum tropika seperti Acasia spp. Tanin terkondensasi paling banyak tersebar di tanaman dan dianggap sebagai tanin tanaman (Cannas 2009). Dalam uji kualitatifnya, tanin dapat membentuk kompleks dengan larutan feri klorida menghasilkan warna biru kehitaman.
3
klorida, ekstraksi kembali dengan aseton, dan penghilangan lipid dari bahan yang larut dalam aseton dan eter. Penambahan natrium klorida sedikit demi sedikit dapat mengendapkan tanin. Etanol dapat digunakan untuk melarutkan tanin yang mengendap (Robinson 1995).
Triterpenoid/Steroid
Triterpenoid merupakan senyawa dengan kerangka karbon berasal dari 6 satuan isoprena dan dibiosintesis dari hidrokarbon C30 asiklik skualena. Triterpenoid berstruktur
siklik yang relatif rumit; kebanyakan berupa alkohol, aldehida, atau asam karboksilat; tidak berwarna, berbentuk kristal, biasanya bertitik leleh tinggi, optis aktif, dan umumnya sukar dicirikan karena tidak ada keaktifan kimia secara khusus yang dimiliki (Harborne 1987).
Lebih lanjut menurut Harborne (1987), triterpenoid dapat digolongkan menjadi 4 golongan, yaitu triterpena, steroid, saponin, dan glikosida jantung. Triterpena dan steroid terdapat dalam bentuk glikosida. Triterpena tertentu terkenal dengan rasanya yang pahit seperti limonena dalam buah jeruk.
Struktur steroid sangat beragam sehingga metode isolasi umum sulit diperoleh. Senyawa steroid sebagian besar nonpolar hingga semipolar sehingga proses isolasi dapat menggunakan pelarut benzena atau eter yang nonpolar. Di sisi lain, senyawa glikosida umumnya diekstraksi menggunakan pelarut polar seperti etanol dan metanol (70−90%) dengan pemanasan (Robinson 1995).
Ekstraksi
Ekstraksi merupakan metode pemisahan secara fisik atau kimia satu atau lebih senyawa yang diinginkan dari larutan atau padatan yang mengandung campuran senyawa (Hunt 1988). Pemisahan pada ekstraksi menggunakan prinsip like dissolve like, artinya kelarutan zat dalam pelarut bergantung pada kepolarannya. Zat yang polar hanya larut dalam pelarut polar, begitu pula zat nonpolar hanya larut dalam pelarut nonpolar. Pemilihan pelarut dalam ekstraksi harus memperhatikan selektivitas, kemampuan mengekstraksi komponen sasaran, toksisitas, kemudahan untuk diuapkan, dan harga (Harborne 1987).
Secara umum terdapat tiga metode ekstraksi, yaitu metode perkolasi, maserasi, dan soxhletasi (Houghton & Raman 1998). Maserasi merupakan metode ekstraksi dengan
cara merendam sampel dalam pelarut tunggal atau campuran dengan atau tanpa pengadukan, tanpa pemanasan untuk mengekstraksi sampel yang relatif mudah rusak oleh panas.
Menurut List dan Schmidt (1989), metode maserasi relatif sederhana karena tidak memerlukan alat-alat yang rumit, relatif mudah, murah, dan dapat menghindari rusaknya komponen senyawa akibat panas. Namun, waktu yang diperlukan relatif lama
(umumnya 1−2 hari perendaman) dan penggunaan pelarut tidak efektif dan efisien (Meloan 1999).
Uji Antioksidan Metode DPPH dan Antioksidan
Halliwell dan Gutteridge (1997) mendefinisikan antioksidan ke dalam 4 pengertian. Pertama, antioksidan diartikan sebagai bahan yang mampu mengeliminasi radikal bebas dan spesies reaktif secara katalitik. Kedua, antioksidan diartikan sebagai protein yang mampu meminimumkan sifat prooksidan (seperti transferin dan metalotionein). Ketiga, antioksidan berupa protein yang mampu melindungi biomolekul dari kerusakan. Keempat, antioksidan adalah kelompok bahan yang mampu “memakan” spesies oksigen dan nitrogen yang reaktif.
Menurut Qonita (2009), terdapat 3 macam antioksidan. (1) Antioksidan dapat dibuat oleh tubuh, berupa enzim antara lain superoksida dismutase, glutatione peroksidase, peroksidase, dan katalase. (2) Antioksidan alami dapat diperoleh dari tanaman atau hewan, misalnya tokoferol, vitamin C, beta karotena, flavonoid, dan senyawa fenolik. (3) Antioksidan sintetik, dibuat dari bahan-bahan kimia seperti hidroksianisol berbutil (BHA), hidroksitoluena berbutil (BHT), t-butilhidrokuinon (TBHQ), propil galat (PG), dan asam norhidroguairetat (NDGA) yang ditambahkan dalam makanan untuk mencegah kerusakan lemak.
2009). Reaksi ini menyebabkan terjadinya perubahan warna yang dapat diukur dengan spektrofotometer UV-tampak sehingga aktivitas peredaman radikal bebas oleh sampel dapat ditentukan (Zuhra et al. 2008).
O2N
N-N(C6H5)2 NO2
NO2
+ AH
O2N
N-N(C6H5)2 NO2
NO2 H
+ A
1,1-Difenil-2-pikrilhidrazil 1,1-Difenil-2-pikrilhidrazin
Gambar 3 Mekanisme reaksi metode DPPH (Molyneux 2004).
Uji Toksisitas Metode BSLT
Metode uji letalitas larva udang (BSLT) menggunakan larva udang Artemia salina Leach sebagai hewan uji. Metode ini cukup banyak digunakan untuk pencarian senyawa antikanker baru yang berasal dari tanaman (Meyer et al. 1982).
Larva udang yang digunakan adalah yang sudah berumur 48 jam, karena mempunyai daya resistensi paling rendah terhadap kondisi lingkungannya. Senyawa metabolit sekunder toksik akan menyebabkan kematian larva udang melalui 2 proses, inhalasi (pernapasan) dan difusi. Pada proses inhalasi, toksikan masuk ke tubuh melalui saluran pernafasan: nasofaring, trakea, bronkus, serta lasinia paru-paru yang terdiri atas bronkiol pernafasan, saluran alveolar, dan alveoli. Proses difusi adalah penyerapan toksikan dalam jumlah banyak melalui kulit udang yang tipis. Lewat kedua proses tersebut, toksikan secara sistemik menyebar ke jaringan lain dan memberikan efek letal (Sukardiman et al. 2004).
A. salina Leach merupakan udang invertebrata dari fauna pada ekosistem perairan laut. Udang renik ini mempunyai peranan yang penting dalam aliran energi dan rantai makanan. Spesies invertebrata ini umumnya digunakan sebagai organisme sentinel sejati berdasarkan pada penyebaran, luasnya karakteristik ekologi, dan sensitivitasnya terhadap bahan kimia (Calleja & Persoone 1992).
Kanker dan Uji Proliferasi Sel Kanker Metode MTT
Penyakit kanker disebabkan oleh pertumbuhan sel-sel jaringan tubuh yang tidak normal. Sel-sel kanker akan berkembang
dengan cepat, tidak terkendali, dan akan terus membelah diri, selanjutnya menyusup ke jaringan sekitarnya (invasive) dan terus menyebar melalui jaringan ikat, darah, dan menyerang organ-organ penting serta syaraf tulang belakang. Dalam keadaan normal, sel hanya akan membelah diri untuk menggantikan sel-sel yang telah mati dan rusak. Sebaliknya sel kanker akan membelah terus meskipun tubuh tidak memerlukannya sehingga akan terjadi penumpukan sel baru yang disebut tumor ganas. Penumpukan sel tersebut mendesak dan merusak jaringan normal, sehingga mengganggu organ yang ditempatinya. Kanker dapat terjadi di berbagai jaringan dalam hingga organ tubuh, mulai dari kaki hingga kepala (Agoes 2008).
Uji MTT merupakan uji proliferasi sel kanker untuk mengetahui pertumbuhan dan kelangsungan hidup sel kanker. Dalam uji ini,
3-[4,5-dimetiltilazol-2-il]-2,5-difeniltetrazolium bromide (MTT) mengalami reaksi reduksi oleh suksinat dehidrogenase dalam mitokondria sel hidup (Wang et al. 2009), dan membentuk produk formazan (Gambar 4) (Chapdelaine 2010). Dengan penambahan dimetil sulfoksida (DMSO), dan isopropanol, formazan akan membentuk warna biru yang dapat diukur absorbansinya secara kolorimetri (Barile 1997). Kandungan suksinat dehidrogenase relatif konstan, sehingga jumlah formazan biru yang dihasilkan sebanding dengan jumlah sel hidup yang aktif melakukan metabolisme yang terdapat dalam kultur (Wang et al. 2009; Chapdelaine 2010).
Gambar 4 Mekanisme reaksi MTT menjadi MTT formazan (Kubota et al. 2003).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah daun tanaman tin yang berasal dari Jawa Barat (Bandung dan Bogor), CH3OH, C6H14, C4H9OH, CHCl3, C2H5OH,
FeCl3 1%, NH4OH, H2SO4, HCl pekat, amil
5
Mg, natrium sulfat anhidrat, pelat aluminium jenis silika gel G60F254 dari Merck, larva A.
salina Leach, galur sel kanker karsinoma serviks manusia (HeLa), 3-[4,5-dimetiltilazol-2-il]-2,5-difeniltetrazolium bromida (MTT), medium Roswell Park Memorial Institue (RPMI) 1640, salin buferfosfat (PBS) pH 7.4, dan dimetil sulfoksida (DMSO).
Alat-alat yang digunakan adalah alat kaca, neraca analitik, oven, penguap putar, pelat KLT analitik, pelat KLT preparatif, lampu ultraviolet (UV), spektrofotometer UV-tampak, microplate 96 wells, dan inkubator CO2.
Metode Penelitian
Lingkup Kerja
Penelitian ini dilaksanakan dalam 6 tahap, yaitu (1) identifikasi tumbuhan, preparasi sampel, uji kandungan air, dan uji fitokimia, (2) ekstraksi flavonoid, steroid, dan tanin, (3) uji toksisitas metode BSLT, (4) uji aktivitas antioksidan metode DPPH, (5) fraksionasi ekstrak teraktif menggunakan KLT preparatif, serta (6) uji proliferasi sel kanker HeLa dengan metode MTT dan pencirian senyawa dengan spektofotometer UV-tampak dan FTIR. Bagan alir lingkup kerja terdapat pada Lampiran 1.
Identifikasi Tumbuhan dan Persiapan Sampel
Tanaman tin diidentifikasi di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI). Setelah mendapatkan keterangan identifikasi tumbuhan (Lampiran 2), daun tin diambil dan dicuci lalu dikeringkan dengan dijemur di bawah sinar matahari selama 7 hari. Daun tin kering digiling menggunakan mesin penggiling hingga diperoleh simplisia daun tin dengan ukuran 40 mesh.
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105 ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g sampel daun tin dimasukkan ke dalam cawan dan dipanaskan pada suhu 105 ºC selama 3 jam, kemudian didinginkan dalam eksikator dan ditimbang. Penetapan kadar air dilakukan berdasarkan bobot kering sampel, dilakukan sebanyak 3 ulangan (triplo).
Kadar air
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Uji Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 0.5 g simplisia daun tin ditambahkan 10 mL air panas kemudian dididihkan selama 5 menit dan disaring. Filtrat ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat-kuat. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Alkaloid. Sebanyak 0.5 g simplisia daun tin dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH pekat, disaring ke
dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok bersamaan dengan penambahan 10 tetes H2SO4 2 M kemudian lapisan asamnya
dipindahkan ke dalam tabung reaksi lainnya. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf. Uji positif ditandai dengan muncul endapan berwarna putih, cokelat, dan merah jingga berturut-turut pada pereaksi Mayer, Wagner, dan Dragendorf.
Uji Terpenoid dan Steroid. Uji ini menggunakan pereaksi Lieberman-Buchard. Sebanyak 0.5 g simplisia daun tin dilarutkan dengan 25 mL etanol panas (50 ºC) selama 1 jam, disaring, dan residu ditambahkan eter. Filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid serta hijau atau biru untuk steroid.
Uji Tanin. Sebanyak 0.5 g simplisia daun tin dilarutkan dengan 10 mL air panas, dididihkan selama 5 menit, lalu disaring. Filtrat ditambahkan 10 mL FeCl3 1%. Uji
positif ditandai dengan munculnya warna hijau kehitaman atau biru tua.
Ekstraksi Flavonoid (Markham 1988)
Sampel daun ditimbang sebanyak 50 g kemudian dimaserasi dengan 200 mL pelarut MeOH:H2O (9:1) sebanyak 3 kali. Sampel
disaring dan diambil filtratnya. Residu dimaserasi dengan 200 mL pelarut MeOH:H2O (1:1) sebanyak 3 kali, kemudian
6
dipekatkan dengan penguap putar sampai menjadi sepertiga volume semula.
Ekstrak hasil pemekatan kemudian dipartisi berturut-turut dengan n-heksana dan kloroform. Lapisan MeOH:H2O dipisahkan
dari lapisan heksana dan kloroform. Fraksi MeOH:H2O dipekatkan hingga seluruh pelarut
organik hilang, kemudian dikeringbekukan selama 24 jam untuk menghilangkan sisa pelarut air. Ekstrak flavonoid lalu diuji toksisitas dan antioksidan. Bagan alir ekstraksi flavonoid terdapat pada Lampiran 3.
Ekstraksi Steroid (Heryani 2002)
Sampel daun ditimbang sebanyak 50 g kemudian dimaserasi dengan 200 mL pelarut MeOH sebanyak 3 kali, dipisahkan antara filtrat dan residunya. Setiap maserasi dilakukan selama 24 jam dan disertai dengan pengadukan teratur. Seluruh filtrat dikumpulkan menjadi satu, kemudian dipekatkan dengan penguap putar sampai menjadi sepertiga volume semula.
Ekstrak hasil pemekatan dihidrolisis dengan KOH 10% (dalam EtOH) di atas penangas air menggunakan suhu 100 ºC selama 3 jam. Hasil hidrolisis disaring dan dikeringkan dengan penguap putar. Hidrolisat kering diekstrak menggunakan dietil eter (Et2O) dan dicuci berturut-turut dengan H2O,
HCl 2 N, NaHCO3 jenuh, dan NaCl jenuh.
Fase air dari hasil pencucian dibuang, fase Et2O diambil dan dikeringkan dengan Na2SO4.
Ekstrak diuapkan dengan penguap putar sampai didapatkan ekstrak kering steroid untuk diuji toksisitas dan antioksidan. Bagan alir ekstraksi steroid terdapat pada Lampiran 4.
Ekstraksi Tanin (Heryani 2002)
Sampel daun ditimbang sebanyak 50 g kemudian dimaserasi dengan 200 mL pelarut MeOH sebanyak 3 kali, dipisahkan antara filtrat dan residunya. Setiap maserasi dilakukan selama 24 jam dan disertai dengan pengadukan teratur. Seluruh filtrat dikumpulkan menjadi satu, kemudian dipekatkan dengan penguap putar sampai menjadi sepertiga volume semula.
Ekstrak hasil pemekatan dipartisi dengan heksana. Lapisan MeOH dipisahkan dari lapisan heksana. Fraksi MeOH diekstraksi menggunakan aseton:air (70:30) + 0.1% asam askorbat, lalu disaring. Filtrat diambil, dicuci berturut-turut dengan CHCl3 dan etil asetat.
Larutan pencuci dibuang. Ekstrak diuapkan dengan penguap putar sampai didapatkan
ekstrak kering tanin untuk diuji toksisitas dan antioksidan. Bagan alir ekstraksi tanin terdapat pada Lampiran 5.
Uji Toksisitas Metode BSLT (McLaughlin
et al. 1998)
Penetasan Larva. Larva A. salina Leach ditimbang sebanyak 20 mg kemudian dimasukkan ke dalam wadah khusus berisi air laut yang sudah disaring. Setelah diaerasi, larva dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Larva yang sudah menetas diambil untuk digunakan dalam uji toksisitas.
Persiapan Larutan Sampel. Larutan induk sampel 2000 ppm dibuat dengan menimbang 10 mg ekstrak, lalu dilarutkan dalam 0.005 mL etanol dan ditambahkan air laut hingga menjadi 5 mL. Larutan sampel dengan konsentrasi 10, 100, 500, dan 1000 ppm dibuat dengan mengencerkan 0.005, 0.050, 0.250, dan 0.500 mL larutan induk dengan air laut hingga volumenya menjadi 1 mL.
Uji Toksisitas. Sebanyak 10 ekor larva A. salina Leach yang sehat (berdasarkan motilitas dan kemampuan larva mencari cahaya) dimasukkan ke dalam vial uji yang berisi air laut. Larutan ekstrak daun tin ditambahkan pada masing-masing vial uji dengan konsenerasi 10, 100, 500, dan 1000 ppm, sedangkan untuk control, tidak ditambahkan larutan ekstrak. Masing-masing dibuat 3 ulangan. Pengamatan dilakukan setelah 24 jam dengan menghitung jumlah larva yang mati dari total larva yang dimasukkan dalam vial uji. Penghitungan menggunakan bantuan kaca pembesar.
Uji Antioksidan Metode DPPH
Aktivitas penangkapan radikal (%)
A adalah absorbans larutan DPPH tanpa sampel dan B adalah absorbans sampel (larutan DPPH dan larutan ekstrak) yang telah dikoreksi dengan absorbans larutan ekstrak tanpa DPPH.
Pemilihan Eluen Terbaik (Harborne 1987)
Pelat KLT yang digunakan adalah pelat aluminium jenis silika gel G60F254 dari Merck
dengan ukuran lebar 1 cm dan tinggi 10 cm. Ekstrak pekat metabolit sekunder teraktif ditotolkan pada pelat KLT sebanyak 25 totolan. Setelah kering, langsung dielusi dalam bejana elusi yang telah dijenuhkan oleh uap eluen pengembang. Eluen awal yang digunakan adalah metanol, kloroform, etil asetat, n-butanol, n-heksana, serta berbagai nisbah kloroform, etil asetat, metanol, asam asetat, etil asetat, dan air. Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Eluen yang menghasilkan noda terbanyak dan terpisah dengan baik dipilih sebagai eluen terbaik.
Fraksionasi Menggunakan KLT Preparatif
Ekstrak teraktif ditotolkan pada pelat, kemudian dielusi dengan KLT preparatif menggunakan eluen metanol:etil asetat:air (1.5:8:0.5) dan diperoleh beberapa pita. Pita yang dihasilkan diamati menggunakan sinar UV pada 366 nm, lalu ditandai dan dikerok. Kemudian dilarutkan lalu disaring dan diuapkan dengan penguap putar.
Pencirian Senyawa dengan
Spektrofotometer UV-tampak
Sebanyak 1 mg fraksi teraktif dilarutkan dengan metanol, lalu dimasukkan ke dalam labu takar 50 mL dan ditera dengan pelarut. Larutan dimasukkan ke dalam kuvet dan ditempatkan dalam tempat sampel pada alat spektrofotometer UV-tampak. Analisis dilakukan pada rentang panjang gelombang 400−200 nm.
Pencirian Senyawa dengan FTIR
Sedikit fraksi teraktif (kira-kira 1−2 mg) ditambahkan bubuk KBr murni (kira-kira 200 mg) kemudian diaduk hingga rata. Campuran ditempatkan dalam cetakan dan ditekan dengan menggunakan alat penekan mekanik. Tekanan dipertahankan beberapa menit, kemudian sampel (pelet KBr yang terbentuk) diambil dan ditempatkan dalam tempat sampel
pada alat spektrofotometer FTIR untuk dianalisis.
Uji Proliferasi Sel Metode MTT (Nurlaila 2011)
Media sel dikeluarkan dari flask (botol kultur), kemudian 5 mL PBS ditambahkan untuk membersihkan sel dari sisa media. Sel dilepaskan dari dinding flask dengan menambahkan 2.5 mL tripsin, kemudian diinkubasi pada suhu 37 ºC selama 5 menit. Sel yang telah lepas dimasukkan ke dalam tabung 15 mL dengan menambahkan 2 mL media. Media sel disentrifugasi, kemudian supernatan dibuang dan ditambahkan 3 mL media baru. Viabilitas sel dihitung dengan hemositometer.
Sel ditumbuhkan menggunakan microplate 96 wells sebanyak masing-masing 100 µL/sumur dengan jumlah sel 5×103 sel/sumur. Sel diinkubasi pada suhu 37 ºC selama 24 jam dalam inkubator CO2. Media kultur dibuang,
kemudian ditambahkan ekstrak daun tin dengan deret konsentrasi 50, 100, 200, 400, dan 800 ppm sebanyak 100 µL/sumur dengan 3 kali pengulangan. Sebagai pembanding, dibuat kontrol sel (berisi media sel tanpa ekstrak). Setelah diinkubasi pada suhu 37 ºC selama 48 jam, ditambahkan MTT sebanyak 10 µL/sumur dan diinkubasi kembali pada suhu yang sama selama 4 jam hingga terbentuk formazan yang berwarna biru pada sel hidup. Selanjutnya ditambahkan HCl-isopropanol sebanyak 100 µL/sumur, digoyang secara stabil selama 10 menit, dan dibaca serapannya dengan menggunakan ELISA reader pada panjang gelombang 590 nm. Serapan kemudian dikonversi ke dalam bentuk persen penghambatan.
HASIL DAN PEMBAHASAN
Kadar Air
8
Kadar air simplisia daun tin didapatkan sebesar 3.61% dari 3 kali ulangan dengan nilai RSD 2.19% (Lampiran 6). Nilai tersebut berarti dalam 100 g simplisia terkandung air sebanyak 3.61 g. Hasil ini menunjukkan bahwa simplisia daun tin dapat disimpan dalam jangka waktu relatif lama karena memiliki kadar air kurang dari 10% sesuai dengan ketentuan standar mutu Materia Medika Indonesia (MMI) (Prawirosujanto et al. 1995).
Uji Fitokimia
Uji fitokimia merupakan uji kualitatif untuk menentukan kandungan senyawa metabolit sekunder di dalam sampel. Berdasarkan hasil uji ini, tahap ekstraksi spesifik selanjutnya ditentukan. Uji fitokimia simplisia daun tin dalam penelitian sebelumnya menunjukkan kandungan flavonoid, steroid, triterpenoid, alkaloid, dan tanin (Sirisha et al. 2010; Krishna et al. 2007).
Tabel 1 Hasil uji fitokimia Uji Fitokimia Hasil uji
Flavonoid +++
Alkaloid +
Terpenoid -
Tanin ++
Steroid +
Keterangan:
+++ : intensitas tinggi ++ : intensitas sedang + : intensitas rendah − : tidak terdeteksi
Simplisia daun tin mengandung semua metabolit sekunder yang diujikan kecuali terpenoid, namun dalam intensitas yang berbeda. Perbedaan intensitas terlihat dari jumlah tanda positif (+) yang digunakan pada Tabel 1. Flavonoid menghasilkan intensitas warna paling besar dengan warna merah yang intens pada lapisan amil alkohol. Tanin menghasilkan warna hijau kehitaman dengan intensitas warna lebih lemah bila dibandingkan dengan flavonoid. Terpenoid dan steroid diujikan bersamaan dan menghasilkan warna hijau dengan intensitas warna cukup rendah. Hal ini menunjukkan bahwa simplisia daun tin mengandung steroid dan tidak mengandung terpenoid. Uji alkaloid dilakukan 2 kali. Pengujian pertama menggunakan simplisia sebanyak 0.5 g dan tidak menunjukkan alkaloid. Pengujian kedua menggunakan 1 g simplisia dan menunjukkan
alkaloid, namun dengan intensitas sangat kecil.
Ekstraksi
Senyawa aktif pada tanaman atau bahan alam dapat diperoleh melalui proses ekstraksi. Proses ekstraksi pada penelitian ini menggunakan metode maserasi, yaitu dengan merendam sampel pada pelarut yang sesuai. Maserasi dipilih untuk menghindari rusaknya komponen senyawa akibat panas karena kandungan senyawa dalam sampel belum diketahui daya tahannya terhadap panas (Harborne 1987).
Ekstraksi simplisia daun tin dilakukan untuk mendapatkan 3 metabolit sekunder, yaitu flavonoid, tanin, dan steroid. Metode ekstraksi spesifik digunakan sesuai dengan ekstrak metabolit sekunder yang diinginkan. Ekstraksi flavonoid mengacu pada Markham (1988) memberikan rendemen 11.08%. Ekstraksi tanin dan steroid mengacu pada Heryani (2002), masing-masing menghasilkan rendemen 1.75% dan 0.58%.
Rendemen ekstrak flavonoid lebih besar bila dibandingkan dengan ekstrak tanin dan steroid. Hal ini disebabkan oleh kesesuaian antara pelarut pengekstrak yang digunakan, kepolaran metabolit sekunder, dan proses ekstraksi yang digunakan. Pemilihan pelarut merupakan faktor penting dalam melakukan ekstraksi suatu senyawa. Jenis pelarut yang digunakan dalam proses ekstraksi akan memengaruhi jenis senyawa bioaktif yang terekstraksi karena setiap pelarut memiliki efisiensi dan selektivitas yang berbeda untuk melarutkan komponen bioaktif dalam bahan. Kelarutan suatu senyawa dalam pelarut bergantung pada gugus-gugus yang terikat pada pelarut tersebut. Pelarut yang digunakan dalam ekstraksi harus dapat menarik komponen aktif dalam campuran.
9
Gambar 5 Rendemen ekstrak daun tin.
Uji Antioksidan Metode DPPH
Antioksidan dapat melindungi sel tubuh dari radikal bebas dengan cara mengikat radikal bebas tersebut sehingga dapat memperlambat atau mencegah oksidasi sel oleh radikal bebas. Oksidasi ialah proses kimia yang melibatkan transfer elektron dari suatu zat ke bahan pengoksidasi. Keberadaan senyawa antioksidan dalam suatu bahan dapat dideteksi dengan melakukan uji aktivitas, salah satunya dengan metode DPPH.
Radikal bebas DPPH lazim digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau ekstrak bahan alam (Rakesh et al. 2010). Senyawa DPPH menerima transfer elektron atau radikal hidrogen dari antioksidan membentuk molekul diamagnetik yang stabil.
Metode uji aktivitas antioksidan menggunakan radikal bebas DPPH dipilih karena sederhana, cepat, dan mudah untuk penapisan aktivitas penangkapan radikal beberapa senyawa. Selain itu, metode ini terbukti akurat, terpercaya, dan praktis. Radikal DPPH menghasilkan absorbans yang kuat pada panjang gelombang maksimum 517 nm dan berwarna ungu gelap. Setelah bereaksi dengan senyawa antioksidan, DPPH akan tereduksi dan warnanya berubah menjadi kuning. Perubahan tersebut dapat diukur dengan spektrofotometer dan dialurkan terhadap konsentrasi (Ordon et al. 2006).
Tinggi atau rendahnya aktivitas antioksidan suatu zat dapat dilihat dari nilai IC50-nya. IC50 adalah konsentrasi zat
antioksidan yang dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi zat antioksidan yang memberikan persen penghambatan sebesar 50%. Semakin kecil nilai IC50 berarti aktivitas antioksidannya
semakin tinggi (Molyneux 2004). Nilai IC50
ini didapat dengan cara mengalurkan
konsentrasi sampel uji dengan nilai persen penghambatannya. Setelah itu, persamaan garis linear ditentukan dan dicari konsentrasi zat yang dapat menyebabkan persen penghambatan sebesar 50%.
Kontrol positif yang digunakan pada uji antioksidan adalah vitamin C. Pada Tabel 2 terlihat bahwa ekstrak vitamin C menghasilkan IC50 yang lebih kecil
dibandingkan dengan ekstrak flavonoid dan tanin. Hasil ini menunjukkan bahwa vitamin C mempunyai daya hambat yang lebih baik terhadap radikal bebas karena pada konsentrasi 4.5 ppm dapat menghambat 50% radikal bebas, sedangkan ekstrak flavonoid dan tanin daun tin membutuhkan konsentrasi berturut-turut 150 dan 286 ppm. Di antara kedua ekstrak daun tin ini, ekstrak flavonoid mempunyai daya hambat lebih baik karena mempunyai nilai IC50 lebih kecil. Ekstrak
steroid daun tin menghasilkan nilai IC50
negatif, yaitu -2.295 ppm. Belum diketahui penyebab ekstrak steroid daun tin menghasilkan nilai IC50 negatif. Penelitian
yang dilakukan oleh Juniarti (2009) terhadap ekstrak steroid dari daun saga tidak menunjukkan aktivitas antioksidan. Perhitungan aktivitas antioksidan metode DPPH terlampir pada Lampiran 7.
Tabel 2 Aktivitas antioksidan
No. Sampel IC50
(mg/L) 1 Ekstrak flavonoid daun tin 150
2 Ekstrak tanin daun tin 286
3 Ekstrak steroid daun tin -2.295
4 Vitamin C 4.5
Menurut Zuhra (2008), suatu senyawa dikatakan antioksidan sangat kuat jika nilai IC50 kurang dari 50 ppm, kuat jika IC50 50−100 ppm, sedang jika IC50 100-150 ppm,
dan lemah jika IC50 151-200 ppm. Hasil uji
menunjukkan bahwa vitamin C tergolong antioksidan sangat kuat, ekstrak flavonoid daun tin memiliki aktivitas antioksidan sedang, sedangkan ekstrak tanin daun tin kurang berpotensi sebagai antioksidan.
Uji Toksisitas Metode BSLT
BSLT dilakukan untuk menentukan potensi bioaktif senyawa bahan alam dan toksisitas senyawa kimia yang terkandung dalam tumbuhan obat. Uji toksisitas dilakukan menggunakan larva udang A. salina Leach 11.08 1.75 0.58 0.00 2.00 4.00 6.00 8.00 10.00 12.00
Flavonoid Tanin Steroid
10
yang berumur 48 jam karena mempunyai daya resistensi paling rendah terhadap kondisi lingkungannya.
Pengujian didahului dengan penetasan telur larva selama 48 jam, lalu ekstrak dengan berbagai konsentrasi dimasukkan masing-masing ke dalam air laut yang berisi larva udang. Kematian larva diamati setelah 24 jam. Uji toksisitas menghasilkan nilai LC50 untuk
ekstrak flavonoid, tanin, steroid masing-masing sebesar 191.43, 150.14, dan 153.85 ppm (Gambar 6). Perhitungan uji toksisitas metode BSLT terlampir pada Lampiran 8.
Menurut Meyer et al. (1982), tingkat toksisitas ekstrak tanaman dapat ditentukan dengan melihat harga LC50. Ekstrak dianggap
sangat toksik bila memiliki nilai LC50 di
bawah 30 ppm, toksik bila LC50 30−1000
ppm, dan tidak toksik bila LC50 di atas 1000
ppm. Berdasarkan kriteria di atas, ketiga ekstrak tergolong toksik. Ekstrak tanin dan steroid daun tin memiliki nilai LC50 lebih
kecil sehingga sifat toksiknya lebih kuat bila dibandingkan dengan ekstrak flavonoid daun tin (Gambar 6). Namun, berdasarkan uji T (Lampiran 9), nilai LC50 ketiga ekstrak tidak
berbeda nyata.
Gambar 6 Aktivitas toksisitas ekstrak daun tin.
Penentuan Eluen Terbaik dengan KLT
Berdasarkan uji antioksidan dan toksisitas, ekstrak flavonoid daun tin digunakan pada tahap selanjutnya. Ekstrak dianalisis dengan KLT analitik menggunakan fase diam silika gel G60F254 dari Merck untuk menentukan
komposisi eluen terbaik yang akan digunakan dalam fraksionasi menggunakan KLT preparatif. Pelarut yang digunakan sebagai eluen adalah n-heksana, kloroform, etil asetat, n-butanol, metanol, etil asetat, dan air. Profil kromatogram diamati di bawah lampu UV pada λ 254 dan 366 nm.
Penggabungan beberapa eluen dengan berbagai nisbah menghasilkan eluen terbaik dari eluen yang diujikan, yaitu metanol:etil asetat:air (1.5:8:0.5) (Gambar 7). Menurut Skoog et al. (2004), eluen terbaik adalah yang menghasilkan jumlah noda terbanyak dan terpisah dengan baik. Eluen metanol:etil asetat:air (1.5:8:0.5) ini selanjutnya digunakan pada proses fraksionasi menggunakan KLT preparatif.
Gambar 7 Hasil pemisahan ekstrak flavonoid menggunakan eluen metanol:etil asetat:air (1.5:8:0.5) dengan 3 kali ulangan.
Fraksionasi dengan KLT Preparatif
Ekstrak flavonoid difraksionasi lebih lanjut dengan KLT preparatif (KLTp). Fase gerak yang digunakan metanol:etil asetat:air (1.5:8:0.5) dan fase diam silika gel yang tercetak pada lempengan kaca. Silika gel merupakan senyawa anhidrat, sehingga perlu diaktifkan dalam oven selama 30 menit sebelum digunakan untuk melepaskan air yang terikat secara fisik pada permukaannya. Silika gel dapat menjerap air sebanyak 3.5% bobot keringnya dalam kelembapan sekitar
40−50% (Septianti 2011). Hasil fraksionasi ekstrak flavonoid ditunjukkan pada Lampiran 10.
Silika gel bersifat polar sehingga akan mengikat senyawa yang bersifat polar juga. Senyawa polar akan cepat bergerak jika menggunakan pelarut yang polar, begitu juga sebaliknya (Harvey 2000). Noda yang terbentuk diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm dan dihasilkan 9 fraksi. Semua fraksi dihitung rendemennya. Dari 9 fraksi yang dihasilkan, fraksi 1, 2, 4, dan 7 digunakan dalam uji lanjutan karena jumlahnya memadai.
191.43
150.14 153.85
0 50 100 150 200 250
Flavonoid Tanin Steroid
Uji Proliferasi Sel Kanker
Pengujian aktivitas antikanker dilakukan terhadap 4 fraksi hasil fraksinasi dan ekstrak flavonoid dengan berbagai konsentrasi, yaitu 50, 100, 200, 400, dan 800 ppm. Konsentrasi dipilih di bawah 800 ppm karena pada uji toksisitas, ekstrak flavonoid tergolong toksik. Sel kanker yang digunakan adalah sel HeLa dan uji proliferasi dilakukan menggunakan metode MTT. Metode ini relatif cepat, peka, akurat, dapat digunakan untuk mengukur sampel dalam jumlah banyak, dan hasilnya bisa memprediksi sifat sitotoksik suatu bahan. Namun, metode ini tidak dapat menggambarkan morfologi sel. Akibatnya, apabila terdapat kelainan morfologi akan tetap dihitung sebagai sel hidup, walaupun perubahan morfologi dari suatu sel dapat diakibatkan dari toksisitas suatu bahan.
Hasil uji proliferasi sel kanker (Lampiran 11) menunjukkan bahwa tidak semua fraksi memiliki aktivitas penghambatan sel kanker. Beberapa fraksi pada beberapa konsentrasi yang menghasilkan nilai % inhibisi negatif. Hal ini dapat terjadi karena 2 hal. Pertama, pada konsentrasi tertentu ekstrak dapat memicu perkembangan sel kanker dan kedua, terdapat kenaikan jumlah sel kanker yang mati pada blangko. Fraksi F7 teraktif, dengan nilai
penghambatan yang paling besar, yaitu 57.18% pada konsentrasi 800 ppm.
Analisis Spektrum UV-Tampak
Flavonoid mengandung sistem aromatik terkonjugasi dan karena itu, menunjukkan pita serapan kuat pada daerah spektrum UV-tampak (Harborne 1987). Spektrum khas flavonoid terdiri atas dua panjang gelombang maksimum, yaitu 240–285 nm (pita 2) dan 300–550 nm (pita 1). Rentang serapan spektrum UV-tampak senyawa flavonoid ditunjukkan pada Tabel 3 (Markham 1988).
Fraksi F7 (fraksi teraktif) dianalisis
dengan menggunakan spektrofotometer UV-tampak. Pemayaran dilakukan dengan perubahan panjang gelombang 2 nm. Spektrum UV-tampak fraksi F7 memiliki 2
panjang gelombang maksimum, 325 nm (bahu) dan 268 nm. Hasil tersebut menunjukkan terjadinya transisi σ→σ*, dan
π→π* yang dihasilkan dari kromofor C=C terkonjugasi dan C−O. Senyawa yang
mempunyai transisi n→σ*, dan σ→σ* akan mengabsorpsi cahaya di daerah UV pada panjang gelombang 200-400 nm (Creswell et al. 2005). Menurut Markham (1988) seperti
tertulis pada Tabel 3, serapan pada panjang gelombang 325 nm dan 268 nm merupakan flavonoid golongan isoflavon atau flavon. Spektrum UV-tampak fraksi F7 ditunjukkan
pada Lampiran 12.
Tabel 3 Rentang serapan spektrum UV-tampak senyawa flavonoid (Markham 1988)
Pita 2 (nm) Pita 1 (nm) Jenis Flavonoid 250−280 310−350 Flavon 250−280 330−360 Flavonol (3-OH
tersubstitusi) 250−280 350−385 Flavonol (3-OH
bebas) 245−275 310−330 bahu Isoflavon 275−295 300−330 bahu Flavanon dan
dihidroflavonol 230−270 340−390 bahu Kalkon
230−270
(kekuatan rendah)
380−430 Auron
270−280
(Kekuatan rendah)
465−560 Antosianidin dan antosianin
Analisis Spektrum FTIR
Analisis spektrum FTIR fraksi F7 (Tabel 4)
menunjukkan beberapa gugus fungsi seperti – OH (3435.00 cm-1) yang didukung juga oleh munculnya serapan pada 1114.55 cm-1 untuk ikatan C-O. Gugus C=C aromatik ditunjukkan dengan munculnya serapan pada bilangan gelombang 1627.00 cm-1. Spektrum FTIR fraksi F7 dapat dilihat pada Lampiran 11.
Tabel 4 Absorpsi FTIR gugus-gugus fungsi fraksi F7
Bilangan Gelombang
(cm-1)
Literatur*
(cm-1) Gugus dugaan 3435.00 3200−3450 Regang O-H 1627.00 1500−1675 Regang C=C aromatik 1114.00 1000−1300 Regang C-O
*) Sumber: Creswell et al. (2005)
SIMPULAN DAN SARAN
Simpulan
Ekstrak flavonoid daun tin memiliki aktivitas antioksidan yang lebih baik dibandingkan dengan ekstrak tanin dan steroid, dengan nilai IC50 150 ppm.
ekstrak flavonoid. Fraksi F7 memiliki daya
hambat proliferasi sel kanker tertinggi, yaitu 57.18% pada konsentrasi 800 ppm. Berdasarkan identifikasi menggunakan spektrofotometer UV dan FTIR, fraksi F7
kemungkinan adalah senyawa golongan isoflavon atau flavon.
Saran
Perlu dilakukan uji hambatan proliferasi sel kanker dari ekstrak tanin dan steroid daun tin untuk mengetahui potensinya sebagai antikanker.
DAFTAR PUSTAKA
Agoes A. 2008. Obat antikanker. Di dalam: Rahardjo R, editor. Kumpulan Kuliah Farmakologi, Fakultas Kedokteran, Universitas Sriwijaya. Ed ke-2. Jakarta: Penerbit Buku Kedokteran EGC. hlm 261-271.
[AOAC] Association of Official Analitycal Chemist. 2006. Official Methode of Analysis. Ed ke-18. Washington DC: AOAC.
Astawan M. 2009. A-Z Ensiklopedia Gizi Pangan Untuk Keluarga. Jakarta: Dian Rakyat
Barile FA. 1997. Continuous cell line as a model for drug toxicity assessment. Di dalam: Castell JV, Gomez-Lechon MJ, editor. In Vitro Methods in Pharmaceutical Research. California: Academic Pr. hlm 33-54.
Calleja MC, Persoone G. 1992. Cyst-based toxicity tests IV, the potential of ecotoxicological tests for the prediction of acute toxicity in man as evaluated on the first ten chemicals of the MEIC progme ATLA. Altern Lab Anim 20(3):396-405.
Cannas A. 2009. Tannins: fascinating but sometimes dangerous molecules. [terhubung berkala]. http://www.ansci.cornell.edu/plants/toxica gents/tanin.html [8 Apr 2012].
Chapdelaine JM. 2010. MTT Reduction-A Tetrazolium-Based Colorimetric Assay for Cell Survival and Proliferation. Pennsylvania: Pharmakon Res Int.
Creswell CJ, Olaf AR dan Malcolm MC. 2005. Analisis Spektrum Senyawa Organik Ed ke 3. Bandung: ITB.
Djadjanegara I, Wahyudi P. 2010. Uji sitotoksisitas ekstrak etanol herba ceplukan (Physalis angulata Linn.) terhadap sel T47D secara in vitro. J Ilmu Kefarmasian Ind 1:41-47.
Gibbs JB. 2000. Mechanism-based target identification and drug discovery in cancer research. Science 287:1969-1972.
Halliwell B, Gutteridge JMC. 1997. Free Radicals in Biology and Medicine. Oxford: Oxford Univ Pr.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Phytohemical Methods.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gedia Pustaka Utama.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill.
Heryani H. 2002. Kajian Fraksi Aktif dan Formulasi Tabat Barito (Ficus deltoidea Jack) sebagai Anti Kanker Mikroorganisme Klinis [Disertasi]. Bogor: Institut Pertanian Bogor.
Houghton JB, Raman A. 1998. Laboratory Handbook for Fractionation of Natural Extract. London: Chapman and Hall.
Hunt C. 1988. The Encyclopedia Dictionary of Science. Oxford: Equinox.
Irwin K. 2008. Fruits, vegetables, teas may protect smokers from lung cancer. [terhubung berkala]. http://newsroom.ucla.edu/portal/ucla/fruits -vegetables-and-teas-may-51210. aspx. [14 Apr 2011].
Joseph B, Raj SJ. 2011. Pharmacognostic and phytochemical properties of Ficus carica Linn –An overview. Int J PharmTech Res 3:8-12.
13
antioksidan (1,1-diphenyl-2-pikrilhydrazyl) dari ekstrak daun saga (Abrus precatorius L.). Makara Sains 13:50-54.
[Kemenkes] Kementerian Kesehatan RI. 2012. Kanker Penyebab Kematian Keenam Terbesar di Indonesia [terhubung berkala].
http://www.depkes.go.id/index.php/berita/i
nfo-umum-kesehatan/539-kanker- penyebab-kematian-keenam-terbesar-di-indonesia.html [09 Jul 2012].
Krishna MG, Pallavi E, Ravi KB, Ramesh M, Venkatesh S. 2007. Hepatoprotective activity of Ficus carica Linn. leaf extract against carbon tetrachloride-induced hepatotoxicity in rats. DARU 15(3):162-166.
Kubota T. 2003. Cancer Chemotherapy Chemosensitivity Testing is Useful In Evaluating the Appropriate Adjuvant Cancer Chemotherapy for Stages III/IV Gastric Cancers Without Peritoneal Dissemination. Anticancer Res. 23:583-587.
Lanskya EP, Helena M. Paavilainena, Pawlusb AD, Newmana RA. 2008. Ficus
spp. (fig): Ethnobotany and potential as
anticancer and anti-inflammatory agents. Ethnopharmacol 119:195–213.
List PH, Schmidt PC. 1989. Phytopharmauceutical Technology. Boston: CRC Pr.
Marais JPJ, Deavours B, Dixon R, Ferreira D. 2006. The stereochemistry of flavonoids. Di dalam: Grotewold E, editor. The Science of Flavonoids. New York: Springer Science & Business Media. hlm 1-46.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Techniques of Flavonoid Identification.
McLaughlin JL, Rogers LL, dan Anderson JE. 1998. The Use of Biological Assays to Evaluate Botanicals. Drug information journal 32: 513-524.
Meloan CE. 1999. Chemical Separation. New York: J Willey.
Meyer BN et al. 1982. Brine shrimp: A convenient general bioassay for active plants constituents. Planta Med 45:31-34.
Miller AL. 1996. Antioxidant flavonoid: structure, function, and clinical usage. Alt Med Rev 1(2):103-111.
Molyneux P. 2004. The use of the stable free radical diphenylpicryl-hydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J. Sci. Technol. 26: 211– 219.
Nix S. 2010. How to manage and identify fig. [terhubung berkala]. http://forestry.about.com/od/ silviculture /p/fig.htm. [9 Mei 2011].
Nurlaila. 2011. Fraksi Aktif Ekstrak Daun Sansevieria trifasciata Prain Sebagai Penghambat Pertumbuhan Sel Lestari HeLa [Skripsi]. Bogor: Institut Pertanian Bogor.
Oktavia JD. 2011. Pengoptimuman Ekstraksi Flavonoid Daun Salam (Syzygium polyanthum) dan Analisis Sidik Jari dengan Kromatografi Lapis Tipis [Skripsi]. Bogor: Institut Pertanian Bogor.
Ordon ez AAL, Gomez V, Vattuone MA, Isla MI. 2006. Antioxidant activities of Sechium edule (jacq.) swartz extracts. Food Chem 97: 452-458.
Pengelly A. 2004. The Constituents of Medicinal Plants: an Introduction to the Chemistry and Therapeutics of Herbal Medicine. Ed ke-2. Australia: Allen & Unwin.
Pietta P., Gardana C, Pietta A. 2003. Flavonoids in herbs. Di dalam: Catherine AR, Packer L, editor. Flavonoids in Health and Disease, Second Edition, Revised and Expanded. New York: Marcel Dekker. hlm 43-69.
14
Qonita. 2009. Antioksidan. [terhubung berkala]. http://drqonita.multiply.com/ journal/item/14/ Anti_Oksidan. [15 Apr 2010].
Rakesh SU, Patil PR, Salunkhe VR. 2010. Free radical scavenging activity of hydroalcoholic extracts if dried flowers of Nymphaea stellata Wild. International Journal of Pharma and Bio Sciences 1(2): 1-9.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Ed ke-6. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari The Organic Constituent of Higher Plants.
Salazar-Aranda R, Perez-Lopez LA,
Lopez-Arroyo J, Alanıs-Garza BA, dan Torres NW de. 2009. Antimicrobial and Antioxidant Activities of Plants from Northeast of Mexico. eCAM 1-6.
Septianti A. 2011. Pengukuran Kapasitas Antioksidan Ekstrak Daun Teh Hijau (Camellia sinensis) dengan Metode DPPH dan Voltammetri Siklik [Skripsi]. Bogor: Institut Pertanian Bogor.
Sidi. 2010. Khasiat Tin. Trubus Ed ke-482:24.
Singh AP. 2002. A Treatise on Phytochemistry. Chandigarh: Emedia Science.
Sirait M. 2007. Penuntun Fitokimia dalam Farmasi. Bandung: Penerbit ITB.
Sirisha N, Sreenivasulu M, Sangeeta K, Chetty CM. 2010. Antioxidant properties of ficus species – A review. IntJ PharmTech Res 2(4):2174-2182.
Skoog DA, Holler PJ, Nieman TA. 2004. Principles of Instrumental Analysis. Ed ke-5. Philadelphia: Hartcaurt Brace.
Sobir, Amalya M. 2011. 20 Buah Koleksi Ekslusif. Jakarta: Penebar Swadaya.
Soetarno S, dan Soediro LS. 1997. Standardisasi Mutu Simplisia dan Extrak Bahan Obat Tradisional, Presidium Temu Ilmiah Nasional Bidang Farmasi.
Stauth D. 2007. Studies force new view on biology of flavonoids. [terhubung berkala]. http://www.eurekalert.org/pub_releases/20 07-03/osu-sfn030507.php. [13 Apr 2011].
Soehartati. 2012. Jika tidak dikendalikan 26 juta orang di dunia menderita kanker. [terhubung berkala]. http://www.depkes.go.id/index.php/berita/
press-release/1060-jika-tidak- dikendalikan-26-juta-orang-di-dunia-menderita-kanker-.html [09 Jul 2012].
Sukardiman, Rahman A, Pratiwi FN. 2004. Uji praskrining aktivitas antikanker ekstrak eter dan ekstrak metanol Marchantia cf. planiloba Steph. dengan metode uji kematian larva udang dan profil densitometri ekstrak aktif. Surabaya: Fakultas Farmasi, Universitas Airlangga. Airlangga J Pharm (4)3:24-30.
Wang Y et al. 2009. Screening Antitumor Compounds Psoralen and Isopsoralen from Psoralea corylifolia L Seeds. Hang Zhou: College of Pharmaceutical Science, Zhengjiang University.
16
Lampiran 1 Bagan alir penelitian
Fraksionasi menggunakan KLT Preparatif Simplisia daun tin
Ekstraksi flavonoid Ekstraksi tanin Ekstraksi terpenoid
Uji toksisitas BSLT Uji antioksidan DPPH
Ekstrak teraktif
Fraksi teraktif
Uji proliferasi sel kanker HeLa dengan metode MTT Uji Fitokimia
Pendugaan senyawa menggunakan Spektrofotometer UV dan FTIR
18
Lampiran 3 Ekstraksi flavonoid
Dipekatkan dengan penguap putar
Partisi berturut-turut dengan heksana dan kloroform Serbuk daun tin
Maserasi
[Pelarut MeOH:H2O (9:1)]
Maserasi
[Pelarut MeOH:H2O (1:1)]
Filtrat dikumpulkan
Filtrat pekat (volume sepertiga volume semula)
Fraksi air Fraksi heksana dan
kloroform
Dikeringbekukan selama 24 jam Ekstrak flavonoid
19
Dipekatkan dengan penguap putar
Dipekatkan dengan penguap putar
Fase air (pencuci dibuang)
Lampiran 4 Ekstraksi steroid
Serbuk daun tin
Maserasi (Pelarut MeOH)
Dihidrolisis dengan KOH 10% (dalam EtOH) Diatas penangas air, 100ºC, 3 jam
Saring (mendapatkan hidrolisat)
Ampas dibuang Ekstrak Et2O
Cuci berturut-turut dengan (H2O, HCl 2N, NaHCO3 jenuh, NaCl jenuh)
Fase Et2O
Keringkan dengan Na2SO4 anhidrida
20
Dipekatkan dengan penguap putar
Residu dibuang
Cucian dibuang
Cucian dibuang
Lampiran 5 Ekstraksi tanin
Serbuk daun tin
Maserasi (Pelarut MeOH)
Dipartisi dengan heksana
Ekstraksi dengan aseton:air (70:30) + 0.1% asam askorbat
Ekstrak dicuci dengan CHCl3
Ekstrak dicuci dengan Etil asetat
21
Lampiran 6 Kadar air simplisia daun tin
Ulangan
Bobot
Awal
Bobot
Akhir
Kadar air
Rerata
SB
SBR
(g)
(g)
(%[b/b])
(%[b/b]) (%[b/b])
(%)
1
2.0004
1.9274
3.65
3.61
0.08
2.19
2
2.0005
1.9274
3.65
3
2.0001
1.9298
3.51
#
Simpangan Baku Rerata (% SBR)
∑
Simpangan aku (
)
∑
Simpangan aku Rerata (%S R)=
.100% =
.100% = 2.19%
Keterangan:
Bobot awal adalah bobot simplisia sebelum dikeringkan (g)
22
y = 0.1458x + 28.094 R² = 0.977
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00
0 100 200 300
%
i
n
h
ib
is
i
konsentrasi (ppm)
y = 0.1073x + 19.314 R² = 0.9312
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00
0 100 200 300
%
in
h
ib
is
i
konsentrasi (ppm)
y = -0.0161x + 13.045 R² = 0.6299
0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00
0 100 200 300
%
i
n
h
ib
is
i
konsentrasi (ppm)
Lampiran 7 Hasil uji aktivitas antioksidan metode DPPH
1.
Ekstrak flavonoid
Konsentrasi
(mg/L)
% Inhibisi
200
58.78
100
39.99
50
34.38
12.5
30.89
3.125
29.75
Perhitungan IC
50flavonoid
X = konsentrasi (ppm), Y= % inhibisi
# Y = 0.1458.X + 28.094
50 = 0.1458 . X + 28.094
X = 150 ppm
2.
Ekstrak tanin
Konsentrasi
(mg/L)
% Inhibisi
200
40.34
100
32.47
50
21.82
12.5
19.16
3.125
22.02
Perhitungan IC
50tanin
X = konsentrasi (ppm), Y= % inhibisi
# Y = 0.1073.X + 19.314
50 = 0.1073.X + 19.314
X = 286 ppm
3.
Ekstrak steroid
Konsentrasi
(mg/L)
% Inhibisi
200
10.47
100
10.73
50
10.97
12.5
12.98
23
y = 6.7754x + 19.241 R² = 0.9481
0.00
10.00
20.00
30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
0 5 10 15
%
i
n
h
ib
is
i
konsentrasi (ppm)
Lanjutan Lampiran 7
Perhitungan IC
50steroid
X = konsentrasi (ppm), Y= % inhibisi
Y = -0.0161.X + 13.045
50 = -0.0161.X + 13.045
X = -2,295 ppm
4.
Vitamin C
Konsentrasi
(mg/L)
% Inhibisi
200
82.42
100
70.86
50
62.72
12.5
34.55
3.125
21.82
Perhitungan IC
50Vitamin C
X = konsentrasi (ppm), Y= % inhibisi
Y = 6.7754.X + 19.241
24
y = 0.0173x + 1.3115 R² = 0.8874
0
0.5
1 1.5 2 2.5 3 3.5
0.00 50.00 100.00 150.00
Log
K
on
sent
ra
si
% Kematian
y = 0.0248x + 1.042 R² = 0.987
0 0.5 1 1.5 2 2.5 3 3.5
0 50 100
Log
K
on
sent
ra
si
% Kematian
y = 0.0211x + 1.1321 R² = 0.9919
0 0.5 1 1.5 2 2.5 3 3.5
-50.00 0.00 50.00 100.00
Log
K
on
sent
ra
si
% Kematian
Lampiran 8 Hasil uji aktivitas toksisitas metode BSLT
1.
Kapasitas LC
50ekstrak flavonoid
Perhitungan LC
50y = Log konsentrasi, x= % kematian
y = 0.0248x + 1.042
y = 0.0248(50) + 1.042
y = 2.282
Log (A) = 2.282
A = 191.43 ppm
2.
Kapasitas LC
50ekstrak tanin
Perhitungan LC
50y = Log konsentrasi, x= % kematian
y = 0.0173x + 1.3115
y = 0.0173(50) + 1.3115
y = 2.1765
Log (A) = 2.1765
A = 150.14 ppm
3.
Kapasitas LC
50ekstrak steroid
Perhitungan LC
50y = Log konsentrasi, x= % kematian
y = 0.0211x + 1.1321
y = 0.0211(50) + 1.1321
y = 1.7802
25
Lampiran 9 Hasil uji
T
nilai LC
50Paired T-Test and CI: Flavonoid; Tanin
Paired T for Flavonoid - TaninN Mean StDev SE Mean Flavonoid 4 45,7634 35,6470 17,8235 Tanin 4 49,9612 48,4224 24,2112 Difference 4 -4,19778 19,81740 9,90870
95% CI for mean difference: (-35,73169; 27,33612)
T-Test of mean difference = 0 (vs not = 0): T-Value = -0,42 P-Value = 0,700
Menghasilkan tolak H0 dan terima H1, sehingga flavonoid dan tanin tidak berbeda nyata
Paired T-Test and CI: Flavonoid; Steroid
Paired T for Flavonoid - SteroidN Mean StDev SE Mean Flavonoid 4 45,7634 35,6470 17,8235 Steroid 4 49,5008 41,9956 20,9978 Difference 4 -3,73738 9,61862 4,80931
95% CI for mean difference: (-19,04275; 11,56800)
T-Test of mean difference = 0 (vs not = 0): T-Value = -0,78 P-Value = 0,494
Menghasilkan tolak H0 dan terima H1, sehingga flavonoid dan steroid tidak berbeda nyata
Lampiran 10 Hasil fraksionasi ekstrak flavonoid menggunakan KLT preparatif
Fraksi
Rf
Bobot
kosong
Bobot
kosong+sampel
Bobot
fraksi
Rendemen
(g)
(g)
(g)
(%)
1
0.06
37.6388
37.6466
0.0078
1.91
2
0.17
36.8145
36.8370
0.0225
5.52
3a
0.27
37.2892
37.2897
0.0005
0.12
3b
0.23
37.5775
37.5796
0.0021
0.51
4
0.30
38.5986
38.6086
0.0100
2.45
5
0.39
36.6021
36.6056
0.0035
0.86
6
0.65
37.3032
37.3054
0.0022
0.54
7
0.81
37.4041
37.4130
0.0089
2.18
8
0.95
37.3094
37.3132
0.0038
0.93
Total
0.0613
15.03
Perhitungan Rendemen :
Jumlah ekstrak = 0.2029 + 0.2050 = 0.4079 g
% Rendemen
26
Lampiran 11 Uji proliferasi sel kanker HeLa
Konsentrasi
% Inhibisi
(ppm)
Fraksi 1
Fraksi 2
Fraksi 4
Fraksi 7
Crude
800
44.53
-1.22
33.58
57.18
6.33
400
17.52
0.73
-18.73
3.16
14.11
200
15.09
-41.36
33.09
-12.41
6.57
100
7.79
13.38
17.76
7.76
0.19
50
13.36
16.30
-8.76
-51.34
-9.73
44.53
33.58
57.18
-60.00 -40.00 -20.00 0.00 20.00 40.00 60.00 80.00