PENGARUH PERLAKUAN RIZOBAKTERI
PADA BENIH DAN TANAMAN SERTA PEMUPUKAN FOSFAT
TERHADAP PERTUMBUHAN TANAMAN
TETUA BETINA JAGUNG HIBRIDA
CANDRA BUDIMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Perlakuan Rizobakteri pada Benih dan Tanaman serta Pemupukan Fosfat terhadap
Pertumbuhan Tanaman Tetua Betina Jagung Hibrida adalah karya saya
dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan didalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
ABSTRACT
CANDRA BUDIMAN. Effect of Rhizobacteria Treatment on Seed and Plant as well as Phosphate Fertilize on the Growth of Female Parent of Hybrid Maize. Supervised by: MEMEN SURAHMAN, SATRIYAS ILYAS and GIYANTO. The use of quality seeds from improved varieties will produce plants more productive and efficient. Seed quality constitute of genetic, physical, physiological, and health quality. Phosphate fertilizer can enhance plant growth, however only 10-30% of fertilizer P that can be absorbed by plants. The use of rhizobacteria can enhance phosphate uptake and plant growth. The objectives of this study were to improve the quality of physiological seeds and plant growth hybrid corn using rhizobacteria and phosphate fertilizers. The research has conducted in three stages of experiments in the laboratory, greenhouse and in the field. Experiment used parent of hybrid corn seed cv. Bima-3, namely: Nei9008 (female parent) and Mr14 (male parent). The groups of isolates Actinomycetes,
Bacillus spp. and fluorescent pseudomonads are used in these experiments. The experiment steps were: (1) characterization and screening of rhizobakteria, (2) Evaluation of selected rhizobacteria on seed quality and seedling growth of female parent and (3) Effect of rhizobakteria treatment and phosphate fertilizer on plant growth of female parent. Experiment 3 were conducted in two seasons, season I using six isolates selected from Experiment 1 and 2, while the season II using two isolates which indicated the best result from season I. In the field experiment, the seeds has planted in polybags with sterilized soil. Experiment 3 was arranged in Split Plot Design. The main plot consisted of five doses of phosphate fertilizer, which is 0, 75, 125, 175, and 200 kg SP-36/ha (100% of recommended dosage). Subplot is rhizobacteria treatment. The results showed, there were five isolate choosed from 10 isolates of each genus of rhizobacteria based on the criteria of high producing phosphatase, negative hypersensitive reaction test, producing IAA and chitinase. Experiment 2 showed the rhizobacteria B28 and B46 increase growth rate and seed vigor index. The results of Experiment 1 and 2, rhizobacteria AB2, ATS4, B28, P14 and P31 was selected based on the ability to improve the physiological seed quality of female farent and rhizobacteria B42 based on the highest production of IAA (14.4 µg/ml). Field experiment at the season I, there were rhizobacteria ATS4 and B28 increased plant growht compare to other rhizobacteria. The results from season II, ATS4 has potential to promote plant growth with average number of leaf and plant height at 4 weeks after planting 5.2 and 56.88 cm compared to control 4.8 and 55.98 cm respectively. Phosphate fertilizer strongly influenced on the average number of leaves and plant height. In the season II at 2 and 4 weeks after planting, fertilizing with the recommended dose (200 kg SP-36/ha) showed highest average the number of leaves and the plant height compared with other treatments.
RINGKASAN
CANDRA BUDIMAN. Pengaruh Perlakuan Rizobakteri pada Benih dan Tanaman serta Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina Jagung Hibrida. Dibimbing oleh: MEMEN SURAHMAN, SATRIYAS ILYAS dan GIYANTO.
Penggunaan benih bermutu dari varietas unggul akan menghasilkan tanaman yang lebih produktif dan efisien. Mutu benih mencakup mutu genetik, fisik, fisiologis dan patologis. Pupuk fosfat (P) dapat meningkatkan pertumbuhan tanaman, namun hanya 10-30% pupuk P yang dapat diserap oleh tanaman. Penggunaan rizobakteri dapat meningkatkan serapan pupuk P dan pertumbuhan tanaman. Tujuan penelitian ini adalah untuk meningkatkan mutu fisiologis benih dan pertumbuhan tanaman tetua betina jagung hibrida.
Penelitian ini dilakukan dalam tiga tahap percobaan di laboratorium, rumah kaca dan lapangan. Percobaan menggunakan tetua betina jagung hibrida Bima-3, yaitu: Nei9008 (tetua betina) dan Mr14 (tetua jantan). Rizobakteri yang digunakan dari kelompok Aktinomiset, Bacillus spp. dan Pseudomonas
kelompok fluorescens. Percobaan yang dilakukan adalah: (1) Karakterisasi dan penapisan rizobakteri, (2) Evaluasi pengaruh isolat terseleksi terhadap mutu benih dan bibit tetua betina dan (3) Pengaruh perlakuan rizobakteri dan pemupukan fosfat terhadap pertumbuhan tanaman tetua betina. Percobaan 3 dilaksanakan dalam dua musim, musim I menggunakan enam isolat hasil Percobaan 1 dan 2, musim II menggunakan dua isolat yang menunjukkan hasil terbaik dari percobaan musim I. Benih ditanam dalam polybag dengan tanah steril. Percobaan 3 menggunakan Rancangan Petak Terbagi. Petak utama adalah lima taraf dosis pupuk fosfat, yaitu: 0, 75, 125, 175 dan 200 kg SP-36/ha (100% dari dosis anjuran). Anak petak adalah perlakuan rizobakteri.
Berdasarkan karakterisasi dari 30 isolat rizobakteri yang diuji didapatkan 23 rizobakteri yang mampu memproduksi fosfatase dengan enam rizobakteri diantaranya positif menunjukkan reaksi hipersensitif pada daun tembakau. Pada 18 rizobakteri yang diuji produksi IAAnya, didapatkan seluruh isolat mampu memproduksi IAA. Pada 15 rizobakteri yang diuji produksi kitinasenya, didapatkan 12 rizobakteri yang mampu memproduksi kitinase. Hasil Percobaan 1 dipilih lima isolat dari 10 isolat rizobakteri pada setiap genus, berdasarkan kriteria produksi fosfatase, hypersensitivereaction negatif, IAA dan kitinase. Percobaan 2 menunjukkan rizobakteri B28 dan B46 meningkatkan kecepatan tumbuh dan indeks vigor benih. Hasil Percobaan 1 dan 2 dipilih rizobakteri AB2, ATS4, B28, P14 dan P31 berdasarkan kemampuan meningkatkan mutu fisiologis benih tetua betina, serta rizobakteri B42 berdasarkan produksi IAA teringgi (14.4 µg/ml).
tinggi tanaman pada 4 minggu setelah tanam berturut-turut 5.2 dan 56.88 cm dibandingkan kontrol 4.8 dan 55.98 cm. Perlakuan pupuk fosfat mempengaruhi jumlah daun dan tinggi tanaman. Pada musim II umur 2 dan 4 minggu setelah tanam, pemupukan dengan dosis anjuran (200 kg SP-36/ha) menunjukkan rata-rata jumlah daun dan tinggi tanaman tertinggi dibandingkan dengan perlakuan lainnya.
Kata kunci: Aktinomiset, Bacillus spp., mutu fisiologis benih, Pseudomonas
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjaun suatu masalah; dan
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PENGARUH PERLAKUAN RIZOBAKTERI
PADA BENIH DAN TANAMAN SERTA PEMUPUKAN FOSFAT
TERHADAP PERTUMBUHAN TANAMAN
TETUA BETINA JAGUNG HIBRIDA
CANDRA BUDIMAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sain pada
Program Studi Ilmu dan Tenologi Benih
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pengaruh Perlakuan Rizobakteri pada Benih dan Tanaman serta Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina Jagung Hibrida
Nama : Candra Budiman NIM : A251100021
Disetujui Komisi Pembimbing
Diketahui
Tanggal Ujian: 28 Juni 2012 Tanggal Lulus:
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr Ketua Program Studi
Ilmu dan Teknologi Benih
Prof. Dr. Ir.Satriyas Ilyas, MS
Dr. Ir. Giyanto, MSi Anggota Prof. Dr. Ir.Satriyas Ilyas, MS
Anggota
PRAKATA
Puji syukur penulis hadiratkan kepada Allah SWT atas segala rahmat dan karuniaNya sehingga penelitian dan penulisan tesis ini dapat diselesaikan. Penelitian dilaksanakan pada bulan Juli 2011 – Mei 2012. Penelitian berjudul “Pengaruh Perlakuan Rizobakteri pada Benih dan Tanaman serta Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina Jagung Hibrida”. Tesis ini dibuat sebagai salah satu syarat untuk menyelesaikan studi di Sekolah Pascasarjana IPB.
Terima kasih penulis ucapkan kepada Dr. Ir. Memen Surahman, MSc.Agr, Prof. Dr. Ir. Satriyas Ilyas, MS, dan Dr. Ir. Giyanto, MSi selaku komisi pembimbing yang telah banyak memberi saran untuk kesempurnaan tesis ini. Terimaksih untuk KKP3T Dikti yang telah membiayai pelaksanaan penelitian ini. Terimakasih kepada keluarga tercinta Ayahanda Rajiman, Ibunda Refinelwati, Nenekku Rukanah serta kedua adikku tercinta Cindra Rahma dan Sesria Emitra, yang telah memberikan kasih sayang, dorongan, semangat dan do’a. Untuk Ezy Y. Rezki terimakasih atas bantuan, dorongan, semangat dan do’anya. Penulis juga tidak lupa mengucapkan terimakasih kepada Pak Awaludin, Pak Tjipto, Pak Jekvy, Mas Gani, Bu Lia, Izza, Ida, Tatit, Mba Tita, Pak Gandi, Pak Milin, dan rekan-rekan ITB 2010 serta pihak-pihak yang terlibat secara langsung maupun tidak dalam pelaksanaan penelitian maupun penyelesaian studi saya. Demikian tesis ini disusun berdasarkan hasil penelitian, semoga dapat memberikan manfaat.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Solok, Provinsi Sumatera Barat pada tanggal 20 Januari 1987. Penulis adalah anak pertama dari tiga bersaudara dari pasangan Bapak Rajiman dan Ibu Refinelwati.
Penulis menyelesaikan pendidikan dasar di SD Negeri 01 Menangkerang Tanjung Bingkung pada tahun 1999. Pada tahun 2002 penulis menyelesaikan pendidikan di SLTP Negeri 01 Solok dan lulus dari SMA Negeri 01 Solok pada tahun 2005. Pada tahun 2005 penulis diterima sebagai mahasiswa Institut Pertanian Bogor melalui Seleksi Penerimaan Mahasiswa Baru. Pada tahun 2006 penulis diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, kemudian lulus pada tahun 2009. Penulis mendapatkan kesempatan melanjutkan studi S2 pada Program Studi Ilmu dan Teknologi Benih pada tahun 2010.
Bogor, Juli 2012
DAFTAR ISI
Rizobakteri sebagai Pemacu Pertumbuhan Tanaman dan Agens Pengendali Hayati ... 6
METODOLOGI PENELITIAN ... 10
Waktu dan Tempat ... 10
Benih Tetua Jagung Hibrida ... 10
Isolat Rizobakteri ... 10
Percobaan 1. Karakterisasi dan Penapisan Rizobakteri ... 13
Percobaan 2. Evaluasi Pengaruh Isolat Terseleksi terhadap Mutu Benih dan Bibit Tetua Betina ... 14
Percobaan 3. Pengaruh Perlakuan Rizobakteri dan Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina ... 15
HASIL DAN PEMBAHASAN ... 18
Hasil ... 18
Percobaan 1. Karakterisasi dan Penapisan Rizobakteri ... 18
Percobaan 2. Evaluasi Pengaruh Isolat Terseleksi terhadap Mutu Benih dan Bibit Tetua Betina ... 25
Percobaan 3. Pengaruh Perlakuan Rizobakteri dan Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina ... 28
Pembahasan ... 34
SIMPULAN DAN SARAN ... 40
DAFTAR TABEL
Nomor Halaman
1. Isolat rizobakteri yang digunakan dalam penelitian ... 12
2. Produksi fosfatase oleh beberapa isolat rizobakteri pada media Pikovskaya ... 19
3. Reaksi hipersensitif rizobakteri pada daun tembakau ... 20
4. Produksi kitinase oleh beberapa isolat rizobakteri pada media Kitin 1% ... 23
5. Penapisan rizobakteri berdasarkan produksi fosfatase, hypersensitive reaction, produksi indole acetic acid dan produksi kitinase ... 24
6. Pengaruh perlakuan benih dengan rizobakteri terhadap indeks vigor, daya berkecambah, dan kecepatan tumbuh ... 26
7. Pengaruh perlakuan benih dengan rizobakteri terhadap tinggi bibit, panjang akar, bobot basah dan kering bibit ... 28
8. Pengaruh pupuk fosfat terhadap tinggi tanaman (cm) ... 29
9. Pengaruh pupuk fosfat terhadap jumlah daun ... 29
10. Pengaruh perlakuan rizobakteri terhadap tinggi tanaman (cm) ... 30
11. Pengaruh perlakuan rizobakteri terhadap jumlah daun ... 30
12. Pengaruh pupuk fosfat terhadap tinggi tanaman (cm) ... 31
13. Pengaruh pupuk fosfat terhadap jumlah daun ... 32
14. Pengaruh perlakuan rizobakteri terhadap tinggi tanaman (cm) ... 32
15. Pengaruh perlakuan rizobakteri terhadap dan jumlah daun ... 33
16. Pengaruh pemupukan fosfat terhadap biomassa tanaman (g/tanaman) ... 33
DAFTAR GAMBAR
Nomor Halaman 1. Bagan alir penelitian ... 11 2. Jarak tanam jagung di antara baris dan di dalam baris tanaman ... 17 3. Tata letak tetua jantan dan betina ... 17 4. Pembentukan zona bening oleh beberapa rizobakteri pada media
Pikovskaya ... 18 5. Gejala nekrosis oleh rizobakteri pada daun tembakau setelah 24 jam
DAFTAR LAMPIRAN
Nomor Halaman
1. Deskripsi varietas Bima-3 ... 49
2. Deskripsi galur tetua betina Bima-3: Nei9008 ... 51
3. Deskripsi galur tetua jantan Bima-3: Mr14 ... 52
4. Hasil analisi tanah Percobaan 3 musim I ... 53
PENDAHULUAN
Latar Belakang
Benih merupakan input utama dalam produksi pertanian. Penggunaan benih bermutu dari varietas unggul akan menghasilkan tanaman yang produktif dan lebih efisien. Produktivitas jagung dapat ditingkatkan dengan pengembangan varietas unggul yang adaptif terhadap kondisi lingkungan, seperti varietas hibrida. Pada tahun 2010, total produksi jagung 18.3 juta ton dari 4.1 juta ha dengan produktivitas 4.4 ton/ha (BPS Indonesia, 2011). Target produksi jagung pada tahun 2010 adalah 19.8 juta ton, jadi masih ada kekurangan 1.5 juta ton.
Untuk mendukung peningkatan produksi jagung di Indonesia, Karama (2004) berpendapat bahwa kebijakan perbenihan jagung komersil tingkat nasional sebaiknya diproduksi di Indonesia. Namun hingga saat ini, sumber daya dan kelembagaan perbenihan jagung dalam negeri belum merupakan produsen pertanian yang mumpuni dan berdaya saing handal (Baihaki 2004). Oleh sebab itu, aspek pemahaman ilmu pemuliaan praktis dalam kehidupan pertanian khususnya ilmu dan teknologi menghasilkan benih jagung hibrida bermutu oleh petani harus diperluas dan ditingkatkan.
Produksi benih jagung hibrida menggunakan dua galur tetua, yaitu tetua betina yang dibuang bunga jantannya (detaseling) dan tetua jantan yang menghasilkan polen untuk membuahi bunga betina (tongkol) tetua betina. Benih jagung hibrida didapatkan dari tanaman tetua betina. Untuk itu perlu perlakuan yang dapat meningkatkan pertumbuhan tetua betina sehingga mengasilkan benih hibrida dengan produktivitas dan mutu yang tinggi.
Mutu benih menyangkut mutu genetis, fisik, fisiologis dan patologis (Ilyas 2010). Berkaitan dengan mutu benih, hal-hal yang perlu diperhatikan adalah sebagai berikut: (1) teknik produksi benih berkualitas; (2) teknik mempertahankan mutu benih yang telah dihasilkan, penyimpanan dan pendistribusiannya; dan (3) teknik deteksi kualitas benih (Saenong et al. 2005).
produksi tanaman. Benih dengan mutu fisiologis yang tinggi akan menghasilkan tanaman yang sehat dengan sistem perakaran yang berkembang dengan baik, dapat lebih tahan terhadap kondisi lingkungan yang tidak menguntungkan, pertumbuhan bibit yang cepat, dan terbukti berkorelasi dengan hasil yang tinggi (Harris et al. 2000).
Salah satu cara untuk peningkatan produktivitas dan mutu fisiologis benih adalah dengan pemberian pupuk fosfat (P). Fosfor memiliki peran yang sangat penting dalam semua aktivitas biokimia dalam sel hidup. Energi makhluk hidup didapatkan dari perubahan ikatan adenosin trifosfat (ATP) menjadi adenosin difosfat (ADP). Adenosin trifosfat juga menjadi sumber energi utama dalam perkecambahan benih. Benih dengan kandungan P total tinggi memiliki vigor yang lebih tinggi, dan lebih mampu mempertahankan viabilitasnya selama periode simpan (Bewly & Black 1978 dalam Agustin 2011).
Ketersediaan fosfat terbaik dalam kisaran pH 6 – 7. Kalsium fosfat mulai mengendap pada kisaran pH 6.0, dan cenderung membentuk apatit pada pH di atas 7.0 (Foth, 1988). Penggunaan rizobakteri dapat membantu melarutkan bentuk-bentuk fosfat yang tidak tersedia menjadi bentuk yang tersedia bagi tanaman sehingga penggunaan pupuk P lebih efisien (Prihartini 2009). Bentuk dominan dari fosfat tersedia bagi tanaman adalah H2PO4- (Foth 1988). Hanya 10-30% pupuk yang diberikan dapat diserap oleh tanaman, selebihnya tersimpan dalam tanah sebagai residu (Jones 1982).
Fungsi rizobakteri terhadap pertumbuhan tanaman adalah: (i) membantu meningkatkan serapan nutrisi; (ii) mencegah perkembangbiakan organisme patogen; dan (iii) menyediakan hormon pertumbuhan (Glick et al. 2007). Inokulasi benih dengan rizobakteri secara signifikan meningkatkan daya berkecambah dan vigor benih jagung (Gholami et al. 2009) dan padi (Agustiansyah et al. 2010).
mengenai pemanfaatan rizobakteri sebagai pelarut fosfat dan penghasil hormon pertumbuhan perlu dilakukan pada tetua betina jagug hibrida.
Tujuan
Penelitian ini bertujuan untuk meningkatkan mutu fisiologis benih dan pertumbuhan tanaman tetua betina jagung hibrida, melalui penggunaan rizobakteri dan pemupukan fosfat.
Hipotesis
1. Penggunaan rizobakteri dapat meningkatkan mutu fisiologis benih dan pertumbuhan tanaman tetua betina jagung hibrida.
2. Pemberian pupuk fosfat dapat meningkatkan pertumbuhan tanaman tetua betina jagung hibrida.
TINJAUAN PUSTAKA
Mutu Benih Jagung Hibrida
Ilyas (2010) menyatakan bahwa mutu benih menyangkut mutu genetis, fisik, fisiologis, dan patologis. Mutu genetis menjabarkan sifat-sifat unggul yang diwariskan dari pohon induknya. Mutu fisik tidak hanya menyangkut struktur morfologis tetapi juga ukuran dan berat benih. Mutu fisiologis berhubungan dengan viabilitas dan vigor. Mutu patologis atau kesehatan benih menunjukkan keberadaan patogen didalam benih.
Berbagai tolak ukur telah dikembangkan untuk menilai mutu fisiologis suatu lot benih. Menurut Sadjad (1994), viabilitas benih adalah daya hidup benih yang dapat ditunjukkan dalam berbagai fenomena fisiologis maupun biokimia. Informasi pengujian viabilitas dan vigor benih dapat berupa pengujian bersifat langsung maupun tidak langsung (Sadjad 1980). Pengujian langsung dapat dilakukan dengan melihat gejala perkecambahan, sementara pengujian tidak langsung dapat dilakukan dengan mengukur aktivitas metabolisme (biokimia) dan kondisi benih yang mempengaruhi mutu benih.
Varietas hibrida merupakan generasi pertama hasil persilangan antara tetua berupa galur inbrida. Produksi benih jagung hibrida menggunakan dua galur tetua, yaitu tetua betina yang dibuang bunga jantannya (detaseling) dan tetua jantan yang menghasilkan polen untuk membuahi bunga betina (tongkol) tetua betina. Benih jagung hibrida diperoleh dari tongkol tetua betina.
Fosfor memiliki peran yang sangat penting dalam semua aktivitas biokimia dalam sel hidup. Energi makhluk hidup didapatkan dari perubahan ikatan adenosin trifosfat (ATP) menjadi adenosin difosfat (ADP). Fosfor juga menjadi sumber energi utama dalam perkecambahan benih. Benih dengan kandungan P total tinggi memiliki vigor yang lebih tinggi, dan lebih mampu mempertahankan viabilitasnya selama periode simpan (Bewly & Black 1978
dalam Agustin 2011). Aplikasi pupuk fosfat (P) juga dapat meningkatan mutu fisiologis dan produktivitas benih.
Perlakuan Benih
Perlakuan benih adalah semua proses baik fisik, biologi maupun kimia yang diaplikasikan kepada benih (BPMBTPH 2005). Djojosumarto (2000) menambahkan bahwa perlakuan benih adalah mencampur benih yang akan ditanam dengan pestisida (umumnya insektisida dan fungisida). Pencampuran dapat dilakukan dengan dua cara yaitu pencampuran kering dan pencampuran basah (slurry).
Tujuan perlakuan benih adalah 1) menghilangkan sumber infeksi benih (disinfeksi) untuk melawan patogen tular benih dan hama; 2) perlindungan terhadap benih melawan hama dan patogen yang mungkin berada di tanah atau udara ketika benih muncul di permukaan tanah; 3) meningkatkan perkecambahan benih atau melindungi benih dari patogen dan hama (Desai et al. 1997).
Salah satu perlakuan benih yang telah terbukti efektif adalah
matriconditioning. Menurut Khan et al. (1990) matriconditioning adalah perlakuan hidrasi benih terkontrol dengan media padat lembab yang menggunakan potensial matriks dalam proses imbibisi air ke benih untuk memperbaiki pertumbuhan bibit. Matriconditioning dapat memperbaiki kerusakan-kerusakan dalam benih melalui proses metabolisme yang terkendali, sehingga mampu menurunkan waktu perkecambahan dan meningkatkan daya berkecambah benih, serta meningkatkan kemampuan tumbuh dan produksi di lapang.
Xoo terbawa benih (mutu patologis) padi. Hasil penelitian Agustiansyah et al.
(2010) menggunakan matriconditioning dengan P. diminuta A6 atau B. subtilis
A54 mampu meningkatkan pertumbuhan bibit padi di rumah kaca.
Rizobakteri sebagai Pemacu Pertumbuhan Tanaman dan Agens Pengendali
Hayati
Glick et al. (2007), melaporkan bahwa fungsi rizobakteri terhadap pertumbuhan tanaman adalah: (i) membantu dalam memperoleh nutrisi seperti nitrogen, fosfor atau besi; (ii) mencegah perkembangbiakan organisme patogen; dan (iii) menyediakan hormon tanaman seperti auksin atau sitokinin, atau menurunkan produksi etilen melalui aktivitas enzim 1-aminocyclopropane-1-karboksilat (ACC) deaminase.
Sintesis IAA dari triptopan melalui asetonitril (IAN), Indol-3-asetamida (IAM), dan asam indol-3-piruvat (IpyA). Menurut Zakharova et al.
(1999) bakteri dapat mensintesis IAA melalui ketiga lintasan ini, sedangkan tanaman umumnya melalui lintasan IAM dan IpyA. Menurut Salisbury dan Ross (1992), IAA berfungsi menstimulasi perpanjangan sel, meregulasi dominansi apikal, dan merangsang pembentukan akar-akar lateral dan adventif. Secara struktural IAA terkait dengan asam amino triptofan.
Penggunaan rizobakteri perlarut fosfat seperti Pseudomonas spp. dan
Bacillus spp. dapat melarutkan bentuk-bentuk fosfat yang sukar larut sehingga menjadi bentuk yang tersedia bagi tanaman (Rodriquez 1999; Subba-Rao 2007; Prihartini 2009; Agustiansyah 2011) dan menghasilkan hormon tumbuh asam indol asetat (IAA), giberelin dan sitokinin (Faccini et al. 2004; Agustiansyah 2011), dengan demikian penggunaan pupuk P lebih efisien dan dapat dihemat. Menurut Khan et al. (2009), peningkatan pelarutan fosfat adalah hasil kombinasi antara penurunan pH tanah dan produksi asam organik dari bakteri pelarut fosfat yang diberikan, sedangkan menurut Goenadi (2008), kemampuan melarutkan fosfat oleh mikroba pelarut fosfat juga ditentukan oleh enzim fosfatase dan asam organik yang dihasilkan.
benih jagung. Namun, peningkatan tersebut bervariasi antar jenis bakteri. Bakteri
A. lipoferum DSM1691 meningkatkan daya berkecambah benih jagung hingga 18.5% dibanding tanpa inokulasi. Sementara peningkatan indeks vigor tertinggi diperoleh dari inokulasi A. brasilense DSM 1690 dan P. putida R-168.
Pada tanaman pisang dalam kondisi hidroponik, pemberian PGPR dapat meningkatkan volume dan panjang akar, tinggi tanaman (42– 50%), luas daun (128 – 134%), kandungan klorofil (25 – 33%) dan berat kering total (Baset et al.
2010). Pada skala percobaan laboratorium, perlakuan benih dengan
matriconditioning + P. diminuta A6, perendaman dalam P. diminuta A6atau P. aeruginosa A54 merupakan perlakuan benih terbaik untuk meningkatkan viabilitas dan vigor benih. Perlakuan matriconditioning + P. aeruginosa A54 merupakan perlakuan benih terbaik dalam meningkatkan pertumbuhan bibit padi (Agustiansyah 2011). Hasil penelitian lainnya menunjukkan bahwa penggunaan mikroorganisme melalui aplikasi pada benih sebelum tanam secara nyata meningkatkan produksi padi (Agustiansyah et al. 2010; Thakuria et al. 2004; Kazempour 2004; Biswas et al. 2000), kedelai (Bai et al. 2002; Bai et al. 2003; Dashtil et al. 2005), jagung (Thuar et al. 2004) dan cabai (Estrada et al. 2004; Ilyas 2006).
Dalam kaitanya sebagai agens hayati, beberapa jenis mikroorganisme dari kelompok bakteri (Pseudomonas spp., Bacillus spp., Serratia spp.) dan cendawan (Trichoderma spp.) telah dikembangkan dan dilaporkan efektif untuk mengendalikan penyakit tanaman. Bacillus spp. efektif mengendalikan Alternaria solani, Stemphilium solani (Silva et al. 2004), Colletotrichum capsici (Sutariati et al. 2006) dan Xoo (Agustiansyah 2011). Pseudomonas spp. efektif terhadap
Rhizoctonia solani (Gnanamanikam et al. 1999; Estrada et al. 2004), Alternaria
sp. (Estrada et al. 2004), C. capsici (Sutariati et al 2006), Xoo (Agustiansyah 2011; Gnanamanikam 1995; Gnanamanikam et al. 1999; Velusamy et al. 2006).
Proses pengendalian pada umumnya dilakukan dengan cara mengkolonisasi akar tanaman melalui mekanisme kompetisi nutrisi dengan patogen atau dengan menghasilkan senyawa metabolit sekunder seperti
antimicrobial antibiotic 2,4-diacetylphloroglucinol (DAPG) (Velusamy et al.
protease dan selulase (Zhang 2002), yang berperan sebagai senyawa anti-mikroba untuk menekan pertumbuhan patogen. Senyawa 2,4-diacetylphloroglucinol merupakan antibakterial, antifungal, antiviral dan antihelmintik serta sudah diterapkan sebagai agens hayati pada penyakit tembakau, gandum, dan sugar beet.
Kitinase merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin. Berdasarkan cara kerjanya dalam mendegradasi substrat, kitinase dibedakan ke dalam dua kelompok utama: endokitinase dan eksokitinase. Endokitinase memotong polimer kitin secara acak menghasilkan dimer, trimer, tetramer dan atau oligomer gula. Eksokitinase memotong kitin hanya dari ujung non reduksi. Bila hasil protongan berupa monomer maka enzim tersebut dinamakan Nacetylheksosaminidase, namun bila potongan yang dihasilkan berupa dimer maka enzim tersebut disebut sitobiosidase (Cohen-Kupiec & Chet 1998 Dalam Toharisman 2007).
Dinding sel fungi umumnya tersusun dari kitin. Rizobakteri yang dapat menghasilkan kitinase diharapkan mampu mendegradasi kitin pada dinding sel fungi. Fukamizo (2001) melaporkan hasil uji spektra terhadap Fusarium oxysporum, dimana spektra dinding selnya serupa dengan kitin yang memiliki tingkat asetilasi 65-75%. Hal ini menunjukkan bahwa sebagian besar komponen penyusun dinding sel fungi tersebut adalah kitin. Meskipun secara spesifik penggunaan kitinase dalam pengendalian penyakit jagung belum pernah dilakukan, dengan analogi yang sama seperti di atas kemungkinan besar penyakit-penyakit jagung yang disebabkan fungi bisa dikendalikan oleh rizobakteri penghasil kitinase.
DNA, RNA, dan protein memegang peranan penting dalam mekanisme sel secara normal (Pelczar & Chan 2005).
METODOLOGI PENELITIAN
Waktu dan Tempat
Percobaan ini dilakukan dalam tiga tahapan percobaan yang dilaksanakan di laboratorium, rumah kaca dan lapang (Gambar 1). Penelitian dilaksanakan pada bulan Juli 2011 sampai Mei 2012 di Laboratorium Ilmu dan Teknologi Benih Departemen Agronomi dan Hortikultura, Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, rumah kaca Laboratorium Benih Leuwikopo, dan Laboratorium Lapang Cikabayan Departemen Agronomi dan Hortikultura IPB.
Benih Tetua Jagung Hibrida
Tetua jagung hibrida varietas Bima-3 yang digunakan adalah: Nei 9008 sebagai tetua betina dan Mr14 sebagai tetua jantan. Benih diperoleh dari Balai Penelitian Tanaman Serealia Maros, Sulawesi Selatan. Kedua benih tetua jagung hibrida yang digunakan dipanen pada bulan Mei 2011, dan disimpan pada suhu ± 20 0C mengunakan kemasan kantong plastik dengan kadar air awal 11%. Percobaan 2 di rumah kaca hanya menggunakan benih tetua betina. Percobaan 2 dilaksanakan pada bulan Agustus 2011. Percobaan 3 di lapang menggunakan kedua tetua hibrida, tetapi hanya tetua betina yang diberi perlakuan dengan rizobakteri dan pemupukan fosfat. Percobaan 3 musim I dilaksanakan pada bulan September sampai Desember 2011. Percobaan 3 musim II dilaksanakan pada bulan Februari sampai Mei 2012.
Isolat Rizobakteri
Output: 15 rizobakteri terpilih Percobaan 1 dilakukan di Laboratorium
Bakteriologi Dept. Proteksi Tanaman.
Pengujian yang dilakuakan: (1) Uji Pelarutan Fosfat, (2) Uji Hypersensitive Reaction, (3) Uji Produksi IAA, (4) Uji Produksi Enzim Kitinase dan (5) Penapisan isolat rizobakteri.
Percobaan 2 dilakukan di Rumah kaca Dept. Agronomi dan Hortikultura.
1. Uji mutu fisiologis benih tetua betina. Variabel yang diamati: daya berkecambah, indeks vigor dan kecepatan tumbuh.
Percobaan 3 dilakukan di Laboratorium Lapang Cikabayan.
Pengujian dilakukan dalam 2 musim.
Tabel 1. Isolat rizobakteri yang digunakan dalam penelitian
Isolat Genus Asal Isolat Referensi
P11 Pseudomonas kelompok fluorescens Citere-Pengalengan Ratdiana (2012) P12 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P13 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P14 Pseudomonas kelompok fluorescens Landungsari-Malang Ratdiana (2012) P16 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P17 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P24 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P31 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Ratdiana (2012) P32 Pseudomonas kelompok fluorescens Koleksi laboratorium bakteriologi DPT Penelitian ini P34 Pseudomonas kelompok fluorescens Batu-Malang Ratdiana (2012) B11 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini B13 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini B26 Bacillus spp. Tembilahan- Riau Penelitian ini B28 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini
B29 Bacillus spp. Bogor Penelitian ini
B31 Bacillus spp. Tembilahan- Riau Penelitian ini B36 Bacillus spp. Tembilahan- Riau Penelitian ini B37 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini B42 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini B46 Bacillus spp. Koleksi laboratorium bakteriologi DPT Penelitian ini
AB2 Aktinomiset Tanah perakaran bambu Himmah (2012)
AB3 Aktinomiset Tanah perakaran bambu Himmah (2012)
AB4 Aktinomiset Tanah perakaran bambu Himmah (2012)
AB10 Aktinomiset Tanah perakaran bambu Himmah (2012)
AB11 Aktinomiset Tanah perakaran bambu Himmah (2012)
APS12 Aktinomiset Tanah perakaran sawit Himmah (2012)
ATS4 Aktinomiset Tanah sawah Himmah (2012)
ATS5 Aktinomiset Tanah sawah Himmah (2012)
Percobaan 1. Karakterisasi dan Penapisan Rizobakteri
Seluruh pengujian menggunakan rizobakteri murni dengan optical density
(OD) yang sama. Optical density diukur pada panjang gelombang 600 nm. Pengujian pelarutan fosfat dan kitinase menggunakan metode sumur, media agar yang telah mengeras dilubangi dengan borer berdiameter 5 mm. Isolat rizobakteri berumur 48 hari dengan nilai OD 0.5 dimasukkan ke dalam lubang/sumur sebanyak 50 µl. Data yang dihasilkan dianalisis dengan uji t.
Uji Pelarutan Fosfat. Uji ini dilakukan dengan menggunakan media
Pikovskaya (Subba-Rao 1999), dengan komposisi 10 g glukosa, 5 g Ca3HPO4, 0.5 g (NH4)2SO4, 0.2 g KCl, 0.1 g MgSO4.7H2O, 0.5 g ekstrak khamir, 25 mg MnSO4, 25 mg FeSO4, dan 20 g agar Bacto dalam 1 liter akuades. Suspensi isolat bakteri berumur 24-48 jam ditumbuhkan pada media Phikovskaya dengan metode sumur, evaluasi pelarutan fosfat dilihat dari zona bening yang dihasilkan di sekitar koloni setelah inkubasi selama 3 hari untuk Pseudomonas kelompok fluerescens dan Bacillus spp. dan 7 hari untuk Aktinomiset.
Uji Hypersensitive Reaction (HR). Pengujian HR perlu dilakukan sebelum mempelajari karakter rizobakteri. Pengujian HR bertujuan untuk menyeleksi isolat bakteri patogen tanaman. Pengujian dilakukan dengan cara menyuntikkan isolat bakteri berumur 24 jam ke daun tembakau. Evaluasi dilakukan berdasarkan gejala nekrosis pada daun tembakau. Isolat yang menunjukkan gejala nekrosis (HR+) mengindikasikan isolat tersebut merupakan patogen tanaman. Isolat dengan HR+ tidak diuji lebih lanjut.
Uji Produksi IAA. Pengujian produksi IAA yang dilakukan mengacu
dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 ml reagen Salkowski (perbandingan filtrat: reagen = 1:1). Suspensi kemudian diinkubasikan selama 60 menit pada suhu ruang di dalam ruang gelap. Selanjutnya dilakukan pengukuran serapan IAA-nya dengan menggunakan spektrofotometer (Spectronic 20) pada panjang gelombang 510 nm.
Uji Produksi Enzim Kitinase. Uji produksi kitinase dilakukan dengan
menggunakan media kitin 1%, dengan komposisi 15 g agar Bacto, 5 g glukosa, 2 g pepton, 10 g koloidal chitin, 0.5 g K2HPO4, 0.5 g MgSO4, 0.5 g NaCl dalam 1 liter akuades (Cattelan et al. 1999). Isolat rizobakteri terlebih dahulu ditanam pada media King’s B selama 24 jam. Sebanyak 1µl suspensi rizobakteri tersebut kemudian diteteskan diatas media kitin 1% dengan metode sumur. Adanya aktivitas kitinolitik ditandai dengan terbentuknya zona bening di sekitar suspensi isolat setelah inkubasi selama 3 hari untuk Pseudomonas kelompok fluerescens dan Bacillus spp. serta 7 hari untuk Aktinomiset.
Penapisan isolat rizobakteri. Penapisan rizobakteri dimulai dari
pengujian kemampuan rizobakteri dalam malarukan fosfat. Rizobakteri yang mampu melarutkan fosfat diharapkan dapat membantu melarutkan fosfat yang terikat menjadi tersedia. Seluruh rizobakteri diuji rekasi hipersensistifnya pada daun tembakau. Rizobakteri yang memeiliki kemampuan melarutkan fosfat yang tinggi dan tidak menunjukkan gejala hipersensitif pada daun tembakau, dipilih dan diuji kemampuan produksi IAA-nya. Dari hasil pengujian pelarutan fosfat, pengujian HR dan menghasilkan indole acetic acid (IAA) dipilih masing-masing lima isolat dari ketiga genus rizobakteri untuk diuji kitinase dan digunakan pada Percobaan 2.
Percobaan 2. Evaluasi Pengaruh Isolat Terseleksi terhadap Mutu Benih dan
Bibit Tetua Betina
yang digunakan adalah tetua betina hibrida varietas Bima-3. Benih jagung diberi perlakuan osmoconditioning dengan rizobakteri dengan nilai OD 0.5 selama 12 jam. Benih ditanam dalam bak plastik (40 cm x 25 cm x 10 cm) yang berisi media pasir steril sebanyak 25 butir. Untuk menjaga kelembaban media dilakukan penyiraman tiap hari.
Variabel yang diamati berupa: daya berkecambah, indeks vigor, kecepatan tumbuh, bobot basah dan kering bibit, tinggi bibit dan panjang akar (umur 4 minggu). Daya berkecambah dihitung dari persentase jumlah kecambah normal pada pengamatan hitungan ke-1 (5 hari) dan pengamatan hitungan ke-2 (7 hari). Indeks vigor dihitung dari persentase kecambah normal pada pengamatan hitungan ke-1. Kecepatan Tumbuh Benih (KCT) dihitung berdasarkan jumlah pertambahan persentase kecambah normal/etmal (1 etmal = 24 jam) (Sadjad et al., 1999), diamati hingga pengamatan hitungan ke-2. Bobot basah perbibit dihitung dengan menimbang dari seluruh bibit dibagi jumlah bibit yang ditimbang setelah dikering anginkan selama ± 2 jam. Bobot kering perbibit dihitung dengan menimbang dari seluruh bibit dibagi jumlah bibit yang ditimbang setelah dioven pada suhu 600C selama 3 x 24 jam. Tinggi bibit diukur pada umur 9 hari setelah tanam (HST) dan 28 HST. Panjang akar hanya diukur pada umur 28 HST, bibit dibongkar dari bak plastik, dicuci dan diukur panjang akarnya.
Data yang dikumpulkan dianalisis menggunakan analisis ragam (Anova) dengan bantuan software SAS versi 9.0. Jika terdapat pengaruh nyata, maka dilanjutkan dengan Duncan pada taraf 5%.
Percobaan 3. Pengaruh Perlakuan Rizobakteri dan Pemupukan Fosfat
terhadap Pertumbuhan Tanaman Tetua Betina
perlakuan benih yang terdiri atas (1) kontrol (air), perlakuan dengan rizobakteri yaitu: (2) AB2; (3) ATS4; (4) B28; (5) B42; (6) P14; dan (7) P31. Total terdapat 105 satuan percobaan. Setiap satuan percobaan terdiri atas tiga polybag. Percobaan musim II dilakukan pada bulan Februari – Mei 2012. Anak petak adalah perlakuan benih yang terdiri atas (1) kontrol (air), perlakuan dengan rizobakteri yaitu: (2) ATS4 dan (3) B28. Total terdapat 60 satuan percobaan.
Rizobakteri yang digunakan pada musim I adalah enam yang terbaik dari hasil Percobaan 2. Pada musim II digunakan dua rizobakteri terbaik dari hasil musim I. Aplikasi rizobakteri dan pupuk P dilakukan terhadap tetua betina jagung hibrida varietas Bima-3 sesuai dengan perlakuan. Pemupukan tetua jantan dilakukan sesuai rekomendasi yaitu 300 kg Urea, 200 kg SP-36, dan 100 kg KCl/ha. Rizobakteri sebagai perlakuan diberikan dua kali yaitu sebagai seed treatment (osmoconditioning) dan saat tanaman berumur 30 hari. Perlakuan
osmoconditioning menggunakan perbandingan antara benih : suspensi inokulum rizobakteri adalah 1 : 1.2 (g : ml). Suspensi inokulum rizobakteri yang digunakan diukur secara kuantitatif dengan pengukuran kerapatan optik bakteri (optical density) menggunakan spektrofotometer. Aplikasi rizobakteri kedua dilakukan dengan menyiramkan 50 ml larutan rizobakteri dengan populasi ± 109 kepada setiap tanaman pada umur 30 hari setelah tanam (MST).
Untuk mengetahui kandungan hara tanah (N, P, K, S dan C-organik), sebelum penanaman sampel tanah dianalisis di laboratorium. Tanah yang digunakan disterilsasi menggunakan outoklaf, kemudian dimasukkan ke dalam
polybag (40 cm x 40 cm x 40 cm) sebanyak 9 kg/polybag. Benih ditanam sebanyak dua benih/polybag. Penjarangan menjadi satu tanaman/polybag
* * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * 75 cm * * * * * * * * * * * * * * * * * * * * * * * * * * * * *
* * * * * * * * * * * * * * * * * * * * * * * * * * * * * 20 cm
Gambar 2. Jarak tanam jagung di antara baris dan di dalam baris tanaman
# # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # #
Ket : # = tetua jantan ; * = tetua betina
Gambar 3. Tata letak tetua jantan dan betina
Pengamatan pertumbuhan tanaman tetua betina dilakukan terhadap (1) tinggi tanaman, (2) jumlah daun, (3) bobot basah dan kering tajuk dan (4) bobot basah dan kering akar. Tinggi tanaman diukur tiap dua minggu. Tinggi tanaman diukur dari pangkal batang sejajar tanah hingga pucuk tanaman pada umur 2, 4, 6 dan 8 MST. Tinggi tanaman pada fase generatif diukur dari pangkal batang sejajar tanah hingga cabang malai pertama pada 8 MST. Jumlah daun diukur bersamaan dengan pengukuran tinggi tanaman. Pucuk daun yang sudah membuka sempurna dihitung sebagai daun. Bobot basah tajuk dan akar dihitung dengan menimbang tajuk atau akar setelah dikering anginkan selama ± 2 jam. Bobot kering tajuk dan akar dihitung dengan menimbang tajuk atau akar setelah dioven pada suhu 600C selama 3 x 24 jam.
HASIL DAN PEMBAHASAN
Hasil
Percobaan 1. Karakterisasi dan Penapisan Rizobakteri
Uji Pelarutan Fosfat
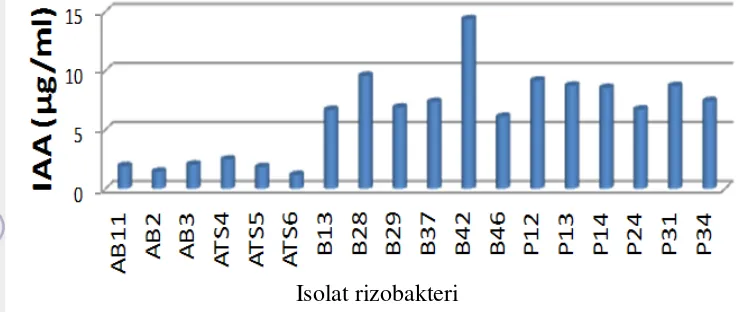
Kemampuan rizobakteri melarutkan fosfat dievaluasi melalui ukuran zona bening yang dibentuk pada media Piskovkaya. Media Pikovskaya merupakan media spesifik untuk memudahkan isolasi mikrob pelarut fosfat. Media spesifik Pikovskaya menggunakan sumber fosfat dari dari bentuk fosfat tak larut berupa kalsium fosfat. Warna putih susu yang nampak tersebut merupakan warna putih dari kalsium fosfat yang bersifat tidak larut. Butiran sangat halus kalsium fosfat dari media Pikovskaya yang menyebar secara merata pada media yang menyebabkan visualisasi media Pikovskaya menjadi berwarna putih susu. Rizobakteri yang dapat melarutkan kalsium fosfat dapat tumbuh dan berkembang pada media Pikovskaya. Kalsium fosfat yang larut akan menyebabkan warna media menjadi bening. Zona bening yang lebih besar menunjukkan kemampuan produksi fosfatatase yang lebih tinggi (Gambar 4).
Gambar 4. Pembentukan zona bening oleh beberapa rizobakteri pada media Pikovskaya
Seluruh isolat dari kelompok Aktinomiset mampu membentuk zona bening sebagai indikasi kemampuan melarutkan fosfat, dengan tingkat yang berbeda-beda pada setiap isolat. Isolat AB4 dan AB3 memiliki kemampuan melarutkan fosfat tertinggi dibanding isolat kelompok Aktinomiset lainnya (Tabel
2). Rizobakteri Pseudomonas kelompok fluerescens yang mampu melarutkan fosfat yaitu: P12, P13, P14, P24 dan P31. Rizobakteri Pseudomonas kelompok fluerescens memiliki kemampuan yang lebih tinggi melarutkan fosfat dibanding isolat kelompok Bacillus spp. dan Aktinomiset. Menurut Goenadi (2008), enzim fosfatase dan asam organik harus dihasilkan oleh mikroba pelarut fosfat agar mampu melarutkan senyawa fosfat.
Tabel 2. Produksi fosfatase oleh beberapa isolat rizobakteri pada media Pikovskaya
Beberapa karakter penting rizobakteri dalam meningkatkan pertumbuhan tanaman adalah menghasilkan hormon tumbuh seperti IAA (Thakuria et al. 2004; Teixeira et al. 2007; Karnwal. 2009), giberelin (Joo et al. 2005), memfiksasi N (Bai et al. 2003; Park et al. 2005; Hafeez et al. 2006), melarutkan P (Faccini et al.
Hypersensitive Reaction (HR)
Uji HR merupakan salah satu metode untuk mengetahui karakter mikroba sebagai patogen tumbuhan atau tidak. Setelah dilakukan isolasi dari lapangan sangat penting untuk melihat sifat patogenesis rizobakteri agar dapat diuji lebih lanjut. Dalam penelitian ini pengujian patogenesitas isolat rizobakteri yang digunakan adalah pengujian HR pada daun tembakau. Daun tembakau akan berwarna coklat dan kering akibat nekrosis jika rizobakteri yang diujikan merupakan patogen. Menurut Klement (1990), respon hipersensitif merupakan reaksi pertahanan cepat dari tanaman terhadap patogen yang tidak kompatibel disertai dengan kematian sel yang cepat pada jaringan yang diinjeksi bakteri.
Rizobakteri yang menunjukkan gelala hipersensitif pada daun tembakau diduga merupakan patogen bagi tanaman. Berdasarkan pengujian HR dari 10 isolat kelompok Aktinomiset terdapat empat isolat yang positif adalah AB4, AB10, APS12 dan ATS8. Pada kelompok Bacillus spp. yang diuji terdapat tiga isolat yang menunjukkan gejala hipersensitif yaitu B11, B31 dan B36. Pada
Pseudomonas kelompok fluorescens terdapat tiga isolat yang positif yaitu P16, P17, dan P32 (Tabel 3).
Tabel 3. Reaksi hipersensitif rizobakteri pada daun tembakau
Rizobakteri Reaksi Rizobakteri Reaksi Rizobakteri Reaksi
AB2 - B11 + P11 -
Bakteri tidak dapat berkembang di dalam daun tembakau karena sel bakteri tidak kompatibel dengan sel daun tembakau (Kerr & Gibb 1997 dalam Asrul 2005).
Gambar 5. Gejala nekrosis oleh rizobakteri pada daun tembakau setelah 24 jam inkubasi
Produksi IAA
Rizobakteri dapat meningkatkan pertumbuhan tanaman melalui senyawa bioaktif yang dihasilkan. Salah satunya dengan menghasilkan hormon pertumbuhan asam indol asetat (IAA). Asam indol asetat merupakan hormon auksin endogen yang disintesis dalam berbagai bagian tubuh tanaman dan umumnya berasosiasi dengan bagian tanaman yang sedang aktif tumbuh dan berkembang seperti pada meristem ujung tunas, ujung akar, dan kambium.
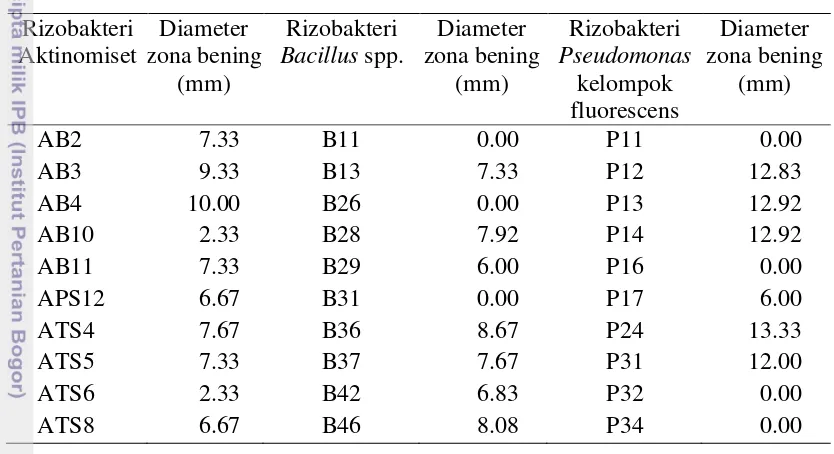
Seluruh isolat rizobakteri yang diuji mampu memproduksi IAA. Pada penelitian ini rizobakteri dari kelompok Bacillus spp. dan Pseudomonas kelompok fluerescens menghasilkan IAA lebih tinggi dibandingkan isolat dari kelompok
Actinomycetes spp. Isolat B42 memiliki produksi IAA tertinggi (Gambar 6). Menurut Thakuria et al. (2004), rizobakteri dari kelompok Bacillus spp. menghasilkan IAA lebih tinggi. Tetapi Ahmad et al. (2005) menyampaikan bahwa kemampuan rizobakteri kelompok Pseudomonas spp. menghasilkan IAA lebih besar dibandingkan rizobakteri lain.
Isolat rizobakteri
Gambar 6. Produksi indole acetic acid oleh berbagai isolat rizobakteri
Rizobakteri yang digunakan diharapkan dapat menyediakan IAA bagi tanaman. Beberapa bakteri mampu memproduksi IAA antara lain Pseudomonas putida (Patten & Glick 2002), Pseudomonas diminuta dan Bacillus subtilis
(Agustiansyah 2011), serta Actinomycetes spp. (Yusepi 2011).
Uji Produksi Enzim Kitinase
Menurut Van Loon (2007), karakter rizobakteri dalam mengendalikan penyakit maupun populasi patogen bisa melalui beberapa cara. Karakter tesebut antara lain: produksi senyawa antibiosis, persaingan ruang atau nutrisi, kompetisi pemanfaatan unsur Fe melalui produksi siderofor, induksi mekanisme resistensi, inaktivasi faktor perkecambahan patogen, degradasi faktor patogenesitas seperti misalnya toksin, parasitisme yang melibatkan produksi enzim ekstraseluler pendegradasi dinding sel, misalnya kitinase, β-1.3 glukanase.
Gambar 7. Pembentukan zona bening oleh rizobakteri ATS4 pada media Kitin 1%
Pada pengujian produksi kitinase pada media Kitin 1%, didapatkan hasil isolat AB3, ATS5, ATS4 dan B42 yang memiliki produksi kitinase tertinggi berturut-turut 11.33, 10.83, 8.67 dan 8.67 mm (Tabel 4). Hasegawa et al. (2006) melaporkan beberapa isolat Streptomyces diketahui mampu memproduksi enzim-enzim hidrolitik seperti selulase, hemiselulase, kitinase, amilase, dan glukanase. Pada pengujian ini juga dapat dilihat bahwa seluruh isolat Actynomicetes spp. dan
Bacillus spp. mampu menghasilkan kitinase.
Tabel 4. Produksi kitinase oleh beberapa isolat rizobakteri pada media Kitin 1% Rizobakteri
Penentuan jenis rizobaktei yang digunakan dalam penelitian ini dilakukan beberapa tahap. Karakter mampu memproduksi fosfatase menjadi karakter utama dalam pemilihan rizobakteri sesuai dengan tujuan penelitian. Untuk memastikan keamanan hayati bahwa rizobakteri terpilih bukan patogen tumbuhan, maka dilakukan uji HR dimana rizobakteri dengan HR negatif digunakan untuk penelitian lebih lanjut. Pengujian lebih lanjut dalam kemampuan menghasilkan IAA digunakan sebagai parameter kemampuan rizobakteri menginduksi
pertumbuhan tanaman. Pengujian kemampuan dalam produksi kitinase sebagai indikator kemampuan rizobakteri dalam mengendalikan patogen tanaman.
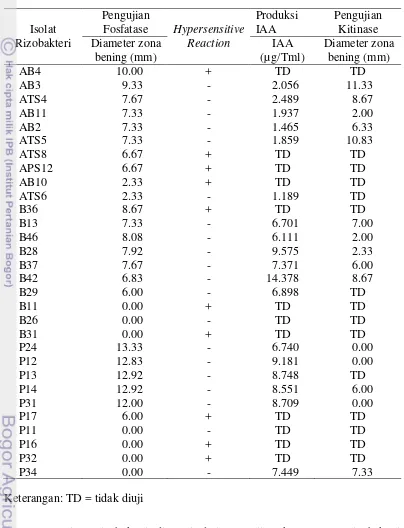
Tabel 5. Penapisan rizobakteri berdasarkan produksi fosfatase, hypersensitive reaction, produksi indole acetic acid dan produksi kitinase
Isolat
dan HR dipilih masing-masing enam rizobakteri pada setiap kelompok rizobakteri untuk diuji kemampuan produksi IAAnya. Rizobakteri yang digunakan pada Percobaan 2 dipilih masing-masing lima rizobakteri pada setiap genus berdasarkan kemampuan produksi fosfatase, IAA dan pertimbangan lain.
Rizobakteri AB4 dan B36 yang memiliki produksi fosfatase tertinggi pada masing-masing kelompoknya tidak diuji produksi IAA-nya karena menunjukkan gejala hipersensitif pada daun tembakau. Rizobakteri P17 yang memiliki kemampuan produksi fosfatase tidak diuji lebih lanjut karena menunjukkan gejala hipersensitif pada daun tembakau, sedangkan rizobakteri P34 dipilih karena lebih mudah dikulturkan dibanding rizobakteri P11.
Percobaan 2. Evaluasi Pengaruh Isolat Terseleksi terhadap Mutu Benih dan Bibit Tetua Betina
Isolat yang digunakan adalah lima isolat terbaik dari masing-masing genus rizobakteri yang diuji pada Percobaan 1. Perlakuan benih dengan rizobakteri B28 dapat meningkatkan IV, DB, dan KCT benih berturut-turut 48%, 80% dan 12%/etmal dibanding kontrol berturut-turut 29%, 65%, dan 7.25%/etmal (Tabel 6). Menurut Desai et al. (1997) salah satu tujuan perlakuan adalah memperbaiki perkecambahan benih dan melindungi benih dari hama dan penyakit. Perlakuan benih menggunakan rizobakter diharapkan meningkatkan mutu benih dan bibit.
Tabel 6. Pengaruh perlakuan benih dengan rizobakteri terhadap indeks vigor, daya berkecambah, dan kecepatan tumbuh
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
mikroba khususnya Bacillus spp. dapat berfungsi sebagai PGPR sekaligus dapat berperan sebagai pengendali penyakit tanaman. Kemampuan Bacillus spp. didukung oleh pembentukan spora pada kondisi lingkungan yang tidak menguntungkan (Kloepper et al. 1999).
Pengaruh positif dari perlakuan benih dengan agens hayati telah dilaporkan pada benih jagung (Gholami et al. 2009) dan padi (Ashrafuzzaman et al. 2009). Menurut Gholami et al. (2009), perbaikan viabilitas dan vigor benih ini diduga disebabkan oleh peningkatan sintesis hormon seperti IAA atau giberelin (GA3) sebagai pemicu aktivitas enzim amilase yang berperan dalam perkecambahan. Disisi lain, peningkatan viabilitas dan vigor benih dapat disebabkan oleh hilang atau berkurangnya patogen yang terdapat pada benih, sehingga perkecambahan benih lebih mudah karena tidak ada tekanan dari patogen.
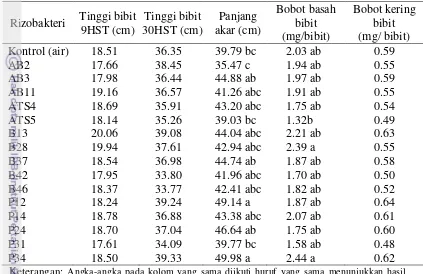
Panjang akar bibit menunjukkan perlakuan benih dengan rizobakteri P12 (49.12 cm) dan P34 (49.99 cm) meningkat secara nyata dibanding kontrol (39.79 cm). Berdasarkan tinggi bibit pada 9 dan 30 HST, terdapat beberapa perlakuan benih dengan rizobakteri yang cenderung meningkatkan tinggi tanaman. Tinggi tanaman pada perlakuan benih dengan rizobakteri B13, B28, dan AB11 pada 9 HST berturut-turut 20.06, 19.94 dan 19.16 cm dibanding kontrol 18.51 cm. Tinggi tanaman umur 30 HST pada perlakuan benih dengan rizobakteri P24, P12 dan P34 berturut-turut 46.64, 49.14 dan 49.98 cm dibanding kontrol 39.79 cm (Tabel 7).
Tabel 7. Pengaruh perlakuan benih dengan rizobakteri terhadap tinggi bibit, panjang akar, bobot basah dan kering bibit
Rizobakteri Tinggi bibit
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
Berdasarkan pengaruh perlakuan benih dengan rizobakteri meningkatkan viabilitas dan vigor benih, dipilih isolat B28 (Bacillus spp.), P14, P31 (Pseudomonas kelompok fluerescens), AB2, dan ATS4 (Aktinomiset.). Isolat B42 (Bacillus spp.) juga dipilih karena menghasilkan IAA dan kitinase tertinggi berturut-turut 14.38 µg/ml dan 8.67 mm dibanding rizobakteri lainnya pada genus
Percobaan 3. Pengaruh Perlakuan Rizobakteri dan Pemupukan Fosfat terhadap Pertumbuhan Tanaman Tetua Betina
Penelitian dilaksanakan dalam dua kali penanaman di dalam polybag di Kebun Percobaan Cikabayan. Musim I digunakan enam isolat rizobakteri hasil Percobaan 1 dan 2. Musim II menggunakan dua isolat hasil musim I.
Musim I
Perlakuan pupuk fosfat secara statistik tidak berbeda nyata terhadap tinggi tanaman pada umur 2, 6, dan 9 MST. Hal ini diduga disebabkan kandungan hara P tersedia pada tanah yang digunakan sudah sangat tinggi (P2O5 metode Olsen: 43 ppm). Menurut Balai Penelitian Tanah (2005), kriteria penilaian hasil analisis tanah untuk P2O5 metode Olsen > 20 ppm termasuk kriteria P tersedia sangat tinggi. Pada umur 4 MST, pemupukan fosfat dengan dosis 125 dan 200 kg/ha SP36 meningkatkan tinggi tanaman dibanding tanpa pemupukan (Tabel 8). Jumlah daun tanaman tetua jagung hibrida tidak dipengaruhi oleh pemupukan fosfat (Tabel 9).
Tabel 8. Pengaruh pupuk fosfat terhadap tinggi tanaman (cm) Dosis pupuk
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
Tabel 9. Pengaruh pupuk fosfat terhadap jumlah daun Dosis pupuk
Rizobakteri B28 dan B42 memiliki potensi untuk dikembangkan lebih lanjut. Walaupun peningkatan tinggi tanaman dan jumlah daun tidak nyata secara statistik. Hal ini mungkin disebabkan oleh penggunaan tanah dengan kandungan hara P dan K yang tinggi (Tabel Lampiran 2), sehingga aktivitas rizobakteri tidak berfungsi secara optimal dalam membantu pertumbuhan tanaman. Pengaruh perlakuan benih dengan rizobakteri sebagian besar menurunkan tinggi tanaman pada 2 MST (Tabel 10), sedangkan jumlah daun tidak dipengaruhui aplikasi rizobakteri (Tabel 11). Pada umur 6 MST rizobakteri B42 menghasilkan jumlah daun lebih banyak dibanding rizobakteri B28, P31 dan P14.
Tabel 10. Pengaruh perlakuan rizobakteri terhadap tinggi tanaman (cm)
Rizobakteri Tinggi tanaman minggu ke-
2 4 6 9
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
Tabel 11. Pengaruh perlakuan rizobakteri terhadap jumlah daun
Rizobakteri Jumlah daun minggu ke-
2 4 6 9
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
terhambat. Sejumlah enzim berasosiasi dengan induksi ketahanan sistemtik, seperti peroksidase, phenylalanine ammonia-lyase (PAL), lipoxygenase, β-1.3 glucanase, dan chitinase (Van Loon 2007). Silva et al. (2004) dan Agrios (2005) menyatakan bahwa tingginya aktivitas enzim peroksidase berhubungan dengan lignfikasi sel dan papilla, serta pembentukan hidrogen peroksida yang dapat secara langsung menghambat patogen. Peningkatan enzim peroksidase dan enzim lain yang bersifat antimikroba diatur oleh keberadaan asam jasmonat dan etilen yang keduanya diaktifkan oleh mikroorganisme yang bersifat saprofit seperti rizobakteri (Van Loon et al. 1998).
Berdasarkan hasil percobaan pada musim I, dilanjutkan pada percobaan musim 2 dengan menggunakan 2 isolat terbaik yang dapat meningkatkan pertumbuhan. Tanah yang digunakan diganti dengan tanah yang lebih miskin unsur hara dengan harapan potensi yang dimiliki oleh isoalat yang digunakan lebih terlihat.
Musim II
Tanah yang digunakan pada musim I merupakan tanah sawah dari BB Biogen yang telah disterilisasi dengan kandungan hara P tersedia 43 ppm (sangat tinggi), sehingga pengaruh perlakuan pupuk P tidak terlalu terlihat. Pada musim II digunakan tanah dari Kebun Percobaan Cikabayan.
Tabel 12. Pengaruh pupuk fosfat terhadap tinggi tanaman (cm)
Dosis pupuk P Tinggi tanaman minggu ke- Tinggi tanaman hasil yang tidak berbeda nyata pada uji Duncan 5 %.
tanaman tertinggi dibanding perlakuan lain kecuali perlakuan 125 kg SP-36/ha. Tinggi tanaman pada 6 dan 8 MST serta pada fase generatif, perlakuan tanpa pemupukan menunjukkan tinggi tanaman paling rendah dibanding perlakuan lainnya (Tabel 12).
Tabel 13. Pengaruh pupuk fosfat terhadap jumlah daun Dosis pupuk
Keterangan: Angka-angka pada kolom yang sama diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan 5 %.
Pada 2 MST pemupukan fosfat belum berpengaruh terhadap jumlah daun. Jumlah daun dipengaruhi perlakuan dosis pupuk P pada umur 4 dan 6 MST, dimana pemupukan dengan dosis anjuran (200 kg SP-36/ha) menunjukkan jumlah daun terbanyak dibanding perlakuan lain, sedangkan pada 8 MST, perlakuan tanpa pemupukan menunjukan jumlah daun yang lebih sedikit dibanding perlakuan lain (Tabel 13).
Aplikasi rizobakteri pada musim II secara statistik masih tidak terlihat. Pada tinggi tanaman rizobakteri B28 juga menunjukkan terjadinya penghambatan pertumbuhan dibanding kontrol, tapi pada 8 MST dan fase generatif, rizobakteri ATS4 menunjukan penghambatan pertumbuhan dibanding perlakuan lainnya (Tabel 14).
Tabel 14. Pengaruh perlakuan rizobakteri terhadap tinggi tanaman (cm) Rizobakteri Tinggi tanaman minggu ke- Tinggi tanaman
Perlakuan benih dan aplikasi penyiraman rizobakteri diharapkan dapat berdampak positif terhadap pertumbuhan tanaman. Isolat rizobakteri B28 menghasilkan IAA cukup tinggi (9.26 µg/ml) namun nenunjukkan gejala menghambat pertumbuhan. Sutariati et al. (2006) melaporkan tidak terdapat hubungan antara produksi hormon tumbuh IAA oleh rizobakteri dengan pertumbuhan tanaman, diduga ada faktor lain berperan dalam peningkatan pertumbuhan bibit cabai yang diberi perlakuan rizobakteri.
Rizobakteri ATS4 cenderung meningkatkan jumlah daun pada 6 MST dibanding kontrol (Tabel 15). Jumlah daun yang dihasilkan B28 paling sedikit dibanding perlakuan lainnya. Berdasarkan penelitian sebelumnya, untuk meningkatkan vigor tanaman dapat dilakukan dengan memodifikasi mikroflora di sekitar benih dengan cara memberikan secara langsung mikroorganisme khusus pada benih. Pemberian secara langsung pada benih tersebut akan mengurangi mikroflora patogenik di sekitar benih karena saat ditanam, benih akan langsung dikolonisasi mikroorganisme yang sudah ada sebelumnya (Simon et al. 2001). Tabel 15. Pengaruh perlakuan rizobakteri terhadap dan jumlah daun
Rizobakteri Jumlah daun minggu ke-
2 4 6 8
Kontrol (air) 3.8 4.5 4.8 6.5
ATS4 3.8 4.5 5.2 6.4
B28 3.6 4.4 4.9 6.0
Pemupukan dan perlakuan rizobakteri tidak berpengaruh terhadap bobot basah dan kering tajuk serta bobot basah dan kering akar tanaman. Peningkatan pemupukan menunjukkan kecenderungan peningkatan bobot kering tajuk tanaman (Tabel 16). Pada bobot kering akar terdapat kecenderungan rizobakteri B28 meningkatkan bobot basah dan kering akar (Tabel 17). Menurut Kloepper et al.
Tabel 16. Pengaruh pemupukan fosfat terhadap biomassa tanaman (g/tanaman)
Tabel 17. Pengaruh perlakuan rizobakteri terhadap biomassa tanaman (g/tanaman) Rizobakteri Bobot basah
Pembahasan
Isolasi mikroorganisme dari tanaman, tanah maupun perakaran tanaman merupakan langkah awal dalam mendapatkan mikroorganisme yang dapat berperan sebagai pemacu pertumbuhan maupun agens hayati. Pengujian lebih lanjut ke arah karakter yang diharapkan sebaiknya dilakukan setelah menyisihkan isolat yang diduga patogen. Langkah awal yang dapat digunakan adalah pengujian HR pada daun tembakau. Menurut Klement (1990), respon hipersensitif merupakan reaksi pertahanan cepat dari tanaman terhadap patogen yang tidak kompatibel disertai dengan kematian sel yang cepat pada jaringan yang diinjeksi bakteri. Namun tidak semua patogen dapat dideteksi dengan pengujian HR, misalnya bakteri Pseudomonas solanacearum penyebab penyakit layu bakteri pada tanaman tembakau.
Asrul (2005) menambahkan bahwa gejala water soaking disebabkan hilangnya elektrolit pada daun secara cepat, kemudian berkembang menjadi nekrosis tahap awal. Selanjutnya gejala nekrosis berkembang atau menyebar luas ke bagian daun lain seperti tulang daun dan menimbulkan gejala layu. Menurut Campbell et al. (2002), sel-sel tempat infeksi mengeluarkan senyawa kimia pertahanan dan menutup daerah infeksi, sel-sel tersebut merusak dirinya sendiri sehingga terbentuk lesio atau luka pada daerah yang terinfeksi sehingga melindungi bagian daun lainnya.
Berdasarkan pengujian di laboratorium, 15 isolat rizobakteri yang digunakan pada Percobaan 2 mampu memproduksi fosfatase, hormon pertumbuhan (IAA) dan kitinase, kecuali rizobakteri P24, P12 dan P31 yang tidak mampu memproduksi kitinase. Indole acetic acid merupakan hormon auksin pertama pada tumbuhan yang mengendalikan berbagai proses fisiologi penting meliputi pembelahan dan perkembangan sel, diferensiasi jaringan serta respons terhadap cahaya dan gravitasi (Salisbury & Ross 1992). Indole acetic acid
disintesis dalam berbagai bagian tubuh tanaman dan umumnya berasosiasi dengan bagian tanaman yang sedang aktif tumbuh dan berkembang seperti pada meristem ujung tunas, ujung akar, dan kambium.
Tanaman bisa saja tidak mampu memenuhi kebutuhan auksin secara optimal sehingga diperlukan tambahan hormon auksin dari luar. Mikroorganisme mampu menghasilkan hormon tumbuhan seperti auksin, sitokinin dan giberelin (Leveau & Lindow 2005). Pada penelitian ini, seluruh isolat rizobakteri yang diuji mampu memproduksi IAA. Rizobakteri dari kelompok Bacillus spp. dan
Pseudomonas kelompok fluerescens menghasilkan IAA lebih tinggi dibandingkan isolat dari kelompok Actinomycetes spp. Menurut Thakuria et al. (2004), rizobakteri dari kelompok Bacillus spp. menghasilkan IAA lebih tinggi. Ahmad et al. (2005) menyampaikan bahwa kemampuan rizobakteri kelompok Pseudomonas
spp. menghasilkan IAA lebih besar dibandingkan rizobakteri lain.
Menurut Karnval (2009), produksi IAA oleh rizobakteri hanya akan terjadi jika konsentrasi asam amino triptofan di daerah perakaran tanaman cukup tinggi. Beberapa bakteri mampu memproduksi IAA antara lain Pseudomonas putida
(Patten & Glick 2002), P. diminuta dan Bacillus subtilis (Agustiansyah 2011), serta Actinomycetes spp. (Yusepi 2011). Bakteri penghasil IAA mempunyai kemampuan membantu berbagai proses tersebut dengan memasukkan IAA ke dalam pool auksin tanaman. Akar merupakan organ tanaman yang paling sensitif terhadap fluktuasi kadar IAA dan responsnya pada peningkatan jumlah IAA eksogenous meluas dari pemanjangan akar primer, pembentukan akar lateral dan akar liar, sampai penghentian pertumbuhan (Widyawati 2008).
rizobakteri mengendalikan penyakit atau patogen melalui produksi enzim ekstraseluler pendegradasi dinding sel, misalnya kitinase, β-1.3 glukanase. Pada penelitian ini tidak semua isolat mampu menghasilkan kitinase. Rizobakteri AB3, ATS5, ATS4 dan B42 memiliki produksi kitinase tinggi dengan zona bening lebih dari 8.5 mm. Menurut Hasegawa et al. (2006), isolat Streptomyces diketahui mampu memproduksi enzim-enzim hidrolitik seperti selulase, hemiselulase, kitinase, amilase, dan glukanase. Streptomyces merupakan bagian dari kelompok besar Aktinomiset, berdasarkan penelitian ini juga didapatkan bahwa kelompok Aktinomiset (AB3 dan ATS5) mampu menghasilkan kitinase lebih tinggi dari genus Bacillus dan Pseudomonas kelompok fluerescens.
Pada penelitian hanya perlakuan benih dengan rizobakteri B28 dan B46 secara nyata meningkatkan vigor benih (indeks vigor dan kecepatan tumbuh). Berdasarkan penelitian dapat dilihat bahwa parameter vigor benih lebih sensitif dibanding parameter viabilitas benih, karena lebih dapat membedakan perlakuan benih dengan rizobakteri. Kedua isolat B28 dan B46 termasuk kelompok Bacillus
spp., berbagai penelitian juga menunjukkan bahwa Bacillus spp. dapat berfungsi sebagai PGPR sekaligus dapat berperan sebagai pengendali penyakit tanaman.
Pengaruh positif dari perlakuan benih dengan agens hayati telah dilaporkan pada benih jagung (Gholami et al. 2009) dan padi (Agustiansyah et al.
2010; Ashrafuzzaman et al. 2009). Menurut Gholami et al. (2009), perbaikan viabilitas dan vigor benih ini diduga disebabkan oleh peningkatan sintesis hormon seperti IAA atau giberelin (GA3) sebagai pemicu aktivitas enzim amilase yang berperan dalam perkecambahan. Berdasarkan penelitian isolat B28 dan B46 mampu menghasilkan IAA berturut-turut 9.6 µg/ml dan 6.1 µg/ml. Walaupun tidak berbeda nyata, isolat B42 yang menghasilkan IAA tertinggi (14.4 µg/ml) juga mampu meningkatkan viabilitas dan vigor bibit tetua betina dibanding kontrol.
Perlakuan benih dengan seluruh isolat dari kelompok Bacillus spp., cenderung dapat meningkatkan panjang akar dibanding kontrol. Penelitian lain juga menunjukkan aplikasi benih dengan rizobakteri Pseudomonas spp. dan
okra (Adesemoye et al. 2008), sedangkan pada benih jarak pagar meningkatkan bobot kering bibit, luas daun, dan kandungan klorofil bibit (Desai et al. 2007), meningkatkan tinggi bibit dan panjang akar padi (Agustiansyah 2010). Menurut Yusepi (2011), aplikasi aktinomiset endofit pada padi mampu meningkatkan tinggi tanaman, panjang akar, dan bobot kering total tanaman dibanding perlakuan IAA sintetik 0.1 ppm.
Dalam aplikasinya pada pertumbuhan tanaman di polybag, respon isolat yang diharapkan tidak tampak secara optimal. Pada musim I tanah yang digunakan memiliki pH 5.6 (asam), kondisi ini tidak ideal untuk pertumbuhan ketiga kelompok isolat yang digunakan. Pada musim II tanah yang digunakan memiliki memiliki pH 4.1 (sangat asam). Umumnya bakteri tumbuh optimum pada pH netral. Menurut Goodfellow dan Williams (1983) dalam Ulya (2009), Aktinomiset merupakan kemoorgnotrof, aerobic, mesofilik dan tumbuh optimum pada pH netral. Pada dasarnya aktivitas dan keberadaannya sangat ditentukan oleh faktor pertumbuhan, ketersediaan makanan, bahan organik yang terkandung di dalam media, salinitas, pH, temperatur serta kelembaban relatif lingkungannya.
Kemampuan menghasilkan IAA ditentukan oleh jenis rizobakteri yang diuji dan kemampuan mengkolonisasi akar tanaman (Thakuria et al. 2004; Karnval 2009). Kemampuan rizobakteri mengkolonisasi perakaran tanaman berimplikasi pada jumlah asam amino triptofan yang diperoleh dari eksudat akar tanaman. Menurut Patten dan Glick (2002) respons tanaman terhadap IAA yang dihasilkan mikrob berbeda-beda bergantung pada spesies tanaman dan konsentrasi IAA yang dihasilkan.