PENINGKATAN INTENSITAS PIGMEN DAN KADAR
LOVASTATIN ANGKAK OLEH
Monascus purpureus
KO-KULTUR DENGAN KHAMIR AMILOLITIK INDIGENUS
DANIK DANIA ASADAYANTI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi yang berjudul,
“ Peningkatan Intensitas Pigmen dan Kadar Lovastatin Angkak Oleh Monascus purpureus Ko-kultur dengan Khamir Amilolitik Indigenus ”
Adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain, telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir dari disertasi ini.
Bogor, Juli 2011
ABSTRACT
DANIK DANIA ASADAYANTI 2010. Improvement of pigment and lovastatin angkak production by Monascus purpureus strains co-cultured with indigenous amylolitic yeast. Under supervision of Betty Sri Laksmi Jenie, as Head of Supervisor, Harsi D. Kusumaningrum and Novik Nurhidayat as members.
Angkak is a natural food colorant while lovastatin have been reported recently as bioactive component due to its capacity lowering cholesterol biosynthesis level in rat and human. Pigment and lovastatin angkak are secondary metabolites of Monascus purpureus. The objectives of this study were to increase pigment and lovastatin productions by co-cultured with Endomycopsis burtonii. Six strains of M. purpureus (107cfu/ml) were co-cultured with various concentrations of E. burtonii (103-105) cfu/ml at three different feeding times (day 2, 4, and 6). Feeding time and concentration of E. burtonii affected the productions of both pigment and lovastatin. The highest productions of red pigment and lovastatin were achieved by the same strain (M. purpureus TOS) at 104
cfu/ml of E. burtonii added at day 6. Expression of the genes that responsible for lovastatin production were analyzed by
PCR and RT-PCR method. The phenotypic character of M. purpureus TOS with high lovastatin production was conformed by the high intensity of its gene expression. The stabilities of pigment and lovastatin were studied at various temperatures (70-121)˚C and contact times (15, 30, and 45 minutes) and various pH (3,0; 5,0 ; and 7,0) with contact times (2, 4, 6, 8 h). The results showed that both red pigment produced by mono- and co-culture were stable at 70-121˚C for 15-45 minutes and at pH 7,0 with contact times for 4-8 h. However at lower pH 3,0 and 5,0 with contact times for 2-8 h caused degradation of red pigment.produced by either monoculture or co-cultured. Heating angkak at 70-121˚C for 15-30 and at pH 7,0 for 2-8 h did not affect the lovastatin concentration, while heating at 121˚C with longer contact time (45 minutes) and at pH 3,0-5,0 for 2-8 h caused the degradation of lovastatin (by co-culture). The concentration of lovastatin (by mono-culture) did not affect by heating 70-121˚C for 15-45 minutes and at pH 3,0-7,0 with contact times for 4-8 h.
RINGKASAN
DANIK DANIA ASADAYANTI 2011. Peningkatan Intensitas Pigmen dan Kadar Lovastatin Angkak oleh Monascus purpureus Ko-kultur dengan Khamir Amilolitik Indigenus. Di bawah bimbingan Betty Sri Laksmi Jenie, sebagai Ketua komisi pembimbing, Harsi D. Kusumaningrum dan Novik Nurhidayat sebagai anggota komisi pembimbing.
Pigmen angkak merupakan produk fermentasi Monascus purpureus pada substrat beras dan sudah lama digunakan sebagai pewarna alami makanan. Beberapa penelitian terakhir melaporkan bahwa angkak juga mengandung komponen bioaktif yaitu lovastatin yang memiliki manfaat terhadap kesehatan yaitu menurunkan kadar kolesterol pada tikus dan manusia. Produk angkak dapat diunggulkan sebagai ingredien pangan fungsional. Namun demikian, kandungan lovastatin angkak relatif rendah (rata-rata 0,2-0,9%). Penelitian ini bertujuan untuk meningkatkan intensitas pigmen merah dan lovastatin angkak, melalui ko-kultur M. purpureus dengan khamir amilolitik indigenus.
Penelitian dibagi dalam beberapa tahap yaitu 1) Seleksi khamir indigenus untuk mendapatkan khamir yang memiliki aktivitas amilolitik 2) Ko-kultur enam strain M. purpureus dengan khamir terseleksi pada produksi angkak, kemudian dianalisis intensitas pigmen, kadar lovastatin dan sitrinin 3) Analisis ekspresi gen penghasil lovastatin tertinggi angkak hasil ko-kultur M. purpureus dengan khamir amilolitik indigenus menggunakan RT-PCR serta 4) Analisis stabilitas pigmen dan lovastatin angkak hasil ko-kultur terhadap variasi suhu dan pH.
Seleksi khamir amilolitik indigenus, dilakukan terhadap 16 strain khamir, dan dari hasil seleksi hanya diperoleh satu strain khamir positif amilolitik, yaitu Endomycopsis burtonii. Khamir terseleksi kemudian ditambahkan pada fermentasi M. purpureus hari ke 2, 4, dan 6 dengan variasi konsentrasi E. burtonii 103,104 , 105
Aplikasi ko-kultur M. purpureus dengan E. burtonii berpengaruh nyata dalam meningkatkan produksi pigmen merah angkak terhadap semua strain dibanding tanpa ko-kultur (kontrol). Perlakuan konsentrasi dan waktu penambahan E.burtonii berpengaruh nyata dalam meningkatkan produksi pigmen merah angkak. Secara umum penambahan E. burtonii yang terlalu dini (H2) dengan berbagai konsentrasi tidak mampu meningkatkan produksi pigmen merah oleh M. purpureus.
cfu/ml.
Intensitas pigmen merah tertinggi dihasilkan oleh strain TOS H6104 yakni hasil fermentasi oleh strain M. purpureus TOS dengan penambahan E. burtonii dengan konsentrasi 104
Kadar lovastatin enam strain Monascus purpureus sebelum ko-kultur menunjukkan, kemampuan yang berbeda dalam memproduksi lovastatin. Kadar
lovastatin strain JmbA3M (1,42%) dan strain AS3K (1,27%) secara statistik tidak berbeda nyata (α : 5%) dan lebih tinggi dibanding strain lainnya TOS (0,8%,), JmbA (0,37%), AID (0,17) dan JmbA5K (0,1%). Kadar lovastatin setelah ko-kultur menunjukkan, enam strain M. purpureus memberikan respon yang bervariasi (spesifik strain) terhadap penambahan E. burtonii dengan jumlah dan waktu yang divariasikan. Terhadap strain JmbA5K dan AS3K, penambahan E. burtonii pada berbagai variasi waktu dan jumlah, menyebabkan penurunan produksi lovastatin dibanding kontrol. Sebaliknya untuk strain JmbA3M dan AID penambahan E. burtonii pada berbagai konsentrasi dan waktu, memberikan pengaruh peningkatan produksi lovastatin yang cukup signifikan. Pada strain JmbA dan TOS pengaruh variasi waktu dan jumlah penambahan E. burtonii menyebabkan peningkatan maupun penurunan produksi lovastatin. Strain JmbA mengalami peningkatan produksi lovastatin pada penambahan E. burtonii hari ke 2 dengan jumlah 104 cfu/ml, hari ke 4 dengan jumlah 103, 104 cfu/ml, dan hari ke 6 dengan jumlah 104 cfu/ml. Untuk strain TOS peningkatan produksi lovastatin terjadi pada penambahan E. burtonii hari ke 4 dengan jumlah 103, 104, 105 cfu/ml dan hari ke 6 pada jumlah 103, 104 cfu/ml. Kadar lovastatin tertinggi dihasilkan oleh strainTOS dengan perlakuan penambahan E. burtonii pada hari ke 6 dengan jumlah 104
Hasil isolasi total RNA untuk tujuan pengujian ekspresi gen strain M. . purpureus penghasil lovastatin tertinggi setelah ko-kultur dengan E. burtonii, menunjukkan kemurnian yang baik, diperoleh rasio absorbansi A
cfu/ml.
260nm/A280nm semua strain di atas 1,8. Konsentrasi total RNA tertinggi ditunjukkan M. purpureus strain TOS H6104 (1860 µg/ml), kemudian diikuti strain AID H2104 (1020 µg/ml), AID (kontrol : 968 µg/ml), JMBA (kontrol: 668 µg/ml), TOS (kontrol: 548 µg/ml), dan JMBA H4103(532 µg/ml). Intensitas ekspresi gen penghasil lovastatin tertinggi dihasilkan M. purpureus strain TOS H6104 (11691) kemudian diikuti AID H2103 (9531), TOS (kontrol: 8910), JmbA H4103(5994), AID (kontrol : 5940) , dan JMBA (kontrol: 3537). Sifat fenotipik M. purpureus TOS H6104
Perlakuan pemanasan 70˚C , 100˚C dan 121˚C selama 15, 30, dan 45 menit untuk tujuan analisis stabilitas pigmen dan kadar lovastatin menunjukkan bahwa pigmen merah angkak baik yang diproduksi secara monokultur maupun ko-kultur, relatif stabil pada suhu pemanasan 70-121˚C selama 15-45 menit. Pigmen merah angkak (monokultur dan ko-kultur) juga stabil oleh perlakuan pH 7,0 dengan waktu kontak 2, 4, 6 dan 8 jam. Akan tetapi pada pH lebih rendah (3,0 dan 5,0) dengan waktu kontak 2-8 jam menyebabkan penurunan intensitas pigmen merah.
hasil ko-kultur menggunakan E. burtonii berkaitan dengan produksi lovastatin tinggi, sejalan dengan sifat genotipiknya yang ditunjukkan dengan tingginya intensitas ekspresi gen penghasil lovastatin.
@ Hak cipta milik IPB, tahun 2011
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebut sumber
.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PENINGKATAN INTENSITAS PIGMEN DAN KADAR
LOVASTATIN ANGKAK OLEH Monascus purpureus
KO-KULTUR DENGAN KHAMIR AMILOLITIK INDIGENUS
DANIK DANIA ASADAYANTI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi
Nama NRP
: Peningkatan Intensitas Pigmen dan Kadar Lovastatin Angkak Oleh Monascus purpureus Ko-kultur Dengan Khamir Amilolitik Indigenus
: Danik Dania Asadayanti : F261040071
Menyetujui Komisi Pembimbing
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Ketua
Dr. Ir. Harsi Dewantari Kusumaningrum Dr. Novik Nurhidayat
Anggota Anggota
Mengetahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti H, M.Sc Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Alhamdulillahirobbil’alamin, puji dan syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat, hidayah dan karuniaNya, sehingga penulisan penelitian dengan judul “ Peningkatan Intensitas Pigmen dan Kadar Lovastatin Angkak Oleh Monascus purpureus Ko-kultur dengan Khamir Amilolitik Indigenus” dapat diselesaikan.
Ucapan terima kasih yang tak terhingga penulis sampaikan kepada:
1. Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS selaku ketua komisi pembimbing dan Dr. Ir. Harsi Dewantari Kusumaningrum, Dr. Novik Nurhidayat selaku komisi pembimbing atas bimbingan, arahan dan masukannya, sehingga penulis dapat menyelesaikan penelitian ini dengan baik.
2. Dr. Ir Dahrul Syah dan Dr. Sukarno M.Sc. selaku Penguji Luar Komisi pada Ujian tertutup.
3. Dr. Asrul M Fuad dan Prof. Dr. Ir. Maggy Thenawidjaya S selaku Penguji Luar Komisi pada ujian terbuka.
4. Pusat Pengembangan Pendidik dan Tenaga Kependidikan Pertanian (VEDCA) yang telah membiayai studi S3.
5. LIPI Bidang Mikrobiologi, Cibinong yang telah memfasilitasi pelaksanaan penelitian ini.
6. Ibu dan almarhum ayah tercinta, ibu mertua, yang selalu mendoakan dan memberikan petuah dalam menempuh pendidikan dan kehidupan selama ini. Tak akan pernah mampu terbalaskan apa yang pernah diberikan kepada penulis dan keluarga.
7. Suami tercinta Ir. M. Bakrun Dahlan MM , anak-anakku tercinta, Tesia Aisyah Rahmania, Runia Aisyah Isnaini, dan Muhammad Rashid Kurniawan, yang senantiasa memberikan motivasi, kesabaran, kasih sayang dan pengertian selama ini.
9. Kepada seluruh keluarga besar dan teman-teman Program Studi Ilmu Pangan (IPN) IPB atas doa dan dorongan semangatnya.
10.Bapak ibu staf dan teknisi LIPI Bidang Mikrobiologi, Cibinong yang telah membantu selama penelitian dan atas doa dan dorongannya.
11.Rekan-rekan staf Departemen Agroindustri dan Teknik Kimia VEDCA beserta, semua staf VEDCA atas doa, motivasi, pengertian. Serta,
12.Semua pihak yang tidak dapat penulis sebutkan satu per satu atas segala do’a, bantuan dan dukungannya.
Penulis menyadari bahwa tulisan ini jauh dari sempurna, saran dan masukan sangat diharapkan untuk perbaikan. Semoga tulisan ini bermanfaat.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 21 Agustus 1965 dari ayahanda almarhum H. Supardi Akhmad BA dan ibunda Hj. Sukartinah. Penulis adalah lulusan sarjana Fakultas Teknologi Pertanian jurusan Pengolahan Hasil Pertanian, Universitas Gadjah Mada, lulus tahun 1989. Penulis melanjutkan studi ke jenjang S2 jurusan Teknologi Pasca Panen, Universitas Brawijaya. Malang, lulus tahun 1995. Penulis bekerja sebagai widyaiswara Departemen Agroindustri, Pusat Pengembangan dan Pemberdayaan Pendidik dan Tenaga Kependidikan Pertanian (PPPPTK Pertanian/VEDCA) Cianjur, Jawa Barat dari tahun 1990 sampai sekarang. Tahun 2004, penulis mendapat beasiswa dari PPPPTK Pertanian untuk melanjutkan studi S3 di IPB pada program studi Ilmu Pangan. Tahun 2006-2007, penulis mendapat tugas sebagai Kepala Departemen Agroindustri.di PPPPTK Pertanian. Pada tahun 2007 penulis mendapat kesempatan sebagai tim penulis buku “TEKNOLOGI PANGAN” untuk SMK Pertanian seluruh Indonesia.
DAFTAR ISI
Halaman PRAKATA………
DAFTAR RIWAYAT HIDUP……… DAFTAR TABEL……… DAFTAR GAMBAR……… DAFTAR LAMPIRAN……… i ii iii iv v
1. PENDAHULUAN
Latar Belakang……….………. Tujuan Penelitian. ……….……… Tujuan Khusus. ……….……… Hipotesis Penelitian.……….…………. Manfaat penelitian……….………
1 1 1 3 3 4
2. TINJAUAN PUSTAKA……….. Pigmen Angkak………... Monascus purpureus West, Kapang Penghasil Angkak………. Lovastatin………………..
Gen Yang Bertanggung Jawab Pada Biosintesis Lovastatin ………… Ekspresi Gen ………. Sitrinin……… Khamir Amilolitik………...
Aplikasi Ko-kultu pada Proses Fermentasi... 5 5 11 12 14 16 22 27 33
3. METODOLOGI UMUM………..
Tempat dan Waktu Penelitian……….. Bahan dan Alat... Metodologi Penelitian……… Diagram Alir Penelitian…………
Daftar Pustaka………. 35 35 35 36 37 40
4. PENINGKATAN PRODUKSI PIGMEN ANGKAK OLEH Monascus purpureus KO-KULTUR DENGAN KHAMIR
AMILOLITIK INDIGENUS ………..
Abstrak……….
Pendahuluan ………...
Metode Penelitian………. Hasil dan Pembahasan………
Simpulan………. DaftarPustaka………. 46 49 60 60 5. PENINGKATAN KADAR LOVASTATIN ANGKAK OLEH
Monascus purpureus KO-KULTUR DENGAN Endomycopsis burtonii
Abstrak………. …………..
Pendahuluan ………... Bahan dan Metode Penelitian………..
Hasil da Pembahasan………
Simpulan………..
Daftar Pustaka……….
64 64 64 65 69 75 76
6. EKSPRESI GEN YANG BER.PERAN PADA BIOSINTESIS LOVASTATIN Monascus purpureus KO-KULTUR DENGAN
Endomycopsis burtonii...
Abstrak………
Pendahuluan ………... Bahan dan Metode Penelitian……… Hasil dan Pembahasan………
Simpulan……….
Daftar Pustaka…………….
78 78 78 79 82 89 89
7. STABILITAS PIGMEN DAN LOVASTATIN ANGKAK HASIL KO-KULTUR Monascus purpureus DENGAN
Endomycopsis burtonii TERHADAP SUHU DAN pH …………..
Abstrak………
Pendahuluan ………
Bahan dan Metode Penelitian………. Hasil dan Pembahasan……….
Simpulan………..
Daftar Pustaka………. ………
92 92 92 93 96 107 108
8. PEMBAHASAN UMUM……….. 110
9. SIMPULAN DAN SARAN………. 117
DAFTAR TABEL
Halaman Tabel 2.1 Binatang percobaan, dosis dan pengaruh patologi
pemberian sitrinin……… 17
Tabel 2.2 Nilai LD50
Percobaan……… 18 sitrinin terhadap beberapa jenis hewan
Tabel 2.3 Efek asam lemak dengan variasi panjang rantai karbon pada produksi pigmen dan sitrinin menggunakan M. ruber dengan adanya glukosa
dan MSG……… 20
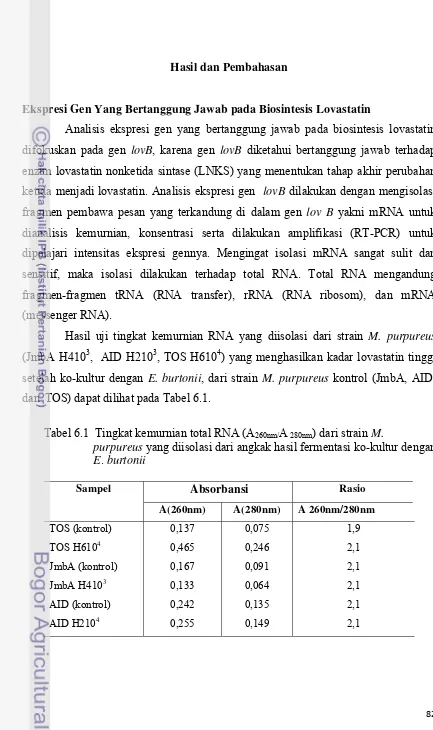
Tabel 6.1 Tingkat kemurnian total RNA (A260nm/A 280nm
) dari strain M. purpureus yang diisolasi dari angkak hasil fermentasi ko-kultur dengan E. burtonii …………
77
Tabel 6.2 Pengaruh ko-kultur M. purpureus dengan E. burtonii terhadap konsentrasi total RNA ………
79
Tabel 6.3 Intensitas ekspresi gen (lov B) strain M. purpureus ko-kultur dengan E.burtonii………..
DAFTAR GAMBAR
Halaman
Gambar 2.1 Produk fermentasi kapang Monascus purpureus pada media beras (Angkak)...
5 Gambar 2.2 Pembentukan metabolit sekunder pigmen ...
7
Gambar 2.3 Skema pembentukan pigmen pada Monascus ruber 9
Gambar 2.4 Komponen utama pigmen angkak ... 10
Gambar 2.5 Penampang kapang Monascus sp ... 12
Gambar 2.6 Stuktur kimia lovastatin ... 13
Gambar 2.7 Biosintesis lovastatin ... 15
Gambar 2.8 Bagian-bagian khamir... 22
31 Gambar 3.1 Bagan alir tahapan penelitian……….. Gambar 4.1 Kurva pertumbuhan enam kultur Monascus purpureus….. 44 Gambar 4.2 Pengaruh konsentrasi dan waktu penambahan E. burtonii
terhadap intensitas pigmen merah strain Monascus
purpureus...
45
Gambar 4.3 Pengaruh konsentrasi dan waktu penambahan E.burtonii terhadap intensitas pigmen jingga angkak menggunakan strain
Monascus purpureus ………
50
Gambar 4.4 Pengaruh konsentrasi dan waktu penambahan E.burtonii terhadap intensitas pigmen kuning angkak menggunakan
enam strain M. purpureus ...
53
Gambar 5.1 Kadar lovastatin angkak yang diproduksi oleh beberapa strain Monascus purpureus ………
63
Gambar 5.2 Pengaruh konsentrasi dan waktu penambahan E. burtonii terhadap produksi lovastatin enam strain M. purpureus... Gambar 5.3 Kadar sitrinin angkak oleh M. Purpureus sebelum (K) dan
setelah ko-kultur dengan E.burtonii………
65
69 Gambar 6.1 Hasil isolasi total RNA strain M. purpureus ko-kultur
dengan E. burtonii (MK : marker (Sharp DNA Ladder Marker), 1: JmbA, 2: JmbA H4103, 3: AID, 4:AIDH2103, 5: TOS H6104, 6:
80
Gambar 6.2 Pola ekspresi gen (lov B) pada M. purpureus hasil ko- kultur menggunakan E. burtonii. Mk: marker (Sharp DNA Ladder Marker, 100 bp, CRBC), 1: JmbA (k), 2: JmbA H4103, 3: AID (k), 4: AID H2103, 5: TOS(k), 6: TOS H6104
81
……….. Gambar 6.3 Elektrogram analisis pita pada elektroforesis hasil
amplifikasi cDNA pada gel agarosa strain-strain
M. purpureus ko-kultur dengan E. burtonii ……….
83
Gambar 7.1 Pengaruh suhu terhadap stabilitas pigmen merah angkak (a) monokultur, (b) ko-kultur M. purpureus TOS dengan E. burtonii……….
92
Gambar 7.2 Pengaruh perlakuan pH terhadap stabilitas pigmen merah angkak, (a) monokultur (b) ko-kultur M. purpureus TOS dengan E. burtonii ………
95
Gambar 7.3 Pengaruh suhu terhadap stabilitas pigmen kuning angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
96
Gambar 7.4 Pengaruh pH terhadap stabilitas pigmen kuning angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
97
Gambar 7.5 Pengaruh suhu terhadap stabilitas pigmen jingga angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
98
Gambar 7.6 Pengaruh pH terhadap stabilitas pigmen jingga angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
99
Gambar 7.7 Pengaruh suhu terhadap stabilitas kadar lovastatin angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
100
Gambar 7.8 Pengaruh pH terhadap stabilitas kadar lovastatin angkak (a) monokultur (b) ko-kultur M. purpureus TOS dengan E.
burtonii ………..
1
1.
PENDAHULUAN
Latar Belakang
Angkak merupakan produk fermentasi kapang Monascus purpureus yang umumnya ditumbuhkan pada substrat beras. Angkak mengandung pigmen alami yang telah lama digunakan sebagai pewarna makanan di Cina, Taiwan, Filipina dan Indonesia untuk mewarnai produk-produk seperti ikan, daging, acar, anggur, pasta ikan, keju, dan sebagainya (Kaur et al 2009). Pigmen angkak merupakan produk metabolit sekunder yang dihasilkan oleh M. purpureus yang terdiri dari pigmen merah, kuning, dan jingga. Komponen utama pigmen merah yaitu rubropunktamin (C21H29NO4) dan monaskorubramin (C23 H29NO4), pigmen jingga yaitu rubropunktatin (C21 H22 O5) dan monaskorubrin (C23 H26 O5), pigmen kuning yaitu monaskin (C21 H26 O5) dan ankaflavin (C23 H30 O5
Pengembangan produksi pigmen angkak sangat prospektif dilakukan mengingat potensinya yang cukup besar sebagai pigmen alami yang aman diaplikasikan pada produk pangan. Beberapa peneliti melakukan upaya peningkatan produksi pigmen angkak. Produksi pigmen merah melalui aplikasi ko-kultur dilakukan oleh Lim et al (2000). Ko-kultur dilakukan antara Monascus sp. dengan Saccharomycescerevisiae rekombinan yang mengekspresikan gen glukoamilase dari Aspergillus niger. Produksi pigmen merah dilakukan pada fermentasi kultur cair dan hasil yang diperoleh menunjukkan peningkatan produksi pigmen merah sebesar 19% dibandingkan ko-kultur Monascus dengan S. cerevisiae tanpa perlakuan rekombinan.
).
2 (Nurhidayat, 2011). Selama ko-kultur enzim-enzim hidrolitik yang diproduksi khamir dapat menyerang dinding sel M. purpureus. Kondisi ini memacu kapang M. purpureus untuk melakukan pertahanan diri (defense mechanism) dengan mengeluarkan atau memproduksi komponen-komponen hidrofobik berupa metabolit sekunder seperti pigmen dan lovastatin (Shin et al 1998
Lovastatin merupakan bahan bioaktif kelompok statin yang sangat penting dalam perkembangan biomedis (Altieri, 2001). Secara umum lovastatin dikenal sebagai agen penurun kolesterol dengan melakukan penghambatan enzim HMG-CoA reductase (3-hidroksi metilglutaril CoA reduktase) yang berperan penting dalam biosintesis kolesterol . Sampai saat ini Indonesia masih tergantung pada impor bahan ini. Beberapa kajian ilmiah telah dilakukan berkaitan potensi lovastatin yang dikandung angkak sebagai bahan biomedik. Jiyuan Ma et al., (2000) meneliti efek hipotrigliseridemik angkak pada tikus. Po-Shiuan et al., (2003) melaporkan ekstrak cair M. purpureus M9011 mampu mencegah hipertensi pada tikus. Kurniawati (2004) juga membuktikan bahwa angkak dapat menurunkan kadar kolesterol pada darah tikus Sprague Dawley.
Pengembangan angkak sebagai penghasil pigmen sekaligus lovastatin sangat potensial sebagai ingredien pangan fungsional. Permasalahan utama dalam pengembangan lovastatin adalah produksinya yang relatif rendah selama fermentasi angkak, yaitu berkisar antara 0,2%-1,0%. Upaya meningkatkan produksi lovastatin dengan melakukan eksplorasi mikroorganisme indigenus Indonesia terus dilakukan. Upaya yang telah dilakukan adalah dengan menemukan strain-strain M. purpureus yang mampu memproduksi pigmen dan lovastatin tinggi. Astuti (2004) malakukan seleksi isolat Monascus purpureus penghasil lovastatin. Hasil yang diperoleh menunjukkan bahwa isolat M. purpureus JmbA merupakan isolat penghasil lovastatin tertinggi yakni sebesar 0,9% (bk).
3 pertahanan diri (defense mechanism) dengan melakukan overproduksi komponen hidrofobik seperti pigmen dan lovastatin (Shin et al 1998).
Angkak sebagai ingredien pangan fungsional perlu dilakukan penelitian untuk meningkatkan baik pigmen merah maupun kadar lovastatin melalui aplikasi ko-kultur M. purpureus dengan khamir amilolitik indigenus.
Tujuan Penelitian Tujuan Umum
Secara umum penelitian ini bertujuan untuk meningkatkan produksi pigmen merah dan lovastatin angkak dengan menggunakan strain Monascus purpureus ko-kultur dengan khamir amilolitik indigenus.
Tujuan khusus Tujuan khusus dari penelitian ini adalah :
1. Memperoleh strain khamir indigenus yang mempunyai aktivitas amilolitik.
2. Memperoleh produk angkak berkadar pigmen merah dan lovastatin tinggi, melalui fermentasi ko-kultur Monascus purpureus dengan khamir amilolitik.
3. Mengetahui stabilitas pigmen dan lovastatin angkak hasil ko-kultur M. purpureus dengan khamir amilolitik indigenus terhadap suhu dan pH.
4. Mengetahui ekspresi gen yang bertanggung jawab pada produksi lovastatin pada Monascus purpureus setelah ko-kultur dengan khamir amilolitik.
5. Mengetahui stabilitas pigmen dan lovastatin angkak oleh pengaruh suhu dan pH.
Hipotesis
1. Ko-kultur Monascus purpureus dan khamir amilolitik mampu meningkatkan produksi pigmen dan lovastatin angkak.
2. Waktu dan konsentrasi penambahan khamir amilolitik selama fermentasi angkak, akan mempengaruhi produksi pigmen dan lovastatin
3. Ko-kultur Monascus purpureus dan khamir amilolitik akan meningkatkan intensitas ekspresi gen yang berperan pada produksi lovastatin.
4 .
Manfaat Penelitian
5 TINJAUAN PUSTAKA
Pigmen Angkak
Angkak merupakan produk fermentasi kapang Monascus purpureus yang umumnya ditumbuhkan pada substrat beras. Angkak mengandung pigmen alami yang telah lama digunakan sebagai pewarna makanan di Cina, Taiwan, dan Filipina untuk mewarnai produk-produk seperti ikan, daging , acar, anggur, pasta ikan, keju, dan sebagainya (Hesseltine, 1965). Angkak juga populer dengan berbagai nama seperti Beni-koju, Hong-Qu (Cina), Monascus, bheni-koji Red Koji dan aga-koji (Jepang), red fermented rice atau red yeast rice (beberapa negara yang berbahasa Inggris) Red Leaven, Red Rice, Red Rice Yeast, Red Yeast Rice, Went, Xue Zhi Kang, Zhi Tai., ang-quac, dan anka (Manjasari 2005).Profil produk fermentasi ini dapat dilihat pada Gambar 2.1.
Gambar 2.1 Produk fermentasi kapang Monascus purpureus pada media beras (Angkak) (Anonim, 2001)
6 dipecah menjadi heksosa atau pentosa. Sumber energi kedua setelah karbohidrat adalah protein. Protein dipecah menjadi asam-asam amino. Tahap berikutnya merupakan pemecahan menjadi senyawa dengan dua atau tiga atom karbon.
Pemecahan glukosa menjadi asam piruvat terjadi melalui lintasan heksosa di fosfat (HDP). Tahap pertama dari lintasan HDP adalah fosforilasi glukosa menjadi glukosa-6-fosfat yang dikatalisis oleh enzim heksokinase dan memerlukan satu molekul ATP dan ion magnesium. Tahap selanjutnya dikatalisis oleh enzim fosfoglukoisomerase. Fosforilasi fruktosa-6-fosfat menjadi fruktosa 1,6-difosfat dikatalisis oleh enzim fosfofruktokinase dan memerlukan satu molekul ATP dan ion magnesium.
Pemecahan fruktosa 1,6-difosfat menjadi senyawa triosa fosfat yaitu gliseraldehida-3-fosfat dan dihidroksi aseton fosfat. Jalur yang umum dipakai oleh mikroorganisme untuk menghasilkan energi adalah jalur HDP (Fardiaz, 1989). Pada tahap selanjutnya terjadi oksidasi dan fosforilasi gliseraldehida-3-fosfat menjadi asam 1,3 difosfogliserat. Selanjutnya terjadi pemindahan ikatan fosfat ke molekul ADP sehingga terbentuk 1 molekul ATP dan asam 3-fosfogliserat. Isomerasi dan pelepasan satu molekul air menghasilkan asam fosfoenol piruvat yang memiliki ikatan fosfat berenergi tinggi dalam molekulnya. Tahap terakhir dari proses ini adalah pemindahan ikatan fosfat berenergi tinggi dari fosfoenol piruvat ke molekul ADP sehingga terbentuk satu molekul ATP dan asam piruvat (Rachman, 1989).
Bila nitrogen yang terdapat dalam substrat habis, maka hasil dari glikolisis dialihkan untuk membentuk metabolit sekunder. Asam piruvat dari lintasan HDP mengalami dekarboksilasi oksidatif dengan bantuan enzim piruvat dehidrogenase dan koenzim A membentuk asetil koA dan malonil koA, kemudian membentuk gugus poliketida yang dapat digunakan untuk pembentukan pigmen. Skema pembentukan pigmen dapat dilihat pada gambar 2.2.
7 Glukosa Pentosa
Glukosa-6-fosfat tetrosa
Triosa
Piruvat CO
Asetaldehida 2
Asetil KoA
Koenzim A Poliketida
Malonil KoA
Pembentukan pigmen
Gambar 2.2 Pembentukan metabolit sekunder pigmen (Turner, 2000)
Hajjaj et al., (2000) juga memberikan ilustrasi skema pembentukan pigmen seperti tersaji pada Gambar 2.3. Pada skema ini pembentukan pigmen terkait dengan lintasan sintesis asam lemak. Satu molekul asetat dan 3 molekul malonat oleh adanya enzim asam lemak sintetase akan dibentuk asam oktanoat. Satu molekul asetat dan 5 molekul malonat yang lain oleh adanya enzim poliketida sintetase akan dibentuk heksaketida. Dengan adanya asetil koA, asam lemak yang terbentuk akan membentuk
β-ketoacid, sedangkan heksaketida selanjutnya akan membentuk poliketida kromofor. Melalui proses esterifikasi poliketida kemudian akan membentuk monaskorubrin dan oleh adanya asam glutamat akan terbentuk N-glutarilmonaskorubramin.
8 dari pati dan sumber N berasal dari nitrat, ammonia, atau N organik seperti protein dan urea, sedangkan sumber N dari udara tidak dapat dipakai.
Pada jenis kapang Monascus terjadi proses ekstrusi cairan melalui ujung hifa dan membentuk cairan seperti getah yang tidak beraturan. Cairan ini lalu pecah dan menyebarkan partikel-partikel bulat kecil ke ujung hifa. Ketika kultur masih muda, cairan ekstrusinya tidak berwarna, lama-kelamaan akan berubah menjadi merah, kuning, atau jingga jika kultur ditambahkan pada media PDA. Skema pembentukan pigmen pada kapang Monascus tersaji pada Gambar 2.3.
Komponen utama pigmen angkak terdiri dari pigmen orange yaitu rubropunktatin (C21 H22 O5) dan monaskorubrin (C23 H26 O5), kuning yaitu monaskin (C21 H26 O5) dan ankaflavin (C23 H30 O5), serta merah yaitu rubropunktamin (C21H29NO4) dan monaskorubramin (C23 H29NO4
Perubahan warna pada pigmen angkak dari warna jingga (monaskorubrin dan rubropunktatin)ke warna merah (monaskobramin dan rubropunktamin), terjadi kerena pergantian atom oksigen piranoid pada pigmen jingga oleh gugus -NH pada keadaan basa sehinggga membentuk pigmen merah. Pigmen kuning (monaskin dan ankaflavin) merupakan turunan dari pigmen jingga, bila bereaksi dengan molekul grup amino maka warnanya akan berubah menjadi merah.
). Struktur dari komponen-komponen tersebut dapat dilihat pada Gambar 2.4
Pigmen yang dihasilkan M. purpureus mempunyai kestabilan yang lebih baik bila disimpan pada pH netral atau alkali. Pigmen ini juga mempunyai kemampuan membentuk komplek dengan arginin, MSG, glisin atau BSA yang mempunyai struktur kristal dan warnanya sangat merah.
10 Gambar 2.4 Komponen utama pigmen angkak (Yuan, 2001)
Monascus purpureus, Kapang Penghasil Angkak
Di alam terdapat berbagai spesies kapang penghasil angkak seperti Monascus bakeri, M. rubropunctatus Sato, M. purpureus Wentii, M. anka Sato, M. rugriguosus Sato, dan M. ankanakazawa. Spesies yang paling umum digunakan sebagai penghasil angkak adalah M. purpureus West (Hesseltine, 1965).
11 hanya mempunyai satu septat, sedangkan yang lebih panjang mempunyai 2-6 septat. Konidiofora dapat dibedakan dari filamen yang lain dengan bentuk apeks yang berstruktur vesikuler. Vesikel yang membesar dipisahkan oleh septat yang berada dibawahnya dan membentuk rantai. Pada kelembaban dan suhu yang mendukung pertumbuhannya, konidia dapat bergerminasi setelah 4-5 jam pada medium agar. Profil kapang Monascus sp dapat dilihat pada Gambar 2.5.
Fenomena tidak umum yang terjadi pada kapang jenis Monascus adalah keluarnya cairan granular melalui ujung hifa. Menurut Yuan (1980), cairan yang keluar tersebut bersatu pada ujung hifa dan membentuk cairan seperti getah yang tidak beraturan bentuknya. Cairan ini kemudian pecah dan menyebarkan partikel-partikel bulat kecil ke ujung hifa. Ketika kultur masih muda, cairan tidak berwarna, tetapi lama kelamaan berubah menjadi kemerahan, kuning, merah atau jingga jika kultur ditumbuhkan pada PDA (Potato Dextrose Agar) atau agar Sabouraud. Pigmen ini paling cepat tampak setelah pertumbuhan 40-48 jam. Pigmen merah yang dihasilkan tidak hanya dapat diamati pada kandungan bagian dalam hifa tetapi dapat berdifusi menembus bagian dalam substrat (Hesseltine, 1965).
Gambar 2.5 Penampang kapang Monascus sp (Anonim, 2001)
12 adalah maltase, invertase, lipase, alfa-glukosidase, oksidase, dan ribonuklease (Steinkraus, 1983).
Lovastatin
Selama fermentasi, selain memproduksi pigmen Monascus sp juga menghasilkan komponen metabolit sekunder lainnya seperti lovastatin. Menurut sistematika penamaan (IUPAC), lovastatin dikenal sebagai [1S [1(R*),3,7,8(2S*,4S*), 8a]]-1,2,3,7, 8,8a-hexahidro-3,7-dimetil-8-[2-(tetrahidro-4-hidroxi-6-oxo-2H-piran-2-yl)etil]-1-naptalenil2-metilbutanoat. Rumus empirik lovastatin C24H36O5,
Lovastatin berbentuk bubuk kristal berwarna putih, tidak larut dalam air tetapi larut dalam etanol, metanol, dan asetonitril. Lovastatin juga dikenal sebagai monakolin K atau mevinolin.
mempunyai berat molekul (BM) 404.55 dan mempunyai srtruktur kimia seperti pada Gambar 2.6.
Gambar 2.6 Stuktur kimia lovastatin (Anonim, 2001)
Lovastatin dapat diproduksi oleh M. ruber, Penicillium breviconpactum, dan Aspegillus terreus. Lovastatin juga secara alami diproduksi oleh fungi kelas tinggi tertentu seperti Pleurotus ostreatus (oyster mushroom) dan mempunyai kekerabatan yang cukup dekat dengan Pleurotusspp.
13 FDA (USA) pada bulan Agustus 1987. Pada tahun 1998, FDA mengizinkan suplemen yang mengandung angkak yang secara alami mengandung lovastatin, dengan argumen produk tersebut mengandung senyawa yang mempunyai potensi medis. Pembentukan kolesterol dan lemak sepanjang dinding pembuluh darah (dikenal sebagai atherosklerosis) dapat menyebabkan penurunan aliran darah dan suplai oksigen ke organ-organ hati, otak, dan bagian lain dari tubuh. Penurunan lemak dan kolesterol dapat membantu menurunkan atau mencegah penyakit hati, angina (chest pain), stroke, dan serangan-serangan hati.
Lovastatin berikatan dengan sisi aktif enzim HMG CoA reduktase, sekali terikat maka tidak dapat diubah lagi menjadi produk (asam mevalonat). Dengan demikian pembentukan asam mevalonat terhambat, sehingga pembentukan kolesterol tidak terjadi. Untuk dapat terikat dengan sisi aktif enzim HMG CoA-reduktase, lovastatin harus berkompetisi dengan HMG CoA. Untuk memenangkan kompetisi lovastatin harus tersedia dalam jumlah yang cukup. Jika jumlah atau kadar lovastatin sedikit, untuk berkompetisi dengan HMG CoA kemudian berikatan dengan sisi aktif enzim HMG CoA reduktase peluangnya kecil. Dosis maksimal yang direkomendasikan untuk mengkonsumsi lovastatin adalah 80 mg per hari dan dapat mereduksi rata-rata LDL kholesterol 40%, suatu reduksi yang jauh lebih tinggi dibanding beberapa terapi yang umum dilakukan saat ini.
Jalur biosintesis lovastatin pada Aspergillus terreus telah diteliti menggunakan NMR (nuclear magnetic resonance) dan spektroskopi massa. Studi ini menginformasikan bahwa lovastatin disusun oleh 2 rantai poliketida yang berbeda bergabung melalui ikatan suatu ester. Hal ini membuktikan bahwa 2 poliketida ini tersusun oleh 2 poliketida sintase yang berbeda yang berasal dari kloning dan karakterisasi kluster gen pada A. terreus yang bertanggung jawab pada biosintesis lovastatin.
14 Beberapa sumber nitrogen organik maupun anorganik yang dimetabolisme oleh A. terreus, glutamat dan histidin memberikan level biosintesis lovastatin tertinggi.
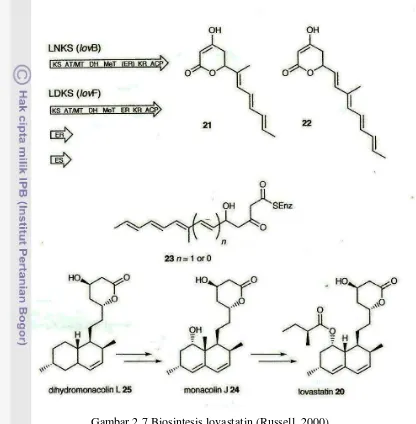
Gen Yang Bertanggung Jawab Pada Biosintesis Lovastatin
15 Gambar 2.7 Biosintesis lovastatin (Russell, 2000)
16 EKSPRESI GEN
Ekspresi gen adalah pemunculan informasi yg dikandung suatu gen menjadi suatu bentuk sifat organisme atau menjadi suatu proses metabolisme organisme. Ekspresi gen dapat juga diartikan sebagai proses penterjemahan informasi yang terkandung pada struktur gen menjadi proses metabolisme atau pola kehidupan organisme (Turner et al. 1998). Dua tahapan penting pada ekspresi gen adalah transkripsi yaitu transfer informasi genetik dari DNA ke RNA, DNA digunakan sebagai model cetakan untuk sintesis RNA, dan translasi yang merupakan proses penterjemahan informasi genetik yang terdapat pada RNA ke dalam polipeptida. RNA (mRNA) akan menjadi model untuk sintesis protein (Hames et al. 2000). Metode yang digunakan untuk melakukan analisis ekspresi gen adalah Polymerase Chain Reaction (PCR) dan Reverse Transcriptase Polymerase Chain Reaction (RT PCR).
Polymerae Chain Reaction (PCR) dan
Reaksi berantai polimerase (PCR) adalah suatu metode enzimatik untuk melipatgandakan secara eksponesial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini pertama kali dikembangkan pada tahun 1985 oleh Kary B. Mullis, seorang peneliti di perusahaan CETUS Corporation. Saat ini metode PCR telah banyak digunakan untuk berbagai macam manipulasi dan analisis genetik. Pada awal perkembangannya metode ini hanya digunakan untuk melipatgandakan molekul DNA, tetapi dikembangkan lebih lanjut sehingga dapat digunakan pula untuk melipatgandakan dan melakukan kuantifikasi molekul mRNA.
Reverse Transcriptase Polymerase Chain Reaction (RT PCR)
17 menyusupkan materi genetiknya yang berupa RNA ke dalam genom targetnya.
PRIMER
Di
laboratorium, RT PCR umumnya dilakukan untuk menganalisis tingkat ekspresi
genetik, karena ekspresi setiap gen berbeda-beda, maka proses RT PCR harus dilakukan secara efisien dan tidak boleh melewatkan RNA dari gen yang tergolong
‘low copy’ dan sulit.
Primer merupakan sepotong DNA pendek utas tunggal atau lebih dikenal
dengan oligonukleotida, panjangnya antara 10 sampai sekitar 40 basa saja. Primer
berfungsi sebagai penginisiasi reaksi polimerisasi DNA secara in vitro, karena tanpa
primer, reaksi polimerisasi DNA tidak akan terjadi meskipun enzim dan komponen
lainnya sudah tersedia. Selain itu primer juga berfungsi untuk membatasi daerah
mana yang akan diamplifikasi pada reaksi PCR. Karena berbeda dengan proses
penggandaan DNA di dalam sel yang mengkopi seluruh DNA genom secara utuh,
pada PCR hanya dapat mengamplifikasi daerah tertentu saja dengan ukuran hingga
sekitar 10.000 basa. Karena fungsi primer sebagai inisiator sekaligus pembatas daerah
yang akan diamplifikasi, maka idealnya primer memiliki urutan basa nukleotida yang
tepat berpasangan dengan urutan basa DNA target yang akan diamplifikasi, dan tidak
menempel di bagian lainnya. Dengan demikian disain primer yang baik merupakan
hal esensial bagi keberhasilan reaksi PCR. Memang sulit untuk membuat primer yang
ideal, namun sedapat mungkin diperoleh keseimbangan antara spesifisitas dan
efisiensi. Spesifisitas didefiniskan sebagai frekuensi terjadinya mispriming
(kesalahan penempelan) primer pada tempat yang tidak seharusnya. Primer dengan
spesifisitas buruk akan terlihat dari banyaknya pita-pita yang tidak diinginkan saat produk PCR divisualisasi dengan elektroforesis gel. Efisiensi primer adalah seberapa
dekat perolehan jumlah produk PCR dengan nilai teoritis yang seharusnya dicapai (
18
Tahap-tahap dalam mendisain primer
1. Menentukan Tujuan
Tujuan mendisain primer harus ditetapkan terlebih dulu sebelum melakukan
kegiatan-kegiatan berikutnya.
2. Menyiapkan Sekuen Referensi
Pencarian sekuen referensi dapat dilakukan dari database GenBank di situs
NCBI. Jumlah sekuen referensi bisa satu, dua atau lebih, sebetulnya 1 sekuen sudah bisa dijadikan referensi asalkan yakin bahwa sampel target memiliki kesamaan spesies atau dengan kata lain secara genetik sangat mirip. Namun jika bisa memperoleh banyak sekuen tentu akan lebih baik agar dapat mendisain primer di daerah yang benar-benar sama (conserved region) setelah sekuen tersebut disejajarkan (alignment
3. Secara Manual atau dengan bantuan software ).
Pada dasarnya sembarang daerah tertentu pada sekuen referensi dapat
dijadikan primer, tanpa perlu bantuan software khusus. Namun cara ini amat berisiko
karena kita tidak mengetahui bagaimana kualitas primer nantinya sebab ada beberapa
parameter yang harus diperhatikan dalam mendisain primer. Beberapa software dapat
digunakan untuk membantu mendisain primer seperti PerlPrimer, Primer3Plus dan
sebagainya. Tampilan Primer3Plus
4. Mendisain primer
sangat sederhana, namun kemampuannya sudah
teruji dan digunakan oleh banyak peneliti di seluruh dunia.
19
Pada kotak yang tersedia, dimasukkan sekuen referensi yang dipilih, atau dapat mengunggah (upload) sekuen dari file di komputer.
Primer yang ingin didisain dipilih, sense primer (left primer), antisense (right primer) dan probe untuk hibridisasi (internal oligo). Kotak yang ada di bawahnya dapat diisi jika sudah memiliki kandidat primer.
Beberapa parameter lain dapat ditentukan jika diperlukan seperti excluded region (daerah dimana primer tidak boleh menempel di situ), targets (primer harus mengapit daerah tersebut) dan included region (kedua primer harus berada di dalam daerah ini).
Beberapa opsi yang lebih mendalam dapat ditambahkan pula pada tab General Settings, Advance Settings, Internal Oligo, Penalty Weights dan Sequence Quality. Namun untuk saat ini dibiarkan dalam pilihan defaultnya.
Jika semua opsi sudah terisi, tombol PICK PRIMERS ditekan untuk memulai pencarian primer yang terbaik.
20
Primer3Plus akan memberikan beberapa alternatif pasangan primer yang dapat
dipilih. Pada gambar di atas terlihat pasangan primer pertama.
Nama Left Primer dan Right Primer
Sekuen kedua primer
Posisi primer pada sekuen referensi, panjang primer, Titik Leleh (Tm), % GC dan
beberapa parameter terkait struktur sekunder yang mungkin terjadi.
Ukuran produk PCR
Menguji spesifisitas primer
Primer yang baru saja didesain harus diuji spesifisitasnya agar yakin bahwa
primer-primer tersebut akan mengamplifikasi target yang diinginkan. Pengujian spesifisitas
21 Pemilihan primer RT
Ada tiga pilihan primer yang dapat digunakan seperti: oligo dT, random
primer atau primer spesifik gen. Beberapa peneliti banyak menggunakan oligo dT karena bisa mendapatkan salinan cDNA lengkap dari full mRNA, akan tetapi, jika
mRNA-nya panjang (>4 kb) atau tidak memiliki ekor poly A (mRNA prokariot),
maka pilihannya adalah random primer. Dengan random primer, ujung 5′ gen-gen yang panjang dapat ditranskripsi balik, tetapi cDNA yang diperoleh mungkin tidak
full dari seluruh gen. Biasanya digunakan
Pilihan ketiga adalah primer spesifik gen yang dapat meningkatkan
sensitivitas dengan mengarahkan seluruh aktifitas enzim RT untuk mentranskripsi
balik hanya RNA tertentu saja. Jika yang kita lakukan adalah one-step RT PCR,
primer spesifik gen digunakan karena primer RT juga nantinya digunakan sebagai
primer reverse pada reaksi PCR-nya.
random primer 6-mers, namun apabila
digunakan 8 atau 9-mers dapat meningkatkan ukuran cDNA karena primernya akan
terhibridisasi lebih jarang. Aplikasi qPCR (quantitative PCR) pada gen-gen eukariot,
hasil terbaik bisa diperoleh dengan menggunakan kombinasi random primer panjang
dan oligo dT.
Struktur Sekunder RNA
Struktur sekunder ini bisa menjadi masalah dalam transkripsi balik RNA
secara utuh. Ibarat menemui jalan buntu, enzim RT dapat berhenti ketika menemui
struktur sekunder pada RNA-nya. Sulit memang memprediksi apakah RNA kita akan
memiliki struktur sekunder, tapi biasanya kandungan GC yang tinggi bisa kita jadikan
indikator bahwa RNA akan sulit untuk memisah dan mungkin tidak akan benar-benar
menjadi utas tunggal sebelum reaksi. Untuk mengatasinya, bisa dengan melakukan
denaturasi dulu pada suhu 65°C selama 5 menit sebelum reaksi RT agar RNA-nya
dalam keadaan rileks.
Pendekatan lainnya adalah dengan menggunakan enzim RT yang dapat
bekerja pada suhu yang lebih tinggi dari RT standar. Ada juga enzim RT yang
22 Menyingkirkan gDNA
Kontaminasi DNA genom (gDNA) pada RNA merupakan salah satu
penyebab terjadinya false positif saat reaksi PCR nantinya. Ada beberapa cara untuk menyingkirkan gDNA, misalnya pemberian DNase selama proses atau setelah isolasi
RNA. Jika sampel RNA diisolasi dari sel eukariot, maka cara terbaik menghindari
kontaminasi gDNA ketika PCR adalah dengan mendesain primer yang menyeberangi
intron atau batas intron-exon. Seperti diketahui bahwa mRNA pada eukariot
merupakan hasil transkripsi dari exon pada gDNA tanpa diselingi lagi oleh
intron-intron. Dengan cara ini tidak akan terjadi amplifikasi terhadap gDNA (atau
setidaknya akan memiliki produk PCR yang berbeda ukurannya). Satu hal yang harus
diwaspadai adalah pseudogene, yaitu salinan dari mRNA hasil splicing yang
diinsersikan ke dalam genom. Primer yang didesain hanya untuk mRNA tadi tetap
akan mengamplifikasi pseudogene ini. Untuk mRNA prokariot masalah tidak akan
selesai dengan primer yang didesain menyeberangi intron karena gDNA prokariot
tidak memiliki intron, sehingga penyingkiran gDNA ini amat krusial untuk
keakuratan pengukuran ekspresi gen. Satu-satunya pilihan adalah reaksi enzimatik
selama proses isolasi mRNA seperti yang diuraikan di atas. Harus dipastikan pula
bahwa gDNA benar-benar tidak mengganggu amplifikasi, misalnya dengan
buffer-buffer tertentu penghilang sisa-sisa DNA atau dengan mengamplifikasi (PCR)
langsung RNA hasil isolasi tanpa melalui proses RT PCR. Jika amplifikasi PCR tetap
terjadi berarti gDNA masih ada di dalamnya.
SITRININ
23 notatum, P. exposum, P. velutinum, P. camescen, P. viridicatum, P. palitans, P.
claviforme) , Aspergillus A. niveus, A. terreus, A. candidus) Monascus. Clavariopsis aquatica dan Blennoria sp. Selain diproduksi sejumlah jamur, sitrinin juga dapat diproduksi dari daun-daunan di Australia (Crotalaria crispata).
Karakteristik Fisik dan Kimia Sitrinin
Sitrinin berbentuk kristal, berwarna kukuningan, larut dalam pelarut lemak sedikit larut dalam air, larut dalam NaOH, Na2CO3 atau larutan natrium asetat. Bersifat termolabil dalam asam atau larutan basa, berwarna oranye dalam larutan basa; coklat dalam FeCl3; hijau dengan TiCl3, merah anggur dengan H2O2
Sitrinin mempunyai titik cair 178 dan 179 C. Absorpsi ultra violet dalam etanol (955) adalah 222 (∈ = 4710) nm (Cartwright et al., 1949., Hajjaj et al).
yang diikuti dengan NaOH .
Gambar 2.8 Struktur molekul sitrinin (Hajjaj 2000)
Daya Racun
1. Daya Racun Pada Binatang
24 Tabel 2.1 Binatang percobaan, dosis dan pengaruh patologi pemberian sitrinin
Jenis hewan percobaan Dosis (mg/kg BB) Efek patologi
Kelinci 20-75
20 8 minggu
Pembengkakan ginjal Neukrosis akut
Kerusakan ginjal kronis Depresi
Glukose urea
Tikus 48
14-32
2 hari 2 minggu
Neukrosis akut
Kerusakan ginjal kronis
Babi 100
40
2 hari 5-6 minggu
Neukrosis akut
Kerusakan ginjal kronis
Sumber: Wiley dan Morehouse (1977)
2. Kandungan toksin pada urin
Sitrinin yang disuntikkan pada beberapa hewan percobaan menyisakan residu sitrinin di dalam darah dan urin binatang tersebut. Kelinci yang mendapat suntikan 24-44 mg/kg melalui intravenous, intramuskuler atau subkutan, maka dalam waktu 5 menit darah kelinci tersebut mengandung sitrinin dalam jumlah banyak berkisar antara 33 hingga 67g/ml. Sitrinin akan bertahan dalam darah selama 24 jam. Bila diberikan melalui oral, darah kelinci dapat mengandung sitrinin sebanyak 15 sampai 20 g/ml dalam waktu 3 jam. Sekitar 20% sitrinin diikat plasma darah. Anjing yang diberi suntikan sitrinin melalui intravenous pada urinnya mengandung sitrinin sebanyak 22 persen setelah 48 jam.
3. Efek biologi lain
25 Tabel 2.2 Nilai LD50
Jenis Hewan
sitrinin terhadap beberapa jenis hewan percobaan
LD50 (mg/kg) Cara pemberian
Tikus 67,0 Suntikan pada subkutan
atau pada intraperitoneal
Babi 37,0 Suntikan pada subkutan
Kelinci 19,0 Suntikan pada intravenous
Marmut 35,0
110,0
Suntikan pada subkutan Suntikan intraperitoneal oral Sumber: Wiley dan Morehouse (1977)
Biosintesis sitrinin
Percobaan dengan [ 1-14C] asetat dan [ 14C] format Aspergilus candidus menunjukkan bahwa sitrinin berasal dari kondensasi 5 unit asetat, dan introduksi terhadap tiga-satu unit karbon pada C-11 dan C-13 . Biosintesa asal yang serupa diperlihatkan untuk produksi sitrinin dari P. citrinum. Biosintesa sitrinin dari P. citrinum adalah [ 114C] dan [ 6-14
Reduksi sitrinin
C] glukosa. Keduanya mempunyai atom C dengan posisi yang sama. Pola label pada radioaktif sitrinin membukt ikan asal molekul-molekul skeleton dari 2 unit karbon. Atom C-10 lebih aktif mendukung lintasan asesat malonal. Penggabungan satu unit karbon tampaknya berurutan C-11, C-12 dan C-13. Okhratoksin A dan sitrinin yang keduanya berasal dari P.viridicatum cenderung mendukung penggabungan yang dimulai pada C-11. Sitrinin ditemukan bersama okhratoksin pada bebijian (gandum, jawawut), yang terkontaminasi oleh P. citricum. Selain itu sitrinin juga dijumpai pada buah apel yang tercemar P. expansus dan juga patulin. Pada kacang tanah sitrinin ditemukan bersama aflatoksin yang terinfeksi A. flavus, P. citrinum dan A. terreus (Hajjaj 2000).
26 rendah, intensitas warna tinggi dan kadar sitrinin yang relatiif tinggi juga. Kadar sitrinin yang terkandung dalam Monascus purpureus dapat direduksi dengan perlakuan penambahan asam lemak rantai medium seperti yang dilaporkan oleh Hajjaj et al (2000). Percobaan yang dilakukan Hajjay dengan penambahan beberapa jenis asam lemak dengan panjang rantai yang bervariasi, menunjukkan hasil yang bervariasi. Hasil terbaik ditunjukkan penambahan asam lemak rantai medium yaitu asam oktanoat.
Prinsip dasar yang menjadi pertimbangan penambahan asam lemak untuk tujuan reduksi sitrinin adalah memotong jalur metabolism pembentukan metabolit sekunder pada Monascus sp. Percobaan menggunakan 13C
Tabel 2.3 Efek asam lemak dengan variasi panjang rantai karbon pada produksi pigmen dan sitrinin menggunakan M. ruber dengan adanya glukosa dan MSG
nuclear magnetic
resonance menunjukkan bahwa biosintesis pigmen merah pada Monascus ternyata menggunakan sekaligus dua jalur (pathway) seperti terlihat pada gambar 4, yaitu jalur pembentukan struktur kromophore (polyketide synthase) dan jalur sintesis asam lemak (the fatty acid synthesis pathway). Dengan memotong jalur sintesis asam lemak dengan cara menambahkan asam lemak dari luar, ternyata dapat mereduksi kandungan sitrinin pada Monascus sp. Hasil penelitian Hajjay (2000) tersaji pada tabel berikut .
a
Tipe asam lemak yang ditambahkan
Konsentrasi (mg/g biomasa) b
Pigmen merah Sitrinin
Kontrol 54 14
Asam heksanoat 43,5 10
Asam oktanoat 114 7,4
Asam dekanoat 52,5 9,0
Asam dodekanoat 51 3,6
Asam miristat 54 14,6
Asam stearat 51 11,6
Asam oleat 55,5 13
Keterangan: a. Masing-masing pada konsentrasi 5 gram/liter. Level sitrinin dan
pigmen diukur setelah 95 jam pertumbuhan M. Ruber.b. pada 1 mM. Sumber : Hajjay et al 1999
27 Perlakuan lain yang juga sering dilakukan untuk tujuan reduksi sitrinin adalah mutagenesis. Mutagenesis dilakukan misalnya dengan penyinaran menggunakan sinar UV, perendaman dengan larutan kimia etidibium bromid dan sebagainya. Upaya-upaya tersebut terbukti dapat mereduksi kandungan sitrinin dengan hasil bervariasi. Meskipun upaya reduksi sitrinin sering dilakukan pada produksi angkak, secara alami strain-strain Monascus purpureus memiliki kandungan sitrinin yang cukup rendah.
Khamir Amilolitik
Khamir merupakan mikroorganisme golongan fungi yang dibedakan bentuknya dari mould (kapang) karena ber sel tunggal (uniseluler).
Reproduksi vegetatif pada khamir terutama dengan cara pertunasan. Sebagai sel tunggal, khamir tumbuh dan berkembang biak lebih cepat dibanding dengan mould yang tumbuh dengan pembentukan filamen. Khamir sangat mudah dibedakan dengan mikroorganisme yang lain misalnya dengan bakteri, khamir mempunyai ukuran sel yang lebih besar dan morfologi yang berbeda. Sedangkan dengan protozoa, khamir mempunyai dinding sel yang lebih kuat serta tidak melakukan photosintesis bila dibandingkan dengan ganggang atau algae. Dibandingkan dengan kapang dalam pemecahan bahan komponen kimi, khamir lebih efektif memecahnya dan lebih luas permukaan serta volume hasilnya lebih banyak. Khamir dapat dibedakan atas dua kelompok berdasarkan sifat metabolismenya yaitu bersifat fermentatif dan oksidatif. Jenis fermentatif dapat melakuka n fermentasi alkohol yaitu memecah gula (glukosa) menjadi alkohol dan gas contohnya pada produk roti. Sedangkan oksidatif (respirasi) akan menghasilkan karbon dioksida dan air. Keduanya bagi khamir dipergunakan untuk energi walaupun energi yang dihasilkan melalui respirasi lebih tinggi dari yang melalui fermentasi (Fardiaz 1992).
28 Gambar 2.9 Bagian-bagian khamir (Anonim, 2004)
Identifikasi khamir untuk kepentingan klasifikasi sedikit berbeda dengan kapang. Pada kapang idintifikasi biasanya didasarkan atas bentuk morfologinya, sedangkan identifikasi khamir selain didasarkan pada morfologi juga ditentukan oleh sifat-sifat lainnya yaitu sifat kultur, fisiologi dan reproduksi seksual.
Berdasarkan sifat-sifat tersebut khamir dapat dibedakan atas tiga kelas, yaitu: 1. Kelas Ascomycetes atau khamir askosporogenous, dimana spora tumbuh di dalam
askus.
2. Kelas Basidiomycetes yang membentuk spora pada basidium.
29 aktivitas pada asam-asam organik, aktivitas dalam degradasi protein, aktivitas dalam degradasi lemak, aktivitas dalam degradasi selulosa, pektin dan xilan, serta aktivitas dalam degradasi pati. Khususnya khamir yang memiliki kemampuan dalam degradasi pati, telah menjadi subyek penelitian-penelitian di seluruh dunia. Penelitian yang dilakukan adalah berkaitan dengan sifat amilolitik khamir pada pati dalam memproduksi etanol dan biomassa khamir untuk memproduksi minuman dan makanan. Enzim amilase sebagai aktivitas amilolitik pada khamir, diproduksi secara ekstraseluler. Secara umum kelompok khamir yang mempunyai kemampuan amilolitik jumlahnya relatif sedikit antara lain Schwaniomyces occidentalis, Saccharomycopsis fibuliger, Sacch diastiticus, Candida dan Pichia Sedangkan jenis-jenis khamir lainnya tidak memproduksi amilase (Roosifta 2004).
Khamir amilolitik memiliki potensi penting pada produk-produk dimana pati digunakan sebagai bahan utamanya sehingga dapat menyumbangkan flavor yang dikehendaki. Peran amilase khamir yang cukup familiar pada produk fermentasi Indonesia adalah pada tape ketan atau tape singkong (ubi kayu). Pada fermentasi sayur asin dan asam terdapat beberapa yeast jenis Candida sake dan C. guilliermondii yang menggunakan substrat maltosa dan pati untuk diubah menjadi glukosa, kemudian dimetabolisme lebih lanjut menjadi asam-asam organik seperti asam laktat, asetat, suksinat, etanol dan gliserol (Puspito & Fleet 1985). Takeuchi et al (2006), melakukan purifikasi dan karakterisasi α-amilase dari Pichia burtonii yang diisolasi dari starter tradisional “Murcha” dari Nepal. P. burtonii memproduksi enzim amilolitik ekstraseluler katika dikulturkan pada media yang mengandung pati. Enzim hasil purifikasi diberi nama Pichia burtoniiα-amilase (PBA) suatu glikoprotein yang memiliki berat molekul 51 kDa, mempunyai aktivitas optimal pada pH 5,0 pada suhu 40˚C, dan aktivitasnya dihambat oleh ion-ion logam seperti Cd2+, Cu2+, Hg2+, Al2+, dan Zn2+.
30 Schizosaccharomyces
Schizosaccharomyces melakukan reproduksi aseksual dengan cara pembelahan dan membentuk empat atau delapan askospora per askus setelah melakukan konjugasi isogamik. Khamir jenis ini sering ditemukan pada buah-buahan tropis, molase, tanah, madu, dan sumber-sumber lainnya. Spesies yang paling umum dijumpai adalah S. pombe.
Kelompok khamir ini tidak memproduksi etanol dalam konsentrasi tinggi. S. pombe juga dikenal sebagai ”fission yeast”. Khamir ini digunakan sebagai model organisme dalam biologi dan sel molekuler. Merupakan eukaryote unicellullar, berbentuk batang berukuran diameter 3-4 mikrometer dan panjang 7-14 mikrometer. Khamir ini juga merupakan eukariot yang memiliki genom terpendek yaitu sekitar 13,8 million pasangan basa.
S.
pombe memfermentasi asam malat menjadi etanol dan CO2 dan telah digunakan secara komersial dalam fermentasi champagne. Fermentasi dengan S. pombe menghasilkan wine yang titrat keasaman dapat dikurangi karena mempunyai kemampuan memfermentasi asam malolaktat, tetapi menghasilkan wine dengan kualitas buruk.
Pichia
Sel khamir ini berbentuk oval sampai silinder, dan kemungkinan juga membentuk pseudomiselium. Asckospora berbentuk bulat atau seperti topi, dengan jumlah satu sampai empat per askus. Genus Pichia terdiri dari 56 spesies. Pichia membranefaciens mampu survive pada konsentrasi alkohol tinggi. Pichia merupakan khamir nitrat-negatif tetapi beberapa genus seperti Hansenula menunjukkan nitrat-positif.
31 Maka dari itu adanya sequester alkohol oksidase di dalam organel sub seluler peroksisom berfungsi mencegah toksisitas dari hidrogen peroksida.
Saccharomyces
Sel khamir yang termasuk jenis ini mungkin berbentuk bulat, oval, atau memanjang dan mungkin membentuk pseudomiselium. Reproduksi khamir dilakukan dengan cara pertunasan multipolar, atau melalui pembentukan askospora. Spesies yang paling umum digunakan dalam industri makanan adalah Saccharomyces cerevisiae, misalnya dalam pembuatan roti, anggur, brem, gliserol, enzim invertase.
Koloni S. cerevisiae berwarna putih kekuningan, agak berlendir, dan mempunyai aroma khas seperti aroma roti. Untuk pertumbuhannya membutuhkan oksigen, cahaya, dan suhu. Suhu optimum pertumbuhannya adalah 30C, suhu maksimum 35-37C, dan suhu minimumnya adalah 9-11C (Judo amidjojo, et al, 1992).
Saccharomyces cerevisiae melakukan perbanyakan diridengan pertunasan (budding) atau pada beberapa kasus dengan melakukan pembelahan (fission), meskipun beberapa khamir seperti Candida albicans dapat tumbuh sebagai filament-filamen (miselium) sederhana yang tidak beraturan. Mereka juga dapat bereproduksi secara seksual, membentuk asci yang megandung lebih dari 8 askospora-askospora.
Saccharomyces cerevisiae dikenal sebagai "bakers yeast" atau "brewers yeast". Khamir memfermentasi gula yang ada pada tepung atau yang ditambahkan pada adonan, menghasilkan karbon dioxida (CO2) dan alkohol (ethanol). Pada adonan roti CO2 terperangkap sebagai gelembung-gelembung udara kecil dalam adonan, sehingga adoanan kelihatan mengembang.
Endomycopsis
32 pati, contohnya Endomycopsis fibuliger. Jenis Endomycopsis burtonii dapat diisolasi dari produk fermentasi tape baik tape singkong maupun tape ketan
Sifat Fisiologi Khamir
Sifat fisiologi khamir secara umum berkaitan erat dengan kondisi pertumbuhan, metabolisme, dan substrat untuk pertumbuhan khamir. Kondisi pertumbuhan yang berkaitan dengan batas aktivitas air berkisar 0,88-0,94. Kisaran suhu untuk pertumbuhan kebanyakan khamir pada umumnya hampir sama dengan kapang, yaitu mempunyai kisaran suhu optimum 25-30°C dan kisaran suhu maksimum pertumbuhan 35-47°C. Kebanyakan khamir lebih menyukai tumbuh pada keadaan asam, yaitu pada pH 4-4,5, dan tidak dapat tumbuh dengan baik pada medium alkali, kecuali jika telah beradaptasi. Khamir tumbuh baik pada kondisi aerobik.
Metabolisme dan substrat untuk pertumbuhan khamir berkaitan erat dengan hal-hal sebagai berikut: Khamir dapat dibedakan atas dua kelompok berdasarkan sifat metabolismenya, yaitu yang bersifat fermentatif dan oksidatif. Khamir fermentatif dapat melakukan fermentasi alkohol, yaitu memecah glukosa melalui jalur glikolisis (Embden Meyerhoff-Parnas).
Penelitian yang dilakukan oleh Suha et al (2000), berkaitan dengan analisis fisiologi ko-kultur Monascus sp J101 dengan S. cereviseae menunjukkan bahwa selama proses fermentasi Monascus sp. J101 dengan S. cereviseae kultur filtrat distimulasi untuk membentuk spora reproduktif yang secara bertahap menghasilkan akselerasi reproduksi dan proliferasi sel. Juga dideteksi aktivitas protein kinase C. Khitinase (EC 3.2.1.14), suatu protein 120-kDa yang disekresikan dimurnikan dari kultur filtrat S. cereviseae sebagai efektor. Kultur filtrat mengandung total lipid
33 kira-kira 4 kali lebih banyak dibanding tanpa kokultur (terutama asam oleat dan asam linoleat). Penambahan asam lemak dari luar hanya berkontribusi pada peningkatan masa sel.
Perubahan morfologi dan peningkatan produksi pigmen Monascus selama ko-kultur dengan S. cerevisiae atau A. oryzae diteliti oleh Shin et al.(1998). Dilaporkan terjadi perubahan morfologi yang signifikan pada kultur Monascus. Dengan kokultur menunjukkan peningkatan masa sel dua kali lipat dan pigmen mengalami peningkatan 30-40 kali dibanding monokultur. Sebaliknya kokultur antara Monascus dengan Bacillus cereus tidak terjadi perubahan morfologi, peningkatan pertumbuhan sel, dan peningkatan produksi pigmen.
Kokultur antara Monascus dan S. cerevisiae lebih efektif dalam meningkatkan produksi pigmen dibanding dengan A. oryzae. Dilaporkan bahwa peningkatan pertumbuhan sel dan peningkatan produksi pigmen terjadi berhubungan dengan perubahan morfologi.
Beberapa enzim hidrolitik diproduksi oleh S. cerevisiae seperti amilase dan kitinase yang berfungsi sebagai efektor. Penambahan enzim komersial amilase dan protease dari A. oryzae keduanya menyebabkan perubahan morfologi di dalam sel Monascus dan efektif dalam meningkatkan produksi pigmen. Sebaliknya lisozim, amilase dan protease dari spesies Bacillus, protease dari Staphylococcus, dan khitinase dari Streptomyces tidak efektif. Enzim hidrolitik menyebabkan perubahan morfologi dan peningkatan produksi pigmen berkaitan dengan kemampuannya mendegradasi dinding sel Monascus. Terjadi peningkatan produksi pigmen sekitar 10 kali lipat dengan menggunakan kokultur S. cerevisiae pada fermentasi cair oleh Monascus.
Aplikasi Ko-kultur pada Proses Fermentasi
34 yang diharapkan dari kegiatan fermentasi. Beberapa peneliti telah mengaplikasikan ko-kultur pada topik penelitian mereka. Mays et al. 1984, melakukan ko-kultur antara Lactobacillus dengan Veillonella untuk produksi asam propionat. Prinsip ko-kultur tersebut adalah suatu proses untuk produksi asam laktat atau garamnya dan asam propionat dan atau asam asetat atau garamnya oleh katabolisme suatu substrat karbohidrat melalui proses fermentasi bakteri dua tahap secara simultan. Tahap pertama, karrbohidrat dikonversi menjadi asam laktat oleh bakteri sakarolitik seperti Lactobacillus casei subspesies rhamnosus. Pada tahap ke dua, asam laktat secara resultante difermentasi menjadi asam propionat dan asam asetat, karbon dioksida dan hidrogen oleh bakteri kedua yang diadaptasi untuk mampu tumbuh dengan keberadaan bakteri pertama, misalnya jenis-jenis bakteri yang mampu mengkatabolisme asam laktat seperti Veillonella criceti.
Simove et al. 2004 menggunakan kultur campuran Rhodotorula rubra GED10 dan bakteri yoghurt (Streptococcus thermophilus 13a+Lactobacillus bulgaricus 2-11) untuk produksi beberapa eksopolisakarida. Metode yang digunakan adalah campuran mikroba tersebut dikultivasi pada media whey keju yang telah diultrafiltrasi (WU). Hasil dari penelitian menunjukkan bahwa laktosa yang terdapat di dalam substrat WU dapat secara efektif digunakan oleh campuran mikroba Rhodotorula rubra GED10 dan bakteri yoghurt (Streptococcus thermophilus 13a+Lactobacillus bulgaricus 2-11) untuk sintesis beberapa eksopolisakarida.
35 3. METODOLOGI UMUM
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bidang Mikrobiologi LIPI Cibinong, dan Laboratorium Pengujian, VEDCA, Cianjur. Penelitian berlangsung dari bulan Desember 2007 sampai dengan April 2009.
Bahan dan Alat
Bahan yang digunakan sebagai substrat fermentasi Monascus purpureus adalah beras jenis IR 42 yang diperoleh di sekitar pasar Bogor, Jawa Barat. Kultur mikroba untuk produksi angkak menggunakan enam strain M. purpureus (koleksi laboratorium Bidang Mikrobiologi, Pusat Penelitian Biologi, LIPI, Cibinong, Bogor) yang terdiri dari TOS, AID, JmbA, JmbA5K, JmbA3M, dan dan AS3K. Khamir indigenus yang digunakan adalah 16 strain yaitu lima strain koleksi Lab. Ilmu Hayati ITB : Saccharomyces cerevisiae, Pichia, Schizosaccharomyces, Endomycopsis burtonii, Candida utilis dan 11 strain koleksi laboratorium Bidang Mikrobiologi, Pusat Penelitian Biologi, LIPI, Cibinong, Bogor: S. cerevisiae Mka, Mkb, Unb, Mk, Imb, Gl, D5a, Mgb, Hm, Dmga, dan Kd.
Bahan-bahan kimia yang digunakan meliputi etanol 70%, media Malt Ekstrak Agar (MEA), bacto agar, pati 2%, NaCl 5gr/l, NaOH 1M, HCL 1M,
buffer Tris HCl 20 mM (pH 7,0) , akuades, metanol, standar lovastatin, standar sitrinin. 0,1 mol/l NaOH, asetonitril, H3PO4, etil asetat, bahan-bahan kimia untuk
isolasi m. RNA meliputi : TRIzol, kloroform, isopropil alkohol, etanol 75% (perlakuan DEPC-treated water) RNase free water (water add diethylpyrocarbonate /DEPC), Stock buffer (200 mM NaCl ; 200 mM Tris-Cl pH 7,5 ; 1,5 mM MgCl ; 2% SDS, buffer TAE, gel agarosa.
Alat-alat yang digunakan meliputi autoklaf, High Pressure Liquid Chromatography (HPLC), laminar air flow, perangkat gel elektroforesis,
36 Metode Penelitian
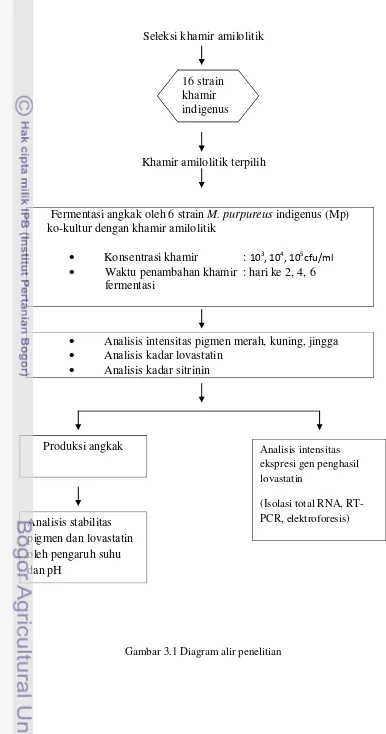
[image:52.595.96.518.108.816.2]Penelitian ini dilaksanakan dalam 4 tahap seperti terlihat pada Gambar 3.1, meliputi:
1). Seleksi 16 isolat khamir indigenus untuk mendapatkan khamir amilolitik dan pengamatan kurva pertumbuhan enam strain M. purpureus
2). Produksi angkak oleh M. purpureus ko-kultur dengan khamir indigenus terpilih (khamir amilolitik). Angkak yang dihasilkan kemudian dilakukan analisis intensitas warna, kadar lovastatin dan kadar sitrinin.
3). Analisis intensitas ekspresi gen yang bertanggung jawab pada biosintesis lovastatin dari M. purpureus penghasil lovastatin tertinggi setelah di ko-kultur dengan khamir amilolitik. Tahap ini dilakukan dengan melalui serangkaian analisis meliputi : isolasi total RNA, transkripsi balik menggunakan PCR ( Reverse-Transcription Polymerase Chain Reaction), elektroforesis, dan
pengukuran densitas.
4). Mempelajari stabilitas pigmen dan lovastatin angkak oleh pengaruh suhu dan pH.
Seleksi khamir amilolitik indigenus (Naiola, 2008)
37 Seleksi khamir amilolitik
Khamir amilolitik terpilih
Fermentasi angkak oleh 6 strain M. purpureus indigenus (Mp) ko-kultur dengan khamir amilolitik
• Konsentrasi khamir : 103, 104, 105 • Waktu penambahan khamir : hari ke 2, 4, 6
fermentasi
cfu/ml
• Analisis intensitas pigmen merah, kuning, jingga �