SELEKSI
IN VITRO
KALUS EMBRIOGENIK KELAPA
SAWIT (
Elaeis guineensis
Jacq.) MODERAT TAHAN
TERHADAP
Ganoderma boninense
Pat.
ANTONIUS DONY MADU PRAPTOMO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Seleksi In Vitro Kalus Embriogenik Kelapa Sawit (Elaeis guineensis Jacq.) Moderat Tahan terhadap Ganoderma boninense Pat.adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Antonius Dony MP
RINGKASAN
ANTONIUS DONY MADU PRAPTOMO. 2014. Seleksi In Vitro Kalus Embriogenik Kelapa Sawit (Elaeis guineensis Jacq.) Moderat Tahan terhadap Ganoderma boninense Pat. Dibimbing oleh NI MADE ARMINI WIENDI dan NURITA TORUAN-MATHIUS.
Variasi somaklonal pada kultur jaringan kelapa sawit berpotensi sebagai sumber keragaman genetik baru ketahanan terhadap penyakit busuk pangkal batang (BPB) yang disebabkan oleh Ganoderma boninense Pat melalui teknik seleksi in vitro. Tujuan umum penelitian ini yaitu mengembangkan prosedur teknik seleksi in vitro ketahanan kultur kalus kelapa sawit terhadap G. boninsense Pat. penyebab penyakit Busuk Pangkal Batang pada tanaman kelapa sawit. Tujuan khusus penelitian yaitu (i) Mendapatkan isolat G. boninense. yang memiliki tingkat virulensi tertinggi berdasarkan karakter fisiologisnya, (ii) Menetapkan kondisi optimal teknik seleksi ketahanan kultur kalus kelapa sawit terhadap Ganoderma boninense Pat., (iii) Menetapkan senyawa aktif dalam kultur filtrat Ganoderma boninense Pat. penyebab nekrosis sel kalus kelapa sawit.
Sepuluh isolat G. boninense digunakan untuk evaluasi isolat virulen melalui media 2% malt ekstrak agar (MEA) dan penambahan asam Tanik 5%, 1 mM 2,2-azino-bis (3-etilbenzotiazolin-6-sulfonat) sebagai media kromogenik melalui sebelas peubah. Kalus embriogenik remah kelapa sawit Tenera sebanyak 0.1 g digunakan untuk seleksi dan isolat patogen G. boninense dipilih yang paling virulen. Panen filtrat dilakukan setiap tiga hari selama 30 hari untuk penentuan waktu panen filtrat optimal. Konsentrasi letal filtrat ditentukan darisembilan belas media uji toksisitas, ditambahkan dari 0 sampai 50% (v/v). Seleksi dilakukan selama 3 bulan yang diulang empat kali pada konsentrasi filtrat 20%, 24%, 28%, 32%, dan 36% (v/v). Visualisasi area nekrosis dilakukan dengan pewarnaan jaringan dengan teknik mikrotom. Analisis kimia filtrat G. boninense dilakukan pada asam organik, ergosterol, protein dan polisakarida. Kebocoran elektrolit digunakan untuk mengetahui peran senyawa dalam filtrat melalui analisis lintas.
Isolat G. boninense dengan virulensi tertinggi adalah strain G3-11-U5. Kultur filtrat G. boninense dengan filtrasi pada waktu panen 15 hari setelah inokulasi digunakan sebagai sumber agen seleksi. Konsentrasi letal filtrat adalah 40% (v/v). Konsentrasi subletal filtrat optimal adalah 32% (v/v). Periode seleksi terbaik dilakukan selama 3 bulan per siklus selama empat siklus. Aktivitas enzim peroksidase dan enzim fenilalanina amonia liase dapat digunakan sebagai indikator peubah ketahanan kalus. Gejala nekrosis teramati pada irisan mikrotome dipengaruhi konsentrasi dan waktu pemaparan filtrat. Asam oksalat dan kelompok protein merupakan senyawa fitotoksin terhadap kalus kelapa sawit berdasarkan analisis lintas. Hasil seleksi in vitro diperoleh enam tunas in vitro putatif moderat tahan terhadap G. boninense.
SUMMARY
ANTONIUS DONY MADU PRAPTOMO. In Vitro Selection of Oil Palm (Elaeis guineensis Jacq.) Embryogenic Callus Moderate Resistance to Ganoderma boninense Pat. Supervised by NI MADE ARMINI WIENDI and NURITA TORUAN-MATHIUS.
Somaclonal variation in oil palm tissue culture has the potential as a new source of genetic variability of resistance to basal stem rot (BPB) disease caused by Ganoderma boninense Pat. The general objective of this research was to develop the in vitro selection technique procedure of oil palm callus culture resistance against G. boninsense, the causal agent of Basal Stem Rot disease. The specific objective of the research were to: (i) Obtain isolates of G. boninense which have the highest level of virulence based on physiological characteristics, (ii) Determine the optimal conditions for oil palm callus culture resistance selection technique against G. boninense, (iii) Determine the active compounds in the culture filtrate of G. boninense which cause cell necrosis in oil palm callus.
Ten isolates of G. boninense were used for the selection of pathogenic isolates by using as chromogenic medium: 5% tannin acid and 1 mM 2,2-azino-bis (3-etilbenzotiazolin-6-sulfonic acid) with five variables. About 0.1 g clump embryogenic callus of Tenera were used to test the virulence of G. boninense. Filtrate of selected G. boninense was harvested every three days for 30 days to determine optimum harvest time. Lethal concentration of the filtrate on oil palm callus was determined by growing the callus in nineteen toxicity test mediums supplied with filtrate with varying concentration from 0 to 50% (v/v). Sub lethal concentration was determined by growing the callus on mediums with filtrate concentration of 20%, 24%, 28%, 32%, and 36% (v/v). Surviving callus were subcultured on the same medium for four times every three months. Visualization of necrosis area was done using tissue colorization with microtome. Chemical analysis of G. boninense filtrate was done for organic acid, ergosterol, protein, and polysaccharide. Path analysis was used to measure electrolyte leakage in order to know the role of these compounds in the toxicity of G. boninense filtrate.
The highest virulence of G .boninense was achieved by G3-11-U5 strain. Culture filtrat as selection agent was harvested 15 days after inoculation. The sub lethal concentration of filtrate was 32% (v/v). The best selection process was done in 3 months per cycles with four cycles. Enzyme activity comparison between control and selected callus showed that peroxidase and phenylalanine ammonia lyase enzyme activity could be used as variables to determine the resistance level of selected callus. Necrosis symptoms observed in microtome slices were influenced by exposure time of callus to filtrate and filtrate concentration on the medium. Path analysis revealed that oxalic acid and some unidentified crude proteins were toxic to oil palm callus. Six in vitro shoots with putative moderate resistance against G. boninense were obtained from this selection process.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SELEKSI
IN VITRO
KALUS EMBRIOGENIK KELAPA
SAWIT (
Elaeis guineensis
Jacq.) MODERAT TAHAN
TERHADAP
Ganoderma boninense
Pat.
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Seleksi In vitro Kalus Embriogenik Kelapa Sawit (Elaeis guineensis Jacq.) Moderat Tahan terhadap Ganoderma boninense Pat.
Nama : Antonius Dony Madu Praptomo NIM : A253100071
Disetujui oleh
Komisi Pembimbing
Dr Ir Ni Made Armini Wiendi, MS
Ketua
Diketahui oleh
Dr Nurita Toruan-Mathius, MS Anggota
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc.Agr
PRAKATA
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala berkat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian bertema teknik seleksi in vitro dilaksanakan sejak bulan April 2012 hingga November 2013. Penelitian ini merupakan salah satu upaya untuk mendapatkan sumber genetik baru terutama pada sifat ketahanan terhadap penyakit busuk pangkal batang yang disebabkan oleh patogen G. boninense. Selanjutnya penelitian dilakukan dalam beberapa seri penelitian dengan berjudul : Seleksi In vitro Kalus Embriogenik Kelapa Sawit (Elaeis guiniensis Jacq.) Moderat Tahan terhadap Ganoderma boninense Pat.
Ucapan terima kasih penulis sampaikan kepada :
1. Dr Ir Ni Made Armini Wiendi, MS selaku ketua komisi pembimbing dan Dr Nurita Toruan-Mathius, MS sebagai anggota komisi pembimbing yang dengan sabar memberikan bimbingan, arahan dan ilmunya bagi penulis. 2. Prof Dr Ir Meity Suradji Sinaga, MSc selaku dosen penguji luar komisi yang
telah memberikan saran dan masukan demi perbaikan tesis ini.
3. Bpk. Jo Daud Darsono selaku HoU dan Dr Tony Liwang, MSc selaku Division Head of Plant Production and Biotechnology PT. SMART. tbk yang telah memberi izin dan dana penulis melanjutkan tugas belajar pada jenjang Magister di IPB.
4. Randi Abdur Rohman, SSi, Hadi Septian Guna Putra, SSi dan Yogo Adhi Nugroho, MSc yang banyak membantu dan berdiskusi selama proses penelitian dan penulisan.
5. Ibu Lisa, Ibu Helena, Bpk Irang, Bpk Yanto, Ibu Cyntia, Ibu Urip dan staf Plant Production lainnya yang telah memberi kultur kalus kelapa sawit dan dukungan moril.
6. Rekan rekan staf Biotek PT SMART.tbk yang tidak dapat disebutkan satu per satu atas segala dukungannya.
7. Warid, Tinche, Iin, Irni, Aziz dan rekan-rekan seangkatan PBT IPB 2010 dalam perjuangannya selama ini.
8. Saudara Sanju dan Pipit dengan segala ketelitian dan kesabarannya membantu secara teknis pelaksanaan penelitian.
9. Bapak Ag. Sudarno, Mas Darwanto, Mbak Novi, Dik Dian, Bpk. Purnama dan Ibu yang telah memberi dukungan moril kepada penulis.
10. Istri tercinta YMM Anita Nugraheni dan buah hati kami Sebastian Gamma dengan segala penuh cinta, doa, kerelaan dan kesabaran menemani selama proses belajar ini.
Serta semua pihak yang telah banyak memberikan bantuan dan dukungan moril serta inspirasi bagi penulis. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 4
Ruang Lingkup Penelitian 4
Bagan Alir Kegiatan Penelitian 4
TINJAUAN PUSTAKA 5
Variasi Somaklonal pada Kultur Jaringan Kelapa Sawit 5 Patogenesitas G. boninense pada Tanaman Kelapa Sawit 8
Efektor 10
EVALUASI ISOLAT Ganoderma boninense Pat. VIRULEN 12
Pendahuluan 13
Tujuan Penelitian 13
Bahan dan Metode 13
Analisis Data 16
Hasil dan Pembahasan 17
Simpulan 24
OPTIMASI TEKNIK SELEKSI IN VITRO KETAHANAN KALUS
EMBRIOGENIK KELAPA SAWIT TERHADAP Ganoderma boninense Pat. 25
Pendahuluan 26
Tujuan Penelitian 27
Bahan dan Metode 27
Peubah Amatan 32
Analisis Data 32
Hasil dan Pembahasan 34
Simpulan 49
ANALISIS KANDUNGAN SENYAWA AKTIF DALAM FILTRAT DAN RESPONS KALUS KELAPA SAWIT PADA UJI TOKSISITAS FILTRAT
Ganoderma boninense Pat. 50
Pendahuluan 51
Tujuan 52
Bahan dan Metode 52
Analisis Data 55
Hasil dan Pembahasan 57
Simpulan 73
SIMPULAN UMUM 78
DAFTAR PUSTAKA 78
LAMPIRAN 92
DAFTAR ISTILAH 105
RIWAYAT HIDUP 108
DAFTAR TABEL
1 Isolat uji virulensi Ganoderma boninense berdasarkan daerah dan jenis
tanah 14
2 Pengaruh jenis isolat terhadap diameter zona reaksi, diameter miselium, indeks isolat serta intensitas kepekatan warna pada media ATT 18 3 Pengaruh jenis isolat terhadap diameter zona, diameter koloni, indeks
isolat serta intensitas kepekatan warna pada media ABTS 20 4 Pengaruh jenis isolat terhadap laju tumbuh miselium pada media uji
MEA, ATT dan ABTS 22
5 Hasil pengujian karakter fisiologis dalam pendugaan tingkat virulensi
sepuluh isolat G. boninense 23
6 Pengaruh metode modifikasi kultur patogen terhadap penurunan jumlah
kalus hidup dan berat basah kalus 34
7 Waktu panen filtrat terhadap penurunan jumlah kalus hidup 36 8 Uji toksisitas media YMB dan filtrat terhadap jumlah kalus hidup dalam
penentuan konsentrasi letal filtrat G. boninense 39 9 Pengaruh konsentrasi sub letal filtrat terhadap penurunan jumlah kalus
hidup dan selisih berat basah kalus 40
10 Pengaruh siklus seleksi terhadap penurunan jumlah kalus hidup dan
selisih berat basah kalus 41
11 Pengaruh konsentrasi filtrat terhadap perkecambahan embrio somatik
dan pembentukan tunas pada siklus seleksi keempat 43 12 Pengukuran aktivitas enzim kitinase, fenilalaninina amonia liase dan
peroksidase berdasarkan asal kalus dan media induksi 47 13 Pengaruh dual kultur terhadap pencokelatan kalus, penurunan jumlah
regenerasi kalus dan penurunan berat basah kalus 58 14 Pengaruh konsentrasi penduga subletal dan letal filtrat terhadap luas area
nekrosis jaringan kalus kelapa sawit 60
15 Perbandingan konsentrasi asam-asam organik filtrat dan kontrol pada
pengujian kebocoran ion 65
16 Perbandingan konsentrasi total protein filtrat dan kontrol pada pengujian
17 Perbandingan konsentrasi ergosterol filtrat dan kontrol pada pengujian
kebocoran ion 67
18 Perbandingan konsentrasi total polisakarida filtrat dan kontrol pada
pengujian kebocoran ion 67
19 Korelasi peubah kimia oksalat, ergosterol, polisakarida dan protein pada
filtrat terhadap kebocoran ion kalus 70
DAFTAR GAMBAR
1 Sistem regenerasi in vitro eksplan daun kelapa sawit melalui
embriogenesis tidak langsung 7
2 Skema ilustrasi jaringan tanaman inang terinfeksi patogen sebagai aksi
dari efektor apoplastis dan sitoplasmik 10
3 Media kromogenik pada uji fisiologis isolat.
4 Alur kerja percobaan deteksi isolat virulen G. boninense 16 5 Hasil reaksi oksidasi sepuluh isolat G. bonineses menggunakan media
ATT 17
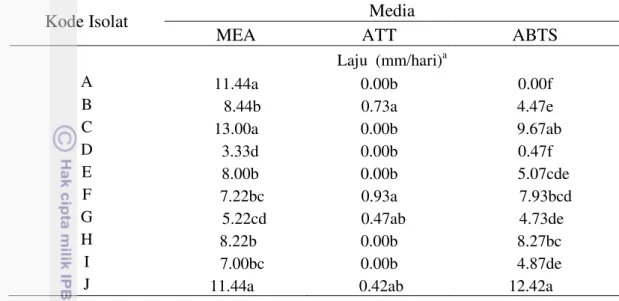
6 Hasil reaksi oksidasi sepuluh isolat G. bonineses pada media ABTS 19 7 Diameter morfologi koloni G. boninense pada media MEA pada 6 hsi 21 8 Dendrogram berdasarkan karakter fisiologis sepuluh isolat kelompok G.
boninense 24
9 Tahap persiapan teknik seleksi in vitro kultur kalus kelapa sawit untuk
ketahanan terhadap G. boninense 28
10 Metode dual layer G. boninense modifikasi kultur patogen pada seleksi
kalus embriogenik kelapa sawit 30
11 Alur kerja optimasi teknik seleksi in vitro kultur kalus kelapa sawit
untuk ketahanan terhadap G. boninense 33
12 Pengaruh metode modifikasi kultur G. boninense terhadap kalus
embriogenik kelapa sawit selama 2 bulan 35
13 Pola penambahan biomas miselium G. boninense pada setiap waktu
panen filtrat 37
14 Pola perubahan derajat kemasaman media tumbuh G. boninense 38 15 Embrio somatik pada kalus terseleksi pada siklus seleksi keempat 44 16 Inisiasi embrio somatik serta tahapan perkembangan proembrio yang
berasal dari kalus terseleksi pada siklus seleksi pertama 45 17 Berkas jaringan proembrio pada irisan tipis jaringan kalus embriogenik
kelapa sawit 45
18 Germinasi embrio menjadi tunas in vitro hasil seleksi pada konsentrasi
32% (v/v) disiklus ke IV 46
20 Kalus terseleksi dan kontrol setelah 3 hari inkubasi untuk uji biokimia aktivitas enzim peroksidase, PAL dan kitinase 48 21 Alur kerja evaluasi pengaruh fitotoksin filtrat G. boninense terhadap
kalus kelapa sawit 56
22 Penampakan makroskopis jaringan sel clump kalus kelapa sawit 57 23 Penampakan makroskopis clump kalus kelapa sawit yang mengalami
perubahan warna cokelat selama 2 bulan 57
24 Penampakan irisan tipis transversal jaringan kalus kelapa sawit 59 25 Penampakan transversal irisan tipis jaringan kalus kelapa sawit yang
menunjukkan nekrosis 60
26 Embrio somatik pada kalus terseleksi pada siklus seleksi I 61 27 Irisan tipis jaringan sel kalus kelapa sawit terpapar filtrat G. boninense 62 28 Kromatogram asam organik dalam filtrat G. boninense 63 29 Pola kandungan asam organik dalam filtrat pada waktu panen filtrat 64 30 Pola kandungan total protein dalam filtrat pada waktu panen filtrat 65 31 Kromatogram ergosterol pada pengukuran kultur filtrat G. boninense 66
32 Model regresi linier pengaruh filtrat 68
33 Model regresi linier pengaruh asam oksalat 69
34 Model analisis lintas 71
35 Mikrograf elektron penampang kalus embriogenik kelapa sawit 72
DAFTAR LAMPIRAN
1 Sidik ragam diameter zona reaksi isolat pada media ATT 92 2 Sidik ragam diameter koloni isolat pada media ATT 92
3 Sidik ragam indeks isolat pada media ATT 92
4 Skor intensitas warna pada zona reaksi oksidasi di media ATT 92 5 Sidik ragam diameter zona reaksi isolat pada media ABTS 92 6 Sidik ragam diameter miselium isolat pada media ABTS 93
7 Sidik ragam indeks isolat pada media ABTS 93
8 Skor intensitas warna pada zona reaksi oksidasi di media ABTS 93 9 Sidik ragam laju pertumbuhan miselium pada media ATT 93 10 Sidik ragam laju pertumbuhan miselium pada media ABTS 93 11 Sidik ragam laju pertumbuhan miselium pada media MEA 94 12 Analisis cluster berdasarkan sebelas karakter fisiologis 94 13 Sidik ragam penurunan jumlah kalus hidup pada metode modifikasi
patogen 94
14 Sidik ragam penurunan berat basah kalus pada metode modifikasi
patogen 94
17 Sidik ragam regresi rasio kalus hidup pada penentuan konsentrasi letal 95 18 Sidik ragam penurunan jumlah kalus hidup pada penentuan konsentrasi 95 19 Sidik ragam penurunan selisih berat basah kalus pada penentuan
konsentrasi subletal melalui empat siklus penapisan 96 20 Sidik ragam pengaruh media dan asal kalus serta interaksinya terhadap
aktivitas enzim peroksidase 96
21 Sidik ragam pengaruh media dan asal kalus serta interaksinya terhadap
aktivitas enzim fenilalanina amonia liase 96
22 Sidik ragam pengaruh media dan asal kalus serta interaksinya terhadap
aktivitas enzim kitinase 97
23 Larutan seri Jonsen dan lama waktu perendaman pada tahap fiksasi
spesimen 97
24 Larutan pewarnaan, tahap perendaman dan lama perendaman pada tahap
pewarnaan spesimen 97
25 Model regresi peubah aktivitas enzim fenilalanina amonia liase standar
enzim Rhodotorula glutinis 98
26 Model regresi peubah aktivitas enzim peroksidase standar enzim Horse
radish peroksidase 98
28 Model regresi peubah aktivitas enzim β-N-Acetyl glucosaminidase
standar enzim Canavalia ensiformis 99
27 Kandungan asam α-ketoglutarat dari media YMB 99
29 Kandungan asam sitra dari media YMB 99
30 Kandungan asam malat dari media YMB 100
31 Kandungan asam oksalat dari media YMB 100
32 Kandungan ergosterol dari media YMB 100
33 Kandungan protein total dari media YMB 100
34 Kandungan polisakarida total dari media YMB 101 35 Statistika diskriptif peubah eksogenus dan endogenus pada analisis
lintas 101
36 Korelasi Pearson antar peubah eksogenus dan endogenus pada analisis
lintas 101
37 Sidik ragam regresi kebocoraan elektrolit 102
38 Nilai b peubah eksogenus terhadap peubah kebocoran elektrolit kalus
pada analisis lintas 102
39 Validasi metode analisis kandungan polisakarida total menggunakan
standar β-glukan 102
40 Validasi metode analisis kandungan asam α-ketoglutarat, sitrat, malat
dan oksalat 103
41 Validasi metode analisis kandungan ergostrol menggunakan standar
ergosterol 104
42 Validasi metode analisis kandungan protein total menggunakan standar
PENDAHULUAN
Latar Belakang
Penyakit busuk pangkal batang (BPB) merupakan penyakit yang sangat penting pada perkebunan kelapa sawit di Asia Tenggara, khususnya Malaysia dan Indonesia. Cendawan Ganoderma boninense Pat. diketahui sebagai penyebab umum penyakit BPB pada kelapa sawit. Pada tahun 1931, penyakit ini untuk pertama kali dilaporkan oleh Thompson menyerang tanaman kelapa sawit di Malaysia dan Indonesia. Pada awalnya, G. boninense dianggap menyerang tanaman kelapa sawit yang sudah tua, namun diketahui dapat menyerang tanaman yang masih muda. Ariffin et al. (1989) melaporkan bahwa tanaman kelapa sawit berumur 1 tahun dapat diinfeksi oleh G. boninense.
Zakaria et al. (2005) melaporkan bahwa penyakit BPB memperpendek umur produktif tanaman kelapa sawit, serta mengakibatkan kehilangan hasil secara ekonomi. Kerugian ekonomi akibat penyakit BPB antara lain menurunnya hasil panen tandan buah segar (TBS) dan kematian tanaman. Menurut Roslan dan Idris (2011) kehilangan hasil TBS kelapa sawit dapat mencapai 0.2 sampai 24.0%, terhitung sejak tanaman berumur 10 sampai 22 tahun.
Kejadian penyakit BPB di Indonesia dilaporkan dapat mencapai 80% di beberapa perkebunan yang telah lama berproduksi (Susanto dan Sudharto 2003). Susanto (2002) melaporkan bahwa kejadian penyakit akan meningkat seiring dengan replanting tanaman, saat replanting ke empat dapat mencapai 11%. Kejadian penyakit BPB meningkat pada tanaman yang telah berumur lebih dari 16 tahun dapat mencapai 13% sampai 87% (Virdiana et al. 2011).
Penyakit BPB sukar dikendalikan, hal itu disebabkan oleh cara hidup cendawan G. boninense dan sifat infeksinya. Sebagai cendawan saprofit fakultatif yang bersifat nekrotropik, G. boninense mampu hidup pada jaringan mati tanaman di tanah serta dapat menginfeksi jaringan hidup inangnya. Kisaran inang yang luas serta mempunyai keragaman genetik mating yang tinggi memberikan peluang G. boninense bertahan dalam kondisi lingkungan yang berubah. Bentuk miselium resisten, basidiospora dan struktur klamidospora pada G. boninense dapat meningkatkan ketahanannya dalam kondisi cekaman.
Proses infeksi yang lambat, menyebabkan gejala eksternal berbeda dengan gejala internal. Hal tersebut menimbulkan kesulitan dalam mendeteksi gejala penyakit saat awal infeksinya. Usaha pengendalian penyakit yang dilakukan pada saat gejala terlihat umumnya sudah terlambat karena perkembangan penyakit telah mencapai 60% sampai 70% (Shamala et al. 2006).
2
hasilnya masih belum memuaskan oleh karena efektifitas metode dan biaya yang cukup besar dalam aplikasinya.
Penggunaan bahan tanaman kelapa sawit tahan terhadap penyakit BPB merupakan pengendalian yang lebih efektif dan efisien dalam jangka panjang. Beberapa persilangan telah dilakukan untuk mendapatkan genotipe tahan terhadap penyakit BPB, namun belum mendapatkan hasil yang diharapkan. Beberapa genotipe kelapa sawit Tenera yang berasal dari Afrika terindikasi lebih tahan terhadap penyakit BPB yang menunjukkan gejala penyakit lebih lambat daripada Dura Deli (Idris et al. 2004). Laporan tersebut menunjukkan keragaman genetik untuk sifat tahan terhadap penyakit BPB masih terbatas.
Keragaman genetik yang sempit merupakan salah satu faktor penghambat keberhasilan program pemuliaan kelapa sawit untuk ketahanan terhadap penyakit BPB. Sifat ketahanan terhadap penyakit biasanya melibatkan banyak gen minor, sehingga program pemuliaan memerlukan sumber gen-gen ketahanan baru. Pendekatan lain perlu dilakukan untuk mendapatkan sumber gen baru sehingga diharapkan program pemuliaan menjadi relatif singkat, murah dan mudah namun sifat tahan yang diperoleh dapat stabil ekpresinya secara genetik.
Kultur jaringan kelapa sawit dapat menjadi salah satu sumber keragaman genetik yang potensial untuk dimanfaatkan dalam program pemuliaan tanaman kelapa sawit. Proses selama tahap kultur jaringan dapat menginduksi perubahan salinan genetik pada jaringan eksplan yang diinduksi oleh kondisi in vitro. Menurut Larkin dan Scrowcrot (1981) keragaman genetik yang terinduksi melalui proses kultur jaringan disebut variasi somaklonal.
Ho dan Tan (1990) melaporkan bahwa tanaman hasil kultur jaringan kelapa sawit menunjukkan fenomena variasi somaklonal yang disebut buah mantel. Ong-Abdullah et al. (2005) melaporkan bahawa terdapat beberapa perubahan fenotipe pada vegetatif tanaman klonal kelapa sawit seperti daun erek, daun kimera dan beberapa perubahan bentuk yang lain. Walaupun perubahan tersebut cenderung bersifat negatif, potensi variasi somaklonal kelapa sawit yang bersifat positif masih belum banyak diketahui sehingga perlu diekplorasi untuk mendapatkan manfaat.
Teknik seleksi in vitro berpotensi menjadi solusi untuk mendapatkan genotipe kelapa sawit tahan penyakit BPB melalui pemanfaatan variasi somaklonal. Teknik ini telah berhasil dimanfaatkan untuk mendapatkan galur-galur yang toleran terhadap tekanan faktor biotik maupun abiotik (Svabova dan Lebeda 2005; Rai et al. 2011). Keberhasilan teknik seleksi in vitro pada tanaman tahunan telah banyak dilaporkan. Sebagai contoh pada Eucalyptus marginata tahan terhadap Phytophthora cinnamomi (Cahill et al. 1992), tanaman Coffea arabica tahan terhadap Colletotrichum kahawae (Nyange et al. 1997) dan tanaman Malus domestica tahan terhadap Phytophthora cactorum (Mezzetti et al. 1992).
3 menunjukkan bahwa teknik seleksi in vitro dapat menginduksi peningkatan ekspresi patogenesis-related proteins (PR), peptida antifungi atau biosintesis fitoaleksin.
Beberapa prinsip dasar yang perlu dipenuhi dalam aplikasi teknik seleksi in vitro pada tanaman, meliputi perbanyakan tanaman secara in vitro melalui somatik embriogenesis tidak langsung. Kultur in vitro tanaman dapat berupa kultur suspensi sel, kalus, bahkan tunas in vitro. Proses perbanyakan klonal kelapa sawit jalur somatik embriogenesis tidak langsung memerlukan waktu yang cukup lama dan melalui sub kultur berulang. Kondisi tersebut diperkirakan dapat meningkatkan kejadian mutasi sehingga menimbulkan keragaman genetik. Selain itu, keragaman genetik dapat berasal dari sumber jaringan eksplan yang digunakan dalam perbanyakan, disebut pre-existing (Skirvin et al. 1994).
Teknik seleksi in vitro membutuhkan protokol perbanyakan klonal tanaman secara lengkap dan terbakukan. Hal tersebut berkaitan dengan tujuan akhir dari teknik ini, yaitu menapis sel mutan yang diinginkan dan meregenerasi sel mutan tersebut menjadi tanaman lengkap. Sejauh ini telah tersedia protokol dalam proses perbanyakan tanaman kelapa sawit unggul (Wong et al. 1997). Adanya protokol tersebut membuat potensi pemanfaatan kultur jaringan kelapa sawit untuk pengembangan teknik seleksi in vitro semakin terbuka.
Seleksi in vitro memerlukan suatu agen seleksi. Agen seleksi merupakan faktor yang terlibat secara langsung dalam proses cekaman pada tanaman secara fisiologis. Agen seleksi untuk ketahanan terhadap penyakit tanaman dapat menggunakan kultur filtrat patogen, senyawa patotoksinnya atau dengan isolat patogennya (Svabova dan Labeda 2005). Agen seleksi yang sesuai pada G. boninense merupakan permasalahan penting dalam pengembangan teknik seleksi in vitro kelapa sawit untuk ketahanan terhadap penyakit BPB. Dharmaputra et al. (1990) melaporkan bahwa filtrat G. boninense memiliki potensi digunakan dalam mempelajari respons sel kelapa sawit terhadap G. boninense.
Menurut Paterson (2007) G. boninense termasuk dalam kelompok cendawan busuk putih (white rot) yang aktif mensekresikan enzim-enzim lignolitik, pendegradasi komponen lignin dinding sel tanaman. Elissetche et al. (2006) melaporkan bahawa terdapat akumulasi asam oksalat pada media tumbuh G. australe. Kultur cair G. lucidum dilaporkan juga mengandung berbagai macam senyawa metabolit seperti kelompok terpenoid dan polisakarida (Zhu et al. 2009). Kehadiran senyawa-senyawa tersebut dalam media tumbuh cendawan menunjukkan penggunaan fitrat G. boninense berpotensi sebagai agen seleksi dalam memilih somaklon yang memiliki tingkat ketahanan tertentu dari kultur in vitro kelapa sawit.
Tujuan Penelitian
4
Manfaat Penelitian
Manfaat hasil penelitian adalah dapat digunakan sebagai rujukan teknis tahap awal penerapan teknik seleksi in vitro pada tanaman tahunan khususnya untuk ketahanan terhadap penyakit Busuk Pangkal Batang yang disebabkan oleh kelompok cendawan busuk putih.
Ruang Lingkup Penelitian
Penelitian ini mencakup tiga bagian, yaitu metode seleksi untuk mendapatkan isolat virulen G. boninense, beberapa seri percobaan penetapan kondisi optimal agen seleksi pada G. boninense hingga diperoleh tunas in vitro kelapa sawit, dan menduga jenis senyawa yang terkandung dalam filtrat G. boninense dalam hubungannya sebagai agen seleksi terhadap kalus kelapa sawit.
Bagan Alir Kegiatan Penelitian
I.Evaluasi Virulensi Isolat Ganoderma boninense Pat.
Tujuan : Mendapatkan isolat Ganoderma boninense Pat. yang memiliki tingkat virulensi tertinggi berdasarkan karakter fisiologisnya
Output : Isolat Ganoderma boninense Pat. dengan ciri virulensi tertinggi
II. Optimasi Teknik Seleksi Ketahanan Kalus Embriogenik Kelapa Sawit terhadap Ganoderma boninense Pat. Secara In vitro
Tujuan : Menetapkan kondisi optimal teknik seleksi ketahanan kultur kalus kelapa sawit terhadap Ganoderma boninense Pat.
Output : Kondisi optimal teknik seleksi in vitro ketahanan kultur kelapa sawit terhadap Ganoderma boninense Pat dan peubah ketahanan nya.
III. Analisis Kandungan Senyawa Aktif Dalam Filtrat dan Respons Kalus Kelapa Sawit pada Uji Toksisitas Filtrat Ganoderma boninense Pat.
Tujuan : Menetapkan senyawa aktif dalam kultur filtrat Ganoderma boninense Pat. penyebab nekrosis sel kalus kelapa sawit
5
TINJAUAN PUSTAKA
Variasi Somaklonal pada Kultur Jaringan Kelapa Sawit
Perbanyakan kelapa sawit secara in vitro dapat dikatakan sukses, namun terdapat aspek negatif berupa abnormalitas tanaman di lapang (Ho et al. 2008). Ong-Abdullah et al. (2005) melaporkan beberapa tipe keragaman somaklonal pada organ vegetatif maupun reproduktif tanaman klonal kelapa sawit. Keragaman organ vegentatif antara lain daun erek, daun kimera dan struktur bunga berubah menjadi daun. Pada bagian reproduktif dilaporkan ditemukan tanaman jantan, bunga androgenous, dan buah mantel.
Secara intensif keragaman somaklonal telah banyak diamati pada tanaman monokotil kurma (Phoenix dactylifera L.). Al Kaabi et al. (2005) melaporkan sedikitnya ada tujuh keragaman morphologi yang teramati pada tanaman klonal kurma di antaranya pertumbuhan bushiness (0.1%–1.4%), daun kimera (0.02%), kerdil (0.4 - 30%), daun putih kehilangan hijau daun (0.06%), deformasi tunas (0.05%), pembungaan terlambat (abnormalitas organ reproduktif 50%), buah mantel (80 – 100%).
Beberapa faktor yang diduga menjadi penyebab variasi somaklonal pada tanaman hasil kultur jaringan kelapa sawit adalah :
Genotipe Sumber Bahan Tanam (Ortet)
Perbanyakan klonal kelapa sawit umumnya melalui metode somatik embriogenesis tidak langsung. Metode ini dikerjakan melalui beberapa tahap yaitu induksi eksplan menjadi kalus, kalus membentuk embroid dan embroid menjadi ramet. Perbanyakan klonal kelapa sawit dianggap kurang efisien dalam skala komersial karena hanya sekitar 50% hingga 80% ortet yang dapat menghasilkan ramet (Soh et al. 2011). Menurut Soh et al. (2011) kemampuan kalogenesis eksplan daun kelapa sawit rata-rata sekitar 15% dan hanya 25% ortet yang menghasilkan embroid dengan poliferasi embroid kurang dari 5%.
Ginting dan Fatmawati (1995) melaporkan kemampuan kalogenesis bahan ortet berbeda-beda berdasarkan originnya. Kalogenesis bahan ortet asal Yangambi, Avros, Dumpy Avros dan Cameroon diperkirakan sekitar 20%, asal Avros, Lame sekitar 16%, sedangkan asal Nifor sekitar 11%. Walau demikian, Syed Alwee et al. (2010) melaporkan bahwa bahan ortet asal Lame menunjukkan paling berhasil dalam perbanyakan klonal dibandingkan dengan origin lainnya. Sanputawong dan Te-chato (2008) melaporkan bahwa perbedan kalogenesis dan embriogenesis kelapa sawit akibat pengaruh genotipe berdasarkan pada 16 persilangan Dura x Pisifera.
Sumber Jaringan Eksplan
6
muda memberikan keuntungan dalam jumlah eksplan yang diperoleh lebih banyak, ukuran lebih seragam serta mudah dalam sterilisasinya.
Eksplan asal bunga telah digunakan di beberapa laboratorium. Eksplan bunga diambil dari bagian bunga muda dengan seludang belum terbuka dan dipotong kecil sekitar 2 sampai 4 mm lalu dikulturkan (Vovola dan Lord 2004). Vovola dan Lord (2004) menemukan bahwa penggunaan eksplan bunga mampu menginduksi abnormalitas morfogenesis sel kalus menjadi tunas.
Media Kultur
Komposisi media dasar in vitro pada banyak tanaman sangat berpengaruh terhadap keberhasilan perbanyakan demikian juga pada kelapa sawit. Media dasar kultur jaringan tanaman umumnya mengandung hara mineral antara lain N, P, K, Ca, Mg, S, Fe, B, Mn, Cu, Zn dan Mo. Media dasar Murashige dan Skoog (MS) banyak digunakan dalam perbanyakan in vitro kelapa sawit dengan beberapa modifikasi (Wooi 1993).
Beberapa penelitian menggunakan media dasar lain, diantaranya media Eeuwens (Y3), Broun & Wood dan N6
Zat pengatur tumbuh merupakan salah satu bahan esensial dalam sistem regenerasi in vitro berbagai tanaman. Jenis dan komposisinya pada media in vitro dapat mendorong arah perkembangan suatu eksplan ke jalur organogenesis atau
dengan modifikasi tertentu (Sogeke at al. 1999; Muniran et al. 2008; Kramut dan Te-chato 2010). Hasil penelitian Sogeke (1996) menunjukkan bahwa media Y3 menghasilkan regenerasi kalus dan embrio somatik yang lebih baik dibandingkan dengan media lainnya. Al-Khayri (2011) melaporkan adanya perbedaan media dasar untuk setiap tahap perkembangan kultur tanaman.
Eksplan dalam kondisi in vitro, belum mampu menghasilkan fotosintat sehingga perlu ditambahkan gula sebagai sumber karbon utama untuk pertumbuhan dan perkembangannya. Selain sebagai sumber karbon, gula juga berfungsi sebagai pengatur tekanan osmotik dalam media (George dan Sherington 1984). Sukrosa digunakan lebih sering dalam perbanyakan in vitro kelapa sawit pada konsentrasi 1% hingga 3% (b/v) (Wooi 1993). Gula diantaranya glukosa, fruktosa, sorbitol dan manitol juga ditambahkan dalam skala percobaan. Gula sukrosa pada media in vitro kelapa sawit menunjukkan lebih baik daripada jenis gula lainnya (Hilae dan Te-chato 2005).
Senyawa organik lain juga ditambahkan pada beberapa media in vitro kelapa sawit seperti myo inositol, vitamin seperti niasin, tiamin (B1), piridoksin (B6) dan glisin (Muniran et al. 2008). Penambahan vitamin diharapkan dapat memperbaiki proses enzimatik pada jaringan kultur tanaman (George dan Sherington 1984). Senyawa kompleks yang lain juga digunakan, diantaranya kasein hidrolisat dan air kelapa. Penambahan senyawa tersebut dengan tujuan memperbaiki pertumbuhan kultur (Wooi 1993). Asam amino seperti glutamin, arginin dan asparagin terutama pada media dasar Euweans digunakan sebagai salah satu sumber nitrogen organik (Muniran et al. 2008). Agar-agar digunakan sebagai bahan pemadat pada media kultur jaringan kelapa sawit. Pada fase perkembangan tertentu penggunaan pitagel memberikan pengaruh lebih baik dari pada jenis pemadat lainnya (Wong et al. 1997).
7 embriogenesis (George dan Sherington 1984). Efektivitas kalogenesis dan embriogenesis jaringan eksplan kelapa sawit salah satunya dipengaruhi oleh jenis dan komposisi zat pengatur tumbuh yang digunakan. Golongan auksin yang umum digunakan adalah 1-Naphthaleneacetic acid (NAA), 2.4-Dichlorophenoxyacetic acid (2.4-D), Indole-3-butyric acid (IBA), 3.6- dichloro-2-methoxybenzoic acid (Decamba) dan pikloram (Wong et al. 1997; Kramut dan Te-Chato 2010).
Media cair kultur kelapa sawit dapat menggunakan hormon golongan sitokinin seperti N6
Tipe Kalus
-(2-Isopentenyl) adenine (2-IP), 6-benzyladenine (BA) dan kinetin (Paranjothy et al. 1989; Aberlenc-Bertossi et al. 1999; Te-Chato et al. 2008). Asam giberelat (GA) juga digunakan dalam regenerasi in vitro kelapa sawit yang berperan dalam induksi pemanjangan jaringan (Suranthran et al. 2011). Namun penggunaan sitokinin cenderung dihindari pada perbanyakan klonal kelapa sawit, karena diduga dapat menyebabkan abnormalitas organ generatif maupun vegetatif (Paranjothy et al. 1989; Inpeuy et al. 2011).
Periode Perbanyakan In vitro
Tahap perkembangan eksplan daun kelapa sawit meliputi tahap induksi kalus, diferensiasi dan perkembangan kalus, pembentukan embroid, pendewasaan dan perkecambahan embrio. Wong et al. (1997) melaporkan waktu yang dibutuhkan untuk keselurahan tahapan perbanyakan klonal kelapa sawit antara 9 - 52 bulan (Gambar 1). Periode waktu perbanyakan dapat dikurangi menjadi 29 bulan yaitu melalui pemilihan ortet dilapang dan perbaikan protokol in vitro (Soh et al. 2011).
Menurut Besse et al. (1992) terdapat dua tipe kalus yaitu kalus fast growing callus (FGC) dan nodular compact callus (NCC). Dua tipe kalus tersebut memiliki morfologi dan fisiologi yang berbeda, namun mempunyai kemampuan Gambar 1 Sistem regenerasi in vitro eksplan daun kelapa sawit melalui
embriogenesis tidak langsung (Wong et al. 1997) Induksi kalus (1 – 15 bulan)
Diferensiasi (1 - 12 bulan)
Proliferasi dan perkecambahan (6 – 10 bulan)
Induksi akar dan perkembangan (1 – 15 bulan)
Eksplan Daun
Kalus
Embrioid
Tunas
8
embriogenesis yang hampir sama. Kalus FGC dapat muncul dari jenis kalus NCC. Hal ini berhubungan dengan umur kalus dan waktu subkultur yang lama.
Ramet kelapa sawit yang dihasilkan dari kalus FGC menunjukkan fenomena buah mantel lebih tinggi daripada asal kalus NCC (Jaligot et al. 2000). Menurut Paranjothy et al. (1993) abnormalitas buah dilapang berhubungan dengan frekuensi subkultur yang tinggi serta umur kalus. Basse et al. (1992) melaporkan sitokinin endogen lebih rendah pada kalus tipe FGC dibandingkan dengan tipe kalus NCC. Namun auksin tidak berbeda nyata antara tipe FGC dengan kalus tipe NCC.
Kalus jenis FGC biasanya muncul secara spontan dengan frekuensi yang rendah di area tertentu pada kultur kalus. Kalus FGC menunjukkan berwarna putih lembut dan friabel. Kalus tipe ini mempunyai sel bervakuola dan volume vakuola bertambah besar pada sel turunannya serta tidak terlihat senyawa fenol. Bertambahnya waktu subkultur menyebabkan peningkatan pembesaran vakuola sel dan berat basah kalus jenis ini (Besse et al. 1992).
Keseimbangan eksogen antara auksin dan sitokinin pada media dapat menstimulasi pembentukan kalus FGC atau jenis NCC secara acak. Morfologi kalus yang akan terbentuk sangat dipengaruhi oleh jenis eksplan dan keragaman kondisi lingkungan ortet. Kondisi itu menginduksi perbedaan konsentrasi auksin dan sitokinin endogen eksplan.
Laporan Muniran et al. (2008) menunjukkan terdapat pengaruh komposisi media kultur terhadap perbedaan kalogenesis dan embriogenesis kelapa sawit. Inpeuy et al. (2011) menghasilkan ramet kelapa sawit abnormal pada media kultur yang mengandung air kelapa dan sitokinin. Hal tersebut menunjukkan ketidak-seimbangan hara nutrisi pada media kultur jaringan dapat menginduksi kondisi abnormal pada regeneran, yang menunjukkan plastisitas fenotipe tanaman terhadap cekaman lingkungan (Brautigam et al. 2013).
Patogenesitas G. boninense pada Tanaman Kelapa Sawit
Proses Infeksi G. boninense pada Tanaman
Cendawan G. boninense dikenal secara umum sebagai patogen penyebab penyakit busuk pangkal batang (BPB) pada kelapa sawit. Dua spesies Ganoderma yang lain diketahui juga bersifat patogenik pada kelapa sawit yaitu G. zonatum and G. miniatocinctum (Idris et al. 2001). Ganoderma merupakan organisme pendegradasi lignin yang efesien sehingga digolongkan sebagai cendawan busuk putih (White Rot).
Cendawan Ganoderma hidup sebagai saprofit dengan mengkolonisasi kayu mati untuk bertahan hidup ketika inang tidak ditemukan (Eriksson et al. 1990). Cendawan G. bonisnense secara umum bersifat parasit fakultatif oleh karena beraktivitas parasit, tetapi tidak seutuhnya mengandalkan pada inangnya untuk menyelesaikan siklus hidupnya (Khairudin 1993).
9 tumbuh sepanjang akar terinfeksi menuju bagian pangkal batang melalui jaringan pembuluh (Arrifin et al. 1991). Hasil pengamatan mikroskopis miselium terlihat ditemukan pada jaringan korteks, endodermis, xilem, floem dan sel parenkima (Rees et al. 2009).
Rees et al. (2009) menyatakan bahwa cendawan G. boninense bersifat hemibiotropi. Massa miselium dalam jumlah cukup dibutuhkan untuk dapat menyebabkan gejala penyakit. Cendawan G. boninense memerlukan energi untuk dapat menginfeksi jaringan akar sel inang. Kontak yang baik antara miselium dengan akar diperlukan untuk dapat berpenetrasi langsung ke dalam jaringan epidermis akar.
Miselium dalam jaringan epidermis akar berkembang mengkolonisasi jaringan akar secara cepat. Keadaan tersebut menunjukkan perubahan tipikal dari nekrotropi. Tahap nekrotropi tersebut dapat terlihat pada jaringan pangkal batang kelapa sawit berupa perubahan warna kuning kecokelat sampai hitam.
Proses penetrasi dan kolonisasi cendawan umumnya memerlukan kerja enzim pendegradasi jaringan tanaman di antaranya adalah pektinase, selulase, hemiselulase dan ligninase. Cendawan busuk putih memiliki kemampuan mendegradasi komponen lignin kayu lebih dominan daripada mendegradasi selulosa atau hemiselulosa. Namun, pada G. boninense degradasi selulosa dan lignin dilakukan hampir bersamaan, kondisi tersebut merupakan ciri dari pelapuk kayu yang bertipe simultan (Rees et al. 2009).
Produk Enzim Ganoderma Sp. dalam Aktivitas Infeksi
Cendawan G. boninense memiliki kemampuan menghidrolisis pati dengan cepat pada jaringan parenkima bagian batang bawah kelapa sawit (Rees et al. 2009; Cooper et al. 2011). Hidrolisis pati pada sel parenkim umumnya menggunakan enzim glukosidase diubah menjadi Asetil-CoA yang diperlukan dalam metabolisme sel cendawan.
Enzim ekstraseluler lignolitik yang utama pendegradasi lignin adalah lignin peroksidase (LiP), manganase peroksidase (MnP) dan lakase (Hatakka 2001). Sejauh ini enzim pendegradasi lignin diketahui ekstraseluler dan non spesifik, berperan dalam reaksi oksidatif yang berbeda pada struktur aromatik lignin dan pemutusan ikatan antara unit dasar (Eriksson et al. 1990, Kuhad et al. 1997).
Enzim lignin peroksidase merupakan peroksidase yang mengandung senyawa heme. Enzim LiP merupakan katalis oksidasi senyawa aromatik non fenolik. Reaksi ynag dihasilkan berupa radikal kation yang akan mendekomposisi komponen lignin pada kayu secara kimiawi (Conesa et al. 2002; Martinez 2002). Pada kebanyakan golongan cendawan busuk putih enzim lignolitik yang paling banyak adalah MnP dan lakase (Hatakka 2001).
Enzim Mn peroksidase (MnP) merupakan peroksidase yang mengandung heme yang dihasilkan oleh cendawan pendegradasi lignin. Enzim MnP mengoksidase senyawa fenolik menjadi radikal fenolik dengan oksidasi Mn (II) menjadi Mn (III) dengan H2O2 sebagai pengoksidasi. Mn (III) dikelat oleh asam
10
Enzim lakase merupakan oksidase multikoper fenol, senyawa fenol teroksidasi menjadi radikal fenolik. Lakase memiliki senyawa mediator di alam, yang membuat lakase mampu mengoksidasi gugus senyawa non fenolik (Eggert et al. 1996a). Senyawa mediator secara sintetis seperti ABTS [2,2’-azinobis (3-etilbenztazoline-6-sulfonate) ]. Lakase pertama kali diisolasi dari tanaman tetapi terdapat juga pada cendawan dan beberapa bakteri (Thurston 1994). Lakase pada cendawan berperan dalam proses degradasi lignin, sporulasi produksi pigmen, pembentukan badan buah dan patogenesitas (Thurston 1994, Mayer dan Staples 2002). Lakase merupakan enzim ekstraseluler lignolitik yang tersekresi saat awal infeksi ke sekeliling media cendawan.
Menurut Dashtban et al. (2010) degradasi lignoselulose pada kayu memerlukan kombinasi dari enzim lignolitik, asam organik, mediator dan enzim pendukung lainnya. Ekstraseluler enzim liknolitik bekerja melalui produksi radikal bebas hidroksil (.
Efektor
OH) yang akan mengubah struktur polimer fenol pada lignin menjadi fraksi senyawa yang lebih sederhana. Pemecahan lignin melalui kerja enzim lignolitik memerlukan bantuan mediator diantaranya asam oksalat, asam glioksilat, dan veratil alkohol. Senyawa mediator yang kecil memungkinkan untuk membawa radikal bebas masuk ke dalam dinding sel tanaman, sehingga menyebabkan komponen senyawa penyusun dinding sel menjadi tidak stabil dan akhirnya jaringan nekrosis.
Interaksi patogen-tanaman melibatkan sekresi protein dan molekul –molekul lain sehingga patogen mampu memodulasi rangkaian pertahanan tanaman dan memungkinkan kolonisasi jaringan tanaman (Hogenhout et al. 2009). Istilah efektor digunakkan untuk memahami fungsi molekul-molekul yang disekresikan patogen. Hal ini diterima secara luas sebagai konsep penting untuk pemahaman mekanisme proses kolonisasi jaringan tanaman oleh patogennya.
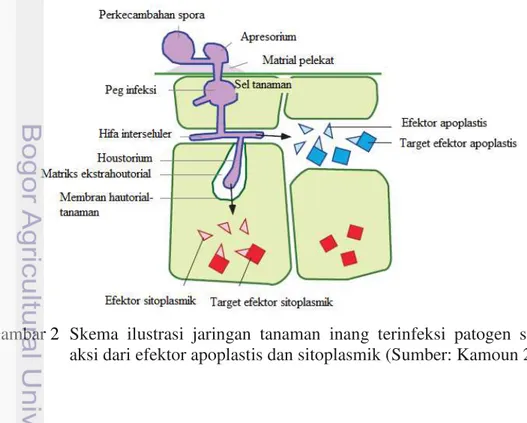
11 Menurut Kamoun (2006) molekul efektor dapat memanipulasi struktural dan fungsional sel tanaman inangnya dalam kesuksesan infeksi dan dapat juga menimbulkan respon pertahanan sel inang. Molekul efektor dapat berfungsi sebagai elisitor dan toksin. Selanjutnya molekul efektor dapat bekerja di daerah antar sel (Apoplastis) dan didalam sel (Sitoplasmik) seperti tersaji pada Gambar 2. Difinisi efektor menunjukkan lebih umum yang mengarah pada tujuan akhir yaitu suksesnya infeksi suatu patogen pada jaringan inangnya.
Tanaman memiliki strategi pertahanan dalam cakupan yang luas sebagai proses pertahanan terhadap serangan patogen. Pertahanan tanaman tersebut secara umum bersifat konstitutif dan sebagian bersifat terinduksi. Respons pertahanan terinduksi oleh pengenalan berbagai faktor kimia yang disebut elisitor (Vidhyasekaran 2008). Asal kata elisitor digunakan untuk mendifinisikan kemampuan suatu molekul menginduksi produksi fitoaleksin namun saat ini umumnya digunakan untuk senyawa yang menstimulasi berbagai tipe pertahanan tanaman (Montesano et al. 2003).
Elisitor merupakan molekul yang sangat stabil yang menginduksi respons imun pada tanaman, berberat molekul rendah dan disintesis atau dilepaskan dari prekursor polimerik selama infeksi. Elisitor dapat diklasifikasikan sebagai elisitor fisik dan kimiawi. Elisitor fisik dapat berupa radiasi sinar UV, radioaktif, cekaman suhu dan pelukaan (Radman et al. 2003). Elisitor kimiawi menurut asalnya dapat dibagi menjadi biogenik dan abiogenik. Elisitor abiogenik dapat berupa senyawa logam berat seperti kadnium, perak, europium dan lantanum. dapat juga merupakan inhibitor metabolisme seperti antibiotik, fungisida dan asam oksalat (Ozeretskovskaya dan Vasyukova 2002; Kim et al. 2008).
Elisitor biogenik dapat dikelompokkan menjadi elisitor endogen dan elisitor eksogen, elisitor endogen merupakan senyawa yang dilepaskan oleh tanaman dan elisitor eksogen dapat berasal dari patogen atau kultur filtrat (Bent dan Mackey 2007). Umumnya elisitor abiogenik diberikan dalam konsentrasi cukup tinggi sedangkan elisitor biogenik diberikan dalam konsentrasi rendah
Elisitor yang memiliki senyawa kimia kompleks dapat berupa fraksi dinding sel cendawan, dari miselium atau sporanya. Elisitor biogenik asal patogen dapat diklasifikasikan menjadi dua kelompok, yaitu elisitor umum dan elisitor spesifik ras. Elisitor umum merupakan elisitor asal patogen yang memicu respons pertahanan baik dari tanaman inang maupun bukan inang (Kruger et al. 2003; Vidhyasekaran 2004).
Elisitor spesifik ras menginduksi respons pertahanan terhadap penyakit hanya pada spesifik kultivar inang sehingga konsep Gene for Gene berlaku pada kasus ini (Bonas dan Lahaye 2002; Montesano et al. 2003). Elisitor spesifik ras dikodekan oleh gen avirulen (avr) patogen memunculkan resistensi hanya dalam varietas tanaman inang yang membawa gen R sesuai ketahanannya (Nimchuk et al. 2001; Nurnberger dan Scheel 2001).
12
EVALUASI ISOLAT
Ganoderma boninense
Pat. VIRULEN
Abstrak
Teknik seleksi in vitro menggunakan patogen Ganoderma boninense Pat. memerlukan isolat dengan tingkat virulensi tinggi. Karakter fisiologis dapat menjadi indikator virulensi G. boninense melalui uji media kromogenik. Tujuan penelitian ini adalah untuk mendapatkan isolat G. boninense Pat. yang memiliki tingkat virulensi tertinggi berdasarkan karakter fisiologisnya. Sepuluh isolat murni G. boninense berasal dari beberapa area perkebunan di Sumatera yang endemik penyakit busuk pangkal batang (BPB). Evaluasi virulensi dilakukan menggunakan media 2 % malt ekstrak agar (MEA), media MEA dengan penambahan 5% asam tanat (ATT) dan media MEA dengan penambahan 1mM asam 2,2’-azinobis ( 3-etilbenztazoline-6-sulfonate) (ABTS). Tingkat virulensi diukur berdasarkan beberapa peubah, meliputi: diameter koloni, diameter zona reaksi, indeks isolat dan laju tumbuh miselium. Berdasarkan karakter fisiologisnya dilakukan pengelompokan isolat uji menggunakan Cluster Analysis. Hasil menunjukkan bahwa isolat G3-11-U5 memiliki skor karakter fisiologis tertinggi. Sepuluh isolat uji terbagi dalam empat kelompok pada tingkat kemiripan fisiologis 61.77 %. Isolat G3-11-U5 membentuk satu kelompok tersendiri sehingga isolat tersebut dapat digunakan sebagai satu-satunya sumber agen seleksi.
Kata kunci: Asam tanat, Asam 2,2’-azinobis (3-etilbenztazoline-6-sulfonate), Media kromogenik, Seleksi isolat
Abstract
In vitro selection techniques using Ganoderma boninense Pat. isolate required with a high level of virulence. Physiological characteristics can be an indicator of G. boninense virulence through chromogenic media test. The purpose of this study was to obtain the G. boninense Pat. isolates highest level of virulence based on its physiology character. Ten pure isolates of G. boninense was collected from several endemic Basal Stem Rot (BSR) disease plantation areas in Sumatra. Virulence evaluation was performed using chromogenic medium, mycelium of each isolate was inoculated into the malt extract agar (MEA) medium, with the addition of 5% tannic acid (ATT) and with the addition of 1 mM 2,2 '-azinobis (3-etilbenztazoline-6-sulfonate) (ABTS) acid. Virulence level was measured by the qualitative variables; include colony diameter, reaction zone diameter, isolates index, and mycelia growth rate. Based on physiological characteristics of isolates, grouping test conducted using Cluster Analysis. The results showed that G3-11-U5 isolate has the highest level of virulence. Tenth isolates were divided into four groups of physiological character that has 61.77% similarity. The G3-11-U5 was formed as one independence group, so that isolate can be use as the only source as selection agent.
13 Pendahuluan
Patogen Ganoderma boninense Pat. penyebab penyakit busuk pangkal batang (BPB) pada kelapa sawit menunjukkan virulensi yang berbeda-beda. Famili Ganodermacea sedikitnya memiliki 250 spesies berdasarkan karakter makro dan mikro morfologinya (Ryvarden 1991). Beberapa spesies Ganoderma sp diketahui berhubungan dengan penyakit busuk pangkal batang pada kelapa sawit diantaranya : G. boninense, G. zonatum, G. miniatocinctum dan G. tornatum. Ganoderma boninense diketahui paling patogenik sedangkan G. tornatum dianggap tidak patogenik dan bersifat saprofit (Miller 1995; Idris 1999). Pilotti (2005) menyatakan bahwa G. zonatum dan G. miniatocinctum kurang patogenik terhadap kelapa sawit.
Senyawa agen seleksi umumnya berupa senyawa toksin yang tersekresi selama proses infeksi terjadi. Senyawa tersebut dapat berupa peptida toksin, enzim atau senyawa metabolit sekunder lainnya. Keragaman karakter fisiologis secara tidak langsung menunjukkan kemungkinan adanya keragaman genetik suatu patogen. Gafur (2003) menyatakan bahwa keragaman karakter fisiologi intraspesies mempengaruhi virulensi cendawan. Hasil penelitian Herliyana (2007) menunjukkan bahwa media kromogenik dapat membedakan karakter fisiologis beberapa isolat Pleurotus yang berhubungan dengan kemampuan mendegradasi kayu.
Jo et al. (2011) menggunakan media kromogenik sebagai indikator enzim-enzim yang terkait dengan faktor virulensi G. neojavanicum. Media kromogenik sering digunakan untuk mendeteksi isolat patogenik secara cepat, murah dan mudah. Pemilihan suatu isolat virulen cendawan busuk putih diduga dapat melalui pendekatan perbedaan karakter fisiologis dengan menggunakan media kromogenik. Pemilihan isolat dengan virulensi tinggi, dilakukan sebagai langkah awal untuk mendapatkan kondisi cekaman yang optimum pada pengembangan teknik seleksi in vitro yang diarahkan untuk ketahanan terhadap faktor biotik.
Tujuan Penelitian
Tujuan penelitian adalah untuk mendapatkan isolat Ganoderma boninense Pat. yang memiliki tingkat virulensi tertinggi berdasarkan karakter fisiologisnya.
Bahan dan Metode Isolat Patogen Ganoderma boninense Pat.
14
Media Peremajaan Isolat Ganoderma boninense Pat.
Isolat cendawan G. boninense ditumbuhkan terlebih dahulu pada media simpan Ganoderma. Media simpan G. boninense berupa serbuk kayu dengan penambahan glukosa 10%, ekstrak malt 10%, ekstrak yeast 1% (w/w) dan penambahan air 20% (w/v). Media serbuk dibuat sebanyak 100 g dengan mencampurkan semua bahan pada alat pencampur (blender) dengan penambahan 20 mL air destilata selama 5 menit dan diulang sebanyak tiga kali. Serbuk kayu berasal dari kayu mahoni yang diperoleh dari tempat penggergajian kayu, tanpa diketahui tempat asal kayu. Hasil campuran media serbuk ditimbang 15 g pada gelas kultur berdiameter 6.5 cm tinggi 13 cm (jam bottle).
Media serbuk pada gelas kultur disterilisasi dengan autoklaf suhu 121 ºC pada tekanan 15 psi selama 20 menit. Setelah sterilisasi, media serbuk dapat diinokulasi dengan inokulum G. boninense sebanyak satu pelubang gabus 5 mm setiap 5 g media serbuk. Media serbuk kayu dapat digunakan sebagai inokulum primer selama ± 3 bulan.
Evaluasi Laju Tumbuh pada Media Malt Extract Agar(MEA)
Percobaan dilakukan dari Mei 2012 sampai Juli 2012 di Laboratorium Microbiome Technology PT SMART. tbk Bogor. Rancangan percobaan digunakan adalah Rancangan Acak Lengkap (RAL) satu faktor, yaitu jenis isolat, terdiri dari sepuluh isolat diulang sebanyak tiga kali.
Pembuatan media MEA 2% dilakukan dengan mencampur 2% (w/v) malt ekstrak, 3% (w/v) agar komersial dan 1 L air destilata dengan pH disesuaikan menjadi 5.5. Larutan dipanaskan hingga merata dalam microwave dalam mode high selama 8 menit. Larutan kemudian diautoklaf pada tekanan 15 psi dan suhu 121 ºC selama 15 menit. Setelah agak dingin sebanyak 20 mL dituang dalam cawan Petri steril berdiameter 90 mm. Inokulasi isolat G. boninense dilakukan dengan menumbuhkan satu pelubang gabus diameter 0.5 mm, potongan koloni miselium masing-masing isolat G. boninense kemudian disimpan dalam inkubator pada suhu 30 ºC. Pengamatan dilakukan pada laju tumbuh miselium (LTM) =(DM6hari-DM3hari
Tabel 1 Isolat uji virulensi Ganoderma boninense berdasarkan daerah dan jenis tanah
)/3.
No Nama isolat Kode Asal kebun Jenis tanah
15 Evaluasi Produksi Polifenoloksidase pada Media Tanik(ATT)
Evaluasi pada media kromogenik dilakukan menurut teknik uji Bavendam bereaksi positif dengan mengunakan asam tanat (Nobels 1948). Rancangan percobaan menggunakan RAL satu faktor, jenis isolat terdiri dari 10 isolat yang diulang sebanyak lima kali.
Pembuatan media AAT dilakukan dengan melarutkan ekstrak malt 2% (w/v), agar komersial 3% (w/v), asam tanat 0.5% (w/v) dalam 1 L akua destilata dengan pH disesuaikan menjadi 5.5. Larutan dicampur merata dalam microwave dengan kondisi mode high selama 8 menit. Sterilisasi dilakukan dengan diautoklaf pada tekanan 15 psi suhu 121 ºC selama 15 menit. Larutan dituang dalam cawan Petri steril (diameter 90 mm) sekitar 20 mL. Inokulasi isolat Ganoderma dilakukan dengan menumbuhkan satu cork bore (diameter 0.5 mm) potongan koloni miselium dari masing-masing isolat Ganoderma dibagian tengah cawan Petri dan disimpan pada suhu 30 ºC pada inkubator.
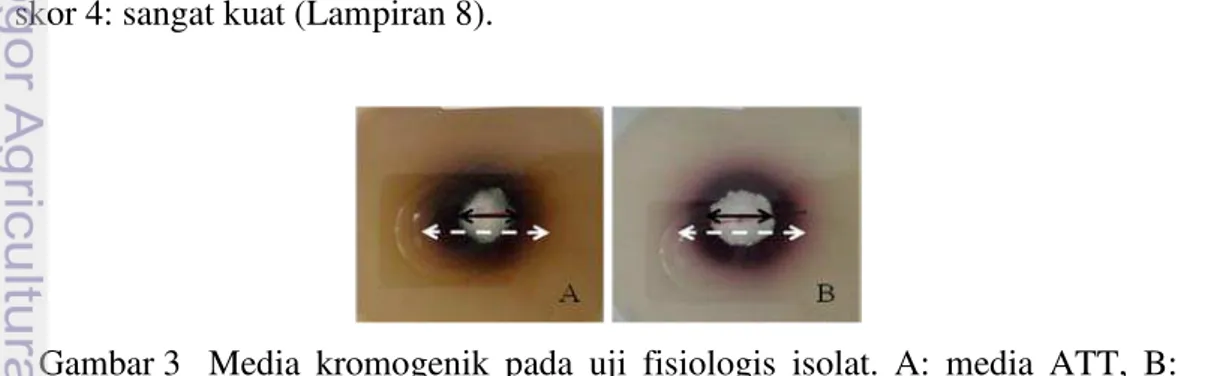
Pengamatan dilakukan pada 3 dan 6 hari setelah inokulasi (Gambar 3) terhadap laju tumbuh miselium (LTM), diameter zona reaksi (DZ), diameter miselium (DM), indeks isolat (IL)= (DZ6 hari/DM6hari) dan intensitas warna(IW)
dengan empat skor yaitu, : + skor 1 : sangat lemah, ++ skor 2 : lemah, +++ skor 3 : kuat dan ++++ skor 4: sangat kuat (Lampiran 4).
Evaluasi P roduksi E nzim L akase pada Media 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic) (ABTS)
Uji media kromogenik untuk deteksi enzim lakase yang dilakukan menurut (Pointing 1999). Percobaan dikerjakan dengan RAL satu faktor, jenis isolat yang terdiri dari 10 isolat G. boninense diinokulasikan pada media ABTS. Setiap perlakuan diulang sebanyak lima kali.
Komposisi media uji ABTS terdiri dari ekstrak malt 2% (w/v), agar komersial 3% (w/v), dan 1 mM asam 2,2-azino-bis (3-ethylbenzothiazoline -6-sulfonic) yang dicampurkan dalam aqua destilata 1 L. Cara pelarutan dan sterilisasi dikerjakan dengan cara yang sama pada pembuatan media ATT. Inokulasi isolat G. boninense dilakukan dengan menumbuhkan satu cork bore (diameter 0.5 mm) potongan koloni miselium dari masing-masing isolat G. boninense dan disimpan pada suhu 30 ºC pada inkubator.
Pengamatan dilakukan pada 3 dan 6 hari setelah inokulasi terhadap laju tumbuh miselium (LTM), diameter zona reaksi (DZ), diameter miselium (DM), indeks isolat (IL)= (DZ6 hari/DM6hari) dan intensitas warna(IW) dengan empat skor
yaitu, : + skor 1 : sangat lemah, ++ skor 2 : lemah, +++ skor 3 : kuat dan ++++ skor 4: sangat kuat (Lampiran 8).
16
Analisis Data
Analisis statistika digunakan untuk menduga isolat yang paling virulen dengan analisis ragam (Anova), apabila hasil analisis nyata dilanjutkan dengan uji Duncan. Pemilihan isolat virulen G. boninense dilakukan dengan seleksi berdasarkan pemenuhan kriteria uji. Isolat yang memiliki skor uji Duncan berkode “a” dan “ab” serta intensitas warna sangat kuat dan kuat yang terbanyak dipilih sebagai isolat paling virulen. Semua hasil dianalisis dengan program SAS. Analisis kelompok dilakukan untuk melihat tingkat kemiripan menurut metode Ward linkage, Euclidean distance menggunakan program Minitab 16. Alur kerja percobaan deteksi virulensi isolat G. boninense disajikan pada Gambar 4.
Gambar 4 Alur kerja percobaan deteksi isolat virulen G. boninense
Evaluasi LTM pada media MEA
Evaluasi Produksi Polifenoloksidase pada media ATT
Evaluasi Produksi Lakase pada Media ABTS Koleksi sepuluh isolat G. boninense Pat.
Karakter fisiologis isolat (LTM, DZ, DM, IL, IW)
Uji selang berganda
Duncan α : 5 %
Pemenuhan Kriteria Uji :
Terbaik, yaitu: skor “a: atau “ab” pada uji Duncan, dan skor intensitas warna kuat dan sangat kuat
Terbanyak, dari total 11 karakter uji
17 Hasil dan Pembahasan
Evaluasi Produksi Polifenoloksidase pada Media Tanik(ATT)
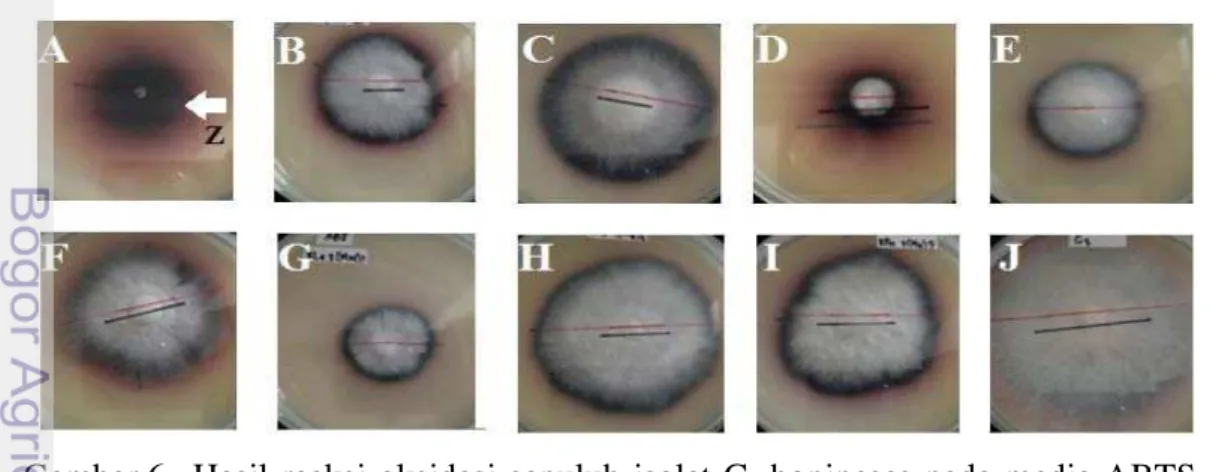
Hasil penelitian menunjukkan sembilan isolat dari sepuluh isolat yang diuji mempunyai reaksi positif pada media AAT. Reaksi oksidasi positif isolat pada media ATT ditandai dengan warna cokelat gelap di sekitar koloni (Gambar 5). Isolat B, C, F, G, I dan J menunjukkan warna cokelat yang sangat gelap. Isolat A menunjukkan warna cokelat tua kehitaman dan isolat D dan E menunjukkan warna cokelat tidak terlalu gelap. Isolat H, tidak menunjukkan reaksi warna. Warna cokelat akan terlihat dengan bertambahnya waktu dan setiap isolat memiliki kepekatan warna yang berbeda-beda.
Diameter zona reaksi pada media tanik tertinggi diperoleh dari isolat J (Tabel 2). Diameter koloni isolat B dan F menunjukkan tidak berbeda dengan isolat G dan J. Peubah indeks isolat pada media ATT tertinggi diperoleh dari isolat J dibandingkan dengan isolat lainnya. Hal tersebut menunjukkan setiap isolat memiliki karakter tertentu yang berbeda-beda. Perbedaan masing-masing karakter tersebut dapat berkaitan dengan interaksi lingkungan tumbuh dan genotipenya.
Warna cokelat yang terbentuk pada media ATT merupakan ciri golongan cendawan pelapuk putih. Media kromogenik pertama kali digunakan oleh Bavendamm pada tahun 1928 untuk karakterisasi fisiologi cendawan pelapuk putih. Ariwibowo (1996) menggunakan teknik yang sama untuk mendeteksi beberapa isolat Ganoderma sp. yang memiliki kemampuan lignolitik terbaik. Penggunaan media kromogenik saat lebih luas untuk mendeteksi dan seleksi mikroba tertentu (Tavocoli et al. 2008; Woo-Sik et al. 2011).
Intensitas warna berbeda antar isolat diduga berhubungan dengan akumulasi jumlah senyawa produk hasil reaksi oksidasi secara enzimatis oleh isolat G. boninense yang diuji. Semakin pekat warna pada media ATT menunjukkan semakin tinggi konsentrasi senyawa produk hasil oksidasi yang terbentuk. Saparrat et al. (2000) melaporkan bahwa isolat cendawan busuk putih diantaranya dari Ganoderma sp. menghasilkan enzim ekstraseluler, yaitu polifenoloksidase. Gambar 5 Reaksi oksidasi sepuluh isolat G. boninense menggunakan media
18
Diameter zona reaksi pada media ATT menunjukkan area reaksi oksidasi berlangsung. Rees et al. (2009) menyatakan bahwa zona reaksi juga ditemukan pada infeksi G. boninense pada jaringan tanaman kelapa sawit yang ditandai dengan area warna cokelat pada jaringan yang sakit. Zona reaksi oksidasi menyebar di sekitar koloni miselium, sehingga luas area zona reaksi pada jaringan terinfeksi menunjukkan keparahan penyakit. Area zona reaksi pada jaringan terinfeksi secara tidak langsung menunjukkan juga jaringan sel tanaman kelapa sawit yang mengalami nekrosis. Isolat yang memiliki zona reaksi yang besar dapat dikatakan lebih virulen daripada isolat dengan zona yang lebih kecil.
Kemampuan tumbuh isolat uji di media ATT dengan kandungan asam tanat menunjukkan secara tidak langsung sistem pertahanan isolat uji di lingkungan sub optimum. Seleksi isolat pada media ATT memberikan kondisi sub optimum untuk pertumbuhan isolat yang diuji, sehingga pertumbuhan koloni akan terhambat. Semua isolat yang diuji memperlihatkan pertumbuhan miseliumnya terhambat.
Asam tanat memiliki sifat racun terhadap hampir semua mikroorganisme, hanya sedikit mikroorganisme yang mampu menetralisir efek racunnya (Field dan Lettinga 1992). Asam tanat merupakan polifenol yang larut dalam air, bersifat anti mikrooganisme, menggumpalkan protein dan salah satu zat ekstraktif pada sel-sel kayu. Zat ekstraktif pada tanaman berkayu berfungsi sebagai zat pengawet alami yang melindungi tanaman dari mikroorganisme parasit (fitoantisipan). Ibrahim-Mohamad et al. (2005) melaporkan bahwa tanaman kelapa sawit mengandung 4.5% asam tanat.
Sifat racun asam tanat terletak pada gugus OH (pirogalol) dan galoil selain itu juga mempunyai sifat penghambatan racun (Staples dan Toenniessen 1981). Senyawa polifenol seperti asam tanat tersusun dari komponen gula dan asam galat yang akan terurai menjadi katekin dengan gugus dihidroksifenol. Selanjutnya membentuk kuinon yang berwarna coklat gelap saat teroksidasi (Kameda 2003). Sifat racun asam galat dapat menurun melalui oksidasi dengan enzim pengoksidasi oleh cendawan menjadi kuinon (Ikehata dan Nicell 2000). Persenyawaan komplek asam tanat akan diurai satu persatu menjadi persenyawaan Tabel 2 Pengaruh jenis isolat terhadap diameter zona reaksi, diameter miselium,
indeks isolat serta intensitas kepekatan warna pada media ATT
Kode isolat Zona reaksi Koloni Indeks ATTa Intensitas warna Diameter (mm)a
A 10.60bcd 5.00b 10.20bc +++ B 21.80b 10.60a 18.36bcd ++++ C 9.20bcd 5.00b 18.40bcd ++++ D 6.20cd 5.00b 12.40bcd ++ E 4.00cd 5.00b 8.00cd ++ F 18.00cb 9.40a 14.59bcd ++++ G 18.00cb 7.60ab 22.62bc ++ H 0.00d 5.00b 0.00d +
I 15.00cb 5.00b 30.00b ++++ J 35.75a 7.20ab 51.25a ++++
a
19 yang lebih sederhana dengan beberapa proses hidrolisis oleh enzim tanase (Beena 2010). Keberadaan enzim tanase pada isolat dapat mempercepat oksidasi polifenol.
Hasil percobaan menunjukkan isolat J memiliki indeks tanik yang paling tinggi. Indeks tanik merupakan rasio diameter zona reaksi oksidase dengan diameter koloni pada media ATT. Suatu isolat yang memiliki nilai rasio tinggi, dapat dikatakan dengan sedikit biomass, isolat tersebut mampu menghasilkan enzim dengan aktivitas tinggi. Arthiningsih (2006) menyatakan bahwa suatu jenis cendawan yang memiliki aktivitas enzim tinggi apabila cendawan tersebut memiliki diameter koloni yang relatif kecil, tetapi menghasilkan diameter zona reaksi yang relatif luas. Indeks tanik selain menggambarkan aktivitas enzim kualitatif, juga menggambarkan kapasitas suatu isolat memproduksi enzim ekstraseluler oksidase.
Evaluasi P roduksi E nzim L akase pada Media 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic) (ABTS)
Semua isolat G. boninense pada media ABTS menunjukkan bereaksi positif yang terlihat pada zona warna disekitar miselium. Kepekatan warna pada masing-masing isolat menunjukkan perbedaan, dengan rentang warna cokelat kemerahan sampai hijau kebiruan (Gambar 6). Isolat C, E, G, H dan J menghasilkan intensitas warna hijau biru. Isolat A, B, D, F dan I memberikan warna cokelat kemerahan. Peningkatan kepekatan warna dapat menunjukkan perbedaan karakter masing-masing isolat.
Isolat C menunjukkan diameter zona reaksi tertinggi, tetapi tidak berbeda nyata dengan isolat F, H, I, dan J (Tabel 3). Diameter zona reaksi pada semua isolat uji di media ABTS dan media ATT menunjukkan perbedaan. Diameter zona reaksi ABTS lebih besar daripada zona reaksi pada media ATT, hal tersebut menandakan media ABTS kurang beracun dibandingkan media ATT. isolat C, F dan J memiliki diameter tertinggi dibandingkan isolat lainnya. Isolat A dan D memiliki nilai indeks tertingg pada media ABTS.
20
Intensitas warna yang terbentuk disekitar isolat pada media ABTS merupakan salah satu karakteristik isolat cendawan pelapuk putih. Sapparat et al. (2000) menggunakan media ABTS untuk mengelompokkan isolat berdasarkan intensitas warna ke dalam empat kelompok, yaitu tanpa adanya oksidasi, oksidasi lemah, oksidasi sedang, dan oksidasi kuat terhadap ABTS.
Menurut Rajendran et al. (2008) terdapat korelasi antara virulensi suatu isolat Ganoderma spp. terhadap tingkat oksidasi ABTS. Desai dan Nityanand (2011) melaporkan bahwa warna hijau biru yang terbentuk pada media ABTS menunjukkan aktivitas enzim polifenoloksidase yang spesifik, yaitu enzim lakase. Kepekatan warna hijau biru yang terbentuk menunjukkan senyawa radikal bebas yang terbentuk sebagai hasil oksidasi oleh enzim lakase dan berkorelasi dengan aktivitasnya.
Senyawa ABTS mampu menjadi mediator reaksi oksidasi terhadap substrat target yang dapat berupa senyawa fenolik atau non fenolik. Senyawa ABTS dioksidasi oleh enzim lakase melalui mekanisme transfer elektron, menghasilkan radikal ABTS. Radikal ABTS selanjutnya mampu melakukan induksi reaksi redoks terhadap senyawa fenol maupun non fenol lain sehingga mengalami perubahan warna (Baldrian 2005).
Adanya senyawa perantara atau mediator ini, enzim lakase dapat berpengaruh terhadap lebih banyak jenis senyawa bercincin karbon daripada jenis enzim oksidator lainnya seperti peroksidase. Johannes dan Majcherczyk (2000) menyatakan bahwa senyawa fenol, anilin, asam 4-hidrosibensoik dan 4-hidroksibensil alkohol merupakan contoh mediator alami enzim lakase yang terdapat pada tanaman.
Evaluasi Laju Tumbuh pada Media Malt Extract Agar(MEA)
Pengamatan morfologis pada media MEA menunjukkan pertumbuhan normal. Pengamatan morfologi koloni miselium pada semua isolat menunjukkan adanya beberapa ciri makroskopis seperti warna, tekstur koloni, tepi koloni, dan ada tidaknya lingkaran konsentris. Seluruh isolat berwarna putih, isolat B, C, E, G, dan J memiliki tekstur permukan koloni yang rata sebaliknya isolat A, D, F, H Tabel 3 Pengaruh jenis isolat terhadap diameter zona, diameter koloni, indeks
isolat serta intensitas kepekatan warna pada media uji
Kode Isolat Zona reaksi Koloni Indeks ABTSa Intensitas warna Diameter (mm)a
A 36.80cd 5.00d 73.60a +++ B 41.80bcd 24.00b 18.47bc +++ C 54.00a 47.20a 11.44c ++++ D 34.00d 6.40d 58.66a +++ E 21.40e 23.60b 8.79c ++++ F 48.80ab 41.40a 11.77c +++ G 36.60cd 27.60bc 14.17bc ++++ H 45.80abc 38.40ab 11.94c ++++ I 47.00abc 26.20b 32.27b +++ J 52.00ab 40.70a 13.44bc ++++
a
21 dan I bertekstur bergelombang (Gambar 7). Tepi koloni terlihat kasar pada isolat D, F, G, dan I sedangkan isolat A, B, C, E, H, dan J bertipe halus. Lingkaran konsentris terlihat pada isolat D, F, G, dan I, namun tidak terlihat pada isolat A, C, B, E, H dan J. Isolat dengan tepi koloni kasar cenderung menunjukkan pertumbuhan miselium yang lambat. Seperti halnya isolat yang memiliki lingkaran konsentris menunjukkan pertumbuhan miselium lebih lambat daripada tanpa adanya lingkaran konsentris.
Isolat A, C dan J memiliki laju tumbuh miselium tertinggi pada media MEA dibandingkan dengan isolat lainnya. Berikutnya, isolat B dan F menunjukkan laju tumbuh miselium tertinggi pada media ATT dan isolat G dan J memiliki laju tumbuh tertinggi pada media ABTS (Tabel 4). Secara umum laju tumbuh miselium semua isolat pada media ABTS tidak menghasilkan perbedaan pertumbuhan miselium dibandingkan dengan media MEA sebagai kontrol (p=0.12). Akan tetapi laju tumbuh miselium pada media ATT berbeda (p=0.00) apabila dibandingkan dengan media MEA dan media ABTS (p=0.00).
Laju tumbuh miselium isolat G. boninense pada