STUDI KARAKTERISTIKGanoderma boninensePat. PADA TANAMAN KELAPA SAWIT (Elaeis guineensisJacq ) DI LAHAN GAMBUT
SKRIPSI
OLEH
PATRA ANJARA GINTING 040302032
HPT
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
STUDI KARAKTERISTIKGanoderma boninensePat. PADA TANAMAN KELAPA SAWIT (Elais guineensisJacq ) DI LAHAN GAMBUT
SKRIPSI
OLEH
PATRA ANJARA GINTING 040302032
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
Disetujui Oleh : Komisi Pembimbing
Ir. Mukhtar Iskandar Pinem, M.Agr Ir. Kasmal Arifin, MSi
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Baru pada tanggal 2 September 1984, dari ayah Andy makmur Ginting dan ibu Wanita Br. Barus. Penulis merupakan anak pertama dari tiga bersaudara.
Pada tahun 1997 penulis lulus dari SD Negeri 050700 Secanggang, pada tahun 2000 penulis lulus dari MTs. Raudhatul Hasanah Medan dan pada tahun 2003 lulus dari SMU Negeri 1 Secanggang. Pada tahun 2004 penulis lulus di Fakultas Pertanian Departemen Hama dan Penyakit Tumbuhan Universitas Sumatera Utara melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah memberikan rahmat dan hidayah Nya sehingga penulis dapat menyelesaikan penelitian ini tepat pada waktunya.
Adapun judul penelitian ini adalah STUDI KARAKTERISTIK Ganoderma boninense Pat. PADA TANAMAN KELAPA SAWIT (Elaeis guineensis Jacq.) DI LAHAN GAMBUT yang merupakan salah satu syarat untuk dapat mencapai gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan banyak terima kasih kepada Bapak Ir. Mukhtar Iskandar Pinem, M.Agr dan Bapak Ir. Kasmal Arifin, Msi selaku dosen pembimbing yang telah banyak membimbing penulis dalam meyelesaikan penelitian ini dan tak lupa juga penulis ucapkan banyak terima kasih kepada Bapak Dr. Agus Susanto, MSi selaku kepala Proteksi Pusat Penelitian Kelapa Sawit (PPKS) Marihat beserta seluruh karyawan PPKS Marihat yang telah banyak memberikan bantuan selama penulis menyelesaikan penelitian ini.
Akhir kata penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu dan semoga penelitian ini dapat bermanfaat bagi pihak yang membutuhkan.
DAFTAR ISI
Botani Tanaman Kelapa Sawit(Elaeis guineensisJacq) .. 9
Syarat Tumbuh . 10
Tanah 11
Iklim 12
Penyakit Busuk Pangkal Batang (Ganoderma boninensePat) .. 15
Biologi Penyakit 17
Gejala serangan . 18
Faktor faktor yang Mempengaruhi Penyakit . 20
Pengendalian . 22
Polymerase Chain Reaction(PCR) .. 22
BAHAN DAN METODA .. 23
Tempat dan Waktu Penelitian .. 25
Bahan dan Alat 26
Metoda Penelitian 27
Pelaksanaan Penelitian 28
PembuatanPotato Dextrose Agar(PDA)
Pembuatan Media Pertumbuhan Cair Malt Yeast Extract Pembuatan Larutan Buffer Pengekstraksi DNA
Pembuatan Larutan Buffer TE (Tris HCl EDTA) Pembuatan Larutan Buffer Tris HCl BSA pH 7,8 Pembuatan Larutan Ringer
Pembuatan Larutan Proteinase K
Pembuatan Larutan Ribonuklease 20 mg/ml buffer TE) Pembuatan Pereaksi dan Buffer untuk PCR
Pembuatan Larutan MgCl2(larutan stok)
Pembuatan Larutan campuran Nukleotida (dNTPs)
Pembuatan 20 l Campuran Pereaksi PCR untuk Mendeteksi
Ganoderma
Pembuatan Larutan Buffer untuk Gel Agarosa Elektroforesis Pembuatan 5 x Larutan Loading (10 ml)
Pembuatan Larutan DNA Marker Pembuatan Larutan 1 Kilo basa (Kb)
Pereaksi untuk Sekuensing DNA Isolasi Jamur
Identifikasi Jamur
Penggerusan Miselium untuk Persiapan Ekstraksi DNA Ekstraksi DNA Menggunakan Metode Moller 1992
Uji kualitas DNA Hasil Ekstraksi dengan Metode Elektroforesis Gel Agarosa
DAFTAR TABEL
Tabel 1. kriteria kesesuain lahan untuk perkebunan kelapa sawit. Tabel 2. SeranganGanodermadi PT. Anak Tasik Pada Tahun 2008
Tabel 3. Persentase seranganGanodermapada setiap Blok di PT. Anak Tasik Tanjung Selamat Estate
Tabel 4. Perbandingan seranganGanodermaantaraBasaldanUpper Stem Rot
DAFTAR GAMBAR
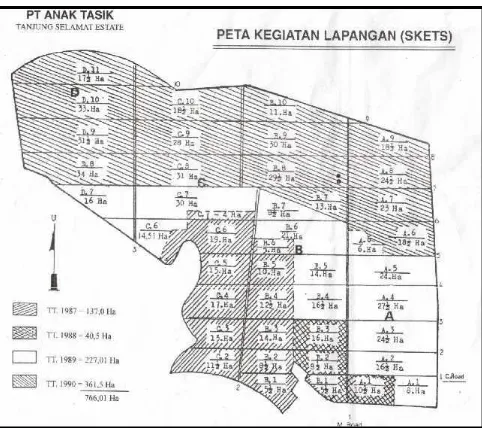
Gambar 1. Peta PT. Anak Tasik Tanjung Selamat Estate
Gambar 2. Gejala seranganGanodermapada tanaman kelapa sawit dengan berbagai tingkatan
Gambar 3. Penyebaran seranganGanodermadi PT. Anak Tasik pada Blok B8 Gambar 4. Perbandingan seranganGanodermaantaraUpper Stem Rotdan
Basal Stem Rot
Gambar 5. Penyebaran seranganGanodermapada skala 4 Gambar 6. Penyebaran seranganGanodermapada Skala 4 dan 3 Gambar 7. Penyebaran seranganGanodermapada Skala 4, 3 dan 2 Gambar 8. Penyebaran seranganGanodermapada Skala 4, 3, 2 dan 1 Gambar 9. Perbedaan gejala serangan berdasarkan letak tumbuh badan buah
Ganodermasp.
Gambar 10. BasidiokapGanodermayang berasal dari atas dan bawah batang kelapa sawit
Gambar 11. Gambar biakan murniGanoderma boninense
Gambar 12.Miseliumdanbasidiospora Ganoderma boninenseyang berasal dari busuk pangkal batang(basal stem rot)
Gambar 13.Miseliumdanbasidiospora Ganoderma boninenseyang berasal dari busuk batang atas (Upper stem rot)
Gambar 14. Hasil amplifikasi PCR dari DNAGanoderma boninense
Gambar 15. jaringan pangkal batang tanaman kelapa sawit yang masih sehat Gambar 16. Jaringan batang tanaman kelapa sawit yang terserangGanoderma
Gambar 17. Kondisi tanaman yang ditumbuhi oleh gulma ipifit pada batang Gambar 18. Kondisi tanaman yang bersih dari gulma ipifit pada batang Gambar 19.Basidiokap Ganoderma yang tumbuh di sela sela pelepah lapuk
DAFTAR LAMPIRAN
Lampiran 1. Peta Areal Perkebunan PT. Anak Tasik Tanjung Selamat Estate Lampiran 2.Peta Areal Perkebunan PT. Anak Tasik Tanjung Selamat Estate Lampiran 3. Penyebaran seranganGanoderma boninensedi PT. Anak Tasik pada
Blok B8
Lampiran 4. Penyebaran seranganGanoderma boninense di PT. Anak Tasik pada Blok B8
Lampiran 5. Penyebaran seranganGanoderma boninense pada skala 4 di PT. Anak Tasik Pada Blok B8
Lampiran 6. Penyebaran seranganGanoderm boninensepada skala 4 dan 3 di PT. Anak Tasik Pada Blok B8
Lampiran 7. Penyebaran seranganGanoderma boninensepada skala 4 ,3 dan 2 di PT. Anak Tasik Pada Blok B8
Lampiran 8. Penyebaran seranganGanoderma boninense pada skala 4 ,3, 2 dan 1 di PT. Anak Tasik Pada Blok B8
ABSTRAK
Patra Anjara Ginting Studi Karakteristik Ganoderma boninense Pat. Pada Tanaman Kelapa Sawit (Elaeis guineensis Jacq.) di Lahan Gambut di bawah bimbingan bapak Ir. Mukhtar Iskandar Pinem selaku ketua komisi pembimbing, bapak Ir. Kasmal Arifin Msi selaku anggota dan bapak DR. Agus Susanto selaku anggota. Penelitian ini menggunakan metode survei yang dilaksanakan di PT. Anak Tasik Tanjung Selamat Estate yang merupakan lahan gambut. Kemudian untuk pengujian sampel dilakukan di Laboratorium Pusat Penelitian Kelapa Sawit Marihat. Adapun tujuan dari penelitian ini adalah untuk mengetahui karakteristik Ganoderma boninense pada tanaman kelapa sawit di lahan gambut dengan menggunakan metode Polymerase Chain Reaction (PCR). Dari hasil penelitian yang dilakukan diketahui bahwa ada perbedaan gejala seranganGanodermapada kelapa sawit di lahan gambut dengan di lahan mineral. Serangan Ganoderma di PT. Anak Tasik pada Blok B8 dengan luas 29,5 hektar yang merupakan lahan gambut cenderung melalui basidiospora yang mengakibatkan busuk batang atas (upper stem rot) yang mencapai 63 % ( 82 tanaman), dan hanya 37 % (49 tanaman) yang merupakan busuk batang bawah
ABSTRACT
Patra Anjara Ginting Study CharacteristicGanoderma boninensePat. At The Oil Palm (Elaeis guineensisJacq.) On the Peatlands By direction of Ir. Mukhtar Iskandar Pinem as the leader of , Mr Ir. Kasmal Arifin Msi as participant dan Mr. DR. Agus Susanto as participant. This research use survey
methode which has been done in PT. Anak Tasik Tanjung Selamat Estate that known as Peatlands. Then, for the sample s tester has been done in Laboratory of
Indonesian Oil Palm Research Institute. As the purpose of this research is to know the characteristic ofGanoderma boninenseat the Oil Palm in Peatlands which use Polymerase Chain Reaction(PCR) methode. From the research that has been done, known that there is the different of Ganoderma at the oil palm in peatlands in the mineral land. The attack ofGanodermain PT. Anak Tasik in
block B8 with 29,5 hectar wides which is the peatlands, usually through basidiospora that caused upper stem rot that archive 63 % (82 plants), and only 37
% (49 plants) that is basal stem rot. For generally the attack ofGanodermain PT. Anak Tasik archive 0,96 % (895 plants) from 94.945 plants which has 766,01 hectar wides. Based on the of fruiting body (basidiokap), the research of pure mycelium, micrograph mycelium and basidiospora and the moleculer tested, so we know that the attack of the disease in Oil Palm in PT. Anak Tasik caused by
PENDAHULUAN
Latar Belakang
Kelapa sawit bukan tanaman asli Indonesia, namun kenyataannya mampu hadir dan berkiprah di Indonesia tumbuh dan berkembang dengan baik dan produk olahannya (minyak sawit) menjadi salah satu komoditi perkebunan yang handal di Indonesia. Kelapa sawit merupakan salah satu komoditi perkebunan yang pangsa pasarnya di dalam negeri besar dan pasaran ekspornya senantiasa terbuka. Konsumsi minyak sawit dunia yang amat besar ini tidak mungkin terpenuhi oleh Malaysia, Nigeria, dan Pantai Gading sebagai produsen utama. Beberapa pengamat sosial ekonomi komoditas perkebunan menyatakan optimismenya bahwa keragaman kegunaan minyak sawit sebagai bahan baku industri pangan dan nonpangan memungkinkan prospeknya lebih cerah dibandingkan dengan kopi dan karet olahan (Tim Penulis PS, 1999).
Kelapa sawit (Elaeis guineensis Jacq) adalah salah satu dari beberapa famili palmae yang menghasilkan minyak nabati, yang disebut minyak sawit (palm oil). Banyak tanaman lain yang dapat dijadikan sumber minyak nabati, seperti kelapa, kacang tanah, kacang kedelai, jagung dan biji bunga matahari. Dari sekian banyak tanaman yang menghasilkan minyak atau lemak, kelapa sawit adalah penyumbang minyak nabati terbesar di dunia yaitu sebesar (2000 - 3000 kg/ha) sedangkan kelapa hanya menyumbang sepertiga yaitu sebesar (700 1000 kg/ha) (Setyohadi, 2005).
optimal yang dikehendaki antara 2000-2500 mm/tahun dengan pembagian yang merata sepanjang tahun. Lama penyinaran matahari yang optimum antara 5 - 7 jam /hari dan suhu optimum berkisar 24 38 0C. Ketinggian di atas permukaan
laut yang optimum untuk kelapa sawit berkisar 0 500 meter. Keadaan iklim yang paling banyak diamati adalah curah hujan, karena curah hujan yang kelebihan atau kekurangan sangat berpengaruh terhadap pertumbuhan dan produktivitas kelapa sawit (Risza, 1994).
Potensi areal perkebunan Indonesia masih terbuka luas untuk tanaman kelapa sawit. Pengembangan perkebunan tidak hanya diarahkan pada sentra sentra produksi seperti Sumatera dan Kalimantan, tetapi daerah potensi pengembangan pengembangan seperti Sulawesi dan Irian Jaya (Papua) terus dilakukan. Data di lapangan menunjukkan kecendrungan peningkatan luas areal perkebunan kelapa sawit khususnya perkebunan rakyat pada periode tiga puluh tahun mencapai 45,1 % per tahun, sementara areal perkebunan negara tumbuh 6,8 % per tahun, dan areal perkebunan swasta tumbuh 12,8 % per tahun (Fauzi dkk, 2005).
suatu konfrensi yang dihadiri oleh berbagai negara, seperti Jerman, Italia, dan Indonesia (Pahan, 2006).
Salah satu cara peningkatan hasil pertanian khususnya dibidang perkebunan kelapa sawit adalah dengan melakukan ekstensifikasi yaitu dengan memperluas areal perkebunan. Hal ini tidak menutup kemungkinan pembukaan lahan gambut sebagai alternatif perluasan areal perkebunan kelapa sawit, mengingat bahwa Indonesia memiliki lahan gambut terluas nomor empat didunia. Menurut perkiraan para pakar luas lahan gambut di Indonesia sekitar 16 sampai 27 juta hektar dan 6 juta hektar diperkirakan sesuai untuk usaha pertanian. Data yang akurat mengenai luas lahan gambut ini belum diperoleh berdasarkan bahan asal, cara terbentuknya, jenis pelapukan dan ketebalan bahan organiknya (Hasibuan, 2006)
Pembukaan lahan gambut untuk pengembangan pertanian atau pemanfaatan lainnya secara langsung mengubah ekosistem kawasan gambut yang telah mantap membentuk suatu ekosistem baru. Pengembangan pertanian lahan gambut dapat diartikan sebagai upaya peningkatan fungsi produksi antara fungsi produksi dan fungsi perlindungan lingkungan dalam ekosistem lahan gambut saling berhubungan dan saling mempengaruhi. Jika fungsi perlindungan menurun maka fungsi produksi dapat terganggu. Dengan kata lain, pembukaan lahan gambut harus memperhatikan atau memperhitungkan juga perubahan yang terjadi baik secara aras dinamika lahan maupun aras keuntungan berupa layanan jasanya terhadap lingkungan, hasil produksi dan nilai nilai sosial lainnya (Noor, 2001).
1. Lahan gambut sebagian besar terhampar di atas lapisan yang mempunyai potensi keasaman yang tinggi dan pencemaran dari hasil oksidasi seperti Fe, Al, dan asam asam organik lainnya. Sebagian lahan gambut terhampar di atas lapisan pasir kuarsa yang miskin hara.
2. Lahan gambut cepat mengalami perubahan lingkungan fisik setelah direklamasi antara lain menjadi kering tak balik, berubah sifat menjadi
hidrofobdan terjadi amblesan.
3. Lahan gambut mudah dan cepat mengalami degradasi kesuburan karena Pengurasan melalui pelindian atau penggelontoran. Walaupun diyakini abu hasil bakaran mengandung hara bagi tanaman, tetapi mudah tererosi dan hilang melalui aliran air.
4. Kawasan gambut merupakan lingkungan yang mempunyai potensi jangkitan penyakit (virulensi) tinggi. Perkembangan organisme penggangu tanaman (gulma, hama dan penyakit) dan gangguan kesehatan manusia (malaria, cacing) yang cukup tinggi.
(Noor, 2001)
kanal, lahan gambut akan menjadi kering. Kondisi tersebut tidak akan dapat mendukung terlaksananya pertanian di lahan gambut tersebut. Selama ini kerusakan lahan gambut telah banyak merugikan masyarakat. Termasuk Negara tetangga. Sebab, ketika dalam keadaan kering lahan gambut sangat mudah terbakar dan menurut perkiraan Wetlands International, asap yang ditimbulkan dari kebakaran gambut di Indonesia setara dengan emisi kendaraan bermotor dan pabrik di seluruh dataran eropa. Pemanfaatan lahan gambut harus disertai dengan pemahaman yang mendalam tentang karakteristik lahan gambut. Kegagalan pemerintah Malaysia dalam perluasan areal perkebunan kelapa sawit di kawasan gambut merupakan kejadian yang bisa dipelajari Indonesia. Itu berarti, lahan gambut sangat sulit untuk diubah fungsinya, harus dipikirkan model pengelolaan yang memberikan manfaat ekologis maupun ekonomis bagi masyarakat (Daryono, 2004).
penyebab penyakit busuk pangkal batang pada tanaman kelapa sawit khususnya di lahan gambut.
Untuk memastikan laporan tersebut, dalam penelitian ini penulis ingin melakukan pengujian DNA jamur penyebab penyakit tersebut. Dalam pengujan ini, penulis menggunakan metode PCR (Polimerase Chain Reaction) yaitu suatu teknik dan amplifikasi fragmen DNA secara in vitro. PCR merupakan salah satu metode untuk mengidentifikasi penyakit infeksi yang dewasa ini banyak dikembangkan, Metoda ini digunakan untuk mengatasi kelemahan metoda diagnosa konvensional seperti imunologi dan mikrobiologi. Teknik PCR didasarkan pada amplifikasi fragmen DNA spesifik dimana terjadi penggandaan jumlah molekul DNA pada setiap siklusnya secara eksponensial dalam waktu yang relatif singkat dan hasil yang akurat (Abdullah, 2003).
Semoga penelitian ini nantinya dapat bermanfaat bagi pihak yang membutuhkan, terutama untuk perkebunan kelapa sawit di lahan gambut.
Tujuan penelitian
Untuk mengetahui karakteristik Ganoderma boninense pada tanaman kelapa sawit di lahan gambut dengan menggunakan metode Polymerase Chain
Reaction(PCR).
Hipotesa Penelitian
Terdapat perbedaan karakteristik antara Ganoderma boninense yang menyerang tanaman kelapa sawit di tanah mineral dengan Ganoderma boninense
Kegunaan Penelitian
Sebagai bahan informasi bagi pihak yang membutuhkan.
Sebagai salah satu syarat untuk dapat menempuh ujian sarjana di
TINJAUAN PUSTAKA
Botani Tanaman
Menurut Sharma (2002) tanaman kelapa sawit diklasifikasikan sebagai berikut : Divisio : Spermatophyta
Tanaman kelapa sawit berakar serabut. Perakarannya sangat kuat karena tumbuh ke bawah dan ke samping membentuk akar primer, sekunder, dan kuarter. Akar primer tumbuh ke bawah di dalam tanah.sampai batas permukaan air tanah. Akar skunder, tertier dan kuarter. Akar primer tumbuh ke bawah di dalam tanah sampai batas permukaan air tanah bahkan akar tertier dan kuarter tumbuh sejajar dengan permukaan air tanah bahkan akar tertier dan kuarter menuju ke lapisan atas atau ke tempat yang banyak mengandung zat hara. Di samping itu, tumbuh pula akar nafas yang muncul di atas permukaan atau di dalam air tanah. Dengan perakaran kuat tersebut, jarang ditemukan pohom kelapa sawit yang tumbang (Fauzi dkk, 2005).
mencapai 90 cm. Tinggi batang untuk tanaman komersial tidak lebih dari 12 meter. Jika tanaman telah mencapai ketinggian lebih dari 12 meter sudah sulit untuk dipanen, maka pada umumnya tanaman di atas umur 25 tahun sudah diremajakan. Batang berfungsi sebagai penyimpan dan pengangkut bahan makanan untuk tanaman serta sebagai penyangga mahkota daun. Pelepah tumbuh secara teratur membentuk spiral yang biasanya terdiri dari 8 spiral. Selanjutnya dinyatakan bahwa kelapa sawit memiliki rumus daun 1/8. Spiral ada yang mengarah ke kiri ada yang ke kanan tergantung sifat genetisnya (Risza,1994).
Susunan daun tanaman kelapa sawit mirip dengan tanaman kelapa yaitu membentuk susunan daun majemuk. Daun daun tersebut akan membentuk suatu pelepah daun yang pasangannya dapat mencapai kurang lebih 7,5 9 meter. Jumlah anak daun pada tiap pelepah berkisar antara 250 400 kelai. Daun muda yang masih kuncup berwarna kuning pucat. Pada tanah yang subur, daun cepat membuka sehingga makin efektif menjalankan fungsinya sebagai tempat berlangsungnya fotosintesis dan juga sebagai alat respirasi. Semakin lama proses fotosintesis berlangsung, maka semakin banyak bahan makanan yang dibentuk sehingga produksi tanaman kelapa sawit akan meningkat (Tim Penulis PS, 1999).
infloresen. Perkembangan infloresen dari proses inisiasi awal sampai membentuk
infloresen lengkap pada ketiak daun memerlukan waktu 2,5 3 tahun. Secara botani, buah kelapa sawit digolongkan sebagai buah drupe, terdiri dari pericarp, yang terbungkus oleh exocarp(kulit), mesocarp, dan endocarp(cangkang).Salah satu sifat ekonomis yang penting dari kelapa sawit yaitu ketebalan cangkang. Sifat ini diidentifikasikan oleh Beirnaet dan Vanderweyen pada tahun 1941 sebagai sifat yang dikendalikan oleh gen tunggal (Pahan, 2006).
Syarat Tumbuh
Tanah
Lahan adalah matriks tempat tanaman berada. Tanpa lahan, tanaman kelapa sawit tidak akan ekonomis untuk diusahakan secara komersial. Lahan yang optimal untuk kelapa sawit harus mengacu kepada 3 faktor, yaitu lingkungan, sifat fisik tanah, kriteria keadaan tanah untuk pengusahaan kelapa sawit. Berikut ini adalah tabel yang menjelaskan kriteria kesesuaian lahan untuk perkebunan kelapa sawit.
Tabel 1 : kriteria kesesuain lahan untuk perkebunan kelapa sawit.
Unsur Kemampuan S1
(KL tinggi) (KL sedang)S2 (KL terbatas)S3 (TidakN sesuai) Ketinggian dari
permukaan air laut 25-200 m 200-300 m 300-400 m < 25 m> 400 m Bentuk daerah dan
lereng Datar-ombak<10% (4,50) Ombak-gelombang 10-22%
berpasir
Gumpal sedang Remah sedangGumpal sedang Gumpal lemah Tidakberstruktur masif Konsistensi tanah Sangat gembur
Tidak lekat GemburAgak lekat Teguh/keraslekat Sangat teguhSangat keras Kelas drainase Sedang Agak cepat
Agak lambat Cepatlambat Sangat cepatSangat lambat Tergenang Erodibilitas Sangat rendah Rendah/sedang Agak tinggi Sangat tinggi Kemasaman tanah 5.0 - 6.0 4.0 - 4.9 3.5 - 3.9 < 3.5
(pH) 6.1-6.5 6.6-7.0 > 7.0
Kesuburan tanah Tinggi Sedang Rendah Sangat
rendah
Keterangan :
Kelas S-1 : kesesuain tinggi (high suitable)potensi produksi > 24 / ton /ha/ tahun. Kelas S-2 : Kesesuain sedang(moderately)potensi produksi 19-24 ton /ha/tahun. Kelas S-3 : kesesuain terbatas (marginally) potensi produksi 13-18 ton/ha/tahun. Kelas N : tidak sesuai (not suitable) potensi produksi < 12 ton/ha/tahun. (Pahan, 2006).
Iklim
Tanaman kelapa sawit membutuhkan intensitas cahaya matahari yang cukup tinggi untuk melakukan fotosintesis, kecuali pada kondisi juvenile di pre-nursery. Pada kondisi langit cerah di daerah zona khatulistiwa, intensitas cahaya matahari bervariasi 1.410 1.540 J / cm2/ hari. Intensitas cahaya matahari sebesar
1.410 J / cm2 / hari terjadi pada bulan Juni dan Desember, sedangkan 1.540
J/cm2/hari terjadi pada bulan Maret dan September. Dengan Semakin menjauhnya
suatu daerah dari garis khatulistiwa misalnya 100LU intensitas cahaya akan turun
dan bekisar 1.218-1.500 J/cm2/hari. Intensitas 1.218 terjadi pada bulan Desember,
sedangkan 1.500 terjadi pada periode bulan Maret September (Pahan, 2006). Produksi TBS/tahun juga dipengaruhi oleh jumlah jam efektif penyinaran matahari.Panjang penyinaran yang dibutuhkan kelapa sawit yaitu 5-12 jam/hari dengan kelembaban udara 80 %. Tanaman kelapa sawit di perkebunan komersial dapat tumbuh dengan baik pada kisaran suhu 24 28 0C. Didaerah sekitar garis
khatulistiwa, tanaman kelapa sawit liar masih dapat menghasilkan buah pada ketinggian 1300 meter dari permukaan laut, dengan demikian, tanaman kelapa sawit diperkirakan masih dapat tumbuh dengan baik sampai kisaran suhu 20 0C,
tetapi pertumbuhannya sudah mulai terhambat pada suhu 15 0C. Menurut
penelitian Ferwerda dan Echrenchon dalam Ferwerda (1977) tanaman kelapa sawit muda dalam fitotron menunjukkan peningkatan produksi daun secara linier pada suhu 12 - 22 0C. Produksi TBS yang tertinggi didapatkan dari daerah yang
rata rata suhu tahunannya berkisar 25 270C (Pahan, 2006).
kering yang berkepanjangan.Curah hujan yang merata dapat menurunkan penguapan dari tanah dan tanaman kelapa sawit. Namun, yang terpenting adalah tidak terjadi defisit air sebesar 250 mm. Bila tanah dalam keadaan kering maka akar akan sulit untuk menyerap mineral dari dalam tanah. Oleh sebab itu, musim kemarau yang berkepanjangan akan menurunkan produksi (Fauzi dkk, 2005)
Penyakit Busuk Pangkal Batang(Ganoderma boninensePat.)
Biologi Penyakit
Menurut Alexopoulus and Mims (1979) Penyakit busuk pangkal batang pada tanaman kelapa sawit diklasifikasikan sebagai berikut :
Kingdom : Myceteae
dulu dianggap sebagai penyakit kebun tua, sekarang penyakit ini terdapat juga di kebun yang masih muda (Semangun, 2000).
Umumnya Ganoderma boninense Pat. Adalah sebagai saprofit pada inangnya, namun juga terkadang sebagai parasit. Spora jamur ini berwarna gelap sampai kecoklat kemerah - merahan, jamur ini berkembang pada pohon yang telah mati. Badan buah (fruiting body) dapat mencapai diameter 30 cm. Warna permukaan atas tubuh buah kemerahan dengan garis putih dan kekuningan. Pada saat matang, bagian atas tubuh buah mengkilat. Permukaan bawah berwarna putih suram yang terdiri dari lapisan pori tempat terbentuknya basidiumberupa tabung yang hialin, bulat dengan diameter 12 . Basidiospora berwarna kecoklatan dengan ukuran 11 x 7-8 (Weber, 1973).
Gejala Serangan
Penyakit busuk pangkal batang dapat diketahui dari mahkota pohon, pohon yang sakit mempunyai janur (daun yang belum membuka, spear leave)
lebih banyak dari pada biasa. Daun berwarna hijau pucat. Daun daun yang tua layu, patah pada pelepahnya dan menggantung disekitar batang. Meskipun mudah dilihat, namun sebenarnya gejala sebenarnya gejala tersebut bukan gejala yang khas dari penyakit busuk pangkal batang, karena gejala seperti ini dapat juga disebabkan oleh gangguan lain yang menyebabkan terhambatnya pangangkutan air dan hara tanaman ke mahkota ( Semangun, 2000).
batang). Infeksi akan menyebar kebagian dalam jaringan akar tanaman kelapa sawit. Serangan akan semakin berat terjadi pada saat tanaman replanting karena sudah terdapat inokulum pada sisa sisa tanaman kelapa sawit sebelumnya (Weber, 1973).
Gejala yang khas sebelum terbentuknya tubuh buah adalah pembusukan pada pangkal batang. Penyakit menyebabkan busuk kering pada jaringan dalam. Pada penampang bagian batang yang terserang ini berwarna coklat muda dengan jalur jalur tidak teratur berwarna lebih gelap yang disebut dengan zone zone
reaksi yaitu tempat tertimbunnya blendok (gum).Di tepi daerah yang terinfeksi terdapat zone yang tidak teratur yang berwarna kuning. Zona berbau seperti minyak sawit yang mengalami fermentasi, yang merupakan akibat dari mekanisme perlawanan tanaman (Agrios, 1978).
Faktor Faktor yang Mempengaruhi Penyakit
Penyakit busuk pangkal batang lebih banyak terdapat di dekat pantai. Hal ini bukan disebabkan oleh faktor lingkungan alamiah, tetapi karena kebun kebun kelapa sawit di dekat pantai banyak yang dibuat di bekas pertanaman kelapa, karena tunggul tunggul kelapa dan kelapa sawit adalah sumber infeksi yang paling kuat, kebun kelapa sawittransplanting atau bekas kebun kelapa pada umumnya menderita penyakit yang lebih berat daripada kebun dibekas hutan atau bekas kebun karet. Intensitas penyakit akan meningkat sejalan dengan umur tanaman. Di kebun kebun kelapa sawit yang dibuat di bekas hutan akan atau kebun karet biasanya busuk pangkal batang baru berjangkit setelah tanaman berumur 15 - 20 tahun, tetapi di kebun-kebun peremajaan (bekas kelapa sawit), penyakit sudah mulai tampak pada tahun kesepuluh, bahkan di kebun kelapa sawit generasi ketiga gejala penyakit sudah tampak pada tahun ketiga umur tanaman (Semangun, 2000).
Salah satu faktor yang mempengaruhi perkembangan penyakit busuk pangkal batang pada tanaman kelapa sawit adalah teknik underplanting, yaitu penanaman bibit baru di bawah pohon lama yang sengaja tidak ditebang pada saat
replanting. Tanaman tua dibiarkan hidup dan terus diambil buahnya. Teknik underplanting berbeda dengan teknikreplanting. Pada teknikreplanting, tanaman tua ditumbangkan seluruhnya terlebih dahulu baru ditanam dengan bibit sawit yang baru. Bahaya penerapan teknik underplanting, kalau dilakukan secara sembarangan malah akan menghancurkan perkebunan kelapa sawit kita dalam waktu yang tidak terlalu lama. Ada keuntungan yang diperoleh dari teknik
mengurangi beban biaya replanting, namun untuk waktu 8 sampai 10 tahun ke depan akan mengakibatkan kerugian yang besar, karena produksi menurun karena terjadi seranganGanodermayang berat (Taniwiryo,2007).
Salah satu yang mempengaruhi beratnya serangan penyakit ditentukan oleh cara pembersihan sisa sisa tanaman kelapa dan kelapa sawit pada saat
replanting. Karena tunggul tunggul ini dapat menjadi inokulum. Selain itu penyakit juga meningkat jika pohon pohon yang sakit dibiarkan berdiri di kebun, karena ini akan menambah sumber inokulum. Dari penelitian Purba et al.
(1987) diketahui bahwa pemupukan dengan unsur makro yang lengkap dapat meningkatkan ketahanan tanaman. Penyakit paling banyak terdapat pada petak petak yang tidak dipupuk dengan N dan Mg. Diperoleh kesan bahwa beberapa faktor yang kurang membantu pertumbuhan tanaman akan membantu perkembangan penyakit, antara lain drainase yang buruk, banjir, dan gulma yang berat. Meskipun demikian hubungan antara faktor faktor tersebut dengan intensitas penyakit ternyata tidak konsisten, sehingga tidak dapat dipakai sebagai pegangan (Semangun,2000).
Pengendalian
Ada beberapa cara yang dapat dilakukan untuk menanggulangi penyakit ini diantaranya adalah dengan cara membersihkan seluruh sisa sisa tanaman yang terdapat di lahan, karena hal ini dapat menjadi sumber inokulum. Tunggul tunggul dan gumpalan akar sekitar tunggul digali, untuk dikumpulkan dan dibakar. Juga dianjurkan agar batang batang pohon tua dipotong potong, dukumpulkan, ditumpuk dengan baik, untuk akhirnya tumpukan itu dibakar. Apabila pembakaran tidak memungkinkan untuk dilakukan, batang batang ditumpuk diantara barisan transplanting, dibiarkan membusuk dan ditutupi oleh tanaman penutup tanah kacangan yang mejalar (legume creeping crover)
(Semangun, 2000).
Secara kultur tehnis, pengendalian penyakit selain dengan menanam varietas tahan, yang tak kalah pentingnya adalah perawatan tanaman, seperti pemupukan yang berimbang. Dengan pemupukan ini diharapkan dapat meningkatkan ketahanan tanaman terhadap serangan penyakit, karena tanaman dalam keadaan yang sehat akan meningkatkan daya tahan tanaman, sehingga tanaman dapat memberikan perlawanan terhadap patogen yang menyerang.
Secara hayati, pengendalian yang dapat dilakukan adalah dengan memberikan mikroorganisme antagonis pada tempat infeksi sebelum atau sesudah terjadinya infeksi.Beberapa jamur yang mempunyai daya antagonis terhadap
Ganoderma boninense adalah Trichoderma koningii, T. harzianum, T. viridae,
Gliocladium sp, dan Penicillium citrinum dan juga dapat dengan memanfaatkan
mengkolonisasi akar secara interseluler (ektomikoriza) atau secara intraseluler
(endomikoriza). Diharapkan dengan pemberian mikoriza pada saat pembibitan, maka tanaman akan lebih tahan terhadap serangan Ganoderma. Selain sebagai biokontrol, mikoriza juga berfungsi sebagai perangsang penyerapan hara dan meningkatkan transportasi air pada tumbuhan, selanjutnya akan meningkatkan pertumbuhan dan hasil tumbuhan (Agrios, 1996).
Apabila tanaman sudah terserang, maka perlu dilakukan pencegahan penyebaran penyakit yaitu dengan cara meracuni pohon yang sudah terserang kemudian ditebang, tunggul beserta dengan gumpalan akarnya digali dengan ukuran 6 x 6 x 6 meter di bekas tempat berdirinya pohon. Jika diketahui adanya pembusukan dini pada pangkal batang, pohon masih dapat ditolong dengan melakukan pembedahan (surgery). Bagian dalam pohon yang busuk dipotong, termasuk bagian yang berwarna kuning. Luka dapat ditutup dengan penutup luka
(Protectant). Untuk keperluan ini dapat digunakan ter, belerang karena efektif dan cukup murah (Semangun, 2000).
Salah satu pecegahan yang dapat dilakukan adalah dengan tidak melakukan underplanting, karena dalam waktu yang tidak terlalu lama
Ganoderma dapat menghancurkan perkebunan kelapa sawit. Meskipun dalam
Dari hasil penelitian yang dilakukan di PT. Anak Tasik, ada beberapa tindakan penanggulangan yang dapat dilakukan terhadap tanaman yang telah terserang. Diantaranya adalah :
1. Melakukan pengumpulan (collecting) badan buah (fruiting body) yang tumbuh pada batang. Badan buah dikumpulkan lalu dimusnahkan (dibakar). Pembakaran dilakukan di luar lahan perkebunan karena lahan gambut mudah terbakar.
2. Membersihkan pelepah lapuk yang masih melekat pada batang tanaman. Hal ini dilaksanakan untuk menghindari kondisi lingkungan mikro yang sesuai bagi perkembanganGanoderma.
3. Setelah dilakukan pembersihan terhadap pelepah yang lapuk, maka dilakukan pembungkusan ( sarungisasi) dengan menggunakan plastik. Hal ini dilakukan untuk menghindari agar basidiospora Ganoderma tidak menempel pada batang tanaman.
Polymerase Chain Reaction (PCR)
Reaksi berantai polymerase ( Polymerase Chain Reaction) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini pertama kali dikembangkan pada tahun 1985 oleh Kary B Mullis, seorang peniliti di perusahaan CETUS
Corporation. Metode ini sekarang telah banyak digunakan untuk berbagai macam
melakukan kuantitasi molekul mRNA. Metode PCR ini sangat sensitif. Sensitivitas tersebut membuatnya dapat digunakan untuk melipatgandakan satu molekul DNA. Dengan menggukan metode PCR, dapat diperoleh pelipatgandaan suatu fragmen DNA (110 bp, 5 x 10-19 mol) sebesar 200.000 kali setelah
dilakukan 20 siklus reaksi selama 220 menit. Kelebihan dari metode ini adalah bahwa reaksi ini dapat dilakukan secara cepat dan dapat dilakukan dengan menggunakan komponen dalam jumlah yang sangat sedikit (Yowono, 2006).
Ada empat komponen utama pada prosesPCRdiantaranya adalah : 1. DNA cetakan, yaitu fragmen DNA yang akan dilipatgandakan.
2. Oligonukleotida primer, yaitu suatu sekuen oligonukleotida pendek (15-20 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA. 3. Deosiribonukleotida trifospat (dNTP) terdiri atas dATP, dCTP, dGTP, dTTP. 4. Enzim DNA polymerase, yaitu enzim yang melakukan katalisis reaksi sintesis rantai DN. Komponen yang lain yang juga penting adalah senyawa
buffer.
Reaksi pelipatgandaan suatu fragmen DNA dimulai denga melakukan denaturasi DNA temple (cetakan) sehingga rantai DNA yang berantai ganda
(double stranded) akan terpisah menjadi rantai tunggal single stranded). Denaturasi DNA dilakukan dengan menggunakan panas 950C selama 1-2 menit,
kemudia suhu diturunkan menjadi 550C sehingga primer akan menempel
efisien jika dilakukan pada suhu yang lebih rendah (370C), tetapi biasanya akan
terjadi penempelan mispriming yaitu penempelan primer pada tempat yang salah. Pada suhu yang lebih tinggi (550C), spesifikasi reaksi amplifikasi akan meningkat,
tetapi secara kesuluruhan efisiensinya akan menurun (Yuwono, 2006).
BAHAN DAN METODA
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di PT. Anak Tasik Tanjung Selamat Estate perkebunan kelapa sawit lahan gambut yang terdapat di Kabupaten Labuhan Batu dan dilanjutkan di Laboratorium Pusat Penelitian Kelapa Sawit (PPKS) Marihat Pematangsiantar, dengan ketinggian tempat ± 350 m dpl. Penelitian ini di laksanakan pada bulan September sampai November 2008.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah badan buah (fruiting body)Ganoderma boninense yang diambil dari perkebunan kelapa sawit lahan gambut. Bahan kimia yang digunakan dalam penelitian ini adalah Potato
Dextrose Agar (PDA) E. Merck, Extract Yeast E. Merck, Enzim Tag DNA
polymerase Mira Diagnostica GmbH leverkusen Germany, Primer ITS 1 ITS 4 dibuat oleh The Europaean Molecular Biology Laboratory (EMBL) dengan nomor akses X 78749, dNTPs yang meliputi dATP, dGTP, dCTP, dTTP Promega Madison USA, Malt Extract, MgCl2, Etidium Bromida, Agarosa, Buffer moller,
CTAB, Polyvinil Pirolidin, NaCl kesemuanya E. Marck, Buffer Tris EDTA HCl, Buffer TBE Nitrogen cair, film polaroid, Alkohol 95 %, khlorox 0,1 %, Aquadest steril, Methylene blue dan minyak imersi.
autoclave, oven, inkobator, kompor, mikroskop, label nama, cutter, kapas steril, alumunium foil, kertas tissue, tabung reaksi, Themocycler (M J Reseach Programable Thermo Cycler tipe 100 M J Reseach Inc Massachusetts USA), alat ultrasentrifugasi, alat vortex, alat elektroforesis, tabung Eppendorf, pengaduk mikrowafe, peralatan sinar UV dan foto polaroid serta alat sekuensing DNA.
Metode Penelitian
Metode penelitian yang digunakan adalah Metode Survei (Steel and
James, 1989).Adapun tahapan dalam penelitian ini adalah sebagai berikut : 1. Mengamati secara langsung tanaman kelapa sawit yang terserang penyakit
Ganoderma boninensedi lapangan.
2. Mengambil sampel penyakit yang menyerang tanaman kelapa sawit di lapangan.
3. Menganalisa karakter DNA penyakit yang menyerang tanaman dengan menggunakanPolymerase Chain reaction( PCR ) di laboratorium.
Pelaksanaan Penelitian
PembuatanPotato Dextrose Agar(PDA)
Diambil PDA(Potato Dextrose Agar)sebanyak 39 gram dididihkan dalam 1 liter aquadest. Setelah mendidih, larutan PDA (Potato Dextrose Agar)
dimasukkan ke dalam erlenmeyer, kemudian ditutup dengan kapas steril dan
alumunium foil, kemudian disterilisasi di dalam autoclaveselama ± 1 jam dengan
suhu 121 1240C pada tekanan 1,25 atm. Setelah 1 jam, PDA (Potato Dextrose
Pembuatan Media Pertumbuhan Cair Malt Yeast Extract (Metode Burger et all 1994)
Ditimbang 15 gram serbuk Malt Yeast ekstrak dilarutkan dengan aquadest secukupnya. Ditimbang 5 gram Yeast ekstrak kemudian dilarutkan di dalam aquadest secukupnya. Kedua larutan digabungkan lalu di tambahkan dengan aquadest sehingga volume menjadi 1000 ml. Disterilkan pada suhu 1210C selama
15 menit
Pembuatan Larutan Buffer Pengekstraksi DNA (Metode Moller)
Dilarutkan 0,61 gram Tris di dalam 45 ml akuades steril ditambahkan 0,15 gram EDTA dan 1 gram SDS. Diatur pH menjadi 8,0 dengan penambahan HCl 37 %, kemudian ditambahkan H2O sampai volume larutan 50 ml , lalu disterilkan
pada suhu 1210C selama 15 menit
Pembuatan Larutan Buffer TE (Tris HCl EDTA)
Dilarutkan 0,061 gram Tris di dalam 45 ml H2O steril ditambahkan dengan
0,015 gram EDTA. Diatur pH larutan menjadi 8,0 dengan penambahan HCl 37 %, kemudian ditambahkan H2O sampai volume larutan 50 ml, lalu disterilkan pada
Pembuatan Larutan Buffer Tris HCl BSA pH 7,8 (Metode Niefold)
Dilarutkan 1,21 gram Tris di dalam 95 ml akuades. Diatur pH menjadi 7,8 dengan penambahan HCl 37 %, cukupkan larutan menjadi 100 ml dengan penambahan H2O. Sterilkan pada suhu 1210 C selama 15 menit. Didinginkan
sampai 500C, lalu ditambahkan 3 gram BSA.
Pembuatan Larutan Ringer
Dilarutkan 1 tablet Ringer di dalam 500 ml akuades, kemudian disterilkan pada suhu 1210C selama 15 menit.
Pembuatan Larutan Proteinase K
Dilarutkan 20 mg Proteinase K di dalam 1 ml larutan Ringer, Kemudian larutan ini disimpan pada suhu -200C.
Pembuatan Larutan Ribonuklease 20 mg/ml buffer TE)
Ditimbang 20 mg ribonuklease A, lalu dilarutkan di dalam 1 ml buffer TE, kemudian dididihkan selama 5 menit dan disimpan pada suhu -200C.
Pembuatan Pereaksi dan Buffer untuk PCR
Dilarutkan 8,11 gram Tris di dalam 95 ml H2O steril, ditambahkan 2,11 gram
(NH4)2SO4 dan 100 l Tween 20. Diatur pH larutan menjadi 8,8 dengan
penambahan HCl 37 %. Cukupkan larutan menjadi 100 ml dengan penambahan H2O, kemudian disterilkan dengan autoklaf pada suhu 1210C selama 5 menit dan
Pembuatan Larutan MgCl2(larutan stok)
Dilarutkan 2,03 gram MgCl26H2O di dalam 100 ml air destilata, kemudian
diautiklaf pada suhu 1210C selama 15 menit dan disimpan pada suhu -200C.
Pembuatan Larutan campuran Nukleotida (dNTPs)
dATP 2,5 mM
dGTP 2,5 mM
dCTP 2,5 mM
dTTP 2,5 mM
10 l dari masing masing dari 100 mM larutan nukleotida awal dilarutkan di dalam 390,0 l H2O millipore. Campuran disimpan pada suhu -200C.
Pembuatan 20 l Campuran Pereaksi PCR untuk MendeteksiGanodermasp.
Komposisi jumlah ( l) Konsentrasi akhir
10 x buffer PCR 2,5 1 x
MgCl2 1,0 1,5 mM
Campuran Nukleotida (10 mM) 2,5
Primer forward (25 M) 0,5
Primer reverse (25 M) 0,5
Tag DNA polymerase 0,5
dd H2O 14,6
Pembuatan Larutan Buffer untuk Gel Agarosa Elektroforesis
10 x buffer elektroforesis (TBE buffer stok)
Tris 890,0 mM
Asam borat 890,0 mM
EDTA 20,0 mM
Air destilata 1000 ml
Dilarutkan 107,8 gram Tris, 55 gram asam borat dan 5,85 EDTA di dalam 1000 ml H2O steril (larutan stok). Larutan buffer disimpan pada suhu kamar. Untuk
elektroforesis larutan stok ini diencerkan dengan H2O steril dengan perbandingan
1 : 10.
Pembuatan 5 x Larutan Loading (10 ml)
Gliserol 50 %
TBE 5 x
Bromofenol biru 0,3 %
Dilarutkan 30 mg bromo fenol biru di dalam 4,25 ml larutan 10 x TBE (larutan stok), ditambahkan 5,75 ml larutan gliserol 87 %. Larutan ini disimpan pada suhu kamar.
Pembuatan Larutan DNA Marker
Pembuatan Larutan 1 Kilo basa (Kb)
Dilarutkan 25 ul 1 Kb plus DNA ladder (Gibco BRL life Technologies Inc Gaithersburg USA) di dalam 25 ul 5 x buffer loading dan 50 ul air destilata steril.
Pembuatan Larutan Ethidium Bromida (Larutan stok)
Dilarutkan 1 gram ethidium bromida di dalam 100 ml air destilata steril (larutan stok). Larutan stok ini disimpan di dalam botol berwarna coklat pada suhu 40C. Dipipet 1 ml ke dalam tabung eppendorf untuk setiap kali pemakaian.
Pembuatan Larutan Enzim Restriksi Mlu 1
Komposisi buffer Mlu 1 terdiri dari :
Tris HCl dengan pH 7,4 50,0 mM
NaCl 50,0 mM
Premix (Perkin Elmer USA) 4 ul 1 x
DNA utas rangkap x ul (250 ng) 250 ng/ul
Primer (ITS1 ITS4 10 pmol) 1 ul 1 pmol
Diambil fruiting body Ganoderma yang dibawa dari lapangan, kemudian dibersihkan dengan menggunakan aquadest, kemudian dipotong persegi dengan ukuran 1 x 1 x 1 cm, lalu disterilkan dengan klorox 0,1 % selama 15 30 detik, kemudian dicuci dengan air steril sebanyak 2 kali lalu dikering anginkan di atas kertas saring yang bersih. kemudian potongan tersebut diambil dengan menggunakan pinset dan ditanam di atas media PDA (Potato Dextrose Agar)
yang terdapat di dalampetridishdengan metodathree pointdan dibiarkan sampai miselium jamur tumbuh selama 1 minggu pada media biakan tersebut. Miselium yang diperoleh pada tahapan ini sering terkontaminasi oleh jamur dan bakteri, untuk itu perlu dilakukan penanaman ulang pada media pertumbuhan PDA baru sampai diperoleh biakan murni. Setelah diperoleh biakan murni, maka sebagian dari isolat ini ditumbuhkan pada media cair Malt-Yeast ekstrak selama 30 hari pada suhu kamar yang selanjutnya digunakan untuk ekstrak DNA.
Identifikasi Jamur
Penggerusan Miselium untuk Persiapan Ekstraksi DNA
Miselium hasil pertumbuhan pada media biakan cair malt-Yeast ekstrak disaring dengan kertas saring Whatman nomor 1 steril lalu dicuci dengan air steril sebanyak 2 kali. Miselium yang diperoleh dipindahkan ke dalam cawan petri yang bersih lalu dikeringkan pada suhu 700C selama satu malam. Miselium kemudian
dipindahkan ke dalam lumpang porselen kemudian digerus sampai halus dengan penambahan gas N2 cair serta penambahan serbuk polyvinyl pirolidin (PVPP)
secukupnya. Serbuk halus yang diperoleh digunakan untuk esktraksi DNA. Sebelum digunakan disimpan di dalam freezer pada suhu -200C.
Ekstraksi DNA Menggunakan Metode Moller 1992
Disuspensikan 50 mg serbuk miselium ke dalam 500 l buffer pengekstaksi Moller, ditambahkan 5 l larutan proteinase K, lalu diinkubasi pada suhu 650C di
dalam waterbat selama 1 jam. Ditambahkan 140 l larutan NaCl untuk mencukupkan konsentrasi garam dan 65 l larutan CTAB 65 % lalu diinkubasi pada suhu 65 0C di dalam waterbat selama 10 menit. Ditambahkan 1 voluma
kloroform : isoamil alkohol (KIAA), lalu diinkubasi pada suhu 0 0C di dalam
baru dan steril. Kemudian ditambahkan 25 l larutan enzim Ribonuklease lalu diinkubasi pada suhu 370 C selama 10 menit di dalam waterbat. Kemudian
ditambahkan larutan isopropanol dingin lalu disimpan pada suhu -200C selama 30
menit. Larutan hasil pendinginan disentrifugasi pada 13000 rpm selama 10 menit pada suhu kamar. Dekantasi larutan bagian atas dengan hati hati serta endapan yang diperoleh dicuci dengan alkohol 70 %, lalu dikeringkan pada suhu 500 C
selama 5 menit. Endapan yang diperoleh dilarutkan dengan 50 l larutan buffer TE kemudian disimpan pada suhu -200C sebelum dilanjutkan untuk uji kualitas
DNA hasil ekstraksi.
Uji kualitas DNA Hasil Ekstraksi dengan Metode Elektroforesis Gel Agarosa
Ditimbang 1,5 gram serbuk agarosa lalu masukkan ke dalam beaker gelas kecil. Ditambahkan 100 ml buffer TBE, lalu dipanaskan pada microwave sampai dengan mendidih. Didinginkan pada suhu 600 C, lalu dituangkan ke dalam alat
menit. Gel kemudian diletakkan di bawah sinar UV lalu difoto dengan film polaroid. Dari hasil uji yang dilakukakan dengan metode elektroforesis semua DNA hasil ekstraksi dari tiap sampel memberikan hasil positif dengan pita tunggal sebanyak 650 pasang basa (bp).
Amplifikasi DNA Utas Rangkap Hasil Ekstraksi sebagai Target dengan Menggunakan Primer ITS 1 ITS 4 dengan Metode Polymerase Chain Reaction (PCR)
Pengembangan diagnosa molekuler untuk identifikasi dan diferensiasi
Ganoderma penyebab penyakit busuk pangkal batang pada daerah ITS 1 ITS 4
pada penelitian ini dilakukan dengan metode PCR.
Primer diurutkan dengan program komputer Oligo 40 2109 dan analisis primer dilakukan dengan metode rychlik (1989 1991) dan metode Roads (1989) yang disesuaikan dengan urutan basa basa ITS 1 ITS 4 dari rDNA
Ganoderma. Urutan basa basa primer ini dibuat oleh European Molecular Biology Labolatory (EMB) dengan nomor akses X. 78749. Urutan srtuktur primer adalah :
ITS 1 5 - TCCGTAGGTGAACCTGCGG 3 sebagai forward primer ITS 4 5 - TCCTCCGCTTATTGATATGC 3 sebagai reverse primer
Komposisi Pereaksi untuk Amplifikasi PCR DNA target (hasil isolasi) 2,0 ul
Tag DNA polymerase 0,4 ul
H2O steril 13,4 ul
Total 22,8 ul (tambahkan sedikit minyak mineral)
Thermocycler (MJ Reseach Programable Thermo Cycler Type PTC 100 MJ Reseach Inc Massachusetts USA diprogram sebagai berikut :
Denaturasi pada suhu 950C selama 5 menit dan denaturasi selanjutnya pada 950C
selama 30 menit. Penapisan (annealing) primer dilakukan pada suhu 520C,
sedangkan pemanjangan rantai DNA (extention) dilakukan pada suhu 720C
selama 50 detik. Diatur siklus sebanyak 35 kali. Penyempurnaan reaksi pada suhu 720C dengan menginkubasi selama 10 menit pada suhu 40C. Sebelum dilakukan
pengujian kualitas DNA hasil amplifikasi sampel disimpan pada suhu -200C.
Uji Kualitas DNA Produk PCR Pada Daerah ITS 1 ITS 4 Dengan Metode Elektroforesis
masing 10 ul produk PCR pada setiap totolan lalu dihomogenkan. Dilakukan juga dengan cara yang sama untuk DNA marker (hanya satu kali saja). Ditotolkan tiap hasil totolan di atas secara teratur pada tiap tiap sumur yang telah tersedia pada pelat elektroforesa. Dieletroforesis dengan kekuatan 75 volt selama 70 menit, kemudian pelat diangkat dan direndam dalam larutan Ethidium Bromida selama 30 menit kemudian direndam dalam akua steril selama 10 menit sebagai pencuci. Hasil divisualisasi dengan sinar UV dan difoto dengan foto polaroid
Peubah amatan
1. Pengamatan gejala serangan dan persentase serangan penyakit di lapangan dilakukan secara visual. Persentase serangan dihitung dengan menggunakan rumus :
2. Untuk mengetahui laju infeksi penyakit di lapangan dihitung dengan menggunakan rumus :
r = 2,3 / t log 10 Xt / Xo Keterangan :
r = laju infeksi
Xo = jumlah tanaman terserang penyakit mula mula Xt = Jumlah tanaman penyakit setelah pengamatan 2,3 = Bilangan alami.
( Oka, 1993 ).
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan di PT. Anak Tasik Tanjung Selamat Estate, dengan luas areal 766,1 ha. Perkebunan ini terletak di desa Tanjung Selamat Kecamatan Kampung Rakyat Kabupaten Labuhan Batu Propinsi Sumatera Utara. Perkebunan ini berada pada ketinggian 1200 meter dari permukaan laut yang merupakan lahan gambut dengan ke dalaman 1- 2 meter dan pH 5- 5,17.
Hasil
Penyakit tanaman merupakan suatu intraksi antara patogen, inang, dan lingkungan. Penyakit tidak akan terjadi jika salah satu faktor tidak mendukung Terjadinya intraksi tersebut jika patogennya virulen, inangnya rentan dan lingkungan yang cocok untuk pertumbuhan patogen. Meskipun patogennya virulen dan lingkungannya mendukung tidak akan terjadi penyakit jika tanamannya tahan. Dibawah ini adalah tabel yang menjelaskan peningkatan seranganGanodermapada pada tanaman kelapa sawit di lahan gambut.
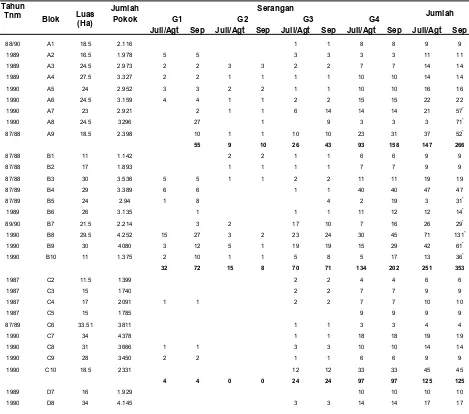
Tabel 2 : SeranganGanodermadi PT. Anak Tasik Pada Tahun 2008
Tahun
Tnm Blok Luas
(Ha)
Jumlah Serangan Jumlah
Pokok G1 G2 G3 G4
Juli/Agt Sep Juli/Agt Sep Juli/Agt Sep Juli/Agt Sep Juli/Agt Sep
1990 D9 31.5 4.194 2 2 1 1 1 1 26 26 30 30
1990 D10 33 4.555 2 2 2 2 41 41 45 45
1990 D11 17.5 2.395 1 1 15 15 16 16
4 4 1 1 7 7 106 106 118 118
Total 766.01 94.945 59 135 25 19 127 145 430 563 641 895
Keterangan :
G1 : 3 daun muda tidak terbuka dan ditandai dengan warna biru
G2 : 3 daun muda tidak terbuka, terdapat 1 fruting body jamurGanodermadan diberi tanda dengan warna hijau
G3 : 3 daun muda tidak terbuka, terdapat lebih dari 1 fruting body jamur
Ganodermadan diberi tanda dengan warna kuning
G4 : Tanaman mati dan diberi tanda dengan warna merah
* : Blok yang sudah dilakukan 2 kali sensus (pertama bulan Juli/Agustus dan kedua bulan September).
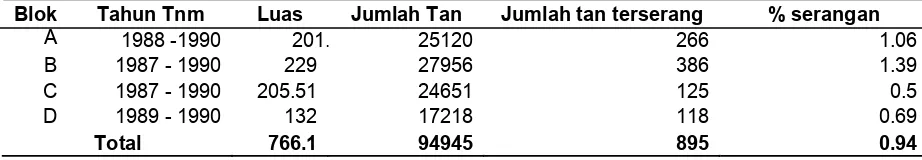
Tabel 3. Persentase seranganGanodermapada setiap Blok di PT. Anak Tasik Tanjung Selamat Estate
Blok Tahun Tnm Luas Jumlah Tan Jumlah tan terserang % serangan
A 1988 -1990 201.5 25120 266 1.06
B 1987 - 1990 229 27956 386 1.39
C 1987 - 1990 205.51 24651 125 0.5
D 1989 - 1990 132 17218 118 0.69
Total 766.1 94945 895 0.94
Dari hasil pengamatan di lapangan diketahui bahwa ada perbedaan yang sangat signifikan antara serangan Ganoderma yang berasal dari bawah (basal)
dengan atas (Upper). Dari 131 tanaman yang terserang Ganoderma di PT. Anak Tasik pada blok B8 dengan berbagai tingkatan 63 % adalah serangan Ganoderma
yang berasal dari atas(Upper stem rot)dan hanya 37 % yang merupakan serangan
Ganoderma yang berasal dari bawah (Basal Stem Rot).Di bawah ini adalah tabel
Tabel 4. Perbandingan seranganGanodermaantaraBasaldanUpper Stem Rotdi PT. Anak Tasik Tanjung Selamat Estate Pada Blok B8
No Keterangan Jumlah Tanaman % Serangan
1 Basal Stem Rot 49 37%
2 Upper Stem Rot 82 63%
Penyakit Busuk Pangkal Batang (BPB) yang disebabkan oleh Ganoderma
merupakan soil born disease sehingga penyebarannya cenderung lambat karena penularannya umumnya melalui kontak akar, sehingga penyakit ini digolongkan ke dalam penyakit yang berbunga sederhana. Namun dari hasil penelitian yang dilakukan di PT. Anak Tasik menunjukkan bahwa 63 % tanaman yang terserang
Ganoderma termasuk Busuk Batang Atas (Upper stem rot). Berikut ini adalah
tabel yang menjelaskan epidemi serangan Ganoderma melalui spora (Upper stem rot)
Tabel 5. Epidemi SeranganGanodermamelaluibasidiospora (USR)
Thn
tan Blok TanJlh
Jumlah
Serangan Jlh Seranganx 63 % Persentaseserangan r/tan/bln
Juli/Agt Sep juli/Agt Sep Juli/Agt Sep
Pengamatan Secara Visual
Pengamatan secara visual dilakukan pada saat mengambil sampel. Pengamatan dilakukan pada areal yang memiliki persentase serangan tertinggi yaitu pada blok B8 tahun tanam 1990 dan jumlah tanaman yang diamati adalah 4.252 tanaman. Pengamatan dilakukan dengan cara mengamati satu persatu tanaman sampel dan mencatat setiap tanaman yang terserang. Dari hasil pengamatan diperoleh hasil yang menunjukkan tingkat serangan yang berbeda pada setiap tanamanyang terserang.
Gambar 2. Gejala seranganGanodermapada tanaman kelapa sawit dengan berbagai tingkatan (Sumber : foto langsung di lapangan ).
G3 G4
Keterangan Gambar :
G1 : Gejala serangan tingkat 1 ditandai dengan 3 daun muda tidak terbuka G2 : Gejala serangan tingkat 2 ditandai dengan 3 daun muda tidak terbuka dan
terdapat 1 badan buah di batang tanaman.
G3 : Gejala serangan tingkat 3 ditandai dengan 3 daun muda tidak terbuka dan terdapat lebih dari 1 badan buah di batang tanaman.
G4 : Gejala serangan tingkat 4 ditandai dengan tanaman mati.
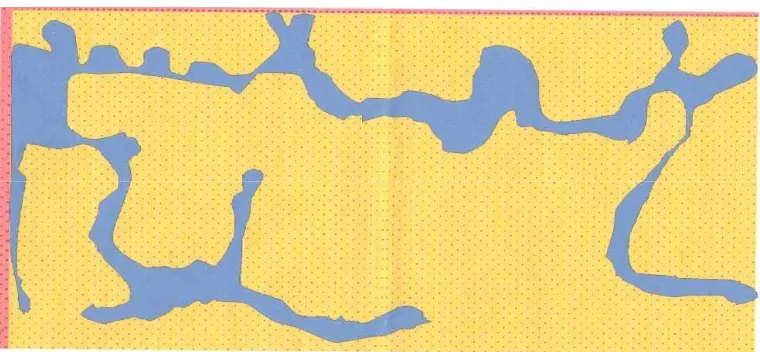
Gambar 3. Penyebaran seranganGanodermadi PT. Anak Tasik pada Blok B8 Keterangan :
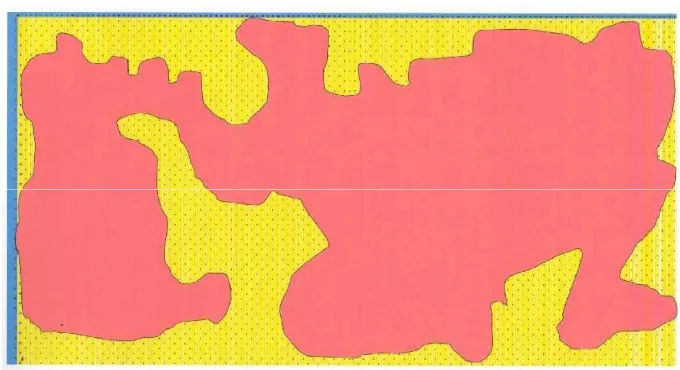
Gambar 4. Perbandingan seranganGanodermaantaraUpper Stem Rotdan
Basal Stem Rot
Keterangan :
: Tanaman yang terserang busuk pangkal batang (basal stem rot) : Tanaman yang terserangn busuk batang atas(upper stem rot)
Dari hasil pengamatan di lapangan, diketahui bahwa terdapat tingkat serangan yang berbeda pada setiap tanaman. Penyebaran tingkat serangan
Ganoderma di lapangan dikelompokkan ke dalam 4 kelompok. Penyebaran
tersebut digambarkan ke dalam peta yang menunjukkan tingkat serangan yang berbeda yang dimulai dari tingkat serangan yang paling berat. Hal ini karena sumber infeksi pertama penyebaran penyakit Ganoderma adalah tanaman yang terserang paling berat.
Keterangan :
: Areal tanaman yang belum terinfeksi penyakitGanoderma
: Areal tanaman yang sudah terinfeksi seranganGanodermadengan skala 4
Gambar 6. Penyebaran seranganGanodermapada Skala 4 dan 3 Keterangan :
: Areal tanaman yang belum terinfeksi penyakitGanoderma
: Areal tanaman yang terinfeksi penyakitGanodermadengan skala 4 dan 3
Keterangan :
: Areal yang belum terinfeksi PenyakitGanoderma
: Areal tanaman yang terinfeksi penyakitGanodermadengan skala 4, 3 dan 2
Gambar 8. Penyebaran seranganGanodermapada Skala 4, 3, 2 dan 1 Keterangan :
: Areal yang belum terinfeksi PenyakitGanoderma
: Areal tanaman yang terinfeksi penyakitGanodermadengan skala 4, 3,2 1 Dari hasil pengamatan di lapangan, gejala serangan pada tanaman dibedakan ke dalam 2 kelompok, yaitu Busuk Pangkal Batang ( Basal Stem Rot)
dan Busuk Batang Atas (Upper Sem Rot). Untuk membedakannya didasarkan kepada letak tumbuhnya badan buah Pada batang tanaman. Apabila Badan buah
Ganodermatumbuh pada pangkal batang maka dimasukkan ke dalam Basal Stem
Gambar 9. Perbedaan gejala serangan berdasarkan letak tumbuh badan buah
Ganodermasp. (Sumber : foto langsung di lapangan ) Keterangan Gambar :
BSR : Badan buahGanodermayang tumbuh di pangkal batang(Basal Stem Rot).
USR : Badan buahGanodermayang tumbuh di atas batang(Upper Stem Rot).
Badan buah Ganoderma yang diambil dari tanaman yang terserang dibedakan menjadi 2, yaitu badan buah yang berasal dari busuk pangkal batang
(Basal Stem Rot)dan busuk batang atas ( Upper Stem Rot ).
BSR USR
Gambar 10. BasidiokapGanodermayang berasal dari atas dan bawah batang kelapa sawit (Sumber : foto langsung )
Keterangan :
USR : Badan buah Ganoderma yang berasal dari busuk batang atas
(upper stem rot)
BSR : Badan buah Ganoderma yang berasal dari busuk pangkal batang
(basal stem rot)
Dilihat dari morfologiya, kedua jenis tubuh buah ini tidak memiliki perbedaan. Keduanya memiliki bentuk morfologi yang sama dan dilihat dari warnanya juga memiliki warna yang sama yaitu permukaannya berwarna kemerahan dan pada saat matang bagian atas tubuh buah mengkilat. Ciri ciri ini menunjukkan bahwa kedua badan buah ini adalah badan buah Ganoderma sp. Pernyataan ini juga didukung oleh Weber (1973) dalam bukunya yang menyatakan bahwa Badan buah (fruiting body) Ganoderma dapat mencapai diameter 30 cm. Warna permukaan atas tubuh buah berwarna kemerahan dengan garis putih kekuningan. Pada saat matang, bagian atas tubuh buah mengkilat. Permukaan bawah berwarna putih suram yang terdiri dari pori pori tempat
terbentuknya basidium berupa tabung hialin bulat dengan diameter 12 u, basidiospora berwarna kecoklatan dengan ukuran 11 x 7-8 u.
Pengamatan makroskopis
Badan buah yang tumbuh pada batang tanaman kelapa sawit diambil untuk diisolasi di laboraorium. Isolasi dilakukan beberapa kali sampai diperoleh biakan murni. Berdasarkan hasil penelitian diketahui bahwa pertumbuhan Ganoderma pada media biakan cenderung lambat, sehingga biakan sering terkontaminasi dengan jamur dan bakteri yang lain. Dibutuhkan waktu selama 2 minggu untuk membiakkan Ganoderma sampai miselium tumbuh memenuhi petridis. Hal ini juga didukung oleh Susanto dan Fahrida (2004) yang menyatakan bahwa inokulasi Ganoderma pada media biakan hingga seluruh permukaan medium tertutupi oleh miseliumGanoderma membutuhkan waktu kurang lebih 2 minggu karena pertumbuhan Ganoderma cenderung lambat. Diameter koloni jamur
Ganoderma boninenseselama 6 hari hanya mencapai 3,2 cm pada suhu 300C.
Gambar 11. Gambar biakan murniGanoderma boninense
( Sumber : foto langsung )
Keterangan Gambar :
BSR : Biakan murniGanodermabusuk batang bawah(Basal Stem Rot)
USR : Biakan murniGanodermabusuk batang atas(Upper Stem Rot)
Dari kedua gambar di atas (Gambar 11) menunjukkan bahwa tidak ada perbedaan warna. Keduanya berwarna putih kekuningan seperti baldu. Pertumbuhan miselium lambat 10 12 hari miselium baru dapat tumbuh memenuhi petridish secara merata. Ciri ciri ini menunjukkan bahwa gambar biakan murni di atas adalah biakan murniGanoderma boninense.
Pengamatan Mikroskopis
Gambar 12.Miseliumdanbasidiospora Ganoderma boninenseyang berasal dari busuk pangkal batang(basal stem rot)
Gambar 13.Miseliumdanbasidiospora Ganoderma boninenseyang berasal dari busuk batang atas (Upper stem rot)
( Sumber : foto langsung dengan perbesaran mikroskop 400 x )
Dari kedua gambar di atas ( Gambar 12 dan 13 ) menunjukkan bahwa tidak ada perbedaan antara miselium dan basidiospora keduanya. Miselium berwarna kecoklatan dan tidak memiliki sekat. Hal ini sesuai dengan pernyataan Weber (1973) yang menyatakan dalam bukunya bahwa basidiospora Ganoderma
sp berwarna kecoklatan dengan ukuran 11 x 7-8 u. Dari ciri ciri di atas menunjukkan bahwa Gambar 11 dan 12 adalah merupakan gambar miselium dan
basidiosporadariGanoderma boninense.
Pengujian Polymerase Chain Reaction (PCR)
Pembahasan
Ganodermamerupakan salah satu penyakit tular tanah(soil borne disease)
sehingga pada umumnya penyakit ini berkembang sangat lambat. Umumnya gejala serangan primer penyakit ini adalah terjadinya pembusukan pada pangkal batang. Namun berdasarkan hasil penelitian yang dilakukan di PT. Anak Tasik yang merupakan lahan gambut, selain melalui kontak akar jamur ini juga dapat menyebar dengan basidiospora melalui udara (air borne disease), sehingga penyebaran penyakit akan semakin cepat. Hal ini dikarenakan di lahan gambut tersebut hampir setiap tahunnya areal akan tergenang oleh air, sehingga dengan adanya genangan air tersebut spora jamur yang terdapat di dalam tanah akan mati karena Ganoderma adalah jamur yang memerlukan udara (aerob). Hal ini didukung oleh Kasno dkk (1986) yang menyatakan bahwa untuk penyebaran
Ganoderma ke daerah yang baru peranan spora yang dilepaskan dari badan buah
( sporophore)mempunyai peranan yang sangat besar. Hal ini karena jumlah spora yang sangat banyak, ukurannya yang sangat kecil, bobotnya yang sangat ringan dan mampu bertahan(dorman)dalam waktu yang sangat lama (bertahun tahun). Dalam hal ini peranan angin sangat besar dalam penyebaran spora. Untuk memberikan gambaran betapa banyak spora yang dilepaskan oleh sebuah badan buah, adalah bahwaGanoderma applantanummelepaskan sebanyak 20 juta spora setiap menit selama periode pelepasan spora. Lamanya periode pelepasan spora dapat berlangsung lama (berbulan bulan).
Basidiokap Ganoderma yang tumbuh di pangkal batang tanaman kelapa
sawit adalah sumber infeksi penyebaran penyakit ini.Basidiospora yang terdapat
yang akhirnya basidiospora ini akan menempel pada batang tanaman yang lain dan apabila didukung oleh kondisi lingkungan yang cocok maka basidiosporaini akan berkembang di tempat tersebut. Basidiospora ini akan tumbuh dan miselium miseliumnya akan masuk kedalam jaringan batang yang mengakibatkan kerusakan pada jaringan batang yang terserang. Inilah yang menyebabkan patahnya batang tanaman pada bagian atas (upper stem rot). Dari hasil penelitian yang dilakukan diketahui bahwa serangan busuk batang atas
(upper stem rot) di PT. Anak Tasik yang merupakan lahan lahan gambut
mencapai 63 % dan hanya 37 % yang merupakan serangan busuk batang bawah
(basal stem rot). Hal ini membuktikan bahwa ada perbedaan karakteristik antara seranganGanodermadi lahan gambut dengan lahan mineral.
Untuk membedakan serangan busuk batang atas dan busuk batang bawah, ada beberapa cara yang dilakukan :
1. Mengamati letak tumbuhnya badan buah pada batang. Apabila badan buah
Ganoderma tumbuh pada pangkal batang maka digolongkan ke dalam basal
stem rot, sedangkan apabila badan buah tumbuh di atas batang maka digolongkanupper stem rot.
Gambar 15. jaringan pangkal batang tanaman kelapa sawit yang masih sehat
Gambar 16. Jaringan batang tanaman kelapa sawit yang terserangGanoderma
Menjaga kebersihan kebun kelapa sawit adalah salah satu pemeliharaan yang sangat penting untuk menjaga kehilangan hasil baik dari persaingan mendapatkan unsur hara, hama dan penyakit, Dengan kondisi kebun yang kurang bersih akan dapat memicu datangnya hama dan terutama adalah penyakit. Kurangnya kebersihan kebun akan dapat memberikan kondisi lingkungan yang sesuai bagi perkembangan penyakit. Perkembangan penyakit sangat dipengaruhi oleh faktor lingkungan seperti curah hujan, intensitas matahari dan yang terpenting adalah kelembaban. Perkembangan penyakit sangat dipengaruhi oleh kelembaban yang tinggi, karena dengan kelembaban yang tinggi sangat berpengaruh positif bagi perkecambahan spora spora jamur.
Jaringan batang yang rusak
Dari hasil penelitian yang dilakukan menunjukkan bahwa kurangnya sanitasi kebun khususnya pada batang tanaman kelapa sawit yang ditumbuhi gulma epifit akan sangat memicu spora spora jamur yang menempel pada tanaman untuk berkembang.
Kondisi tanaman diatas (Gambar 16) akan sangat memicu perkembangan basidiospora Ganoderma yang telah menempel pada batang tanaman, kondisi tanaman di atas (Gambar 15) akan memberikan iklim mikro yang sesuai bagi penyakit Ganoderma (Upper Stem Rot). Basidiospora Ganoderma akan berkembang dan tumbuh pada sela sela pelepah yang telah lapuk dan menyerang batang tanaman, batang akan mengalami pelapukan dan akhirnya patah pada bagian atas batang tanaman.
Gambar 17. Kondisi tanaman yang
Gambar 19.Basidiokap Ganoderma yang tumbuh di sela sela pelepah lapuk yang masih menempel pada batang tanaman (Sumber : Foto langsung)
Gambar di atas (Gambar 19) menunjukkan Basidiokap Ganoderma yang tumbuh pada batang tanaman yang kurang sanitasi. Basidiokap ini akan menjadi sumber inokulum yang baru bagi perkembangan penyakit Ganoderma sp
(Upper stem rot). Menurut Purba, dkk (2004) bahwa kelembaban yang tinggi disekitar kanopi tanaman, pemeliharaan yang tidak memenuhi standar antara lain kondisi gulma disekitar pohon sawit yang kurang terkendali atau rotasi pengendaliannya yang terlambat, diameter piringan yang terlalu kecil tidak sesuai standar, kerapatan pohon yang cukup tinggi akan menambah semakin lengkapnya faktor pemicu maka akan semakin tinggi intensitas penyakit yang akan terjadi dan akan mengakibatkan kehilangan hasil yang semakin banyak.
selanjutnya. Pada tanaman generasi pertama serangan Ganoderma di lahan mineral belum menjadi ancaman yang serius. Pada areal yang terinfeksi setiap tahun 1 2 % tanaman akan mati terserang. Pada generasi kedua penanaman kelapa sawit atau generasi ketiga tingkat serangan dapat terjadi lebih tinggi dan lebih awal. Serangan berat dapat menimbulkan kekurangan populasi tanaman sebesar 20 30 % pada umur 15 tahun atau sebelumnya, sehingga jelas akan menurunkan produksi per hektar dan infeksi hanya terjadi melalui kontak akar dengan akar yang sakit (Lubis, 1992). Dari hasil penelitian yang dilakukan di PT. Anak Tasik yang merupakan lahan gambut diketahui bahwa ada perbedaan gejala dan Persentase serangan Ganoderma di lahan gambut. Penyebaran seranganGanodermadi lahan gambut kebanyakan melaluibasidiosporasehingga dikhawatirkan penyebaran penyakit Ganoderma akan lebih cepat dibandingkan serangan Ganoderma di lahan mineral. Dari hasil penelitian yang dilakukan diketahui bahwa serangan Ganoderma di PT. Anak Tasik pada tanaman generasi pertama dengan umur tanaman 18 21 tahun telah mencapai 895 tanaman atau 0,94 % dari total 94.945 tanaman.
Penyebaran ( epidemi ) Ganoderma di PT. Anak Tasik yang merupakan lahan gambut berbeda dengan penyebaran Ganoderma di lahan mineral. Dari hasil penelitian yang dilakukan diketahui bahwa penyebaran seranganGanoderma
di lahan gambut kebanyakan melalui basidiospora sehingga gejala serangan terlihat pembusukan di atas batang (upper stem rot).Diketahui bahwa dari 4.252 tanaman yang diamati pada blok B8 ada 131 tanaman yang terserangGanoderma
Hal ini membuktikan bahwa penyebaran Ganoderma di PT. Anak Tasik yang merupakan lahan gambut adalah melaluibasidiosporayang dibantu oleh angin.
Dari hasil penelitian yang dilakukan di PT. Anak Tasik yang merupakan lahan gambut diketahui bahwa tanaman yang rusak akibat serangan Ganoderma
boninense cenderung berkelompok. Penyebaran tanaman yang sakit tidak teratur.
Hal ini berkaitan dengan sumber inokulum. Penyebaran tanaman yang sakit dapat dilihat pada (Gambar 3). Hal ini sesuai dengan pernyataan Dharmaputra, dkk (1989) yang menyatakan bahwa dari hasil survei pada beberapa petak contoh pengamatan, menunjukkan bahwa tanaman yang rusak akibat serangan
Ganoderma boninense cenderung berkelompok. Penyebaran tanaman sakit tidak
membentuk pola yang teratur. Hal ini diduga berkaitan erat dengan letak sumber inokulum di dalam tanah yang kontak dengan akar tanaman. Kesempatan terjadinya kontak antara sumber inokulum dengan akara dan adanya ketidakseragaman genetik ketahanan dalam populasi tanaman.
Dari hasil penelitian yang dilakukan diketahui bahwa ada perbedaan laju infeksi yang terjadi di beberapa blok tanaman di PT. Anak Tasik (Tabel 5). Untuk laju infeksi yang tertinggi yang dihitung dengan menggunakan rumus laju infeksi