TINGKAT KEJADIAN
Escherichia coli
PENGHASIL
EXTENDED SPECTRUM β
-LACTAMASE
DI FESES SAPI DI
RUMAH POTONG HEWAN RUMINANSIA KOTA BOGOR
EDDY SUKMAWINATA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Tingkat Kejadian Escherichia coli Penghasil Extended Spectrum β-Lactamase di Feses Sapi di Rumah Potong Hewan Ruminansia Kota Bogor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015 Eddy Sukmawinata NIM B251130011
RINGKASAN
EDDY SUKMAWINATA. Tingkat Kejadian Escherichia coli Penghasil Extended Spectrum β-Lactamase di Feses Sapi di Rumah Potong Hewan Ruminansia Kota Bogor. Dibimbing oleh DENNY WIDAYA LUKMAN dan HADRI LATIF.
Escherichia coli merupakan anggota famili Enterobacteriaceae yang biasa ditemukan pada saluran pencernaan manusia dan hewan. Bakteri ini memiliki kemampuan untuk mendapatkan dan menyebarkan gen resisten terhadap antibiotik. Salah satu mekanisme resistensi E. coli terhadap antibiotik β-laktam adalah dengan memproduksi extended spectrum β-lactamase (ESBL). Bakteri E. coli penghasil ESBL telah resisten terhadap sebagian besar antibiotik golongan β-laktam termasuk generasi ketiga sefalosporin. Rumah potong hewan ruminansia (RPHR) dapat menjadi sumber cemaran E. coli penghasil ESBL pada daging. Sejauh ini belum ada penelitian mengenai keberadaan E. coli penghasil ESBL di feses sapi di Indoneisa, sehingga penelitian ini bertujuan untuk mengetahui tingkat kejadian E. coli penghasil ESBL dari sampel feses sapi di RPHR Kota Bogor, Jawa Barat.
Penelitian dilakukan menggunakan metode cross sectional study, besaran sampel dihitung dengan menggunakan asumsi prevalensi 50%, tingkat kepercayaan 95%, dan tingkat kesalahan 9.13%, sehingga diperoleh besaran sampel sebanyak 120 sampel feses di RPHR Kota Bogor. Pengujian dilakukan dengan isolasi dan identifikasi terhadap E. coli penghasil ESBL. Uji konfirmasi terhadap produksi ESBL dilakukan dengan metode difusi cakram berdasarkan rekomendasi dari Clinical and Laboratory Standards Institute (2014).
Hasil penelitian menunjukkan bahwa pada feses sapi potong di RPHR Kota Bogor ditemukan E. coli penghasil ESBL sebanyak 19 sampel dari 120 sampel yang diperiksa (15.8%). Gen CTX-M diduga lebih dominan ditemukan dibandingkan dengan tipe yang lainnya, karena seluruh isolat menunjukkan hasil positif saat diuji dengan sefotaksim dan sefotaksim yang dikombinasi dengan asam klavulanat.
Keberadaan E. coli penghasil ESBL pada feses, seperti yang dilaporkan pada penelitian ini dapat mencemari lingkungan dan produk pangan. Sifat resistensi E. coli penghasil ESBL terhadap antibiotik dapat disebarkan ke bakteri lain melalui plasmid. Bakteri E. coli yang resisten terhadap antibiotik mengakibatkan terbatasnya pilihan pengobatan. Saat ini E. coli diketahui dapat menyebabkan bermacam penyakit intestinal dan ekstra-intestinal pada manusia, seperti diare, infeksi saluran kemih, septisemia, dan meningitis neonatal.
SUMMARY
EDDY SUKMAWINATA. Occurrence of Extended Spectrum β-Lactamase Producing Escherichia coli Isolated from Cattle Feces in Bogor Slaughterhouse. Supervised by DENNY WIDAYA LUKMAN and HADRI LATIF.
Escherichia coli belongs to the family of Enterobacteriaceae and is common in the gastrointestinal microflora in human and animals. This bacteria has capability to get and disseminate the resistant genes for antibiotics. One of the currently most important resistance mechanisms in E. coli is production of the extended spectrum β-lactamases (ESBL). Extended spectrum β-lactamases producing E. coli confers resistance to the majority of the commonly used β-lactam antimicrobials, including third generation cephalosporins. The slaughterhouse may be one of the major ESBL reservoirs in food animals. This study was aimed to determine the occurrence of ESBL producing E. coli from cattle feces in Bogor Slaughterhouse.
This study was conducted using a cross sectional study. The sample size was calculated based on 95% of convidence level, 9.13% of margin of error, and 50% predicted prevalence and resulted a total of 120 samples for the study. The study was performed by isolation and identification of ESBL producing E. coli. Confirmation test for presence of ESBL was performed by disc diffusion test based on recomendation from Clinical and Laboratory Standards Institute (2014).
The results showed that 19 isolates of E. coli were positive producing ESBL (15.8%). CTX-M ESBL was presumed more dominant than others because all of ESBL isolates showed positive results when tested by cefotaxim and cefotaxim combining with clavulanic acid.
Extended spectrum β-lactamase producing E. coli in feceses could contaminate the environment and foods. Resistance of ESBL producing E. coli to antibiotics can be transmitted to other bacteria by plasmid. The presence of ESBLs causes limited therapeutic options for bacterial infection. Escherichia coli strains can also cause a wide variety of intestinal and extra-intestinal diseases, such as diarrhea, urinary tract infections (UTI), septicemia, and neonatal meningitis.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
TINGKAT KEJADIAN
Escherichia coli
PENGHASIL
EXTENDED SPECTRUM β
-LACTAMASE
DI FESES SAPI DI
RUMAH POTONG HEWAN RUMINANSIA KOTA BOGOR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Tingkat Kejadian Escherichia coli Penghasil Extended Spectrum β-Lactamase di Feses Sapi di Rumah Potong Hewan Ruminansia Kota Bogor
Nama : Eddy Sukmawinata NIM : B251130011
Disetujui oleh Komisi Pembimbing
Dr med vet Drh Denny Widaya Lukman, MSi Ketua
Dr med vet Drh Hadri Latif, MSi Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet Drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT, yang telah memberikan nikmat dan berkah sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 ini ialah Escherichia coli penghasil extended spectrum β-lactamase, dengan judul Tingkat Kejadian Escherichia coli Penghasil Extended Spectrum β-Lactamase di Feses Sapi di Rumah Potong Hewan Ruminansia Kota Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr med vet Drh Denny Widaya Lukman, MSi dan Dr med vet Drh Hadri Latif, MSi selaku pembimbing yang telah banyak memberi bimbingan. Penghargaan juga penulis sampaikan kepada Prof Dr med vet Drh Mirnawati B Sudarwanto selaku Guru Besar di Bagian Kesahatan Masyarakat Veteriner (Kesmavet) Fakultas Kedokteran Hewan (FKH) IPB. Ucapan terima kasih kepada staf laboratorium bagian Kesmavet FKH IPB, serta teman-teman program studi Kesahatan Masyarakat Veteriner (KMV) tahun ajaran 2013/2014 yang telah berbagi dalam suka dan duka selama kegiatan perkuliahan dan penelitian (Drh Ai Srimulyati, Drh Siti Istiqomah, dan Khusnul Khotimah, SSi). Ungkapan terima kasih juga disampaikan kepada papa, mama, istri serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga Allah SWT senantiasa membalas kebaikan dan selalu memberi kesehatan kepada mereka semua. Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Hal ini karena masih terbatasnya pengetahuan, kemampuan serta pengalaman dari penulis sendiri. Penulis berharap tesis ini bermanfaat bagi pengembangan ilmu kedokteran hewan, khususnya mengenai kesehatan masyarakat veteriner. Untuk itu penulis berterima kasih dan terbuka menerima kritik dan saran yang membangun guna penulisan selanjutnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
2 TINJAUAN PUSTAKA 2
Escherichia coli dan Resistensinya terhadap Antibiotik β-Laktam 2
Escherichia coli Penghasil ESBL 4
Cemaran Escherichia coli Penghasil ESBL di Rumah Potong Hewan 4 Dampak Cemaran Escherichia coli Penghasil ESBL terhadap Kesehatan
Masyarakat 6
3 METODE 6
Bahan 6
Alat 7
Disain, Waktu, dan Tempat 7
Besaran Sampel 7
Penarikan Sampel 7
Analisis Laboratorium 7
Isolasi dan Identifikasi Escherichia coli Penghasil ESBL 7
Konfirmasi ESBL 9
Analisis Data 10
4 HASIL DAN PEMBAHASAN 10
5 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR TABEL
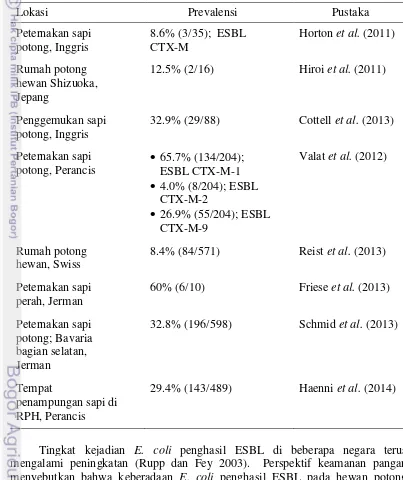
1 Prevalensi E. coli penghasil ESBL pada feses sapi di beberapa negara 5
2 Hasil reaksi uji biokimia E. coli 8
3 Hasil uji konfirmasi E. coli penghasil ESBL pada feses sapi yang
dipotong di RPHR Kota Bogor 10
4 Persentase E. coli penghasil ESBL yang ditemukan berdasarkan asal sapi 12 5 Persentase E. coli yang positif ESBL berdasarkan jenis antibiotik 12
DAFTAR GAMBAR
1 Transfer gen resisten secara horisontal 3
2 Mekanisme resistensi antibiotik 3
3 Koloni diduga E. coli pada media agar MacConkey. Skala: 1 cm. 8 4 Konfirmasi ESBL dengan metode difusi cakram. ESBL positif (A)
ditunjukkan dengan Z2-Z1 ≥5 mm dan/atau Z4-Z3 ≥5 mm dan/atau Z6-Z5 ≥5 mm. ESBL negatif (B) ditunjukkan dengan perbedaan zona
≤2 mm (Dimodifikasi dari Mast Group 2014). 9
5 Hasil uji konfirmasi E. coli penghasil ESBL (sampel nomor 45) menggunakan sefotaksim 30 µg+asam klavulanat 10 µg (A), sefotaksim 30 µg (B), seftazidim 30 µg+asam klavulanat 10 µg (C), seftazidim 30 µg (D), sefpodoksim 10 µg+asam klavulanat 1 µg (E), dan sefpodoksim
1
PENDAHULUAN
Latar Belakang
Salah satu tahapan terpenting dalam rantai penyediaan daging sapi di Indonesia adalah pemotongan hewan di rumah potong hewan ruminansia (RPHR). Penerapan higiene dan sanitasi di RPHR berpengaruh terhadap kualitas daging. Praktik higiene dan sanitasi yang buruk di lingkungan RPHR merupakan sumber pencemaran mikroorganisme terhadap daging yang dihasilkan (Abubakar 2014).
Escherichia coli (E. coli) merupakan salah satu cemaran yang paling banyak ditemukan pada daging (Nørrung et al. 2009). Bakteri ini secara umum berhabitat pada saluran pencernaan dan sering dijadikan sebagai bakteri indikator terhadap kontaminasi fekal pada produk pangan (Ryu et al. 2012). Zurfluh et al. (2013) menambahkan bahwa bakteri ini juga mudah menyebar ke lingkungan.
Bakteri E. coli diketahui mampu memperoleh dan mentransfer gen resisten ke bakteri patogen yang dapat menyebabkan penyakit pada manusia (Ryu et al. 2012). Meningkatnya kejadian resistensi E. coli di dunia, khususnya galur penghasil extended spectrum β-lactamase (ESBL) menjadi masalah yang sangat serius (Rocha-Gracia et al. 2014). Escherichia coli penghasil ESBL telah menunjukkan resistensi terhadap sebagian besar antibiotik golongan β-laktam, termasuk generasi ketiga sefalosporin dengan cara menghidrolisis cincin β-laktam (Ryu et al. 2012).
Gen resisten dapat disebarkan E. coli secara horisontal ke anggota famili Enterobacteriaceae lainnya melalui plasmid. Kemampuan penyebaran ini menunjukkan bahwa pentingnya meningkatkan pemahaman mengenai faktor yang mempengaruhi penyebaran resistensi mikroorganisme diantara manusia dan hewan. Evaluasi juga diperlukan terhadap peranan flora fekal dalam menyebarkan gen resisten antibiotik sebagaimana mekanisme penyebaran resistensi di lingkungan (Carattoli 2008).
Penelitian di bidang peternakan terkait dengan cemaran E. coli penghasil ESBL pada sapi potong masih sangat sedikit dilakukan di Indonesia. Oleh karena itu, penelitian mengenai E. coli penghasil ESBL di RPHR sebagai salah satu tempat yang berisiko dapat mencemari produk daging sapi yang dihasilkan perlu dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui tingkat kejadian E. coli penghasil ESBL di feses sapi di RPHR Kota Bogor, Jawa Barat.
Manfaat Penelitian
2
2
TINJAUAN PUSTAKA
Escherichia coli dan Resistensinya terhadap Antibiotik β-Laktam
Escherichia coli pertama kali dilaporkan sebagai Bacterium coli commune oleh Theodor Escherich saat mengamati bakteri berbentuk batang dari flora fekal seorang bayi. Bakteri ini merupakan anggota famili Enterobacteriaceae dan biasa ditemukan pada saluran pencernaan manusia dan hewan (Whagela 2004; Bhunia 2008). Escherichia coli adalah bakteri Gram negatif, tidak membentuk spora, berbentuk batang dengan ukuran 1.1–1.5 µm × 2.0–6.0 µm, motil atau tidak motil dengan flagela serta dapat tumbuh dengan atau tanpa oksigen, memfermentasi laktosa, dan dapat bertahan pada media sedikit nutrisi (Bell dan Kyriakides 2002). Bakteri ini dapat dijadikan sebagai indikator yang baik dalam menilai kualitas mikrobiologi pangan dibandingkan dengan bakteri lain. Hal ini dikarenakan E. coli mampu bertahan pada media yang kurang baik untuk pertumbuhan bakteri pada umumnya seperti air, lantai, dan permukaan benda mati lainnya. Keberadaan E. coli pada daging dapat berasal dari feses yang mengontaminasi daging selama pemotongan (Suandy 2011). Jumlah E. coli dari setiap gram feses berkisar 106–109 koloni (Whagela 2004).
Escherichia coli dapat berperan sebagai reservoir gen resisten terhadap antibiotik (Blanc et al. 2006; Suandy 2011). Penyebaran gen resisten oleh E. coli ke bakteri patogen dapat terjadi pada saluran pencernaan dan lingkungan (Ryu et al. 2012). Bakteri ini sering digunakan sebagai indikator dalam melakukan monitoring dan surveilans terhadap keberadaan bakteri resisten antibiotik karena teknik isolasinya yang mudah dan efesien (Nhung et al. 2014).
Resistensi antibiotik didefinisikan sebagai ketahanan mikroorganisme terhadap antibiotik yang sebelumnya mikroorganisme tersebut sensitif. Kejadian resistensi antibiotik merupakan konsekuensi dari kesalahan penggunaan antibiotik dan perkembangan mikroorganisme dengan bermutasi (Dierikx 2013). Giedraitienė et al. (2011) menambahkan bahwa resistensi antibiotik yang sering dilaporkan adalah resistensi terhadap antibiotik β-laktam.
Antibiotik β-laktam masih digunakan secara luas untuk pengobatan hewan dan manusia. Penamaan β-laktam karena antibiotik ini memiliki struktur cincin β-laktam yang menjadi bagian aktif dari antibiotik. Antibiotik ini dapat dibagi ke dalam kelas besar seperti penisilin, sefalosporin (generasi 1, 2, 3, dan 4), karbapenem, dan monobaktam. Penggunaan antibiotik ini juga sering dikombinasikan dengan β-laktamase inhibitor seperti asam klavulanat. Asam klavulanat tidak memiliki aktifitas antimikroba, namun hanya sebagai penghambat enzim yang mendegradasi β-laktam (β-laktamase) (Dierikx 2013).
3 pengambilan secara aktif fragmen dari DNA (plasmid) yang berisikan gen bakteri (Davies dan Davies 2010). Mekanisme terjadinya transfer gen resisten secara horisontal dapat dilihat pada Gambar 1.
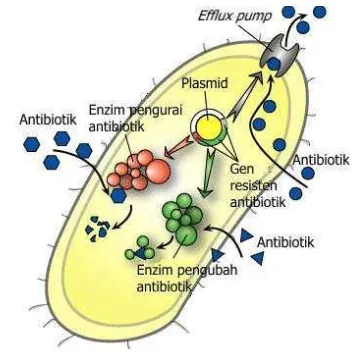
Gambar 1 Transfer gen resisten secara horisontal (Todar 2011)
Mekanisme terjadinya resistensi oleh bakteri terhadap antibiotik β-laktam dapat terjadi melalui empat cara: 1) perubahan penicillin binding protein (PBPs) pada setiap jalur yang menyebabkan lemahnya afinitas cincin β-laktam terhadap PBPs, 2) memiliki dinding sel yang tidak mampu ditembus oleh molekul antibiotik untuk penetrasi ke dalam sel, 3) mengaktifkan mekanisme “efflux pumps” terhadap antibiotik oleh sel, dan 4) memproduksi enzim yang mampu menginaktifasi β-laktam (β-laktamase) (Dierikx 2013). Gambar 2 menunjukkan mekanisme terjadinya resistensi terhadap antibiotik.
4
Meningkatnya kejadian E. coli penghasil ESBL pada pangan asal hewan menjadi banyak diperbincangkan. Inaktifasi β-laktam oleh enzim β-laktamase diketahui mampu menyebabkan bakteri resisten terhadap sefalosporin (Carattoli 2008). Kejadian ini menimbulkan masalah global terhadap keberhasilan pengobatan baik pada manusia maupun pada hewan (Davies dan Davies 2010).
Escherichia coli Penghasil ESBL
Organisme penghasil ESBL saat ini menjadi tantangan bagi ahli mikrobiologi, praktisi, profesional pengendalian infeksi, dan peneliti. Extended spectrum β-lactamase merupakan enzim yang mampu menghidrolisis penisilin, sefalosporin spektrum luas, dan monobaktam (Rupp dan Fey 2003). Organisme ESBL dilaporkan masih sensitif terhadap sefamisin (sefoksitin dan sefotetan) atau karbapenem (meropenem atau imipenem) (CDC 2010).
Gen ESBL berlokasi pada plasmid yang merupakan potongan ekstrakromosom dari DNA yang penting untuk pertumbuhan bakteri. Plasmid mampu bereplikasi sendiri dan berisikan faktor virulensi (gen resisten). Penyebaran gen resisten melalui plasmid dapat terjadi dari bakteri ke bakteri yang berbeda spesies (Dierikx 2013). Karakteristik di atas menjadikan ESBL termasuk ke dalam kategori β-laktamase kelas A (Ghafourian et al. 2014).
Terdapat tiga gen utama pengode ESBL yaitu, TEM, SHV, dan CTX-M (Johns et al. 2012). Gen ESBL tipe TEM merupakan turunan dari β-laktamase tipe TEM-1 dan TEM-2. Berbeda dengan ESBL tipe TEM, sebagian kecil β-laktamase tipe SHV merupakan turunan dari SHV-1 dan sebagian besar melalui perubahan serin menjadi glisin pada posisi 238. Sebagian SHV lainnya mengalami perubahan lisin menjadi glutamat pada posisi 240. Residu serin pada posisi 238 mampu menghidrolisis seftazidim dan residu lisin pada posisi 240 mampu menghidrolisis sefotaksim. Hal yang berbeda juga diperlihatkan oleh ESBL tipe CTX-M yang tidak memiliki titik mutasi. CTX-M diidentifikasi berasal dari kromosom Kluyvera spp. dan mengalami perubahan bentuk di plasmid (Ghafourian et al. 2014). Gen CTX-M merupakan grup baru dari ESBL dan menjadi emerging secara global dalam dekade terakhir. β-laktamase CTX-M saat sekarang memiliki tingkat kejadian yang paling tinggi dari tipe ESBL lainnya di dunia. Cepatnya penyebaran ESBL tipe CTX-M yang dihasilkan E. coli menjadi masalah yang mendapat perhatian dari bidang kedokteran dan kedokteran hewan (Tamang et al. 2014).
Cemaran Escherichia coli Penghasil ESBL di Rumah Potong Hewan
5 Kejadian E. coli penghasil ESBL secara rutin diobservasi dan sering dilaporkan di beberapa negara. Cemaran E. coli penghasil ESBL di tempat pemotongan sapi di Swiss pada populasi yang berumur kurang dari dua tahun menunjukkan prevalensi sebesar 8.4% (84/571) (Reist et al. 2013). Prevalensi E. coli penghasil ESBL dari hasil penelitian yang dilakukan pada feses sapi perah di Jerman diketahui sebesar 60% (6/10) (Friese et al. 2013). Tingkat kejadian E. coli penghasil ESBL pada feses sapi di beberapa negara diringkas pada Tabel 1.
Tabel 1 Prevalensi E. coli penghasil ESBL pada feses sapi di beberapa negara
6
Dampak Cemaran Escherichia coli Penghasil ESBL
terhadap Kesehatan Masyarakat
Escherichia coli merupakan bakteri komensal pada manusia dan hewan,
tetapi juga dapat menjadi penyebab diare dan infeksi ekstra-intestinal (Wu et al. 2013). Bakteri ini telah menimbulkan sejumlah wabah di dunia dan
menjadi tantangan terhadap pengendalian infeksi. Deteksi laboratorium terhadap infeksi bakteri penghasil ESBL dapat menjadi kompleks, membutuhkan waktu panjang, dan sering menunjukkan kesalahan (Rupp dan Fey 2003).
Pelepasan gen resisten ke lingkungan merupakan tantangan terhadap kesehatan masarakat. Keberadaan gen ESBL telah dilaporkan pada air limbah, air permukaan, sampah, dan sedimen (Ma et al. 2012). Manusia dapat terinfeksi bakteri resisten antibiotik melalui kontak lansung, konsumsi daging tercemar, dan lingkungan (FAO 2011). Horton et al. (2011) menambahkan bahwa kontaminasi fekal merupakan faktor penting dalam penyebaran infeksi bakteri penghasil ESBL ke manusia.
Ketika seseorang terinfeksi bakteri yang telah resisten terhadap antibiotik, pengobatan menjadi lebih sulit karena pengobatan dengan antibiotik standar menjadi kurang efektif. Ketidakefektifan antibiotik mengakibatkan pengobatan akan menjadi lebih lama dan dapat menimbulkan komplikasi, kunjungan dokter akan lebih meningkat, pengobatan dengan obat yang lebih kuat dan mahal disertai dengan efek samping yang besar, dan tingkat kematian akibat infeksi bakteri resisten meningkat (FDA 2012). Beberapa infeksi bakteri resisten melalui makanan dapat mengakibatkan infeksi saluran kemih dan blood poisoning. Anak-anak dengan imunitas rendah lebih sering terinfeksi oleh bakteri yang resisten terhadap antibiotik (FAO 2011).
3
METODE
Bahan
7
Alat
Alat yang digunakan dalam penelitian adalah timbangan digital, spatula steril, gelas erlenmeyer, tabung reaksi (20–50 ml) steril, tube shaker, cawan petri steril (diameter 100 mm dan tinggi 15 mm), kantung plastik steril, api bunsen, refrigerator, penangas air, ose, stomacher, autoklaf, label, spidol, waterbath, dan inkubator.
Disain, Waktu, dan Tempat
Penelitian dilakukan menggunakan metode cross sectional study. Sampel yang digunakan untuk analisis adalah feses sapi dari RPHR Kota Bogor, Jawa Barat. Pengujian sampel dilakukan di Laboratorium Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilakukan pada bulan Agustus 2014–April 2015.
Besaran Sampel
Tingkat kejadian E. coli penghasil ESBL yang diisolasi dari feses belum pernah dilaporkan di Indonesia, sehingga besaran sampel dihitung dengan menggunakan asumsi prevalensi (p) 50%, tingkat kepercayaan 95%, tingkat kesalahan (L) 9.13%, dan q = 1 - p. Besaran sampel (n) dihitung menggunakan rumus ukuran contoh untuk menduga prevalensi n = 4pq/L2 (Martin et al. 1987). Berdasarkan perhitungan, besaran sampel diperoleh sebanyak 120 sampel. Pengambilan sampel dilakukan sebanyak enam tahap dan pada setiap tahapan diambil 20 sampel.
Penarikan Sampel
Penarikan sampel dilakukan pada setiap tahap pengambilan sampel dengan teknik penarikan contoh acak sistematis. Sampel diambil pada setiap selang ke-k berdasarkan jumlah populasi sapi di tempat penampungan RPHR Kota Bogor. Sampel feses diambil dari rektum sapi yang telah dipotong. Sampel diberi kode berupa nomor telinga, asal feedlot, dan tanggal pengambilan sampel. Setelah sampel diambil, sampel disimpan pada cooler box dan dibawa ke laboratorium.
Analisis Laboratorium
Isolasi dan Identifikasi Escherichia coli Penghasil ESBL
8
sefotaksim dan diinkubasi dalam kondisi aerobik pada suhu 37 °C selama 24 jam. Koloni dengan bentuk bulat, berukuran 3–6 mm, berwarna merah, dan dikelilingi zona keruh diduga sebagai E. coli (Gambar 3).
Koloni yang diduga E. coli diuji lebih lanjut dengan pewarnaan Gram, uji KOH, uji oksidase, dan uji biokimia (indol, methyl red, Voges-Proskauer, dan sitrat/IMViC). Bakteri E. coli ditunjukkan dengan karakteristik hasil uji KOH positif dan uji oksidase negatif. Hasil reaksi uji biokimia E. coli mengacu pada Standar Nasional Indonesia (SNI) 2897 Tahun 2008 tentang Metode Pengujian Cemaran Mikroba dalam Daging, Telur, dan Susu Serta Hasil Olahannya. Interpretasi hasil reaksi uji biokimia E. coli dapat dilihat pada Tabel 2. Keseluruhan koloni disubkultur pada media TSB dan diinkubasi pada suhu 37 °C selama 24 jam. Isolat dikultivasi pada TSA dan diinkubasi pada suhu 37 °C selama 24 jam. Isolat disimpan dalam TSB yang mengandung 20% gliserol pada suhu -20 °C sampai pengerjaan tahap selanjutnya.
Isolat yang diduga E. coli diidentifikasi ke tingkat spesies dengan menggunakan kit uji API 20E. Isolat dikultivasi pada TSB dan diinkubasi pada suhu 37 °C selama 24 jam. Selanjutnya untuk mendapatkan koloni terpisah bakteri dikultivasi pada TSA dan diinkubasi pada suhu 37 °C selama 24 jam. Koloni terpisah sebanyak 1-2 koloni diambil dengan cutton swab steril dan dicampurkan ke dalam 5 ml NaCL 0.85% steril hingga kekeruhannya menyamai dengan McFarland 0.5 atau setara dengan 1-2 × 108 cfu/ml. Selanjutnya suspensi bakteri dimasukkan ke kit uji API 20E dan diinkubasi pada suhu 37 °C selama 24 jam. Pembacaan hasil uji menggunakan kit uji API 20E dilakukan melalui aplikasi ApiwebTM.
Gambar 3 Koloni diduga E. coli pada media agar MacConkey. Skala: 1 cm. Tabel 2 Hasil reaksi uji biokimia E. coli
Tipe organisme Indol Methyl red
Voges-Proskauer Sitrat
9
Konfirmasi ESBL
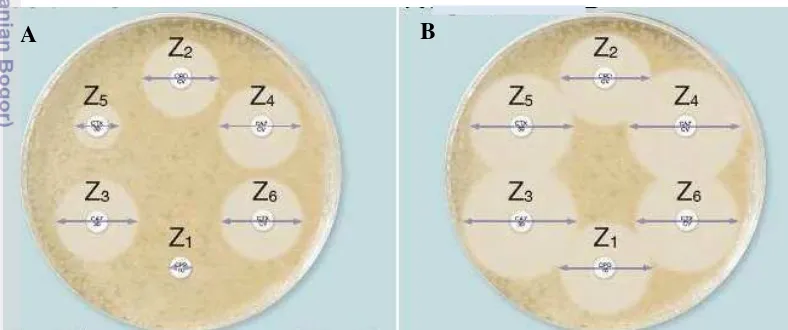
Seluruh isolat E. coli diuji terhadap produksi ESBL dengan metode difusi cakram berdasarkan panduan Clinical and Laboratory Standards Institute (CLSI) (CLSI 2014). Isolat dikultivasi pada TSB dan diinkubasi pada 37 °C selama 24 jam. Biakan dimurnikan kembali pada TSA dan diinkubasi dalam kondisi aerobik pada suhu 37 °C selama 24 jam. Koloni terpisah sebanyak 4-5 koloni diambil dengan cutton swab steril dan dimasukkan ke TSB dan diinkubasi pada suhu 37 °C dan diamati setiap 2 jam (maksimal selama 8 jam) hingga kekeruhannya menyamai dengan McFarland 0.5. Biakan pada TSB diambil menggunakan cutton swab steril dan digoreskan pada MHA dan cakram antibiotik diletakkan pada permukaan MHA, kemudian diinkubasi pada 35 °C selama 24 jam. Zona hambat ditentukan terhadap setiap kertas cakram yang berisikan 30 µg sefotaksim, 30 µg seftazidim, dan 10 µg sefpodoksim dengan atau tanpa kombinasi dengan asam klavulanat dan kemudian dikonfirmasi dengan uji mikrodilusi berdasarkan rekomendasi CLSI. Hasil positif ESBL ditunjukkan dengan perbedaan zona hambat antara antibiotik yang dikombinasi dengan asam klavulanat dengan yang tidak dikombinasi dengan asam klavulanat sebesar ≥5 mm. Escherichia coli ATCC 25922 dan Klebsiella pneumoniae ATCC 700603 digunakan untuk melihat performa terhadap deteksi agen penghasil ESBL dan sebagai kontrol pada setiap uji kepekaan terhadap antibiotik. Konfirmasi ESBL dengan metode difusi cakram diilustrasikan pada Gambar 4.
Keterangan: Z1 seftazidim 30 µg, Z2 seftazidim 30 µg+asam klavulanat 10 µg, Z3 sefotaksim 30 µg, Z4 sefotaksim 30 µg+asam klavulanat 10 µg, Z5 sefpodoksim 10 µg, Z6 sefpodoksim 10 µg+asam klavulanat 1 µg.
Gambar 4 Konfirmasi ESBL dengan metode difusi cakram. ESBL positif (A) ditunjukkan dengan Z2-Z1 ≥5 mm dan/atau Z4-Z3 ≥5 mm dan/atau Z6-Z5 ≥ 5 mm. ESBL negatif (B) ditunjukkan dengan perbedaan zona ≤2 mm (Dimodifikasi dari Mast Group 2014).
Analisis Data
Data yang diperoleh dianalisis secara deskriptif. Data hasil uji tingkat kejadian E. coli penghasil ESBL di feses sapi di RPHR Kota Bogor disajikan
10
dalam bentuk tabel dan gambar. Analisis data dilakukan dengan menggunakan program Microsoft Excel 2007.
4
HASIL DAN PEMBAHASAN
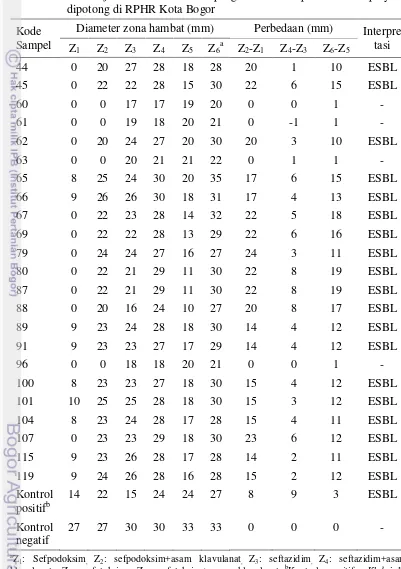
Berdasarkan hasil pengujian laboratorium terhadap feses sapi potong di RPHR Kota Bogor ditemukan E. coli penghasil ESBL sebanyak 19 sampel dari 120 sampel yang diperiksa (15.8%). Hasil uji konfirmasi E. coli penghasil ESBL pada feses sapi di RPHR Kota Bogor disajikan pada Tabel 3. Hasil pengujian juga menunjukkan bahwa E. coli penghasil ESBL ditemukan sebanyak 17% (17/100) dari sampel sapi eks impor dan 10% (2/20) dari sapi lokal (Tabel 4).
Hasil penelitian menunjukkan terdapatnya E. coli penghasil ESBL pada feses sapi yang dipotong di RPHR Kota Bogor. Hal ini tidak jauh berbeda dengan penelitian Hiroi et al. (2011) di feses sapi di RPH Shizuoka, Jepang yang menunjukkan tingkat kejadian E. coli pengahasil ESBL sebesar 12.5% (2/16). Tingkat kejadian E. coli pengahasil ESBL yang lebih tinggi pernah dilaporkan di
feses sapi potong dari 12 RPH di Perancis sebesar 29.4% (143/489) (Haenni et al. 2014). Butaye et al. (2014) menegaskan bahwa RPH merupakan
reservoir tempat terjadinya pencemaran E. coli penghasil ESBL pada pangan asal hewan. Selain RPH, bakteri resisten antibiotik juga telah banyak dilaporkan pada peternakan dan produk daging sapi (Alexander et al. 2010).
Keberadaan E. coli penghasil ESBL di feses sapi yang dipotong di RPHR Kota Bogor dapat terjadi akibat penggunaan antibiotik yang tidak tepat di peternakan. Penggunaan antibiotik golongan β-laktam khususnya sefalosporin generasi ketiga dan keempat diakui sebagai faktor risiko terhadap munculnya bakteri penghasil ESBL pada manusia dan hewan (Johns et al. 2012). Populasi sapi di RPHR Kota Bogor didominasi oleh sapi eks impor. Informasi dari ACSQHC (2015) mengatakan bahwa seftiofur (sefalosporin generasi ketiga) banyak digunakan untuk pengobatan infeksi saluran pernafasan pada sapi potong di negara Australia yang menjadi negara pengekspor sapi ke Indonesia.
Penggunaan antibiotik golongan β-laktam pada sapi potong di Indonesia hampir tidak pernah dilakukan, sehingga keberadaan E. coli penghasil ESBL pada sapi lokal dapat berasal dari lingkungan yang tercemar. Hal ini didukung oleh penyataan Ma et al. (2012) bahwa keberadaan bakteri resisten antibiotik dapat berasal dari lingkungan sekitar tempat pemotongan seperti tanah dan air yang terkontaminasi kotoran atau urin dari sapi. Bakteri E. coli telah menunjukkan perubahan material genetik dan memungkinkan menyebarkan gen resisten ke
bakteri patogen yang dapat menyebabkan penyakit pada manusia (Ryu et al. 2012).
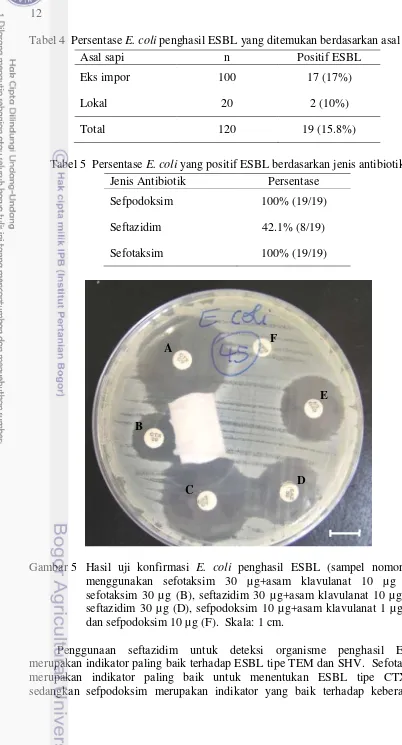
11 berdasarkan jenis antibiotik diringkas pada Tabel 5. Gambar 5 menunjukkan hasil positif uji konfirmasi E. coli penghasil ESBL pada sampel (nomor 45) dengan
Diameter zona hambat (mm) Perbedaan (mm) Interpre tasi
klavulanat, Z5: sefotaksim, Z6: sefotaksim+asam klavulanat.;bKontrol positif: Klebsiella
12
Tabel 4 Persentase E. coli penghasil ESBL yang ditemukan berdasarkan asal sapi
Asal sapi n Positif ESBL
Eks impor 100 17 (17%)
Lokal 20 2 (10%)
Total 120 19 (15.8%)
Tabel 5 Persentase E. coli yang positif ESBL berdasarkan jenis antibiotik Jenis Antibiotik Persentase
Sefpodoksim 100% (19/19)
Seftazidim 42.1% (8/19)
Sefotaksim 100% (19/19)
Gambar 5 Hasil uji konfirmasi E. coli penghasil ESBL (sampel nomor 45) menggunakan sefotaksim 30 µg+asam klavulanat 10 µg (A), sefotaksim 30 µg (B), seftazidim 30 µg+asam klavulanat 10 µg (C), seftazidim 30 µg (D), sefpodoksim 10 µg+asam klavulanat 1 µg (E), dan sefpodoksim 10 µg (F). Skala: 1 cm.
Penggunaan seftazidim untuk deteksi organisme penghasil ESBL merupakan indikator paling baik terhadap ESBL tipe TEM dan SHV. Sefotaksim merupakan indikator paling baik untuk menentukan ESBL tipe CTX-M,
A
B
C D
13 seluruh tipe ESBL (Livermore dan Brown 2005). Uji konfirmasi produksi ESBL menggunakan antibiotik sefalosporin generasi ketiga dan yang dikombinasi dengan asam klavulanat memiliki spesifisitas >98.3%. Penggunaan seftazidim, sefotaksim, dan sefepim masing-masing memiliki sensitifitas sebesar 82.9%, 99.2%, dan 91.1% (Polsfuss et al. 2011). Hasil penelitian menunjukkan bahwa ESBL tipe CTX-M diduga lebih dominan ditemukan dari pada tipe yang lainnya. Gen ESBL CTX-M merupakan grup baru dari ESBL yang dapat ditularkan melalui plasmid (Girlich et al. 2007; Carattoli 2008; Ramos et al. 2013; Korzeniewska dan Harnisz 2013; Tamang et al. 2014).
Jumlah mutasi dari varian ESBL dilaporkan terus meningkat, sehingga infeksi oleh bakteri penghasil ESBL menjadi emerging terhadap kesehatan manusia dan produksi pangan asal hewan (Zurfluh et al. 2013). Sekarang sudah ditemukan lebih dari 300 subtipe ESBL (Korzeniewska dan Harnisz 2013). Bakteri penghasil ESBL juga sering dikaitkan dengan resistensi terhadap antibiotik kelas lain seperti fluorokuinolon, aminoglikosida, dan trimetoprim-sulfametoksazol (Geser et al. 2012). Zurfluh et al. (2013) menyebutkan bahwa gen blaESBL pada plasmid juga merupakan tempat berkumpulnya gen resisten
terhadap kuinolon dan aminoglikosida.
Escherichia coli penghasil ESBL pada feses yang ditemukan di RPHR Kota Bogor berpotensi melepaskan gen-gen resisten ke lingkungan. Kontaminasi bakteri pada air permukaan, terutama yang disebabkan oleh kontaminasi feses dapat menjadi sumber penularan penyakit (Ma et al. 2012). Biosekuriti dalam menangani limbah di RPH harus lebih ditingkatkan untuk mencegah penyebaran E. coli penghasil ESBL ke lingkungan termasuk sungai (Nhung et al. 2014). Sungai merupakan reservoir penting terhadap terhadap penyebaran gen resisten ke bakteri yang berasal dari berbagai sumber (Zurfluh et al. 2013). Lokasi RPHR Kota Bogor yang dekat dengan sungai memiliki risiko yang tinggi terhadap penyebaran E. coli penghasil ESBL. Hal ini menunjukkan bahwa penanganan limbah di RPHR Kota Bogor yang sudah dilengkapi dengan instalasi pengolahan air limbah (IPAL) perlu diawasi lebih ketat. Vektor seperti lalat dan tikus juga diketahui mampu menyebarkan organisme penghasil ESBL ke lingkungan. Oleh karena itu, pengendalian vektor seperti tikus dan lalat sangat perlu dilakukan untuk mencegah penyebaran E. coli resisten antibiotik (Von Salviati et al. 2015).
Keberadaan ESBL mengakibatkan terbatasnya pilihan pengobatan terhadap infeksi bakteri (Nóbrega dan Brocchi 2014). Sebelumnya E. coli penghasil ESBL hanya dianggap sebagai agen infeksi nosokomial (Doi et al. 2010). Bakteri E. coli diketahui dapat menyebabkan bermacam penyakit intestinal dan ekstra-intestinal pada manusia, seperti infeksi saluran kemih, septisemia, dan meningitis neonatal. Diperkirakan 120 juta kasus infeksi saluran urinari terjadi secara global setiap tahun. Selain itu, kasus sepsis yang berkaitan dengan infeksi E. coli diperkirakan terjadi sebanyak 868 000 kasus per tahun di dunia (Wu et al. 2013).
14
makanan yang aman dan pemasakan yang tepat, sangat penting dilakukan untuk menurunkan atau mengeliminasi risiko terjadinya infeksi oleh bakteri yang resisten terhadap antibiotik (Suandy 2011).
5
SIMPULAN DAN SARAN
Simpulan
Tingkat kejadian E. coli penghasil ESBL pada feses sapi potong di RPHR Kota Bogor sebesar 15.8%. Keberadaan E. coli penghasil ESBL dapat menjadi ancaman terhadap kesehatan masyarakat karena kemampuannya menyebarkan gen resisten ke lingkungan, makanan, manusia, hewan, dan bakteri patogen lainnya.
Saran
Berdasarkan penelitian ini, disarankan sampel untuk penelitian berikutnya dapat berasal dari feses hewan di peternakan dan daging di pasar. Selain itu, disarankan ada penelitian lanjutan ke tingkat genetik untuk mengetahui tipe gen penghasil ESBL. Pemerintah perlu membuat regulasi hukum (kebijakan) yang jelas mengenai peredaran, pengawasan, serta penggunaan antibiotik pada hewan. Pemerintah diharapkan dapat meningkatkan pembinaan dan pengawasan terhadap sanitasi dan higiene pada rumah potong hewan serta meningkatkan kesadaran dan kepedulian masyarakat terhadap keamanan pangan asal hewan.
DAFTAR PUSTAKA
Abubakar. 2014. Revitalisasi dan peningkatan kualitas rumah potong hewan (RPH) mendukung swasembada daging 2014. BB Pascapanen [Internet]. [diunduh 2015 Jan 30]. Tersedia pada: http://pascapanen.litbang.deptan. go.id/index. php/en/berita/244.
ACSQHC [Australian Commission on Safety and Quality in Health Care]. 2015. Australian One Health Antimicrobial Resistance Colloquium Background Paper [Internet]. [diunduh 2015 Jul 09]. Tersedia pada: http://www.safetyandquality.gov.au/wp-content/uploads/2013/07/Briefing-paper-for-One-Health-AMR-Colloquium-participants-Final-Jul-2013.pdf. Alexander TW, Inglis GD, Yanke LJ, Topp E, Read RR, Reuter T, McAllister TA.
2010. Farm-to-fork characterization of Escherichia coli associated with feedlot cattle with a known history of antimicrobial use. Int J Food Microbiol. 137:40-48. doi:10.1016/j.ijfoodmicro.2009.11.008.
Bell C, Kyriakides A. 2002. Salmonella: A Pratical Approach to the Organism and Its Control in Food. Iowa (US): Blackwell Sci.
15 Olahannya. Jakarta (ID): Badan Standardisasi Indonesia.
Butaye P, van Duijkeren E, Prescott JF, Schwarz S. 2014. Antimicrobial
[CDC] Centers for Disease Control and Prevention. 2010. Laboratory detection of extended-spectrum β-lactamases (ESBLs). CDC [Internet]. [diunduh 2015 Feb 22]. Tersedia pada: http://www.cdc.gov/ HAI/settings/lab/ lab_esbl.html.
[CLSI] Clinical and Laboratory Standards Institute. 2014. Performance Standards for Antimicrobial Susceptibility Testing: Twenty-Second Informational Supplement. Wayne (US): Clinical and Laboratory Standards Institute.
Cottell JL, Kanwar N, Courtade LC, Chalmers G, Scott HM, Norby B, Loneragan GH, Boerlin P. 2013. blaCTX-M-32 on an IncN plasmid in Escherichia coli from beef cattle in the United States. Antimicrob Agents Chemother. 57(2): 1096-1097.
Davies J, Davies D. 2010. Origins and evolution of antibiotic resistance [ulas balik]. Microbiol Mol Biol Rev. 74:417-433. doi:10.1128/MMBR.00016-10. Dierikx CM. 2013. β-lactamases in Enterobacteriaceae in broiler [tesis]. Utrecht
(NL): GVO [Internet]. [diunduh 2014 Feb 22]. Tersedia pada: http://dspace.library.uu.nl/handle/1874/275609.
Doi Y, Paterson DL, Egea P, Pascual A, López-Cerero L, Navarro MD, Adams-Haduch JM, Qureshi ZA, Sidjabat HE, Rodríguez-Bańo J. 2010. Extended -spectrum and CMY-type β-lactamase-producing Escherichia coli in clinical samples and retail meat from Pittsburgh, USA and Seville, Spain. Clin Microbiol Infect. 16:33-38. doi:10.1111/j.1469-0691.2009.03001.x.
[FAO] Food and Agriculture Organization. 2011. Antibiotics in farm animal production. Public health and animal welfare. FAO [Internet]. [diunduh 2015 Feb 22]. Tersedia pada: http://www.fao.org/fileadmin/user_upload/ animalwelfare/antibiotics_in_animal_farming.pdf.
[FDA] Food and Drug Administration. 2012. Antimicrobial resistance. FDA [Internet]. [diunduh 2015 Feb 22]. Tersedia pada:http://www.fda.gov/ NewsEvents/PublicHealthFocus/ucm235649.htm.
16
Geser N, Stephan R, Korczak BM, Beutin L, Hächler H. 2012. Molecular identification of extended spectrum β-lactamase genes from Enterobacteriaceae isolated from healthy human carriers in Switzerland. Antimicrob Agents Chemother. 56(3):1609-1612. doi:10.1128/AAC.05539-11.
Ghafourian S, Sadeghifard N, Soheili S, Sekawi Z. 2014. Extended spectrum β -lactamases: definition, classification and epidemiology. Curr Issues Mol Biol. 17:11-22.
Giedraitienė A, Vitkauskienė A, Naginienė R, Pavilonis A. 2011. Antibiotic resistance mechanisms of clinically important bacteria [ulas balik]. Medicina. 47(3):137-146. Comparative prevalence and characterization of ESBL producing Enterobacteriaceae in dominant versus subdominant enteric flora in veal calves at slaughterhouse, France. Vet Microbiol. 171:321-327. doi:10.1016/j.vetmic.2014.02.023.
Hiroi M, Yamazaki F, Harada T, Takahashi N, Iida N, Noda Y, Yagi M, Nishio T, Kanda T, Kawamori F, Sugiyama K, Masuda T, Hara-Kudo Y, Ohashi N. 2011. Prevalence of extended spectrum β-lactamase producing Escherichia coli and Klebsiella pneumoniae in food producing animals. J Vet Med Sci. 74(2): 189-195. doi: 10.1292/jvms.11-0372.
Horton RA, Randall LP, Snary EL, Cockrem H, Lotz S, Wearing H, Duncan D, Rabie A, McLaren I, Watson E, La Ragione RM, Coldham NG. 2011. Fecal carriage and shedding density of CTX-M extended spectrum β-lactamase producing Escherichia coli in cattle, chickens, and pigs:
implications for environmental contamination and food production. Appl Environ Microbiol. 77 (11): 3715-3719. doi:10.1128/AEM.02831-10.
Johns I, Verheyen K, Good L, Rycroft A. 2012. Antimicrobial resistance in faecal Escherichia coli isolates from horses treated with antimicrobials: a longitudinal study in hospitalised and non-hospitalised horses. Vet Microbiol. 159:381-389. doi:10.1016/j.vetmic.2012.04.010.
Korzeniewska E, Harnisz M. 2013. Extended spectrum beta-lactamase (ESBL)-positive Enterobacteriaceae in municipal sewage and their emission to the environment. J Environ Man. 128:904-911. doi:10.1016/ j.jenvman.2013.06.051.
Livermore DM, Brown DFJ. 2005. Detection of β-lactamase-mediated resistance. BSAC [Internet]. [diunduh 2015 Feb 12]. Tersedia pada: http://bsac.org.uk/wp-content/uploads/2012/02/Chapter_6.pdf.
17 Martin SW, Meek AH, Willeberg P. 1987. Veterinary Epidemiology: Principles
and Methods. Iowa (US): Iowa State University Pr.
Mast Group. 2014. ESBL and AmpC detection disc sets. Mast Group [Internet]. [diunduh 2015 Feb 22]. Tersedia pada: http://www.mastgrp.com.
Nhung NT, Cuong NV, Campbell J, Hoa NT, Bryant JE, Truc NTT, Kiet BT, Jombart T, Trung NV, Hien, Thwaites, Baker S, Carrique-Mas J. 2014. High levels of antimicrobial resistance among Escherichia coli isolates from livestock farms and synanthropic rats and shrews in the Mekong Delta of Vietnam. Appl Environ Microbiol. 81:812-820. doi:10.1128/AEM. 03366-14.
Nóbrega DB, Brocchi M. 2014. An overview of extended spectrum beta-lactamases in veterinary medicine and their public health consequences [ulas balik]. J Infect Dev Ctries. 8(8):954-960. doi:10.3855/jidc.4704. Nørrung B, Andersen JK, Buncic S. 2009. Main Concerns of Pathogenic
Microorganism in Meat. Di dalam: Toldrá F, editor. Safety of Meat and Processed Meat. Valencia (SP): Springer. hlm 3-29.
Polsfuss S, Bloemberg GV, Giger J, Meyer V, Bӧttger EC, Hombach M. 2011. Evaluation of a diagnostic flow chart for detection and confirmation of extended spectrum β-lactamases (ESBL) in Enterobacteriaceae. Clin Microbiol Infect. 18:1194-1204. doi:10.1111/j.1469-0691.2011.03737.x. Ramos S, Igrejas G, Silva N, Jones-Dias D, Capelo-Martinez JL, Caniça M, Poeta
P. 2013. First report of CTX-M producing Escherichia coli, including the new ST2526, isolated from beef cattle and sheep in Portugal. Food Control. 31:208-210. doi:10.1016/j.foodcont.2012.10.011.
Reich F, Atanassova V, Klein G. 2013. Extended spectrum β-lactamase and AmpC-producing Enterobacteriaceae in healthy broiler chickens, Germany. Emerg Infect Dis. 19(8):1253-1259. doi:10.3201/eid1908.120879.
Reist M, Geser N, Hächler H, Schärrer S, Stephan R. 2013. ESBL-producing Enterobacteriaceae: occurrence, risk factors for fecal carriage and strain traits in the Swiss slaughter cattle population younger than 2 years sampled at abattoir level. Plos One. 8(8):71717-71725. doi:10.1371/ journal.pone.0071725.
Rocha-Gracia CR, Cortés-Cortés G, Lozano-Zaraín P, Bello F, Martínez-Laguna Y, Torres C. 2014. Faecal Escherichia coli isolates from healthy dogs harbour CTX-M-15 and CMY-2 β-lactamases. Vet J. 203(3):315-319. doi: 10.1016/j.tvjl.2014.12.026.
Rupp ME, Fey PD. 2003. Extended spectrum β-lactamase (ESBL)-producing Enterobacteriaceae. Drugs. 63(4):353-365.
Ryu SH, Lee JH, Park SH, Song MO, Park SH, Jung HW, Park GY, Choi SM, Kim MS, Chae YZ, Park SG, Lee YK. 2012. Antimicrobial resistance profiles among Escherichia coli strains isolated from commercial and cooked foods. Int J Food Microbiol. 159:263-266. doi:10.1016/ j.ijfoodmicro.2012.09.001.
Salvadori M, Coleman BL, Louie M, Mcewen S, Mcgeer A. 2004. Consumption of Antimicrobial Resistant Escherichia coli Contaminated Well Water: Human Health Impact. New York (US): PSI Clinical Research. hlm 6-25. Schmid A, Hörmansdorfer S, Messelhäusser U, Käsbohrer A, Sauter-Louis C,
18
Sudarwanto M, Akineden O, Odenthal S, Gross M, Usleber E. 2015. Extended-spectrum β-lactamase (ESBL) producing Klebsiella pneumoniae in bulk tank milk from dairy farms in Indonesia. Foodborne Pathog Dis. 12(7):585-590. doi: 10.1089/fpd.2014.1895.
Tamang MD, Gurung M, Kang MS, Nam HM, Moon DC, Jang GC, Jung SC, Park YH, Lim SK. 2014. Characterization of plasmids encoding CTX-M β -lactamase and their addiction systems in Escherichia coli isolates from animals. Vet Microbiol. 174:456-462. doi.org/10.1016/j.vetmic.2014.10. 004.
Todar K. 2011. Online textbook of bacteriology [Internet]. [diunduh 2015 Feb 22]. Tersedia pada: http://www.textbookof bacteriology.net/ resantimicrobial_3.html.
Usoz EO, González D, Vitas AI, Leiva J, Jalón IG, Casquero AF, Escolano MS. 2012. Prevalence of extended spectrum β-lactamase producing Enterobacteriaceae in meat products sold in Navarra, Spain. Meat Sci. 93(2):316-21. doi:10.1016/j.meatsci.2012.09.009.
Valat C, Auvray F, Forest K, Métayer V, Gay E, de Garam P, Madec JY, Haenni M. 2012. Phylogenetic grouping and virulence potential of extended spectrum β-lactamase producing Escherichia coli strains in cattle. Appl Environ Microbiol. 78 (13): 4677-4682. doi:10.1128/AEM.00351-12.
Von Salviati C, Laube H, Guerra B, Roesler U, Friese A. 2015. Emission of ESBL/AmpC-producing Escherichia coli from pig fattening farms to surrounding areas. Vet Microbiol. 175:77-84. doi:10.1016/ j.vetmic.2014.10. 010.
Whagela SD. 2004. Pathogenic Escherichia coli. Di dalam: Beier RC, Pillai SD, Phillips TD, Ziprin RL, editor. Preharvest and Postharvest Food Safety: Contemporary Issue and Future Direction. Iowa (US): Blackwell Sci and The Institute of Food Technologist Pr.
Wu G , Day MJ, Mafura MT, Garcia JN, Fenner JJ, Sharma M, van Essen-Zandbergen A, Rodríguez I, Dierikx C, Kadlec K, Schink AK, Wain J, Helmuth R, Guerra B, Schwarz S, Threlfall J, Woodward MJ, Woodford N, Coldham N, Mevius D. 2013. Comparative analysis of ESBL-positive Escherichia coli isolates from animals and humans from the UK, The Netherlands and Germany. Plos One. 9(9): 108834-108843. doi:10.1371/ journal.pone.0108834.
19