ABSTRAK
BESTRAN VIRLANDO PANJAITAN. Aplikasi Primer Mikrosatelit pada Proses Seleksi Padi Varietas Code untuk Sifat Umur Berbunga. Dibimbing oleh I MADE ARTIKA dan JOKO PRASETIYONO.
Code merupakan varietas padi unggul tahan penyakit hawar daun bakteri, namun umur berbunga padi Code masih cukup lama. Hal tersebut mendorong dilakukannya perbaikan genetik padi varietas Code untuk mempersingkat umur berbunga. Perbaikan potensi varietas Code dengan penyisipan gen qDTH8 yang mengatur sifat umur berbunga diharapkan dapat mempersingkat umur panen dan menambah hasil panen per tahun. Penelitian ini bertujuan menyeleksi galur padi BC1F1 Code-qDTH8 yang dilakukan dengan menggunakan metode analisis molekuler PCR berbasis primer mikrosatelit atau SSR (Simple Sequence Repeat) dan analisis karakter agronomi padi BC1F1. Sebanyak 250 galur padi BC1F1 Code-qDTH8 hasil persilangan Code dan IR64-NILs-qDTH8 [YP1] diseleksi dengan menggunakan primer RM5556 (qDTH8), RM6838 (qDTH8), dan RM20582 (Xa7). Berdasarkan analisis molekuler, dari 250 galur BC1F1 sebanyak 136 galur memenuhi pola genotipe heterozigot Xa7 dan heterozigot qDTH8. Hasil pengamatan karakter agronomis umur berbunga 136 galur BC1F1 menunjukkan adanya pengurangan umur berbunga sekitar 14 hari.
Kata kunci: Code, IR64-NILs-qDTH8 [YP1], qDTH8, SSR, Padi
ABSTRACT
BESTRAN VIRLANDO PANJAITAN. Microsatellite Primer Application in Selection Process of Rice Variety of Code for Heading Date Character. Supervised by I MADE ARTIKA and JOKO PRASETIYONO.
Code is a variety of rice resistant to bacterial leaf blight disease, but heading date of Code variety is long. It encouraged genetic improvement of Code variety to shorten the heading date. The improvement of Code by inserting qDTH8 that controls heading day character is expected to shorten harvest time and to increase yield of harvest per year. This study was aimed to select BC1F1 Code-qDTH8 lines using microsatellite primer or SSR (Simple Sequence Repeat) of PCR molecular analysis method and to analyze agronomic characters of BC1F1. As many as 250 lines of BC1F1, derived from Code and IR64-NILs-qDTH8 [YP1] were screened using RM5556 (qDTH8), RM6838 (qDTH8), and RM20582 (Xa7) primers. Based on the molecular analysis, there were 136 cultivars from 250 cultivars that had same genotype pattern of heterozygote allele for Xa7 and homozygote allele for qDTH8. The heading date of BC1F1 has been shorten by 14 days based on observation of agronomic characters in 136 BC1F1 cultivars.
APLIKASI PRIMER MIKROSATELIT PADA PROSES
SELEKSI PADI VARIETAS CODE UNTUK SIFAT
UMUR BERBUNGA
BESTRAN VIRLANDO PANJAITAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
APLIKASI PRIMER MIKROSATELIT PADA PROSES
SELEKSI PADI VARIETAS CODE UNTUK SIFAT
UMUR BERBUNGA
BESTRAN VIRLANDO PANJAITAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Primer Mikrosatelit pada Proses Seleksi Padi Varietas Code untuk Sifat Umur Berbunga adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh BB Biogen atas nama Dr. Joko Prasetiyono, MSi. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada BB Biogen.
ABSTRAK
BESTRAN VIRLANDO PANJAITAN. Aplikasi Primer Mikrosatelit pada Proses Seleksi Padi Varietas Code untuk Sifat Umur Berbunga. Dibimbing oleh I MADE ARTIKA dan JOKO PRASETIYONO.
Code merupakan varietas padi unggul tahan penyakit hawar daun bakteri, namun umur berbunga padi Code masih cukup lama. Hal tersebut mendorong dilakukannya perbaikan genetik padi varietas Code untuk mempersingkat umur berbunga. Perbaikan potensi varietas Code dengan penyisipan gen qDTH8 yang mengatur sifat umur berbunga diharapkan dapat mempersingkat umur panen dan menambah hasil panen per tahun. Penelitian ini bertujuan menyeleksi galur padi BC1F1 Code-qDTH8 yang dilakukan dengan menggunakan metode analisis molekuler PCR berbasis primer mikrosatelit atau SSR (Simple Sequence Repeat) dan analisis karakter agronomi padi BC1F1. Sebanyak 250 galur padi BC1F1 Code-qDTH8 hasil persilangan Code dan IR64-NILs-qDTH8 [YP1] diseleksi dengan menggunakan primer RM5556 (qDTH8), RM6838 (qDTH8), dan RM20582 (Xa7). Berdasarkan analisis molekuler, dari 250 galur BC1F1 sebanyak 136 galur memenuhi pola genotipe heterozigot Xa7 dan heterozigot qDTH8. Hasil pengamatan karakter agronomis umur berbunga 136 galur BC1F1 menunjukkan adanya pengurangan umur berbunga sekitar 14 hari.
Kata kunci: Code, IR64-NILs-qDTH8 [YP1], qDTH8, SSR, Padi
ABSTRACT
BESTRAN VIRLANDO PANJAITAN. Microsatellite Primer Application in Selection Process of Rice Variety of Code for Heading Date Character. Supervised by I MADE ARTIKA and JOKO PRASETIYONO.
Code is a variety of rice resistant to bacterial leaf blight disease, but heading date of Code variety is long. It encouraged genetic improvement of Code variety to shorten the heading date. The improvement of Code by inserting qDTH8 that controls heading day character is expected to shorten harvest time and to increase yield of harvest per year. This study was aimed to select BC1F1 Code-qDTH8 lines using microsatellite primer or SSR (Simple Sequence Repeat) of PCR molecular analysis method and to analyze agronomic characters of BC1F1. As many as 250 lines of BC1F1, derived from Code and IR64-NILs-qDTH8 [YP1] were screened using RM5556 (qDTH8), RM6838 (qDTH8), and RM20582 (Xa7) primers. Based on the molecular analysis, there were 136 cultivars from 250 cultivars that had same genotype pattern of heterozygote allele for Xa7 and homozygote allele for qDTH8. The heading date of BC1F1 has been shorten by 14 days based on observation of agronomic characters in 136 BC1F1 cultivars.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
BESTRAN VIRLANDO PANJAITAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
APLIKASI PRIMER MIKROSATELIT PADA PROSES
SELEKSI PADI VARIETAS CODE UNTUK SIFAT
Judul Skripsi : Aplikasi Primer Mikrosatelit pada Proses Seleksi Padi Varietas Code untuk Sifat Umur Berbunga
Nama : Bestran Virlando Panjaitan NIM : G84100083
Disetujui oleh
Dr Ir I Made Artika, MAppSc Dr Joko Prasetiyono, MSi Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah melimpahkan berkat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik dan lancar. Karya ilmiah yang berjudul Aplikasi Primer Mikrosatelit pada Proses Seleksi Padi Varietas Code untuk Sifat Umur Berbunga ini dilaksanakan pada bulan Februari hingga Juli 2014 di laboratorium Biologi Molekuler dan rumah kaca Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB BIOGEN).
Penulis mengucapkan terima kasih kepada Dr Ir I Made Artika, MAppSc dan Dr Joko Prasetiyono, MSi sebagai pembimbing penelitian yang telah membimbing dan memberikan pengarahan dalam upaya penyelesaian karya ilmiah ini. Ucapan terima kasih penulis sampaikan terutama kepada kepada orang tua, Bapa dan Mama, serta seluruh keluarga atas doa dan bantuannya kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Ibu Ma’sumah, Ibu Tasliah, dan seluruh rekan-rekan lainnya di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB BIOGEN).
Penulis mengharapkan kritik dan saran yang membangun untuk menyempurnakan isi karya ilmiah ini. Semoga hasil penelitian dan karya ilmiah ini dapat bermanfaat bagi semua pihak dalam bidang ilmu pengetahuan, khususnya bidang biokimia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL 4
Kualitas dan Kuantitas DNA Padi BC1F1 Code-qDTH8 4 Seleksi BC1F1 Code-qDTH8 secara Molekuler 5
Karakter Agronomis Padi BC1F1 Code-qDTH8 7
PEMBAHASAN 9
Karakterisasi DNA Hasil Isolasi 9
Amplifikasi DNA Padi BC1F1 Code-qDTH8 9
Karakter Agronomi Padi BC1F1 Code-qDTH8 10
SIMPULAN DAN SARAN 13
DAFTAR PUSTAKA 13
LAMPIRAN 16
DAFTAR TABEL
1 Hasil pengukuran kuantitas dan kemurnian DNA padi BC1F1 5
2 Hasil scoring pita elektroforegram DNA padi 6
3 Pola genotipe padi BC1F1 dengan seleksi 3 marka 6 4 Tabulasi hasil pengamatan karakter agronomis padi BC1F1 Code-qDTH8 8
DAFTAR GAMBAR
1 Elektroforegram beberapa DNA daun padi BC1F1 hasil isolasi 5 2 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM5556 6 3 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM6838 7 4 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM20582 7
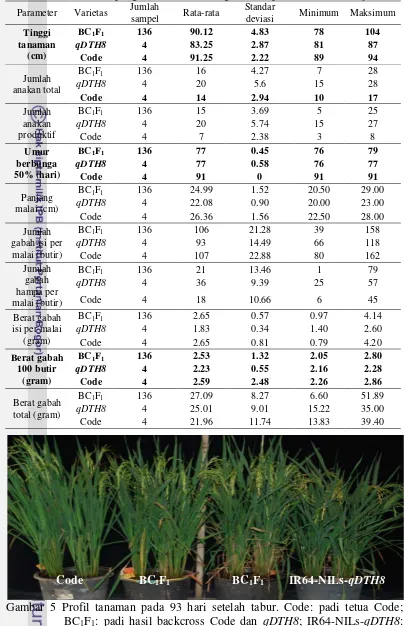
5 Profil tanaman pada 93 hari setelah tabur 8
6 Regulasi proses pembungaan oleh gen DTH8 (Ghd8) terhadap gen Ehd1,
Hd3a, dan RFT1 12
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
2 Diagram persilangan 17
3 Elektroforegram DNA padi 18
4 Informasi primer yang digunakan dalam penelitian 21 5 Tabel scoring analisis molekuler padi BC1F1 21
6 Sebaran Data Karakter Agronomi BC1F1 24
PENDAHULUAN
Padi varietas Code merupakan kelompok padi sawah varietas unggul tahan penyakit hawar daun bakteri (HDB) yang merupakan hasil persilangan IR64 dan IRBB7. Padi Code memiliki gen Xa7 yang terkait dengan ketahanan beberapa strain Xanthomonas oryzae pv oryzae, seperti strain II, IV, dan VIII. Padi Code juga diketahui memiliki ketahanan terhadap wereng coklat biotipe 1, 2, dan agak tahan terhadap biotipe 3. Karakteristik lain dari padi Code adalah umur tanaman 115-125 hari, dapat menghasilkan anakan sekitar 16-24 batang, tinggi tanaman sekitar 97-103 cm dan hasil panen sekitar 5.4 ton/ha (Leung et al. 2004; Suprihatno et al. 2009). Meskipun padi varietas Code memiliki sifat unggul tahan terhadap HDB, perbaikan varietas padi Code tetap perlu dilakukan untuk memenuhi kebutuhan pangan nasional yang terus meningkat dan menghadapi fenomena perubahan iklim yang terjadi. Salah satu langkah pengembangan yang dapat dilakukan untuk menghadapi perubahan iklim, yaitu dengan cara penyisipan gen pengatur umur berbunga (Days to Heading). Salah satu gen pengatur umur berbunga yang cukup dikenal adalah qDTH8, yaitu gen penyandi umur berbunga yang terletak pada kromosom 8 (Zhang et al. 2006; Fujita et al. 2010).
Proses seleksi varietas padi dapat dilakukan dengan metode konvensional dan dengan metode marka molekuler. Pengembangan varietas secara konvensional dapat dilakukan dengan cara melakukan proses seleksi fenotipe atau morfologi terhadap tanaman yang memiliki suatu sifat unggul dan kemudian disilangkan. Metode ini memiliki beberapa kelemahan, yaitu hasil persilangan yang tidak konsisten dan waktu persilangan yang cukup lama (Nuraida 2012). Metode marka molekuler kemudian dirancang untuk mengatasi kelemahan dari metode konvensional. Metode marka molekuler memanfaatkan suatu sifat unggul yang dapat diwariskan oleh tanaman sehingga sifat tersebut dapat dimiliki oleh keturunan selanjutnya. Proses identifikasi sifat itu sendiri dilakukan dengan menggunakan marka DNA sehingga varietas yang dihasilkan lebih konsisten dan lebih akurat (Azrai 2006).
Marka DNA merupakan marka pengembangan dari marka isozim yang memiliki beberapa kelebihan, seperti kemampuan untuk melingkupi seluruh genom tanaman, jumlahnya tidak terbatas, tidak dipengaruhi oleh regulasi perkembangan jaringan, dan memiliki kemampuan tinggi untuk menangkap keragaman karakter antarindividu (Nuraida 2012). Penggolongan marka DNA dengan menggunakan mesin PCR (Polymerase Chain Reaction) dapat dibagi ke dalam tiga golongan, yaitu marka berdasarkan hibridisasi DNA (Restriction Fragment Length Polymorphism [RFLP]), marka berdasarkan pada reaksi rantai polimerase PCR secara acak (Random Amplified Polymorphic DNA [RAPD] dan Amplified Fragment Length Polymorphism [AFLP]), dan marka berdasarkan pada PCR yang menggunakan primer terarah (Sequence Tagged Sites [STS], Sequence Characterized Amplified Regions [SCARs], Simple Sequence Repeats [SSR] atau mikrosatelit, dan Single Nucleotide Polymorphism [SNPs]) (Azrai 2005).
disilangbalikkan (backcross) dengan Code sehingga menghasilkan tanaman padi BC1F1 yang mengandung gen Xa7 dan qDTH8.
Proses seleksi terhadap padi galur BC1F1 secara molekuler dengan primer mikrosatelit masih belum dilakukan. Selain itu, analisis karakter agronomi padi Code masih belum banyak diketahui. Penelitian ini bertujuan menyeleksi galur padi BC1F1 Code-qDTH8 yang dilakukan dengan menggunakan metode analisis molekuler PCR berbasis primer mikrosatelit atau SSR (Simple Sequence Repeat) dan analisis karakter agronomi padi BC1F1 Code-qDTH8. Manfaat dari penelitian ini adalah diperolehnya galur BC1F1 Code x IR64-NILs-qDTH8 [YP1] dengan umur berbunga yang lebih singkat dibandingkan dengan galur Code. Penelitian ini juga akan mempermudah proses pemilihan genotipe untuk menghasilkan keturunan BC2F1 dan BC1F2.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan, antara lain tanaman padi (Code, IR64-NILs-qDTH8 [YP1], dan galur-galur BC1F1 Code-qDTH8), medium tanah, nitrogen cair, etanol absolut, etanol 70%, kloroform:isoamilalkohol (24:1), isopropanol dingin, RNase, bufer ekstrak (EDTA 50 mM, tris-HCl 100 mM pH 8.0, NaCl 500 mM, SDS (Sodium Deodecyl Sulphate) 1.25%, dan NaOH 8.3 mM), agarose, bufer Tris Boric EDTA (TBE) 0.5X, loading buffer (loading dye), larutan TE 1X, DNA ladder 100 bp (Generuler), primer mikrosatelit (RM 20852, RM 20593, RM 5556, RM 6836, dan M5), bufer PCR 1X (10 mM tris-HCl pH 8.3, 50 mM KCl, 1.5 mM MgCl2, 0.01% gelatin), 100 μM dNTPs (dATP, dCTP, dGTP, dan dTTP), 0.5 μM primer (forward & reverse), 1 unit taq DNA polymerase, dan ddH2O.
Alat-alat yang digunakan, antara lain bak plastik, ember, sumpit, kertas saring, tabung mikro, neraca analitik, sentrifus Beckman MicrofugeTM 12, pipet mikro, pipet volumetrik, penangas air, cetakan gel, sisir, spatula, erlenmeyer, gelas piala, gelas ukur, autoklaf, magnetic stirrer, microwave, parafilm, PS500XT DC power supply, alat elektroforesis, UV transilluminator (Chemidoc gel system BIORADTM), minivortex BioRad, mesin PCR (PCR BioRad T100TM Thermal Cycler), dan spektrofotometer nanodrop Thermo Fisher Scientific 2009.
Prosedur Penelitian
Penumbuhan Benih Padi Code, IR64-NILs-qDTH8, dan BC1F1
Isolasi DNA Padi Metode Miniprep (Dellaporta et al. 1983)
Sebanyak 0.5 gram sampel daun padi dipotong kecil-kecil dan dimasukkan ke dalam tabung 2 mL. Tabung dikumpulkan dalam suatu wadah. Nitrogen cair ditambahkan dan dibiarkan selama 5 menit. Tabung mikro diambil dan digerus dengan sumpit hingga menjadi serbuk halus. Tabung yang telah berisi serbuk daun padi tersebut ditambahkan 800 µL bufer ekstrak, lalu diinkubasi pada suhu 65o C selama 15 menit. Setelah itu, tabung dibolak-balik agar ekstrak tercampur secara merata. Selanjutnya, 800 µL larutan campuran kloroform dan isoamilalkohol dengan perbandingan 24:1 ditambahkan ke dalam tabung, kemudian tabung dibolak-balik kembali hingga larutan tercampur dengan merata. Tabung kemudian disentrifus dengan kecepatan 8000 rpm selama 20 menit.
Supernatan yang terbentuk diambil ± 600 µL dan dipindahkan ke dalam tabung baru. Selanjutnya ditambahkan etanol absolut dingin sebanyak dua kali volume supernatan yang diambil, tabung dibolak-balik hingga tercampur merata lalu diinkubasi selama ± 1 jam ke dalam freezer (-20 oC). Setelah diinkubasi selama ± 1 jam, kemudian disentrifugasi selama 15 menit dengan kecepatan 12000 rpm. Supernatan dibuang, sedangkan pelet yang terbentuk ditambahkan 800 µL etanol 70 % lalu disentrifugasi kembali dengan kecepatan 12000 rpm selama 15 menit. Selanjutnya, supernatan dibuang dan pelet yang diperoleh dikeringanginkan selama semalam (overnight). Pelet yang telah kering dilarutkan dengan 200 μL ddH2O untuk analisis selanjutnya.
Analisis Kualitatif DNA dengan Elektroforesis Gel Agarosa (Sambrook & Russell 2001)
Gel agarosa 0.8 % dan bufer TBE 0.5x disiapkan pada cetakan terlebih dahulu. Larutan dipanaskan ke dalam microwave selama 2-4 menit hingga agar larut. Larutan yang sudah tercampur dimasukkan ke dalam cetakan agar yang sudah diberi cetakan sumur. Setelah gel agarosa memadat, gel dimasukkan ke dalam bak elektroforesis yang berisi 0.5 x bufer TBE. Sebanyak 1 μL sampel DNA ditambahkan dengan 1 μL loading dye dan dicampur, kemudian dimasukkan ke dalam sumur gel. Proses running elektroforesis dilakukan dengan voltase 100V selama ± 90 menit. Hasil running elektroforesis selanjutnya divisualisasi dengan UV transiluminator.
Analisis Kuantitatif DNA dengan Spektrofotometer Nanodrop (Thermo Fisher Scientific 2009)
Analisis SSR (Fujita et al. 2012)
Campuran larutan PCR dibuat dengan mencampurkan 3 μL DNA (50 ng/ µL) dan PCR MIX yang mengandung 2 µL 10x bufer PCR, 0.2 µL dNTPs 10 µM, 0.2 µL MgCl2, 0.5 µL GC-Rich, 1 µL primer reverse dan forward 5 µM (RM 5556, RM 6836, dan RM20582 [Xa7]), 0.12 µL Taq DNA polimerase dan ditambahkan ddH2O hingga volume mencapai 10 µL. Campuran DNA dimasukkan ke dalam plate dan kemudian dimasukkan ke dalam mesin PCR. Program PCR yang digunakan adalah denaturasi awal selama 5 menit pada suhu 94oC, dilanjutkan dengan 35 siklus yang terdiri atas: denaturasi (denaturation) selama 60 detik pada suhu 94oC, penempelan primer (annealing) selama 60 detik pada suhu 55oC, dan perpanjangan primer (extension) selama 2 menit pada suhu 72oC. Perpanjangan primer terakhir dilakukan selama 7 menit pada suhu 72oC.
Elektroforesis Hasil PCR (Sambrook et al. 1989)
Analisis hasil PCR menggunakan elektroforesis gel poliakrilamida (PAGE) diawali dengan menyiapkan rangkaian alat elektroforesis terlebih dahulu. Plat kaca dibersihkan dengan alkohol dan dibiarkan hingga kering. Kaca yang telah kering lalu digabungkan yaitu antara kaca A dan kaca B. Gel poliakrilamid dibuat dengan mencampurkan larutan PAGE yaitu 8% poliakrilamid sebanyak 800 ml, APS (Ammonium Persulfat) 10% sebanyak 800 µL dan TEMED (tetrametilen-etilendiamin) sebanyak 80 µL. Campuran diaduk hingga merata lalu dituangkan ke dalam cetakan kaca yang telah dirangkai terlebih dahulu dengan cepat. Gel didiamkan memadat selama 60 menit.
Gel poliakrilamid yang telah memadat pada cetakan kaca dimasukan ke dalam tangki elektroforesis horizontal dan ditambahkan bufer TBE 0.5x ke dalamnya. Setelah gel siap, produk PCR yang telah ditambahkan 4µL loading dye dimasukkan ke dalam sumur gel sebanyak 4 µL dan disertakan DNA marker 100 bp ladder sebanyak 3 µL sebagai pembanding pada sumur pertama untuk melihat ukuran DNA. Selanjutnya sampel DNA dialiri arus listrik dengan daya 100 volt selama 90 menit. Gel poliakrilamid yang telah selesai running dicuci dengan dH2O dan diwarnai dengan etidium bromida. Gel poliakrilamid kemudian didokumentasi dengan alat gel doc Biorad.
Analisis Data
Data molekuler yang diperoleh dari pita-pita DNA hasil elektroforesis dianalisis dengan melihat posisi pita dalam elektroforegram dan digunakan sebagai penentu seleksi tanaman BC1F1. Data agronomi yang meliputi data tinggi tanaman, jumlah anakan, jumlah anakan produktif, umur berbunga, panjang malai, jumlah gabah isi, jumlah gabah hampa, berat 100 butir gabah, dan berat gabah total dianalisis menggunakan program Microsoft Excel dan program statistik SAS.
HASIL
Kualitas dan Kuantitas DNA Padi BC1F1 Code-qDTH8
menunjukkan sampel hasil isolasi yang murni karena tidak ditemukan adanya smear pada pita. Uji kualitatif DNA menggunakan DNA lambda sebagai pembanding yang telah diketahui konsentrasinya, yaitu sebesar 50 ng/µL. Uji kuantitas DNA dilakukan untuk mengetahui konsentrasi dan kemurnian DNA hasil isolasi. Hasil elektroforesis menunjukkan bahwa tidak terdapat fragmen smear dan ketebalan pita DNA sampel lebih tebal dibandingkan pita DNA lambda. Hasil pengukuran kuantitas DNA menggunakan spektrofotometer nanodrop berada pada rentang 10-3700 ng/µL dan kemurniannya berada pada rentang 1.8-2.0 (Tabel 1).
Gambar 1 Elektroforegram beberapa DNA daun padi BC1F1 hasil isolasi. DNA lamda konsentrasi 50 ng/μL: Marker; (146), (149), (152), (157), (161), (165), (170), (178), (184), (188), dan (192): Sampel DNA padi BC1F1. Tabel 1 Hasil pengukuran konsentrasi dan kemurnian DNA padi BC1F1
A260/A280 Jumlah Sampel Konsentrasi (μg/mL) Jumlah Sampel
1.78 1 10 – 500 53
Seleksi BC1F1 Code-qDTH8 secara Molekuler
Seleksi tanaman padi BC1F1 dilakukan dengan menggunakan primer RM5556, RM6838, dan RM20582 yang kemudian diamplifikasi dengan mesin PCR. Primer RM5556, RM6838, dan RM20582 adalah marka pengapit untuk mendeteksi lokus qDTH8 dan Xa7 pada tanaman padi. Dalam proses amplifikasi DNA, ketiga primer juga memiliki keunggulan untuk mendeteksi multi alel di dalam lokus kromosom (Susanto et al. 2008). Hasil amplifikasi kemudian dipisahkan dengan elektroforesis untuk melihat pita-pita DNA yang dimiliki oleh tiap tanaman.
homozigot menandakan bahwa hanya satu gen yang diwariskan dari tetua IR64-NILs-qDTH8 [YP1] atau tetua Code.
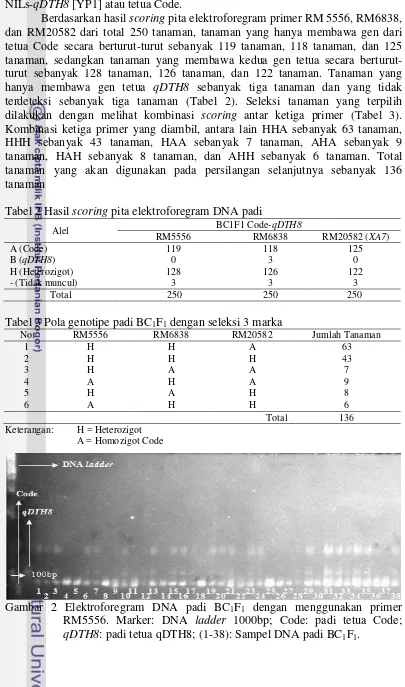
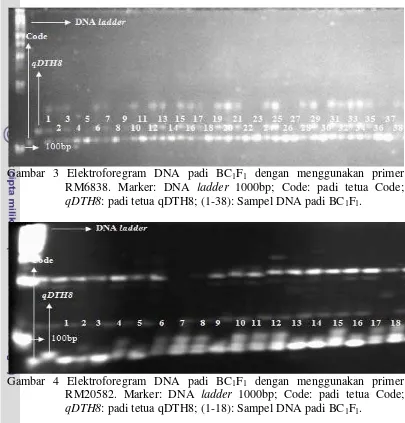
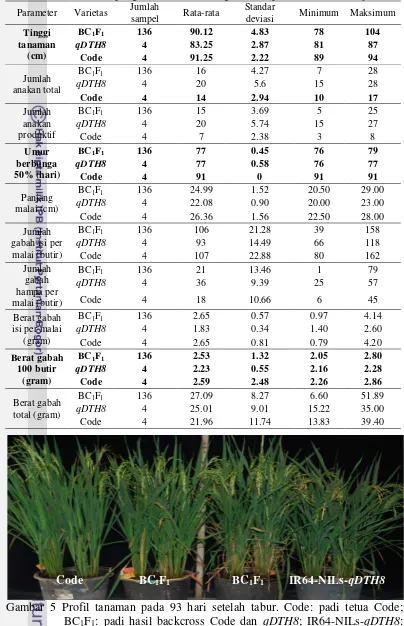
Berdasarkan hasil scoring pita elektroforegram primer RM 5556, RM6838, dan RM20582 dari total 250 tanaman, tanaman yang hanya membawa gen dari tetua Code secara berturut-turut sebanyak 119 tanaman, 118 tanaman, dan 125 tanaman, sedangkan tanaman yang membawa kedua gen tetua secara berturut-turut sebanyak 128 tanaman, 126 tanaman, dan 122 tanaman. Tanaman yang hanya membawa gen tetua qDTH8 sebanyak tiga tanaman dan yang tidak terdeteksi sebanyak tiga tanaman (Tabel 2). Seleksi tanaman yang terpilih dilakukan dengan melihat kombinasi scoring antar ketiga primer (Tabel 3). Kombinasi ketiga primer yang diambil, antara lain HHA sebanyak 63 tanaman, HHH sebanyak 43 tanaman, HAA sebanyak 7 tanaman, AHA sebanyak 9 tanaman, HAH sebanyak 8 tanaman, dan AHH sebanyak 6 tanaman. Total tanaman yang akan digunakan pada persilangan selanjutnya sebanyak 136 tanaman
Tabel 2 Hasil scoring pita elektroforegram DNA padi
Alel BC1F1 Code-qDTH8
RM5556 RM6838 RM20582 (XA7)
Tabel 3 Pola genotipe padi BC1F1 dengan seleksi 3 marka
No. RM5556 RM6838 RM20582 Jumlah Tanaman
1 H H A 63
Keterangan: H = Heterozigot
A = Homozigot Code
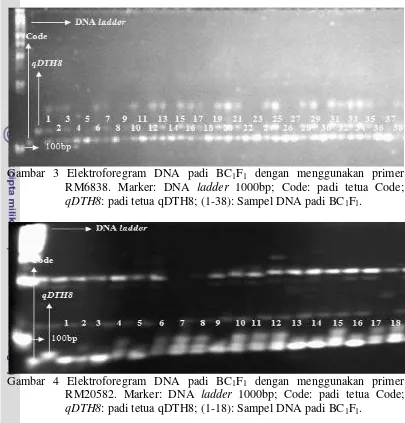
Gambar 3 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM6838. Marker: DNA ladder 1000bp; Code: padi tetua Code; qDTH8: padi tetua qDTH8; (1-38): Sampel DNA padi BC1F1.
Gambar 4 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM20582. Marker: DNA ladder 1000bp; Code: padi tetua Code; qDTH8: padi tetua qDTH8; (1-18): Sampel DNA padi BC1F1.
Karakter Agronomis Padi BC1F1 Code-qDTH8
Tabel 4 Tabulasi hasil pengamatan karakter agronomis padi BC1F1 Code-qDTH8
Parameter Varietas Jumlah
sampel Rata-rata
Standar
deviasi Minimum Maksimum
Tinggi
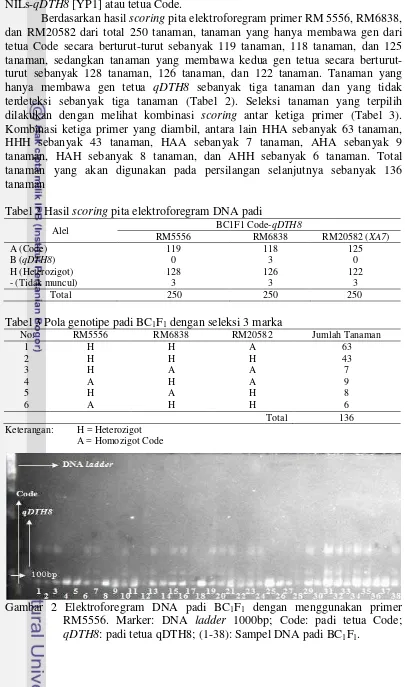
Gambar 5 Profil tanaman pada 93 hari setelah tabur. Code: padi tetua Code; BC1F1: padi hasil backcross Code dan qDTH8; IR64-NILs-qDTH8: padi tetua qDTH8.
PEMBAHASAN
Karakterisasi DNA Hasil Isolasi
Penggunaan metode isolasi Dellaporta et al. (1983) yang dimodifikasi telah berhasil mengisolasi DNA dari daun padi BC1F1 Code-qDTH8. Pemilihan daun padi merupakan salah satu faktor penting dalam proses isolasi DNA. Daun yang diambil untuk diisolasi merupakan daun padi muda yang masih berada dalam tahap pembelahan sehingga daun muda memiliki kuantitas yang lebih banyak dibandingkan daun tua atau bagian tanaman lainnya. Faktor lain yang mempengaruhi keberhasilan proses isolasi adalah penggunaan nitrogen cair untuk memecahkan sel tanaman. Nitrogen cair digunakan untuk membekukan jaringan pada tanaman sehingga meminimalkan potensi degradasi DNA ketika dilakukan penggerusan. Selain itu, nitrogen cair juga tidak menghasilkan residu setelah proses penggerusan karena sifatnya yang volatil (Tan et al. 2013). Beberapa senyawa kimia lain yang juga berperan penting pada metode ini, yaitu EDTA, Na-bisulfit, NaCl, SDS, dan Tris-HCl. Senyawa EDTA berperan dalam pengikatan ion Mg2+ dan menginaktivasi DNase, Na-bisulfit meningkatkan daya presipitasi DNA, NaCl menghasilkan ion Na+ yang akan menghalangi ion negatif dari DNA dan meningkatkan presipitasi DNA, SDS berperan dalam melarutkan protein dan lipid membran sel, sedangkan Tris-HCl berperan dalam menjaga pH larutan dan meningkatkan permeabilitas membran luar (Tan et al. 2013).
Spektrofotometer merupakan metode standar dalam pengukuran kuantitas DNA hasil isolasi. Spektrofotometer juga dapat digunakan untuk menentukan kemurnian DNA. Nilai kemurnian dari suatu sampel DNA hasil isolasi dapat dinyatakan dengan perbandingan nilai absorbansi pada panjang gelombang 260 nm dan 280 nm. Kemurnian suatu DNA dapat dikatakan baik apabila berada pada rentang 1.8 hingga 2.0 karena pada rentang ini kemampuan DNA menyerap cahaya lebih baik (Aliyu et al. 2013). Kemurnian DNA dipengaruhi oleh beberapa faktor, salah satunya adalah penggunaan RNase. Perlakuan RNase terhadap sampel dapat menghilangkan RNA dari sampel dan mengurangi terjadinya peristiwa smear pada hasil elektroforesis. Proses degradasi RNA dari sampel DNA akan menghasilkan kualitas DNA hasil isolasi yang lebih baik (Aliyu et al. 2013).
Hasil pengukuran konsentrasi DNA tersebar dalam rentang yang cukup besar sedangkan hasil pengukuran kemurnian seluruh DNA sampel berada pada rentang 1.8 hingga 2.0. Adanya konsentrasi DNA hasil isolasi yang kecil dapat disebabkan oleh pelaksaan isolasi yang kurang cermat. Meskipun beberapa sampel memiliki konsentrasi DNA yang sedikit, proses amplifikasi DNA tetap dapat dijalankan karena metode SSR memiliki kelebihan, yaitu dapat dioperasikan dalam kondisi konsentrasi DNA yang sangat kecil (Xu 2010).
Amplifikasi DNA Padi BC1F1 Code-qDTH8
ditemukan pada region coding dan non-coding (Miah et al. 2013). Mikrosatelit menggunakan sepasang primer (forward dan reverse) yang diamplifikasi berdasarkan konservasi daerah yang diapit marka untuk suatu gen yang ada dalam kromosom (Azrai 2005). Konsep daerah yang diapit oleh marka dikenal dengan istilah flanking marker. Semakin dekat jarak suatu primer terhadap lokus target, maka pewarisan lokus target dapat terus terjadi untuk generasi selanjutnya (Collard et al. 2005).
Gen pengatur sifat umur berbunga qDTH8 atau Ghd8 (HD5) pada padi BC1F1 merupakan QTL (Quantitative Trait Loci) yang diturunkan oleh tetua IR64-NILs-qDTH8 [YP1] dan terdapat pada kromosom 8 yang menurut bank data Gramene (www.gramene.org) berada pada posisi 35.7 cM. Gen qDTH8 mengekspresikan sifat umur berbunga yang kemudian dapat mempersingkat umur panen padi. Sifat umur berbunga merupakan sifat penting yang diperlukan untuk kemampuan adaptasi suatu tanaman terhadap kondisi lingkungan disekitarnya sehingga sifat ini dipengaruhi oleh panjang hari dan temperatur lingkungan. Gen pengatur sifat umur berbunga sendiri tidak terfokus pada satu kromosom tetapi tersebar di beberapa kromosom padi atau dikenal dengan istilah polygenic character (Naeem et al. 2013). Gen qDTH8 sendiri dapat dideteksi dengan menggunakan primer RM5556 dan RM6838. Kedua primer ini bertindak sebagai primer pengapit daerah lokus qDTH8, yaitu menurut bank data Gramene pada posisi 26 cM dan 42.9 cM.
Pemilihan tanaman BC1F1 sendiri didasarkan atas kombinasi pita dari primer RM5556, RM6838, dan RM20582. Galur dengan pita heterozigot dipilih pada elektroforegram primer RM5556 dan RM6838 sedangkan galur dengan pita homozigot dipilih pada elektroforegram primer RM20582. Pemilihan pita heterozigot untuk primer RM5556 dan RM6838 disebabkan oleh adanya gen qDTH8 dari tetua IR64-NILs-qDTH8 [YP1] yang akan disisipkan ke dalam gen tetua Code pada galur BC1F1. Oleh karena itu, gen dari kedua tetua harus berada dalam galur BC1F1. Primer RM20582 sendiri memilih pita heterozigot karena gen Xa7 hanya berasal dari tetua Code. Pita homozigot yang mengikuti tetua tetua IR64-NILs-qDTH8 [YP1 secara otomatis tidak dipilih karena tidak mengandung gen tetua Code pada galur BC1F1. Penyebab terjadinya pita homozigot tetua NILs-qDTH8 [YP1] dikarenakan adanya penyerbukan sendiri antar tetua IR64-NILs-qDTH8 [YP1] pada saat pembentukan benih BC1F1.
Produk amplifikasi antar ketiga primer dapat dilihat dengan menggunakan elektroforesis pada gel poliakrilamid 8%. Gramene marker view menyebutkan bahwa produk amplifikasi primer RM5556 sebesar 102 bp, produk amplifikasi primer RM6838 sebesar 120 bp, dan produk amplifikasi primer RM20582 sebesar 83 bp. Berdasarkan hasil pita elektroforegram, pita DNA primer RM5556 dan RM6838 memiliki ukuran pita dibawah 200 bp sedangkan pita DNA primer RM20582 memiliki ukuran pita dibawah 100 bp. Hal ini menunjukkan bahwa hasil amplifikasi sesuai dengan bank data Gramene.
Karakter Agronomi Padi BC1F1 Code-qDTH8
penting yang menggambarkan kondisi dari suatu varietas tanaman. Pengamatan karakter agronomi juga sering dilakukan sebagai pembuktian hasil analisis molekuler. Hasil pengamatan pada karakter tinggi tanaman, jumlah anakan total, jumlah anakan produktif, dan umur berbunga tidak memiliki ulangan sehingga tidak dilakukan uji lanjut statistik karena hanya membandingkan hasil tetua dengan turunan. Tetua yang digunakan sebagai pembanding adalah tetua Code karena penelitian ini bertujuan untuk meningkatkan potensi dari tetua Code, terutama pada karakter umur berbunga.
Karakter tinggi tanaman mempengaruhi tingkat kemampuan suatu tanaman untuk berfotosintesis dan menghasilkan asimilat. Tanaman ideal setidaknya memiliki tinggi sekitar 80-100 cm agar dapat menghasilkan potensi hasil yang tinggi (Peng et al. 2008). Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata tinggi tanaman sebesar 90.12 cm sedangkan tetua Code memiliki rata-rata tinggi tanaman sebesar 91.25 cm. Takeuchi (2011) menyebutkan bahwa aktivitas pemendekan umur tanaman sering mengakibatkan terjadinya pemendekan tinggi tanaman dan panjang malai. Meskipun nilai rata-rata tinggi tanaman galur BC1F1 berada dibawah tetua Code, nilai tersebut masih berada pada rentang tinggi tanaman yang ideal sehingga dapat menghasilkan potensi hasil yang tinggi.
Jumlah anakan padi dapat dibedakan sebagai jumlah anakan total dan jumlah anakan produktif. Jumlah anakan total merupakan jumlah keseluruhan dari anakan sedangkan jumlah anakan produktif merupakan jumlah anakan yang dapat menghasilkan malai. Dalam arti lain, jumlah anakan total memiliki nilai yang lebih besar atau sama dengan jumlah anakan produktif karena tidak semua anakan dapat menghasilkan malai. Jumlah anakan produktif biasanya berkisar antara 10-15 batang untuk setiap tanaman (Peng et al. 2008). Jumlah anakan total dan anakan produktif galur BC1F1 yang lebih besar dibanding tetua Code menggambarkan adanya peningkatan produksi. Hal ini juga berdampak pada meningkatnya jumlah malai dan jumlah gabah yang akan dihasilkan.
Panjang malai merupakan karakter agronomis yang berpengaruh terhadap jumlah gabah yang dihasilkan. Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata panjang malai sebesar 24.99 cm sedangkan tetua Code memiliki rata-rata panjang malai sebesar 26.36 cm. Penurunan nilai rata-rata panjang malai dapat disebabkan oleh adanya gen penyandi umur berbunga. Berdasarkan hasil uji lanjut Dunnett, terdapat empat galur yang mempunyai panjang malai berbeda nyata lebih kecil dibandingkan dengan tetua Code, yaitu sampel BC1F1 nomor 110, 31, 32, dan 129.
100,41, 27, dan 3, serta pengurangan berat gabah 100 butir pada sampel nomor 31 akibat adanya penurunan tinggi tanaman dan panjang malai.
Pengamatan umur berbunga dilakukan terhadap 50% jumlah anakan yang telah berbunga untuk setiap tanaman. Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata umur berbunga sebesar 77 hari sedangkan tetua Code memiliki rata-rata umur berbunga sebesar 91 hari. Hal ini menunjukkan adanya penyingkatan umur berbunga sehingga waktu panen yang diperlukan juga semakin cepat. Selain itu, rata-rata umur berbunga galur BC1F1 sama dengan rata-rata umur berbunga tetua IR64-NILs-qDTH8 [YP1] yang menandakan adanya pewarisan gen qDTH8 yang menyandi umur berbunga ke dalam galur BC1F1.
Umur berbunga merupakan jumlah hari yang diperlukan oleh padi untuk memasuki fase generatif atau fase berbunga (Yano et al. 2001). Umur berbunga sendiri dipengaruhi oleh waktu yang diperlukan pada fase pertumbuhan vegetatif dan sensitivitas cahaya tanaman padi (Ranawake & Amarasighe 2014). Proses pembungaan pada tanaman dibedakan dalam dua kategori, yaitu pembungaan pada tanaman berhari pendek dan tanaman berhari panjang. Mekanisme pembungaan juga diregulasi oleh beberapa gen, seperti Hd1, Ehd1, OsMADS51, Hd3a, dan RFT1. Pada tanaman berhari pendek, seperti padi, gen Ehd1, Hd3a, dan RFT1 sangat berperan dalam mekanisme pembungaan dengan mempersingkat umur berbunga tanaman tersebut (Gambar 6). Ekspresi gen Ehd1, Hd3a, dan RFT1 sendiri akan terhambat pada tanaman berhari panjang. Gen qDTH8 atau Ghd8 (Grain, height, dan heading date) dapat meningkatkan proses ekspresi gen Ehd1, Hd3a, serta RFT1 dan dapat menyebabkan peristiwa ekspresi yang berlebihan sehingga umur berbunga tanaman akan semakin singkat (Yan et al. 2010).
Gen qDTH8 menyandi protein HAP3 yang bertindak sebagai faktor transkripsi pada proses transkripsi gen. Gen qDTH8 meregulasi proses ekspresi gen florigen Hd3a yang dapat memicu terjadinya proses pembungaan pada tanaman padi (Xiang et al. 2013). Proses transkripsi dari gen Hd3a terjadi di dalam sel daun dan hasil dari proses transkripsi, yaitu mRNA, akan dibawa menuju ujung meristem batang melalui saluran floem. Pergerakan mRNA dari daun menuju meristem untuk mengaktivasi gen pembungaan menggambarkan sifat seperti hormon yang dimiliki oleh gen Hd3a. Komponen mRNA akan berinteraksi dengan reseptor protein 14-3-3 dan masuk menuju sel meristem (Taoka et al. 2011). Protein hasil translasi mRNA Hd3a akan membentuk Florigen Activation Complex (FAC) yang bertindak sebagai faktor transkripsi gen penyandi perbungaan, yaitu gen LFY dan AP1 (Corbesier & Coupland 2006).
SIMPULAN DAN SARAN
Seleksi galur BC1F1 hasil persilangan Code dan IR64-NILs-qDTH8 [YP1] berhasil dilakukan dengan menggunakan tiga primer mikrosatelit (SSR), yaitu primer RM20582 untuk gen ketahanan Xa7 serta primer RM5556 dan RM6838 untuk gen penyandi umur berbunga qDTH8. Terjadi pemendekan umur berbunga galur BC1F1 dibandingkan dengan umur berbunga tetua Code sebesar 14 hari. Pemendekan umur berbunga pada galur BC1F1 juga menyebabkan peristiwa penurunan tinggi tanaman dan penurunan berat gabah 100 butir yang tidak terlalu signifikan. Perlu dilakukan penelitian lebih lanjut dalam proses seleksi tanaman padi pada generasi selanjutnya dan menentukan karakteristik gen penyandi umur berbunga lainnya, selain gen qDTH8.
DAFTAR PUSTAKA
Aliyu RE, Wasiu AA, Dangora DB, Ademola JO, Adamu AK. 2013. Comparative study of genomic DNA extraction protocols in rice species. International Journal of Advancements in Research & Technology. 2(2):1-3.
Azrai M. 2006. Sinergi teknologi marka molekuler dalam pemuliaan tanaman jagung. Jurnal Litbang Pertanian. 25(3):81-89.
Azrai M. 2005. Pemanfaatan marka molekuler dalam proses seleksi pemuliaan tanaman. Jurnal AgroBiogen. 1(1):26-37.
Collard BC, Mackill DJ. 2007. Marker-assisted selection: an approach for precision plant breeding in the twenty first century. Phil Trans R Soc B. 363:557-572. (doi: 10.1098/rstb.2007.2170)
Corbesier L, Coupland G. 2006. The quest for florigen: a review of recent progress. Journal of Experimental Botany. 57(13):3395-3403.
Dellaporta SL, Wood J, Hicks JB. 1983. A plant DNA minipreparation: version II. Plant Mol Biol Rep. 1(4):19-21.
Fujita D, Tagle AG, Ebron LA, Fukuta Y, Kobayashi N. 2012. Characterization of near-isogenic lines carrying QTL for high spikelet number with the genetic background of an indica rice variety IR64 (Oryza sativa L). Breeding Science. 62:18-26.
Fujita D, Santos REM, Ebron LA, Yanoria MJT, Kato H, Kobayashi S, Uga Y, Araki E, Takai T, Tsunematsu H, et al. 2010. Characterization of introgression lines for yield-related traits with indica-type rice variety IR64 genetic background. JARQ. 44(3):277-290.
Ma J, Ma W, Ming D, Yang S, Zhu Q. 2006. Characteristics of rice plant with heavy panicle. Agri Sci. 5 (12):101-105.
Miah G, Rafii MY, Ismail MR, Puteh AB, Rahim HA, Islam KH, Latif MA. 2013. A review of microsatellite markers and their application in rice breeding programs to improve blast disease resistance. Int J Mol Sci. 14:22499-22528.
Naeem M, Iqbal M, Khan MA, Nazeer W, Rizwan M, Ijaz M. 2013. Importance of QTL mapping for heading date in rice. World Applied Sciences Journal. 22(7):1001-1006.
Nuraida D. 2012. Pemuliaan tanaman cepat dan tepat melalui pendekatan marka molekuler. El-Hayah. 2(2):97-103.
Peng S, Khush GS, Virk P, Tang Q, Zou Y. 2008. Progress in ideotype breeding in increase rice yield potential. Field Crop Res. 108:32-38.
Ranawake AL, Amarasinghe UGS. 2014. Trait effect in different days to flowering groups of rice cultivars as described by path analysis. International Journal of Scientific and Research Publications. 4(7):1-9.
Sambrook J, DW Russell. 2001. Molecular Cloning: A Laboratory Manual. Edisi 3. New York (GB): Coldspring Harbor Laboratory Press.
Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular Cloning a Laboratory Manual, Ed ke-1. New York (US): Cold Spring Harbor Laboratory.
Suprihatno B, Daradjat AA, Satoto, Baehaki SE, Widiarta IN, Setyono A, Indrasari SD, Lesmana OS, Sembiring H. 2009. Deskripsi Varietas Padi. Subang(ID): Balai Besar Penelitian Tanaman Padi.
Susanto U, Aswidinnoor H, Koswara J, Setiawan A, Lopena V, Torizo L, Parminder VS. 2008. QTL mapping of yield, yield components, and morphological traits in rice (Oryza sativa L.) using SSR marker. Bul. Agron. 36(3):188-195.
Takeuchi Y. 2011. Developing isogenic lines of Japanese rice cultivar ‘Koshihikari’ with early and late heading. JARQ. 45(1):15-22.
Tan H, Tie M, Zhang L, ZhuY, Li H. 2013. The effects of three different grinding methods in DNA extraction of cowpea (Vigna unguiculata L. Walp). African Journal of Biotechnology. 12(16):1946-1951.
Taoka K, Ohki I, Tsuji H, Furuita K, Hayashi K, Yanase T, Yamaguchi M, Nakashima C, Purwestri YA, Tamaki S, et al. 2011. 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen. Nature. 476:332-338.
Thermo Fisher Scientific. 2009. Nanodrop 2000/200c Spectrophotometer V1.0 User Manual. Wilmington (US): Thermo Fischer Scientific.
Xiang C, Qu L, Gao Y, Shi Y. 2013. Flower development and photoperiodic control of flowering in rice. Rice Science. 20(2):79-87.
Yan WH, Wang P, Chen HX, Zhou HJ, Li QP, Wang CR, Ding ZH, Zhanf YS, Yu SB, Xing YZ, Zhang QF. 2010. A major QTL, Ghd8, plays pleiotropic roles in regulating grain productivity, plant height, and heading date in rice. Molecular Plant. 4(2):319-330.
Yano M, Kojima S, Takahashi Y, Lin HX, Sasaki T. 2001. Genetic control of flowering time in rice, a short-day plant. Plant Physiology. 127:1425-1429. Zhang Y, Luo L, Xu C, Zhang Q, Xing Y. 2006. Quantitative trait loci for panicle
Lampiran 1 Bagan alir penelitian
Lampiran 2 Diagram persilangan
♀ Code x ♂ IR64-NILs-qDTH8 [YP1]
x
100 F1 Code
5 BC1F1 x Code
BC2F1
Penyemaian benih galur
BC1F1
Isolasi DNA galur BC1F1
Uji kualitatif dan
kuantitatif DNA
Analisis SSR
Pemeliharaan tanaman
hasil analisis SSR
Pengamatan karakter
agronomi
BC1F2 136 BC1F1
Lampiran 3 Elektroforegram DNA padi RM5556 (Sampel 1-250)
1 76
qDTH8
Code DNA Ladder
63 96
DNA Ladder
97 148
Code
qDTH8
DNA Ladder
147 190
DNA Ladder 100bp
100bp
100bp
100bp
191 250
DNA Ladder
100bp
qDTH8
Lampiran 3 Elektroforegram DNA padi (Lanjutan) RM6838 (Sampel 1-250)
DNA Ladder
Code
qDTH8
100bp
1 73
DNA Ladder
100bp
61 96
DNA Ladder
100bp Code
qDTH8
97 154
DNA Ladder
100bp
155 190
DNA Ladder
100bp Code
qDTH8
Lampiran 3 Elektroforegram DNA padi (Lanjutan)
RM20582 (Sampel 1-250)
DNA Ladder
100bp
225 250
DNA Ladder
100bp Code
qDTH8
1 69
DNA Ladder
61 96
100bp
DNA Ladder
100bp Code
qDTH8
97 154
DNA Ladder
100bp
Lampiran 3 Elektroforegram DNA padi (Lanjutan)
Lampiran 4 Informasi primer yang digunakan dalam penelitian
Primer Kromosom Lokus Sekuen
RM5556 8 qDTH8 F-ATCTCCCTCCCTCTCCTCAC
R-TCCACACCTTCACAGTTGAC
RM6838 8 qDTH8 F-ATTAATACCGCTACCACGCG
R-TCCTCCTCCACCTCAATCAC
RM20582 6 Xa7 F-AGAGCGTCGTCCTTCACCATCC
R-GGCCAATACGACGATACATTACACG
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
124 A H A 249 A H H
125 H A H 250 A A H
Keterangan: A = Genotipe Code B = Genotipe IR64-NILs-qDTH8
H = Heterozigot - = Kosong
Lampiran 6 Sebaran Data Karakter Agronomi BC1F1
Lampiran 7 Analisis varian (ANOVA) dan uji lanjut Dunnett terhadap data pengamatan karakter agronomis (panjang malai, jumlah gabah isi, jumlah gabah hampa, dan bobot gabah 100 butir) beberapa galur BC1F1
Karakter: Panjang Malai (PM)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 545.93 4.01 2.7 < .0001
Kesalahan 274 407.53 1.48
Total terkoreksi 410 953.47
R-Kuadrat Ragam koefisien MSE Root Rata-rata PM
0.57 4.87 1.21 25
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 545.93 4.01 2.7 < .0001
Karakter: Jumlah Gabah Isi (JGI)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 101995.57 749.96 2.49 < .0001
Kesalahan 274 82412.00 300.77
Total terkoreksi 410 184407.57
R-Kuadrat Ragam koefisien MSE Root Rata-rata JGI
0.55 16.32 17.34 106.23
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 101995.57 749.96 2.49 < .0001
Karakter: Jumlah Gabah Hampa (JGH)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 52125.44 383.27 4.85 < .0001
Kesalahan 274 21662.67 79.06
Total terkoreksi 410 73788.10
R-Kuadrat Ragam koefisien MSE Root Rata-rata JGH
0.7 42.53 8.89 20.9
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 52125.44 383.27 4.85 < .0001
Karakter: Berat Gabah 100 Butir (BG)
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 75.25 0.55 2.71 < .0001
Kesalahan 274 55.91 0.20
Total terkoreksi 410 131.17
R-Kuadrat Ragam koefisien MSE Root Rata-rata BG
Lampiran 7 Analisis varian (ANOVA) dan uji lanjut Dunnett terhadap data pengamatan karakter agronomis (panjang malai, jumlah gabah isi, jumlah gabah hampa, dan bobot gabah 100 butir) beberapa galur BC1F1 (Lanjutan)
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 75.25 0.55 2.71 < .0001
Uji lanjut Dunnett Galur
BC1F1
Panjang malai (cm)
Jumlah gabah isi (butir)
Jumlah gabah hampa (butir)
Berat gabah 100 butir (gram)
3 26.17 126 43a+ 2.53
8 26.83 124 48a+ 2.64
26 24.83 90 45a+ 2.4
27 25.00 109 44a+ 2.54
31 22.83a- 50a- 52a+ 2.47
a-32 22.83a- 93 35 2.57
41 23.33 99 44a+ 2.52
55 26.17 119 51a+ 2.56
98 26.50 114 49a+ 2.58
100 25.67 118 44a+ 2.53
110 22.83a- 99 4 2.52
129 22.17a- 88 16 2.44
Keterangan: Angka yang diikuti huruf a+ dan a- berbeda nyata lebih tinggi dan lebih rendah dari
RIWAYAT HIDUP
Penulis dilahirkan di Batam pada tanggal 28 Agustus 1992 dari ayah Pangihutan Panjaitan dan ibu Surta Tobing. Penulis merupakan anak pertama dari tiga bersaudara. Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMAN 1 Batam pada tahun 2010 dan pada tahun yang sama diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Analisis SSR (Fujita et al. 2012)
Campuran larutan PCR dibuat dengan mencampurkan 3 μL DNA (50 ng/ µL) dan PCR MIX yang mengandung 2 µL 10x bufer PCR, 0.2 µL dNTPs 10 µM, 0.2 µL MgCl2, 0.5 µL GC-Rich, 1 µL primer reverse dan forward 5 µM (RM 5556, RM 6836, dan RM20582 [Xa7]), 0.12 µL Taq DNA polimerase dan ditambahkan ddH2O hingga volume mencapai 10 µL. Campuran DNA dimasukkan ke dalam plate dan kemudian dimasukkan ke dalam mesin PCR. Program PCR yang digunakan adalah denaturasi awal selama 5 menit pada suhu 94oC, dilanjutkan dengan 35 siklus yang terdiri atas: denaturasi (denaturation) selama 60 detik pada suhu 94oC, penempelan primer (annealing) selama 60 detik pada suhu 55oC, dan perpanjangan primer (extension) selama 2 menit pada suhu 72oC. Perpanjangan primer terakhir dilakukan selama 7 menit pada suhu 72oC.
Elektroforesis Hasil PCR (Sambrook et al. 1989)
Analisis hasil PCR menggunakan elektroforesis gel poliakrilamida (PAGE) diawali dengan menyiapkan rangkaian alat elektroforesis terlebih dahulu. Plat kaca dibersihkan dengan alkohol dan dibiarkan hingga kering. Kaca yang telah kering lalu digabungkan yaitu antara kaca A dan kaca B. Gel poliakrilamid dibuat dengan mencampurkan larutan PAGE yaitu 8% poliakrilamid sebanyak 800 ml, APS (Ammonium Persulfat) 10% sebanyak 800 µL dan TEMED (tetrametilen-etilendiamin) sebanyak 80 µL. Campuran diaduk hingga merata lalu dituangkan ke dalam cetakan kaca yang telah dirangkai terlebih dahulu dengan cepat. Gel didiamkan memadat selama 60 menit.
Gel poliakrilamid yang telah memadat pada cetakan kaca dimasukan ke dalam tangki elektroforesis horizontal dan ditambahkan bufer TBE 0.5x ke dalamnya. Setelah gel siap, produk PCR yang telah ditambahkan 4µL loading dye dimasukkan ke dalam sumur gel sebanyak 4 µL dan disertakan DNA marker 100 bp ladder sebanyak 3 µL sebagai pembanding pada sumur pertama untuk melihat ukuran DNA. Selanjutnya sampel DNA dialiri arus listrik dengan daya 100 volt selama 90 menit. Gel poliakrilamid yang telah selesai running dicuci dengan dH2O dan diwarnai dengan etidium bromida. Gel poliakrilamid kemudian didokumentasi dengan alat gel doc Biorad.
Analisis Data
Data molekuler yang diperoleh dari pita-pita DNA hasil elektroforesis dianalisis dengan melihat posisi pita dalam elektroforegram dan digunakan sebagai penentu seleksi tanaman BC1F1. Data agronomi yang meliputi data tinggi tanaman, jumlah anakan, jumlah anakan produktif, umur berbunga, panjang malai, jumlah gabah isi, jumlah gabah hampa, berat 100 butir gabah, dan berat gabah total dianalisis menggunakan program Microsoft Excel dan program statistik SAS.
HASIL
Kualitas dan Kuantitas DNA Padi BC1F1 Code-qDTH8
menunjukkan sampel hasil isolasi yang murni karena tidak ditemukan adanya smear pada pita. Uji kualitatif DNA menggunakan DNA lambda sebagai pembanding yang telah diketahui konsentrasinya, yaitu sebesar 50 ng/µL. Uji kuantitas DNA dilakukan untuk mengetahui konsentrasi dan kemurnian DNA hasil isolasi. Hasil elektroforesis menunjukkan bahwa tidak terdapat fragmen smear dan ketebalan pita DNA sampel lebih tebal dibandingkan pita DNA lambda. Hasil pengukuran kuantitas DNA menggunakan spektrofotometer nanodrop berada pada rentang 10-3700 ng/µL dan kemurniannya berada pada rentang 1.8-2.0 (Tabel 1).
Gambar 1 Elektroforegram beberapa DNA daun padi BC1F1 hasil isolasi. DNA lamda konsentrasi 50 ng/μL: Marker; (146), (149), (152), (157), (161), (165), (170), (178), (184), (188), dan (192): Sampel DNA padi BC1F1. Tabel 1 Hasil pengukuran konsentrasi dan kemurnian DNA padi BC1F1
A260/A280 Jumlah Sampel Konsentrasi (μg/mL) Jumlah Sampel
1.78 1 10 – 500 53
Seleksi BC1F1 Code-qDTH8 secara Molekuler
Seleksi tanaman padi BC1F1 dilakukan dengan menggunakan primer RM5556, RM6838, dan RM20582 yang kemudian diamplifikasi dengan mesin PCR. Primer RM5556, RM6838, dan RM20582 adalah marka pengapit untuk mendeteksi lokus qDTH8 dan Xa7 pada tanaman padi. Dalam proses amplifikasi DNA, ketiga primer juga memiliki keunggulan untuk mendeteksi multi alel di dalam lokus kromosom (Susanto et al. 2008). Hasil amplifikasi kemudian dipisahkan dengan elektroforesis untuk melihat pita-pita DNA yang dimiliki oleh tiap tanaman.
homozigot menandakan bahwa hanya satu gen yang diwariskan dari tetua IR64-NILs-qDTH8 [YP1] atau tetua Code.
Berdasarkan hasil scoring pita elektroforegram primer RM 5556, RM6838, dan RM20582 dari total 250 tanaman, tanaman yang hanya membawa gen dari tetua Code secara berturut-turut sebanyak 119 tanaman, 118 tanaman, dan 125 tanaman, sedangkan tanaman yang membawa kedua gen tetua secara berturut-turut sebanyak 128 tanaman, 126 tanaman, dan 122 tanaman. Tanaman yang hanya membawa gen tetua qDTH8 sebanyak tiga tanaman dan yang tidak terdeteksi sebanyak tiga tanaman (Tabel 2). Seleksi tanaman yang terpilih dilakukan dengan melihat kombinasi scoring antar ketiga primer (Tabel 3). Kombinasi ketiga primer yang diambil, antara lain HHA sebanyak 63 tanaman, HHH sebanyak 43 tanaman, HAA sebanyak 7 tanaman, AHA sebanyak 9 tanaman, HAH sebanyak 8 tanaman, dan AHH sebanyak 6 tanaman. Total tanaman yang akan digunakan pada persilangan selanjutnya sebanyak 136 tanaman
Tabel 2 Hasil scoring pita elektroforegram DNA padi
Alel BC1F1 Code-qDTH8
RM5556 RM6838 RM20582 (XA7)
Tabel 3 Pola genotipe padi BC1F1 dengan seleksi 3 marka
No. RM5556 RM6838 RM20582 Jumlah Tanaman
1 H H A 63
Keterangan: H = Heterozigot
A = Homozigot Code
Gambar 3 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM6838. Marker: DNA ladder 1000bp; Code: padi tetua Code; qDTH8: padi tetua qDTH8; (1-38): Sampel DNA padi BC1F1.
Gambar 4 Elektroforegram DNA padi BC1F1 dengan menggunakan primer RM20582. Marker: DNA ladder 1000bp; Code: padi tetua Code; qDTH8: padi tetua qDTH8; (1-18): Sampel DNA padi BC1F1.
Karakter Agronomis Padi BC1F1 Code-qDTH8
Tabel 4 Tabulasi hasil pengamatan karakter agronomis padi BC1F1 Code-qDTH8
Parameter Varietas Jumlah
sampel Rata-rata
Standar
deviasi Minimum Maksimum
Tinggi
Gambar 5 Profil tanaman pada 93 hari setelah tabur. Code: padi tetua Code; BC1F1: padi hasil backcross Code dan qDTH8; IR64-NILs-qDTH8: padi tetua qDTH8.
PEMBAHASAN
Karakterisasi DNA Hasil Isolasi
Penggunaan metode isolasi Dellaporta et al. (1983) yang dimodifikasi telah berhasil mengisolasi DNA dari daun padi BC1F1 Code-qDTH8. Pemilihan daun padi merupakan salah satu faktor penting dalam proses isolasi DNA. Daun yang diambil untuk diisolasi merupakan daun padi muda yang masih berada dalam tahap pembelahan sehingga daun muda memiliki kuantitas yang lebih banyak dibandingkan daun tua atau bagian tanaman lainnya. Faktor lain yang mempengaruhi keberhasilan proses isolasi adalah penggunaan nitrogen cair untuk memecahkan sel tanaman. Nitrogen cair digunakan untuk membekukan jaringan pada tanaman sehingga meminimalkan potensi degradasi DNA ketika dilakukan penggerusan. Selain itu, nitrogen cair juga tidak menghasilkan residu setelah proses penggerusan karena sifatnya yang volatil (Tan et al. 2013). Beberapa senyawa kimia lain yang juga berperan penting pada metode ini, yaitu EDTA, Na-bisulfit, NaCl, SDS, dan Tris-HCl. Senyawa EDTA berperan dalam pengikatan ion Mg2+ dan menginaktivasi DNase, Na-bisulfit meningkatkan daya presipitasi DNA, NaCl menghasilkan ion Na+ yang akan menghalangi ion negatif dari DNA dan meningkatkan presipitasi DNA, SDS berperan dalam melarutkan protein dan lipid membran sel, sedangkan Tris-HCl berperan dalam menjaga pH larutan dan meningkatkan permeabilitas membran luar (Tan et al. 2013).
Spektrofotometer merupakan metode standar dalam pengukuran kuantitas DNA hasil isolasi. Spektrofotometer juga dapat digunakan untuk menentukan kemurnian DNA. Nilai kemurnian dari suatu sampel DNA hasil isolasi dapat dinyatakan dengan perbandingan nilai absorbansi pada panjang gelombang 260 nm dan 280 nm. Kemurnian suatu DNA dapat dikatakan baik apabila berada pada rentang 1.8 hingga 2.0 karena pada rentang ini kemampuan DNA menyerap cahaya lebih baik (Aliyu et al. 2013). Kemurnian DNA dipengaruhi oleh beberapa faktor, salah satunya adalah penggunaan RNase. Perlakuan RNase terhadap sampel dapat menghilangkan RNA dari sampel dan mengurangi terjadinya peristiwa smear pada hasil elektroforesis. Proses degradasi RNA dari sampel DNA akan menghasilkan kualitas DNA hasil isolasi yang lebih baik (Aliyu et al. 2013).
Hasil pengukuran konsentrasi DNA tersebar dalam rentang yang cukup besar sedangkan hasil pengukuran kemurnian seluruh DNA sampel berada pada rentang 1.8 hingga 2.0. Adanya konsentrasi DNA hasil isolasi yang kecil dapat disebabkan oleh pelaksaan isolasi yang kurang cermat. Meskipun beberapa sampel memiliki konsentrasi DNA yang sedikit, proses amplifikasi DNA tetap dapat dijalankan karena metode SSR memiliki kelebihan, yaitu dapat dioperasikan dalam kondisi konsentrasi DNA yang sangat kecil (Xu 2010).
Amplifikasi DNA Padi BC1F1 Code-qDTH8
ditemukan pada region coding dan non-coding (Miah et al. 2013). Mikrosatelit menggunakan sepasang primer (forward dan reverse) yang diamplifikasi berdasarkan konservasi daerah yang diapit marka untuk suatu gen yang ada dalam kromosom (Azrai 2005). Konsep daerah yang diapit oleh marka dikenal dengan istilah flanking marker. Semakin dekat jarak suatu primer terhadap lokus target, maka pewarisan lokus target dapat terus terjadi untuk generasi selanjutnya (Collard et al. 2005).
Gen pengatur sifat umur berbunga qDTH8 atau Ghd8 (HD5) pada padi BC1F1 merupakan QTL (Quantitative Trait Loci) yang diturunkan oleh tetua IR64-NILs-qDTH8 [YP1] dan terdapat pada kromosom 8 yang menurut bank data Gramene (www.gramene.org) berada pada posisi 35.7 cM. Gen qDTH8 mengekspresikan sifat umur berbunga yang kemudian dapat mempersingkat umur panen padi. Sifat umur berbunga merupakan sifat penting yang diperlukan untuk kemampuan adaptasi suatu tanaman terhadap kondisi lingkungan disekitarnya sehingga sifat ini dipengaruhi oleh panjang hari dan temperatur lingkungan. Gen pengatur sifat umur berbunga sendiri tidak terfokus pada satu kromosom tetapi tersebar di beberapa kromosom padi atau dikenal dengan istilah polygenic character (Naeem et al. 2013). Gen qDTH8 sendiri dapat dideteksi dengan menggunakan primer RM5556 dan RM6838. Kedua primer ini bertindak sebagai primer pengapit daerah lokus qDTH8, yaitu menurut bank data Gramene pada posisi 26 cM dan 42.9 cM.
Pemilihan tanaman BC1F1 sendiri didasarkan atas kombinasi pita dari primer RM5556, RM6838, dan RM20582. Galur dengan pita heterozigot dipilih pada elektroforegram primer RM5556 dan RM6838 sedangkan galur dengan pita homozigot dipilih pada elektroforegram primer RM20582. Pemilihan pita heterozigot untuk primer RM5556 dan RM6838 disebabkan oleh adanya gen qDTH8 dari tetua IR64-NILs-qDTH8 [YP1] yang akan disisipkan ke dalam gen tetua Code pada galur BC1F1. Oleh karena itu, gen dari kedua tetua harus berada dalam galur BC1F1. Primer RM20582 sendiri memilih pita heterozigot karena gen Xa7 hanya berasal dari tetua Code. Pita homozigot yang mengikuti tetua tetua IR64-NILs-qDTH8 [YP1 secara otomatis tidak dipilih karena tidak mengandung gen tetua Code pada galur BC1F1. Penyebab terjadinya pita homozigot tetua NILs-qDTH8 [YP1] dikarenakan adanya penyerbukan sendiri antar tetua IR64-NILs-qDTH8 [YP1] pada saat pembentukan benih BC1F1.
Produk amplifikasi antar ketiga primer dapat dilihat dengan menggunakan elektroforesis pada gel poliakrilamid 8%. Gramene marker view menyebutkan bahwa produk amplifikasi primer RM5556 sebesar 102 bp, produk amplifikasi primer RM6838 sebesar 120 bp, dan produk amplifikasi primer RM20582 sebesar 83 bp. Berdasarkan hasil pita elektroforegram, pita DNA primer RM5556 dan RM6838 memiliki ukuran pita dibawah 200 bp sedangkan pita DNA primer RM20582 memiliki ukuran pita dibawah 100 bp. Hal ini menunjukkan bahwa hasil amplifikasi sesuai dengan bank data Gramene.
Karakter Agronomi Padi BC1F1 Code-qDTH8
penting yang menggambarkan kondisi dari suatu varietas tanaman. Pengamatan karakter agronomi juga sering dilakukan sebagai pembuktian hasil analisis molekuler. Hasil pengamatan pada karakter tinggi tanaman, jumlah anakan total, jumlah anakan produktif, dan umur berbunga tidak memiliki ulangan sehingga tidak dilakukan uji lanjut statistik karena hanya membandingkan hasil tetua dengan turunan. Tetua yang digunakan sebagai pembanding adalah tetua Code karena penelitian ini bertujuan untuk meningkatkan potensi dari tetua Code, terutama pada karakter umur berbunga.
Karakter tinggi tanaman mempengaruhi tingkat kemampuan suatu tanaman untuk berfotosintesis dan menghasilkan asimilat. Tanaman ideal setidaknya memiliki tinggi sekitar 80-100 cm agar dapat menghasilkan potensi hasil yang tinggi (Peng et al. 2008). Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata tinggi tanaman sebesar 90.12 cm sedangkan tetua Code memiliki rata-rata tinggi tanaman sebesar 91.25 cm. Takeuchi (2011) menyebutkan bahwa aktivitas pemendekan umur tanaman sering mengakibatkan terjadinya pemendekan tinggi tanaman dan panjang malai. Meskipun nilai rata-rata tinggi tanaman galur BC1F1 berada dibawah tetua Code, nilai tersebut masih berada pada rentang tinggi tanaman yang ideal sehingga dapat menghasilkan potensi hasil yang tinggi.
Jumlah anakan padi dapat dibedakan sebagai jumlah anakan total dan jumlah anakan produktif. Jumlah anakan total merupakan jumlah keseluruhan dari anakan sedangkan jumlah anakan produktif merupakan jumlah anakan yang dapat menghasilkan malai. Dalam arti lain, jumlah anakan total memiliki nilai yang lebih besar atau sama dengan jumlah anakan produktif karena tidak semua anakan dapat menghasilkan malai. Jumlah anakan produktif biasanya berkisar antara 10-15 batang untuk setiap tanaman (Peng et al. 2008). Jumlah anakan total dan anakan produktif galur BC1F1 yang lebih besar dibanding tetua Code menggambarkan adanya peningkatan produksi. Hal ini juga berdampak pada meningkatnya jumlah malai dan jumlah gabah yang akan dihasilkan.
Panjang malai merupakan karakter agronomis yang berpengaruh terhadap jumlah gabah yang dihasilkan. Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata panjang malai sebesar 24.99 cm sedangkan tetua Code memiliki rata-rata panjang malai sebesar 26.36 cm. Penurunan nilai rata-rata panjang malai dapat disebabkan oleh adanya gen penyandi umur berbunga. Berdasarkan hasil uji lanjut Dunnett, terdapat empat galur yang mempunyai panjang malai berbeda nyata lebih kecil dibandingkan dengan tetua Code, yaitu sampel BC1F1 nomor 110, 31, 32, dan 129.
100,41, 27, dan 3, serta pengurangan berat gabah 100 butir pada sampel nomor 31 akibat adanya penurunan tinggi tanaman dan panjang malai.
Pengamatan umur berbunga dilakukan terhadap 50% jumlah anakan yang telah berbunga untuk setiap tanaman. Berdasarkan hasil pengamatan, galur BC1F1 memiliki rata-rata umur berbunga sebesar 77 hari sedangkan tetua Code memiliki rata-rata umur berbunga sebesar 91 hari. Hal ini menunjukkan adanya penyingkatan umur berbunga sehingga waktu panen yang diperlukan juga semakin cepat. Selain itu, rata-rata umur berbunga galur BC1F1 sama dengan rata-rata umur berbunga tetua IR64-NILs-qDTH8 [YP1] yang menandakan adanya pewarisan gen qDTH8 yang menyandi umur berbunga ke dalam galur BC1F1.
Umur berbunga merupakan jumlah hari yang diperlukan oleh padi untuk memasuki fase generatif atau fase berbunga (Yano et al. 2001). Umur berbunga sendiri dipengaruhi oleh waktu yang diperlukan pada fase pertumbuhan vegetatif dan sensitivitas cahaya tanaman padi (Ranawake & Amarasighe 2014). Proses pembungaan pada tanaman dibedakan dalam dua kategori, yaitu pembungaan pada tanaman berhari pendek dan tanaman berhari panjang. Mekanisme pembungaan juga diregulasi oleh beberapa gen, seperti Hd1, Ehd1, OsMADS51, Hd3a, dan RFT1. Pada tanaman berhari pendek, seperti padi, gen Ehd1, Hd3a, dan RFT1 sangat berperan dalam mekanisme pembungaan dengan mempersingkat umur berbunga tanaman tersebut (Gambar 6). Ekspresi gen Ehd1, Hd3a, dan RFT1 sendiri akan terhambat pada tanaman berhari panjang. Gen qDTH8 atau Ghd8 (Grain, height, dan heading date) dapat meningkatkan proses ekspresi gen Ehd1, Hd3a, serta RFT1 dan dapat menyebabkan peristiwa ekspresi yang berlebihan sehingga umur berbunga tanaman akan semakin singkat (Yan et al. 2010).
Gen qDTH8 menyandi protein HAP3 yang bertindak sebagai faktor transkripsi pada proses transkripsi gen. Gen qDTH8 meregulasi proses ekspresi gen florigen Hd3a yang dapat memicu terjadinya proses pembungaan pada tanaman padi (Xiang et al. 2013). Proses transkripsi dari gen Hd3a terjadi di dalam sel daun dan hasil dari proses transkripsi, yaitu mRNA, akan dibawa menuju ujung meristem batang melalui saluran floem. Pergerakan mRNA dari daun menuju meristem untuk mengaktivasi gen pembungaan menggambarkan sifat seperti hormon yang dimiliki oleh gen Hd3a. Komponen mRNA akan berinteraksi dengan reseptor protein 14-3-3 dan masuk menuju sel meristem (Taoka et al. 2011). Protein hasil translasi mRNA Hd3a akan membentuk Florigen Activation Complex (FAC) yang bertindak sebagai faktor transkripsi gen penyandi perbungaan, yaitu gen LFY dan AP1 (Corbesier & Coupland 2006).
Lampiran 1 Bagan alir penelitian
Lampiran 2 Diagram persilangan
♀ Code x ♂ IR64-NILs-qDTH8 [YP1]
x
100 F1 Code
5 BC1F1 x Code
BC2F1
Penyemaian benih galur
BC1F1
Isolasi DNA galur BC1F1
Uji kualitatif dan
kuantitatif DNA
Analisis SSR
Pemeliharaan tanaman
hasil analisis SSR
Pengamatan karakter
agronomi
BC1F2 136 BC1F1
Lampiran 3 Elektroforegram DNA padi RM5556 (Sampel 1-250)
1 76
qDTH8
Code DNA Ladder
63 96
DNA Ladder
97 148
Code
qDTH8
DNA Ladder
147 190
DNA Ladder 100bp
100bp
100bp
100bp
191 250
DNA Ladder
100bp
qDTH8
Lampiran 3 Elektroforegram DNA padi (Lanjutan) RM6838 (Sampel 1-250)
DNA Ladder
Code
qDTH8
100bp
1 73
DNA Ladder
100bp
61 96
DNA Ladder
100bp Code
qDTH8
97 154
DNA Ladder
100bp
155 190
DNA Ladder
100bp Code
qDTH8
Lampiran 3 Elektroforegram DNA padi (Lanjutan)
RM20582 (Sampel 1-250)
DNA Ladder
100bp
225 250
DNA Ladder
100bp Code
qDTH8
1 69
DNA Ladder
61 96
100bp
DNA Ladder
100bp Code
qDTH8
97 154
DNA Ladder
100bp
Lampiran 3 Elektroforegram DNA padi (Lanjutan)
Lampiran 4 Informasi primer yang digunakan dalam penelitian
Primer Kromosom Lokus Sekuen
RM5556 8 qDTH8 F-ATCTCCCTCCCTCTCCTCAC
R-TCCACACCTTCACAGTTGAC
RM6838 8 qDTH8 F-ATTAATACCGCTACCACGCG
R-TCCTCCTCCACCTCAATCAC
RM20582 6 Xa7 F-AGAGCGTCGTCCTTCACCATCC
R-GGCCAATACGACGATACATTACACG
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
Lampiran 5 Tabel scoring analisis molekuler padi BC1F1 (Lanjutan)
Sampel Primer Sampel Primer
RM5556 RM6838 RM20582 RM5556 RM6838 RM20582
124 A H A 249 A H H
125 H A H 250 A A H
Keterangan: A = Genotipe Code B = Genotipe IR64-NILs-qDTH8
H = Heterozigot - = Kosong
Lampiran 6 Sebaran Data Karakter Agronomi BC1F1
Lampiran 7 Analisis varian (ANOVA) dan uji lanjut Dunnett terhadap data pengamatan karakter agronomis (panjang malai, jumlah gabah isi, jumlah gabah hampa, dan bobot gabah 100 butir) beberapa galur BC1F1
Karakter: Panjang Malai (PM)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 545.93 4.01 2.7 < .0001
Kesalahan 274 407.53 1.48
Total terkoreksi 410 953.47
R-Kuadrat Ragam koefisien MSE Root Rata-rata PM
0.57 4.87 1.21 25
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 545.93 4.01 2.7 < .0001
Karakter: Jumlah Gabah Isi (JGI)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 101995.57 749.96 2.49 < .0001
Kesalahan 274 82412.00 300.77
Total terkoreksi 410 184407.57
R-Kuadrat Ragam koefisien MSE Root Rata-rata JGI
0.55 16.32 17.34 106.23
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 101995.57 749.96 2.49 < .0001
Karakter: Jumlah Gabah Hampa (JGH)
Sumber Df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 52125.44 383.27 4.85 < .0001
Kesalahan 274 21662.67 79.06
Total terkoreksi 410 73788.10
R-Kuadrat Ragam koefisien MSE Root Rata-rata JGH
0.7 42.53 8.89 20.9
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 52125.44 383.27 4.85 < .0001
Karakter: Berat Gabah 100 Butir (BG)
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Model 136 75.25 0.55 2.71 < .0001
Kesalahan 274 55.91 0.20
Total terkoreksi 410 131.17
R-Kuadrat Ragam koefisien MSE Root Rata-rata BG
Lampiran 7 Analisis varian (ANOVA) dan uji lanjut Dunnett terhadap data pengamatan karakter agronomis (panjang malai, jumlah gabah isi, jumlah gabah hampa, dan bobot gabah 100 butir) beberapa galur BC1F1 (Lanjutan)
Sumber df Jumlah kuadrat Kuadrat tengah F Pr>F
Perlakuan 136 75.25 0.55 2.71 < .0001
Uji lanjut Dunnett Galur
BC1F1
Panjang malai (cm)
Jumlah gabah isi (butir)
Jumlah gabah hampa (butir)
Berat gabah 100 butir (gram)
3 26.17 126 43a+ 2.53
8 26.83 124 48a+ 2.64
26 24.83 90 45a+ 2.4
27 25.00 109 44a+ 2.54
31 22.83a- 50a- 52a+ 2.47
a-32 22.83a- 93 35 2.57
41 23.33 99 44a+ 2.52
55 26.17 119 51a+ 2.56
98 26.50 114 49a+ 2.58
100 25.67 118 44a+ 2.53
110 22.83a- 99 4 2.52
129 22.17a- 88 16 2.44
Keterangan: Angka yang diikuti huruf a+ dan a- berbeda nyata lebih tinggi dan lebih rendah dari