POTENSI TEPUNG BIJI ROSELA (Hibiscus sabdariffa LINN) UNTUK PERTUMBUHAN DAN IMUNITAS IKAN PATIN
(Pangasionodon hypopthalmus)
ALLAMANDA CATHARICA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Tepung Biji Rosela (Hibiscus sabdariffa Linn) untuk Pertumbuhan dan Imunitas Ikan Patin (Pangasionodon hypopthalmus) adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Allamanda Catharica
RINGKASAN
ALLAMANDA CATHARICA. Potensi Tepung Biji Rosela (Hibiscus sabdariffa Linn) untuk Pertumbuhan dan Imunitas Ikan Patin (Pangasionodon hypopthalmus). Dibimbing oleh NUR BAMBANG PRIYO UTOMO dan SRI NURYATI.
Kendala utama pada usaha budidaya ikan adalah ketersediaan bahan baku pakan dan serangan penyakit. Oleh karena itu, ketersediaan pakan yang berkualitas yang tidak hanya mampu meningkatkan pertumbuhan ikan tapi juga mampu meningkatkan imunitas ikan sangat diperlukan. Biji rosela yang mempunyai kandungan protein cukup tinggi, asam lemak tak jenuh, mineral dan vitamin terutama tokoferol berpotensi sebagai bahan baku pakan alternatif. Penelitian ini bertujuan untuk mendapatkan dosis optimal tepung biji rosela yang mampu meningkatkan kinerja pertumbuhan dan imunitas patin.
Penelitian ini terdiri dari dua tahap penelitian, percobaan dosis optimal dan percobaan metode pemberian pakan uji. Percobaan dosis optimal dilakukan dengan menggunakan 35 ekor benih patin pada tiap akuarium berukuran 60x30x35 cm dengan rancangan 5 perlakuan 3 ulangan. Perlakuan yang dilakukan adalah pemberian pakan berupa pakan kontrol/perlakuan A (0% tepung biji rosela), dan pakan yang telah ditambahkan tepung biji rosela (2, 4, 6 dan 8%) sebagai perlakuan B sampai E. Parameter yang diuji adalah kelangsungan hidup, kinerja pertumbuhan dan gambaran darah. Sampel darah diambil untuk mengukur hematokrit, hemoglobin, sel darah merah total, sel darah putih total, diferensial leukosit dan aktivitas fagositik pada hari ke-0, ke-10, ke-20 dan ke-30. Uji tantang dilakukan pada hari pemeliharaan ke-31 dengan tujuan mengetahui kinerja imunitas melalui penyuntikan bakteri Aeromonas hydrophila. Hasil penelitian menunjukkan bahwa perbedaan dosis tepung biji rosela menyebabkan perbedaan yang nyata terhadap konsumsi pakan, retensi protein dan retensi lemak, sedangkan terhadap efisiensi pakan, kelangsungan hidup dan laju pertumbuhan harian tidak menyebabkan perbedaan yang nyata (P<0.05). Hasil pengukuran pada parameter imunitas, secara umum didapatkan bahwa tidak ada perbedaan yang nyata antar perlakuan (P<0.05). Hasil tersebut didukung oleh tingkat kelangsungan hidup setelah uji tantang yang menunjukkan hasil tidak berbeda nyata antar perlakuan (P<0.05). Berdasarkan keseluruhan hasil penelitian didapatkan bahwa dosis tepung biji rosela 4% (perlakuan C) merupakan yang terbaik karena dapat memberikan retensi protein tertinggi, sehingga untuk percobaan selanjutnya pakan uji yang digunakan adalah pakan C.
hari pertama dan pakan uji terbaik pada sepuluh hari terakhir). Semua perlakuan pada hari ke-21 diuji tantang dengan diinjeksi bakteri Aeromonas hydrophila, kecuali pada kontrol negatif (K-). Ini dilakukan untuk mengetahui kinerja imunitas ikan setelah diberi perlakuan. Parameter yang diuji adalah kelangsungan hidup, kinerja pertumbuhan dan gambaran darah. Sampel darah diambil untuk mengukur hematokrit, hemoglobin, sel darah merah total, sel darah putih total, diferensial leukosit dan aktivitas fagositik pada hari ke-0, ke-5, ke-10, ke-15 dan ke-20. Hasil penelitian menunjukkan ada perbedaan nyata terhadap konsumsi pakan (P<0.05), sedangkan parameter efisiensi pakan, kelangsungan hidup dan laju pertumbuhan harian tidak berbeda nyata antar perlakuan (P<0.05). Hasil uji parameter imunitas, berdasarkan tingkat kelangsungan hidup setelah uji tantang didapatkan perbedaan yang nyata antar perlakuan dengan hasil terbaik adalah perlakuan B, yakni pemberian pakan komersil pada lima hari pertama, kemudian pakan uji terbaik pada hari ke-6 sampai hari ke-15 dan pakan komersil pada lima hari terakhir. Perlakuan B ini menunjukkan kelangsungan hidup tertinggi di luar kontrol setelah injeksi Aeromonas hydrophila yakni rata-rata 62.1% (P<0.05). Berdasarkan kedua tahapan penelitian yang dilakukan, didapatkan bahwa hasil terbaik terjadi pada perlakuan dengan dosis tepung biji rosela 4%, pemberian pakan lima hari pertama menggunakan pakan komersil, hari 6 sampai hari ke-15 memakai pakan uji serta lima hari terakhir menggunakan pakan komersil.
SUMMARY
ALLAMANDA CATHARICA. Potential Roselle Seed Meal for Growth and Immunity in Striped Catfish. Supervised by NUR BAMBANG PRIYO UTOMO and SRI NURYATI.
The main constraint on aquaculture is the availability of the raw material feed and disease attack. Therefore, the availability of high-quality feed that is not only able to increase fish growth but also capable of increasing absolute fish immunity must exist. Roselle seeds, with relatively vitamins especially tocopherol has a potential as an alternative ingredient. This study was conducted to determine the effect of dietary level of roselle seeds meal on growth performance, immune responses and resistance of striped catfish to Aeromonas hydrophila challenge.
In the first experiment, five diets were formulated to contain 0 (control), 2, 4, 6 and 8% roselle seeds meal per 100 g diets. Thirty five fishes with 1.33-1.51 g initial body weights were cultured in 15 aquarium with 60x30x35 cm dimention for 40 days. Fish were fed on these diets two times a day until apparent satiation. Feed consumption, lipid and protein retention increased with increasing doses of roselle seed meal (p<0.05). No significant differences were found in the growth rate, feed efficiency and survival rate in this study. The results of measurement on immune responses and resistance of striped catfish to Aeromonas hydrophila
challenge, it was found that there was no significant difference between treatments (p<0.05). Based on the overall results of the study showed that the dose of roselle seed meal 4% ( treatment of C ) is the best because it can provide the highest protein retention, so for second experiment this experimental diets was then applied.
The second experiment, thirty five fishes with 1.33-1.51 g initial body weights were cultured in 18 aquarium with 60x30x35 cm dimention for 30 days. Fish were fed on these diets two times a day until apparent satiation. Fish were assigned randomly to six feeding regimes, namely, a control (positive and negative control), fed continuously with commercial diets for 20 days. Treatment of A, fed continuously with experimental diets for 20 days. Treatment of B, fed with commercial diets on the first five days, then fed with experimental diets day 6 to day 15 and the commercial diets on the last five days. Treatment of C, fed with experimental diets on the first five days, commercial diets on the second five days, experimental diets on the third five days and commercial diets on the last five days. Treatment of D, namely the provision of commercial diets in the first ten days and the experimental diets in the last ten days. All treatments at day 21 challenged with Aeromonas hydrophila, except in the negative control.
conducted found that roselle seed meal with a dose of 4% with a frequency of the first five days of feeding commercial diets, on the day 6 to day 15 feeding experimental and the last five days of feeding commercial diets is the best diets.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
POTENSI TEPUNG BIJI ROSELA (Hibiscus sabdariffa LINN)
UNTUK PERTUMBUHAN DAN IMUNITAS IKAN PATIN (Pangasionodon hypopthalmus)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Potensi Tepung Biji Rosela (Hibiscus sabdariffa Linn) untuk Pertumbuhan dan Imunitas Ikan Patin (Pangasionodon hypopthalmus)
Nama : Allamanda Catharica NIM : C151100121
Disetujui oleh Komisi Pembimbing
Dr Ir Nur Bambang Priyo Utomo, MSi Ketua
Dr Sri Nuryati, SPi., MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah berjudul “Potensi Tepung Biji Rosela (Hibiscus sabdariffa Linn) untuk Pertumbuhan dan Imunitas Ikan Patin (Pangasionodon hypopthalmus)” berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Nur Bambang Priyo Utomo, MSi dan Dr Sri Nuryati,SPi., MSi selaku pembimbing, Dr Ir Dinar Tri Soelistyowati, DEA sebagai dosen penguji luar komisi serta Dr Dinamella Wahjuningrum, SSi., MSi yang telah banyak memberikan saran. Terima kasih kepada Yayasan Pendidikan Islam Bende Seguguk Kayuagung (YPIBSK) atas bantuan beasiswa pada tahun pertama perkuliahan. Terima kasih pula kepada Pemerintah RI, melalui Dirjen Dikti, Kementerian Pendidikan dan Kebudayaan atas bantuan beasiswa dalam program BPPS On Going dan Lembaga Pengelola Dana Pendidikan (LPDP) atas bantuan beasiswa tesis dalam program beasiswa tesis dan disertasi LPDP. Ungkapan terima kasih juga penulis sampaikan kepada bapak (alm), mama, adik-adik (Yolanda & Caliandra) serta seluruh keluarga untuk doa dan cintanya, ikhwatifillah UKA 305 dan Himmpas IPB atas ukhuwahnya. Penulis sampaikan pula terima kasih dan penghargaan kepada semua pihak yang telah membantu secara langsung atau tidak langsung terutama kepada Pak Ranta, Pak Wasjan, Mbak Retno dan temen-temen di LKI yang telah membantu proses analisis sampel, teman-teman mahasiswa Program Studi Ilmu Akuakultur, Sekolah Pascasarjana IPB angkatan 2010 atas kekompakan dan kerjasamanya yang baik.
Akhirnya, penulis berharap semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu pengetahuan. Namun demikian penulis menyadari hasil penelitian dalam karya ilmiah ini bukanlah kebenaran mutlak karena sangat mungkin berubah seiring berkembangnya ilmu pengetahuan.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
2 TINJAUAN PUSTAKA 2
Kebutuhan Nutrisi Ikan 2
Tepung biji rosela 3
Imunomodulator dan Imunitas Ikan 3
3 METODE 4
Waktu dan Tempat 4
Persiapan Pakan Uji 4
Persiapan Bakteri Uji 5
Persiapan Ikan Uji 6
Tahapan Penelitian 6
Parameter Pengamatan 8
Analisis Kimia Bahan Pakan, Pakan dan Ikan Uji 10
Analisis Statistik 10
4 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 22
5 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
LAMPIRAN 29
DAFTAR TABEL
1 Syarat mutu pakan ikan patin 2
2 Komposisi pakan percobaan 5
3 Rata-rata Kelangsungan Hidup (KH), Efisiensi Pakan (EP), Retensi Lemak (RL), Retensi Protein (RP), Laju Pertumbuhan Harian (LPH) dan
Konsumsi Pakan (KP) 11
4 Rata-rata Kelangsungan Hidup (KH), Efisiensi Pakan (EP), Laju Pertumbuhan Harian (LPH) dan Konsumsi Pakan (KP) 16
DAFTAR GAMBAR
1 Skema percobaan kedua 7
2 Sel darah merah total percobaan pertama 12
3 Sel darah putih total percobaan pertama 13
4 Hemoglobin percobaan pertama 13
5 Hematokrit percobaan pertama 14
6 Aktivitas fagositik percobaan pertama 15
7 Diferensial leukosit percobaan pertama 15
8 Kelangsungan hidup setelah uji tantang percobaan pertama 16
9 Sel darah merah total percobaan kedua 17
10 Sel darah putih total percobaan kedua 18
11 Hemoglobin percobaan kedua 18
12 Hematokrit percobaan kedua 19
13 Aktivitas fagositik percobaan kedua 20
14 Diferensial leukosit percobaan kedua 21
15 Kelangsungan hidup setelah uji tantang percobaan kedua 21
DAFTAR LAMPIRAN
1 Prosedur analisis kimia bahan pakan dan tubuh ikan 29 2 Hasil analisis proksimat bahan baku pakan, pakan dan ikan 32
3 Perhitungan retensi lemak (%) 33
4 Perhitungan retensi protein (%) 34
PENDAHULUAN
Latar Belakang
Kendala utama pada usaha budidaya ikan adalah ketersediaan bahan baku pakan dan serangan penyakit. Pakan merupakan komponen biaya terbesar dalam usaha budidaya ikan, sehingga keberadaannya sangat mempengaruhi laba yang akan diperoleh pembudidaya ikan. Serangan penyakit merupakan salah satu faktor lainnya yang akan mempengaruhi laba yang akan didapatkan oleh pembudidaya ikan, karena jika terjadi serangan penyakit kemungkinan untuk adanya kematian massal pada komoditi yang dibudidayakan akan sangat besar, dan itu akan sangat merugikan. Oleh karena itu, ketersediaan pakan yang berkualitas yang tidak hanya mampu meningkatkan pertumbuhan ikan tapi juga mampu meningkatkan imunitas ikan mutlak harus ada.
Rosela (Hibiscus sabdariffa Linn) merupakan tanaman yang dikenal mempunyai banyak manfaat terutama pada bidang kesehatan. Rosela juga termasuk tanaman yang relatif mudah dibudidayakan karena toleran terhadap berbagai jenis tanah dan cuaca serta tidak membutuhkan waktu yang lama untuk dipanen (Ismail et al. 2008). Total panen rosela berkisar 25 kuintal kelopak segar per hektar, dan dari hasil tersebut didapatkan 250 kg rosela kering dan 44 kg biji rosela kering.
Hasil uji proksimat pada tepung biji rosela menunjukkan kandungan proteinnya 34.85%, tidak jauh berbeda dengan kandungan protein tepung kedelai 39.85% dan hasil uji kandungan protein yang dilaporkan oleh Hainida et al.
(2008) yakni berkisar 18-35%. Selain itu, biji rosela juga mengandung asam lemak tak jenuh oleat dan linoleat, mineral serta vitamin diantaranya tokoferol. Hasil uji kandungan tokoferol pada tepung biji rosela yang dilakukan oleh Mohamed et al. (2007) adalah sebesar 2000 mg/kg tepung biji rosela dengan persentase tertinggi adalah -tokoferol (74.5%) diikuti oleh α-tokoferol (25.0%) dan δ-tokoferol (0.5%). Potensi tersebut membuat biji rosela dapat dikembangkan sebagai alternatif bahan penyusun pakan yang mampu meningkatkan pertumbuhan dan imunitas ikan.
Beberapa penelitian telah dilakukan terkait pemanfaatan tepung biji rosela pada pertumbuhan ikan yakni pada african catfish dan nila, begitu pula terkait pemanfaatannya untuk meningkatkan imunitas pada tikus, akan tetapi pada patin belum dilakukan. Penelitian ini merupakan penelitian awal pada patin, sehingga dosis optimal yang dibutuhkan untuk meningkatkan pertumbuhan dan imunitas patin belum diketahui, begitu pula dengan pemberian pakannya masih belum diketahui metode yang paling efektif dan efisien.
Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Mendapatkan dosis optimal tepung biji rosela yang mampu meningkatkan pertumbuhan dan imunitas patin
2
TINJAUAN PUSTAKA
Kebutuhan Nutrisi Ikan
Kebutuhan nutrisi masing-masing ikan berbeda menurut jenis dan ukuran. Pada penelitian ini ikan yang digunakan adalah ikan patin. Menurut BSN (2009) dalam SNI 7548:2009 kadar air dan kadar abu maksimal, kadar protein dan kadar lemak minimal serta kadar serat kasar dan non protein nitrogen maksimal untuk ikan patin adalah sebagaimana ditunjukkan pada Tabel 1.
Tabel 1 Syarat mutu pakan ikan patin (BSN 2009)
Jenis Uji Satuan
(as feed) Persyaratan Benih
Kadar air, maks % 12
Kadar abu, maks % 12
Kadar protein,min % 30
Kadar lemak,min % 5
Kadar serat kasar, maks % 8
Non protein nitrogen, maks % 0.20
Kestabilan dalam air (setelah 5 menit), min % 90
Cemaran mikroba/toksin
-Kapang, maks kol/g 50
- Aflatoksin, maks µg/kg 50
- Salmonella kol/g Negatif
Kandungan antibiotik 0
Bentuk dan diameter mm Crumble/pelet (< 2)
Patin merupakan golongan catfish yang kebutuhan proteinnya dalam pakan berkisar 25-50% bergantung ukuran ikan, suhu perairan, jumlah energi non protein dalam pakan, kualitas protein dan manajemen pakan (Robinson et al.
2001). Ditambahkan oleh Wilson (2002) umumnya kebutuhan protein pada ikan menurun seiring bertambahnya ukuran dan umur ikan. Sebagai contoh larva
channel catfish membutuhkan 40% protein, sedangkan benih butuh 30-35% protein dan ikan yang lebih besar (>110g) membutuhkan 25-35% protein. Perubahan suhu perairan juga mempengaruhi kebutuhan protein pada beberapa ikan. Sebagai contoh striped bass membutuhkan 47% protein pada suhu 20 oC dan 55% protein pada suhu 24 oC, akan tetapi secara umum perubahan suhu lebih berpengaruh pada konsumsi pakan dibandingkan kebutuhan protein secara khusus.
3 Tepung biji rosela
Biji rosela mengandung protein yang relatif tinggi berkisar 18-35% tergantung lokasi rosela dibudidayakan serta perlakuan sebelum diuji (Hainida et al. 2008). Selain itu, biji rosela juga merupakan sumber asam lemak tak jenuh terutama oleat dan linoleat, sumber mineral kalsium (Ca), natrium (Na), besi (Fe), magnesium (Mg), tembaga (Cu), kalium (K) dan fospor (P) (Nzikou et al. 2011). Biji rosela juga mengandung tokoferol terutama α, , dan tokoferol (Mohd-Esa
et al. 2010; Nyam et al. 2010). α-tokoferol berfungsi sebagai stimulator limfosit B dan T (Anderson 1996) serta berfungsi dalam oksidasi lipid. Tidak optimalnya kandungan α-tokoferol dapat menyebabkan rendahnya pertumbuhan, konversi pakan dan kelangsungan hidup. Selain itu dapat juga menimbulkan anemia,
muscular dystropsy dan depigmentation (Hendricks 2002).
Penelitian mengenai pemanfaatan biji rosela sebagai sumber protein penyusun pakan ikan sudah dilakukan. Fagbenro et al. (2004) telah melakukan penelitian mengenai pemanfaatan tepung biji rosela sebagai pengganti tepung kedelai pada pakan nila, dan hasilnya menunjukkan bahwa penggantian tepung kedelai dengan tepung biji rosela sebanyak 30% dari 450 g tepung kedelai per kg pakan memberikan pertumbuhan yang sama dengan pertumbuhan pada perlakuan yang hanya menggunakan tepung kedelai. Pada african catfish, subsitusi tepung kedelai ke tepung biji rosela memberikan hasil yang lebih tinggi dibandingkan pada ikan nila yakni penggantian tepung kedelai dengan tepung biji rosela sebanyak 60% dari 450 g tepung kedelai per kg pakanmemberikan pertumbuhan yang sama dengan pertumbuhan pada perlakuan yang hanya menggunakan tepung kedelai (Fagbenro 2005). Pemanfaatan ekstrak biji rosela untuk meningkatkan sistem imun juga telah dilakukan, akan tetapi pada hewan non ikan yakni tikus. Hasilnya menunjukkan bahwa 200 mg ekstrak biji rosela per kg pakan mampu menurunkan tingkat toksisitas natrium nitrat yang diberikan terus-menerus kepada tikus (Bako et al. 2009).
Imunomodulator dan Imunitas Ikan
Imunomodulator adalah zat/senyawa baik berupa sintetis maupun biologis yang ditambahkan untuk memodifikasi respon sistem imun atas ancaman terhadapnya. Imunomodulator dapat diklasifikasikan menjadi tiga kategori;
imunoadjuvan, imunostimulan dan imunosupresan. Imunoadjuvan digunakan untuk meningkatkan kemanjuran vaksin sehingga dianggap sebagai stimulan kekebalan spesifik, contohnya Freund’s adjuvant. Imunostimulan digunakan untuk respon imun non spesifik dengan meningkatkan daya tahan tubuh terhadap infeksi. Pada tubuh yang sehat bertindak sebagai imunopotentiator (meningkatkan tingkat dasar respon imun) dan imunoterapi (meningkatkan respon imun pada individu dengan gangguan kekebalan) (Saroj et al. 2012). Terakhir
imunosupresan, digunakan untuk mengurangi aktivasi atau efektivitas sistem imun. Beberapa bagian dari sistem imun memiliki pengaruh imunosupresif pada bagian lain dari sistem imun, dan bersifat imunosupresif pada kondisi pengobatan lainnya sebagai reaksi merugikan (Rathee et al. 2012).
4
NK (natural killer) seperti halnya limfosit T dan B. Teleostei juga memiliki komponen imun humoral seperti komplemen, lisozim, natural hemolysin, transferin dan C-reactive protein serta sitokin (interferon, interleukin 2, macrophage activating factors) (Sakai 1999). Ditambahkan oleh Uribe et al.
(2011) ikan adalah organisme yang hidup bebas dari tahap embrio kehidupan di lingkungan perairan. Oleh karena itu, ikan memiliki mekanisme perlindungan diri dari berbagai mikroorganisme yakni sistem imun bawaan untuk jangka waktu yang relatif lama mulai dari tahap awal embriogenesis. Ini terjadi karena keterbatasan sistem imun adaptif, sifat poikiloterm ikan, keterbatasan repertoar antibodi serta lambannya proliferasi, pematangan dan memori limfosit ikan.
Komponen-komponen dalam respon imun bawaan umumnya terbagi menjadi tiga kompartemen; penghalang epitel/mukosa, parameter humoral dan komponen selular. Penghalang epitel dan mukosa pada kulit, insang dan saluran makanan adalah penghalang penyakit yang sangat penting pada ikan yang hidup di lingkungan yang mengandung agen yang berpotensi membahayakan. Respon ini, memerlukan serangkaian mekanisme yang melibatkan faktor-faktor humoral, sel dan jaringan, peptida antimikroba dan faktor komplemen. Faktor-faktor humoral bisa berupa reseptor selular atau molekul yang larut dalam plasma dan cairan tubuh lainnya (Uribe et al. 2011). Ditambahkan oleh Kiron (2012) beragam faktor antimikroba yang ditemukan dalam lendir (mukosa) menghambat kolonisasi integumen oleh mikroorganisme yang berpotensi membahayakan, sedangkan insang merupakan organ multifungsi, selain sebagai organ pernafasan juga terlibat dalam sistem imun dengan menghasilkan mukosa. Mukosa terhubung dengan jaringan limfoid yang merupakan pusat makrofag, netrofil, limfosit dan sel
mast/eosinofilik granulosit.
METODE
Waktu dan Tempat
Penelitian dilakukan di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Analisis proksimat dilakukan di Laboratorium Nutrisi Ikan, sedangkan pemeliharaan ikan dan analisis imunitas ikan dilakukan di Laboratorium Kesehatan Ikan. Penelitian ini dilakukan dari bulan Oktober 2012 sampai Mei 2013.
Persiapan Pakan Uji
5 Tepung biji rosela yang sudah siap, kemudian dicampur dengan bahan-bahan lain selanjutnya diproses menjadi pakan uji dengan komposisi sebagaimana ditunjukkan pada Tabel 2.
Tabel 2 Komposisi pakan percobaan
Bahan pakan Jenis pakan (dosis tepung biji rosela)
A (0%) B (2%) C (4%) D (6%) E (8%)
Tepung ikan 18.00 18.00 18.00 18.00 18.00
Tepung meat bone 17.18 17.18 17.18 17.18 17.18
Tepung jagung 35.86 35.55 35.22 34.90 34.55
Tepung kedelai 18.96 17.27 15.60 13.92 12.27
Tepung biji rosela (TBR) 0.00 2.00 4.00 6.00 8.00
Minyak ikan 2.00 2.00 2.00 2.00 2.00
Vitamin-Mineral mix* 4.00 4.00 4.00 4.00 4.00
Binder (Tepung tapioka) 4.00 4.00 4.00 4.00 4.00
Total (%) 100.00 100.00 100.00 100.00 100.00
*g kg-1 vitamin-mineral mix; Maltodextrin 763.75; vitamin A 20.00; vitamin D3 20.00; vitamin E
20.00; vitamin K 30.50; vitamin C 50.00; vitamin B1 3.00; vitamin B2 2.00; vitamin B6 2.50; niacin 7.00; cd panthothenat 6.00; methionin 50.00; lysin 50.00; folic acid 0.25; choline chloride 5.00.
Persiapan Bakteri Uji
Bakteri uji yang digunakan adalah Aeromonas hydrophila hasil isolasi ikan yang sakit. Bakteri disuntikkan secara intraperitoneal pada sepuluh ekor ikan patin untuk menguji virulensinya. Bakteri diisolasi kembali dengan menggoreskan jarum ose ke bagian ginjal kemudian dibiakkan di media TSA (tryptone soya agar) dalam cawan petri dan diinkubasi selama 24 jam pada suhu kamar. Koloni bakteri hasil isolasi diamati morfologinya berdasarkan warna dan bentuk. Biakan murni didapatkan dengan mengambil setiap koloni bakteri yang tumbuh terpisah dan berlainan morfologinya, diisolasi kembali ke dalam media TSA miring dan diinkubasi pada suhu kamar selama 24 jam. Karakterisasi yang dilakukan meliputi pengamatan morfologi koloni secara visual, meliputi warna, elevasi dan tepian sel. Uji yang dilakukan meliputi pewarnaan Gram, uji motilitas, uji oksidatif/fermentatif, uji katalase dan uji oksidase.
Penentuan tingkat virulensi bakteri dilakukan dengan menghitung nilai LD50 (Sarkar & Rashid 2012). Hal ini penting untuk mengetahui konsentrasi bakteri yang digunakan baik untuk uji in vitro maupun uji tantang. Sebelum digunakan dilakukan regenerasi bakteri terlebih dahulu dengan cara bakteri stok dari kultur primer dibiakkan dalam media TSA miring sebanyak satu ose dan diinkubasi selama 24 jam pada suhu 27 oC. Sebanyak satu ose bakteri diambil dari biakan terbaru berumur 24-48 jam dan diinokulasikan ke dalam erlenmeyer yang berisi 25 ml media TSB (tryptone soya broth), kemudian diinkubasi selama 24 jam dengan suhu 27 oC pada water bath shaker. Dalam uji LD50 ini digunakan akuarium berukuran 60x30x33 cm yang disusun untuk empat perlakuan tiga ulangan. Masing-masing akuarium diisi dengan 10 ekor ikan. Penyuntikan bakteri
6
menghitung jumlah ikan yang masih hidup dan yang mati sampai hari ke-7. Penghitungan dilakukan untuk mengetahui nilai LD50 yaitu konsentrasi dimana ikan mati sebanyak 50% dari populasi pada batas waktu tertentu.
Persiapan Ikan Uji
Ikan uji yang digunakan adalah patin (Pangasionodon hypopthalmus) yang dibeli dari petani ikan di Bogor. Bobot awal ikan uji berkisar 1.33-1.51 gr/ekor. Total jumlah ikan uji berkisar 2000 ekor untuk dua tahap penelitian. Ikan uji dibawa dengan sistem transportasi tertutup, yaitu dengan menggunakan kantung plastik yang berisi oksigen. Setelah sampai di lokasi penelitian, ikan uji ditampung dalam satu buah bak fiberglass bervolume 500 liter air diaerasi dan diberi pakan komersial sekenyangnya pada pagi dan sore hari selama 10 hari sebagai proses aklimatisasi ikan uji terhadap kondisi lingkungan percobaan.
Tahapan Penelitian
Ada dua rangkaian penelitian utama yang dilakukan. Pertama, penelitian tentang dosis tepung biji rosela yang mampu mempengaruhi pertumbuhan dan imunitas ikan. Kedua, penelitian mengenai metode pemberian pakan uji yang akan mempengaruhi pertumbuhan dan imunitas ikan.
Penelitian pertama adalah percobaan dosis optimal. Penelitian ini dilakukan dengan menggunakan rancangan acak lengkap dengan lima perlakuan dan tiga ulangan. Perlakuannya adalah persentase tepung biji rosela dalam pakan 0% (kontrol/A), 2% (B), 4% (C), 6% (D) dan 8% (E) dengan komposisi bahan sebagaimana Tabel 2. Pemeliharaan ikan dilakukan pada akuarium berukuran 60x30x35 cm dengan volume air 36 liter. Masing-masing akuarium diisi dengan 35 ekor ikan per akuarium dengan bobot awal 1.33-1.51 gr/ekor. Setelah itu, ikan diberi pakan uji hingga kenyang setiap dua kali sehari yakni pada pukul 07:00 dan 18:00.
Percobaan dilakukan selama 30 hari dengan parameter yang diuji adalah kelangsungan hidup, efisiensi pakan, retensi lemak dan protein, laju pertumbuhan harian serta konsumsi pakan. Untuk imunitas terbaik, dilakukan pengambilan sampel darah pada hari ke-0, ke-10, ke-20 dan hari ke-30 untuk mengukur hematokrit, hemoglobin, sel darah merah total, sel darah putih total, diferensial leukosit dan aktivitas fagositik.
Hari ke-31 dilakukan uji tantang. Uji tantang dilakukan untuk memastikan bahwa pakan yang mengandung tepung biji rosela mempunyai kemampuan untuk meningkatkan imunitas ikan, yakni melalui penyuntikan bakteri Aeromonas hydrophila dengan kepadatan 108 cfu/ml. Pengamatan dilakukan selama 7 hari dengan setiap hari dilakukan pengamatan jumlah ikan yang mati.
Penelitian kedua adalah percobaan metode pemberian pakan uji. Percobaan
7 injeksi bakteri Aeromonas hydrophila dengan kepadatan 108 cfu/ml dan pengamatan pasca injeksi selama 7 hari.
Percobaan dilakukan dengan menggunakan rancangan acak lengkap dengan enam perlakuan dan tiga ulangan. Perlakuannya adalah kontrol positif (K+), yakni pemberian pakan dengan pakan komersil selama 20 hari kemudian dilakukan uji tantang dengan diinjeksi bakteri Aeromonas hydrophila. Kontrol negatif (K-), yakni pemberian pakan komersil selama 20 hari tanpa dilakukan uji tantang menggunakan bakteri Aeromonas hydrophila. Perlakuan A, yakni pemberian pakan uji terbaik selama 20 hari kemudian diinjeksi dengan bakteri Aeromonas hydrophila. Perlakuan B, yakni pemberian pakan komersil pada lima hari pertama, pemberian pakan uji terbaik pada hari ke-6 sampai dengan hari ke-15, pemberian pakan komersil pada lima hari terakhir dan pada hari ke-21 dilakukan uji tantang dengan injeksi bakteri Aeromonas hydrophila. Perlakuan C, yakni pemberian pakan uji terbaik pada lima hari pertama, pakan komersil pada lima hari ke-2, pakan uji terbaik pada lima hari ke-3 dan pakan komersil pada lima hari terakhir, selanjutnya pada hari ke-21 dilakukan uji tantang dengan injeksi bakteri
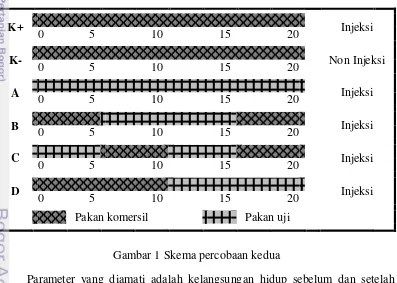
Aeromonas hydrophila. Terakhir perlakuan D, yakni pemberian pakan komersil pada sepuluh hari pertama dan pakan uji terbaik pada sepuluh hari terakhir yang dilanjutkan dengan uji tantang diinjeksi bakteri Aeromonas hydrophila. Berikut skema rancangan penelitian yang dilakukan pada Gambar 1.
Gambar 1 Skema percobaan kedua
8
Parameter Pengamatan
Peubah yang akan diamati dalam penelitian ini adalah sebagai berikut: 1. Kelangsungan hidup.
Tingkat kelangsungan hidup dihitung berdasarkan persamaan Zonneveld et al. (1991):
2. Laju pertumbuhan harian
Laju pertumbuhan harian dihitung dengan menggunakan rumus berikut ini (Huisman 1987) :
α =
Keterangan: α = Laju pertumbuhan harian (%) t = Waktu pemeliharaan (hari)
Wt = Rerata bobot individu pada akhir pemeliharaan (g) W0 = Rerata bobot individu pada awal pemeliharaan (g) 3. Efisiensi pakan
Efisiensi pakan (EP) akan dihitung dengan menggunakan rumus:
4. Retensi protein (RP)/lemak (L)
Nilai retensi protein/lemak akan dihitung berdasarkan persamaan Takeuchi (1988):
KH (%) = ∑ total ikan akhir (ekor) x 100% ∑ total ikan awal (ekor)
EP (%) =
[(WT + WD) – W0]
X 100% F
Keterangan : Wt = Bobot total ikan pada akhir pemeliharaan (gram) W0 = Bobot total ikan pada awal pemeliharaan(gram) Wd = Bobot total ikan yang mati selama pemeliharaan
(gram)
f = Jumlah pakan yang diberikan (gram)
RP/L (%) = (F - I) X 100% P/L
Keterangan : F = Jumlah protein/lemak tubuh pada akhir pemeliharaan (gram)
I = Jumlah protein/lemak tubuh pada awal pemeliharaan (gram)
9 5. Sel darah merah total
Darah dihisap dengan pipet pengukur sel darah merah yang berisi bulir pengaduk warna merah sampai skala 1. Setelah itu ditambahkan larutan Hayem’s sampai skala 101. Pengadukan darah di dalam pipet dilakukan dengan mengayunkan tangan membentuk angka delapan selama 3-5 menit sehingga darah tercampur dengan merata. Selanjutnya dua tetes pertama dari larutan darah dalam pipet dibuang, kemudian larutan darah dalam pipet diteteskan pada
haemocytometer dan ditutup dengan gelas penutup. Penghitungan jumlah sel darah merah dilakukan dengan mikroskop binokuler dengan pembesaran 400x (Blaxhall & Daisley 1973). ditambahkan sampai warna merah dan HCl tersebut seperti warna larutan standar yang ada pada Hb-meter. Pembacaan skala dilakukan dengan melihat permukaan cairan dan dicocokan dngan skala tabung sahli yang dilihat pada skala jalur gr % (kuning) yang berarti banyaknya hemoglobin dalam gram per 100 ml darah (Wedemeyer & Yasutake 1977).
7. Hematokrit
Salah satu ujung tabung mikrohematokrit dicelupkan ke dalam tabung yang berisi darah, maka darah akan merambat secara kapiler sampai mencapai ¾ bagian tabung. Selanjutnya ujung tabung ditutup dengan cara menancapkan ujung tabung ke dalam crytoceal kira-kira 1 mm. Tabung hematokrit tersebut disentrifugasi dengan kecepatan 5000 rpm selama 5 menit. Setelah itu dilakukan pengukuran panjang bagian darah yang mengendap serta panjang total volume darah yang terdapat di dalam tabung (Anderson & Siwicki 1995).
8. Sel darah putih total
Darah dihisap dengan pipet yang berisi bulir pengaduk berwarna putih sampai skala 0.5. Selanjutnya ditambahkan larutan Turk’s sampai skala 11 lalu pipet diayunkan membentuk angka 8 selama 3-5 menit sehingga darah tercampur secara merata. Dua tetes pertama larutan darah dibuang dari dalam pipet, kemudian darah dari dalam pipet diteteskan ke dalam haemocytometer kemudian ditutup dengan gelas penutup. Penghitungan sel darah putih dilakukan dengan menggunakan mikroskop pada pembesaran 400 x (Blaxhall & Daisley 1973).
9. Diferensial leukosit
Darah diteteskan pada gelas objek bagian kanan atas. Selanjutnya gelas objek yang lain diletakkan diatas tetesan darah sampai membentuk sudut sekitar 30 0, lalu ditarik sampai darah menyebar sepanjang tepi gelas objek pertama. Setelah itu ulasan dikeringudarakan, lalu direndam dalam larutan Giemsa (1:20) selama 15-20 menit. Kemudian dibilas dengan akuades, ditutup dengan gelas penutup dan diamati menggunakan mikroskop (Blaxhall & Daisley 1973).
10. Aktivitas fagositik
10
ulas. Preparat ini difiksasi dengan methanol selama 5 menit lalu dikeringkan, kemudian direndam dalam larutan Giemsa selama 15 menit, lalu dicuci dengan air mengalir dan dikeringkan. Pengamatan dilakukan dengan menggunakan mikroskop (Anderson & Siwicki 1995).
Analisis Kimia Bahan Pakan, Pakan dan Ikan Uji
Analisis kimia yang dilakukan dalam uji ini adalah analisis proksimat bahan pakan (tepung ikan, tepung meat bone, tepung biji rosela, tepung jagung, tepung kedelai dan tepung tapioka), pakan uji dan ikan uji (Lampiran 2). Analisis proksimat meliputi pengukuran kadar air, protein kasar, lemak kasar, kadar abu, serat kasar dengan metode AOAC (1984) dalam Takeuchi (1988). Analisis kimia juga dilakukan untuk menghitung tokoferol total dengan metode PORIM (Palm Oil Research Institute of Malaysia) (Lin et al. 1995).
Analisis Statistik
Parameter yang diukur dianalisis sidik ragam (ANOVA). Perbedaan antar perlakuan diketahui melalui hasil pengujian menggunakan uji F (sidik ragam) dengan selang kepercayaan 95%. Hasil uji F yang berbeda nyata, dilanjutkan dengan uji Tukey.
HASIL DAN PEMBAHASAN
Hasil Percobaan Dosis Optimal
Percobaan dosis optimal ini merupakan penelitian tahap satu dari dua tahap penelitian yang dilakukan. Parameter yang diamati untuk mendapatkan dosis optimal adalah kelangsungan hidup, efisiensi pakan, retensi lemak, retensi protein, laju pertumbuhan harian dan konsumsi pakan. Rata-rata hasil pengukuran parameter-parameter tersebut disajikan pada Tabel 3. Hasil penelitian menunjukkan bahwa kelangsungan hidup seluruh perlakuan adalah 100.00±0.000%, sedangkan efisiensi pakan berada pada kisaran 25.74±4.686 sampai dengan 31.75±2.881%. Dua parameter ini, ditambah laju pertumbuhan harian menunjukkan hasil yang tidak berbeda nyata. Laju pertumbuhan harian di kisaran 1.48±0.052 sampai dengan 1.71±0.143%.
11 (275.21±0.249 gr) untuk konsumsi pakan total dan E (1.41±0.020 gr) untuk konsumsi pakan per individu.
Tabel 3 Rata-rata Kelangsungan Hidup (KH), Efisiensi Pakan (EP), Retensi Lemak (RL), Retensi Protein (RP), Laju Pertumbuhan Harian (LPH) dan Konsumsi Pakan (KP)*
Parameter A (0%) B (2%) C (4%) D (6%) E (8%)
KH (%)** 100.00±0.000a 100.00±0.000a 100.00±0.000a 100.00±0.000a 100.00±0.000a
EP (%) 27.34±1.381a 26.42±3.625a 31.75±2.881a 26.42±0.749a 25.74±4.686a
RL (%) 81.02±2.820b 90.19±8.519b 84.66±9.379b 14.55±2.699a 15.75±4.596a
RP (%) 40.62±1.062ab 44.53±4.217ab 55.55±3.017b 50.01±2.035b 29.11±6.435a
LPH (%) 1.71±0.143a 1.56±0.099a 1.68±0.192a 1.48±0.052a 1.50±0.145a
KP (gr) 301.79±0.212e 300.27±0.235d 297.45±0.500c 275.21±0.249a 282.02±0.001b
KP per
indv(gr) 3.40±0.020
c
2.65±0.010b 2.60±0.020b 2.55±0.020b 1.41±0.020a
*Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Tukey).
**Kelangsungan hidup sebelum uji tantang.
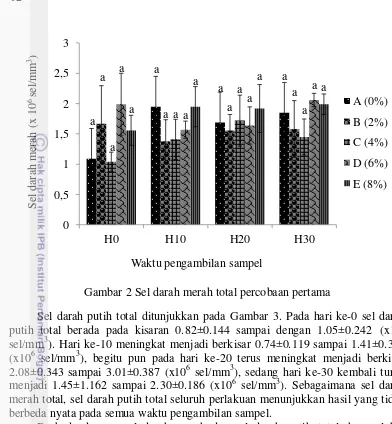
Penelitian tahap satu ini selain mengukur parameter-parameter diatas (Tabel 3) juga melakukan pengukuran pada sampel darah. Ini dilakukan untuk menambah informasi mengenai pengaruh tepung biji rosela terhadap imunitas ikan. Pengukuran dilakukan pada hari ke-0, ke-10, ke-20 dan ke-30. Hasil pengukuran pada sampel darah ditunjukkan melalui grafik pada Gambar 2 sampai 7.
12
Gambar 2 Sel darah merah total percobaan pertama
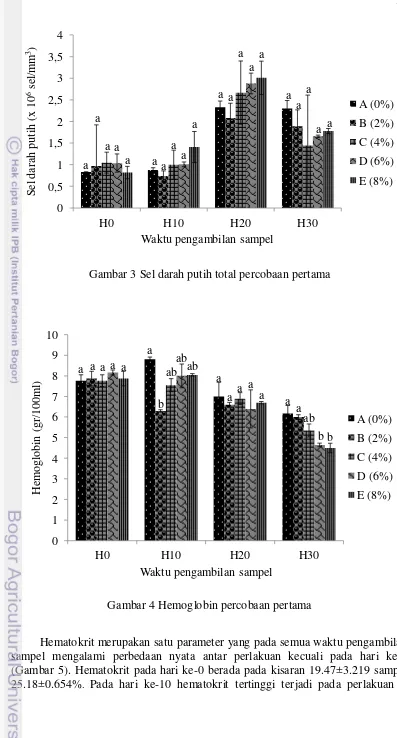
Sel darah putih total ditunjukkan pada Gambar 3. Pada hari ke-0 sel darah putih total berada pada kisaran 0.82±0.144 sampai dengan 1.05±0.242 (x106 sel/mm3). Hari ke-10 meningkat menjadi berkisar 0.74±0.119 sampai 1.41±0.360 (x106 sel/mm3), begitu pun pada hari ke-20 terus meningkat menjadi berkisar 2.08±0.343 sampai 3.01±0.387 (x106 sel/mm3), sedang hari ke-30 kembali turun menjadi 1.45±1.162 sampai 2.30±0.186 (x106 sel/mm3). Sebagaimana sel darah merah total, sel darah putih total seluruh perlakuan menunjukkan hasil yang tidak berbeda nyata pada semua waktu pengambilan sampel.
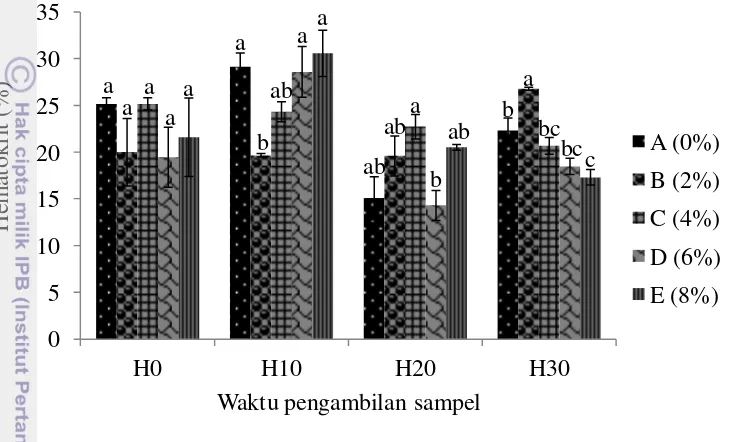
Berbeda dengan sel darah merah dan sel darah putih total, hemoglobin menunjukkan hasil yang berbeda nyata antar perlakuan pada hari ke-10 dan hari ke-30 (Gambar 4). Hemoglobin hari ke-0 berada pada kisaran 7.77±0.285 sampai 8.17±0.120 gr 100ml-1. Hari ke-10 terjadi perbedaan nyata, hemoglobin tertinggi terjadi pada perlakuan A dengan rata-rata 8.80±0.115 gr 100ml-1 dan terendah pada perlakuan B dengan rata-rata 6.30±0.058 gr 100ml-1. Hari ke-20 terjadi penurunan sehingga berada diantara 6.40±0.924 sampai 7.00±0.693 gr 100ml-1, akan tetapi tidak ada perbedaan nyata antar perlakuan. Hari ke-30 semakin menurun dan terjadi perbedaan nyata antar perlakuan dengan hemoglobin tertinggi masih pada perlakuan A (6.17±0.393 gr 100ml-1) akan tetapi yang terendah perlakuan E (4.50±0.231 gr 100ml-1).
13
Gambar 3 Sel darah putih total percobaan pertama
Gambar 4 Hemoglobin percobaan pertama
14
(30.60±2.471%) dan terendah perlakuan B (19.68±0.188%). Hematokrit hari ke-20 mengalami penurunan dengan hasil tertinggi terjadi pada perlakuan C (22.73±1.313%) dan terendah perlakuan D (14.31±1.596%). Hari ke-30 terjadi peningkatan kembali dengan hasil yang tertinggi terjadi pada perlakuan B (26.81±0.159%) sedang yang terendah pada perlakuan E (17.33±0.820%).
Gambar 5 Hematokrit percobaan pertama
Aktivitas fagositik menunjukkan hasil yang tidak berbeda nyata antar perlakuan pada semua waktu pengambilan sampel (Gambar 6). Hari ke-0 aktivitas fagositik berkisar 52.33±1.667 sampai 62.67±4.484%, sedangkan hari ke-10 meningkat meskipun pada perlakuan B dan C terjadi penurunan (38.21±10.727 sampai 74.14±8.947%). Hari ke-20 semakin meningkat menjadi berkisar 82.33±5.812 sampai 89.67±2.404%, terakhir pada hari ke-30 kembali menurun sehingga berada pada kisaran 29.50±5.500 sampai 44.00±2.000%.
15
Gambar 6 Aktivitas fagositik percobaan pertama
Gambar 7 Diferensial leukosit percobaan pertama
16
Gambar 8 Kelangsungan hidup setelah uji tantang percobaan pertama Percobaan Metode Pemberian Pakan Uji
Percobaan ini merupakan penelitian lanjutan setelah didapatkan dosis optimal. Berdasarkan hasil pengukuran semua parameter, disimpulkan bahwa pakan yang terbaik adalah pakan yang digunakan pada perlakuan C. Kesimpulan ini diambil terutama karena berdasarkan pengukuran pada retensi protein persentase pada perlakuan C tertinggi. Oleh karena itu, pada percobaan tahap dua ini pakan yang digunakan sebagai pakan uji adalah pakan C dan pakan komersil. Kelangsungan hidup, efisiensi pakan, laju pertumbuhan harian dan konsumsi pakan ditunjukkan pada Tabel 4. Hasil penelitian menunjukkan bahwa kelangsungan hidup, efisiensi pakan dan laju pertumbuhan harian tidak berbeda nyata tiap perlakuan. Kelangsungan hidup seluruh perlakuan sebelum uji tantang adalah rata-rata 100.00±0.000%, efisiensi pakan berada diantara 16.20±0.573 sampai 20.58±0.651% dan laju pertumbuhan harian berkisar 1.93±0.065 sampai 2.59±0.603%. Konsumsi pakan berbeda nyata antar perlakuan. Konsumsi pakan tertinggi terjadi pada kontrol positif dengan nilai konsumsi pakan 642.37±5.157 gr, meskipun tidak berbeda nyata dengan kontrol negatif dengan nilai konsumsi pakan 642.29±4.463 gr. Semakin menurun pada perlakuan C dengan nilai konsumsi pakan 498.72±6.753gr yang menunjukkan hasil tidak berbeda nyata dengan perlakuan B dan D dengan nilai konsumsi pakan 498.51±6.250gr dan 498.42±8.704gr. Nilai konsumsi pakan terendah terjadi pada perlakuan A, yakni 354.67±4.711 gr.
Tabel 4 Rata-rata Kelangsungan Hidup (KH), Efisiensi Pakan (EP), Laju Pertumbuhan Harian (LPH) dan Konsumsi Pakan (KP)*
Parameter K+ K- A B C D
KH (%)** 100.00±0.000a 100.00±0.000a 100.00±0.000a 100.00±0.000a 100.00±0.000a 100.00±0.000a EP (%) 16.20±0.573a 17.32±1.281a 20.58±0.651a 18.52±1.784a 19.28±2.683a 18.82±1.834a LPH (%) 2.59±0.603a 2.73±0.174a 1.93±0.065a 2.35±0.208a 2.41±0.319a 2.37±0.167a KP (gr) 642.37±5.157c 642.29±4.463c 354.67±4.711a 498.51±6.250b 498.72±6.753b 498.42±8.704b
*Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Tukey).
**Kelangsungan hidup sebelum uji tantang.
A (0%) B (2%) C (4%) D (6%) E (8%)
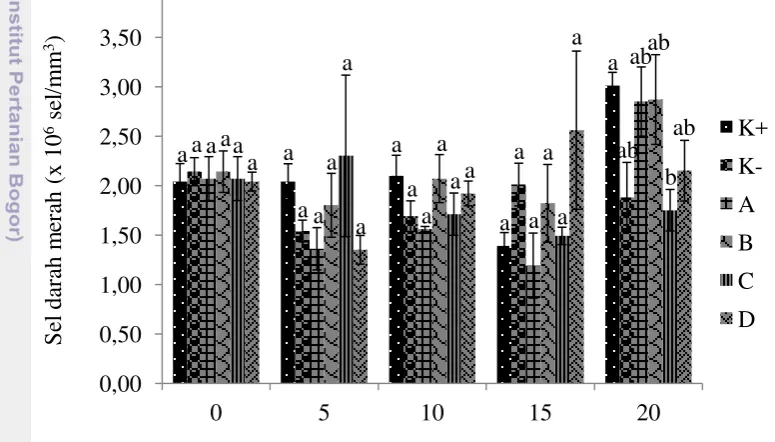
17 Pengukuran pada sampel darah merupakan satu kegiatan yang dilakukan dengan tujuan mengetahui pengaruh tepung biji rosela terhadap imunitas ikan. Pengukuran pada sampel darah hari ke-0 secara keseluruhan menunjukkan hasil tidak berbeda nyata antar perlakuan termasuk sel darah merah total (Gambar 9). Sel darah merah total hari ke-0 berada pada kisaran 2.04±0.182 sampai 2.14±0.210 (x106 sel/mm3). Hari ke-5 menurun kecuali pada perlakuan C terjadi peningkatan dengan nilai berkisar 1.35±0.177 sampai 2.30±1.001 (x106 sel/mm3). Hari ke-10 terjadi peningkatan akan tetapi pada perlakuan C terjadi penurunan dengan nilai berkisar pada 1.56±0.026 sampai 2.10±0.206 (x106 sel/mm3). Hasil hari ke-15 tidak terlalu berbeda dengan hasil sebelumnya, tidak ada perbedaan yang nyata antar perlakuan dengan sel darah merah total berkisar 1.19±0.329 sampai 2.56±0.800 (x106 sel/mm3). Hari ke-20 terjadi perbedaan nyata antar perlakuan dengan sel darah merah total tertinggi adalah kontrol positif 3.01±0.135 (x106 sel/mm3) dan terendah perlakuan C (1.75±0.210 x106 sel/mm3).
Gambar 9 Sel darah merah total percobaan kedua
Sel darah putih total pada percobaan kedua secara keseluruhan semakin meningkat dengan kisaran 0.98±0.177 sampai 1.80±0.129 (x106 sel/mm3) dan 1.54±0.237 sampai 2.31±0.245 (x 106 sel/mm3).
Hemoglobin pada hari ke-0 sampai hari ke-10 menunjukkan hasil yang tidak berbeda nyata antar perlakuan (Gambar 11). Secara berurutan dari hari ke-0, ke-5
a a a
Waktu pengambilan sampel (Hari ke-)
18
dan hari ke-10 berada pada kisaran 3.87±0.371 sampai 5.07±0.705 gr 100ml-1, antara 4.13±0.163 sampai 4.87±0.726 gr 100ml-1 dan diantara 5.07±0.638 sampai 6.47±0.993 gr 100ml-1. Hari ke-15 dan hari ke-20, terjadi perbedaan nyata antar perlakuan. Hemoglobin pada pengukuran hari ke-15 tertinggi pada perlakuan D (9.93±0.589 gr 100ml-1) dan terendah pada kontrol positif, negatif dan perlakuan A yang berada pada kisaran 4.33± 0.408 sampai 6.20± 1.122 gr 100ml-1, sedangkan pada hari ke-20 hemoglobin tertinggi pada perlakuan A (9.20±0.510 gr 100ml-1) dan terendah pada perlakuan C dan D (6.87±0.942 dan 7.13±0.467 gr 100ml-1).
Gambar 10 Sel darah putih total percobaan kedua
Gambar 11 Hemoglobin percobaan kedua
a
Waktu pengambilan sampel (Hari ke-)
K+
Waktu pengambilan sampel (Hari ke-)
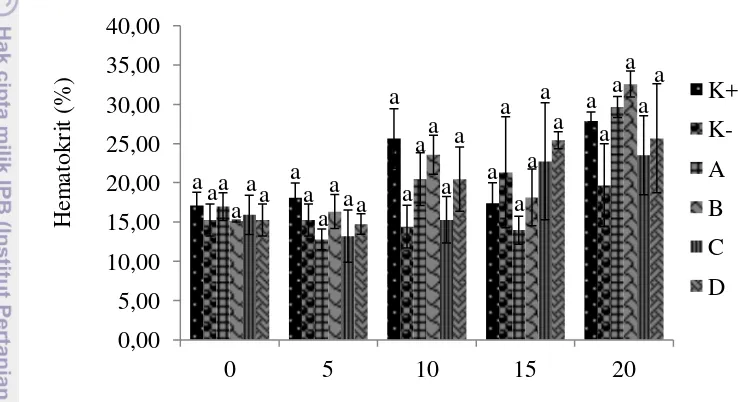
19 Hematokrit percobaan kedua ditunjukkan pada Gambar 12. Secara keseluruhan hematokrit antar perlakuan menunjukkan hasil yang tidak berbeda nyata. Hari ke-0 hematokrit berada pada kisaran 15.13±0.127 sampai 17.09±1.710%. Hari ke-5 sedikit meningkat pada kontrol positif dan perlakuan B, akan tetapi menurun pada perlakuan lainnya dengan nilai rerata 12.80±1.310 sampai 18.10±1.887%. Hari ke-10 terus meningkat menjadi 14.44±2.722 sampai 25.66±3.788%. Pada hari ke-15 terjadi sedikit penurunan menjadi 13.97±1.771 sampai 25.43±1.076%, akan tetapi pada hari ke-20 meningkat kembali menjadi 19.71±5.274 sampai 32.61±1.653%.
Gambar 12 Hematokrit percobaan kedua
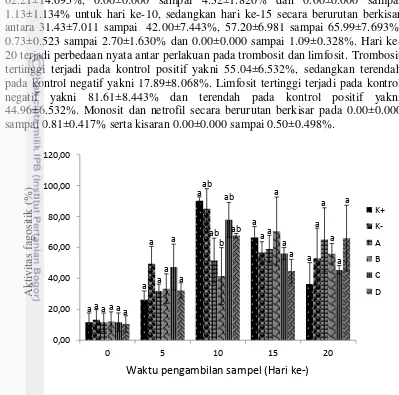
Aktivitas fagositik ke-0 dan hari ke-5 menunjukkan hasil yang tidak berbeda nyata (Gambar 13). Aktivitas fagositik hari ke-0 berkisar pada 10.56±5.300dan 13.33±6.667%. Hari ke-5 meningkat menjadi berkisar 26.11±5.800 sampai 49.52±11.162%. Hari ke-10 terjadi perbedaan nyata antar perlakuan dengan persentase tertinggi terjadi pada kontrol positif (+) dengan rata-rata 90.14±2.506%, terendah pada perlakuan B dengan rata-rata 41.48±18.373%. Hari ke-15 dan ke-20 terjadi penurunan aktivitas fagositik. Selain itu, tidak terjadi perbedaan yang nyata antar perlakuan. Persentase aktivitas fagositik pada hari ke-15 berkisar 44.67±7.637 sampai 70.39±22.189% sedangkan hari ke-20 pada kisaran 36.30±13.865sampai 65.95±21.287%.
Diferensial leukosit dalam hal ini trombosit, limfosit, monosit dan netrofil pada percobaan kedua ditunjukkan pada Gambar 14. Trombosit, limfosit, monosit dan netrofil pada hari ke-0 secara berurutan berkisar 33.08±4.162 sampai 43.39±7.697%, 50.20±8.234 sampai 62.62±5.750%, 2.30±1.204 sampai 7.29±3.230% dan 0.00±0.000 sampai 2.05±1.156%. Hari ke-5 pengukuran diferensial leukosit ada satu parameter yang mengalami perbedaan yang nyata antar perlakuan yakni netrofil. Netrofil pada kontrol positif menunjukkan angka 0.28±0.142% sedang perlakuan lain 0.00±0.000%. Parameter lainnya menunjukkan tidak ada perbedaan yang nyata antar perlakuan. Trombosit, limfosit dan monosit secara berurutan, 26.41±11.781 sampai 39.46±8.512%, 60.37±8.683
a a
Waktu pengambilan sampel (Hari ke-)
20
sampai 72.20±11.732%, 0.17±0.173 sampai 1.39±0.736% dan 0.00±0.000 sampai 0.28±0.142%. Hari ke-10 dan ke-15 tidak ada yang mengalami perbedaan nyata antar perlakuan. Secara berurutan hasil pengukuran trombosit, limfosit, monosit dan netrofil adalah 35.35±14.121 sampai 62.97±2.859%, 33.52±3.930 sampai 62.21±14.695%, 0.00±0.000 sampai 4.32±1.820% dan 0.00±0.000 sampai 1.13±1.134% untuk hari ke-10, sedangkan hari ke-15 secara berurutan berkisar antara 31.43±7.011 sampai 42.00±7.443%, 57.20±6.981 sampai 65.99±7.693%, 0.73±0.523 sampai 2.70±1.630% dan 0.00±0.000 sampai 1.09±0.328%. Hari ke-20 terjadi perbedaan nyata antar perlakuan pada trombosit dan limfosit. Trombosit tertinggi terjadi pada kontrol positif yakni 55.04±6.532%, sedangkan terendah pada kontrol negatif yakni 17.89±8.068%. Limfosit tertinggi terjadi pada kontrol negatif yakni 81.61±8.443% dan terendah pada kontrol positif yakni 44.96±6.532%. Monosit dan netrofil secara berurutan berkisar pada 0.00±0.000 sampai 0.81±0.417% serta kisaran 0.00±0.000 sampai 0.50±0.498%.
Gambar 13 Aktivitas fagositik percobaan kedua
Kelangsungan hidup setelah uji tantang disajikan pada Gambar 15. Grafik menunjukkan terjadi perbedaan yang nyata antar perlakuan. Kelangsungan hidup tertinggi terjadi pada kontrol negatif (100.00±0.000%), karena memang tidak dilakukan penyuntikan Aeromonas hydrophila, diikuti kontrol positif (85.64±5.260%), perlakuan B (62.10±9.644%), perlakuan D (46.92±11.940%), perlakuan C (33.15±12.046%) dan terendah perlakuan A (24.88±4.750%).
a
Waktu pengambilan sampel (Hari ke-)
21
Gambar 14 Diferensial leukosit percobaan kedua
Gambar 15 Kelangsungan hidup setelah uji tantang percobaan kedua
K+1 K-1 A B C D
Waktu pengambilan sampel (Hari ke-)
K+ K- A B C D
Waktu pengambilan sampel (Hari ke-)
K+ K- A B C D
Waktu pengambilan sampel (Hari ke-)
K+ K- A B C D
Waktu pengambilan sampel (Hari ke-)
22
Pembahasan Percobaan Dosis Optimal
Penelitian ini merupakan studi pertama untuk mengevaluasi pengaruh perbedaan dosis tepung biji rosela pada pakan patin. Hasil penelitian menunjukkan bahwa perbedaan dosis tepung biji rosela tidak memberikan pengaruh yang berbeda nyata terhadap laju pertumbuhan harian, efisiensi pakan dan tingkat kelangsungan hidup patin (Tabel 3). Laju pertumbuhan harian, efisensi pakan dan kelangsungan hidup ikan merupakan beberapa parameter yang umumnya digunakan untuk mengetahui pertumbuhan ikan dan juga untuk mengevaluasi bahan penyusun pakan. Tidak ada perbedaan yang nyata antar perlakuan, baik yang diberi pakan dengan tepung biji rosela maupun tanpa tepung biji rosela menunjukkan bahwa tepung biji rosela layak sebagai alternatif bahan penyusun pakan tambahan bagi patin.
Perhitungan retensi protein dan retensi lemak dilakukan untuk mengetahui kemampuan ikan yang telah diberi pakan uji dalam menyimpan dan memanfaatkan protein dan lemak pakan. Hasil penelitian menunjukkan bahwa nilai retensi protein dan lemak mengalami perbedaan yang nyata antar perlakuan (Tabel 3). Retensi protein tertinggi terjadi pada perlakuan C, yakni perlakuan yang diberi pakan yang mengandung tepung biji rosela 4%, yang menunjukkan hasil tidak berbeda nyata dengan perlakuan D, perlakuan yang diberi pakan yang mengandung tepung biji rosela 6%. Penurunan ditunjukkan oleh perlakuan B, perlakuan yang diberi pakan yang mengandung tepung biji rosela 2% dan perlakuan A (kontrol), perlakuan yang diberi pakan yang tidak mengandung tepung biji rosela, sedangkan pada perlakuan E, perlakuan yang diberi pakan yang mengandung tepung biji rosela 8% terjadi penurunan drastis. Hasil ini menunjukkan bahwa dibandingkan dengan kontrol (A) penambahan tepung biji rosela lebih memberikan pengaruh terhadap kemampuan ikan dalam menyimpan protein, meskipun berdasarkan hasil perhitungan pada konsumsi pakan lebih rendah dibandingkan dengan kontrol (A). Namun demikian, meski nilai retensi protein pada perlakuan C dan D lebih tinggi dibanding perlakuan kontrol (A) atau minimal setara sebagaimana perlakuan B, terjadi penurunan secara drastis pada perlakuan E. Diduga ini terjadi karena rendahnya konsumsi pakan per individu, yakni hanya 1.41±0.020 gr (Tabel 3) yang akhirnya mempengaruhi jumlah konsumsi protein pakan.
Protein merupakan nutrien yang sangat diperlukan untuk pertumbuhan dan mempertahankan kehidupan bagi semua hewan termasuk ikan. Berbagai jenis protein juga berperan sebagai pelindung dalam darah hewan vertebrata. Berbagai jenis antibodi merupakan protein pelindung terhadap antigen. Fibrinogen, trombin,
23 semakin baik begitu pula dengan kelangsungan hidup setelah uji tantang semakin tinggi.
Pemberian tepung biji rosela juga mempengaruhi kemampuan ikan dalam menyimpan dan memanfaatkan lemak pakan, hal ini terlihat pada perlakuan C dan B yang nilai retensi lemaknya tinggi meski tidak berbeda nyata dengan perlakuan kontrol (A). Hasil yang berbeda terjadi pada perlakuan D dan E yang menunjukkan hasil yang sangat rendah. Ini kemungkinan terjadi akibat kurangnya asupan pakan pada perlakuan D dan E karena berdasarkan nilai konsumsi pakan, perlakuan D dan E nilai konsumsi pakannya paling rendah. Rendahnya konsumsi pakan ini, kemungkinan dikarenakan oleh rendahnya palatabilitas akibat masih adanya senyawa antinutrisi. Menurut Fagbenro (2005) biji rosela diketahui memiliki senyawa antinutrisi berupa tanin, inhibitor α-amilase, inhibitor protease, asam fitat dan gosipol. Senyawa antinutrisi diketahui dapat mempengaruhi palatabilitas. Jobling et al. (2001) menyatakan bahwa palatabilitas bervariasi tergantung pada bahan baku salah satunya zat antinutrisi dan kualitas pakan. Upaya yang dapat dilakukan untuk menghilangkan atau meminimalisir kandungan senyawa antinutrisi dalam bahan baku pakan adalah dengan pengolahan. Namun demikian, karena kandungan senyawa antinutrisi yang terkandung dalam biji rosela relatif bervariasi, maka diduga senyawa antinutrisi tersebut masih ada meski sudah dilakukan pengolahan.
Dabrowski et al. (2007) menambahkan, rendahnya konsumsi pakan bisa diakibatkan oleh tidak seimbangnya kadar asam amino pakan. Menurut Herman (1970) dalam Francis et al. (2001) gosipol pada kadar tertentu dapat menyebabkan defisiensi asam amino tertentu seperti metionin yang penting untuk metabolisme lemak. Tingginya kadar gosipol terutama pada perlakuan yang dosis tepung biji roselanya paling tinggi diduga menyebabkan rendahnya retensi lemak bahkan mungkin juga retensi protein. Selain gosipol, senyawa tanin juga diketahui mampu mempengaruhi proses pencernaan. Buyukcapar dan Kamalak (2007) menyatakan bahwa tanin turut campur dalam proses pencernaan dengan cara mengikat enzim atau komponen pakan lainnya seperti protein dan mineral. Tanin juga menurunkan kemampuan penyerapan vitamin B12, bertanggung jawab pada penurunan laju pertumbuhan, rendahnya kecernaan protein dan menurunnya ketersediaan asam amino.
24
tertinggi pada perlakuan A, akan tetapi nilai ini tidak berbeda nyata dengan perlakuan B. Berdasarkan keseluruhan hasil perhitungan pada imunitas, dikaitkan dengan kelangsungan hidup setelah uji tantang didapatkan bahwa penambahan tepung biji rosela pada pakan berpotensi untuk meningkatkan imunitas setelah sepuluh hari pemberian pakan. Akhirnya, berdasarkan keseluruhan parameter, baik pertumbuhan dan imunitas, didapatkan bahwa perlakuan C dengan dosis tepung biji rosela 4% adalah yang paling optimal, karena nilai retensi proteinnya paling tinggi, begitu pula dengan parameter pertumbuhan lainnya serta parameter imunitas, relatif tinggi dan stabil meskipun pada beberapa parameter tidak berbeda nyata dengan perlakuan lainnya.
Percobaan Metode Pemberian Pakan Uji
Percobaan ini merupakan penelitian lanjutan setelah didapatkan dosis yang optimal. Hasil perhitungan terhadap parameter pertumbuhan, didapatkan bahwa frekuensi pemberian pakan uji tidak memberikan pengaruh yang berbeda nyata terhadap laju pertumbuhan harian, efisiensi pakan dan tingkat kelangsungan hidup patin, akan tetapi memberi pengaruh yang nyata pada konsumsi pakan (Tabel 4). Perlakuan dengan persentase konsumsi pakan tertinggi terjadi pada kontrol positif yang menunjukkan hasil tidak berbeda nyata dengan kontrol negatif. Kontrol positif dan kontrol negatif tersebut merupakan perlakuan dengan pemberian pakan komersil selama 20 hari. Selanjutnya semakin menurun pada perlakuan C, yakni pemberian pakan uji terbaik pada lima hari pertama, pakan komersil pada lima hari ke-2, pakan uji terbaik pada lima hari ke-3 dan pakan komersil pada lima hari terakhir. Hasil ini tidak berbeda nyata dengan perlakuan B dan D, yakni pemberian pakan komersil pada lima hari pertama, kemudian pakan uji terbaik pada hari ke-6 sampai hari ke-15 dan pakan komersil pada lima hari terakhir (perlakuan B) dan pemberian pakan komersil pada sepuluh hari pertama dan pakan uji terbaik pada sepuluh hari terakhir (perlakuan D). Nilai konsumsi pakan terendah terjadi pada perlakuan A, yakni pemberian pakan dengan pakan uji terbaik selama 20 hari. Rendahnya konsumsi pakan sebagaimana pada percobaan tahap satu kemungkinan dikarenakan oleh rendahnya palatabilitas akibat masih adanya senyawa antinutrisi.
Perhitungan parameter imunitas pada percobaan kedua dilakukan sebanyak lima kali pengambilan sampel darah, yakni pada hari ke-0, hari ke-5, hari ke-10, hari ke-15 dan hari ke-20. Pengambilkan sampel dilakukan pada enam parameter, diantaranya adalah sel darah merah total, sel darah putih total, hemoglobin, hematokrit, aktivitas fagositik dan diferensial leukosit (trombosit, limfosit, monosit dan netrofil). Untuk mengetahui kinerja tepung biji rosela terhadap imunitas ikan, dilakukan pengukuran tingkat kelangsungan hidup setelah uji tantang dengan bakteri Aeromonas hydrophila di hari ke-21 pada semua perlakuan kecuali kontrol negatif.
25 yang lainnya masih menggunakan pakan komersil. Hasil yang menunjukkan bahwa tidak adanya perbedaan yang nyata antar perlakuan selain dari kontrol positif menunjukkan bahwa pemberian pakan uji yang mengandung tepung biji rosela selama lima hari pertama tidak menyebabkan perbedaan yang nyata pada netrofil jika dibandingkan dengan perlakuan yang diberi pakan komersil.
Perhitungan pada hari ke-10 menunjukkan hasil perbedaan yang nyata pada aktivitas fagositik. Persentase tertinggi adalah kontrol positif, diikuti oleh kontrol negatif, perlakuan C, D dan A yang menunjukkan hasil tidak berbeda nyata antar mereka, sedangkan persentase yang terendah terjadi pada perlakuan B, yakni pemberian pakan komersil pada lima hari pertama, kemudian pakan uji terbaik pada hari ke-6 sampai hari ke-15 dan pakan komersil pada lima hari terakhir. Pada hari ke-10 ini, selain perlakuan A yang selalu menggunakan pakan uji sebagai pakan, ada perlakuan B yang sudah mulai menggunakan pakan uji selama lima hari, sedangkan perlakuan C yang lima hari awal menggunakan pakan uji sudah beralih diberi pakan komersil. Hasil yang menunjukkan bahwa aktivitas fagositik pada perlakuan B rendah, kemungkinan terjadi akibat adanya peralihan dari pakan komersil ke pakan uji tanpa sempat dipuasakan dahulu, yang menyebabkan ikan menjadi stres sehingga menekan sistem imun. Menurut Uribe et al. (2011), dari beberapa faktor internal dan eksternal yang bisa mempengaruhi sistem imun non spesifik (bawaan) adalah stres.
Hari ke-15, perbedaan yang nyata terjadi pada hemoglobin. Hemoglobin tertinggi terjadi pada perlakuan D, yakni pemberian pakan komersil pada sepuluh hari pertama dan pakan uji terbaik pada sepuluh hari terakhir, diikuti oleh perlakuan B dan C, yakni pemberian pakan komersil pada lima hari pertama, kemudian pakan uji terbaik pada hari ke-6 sampai hari ke-15 dan pakan komersil pada lima hari terakhir (perlakuan B) dan yakni pemberian pakan uji terbaik pada lima hari pertama, pakan komersil pada lima hari ke-2, pakan uji terbaik pada lima hari ke-3 dan pakan komersil pada lima hari terakhir (perlakuan C), sedangkan yang terendah terjadi pada perlakuan A, yakni pemberian pakan uji terbaik selama 20 hari, tapi hasil ini tidak berbeda nyata dengan kontrol positif dan kontrol negatif. Pada hari ke-15 ini, perlakuan yang diberi pakan uji yang mengandung tepung biji rosela adalah perlakuan A, B, C dan D. Hasil ini yang menunjukkan bahwa pemberian pakan uji selama lima hari setelah sepuluh hari sebelumnya diberi pakan komersil lebih baik dibandingkan dengan pemberian pakan uji terus menerus selama 15 hari, ataupun dengan pakan komersil terus menerus selama 15 hari, sedangkan pemberian pakan uji selama sepuluh hari setelah lima hari diberi pakan komersil dan pemberian pakan uji yang diselingi oleh pemberian pakan komersil pada lima hari ke-2 relatif baik.
26
terjadi akibat rendahnya jumlah sel darah merah pada perlakuan tersebut. Trombosit tertinggi pada kontrol positif sedangkan yang terendah pada kontrol negatif, sebaliknya dengan limfosit hasil tertinggi pada kontrol negatif sedangkan terendah pada kontrol positif. Rendahnya limfosit umumnya disebabkan tingginya trombosit begitu juga sebaliknya. Pada hari ke-20 ini, perlakuan yang diberi pakan uji yang mengandung tepung biji rosela adalah perlakuan A dan D. Hasil menunjukkan bahwa hemoglobin tertinggi adalah pada perlakuan A, yakni pemberian pakan dengan pakan uji selama 20 hari. Ini artinya, pemberian pakan uji yang mengandung tepung biji rosela secara terus menerus sampai jangka waktu tertentu, dalam hal ini 20 hari berpeluang untuk meningkatkan hemoglobin. Akan tetapi ada titik kritis pada lima belas hari pertama. Untuk lebih jelas bisa dilihat pada Lampiran 4. Selain itu, hasil perhitungan pada hari ke-20 ini juga menunjukkan bahwa pola pemberian pakan dengan pakan uji yang mengandung tepung biji rosela selama sepuluh hari jauh lebih efektif dan efisien dibandingkan pemberian pakan uji terus menerus (perlakuan A) atau diselang-seling lima hari antara pakan komersil dengan pakan uji (perlakuan C). Jadi ada dua alternatif pola yang bisa diambil, perlakuan B dan perlakuan D, akan tetapi bila melihat dari persentase kelangsungan hidup setelah uji tantang, maka yang terbaik adalah perlakuan B dengan persentase kelangsungan hidup 62,1% (Gambar 15).
SIMPULAN DAN SARAN
Simpulan
Dosis optimal tepung biji rosela yang mampu mempengaruhi kinerja pertumbuhan dan imunitas patin adalah dosis tepung biji rosela 4% yang memberikan persentase retensi protein dan retensi lemak yang terbaik, yakni 84,66±9,379 % (retensi protein) dan 55,55±3,017 % (retensi lemak).
Metode pemberian pakan uji yang terbaik yang mampu mempengaruhi kinerja pertumbuhan dan imunitas ikan patin adalah dengan pola pemberian pakan selama sepuluh hari pada perlakuan B yang persentase kelangsungan hidupnya tertinggi di luar kontrol (62.1%).
Saran
Perlu dilakukan penelitian terkait nilai kecernaan tepung biji rosela dan palatabilitasnya pada ikan patin, serta pengembangan teknik pengolahan biji rosela yang bisa menghilangkan zat antinutrien yang terkandung di dalamnya.
DAFTAR PUSTAKA
27
Asian Aquaculture II. Manila (PH): Fish Health Section, Asian Fisheries Society. Hlm 185-202.
Anderson DP. 1996. Environmental factors in fish health: Immunological aspects. Di dalam: Iwama G, Nakanishi T, editor. Fish Immune System: Organism, Pathogen and Environment. California (US): Academic Press. Hlm 289-310. [BSN] Badan Standardisasi Nasional. 2009. Pakan buatan untuk ikan patin
(Pangasius sp). SNI 7548:2009.
Bako IG, Mabrouk MA, Abubakar A. 2009. Antioxidant effect of ethanolic seed extract of Hibiscus sabdariffa Linn (Malvaceae) alleviate the toxicity induced by chronic administration of sodium nitrate on some haematological parameters in wistars rats. Adv J Food Sci Technol. 1:39-42.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. J Fish Biol. 5(6):771-781.
Buyukcapar HM, Kamalak A. 2007. Condensed tannin contents of some legume seeds used in fish nutrition. J Bio Sci 7(1): 74-76.
Dabrowski K, Arslan M, Terjesen BF, Zhang Y. 2007. The effect of dietary indispensable amino acid imbalances on feed intake: Is there a sensing of deficiency and neural signaling present in fish. Aquaculture. 268: 136-142. Fagbenro OA. 2005. Soybean meal substitution with roselle (Hibiscus sabdariffa
L.) seed meal in dry practical diets for fingerlings of the african catfish, Clarias gariepinus (Burchell 1822). J Ani & Vet Adv. 4:473-477.
Fagbenro OA, Akande TT, Fapohunda OO, Akegbejo-Samsons Y. 2004. Comparative assessment of roselle (Hibiscus sabdariffa var. sabdariffa) seed meal and kenaf (Hibiscus sabdariffa var. altissima) seed meal as replacement for soybean meal in practical diets for fingerlings of nile tilapia, Oreochromis niloticus. Di dalam: Bolivar RB, Mair GC, Fitzsimmons K, editor. Proceedings the 6th International Symposium on Tilapia in Aquaculture Philippine International Convention Center Roxas Boulevard [Internet]. [2004 Sept 12-16; Manila, Philippines. Hlm 277-288; [diunduh 2012 Jan 25]. Tersedia pada
http://ag.arizona.edu/azaqua/ista/ista6/ ista6web/pdf/277.pdf
Francis G, Makkar HPS, Becker K. 2001. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish. Aquaculture. 199: 197-227
Hainida KIE, Amin I, Normah H, Mohd-Esa N. 2008. Nutritional and amino acid contents of differently treated roselle (Hibiscus sabdariffa L.) seeds. Food Chemistry. 111:906-911.
Hendricks JD. 2002. Adventitious Toxins. Di dalam: Halver JE, Hardy RW, editor. Fish Nutrition. California (US): Academic Press. Ed ke-3. Hal: 601-649 Huisman EA. 1987. Principles of fish production. Wageningen (NL):
Departemen of fish culture and fisheries, Wageningen Agriculture University.170 hal.
Ismail A, Hainida KIE, Saadiah MNH. 2008. Roselle (Hibiscus sabdariffa L.) seeds-nutritional composition, protein quality and health benefits. Food:Global Sci Books. 2:1-16.