PENGARUH JENIS EKSPLAN DAN KOMPOSISI MEDIA TERHADAP PEMBENTUKAN
TUNAS TANAMAN KARET (Hevea brasiliensis Muell. Arg) SECARA IN VITRO
SKRIPSI
OLEH : EMMY ROSITA
110301150/PEMULIAAN TANAMAN
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
PENGARUH JENIS EKSPLAN DAN KOMPOSISI MEDIA TERHADAP PEMBENTUKAN
TUNAS TANAMAN KARET (Hevea brasiliensis Muell. Arg) SECARA IN VITRO
SKRIPSI
OLEH : EMMY ROSITA
110301150/PEMULIAAN TANAMAN
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana Di Fakultas PertanianUniversitas Sumatera Utara, Medan
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Pengaruh Jenis Eksplan dan Komposisi Media
Terhadap Pembentukan Tunas Tanaman Karet (Hevea brasiliensis Muell. Arg) Secara In Vitro
Nama : Emmy Rosita NIM : 110301150
Program Studi : Agroekoteknologi Minat Studi : Pemuliaan Tanaman
Disetujui oleh : Komisi Pembimbing
(Luthfi A. M Siregar, SP., MSc., Ph.D) (Ir. E.Harso Kardhinata, MSc.) Ketua Anggota
Mengetahui
ABSTRACT
EMMY ROSITA, 2015 :The effect explant and medium on shoot formationof rubber tree(Hevea brasiliensis Muell. Arg.)cultureby Luthfi A. M Siregar and E. Harso Kardhinata.
The aimed of the research is to know theinfluents types of explant of rubber treein the diffeerent medium composition. The research was carried out in the Microccuting Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia,from March to July 2015. The research used completely randomized design with two factors, i.e.:types of explant, consist of 2 levels : shoot explant and stock explant,and the medium with combination of growth regulators consist of six composition ; MS + BAP 0,5 mg/l; MS + BAP 1 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l. All aplication was replicate15 times.
The results showed that kinds of explant and medium with combination of growth regulators gave significantly to total shoot. Interaction kinds of explant and medium with combination of growth regulators gave significantly to percent of shoot, shoots lenght, percent of leaf induction, and leaves number. The medium of MS + BAP 0,5 mg/l was the best medium to multiplication of rubber.
ABSTRAK
EMMY ROSITA, 2015 : Pengaruh Jenis Eksplan dan Komposisi Media Terhadap Pembentukan Tunas Tanaman Karet (Hevea brasiliensis Muell. Arg.) Secara In Vitro, dibimbing oleh Luthfi A. M. Siregar dan E. Harso Kardhinata.
Penelitian ini bertujuan untuk mengetahui pengaruh jenis eksplan tanaman karet (Hevea brasiliensis Muell. Arg.) pada beberapa komposisi media secara in vitro. Penelitian ini dilaksanakan Laboratorium Kultur Microcutting Tanaman KaretPT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan Maret 2015 sampai dengan Juli 2015. Rancangan yang digunakan adalah rancangan acak lengkap dengan 2faktor perlakuan yaitu jenis eksplan yang terdiri dari 2jenis yaitu pucuk dan bonggol sedangkan media dengan campuran zat pengatur tumbuh yang terdiri dari 6 komposisi yaitu MS + BAP 0,5 mg/l; MS + BAP 1 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l dengan 15 ulangan.
Hasil penelitian menunjukkan bahwa perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap jumlah tunas. Interaksi jenis eksplan dan komposisi media berpengaruh nyata terhadap persentase munculnya tunas, panjang tunas, persentase terbentuknya daun, dan jumlah daun. Media WPM + BAP 0,5 mg/l merupakan media terbaik untuk pembentukan tunas dengan eksplan bonggol pada multiplikasi tanaman karet.
RIWAYAT HIDUP
Emmy Rosita, dilahirkan di Padangsidimpuan pada tanggal 15 September 1992 dari ayahanda Hermanto dan ibunda Azizah Harahap. Penulis merupakan putri kedua dari tiga bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD N 200117 Padangsidimpuan lulus pada tahun 2005, MTsN Model Padangsidimpuan lulus pada tahun 2008 dan MAN 1 Padangsidimpuan lulus pada tahun 2011. Tahun 2011 diterima sebagai mahasiswa melalui jalur SNMPTN ( Seleksi Nasional Mahasiswa Perguruan Tinggi Negeri) pada program studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan.
Selama mengikuti perkuliaahan penulis pernah berkesempatan membantu dosen menjadi asisten Laboratorium Anatomi Tumbuhan. Selain itu penulis aktif dalam organisasi Himpunan Mahasiswa Islam (2011-2013) dan HIMAGROTEK.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT, karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul
“Pengaruh Jenis Eksplan dan Komposisi Media Terhadap Pembentukan
Tunas TanamanKaret (Hevea brasiliensis Muell. Arg) Secara In Vitro”yang
merupakansalahsatusyaratuntukmendapatkan gelar sarjana di Program Studi AgroekoteknologiFakultas Pertanian Universitas Sumatera Utara, Medan
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Luthfi A. M. Siregar, SP., MSc., Ph.Dselaku ketua komisipembimbing dan
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata, penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi pihakyang membutuhkan.
Medan, Desember 2015
DAFTAR ISI
ABSTRACT ... i
ABSTRAK ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesa Penelitian ... 4
Kegunaan Penelitian ... 5
TINJAUAN PUSTAKA Botani Tanaman ... 6
Kultur Jaringan ... 7
Eksplan ... 9
Media Kultur ... 10
Lingkungan In Vitro ... 12
Zat Pengatur Tumbuh ... 13
Kajian In Vitro Tanaman Karet ... 14
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 17
Bahan dan Alat Penelitian ... 17
Metode Penelitian ... 17
PELAKSANAAN PENELITIAN Sterilisasi Alat-Alat ... 20
Pembuatan Media... 20
Persiapan Ruang Tanam ... 23
Subkultur ... 23
Pemeliharaan Eksplan ... 24
Peubah Amatan ... 24
Persentase Munculnya Tunas (%) ... 24
Umur munculnya tunas (hari) ... 24
Panjang Tunas (cm) ... 25
Persentase Terbentuknya Daun ... 25
Jumlah Daun (helai) ... 25
Kehadiran Kalus ... 25
Warna Kalus ... 25
Morfogenesis ... 26
HASIL DAN PEMBAHASAN Hasil Persentase Munculnya Tunas (%) ... 27
Umur munculnya tunas (hari) ... 28
Jumlah Tunas (tunas) ... 29
Panjang Tunas (cm) ... 30
Persentase Terbentuknya Daun ... 31
Jumlah Daun (helai) ... 32
Kehadiran Kalus ... 34
Warna Kalus ... 35
Morfogenesis ... 35
Pembahasan Pengaruh jenis eksplan terhadap pembentukan tunas tanaman karet ... 35
Pengaruh komposisi media yang berbeda terhadap pembentukan tunas tanaman karet... 36
Pengaruh interaksi jenis eksplan dan komposisi media yang berbeda terhadap pembentukan tunas ... 37
KESIMPULAN DAN SARAN Kesimpulan ... 44
Saran ... 44 DAFTAR PUSTAKA
DAFTAR TABEL
No ... Hal 1. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap persentase munculnya tunas (%) ... 27 2. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap umur munculnya tunas ... 29 3. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap jumlah tunas ... 29 4. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap panjang tunas ... 30 5. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap persentase terbentuknya daun (%) ... 31 6. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda
terhadap jumlah daun ... 32 7. Rekapitulasi peubah amatan sidik ragam pada multiplikasi tunas
mikro tanaman karet pada jenis eksplan dan komposisi media yang
DAFTAR GAMBAR
No ... Hal 1. Eksplan sebelum membentuk tunas pada perlakuanT2 (bonggol) dan
media A4 (WPM + BAP 0,5 mg/l) ... 28 2. Eksplan setelah membentuk tunaspada perlakuan T2 (bonggol) dan
media A4 (WPM + BAP 0,5 mg/l) ... 28 3. Eksplan setelah membentuk daunpada perlakuan T2 (bonggol) dan
media A4 (WPM + BAP 0,5 mg/l) ... 33 4. Kehadiran kalus dari eksplan T2 (bonggol) dan media A5
DAFTAR LAMPIRAN
No ... Hal
1. Data Pengamatan Persentase Munculnya Tunas (%) ... 49
2. Data Transformasi Persentase Munculnya Tunas Arcsin ... 50
3. Daftar Sidik Ragam Persentase Munculnya Tunas. ... 50
4. Data Pengamatan Umur Munculnya Tunas Tunas (hari) ... 51
5. Data Pengamatan Jumlah Tunas (Tunas) ... 52
6. Data Transformasi Jumlah Tunas ... 53
7. Daftar Sidik Ragam Jumlah Tunas. ... 53
8. Data Pengamatan Panjang Tunas (cm) ... 54
9. Data Transformasi Panjang Tunas ... 55
10. Daftar Sidik Ragam panjang Tunas ... 55
11. Data Pengamatan Persentase Terbentuknya Daun (%) ... 56
12. Data Transformasi Persentase Terbentuknya Daun Arcsin ... 57
13. Daftar Sidik Ragam Persentase Terbentuknya Daun... 57
14. Data Pengamatan Jumlah Daun (helai) ... 58
15. Data Transformasi Jumlah Daun ... 59
16. Daftar Sidik Ragam Jumlah Daun ... 59
17. Komposisi Medium Murashige dan Skoog (MS) ... 60
18. Komposisi Medium Woody Plant Medium (WPM) ... 61
19. Bagan Penelitian ... 62
20. Kegiatan Penelitian ... 63
ABSTRACT
EMMY ROSITA, 2015 :The effect explant and medium on shoot formationof rubber tree(Hevea brasiliensis Muell. Arg.)cultureby Luthfi A. M Siregar and E. Harso Kardhinata.
The aimed of the research is to know theinfluents types of explant of rubber treein the diffeerent medium composition. The research was carried out in the Microccuting Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia,from March to July 2015. The research used completely randomized design with two factors, i.e.:types of explant, consist of 2 levels : shoot explant and stock explant,and the medium with combination of growth regulators consist of six composition ; MS + BAP 0,5 mg/l; MS + BAP 1 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l. All aplication was replicate15 times.
The results showed that kinds of explant and medium with combination of growth regulators gave significantly to total shoot. Interaction kinds of explant and medium with combination of growth regulators gave significantly to percent of shoot, shoots lenght, percent of leaf induction, and leaves number. The medium of MS + BAP 0,5 mg/l was the best medium to multiplication of rubber.
ABSTRAK
EMMY ROSITA, 2015 : Pengaruh Jenis Eksplan dan Komposisi Media Terhadap Pembentukan Tunas Tanaman Karet (Hevea brasiliensis Muell. Arg.) Secara In Vitro, dibimbing oleh Luthfi A. M. Siregar dan E. Harso Kardhinata.
Penelitian ini bertujuan untuk mengetahui pengaruh jenis eksplan tanaman karet (Hevea brasiliensis Muell. Arg.) pada beberapa komposisi media secara in vitro. Penelitian ini dilaksanakan Laboratorium Kultur Microcutting Tanaman KaretPT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan Maret 2015 sampai dengan Juli 2015. Rancangan yang digunakan adalah rancangan acak lengkap dengan 2faktor perlakuan yaitu jenis eksplan yang terdiri dari 2jenis yaitu pucuk dan bonggol sedangkan media dengan campuran zat pengatur tumbuh yang terdiri dari 6 komposisi yaitu MS + BAP 0,5 mg/l; MS + BAP 1 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l dengan 15 ulangan.
Hasil penelitian menunjukkan bahwa perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap jumlah tunas. Interaksi jenis eksplan dan komposisi media berpengaruh nyata terhadap persentase munculnya tunas, panjang tunas, persentase terbentuknya daun, dan jumlah daun. Media WPM + BAP 0,5 mg/l merupakan media terbaik untuk pembentukan tunas dengan eksplan bonggol pada multiplikasi tanaman karet.
PENDAHULUAN Latar Belakang
Karet (Hevea brasiliensis) berasal dari benua Amerika dan saat ini menyebar luas ke seluruh dunia. Karet dikenal di Indonesia sejak masa kolonial Belanda, dan merupakan salah satu komoditas perkebunan yang memberikan sumbangan besar bagi perekonomian Indonesia (Janudianto et al., 2013). Indonesia merupakan negara pemasok karet alam terbesar ke-2 ke pasar dunia dengan total produksi karet alam sebesar 3,1 juta ton dan kontribusi devisa senilai usd 4,7 miliar pada 2014. Saat ini, pemanfaatan karet alam di dalam negeri sekitar 18% dari total produksi, antara lain untuk industri ban, sarung tangan, ban vulkanisir, dan lain-lain. Sebagian besar diekspor dalam bentuk mentah, yaitu crumb rubber (karet remah), ribbed smooked sheets (RSS), dan lateks pekat (Muhammad, 2015).
kombinasi batang atas dan batang bawah menampilkan potensi produksi dan karakter unggul lain secara maksimal karena perbedaan tingkat juvenilitas.
Microcutting merupakan salah satu teknik mikropropagasi tanaman berbasis kultur in vitro dan telah berhasil diaplikasikan untuk perbanyakan tanaman karet asal biji (seedling) dengan menggunakan tunas aksilar sebagai eksplan. Keuntungan teknik tersebut adalah terbukanya peluang untuk menghasilkan batang bawah klonal yang selama ini belum pernah ada pada tanaman karet. Penggunaan batang bawah klonal akan meningkatkan keseragaman pertanaman karet di lapang, karena klon batang atas didukung oleh batang bawah yang sama dan lebih seragam, dibandingkan dengan batang bawah asal biji yang digunakan saat ini (Haris et al., 2009). Di era tahun 1980-an, perbanyakan bahan tanam karet melalui kultur in vitro banyak dilakukan di CIRAD (France Agricultural Research Centre for International Development) Perancis, menggunakan dua macam teknik, yaitu somatik embriogenesis dan in vitro microcutting. Khusus untuk teknik in vitro microcutting keberhasilan dicapai dengan menggunakan eksplan yang berasal dari tanaman seedling muda (Haris, 2013).
yang ditambahkan dalam media pada penelitian ini adalah Naphtalene-3-acetic acid (NAA) sedangkan golongan sitokininnya adalah Benzylamino purine (BAP). Pemberian hormon BAP dan NAA pada perbanyakan tanaman karet secara in vitro telah banyak dilakukan sebelumnya. Berdasarkan penelitian yang dilakukan oleh Harahap et al. (2014) menyatakan pemberian kombinasi BAP dan NAA pada media MS menunjukkan pengaruh yang berbeda nyata terhadap persentase munculnya tunas, jumlah tunas, panjang tunas dan umur munculnya tunas, dengan hasil terbaik pada perlakuan A5(BAP 1 mg/l + NAA 0 mg/l). Sedangkan menurut Sundari et al. (2014) pemberian kombinasi konsentrasi BAP dan NAA pada media WPM berpengaruh terhadap persentase eksplan membentuk tunas. Persentase eksplan hidup tertinggi juga terdapat pada perlakuan A3 (0.5 mg/l BAP + 0.25 mg/l NAA) yaitu sebesar 73.33%. Persentase ekplan membentuk tunas tertinggi yaitu pada perlakuan A3 (0.5 mg/l BAP + 0.25 mg/l NAA) yaitu dengan rataan sebesar 73.33.
Media yang cocok untuk tanaman tahunan menurut (Mariska dan Ragapadmi, 2001; Nursetiadi, 2008) adalah media WPM. Sedangkan media Murashige dan Skoog (MS) dapat digunakan pada hampir semua jenis kultur. Keistimewaan medium MS adalah kandungan nitrat, kalium dan ammoniumnya yang tinggi, dan jumlah hara anorganiknya yang layak untuk memenuhi kebutuhan banyak sel tanaman dalam kultur (Wetter dan Constabel, 1991).
jumlah tunas dan jumlah daun terbanyak (Hanifah, 2008). Pada tanaman Anthurium plowmanii Croat., eksplan nodus batang memberikan hasil lebih baik dibandingkan eksplan akar maupun daun. Zat pengatur tumbuh BAP 0,3 ppm + NAA 0,3 ppm yang terkandung dalam media pada eksplan nodus batang menghasilkan kalus terbaik yang berdiferensiasi menjadi akar dan tunas (Rahmaniar, 2007). Menurut Kholida (2007) pada tanaman Adenium obesum Roem. Dan Schult., menunjukkan bahwa eksplan tunas apikal + BAP 2 ppm + IAA 1,5 ppm dapat tumbuh menjadi kalus kemudian berdiferensiasi menjadi tunas (Purwanto, 2008).
Berdasarkan uraian di atas, peneliti tertarik untuk melakukan mikropropagasi tanaman karet secara in vitro terhadap beberapa komposisi media dengan bagian eksplan yang berbeda yaitu tunas pucuk dan nodus.
Tujuan Penelitian
Untuk mengetahui pengaruh jenis eksplan tanaman karet dan komposisi media terhadap pertumbuhan dan perkembangan tunas mikro tanaman karet. Hipotesis Penelitian
- Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
karet pada beberapa komposisi media.
- Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
karet pada jenis eksplan.
- Ada interaksi perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
Kegunaan Penelitian
TINJAUAN PUSTAKA Botani Tanaman
Struktur botani tanaman karet (Hevea brasiliensis Muell. Arg) menurut Steenis (2005) ialah tersusun sebagai berikut : Kingdom : Plantae; Divisio: Spermatophyta ; Subdivisio : Angiospermae; Kelas: Dicotyledoneae; Ordo : Euphorbiales; Famili : Euphorbiaceae; Genus : Hevea.
Akar tanaman karet berupa akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi ke atas. Dengan akar seperti itu pohon karet
dapat berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2006).
Karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa mencapai 15-25 meter. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi. Di beberapa kebun karet ada kecondongan arah tumbuh tanamannya agak miring ke arah utara. Batang tanaman ini mengandung getah yang dikenal dengan nama lateks. Daun karet terdiri dari tangkai daun utama dan tangkai anak daun. Panjang tangkai utama 3-20 cm, sedangkan panjang tangkai anakdaun antara 3-10 cm. Anak daun
berbentuk memanjang elips, memanjang dengan ujung runcing (Nazaruddin, 1992 ; Nugroho, 2010).
Karakteristik bunga jantan karet pada beberapa tetua karet cukup bervariasi yaitu 295-500 bunga per tangkai dengan rata-rata 383,4 per tangkai dan 2065-2640 bunga per karangan dengan rata-rata 3482,6 bunga per karangan. Masing-masing bunga jantan dari setiap tetua tumbuh di setiap tangkai utama dan cabang-cabangnya, untuk satu tangkai bunga tersusun atas tiga bunga jantan (trifolia) yang berwarna kuning ( Syarifah dan Wulan, 2007 ; Mardianto, 2011).
Karet merupakan tanaman berbuah polong (diseliputi kulit yang keras) yang sewaktu masih muda buahnya berpaut erat dengan rantingnya. Buah karet dilapisi oleh kulit tipis berwarna hijau dan di dalamnya terdapat kulit yang keras dan berkotak. Tiap kotak berisi sebuah biji yang dilapisi tempurung, setelah tua warna kulit buah berubah menjadi keabu-abuan dan kemudian mengering. Pada waktunya pecah dan matang, bijinya tercampak lepas dari kotaknya. Tiap buah tersusun atas 2-4 kotak biji (Budiman, 2012).
Kultur Jaringan
Kultur jaringan tanaman terdiri dari sejumlah teknik untuk menumbuhkan organ, jaringan, dan sel tanaman. Jaringan dapat dikulturkan pada agar padat atau hara cair. Jika ditanaman dalam agar, jaringan akan membentuk kalus, yaitu massa atau sel-sel yang tak tertata. Kultur agar juga merupakan teknik untuk
meristem dan juga untuk mempelajari organogenesis (Wetter dan Constabel, 1991; Jumroh, 2013).
buatan dengan kandungan nutrisi lengkap dan zat pengatur tumbuh, serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol (Yusnita, 2003).
Perbanyakan tanaman melalui kultur jaringan (in vitro) menawarkan peluang besar untuk menghasilkan jumlah bibit tanaman yang banyak dalam waktu relatif singkat sehingga lebih ekonomis. Teknik perbanyakan tanaman ini dapat dilakukan sepanjang waktu tanpa tergantung musim. Selain itu, perbanyakan tanaman dengan teknik in vitro mampu mengatasi kebutuhan bibit dalam jumlah besar, serentak, dan bebas penyakit sehingga bibit yang dihasilkan lebih sehat serta seragam. Oleh sebab itu, kini perbanyakan tanaman secara kultur jaringan merupakan teknik alternatif yang tidak dapat dihindari bila penyediaan bibit tanaman harus dilakukan dalam skala besar dan dalam waktu relatif singkat (Andaryani, 2010).
Perbanyakan tanaman melalui kultur jaringan dapat dilakukan melalui perbanyakan tunas-tunas baru dari tunas aksilar. Tunas aksilar yang digunakan adalah nodus tunggalnya sehingga kemudian dikenal sebagai mikrostek. Pada teknik ini hal yang terpenting yang menjadi orientasi adalah merangsang pertumbuhan tunas, subkultur mikrostek untuk menghasilkan tunas baru demikian seterusnya kemudian dilakukan pengakaran (Santoso dan Nursandi, 2004).
digunakan untuk merangsang pembentukan tunas tersebut berasal dari golongan sitokinin seperti BAP, 2-iP, kinetin, atau thidiadzuron (TDZ) (Jumroh, 2013). Eksplan
Bahan tanaman yang dikulturkan lazim disebut eksplan. Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penting penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur. Umumnya, bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif. Jaringan tanaman yang masih muda mempunyai daya regenerasi lebih tinggi, sel-selnya masih aktif membelah diri, dan relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Secara umum terdapat empat sumber yang digunakan dalam perbanyakan mikro (micropropagation) untuk menghasilkan plantlet, yaitu (1) meristem, (2) apex, (3) nodus (node) dan (4) bermacam-macam eksplan. Meristem, apex dan nodus dapat dikulturkan menjadi tunas. Tunas yang dihasilkan selanjutnya dapat digunakan sebagai sumber untuk menghasilkan tunas-tunas baru dengan menggunakan percabangan axilari. Tunas-tunas tersebut kemudian dapat dikembangkan lebih lanjut sehingga terbentuk perakaran dan akhirnya menjadi plantlet (Yuwono, 2006 ; Fitriani, 2008).
Hartmann et al. (1990) menyatakan bahwa jaringan-jaringan yang sedang aktif tumbuh pada awal masa pertumbuhan biasanya merupakan bahan eksplan yang paling baik. Pierik (1997) juga menyarankan untuk menggunakan jaringan-jaringan muda dan lunak karena pada umumnya jaringan-jaringan tersebut lebih muda berploriferasi daripada jaringan berkayu atau yang sudah tua. Selain itu, Pierik (1997) menyatakan bahwa pada umumnya bagian-bagian vegetatif lebih siap beregenerasi daripada bagian-bagian generatif. Eksplan mata tunas yang diperoleh dari tanaman yang sedang istirahat, lebih sulit daripada mata tunas yang diperoleh dari tanaman yang sedang aktif tumbuh.
Ukuran eksplan yang dikulturkan turut menentukan keberhasilan dari suatu teknik kultur jaringan. Ukuran eksplan yang terlalu kecil akan kurang daya tahannya bila dikulturkan. Sedangkan bila ukurannya terlalu besar akan sulit didapatkan eksplan yang steril. Mariska dan Sukmadjaja (2003) juga menambahkan bahwa ukuran eksplan yang dapat digunakan dalam teknik kultur jaringan bervariasi dari ukuran mikroskopik (±0,1 mm) hingga 5 cm (Jumroh, 2013).
Media Kultur
jumlah zat seperti yang ditentukan, diperlukan penimbangan dan penakaran bahan secara tepat. Ketidaktepatan ukuran dapat menyebabkan terjadinya proses yang tidak dikehendaki (Nursetiadi, 2008).
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang selanjutnya diinduksi membentuk tanaman yang lengkap (disebut sebagai planlet), sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber karbon, vitamin, zat pengatur tumbuh dan suplemen organik (Yuwono, 2008).
Beberapa media dasar yang banyak digunakan dalam kultur jaringan antara lain media dasar Murashige dan Skoog (1962) yang dapat digunakan untuk hampir semua jenis kultur, media dasar B5 untuk kultur sel kedelai dan legume lainnya, media dasar White (1934) sangat cocok untuk kultur akar tanaman tomat, media dasar Vacin dan Went (1949) digunakan untuk kultur jaringan anggrek, media dasar Nitsch dan Nitsch (1969) digunakan dalam kultur tepung sari (pollen) dan kultur sel, media dasar Schenk dan Hildebrandt (1972) untuk kultur jaringan tanaman monokotil, media dasar WPM (Woody Plant Medium, 1981) khusus untuk tanaman berkayu (Nursetiadi, 2008).
Kalsium pantetonut, Piridoxin fosfat, Thiamin-HCl, dan Nicotinamida (Wattimena et al., 1992).
Formulasi dasar dari garam mineral buatan Murashige dan Skoog merupakan media kultur yang khas dan biasa digunakan dalam propagasi tanaman secara in vitro. Nutrisi mineral dapat dibagi dalam tiga kelas: garam mineral nutrisi makro, garam mineral nutrisi mikro dan sumber besi. Garam-garam nutrisi makro dibutuhkan dalam jumlah relatif besar dan jumlah yang dibutuhkan untuk membuat 1 liter media cukup besar sehingga dapat ditimbang dengan cukup teliti dengan menggunakan alat timbangan miligram (Wetherel, 1982 ; Fitriani, 2008).
Media kultur jaringan yang dirancang untuk tanaman berkayu seperti buah-buahan adalah WPM hasil komposisi dari Llyoyd dan McCown, 1981. Media WPM merupakan media dengan konsentrasi ion yang rendah pada jaman sesudah penemuan media MS. Media ini konsisten sebagai media untuk tanaman berkayu yang dikembangkan oleh ahli lain, sulfat yang digunakan lebih tinggi dari sulfat pada media tanaman berkayu lain (Gunawan, 1992).
Lingkungan in Vitro
Kultur jaringan tanaman mempunyai pertumbuhan yang berbeda tergantung dari tipe lingkungan kultur dimana jaringan tanaman tersebut ditumbuhkan. Intensitas, kualitas, dan lamanya penyinaran, temperatur, oksigen/karbon dioksida, dan konsentrasi gas-gas lain, dan juga komposisi dari medium memegang peranan penting dalam morfogenesis jaringan tanaman tersebut (Sofia, 1997).
botol kultur, dan kelembaban), sterilisasi alat dan media (media tanaman, zat pengatur tumbuh, pH meter, peralatan yang dipakai pada saat penanaman), dan sterilisasi bahan tanaman. Di samping itu, Hendaryono dan Wijayani (!994), menyebutkan ada 4 faktor lingkungan yang harus tetap terkontrol untuk keberhasilan tujuan kultur jaringan, yaitu keasaman, kelembaban, cahaya dan temperatur. Untuk keasaman media atau pH memiliki nilai yang relatif sempit dengan titik optimal pH 5,0-6,0. Bila eksplan mulai tumbuh, pH dalam lingkungan kultur jaringan umumnya akan naik apabila nutrien habis terpakai. Kelembaban relatif (RH) lingkungan yang diperlukan biasanya mendekati 100%. Sedangkan intensitas cahaya yang rendah mempertinggi embryogenesisi dan organogenesis. Yoeman (1990) menyatakan bahwa penyinaran dalam kultur jaringan menggunakan lampu flourescensdengan intensitas antara 1000-1500 lux selama 16 jam sehari. Hartmann et al. (2002), temperatur yang sering digunakan pada kultur jaringan adalah kisaran antara 20-30°C (68-81°F) (Jumroh, 2013).
ZPT
Zat pengatur tumbuh dalam tanaman terdiri dari lima kelompok yaitu, Auksin, Giberelin, Sitokinin, Etilen dan Inhibitor dengan ciri khas serta pengaruh
yang berlainan terhadap proses fisiologis tanaman (Hendaryono dan Wijayani, 1994).
Auksin pada kultur jaringan dikenal sebagai hormon yang berperan menginduksi kalus, menghambat kerja sitokinin membentuk klorophil dalam proses embriogenesis, dan auksin juga dapat mempengaruhi kestabilan genetik sel tanaman (Santoso dan Nursandi, 2003). Hormon auksin diketemukan dalam jaringan muda yaitu pada pucuk dan endosperm yang sel-selnya masih aktif membelah (Purwanto, 2008).
Menurut Wattimena et al. (1992), sitokinin mempengaruhi berbagai proses fisiologis di dalam tanaman terutama mendorong pembelahan sel. Peran sitokinin dalam kultur in vitro mempunyai dua peran penting yaitu merangsang pembelahan sel sserta pembentukan dan perbanyakan tunas aksilar dantunas adventif, tetapikadar sitokin yang optimum ini dapat menghambat pertumbuhan dan pembentukan akar. Salah satu jenis ZPT dari golongan sitokinin yang sering dipakai dalam kultur jaringan yaitu BAP (6-benzylamino purin). 6-Benzylamino purin (BAP) merupakan salah satu sitokinin sintetik yang aktif dan daya merangsangnya lebih lama karena tidak mudah dirombak oleh enzim dalam tanaman (Jumroh, 2013).
Kajian In Vitro Tanaman Karet
batang bawah klonal (Carron dan Enjalric, 1983) guna memenuhi kebutuhan dan meningkatkan kualitas batang bawah yang selama ini dihasilkan dari biji. Meningkatnya kebutuhan batang bawah menyebabkan ketersediaan biji tidak mencukupi lagi karena tergantung pada beberapa klon karet penghasil biji batang bawah dan pada musim biji yang hanya berlangsung satu kali dalam setahun. Di samping itu, kelemahan lain dari penggunaan bibit asal biji sebagai batang bawah adalah adanya keragaman batang bawah dan kekurang-mampuan kombinasi batang atas dan batang bawah menampilkan potensi produksi dan karakter unggul
lain secara maksimal karena per-bedaan tingkat juvenilitas (Abbas dan Ginting, 1981).
Keberhasilan tersebut membuka peluang perbanyakan tanaman karet secara in vitro, yang dapat dilakukan untuk dua tujuan. Pertama dan yang paling ideal adalah untuk perbanyakan klonal tanaman karet unggul secara massal sehingga bibit yang diperoleh tidak memerlukan batang bawah dan merupakan klon utuh (whole clone). Namun ternyata hal tersebut tidak mudah karena sebagian besar klon-klon karet yang direkomendasikan untuk ditanam dalam skala luas kurang responsif terhadap lingkungan kultur in vitro (Haris, 2013).
mg/l NAA) yaitu dengan rataan sebesar 73.33 sedangkan yang terendah adalah pada perlakuan A5 (1 mg/l BAP + 0 mg/l NAA) yaitu 13.33.
Berdasarkan penelitian yang dilakukan oleh Harahap et al. (2014) menyatakan pemberian kombinasi BAP dan NAA pada media MS untuk kultur jaringan tanaman karet menunjukkan pengaruh yang berbeda nyata terhadap persentase munculnya tunas, jumlah tunas, panjang tunas dan umur munculnya tunas, dengan hasil terbaik pada perlakuan A5(BAP 1 mg/l + NAA 0 mg/l).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera
Utara, Indonesia. Penelitian ini dimulai pada bulan Maret 2015 sampai dengan Juli 2015.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah pucuk dan bonggol yang memiliki satu mata tunas dari hasil primary culture tanaman karet dengan genotipe 91 yang merupakan koleksi dari PTPN III, komposisi media yang digunakan larutan stok media MS dan WPM sebagai media tumbuh tanaman dengan NAA dan BAP sebagai zat pengatur tumbuh (ZPT) yang digunakan. Bahan penyusun media lainnya, agar, aquadest steril, dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur, hot plate dengan magnetik stirer, Erlenmeyer, gelas ukur, kaca tebal, pipet ukur, pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, aluminium foil, kompor gas, minisar, pipet mikro, tip, pipet tetes, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) faktorial, dengan dua faktor perlakuan yaitu :
T1 : Eksplan pucuk T2 : Eksplan bonggol
Faktor II : Komposisi media kultur dengan campuran zat pengatur tumbuh yaitu: A1 : MS + BAP 0,5 mg/l
A2 : MS + BAP 1 mg/l
A3 : MS + BAP 1,5 mg/l + NAA 0,1 mg/l A4 : WPM + BAP 0,5 mg/l
A5 : WPM + BAP 0,5 mg/l + NAA 0,25 mg/l A6 : WPM + BAP 0,5 mg/l + NAA 0,5 mg/l Sehingga diperoleh kombinasi perlakuan sebagai berikut:
T1A1 T2A1 T1A2 T2A2 T1A3 T2A3 T1A4 T2A4 T1A5 T2A5 T1A6 T2A6
Jumlah perlakuan : 12
Jumlah ulangan : 15
Jumlah eksplan tiap tabung uji : 1 Jumlah seluruh eksplan : 180 Jumlah seluruh tanaman : 180
Yijk = Nilai pengamatan unit percobaan pada perlakuan jenis eksplan ke-i, media dengan campuran zat pengatur tumbuh ke-j, dan ulangan ke-k µ = Nilai tengah umum
αi = Pengaruh jenis eksplan ke-i
βj = Pengaruh media dengan campuran zat pengatur tumbuh ke-j
(αβ)ij = Nilai tambah pengaruh interaksi jenis eksplan ke-i dan media dengan
zat pengatur tumbuh ke-j
εijk = Galat percobaan
PELAKSANAAN PENELITIAN Sterilisasi Alat
Alat-alat dissecting-set dan glass ware yang akan digunakan untuk kultur in vitro dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan panas atau letakkan pada rak tabung, sedangkan untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan tabung/botol dengan autoklaf pada tekanan 1 atm dan suhu 121oC selama 60 menit. Setelah itu sterilkan secara kering tabung/botol di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
MS (Murashige and Skoog)
Media yang digunakan adalah media Murashige and Skoog (MS) padat. Sebelum dilakukan pembuatan media MS, dilakukan pembuatan larutan stok ZPT BAP dan NAA. Larutan stok ZPT masing-masing dibuat 100 mg/100 ml. Larutan stok BAP dan NAA disaring menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
dikehendaki adalah 5,8, untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan NaOH dan HCl 0,1 N. Letakkan agar mikrobiologi dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 2000 ml dan ditutup dengan aluminium foil. Hasil Media MS secara keseluruhan di sterilisasi dengan tekanan 1 atm pada suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan ke ruangan Laminar Air Flow Cabinet (LAFC) untuk dibagikan ke 3 tabung erlenmeyer berukuran 1000 ml dengan masing-masing tabung berisi 500 ml. Masukkan BAP dan NAA menggunakan mikropipet ke masing-masing tabung uji sesuai perlakuan. Dituangkan media ke dalam tabung uji berisikan 13 ml/tabung dan ditutup dengan penutup tabung steril untuk subkultur, sehingga didapat ± 38 tabung uji, lalu dipisahkan untuk dua jenis eksplan masing-masing 15 tabung uji. Tabung uji diberi label sesuai dengan perlakuan, selanjutnya disimpan dalam ruang kultur sebelum digunakan.
WPM (Woody Plant Medium)
Media yang digunakan adalah media Woody Plant Medium (WPM). Sebelum dilakukan pembuatan media WPM, dilakukan pembuatan larutan stok ZPT BAP dan NAA. Larutan stok ZPT masing-masing dibuat 100 mg/100 ml. Kemudian larutan stok BAP dan NAA disaring menggunakan minisar guna meningkatkan sterilitas dari ZPT tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
100x, larutan iron dengan pembesaran 50x, larutan vitamin dengan pembesaran 100x, sukrosa 50 g, myo-inositol 0,1 g dan agar 5 g. Tahap berikutnya, sukrosa dimasukkan ke dalam beaker glass yang telah berisi aquades 750 ml, lalu diaduk dengan menggunakan magnetik stirer sebagai pengaduk. Kemudian ditambahkan myo-inositol diaduk hingga larut. Dimasukkan larutan stok hara makro 75 ml, larutan stok hara mikro 7,5 ml, iron 6 ml dan vitamin 3 ml. Kemudian larutan ditepatkan menjadi 1500 ml dengan menambahkan aquades. Keasaman diukur dengan pH meter. pH yang dikehendaki adalah 5,8 untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan KOH dan HCl 0,1 N. Ditambahkan agar biotek dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 2000 ml dan ditutup dengan aluminium foil dan diikat dengan tali
plastik. Kemudian media WPM di sterilisasi dengan tekanan 17,5 psi pada suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media
Persiapan Ruang Tanam
Seluruh permukaan laminar air flow cabinet sebelumnya dibersihkan terlebih dahulu menggunakan alkohol 96% lalu di sterilkan dengan sinar ultra violet selama 1 jam sebelum proses penanaman dilakukan. Semua alat dan bahan yang akan dipakai harus disemprot dengan alkohol 96% dan beberapa alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi. Steribox dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Subkultur
Kegiatan penanaman dilakukan di LAFC dan di bawah api bunsen. Tabung uji diletakkan di rak kultur di bawah cahaya dan ruangan memiliki air conditioner dengan suhu 18oC. Kondisi pemeliharaan dan lingkungan kultur sama seperti pada tahap kultur primer. Satu siklus tahap multiplikasi adalah empat minggu, dan tahap ini dapat diulang antara 3 – 12 siklus tergantung jumlah planlet yang diinginkan.
Pemeliharaan Eksplan
Tabung-tabung uji diletakkan pada rak kultur di dalam ruang kultur. Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari disemprot dengan alkohol 96% atau dan disemprot formalin agar bebas dari organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu ruangan kultur yang digunakan + 20-25°C, paling optimum 18oC dan intensitas cahaya 2000 lux serta dengan kondisi ruangan memiliki air conditioner dengan hefa yang dibersihkan selama 6 bulan sekali. Apabila mengalami kontaminasi, segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Peubah Amatan
Persentase Eksplan Membentuk Tunas (%)
Pengamatan dilakukan pada akhir percobaan berdasarkan jumlah tunas yang muncul dari keseluruhan ulangan.
Persentase terbentuknya tunas = jumlah tunas yang terbentuk x 100% jumlah eksplan seluruhnya (per perlakuan) Umur Muncal Tunas
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian dengan menghitung jumlah tunas baru yang terbentuk dari setiap eksplan dan jumlah tunas baru yang terbentuk dibagi dengan jumlah ulangan.
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi. Panjang tunas keseluruhan dari setiap perlakuan dibagi dengan jumlah ulangan. Pengukuran dilakukan pada akhir penelitian.
Persentase Terbentuknya Daun (%)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna pada eksplan. Pengamatan dilakukan pada akhir penelitian. Persentase terbentuknya daun dihitung pada akhir penelitian dengan rumus:
Persentase terbentuknya daun = jumlah daun yang terbentuk x 100% jumlah eksplan seluruhnya (per perlakuan) Jumlah Daun (helai)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna pada eksplan yang dilakukan pada akhir percobaan.
Kehadiran Kalus (visual)
Kehadiran kalus dilihat dari ada atau tidaknya kemunculan kalus dari tunas-tunas samping yang bersifat positif atau negatif bagi penelitian. Dilihat pada akhir percobaan.
Warna Kalus (visual)
Morfogenesis
HASIL DAN PEMBAHASAN Hasil
Dari hasil analisis data yang dilakukan, diperoleh bahwa perlakuan jenis eksplan yang berbeda memberikan pengaruh nyata terhadap jumlah tunas. Pada perlakuan komposisi media yang berbeda memberikan pengaruh nyata terhadap jumlah tunas, panjang tunas, persentase terbentuknya daun, dan jumlah daun. Untuk interaksi antara jenis eksplan dan komposisi media yang berbeda memberikan pengaruh nyata terhadap pernsentase munculnya tunas, panjang tunas, persentase terbentuknya daun, dan jumlah daun.
Persentase Munculnya Tunas (%)
Hasil pengamatan serta sidik ragam terhadap parameter persentase munculnya tunas pada perlakuan jenis eksplan dan komposisi media yang berbeda (Lampiran 1-3) belum menunjukkan pengaruh yang nyata, akan tetapi interaksi antara perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap persentase munculnya tunas.
Rataan persentase munculnya tunas dari perlakuan jenis eksplan dan komposisi media yang berbeda dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap persentase munculnya tunas (%) 4 minggu setelah subkultur Jenis
eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
T1 58,33b 50,00bc 88,89a 50,00bc 42,86c 42,86c 55,49 T2 88,89a 81,82a 50,00bc 90,00a 83,33a 22,22d 69,38 Rataan 73,61 65,91 69,44 70,00 63,10 32,54 62,43 Keterangan: *Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. **Perlakuan T1= pucuk; T2= Bonggol.
Tabel 1, memperlihatkan persentase munculnya tunas tertinggi pada interaksi jenis eksplan dan komposisi media yang berbeda terdapat pada perlakuan T2A4 yaitu T2 (bonggol) dan A4 (WPM + BAP 0,5 mg/l) dengan rataan (90,00) % dan terendah terdapat pada perlakuan T2A6 yaitu T2 (bonggol) dan A4 (WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) dengan rataan (22,22) %. Perlakuan T2A4, T2A1, T1A3, T2A5, T2A2 berbeda nyata dengan perlakuan T1A1, T1A2, T2A3, T1A4, T1A5, T1A6, T2A6.
Gambar eksplan sebelum dan sesudah membentuk tunas pada salah satu perlakuan dapat dilihat pada gambar 1 dan gambar 2.
Gambar 1. Eksplan bonggol sebelum Gambar 2. Eksplan bonggol setelah membentuk tunas membentuk tunas
Umur Munculnya Tunas (hari)
Hasil pengamatan terhadap parameter umur munculnya tunas pada perlakuan jenis eksplan dan komposisi media yang berbeda (Lampiran 4). Rataan umur munculnya tunas dari perlakuan jenis eksplan dan komposisi media dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap umur munculnya tunas (hari) 4 minggu setelah subkultur Jenis
eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
[image:43.595.114.502.338.515.2]Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM BAP 0,5 mg/l + NAA 0,5 mg/l.
Jumlah Tunas
Hasil pengamatan serta sidik ragam terhadap parameter jumlah tunas pada perlakuanjenis eksplan dan komposisi media yang berbeda (Lampiran 5-7) menunjukkan pengaruh yang nyata terhadap jumlah tunas pada 4 minggu setelah subkultur, akan tetapi interaksi antara perlakuan jenis eksplan dan komposisi media yang berbeda belum memberikan pengaruh yang nyata terhadap jumlah tunas.
Rataan jumlah tunas dari perlakuan jenis eksplan dan komposisi media yang berbeda dapat dilihat pada Tabel 3.
Tabel 3. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap jumlah tunas (tunas) 4 minggu setelah subkultur
Jenis eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
T1 0,58 0,50 0,89 0,63 0,43 0,43 0,58b T2 1,44 0,91 1,17 0,90 1,00 0,22 0,94a Rataan 1,01a 0,70c 1,03a 0,76b 0,71c 0,33d 0,76 Keterangan : *Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. **Perlakuan T1= pucuk; T2= Bonggol.
Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM BAP 0,5 mg/l + NAA 0,5 mg/l.
(0,33). Komposisi media A1dan A3 berbeda nyata terhadap perlakuan A2, A4, A5, dan A6.
Panjang Tunas (cm)
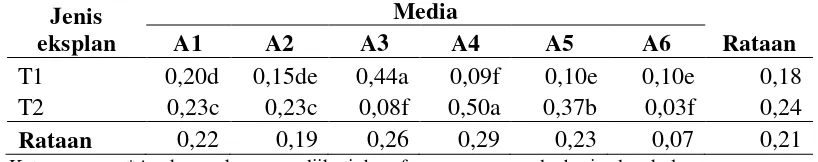
Hasil pengamatan serta sidik ragam terhadap parameter panjang tunas pada perlakuan jenis eksplan (Lampiran 8-10) belum menunjukkan pengaruh yang nyata terhadap panjang tunas pada 4 minggu setelah subkultur, sedangkan komposisi media yang berbeda serta interaksi antara perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap panjang tunas.
Rataan panjang tunas dari perlakuan jenis eksplan dan komposisi media yang berbeda dapat dilihat pada Tabel 4.
Tabel 4. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap panjang tunas (cm) 4 minggu setelah subkultur
Jenis eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
T1 0,20d 0,15de 0,44a 0,09f 0,10e 0,10e 0,18 T2 0,23c 0,23c 0,08f 0,50a 0,37b 0,03f 0,24
Rataan 0,22 0,19 0,26 0,29 0,23 0,07 0,21
Keterangan : *Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. **Perlakuan T1= pucuk; T2= Bonggol.
Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM BAP 0,5 mg/l + NAA 0,5 mg/l.
[image:45.595.109.518.420.501.2]dengan perlakuan T2A5, T1A1,T2A1, T2A2, T1A2, T1A5, T1A6, T1A4, T2A3, T2A6.
Persentase Terbentuknya Daun (%)
Hasil pengamatan serta sidik ragam terhadap parameter persentase terbentuknya daun pada perlakuan jenis eksplan belum menunjukkan pengaruh yang nyata, sedangkan komposisi media yang berbeda dan interaksi antara perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap persentase terbentuknya daun (Lampiran 11-13).
Rataan persentase terbentuknya daun dari perlakuan jenis eksplan dan komposisi media yang berbeda dapat dilihat pada Tabel 5.
Tabel 5. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap persentase terbentuknya daun (%) 4 minggu setelah subkultur Jenis
eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
T1 0,00d 0,00d 33,33b 0,00d 0,00d 0,00d 5,56 T2 0,00d 0,00d 0,00d 50,00a 25,00c 0,00d 12,50
Rataan 0,00 0,00 16,67 25,00 12,50 0,00 9,03
Keterangan : *Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%.
**Perlakuan T1= pucuk; T2= Bonggol.
Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM BAP 0,5 mg/l + NAA 0,5 mg/l.
mg/l), A6 (WPM BAP 0,5 mg/l + NAA 0,5 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l) dengan rataan (0,00). Perlakuan T2A4 berbeda nyata dengan seluruh perlakuan.
Jumlah Daun (helai)
Hasil pengamatan serta sidik ragam terhadap parameter jumlah daun pada perlakuan jenis eksplan belum menunjukkan pengaruh yang nyata, sedangkan komposisi media yang berbeda dan interaksi antara perlakuan jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap jumlah daun (Lampiran 14-16).
Rataan jumlah daun dari perlakuan jenis eksplan dan komposisi media yang berbeda dapat dilihat pada Tabel 6.
Tabel 6. Pengaruh perlakuan jenis eksplan dan komposisi media yang berbeda terhadap jumlah daun (helai) 4 minggu setelah subkultur
Jenis eksplan
Media
Rataan
A1 A2 A3 A4 A5 A6
T1 0,00d 0,00d 1,11b 0,00d 0,00d 0,00d 0,19 T2 0,00d 0,00d 0,00d 1,40a 0,42c 0,00d 0,30
Rataan 0,00 0,00 0,56 0,70 0,21 0,00 0,24
Keterangan : *Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%.
**Perlakuan T1= pucuk; T2= Bonggol.
Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM BAP 0,5 mg/l + NAA 0,5 mg/l.
A4 (WPM + BAP 0,5 mg/l), A5 (WPM BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM BAP 0,5 mg/l + NAA 0,5 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l) dengan rataan (0,00). Perlakuan T2A4 berbeda nyata dengan seluruh perlakuan.
Gambar 3. Eksplan setelah membentuk daun pada perlakuan T2 (bonggol) dan media A4 (WPM + BAP 0,5 mg/l)
Tabel 7. Rekapitulasi Peubah Amatan Sidik Ragam pada Multiplikasi Tunas Mikro Tanaman Karet Pada Jenis Eksplan dan Komposisi Media yang Berbeda (4 minggu setelah subkultur)
Peubah Amatan Perlakuan
T A T x A
Persentase Munculnya Tunas (%)a tn tn **
Umur Muncul tunas (hari)a - - -
Jumlah Tunas (tunas)a ** ** tn
Panjang Tunas (cm)a tn ** **
Persentase terbentuknya Daun (%)a tn ** **
Jumlah Daun (helai)a tn ** **
Kehadiran Kalus Ada ada ada
Warna Kalus Ada ada ada
Morfogenesis Tidak ada Tidak ada Tidak ada Keterangan: T= Jenis eksplan
A= komposisi media yang berbeda
TxA= interaksi jenis eksplan dengan komposisi media yang berbeda **= sangat nyata pada taraf 5 %
tn= tidak nyata a= transformasi data
[image:48.595.243.372.198.383.2] [image:48.595.112.517.473.645.2]Kehadiran kalus ditemukan pada perlakuan T2 (jenis eksplan bonggol) dan media A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l). Kehadiran kalus muncul pada minggu ke-3 setelah subkultur. Kalus terdapat pada bekas potongan bonggol.
Gambar 4. Kehadiran kalus dari eksplan T2 (bonggol) dan media A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l).
Warna Kalus
Kalus yang terbentuk memiliki warna putih kehijauan. Warna kalus yang terbentuk dapat diamati secara visual.
Morfogenesis
Berdasarkan kemunculan terbentuknya tunas mikro tanaman karet,maka tidak diperoleh kemunculan tunas dliuar jaringan meristem aksilar (pangkal batang, ujung batang, atau bagian lain dari eksplan).
Pembahasan
[image:49.595.256.403.205.382.2]Dari hasil analisis data secara statistik diketahui bahwa perlakuan jenis eksplan memberikan pengaruh yang nyata terhadap jumlah tunas dan belummemberikan pengaruh nyata pada peubah amatan lain.
Pada peubah amatan jumlah tunas tertinggi pada perlakuan jenis eksplan terdapat pada perlakuan T2 (bonggol) dengan rataan (0,94) dan terendah pada perlakuan T1 (pucuk) dengan rataan (0,58). Pada eksplan pucuk, tunas yang muncul hanya berjumlah satu yang berasal dari tunas pucuk yang memanjang, sedangkan pada eksplan bonggol dengan satu mata tunas jumlah tunas tertinggi adalah tiga tunas yang terdapat pada pangkal batang. Jaringan meristem organ bonggol tanaman mikro merupakan jaringan yang dapat membentuk tunas apabila jaringan tersebut ditempatkan pada komposisi medium dan zat pengatur tumbuh yang sesuai. Hal ini juga didukung oleh Gunnatilleke dan Samaranayake (1988) yang menyatakan bahwa terjadi pemanjangan tunas aksilar dan pada beberapa pengkulturan, masing-masing tunas tanaman karet menghasilkan dua tunas aksilar dibawah tunas terminal dengan panjang 0.5 – 0.7 cm dan tumbuhnya tunas aksilar dilihat dalam waktu seminggu pada semua media dan tunas terminal tumbuh lebih cepat dari tunas aksilar pada tanaman karet. Sedangkan hasil dari penelitian ini tunas aksilar lebih baik pertumbuhannya daripada tunas terminal. Hal ini dapat disebabkan oleh pengaruh kondisi fisiologis eksplan dan hormon endogen. Menurut Yusnita (2003) kondisi fisiologis, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur.
mengalami pertumbuhan yang lambat. Hal ini dikaitkan dengan pertumbuhan tunas hanya muncul dari titik tumbuh terminalnya saja. Hal ini mungkin disebabkan belum diperolehnya komposisi medium dan zat pengatur tumbuh yang sesuaiuntuk mendorong pertumbuhan pucuk aksilar. Paranjothy dan Gandimathi (1976) yang mencoba mengkulturkan tunas ujung pucuk (panjang 2-3 cm), yang berasal dari perbanyakan pertama dengan biji. Walupun tunas ini mengalami perakaran di medium cair MS, namun tunas tersebut mengalami kegagalan pertumbuhan pada medium MS padat.
Pengaruh Komposisi Media yang Berbeda terhadap Pembentukan Tunas Tanaman Karet Secara In Vitro
Dari hasil analisis data secara statistik diperoleh bahwa perlakuan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap jumlah tunas, panjang tunas, persentase munculnya daun, dan jumlah daun. Panjang tunas, persentase munculnya tunas dan jumlah daun dibahas pada interaksi jenis eksplan dan komposisi media yang berbeda karena memberikan pengaruh yang nyata terhadap peubah amatan tersebut.
MS yang ditambahkan BAP 1,0 mg/l dan NAA 0 mg/l, dan medium MS yang ditambahkan BAP 1,5 mg/l dan NAA 0,1 mg/l. Hal ini juga didukung oleh Gunnatilleke dan Samaranayake (1988) yang menyatakan bahwa hanya dengan 0.5 mg/l dan 4.0 mg/l BAP dan 0.5 mg/l BAP yang dikombinasi dengan 0.1 mg/l IBA maka terjadi pemanjangan tunas aksilar dan pada beberapa pengkulturan, masing-masing tunas tanaman karet menghasilkan dua tunas aksilar dibawah tunas terminal dengan panjang 0.5 – 0.7 cm. Menurut Wattimena et al. (1992) ploriferasi tunas aksilar hanya memerlukan sitokinin dalam konsentrasi yang tinggi tanpa auksin atau auksin dalam konsentrasi yang rendah sekali.
Pengaruh Interaksi Jenis Eksplan dan Komposisi Media yang Berbeda terhadap Pembentukan Tunas Tanaman Karet Secara In Vitro
Interaksi antara jenis eksplan dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap persentase munculnya tunas, panjang tunas,persentase terbentuknya daun, dan jumlah daun.
secara in vitro, yang menunjukkan bahwa pada pemberian BAP yang lebih tinggi dari NAA pada medium MS dengan eksplan buku yang aktif yaitu yang memiliki daun, pada 8 minggu setelah tanam perlakuan S0 (tanpa hormon) dan S1 (2 ppm kinetin + 1 ppm BAP + 0.2 ppm NAA) diperoleh 90 % terhadap persentase munculnya tunas dan pada 12 minggu setelah tanam seluruh perlakuan baik S0 dan S1 serta S2 ( 7.5 ppm Kinetin + 3.75 BAP + 0.2 ppm NAA) dan S3 ( 10 ppm Kinetin + 5 pm BAP + 0.2 NAA) memberikan respon sebesar 100 % terhadap persentase munculnya tunas. Sumiasri dan Priadi (2002) menyatakan bahwa konsentrasi BAP yang optimal untuk memacu pertumbuhan tanaman bervariasi dan tergantung pada jenis tanaman. Banyak jumlah tunas yang terbentuk karena tercapainya antara zat pengatur tumbuh eksogen dengan eksplan untuk merangsang pemunculan tunas-tunas baru, karena untuk menghasilkan tunas dalam jumlah banyak eksplan yang dikulturkan juga berasal dari tunas sehingga eksplan yang digunakan lebih aktif merespon zat pengatur tumbuh.
yang tertinggi sebesar 17 mm. Menurut Miah et al. (2008) menyatakan bahwa yang menghasilkan panjang tunas lebih tinggi pada konsentrasi 1 mg/l BAP yaitu pada eksplan nodus yaitu 22,20 cm dibandingkan dengan eksplan pucuk 19,35 cm pada C. macroptera. Menurut penelitian Gunatilleke dan Samaranayake (1988) yang menyatakan bahwa pengkulturan karet menggunakan eksplan tunas pucuk yang baik terdapat pada media dengan 0,5 mg dan 4,0 mg/l BAP dan 0,005; 0,1; 0,5 mg/l IBA, sedangkan pertumbuhan eksplan nodus dengan mata tunas diketahui lebih baik pada 0,5 mg/l BAP + 0,005 mg/l IBA.
pada media pertumbuhan tetapi bergantung pula pada interaksi antara auksin eksogen dan endogen.
Jumlah daun tertinggi pada interaksi perlakuan jenis eksplan dan komposisi media yang berbeda terdapat pada perlakuan T2A4 yaitu T2 (bonggol), A4 (WPM + BAP 0,5 mg/l) dengan rataan (1,40) daun dan terendah terdapat pada perlakuan T1A1, T1A2, T1A4, T1A5, T1A6, T2A1, T2A2, T2A3, T2A6 yaitu dengan jenis eksplan T1 (pucuk) dan T2 (bonggol) dengan masing-masing media A1 (MS + BAP 0,5 mg/l), A2 (MS + BAP 1 mg/l), A4 (WPM + BAP 0,5 mg/l), A5 (WPM BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM BAP 0,5 mg/l + NAA 0,5 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l) dengan rataan (0,00). Hal ini menunjukkan bahwa eksplan bonggol dengan mata tunas dan media dengan tambahan zpt berpengaruh dalam membentuk daun. Penambahan sitokinin dalam konsentrasi rendah dan tanpa auksin dapat mendorong diferensiasi ke arah pembentukan daun. Menurut George dan Sherrington (1984), menyatakan bahwa kemampuan suatu eksplan untuk berdiferensiasi tidak hanya bergantung pada penambahan auksin pada media pertumbuhan tetapi bergantung pula pada interaksi antara auksin eksogen dan endogen. Menurut Nursetiadi (2008), dengan penambahan sitokinin (BAP) pada media dapat mendorong sel–sel meristem pada eksplan untuk membelah dan mempengaruhi sel lainnya untuk berkembang menjadi tunas dan membentuk daun.
T2A4 yaitu T2 (bonggol), A4 (WPM + BAP 0,5 mg/l). Hal ini diduga karena pada eksplan tersebut memiliki mata tunas yang masih muda dan aktif membelah sehingga saat ditambah BAP mampu menghasilkan tunas dengan cepat yaitu dalam waktu 1 minggu. Menurut Kosmiatin et al. (2005) menyatakan bahwa waktu induksi tunas tercepat diperoleh dari eksplan buku tanpa daun. Eksplan yang relatif lebih mudah diinduksi tunasnya adalah eksplan yang memiliki jaringan meristem atau bakal tunas pada buku. Menurut Miah et al. (2008) yang menyatakan bahwa pemberian 1,0 mg/l BAP pada tanaman C. macroptera Mont. menunjukkan hari muncul tunas tercepat pada eksplan nodus yaitu 6 HST dari pada menggunakan eksplan tunas apeks yaitu 7 HST.
Dari hasil penelitian yang dilakukan diperoleh bahwa dalam multiplikasi tanaman karet menghasilkan kalus dengan warna kehijauan. Hal ini menunjukkan bahwa kalus mengandung klorofil. Hal ini diduga karena panambahan sitokinin dalam media. Menurut Kresnawati (2006), menyatakan bahwa warna kalus dari suatu eksplan dipengaruhi oleh zat pengatur tumbuh. Warna kalus yang bermacam-macam diakibatkan oleh adanya pigmentasi cahaya dan asal eksplan. Pigmentasi bisa merata keseluruh permukaan kalus atau hanya sebagian saja, bisa dilihat adanya perbedaan warna dalam satu kalus yaitu putih, hijau, coklat, putih kecoklatan, dan putih kehijauan. Warna putih kehijauan memungkinkan warna paling cerah dengan kandungan klorofil lebih sedikit. Warna hijau pada kalus akibat efek sitokinin dalam pembentukan klorofil.
KESIMPULAN DAN SARAN Kesimpulan
Eksplan bonggol merupakan eksplan yang terbaik untuk menghasilkan jumlah tunas. Medium MS + BAP 0,5 mg/l memberikan hasil yang terbaik pada jumlah tunas sedangkan medium WPM +0,5 mg/l BAP merupakan medium terbaik untuk panjang tunas, persentase terbentuk daun, dan jumlah daun. Penggunaan jenis eksplan bonggol dalam WPM + BAP 0,5 mg/l menghasilkan persentase munculnya tunas, panjang tunas, persentase terbentuknya daun, dan jumlah daun yang terbaik selama 14 hari masa pengkulturan.
Saran
DAFTAR PUSTAKA
Abbas BS dan S. Ginting. 1981. Influence of Rootstock and Scion on Girth Increment in Rubber Trees. Buletin Balai Penelitian Perkebunan Medan. Vol 12 : 145-152.
Andaryani, S. 2010. Kajian Penggunaan Berbagai Konsentrasi Bap Dan 2,4-D Terhadap Induksi Kalus Jarak Pagar (Jatropha curcas L.) Secara In Vitro. Fakultas Pertanian Universitas Sebelas Maret.
Budiman, H., 2012. Budidaya Karet Unggul Prospek Jitu Investasi Masa Depan. Pustaka Baru Press, Yogyakarta.
Carron, M.P.dan F. Enjalric. 1983. Perspectives du micro bouturage de l’Hevea
brasiliensis. Caoutchoucs et Plastiques 627-628, 65-68
Damanik, S., M. Syakir, M. Tasma, dan Siswanta. 2010. Budidaya dan Pasca Panen Karet. Pusat penelitian dan Pengembangan Perkebunan.
Delmer, D. P. dan Amor, Y. 1995. Cellulose biosynthesis. Plant Cell 7, 987-1000. Fitriani, H. 2008. Kajian Konsentrasi BAP Dan NAA terhadap Multiplikasi
Tanaman Artemisia annua L. Secara In Vitro. Fakultas Pertanian Universitas Sebelas Maret.
George, E. F., dan P. D. Sherrington. 1984. Plant Propagation by Tissue Culture. Exegetics Limited. England.
Gunnatilleke, I.D. dan Samaranayake, C. 1988. Shoot Tip Culture as a Method of Micropropagation of Hevea. Diakses dari Http://dl.nsf.ac.lk.
Gunawan LW. 1992. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan Tanaman. PAU Bioteknologi IPB. Bogor.
Hanifah, N. 2008. Pengaruh Konsentrasi NAA dan BAP terhadap Pertumbuhan Eksplan Jarak Pagar (Jatropha curcas L.) secara In Vitro. Skripsi Fakultas Pertanian UNS. Surakarta.
Harahap, P. S., L. A. M. Siregar, dan Y. Husni. 2014. Kajian Awal : Respon Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell Arg.) dalam Medium MS. Jurnal Online Agroekoteknologi. Vol.3(1) : 229 – 237.
Haris, N. 2013. Batang Bawah Klonal : Apakah Mungkin pada Tanaman Karet?. www.ibriec.org, juli 2013 1(1), Hal. 20-24.
Hartmann, H.T., Kester, D.E., Davies, F.T., dan Geneve, R.L. 1990. Plants Propagation and Practiese. Englewood Clifts. New Jersey: Prentice-Hall International, Inc.
Hendaryono, D. P. S., dan A. Wijayanto.1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Secara Vegetatip. Kanisius, Yogyakarta.
Janudianto, P, A., Napitupulu, H., dan Rahayu. S. 2013. Panduan Budidaya Karet Untuk Petani Skala Kecil. Rubber cultivation guide for small-scale farmers. Lembar Informasi AgFor 5. Bogor, Indonesia: World Agroforestry Centre (ICRAF) Southeast Asia Regional Program.
Jumroh, P.H. 2013. Pengaruh Periode Subkultur Terhadap Mikropropagasi Puar Tenangau (Elettariopsis sp.).Fakultas Pertanian. Universitas Sumatera Utara, Medan.
Kholida, M. 2007. Pengaruh Jenis Eksplan dan Zat Pengatur Tumbuh terhadap Multiplikasi Adenium (Adenium obesum Roem. & Schult.) secara In Vitro. Skripsi Fakultas Pertanian UNS. Surakarta.
Kosmiatin, M., A. Husni dan I. Mariska. 2005. Perkecambahan dan Perbanyakan Gaharu Secara In Vitro. Jurnal Agrobiogen 1 (2) : 62 – 67.
Kresnawati, E. 2006. Pengaruh Zat Pengatur Tumbuh Naa Dan Kinetin Terhadap Induksi Kalus Dari Daun Nilam (Pogostemon cablin Beth). Skripsi. Universitas Muhammadiyah Surakarta.
Mardianto, K, 2011. Karakteristik Bunga dan Biji dalam Hubungannya dengan Aktivitas Persilangan Tetua Karet. Warta Karet. Balai Penelitian Sungei Putih.
Mariska, I., dan Ragapadmi, P. 2001. Perbanyakan Vegetatif Tanaman Tahunan Melalui Kultur In Vitro. J. Litbang Pertanian. 20 (1).
Mariska, I dan D. Sukmadjaja. 2003. Perbanyakan Bibit Abaka Melalui Kultur Jaringan.Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. Mendanha, A.B.L., Roberto, A. A.T., dan Adelson, B. F. 1998.
Micropropagation of rubber trees (Hevea brasiliensis Muell. Arg.). Genet. Mol. Biol. vol. 21(3) São Paulo.
Montoro P, MP Carron, L Lardet, A Clement-Demange dan J Leclercq. 2010. Biotechnologies of rubber tree (Hevea brasiliensis). Aus Pac J Mol Biol Biotechnol 18(1), 81-83.
Murashige, T. dan F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473-497.
Muhammad, N. N. 2015. Produk Berbasis Karet Alam Harus Jadi Produk Pendukung Pembangunan Infrastruktur Nasional. Kementerian Perdagangan. Siaran Pers Bersama.
Nayanakantha, N.M.C. dan P. Seneviratne (2007). Tissue culture of rubber: past, present and future prospects. Ceylon J Sci 36(2), 116-125.
Nugroho, P.S. 2010. Karakterisasi Biologi Isolat-Isolat Rigidoporus microporus Pada Tanaman Karet (Hevea brasiliensis) Asal Cilacap. Fakultas Pertanian Universitas Sebelas Maret, Surakarta.
Normayati, C. H. dan Jamnah, A. R. 2014. Induction Of Shoots And Roots From Vegetative Tissue Culture Of Hevea brasiliensis RRIM 2020. J. Trop. Plant Physiol. 6 (2014): 1-9
Nursetiadi, E. 2008. Kajian Macam Media dan Konsentrasi BAP terhadap
Multifikasi Tanaman Manggis ( Garcinia mangostana L.) Secara Invitro. Universitas Sebelas Maret, Surakarta. Hal 11-12.
Paranjothy, K. dan Gandimathi, H. (1976). Tissue and Organ Culture of Hevea. Proceedings of International. Rubber Conference, Kuala Lumpur, Malaysia. Pp 59-84.
Pardal, S. J., Ika, M., E. G. Lestari., dan Slamet. 2004. Regenerasi Tanaman dan Transformasi Genetik Salak Pondoh untuk Rekayasa Buah partenokarpi. J. Bioteknologi Pertanian. 9 (2) : 49-55.
Pierik, R. L. M., 1987. In Vitro Culture of Hinger Plant. Martinus Nijhoft Publisher. Netherlands.
Purwanto, A. 2008. Kajian Macam Eksplan Dan Konsentrasi Iba Terhadap Multiplikasi TanamanManggis (Garcinia mangostana L.) Secara in vitro. Fakultas Pertanian Universitas Sebelas Maret.
Santoso, U. dan F. Nursandi. 2001. Kultur Jaringan Tanaman. Penerbit UMM, Malang.
Seneviratne, P., A. W. Flegmann and G. A. S. Wijsekera. 1996. The Positional Effect of The Explant on In Vitro Growth of Axillary Buds of Hevea brasiliensis. Journal of The Rubber Research Institute of Sri Lanka. 78: 60-68 .
Setiawan, D. H., dan Andoko, A. 2005. Petunjuk Lengkap Budidaya Karet. Agromedia Pustaka, Jakarta..
Sianturi, H. S. D., 2001. Budidaya Tanaman Karet. Fakultas Pertanian USU. Medan.
Sofia, D. 1997. Pengaruh Berbagai Konsentrasi Benzyl Amino Purine dan Cycocel Terhadap Pertumbuhan Embrio Kedelai (Glycine max L. Merr) Secara In Vitro. Fakultas Pertanian Universitas Sumatera Utara, Medan. Steel, R.G dan J.H. Torrie, 1993. Prinsip Dan Prosedur Statiska (Pendekatan
Biometric) Penerjemah B. Sumantri. Gramedia Pustaka Utama, Jakarta. Steenis, C. G. G. K., 2005. Flora. PT. Pradnya Paramita. Jakarta.
Sundari, L., L. A. M. Siregar, dan D. S. Hanafiah. 2014. Kajian Awal : Respon Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell