INDUKSI TUNAS MIKRO TANAMAN KARET (Hevea brasiliensis Muell. Arg.) DARI EKSPLAN NODUS PADA MEDIA MS DENGAN PEMBERIAN BENZIL AMINO
PURIN (BAP) DAN NAFTALEN ASAM ASETAT (NAA)
SKRIPSI
OLEH:
PERMATA SARI HARAHAP 100301185/PEMULIAAN TANAMAN
PROGRAM STUDI AGROTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
INDUKSI TUNAS MIKRO TANAMAN KARET (Hevea brasiliensis Muell. Arg.) DARI EKSPLAN NODUS PADA MEDIA MS DENGAN PEMBERIAN BENZIL AMINO
PURIN (BAP) DAN NAFTALEN ASAM ASETAT (NAA)
SKRIPSI
OLEH :
PERMATA SARI HARAHAP 100301185/PEMULIAAN TANAMAN
Skripsi merupakan salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI AGROTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
Judul : Induksi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell. Arg.) dari Eksplan Nodus pada Media MS dengan Pemberian Benzil Amino Purin (BAP) dan Naftalen Asam Asetat (NAA)
Nama : Permata Sari Harahap
NIM : 100301185
Program Studi : Agroteknologi
Disetujui Oleh : Komisi Pembimbing
Luthfi Aziz M. Siregar, SP., M.Sc., Ph.D Ir. Yusuf Husni Ketua Anggota
Mengetahui :
RINGKASAN EKSEKUTIF
Kebun Gunung Pamela berdiri pada tahun 1925 bersama CMO (Cultur Mascapay Onderling) dengan luas konsensi 5.525 Ha, sebagai komoditi
awal adalah tanaman karet seluas ± 2500 Ha. Pembagian CMO pada saat itu adalah Kebun Gunung Para, Kebun Gunung Pamela dan Kebun Gunung Monako. Permintaan bahan tanam (bibit) karet untuk peremajaan dan perluasan areal di PT. Perkebunan Nusantara III terus meningkat sejalan dengan adanya program revitalisasi perkebunan yang dicanangkan oleh Pemerintah. Kebutuhan bibit karet PTPN III diperkirakan mencapai hampir 1,6 juta bibit per tahun, sedangkan kemampuan penyediaannya masih sangat terbatas.
Perbanyakan bibit karet sampai saat ini dilakukan dengan cara okulasi, sehingga diperlukan ketersediaan batang atas dan batang bawah. Batang atas diperbanyak secara klonal dengan cara menempelkan mata tunas yang diambil dari tanaman karet di kebun kayu okulasi. Batang bawah merupakan tanaman asal biji (seedling) sehingga ketersediaannya sangat tergantung pada musim biji yang umumnya hanya berlangsung satu kali dalam setahun. Idealnya, batang bawah yang digunakan juga merupakan tanaman hasil seleksi. Akan tetapi, pada tanaman karet penggunaan batang bawah hasil seleksi dengan karakter unggul seperti kemampuan adaptabilitas dengan berbagai lingkungan tanah atau toleran terhadap patogen tanah, belum dilakukan selama ini karena teknik perbanyakan batang bawah secara klonal belum tersedia.
penyediaan batang bawah adalah Kultur in Vitro yaitu cara perbanyakan klonal tanaman secara aseptik dan Microcutting merupakan salah satu teknik berbasis kultur in vitro tersebut. Teknologi microcutting telah dikembangkan oleh tim CIRAD-Perancis sepanjang tahun 1980-1990-an dan telah melakukan kerjasama dengan Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) dan Balai Penelitian Karet Sungei Putih.
Laboratorium Penelitian di BPBPI saat ini baru dapat menghasilkan sekitar 500 planlet setiap bulan. Untuk perbanyakan skala besar diperlukan keterlibatan perusahaan perkebunan besar dan salah satu perusahaan yang tepat adalah PT. Perkebunan Nusantara III (PTPN III). PTPN III merupakan salah satu perusahaan perkebunan dengan komoditas utamanya adalah tanaman karet dan kelapa sawit. Sebagai perusahaan yang sehat, dinamis, berpandangan jauh ke depan serta tanggap dengan kemajuan teknologi, PTPN III merupakan institusi yang ideal dalam pengembangan teknologi microcutting untuk perbanyakan batang bawah klonal secara massal.
Pengembangan teknologi microcutting di PTPN III di mulai pada akhir tahun 2008 tepatnya pada tanggal 10 November 2008 melalui Surat Perjanjian Kerjasama di Bidang Perbanyakan In Vitro Tanaman Karet dan Penelitian Peningkatan Efisiensi Proses Perbanyakannya. Lingkup pekerjaan pada perjanjian kerjasama tersebut adalah:
• Melakukan penelitian peningkatan efisiensi proses perbanyakan tanaman karet dengan teknologi microcutting di Laboratorium Balai Penelitian Bioteknologi Perkebunan Indonesia.
Hasil akhir dari kerjasama tahun pertama ini adalah telah selesai dilaksanakan pembangunan laboratorium kultur in vitro tanaman karet di kebun Gunung Pamela dan masih dilaksanakan penelitian berkelanjutan untuk peningkatan efisiensi proses perbanyakan tanaman karet dengan teknologi microcutting di BPBPI-Bogor.
Teknologi microcutting PTPN III terus dilanjutkan untuk tahun ke-II (tahun 2010) melalui Surat Perjanjian Kerjasama di Bidang Perbanyakan In Vitro Tanaman Karet dan Penelitian Peningkatan Efisiensi Proses Perbanyakannya. Hasil akhir dari kerjasama tahun ke-II masih belum memberikan hasil yang sesuai dengan target pencapaian. Sehingga kerjasama di Bidang Perbanyakan In Vitro Tanaman Karet masih perlu untuk dilanjutkan kembali.
ABSTRACT
PERMATA SARI HARAHAP, 2014 : Induction of Rubber Micro Shoot from Node Explant in MS Medium with Benzyl Amino Purine (BAP) and Naphthalene Acetic Acid (NAA), supervised by Luthfi A. M Siregar and Yusuf Husni.
The aimed of research to determine the best medium for micro shoot induction of rubber plant (Hevea brasiliensis Muell. Arg.) from node explant in MS medium with Benzyl Amino Purine (BAP) and Naphthalene Acetic Acid (NAA). The research was carried out in the In Vitro Culture Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. The research began from April to June 2014. The research used Completely Randomized Design non factorial with sixteen treatments and six replications.
The results showed that combination of BAP and NAA concentrations gave significantly effect on percent of shoots emergence, shoots number, shoots length and shoots emergence age, but it hasn’t significantly effect on percent of leaves formation and leaves number. Each treatment has different result and it can be concluded that the best combination concentrated to produce leaf of microshoot rubber was MS + 1 mg/l BAP + 0 mg/l NAA.
ABSTRAK
PERMATA SARI HARAHAP, 2014 : Induksi Tunas Mikro Tanaman Karet dari Eksplan Nodus pada Media MS dengan Pemberian Benzil Amino Purin
(BAP) dan Naftalen Asam Asetat (NAA), dibimbing oleh Luthfi A. M Siregar dan Yusuf Husni.
Penelitian ini bertujuan mendapatkan medium yang tepat pada induksi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dari eksplan nodus pada medium MS dengan pemberian Benzil Amino Purin (BAP) dan Naftalen Asam Asetat (NAA). Penelitian ini dilaksanakan Laboratorium Kultur In Vitro PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan April 2014 sampai dengan Juni 2014. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) non faktorial dengan 16 perlakuan dan 6 ulangan.
Hasil penelitian menunjukkan bahwa kombinasi konsentrasi BAP dan NAA berpengaruh nyata terhadap untuk persentase munculnya tunas, jumlah tunas, panjang tunas dan umur munculnya tunas, tetapi belum berpengaruh nyata terhadap persentase terbentuknya daun dan jumlah daun. Masing-masing perlakuan memiliki hasil yang berbeda dan dapat disimpulkan bahwa kombinasi konsentrasi terbaik untuk pertumbuhan daun pada tunas mikro tanaman karet ialah MS + 1 mg/l BAP + 0 mg/l NAA.
RIWAYAT HIDUP
Permata Sari Harahap dilahirkan di Medan pada tanggal 31 Mei 1992 anak dari pasangan Muslim Harahap, SP dan Mardiana Ritonga, S.Pd sebagai anak ketiga dari tiga bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD Swasta Al-Washliyah 11 Medan lulus pada tahun 2004, SMP Negeri 15 Medan lulus tahun 2007 dan SMA Negeri 5 Medan lulus tahun 2010. Tahun 2010 diterima sebagai mahasiswa melalui jalur SNMPTN (Seleksi Nasional Mahasiswa Perguruan Tinggi Negeri) pada Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Induksi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell. Arg) dari
Eksplan Nodus pada Media MS dengan Pemberian Benzil Amino Purin
(BAP) dan Naftalen Asam Asetat (NAA)”.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ayahanda Muslim Harahap, SP dan Ibunda Mardiana Ritonga, S.Pd. yang telah memberikan dukungan moril dan materiil kepada penulis. Serta kepada Harry Perdana Harahap, S.Sos, Dian Mustika Harahap, S.Pd, Afridayani Afnel S.KM sebagai saudara yang selalu memotivasi saya. Penulis menyampaikan ucapan terima kasih kepada Bapak Luthfi Aziz Mahmud Siregar, SP., M.Sc., PhD., selaku ketua komisi pembimbing dan Bapak Ir. Yusuf Husni selaku anggota komisi pembimbing yang telah membimbing dan memberikan berbagai masukan, mulai dari penetapan judul, melakukan penelitian, sampai pada ujian akhir.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh sebab itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata, penulis mengucapkan terima kasih.
Medan, September 2014
DAFTAR ISI
Zat Pengatur Tumbuh ... 17
BAHAN DAN METODE PENELITIAN ... 21
Tempat dan Waktu ... 21
Sterilisasi Bahan Tanaman di Lapangan ... 25
Pengambilan Bahan Tanaman ... 26
Sterilisasi Bahan Tanaman di Laboratorium ... 26
Persiapan Ruang Tanam ... 26
Pemeliharaan Eksplan ... 27
Peubah Amatan ... 28
Persentase Munculnya Tunas (%) ... 28
Jumlah Tunas (tunas) ... 28
Panjang Tunas (cm)... 28
Persentase Terbentuknya Daun(%) ... 28
Jumlah Daun (helai) ... 28
Umur Munculnya Tunas (hari)... 29
HASIL DAN PEMBAHASAN Hasil ... 30
Persentase Munculnya Tunas (%) ... 30
Jumlah Tunas (tunas) ... 31
Panjang Tunas (cm)... 32
Persentase Terbentuknya Daun(%) ... 34
Jumlah Daun (helai) ... 34
Umur Munculnya Tunas (hari)... 36
Pembahasan ... 37
KESIMPULAN DAN SARAN Kesimpulan ... 46
Saran ... 46
DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal. 1. Persentase munculnya tunas (%) dalam medium MS + kombinasi BAP
dan NAA dari eksplan nodus 6 minggu setelah pengkulturan ... 30 2. Jumlah tunas (tunas) dalam medium MS + kombinasi BAP dan NAA
dari eksplan nodus 6 minggu setelah pengkulturan ... 31 3. Panjang tunas (cm) dalam medium MS + kombinasi BAP dan NAA
dari eksplan nodus 6 minggu setelah pengkulturan ... 33 4. Persentase terbentuknya daun (%)dalam medium MS + kombinasi BAP
dan NAA dari eksplan nodus 6 minggu setelah pengkulturan ... 35 5. Jumlah daun (helai) dalam medium MS + kombinasi BAP dan NAA
dari eksplan nodus 6 minggu setelah pengkulturan ... 36 6. Umur munculnya tunas (hari) dalam medium MS + kombinasi BAP dan
NAA dari eksplan nodus 3 minggu setelah pengkulturan ... 37
No. Hal.
1. Pembibitan Karet dan Primary Culture Karet ... 7 2. Induksi tunas dari eksplan buku (a) pada media MS dengan perlakuan A10 (1.5 mg/l BAP + NAA 0.1 mg/l) dan (b) A12 (1.5 mg/l BAP + NAA 0.5 mg/l) setelah 6 MST ... 31 3. Induksi tunas dari eksplan buku (a) pada media MS dengan perlakuan A10 (1.5 mg/l BAP + NAA 0.1 mg/l) dan (b) A15 (2 mg/l BAP + NAA 0.25 mg/l) setelah 6 MST ... 34 4. Induksi ketiga tunas dari eksplan buku (nodus) pada media MS dengan perlakuan A10 (1.5 mg/l BAP + NAA 0.1 mg/l) setelah 6 MST ... 36 5. Induksi tunas dari eksplan buku (a) pada media MS dengan perlakuan A6
DAFTAR LAMPIRAN
No. Hal.
1. Data Pengamatan Persentase Munculnya Tunas (%) ... 51
2. Data Transformasi Persentase Munculnya Tunas Arcsin √P ... 52
3. Daftar Sidik Ragam Persentase Munculnya Tunas ... 52
4. Uji Jarak Berganda Duncan Persentase Munculnya Tunas... 53
5. Data Pengamatan Jumlah Tunas 5 dan 6 MST (tunas) ... 53
6. Data Transformasi Jumlah Tunas 5 dan 6 √X+0.5 ... 54
7. Daftar Sidik Ragam Jumlah Tunas 5 dan 6 MST ... 54
8. Uji Jarak Berganda Duncan Jumlah Tunas 5 dan 6 MST ... 55
9. Data Pengamatan Panjang Tunas (cm) ... 55
10.Data Transformasi Panjang Tunas √X+0.5 ... 56
11.Daftar Sidik Ragam Panjang Tunas (cm) ... 56
12.Uji Jarak Berganda Duncan Panjang Tunas ... 57
13.Data Pengamatan Persentase Terbentuknya Daun (%) ... 58
14.Data Transformasi Persentase Terbentuknya Daun Arcsin √P ... 58
15.Data Sidik Ragam Persentase Terbentuknya Daun ... 58
16.Daftar Pengamatan Jumlah Daun (helai) ... 59
17.Daftar Transformasi Jumlah Daun √X+0.5 ... 59
18.Daftar Sidik Ragam Jumlah Daun... 60
19.Data Pengamatan Umur Munculnya Tunas (Hari)... 54
20.Komposisi Media Murashige dan Skoog (MS) ... 61
21.Kegiatan Penelitian ... 62
22.Bagan Penelitian... 63
ABSTRACT
PERMATA SARI HARAHAP, 2014 : Induction of Rubber Micro Shoot from Node Explant in MS Medium with Benzyl Amino Purine (BAP) and Naphthalene Acetic Acid (NAA), supervised by Luthfi A. M Siregar and Yusuf Husni.
The aimed of research to determine the best medium for micro shoot induction of rubber plant (Hevea brasiliensis Muell. Arg.) from node explant in MS medium with Benzyl Amino Purine (BAP) and Naphthalene Acetic Acid (NAA). The research was carried out in the In Vitro Culture Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. The research began from April to June 2014. The research used Completely Randomized Design non factorial with sixteen treatments and six replications.
The results showed that combination of BAP and NAA concentrations gave significantly effect on percent of shoots emergence, shoots number, shoots length and shoots emergence age, but it hasn’t significantly effect on percent of leaves formation and leaves number. Each treatment has different result and it can be concluded that the best combination concentrated to produce leaf of microshoot rubber was MS + 1 mg/l BAP + 0 mg/l NAA.
ABSTRAK
PERMATA SARI HARAHAP, 2014 : Induksi Tunas Mikro Tanaman Karet dari Eksplan Nodus pada Media MS dengan Pemberian Benzil Amino Purin
(BAP) dan Naftalen Asam Asetat (NAA), dibimbing oleh Luthfi A. M Siregar dan Yusuf Husni.
Penelitian ini bertujuan mendapatkan medium yang tepat pada induksi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dari eksplan nodus pada medium MS dengan pemberian Benzil Amino Purin (BAP) dan Naftalen Asam Asetat (NAA). Penelitian ini dilaksanakan Laboratorium Kultur In Vitro PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan April 2014 sampai dengan Juni 2014. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) non faktorial dengan 16 perlakuan dan 6 ulangan.
Hasil penelitian menunjukkan bahwa kombinasi konsentrasi BAP dan NAA berpengaruh nyata terhadap untuk persentase munculnya tunas, jumlah tunas, panjang tunas dan umur munculnya tunas, tetapi belum berpengaruh nyata terhadap persentase terbentuknya daun dan jumlah daun. Masing-masing perlakuan memiliki hasil yang berbeda dan dapat disimpulkan bahwa kombinasi konsentrasi terbaik untuk pertumbuhan daun pada tunas mikro tanaman karet ialah MS + 1 mg/l BAP + 0 mg/l NAA.
PENDAHULUAN
Latar Belakang
Tanaman karet (Hevea brasiliensis) berasal dari negara Brazil. Tanaman ini merupakan sumber utama bahan tanaman karet alam dunia. Jauh sebelum tanaman karet ini dibudidayakan, penduduk asli di berbagai tempat seperti Amerika Serikat, Asia, dan Afrika Selatan menggunakan pohon yang juga menghasilkan getah. Pohon karet pertama kali hanya tumbuh di Amerika Selatan, namun setelah percobaan berkali-kali oleh Henry Wickham, pohon ini berhasil dikembangkan di Asia Tenggara, dimana sekarang tanaman ini banyak dikembangkan di Asia sebagai sumber karet alami (Budiman, 2012).
Luas areal perkebunan karet yang dikelola oleh PT. Perkebunan Nusantara III (PTPN III) saat ini terdiri atas 45.327 ha kebun eksisting dan 9.150 ha kebun plasma. Dengan asumsi setiap tahun dilakukan peremajaan sebesar 5 % dari luas areal tersebut diperlukan bahan tanamn karet sebanyak 1,5 juta bibit per tahun. Kebutuhan bahan tanam tersebut sampai saat ini diperoleh melalui cara konvensional menggunakan batang bawah dari biji dan batang atas dari klon-klon yang direkomendasikan. Menyadari berbagai keterbatasan dalam penyediaan bibit secara konvensional antara lain keragaman batang bawah relatif tinggi, ketersediaan biji mulai berkurang dan tuntutan peningkatan produktivitas diperlukan inovasi teknologi dalam penyediaan bibit karet (Muluk, 2009).
sehingga perlu dikelolah secara tepat dan tepat hingga ditanam di lahan pembibitan batang bawah (Mahardika, 2013).
Semua spesies Hevea memiliki jumlah kromosom ialah 2n = 36, dengan pengecualian satu triploid klon H. guinensis (2n = 54) dan adanya satu genotipe H. pauciflora dengan 2n = 18. Meskipun Hevea berperilaku sebagai diploid, itu diyakini menjadi amphidiploid (2n = 36; x = 9) yang stabil selama evolusi.
Anggapan ini didukung oleh ketaatan tetravalents selama meiosis (Janick, 2007).
Berbeda dengan batang atas, batang bawah masih diambil dari biji tanaman. Biji berasal dari klon - klon, seperti GT 1, PB 260, RRIC 100, dan AVROS 2037. Digunakannya biji sebagai batang bawah memiliki beberapa dampak negatif, seperti perbedaan karakter awal dari genotipe. Batang bawah bervariasi bisa membuat batang atas mengalami diferensiasi sehingga akan berdampak pada produksi lateks, diameter batang, bentuk daun, dan tampilan morfologinya. Untuk memecahkan kasus ini, batang bawah harus homogen. Maka, batang bawah harus diperbanyak secara klonal dengan kultur jaringan tanaman (Pratama, 2008).
daripada metode konvensional dan paling tidak mungkin untuk menghasilkan tanaman genetik menyimpang (Gunatilleke dan Chandra, 1988).
Microcutting merupakan salah satu teknik mikropropagasi tanaman berbasis kultur in vitro dan telah berhasil diaplikasikan untuk perbanyakan tanaman karet asal biji (seedling) dengan menggunakan tunas aksilar sebagai eksplan. Keuntungan teknik tersebut adalah terbukanya peluang untuk menghasilkan batang bawah klonal yang selama ini belum pernah ada pada tanaman karet. Penggunaan batang bawah klonal akan meningkatkan keseragaman pertanaman karet di lapang, karena klon batang atas didukung oleh batang bawah yang sama dan lebih seragam, dibandingkan dengan batang bawah asal biji yang digunakan saat ini. Di samping itu, teknologi perbanyakan tersebut juga membuka peluang untuk melakukan seleksi terhadap batang bawah sesuai dengan karakter yang diinginkan, misalnya batang bawah dengan karakter tahan terhadap penyakit akar atau toleran terhadap kondisi lahan kering. Material bahan tanam tersebut kemudian dapat diperbanyak secara klonal. Penggunaan batang bawah unggul dan klonal berpeluang besar untuk meningkatkan produksi lateks
dari batang atas karena diduga potensi produksi dapat ditampilkan secara optimal (Haris, dkk, 2009).
multiplikasi, perakaran dan aklimatisasi. Untuk tahap multiplikasi, eksplan primer dapat diinduksi kembali hingga 5 atau 6 kali. Tingkat multiplikasi microcutting hasilnya rendah. Setelah induksi perakaran, dikombinasikan dengan aklimatisasi dilakukan selama 4-6 minggu di rumah kaca sebelum transfer planlet ke lapangan. Mendanha, et al, ( 1998) menyatakan bahwa tunas diperoleh dari ketiak tunas pada media Murashige and Skoog dilengkapi dengan pengatur pertumbuhan dan pembentukan organ mirip dengan diinduksi auksin Skoog. Menginduksi kalus
dari ketiak tunas pada daun tetapi gagal untuk menumbuhkan tunas (Janick, 2007).
Ada banyak formulasi yang media yang berbeda, empat media yang representatif. Murashige-Skoog (MS) dan Medium Linsmaier-Skoog telah digunakan secara luas untuk berbagai jenis budaya dan spesies, terutama pada tanaman herba. Untuk tanaman berkayu, pengenceran tiga sampai sepuluh kali dalam garam anorganik atau pergeseran media anorganik lainnya yang diharapkan. Woody Plant Medium (WPM) dikembangkan untuk tanaman berkayu dan Anderson (AND) sedang dikembangkan untuk tanaman fhotodendrons. Media Gamborg (B5) telah digunakan secara luas untuk kultur sel dan jaringan (Hartmann, dkk, 2002).
Tujuan Penelitian
Untuk mendapatkan medium yang tepat pada induksi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dari eksplan nodus pada medium MS dengan pemberian Benzil Amino Purin (BAP) dan Naftalen Asam Asetat (NAA).
Hipotesis Penelitian
Ada pengaruh kombinasi BAP dan NAA pada medium MS terhadap
induksi tunas mikro dari eksplan nodus pada tanaman karet (Hevea brasiliensis Muell. Arg.).
Kegunaan Penelitian
TINJAUAN PUSTAKA
Pengenalan Tanaman Karet
Sistematika bahan tanaman karet (H. brasiliensis Muell. Arg.) menurut
Steenis (2005) ialah : Kingdom : Plantae; Divisio: Spermatophyta;
Subdivisio : Angiospermae; Kelas : Dicotyledoneae; Ordo : Euphorbiales; Famili : Euphorbiaceae; Genus : Hevea.
Akar tanaman karet berupa akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi ke atas. Dengan akar seperti itu pohon karet
dapat berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2006).
Tanaman karet merupakan tanaman yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa 15-25 meter. Batang biasanya tumbuh lurus dan memiliki percabangan tinggi di atas. Batang tanaman ini mengandung getah atau lateks (Syamsulbahri, 1996).
Tanaman karet adalah anggota famili Euphorbiaceae. Berbentuk pohon, tinggi 10-20 m, bercabang dan mengandung banyak getah susu. Daun berselang-seling, tangkai daun panjang, 3 anak daun yang licin bertangkai, petiola pendek, hijau dan memiliki panjang 3,5-30 cm. Helaian anak daun bertangkai pendek dan berbentuk elips atau bulat telur, pangkal sempit dan tegang, ujung runcing, sisi atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm dan lebar 2,5-12,5 cm (Sianturi, 2001).
betina. Penyerbukannya dapat terjadi dengan penyerbukan sendiri dan penyerbukan silang (Setyamidjaja,1993).
Karakteristik bunga jantan pada beberapa tetua karet cukup bervariasi, yaitu 295-500 bunga per tangkai dengan rata-rata 383,4 per tangkai dan 2065-2640 bunga per karangan dengan rata-rata 3482,6 bunga per karangan. Masing-masing bunga jantan dari setiap tetua tumbuh di setiap tangkai utama dan cabang-cabangnya, untuk satu tangkai bunga tersusun atas tiga bunga jantan (trifolia) yang berwarna kuning (Syarifah dan Woelan, 2007; Mardianto, 2011).
Buah beruang tiga, jarang yang beruang 4 hingga 6 diameter buah 3-5 cm dan terpisah 3, 4, 6. Coci bekatup dua, pericarp berbentuk endokarp berkayu. Biji besar, bulat persegi empat, tertekan pada satu atau dua sisinya, berkilat, berwarna coklat muda, dengan noda-noda cokelat tua, panjang 2-3,5 cm dan lebar 1,5–3 cm dan tebal 1,5-2,5 cm (Sianturi, 2001).
Dalam satu kapsul buah karet umumnya terdapat 3 butir biji. Buah yang masih muda secara bertahap selama 4 minggu pertama dari sejak penyerbukan,
dan buah mencapai ukuran maksimum pada umur 3 bulan setelah penyerbukan (Pustaka Litbang Deptan, 2012).
Kultur Jaringan
Teknik kultur jaringan dimulai ketika Schwan dan Schleiden mengemukakan teori totipotensi yang menyatakan bahwa sel-sel bersifat otonom dan pada prinsinya mampu beregenerasi menjadi tanaman lengkap. Jaringan tanaman dapat diisolasi dan di kultur hingga berkembang menjadi tanaman normal dengan melakukan manipulasi terhadap kondisi lingkungan dan nutrisinya (Zulkarnain, 2009).
Kultur jaringan merupakan teknik menumbuhkembangkan bagian tanaman, baik berupa sel, jaringan atau organ dalam kondisi aseptik secara in vitro. Yang dicirikan oleh kondisi kultur yang aseptik, penggunaan media kultur buatan dengan kandungan nutrisi lengkap dan zat pengatur tumbuh, serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol (Yusnita, 2003).
Kultur jaringan akan lebih besar persentase keberhasilannya bila menggunakan jaringan meristem. Jaringan meristem adalah jaringan muda, yaitu jaringan yang terdiri dari sel-sel yang selalu membelah, dindingnya tipis belum mempunyai penebalan dari zat pectin, plasmanya penuh dan vakuolanya kecil-kecil. Kebanyakan orang menggunakan jaringan ini untuk tissue culture. Sebab, jaringan meristem keadaannya selalu membelah, sehingga diperkiran mempunyai zat hormon yang mengatur pembelahan (Hendaryono dan Wijayani, 1994).
Kultur in vitro tanaman karet (H. brasiliensis Muell. Arg.) dapat dilakukan dengan microcutting dan embriogenesis somatik. Teknologi in vitro microcutting karet dikembangkan untuk menghasilkan batang bawah klonal guna memenuhi kebutuhan dan meningkatkan kualitas batang bawah yang selama ini dihasilkan dari biji. Meningkatnya kebutuhan batang bawah menyebabkan ketersediaan biji tidak mencukupi lagi karena tergantung pada beberapa klon karet penghasil biji batang bawah dan pada musim biji yang hanya berlangsung satu kali dalam setahun. Di samping itu, kelemahan lain dari penggunaan bibit asal biji sebagai batang bawah adalah adanya keragaman batang bawah dan kekurang-mampuan kombinasi batang atas dan batang bawah menampilkan potensi produksi dan karakter unggul lain secara maksimal karena perbedaan tingkat juvenilitas (Sumaryono, dkk, 2012).
perakaran tanaman karet asal seedling yaitu suatu kondisi yang sulit dicapai melalui perbanyakan stek konvensional di masa lalu (Haris, 2013).
Pada dasarnya kultur in vitro merupakan suatu proses perbanyakan sel, jaringan, organ atau protoplas dengan teknik steril. Keberhasilan teknologi in vitro masih terbatas pada beberapa tanaman tertentu saja. Kultur in vitro juga memberikan pengertian tentang studi fisiologi, biokimia, genetika, pertumbuhan dan perkembangan spesies tanaman pada tingkat molekuler (Nasir, 2000).
Keberhasilan tersebut membuka peluang perbanyakan tanaman karet secara in vitro, yang dapat dilakukan untuk dua tujuan. Pertama dan yang paling ideal adalah untuk perbanyakan klonal tanaman karet unggul secara massal sehingga bibit yang diperoleh tidak memerlukan batang bawah dan merupakan klon utuh (whole clone). Namun ternyata hal tersebut tidak mudah karena sebagian besar klon-klon karet yang direkomendasikan untuk ditanam dalam skala luas kurang responsif terhadap lingkungan kultur in vitro (Haris, 2013). Eksplan
Bahan tanaman yang dikulturkan lazim disebut eksplan. Dalam hal perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penting penentu keberhasilan. Umur fisiologis, umur otogenetik, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur (Yusnita, 2003).
dan zat pengatur tumbuh yang digunakan (dalam hal jenis zat pengatur tumbuh dan konsentrasinya), bagian tanaman yang dijadikan eksplan, lingkungan tumbuhnya (Gunawan, 1995).
Sumber asal eksplan dapat mempengaruhi pertumbuhan dan potensial morfogenetiknya. Eksplan yang berasal dari satu jenis organ misalnya, juga diketemukan adanya keragaman dalam regenerasinya. Ukuran eksplan untuk dikulturkan juga mempengaruhi keberhasilannya. Ukuran yang terlampau kecil akan kurang daya tahannya bila dikulturkan, sementara bila terlampau besar akan sulit mendapatkan eksplan yang steril. Setiap jenis tanaman maupun organ memiliki ukuran eksplan yang optimum untuk dikulturkan (Armini, dkk, 1992).
Ada beberapa informasi tentang mikropropagasi Hevea menggunakan eksplan yang berbeda, sebagian besar berasal dari bibit. Setelah itu, planlet dengan tunas dan akar berhasil dikembangkan oleh berbagai peneliti bernaman Gunatilleke, Carron, Sompong dan Muangkaewngam, Kyte dan Kleyn, Paranjothy dan Glandimethi yaitu diinduksi perakarannya di planlet yang berasal dari kultur jaringan, tetapi tidak dapat mematikan bahan dari klon, meskipun mereka regenerasi dari tunas dari tunas samping dari beberapa klon. Sebagian besar in vitro Hevea diarahkan melalui kultur pucuk, kultur nodus, embriogenesis somatik dan transformasi genetik (Dickson, dkk, 2011).
10-25 tahun, pertumbuhan normal dan sehat, penyadapan sesuai norma, luas blok minimal 15 ha, dan topografi relatif datar (Budiman, 2012).
Perbedaan diantara proliferasi tunas aksilar muda dan klon telah dilaporkan oleh Carron dkk pada tahun 1984 dimana proliferasi tunas yang tinggi peningkatannya pada bahan tanaman yang muda. Tanaman yang telah berhasil melalui kultur in vitro dari bahan klon sejak tahun 1985 oleh Carron meskipun tingkat proliferasi dari ini bahan belum dipublikasi (Seneviratne, dkk, 1998).
Eksplan pada tahap kultur primer merupakan potongan batang tanaman karet muda yang dipelihara dalam polibag di rumah kaca dan eksplan tersebut memiliki minimal satu mata tunas aksilar (axillary bud). Dalam kondisi in vitro, eksplan yang bebas dari kontaminan dan tumbuh baik dapat diperbanyak melalui subkultur berulang-ulang sehingga kultur primer merupakan tahap yang menentukan untuk keberhasilan dan keberlanjutan perbanyakan tanaman menggunakan teknologi tersebut (Haris, dkk, 2009).
Untuk mendapatkan bahan tanaman okulasi yang baik diperlukan entres yang baik dan dari kelompok klon anjuran. Klon-klon anjuran adalah klon-klon yang direkomendasikan untuk pertanaman komersial yang telah dilepas seperti :
a. Klon Penghasil Lateks : BPM 24, BPM 27, BPM 109, IRR 104, PB 217, dan PB 260.
b. Klon Penghasil Lateks Kayu : BPM 1, PB 330, PB 340, RRIC 100, AVROS 2037, IRR 5, IRR 32, IRR 39, IRR 42, IRR 112, dan IRR 118. c. Klon Penghasil Kayu : IRR 70, IRR 71, IRR 72, dan IRR 78.
digunakan dengan beberapa pertimbangan antara lain dengan memperhatikan kepentingan pengguna untuk penanaman klon tersebut pada wilayah tertentu dan spesifikasi tertentu (Budiman, 2012).
Media Kultur
Media tanam dalam kultur jaringan adalah tempat untuk tumbuh eksplan. Media tanam harus berisi semua zat yang diperlukan untuk menjamin pertumbuhan eksplan. Bahan-bahan yang diramu berisi campuran garam mineral, sumber unsur makro dan mikro, gula, protein, vitamin dan hormon tumbuh. Dengan demikian keberhasilan kultur jaringan jelas ditentukan oleh media tanam dan jenis tanaman. Campuran media yang satu mungkin cocok untuk jenis-jenis tanaman tertentu, tetapi tidak cocok untuk jenis-jenis tanaman lainnya (Hendaryono dan Wijayani, 1994).
Komponen media kultur yang lengkap ialah sebagai berikut :
1. Air destilasi (akuades) atau air bebas ion sebagai pelarut atau solven 2. Hara-hara makro dan mikro
3. Gula (umumnya sukrosa) sebagai sumber energi 4. Vitamin, asam amino, dan bahan organik lainnya 5. Zat pengatur tumbuh
6. Suplemen berupa bahan-bahan alami, jika diperlukan 7. Agar-agar atau gelrite sebagai pemadat media
(Yusnita, 2003).
tanaman lengkap. Pembentukan bagian tanaman (morfogenesis) langsung maupun tidak langsung tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, anorganik dan zat pengatur tumbuh dalam suatu media kultur (Wattimena, et al, 1992).
Media yang digunakan secara luas adalah media Murashige & Skoog (MS) yang dikembangkan pada tahun 1962. Dari berbagai komposisi dasar ini kadang-kadang dibuat modifikasi, misalnya hanya menggunakan ½ dari konsentrasi dari garam-garam makro yang digunakan (½ MS) atau menggunakan komposisi garam makro berdasarkan MS, tetapi mikro dan vitamin berdasarkan komposisi Heller. Zat pengatur tumbuh yang akan digunakan disesuaikan dengan tujuan inisiasi kultur (Gunawan, 1995).
Penelitian terhadap pengaruh komposisi medium kultur dapat dimulai, misalnya menggunakan medium dasar MS dengan mencoba berbagai taraf unsur-unsur makro, seperti ¼, ½. ¾, atau konsentrasi penuh (full strength). Apabila telah diperoleh hasil yang memuaskan maka dapat dilihat pula formulasi unsur-unsur makro atau komposisi ion dari medium lain dan dicoba untuk melihat perbedaannya (Zulkarnain, 2009).
Jika metode ini akan berhasil digunakan dalam propagasi Hevea, harus ada proliferasi cepat dari tunas dari eksplan (Gunatilleke dan Chandra, 1988).
Perbandingan produksi akar yang lebih baik telah diamati pada medium MS setengah yang tidak ditambahkan hormon daripada fitohormon yang telah dilengkapi dengan konsentrasi dan kombinasi yang berbeda yang menghasilkan pembentukan akar yang lebih sedikit. Oleh karena itu, medium MS setengah (tanpa hormon) dipertimbangkan lebih baik untuk produksi akar dibandingkan dengan media MS (Islam, et al, 2005).
Sukrosa sering ditambahkan pada medium kultur jaringan sebagai sumber energi yang diperlukan untuk induksi kalus. Sukrosa dengan konsentrasi 2%-5% merupakan sumber karbon. Penggunaan sukrosa di atas kadar 3% menyebabkan terjadinya penebalan dinding sel. Pengaruh rangsangan dari gula terhadap pertumbuhan ditentukan juga oleh cara sterilisasinya. Penggunaan autoklaf untuk sterilisasi dapat memberikan pengaruh baik atau buruk terhadap pertumbuhan,
tergantung dari gula yang digunakan dalam medium tersebut (Hendaryono dan Wijayani, 1994).
Tumbuhnya tunas aksilar dilihat dalam waktu satu minggu pada semua media dan tunas terminal tumbuh lebih cepat dari tunas aksilar. Daun membuka dan berubah menjadi hijau. Respon yang berulang pada setiap perlakuan yaitu variabel yang digunakan (Gunatilleke dan Chandra, 1988).
Lingkungan in Vitro
merupakan pencerminan dari kebutuhan periodisitas tanaman yang bersangkutan
di lapangan. Kualitas cahaya mempengaruhi arah diferensiasi jaringan (Yusnita, 2003).
pH adalah kondisi asam dan basa yang harus diatur sedemikian rupa sehingga tidak mengganggu fungsi membran sel dan pH dari sitoplasma. Pengaturan pH selain memperhatikan kepentingan fisiologis sel, juga harus mempertimbangkan faktor-faktor:
1. Kelarutan dari garam-garam penyusun media
2. Pengambilan dari zat pengatur tumbuh dan garam-garam lain. 3. Efisiensi pembekuan agar-agar
Sel-sel tanaman membutuhkan pH sedikit asam barkisar antara 5,5 – 5,8.
Pengaturan pH biasa dilakukan dengan menggunakan NaOH atau HCl (Gunawan, 1995).
Temperatur yang dibutuhkan untuk dapat terjadi pertumbuhan yang optimal umumnya adalah berkisar di antara 200-300C. Sedangkan temperatur optimum untuk pertumbuhan kalus endosperm adalah sekitar 250C. Faktor lingkungan, disamping faktor makanan (media tanam) yang cocok, dapat mempengaruhi pertumbuhan dan diferensiasi (Hendaryono dan Wijayani, 1994).
Lingkungan tumbuh yang dapat mempengaruhi regenerasi tanaman meliputi temperatur, penyinaran, kualitas panjang penyinaran, intensitas penyinaran, serta ukuran wadah kultur (Gunawan, 1995).
30μmol foton/m2/detik, kelembaban relatif berkisar antara 65-80%. Faktor pendukung lain pada lingkungan in vitro ialah pencegahan kontaminasi yang tinggi mencapai 60% melalui salah cara yaitu pengganti hefa filter pada Laminar Air Flow Cabinet dan Air Conditioner ruangan selama 6 bulan sekali.
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis (Wattimena, et al, 1992).
Pengaruh auksin dan hormon tumbuhan lainnya dalam mengatur pertumbuhan atau pembentukan daun belum diketahui dengan jelas. Sedangkan kerja atau peranan sitokinin sendiri belum dimengerti dan tidak cukup bukti-bukti
yang jelas untuk menguatkan hasil dari suatu proses biokimia (Davies, 1987).
dalam hal jenis takaran auksin dan sitokinin untuk menginduksi terjadinya morfogenesis (Kyte,1983;Torres,1989) (Zulkarnain, 2009).
Pertumbuhan tanaman secara alami dikendalikan oleh hormon endogen dan hormon ini terdapat pada tanaman dalam jumlah yang kecil. Pemberian senyawa-senyawa sintetik tersebut akan mengubah keseimbangan hormon dalam tanaman hingga menimbulkan suatu respon tertentu (Manurung, 1995).
Melalui spesifikasinya, bahan kimia untuk tambahan dalam merangsang perakaran yang telah teruji di banyak genera, ketika tingkat dari nutrisi yang cukup tinggi dan tidak terbatas. Berbagai auksin yang aktif yaitu IAA, IBA, dan NAA. Ternyata, IBA sering lebih efektif daripada IAA. Baik IAA dan IBA merupakan auksin perangsang perakaran. IBA menyediakan keberhasilan total yang lebih terhadap perakaran daripada IAA. Karena IAA itu sendiri, perakarannya terstimulasi dengan rangsangan yang lebih besar lagi yang harus dilanjutkan dengan produksi dari etilen (Jacob, 1979).
Auksin yang paling banyak digunakan pada kultur in vitro adalah indole-3 acetic acid (IAA), α-naphthalencetic acid (α-NAA), dan
namun senyawa ini mudah mengalami degradasi akibat pengaruh cahaya dan oksidasi enzimatik (Zulkarnain, 2009).
Gunawan (1995), mengemukakan bahwa level auksin dalam eksplan tergantung dari bagian tanaman yang diambil dan jenis tanamannya. Oleh karena itu sulit untuk menentukan suatu formula terbaik pada setiap penggunaan. Golongan auksin yang sering ditambahkaa adalah 2,4-D, IAA, NAA, dan IBA. (Hendaryono dan Wijayani, 1994). ZPT bila diberikan dalam konsentrasi tinggi akan menghambat pertumbuhan tanaman.
Sitokinin (BAP) berfungsi sebagai perangsang pertumbuhan tunas, berpengaruh terhadap metabolisme sel, pembelahan sel, merangsang sel, mendorong pembentukan buah dan biji, mengurangi dormansi apikal, serta mendorong inisiasi tunas lateral (Wattimena, et al, 1992).
Sitokinin merupakan nama kelompok hormon tumbuh yang sangat penting sebagai pemacu pertumbuhan dan morfogenesis dalam kultur jaringan seperti halnya pada auksin, selain sitokinin alami juga terdapat sintetisnya yang tergolong dalam zat pengatur tumbuh (Santoso dan Fatimah, 2005).
Auksin umumnya menghambat pertumbuhan tunas, sedangkan kombinasi konsentrasi sitokinin yang tinggi dengan auksin rendah penting dalam pembentukan tunas dan daun. Dalam kultur jaringan kedua golongan zat pengatur tumbuh ini terbukti berperan dalam menunjang pertumbuhan jaringan apabila digunakan pada konsentrasi yang tepat (Fereol, et al., 2002)
ZPT dari golongan sitokinin yang sering dipakai dalam kultur jaringan yaitu BAP (6-benzylaminopurine). 6-Benzilaminopurine (BAP) merupakan salah satu sitokinin sintetik yang aktif dan daya merangsangnya lebih lama karena tidak mudah dirombak oleh enzim dalam tanaman. Penggunaan BAP dengan konsentrasi tinggi dan masa yang panjang dapat menentukan kemampuan pembentukan jumlah tunas dan bentuk tunas. Pada konsentrasi BAP yang lebih tinggi dan masa induksi yang lebih lama menyebabkan penampakan abnormal dan menyebabkan penurunan jumlah regenerasi yang diperoleh (Gunawan, 1995).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur In Vitro PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi,
Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan April 2014 sampai dengan Juni 2014.
Bahan dan Alat
Bahan eksplan yang digunakan dalam penelitian ini adalah nodus dari bahan tanaman karet yang berasal dari rumah kaca, larutan stok media MS sebagai media tumbuh tanaman, NAA dan BAP sebagai zat pengatur tumbuh (ZPT) yang digunakan, eksplan yang digunakan dengan panjang 2 – 2.5 cm. Bahan penyusun media MS, BAP, NAA, agar microbiology, aquadest steril, dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur, hot plate dengan magnetik stirer, erlenmeyer, gelas ukur, kaca tebal, pipet ukur, pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, aluminium foil, kompor gas, minisar, mikropipet, tip, pipet tetes, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan penambahan zat pengatur tumbuh, sebagai berikut : A1 : 0.5 mg/l BAP + 0 mg/l NAA
A3 : 0.5 mg/l BAP + 0.25 mg/l NAA A4 : 0.5 mg/l BAP + 0.5 mg/l NAA A5 : 1 mg/l BAP + 0 mg/l NAA A6 : 1 mg/l BAP + 0.1 mg/l NAA A7 : 1 mg/l BAP + 0.25 mg/l NAA A8 : 1 mg/l BAP + 0.5 mg/l NAA A9 : 1.5 mg/l BAP + 0 mg/l NAA A10 : 1.5 mg/l BAP + 0.1 mg/l NAA A11 : 1.5 mg/l BAP + 0.25 mg/l NAA A12 : 1.5 mg/l BAP + 0.5 mg/l NAA A13 : 2 mg/l BAP + 0 mg/l NAA A14 : 2 mg/l BAP + 0.1 mg/l NAA A15 : 2 mg/l BAP + 0.25 mg/l NAA A16 : 2 mg/l BAP + 0.5 mg/l NAA Jumlah perlakuan : 16 Jumlah ulangan : 6 Jumlah eksplan tiap botol : 1 Jumlah seluruh eksplan : 96 Jumlah seluruh tanaman : 96
Model statistika yang digunakan sebagai berikut:
Yij = m + Ti + ε ij
i = 1,2,3…16 j = 1,2,3…6
m = Nilai tengah umum
Ti = Pengaruh perlakuan BAP dan NAA ke-i
εij = Pengaruh galat percobaan dari perlakuan BAP dan NAA ke-i dan ulangan ke-j.
PELAKSANAAN PENELITIAN
Sterilisasi Alat
Alat-alat dissecting-set dan glass ware yang akan digunakan untuk kultur in vitro dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan panas atau letakkan pada rak tabung, sedangkan untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan tabung/botol dengan autoklaf pada tekanan 1 atm dan suhu 121oC selama 60 menit. Setelah itu sterilkan secara kering tabung/botol di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media Murashige and Skoog (MS) padat. Sebelum dilakukan pembuatan media MS, dilakukan pembuatan larutan stok hormon BAP dan NAA. Larutan stok hormon masing-masing dibuat 100mg/100ml. Larutan stok BAP dan NAA disaring menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
meter. pH yang dikehendaki adalah 5,8, ntuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan NaOH dan HCl 0,1 N. Letakkan agar microbiology dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 5000ml dan ditutup dengan aluminium foil. Hasil Media MS secara keseluruhan di sterilisasi dengan tekanan 1 atm pada suhu 121°C selama 1 jam 30 menit di autoklaf. Setelah proses sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan ke ruangan Laminar Air Flow Cabinet (LAFC) untuk dibagikan ke 16 tabung erlenmeyer berukuran 500ml dengan masing-masing tabung berisi 250ml. Teteskan BAP dan NAA ke masing-masing tabung uji sesuai perlakuan. Lalu setiap perlakuan ditepatkan hingga masing-masing perlakuan menjadi 300ml. Dituangkan media ke dalam tabung uji berisikan 13ml/tabung dan ditutup kain kasa steril yang dibalut dan diikat benang. Sehingga didapat ± 23 tabung uji. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Sterilisasi Bahan Tanaman di Lapangan
Pengambilan Bahan Tanaman
Bahan tanaman yang digunakan ialah yang telah diberikan fungisida berbahan kimia mankozeb. Bahan tanaman yang digunakan ialah bibit karet yang telah latern (daun terbuka sempurna) dan berwarna hijau terang, batang tanaman kokoh dan berwarna hijau, serta berpayung dua. Batang bawah dari tanaman karet itu sendiri berasal dari seedling klon karet tertentu yang selanjutnya diokulasi menghasilkan genotipe 85 (kodefikasi genotipe dari Balai Penelitian Karet Sungei Putih). Bagian yang diambil ialah buku-buku entres yang digunakan sebagai bahan eksplan.
Sterilisasi Bahan Tanaman di Laboratorium
Sterilisasi di laboratorium ialah dengan mencuci bahan tanaman menggunakan air mengalir dengan menggunakan kuas untuk menghilangkan olesan dithane. Bilas eksplan dengan cara memasukkan eksplan ke dalam tabung toples kemudian diisi alkohol 70% dan diguncang selama 1 menit. Rendam eksplan ke dalam tabung toples berisi larutan H2O2 dengan konsentrasi 17% selama 20 menit. Setelah selesai larutan tersebut dibuang, tabung toples diisi aquadest dan diguncang selama 1 menit dan dibuang kembali. Rendam kembali eksplan dengan aquadest di dalam tabung toples selama 2 x 15 menit. Kemudian air tersebut dibuang dari tabung toples.
Persiapan Ruang Tanam
alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi. Steri box dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Penanaman
Eksplan yang digunakan adalah nodus dari bahan tanaman karet yang telah di sterilisasi sebelumnya. Kemudian nodus-nodus disterilasi dengan standar yang dimiliki Laboratorium In Vitro Kebun Gunung Pamela, lalu langsung ditanam pada tabung uji yang sudah berisikan agar sebanyak 13 ml/tabung uji. Eksplan yang digunakan berukuran 2 – 2.5 cm, apabila ukuran eksplan belum sesuai maka dipotong menggunakan gunting steril dan tajam. Eksplan yang akan dikulturkan ke dalam media tanam diletakkan di piringan kaca tebal dengan alas kertas plano. Kemudian eksplan ditanamkan ke dalam tabung uji sesuai dengan perlakuan, setiap tabung uji terdiri dari 1 eksplan. Kemudian ujung tabung uji ditutup dengan menggunakan kain kasa steril yang dibalut dan diikat benang. Kegiatan penanaman dilakukan di LAFC dan di bawah api bunsen. Tabung uji diletakkan di rak kultur di bawah cahaya dan ruangan memiliki air conditioner dengan suhu 18oC.
Pemeliharaan Eksplan
cahaya 2000 lux serta dengan kondisi ruangan memiliki air conditioner dengan hefa filter yang dibersihkan setiap 6 bulan sekali. Apabila mengalami kontaminasi, segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Peubah Amatan
Persentase Munculnya Tunas (%)
Pengamatan dilakukan pada akhir percobaan berdasarkan jumlah tunas yang muncul dari keseluruhan ulangan.
Persentase munculnya tunas = jumlah daun yang terbentuk
jumlah eksplan seluruhnya (per perlakuan) x 100%
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian dengan menghitung jumlah tunas baru yang terbentuk dari setiap eksplan dan jumlah tunas baru yang terbentuk dibagi dengan jumlah ulangan.
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi. Panjang tunas keseluruhan dari setiap perlakuan dibagi dengan jumlah ulangan. Pengukuran dilakukan pada akhir penelitian.
Persentase Terbentuknya Daun (%)
Pengamatan dilakukan pada akhir percobaan berdasarkan jumlah daun yang terbentuk dari setiap eksplan.
Persentase terbentuknya daun = jumlah daun yang terbentuk
Jumlah Daun (helai)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna pada eksplan yang dilakukan pada akhir percobaan.
Umur Muncul Tunas (hari)
HASIL DAN PEMBAHASAN
Hasil
Dari hasil analisis data yang dilakukan, diperoleh bahwa pemberian kombinasi BAP dan NAA berpengaruh sangat nyata terhadap persentase munculnya tunas, jumlah tunas, panjang tunas, dan umur munculnya tunas dan hingga 6 MST, sedangkan pemberian BAP dan NAA yang tidak berpengaruh nyata terhadap peubah amatan jumlah daun dan persentase terbentuknya daun.
Persentase Munculnya Tunas (%)
Data pengamatan dan sidik ragam persentase umur munculnya tunas dapat dilihat pada Lampiran 1-3. Dari tabel sidik ragam diketahui bahwa perlakuan dari kombinasi konsentrasi BAP dan NAA secara keseluruhan berpengaruh nyata terhadap persentase munculnya tunas. Rataan persentase munculnya tunas dari perlakuan kombinasi BAP dan NAA dapat dilihat pada Tabel 1.
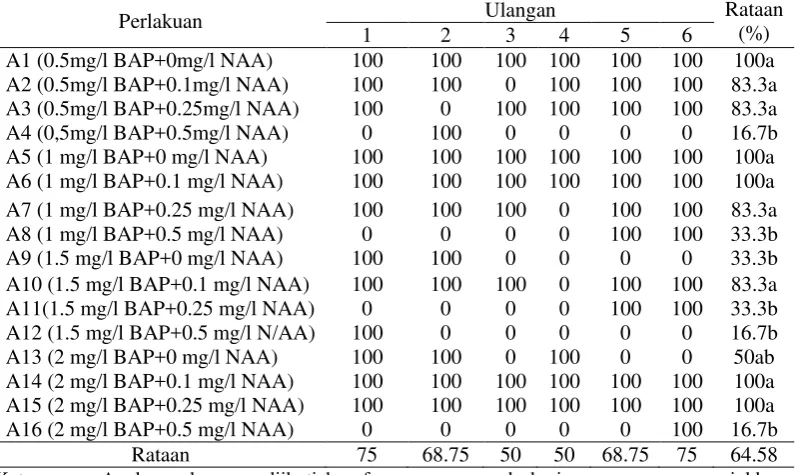
Tabel 1. Persentase munculnya tunas (%) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 6 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
(%)
a. b.
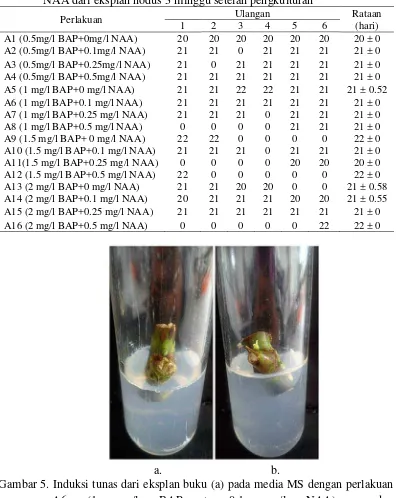
Gambar 2. Induksi tunas dari eksplan buku pada media MS dengan perlakuan
(a) A10 (1.5 mg/l BAP + 0.1 mg/l NAA) dan (b) A12 (1.5 mg/l BAP + 0.5 mg/l NAA) setelah 6 MST.
Tabel 1. dapat dilihat bahwa persentase munculnya tunas pada pemberian kombinasi BAP dan NAA terdapat pada perlakuan A1, A2, A3, A5, A6, A7, A10, A14, A15 berbeda nyata dengan perlakuan A4, A8, A9, A11, A12, A16 dan tidak berpengaruh nyata terhadap perlakuan A13.
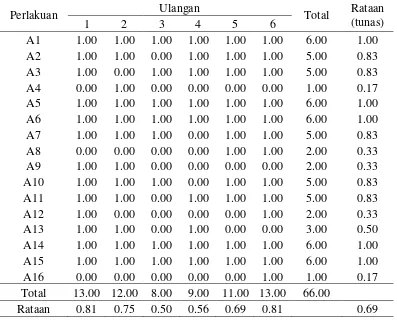
Jumlah Tunas (tunas)
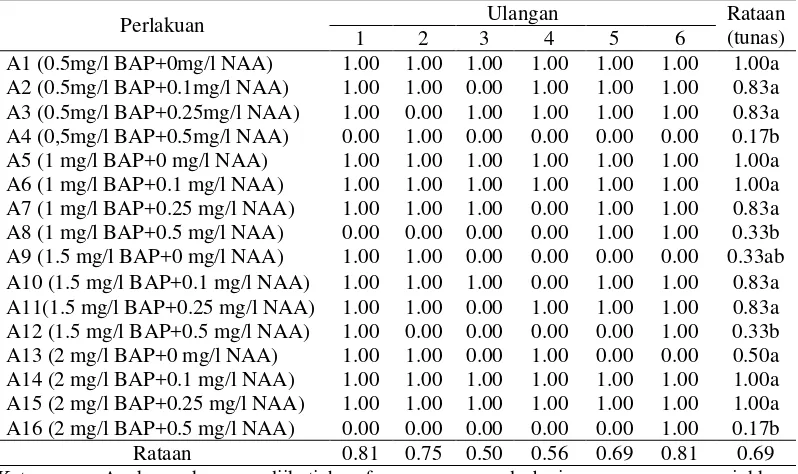
Tabel 2. Jumlah tunas (tunas) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 6 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
(tunas)
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %.
Tabel 2. dapat dilihat bahwa jumlah tunas dalam pemberian kombinasi BAP dan NAA terdapat pada perlakuan A1, A2, A3, A5, A6, A7, A10, A11, A13, A14, A15 berbeda nyata dengan perlakuan A4, A8, A12, A16 dan tidak berpengaruh nyata terhadap perlakuan A9.
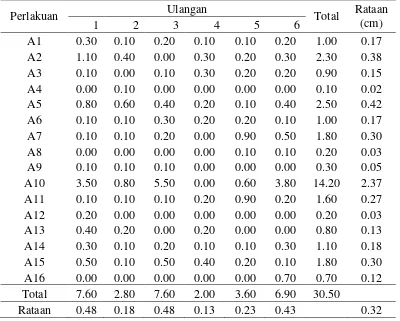
Panjang Tunas (cm)
Tabel 3. Panjang tunas (cm) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 6 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
(cm)
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %.
a. b.
Gambar 3. Induksi tunas dari eksplan buku pada media MS dengan perlakuan
(a) A10 (1.5 mg/l BAP + 0.1 mg/l NAA) dan (b) A15 (2 mg/l BAP + 0.25 mg/l NAA) setelah 6 MST.
nyata dengan perlakuan lainnya. Selain dari perlakuan A10, semua perlakuan lainnya tidak berbeda nyata.
Persentase Terbentuknya Daun (%)
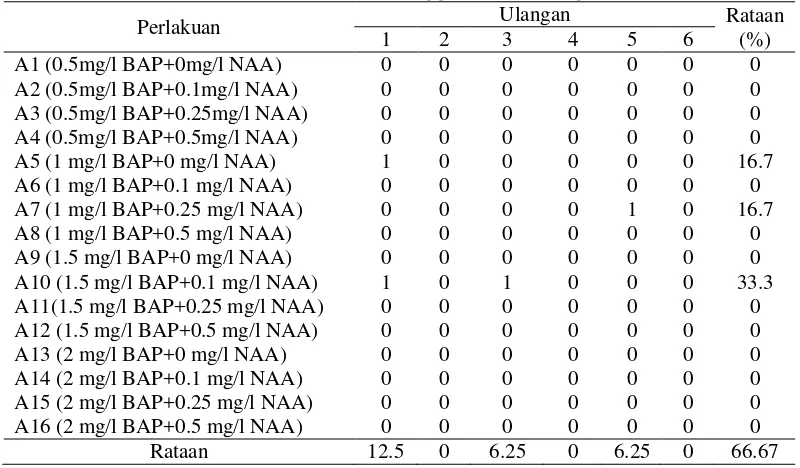
Data pengamatan persentase terbentuknya daun dapat dilihat pada Lampiran 10-12. Dari hasil pengamatan ditandai dengan terbentuknya daun dari setiap eksplan. Rataan persentase terbentuknya daun dari perlakuan kombinasi BAP dan NAA dapat dilihat pada Tabel 4.
Tabel 4. Persentase terbentuknya daun (%) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 6 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
(%)
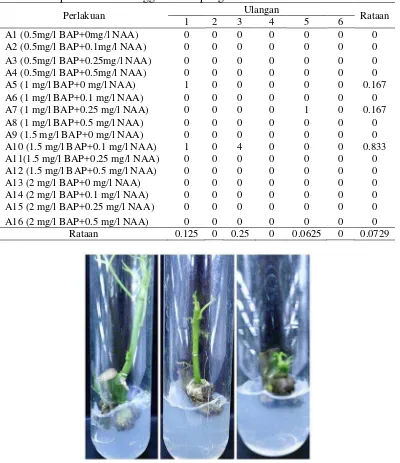
Tabel 5. Jumlah daun (helai) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 6 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
1 2 3 4 5 6
Gambar 4. Induksi ketiga tunas dari eksplan buku (nodus) pada media MS dengan perlakuan A10 (1.5 mg/l BAP + 0.1 mg/l NAA) setelah 6 MST.
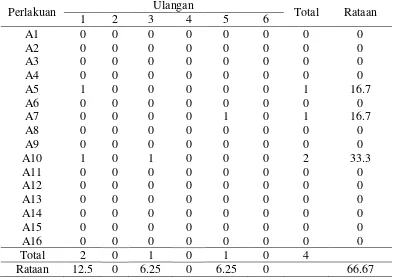
Umur Munculnya Tunas(hari)
Tabel 6. Umur munculnya tunas (hari) dalam medium MS + kombinasi BAP dan NAA dari eksplan nodus 3 minggu setelah pengkulturan
Perlakuan Ulangan Rataan
(hari)
1 2 3 4 5 6
A1 (0.5mg/l BAP+0mg/l NAA) 20 20 20 20 20 20 20 ± 0
A2 (0.5mg/l BAP+0.1mg/l NAA) 21 21 0 21 21 21 21 ± 0
A3 (0.5mg/l BAP+0.25mg/l NAA) 21 0 21 21 21 21 21 ± 0
A4 (0.5mg/l BAP+0.5mg/l NAA) 21 21 21 21 21 21 21 ± 0
A5 (1 mg/l BAP+0 mg/l NAA) 21 21 22 22 21 21 21 ± 0.52
A6 (1 mg/l BAP+0.1 mg/l NAA) 21 21 21 21 21 21 21 ± 0
A7 (1 mg/l BAP+0.25 mg/l NAA) 21 21 21 0 21 21 21 ± 0
A8 (1 mg/l BAP+0.5 mg/l NAA) 0 0 0 0 21 21 21 ± 0
A9 (1.5 mg/l BAP+ 0 mg/l NAA) 22 22 0 0 0 0 22 ± 0
A10 (1.5 mg/l BAP+0.1 mg/l NAA) 21 21 21 0 21 21 21 ± 0
A11(1.5 mg/l BAP+0.25 mg/l NAA) 0 0 0 0 20 20 20 ± 0
A12 (1.5 mg/l BAP+0.5 mg/l NAA) 22 0 0 0 0 0 22 ± 0
A13 (2 mg/l BAP+0 mg/l NAA) 21 21 20 20 0 0 21 ± 0.58
A14 (2 mg/l BAP+0.1 mg/l NAA) 20 21 21 21 20 20 21 ± 0.55 A15 (2 mg/l BAP+0.25 mg/l NAA) 21 21 21 21 21 21 21 ± 0
A16 (2 mg/l BAP+0.5 mg/l NAA) 0 0 0 0 0 22 22 ± 0
a. b.
Gambar 5. Induksi tunas dari eksplan buku (a) pada media MS dengan perlakuan
Pembahasan
Pengaruh pemberian BAP dan NAA terhadap induksi tunas tanaman karet
Dari hasil analisis data statistik dapat diketahui bahwa perlakuan kombinasi
BAP dan NAA berbeda nyata terhadap peubah amatan persentase munculnya tunas,
jumlah tunas, panjang tunas, umur munculnya tunas dan tidak berbeda nyata terhadap
peubah amatan persentase terbentuknya daun dan jumlah daun. Hal ini terlihat dari
rataan setiap peubah amatan.
Dari hasil penelitian yang telah dilakukan dapat diperoleh bahwa persentase munculnya tunas pada tanaman karet bervariasi pada setiap perlakuan.
Pada peubah amatan ini, rataan tertinggi terdapat pada perlakuan A1 (0,5 mg/l BAP+ 0 mg/l NAA), A5 (1 mg/l BAP + 0 mg/l NAA), A6 (1 mg/l BAP + 0.1 mg/l NAA), A14 (2 mg/l BAP + 0.1 mg/l NAA), A15 (2 mg/l BAP + 0.25 mg/l NAA) yaitu sebanyak 100% dan rataan terendah
terdapat pada perlakuan A4 (0.5 mg/l BAP + 0.5 mg/l NAA), A12 (1.5 mg/l BAP + 0.5mg/l NAA), A16 (2 mg/l BAP + 0.5 mg/l NAA). Hal ini
tanaman dalam jumlah yang kecil. Pemberian senyawa-senyawa sintetik tersebut akan mengubah keseimbangan hormon dalam tanaman hingga menimbulkan suatu respon tertentu.
Pada peubah amatan jumlah tunas dengan pemberian kombinasi konsentrasi BAP dan NAA pada perlakuan A1 (0,5 mg/l BAP + 0 mg/l NAA),
A5 (1 mg/l BAP + 0 mg/l NAA), A6 (1 mg/l BAP + 0.1 mg/l NAA), A14 (2 mg/l BAP + 0.1 mg/l NAA), A15 (2 mg/l BAP + 0.25 mg/l NAA)
memiliki rataan jumlah tunas sebanyak 1 tunas. Dari seluruh perlakuan tersebut diketahui bahwa seluruh konsentrasi BAP (sitokinin) berpengaruh terhadap pembentukan tunas dan didukung dengan konsentrasi NAA (auksin) yang tidak terlalu tinggi, karena auksin biasanya bersifat menghambat kehadiran tunas. Menurut Wattimena, et al, (1992) bahwa sitokinin berfungsi sebagai perangsang pertumbuhan tunas, berpengaruh terhadap metabolisme sel. Dan yang diungkapkan oleh Fereol, et al, (2002) auksin umumnya menghambat pertumbuhan tunas, sedangkan kombinasi konsentrasi sitokinin yang tinggi dengan auksin yang rendah penting dalam pembentukan tunas dan daun. Sehingga kedua golongan zat pengatur tumbuh ini berperan dalam menunjang pertumbuhan jaringan apabila pada konsentrasi yang tepat.
panjang tunas. Karena menurut Gunawan (1985) level auksin dalam eksplan tergantung bagian tanaman yang diambil dan jenis tanamannya. Sehingga sulit menetukan formula terbaik pada setiap penggunaan. Armini, et al, (1991) menambahkan bahwa sitokinin dan auksin memiliki peranan yang sangat penting dalam menginduksi tunas adventif. Nisbah keduanya akan menentukan pembentukan tunas adventif dan akar.
Dari hasil analisis data secara statistik diketahui bahwa persentase terbentuknya daun pada kombinasi BAP dan NAA belum meunjukkan pengaruh yang nyata. Hal ini diduga akibat pemberian zat pengatur tumbuh belum sesuai untuk mendukung proses terbentuknya daun.Walaupun Gunatilleke dan Chandra (1988) telah menyatakan bahwa tumbuhnya tunas terminal lebih cepat dari tunas aksilar, daun membuka dan berubah menjadi hijau. Namun pada perlakuan yang diberikan belum ada yang mendukung terbentuknya daun secara sempurna. Karena dalam penetuan kombinasi zpt bukanlah hal yang mudah. Fereol, et al, (2002) menyatakan bahwa kombinasi konsentrasi sitokinin tinggi dengan auksin yang rendah penting dalam pembentukan tunas dan daun. Dalam kultur jaringan kedua golongan zpt ini terbukti berperan dalam menunjang pertumbuhan jaringan apabila digunakan dalam konsentrasi yang tepat.
eksplan karet. Menurut Davies (1987) bahwa pengaruh auksin dan hormon tumbuhan lainnya dalam mengatur pertumbuhan atau pembentukan daun belum diketahui dengan jelas. Sedangkan kerja atau peranan sitokinin sendiri belum dimengerti dan tidak cukup bukti-bukti yang jelas untuk menguatkan hasil dari suatu proses biokima.
Dari hasil analisi data secara statistik pada peubah amatan umur munculnya tunas diperoleh rataan munculnya tunas berkisar 20-22 hari setelah tanam atau pada umur 3 MST. Menurut Gunatilleke dan Chandra (1988) pada penelitiannya bahwa tumbuhnya tunas aksilar dilihat dalam waktu satu minggu pada semua media dan tunas terminal tumbuh lebih cepat dari tunas aksilar. Namun pengaruh kombinasi konsentrasi BAP dan NAA juga sangat mempengaruhi umur munculnya tunas tersebut, karena Gunawan (1995) menyatakan bahwa BAP merupakan salah satu sitokinin sintetik yang aktif dan memiliki daya rangsang yang lama karena tidak mudah dirombak oleh enzim dalam tanaman.
Hendaryono dan Wijayani (1994) bahwa ZPT bila diberikan dalam konsentrasi tinggi akan menghambat pertumbuhan tanaman.
Dari hasil analisis data secara statistik diketahui bahwa pada pemberian
konsentrasi BAP yang rendah (0,5 mg/l) yang dikombinasikan dengan NAA (0 mg/l, 0.1 mg/l, 0.25 mg/l, 0.5 mg/l) cenderung memberikan pengaruh
yang nyata terhadap jumlah tunas. Pada konsentrasi BAP (1 mg/l) yang dikombinasikan dengan NAA (0 mg/l, 0.1 mg/l, 0.25 mg/l, 0.5 mg/l) memberikan pengaruh yang nyata terhadap persentase munculnya tunas dan jumlah tunas.
Pada konsentrasi BAP (1.5 mg/l) yang yang dikombinasikan dengan NAA (0 mg/l, 0.1 mg/l, 0.25 mg/l, 0.5 mg/l) menunjukkan hasil pada panjang
lainnya, termasuk auksin baik dalam efek menghambat maupun efek yang mendorong pembelahan sel.
Dari hasil analisis data secara statistik diketahui bahwa pada pemberian konsentrasi NAA (0.5 mg/l) dengan seluruh kombinasi BAP memberikan pengaruh yang tidak nyata terhadap seluruh peubah amatan. Hal ini dikarenakan auksin umumnya menghambat pertumbuhan tunas bila dalam konsentrasi yang terlalu tinggi. Sehingga antara sitokinin dan auksin tidak saling menunjang pertumbuhan jaringan. Menurut Zulkarnain (2009) auksin disintesis secara alamiah di dalam tubuh tanaman, namun senyawa ini mudah mengalami degradasi akibat pengaruh cahaya dan oksidasi enzimatik. Sehingga menyebabkan NAA ini tidak menunjukkan pengaruh yang baik pada seluruh perlakuan.
Dari hasil penelitian didapat bahwa teknik microcutting menggunakan jaringan meristem mendapatkan hasil yang baik. Teknik ini mempermudah pemulia tanaman dalam mempercepat pencapaian hasil tanaman dan sistem perakaran tanaman pada teknik ini menyerupai sistem perakaran tanaman karet secara konvensional. Hal ini didukung oleh literatur Hendaryono dan Wijayani (1994) menyatakan kultur jaringan lebih besar persentase keberhasilannya bila menggunakan jaringan meristem yang merupakan jaringan muda yang selalu membelah, dindingnya tipis belum mempunyai penebalan dari zat pectin, sehingga diperkiran mempunyai zat hormon yang mengatur pembelahan.
memiliki zat phenolat yang tinggi, sehingga dianjurkan setelah pemotongan eksplan tidak dibiarkan dalam jangka waktu yang lama karena akan merusak jaringan tanaman karet. Pengaturan pH dan temperatur merupakan faktor utama dari lingkungan in vitro sebagai pemicu kebehasilan. Hal ini didukung oleh literatur Hendaryono dan Wijayani (1994) menyatakan sel-sel tanaman membutuhkan pH sedikit asam antara 5,5-5.8 dengan temperatur yang dibutuhkan berkisar 20o-30o C. dengan temperatur optimum untuk pertumbuhan kalus adalah sekitar 25oC. Faktor lain diperkuat dengan pernyataan Yusnita (2003) cahaya
dinyatakan dengan dimensi lama penyinaran, intensitas dan kualitasnya. Prof Murashige menyarankan untuk mengasumsikan kebutuhan lama penyinaran.
Kualitas cahaya mempengaruhi arah diferensiasi jaringan.
pada perlakuan 0.075 mg/l BAP dan 0.01 mg/l NAA, Dickson, dkk menyatakan harus lebih banyak lagi penemuan yang dilakukan untuk mendapatkan paduan yang tepat dalam propagasi karet serta penggunaan sitokinin dan auksin yang tidak terlalu tinggi pada media MS.
Dari hasil penelitian diperoleh kombinasi BAP dan NAA yang terbaik dalam induksi tunas tanaman karet yang terdapat pada konsentrasi BAP 1 mg/l + NAA 0 mg/l pada medium MS. Kombinasi ini menghasilkan jumlah tunas dengan rataan yaitu 1 buah tunas, panjang tunas dengan rataan yaitu 0.42 cm, serta umur munculnya tunas yang tepat dengan rataan ±21 hari.. Hal ini menunjukkan bahwa pada pemberian konsentrasi BAP yang tidak terlalu tinggi dan tanpa pemberian auksin memberikan hasil yang baik. Terbukti bahwa tidak diperlukan konsentrasi auksin yang tinggi guna mencegah terjadinya hambatan pertumbuhan tunas dan daun. Hal ini sesuai dengan pernyataan Fereol, et al., (2002) yang menyatakan bahwa auksin umumnya menghambat pertumbuhan tunas, sedangkan kombinasi konsentrasi sitokinin yang tinggi dengan auksin rendah penting dalam pembentukan tunas dan daun. Dalam kultur jaringan kedua golongan zat pengatur tumbuh ini terbukti berperan dalam menunjang pertumbuhan jaringan apabila digunakan pada konsentrasi yang tepat. Ditambah pernyataan Wattimena, et al, (1992) yang menyatakan bahwa aktivitas sitokinin tergantung juga dari aktivitas fitohormon lainnya, terutama auksin, baik dalam efek menghambat maupun efek mendorong pembelahan sel.
KESIMPULAN DAN SARAN
Kesimpulan
BAP dan NAA menunjukkan bahwa zat pengatur tumbuh pada golongan ini tepat dengan interval konsentrasi yang sesuai.
Kombinasi konsentrasi BAP 0.5 mg/l, 1 mg/l, 1.5 mg/l, dan 2 mg/l dengan NAA 0 mg/l, 0.1 mg/l, 0.25 mg/l, dan 0.5 mg/l pada media MS menunjukkan pengaruh yang berbeda nyata terhadap persentase munculnya tunas, jumlah tunas, panjang tunas dan umur munculnya tunas, dengan hasil terbaik pada perlakuan A5 (BAP 1 mg/l + NAA 0 mg/l).
Pemberian kombinasi perlakuan BAP 1.5 mg/l dan NAA 0.1 mg/l memberikan respon panjang tunas yang baik dan terjadinya pertumbuhan daun.
Saran
DAFTAR PUSTAKA
Armini, A.N. M., Wattimena dan Gunawan L.W., 1991. Perbanyakan Tanaman Bioteknologi Tanaman Laboratorium Kultur Jaringan. Departemen Pendidikan dan Kebudayaan Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor.
., 1992. Zat Pengatur Tumbuh. Hal 150-200. Dalam: Tim Laboratorium Kultur Jaringan Tanaman (Eds.). Bioteknologi Tanaman 1. Pusat Antar Universitas. Insitut Pertanian Bogor. Bogor.
Budiman, H., 2012. Budidaya Karet Unggul Prospek Jitu Investasi Masa Depan. Pustaka Baru Press. Yogyakarta.
Budi, R.S dan Chairani., 2010. Pengujian Konsentrasi Zat Pengatur Tumbuh Auksin dan Pupuk Daun Terhadap Pertumbuhan Mata Okulasi Tanaman Karet (Hevea brasiliensis Muell. Arg.) - Jurnal Penelitian Bidang Ilmu PErtanian Vol.9 No.2 Agustus 2011. FP UISU, Medan.
Boerhendhy, I., 2009. Pengelolaan Biji Karet untuk Bibit Warta Penelitian dan Pengembangan Pertanian Vol. 31 No.5, 2009. Balai Penelitian Sembawa, Palembang.
Davies, P.J., 1987. The Plant Hormones. Their Nature. Machmilan Publishing Company, New York.
Dickson, I., Anthony, O., Jammadire, E., Olay ode, M., Fajimi, O., dan Sunday, A., 2011. Full Length Research Paper In vitro Culture of Hevea brasiliensis (Rubber Tree) Embryo. J. of Pla Breed and Crop Sci Vol. 3(9), pp.185-189, Sept 2011. Available online Biotechnology, National Centre for Genetic Resources and Biotechnology, Oyo State. Nigeria.
Fereol, L., Chovelon , V., Causse, S., Michaux-Ferriere, N., and Kahane R. 2002. Evidence of Somatic Embryogenesis Process for Plant Regeneration in Garlic (Allium sativum L). Plant Cell Reports. 21: 197-203.
Gunawan, L.W., 1995. Teknik Kultur Jaringan In Vitro dalam Hortikultura. Penebar Swadaya. Jakarta.
Gunnatilleke, I.D. dan Chandra Samaranayake., 1988. Shoot Tip Culture as a Method of Micropropagation of Hevea. Diakses dari Http://dl.nsf.ac.lk. Hartmann, H.T., Dale E.K., Fred T.D., dan Robert L.G., 2002. Plant Propagation
Hendaryono, D. P. S., dan A. Wijayani., 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Secara Vegetatip. Kanisius, Yogyakarta.
Indraty, I.S., 2009. Faktor Kunci mengelola Klon dan Entres Karet. Balai Penelitian Getas, Salatiga.
Islam, M. A., H. Zubair, N. Imtiaz, M. F. Chauhary. 2005. Effect of Different Plant Growth Regulators for the Economical Production of in Vitro Root Cultures of Cicer arietinum L. International Journal Agriculture and Biology.
Jacob. 1979. Plant Hormones and Plant Development. Cambridge University Press, USA.
Janick, J., 2007. Hevea Rubber Breeding and Genetics. Vol 29 (4), Hal 177-283, ISBN 0-470-05241-9-2007. John Wiley & Sons, Inc.
Mahardika, A., 2013. Cermat Memilih Benih Dalam Menghasilkan Benih Karet Bermutu (Hevea brasiliensis). Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan. Surabaya.
Manurung, S. O. 1995. Penggunaan Hormon dan Zat Pengatur Tumbuh pada Kedelai. Badan Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan pengembangan Tanaman pangan, Bogor.
Mendanha A BL, de Almeida Torres RA, de Barros Freire A., 1998. Micropropagation of Rubber Tree (Hevea brasiliensis Muell. Arg.) Genetics and Molecular Biology pg.21, 1415.
Montoro, P., M.P.Carron, Francoise G., Ludovic L., dan Julie L., 2012. Development of New Varietal Types Based on Rejuvenation by Somatic Embryogenesis and Propagation by Conventional Budding or Microcutting in Hevea brasilienasis.
Muluk, C., 2009. Pengembangan Teknologi Microcutting Untuk Perbanyakan Bahan Tanam Karet di PT Perkebunan Nusantara III. Prosiding Lokakarya Nasional Pemuliaan Tanaman Karet 2009, PT Perkebunan Nusantara III. Gunung Pamela.
Nasir, M., 2000. Bioteknologi. Potensi Keberhasilannya dalam Bidang Pertanian. RajaGrafindo Persada. Jakarta.
Haris, N., 2013. Batang Bawah Klonal : Apakah Mungkin pada Tanaman Karet?.
Kyte, L. 1983. Plant from Test Tubes: An Introduction to Micropropagation. Portland, Oregon : Timber Press.
Pratama, A., 2008. Behavior of Sevral Genotypes During Microcutting Process in Rubber Plant (Hevea brasiliensis). IPB Journal. Bogor.
Pustaka Litbang Deptan. 2012. Pengelola Biji Karet Untuk Bibit. Diakses dari
Santoso, U., dan Fatimah, N., 2005. Kultur Jaringan Tanaman. UMM Press, Malang.
Seneviratne, P., S.S. Gammanaliyanage., dan G.A.S. Wijesekara., 1998. The Effect of The Origin of the Explant on In vitro Growth of Axilary Buds of Hevea brasiliensis. Tropical Agricultural Research and Extension. 1(2):98-102, 1998.
Setiawan, D. H. dan Andoko, A., 2006. Petunjuk Lengkap Budidaya Karet. Agromedia Pustaka Utama. Jakarta.
Setyamidjaja, D., 1993. Karet Budidaya dan Pengelolaan. Kanisius. Yogyakarta. Sianturi, H. S. D., 2001. Budidaya Tanaman Karet. Fakultas Pertanian USU.
Medan.
Steenis, C. G. G. K., 2005. Flora. PT. Pradnya Paramita. Jakarta.
Sumaryono, Masna, M.S., dan Nurhaimi-Haris. 2012. Daya Hidup Planlet Karet Asal in vitro Microcutting pada Berbagai Periode Penutupan Sungkup Plastik dan Komposisi Media Tumbuh. Menara Perkebunan, 2012 80(1), Hal. 25-31. Balai Penelitian Bioteknologi Perkebunan Indonesia. Bogor. Syamsulbahri., 1996. Bercocok Tanam Tanaman Perkebunan. Fakultas Pertanian
Universitas Brawijaya. Malang.
Syarifah, A.P. dan Woelan, S; Mardianto, K, 2011., 2007. Karakteristik Bunga dan Biji Dalam Hubungannya dengan Aktivitas Persilangan Tetua Karet. Warta Karet. Balai Penelitian Sungei Putih.
Wattimena, G.A., L.W. Gunawan, N.S. Matjik, E. Sjamsudin, N.M.A. Wiendi, dan A. Eniawati., 1992. Bioteknologi tanaman. Tim Laboratorium Kultur Jaringan Tanaman. PAU IPB. Bogor.
Lampiran 1. Data Pengamatan Persentase Munculnya Tunas (%)
Perlakuan Ulangan Total Rataan
(%)
1 2 3 4 5 6
A1 100 100 100 100 100 100 600 100
A2 100 100 0 100 100 100 500 83.3
A3 100 0 100 100 100 100 500 83.3
A4 0 100 0 0 0 0 100 16.7
A5 100 100 100 100 100 100 600 100
A6 100 100 100 100 100 100 600 100
A7 100 100 100 0 100 100 500 83.3
A8 0 0 0 0 100 100 200 33.3
A9 100 100 0 0 0 0 200 33.3
A10 100 100 100 0 100 100 600 83.3
A11 0 0 0 0 100 100 200 33.3
A12 100 0 0 0 0 0 100 16.7
A13 100 100 0 100 0 0 300 50
A14 100 100 100 100 100 100 600 100
A15 100 100 100 100 100 100 600 100
A16 0 0 0 0 0 100 100 16.7
Total 1200 1100 800 800 1100 1200 6300
Lampiran 2. Data Pengamatan Persentase Munculnya Tunas transformasi Arcsin √P
Perlakuan Ulangan Total Rataan
(%)
Lampiran 3. Daftar Sidik Ragam Persentase Munculnya Tunas