INDUKSI TUNAS MIKRO TANAMAN KARET (Hevea brasiliensis Muell. Arg) PADA KOMPOSISI MEDIA DAN GENOTIPE YANG BERBEDA
SKRIPSI
OLEH : HERI HIDAYAT
100301148
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
INDUKSI TUNAS MIKRO TANAMAN KARET (Hevea brasiliensis Muell. Arg) PADA KOMPOSISI MEDIA DAN GENOTIPE YANG BERBEDA
SKRIPSI
OLEH :
HERI HIDAYAT / 100301148 AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Induksi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell. Arg) Pada Komposisi Media Dan Genotipe Berbeda
Nama : Heri Hidayat NIM : 100301148
Program Studi : Agroekoteknologi Minat Studi : Pemuliaan Tanaman
Disetujui oleh : Komisi Pembimbing
Luthfi A. M Siregar, SP., MSc., Ph.D Ir. Eva Sartini Bayu, MP.
Ketua Anggota
Mengetahui :
ABTRACT
HERI HIDAYAT, 2015 : Induction of Rubber Microshoots in the composition of Medium and different genotypes supervised by Luthfi A. M Siregar and Eva SartiniBayu.
The aimed of the research to determine the best genotypesfor shoot induction of rubber tree(Hevea brasiliensis Muell. Arg.) from node explants in the composition of medium. The research was carried out in the Microccuting Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia,from October to Desember 2014. The research used completely randomized design with two factors is genotypes with number of
collections consist of four levels ; genotype 25; genotype 04; genotype 63; genotype 91 while the medium with combination of growth regulators consist of six
levels ; MS + BAP 0,5 mg/l + NAA 0 mg/l; MS + BAP 1 mg/l + NAA 0 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l + NAA 0 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l with five replications.
The results showed that genotypes not gave significantly to all parameters. The medium with combination of growth regulatorsgave significantly different onnumberof shoot induction, total shoot and shoot length. Interaction of genotypes and medium with combination of growth regulators have no significantly to all parameters. The medium of MS + BAP 0,5 mg/l + NAA 0 mg/l was the best medium to induction of microshoot rubber.
ABSTRAK
HERI HIDAYAT, 2015 :Induksi Tunas Mikro Tanaman Karet (Hevea Brasiliensis Muell. Arg.) Pada Komposisi Media dan Genotipe Berbeda,
dibimbing oleh Luthfi A. M Siregar dan Eva Sartini Bayu.
Penelitian ini bertujuan untuk mendapatkan genotipe yang sesuai pada induksi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dari eksplan nodus pada beberapa komposisi media secara in vitro. Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia, dimulai pada bulan Oktober 2014 sampai dengan Desember 2014. Rancangan yang digunakan adalah rancangan acak lengkap dengan 2faktor perlakuan yaitu genotipe dengan beberapa nomor koleksi yang terdiri dari 4 taraf yaitu genotipe 25; genotipe 04; genotipe 63; genotipe 91 sedangkan media dengan campuran zat pengatur tumbuh yang terdiri dari 6 taraf yaitu MS + BAP 0,5 mg/l + NAA 0 mg/l; MS + BAP 1 mg/l + NAA 0 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l + NAA 0 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l dengan 5 ulangan.
Hasil penelitian menunjukan bahwa pelakuan genotipe tidak memberikan berpengaruh nyata terhadap semua parameter. Sementara media dengan campuran zat pengatur tumbuh berpengaruh nyata terhadap jumlah muncul tunas, jumlah tunas dan panjang tunas. Interaksi perlakuan genotipe dan media dengan campuran zat pengatur tumbuh belum berpengaruh nyata terhadap semua peubah amatan. Media MS + BAP 0,5 mg/l + NAA 0 mg/l merupakan media terbaik dalam induksi tunas mikro tanaman karet.
RIWAYAT HIDUP
Heri Hidayat dilahirkan di Medan pada tanggal 14 Januari 1992, putra dari
pasangan Djulahar Djafar, S.IP dan Habsah Sinaga. Penulis merupakan
putrakedua dari dua bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD Negeri 0608003 lulus
pada tahun 2004, SMP SwastaMulia Pratama lulus tahun 2007 dan tahun 2010
penulis lulus dari SMA Swasta Harapan Mandiri dan pada tahun yang sama lulus
seleksi penerimaan mahasiswa baru melalui jalur SPMPRM (Seleksi Penerimaan
Masuk Perguruan RegionalMandiri)pada program studi Agroekoteknologi,
Fakultas Pertanian Universitas Sumatera Utara, Medan.
Selama mengikuti perkuliahan, penulis berkesempatan membantu dosen
sebagai asisten dalam menjalankan praktikum di Laboratorium Dasar Pemuliaan
Tanaman tahun 2014 – 2015 dan Laboratium Bioteknologi Pertanian tahun 2015.
Penulis melaksanakan praktek kerja lapangan (PKL) di PT. Perkebunan
Nusantara III, Kebun Tanah Raja Kecamatan Sei Rampah Kabupaten Deli
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT karena atas
berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang
berjudul“Induksi Tunas Mikro Tanaman Karet (Hevea
brasiliensisMuell.Arg.)Pada Komposisi Media dan Genotipe Berbeda” yang merupakan salah satu syarat untuk mendapatkan gelar sarjana di Program Studi
Agroteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada
Bapak Luthfi A. M. Siregar, SP. MSc. Ph.D selaku ketua komisi pembimbing dan
Ibu Ir. Eva Sartini Bayu,MP. selaku anggota komisi pembimbing yang telah
banyak memberikan arahan serta bimbingan kepada penulis sehingga dapat
menyelesaikan skripsi ini. Ucapan terima kasih juga disampaikan kepada kedua
orang tua tercinta, Djulahar Djafar, S.IP dan Ibunda Habsah Sinaga atas kasih
sayang, semua dukungan dan doanya kepada penulis. Kepada kakak saya tercinta
Lia Harsani atas segala doa dan dukungannya. Disamping itu ucapan terima kasih
penulis sampaikan kepada Bapak Irvin Fauzan Lubis, SP. MM selaku Staf urusan
Inkubasi Bisnis Karet PTPN III Kebun Gunung Pamela, staff PT. Perkebunan
Nusntara III Kebun Gunung Pamela, Laboran Asni, SP dan Rudi yang telah
banyak memberikan dukungan dan bantuan selama penulis melaksanakan
penelitian dan juga kepada seluruh teman-teman mahasiswa Agroteknologi 2010
yang telah banyak membantu penulis dalam melaksanakan penelitian.
Penulis menyadari dalam penulisan skripsi ini masih banyak
membangun demi kesempurnaan skripsi ini. Akhir kata semoga skripsi ini dapat
bermanfaat bagi seluruh pihak yang memerlukan.
Medan, Mei 2015
DAFTAR ISI
Media Kultur Jaringan ... 11
Lingkungan In Vitro ... 12
Zat Pengatur Tumbuh ... 15
BAHAN DAN METODE ... 20
Tempat dan Waktu Penelitian ... 20
Bahan dan Alat Penelitian ... 20
Metode Penelitian... 20
PELAKSANAAN PENELITIAN ... 23
Sterilisasi Alat-Alat ... 23
Pembuatan Media ... 23
Sterilisasi Bahan Tanaman di Lapangan ... 24
Pengambilan Bahan Tanaman ... 25
Sterilisasi Bahan Tanaman di Laboratorium ... 25
Penanaman ... 26
Pemeliharaan Eksplan ... 27
Peubah Amatan ... 27
Persentase Muncul Tunas (%) ... 27
Jumlah Tunas (tunas) ... 27
Panjang Tunas (cm)... 27
Persentase Terbentuk Bakal Daun (%) ... 28
Jumlah Daun (helai) ... 28
Umur Munculnya Tunas (hari)... 28
Kehadiran Kalus ... Warna Kalus ... Morfogenesis ... HASIL DAN PEMBAHASAN ... 29
Hasil ... 29
Persentase Munculnya Tunas (%) ... 29
Jumlah Tunas (tunas) ... 30
Panjang Tunas (cm)... 31
Persentase Terbentuknya Daun (%) ... 32
Jumlah Daun (helai) ... 33
Umur Munculnya Tunas (hari)... 34
Pembahasan ... 36
Pengaruh pemberian BAP dan NAA terhadap induksi tunas tanaman karet ... 36
KESIMPULAN DAN SARAN ... 43
Kesimpulan ... 43
Saran ... 43
DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal.
1. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap persentase muncul tunas (%) ... 2. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur
tumbuh terhadap jumlah tunas (tunas) ... 3. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur
tumbuh terhadap panjang tunas (cm) ... 4. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur
tumbuh terhadap persentase terbentuknya bakal daun ... 5. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur
tumbuh terhadap persentase jumlah daun (helai) ... 6. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur
DAFTAR GAMBAR
No. Hal.
DAFTAR LAMPIRAN
ABTRACT
HERI HIDAYAT, 2015 : Induction of Rubber Microshoots in the composition of Medium and different genotypes supervised by Luthfi A. M Siregar and Eva SartiniBayu.
The aimed of the research to determine the best genotypesfor shoot induction of rubber tree(Hevea brasiliensis Muell. Arg.) from node explants in the composition of medium. The research was carried out in the Microccuting Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia,from October to Desember 2014. The research used completely randomized design with two factors is genotypes with number of
collections consist of four levels ; genotype 25; genotype 04; genotype 63; genotype 91 while the medium with combination of growth regulators consist of six
levels ; MS + BAP 0,5 mg/l + NAA 0 mg/l; MS + BAP 1 mg/l + NAA 0 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l + NAA 0 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l with five replications.
The results showed that genotypes not gave significantly to all parameters. The medium with combination of growth regulatorsgave significantly different onnumberof shoot induction, total shoot and shoot length. Interaction of genotypes and medium with combination of growth regulators have no significantly to all parameters. The medium of MS + BAP 0,5 mg/l + NAA 0 mg/l was the best medium to induction of microshoot rubber.
ABSTRAK
HERI HIDAYAT, 2015 :Induksi Tunas Mikro Tanaman Karet (Hevea Brasiliensis Muell. Arg.) Pada Komposisi Media dan Genotipe Berbeda,
dibimbing oleh Luthfi A. M Siregar dan Eva Sartini Bayu.
Penelitian ini bertujuan untuk mendapatkan genotipe yang sesuai pada induksi tunas mikro tanaman karet (Hevea brasiliensis Muell. Arg.) dari eksplan nodus pada beberapa komposisi media secara in vitro. Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia, dimulai pada bulan Oktober 2014 sampai dengan Desember 2014. Rancangan yang digunakan adalah rancangan acak lengkap dengan 2faktor perlakuan yaitu genotipe dengan beberapa nomor koleksi yang terdiri dari 4 taraf yaitu genotipe 25; genotipe 04; genotipe 63; genotipe 91 sedangkan media dengan campuran zat pengatur tumbuh yang terdiri dari 6 taraf yaitu MS + BAP 0,5 mg/l + NAA 0 mg/l; MS + BAP 1 mg/l + NAA 0 mg/l; MS + BAP 1,5 mg/l + NAA 0,1 mg/l; WPM + BAP 0,5 mg/l + NAA 0 mg/l; WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; WPM + BAP 0,5 mg/l + NAA 0,5 mg/l dengan 5 ulangan.
Hasil penelitian menunjukan bahwa pelakuan genotipe tidak memberikan berpengaruh nyata terhadap semua parameter. Sementara media dengan campuran zat pengatur tumbuh berpengaruh nyata terhadap jumlah muncul tunas, jumlah tunas dan panjang tunas. Interaksi perlakuan genotipe dan media dengan campuran zat pengatur tumbuh belum berpengaruh nyata terhadap semua peubah amatan. Media MS + BAP 0,5 mg/l + NAA 0 mg/l merupakan media terbaik dalam induksi tunas mikro tanaman karet.
PENDAHULUAN Latar Belakang
Tanaman karet (Hevea brasiliensis Muell. Arg.) berasal dari Brazilia, Amerika Selatan tepatnya di wilayah Amazon Brazilia. Tanaman karet mulai
dibudidayakan di Indonesia pada tahun 1864 di Jawa Barat.Sedangkan
perkebunan karet dimulai di Sumatera Utara tahun 1903, dan di Jawa tahun 1906
(Semangun, 2000). Diperkirakan ada lebih dari 3,4 juta hektar perkebunan karet di
Indonesia, 85% di antaranya (2,9 juta hektar) merupakan perkebunan karet yang
dikelola oleh rakyat atau petani skala kecil, dan sisanya dikelola oleh perkebunan
besar milik negara atau swasta (Janudianto, et al, 2013).
Luas areal perkebunan karet yang dikelola oleh PT. Perkebunan Nusantara
III (PTPN III) saat ini terdiri atas 45.327 ha kebun eksisting dan 9.150 ha kebun
plasma. Dengan asumsi setiap tahun dilakukan peremajaan sebesar 5 % dari luas
areal tersebut diperlukan bahan tanamn karet sebanyak 1,5 juta bibit per tahun.
Kebutuhan bahan tanam tersebut sampai saat ini diperoleh melalui cara
konvensional menggunakan batang bawah dari biji dan batang atas dari klon-klon
yang direkomendasikan. (Muluk, 2009).
Perbanyakan bibit karet sampai saat ini masih dilakukan dengan cara
okulasi, sehingga diperlukan ketersediaan batang atas dan batang bawah. Batang
atas adalah tanaman karet klonal karena diperbanyak dari bagian vegetatif
menggunakan mata tunas, sedangkan batang bawah adalah tanaman asal biji
(Haris, 2013). Batang bawah merupakan tanaman asal biji (seedling) sehingga ketersediaannya sangat tergantung pada musim biji yang umumnya hanya
klon - klon, seperti GT 1, PB 260, RRIC 100, dan AVROS 2037. Perbanyakan
batang bawah secara klonal seharusnya juga merupakan tanaman hasil seleksi.
Namun ternyata hal tersebut tidak mudah karena sebagian besar klon-klon karet
yang direkomendasikan untuk ditanam dalam skala luas kurang responsif terhadap
lingkungan kultur in vitro (Haris, 2013).
Salah satu alternatif untuk memenuhi permintaan bibit karet yang
meningkat dan tidak bergantung dengan musim serta untuk menghasilkan batang
bawah secara klonal yang homogen adalah dengan teknik kultur jaringan
tanaman. Dan microcutting merupakan salah satu teknik mikropropagasi tanaman berbasis kultur in vitro dan telah berhasil diaplikasikan untuk perbanyakan tanaman karet asal biji (seedling) dengan menggunakan tunas aksilar sebagai eksplan. Keuntungan teknik tersebut adalah terbukanya peluang untuk
menghasilkan batang bawah klonal yang selama ini belum pernah ada pada
tanaman karet. Penggunaan batang bawah klonal akan meningkatkan keseragaman
pertanaman karet di lapang, karena klon batang atas didukung oleh batang bawah
yang sama dan lebih seragam, dibandingkan dengan batang bawah asal biji yang
digunakan saat ini. Di samping itu, teknologi perbanyakan tersebut juga membuka
peluang untuk melakukan seleksi terhadap batang bawah sesuai dengan karakter
yang diinginkan, misalnya batang bawah dengan karakter tahan terhadap penyakit
akar atau toleran terhadap kondisi lahan kering.Material bahan tanam tersebut
kemudian dapat diperbanyak secara klonal.(Haris, et al, 2009).
Koleksi plasma nutfah ini sangat banyak jumlahnya, sehingga perlu
dilakukan karakterisasi ciri-ciri penting secara bertahap serta membangun suatu
dari sifat yangdiinginkan. Besarnya keragaman genetik yang dimiliki membuka
peluang untuk ditemukannya klon karet unggul baru melalui kegiatan persilangan
buatanyang lebih luas. Pada saat ini telah dikembangkan beberapa
genotipe-genotipe unggul pada beberapa perusahaan perkebunan, misalnya pada
perkebunan nusantara III yang telah menghasilkan beberapa genotipe yang berasal
dari perbanyakan seedling yang telah di okulasi dengan beberapa klon tertentu.
Genotipe tersebut di beri penomoran agar dapat diketahui genotipe yang unggul.
Di perkebunan nusantara III terdapat beberapa penomoran genotipe yaitu genotipe
01, genotipe 04, genotipe 13, genotipe 15, genotipe 16, genotipe 25, genotipe 26,
genotipe 34, genotipe 45, genotipe 63 dan genotipe 91. Dari beberapa penomoran
tersebut di peroleh beberapa genotipe unggul yaitu genotipe 25, genotipe 04,
genotipe 63, dan genotipe 91.
Perbanyakan batang bawah tanaman karet secara klonal melalui
teknologi in vitro microcutting telah berhasil dilakukan. Pengamatan di lapangan pada pertanaman muda menunjukkan pertumbuhan yang seragam
dan memiliki bentuk konikal pada batang bagian bawah (Carron et al., 2000; Carron et al., 2003). Kemudian percobaan yang dilakukan Gunatilleke dan Chandra (1998) menunjukkan adanya multiplikasi pertumbuhan eksplan karet
yang dikulturkan di medium setengah MS, medium MS dengan dan tanpa
penambahan BAP 0.5 mg/l dan IAA 0.5 mg/l. Pada penelitian yang dilakukan
Harahap (2014) di dapat medium MS terbaik untuk multiplikasi pertumbuhan
tunas aksilar karet yaitu medium MS yang ditambahkan BAP 0,5 mg/l dan
NAA 0 mg/l, medium MS yang ditambahkan BAP 1,0 mg/l dan NAA 0 mg/l
penelitian menunjukkan bahwa kombinasi zat pengatur tumbuh BAP dan
NAA berpengaruh nyata terhadap jumlah tunas dan persentase munculnya
tunas. Sedangkan untuk parameter panjang tunas, jumlah daun, dan persentase
munculnya daun tidak memberikan pengaruh nyata.
Hasil penelitian Nursetiadi (2008) menunjukkan bahwa media yang
memberikan hasil yang paling optimal adalah media WPM. Pada media MS,
WPM dan B5 memberikan kecenderungan jumlah tunas yang sama. Konsentrasi
BAP 2 ppm + IBA 0,5 ppm merupakan konsentrasi yang memberikan hasil yang
paling optimal pada panjang tunas dan jumlah daun. Dengan konsentrasi BAP 0
ppm + IBA 0,5 ppm cenderung memberikan hasil yang paling optimal pada
panjang daun. Saat muncul tunas tercepat terdapat pada konsentrasi BAP 1 ppm +
IBA 0,5 ppm. Pada penelitian sebelumnya dilakukan Sundari (2014) di peroleh
medium WPM yang terbaik untuk melakukan multiplikasi tanaman aksilar karet
yaitu medium WPM yang ditambahkan BAP 0,5 mg/l dan NAA 0 mg/l, medium
WPM yang ditambahkan BAP 0,5 mg/l dan NAA 0,25 mg/l dan medium WPM
yang ditambahkan BAP 0,5 mg/l dan NAA 0,5 mg/l. Hasil penelitian
menunjukkan bahwa kombinasi zat pengatur tumbuh BAP dan NAA berpengaruh
nyata terhadap jumlah tunas dan persentase munculnya tunas.
Zat pengatur tumbuh BAP merupakan sitokinin yang berfungsi
mempengaruhi pertumbuhan dan diferensiasi akar, mendorong pembelahan sel
dan pertumbuhan (Dewi, 2008). Menurut Wattimena (1992) salah satu faktor yang
menentukan keberhasilan kultur jaringan adalah zat pengatur tumbuh.
akan mendorong pembelahan sel dan pembentukan morfogenesis tanaman. Media
kultur jaringan yang dirncang untuk tanaman berkayu seperi buah-buahan adalah
woody plant Medium / WPM hasil komposisi dari Llyoyd dan McCown, 1981. NAA adalah zat pengatur tumbuh sintetik yang mampu mengatur berbagai proses
pertumbuhan dan pemanjangan sel (George dan Sherrington, 1984).
Untuk memenuhi kebutuhan batang bawah klonal karet dan untuk
menemukan media yang cocok untuk pertumbuhan karet secara in vitro, maka peneliti tertarik untuk melakukan perbanyakan tanaman karetsecara in vitroterhadap beberapa komposisi media dengan nomor genotipe yang berbeda.
Tujuan Penelitian
Untuk mendapatkan mediayang sesuai pada induksi tunas mikrotanaman
karet (Hevea brasiliensis Muell.Arg.) dari eksplan nodus pada beberapa nomor genotipe berbedasecara in vitro.
Hipotesis Penelitian
Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
karet(Hevea brasiliensis Muell.Arg.) pada beberapa komposisi media.
Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
karet(Hevea brasiliensis Muell.Arg.) pada genotipe berbeda
Ada interaksi perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan gelar sarjanadiFakultas
Pertanian Universitas Sumatera Utara, Medan dan sebagai bahan informasi bagi
TINJAUAN PUSTAKA Botani Tanaman
Sistematika bahan tanaman karet (H. brasiliensis Muell. Arg.) menurut
Steenis (2005) ialah : Kingdom : Plantae; Divisio: Spermatophyta;
Subdivisio : Angiospermae; Kelas : Dicotyledoneae; Ordo : Euphorbiales;
Famili : Euphorbiaceae;Genus : HeveaSpesies: Hevea brassiliensisMuell Arg.
Akar tanaman karet berupaakar tunggang yang mampu menopang
batang tanaman yang tumbuh tinggi ke atas. Dengan akar seperti itu pohon karet
dapat berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan dan
Andoko, 2006).
Tanaman karet merupakan tanaman yang tumbuh tinggidan berbatang
cukup besar.Tinggi pohon dewasa 15-25meter.Batang biasanya tumbuh lurus dan
memiliki percabangan tinggi di atas.Batang tanaman ini mengandung getah atau
lateks (Syamsulbahri, 1996).
Tanaman karet adalah anggota famili Euphorbiaceae.Berbentuk pohon, tinggi 10-20 m, bercabang dan mengandung banyak getah susu. Daun
berselang-seling, tangkai daun panjang, 3 anak daun yang licin bertangkai, petiola pendek,
hijau dan memiliki panjang 3,5-30 cm. Helaian anak daun bertangkai pendek dan
berbentuk elips atau bulat telur, pangkal sempit dan tegang, ujung runcing, sisi
atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm dan lebar
2,5-12,5 cm (Sianturi, 2001).
Daun tanaman karet adalah trifoliata. Tangkai daun panjang, serat daun
Bunganya bergerombol muncul dari ketiak daun (axilary), individu bunga
bertangkai pendek, bunga betina terletak diujung (Syamsulbahri, 1996).
Bunga yang keluar dari ranting – ranting yang baru bersemi itu berbentuk
bunga majemuk dimana satu tangkai bunga tersusun dari banyak bunga. Bunga
majemuk ini terdapat pada ujung ranting yang berdaun. Tiap – tiap karangan
bunga bercabang – cabang (Setyamidjaja, 1993).
Karakteristik bunga jantan pada beberapa tetua karet cukup bervariasi,
yaitu 295-500 bunga per tangkai dengan rata-rata 383,4 per tangkai dan
2065-2640 bunga per karangan dengan rata-rata 3482,6 bunga per karangan.
Masing-masing bunga jantan dari setiap tetua tumbuh di setiap tangkai utama dan
cabang-cabangnya, untuk satu tangkai bunga tersusun atas tiga bunga jantan (trifolia) yang berwarna kuning (Syarifah dan Woelan, 2007; Mardianto, 2011).
Buah beruang tiga, jarang yang beruang 4 hingga 6 diameter buah 3-5 cm
dan terpisah 3, 4, 6. Coci bekatup dua, pericarp berbentuk endokarp berkayu. Biji
besar, bulat persegi empat, tertekan pada satu atau dua sisinya, berkilat, berwarna
coklat muda, dengan noda-noda cokelat tua, panjang 2-3,5 cm dan lebar 1,5–3 cm
dan tebal 1,5-2,5 cm (Sianturi, 2001).
Biji karet terdapat dalam setiap ruang buah. Jadi, jumlah biji biasanya tiga,
kadang enam, sesuai dengan jumlah ruang. Ukuran biji besar dengan kulit keras.
Warnanya cokelat kehitaman dengan bercak-bercak berpola yang khas
(Tim Penulis PS, 2008).
Dalam satu kapsul buah karet umumnya terdapat 3 butir biji.Buah yang masih
mencapai ukuran maksimum pada umur 3 bulan setelah penyerbukan (Pustaka Litbang
Deptan, 2012).
Kultur Jaringan
Teknik kultur jaringan dimulai ketika Schwan dan Schleiden
mengemukakan teori totipotensi yang menyatakan bahwa sel-sel bersifat otonom
dan pada prinsinya mampu beregenerasi menjadi tanaman lengkap. Jaringan
tanaman dapat diisolasi dan di kultur hingga berkembang menjadi tanaman
normal dengan melakukan manipulasi terhadap kondisi lingkungan dan nutrisinya
(Zulkarnain, 2009).
Kultur jaringan merupakan teknik menumbuhkembangkan bagian
tanaman, baik berupa sel, jaringan atau organ dalam kondisi aseptik secara
in vitro. Yang dicirikan oleh kondisi kultur yang aseptik, penggunaan media kultur buatan dengan kandungan nutrisi lengkap dan zat pengatur tumbuh, serta
kondisi ruang kultur yang suhu dan pencahayaannya terkontrol (Yusnita, 2003).
Perbanyakan in vitro dapat dilakukan dengan menggunakan dua cara yaitu melalui organogenesis dan embriogenesis. Organogenesis adalah suatu proses
untuk membentuk dan menumbuhkan tunas dari jaringan meristematik.
Regenerasi eksplan menjadi organ dan planlet dapat diperoleh melalui jalur
organogenesis langsung dan tidak langsung.Organogenesis langsung yaitu eksplan
langsung menumbuhkan sel meristematik yang kemudian berdiferensiasi menjadi
organ (tunas, daun atau akar), sedangkan organogenesis tidak langsung terjadi
pembentukan kalus terlebih dahulu. Embriogenesis merupakan proses
perkembangan sel vegetatif atau sel-sel somatik yang diperoleh dari berbagai
Kultur in vitro tanaman karet (Hevea brasiliensis Muell. Arg.) dapat
dilakukan dengan microcutting dan embriogenesis somatik (Nayanakantha & Seneviratne, 2007; Montoro et al., 2010). Teknologi in vitro
microcutting karet dikembangkan untuk menghasilkan batang bawah klonal (Carron & Enjalric, 1983) guna memenuhi kebutuhan dan meningkatkan kualitas
batang bawah yang selama ini dihasilkan dari biji. Meningkatnya kebutuhan
batang bawah menyebabkan ketersediaan biji tidak mencukupi lagi karena
tergantung pada beberapa klon karet penghasil biji batang bawah dan pada musim
biji yang hanya berlangsung satu kali dalam setahun. Di samping itu, kelemahan
lain dari penggunaan bibit asal biji sebagai batang bawah adalah adanya
keragaman batang bawah dan kekurang-mampuan kombinasi batang atas dan
batang bawah menampilkan potensi produksi dan karakter unggul lain secara
maksimal karena per-bedaan tingkat juvenilitas (Abbas dan Ginting, 1981).
Microcutting merupakan salah satu teknik mikropropagasi tanaman berbasis kultur in vitro dan telah berhasil diaplikasikan untuk perbanyakan
tanaman karet asal biji (seedling) dengan menggunakan tunas aksilar sebagai eksplan (Carron dan Enjarlic, 1983). Proses perbanyakan tanaman karet melalui
teknologi microcutting terdiri atas beberapa tahap, yaitu kultur primer (primary culture), multiplikasi, conditioning (hardening), induksi dan inisiasi
perakaran serta aklimatisasi (Carron et al., 2005). Kultur primer merupakan tahap penanaman eksplan pada medium pertumbuhan steril untuk menginisiasi kultur
aseptik, yang merupakan tahap awal dalam teknologi kultur jaringan
kaca dan eksplan tersebut memiliki minimal satu mata tunas aksilar
(auxiliary bud). Dalam kondisi in vitro, eksplan yang bebas dari kontaminan dan tumbuh baik dapat diperbanyak melalui subkultur berulang-ulang sehingga kultur
primer merupakan tahap yang menentukan untuk keberhasilan dan keberlanjutan
perbanyakan tanaman menggunakan teknologi tersebut (Haris, et al, 2009).
Teknik kultur jaringan akan berhasil dengan baik apabila syarat-syarat
yang diperlukan terpenuhi. Syarat-syarat tersebut meliputi pemilihan eksplan,
penggunaan medium yang cocok, keadaan yang aseptik dan pengaturan udara
yang baik.Meskipun pada prinsipnya semua jenis sel dapat ditumbuhkan, tetapi
sebaiknya dipilih bagian tanaman yang masih muda dan mudah tumbuh yaitu
bagian meristemnya misalnya daun muda, ujung akar, ujung batang, keping biji
dan sebagainya. Apabila menggunakan embrio atau bagian-bagian biji yang lain
sebagai eksplan, yang perlu diperhatikan adalah kemasakan embrio, waktu
imbibisi, temperatur dan dormansi (Hendaryono dan Wijayani, 1994).
Keberhasilan tersebut membuka peluang perbanyakan tanaman karet
secara in vitro, yang dapat dilakukan untuk dua tujuan.Pertama dan yang paling ideal adalah untuk perbanyakan klonal tanaman karet unggul secara massal
sehingga bibit yang diperoleh tidak memerlukan batang bawah dan merupakan
klon utuh (whole clone). Namun ternyata hal tersebut tidak mudah karena sebagian besar klon-klon karet yang direkomendasikan untuk ditanam dalam skala
luas kurang responsif terhadap lingkungan kulturin vitro (Nurhaimi-Haris, 2013).
Eksplan
Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan
eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus
dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan
awal kultur. Umumnya, bagian tanaman yang digunakan sebagai eksplan adalah
jaringan muda yang sedang tumbuh aktif.Jaringan tanaman yang masih muda
mempunyai daya regenerasi lebih tinggi, sel-sel masih aktif membelah diri, dan
relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Sumber asal eksplan dapat mempengaruhi pertumbuhan dan potensial
morfogenetiknya.Eksplan yang berasal dari satu jenis organ misalnya, juga
diketemukan adanya keragaman dalam regenerasinya.Ukuran eksplan untuk
dikulturkan juga mempengaruhi keberhasilannya. Ukuran yang terlampau kecil
akan kurang daya tahannya bila dikulturkan, sementara bila terlampau besar akan
sulit mendapatkan eksplan yang steril. Setiap jenis tanaman maupun organ
memiliki ukuran eksplan yang optimum untuk dikulturkan (Armini, et al, 1992). Kebanyakan kultur in vitro pada Hevea adalah langsung melalui kultur tunas pucuk, kultur tunas, somatik embriogenesis, dan transformasi genetik.
Sebuah studidilakukandiLembaga PenelitianKaret Indiadenganklon unggul
karetmenggunakaneksplan pucukyang berasal daripohon dewasa(Sinha etal, 1985;.. Shobanaetal, 1986; Asokanetal, 1988). Menurut
Sinhaetal. (1985), awalnyatunasyangberegenerasidari
beberapaklonkaretmengalami kegagalan dalam hal pembentukan
akar.Asokaetal.(1988) mengkulturkan tunas ujung pucuk yangberasal daripohonklonaldan melaporkan bahwa terjadi perkembangan pada tunas dan
Menurut Gunawan (1995), ukuran eksplan yang dikulturkan turut
menentukan keberhasilan dari suatu teknik kultur jaringan. Ukuran eksplan yang
terlalu kecil akan kurang daya tahannya bila dikulturkan. Sedangkan bila
ukurannya terlalu besar akan sulit didapatkan eksplan yang steril.
Kondisi fisiologi eksplan memiliki peranan penting bagi keberhasilan
teknik kultur jaringan. Pada umumnya bagian-bagian vegetatif lebih siap
beregenerasi daripada bagian generatif. Eksplan mata tunas yang diperoleh dari
tanaman yang sedang istirahat, lebih sulit berproliferasi daripada mata tunas yang
diperoleh dari tanaman yang sedang aktif tumbuh(Zulkarnain, 2009).
Terdapat beberapa informasi tentang mikropropagasiHevea
menggunakaneksplan yang berbeda, sebagian besar berasal dari bibit
(Thulaseedharan et al., 2000). Akan tetapi, bagian tanaman karet yang efisien untuk perbanyakan skala besar klon Hevea masih belum berkembang. Paranjothy dan Glandimethi (1976) mencoba mengkulturkan tunas ujung pucuk
(panjang 2-3 cm), yang berasal dari perbanyakan pertama dengan biji. Walaupun
tunas ini mengalami perakaran di medium cair MS, namun tunas tersebut
mengalami kegagalan pertumbuhan pada medium MS padat. Kemudian
Enjarlic dan Carron (1982), menggunakan tunas yang berasal dari tanaman asal
biji yang berumur 1-3 tahun di rumah kaca sebagai eksplan untuk dikembangkan
menjadi tanaman berakar.
Untuk mendapatkan bahan tanaman okulasi yang baik diperlukan entres
yang baik dan dari kelompok klon anjuran. Klon-klon anjuran adalah klon-klon
a. Klon Penghasil Lateks : BPM 24, BPM 27, BPM 109, IRR 104, PB 217,
dan PB 260.
b. Klon Penghasil Lateks Kayu : BPM 1, PB 330, PB 340, RRIC 100,
AVROS 2037, IRR 5, IRR 32, IRR 39, IRR 42, IRR 112, dan IRR 118.
c. Klon Penghasil Kayu : IRR 70, IRR 71, IRR 72, dan IRR 78.
Klon-klon anjuran lainnya yang sudah dilepas sperti BPM 1, BPM 1-7,
BPM 109, AVROS 2037, GT 1, PR 255, PR 300, RRIM 600, RRIM 712 masih
dapat digunakan dengan beberapa pertimbangan antara lain dengan
memperhatikan kepentingan pengguna untuk penanaman klon tersebut pada
wilayah tertentu dan spesifikasi tertentu (Budiman, 2012).
Media Kultur Jaringan
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Media kultur tersebut, fisiknya dapat
berbentuk cair atau padat. Kebutuhan nutrisi mineral untuk tanaman yang
dikulturkan secara invitro pada dasarnya sama dengan kebutuhan hara tanaman
yang ditumbuhkan di tanah, meliputi hara-hara makro dan mikro Komponen
media kultur yang lengkap sebagai berikut.
1. Air distilasi (akuades) atauair bebas ion sebagai pelarut atau solven.
2. Hara makro dan mikro
3. Gula (umumnya sukrosa) sebagai sumber energi
4. Vitamin, asam amino dan bahan organik lain
5. Zat Pengatur Tumbuh
6. Suplemen berupa bahan-bahan alami, jika diperlukan
(Yusnita, 2003).
Media yang digunakan secara luas adalah media Murashige & Skoog (MS)
yang dikembangkan pada tahun 1962.Dari berbagai komposisi dasar ini
kadang-kadang dibuat modifikasi, misalnya hanya menggunakan ½ dari konsentrasi dari
garam-garam makro yang digunakan (½ MS) atau menggunakan komposisi garam
makro berdasarkan MS, tetapi mikro dan vitamin berdasarkan komposisi Heller.
Zat pengatur tumbuh yang akan digunakan disesuaikan dengan tujuan inisiasi
kultur (Gunawan, 1995).
ParanjothydanGandhimathi(1975) menyatakanupaya pertama
merekapada kultur pucuk karet. Mereka mampu mengkulturkan ujung tunas
daribibit yangtumbuh dalam kulturaseptikpadamodifikasi media
MSdanmenginduksiperakaran, proliferasitunasdan pada tunastidak didapatkan
hasiloleh mereka. Carrondan lainnyamenyatakan bahwaproduksiplanlet
berasal dari pemotongan noduspadabibitdan beberapa dariklon yang terpilih.
Hanya beberapaplanletdapat diperoleh darisatueksplanoleh Carron etal. Pada
tahun 1982 dan1985. Jika metode iniakanberhasil digunakan
dalampropagasiHevea, harus adaproliferasicepat daritunasdarieksplan (Gunatilleke dan Chandra, 1988).
Penggunaan media tumbuh anggrek saat ini sangat bervariasi. Variasi
media tersebut biasanya dalam bentuk modifikasi komponen penting dalam
media yaitu dengan menambahkan zat-zat lainnya pada media yang mungkin
dapat meningkatkan pertumbuhan eksplan, seperti menambahkan zat-zat
pengatur tumbuh, vitamin, air kelapa, asam-asam amino, maupun jus
(MS), Woody Plant Medium (WPM), Vacin dan Went (VW) telah dicoba
diteliti. Misalnya penelitian Apriani (1996) menggunakan MS + air kelapa, jus
pisang dan tomat, dan penelitian Yulinda (2003) menggunakan VW + air
kelapa, bubur pisang, bubur ubi kayu, ragi dan ampas kedelai. Mereka
menghasilkan modifikasi yang cukup baik. Namun belum ada data atau
penelitian yang menggunakan media standar Knudson C dengan modifikasi
tambahan seperti media di atas.
Lingkungan in Vitro
Dalam teknik kultur jaringan tanaman, cahaya dinyatakan dengan
dimensi lama penyinaran, intensitas dan kualitasnya. Prof. Murashige
menyarankan untuk mengasumsikan kebutuhan lama penyinaran pada kultur
jaringan tanaman merupakan pencerminan dari kebutuhan periodisitas
tanaman yang bersangkutan di lapangan. Kualitas cahaya mempengaruhi arah
diferensiasi jaringan (Yusnita, 2003).
Sel-sel tanaman membutuhkan pH sedikit asam barkisar antara 5,5 –
5,8. Pengaturan pH biasa dilakukan dengan menggunakan NaOH atau HCl.
Pada umumnya terdapat penurunan pH setelah disterilkan dalam autoclave.
(Gunawan, 1995).
Temperatur yang dibutuhkan untuk dapat terjadi pertumbuhan yang
optimal umumnya adalah berkisar di antara 200-300C.Sedangkan temperatur
optimum untuk pertumbuhan kalus endosperm adalah sekitar 250C.(Hendaryono
Lingkungan tumbuh yang dapat mempengaruhi regenerasi tanaman
meliputi temperatur, penyinaran, kualitas panjang penyinaran, intensitas
penyinaran, serta ukuran wadah kultur (Gunawan, 1995).
Kultur jaringan akan berhasil dengan baik apabila syarat-syarat yang
diperlukan terpenuhi. Syarat tersebut adalah pemilihan eksplan, yaitu bagian
tanaman yang digunakan dalam kulturisasi. Penggunaan media yang cocok dan
keadaan yang aseptik dan pengaturan udara yang baik
( Nugroho dan Sugito, 2000).
Pengaruh intensitas cahaya terhadap pembentukan akar bergantung pada
cara pemeberian cahaya tersebut. Protokorm Cymbidium yang berwarna hijau akan membentuk akar dan tunas bila diberi intensitas cahaya 2200 sampai 2500
lux. Untuk keperluan kultur jaringan cahaya putih dari lampu flourscent dengan
intensitas 1000 lux untuk fase inisiasi dan subkultur, sedangkan untuk fase
pengakaran dan persiapan planlet sebelum dilakukan aklimatisasi menggunakan
intensitas 3000 sampai 10000 lux. Lama penyinaran yang dianjurkan adalah 16
jam per hari (Wattimena, et all, 1992).
Suhu yang umum digunakan untuk pengkulturan berbagai jenis tanaman
adalah ± 26°C. Untuk kebanyakan tanaman, suhu yang terlalu rendah (kurang dari
20°C) dapat menghambat pertumbuhan dan suhu yang terlalu tinggi (lebih dari
32°C) menyebabkan tanaman merana (Yusnita, 2003).
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan
nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan pada
dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan
morfologis (Wattimena, et al, 1992).
Dalam kultur jaringan, dua golongan zat pengatur tumbuh yang sangat
penting adalah sitokinin dan auksin (Gunawan, 1992). NAA (Naftaleine Asetat Acid) adalah zat pengatur tumbuh yang tergolong auksin.Pengaruh auksin terhadap perkembangan sel menunjukkan bahwa auksin dapat meningkatkan
sintesa protein.Dengan adanya kenaikan sintesa protein, maka dapat digunakan
sebagai sumber tenaga dalam pertumbuhan.Adapun kinetin (6-furfury amino purine) tergolong zat pengatur tumbuh dalam kelompok sitokinin.Kinetin adalah kelompok sitokinin yang berfungsi untuk pengaturan pembelahan sel dan
morfogenesis.Dalam pertumbuhan jaringan, sitokinin bersama-sama dengan
auksin memberikan pengaruh interaksi terhadap deferensiasi jaringan
(Hendaryono dan Wijayani, 1994).
Auksin yang paling banyak digunakan pada kultur in vitro adalah indole-3-acetic acid (IAA), α-naphthylacetic acid (α-NAA), dan 2,4-dichlorophenoxy acetic acid (2,4-D). Jenis-jenis auksin yang lain seperti 2,4,5-trichlorophenoxyacetid acid (2,4,5-T), indole-3-butyric acid (IBA), dan P-chlorophenoxyyacetic acid (4-CPA) juga merupakan senyawa yang efektif, tetapi penggunaanya tidak sebanyak tiga jenis auksin yang disebut terlebih dahulu.
2,4,5-T dapat meningkatkan pembentukan kalus pada kultur in vitro tanaman biji-bijian, sedangkan IBA sangat efektif untuk menginduksi perakaran.IAA merupan
auksin yang disintesis secara alamiah di dalam tubuh tanaman, namun senyawa ini
mudah mengalami degradasi akibat pengaruh cahaya dan oksidasi enzimatik.Oleh
L-1).Sementara itu α-NAA yang merupakan auksin sintetik tidak mengalami
oksidasi enzimatik seperti halnya IAA. Senyawa tersebut dapat diberikan pada
medium kultur pada konsentrasi yang lebih rendah, berkisar antara 0,1-2,0 mg L-1
(Zulkarnain, 2009).
Sitokinin merupakan nama kelompok hormon tumbuh yang sangat penting
sebagai pemacu pertumbuhan dan morfogenesis dalam kultur jaringan. Seperti
halnya pada auksin, selain sitokinin alami juga terdapat sintesisnya yang
tergolong dalam zat pengatur tumbuh. Kinetin adalah merupakan sitokinin yang
pertama kali ditemukan oleh mahasiswa profesor Skoog’s bernama Carlos Miller
(1954) pada laboratorium di Universitas Wisconsin, yaitu senyawa yang sangat
aktif yang terbentuk dari hasil penguraian sebagian DNA tua sperma ikan hering
atau DNA yang diautoklaf yang menyebabkan terus tumbuhnya kalus tembakau
(Santoso dan Nursandi, 2001).
Sitokinin yang paling banyak digunakan pada kulturin vitro adalah kinetin, benziladenin (BA atau BAP), dan zeatin. Zeatin adalah sitokinin yang disintesis
secara alamiah, sedangkan kinetin dan BA adalah sitokinin sintetik (Zulkarnain,
2009).
Sitokinin merupakan senyawa organik yang menyebabkan pembelahan sel
yang dikenal dengan proses sitokinesis. Sitokinin mempengaruhi berbagai proses
fisiologis di dalam tanaman terutama mendorong pembelahan sel. Salah satu jenis
ZPT dari golongan sitokinin yang sering dipakai dalam kultur jaringan yaitu BAP
(6-benzylaminopurine). 6-Benzilaminopurine (BAP) merupakan salah satu
sitokinin sintetik yang aktif dan daya merangsangnya lebih lama karena tidak
konsentrasi tinggi dan masa yang panjang dapat menentukan kemampuan
pembentukan jumlah tunas dan bentuk tunas. Pada konsentrasi BAP yang lebih
tinggi dan masa induksi yang lebih lama menyebabkan penampakan abnormal dan
menyebabkan penurunan jumlah regenerasi yang diperoleh sedangkan
napthalene-3-acetic acid (NAA) adalah auksin sintetik yang sering ditambahkan dalam media
tanam karena mempunyai sifat lebih stabil dari pada Indol-3-acetic acid (IAA).
IAA dapat mengalami degradasi yang disebabkan adanya cahaya atau enzim
oksidatif. Oleh karena sifatnya yang labil IAA jarang digunakan dan hanya
merupakan hormon alami yang ada pada jaringan tanaman yang digunakan
sebagai eksplan. Sedangkan NAA tidak mudah terurai oleh enzim yang
dikeluarkan sel atau pemanasan pada proses sterilisasi (Gunawan, 1995).
Terdapat kisaran interaksi yang luas antara kelompok auksin dengan
kelompok sitokinin.Kedua kelompok zat pengatur tumbuh tersebut berinteraksi
pula dengan senyawa senyawa kimia lainya dan dipengaruhi oleh faktor-faktor
lingkungan, seperti cahaya dan suhu.Pada kondisi tertentu auksin dapat bereaksi
dengan menyerupai sitokinin, atau sebaliknya (Kyte, 1983). Meskipun demikian,
baik auksin maupun sitokinin, keduanya sering kali diberikan secara bersamaan
pada medium kultur untuk menginduksi pola morfogenesis tertentu, walaupun
ratio yang dibutuhkan untuk induksi perakaran maupun pucuk tidak selalu sama,
terdapat keragaman yang tinggi antargenus, antarspesies, bahkan antar kultivar
dalam hal jenis takaran auksin dan sitokinin untuk menginduksi terjadinya
morfogenesis (Kyte,1983;Torres,1989) (Zulkarnain, 2009).
Pada penelitian yang dilakukan Harahap (2014) di dapat medium MS
ditambahkan BAP 0,5 mg/l dan NAA 0 mg/l, medium MS yang ditambahkan
BAP 1,0 mg/l dan NAA 0 mg/l dan medium MS yang ditambahkan BAP 1,5 mg/l
dan NAA 0,1 mg/l. Hasil penelitian menunjukkan bahwa kombinasi zat pengatur
tumbuh BAP dan NAA berpengaruh nyata terhadap jumlah tunas dan persentase
munculnya tunas. Sedangkan untuk parameter panjang tunas, jumlah daun, dan
persentase munculnya daun tidak memberikan pengaruh nyata. Sedangkan pada
penelitian Sundari (2014) di peroleh medium WPM yang terbaik untuk melakukan
multiplikasi tanaman aksilar karet yaitu medium WPM yang ditambahkan BAP
0,5 mg/l dan NAA 0 mg/l, medium WPM yang ditambahkan BAP 0,5 mg/l dan
NAA 0,25 mg/l dan medium WPM yang ditambahkan BAP 0,5 mg/l dan NAA
0,5 mg/l. Hasil penelitian menunjukkan bahwa kombinasi zat pengatur tumbuh
BAP dan NAA berpengaruh nyata terhadap jumlah tunas dan persentase
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera
Utara, Indonesia.Penelitian ini dimulai pada bulan September 2014 sampai
dengan Desember 2014.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah nodus dari
bahan tanaman karet yang di tanam di rumah kasa, komposisi media yang
digunakan larutan stok media MS dan WPM sebagai media tumbuh tanaman
dengan NAA dan BAP sebagai zat pengatur tumbuh (ZPT) yang digunakan,
eksplan yang digunakan berasal dari beberapa klon yang merupakan koleksi
PTPN III dengan beberapa nomor koleksi dengan panjang 2 – 2,5 cm. Bahan
penyusun media lainnya, agar, aquadest steril.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur, hot plate dengan magnetik stirer, erlenmeyer, gelas ukur, kaca tebal, pipet ukur,
pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, aluminium
foil, kompor gas, minisar, mikropipet, tip, pipet tetes.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap
Faktor I : Genotipe dengan beberapa nomor koleksi dengan 4 taraf
G1 : Genotipe 25
G2 : Genotipe 04
G3 : Genotpe 63
G4 : Genotipe 91
Faktor II : Media dengan campuran zat pengatur tumbuh dengan 6 taraf
A1 : MS + BAP 0,5 mg/l + NAA 0 mg/l
A2 : MS + BAP 1 mg/l + NAA 0 mg/l
A3 : MS + BAP 1,5 mg/l + NAA 0,1 mg/l
A4 : WPM + BAP 0,5 mg/l + NAA 0 mg/l
A5 : WPM + BAP 0,5 mg/l + NAA 0,25 mg/l
A6 : WPM + BAP 0,5 mg/l + NAA 0,5 mg/l
Sehingga diperoleh kombinasi perlakuan sebagai berikut:
G1A1 G2A1 G3A1 G4A1
G1A2 G2A2 G3A2 G4A2
G1A3 G2A3 G3A3 G4A3
G1A4 G2A4 G3A4 G4A4
G1A5 G2A5 G3A5 G4A5
G1A6 G2A6 G3A6 G4A6
Jumlah perlakuan : 24
Jumlah ulangan : 5
Jumlah eksplan tiap tabung uji : 1
Jumlah seluruh eksplan : 120
Adapun model liner dari sidik ragam penelitian sebagai berikut:
Yijk = µ + αi + βj + (αβ)ij + ε ijk
i = 1,2,3,4 j = 1,2,3,4,5,6 k = 1,2,3…10
Yijk = Nilai pengamatan unit percobaan pada perlakuan Genotipe ke-i, Media
dengan campuran zat pengatur tumbuh ke-j, dan ulangan ke-k
µ = Nilai tengah umum αi = Pengaruh Genotipe ke-i
βj = Pengaruh Media dengan campuran zat pengatur tumbuh ke-j
(αβ)ij = Nilai tambah pengaruh interaksi Genotipe ke-i danMedia dengan
zat pengatur tumbuh ke-j
εijk = Galat percobaan
Jika perlakuan (Genotipe, Media dengan campuran zat pengatur tumbuh
dan interaksi) berbedanyata dalam sidik ragam maka dilanjutkan dengan Uji Jarak
PELAKSANAAN PENELITIAN Sterilisasi Alat-Alat
Sebelumsemua alat-alat disterilisasi dan alat-alat kaca digunakan untuk
kultur in vitromaka terlebih dahulu dicuci dan dikeringkan. Selanjutnya tabung dibungkus dengan plastik tahan panas atau letakkan pada rak tabung sedangkan
untuk botol dapat langsung diletakkan pada autoklaf. Setelah itu, semua botol dan
tabung uji dan alat lainnyadisterilkan dalam autoklaf pada suhu 121oC dengan
tekanan 17,5 psi selama 60 menit. Kemudian tabung uji dan botol disterilisasi
kering didalam oven pada temperatur 150oC selama 1-2 jam.
Pembuatan Media
MS (Murashige and Skoog)
Media yang digunakan adalah media Murashige and Skoog (MS) padat.Sebelum dilakukan pembuatan media MS, dilakukan pembuatan larutan
stok hormon BAP dan NAA. Larutan stok hormon masing-masing dibuat
100mg/100ml. Larutan stok BAP dan NAA disaring menggunakan minisar guna
meningkatkan sterilitas dari hormon tersebut dan dilakukan di Laminar.
Pada pembuatan media MS, tahap pertama adalah membuat larutan stok
bahan kimia hara makro dengan pembesaran 10x, hara mikro dengan pembesaran
100x, larutan iron dengan pembesaran 50x, larutan vitamin dengan pembesaran
100x, sukrosa 50 gr, myo-inositol 0,1 gr dan agar 5 gr. Tahap berikutnya, sukrosa
dimasukkan ke dalam beaker glass yang telah berisi akuades 1000 ml, lalu diaduk
dengan menggunakan magnetic stirrer sebagai pengaduk. Kemudian ditambahkan
myo-inositol diaduk hingga larut. Dimasukkan larutan stok hara makro 100ml,
ditempatkan menjadi 5000 ml. Keasaman diukur dengan pH meter. pH yang
dikehendaki adalah 5,8, untuk mengatur pH yaitu menaikkan atau menurunkan pH
dapat digunakan larutan NaOH dan HCl 0,1 N. Letakkan agar mikrobiologi dan
dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar
telah larut). Larutan dipindahkan ke erlenmeyer berukuran 5000ml dan ditutup
dengan aluminium foil. Hasil Media MS secara keseluruhan di sterilisasi dengan
tekanan 1 atm pada suhu 121°C selama 1 jam 30 menit di autoklaf. Setelah proses
sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan ke ruangan
laminaruntuk dibagikan ke 16 tabung erlenmeyer berukuran 500ml dengan
masing-masing tabung berisi 250ml. Teteskan BAP dan NAA ke masing-masing
tabung uji sesuai perlakuan. Lalu setiap perlakuan ditepatkan hingga
masing-masing perlakuan menjadi 300ml. Dituangkan media ke dalam tabung uji
berisikan 13ml/tabung dan ditutup kain kasa steril yang dibalut dan diikat benang.
Sehingga didapat ± 23 tabung uji. Tabung uji diberi label sesuai dengan
perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
WPM(Woody Plant Medium)
Media yang digunakan adalah mediaWoody Plant Medium
(WPM).Sebelum dilakukan pembuatan media WPM, dilakukan pembuatan
larutan stok hormon BAP dan NAA. Larutan stok hormon masing-masing dibuat
100mg/100ml. Kemudian larutan stok BAP dan NAA disaring menggunakan
minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di
laminar.
Pada pembuatan media WPM, tahap pertama adalah membuat larutan stok
100x, larutan iron dengan pembesaran 50x, larutan vitamin dengan pembesaran
100x, sukrosa 50 g, myo-inositol 0,1 g dan agar 5 g. Tahap berikutnya, sukrosa
dimasukkan ke dalam beaker glass yang telah berisi aquades 1000 ml, lalu diaduk dengan menggunakan magnetik stirer sebagai pengaduk. Kemudian ditambahkan
myo-inositol diaduk hingga larut. Dimasukkan larutan stok hara makro 100ml,
larutan stok hara mikro 10ml, iron 20ml dan vitamin 10ml. Kemudian larutan
ditepatkan menjadi 5000ml dengan menambahkan aquades. Keasaman diukur
dengan pH meter. pH yang dikehendaki adalah 5,8, untuk mengatur pH yaitu
menaikkan atau menurunkan pH dapat digunakan larutan KOH dan HCl 0,1 N.
Ditambahkan agar biotek dan dimasak di atas kompor gas sampai larutan
mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer
berukuran 5000ml dan ditutup dengan aluminium foil dan diikat dengan tali
plastik. Kemudian media WPM di sterilisasi dengan tekanan 17,5 psi pada suhu
121°C selama 1 jam 30 menit di autoklaf. Setelah proses sterilisasi selesai, media
dimasukkan ke ruang kultur dan dimasukkan ke laminar untuk dibagikan ke 16
tabung erlenmeyer berukuran 500ml dengan masing-masing tabung berisi 250ml.
Teteskan BAP dan NAA ke masing-masing tabung uji sesuai perlakuan. Lalu
setiap perlakuan ditepatkan hingga masing-masing perlakuan menjadi 300ml.
Dituangkan media ke dalam tabung uji berisikan 13ml/tabung dan ditutup kain
kasa steril yang dibalut dan diikat benang. Sehingga diperoleh ± 23 tabung uji dari
setiap perlakuannya. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya
disimpan dalam ruang kultur sebelum digunakan.
Bahan tanaman batang bawah tanaman karet berasal dari seedlingkaret yang berada di rumah kasa tanaman karet PT. Perkebunan Nusantara III, Kebun
Gunung Pamela. Sterilisasi lapangan ialah dengan memberikan fungisida
berbahan kimia mankozeb yang dicampurkan dengan air, dioleskan pada bahan
tanaman yang akan dijadikan eksplan di rumah kaca. Ditunggu selama 1 malam
untuk fungisida bereaksi mencegah jamur pada bahan tanaman. Dipotong bahan
tanaman yang akan dijadikan eksplan dan diberi label sesuai dengan genotipe
yang diambil.
Pengambilan Bahan Tanaman
Bahan tanaman yang digunakan ialah yang telah diberikan fungisida
berbahan kimia mankozeb.Bahan tanaman yang digunakan ialah bibit karet yang
telah latern (daun terbuka sempurna) dan berwarna hijau terang, batang tanaman
kokoh dan berwarna hijau, serta berpayung dua. Batang bawah dari tanaman karet
itu sendiri berasal dari seedlingkaret pendukung klon tertentu yang selanjutnya diokulasi dengan persilangan stump dan menghasilkan beberapa genotipe berbeda
(kodefikasi genotipe dari Balai Penelitian Karet Sungei Putih). Bagian yang
diambil ialah buku-buku yang terdapat dari setiap batang tersebut.
Sterilisasi Bahan Tanaman di Laboratorium
Eksplan yang telah diambil dari rumah kaca kemudian dicuci di bawah air
bersih yang mengalir dengan menggunakan kuas untuk menghilangkan olesan
dithane. Eksplan dimasukkan ke dalam toples kemudian dimasukkan alkohol 70
% dan diguncang selama 1 menit, setelah itu alkohol dibuang dan toples diisi
kembali dengan H2O2 17 % dan didiamkan selama 20 menit, setelah itu
kemudian dibuang. Eksplan direndam di dalam toples dengan aquades selama 2 x
15 menit, dan kemudian air tersebut dibuang. Dan eksplan sudah siap ditanam.
Persiapan Ruang Tanam
Seluruh permukaan laminarsebelumnya dibersihkan terlebih dahulu
dengan di lap menggunakan alkohol 96% lalu di sterilkan dengan sinar Ultra
Violet selama 1 jam sebelum proses penanaman dilakukan. Semua alat dan bahan
yang akan dipakai harus disemprot dengan alkohol 96% dan beberapa alat seperti
pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam
laminarselama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan
penelitian terkontaminasi.Steri box dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Penanaman
Eksplan yang digunakan adalah nodus dari bahan tanaman karet yang telah
di sterilisasi sebelumnya.Kemudian nodus-nodus disterilasi dengan standar yang
dimiliki Laboratorium Microcutting Karet Kebun Gunung Pamela, lalu langsung ditanam pada tabung uji yang sudah berisikan agar sebanyak 13ml/tabung
uji.Eksplan yang digunakan berukuran 1,5 - 2 cm, apabila ukuran eksplan belum
sesuai maka dipotong menggunakan gunting steril dan tajam. Eksplan yang akan
dikulturkan ke dalam media tanam diletakkan di piringan kaca tebal dengan alas
kertas plano. Kemudian eksplan ditanamkan ke dalam tabung uji sesuai dengan
perlakuan, setiap tabung uji terdiri dari 1 eksplan.Kemudian ujung tabung uji
ditutup dengan menggunakan kain kasa steril yang dibalut dan diikat benang.
diletakkan di rak kultur di bawah cahaya dan ruangan memiliki air conditioner
dengan suhu 18oC.
Pemeliharaan Eksplan
Tabung-tabung uji diletakkan pada rak kultur di dalam ruang kultur.
Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari
disemprot dengan alkohol 96% atau dan disemprot formalin agar bebas dari
organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu
ruangan kultur yang digunakan + 20-25°C, paling optimum 18oC dan intensitas
cahaya 2000 lux serta dengan kondisi ruangan memilikipendingin udara. Apabila
mengalami kontaminasi, segera diambil dari rak kultur agar mencegah
kontaminasi ke tabung lainnya.
Peubah Amatan
Jumlah Muncul Tunas (Tunas)
Pengamatan dilakukan pada akhir penelitian (6MST) berdasarkan
jumlah tunas yang muncul dari keseluruhan ulangan.
Persentase terbentuknya tunas = jumlah tunas yang terbentuk x 100% jumlah eksplan per perlakuan
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian (6MST) dengan menghitung banyaknya
tunas baru yang terbentuk dari setiap eksplan.
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas
milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas
tertinggi..Pengukuran dilakukan pada akhir penelitian (6 MST).
Jumlah daun dihitung dari bakal daun yang terbentuk pada eksplan.
Pengamatan dilakukan pada akhir penelitian (6 MST). Persentase terbentuknya
bakal daun dihitung dengan rumus:
Persentase terbentuknya bakal daun = jumlah bakal daunx 100% jumlah eksplan per perlakuan
Jumlah Daun (helai)
Daun yang dihitung adalah daun yang trifoliat yang sudah berwarna coklat
kehijauan yang sudah kelihatan struktur atau tulang daunnya. Pengamatan
dilakukan pada akhir penelitian (6MST).
Umur Muncal Tunas (Hari)
Umur muncul tunas dihitung dari awal penanaman hingga terbentuknya
tunas dalam satuan hari.
Kehadiran Kalus
Kehadiran kalus dilihat dari ada atau tidaknya kemunculan kalus dari
bekas potongan (pelukaan) eksplan atau dari bagian manapun dari eksplan.
Diobservasi kehadiran kalus pada akhir penelitian (6MST).
Warna Kalus
Dilihat dari penampakan warna kalus yang muncul. Warna kalus dilihat
pada akhir penelitian (6MST).
Morfogenesis
Kemunculan tunas adventif dari jaringan pangkal batang, ujung batang
HASIL DAN PEMBAHASAN Hasil
Dari hasil analisis data yang dilakukan, diperoleh bahwa perlakuan media
dengan campuran zat pengatur tumbuh memberikan pengaruh sangat nyata
terhadap jumlah tunas dan panjang tunas. Pada jumlah muncul bakal daun, jumlah
daun, umur muncul tunas, kehadiran kalus, warna kalus dan morfogenesis tidak
berpengaruh nyata pada perlakuan genotipe dan media dengan campuran zat
pengatur tumbuh. Untuk interaksi antara genotipe dan media dengan campuran
zat pengatur tumbuh belum memberikan pengaruh yang nyata pada seluruh
parameter yang diuji.
Persentase Muncul Tunas (%)
Hasil pengamatan terhadap parameterpersentase muncul tunaspada
perlakuan genotipe dan media dengan campuran zat pengatur tumbuh
(Lampiran 1). Rataan persentase muncul tunas dari perlakuan genotipe dan media
dengan campuran zat pengatur tumbuh dapat di lihat pada Tabel 1.
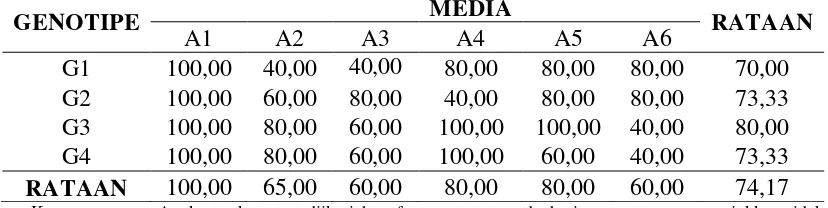
Tabel 1. Pengaruh perlakuan genotipe dan media dengan campuran zatpengatur tumbuh terhadap persentase muncul tunas (%) (6MST).
GENOTIPE MEDIA RATAAN
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5 %. Perlakuan G1= genotipe 25 ;G2= genotipe 04 ; G3= genotipe 63 ; G4= genotipe 91. Perlakuan A1= MS + BAP 0,5 mg/l + NAA 0 mg/l; A2= MS + BAP 1 mg/l + NAA 0 mg/l;A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l + NAA 0 mg/l;A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l
Gambar eksplan sebelum dan sesudah membentuk tunas pada salah satu
Jumlah Tunas (Tunas)
Hasil pengamatan serta sidik ragam terhadapparameter jumlah tunas pada
perlakuan genotipe dan media dengan campuran zat pengatur tumbuh
(Lampiran 2-4), menunjukan bahwa perlakuan media dengan campuran zat
pengatur tumbuh memberikan pengaruh sangat nyata terhadap jumlah tunas pada
6 MST, akan tetapi perlakuan genotipe dan interaksi dari kedua perlakuan ini
belum memberikan pengaruh yang nyata terhadap jumlah tunas.
Rataan jumlah tunas dari perlakuan genotipe dan media dengan campuran
zat pengatur tumbuh dapat di lihat pada Tabel 2.
Tabel 2.Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap jumlah tunas (tunas) (6MST).
GENOTIPE MEDIA RATAAN
Tabel 2, memperlihatkan jumlah tunas tertinggi terdapat pada perlakauan
A1 (MS + BAP 0,5 mg/l + NAA 0 mg/l), A4 (WPM + BAP 0,5 mg/l + NAA 0
mg/l), A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l
)
yaitu dengan rataanmasing-masing (1,0) tunas dan (0,80) tunas sedangkan terendah pada perlakuan A2 (MS
+ BAP 1 mg/l + NAA 0 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l) dan A6
(WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) yaitu dengan rataan masing-masing
(0,65) tunas dan (0,60) tunas. A1 dan A4 berbeda nyata terhadap perlakuan A2,
A3 dan A6 tetapi tidak berbeda nyata dengan perlakuan A5.
Panjang Tunas (cm)
Hasil pengamatan serta sidik ragam terhadap parameterpanjang tunas pada
perlakuan genotipe dan media dengan campuran zat pengatur tumbuh
(Lampiran 5-7), menunjukan bahwa perlakuan media dengan campuran zat
pengatur tumbuh memberikan pengaruh sangat nyata terhadap panjang tunas pada
6 MST, akan tetapi genotipe dan interaksi dari kedua perlakuan ini belum
memberikan pengaruh yang nyata terhadap panjang tunas.
Rataan panjang tunas dari perlakuan genotipe dan media dengan campuran
zat pengatur tumbuh dapat di lihat pada Tabel 3.
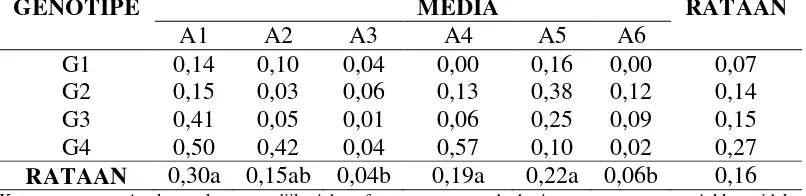
Tabel 3.Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap panjang tunas (cm) (6MST).
GENOTIPE MEDIA RATAAN
Tabel 3, memperlihatkan panjang tunas tertinggi terdapat pada perlakauan
A1 (MS + BAP 0,5 mg/l + NAA 0 mg/l), A5 (WPM + BAP 0,5 mg/l + NAA 0,25
mg/l
),
A4 (WPM + BAP 0,5 mg/l + NAA 0 mg/l) danA2 (MS + BAP 1 mg/l +NAA 0 mg/l) , yaitu dengan rataan masing-masing (0,30) cm dan (0,22) cm, (0,19)
cm dan (0,15) sedangkan terendah pada perlakuan A6 (WPM + BAP 0,5 mg/l +
NAA 0,5 mg/l) dan A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l) yaitu dengan
rataan masing-masing (0,06) cm dan (0,04) cm. A1, A5 dan A4 berbeda nyata
terhadap perlakuan A6 dan A3 tetapi tidak berbeda nyata dengan perlakuan A2.
Jumlah Terbentuk Bakal Daun
Hasil pengamatan serta sidik ragam terhadap parameter
jumlahterbentuknya bakal daun terhadap perlakuan genotipe dan media dengan
campuran zat pengatur tumbuh (Lampiran 8-10), menunjukan bahwa perlakuan
genotipe danmedia dengan campuran zat pengatur tumbuh dan interaksi dari
kedua perlakuan belum memberikan pengaruh nyata terhadap panjang tunas pada
6 MST.
Rataan terbentuknya bakal daun dari perlakuan genotipe dan media
dengan campuran zat pengatur tumbuh dapat di lihat pada Tabel 4.
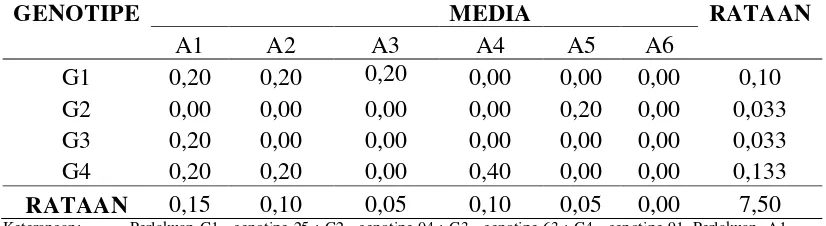
Tabel 4. Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap jumlah terbentuknya bakal daun (6MST).
GENOTIPE MEDIA RATAAN
Jumlah Daun (helai)
Hasil pengamatan serta sidik ragam terhadap parameterjumlah daun
terhadap perlakuan genotipe dan media dengan campuran zat pengatur tumbuh
(Lampiran 13-15), menunjukan bahwa perlakuan genotipe danmedia dengan
campuran zat pengatur tumbuh dan interaksi dari kedua perlakuan belum
memberikan pengaruh nyata terhadap panjang tunas pada 6 MST.Gambar eksplan
memebentuk daun dapat dilihat pada Gambar 3.
Gambar 3. Eksplan Membentuk Daun
Rataan panjang tunas dari perlakuan genotipe dan media dengan campuran
zat pengatur tumbuh dapat di lihat pada Tabel 5.
Tabel 5.Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap jumlah daun (helai) (6MST).
GENOTIPE MEDIA RATAAN
A1 A2 A3 A4 A5 A6
G1 0,0 0,0 0,0 0,0 0,0 0,0 0,0
G2 0,0 0,0 0,0 0,0 0,6 0,0 0,1
G3 0,0 0,0 0,0 0,0 0,0 0,0 0,0
G4 0,0 0,0 0,0 0,2 0,0 0,0 0,0
RATAAN 0,0 0,0 0,0 0,1 0,2 0,0 0,0
Umur Muncul Tunas (hari)
Hasil pengamatan terhadap parameterumur muncul tunaspada perlakuan
genotipe dan media dengan campuran zat pengatur tumbuh
(Lampiran 16). Rataan umur muncul tunas dari perlakuan genotipe dan media
dengan campuran zat pengatur tumbuh dapat di lihat pada Tabel 6.
Tabel 6.Pengaruh perlakuan genotipe dan media dengan campuran zat pengatur tumbuh terhadap umur muncul tunas (hari) (6MST).
GENOTIPE MEDIA RATAAN
Keterangan: Perlakuan G1= genotipe 25 ;G2= genotipe 04 ; G3= genotipe 63 ; G4= genotipe 91. Perlakuan A1= MS + BAP 0,5 mg/l + NAA 0 mg/l; A2= MS + BAP 1 mg/l + NAA 0 mg/l;A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l + NAA 0 mg/l;A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l
Tabel 7. Rekapitulasi Peubah Amatan Sidik Ragam pada Induksi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell. Arg) Pada Komposisi Media dan Genotipe Berbeda (6MST)
M= media dengan campuran zat pengatur tumbuh
G x M = interaksi genotipe dengan media dengan campuran zat pengatur tumbuh ** = sangat nyata pada taraf 5 %
tn = tidak nyata a = transformasi data
Pada semua kultur yang dilakukan tidak ada satupun yang menunjukan
kehadiran kalus.Ketidakhadiran kalus pada tunas mikro tanaman karet merupakan
hal yang diharapkan dalam penelitian ini, sebab microcutting pada tahap primary culture merupakan tahapan awal sehingga tidak diharapkan kehadiran kalus dan hingga akhir pnelitian tidak ditemukan kehadiran kalus.
Warna Kalus
Ketidakhadiran kalus hingga akhir penelitian menyebabkan tidak adanya
warna kalus yang diamati secara visual.
Morfogenesis
Berdasarkan kemunculan tunas mikro tanaman karet, maka tidak diperoleh
kemunculan tunas diluar jaringan meristem aksilar (pangkal batang, ujung batang,
bagian lain dari eksplan).
Pembahasan
Pengaruh genotipe terhadap induksi tunas mikro tanaman karet
Dari hasil analisis data secara statistik diketahui bahwa perlakuan genotipe
belum menunjukkan pengaruh nyata terhadap semua peubah amatan. Hal ini
diduga karena genotipe memberikan respon yang sama terhadap pertumbuhan
induksi tunas mikro terhadap semua media dan zat penagatur tumbuh serta
pengaruhsumber asal dari genotipe serta kodisi fisiologis eksplan. Nugroho dan
Sugito (2000) menyatakan kultur jaringan akan berhasil dengan baik apabila
syarat-syarat yang diperlukan terpenuhi. Syarat tersebut adalah pemilihan eksplan,
yaitu bagian tanaman yang digunakan dalam kulturisasi.Penggunaan media yang
cocok dan keadaan yang aseptik dan pengaturan udara yang baik kemudian
mempengaruhi pertumbuhan dan potensial morfogenetiknya.Eksplan yang berasal
dari satu jenis organ misalnya, juga diketemukan adanya keragaman dalam
regenerasinya.Ukuran eksplan untuk dikulturkan juga mempengaruhi
keberhasilannya. Kemudian Zulkarnain (2009) mengemukakan Kondisi fisiologi
eksplan memiliki peranan penting bagi keberhasilan teknik kultur jaringan. Pada
umumnya bagian-bagian vegetatif lebih siap beregenerasi daripada bagian
generatif. Eksplan mata tunas yang diperoleh dari tanaman yang sedang istirahat,
lebih sulit berproliferasi daripada mata tunas yang diperoleh dari tanaman yang
sedang aktif tumbuh.
Pengaruh media dengan campuran zat pengatur tumbuh terhadap induksi tunas mikro tanaman karet
Dari hasil analisis data secara statistik diperoleh bahwa perlakuan media
dengan campuran zat pengatur tumbuh memberikan pengaruh sangat nyata
terhadap persentase muncul tunas, jumlah tunas, panjang tunas tetapi belum
berpengaruh nyata pada persentase muncul daun, jumlah daun, umur muncul
tunas, kehadiran kalus, warna kalus serta morfogenesis.
Pada peubah amatan persentase muncul tunas, perlakuan memberikan
respon untuk menginduksi tunas tanaman karet. Rataan tertinggi pada jumlah
muncul tunas terdapat pada perlakauan A1 (MS + BAP 0,5 mg/l + NAA 0 mg/l),
A4 (WPM + BAP 0,5 mg/l + NAA 0 mg/l), A5 (WPM + BAP 0,5 mg/l + NAA
0,25 mg/l
)
yaitu dengan rataan masing-masing (1,0) tunas dan (0,80) tunassedangkan terendah pada perlakuan A2 (MS + BAP 1 mg/l + NAA 0 mg/l), A3
(MS + BAP 1,5 mg/l + NAA 0,1 mg/l) dan A6 (WPM + BAP 0,5 mg/l + NAA
0,5 mg/l) yaitu dengan rataan masing-masing (0,65) tunas dan (0,60) tunas. Hal