UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN UJI AKTIVITAS ANTIINFLAMASI
SENYAWA METABOLIT SEKUNDER DARI
RIMPANG KENCUR (Kaempferia galanga L.)
SKRIPSI
MIDA FAHMI
1111102000128
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN UJI AKTIVITAS ANTIINFLAMASI
SENYAWA METABOLIT SEKUNDER DARI
RIMPANG KENCUR (Kaempferia galanga L.)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
MIDA FAHMI
1111102000128
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
Skripsi ini adalah hasil karya saya sendiri, dan semua
sumber baik yang dikutip maupun yang dirujuk telah
saya nyatakan dengan benar.
Nama : Mida Fahmi
NIM : 1111102000128
Tanda Tangan :
Nama : Mida Fahmi Program Studi : Strata-1 Farmasi
Judul : Isolasi dan Uji Aktivitas Antiinflamasi Senyawa Metabolit Sekunder dari Rimpang Kencur (Kaempferia galanga L.)
Etil p-metoksisinamat (EPMS) merupakan senyawa metabolit sekunder yang telah diisolasi dari rimpang kencur dan memiliki aktivitas sebagai antiinflamasi. Penelitian ini bertujuan untuk mengisolasi senyawa metabolit sekunder dari rimpang kencur (Kaempferia galanga L.), menentukan strukturnya, dan menguji aktivitasnya sebagai antiinflamasi. Penelitian ini melakukan ekstraksi pada rimpang kencur (Kaempferia galanga L.) secara berturut-turut menggunakan n-heksan, etil asetat, dan metanol. Identifikasi pola bercak hasil ekstraksi menggunakan kromatografi lapis tipis (KLT) dan kandungan senyawa menggunakan Gas Chromatography-Mass Spectrometry (GCMS). Berdasarkan hasil identifikasi tersebut, isolasi dan pemurnian dilakukan pada ekstrak fraksi etil asetat dengan metode kromatografi. Penentuan kemurnian dilakukan dengan metode KLT dua dimensi dan GCMS, kemudian struktur senyawa murni ditentukan dengan menggunakan Gas Chromatography-Mass Spectrometry (GCMS), Fourier Transform Infrared (FTIR), dan Nuclear Magnetic Resonance (NMR). Pengujian aktivitas antiinflamasi senyawa murni dilakukan dengan metode inhibisi denaturasi Bovine Serum albumin (BSA). Hasil rendemen ekstrak fraksi n-heksan sebesar 12,07 %, fraksi etil asetat sebesar 3,01 %, dan fraksi metanol sebesar 1,4 %. Senyawa murni yang didapatkan yaitu etil sinamat (ES). Struktur ES dan EPMS memiliki perbedaan pada gugus metoksi, yaitu senyawa ES tidak memiliki gugus metoksi. Berdasarkan hasil uji aktivitas antiinflamasi, senyawa ES memiliki aktivitas lebih kecil daripada EPMS dengan nilai hambatan pada beberapa konsentrasi 0,1 ppm (15,4 1,11), 1 ppm (19,77 1,76), 10 ppm (24,9 1,28) dan 100 ppm (28 1,47).
Name : Mida Fahmi Program Study : Pharmacy
Title : Isolation and Antiinflamatory Activity Assays of Secondary Metabolites Compound from Rhizomes of Kaempferia galanga L.
Ethyl p-methoxycinnamate (EPMC) had been isolated from rhizomes of Kaempferia galanga L. and showed antiinflamatory activity. The objectives of this research were to isolate a secondary metabolite compound from rhizomes of Kaempferia galanga L., elucidated the structure, and determined its antiinflamatory activity. In this research, rhizomes of Kaempferia galanga L. were extracted with n-hexane, ethyl acetate, and methanol, respectively. Identifications of the chromatography pattern was monitored by using TLC and GCMS. Based on the GCMS and TLC analysis, the ethyl acetate extract was decided to further purification with chromatography methodes. Identification of purity was done by two-dimensional TLC and GCMS, and structure of pure compound was definited using Gas Chromatography-Mass Spectrometry (GCMS), Fourier Transform Infrared (FTIR), dan Nuclear Magnetic Resonance (NMR). Antiinflamatory activity from was determined by using inhibition on denaturation of Bovine Serum Albumin (BSA). Extraction of rhizomes of Kaempferia galanga L. gave 927,94 g (12,07%) n-hexane extract, 232,51 g (3,01%) ethyl acetate extract, and 115,27 g (1,4%) methanol extract. Based on analysis of spectroscopy data, the purified compound was identified as ethyl cinnamate. Structures of EC and EPMC have difference on methoxy group, that is EC compound dose not has methoxy group. EC show antiinflamatory activity in each concentration 0,1 ppm (15,4 1,11), 1 ppm (19,77 1,76), 10 ppm (24,9 1,28) and 100 ppm (28 1,47).
Puji syukur saya panjatkan kepada Tuhan Yang Maha Esa, karena atas
berkat dan rahmat-Nya, saya dapat menyelesaikan skripsi yang berjudul ”Isolasi dan Uji Aktivitas Antiinflamasi Senyawa Metabolit sekunder dari Rimpang
Kencur (Kaempferia galanga L.)”. Shalawat dan salam tercurah limpahkan kepada Nabi Muhammad SAW, panutan bagi seluruh umat manusia sampai akhir
zaman.
Penulisan skripsi ini dilakukan untuk memenuhi salah satu syarat untuk
mencapai gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam negeri (UIN) Syarif Hidayatullah Jakarta. Saya menyadari
bahwa, selesainya saya sampai menyelesaikan penyusunan skripsi ini tak lepas
dari bantuan dan bimbingan berbagai pihak, dari masa perkuliahan sampai pada
penyusunan skripsi ini selesai, saya mengucapkan terima kasih kepada:
1. Dr. Arief Soemantri, SKM.,M.Kes selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
2. Ismiarni Komala, M.Sc.,Ph.D.,Apt selaku pembimbing pertama dan Eka
Putri, M.Si.,Apt selaku pembimbing kedua, yang memiliki andil besar dalam
proses penelitian dan penyelesaian tugas akhir saya ini, semoga segala
bantuan dan bimbingan ibu mendapat imbalan yang lebih baik di sisi-Nya.
3. Yardi, M.Si.,Ph.D.,Apt selaku ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif
Hidayatullah Jakarta.
4. Yardi, M.Si.,Ph.D.,Apt selaku pembimbing akademik yang telah memberikan
bimbingan selama proses perkuliahan sampai selesainya penyusunan skripsi
saya ini.
5. Bapak dan Ibu staf pengajar dan karyawan yang telah memberikan bimbingan
dan bantuan selama saya menempuh pendidikan di Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN)
Syarif Hidayatullah Jakarta.
6. Rekan-rekan mahasiwa Program Studi Farmasi Fakultas Kedokteran dan Ilmu
sampai akhirnya saya bisa menyelesaikan perkuliahan dan penyusunan
skripsi saya ini, semoga segala amalan dan jerih payah keduanya
mendapat balasan yang lebih baik disisi-Nya.
Semoga Tuhan Yang Maha Esa berkenan membalas segala
kebaikan semua pihak yang telah membantu. Panulis menyadari masih
banyak kekurangan dalam penulisan skripsi ini, namun penulis berharap
skripsi ini membawa manfaat bagi pengembangan ilmu pengetahauan.
Jakarta, 22 Juni 2015
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Mida Fahmi
NIM : 1111102000128
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
ISOLASI DAN UJI AKTIVITAS ANTIINFLAMASI SENYAWA METABOLIT SEKUNDER DARI RIMPANG KENCUR (Kaempferia
galanga L.)
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Jakarta
Pada Tanggal : 22 Juni 2015
Yang menyatakan,
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
2.1.Tinjauan Botani Kaempferia galanga L. ... 4
2.1.1. Klasifikasi Tumbuhan (USDA) ... 4
2.1.2. Deskripsi Tanaman ... 4
2.4.1. Pembuatan simplisia ... 9
2.5.Pemilihan pelarut ... 11
2.6.Ekstraksi ... 12
2.6.1. Prosedur Ekstraksi (Tiwari et al. 2011) ... 13
2.7.Metode Pemisahan ... 15
2.7.1. Kromatografi ... 15
2.8.Metode Spektroskopi dalam Penentuan Struktur ... 17
2.8.1. GCMS ... 17
2.8.2. Spektrofotometri IR ... 17
2.8.3. Spektrometri Nuclear Magnetic Resonance (NMR) ... 18
2.9.Uji Antiinflamasi ... 18
BAB III METODE PENELITIAN ... 20
3.1.Tempan dan Waktu Penelitian ... 20
3.2.Alat dan Bahan ... 20
3.2.1. Alat ... 20
3.2.2. Bahan ... 20
3.3.Prosedur Penelitian ... 21
3.3.4. Isolasi dan Pemurnian Senyawa ... 22
3.3.5. Uji Kemurnian Senyawa Hasil Isolasi ... 24
3.3.6. Penentuan Struktur Molekul Senyawa Hasil Isolasi ... 25
3.3.7. Uji Antiinflamasi ... 26
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1. Determinasi ... 28
4.2. Penyiapan Bahan ... 28
4.3. Ekstraksi ... 28
4.4. Isolasi dan Pemurnian Senyawa ... 30
4.4.1. Analisis Awal Ekstrak Menggunakan KLT dan GCMS ... 30
4.4.2. Pemisahan Kristal ... 31
4.4.3. Kromatografi Kolom Fraksi Etil Asetat ... 32
4.5. Uji Kemurnian Senyawa Fraksi EF8 ... 35
4.5.1. Kromatografi Lapis Tipis Dua Dimensi ... 35
4.5.2. GCMS ... 36
4.6. Penentuan Struktur Molekul Senyawa Hasil Isolasi ... 36
4.6.1. Penentuan Struktur Senyawa Fraksi Gab.8 dengan Spektroskopi Massa ... 37
4.6.2. Identifikasi Fraksi Gab.8 Menggunakan Spektrofotometri IR ... 39
Tabel 4.1. % rendemen setiap fraksi hasil ekstraksi rimpang kencur ... 29
Tabel 4.2. Perbandingan fragmentasi senyawa fraksi D8 dengan senyawa etil sinamat* ... 38
Tabel 4.3. Spektrum IR fraksi D8 ... 40
Tabel 4.4. Perbandingan data EPMS *, etil sinamat**, dan senyawa hasil isolasi ... 44
DAFTAR GAMBAR
Gambar 4.1. Hasil KLT setiap fraksi dengan eluen n-heksan : etil
asetat (4:1) ... 30
Gambar 4.2. Profil KLT EPMS dan kristal hasil pemisahan ... 32
Gambar 4.3. Profil KLT fraksi D vial 17, 18, dan 19 ... 33
Gambar 4.4. Hasil KLT senyawa EPMS dan fraksi D8 ... 35
Gambar 4.5. Kromatografi lapis tipis dua dimensi fraksi D8 ... 36
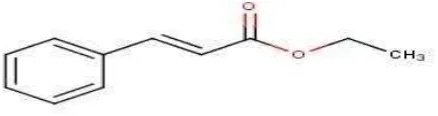
Gambar 4.6. Struktur molekul etil sinamat ... 37
Gambar 4.7. Hasil fragmentasi senyawa fraksi D8 ... 38
Gambar 4.8. Gambaran pola fragmentasi dari spectral peak senyawa etil sinamat ... 39
Gambar 4.9. Spektrum IR fraksi D8 ... 39
Gambar 4.10 Gugus fungsi ester pada struktur senyawa fraksi D8 ... 40
Gambar 4.11. Struktur fenil pada senyawa fraksi D8 ... 41
Gambar 4.12. Struktur alifatik pada senyawa fraksi D8 ... 41
Gambar 4.13. Struktur senyawa EPMS (A) dan etil sinamat (B) ... 44
Lampiran 1. Hasil Determinasi Rimpang Kencur Kaempferia galanga L. . 54
Lampiran 2. Skema Kerja Isolasi ... 55
Lampiran 3. Profil KLT Fraksi D ... 56
Lampiran 4. % Kandungan Senyawa Fraksi N-heksan, Etil Asetat, dan Metanol ... 57
Lampiran 5. Profil KLT Senyawa Fraksi D8 ... 60
Lampiran 6. Hasil Uji Kemurnian Menggunakan GCMS ... 61
Lampiran 7. Hasil Analisa Senyawa Fraksi D8 dengan GCMS ... 62
Lampiran 8. Hasil Analisa Senyawa Fraksi D8 dengan Spektrofotometer IR ... 63
Lampiran 9. Hasil Analisa Senyawa Fraksi D8 dengan ... 64
Lampiran 10. Tabel Hasil Uji Antiinflamasi Senyawa Na-diklofenak ... 68
Lampiran 11. Tabel Hasil Uji Antiinflamasi Senyawa EPMS ... 69
Lampiran 12. Tabel Hasil Uji Antiinflamasi Senyawa Etil Sinamat ... 70
BAB I PENDAHULUAN
1.1 Latar Belakang
Tumbuhan secara luas merupakan sumber sejumlah obat yang memiliki aktivitas yang berbeda-beda seperti antispasmodik, anti-kanker, antimikroba, dan lain sebagainya. Tumbuhan obat merupakan sumber obat alam yang paling kaya di bidang pengobatan tradisional, pengobatan modern, nutraseutikal, suplemen makanan, dan senyawa penuntun untuk obat-obat sintetik (Tiwari et al., 2011).
Hasil penelitian yang sudah banyak dilakukan menunjukkan bahwa pada tumbuhan obat yang berperan dalam perannya sebagai obat yaitu berdasarkan kandungan senyawa metabolit sekunder yang dikandungnya. Metabolit sekunder ini merupakan hasil metabolisme dari tumbuhan itu sendiri dan biasanya hanya ditemukan dalam organisme atau golongan-golongan organisme tertentu saja, tidak semua tumbuhan memiliki kandungan senyawa metabolit sekunder yang sama (Dewick, 2001).
Salah satu tanaman obat asli Indonesia yang telah banyak
dibudidayakan yaitu kencur (Kaempferia galanga L.) dan bagian rimpang kencur ini banyak digunakan sebagai bahan baku industri obat tradisional,
bumbu dapur, bahan makanan, maupun minuman penyegar (Rostiana
dkk., 2003). Tumbuhan ini merupakan salah satu tumbuhan herbal medisinal dari famili Zingiberaceae yang memiliki bermacam-macam kegunaan secara farmakologi yaitu sebagai antiinflamasi, analgesik, nematisida, penolak nyamuk, larvisida, vasorelaksan, sedatif, antineoplastik, antimikroba, antioksidan, antialergi dan penyembuh luka (Umar et al., 2011).
Berdasarkan Review yang dilakukan Umar et al. (2011) terhadap beberapa jurnal tentang aktivitas dari kandungan senyawa metabolit sekunder dari rimpang Kaempferia galanga L., yaitu menunjukkan bahwa etil trans-sinamat dan etil p-metoksisinamat aktif sebagai nematisida, etil
sebagai penolak nyamuk dan larvisida, etil sinamat sebagai vasorelaksan, etil p-metoksisinamat sebagai antineoplastik, luteolin dan apigenin sebagai antioksidan, dan etil p-metoksisinamat sebagai antimikroba. Jurnal ini juga menyatakan bahwa etil p-metoksisinamat dan etil sinamat ditemukan sebagai senyawa vital yang berperan dalam kebanyakan sifat farmakologi dari rimpang Kaempferia galanga L. Berdasarkan penelitian selanjutnya yang dilakukan oleh Umar et al. (2012), menyatakan bahwa etil
p-metoksisinamat beraktivitas sebagai antiinflamasi.
Aktivitas etil p-metoksisinamat sebagai senyawa yang bertanggung jawa terhadap aktivitas ekstrak kencur sebagai antiinflamasi baru ditemukan pada tahun 2012 yang sebelumnya belum bisa ditentukan senyawa mana yang bertanggung jawab sebagai antiinflamasi, sehingga dimungkinkan untuk dilakukan pengujian terhadap senyawa kandungan metabolit lainnya selain etil p-metoksisinamat untuk diujikan aktivitasnya sebagai antiinflamasi. Berdasarkan latar belakang tersebut dan berdasarkan penelusuran pustaka di atas tentang Kaempferia galanga L., terdapat suatu ketertarikan untuk melakukan isolasi kandungan senyawa metabolit sekunder selain etil p-metoksisinamat dan kemudian senyawa yang didapatkan diuji aktivitas antiinflamasinya untuk melihat apakah ada senyawa lain selain etil p-metoksisinamat yang terkandung dalam kencur ini yang memiliki aktivitas sebagai antiinflamasi.
Uji aktivitas antiinflamasi dalam penelitian ini akan dilakukan menggunakan teknik screening assay, dikarenakan berdasarkan pada penelitian yang telah dilakukan oleh Williams et al. (2008) yang menunjukkan teknik screening assay menggunakan Bovine Serum
Albumin menunjukkan langkah yang praktis dan sederhana.
1.2 Rumusan Masalah
Berdasarkan penelusuran pustaka, terdapat ketertarikan untuk
melakukan eksplorasi terhadap kandungan senyawa metabolit sekunder
galanga L. dengan melakukan isolasi terhadap rimpang ini, yang kemudian senyawa yang didapatkan diujikan aktivitas antiinflamasinya.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengisolasi kandungan senyawa metabolit sekunder selain etil p
-metoksisinamat dari rimpang Kaempferia galanga L.
2. Menentukan struktur senyawa metabolit sekunder yang diisolasi. 3. Menguji aktivitas antiinflamasi dari senyawa metabolit sekunder yang
diisolasi.
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat terhadap
perkembangan ilmu pengetahuan tentang pustaka kandungan senyawa
BAB II
TINJAUAN PUSTAKA
2.1. Tinjauan Botani Kaempferia galanga L. 2.1.1. Klasifikasi Tumbuhan (USDA)
Kingdom : Plantae
Subkingdom : Traecheobionta Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Sub Kelas : Commenlinidae
Ordo : Zingiberales
Famili : Zingiberaceae
Genus : Kaempferia
Spesies : Kaempferia galanga Linn.
2.1.2. Deskripsi Tanaman
Kaempferia merupakan genus herbal yang memiliki anggota lebih dari 50 spesies asli dari Asia Timur tropis yang masuk dalam famili Zingiberaceae. Kaempferia merupakan rizoma herbal yang berukuran kecil yang biasanya berbentuk akar tuberous aromatik yang tebal dan rizoma yang pendek (Tang et al., 2014).
Kencur (Kaempferia galanga L.) merupakan salah satu dari lima
jenis tumbuhan yang dikembangkan sebagai tanaman obat asli Indonesia.
Kencur merupakan tanaman obat yang bernilai ekonomis cukup tinggi
sehingga banyak dibudidayakan. Bagian rimpangnya digunakan sebagai
bahan baku industri obat tradisional, bumbu dapur, bahan makanan,
maupun minuman penyegar lainnya (Rostiana dkk., 2003).
2.1.3. Kandungan Kimia
Menurut Hargono (1995), kandungan seyawa Kaempferia galanga
1. Daun : alkaloid, borneol, eucaliptol.
2. Rimpang : tanin, saponin, kalsium oksalat, borneol, kamfen, sineol, etil alkohol, minyak atsiri (2,4%-3.9%) terdiri etil p-metoksisinamate, asam p-metoksisinamat, asam transinamat, p-metoksi stirena, p-asam kumarat, n-pentadekana.
Kandungan senyawa yang terdapat secara melimpah yaitu asam propanoat, pentadekana, etil-p-metoksisinamat. Kandungan lainnya yaitu 1,8-sineol, undekanon, isopropil sinamat, disikloheksilpropandinitril, dipenten dioksida, 9-hidroksi, 2-nonanon, 2,7-oktadien-1-il asetat, etil sikloheksil asetat, cis-11-tetradesenil asetat, 2-heptadekanon, 4-metil isopulegon, champhidin, trans-trans-okta-2,4-dienil asetat, 10-undesil1-1-ol, 3,7-dimetoksikumarin, delta-3carene, alfa pinen, champhene, borneol,
cymene, alpha terpineol, alpha gurjunene, germacrenes, cadinenes,
caryophyllenes, luteolin, dan apigenin (Umar et al., 2011).
2.1.4. Manfaat Kaempferia galanga L.
Zingiberaceae telah ditemukan sebagai sumber yang diperlukan sekali untuk agen pencegahan kanker sejak tumbuhan dari famili Zingiberaceae didemonstrasikan kemungkinan efek hambatnya pada pertumbuhan kanker payudara (MCF-7), kanker kolon (HT-29 dan Col2), kanker paru-paru (A549), kanker perut (SNU-638), dan kanker servic (CaSki). Dilaporkan juga pada skrining ekstrak atau minyak esensial dari sejumlah anggota famili Zingiberaceae yaitu dapat melawan strain bakteri, jamur, dan ragi (Tang et al., 2014).
Kebanyakan rizoma ginger banyak yang bisa dimakan yang telah lama digunakan sebagai bahan untuk pengobatan tradisional selama berabad-abad tetapi tidak sepenuhnya telah dilakukan indentifikasi terhadap aktivitas bioaktifnya (Tang et al., 2014).
sinamat ditemukan sebagai senyawa vital yang berperan dalam kebanyakan sifat farmakologi. Efek aktinosiseptik dari ekstrak Kaempferia
galanga L. sebanding dengan aspirin, mengingat efek nematisida
Kaempferia galanga L. bahkan lebih poten dari pada Carbofuran dan
Na-metan (Umar et al., 2011).
Etil sinamat telah diisolasi dari rimpang Kaempferia galanga L., dan efek vasorelaksannya telah diujikan pada aorta tikus. Etil sinamat menghambat kontraksi yang kuat yang disebabkan oleh tingginya Kalium dan fenileprin dalam keadaan yang bergantung pada konsentrasi, dengan nilai IC50 respektif 0,30+/- 0,05 mM dan 0,38 +/- 0,04 mM. Efek vasorelaksan dari etil sinamat diperantarai melalui berbagai jalur yang mungkin menjelaskan penggunaan secara tradisional tumbuhan induk dalam pengobatan hipertensi (Othman et al., 2002).
Skrining ekstrak untuk aktivitas biologis dimulai dengan brine
shrimp lethality bioassay, diikuti oleh uji aktivitas antihipertensinya pada
tikus yang dianastesi, yang melibatkan pemantauan efek ekstrak pada tekanan darah arteri rata-rata. Kandungan fraksi yang dikandung dari prosedur pemisahan telah dianalisis menggunakan kromatografi gas (Otmant et al., 2006). Analisis terhadap data untuk tes Brine Shrimp
Lethality menggunakan program komputer Finney menunjukkan bahwa
ekstrak ini memiliki bioaktivitas yang poten dengan nilai ED(50) 7,92+/-0,13 mikrogmL(-1). Pemberian ekstrak secara intravena menyebabkan penurunan tekanan arteri basal rata-rata yang dihubungkan dengan dosis 130+/-5 mmHg pada tikus yang dianastesi, dengan efek maksimal dilihat setelah 5-10 menit setelah injeksi. Kromatografi gas menunjukkan bahwa senyawa yang berada pada fraksi aktif pada bioassay ekstrak diklorometan yaitu etil sinamat. Senyawa aktif vasoreleksan, etil sinamat, telah diisolasi sebagai minyak yang berwarna tidak kuat. (Othman et al., 2006).
penghambat yang paling efektif untuk edema. Berdasarkan uji GCMS menunjukan bahwa pada sub-fraksi yang aktif teridentifikasi bahwa etil p -metoksisinamat merupakan senyawa yang dominan terdapat pada fraksi ekstrak tersebut. Berdasarkan hasil uji pada penghambatan edema yang diinduksi karagenan dengan menggunakan etil p-metoksisinamat menunjukkan hasil kemungkinan bahwa etil p-metoksisinamat memiliki aktivitas sebagai antiinflamasi (Umar et al., 2012).
Berdasarkan Review yang dilakukan Umar et al. (2011) terhadap beberapa jurnal tentang kandungan senyawa dan aktivitas dari Kaempferia
galanga L., bahwa Kaempferia galanga L. memiliki aktivitas farmakologi
sebagai analgesik dan antiinflamasi dengan senyawa yang responsibel belum diketahui, aktivitas sebagai nematisida dengan senyawa yang responsibel yaitu etil trans-sinamat dan etil p-metoksisinamat, aktivitas sebagai penangkal nyamukdan larvisida dengan senyawa yang responsibel yaitu etil p-metoksisinamat, etil sinamat dan 3 carene, 2-propionic acid,
aktivitas sebagai vasorelaksan senyawa yang responsibel yaitu etil sinamat, aktivitas sebagai antineoplastik senyawa yang responsibel yaitu etil p-metoksisinamat, aktivitas sebagai antioksidan senyawa yang responsibel yaitu luteolin dan apigenin, dan aktivitas antimikrobial senyawa yang responsibel yaitu etil p-metoksisinamat.
2.2. Inflamasi
Peradangan adalah reaksi lokal pada vaskular dan unsur-unsur pendukung jaringan terhadap cedera yang mengakibatkan pembentukan eksudat kaya protein. Peradangan merupakan respon protektif sistem imun nonspesifik yang bekerja untuk melokalisasi, menetralisasi, atau menghancurkan agen pencedera dan persiapan untuk proses penyembuhan (Price and Wilson, 2002).
Tanda-tanda utama peradangan adalah rubor (kemerahan), kalor
(panas), dolor (nyeri), tumor (pembengkakan), dan fungsio laesa
patogenik. Perhatikan bahwa infeksi tidak sama dengan peradangan dan infeksi hanya merupakan salah satu penyebab peradangan (Price and
Wilson, 2002).
Faktor-faktor yang memicu penyembuhan luka meliputi suplai darah yang baik ke daerah cedera, usia muda, nutrisi yang baik, pendekatan tepi luka yang baik, dan fungsi leukosit serta respon peradangan yang normal. Penyembuhan luka dapat terganggu atau lambat jika ada pemberian kortikosteroid atau adanya benda asing, jaringan nekrotik atau infeksi pada luka (Price and Wilson, 2002).
2.3. Material Tumbuhan
Tumbuhan dikumpulkan baik secara acak atau berdasarkan persediaan pengobatan di area greografis dimana tumbuhan itu ditemukan. Tumbuhan segar atau kering bisa dijadikan sebagai sumber untuk mengisolasi senyawa metabolit sekunder. Banyak yang telah melaporkan tentang sediaan ekstrak dari jaringan tumbuhan segar, namun banyak juga tumbuhan yang digunakan dalam bentuk kering (atau sebagai ekstrak encer) untuk pengobatan tradisional, tumbuhan biasanya dikeringkan dengan diangin-anginkan untuk mendapatkan berat konstan sebelum diekstraksi. Penelitian lain ada yang melakukan pengeringan tumbuhan dengan menggunakan oven sekitar 40 ˚C selama 72 jam (Tiwari et al, 2011).
2.4. Simplisia
golongan, yaitu simplisia nabati, simpisia hewani, dan simplisia pelikan/mineral (Gunawan, 2004).
1. Simplisia nabati
Simplisia nabati adalah simplisia yang dapat berupa tanaman utuh, bagian tanaman, eksudat tanaman, atau gabungan antara ketiganya (Gunawan, 2004). Eksudat tanaman adalah isi sel yang secara sepontan keluar dari tanaman atau dengan cara tertentu sengaja keluar dari selnya. Eksudat tanaman dapat berupa zat-zat atau bahan-bahan nabati lainnya yang dengan cara tertentu dipisahkan diisolasi dari tanamannya (Gunawan, 2004).
2. Simplisia hewani
Simplisia hewani adalah simplisia berupa hewan utuh atau zat-zat berguna yang dihasilkan oleh hewan dan belum berupa bahan kimia murni. Contohnya adalah minyak ikan (Oleum iecoris asselli) dan madu (Mel depuratum) (Gunawan, 2004).
3. Simplisia pelikan atau mineral
Simplisia pelikan atau mineral adalah simplisia berupa bahan pelikan atau mineral yang belum diolah atau telah diolah dengan cara sederhana dan belum berupa bahan kimia murni. Contohnya adalah serbuk seng dan serbuk tembaga (Gunawan, 2004).
2.4.1. Pembuatan simplisia
Dasar pembuatan simplisia meliputi beberapa tahapan. Adapun tahapan tersebut dimulai dari pengumpulan bahan baku, sortasi basah, pencucian, pengubahan bentuk, pengeringan, sortasi kesing, pengepakan, dan penyimpanan (Gunawan, 2004).
1. Pengumpulan bahan baku
2. Sortasi basah
Sortasi basah adalah pemilihan hasil panen ketika tanaman masih segar. Sortasi dilakukan terhadap:
a. Tanah dan kerikil
b. Rumput-rumputan
c. Bahan tanaman lain atau bagian lain dari tanaman yang tidak digunakan
d. Bagian tanaman yang rusak (dimakan ulat dan sebagainya).
3. Pencucian
Pencucian simplisia dilakuakn untuk membersihkan kotoran yang melekat, terutama bahan-bahan yang berasal dari dalam tanah dan juga bahan-bahan yang tercemar pestisida. Pencucian bisa dilakukan dengan menggunakan air (Gunawan, 2004).
4. Pengubahan bentuk
Menurut Gunawan (2004), pada dasarnya pengubahan bentuk simplisia adalah untuk memperluas permukaan bahan baku. Semakin luas permukaan maka bahan baku akan semakin cepat kering. Proses pengubahan bentuk ini meliputi beberapa perlakuan berikut :
a. Perajangan untuk rimpang, daun, dan herbal.
b. Pengupasan untuk buah, kayu, kulit kayu, dan biji dipisahkan dari bonggolnya.
c. Pemiprilan khusus untuk jagung, yaitu biji dipisahkan dari bonggolnya.
d. Pemotonga untuk akar, batang, kayu, kulit kayu, dan ranting. e. Penyerutan untuk kayu.
5. Pengeringan
Menurut Gunawan (2004), proses pengeringan simplisia, terutama bertujuan sebagai berikut :
a. Menurunkan kadar air sehingga bahan tersebut tidak mudah ditumbuhi kapang dan bakteri.
c. Memudahkan dalam hal pengolahan proses selanjutnya (ringkas, mudah disimpan, tahan lama, dan sebagainya).
Berikut ini faktor-faktor yang mempengaruhi pengeringan :
a. Waktu pengeringan. Semakin lama dikeringkan akan semakin kering bahan tersebut.
b. Suhu pengeringan. Semakin tinggi suhunya semakin cepat kering, tetapi harus diperhatikan daya tahan kandungan zat aktif di dalam sel yang kebanyakan tidak tahan panas.
c. Kelembapan udara di sekitarnya dan kelembapan bahan atau kandungan air dari bahan.
d. Ketebalan bahan yang dikeringkan. e. Sirkulasi udara.
f. Luas permukaan bahan. Semakin luas permukaan bahan semakin mudah kering.
6. Sortasi Kering
Sortasi kering adalah pemilihan bahan setelah mengalami proses pengeringan. Pemilihan dilakukan terhadap bahan-bahan yeng terlalu gosong, bahan yang rusak akibat terlindas roda kendaraan (misalnya dikeringkan di tepi jalan raya), atau dibersihkan dari kotoran hewan (Gunawan, 2004).
2.5. Pemilihan pelarut
Keberhasilan dalam menentukan aktivitas biologis dari material tumbuhan berdasarkan pada pemilihan pelarut yang digunakan dalam proses ekstraksi. Sifat-sifat dari pelarut dalam ekstraksi tumbuhan terdiri dari toksisitas yang rendah, mudah untuk diuapkan pada suhu rendah, absorpsi yang cepat pada tumbuhan, memiliki aksi untuk pengawetan, tidak menyebabkan ekstrak menjadi kompleks atau terpisah (Tiwari et al., 2011).
ditangani selanjutnya, perbedaan dalam penghambatan senyawa yang diekstraksi, toksisitas pelarut dalam proses bioassay, potensi bahaya kesehatan dari ekstraktan (Tiwari et al., 2011).
2.6. Ekstraksi
e. Ukuran partikel dari jaringan tumbuhan f. Perbandingan pelarut terhadap sampel
Ekstraksi dalam hal farmaseutik merupakan pemisahan bagian yang aktif secara medisinal dari jaringan tumbuhan (dan hewan) menggunakan pelarut tertentu melalui prosedur standar. Selama ekstraksi, pelarut berdifusi ke dalam material padat tumbuhan dan melarutkan senyawa-senyawa dengan kepolaran yang sama (Tiwari et al., 2011).
Parameter dasar yang mempengaruhi kualitas dari sebuah ekstrak adalah :
a. Bagian tumbuhan yang digunaka sebagai material awal b. Pelarut yang digunakan dalam ekstraksi
c. Prosedur ekstraksi
2.6.1. Prosedur Ekstraksi (Tiwari et al., 2011) 1. Homogenisasi Jaringan Tumbuhan
Homogenisasi jaringan tumbuhan dalam pelarut telah secara luas digunakan oleh para peneliti. Kering atau basah, bagian tumbuhan digiling menggunakan blender untuk mendapatkan ukuran partikel yang halus, diekstrak dalam pelarut tertentu, dan dikocok dengan kuat selama 5-10 menit atau dibiarkan selama 24 jam setelah selesai kemudian ekstrak tersebut disaring. Filtrat kemudian diuapkan pelarutnya dan dilarutkan kembali dalam pelarut untuk menentukan konsentrasi. Beberapa peneliti melakukan sentrifugasi untuk menjernihkan ekstrak.
2. Jenis Ekstraksi
Metode ekstraksi yang telah berhasil yaitu dengan menggunakan kenaikan kepolaran pelarut, dari mulai pelarut non polar (heksan) sampai pelarut yang lebih polar (metanol) untuk menjamin bahwa rentang kepolaran yang luas menyebabkan banyak senyawa yang dikandung dapat terekastraksi.
a. Ekstraksi Soklet
Beberapa peneliti melakukan ekstraksi menggunakan soklet pada material tumbuhan kering dengan menggunakan pelarut organik. Metode ini tidak bisa digunakan untuk ekstraksi senyawa yang termolabil, dimana pemanasan yang lama dapat mengakibatkan degradasi dari senyawa. Ekstraksi menggunakan soklet hanya dibutuhkan jika senyawa yang diinginkan memiliki kelarutan yang terbatas dalam sebuah pelarut dan senyawa yang diinginkan memiliki kelarutan yang tinggi dalam sebuah pelarut tertentu, dengan syarat filtrasi yang digunakan sederhana dan dapat memisahkan senyawa tersebut dari kandungan yang tidak larut. Pelarut yang digunakan selalu baru. Metode ini tidak bisa digunakan untuk senyawa yang termolabil karena pemanasan yang lama mungkin mengakibatkan degradasi dari senyawa.
b. Maserasi
tertutup selama periode yang telah ditentukan dengan frekuensi pengocokan sampai zat yang larut dapat terekstraksi. Metode ini paling cocok untuk senyawa yang termolabil.
c. Dekoktasi
Metode ini digunakan untuk mengekstraksi senyawa dari sampel kasar yang dapat larut dalam air dan stabil setelah melewati proses pemanasan selama 15 menit, pendinginan, dan penyaringan.
d. Infus
Cara ekstraksi infus ini menghasilkan larutan encer yang
mengandung komponen yang mudah larut dalam suhu >90oC dari
simplisia.
e. Digesti
Digesti merupakan bentuk maserasi yang menggunakan pemanasan yang hati-hati selama proses maserasi dan merupakan maserasi dengan pengadukan terus menerus pada temperatur yang lebih tinggi dari
temperatur ruang (umumnya 25-30oC). Digesti ini adalah jenis ekstraksi
maserasi di mana suhu sedang digunakan selama proses ekstraksi
f. Perkolasi
Perkolasi digunakan paling sering untuk kandungan aktif ekstrak dalam sediaan tingtur dan ekstrak cair. Alat yang digunakan yaitu perkulator. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperatur kamar
g. Sonikasi
Prosedur sonikasi meliputi penggunaan ultrasound dengan rentang frekuensi dari 20 kHz sampai 2000 kHZ, ultrasound ini meningkatkan permeabilitas dari dinding sel dan prosedur kavitasi. Walaupun proses ini berguna dalam beberapa kasus, seperti ekstraksi rauwolfi sebuah akar, namun penggunaan dalam skala besar terbatas karena biaya yang mahal. Salah satu kerugian dari prosedur ini yaitu efek dari energi ultrasound
2.7. Metode Fraksinasi
Proses fraksinasi ini merupakan proses pemisahan campuran ke dalam sejumlah fraksi yang mempunyai ciri tersendiri, seperti dua fase pada ekstraksi cair-cair, atau mungkin eluat hasil sebuah kromatografi kolom yang terbagi ke dalam fraksi-fraksi.Tipe fraksinasi tergantung pada sampel masing-masing dan tujuan dari pemisahan (Cannell, 1998).
Untuk menganalisis senyawa hasil isolasi dengan struktur yang komplek, pada umumnya membutuhkan materian yang kemurniannya 89-100%. Jika senyawa berada pada komsentrasi yang tinggi dalam material awal dan ada standar yang siap untuk pembanding, analisis struktur bisa dilakukan dengan kemurnian material yang rendah dan pemurnian mungkin akan membutuhkan langkah yang lebih singkat (Cannell, 1998).
Jika bahan alam dibutuhkan untuk tes biologis, maka yang penting untuk diketahui yaitu derajat kemurnian dan lebih baik murni. Hal ini dikarenakan bahwa kemurnian dapat memberikan kenaikan sebagian atau seluruhnya pada aktivitas biologis. Jika senyawa digunakan untuk uji farmakologi atau farmakokinetik maka senyawa harus sangat murni (umunya > 99%) (Cannell, 1998).
Sebuah sampel dalam beberapa kasus, hanya dibutuhkan memiliki sebagian kemurniannya untuk memperoleh informasi struktur yang cukup. Namun, dalam beberapa kasus juga, seperti dalam studi kristalografi X-ray, material dibutuhkan dalam status kemurnian yang ekstrim, umumnya > 99% (Cannell, 1998).
2.7.1. Kromatografi
1. Kromatografi Lapis Tipis (KLT)
pelat aluminium, atau pelat plastik. Meskipun demikian, kromatografi planar ini dapat dikatakan sebagai bentuk terbuka dari kromatografi kolom (Gandjar, 2007).
Fase gerak yang dikenal sebagai pelarut pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar, 2007).
Kromatografi lapis tipis dalam pelaksanaannya lebih murah dibandingkan dengan kromatografi kolom, demikian juga peralatan yang digunakan. Peralatan yang digunakan dalam kromatografi lapis tipis lebih sederhana dan dapat dikatakan bahwa hampir semua laboratorium dapat melaksanakan setiap saat secara cepat (Gandjar, 2007).
Pemisahan pada umunya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut dikarakterisasi dengan jarak migrasi solut terhadap jarak ujung fase geraknya (Gandjar, 2007).
2. Kromatografi Kolom
Kromatografi kolom merupaka kromatografi yang paling awal yang digunakan untuk pemisahan sampel dalam jumlah yang besar (Gandjar, 2007). Ekstrak yang berasal dari bahan alam biasanya mengandung berbagai jenis senyawa yang berbeda, dan akan sangat sulit untuk mengisolasi senyawa murni dari campuran senyawa tersebut jika hanya dengan menggunakan satu jenis teknik pemisahan saja. Oleh karena itu, pada tahap awal campuran senyawa tersebut harus dipisahkan terlebih dahulu menjadi beberapa fraksi yang mengandung senyawa dengan nilai kepolaran atau ukuran yang sama. Fraksi-fraksi ini dapat secara nyata dipisahkan dengan menggunakan ekstraksi cair-cir atau dapat juga diiringi dengan mengelusinya menggunakan kolom kromatografi (Sarker et al., 2006).
dapat digunakan pada kromatografi kolom. Dengan menggunakan berbagai jenis lempeng KLT serta sistem pelarut yang berbeda, maka sistem yang cocok untuk kromatografi kolom dapat diketahui. Informasi ini akan sangat berguna untuk kondisi awal pada tahap pemisahan dan gradien yang digunakan untuk mengelusi senyawa-senyawa yang sesuai (Reid dan Sarker, 2006).
2.8. Metode Spektroskopi dalam Penentuan Struktur
Teknik spektroskopi adalah salah satu teknik analisa kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik.
2.8.1. GCMS
Kromatografi gas dan spektrometer massa dapat digunakan untuk
memisahkan komponen dengan memberikan waktu retensi dan puncak
elusi yang dapat dimasukkan ke dalam spektrometer massa untuk
memperoleh berat molekul, karakteristik dan informasi fragmentasi
(Heinrich, 2004). Spektrometer massa sebagai metode deteksi yang
memberikan data yang bermakna, yang diperoleh dari penentuan langsung
molekul zat atau fragmen (Heinrich, 2004).
Pada data komputer (Library search) dalam GCMS ini sudah
terdapat ratusan ribu senyawa organik yang sudah didata. Sehingga dapat
menghasilkan hasil pengukuran yang mengeluarkan data kemungkinan
senyawa dari sampel yang diuji. Dari data kemungkinan senyawa ini dapat
dilihat derajat kemiripannya (quality), dengan derajat kemiripan yang lebih
dari 90% dapat dikatakan identik atau sama (Kosela S., 2010).
2.8.2. Spektrofotometri IR
Daerah inframerah pada spektrum elektromagnetik membentang
luas dari berakhirnya spektrum merah dari spektrum nampak sampai
14.000 dan 20 . Rentang spektrum yang paling banyak digunakan
yaitu daerah pertengahan inframerah (mid-infrared) yaitu pada daerah
4000 sampai 200 (2,5 sampai 5 μm) (Willard H.et al., 1988).
Hampir semua senyawa yang memiliki ikatan kovalen, baik
organik maupun anorganik, menyerap berbagai frekuensi radiasi
elektromagnetik diwilayah inframerah dari spektrum elektromagnetik.
Wilayah ini terletak pada panjang gelombang yang berkisar dari sekitar
400 sampai 800 nm (Pavia et al., 2008).
2.8.3. Spektrometri Nuclear Magnetic Resonance (NMR)
NMR merupakan teknik spektroskopi yang mengandalkan sifat magnetik dari inti atom. Ketika ditempakan di daerah magnetik yang kuat, inti tertentu beresonansi pada sebuah karakteristik frekuensi dalam rentang frekuensi radio dari spektrum elektromagnetik. Sedikit variasi dalam frekuensi resonansi ini memberi kita informasi yang detail tentang struktur molekul dimana atom berada (Jacobsen, 2007).
Informasi yang didapatkan dari spektroskopi inframerah yaitu informasi tentang gugus fungsi yang terdapat didalam struktur suatu molekul, kemudian data informasi yang didapatkan dari NMR yaitu informasi secara magnetis tentang sejumlah atom yang dimiliki senyawa tersebut (Pavia et al., 2001). Berdasarkan Willard et al. (1988), karakteristik dari penyerapan energi oleh inti yang berputar dalam medan magnet yang kuat adalah ketika diiradiasi kedua pada daerah yang lemah akan membentuk garis yang tegak lurus, dari hal tersebut maka akan diperoleh infromasi tentang identifikasi dari konfigurasi suatu atom dalam suatu molekul.
2.9. Uji Antiinflamasi
antidenaturasi oleh panas yang dikenakan pada Bovine Serum Albumin
(Williams et al., 2008).
Ketika BSA dipanaskan dan mengalami denaturasi, BSA mengekspresikan antigen untuk reaksi hipersensitif tipe III dan yang mana hal itu dihubungkan untuk penyakit seperti penyakit serum, glomerulonefritis, reumatoid atritis, dan sistem lupus eritematosis (Williams et al., 2008).
Pada uji BSA, jika senyawa sampel menghambat denaturasi dengan persen inhibisi >20% maka dianggap memiliki aktivitas antiinflamasi dan layak untuk dikembangkan lebih lanjut (Williams et al.,
2008). Perhitungan persentasi inhibisi dapat dilakukan dengan menggunakan rumus sebagai berikut:
% Inhibisi =
BAB III
METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Analisis Obat dan
Pangan Halal, Laboratorium Farmakognosi dan Fitokimia, Laboratorium
Penelitian 1, serta Laboratorium Kimia Obat Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta, dan
Laboratorium Kimia LIPI Serpong. Penelitian ini dimulai dari bulan
Oktober 2014 sampai bulan Mei 2015.
3.2. Alat dan Bahan 3.2.1. Alat
Alat-alat yang digunakan dalam penelitian ini, diantaranya Gas
Chromatography-Mass Spectrometry (Agilent 7890A), Nuclear Magnetic
Resonance (Jeol, 500 MHz), Spectrofotometri IR (SHIMADZU), vacuum
rotary evaporator (SB-1000 Eyela), water bath (SB-1000 Eyela), plat
aluminium TLC silica gel 60 (Merck), chamber KLT, blender, kolom
kromatografi, statif, erlenmeyer vacuum, vial, pipa kapiler (Pupik Med),
oven (Memmert), mikropipet (Biorad), timbangan analitik (Kern-ACJ
220-4M), labu ukur (Pyrex), tabung reaksi (Pyrex), vortex mixter
(VM-300), pH meter (methorm), corong, gelas piala, botol gelap, batang
pengaduk, corong pisah, kapas, spatula, kertas saring, rak, aluminium foil.
3.2.2. Bahan
Bahan-bahan yang digunakan adalah rimpang kencur (Kampferia
galanga L.), silica gel 60 (Merck, 0,063-0,200 mm), n-heksan, etil asetat,
metanol, metanol p.a. (Merck), aquabides (Otsuka), natrium diklofenak
(Sigma), natrium hidroksida (Merck), tris base (Sigma), bovine serum
3.3. Prosedur Penelitian 3.3.1. Determinasi
Determinasi tumbuhan kencur dilakukan di Herbarium Bogoriense Bidang Botani, Puslit Biologi, LIPI, Cibinong, Bogor.
3.3.2. Penyiapan Simplisia
Rimpang kencur Kaempferia galanga L. diperoleh dari kebun
Balittro (Balai Penelitian Tanaman Rempah dan Obat) di wilayah
Sukabumi, Jawa Barat. Sebanyak 50 Kg rimpang kencur tersebut
dibersihkan dengan cara dicuci menggunakan air megalir. Kencur yang
telah dibersihkan dirajang sekitar 2-3 mm kemudian dikeringkan dengan
diangin-anginkan tanpa terkena sinar matahari. Kencur yang telah menjadi
berwarna kecokelatan, selanjutnya kencur diblender sampai menjadi
serbuk halus. Serbuk halus yang didapatkan yaitu sebanyak 7,69 Kg.
3.3.3. Ekstraksi
Serbuk simplisia kencur diekstraksi menggunakan metode maserasi
bertingkat. Sebanyak 7,69 Kg dimasukkan ke dalam botol-botol maserasi.
Maserasi pertama yaitu menggunakan n-heksan (35 L). Setiap penyarian
dilakukan selama 3 hari dengan sesekali dilakukan pengocokan. Setelah 3
hari hasil maserasi kemudian disaring menggunakan kertas saring. Setelah
hasil maserasi menggunakan pelarut n-heksan jernih, kemudian ampas sisa
ekstraksi menggunakan n-heksan diekstraksi kembali dengan pelarut
berikutnya yaitu etil asetat (25 L) dan pelarut terakhir yaitu metanol (20 L)
dengan cara maserasi yang sama seperti maserasi pertama. Hasil maserasi
masing-masing diuapkan pelarutnya menggunakan vacuum rotary
evavorator. Hasil penguapan ini menghasilkan ekstrak kental fraksi
n-heksan sebanyak 927,94 mg, fraksi etil asetat sebanyak 232,51 mg, dan
fraksi metanol sebanyak 115,27 mg.
Hasil rendemen dihitung menggunakan rumus di bawah ini:
% rendemen =
3.3.4. Isolasi dan Pemurnian Senyawa
1. Kromatografi Lapis Tipis Fraksi Etil Asetat
Setiap fraksi hasil ekstraksi diidentifikasi menggunakan kromatografi lapis tipis dengan pengembang n-heksan:etil asetat (4:1). Kemudian dilihat di bawah lampu UV pada panjang gelombang 254 nm. Bercak yang muncul dibandingkan dengan bercak senyawa EPMS. Fraksi
etil asetat merupakan fraksi yang memiliki pola bercak yang terpisah lebih
baik daripada fraksi n-heksan dan fraksi metanol.
2. Pemisahan Kristal
Pada fraksi etil asetat terdapat banyak kristal EPMS sehingga
dilakukan pemisahan terhadap kristal tersebut dengan penyaringan
menggunakan vacuum. Kristal yang sudah terpisahkan dianalisis
menggunakan kromatografi lapis tipis dengan senyawa pembanding yaitu
senyawa EPMS untuk memastikan bahwa kristal tersebut merupakan
EPMS.
3. Kromatografi Kolom Fraksi Etil Asetat
Kromatografi kolom dilakukan sebanyak 2 kali. Kromatografi kolom pertama dilakukan pada ekstrak fraksi etil asetat (22,87 g), dengan proses kromatografi kolom sebagai berikut:
a. Penyiapan Fase Padat
Silika gel 60 ditimbang sebanyak 657,49 gram dan kolom
kromatografi yang digunakan yaitu berdiameter 3 cm dan tinggi 75 cm.
Silika gel 60 yang telah ditimbang dikemas ke dalam kolom kromatografi.
b. Membuat Fase Gerak
Fase gerak dibuat dengan menggunakan sistem gradien yaitu dibuat
fase gerak dengan kepolaran yang meningkat. Fase gerak yang digunakan
yaitu :
a. n-heksan 100 %
b. n-heksan : etil asetat (kenaikan perbandingan 20%)
- perbandingan 8:2
- perbandingan 6:4
- perbandingan 2:8
c. etil asetat 100%
d. etil asetat : metanol (kenaikan perbandingan 20%)
- perbandingan 8:2
Pelarut perbandingan pertama dimasukan ke dalam kolom sampai
habis, kemudian dilanjutkan dengan perbandingan selanjutnya sampai
perbandingan terakhir. Hasil elusi ditampung dengan vial-vial dan diberi
nomor secara berurutan. Hasil eluat dimonitor menggunakan kromatografi
lapis tipis untuk melihat bercak yang terlihat di bawah lampu UV 254 nm.
Kromatografi kolom pertama ini menghasilkan 167 vial yang
terkelompokan menjadi 16 fraksi (A-P), dengan fraksi D diambil unkut
dimurmikan lebih lanjut.
Fraksi D digabungkan kemudian dimurnikan dengan kromatografi
kolom kedua. Jumlah gabungan yaitu sebanyak 2,68 g. Proses
kromatografi kolom sebagai berikut:
a. Penyiapan Fase Padat Kolom Kromatografi
Silika gel 60 ditimbang sebanyak 53,53 g dan kolom kromatografi
yang digunakan yaitu berdiameter 2 cm dan tinggi 35 cm.
b. Membuat Fase Gerak
Fase gerak dibuat dengan menggunakan sistem gradien yaitu dibuat
fase gerak dengan kepolaran yang meningkat. Fase gerak yang digunakan
yaitu :
a. n-heksan 100 %
- perbandingan 8:2
- perbandingan 6:4
- perbandingan 4:6
- perbandingan 2:8
c. etil asetat 100%
Setiap perbandingan dibuat sebanyak 200 mL, kecuali n-heksan
digunakan lebih dari 200 mL yaitu sebanyak 8,87 L karena senyawa
sasaran berada pada pengembang nonpolar.
d. Proses Elusi
Pelarut perbandingan pertama dimasukan ke dalam kolom sampai
hasil analisa bercak menggunakan KLT tidak muncul lagi bercak dengan
nilai Rf senyawa sasaran. Setelah itu dilanjutkan dengan perbandingan
selanjutnya sampai perbandingan terakhir. Hasil elusi ditampung dengan
vial-vial dan diberi nomor secara berurutan. Hasil eluat diidentifikasi
menggunakan kromatografi lapis tipis untuk melihat bercak yang terlihat
di bawah lampu UV 254 nm.
Hasil kromatografi kolom kedua mendapatkan 559 vial untuk fase
gerak n-heksan, yang kemudian terbagi ke dalam 9 fraksi berdasarkan
hasil identifikasi pola kromatogram menggunakan KLT. Perbandingan
selanjutnya meghasilkaan 65 vial yang terbagi kedalam 7 fraksi.
Fraksi yang memiliki 1 bercak yaitu fraksi D8. Fraksi D8
selanjutnya dianalisa menggunakan GCMS, spektrofotometri IR, dan
.
3.3.5. Uji Kemurnian Senyawa Hasil Isolasi
Untuk menentukan kemurnian dari senyawa yang didapatkan,
dilakukan identifikasi menggunakan GCMS dengan melihat waktu retensi
dan persentasi dari senyawa.
1. GCMS
Optimasi alat GCMS yaitu menggunakan kolom HP-5MS (30 m x 0,25 mm ID x 0,25 µm); suhu awal 70 0C selama 2 menit, dinaikkan ke
2850C. Kecepatan aliran yang digunakan 1,2 mL/min dengan split 1:100.
Parameter scanning dilakukan dari massa paling rendah yaitu 35 sampai
paling tinggi 550.
2. Kromatografi Lapis Tipis Dua Dimensi
Uji kemurnian senyawa dapat dilakukan dengan menggunakan
KLT dua dimensi. Langkah kerjanya yaitu menyiapkan plat KLT silica gel
60 dengan ukuran persegi (5 cm-5 cm) dan disiapkan pula fase
pengembang dengan perbandingan n-heksan:etil asetat (4:1). Sampel
kemudian ditotolkan pada salah satu ujung sisi plat KLT. Proses
pengembangan yaitu menggunakan 2 arah, arah pertama mengikuti sistem
pengembangan askenden dari sisi bawah tempat sampel ditotolkan. Setelah
kering, selanjutnya pengembangan kedua dengan menggunakan arah
pengembangan askenden kembali yang tegak lurus dari arah pertama.
Kemudian bercak dilihat di bawah lampu UV pada panjang gelombang
254 nm.
3.3.6. Penentuan Struktur Molekul Senyawa Hasil Isolasi
Penentuan struktur senyawa yang didapatkan dilakukan dengan
menganalisa menggunakan Gas Chromatography-Mass Spectrometry,
spektrofotometri IR, dan Proton Nuclear Magnetic Resonance
( ).
1. Analisa Senyawa Fraksi D8 Menggunakan GCMS
Kolom yang digunakan pada analisa menggunakan GCMS adalah HP-5MS (30 m x 0,25 mm ID x 0,25 µm) dengan suhu awal 70 0C selama
2 menit, dinaikkan ke suhu 2850C dengan kecepatan 20 0C/min selama 20
menit. Suhu MSD 2850C dan kecepatan aliran 1,2 mL/min dengan split
1:100. Parameter scanning dilakukan dari massa paling rendah yakni 35
sampai paling tinggi 550. Senyawa diidentifikasi berdasarkan waktu
retensi dan persentasi kesamaan pola fragmentasi dengan senyawa dari
2. Analisa Fraksi D8 dengan Spektrofotometri IR
Sampel disiapkan kira-kira 1-2 mg, kemudian pada sampel tersebut
ditambahkan bubuk KBr murni kira-kira sebanyak 200 mg dan diaduk
hingga homogen. Sampel/pelet KBr diambil yang telah homogen
ditempatkan dalam tempat sampel pada alat spektrofotometri inframerah
untuk dianalisa (Hidayati, 2012).
3. Analisa Struktur Senyawa Fraksi D8 Msenggunakan
Identifikasi senyawa selanjutnya yaitu menggunakan instrumen
NMR 500 MHz (JEOL JNM-ECA 500). Langkah yang dilakukan adalah
10 mg sampel dilarutkan dalam pelarut kloroform bebas proton. Setelah
dilarutkan kemudian dimasukkan kedalam tube khusus NMR untuk
dianalisa .
3.3.7. Uji Antiinflamasi
Pada uji antiinflamasi ini mengacu pada jurnal Williams et al.
(2008), dengan langkah yang pertama dilakukan yaitu membuat reagen
yang akan digunakan sebagai berikut :
1. Pembuatan larutan TBS (Tris Buffer Saline) pH 5,7
Ditimbang sebanyak 605 mg tris base dan 4,35 g NaCl. Kemudian
tris base dan NaCl yang telah ditimbang dilarutkan dalam 500 mL
akuabides. Selanjutnya diukur pH dan dibuat pH menjadi 5,7 dengan
menggunakan asam asetat glasial.
2. Pembuatan larutan Na-diklofenak sebagai kontrol positif
Larutan Na-diklofenak dibuat dalam beberapa variasi konsentrasi
dengan larutan induk dibuat sebesar 10.000 ppm dalam pelarut metanol pa.
Selanjutnya dari larutan induk dibuat konsentrasi 1000, 100, dan 10 ppm
dengan teknik pengenceran.
3. Pembuatan larutan EPMS dan senyawa hasil isolasi
Larutan EPMS dan senyawa fraksi D8 masing-masing dibuat
dalam beberapa variasi konsentrasi dengan larutan induk dibuat sebesar
10.000 ppm dalam pelarut metanol pa. Selanjutnya dari larutan induk
4. Pembuatan larutan BSA (Bovine Serum Albumin) 0,2% (W/V)
Larutan BSA dibuat dalam larutan TBS yang telah disiapkan
sebelumnya. Ditimbang sebanyak 500 mg BSA yang kemudian dilarutkan
dalam larutan TBS sebanyak 250 mL.
Setelah larutan BSA selesai dibuat, selanjutnya dilakukan proses
pengujian dengan membuat larutan sampel uji, larutan kontrol negatif, dan
larutan kontrol positif.
1. Pembuatan larutan sampel uji
Larutan sampel uji dibuat sebanyak 5 mL (masing-masing
konsetrasi), yang terdiri dari 50 μL larutan sampel (dari setiap konsentrasi
10.000, 1000, 100, dan 10 ppm) dan masing-masing di tambahkan larutan
BSA sampai volume 5 mL. Sehingga didapatkan konsentrasi 100, 10, 1,
dan 0,1 ppm.
2. Pembuatan larutan kontrol negatif
Larutan kontrol negatif dibuat sebanyak 5 mL, yang terdiri dari 50 μL metanol dan di tambahkan larutan BSA sampai volume 5 mL.
3. Pembuatan larutan kontrol positif
Larutan kontrol positif dibuat sebanyak 5 mL (masing-masing
konsentrasi), yang terdiri dari 50 μL larutan Na-diklofenak (dari setiap
konsentrasi 10.000, 1000, 100, dan 10 ppm) dan di tambahkan larutan
BSA sampai volume 5 mL pada masing-masing konsentrasi. Sehingga
didapatkan konsentrasi 100, 10, 1, dan 0,1 ppm.
Setiap larutan baik larutan uji, larutan kontrol negatif, maupun
larutan kontrol positif masing-masing diinkubasi selama 30 menit. Hasil
inkubasi selanjutnya dipanaskan menggunakan shacking bath selama 5
menit dengan su u 72 C kemudian didinginkan di bawah suhu ruangan
selama 25 menit. Langkah terakhir yaitu pengukuran absorbansi BSA yang
terdenaturasi menggunakan septrometer UV-Vis (660 nm) dan dihitung
jumlah hambatan yang dihasilkan dengan menggunakan rumus sebagai
berikut:
% Inhibisi =
BAB IV
HASIL DAN PEMBAHASAN
4.1. Determinasi
Determinasi tumbuhan kencur dilakukan di Herbarium Bogoriense
Bidang Botani, Puslit Biologi, LIPI, Cibinong, Bogor dengan hasil
determinasi membuktikan bahwa tumbuhan yang digunakan yaitu
tumbuhan Kaempferia galanga L. dengan famili Zingiberaceae (Lihat
Lampiran 1).
4.2. Penyiapan Bahan
Tumbuhan yang digunakan dalam penelitian ini yaitu rimpang
kencur Kaempferia galanga L. yang diperoleh dari kebun Balittro (Balai
Penelitian Tanaman Rempah dan Obat) di wilayah Sukabumi, Jawa Barat
dan dilakukan diferensiasi di Herbarium Bogoriense, Pusat Biologi, LIPI,
Cibinong, Bogor.
Sebanyak 50 Kg rimpang kencur segar disiapkan. Rimpang kencur
ini dibersihkan dari kotoran-kotoran yang menempel (seperti tanah)
dengan cara dicuci menggunakan air yang mengalir dan kemudian dirajang
tipis dan dikeringkan di dalam ruangan sampai warna menjadi kekuningan.
Setelah kering kemudian dihaluskan menggunakan blender sampai
terbentuk serbuk halus. Hasil penyiapan ini mendapatkan berat bersih
serbuk simplisia sebanyak 7,69 Kg.
4.3. Ekstraksi
Ekstraksi simplisia kencur ini menggunakan cara maserasi
bertingkat. Metode ekstraksi ini dipilih karena merupakan proses ekstraksi
yang mudah dan dapat menjaga senyawa yang tidak tahan terhadap suhu
tinggi. Sebanyak 7,69 Kg serbuk simplisia dimaserasi dengan
pelarut-pelarut yang kepolarannya meningkat dari mulai pelarut-pelarut nonpolar
Maserasi dilakukan dengan tingkat kepolaran pelarut meningkat,
yaitu maserasi pertama menggunakan pelarut n-heksan (nonpolar)
dilakukan berulang kali sampai hasil bening. Ampas dari sisa maserasi
pertama dimaserasi kembali menggunakan pelarut selanjutnya yaitu
pelarut etil asetat (semi polar) dan setelah selesai dengan etil asetat
dilanjutkan dengan pelarut metanol (polar). Penyaringan hasil maserasi
dilakukan selama 3 hari sekali menggunakan kertas saring. Selama proses
maserasi, dilakukan pengocokan dengan tujuan untuk memaksimalkan
proses penyarian metabolit sekunder dari dalam jaringan rimpang kencur.
Jumlah pelarut yang digunakan dalam maserasi ini yaitu n-heksan
sebanyak 35 L, etil asetat sebanyak 25 L, dan metanol sebanyak 20 L.
Tahap terakhir yaitu pengentalan ekstrak atau penguapan pelarut dengan
menggunakan Rotary evavorator. Jumlah ekstrak kental yang dihasilkan
yaitu ekstrak fraksi n-heksan sebanyak 927,94 gram, ekstrak fraksi etil
asetat sebanyak 232,51 gram, dan ekstrak fraksi metanol sebanyak 115,27
gram. Berdasarkan hasil perhitungan persentasi rendemen untuk fraksi
n-heksan yaitu 12,07 %, fraksi etil asetat yaitu 3,01 %, dan fraksi metanol
yaitu 1,4%. Persentasi rendemen ini untuk menyatakan perbandingan
banyaknya kandungan ekstrak yang dapat terekstrak dengan pelarut
(kepolaran tertentu) terhadap jumlah simplisia awal. Hasil perhitungan
rendemen ditunjukkan pada tabel 4.1.
Tabel 4.1. % rendemen setiap fraksi hasil ekstraksi rimpang kencur
4.4. Isolasi dan Pemurnian Senyawa
4.4.1. Analisa Awal Ekstrak Menggunakan KLT dan GCMS
Identifikasi menggunakan kromatografi lapis tipis (KLT) dilakukan
untuk mendeteksi keberagaman kandungan senyawa yang terdapat di
dalam suatu ekstrak dan kemungkinan kemudahan dari kandungan
senyawa tersebut untuk diisolasi. Kromatografi lapis tipis menggunakan
dua fase yaitu fase diam dan fase gerak. Fase diam terdiri dari silika gel 60
dan fase geraknya merupakan pengembang yang terdiri dari beberapa
tingkatan kepolaran. Analisa awal ini menggunakan pengembang dengan
perbandingan n-heksan dan etil asetat (4:1) kemudian perbandingan ini
bisa dinaikkan jika dibutuhkan.
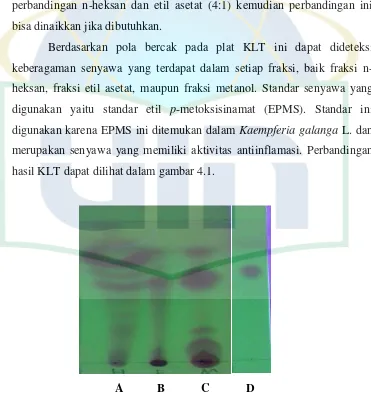
Berdasarkan pola bercak pada plat KLT ini dapat dideteksi
keberagaman senyawa yang terdapat dalam setiap fraksi, baik fraksi
n-heksan, fraksi etil asetat, maupun fraksi metanol. Standar senyawa yang
digunakan yaitu standar etil p-metoksisinamat (EPMS). Standar ini
digunakan karena EPMS ini ditemukan dalam Kaempferia galanga L. dan
merupakan senyawa yang memiliki aktivitas antiinflamasi. Perbandingan
hasil KLT dapat dilihat dalam gambar 4.1.
A B C D
Gambar 4.1. Hasil KLT setiap fraksi dengan eluen n-heksan : etil asetat (4:1)
A : Fraksi n-heksan
C : Fraksi metanol
D : EPMS
Hasil kromatografi lapis tipis menunjukkan bahwa fraksi etil asetat
memiliki senyawa yang dapat diisolasi dengan mudah karena terlihat
bercak yang sudah terpisah. Hasil analisa menggunakan GCMS, fraksi etil
asetat mempunyai senyawa yang terdeteksi dengan GCMS dengan jumlah
senyawa paling sedikit namun ada beberapa diantaranya yang memiliki
persentasi yang cukup dominan selain EPMS (Lihat Lampiran 4).
Berdasarkan hasil analisa menggunakan KLT dan GCMS, fraksi etil asetat
diambil untuk diisolasi lebih lanjut.
4.4.2. Pemisahan Kristal
Fraksi etil asetat banyak mengandung kristal yang merupakan
kristal EPMS, sehingga diambil langkah untuk memisahkan kristal
tersebut dari fraksi etil asetat. Hal ini dilakukan karena kandungan dari
rimpang kencur adalah senyawa etil p-metoksisinamat (EPMS) yang bisa
mencapai sampai 87,4 % yang berbentuk kristal. Proses kristalisasi
senyawa tersebut sangat mudah, sehingga kristal dapat dipisahkan terlebih
dahulu dari fraksi etil asetat, untuk mempermudah proses isolasi
selanjutnya.
Pemisahan dilakukan dengan penyaringan vacuum dan kristal
dianalisa menggunakan kromatografi lapis tipis dengan tujuan untuk
memastikan bahwa kristal tersebut merupakan senyawa EPMS. Setelah
dilakukan pengecekan menggunakan kromatografi lapis tipis, kristal
tersebut merupakan senyawa EPMS karena memiliki Rf yang sama dengan
Gambar 4.2. Profil KLT EPMS dan kristal hasil pemisahan
4.4.3. Kromatografi Kolom Fraksi Etil Asetat
Kromatografi kolom dilakukan untuk proses fraksinasi dengan
menggunakan silika gel 60 sebagai fase diam dan pelarut organik nonpolar
(n-heksan), semipolar (etil asetat), dan polar (metanol) sebagai fase gerak.
Saat proses fraksinasi ini, senyawa akan terpisah berdasarkan pada
kepolarannya. Identifikasi awal terhadap hasil fraksinasi dilakukan dengan
melihat pola bercak pada plat KLT dan kemudian digolongkan
berdasarkan pola bercak yang muncul.
Kolom yang digunakan yaitu berdiameter 3 cm dan tinggi 75 cm.
Jumlah ekstrak fraksi etil asetat yaitu sebanyak 22,87 gram. Silika gel 60
yang digunakan sebanyak 657,49 gram. Sistem fase gerak dibuat dengan
menggunakan sistem gradien dari perbandingan pelarut nonpolar
(n-heksan), semipolar (etil asetat), dan polar (metanol), sebagai berikut :
a. n-heksan 100 %
b. n-heksan:etil asetat (kenaikan perbandingan 20%)
- perbandingan 8:2
- perbandingan 6:4
- perbandingan 4:6
- perbandingan 2:8
c. etil asetat 100%
d. etil asetat:metanol (kenaikan perbandingan 20%)
- perbandingan 8:2
- perbandingan 4:6
- perbandingan 2:8
e. metanol 100%
Setiap fase gerak dibuat sebanyak 200 mL, kecuali metanol
digunakan lebih dari 200 mL untuk pencucian pada fase diam. Hasil elusi
yang telah ditampung dalam vial dianalisa menggunakan kromatografi
lapis tipis untuk melihat bercak yang terlihat di bawah lampu UV 254 nm.
Kromatografi kolom fraksi etil asetat menghasilkan 16 fraksi
(A-P). Fraksi A terdiri dari vial 1-7. Fraksi B terdiri dari vial 8-11. Fraksi C
terdiri dari vial 12-16. Fraksi D terdiri dari vial 17-19 dengan vial 17 sudah
satu bercak. Fraksi E terdiri dari vial 20-24. Fraksi F terdiri dari vial 25.
Fraksi G terdiri dari vial 26-28. Fraksi H terdiri dari vial 29. Fraksi I terdiri
dari vial 30-39. Fraksi J terdiri dari vial 40. Fraksi K terdiri dari vial 41-45.
Fraksi L terdiri dari vial 46-53. Fraksi M terdiri dari vial 54-59. Fraksi N
terdiri dari vial 60-65. Fraksi O terdiri dari vial 66-74. Fraksi P terdiri dari
vial 75-164.
Berdasarkan hasil analisa menggunakan KLT, fraksi D pada vial 17
memiliki bercak tunggal pada panjang gelombang 254 nm. Fraksi D (17)
diuji menggunakan GCMS, dan data hasil GCMS menunjukkan senyawa
yang berbeda dengan EPMS, yaitu tidak adanya gugus metoksi. Fraksi D
(17-19) diputuskan untuk diisolasi lebih lanjut dengan dimurnikan
menggunakan kromatografi kolom kembali. Jumlah fraksi D yaitu
sebanyak 2,68 g.
Kromatografi kolom yang ke dua ini dilakukan untuk proses
pemurnian pada fraksi gabungan D. Kolom yang digunakan berdiameter 2
cm dan tinggi kolom 35 cm. Fase diam yang digunakan yaitu silika gel 60
sebanyak 53,53 g dan fase gerak yang digunakan yaitu n-heksan 100%
sampai hasil KLT menunjukkan tidak ada senyawa yang memiliki Rf yang
sama dengan senyawa sasaran. Selanjutnya fase gerak dinaikkan
kepolarannya dengan menggunakan campuran n-heksan:etil asetat
(kenaikan perbandingan 20%), dan etil asetat 100 %, dengan setiap
perbandingan dibuat 200 mL.
Kromatografi kolom fraksi gabungan ini menghabiskan fase gerak
n-heksan sebanyak 8,87 L dan setiap perbandingan selanjutnya sebanyak
200 mL. Jumlah vial yang didapatkan sebanyak 559 vial untuk fase gerak
n-heksan, yang kemudian terkelompokan kedalam 9 fraksi berdasarkan
hasil identifikasi pola kromatogram menggunakan KLT. Hasil fraksinasi
tersebut yaitu fraksi D1 terdiri dari vial 1-35. Fraksi D2 terdiri dari vial
36-69. Fraksi D3 terdiri dari vial 70-92. Fraksi D4 terdiri dari vial 93-117.
Fraksi D5 terdiri dari vial 118-143. Fraksi D6 terdiri dari vial 144-181.
Fraksi D7 terdiri dari vial 182-195. Fraksi D8 terdiri dari vial 196-476.
Fraksi D9 terdiri dari vial 477-559. Kemudian untuk fase gerak
perbandingan selanjutnya meghasilkaan 65 vial yang terbagi kedalam 6
fraksi. Fraksi D10 terdiri dari vial 560-562, fraksi D11 terdiri dari vial
563-565, fraksi D12 terdiri dari vial 566-570, fraksi D13 terdiri dari vial
571-573, fraksi D14 terdiri dari vial 574-579, dan fraksi D15 terdiri dari
vial 580-585, terakhir fraksi D16 terdiri dari vial 586-627.
Berdasarkan gambar 4.4. di bawah ini dapat dilihat bahwa senyawa
fraksi D8 bercaknya berada di atas bercak EPMS, hal tersebut
menunjukkan bahwa fraksi D8 ini bukan merupakan senyawa EPMS.
Fraksi D8 berdasarkan alasan tersebut diambil untuk ditentukan