KETAMINE DAN PROPOFOL MENGGUNAKAN
METODE GRAVIMETRIK PADA ANJING
I GUSTI NGURAH SUDISMA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi saya yang berjudul :
“Keterpilihan dan Kebakuan Dosis Anestesi Ketamine dan Propofol Menggunakan Metode Gravimetrik pada Anjing”.
adalah gagasan atau hasil penelitian saya sendiri dengan bimbingan dari komisi pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar apapun di perguruan tinggi lain. Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, September 2011 Yang membuat pernyataan,
anaesthetic doses of ketamine and propofol in dogs by a gravimetric method. Under the supervision of Setyo Widodo,Dondin Sajuthi, and Harry Soehartono.
Inhalation anaesthetic agents have been used worldwide for anaesthesia in animals with improving safety and efficacy, but these agents are expensive, difficult or impossible to use for bronchoscopies and laryngoscopies, more over, these may couse organ toxicity, have an operating theatre pollution on personnel, and possible environmental damage caused by nitrous oxide and the halogenated volatile anaesthetics. A suitable alternative methode to compare with and reduce those side effects of inhalation anaesthesia agents is needed.
The aim of this study was to evaluate quality of anaesthesia by gravimetric infusion anaesthesia with ketamine HCl and propofol to get a standard dose of ketamine HCl and propofol in dogs. The quality of anaesthesia, duration of actions, and the physiological response of anaesthesia were evaluated in two steps of the study. In the first step, twenty four male domestic dogs were used in this experiment and divided randomly into six groups. In the second step, twenty male domestic dogs were used and divided randomly into five groups.
In the first step, group 1, group 2, and group 3 were preanaestheted intramuscularly with 0.03 mg/kg BW atropine and 2 mg/kgBW xylazine respectively. Group 4 to 6 received in the same way 0.03 mg/kgBW atropine and 0.2 mg/kgBW midazolam respectively. Group 1 and 4 were induced then with 4 mg/kgBW ketamine HCl, group 2 and 5 with 4 mg/kgBW propofol, and group 3 and 6 were induced with a combination dose of 4 mg/kgBW ketamine HCl and propofol respectively. The quality of anaesthesia, duration of action and the physiological responses were evaluated. From the first step, group 3 was elected the best premedication for the second step.
In the second step, all group received 0.03 mg/kgBW atropine sulfate and 2 mg/kgBW xylazine intramuscularly and were then induced intravenously with 4 mg/kgBW Ketamine HCl and propofol respectively. Following the anaesthesia, group I, II, III in second step received intravenous infusion of mixed ketamine HCl and propofol in saline by a gravimetric method to maintain the anaesthesia status. The doses of mixture were arranged at the rate of 0.2, 0.4, and 0.6 mg/kgBW/ minute respectively. Group IV was only infused with 0.4mg/kgBW/minute propofol in saline and compared to the inhalation anaesthesia, and group V was given isoflurane of 1.0 – 2.0 %. The quality of
anaesthesia, duration of action, heart rate (HR), capillary refill time (CRT), noninvasive
blood pressure (NIBP), electrocardiogram (ECG), respiratory rate (RR), blood oxygen
saturation (SpO2), end tidal CO2 (ET CO2), and rectal temperature (RT) were measured.
All groups showed rapid and smooth inductions, prolonged surgical stage, and rapid recovery. Animals of groups I and II yielded minimal physiological effects. The HR, RR, ET CO2, SpO2, CRT, NIBP, RT, and ECG wave were relatively stable. The combination
of group III showed SpO2 depression, and an increase in instability of HR, RR and ET
CO2. Group IV showed a decrease in HR, SpO2 and respiratory depression. All
combinations showed no significant influence (P>0,05) on the electrocardiogram. The combination of ketamine HCl-propofol at the dose rates of 0.2 and 0.4 mg/kgBW/minute was an ideal dose of gravimetric method of infusion.
I GUSTI NGURAH SUDISMA. Keterpilihan dan kebakuan dosis anestesi ketamine dan propofol menggunakan metode gravimetrik pada anjing. Dibimbing oleh Setyo Widodo,Dondin Sajuthi, dan Harry Soehartono.
Anestesi umum mempunyai resiko jauh lebih besar daripada prosedur pembedahan yang dijalankan, untuk itu diperlukan pemilihan anestetikum yang aman dan ideal. Anestesi inhalasi digunakan sebagai pilihan anestesi yang cukup aman saat ini, tetapi peralatannya rumit dan mahal, tidak mungkin diterapkan pada prosedur bronkoskopi dan laringoskopi, sulit digunakan untuk penanganan pasien di lapangan, menyebabkan keracunan organ, menyebabkan polusi ruangan bedah, dan menyebabkan kerusakan lapisan ozon. Suatu metode alternatif yang aman dibandingkan terhadap efek-efek samping anestesi inhalasi sangat diperlukan.
Penelitian ini bertujuan untuk mendapatkan keterpilihan dan kebakuan dosis anestesi kombinasi ketamine HCl dengan propofol secara infusi gravimetrik pada anjing. Dua puluh empat anjing jantan domestik dibagi enam kelompok perlakuan dan masing-masing empat ekor sebagai ulangan digunakan pada penelitian tahap pertama. Penelitian tahap kedua menggunakan 20 ekor anjing jantan domestik dibagi lima kelompok perlakuan masing-masing empat ekor sebagai ulangan.
Penelitian tahap pertama, grup 1, 2, dan grup 3 dipreanestesi dengan atropine sulfate 0,03 mg/kgBB dan xylazine HCl 2 mg/kgBB secara intramuskuler. Grup 4 sampai 6 dipreanestesi dengan atropine sulfate 0,03 mg/kgBB dan midazolam 0,2 mg/kgBB secara intramuskuler. Grup 1 dan 4 diinduksi secara intravena dengan ketamine HCl 4 mg/kg BB, Grup 2 dan 5 diinduksi secara intravena dengan propofol 4 mg/kg BB, dan Grup 3 dan 6 diinduksi secara intravena dengan kombinasi ketamine HCl 4 mg/kg BB dan propofol 4 mg/kg BB. Dilakukan evaluasi terhadap kualitas anestesi, durasi, dan respon fisiologis. Diperoleh bahwa Grup 3 adalah perlakuan terpilih sebagai preanestesi dan induksi terbaik untuk penelitian tahap kedua.
Penelitian tahap kedua, semua perlakuan dipreanestesi atropine sulfate 0,03 g/kgBB dan xylazine HCl 2 mg/kgBB secara intramuskuler, setelah 10 menit diinduksi intravena dengan ketamine HCl dan propofol dosis 4 mg/kg BB, dan 15 menit kemudian diinfusi secara gravimetrik dengan campuran ketamine HCl 2mg/ml dan propofol 2mg/ml dalam cairan infusi NaCl 0,9% sampai menit ke-120. Dilakukan infusi ketamine HCl-propofol dosis 0,2 mg/kg/menit, 0,4 dan dosis 0,6 mg/kg/menit masing-masing pada grup I, II, dan III. grup IV diinfusi hanya dengan propofol 0,4 mg/kg/menit, serta grup V dianestesi dengan isofluran 1,0 – 2,0%. Sebelum dan selama hewan teranestesi dilakukan pemeriksaan terhadap kualitas anestesi, durasi, frekuensi denyut jantung, capillary refill time (CRT), noninvasive blood pressure (NIBP), elektrokardiogram (EKG), frekuensi respirasi, end tidal CO2 (ET CO2), dan saturasi oksigen (Sp O2
Penelitian tahap pertama menunjukkan bahwa kombinasi preanestesi atropine sulfate–xylazine HCl (0,03 & 2 mg/kgBB) secara intramuskuler, setelah 10 menit diinduksi intravena dengan ketamine HCl-propofol (@ 4 mg/kg BB, memberikan kualitas anestesi yang baik dan aman sehingga dapat digunakan untuk preanestesi dan induksi anestesi pada anjing. Penelitian tahap kedua
jantung, respirasi, ET CO2, Sp O2, nilai CRT, NIBP, suhu tubuh, dan EKG. Sedangkan grup III menunjukkan penurunan tajam terhadap Sp O2 dan peningkatan tidak stabil terhadap denyut jantung, respirasi, serta ET CO2. Pemeliharaan status teranestesi pada grup IV menyebabkan tertekannya respirasi, Sp O2, dan penurunan denyut jantung. Keseluruhan kombinasi perlakuan anestetika tidak mempengaruhi gambaran listrik jantung. Penelitian ini menunjukkan kombinasi ketamine HCl-propofol dosis 0,2-0,4 mg/kg/menit secara infusi gravimetrik menghasilkan kualitas anestesi yang baik dan dapat digunakan untuk pemeliharan status teranestesi sebagai kebakuan dosis anestesi pada anjing.
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
KETAMINE DAN PROPOFOL MENGGUNAKAN
METODE GRAVIMETRIK PADA ANJING
I GUSTI NGURAH SUDISMA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Mayor Ilmu Biomedis Hewan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian Tertutup :
1. Dr. dra. Hj. Ietje Wientarsih, Apt., MSc.
2. drh. Deni Noviana, PhD.
Penguji Luar Komisi Ujian Terbuka :
1. Dr. dr. Bambang Joewono Oetoro, Sp.An (KNA) (Dokter Spesialis Anestesi, Konsultan Neuroanestesi Brawijaya Women & Children Hospital, Tahir Neurosience, Sahid Sahirman Memorial Hospital, Jakarta).
2. Dr. Nastiti Kusumorini
Nama : I Gusti Ngurah Sudisma
NIM : B361070011
Mayor : Ilmu Biomedis Hewan (IBH)
Disetujui
Komisi Pembimbing
Ketua
Dr. drh. Setyo Widodo
Prof. drh. Dondin Sajuthi, M.S.T., Ph.D.
Anggota Anggota
drh. R. Harry Soehartono, MApp Sc., Ph.D.
Diketahui
Ketua Program Mayor Dekan Sekolah Pascasarjana
Ilmu Biomedis Hewan, Institut Pertanian Bogor,
drh. Agus Setiyono, MS., Ph.D., AP Vet Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas
berkatNya penulis dapat menyelesaikan disertasi yang berjudul “Keterpilihan dan
Kebakuan Dosis Anestesi Ketamine dan Propofol menggunakan Metode
Gravimetrik pada Anjing”.
Ucapan terima kasih penulis sampaikan kepada Dr. drh. Setyo Widodo
selaku ketua komisi pembimbing, Prof. drh. Dondin Sajuthi, M.S.T., Ph.D. dan drh.
R. Harry Soehartono, MApp Sc., Ph.D. selaku anggota komisi pembimbing yang
telah banyak memberi saran, nasihat, pengarahan dan pembimbingan yang tulus dan
penuh kesabaran. Penghargaan yang dalam penulis sampaikan kepada Direktur
Jendral Pendidikan Tinggi, Rektor Universitas Udayana, Dekan FKH Universitas
Udayana, Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana IPB, Ketua
Program Mayor IBH Pascasarjana IPB , Direktur Rumah Sakit Hewan IPB, Ketua
Departemen KRP FKH IPB, Ketua Departemen AFF FKH IPB, yang telah
membantu fasilitas dan pelayanan selama studi dan penelitian. Penulis juga
menyampaikan terima kasih kepada rekan mahasiswa pascasarjana IPB dan
teman-teman dalam suka-duka di Asrama Bali Bogor atas dukungan yang tulus dan
kerjasamanya yang penuh kekeluargaan.
Dengan rasa cinta kasih penulis sampaikan terima kasih yang tulus kepada
istri tercinta dr. Ni Gusti Ayu Ketut Widiastiti serta anak tersayang I Gusti Ayu
Dewi Sawitri, I Gusti Ngurah Bagus Nala Purusatama, dan I Gusti Ngurah Bagus
Aryha Wirasha atas kesabaran, dorongan semangat dan pengorbanan selama masa
studi. Kepada kedua orangtua ayah dan ibu, kedua mertua, serta seluruh keluarga
penulis sampaikan terimakasih atas segala pengorbanan, pengertian dan doa yang
tidak pernah putus.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, oleh karena
itu segala kritik dan saran yang bersifat membangun sangat penulis harapkan.
Akhirnya penulis berharap semoga tulisan ini bermanfaat.
Bogor, September 2011
i
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadhirat Tuhan Yang Maha Esa yang telah melimpahkan segala karuniaNya, sehingga penulisan disertasi ini dapat diselesaikan. Penulisan disertasi ini berjudul “Keterpilihan dan kebakuan dosis anestesi campuran ketamine dan propofol menggunakan metode gravimetrik pada anjing”, diajukan untuk memenuhi syarat memperoleh gelar Doktor (S3) pada Program Doktor (S3) Mayor Ilmu Biomedis Hewan (IBH) Program Pascasarjana Institut Pertanian Bogor.
Penelitian disertasi ini dirancang untuk mengetahui kualitas, efektivitas, dan keamanan pemeliharaan status teranestesi secara infusi gravimetrik dengan kombinasi ketamine dan propofol pada anjing. Hasil penelitian ini juga diharapkan mendapatkan keterpilihan dan kebakuan kombinasi dan dosis ketamine-propofol sebagai agen anestesi secara infusi gravimetrik pada anjing. Dengan demikian, pemeliharaan status teranestesi dengan kombinasi ketamine dan propofol secara infusi gravimetrik diharapkan menghasilkan potensi anestesi umum yang baik dan aman. Kombinasi ketamine dan propofol diharapkan dapat menciptakan kondisi sedasi, analgesi, dan relaksasi yang oftimal serta adequat untuk dilakukan tindakan atau prosedur diagnostik maupun terapeutik tanpa menimbulkan gangguan hemodinamik, respiratorik, dan metabolik yang dapat mengancam.
Penulisan disertasi ini telah mendapat masukan dan pengujian oleh dra. Hj. Ietje Wientarsih, Apt., MSc. dalam bidang Farmasi, drh. Deni Noviana, Ph.D dalam bidang Bedah, Dr. dr. Bambang Joewono Oetoro, Sp.An (KNA) dalam bidang Anestesi dan oleh Dr. Nastiti Kusumorini dalam bidang Neuro-Fisiologi.
Penulis menyadari bahwa penulisan dan isi disertasi ini sudah tentu sangat jauh disebut sempurna, untuk itu penulis sangat mengharapkan saran dan masukan serta kritik demi kesempurnaannya.
Bogor, September 2011
ii
RIWAYAT HIDUP
I Gusti Ngurah Sudisma, dilahirkan di Badung Bali pada tanggal 30
Januari 1969, merupakan putra pertama dari tiga bersaudara, pasangan dari Ayahanda I Gusti Ngurah Made Arta dan Ibunda I Gusti Ayu Martini. Menikah dengan dr. Ni Gusti Ayu Ketut Widiastiti dan telah dikaruniai satu orang putri I Gusti Ayu Dewi Sawitri (12 tahun), dua orang putra I Gusti Ngurah Bagus Nala Purusatama (4 tahun) dan I Gusti Ngurah Bagus Aryha Wirasha (2 tahun).
Pendidikan Sekolah Dasar (SD), Sekolah Menengah Pertama (SMP), dan Sekolah Menengah Atas (SMA) penulis tempuh di Bali. Pada tahun 1988 penulis diterima di Program Studi Kedokteran Hewan (PSKH) Universitas Udayana lewat jalur Penelusuran Minat dan Kemampuan (PMDK), tahun 1992 penulis berhasil memperoleh gelar Sarjana Kedokteran Hewan (Drs.Med.Vet) dan ditempat yang sama penulis meraih gelar Dokter Hewan (drh) pada tahun 1994. Sejak tahun 1997 penulis dianggkat menjadi staf dosen (PNS) di FKH Universitas Udayana Bali. Pada akhir tahun 2002, penulis mendapat kesempatan melanjutkan pendidikan jenjang Magister (S-2) di Program Studi Sains Veteriner (SVT) Program Pascasarjana Institut Pertanian Bogor, tahun 2004 memperoleh gelar Magister (M.Si.). Pada akhir tahun 2007 penulis mendapat kesempatan melanjutkan pendidikan jenjang Doktor (S-3) di Program Mayor Ilmu Biomedis Hewan (IBH) Sekolah Pascasarjana Institut Pertanian Bogor, lewat jalur Beasiswa Pendidikan Pascasarjana (BPPS) dari Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional.
Bogor, September 2011
iii
Tinjauan Anestetikum Umum. ...………...……….... 29
Ketamine HCl. ...………..……... 29
Propofol. ... 31
Xylazine ………...………... 34
Midazolam. ………...………... 36
Atropine ……….………...………... 39
Perubahan Aspek Fisiologi dalam Anestesi ..………..…..…. 40
Sistem Kardiovaskuler. ………...……….. 41
Capillary Refill Time (CRT). ………... 45
Klasifikasi Status Pasien. ... 54
Pemantauan Anestesi. ... 55
MATERI DAN METODE PENELITIAN ………....…... 57
Waktu dan Tempat Penelitian. ... 57
Materi Penelitian……..…….…....………... 57
Metode Penelitian ……….………... 61
iv
Gambaran Darah. …...……….……… 68
Protokol dan Pelaksanaan Penelitian. ……….…....……….. 69
Rancangan Penelitian dan Analisis Statistik. ... 69
HASIL DAN PEMBAHASAN. ... 71
Penelitian Pendahuluan. ...….………... 71
Penelitian Tahap Pertama. …….………... 72
Waktu Anestesi. .………... 73
Penelitian Tahap Kedua. ...….………... 108
Waktu Anestesi. .………... 108
KESIMPULAN DAN SARAN. ...………... 145
Kesimpulan. ...…...………... 145
Saran. ... 146
DAFTAR PUSTAKA. ... 147
v
DAFTAR TABEL
No Teks Hal
1. Tahapan dan indikasi status teranestesi oleh anestetikum umum. ... 22
2. Perubahan fisiologi yang diperiksa selama periode anestesi ... 40
3. Kriteria elektrokardiogram (EKG) dan tekanan darah normal pada anjing... 44
4. Kriteria normal pemeriksaan darah pada anjing... 48
5. Tekanan gas respirasi dan gas darah normal pada anjing (mmHg)... 49
6. Data fisiologi anjing... 53
7. Klasifikasi status pasien pada prosedur anestesi ... 54
8. Data hasil edaran kuesioner kepada Dokter Hewan Praktek di Jawa dan Bali dengan responden 87 tempat praktek Dokter Hewan dari 110 kuesioner yang diedarkan (79%). ………... 72
9. Nilai rata-rata ± simpangan baku (rata-rata ± SD) waktu induksi, durasi, dan waktu pemulihan selama perlakuan preanestesi dan induksi anestesi pada anjing. …… 74
10. Nilai rata-rata ± simpangan baku (rata-rata ± SD) denyut jantung, frekuensi respirasi, suhu rektal dan nilai saturasi O2 selama preanestesi dan induksi anestesi pada anjing. ... 82
11. Nilai rata-rata ± simpangan baku (rata-rata ± SD) tekanan darah tidak langsung (NIBP : SAP, DAP, MAP) dan CO2 respirasi selama perlakuan preanestesi dan induksi anestesi pada anjing.……….……… 95
12. Nilai rata-rata ± simpangan baku (rata-rata ± SD) elektrokardiogram (EKG) sadapan II gelombang P dan gelombang R selama perlakuan preanestesi dan induksi anestesi pada anjing……….. 98
13. Nilai rata-rata ± simpangan baku (rata-rata ± SD) elektrokardiogram (EKG) sadapan II interval PR, komplek QRS, interval QT) dan nilai CRT selama perlakuan preanestesi dan induksi anestesi pada anjing……….. 101
14. Nilai rata-rata ± simpangan baku (rata-rata ± SD) waktu induksi, durasi, sadar, dan waktu pemulihan selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan ketamine dan propofol pada anjing. ……….. 109
15. Nilai rata-rata ± simpangan baku (rata-rata ± SD) denyut jantung, frekuensi respirasi, suhu rektal dan nilai saturasi O2 selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan ketamine dan propofol pada anjing. ……….. 116
16. Nilai rata-rata ± simpangan baku (rata-rata ± SD) tekanan darah tidak langsung (NIBP : SAP, DAP, MAP) dan CO2 respirasi selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan ketamine dan propofol pada anjing. ……….. 123
vi
18. Nilai rata-rata ± simpangan baku (rata-rata±SD) elektrokardiogram (EKG) sadapan II interval PR, komplek QRS, interval QT) dan nilai CRT selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara
infusi gravimetrik dengan ketamine dan propofol pada anjing. ………..………….. 135
19. Nilai rata-rata indeks eritrosit darah selama pemberian induksi atropin-xilazin-ketamin-propofol dan pemeliharaan anestesi secara infus gravimetrik dengan ketamin dan propofol pada anjing. ………. 138 20. Nilai rata-rata jumlah sel darah putih , diferensial leukosit, dan kimia darah
selama pemberian induksi atropin-xilazin-ketamin-propofol dan pemeliharaan anestesi secara infus gravimetrik dengan ketamin dan
vii
DAFTAR GAMBAR
No Teks Hal
1. Klasifikasi agen preanestesi yang digunakan pada anestesi umum. ... 10
2. Reseptor GABAA terdiri dari lima subtipe (pentamer) 2α, 2ß, dan 1γ, masing masing subtipe mempunyai N-terminal binding site, terdiri dari 450 asam amino, 4-transmembran (TM) sebagai saluran ion dan tempat terikatnya anestetika. ... 25
3. Skema reseptor N-methyl D-aspartat (NMDA) komfleks. ... 26
4. Anestesi umum bekerja dengan cara mempengaruhi aktivitas transmitter-gate ion channel dengan cara meningkatkan (+) sinyal inhibitori dan/atau menghambat (-) sinyal eksitatori neurotransmiter (Cameron JW 2006)... 27
5. Anestetika volatil (isofluran) bekerja pada reseptor GABAAsubunit α dan anestetika intravena (propofol) bekerja pada reseptor GABAAsubunit β. ... 29
6. Struktur kimia ketamine HCl. ... 30
7. Struktur kimia propofol... 32
8. Struktur kimia xylazine HCl. ... 35
9. Struktur kimia midazolam... 37
10. Struktur kimia atropine... 39
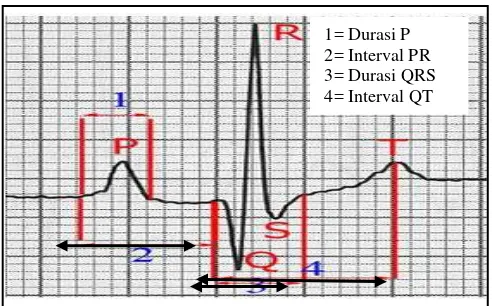
11. Diagram gambaran gelombang elektrokardiogram (EKG)... 44
12. Diagram alir penelitian tahap pertama pada anjing... 59
13. Diagram alir penelitian tahap kedua pada anjing... 61
14. Perubahan rata-rata denyut jantung selama perlakuan kombinasi preanestesi dan induksi anestesi pada anjing. …..………... 77
15. Perubahan rata-rata frekuensi respirasi selama perlakuan kombinasi preanestesi dan induksi anestesi pada anjing. ………... 79
16. Perubahan rata-rata suhu rektal selama perlakuan kombinasi preanestesi dan induksi anestesi pada anjing. ………... 83
17. Perubahan rata-rata saturasi O2 selama perlakuan kombinasi preanestesi dan induksi anestesi pada anjing . ………..…………... 85
18. Perubahan rata-rata tekanan darah sistol (SAP) selama perlakuan preanestesi dan induksi anestesi pada anjing……… 87
19. Perubahan rata-rata tekanan darah diastol (DAP) selama perlakuan preanestesi dan induksi anestesi pada anjing………... 89
20. Perubahan rata-rata tekanan darah rata-rata (MAP) selama perlakuan preanestesi dan induksi anestesi pada anjing……… 91
21. Perubahan rata-rata end tidal CO2 (ET CO2) selama perlakuan preanestesi dan induksi anestesi pada anjing………. 93
viii
23. Perubahan rata-rata frekuensi respirasi selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik
dengan ketamine dan propofol pada anjing. ………...……… 114
24. Perubahan rata-rata suhu rektal selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan
ketamine dan propofol pada anjing. ……… 117
25. Perubahan rata-rata nilai saturasi O2 selama pemberian induksi
atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan
ketamine dan propofol pada anjing. ………..…...………... 119
26. Perubahan rata-rata tekanan darah sistol (SAP) selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik
dengan ketamine dan propofol pada anjing. ……….…. 121
27. Perubahan rata-rata tekanan darah diastol (DAP) selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi
gravimetrik dengan ketamine dan propofol pada anjing. ……….…….. 124
28. Perubahan rata-rata tekanan darah rata-rata (MAP) selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi
gravimetrik dengan ketamine dan propofol pada anjing. ……….…………. 126
29. Perubahan rata-rata end tidal CO2 (ET CO2) selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik
dengan ketamine dan propofol pada anjing. ……….…. 128
30. Perubahan rata-rata nilai CRT selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan
ix
DAFTAR LAMPIRAN
No Teks Hal
1. Contoh cara pembuatan campuran Ketamine-Propofol sebanyak 100 ml ….. 153
2. Nilai rata-rata ± simpangan baku (rata-rata±SD) darah dan kimia darah selama pemberian induksi atropine-xylazine-ketamine-propofol dan pemeliharaan anestesi secara infusi gravimetrik dengan ketamine dan
PENDAHULUAN
Latar Belakang
Anestesi merupakan tahapan yang sangat penting dan strategis pada tindakan pembedahan, karena pembedahan tidak dapat dilakukan bila belum dilaksanakan anestesi. Sejarah membuktikan bahwa ilmu bedah mengalami revolusi pesat setelah ditemukan eter sebagai anestesi umum. Sebelum ditemukan anestesi, tindakan pembedahan tidak dapat dilakukan dengan baik dan ilmu bedah tidak mengalami perkembangan. Setelah Thomas Green Morton melakukan demonstrasi menggunakan eter sebagai anestesi umum untuk pembedahan tumor leher di rumah Sakit Umum Massachusetts pada 16 Oktober 1846, penanganan pasien dengan tindakan pembedahan dapat dilakukan dengan baik dan ilmu bedah berkembang sangat pesat.
Anestesi umum adalah tahapan yang sangat penting dan mempunyai resiko jauh lebih besar dari prosedur pembedahan, karena anestesi yang dalam akan mengancam nyawa pasien. Pemberian agen anestetikum yang kurang atau tidak mencukupi menyebabkan pasien akan tetap merasakan sakit, tetapi apabila dosis anestetikum yang diberikan dalam keadaan cukup atau berlebihan akan dapat mengancam terjadinya kematian. Guna mencegah dua kejadian yang ekstrim tersebut, harus dilakukan pemilihan anestetikum yang memenuhi kriteria ideal, yaitu anestetikum yang menghasilkan sedasi, analgesi, relaksasi, ketidaksadaran, dan aman untuk sitem vital, serta mudah diaplikasikan (Fossum 1997; Miller 2010).
Data penggunaan anestesi pada praktek kedokteran hewan di Indonesia menunjukkan bahwa penggunaan anestesi inhalasi hanya 10,5%, anestesi injeksi 81%, dan anestesi gabungan 8,5%. Penanganan pasien dengan melakukan pembedahan diluar ruangan operasi (eksitu) cukup besar, yaitu 43%. Anestetika yang paling banyak digunakan adalah injeksi kombinasi ketamine-xylazine. Kombinasi ini menghasilkan anestesi tidak stabil, memerlukan pengulangan pemberian, pemulihan lama, mempunyai efek samping kejang dan muntah. Dengan demikan proses pembedahan menjadi terganggu.
Mengatasi kelemahan anestesi inhalasi dan untuk mengatasi permasalahan penggunaaan anestesi di lapangan, digunakan metode anestesi intravena total (total intraveous anesthesia, TIVA). Anestesi intravena total menggunakan anestetika secara intravena (IV) untuk induksi dan pemeliharaan anestesi. Penggunaan mesin pompa infusi dengan komputer pada metode TIVA menghasilkan jumlah infusi yang stabil dan akurat. Metode TIVA mirip dengan penggunaan alat penguap (vaporizer) pada anestesi inhalasi sehingga anestesi menjadi lebih stabil, tetapi pompa infusi yang digunakan masih mahal dan rumit serta tidak cocok untuk penanganan pasien di lapangan. Metode alternatif yang lebih praktis dan paling memungkinkan adalah metode infusi gravimetrik. Metode infusi gravimetrik menggunakan anestetikum parenteral melalui tetes infusi intravena secara terus menerus. Anestetikum dicampur dalam kantong cairan dan cairan anestetikum dialirkan melalui tetes infusi intravena berdasarkan gaya gravitasi dengan dosis dan kecepatan tetes tertentu (Amadasun dan Edomwonyi 2005).
reseptor GABAA subtipe ß3 sehingga menyebabkan ketidaksadaran dan pada reseptor
GABAA
Mengatasi efek samping ketamine, dapat dikombinasikan dengan preanestesi
sedatif hipnotik golongan α2-adrenoceptor seperti xylazine atau golongan benzodiazepin seperti diazepam atau midazolam. Golongan benzodiazepin memperkuat kerja GABA yang merupakan neurotransmiter inhibitori utama pada otak, mampu menekan refleks-refleks polisinaps dan berpengaruh terhadap medulla spinalis (Brander et al. 1991). Midazolam bekerja pada reseptor benzidiazepin dengan cara meningkatkan pengikatan GABA pada reseptor GABA
subtipe ß2, lebih dari setengah jumlah reseptor terdapat pada SSP, akan menyebabkan sedasi. Propofol menghasilkan pengaruh menghilangkan kesadaran dan pelemas otot yang baik, menyebabkan hipotensi arterial, bardikardi, depresi respirasi, dan mengancam nyawa pasien terutama apabila diberikan secara cepat dengan dosis yang tinggi. (Franks 2008; Miler 2010; Stawicki 2007). Pengaruh anestesi dan efek samping propofol sangat berhubungan dengan dosis dan keuntungan penggunaaan propofol dapat diperoleh dengan cara mengkombinasikan dengan anestetikum lain seperti ketamine (McKelvey dan Hollingshead 2003). Ketamine mempunyai tempat kerja yang berbeda dengan propofol. Mekanisme kerja ketamine secara antagonis pada reseptor N-methyl-D-aspartate (NMDA), mempunyai pengaruh analgesik kuat dan mampu meningkatkan pengaruh anestesi apabila dikombinasikan dengan propofol untuk induksi anestesi pada manusia (Lerche et al. 2000). Ketamine dosis rendah menghasilkan analgesik yang baik (Intelisano et al. 2008), tetapi ketamine menyebabkan kekejangan otot dan peningkatan denyut jantung (Pathak et al.1982; Kul et al. 2001).
A
Xylazine HCl adalah golongan alpha
, sehingga menimbulkan penghambatan SSP, mencegah hipertonus otot, meningkatkan efek sedasi dan hipnotik (Stawicki 2007). Midazolam lebih potensial dibandingkan diazepam (Lumb dan Jones 1996; Muir et al. 2000).
2-adrenoceptor stimulant atau alpha-2
adrenergic receptor agonist. Xylazine bekerja melalui mekanisme yang menghambat tonus simpatik karena xylazine mengaktivasi reseptor postsinap α2-adrenoseptor
penurunan peristaltik, relaksasi saluran cerna, dan sedasi. Xylazine menyebabkan relaksasi otot melalui penghambatan transmisi impuls intraneural pada susunan syaraf pusat dan dapat menyebabkan muntah. Xylazine juga dapat menekan termoregulator (Adams 2001). Pemberian atropine sulfat secara bersamaan sebagai preanestesi, dapat menurunkan pengaruh hipersalivasi dan bradikardi dari xylazine (Bishop 1996). Atropine adalah agen menghambat muskarinik atau antimuskarinik dengan mekanisme kerja secara kompetisi dengan reseptor acetilkolin. Penggunaan kombinasi atropine sulfat, xylazine HCl atau midazolam sebagai preanestesi akan memberikan pengaruh lebih baik terhadap anestesi serta meningkatkan potensi anestetikum. Preanestesi juga sangat penting pada hewan untuk tujuan merestrain sebelum dilakukan anestesi.
Penelitian ini dirancang untuk mengetahui kualitas, efektivitas, dan keamanan pemeliharaan status teranestesi secara infusi gravimetrik dengan kombinasi ketamine dan propofol pada anjing. Hasil penelitian ini juga diharapkan mendapatkan keterpilihan dan kebakuan kombinasi dan dosis ketamine-propofol sebagai agen anestesi secara infusi gravimetrik pada anjing. Dilakukan evaluasi terhadap waktu anestesi untuk menentukan kualitas anestesi, evaluasi terhadap fungsi kardiovaskuler dan respirasi untuk menentukan tingkat keamanan penggunaan anestesi. Evaluasi fungsi kardiovaskuler terdiri dari frekuensi denyut jantung, tekanan darah (noninvasive blood pressure/NIBP), capillary refill time (CRT), dan elektrokardiogram (EKG), sedangkan evaluasi fungsi respirasi terdiri dari frekuensi respirasi, end tidal CO2 (ET CO2), dan saturasi oksigen (Sp O2
).
Kerangka Pemikiran
hewan yang dianestesi serta mempunyai resiko jauh lebih besar dibanding prosedur pembedahan yang dijalankan.
Diperlukan pemilihan anestetikum yang ideal yang memenuhi kriteria komponen anestesi : sedasi, analgesi, relaksasi (immobilisasi), ketidaksadaran, aman dan nyaman untuk sistem vital, ekonomis serta mudah diaplikasikan. Sampai saat ini belum ditemukan anestesi umum yang benar-benar aman dan memenuhi kriteria ideal. Anestesi umum inhalasi yang dipandang aman, memerlukan perangkat yang rumit, mahal, dan mempunyai waktu induksi (onset) yang relatif lambat. Keterbatasan anestesi inhalasi adalah tidak bisa digunakan untuk penanganan bronkoskopi dan laringoskopi serta tidak praktis untuk menangani hewan di lapangan.
Anestesi umum alternatif yang masih mungkin dilakukan adalah anestesi umum parenteral. Anestesi parenteral lebih ekonomis dan praktis untuk penanganan hewan di lapangan, tetapi menghasilkan anestesi yang tidak stabil dan sering memerlukan pengulangan atau penambahan dosis anestesi karena waktu anestesi sudah selesai sedangkan tindakan medis atau pembedahan belum selesai dilakukan. Pilihan anestesi yang lebih memungkinkan adalah anestesi parenteral intravena dengan metode anestesi intravena total (TIVA, total intraveous anesthesia). Penggunaan mesin pompa infusi dengan komputer pada metode TIVA menghasilkan anestesi yang stabil dan akurat, sehingga metode TIVA mirip dengan penggunaan alat penguap (vaporizer) pada anestesi inhalasi. Pompa infusi yang digunakan pada metode TIVA masih mahal dan rumit serta tidak cocok untuk penanganan pasien di lapangan.
Metode anestesi yang lebih praktis dan memungkinkan adalah metode infusi gravimetrik melalui tetes intravena. Metode infusi gravimetrik menggunakan anestetikum parenteral melalui tetes infusi intravena secara terus menerus, anestetikum dicampur dalam kantong cairan dan cairan anestetikum dialirkan melalui tetes infusi intravena berdasarkan gaya gravitasi dengan dosis dan kecepatan tetes tertentu.
seperti anjing. Ketamine HCl adalah anestetikum disosiatif dari golongan nonbarbiturat mempunyai sifat menghilangkan rasa sakit (analgesik) yang kuat serta reaksi anestesinya tidak menyebabkan ngantuk (sedasi) (Pathak et al.1982; Kul et al. 2001). Ketamine menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor N methyl D aspartate (NMDA). Ketamine diklasifikasikan sebagai antagonis reseptor NMDA, pada daerah tempat kerja PCP. Afinitas ketamine sangat kuat pada reseptor NMDA, sehingga menghasilkan pengaruh analgesik yang sangat kuat (Stawicki 2007). Antagonis NMDA akan menghambat refleks nosiseptik spinal, menghambat konduksi rasa sakit ke talamus dan daerah kortek. Penghambatan reseptor NMDA dengan dosis ketamine yang rendah akan menghasilkan pengaruh analgesik yang baik (Intelisano et al. 2008).
Propofol termasuk agen anestetikum intravena short acting hyptotic yang dapat diberikan secara berulang atau secara infusi terus menerus. Propofol menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor GABAA (Intelisano et al. 2008). Propofol memperbesar pengaruh GABA yang mempunyai fungsi menghambat aksi (inhibitory) sistem syaraf pusat, meningkatkan konduksi Cl- yang menyebabkan hiperpolarisasi sehingga tingkat rangsangan sel (excitability) menurunkan, menyebabkan sedasi dan relaksasi (Mihic dan Harris 1997; Intelisano et al. 2008). Molekul propofol akan bekerja dan berikatan pada reseptor GABAA pada
membran sel syaraf pada otak khususnya reseptor GABAA subtipe ß3 bagian N265
(ßN265) sehingga menyebabkan ketidaksadaran dan pada reseptor GABAA subtipe
ß2 sehingga menyebabkan sedasi. Propofol menghasilkan pengaruh menghilangkan kesadaran dan sedasi yang baik, tetapi subtipe ß3 yang terdapat pada reseptor GABAA merespon terjadinya depresi respirasi akibat propofol (Henschel et al .2008).
anestetikum lain untuk menurunkan dosis dan meminimalkan pengaruh buruk yang ditimbulkan.
Kombinasi campuran propofol dengan ketamine merupakan anestetika parenteral yang paling umum digunakan sebagai agen induksi untuk anestesi umum inhalasi. Anestesi pada manusia dengan metode TIVA menggunakan propofol dan ketamine, menunjukkan hasil yang sangat memuaskan secara klinik. Metode TIVA dengan propofol digunakan secara luas pada pasien manusia yang ditangani diluar ruang operasi. Kombinasi propofol dan ketamine akan berpotensi menghasilkan sedasi dan relaksasi yang baik karena potensi propofol serta menghasilkan analgesi yang kuat karena potensi ketamine. Kombinasi propofol dan ketamine dapat menurunkan dosis hipnotik propofol dan mengurangi pengaruh depresi kardiovaskuler dan respirasi akibat propofol.
Dengan demikian, pemeliharaan status teranestesi dengan kombinasi ketamine dan propofol secara infusi gravimetrik diharapkan menghasilkan potensi anestesi umum yang baik dan aman. Kombinasi ketamine dan propofol diharapkan dapat menciptakan kondisi sedasi, analgesi, dan relaksasi yang oftimal serta adequat untuk dilakukan tindakan atau prosedur diagnostik maupun terapeutik tanpa menimbulkan gangguan hemodinamik, respiratorik, dan metabolik yang dapat mengancam.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mendapatkan keterpilihan anestetika yang memenuhi kriteria komponen dasar anestesi (sedasi, analgesi, relaksasi, aman, dan mudah diaplikasikan), sedangkan secara khusus tujuan penelitian ini adalah :
1. Memperoleh kombinasi dan dosis preanestesi dan induksi anestesi pada anjing.
2. Memperoleh metode pemeliharaan status teranestesi secara infusi gravimetrik pada anjing.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat :
1. Memberikan keyakinan untuk pemeliharaan status teranestesi secara infusi gravimetrik selama masa pembiusan pada anjing.
2. Kombinasi bahan anestetikum dan dosis ketamine dan propofol dapat dipilih sebagai kebakuan anestetikum pada anjing.
3. Metode dan hasil kajian anestesi infusi gravimetrik pada anjing dapat dijadikan acuan dalam mengkaji anestesi pada spesies lain maupun manusia.
Hipotesis
1. Kombinasi preanestesi atropine-xylazine atau atropine-midazolam dengan induksi ketamine dan propofol menghasilkan waktu induksi (onset) yang lebih singkat, waktu anestesi (duration of action) yang lebih lama dan waktu pemulihan (recovery) yang lebih cepat.
TINJAUAN PUSTAKA
Anestesi
Istilah anestesi dimunculkan pertama kali oleh dokter Oliver Wendell Holmes (1809-1894) berkebangsaan Amerika, diturunkan dari dua kata Yunani : An berarti tidak, dan Aesthesis berarti rasa atau sensasi nyeri. Secara harfiah berarti ketiadaan rasa atau sensasi nyeri. Dalam arti yang lebih luas, anestesi berarti suatu keadaan hilangnya rasa terhadap suatu rangsangan. Pemberian anestetikum dilakukan untuk mengurangi dan menghilangkan rasa nyeri baik disertai atau tanpa disertai hilangnya kesadaran. Seringkali anestesi dibutuhkan pada tindakan yang berkaitan dengan pembedahan. Anestetikum yang diberikan pada hewan akan membuat hewan tidak peka terhadap rasa nyeri sehingga hewan menjadi tenang, dengan demikian tindakan diagnostik, terapeutik, atau pembedahan dapat dilaksanakan lebih aman dan lancar (Tranquilli et al. 2007; Miller 2010).
Preanestesi
Preanestesi adalah pemberian zat kimia sebelum tindakan anestesi umum dengan tujuan utama menenangkan pasien, menghasilkan induksi anestesi yang halus, mengurangi dosis anestetikum, mengurangi atau menghilangkan efek samping anestetikum, dan mengurangi nyeri selama operasi maupun pasca operasi (Debuf 1991; McKelvey dan Hollingshead 2003). Pemilihan preanestetikum dipertimbangkan sesuai dengan spesies, status fisik pasien, derajat pengendalian, jenis operasi, dan kesulitan dalam pemberian anestetikum (Booth dan Branson 1995).
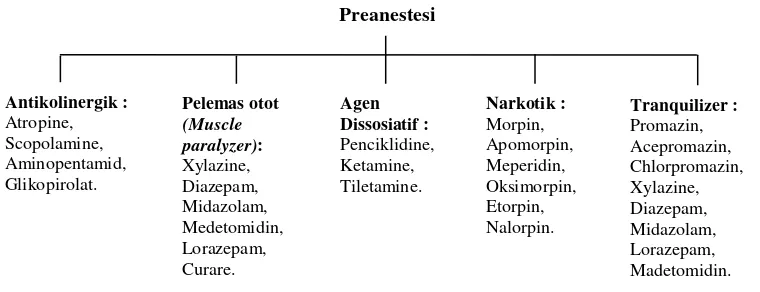
Preanestetikum yang paling umum digunakan pada hewan adalah atropine, acepromazin, xylazine, diazepam, midazolam, dan opioid atau narkotik. Atropine digunakan untuk mengurangi salivasi, peristaltik dan mengurangi bradikardia akibat anestesi. Acepromazin digunakan sebagai penenang atau tranquilizer. Xylazine, medetomidin, diazepam, dan midazolam digunakan sebagai agen sedatif dan merelaksasi otot. Opioid atau narkotik digunakan untuk mengurangi rasa sakit, seperti disajikan pada Gambar 1.
Gambar 1. Klasifikasi agen preanestesi yang digunakan pada anestesi umum (Sumber: Warren 1983; McKelvey dan Hollingshead 2003).
Klasifikasi Anestesi
Keadaan teranestesi dapat dihasilkan secara kimia dengan obat-obatan dan secara fisik melalui penekanan sensori pada syaraf. Obat-obatan anestetika umumnya diklasifikasikan berdasarkan rute penggunaannya, yaitu: 1). Topikal misalnya melalui
kutaneus atau membrana mukosa; 2). Injeksi seperti intravena, subkutan, intramuskular, dan intraperitoneal; 3). Gastrointestinal secara oral atau rektal; dan 4). Respirasi atau inhalasi melalui saluran nafas (Tranquilli et al. 2007).
Anestetetikum juga dapat diklasifikasikan berdasarkan daerah atau luasan pada tubuh yang dipengaruhinya, yaitu : 1). Anestesi lokal, terbatas pada tempat penggunaan dengan pemberian secara topikal, spray, salep atau tetes, dan infiltrasi. 2). Anestesi regional, mempengaruhi pada daerah atau regio tertentu dengan pemberian secara perineural, epidural, dan intratekal atau subaraknoid. 3). Anestesi umum, mempengaruhi seluruh sistem tubuh secara umum dengan pemberian secara injeksi, inhalasi, atau gabungan (balanced anaesthesia) (Adams 2001; McKelvey dan Hollingshead 2003).
Anestesi Lokal
Anestetikum lokal adalah suatu bahan kimia yang mampu menghambat konduksi syaraf perifer tanpa menimbulkan kerusakan permanen pada syaraf tersebut. Mekanisme kerja anestetikum lokal dengan cara menghambat (blok) saluran ion sodium (Na) pada syaraf perifer, konduksi atau aksi potensial pada syaraf terhambat sehingga respon nyeri secara lokal hilang. Anestetikum lokal mencegah proses depolarisasi membran syaraf secara lokal melalui penghambatan saluran ion Na, sehingga membran akson tidak dapat bereaksi dengan neurotransmitter acetilkolin dan membran akan tetap dalam keadaan semipermiabel serta tidak terjadi perubahan potensial. Keadaan tersebut menyebabkan aliran inpuls yang melewati syaraf berhenti, sehingga semua rangsangan tidak sampai ke SSP. Sifat hambatan syaraf umumnya bersifat lokal, selektif, dan tergantung pada dosis atau jumlah obat yang diberikan (Tranquilli et al. 2007; Miller 2010).
Penggunaan anestetikum lokal bisa dilakukan dengan meneteskan pada permukaan daerah yang akan dianestesi (surface aflication), dengan melakukan injeksi secara sub-kutan pada daerah yang akan dianestesi (subdermal, intradermal), serta dengan melakukan pemblokiran pada daerah tertentu (field block anestesi). Anestetikum yang sering digunakan sebagai anestetikum lokal adalah procaine HCI 2% - 4%, Lidocaine 0,5 - 2%, Lidocaine 4%, Tetracaine, bupivacaine 0,25% atau 0,5%, Dibucain, Pehacaine, Lidonest, dan Chlor buthanol dengan dosis pemberian secukupnya (Quantum statis, QS). Lidocaine dan bupivacaine dapat diencerkan dengan larutan salin (bukan air) untuk menurunkan konsentrasinya. Bupivacaine mempunyai onset lebih lambat (20 menit) dan durasi lebih panjang (6 jam) dibandingkan lidocaine (onset lebih cepat dan durasi 1-2 jam) (Adams 2001; Sudisma 2006; Tranquilli et al. 2007).
Anestesi Regional
Anestesi regional adalah tindakan menghilangnya nyeri yang dilakukan dengan cara menyuntikkan anestetikum lokal pada lokasi syaraf yang menginervasi regio atau daerah tertentu sehingga menyebabkan hambatan konduksi inpuls yang reversibel. Anestetikum regional dapat menghilangkan rasa nyeri pada suatu daerah atau regio tertentu secera reversibel tanpa disertai hilangnya kesadaran. Mekanisme kerja dan jenis anestetikum yang digunakan sama dengan anestetikum lokal, tetapi daerah atau luasan pada tubuh yang dipengaruhi adalah daerah atau regio tertentu. Anestesi regional dibedakan berdasarkan rute pemberiannya, yaitu secara epidural, spinal atau intrathekal atau subaraknoid, dan blok pleksus brakhialis (Adams 2001; McKelvey dan Hollingshead 2003).
pembedahan daerah pelvis, dan amputasi daeran kaki belakang. Pada hewan kecil dilakukan antara tulang lumbar terakhir dan tulang sakral 1. Sedangkan pada hewan besar dilakukan antara tulang coccigia 1 dan 2. Anestetikum yang digunakan sama dengan anestetikum lokal, seperti lidocaine 2%, bupivacain 0,5%, ropivacain 0,75% atau mepivacaine 2% dengan dosis pemberian 1ml/5kg BB. Lidocain menghasilkan durasi sekitar 1-2 jam dan bupivacain sekitar 6 jam (McKelvey dan Hollingshead 2003).
Spinal atau intrathekal atau subaraknoid anestesi sama dengan anestesi epidural tetapi dilakukan melalui duramater dan subaraknoid dimana jarum menembus duramater dan subaraknoid sehingga anestetikum masuk ke dalam dan langsung mengenai syaraf spinal, menghasilkan anestesi yang segera dan lebih cepat. Anestesi ini mengakibatkan resiko berontak dan rasa sakit yang memerlukan kesembuhan lebih lama. Anestetikum yang digunakan sama dengan anestetikum lokal. Sedangkan blok pleksus brakhialis adalah anestesi regional dengan cara menyuntikkan anestetikum lokal di daerah perjalanan fleksus brakhialis yang menginervasi daerah kaki depan (Adams 2001; McKelvey dan Hollingshead 2003; Sudisma 2006; Tranquilli et al. 2007).
Anestesi Umum
Mekanisme kerja anestesi umum pada tingkat seluler belum diketahui secara pasti, tetapi dapat dihipotetiskan mempengaruhi sistem otak karena hilangnya kesadaran, mempengaruhi batang otak karena hilangnya kemampuan bergerak, dan mempengaruhi kortek serebral karena terjadi perubahan listrik pada otak. Anestesi umum akan melewati beberapa tahapan dan tahapan tersebut tergantung pada dosis yang digunakan. Tahapan teranestesi umum secara ideal dimulai dari keadaan terjaga atau sadar kemudian terjadi kelemahan dan mengantuk (sedasi), hilangnya respon nyeri (analgesia), tidak bergerak dan relaksasi (immobility), tidak sadar (unconsciousness), koma, dan kematian atau dosis berlebih (Tranquilli et al. 2007; Miller 2010).
Anestesi umum yang baik dan ideal harus memenuhi kriteria : tiga komponen anestesi atau trias anestesi (sedasi, analgesi, dan relaksasi), penekanan refleks, ketidaksadaran, aman untuk sistem vital (sirkulasi dan respirasi), mudah diaplikasikan dan ekonomis. Dengan demikian, tujuan utama dilakukan anestesi umum adalah upaya untuk menciptakan kondisi sedasi, analgesi, relaksasi, dan penekanan refleks yang optimal dan adekuat untuk dilakukan tindakan dan prosedur diagnostik atau pembedahan tanpa menimbulkan gangguan hemodinamik, respiratorik, dan metabolik yang dapat mengancam (Wolfensohn dan Lloyd 2000; Adams 2001; Tranquilli et al. 2007; Miller 2010).
Anestesi umum inhalasi merupakan salah satu metode anestesi umum yang dilakukan dengan cara memberikan agen anestesi yang berupa gas dan atau cairan yang mudah menguap melalui alat anestesi langsung ke udara inspirasi. Mekanisme kerja anestesi umum inhalasi sangat rumit dan sampai saat ini masih merupakan misteri, karena pemberian anestetikum inhalasi melalui pernapasan menuju organ sasaran yang jauh adalah suatu hal yang unik. Hiperventilasi akan menaikkan ambilan anestetikum dalam alveolus dan hipoventilasi akan menurunkan ambilan alveolus. Kelarutan zat inhalasi dalam darah adalah faktor utama yang penting dalam menentukan induksi dan pemulihan anestesi inhalasi. Induksi dan pemulihan akan berlangsung cepat pada zat yang tidak larut dan lambat pada zat yang larut. Kadar alveolus minimal atau minimum alveolar cencentration (MAC) adalah kadar minimal zat anestesi dalam alveolus pada tekanan satu atmosfir yang diperlukan untuk mencegah gerakan pada 50% pasien yang dilakukan rangsangan insisi standar. Immobilisasi tercapai pada 95% pasien apabila kadar anestetikum dinaikkan di atas 30% nilai MAC. Dalam keadaan seimbang, tekanan parsial anestetikum dalam alveoli sama dengan tekanan zat dalam darah dan otak tempat kerja anestetikum (Latief et al. 2007; McKelvey dan Hollingshead 2003).
Anestetika umum inhalasi yang pertama kali dikenal dan digunakan untuk membantu pembedahan adalah N2O. Kemudian menyusul, eter, kloroform, etil
klorida, halotan, metoksifluran, enfluran, isofluran, desfluran, sevofluran, dan xenon. Anestetika umum inhalasi yang umum digunakan saat ini adalah N2
Nitrous oxide (N
O, halotan, enfluran, isofluran, desfluran, sevofluran, dan xenon. Obat obat anestesi yang lain ditinggalkan, karena efek sampingnya yang tidak dikehendaki. Misalnya, eter mudah terbakar dan meledak, menyebabkan sekresi bronkus berlebihan, mual dan muntah, kerusakan hati, dan baunya yang sangat merangsang. Kloroform menyebabkan aritmia dan kerusakan hati. Metoksifluran menyebabkan kerusakan hati, toksik terhadap ginjal, dan mudah terbakar (Latief et al. 2007; McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).
2O) atau dinitrogen monoksida adalah anestesi inhalasi yang
ini bersifat anestetikum lemah, tetapi analgesianya kuat, sehingga jarang digunakan secara tunggal. Anestetikum yang sering dikombinasikan dengan N2O adalah
halotan. Pada akhir anestesi setelah N2O dihentikan, akan cepat keluar mengisi
alveoli, sehingga terjadi pengenceran oksigen dan terjadi hipoksia difusi. Mengatasi hipoksia difusi, biasanya diberikan 100% oksigen selama 5 – 10 menit. Potensi N2O
digunakan pada hewan tidak baik, karena mempunyai MAC yang tinggi. MAC N2
Halotan sering digunakan sebagai induksi anestesi dikombinasikan dengan N
O pada manusia mendekati 100%, tetapi pada anjing hampir 200% dan kucing mendekati 250% (Latief et al. 2007; McKelvey dan Hollingshead 2003).
2
Desfluran adalah halogenasi eter yang rumus bangun dan efek klinisnya mirip dengan isofluran. Desfluran sangat mudah menguap dibandingkan anestetikum lainnya, sehingga perlu menggunakan vaporizer khusus. Potensi desfluran sangat rendah (MAC 6,0%), bersifat simpatomimetik, menyebabkan takikardia dan
hipertensi. Pengaruh depresi nafasnya sama dengan isofluran dan merangsang jalan napas atas sehingga tidak dapat digunakan sebagai induksi anestesi.
Isofluran merupakan halogenasi eter dan secara kimia sangat mirip dengan metoksifluran dan sevofluran. Rentang keamanan isofluran lebih lebar dibandingkan halotan dan metoksifluran, sehingga sangat umum digunakan pada hewan terutama anjing dan kuda walaupun dengan harga yang lebih mahal. Penggunaaan isofluran pada dosis anestesi atau subanestesi menurunkan metabolisme otak terhadap oksigen, tetapi akan meningkatkan aliran darah di otak dan tekanan intrakranial, sehingga menjadi pilihan pada pembedahan otak. Pengaruh terhadap jantung dan curah jantung (cardiac output) sangat minimal, sehingga dapat digunakan pada pasien dengan kelainan jantung. Potensi isofluran lebih kecil dibandingkan halotan karena mempunyai nilai MAC lebih tinggi dibandingkan halotan. Pemeliharaan anestesi dengan isofluran biasanya digunakan konsentrasi 1,5 – 2,5 % isofluran dalam oksigen (Latief et al. 2007; McKelvey dan Hollingshead 2003).
Semua golongan barbiturat untuk keperluan anestesi berada dalam bentuk garam sodium dan dilarutkan dalam air menjadi larutan 2,5 atau 5%. Tiga klas golongan barbiturat yang digunakan pada hewan adalah ultrashort-acting barbiturates (metoheksital), short-acting barbiturates (tiopental), dan intermediate-acting barbiturates (pentobarbital). Sedangkan long-acting barbiturates
(penobarbital) biasanya digunakan untuk sedatip dan antikonvulsi, bukan untuk anestesi. Barbiturat menimbulkan sedasi, hipnosis, dan depresi pernafasan tergantung dosis dan kecepatan pemberian serta pengaruh analgesia yang ditimbulkan sedikit. Efek utama golongan barbiturat adalah depresi pusat pernafasan, depresi pusat vasomotor, dan miokardium sehingga menurunkan curah jantung dan tekanan darah.
Etomidat berbentuk kristal putih, dapat larut dalam air, etanol, dan propilin glikol. Etomidat adalah sedatif hipnotik imidazol yang biasanya digunakan sebagai induksi anestesi pada anjing dan kucing. Kombinasi anestetikum dengan etomidat menghasilkan relaksasi otot yang baik tetapi tidak menghasilkan analgesia dan durasinya sangat singkat seperti propofol, karena metabolisme etomidat sangat cepat. Etomidat mempunyai pengaruh yang minimal terhadap fungsi kardiovaskuler seperti denyut jantung, curah jantung, dan tekanan darah. Etomidat dapat diberikan secara infusi dengan kecepatan dosis 50 -150 µ/kg/menit.
Ketamine adalah anestetikum umum injeksi golongan nonbarbiturat, termasuk golongan phenilsycloheksamin. Ketamine mempunyai efek analgesia yang sangat kuat akan tetapi efek sedasi dan hipnotiknya kurang (tidur ringan). Ketamine meningkatkan tekanan darah sistol maupun diastol kira kira 20- 25%, karena adanya aktivitas syaraf simpatik meningkat dan depresi baroreseptor. Pemberian anestetikum ketamine secara tunggal dosis 10-15 mg/kg berat badan secara intra muskular pada anjing menimbulkan kekejangan otot dan hipersalivasi serta durasi kerja anestesi yang sangat pendek. Mengatasi kerugian penggunaan anestetikum ketamine secara tunggal, ketamine sering dikombinasikan dengan obat lain sebagai preanestesi.
sangat aman diberikan secara intravena dan dapat diberikan secara berulang-ulang atau sebagai alternatif dapat diberikan secara infusi terus-menerus. Propofol mempunyai efek analgesia yang sangat ringan akan tetapi efek sedasi dan hipnotiknya sangat kuat. Efek samping penggunaaan propofol adalah hipotensi, apnea, dan rasa sakit pada tempat suntikan. Efek samping utama yang sangat dihindari dari propofol adalah penekanan sistem respirasi. Efek samping tersebut sangat berkaitan dengan dosis dan kecepatan penyuntikannya, keuntungan penggunaan propofol akan diperoleh dengan cara mengkombinasikan dengan agen anestetikum lain untuk menurunkan dosis dan meminimalkan pengaruh buruk yang ditimbulkan (Stawicki 2007).
Tahapan Anestesi Umum
Tahapan anestesi sangat penting untuk diketahui terutama dalam menentukan tahapan terbaik untuk melakukan pembedahan, memelihara tahapan tersebut sampai batas waktu tertentu, dan mencegah terjadinya kelebihan dosis anestetikum. Tahapan anestesi dapat dibagi dalam beberapa langkah, yaitu: preanestesi, induksi, pemeliharaan, dan pemulihan (McKelvey dan Hollingshead 2003).
Tahap preanestesi merupakan tahapan yang dilakukan segera sebelum dilakukan anestesi, dimana data tentang pasien dikumpulkan, pasien dipuasakan, serta dilakukan pemberian preanestetikum. Induksi adalah proses dimana hewan akan melewati tahap sadar yang normal atau conscious menuju tahap tidak sadar atau
unconscious. Agen induksi dapat diberikan secara injeksi atau inhalasi. Apabila agen induksi diberikan secara injeksi maka akan diikuti dengan intubasi endotracheal tube
Preanestesi dan induksi anestesi dapat diberikan secara bersamaan, seperti pemberian acepromazin, atropine, dan ketamine dicampur dalam satu alat suntik dan diberikan secara intravena (IV) pada anjing. (Adams 2001; McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).
Selanjutnya hewan akan memasuki tahap pemeliharaan status teranestesi. Pada tahap pemeliharaan ini, status teranestesi akan terjaga selama masa tertentu dan pada tahap inilah pembedahan atau prosedur medis dapat dilakukan. Tahap pemeliharaan dapat dilihat dari tanda-tanda hilangnya rasa sakit atau analgesia, relaksasi otot rangka, berhenti bergerak, dilanjutkan dengan hilangnya refleks palpebral, spingter ani longgar, serta respirasi dan kardiovaskuler tertekan secara ringan. Begitu mulai memasuki tahap pemeliharaan, respirasi kembali teratur dan gerakan tanpa sengaja anggota tubuh berhenti. Bola mata akan bergerak menuju ventral, pupil mengalami konstriksi, dan respon pupil sangat ringan. Refleks menelan sangat tertekan sehingga endotracheal tube sangat mudah dimasukkan, refleks palpebral mulai hilang, dan kesadaran mulai hilang. Anestesi semakin dalam sehingga sangat nyata menekan sirkulasi dan respirasi. Pada anjing dan kucing, kecepatan respirasi kurang dari 12 kali per menit dan respirasi semakin dangkal. Denyut jantung sangan rendah dan pulsus sangat menurun karena terjadi penurunan seluruh tekanan darah. Nilai CRT akan meningkat menjadi 2 atau 3 detik. Semua refleks tertekan secara total dan terjadi relaksasi otot secara sempurna serta refleks rahang bawah sangat kendor. Apabila anestesi dilanjutkan lebih dalam, pasien akan menunjukkan respirasi dan kardiovaskuler lebih tertekan dan pada keadaan dosis anestetikum berlebih akan menyebabkan respirasi dan jantung berhenti. Dengan demikian, pada tahap pemeliharaan sangat diperlukan pemantauan dan pengawasan status teranestesi terhadap sistim kardiovaskuler dan respirasi (McKelvey dan Hollingshead 2003; Tranquilli et al. 2007 ).
injeksi dikeluarkan dari darah melalui hati dan dimetabolisme oleh enzim di hati dan metabolitnya dikeluarkan melalui sistem urinari. Pada hewan kucing, ketamine tidak mengalami metabolisme dan dikeluarkan langsung tanpa perubahan melalui ginjal. Kadar anestetikum golongan tiobarbiturat di dalam otak dapat dengan cepat menurun karena dengan cepat disebarkan ke jaringan terutama otot dan lemak, sehingga hewan akan sadar dan terbangun dengan cepat mendahului ekskresi anestetikum dari dalam tubuh hewan. Anestetikum golongan inhalasi akan dikeluarkan dari tubuh pasien melalui sistem respirasi, molekul anestetikum akan keluar dari otak memasuki peredaran darah, alveoli paru-paru, dan akhirnya dikeluarkan melalui nafas. Tanda tanda adanya aktivitas refleks, ketegangan otot, sensitivitas terhadap nyeri pada periode pemulihan dinyatakan sebagai kesadaran kembali (McKelvey dan Hollingshead 2003).
Durasi atau lama waktu kerja anestetikum dan kualitas anestesi dapat dilihat dari pengamatan perubahan fisiologis selama stadium teranestesi. Dikenal dua waktu induksi pada durasi anestesi. Waktu induksi 1 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak dapat berdiri. Waktu induksi 2 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak ada refleks pedal atau hewan sudah tidak merasakan sakit (stadium operasi). Durasi adalah waktu ketika hewan memasuki stadium operasi sampai hewan sadar kembali dan merasakan sakit jika daerah disekitar bantalan jari ditekan. Waktu siuman atau recovery adalah waktu antara ketika hewan memiliki kemampuan merasakan nyeri bila syaraf disekitar jari kaki ditekan atau mengeluarkan suara sampai hewan memiliki kemampuan untuk duduk sternal, berdiri atau jalan (Moens dan Fargetton 1990; Verstegen dan Petcho 1993; McKelvey dan Hollingshead 2003).
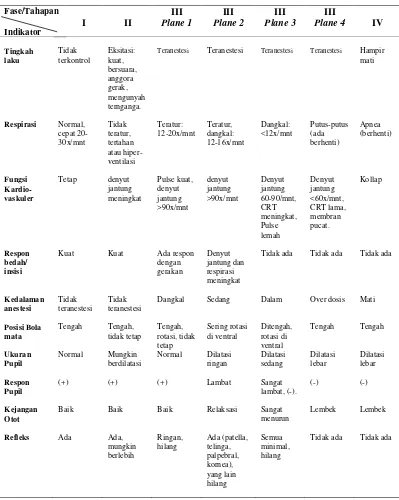
McKelvey dan Hollingshead (2003) dan Tranquilli et al. (2007) menyatakan bahwa untuk memonitor anestesi dilakukan pengamatan tahap-tahap anestesi umum. Kualitas status teranestesi dapat dilihat dari perubahan fisiologis sebagai tanda kedalaman anestesi, seperti disajikan pada Tabel 1.
Tabel 1 Tahapan dan indikasi status teranestesi oleh anestetikum umum
Teranestesi Teranestesi Teranestesi Teranestesi Hampir mati
nyeri. Respirasi dan denyut jantung masih normal atau meningkat, dan semua refleks masih ada; Stadium 2 atau stadium delirium atau eksitasi adalah stadium yang dimulai dari hilangnya kesadaran. Semua refleks masih ada dan bisa muncul berlebihan. Hewan masih dapat mengunyah, menelan, dan mulut umumnya menganga. Kondisi pupil yang dilatasi tetapi akan berkontriksi apabila ada rangsangan sinar. Stadium ini berjalan cepat dan bahkan akan terlewati apabila diberikan preanestesi yang baik. Stadium 2 akan berakhir apabila hewan menunjukkan tanda relaksasi otot, respirasi menurun, dan terjadi penurunan refleks; Stadium 3 atau stadium pembedahan adalah stadium melakukan tindakan bedah dan dibagi menjadi empat plane, yaitu plane 1 atau anestesi ringan, plane 2 atau anestesi pembedahan, plane 3 atau anestesi dalam, dan plane 4 atau paralisa; dan Stadium 4 atau stadium terminal (stadium kelebihan dosis).
Sejarah dan Mekanisme Kerja Anestesi Umum
berlaku untuk anestetikum inhalasi cair atau volatil sedangkan pada anestetikum parenteral seperti pentotal pernyataan di atas tidak berlaku. Hipotesis Vonbibra dan Harles tahun 1847 dan Meyer-Overton tahun 1901 dimentahkan dengan munculnya hipotesis protein membran yang mempengaruhi ion, bahwa membran sel syaraf mengandung protein dan anestetikum akan terikat pada protein, selanjutnya akan mempengaruhi saluran ion. (Mashour 2006; Pretto 2002; Miller 2010).
Dalam perkembangan selanjutnya, pemahaman teori saluran ion yang dipengaruhi oleh neurostransmiter dan reseptor kini diterima sebagai teori mekanisme kerja anestesi umum. Anestetikum akan bekerja mempengaruhi dua jenis reseptor yaitu : 1. Reseptor γ amino butiric acid (GABA) terutama reseptor GABAA
Gamma-amino butiric acid merupakan neurotransmiter inhibitori utama di otak, disintesis dari glutamat dengan bantuan enzim glutamic acid decarboxylase
(GAD), didegradasi oleh GABA-transaminase. Sekali dilepaskan, GABA berdifusi menyeberangi celah sinap untuk berinteraksi dengan reseptornya sehingga menimbulkan aksi penghambatan fungsi SSP. Neurotransmiter GABA lepas dari ujung syaraf gabanergik, berikatan dengan reseptornya, membuka saluran ion Cl, ion Cl masuk ke dalam sel, terjadi hiperpolarisasi sel syaraf , terjadi efek penghambatan transmisi syaraf , dan depresi SSP. Reseptor GABA sebagi tempat terikatnya GABA terdiri dari dua jenis, yaitu ionotropik (GABA
yang merupakan reseptor inhibitori, dan 2. Reseptor Glutamat yang merupakan reseptor eksitatori kususnya pada sub tipe N-methyl D-aspartat (NMDA) (Rudolph dan Antkowiak 2004; Cameron 2006; Garcia et al. 2010 ) .
A) dan metabotropik
(GABAB). Reseptor GABAA terletak di postsinaptik dan cukup penting karena
merupakan tempat aksi obat-obat benzodiazepin dan golongan barbiturat. Reseptor GABAA terdiri dari lima subtipe (pentamer) 2α, 2ß, da n 1γ, masing masing subtipe
mempunyai N-terminal binding site, terdiri dari 450 asam amino, dan mempunyai 4-transmembran (TM) saluran ion. Sampai saat ini telah diketahui ada 19 reseptor subunit GABAA, yaitu lebih dari 85% konsentrasinya dalam bentuk kombinasi α1ß2γ2, α2ß3γ2, dan α3ß1 -3γ2. Reseptor GABAA adalah reseptor komfleks yang
dan neurosteroid (Gambar 2) (Rudolph dan Antkowiak 2004; Cameron 2006; Garcia
et al. 2010; Miller 2010) .
Gambar 2. Reseptor GABAA terdiri dari lima subtipe (pentamer) 2α, 2ß, dan 1γ, m asing
masing subtipe mempunyai N-terminal binding site, terdiri dari 450 asam amino, 4-transmembran (TM) sebagai saluran ion dan tempat terikatnya anestetika (Sumber: Cameron J Weir 2006; Miller 2010) .
Glutamat merupakan asam amino yang termasuk neurotransmiter eksitatori dan berperan penting dalam fungsi sistem syaraf pusat. Reseptor glutamat yang teridentifikasi secara farmakologi terdiri dari subtipe reseptor N-methyl D-aspartat
(NMDA), 5-hydroxy tryptamine (5HT), dan amino hydroxy methyl
isoxazolepropionate (AMPA). Aktivasi reseptor NMDA akan meningkatkan Ca+ dan Na+ intrasel dan memicu aksi potensial. Terikatnya neurostransmiter glutamat pada reseptor NMDA, menyebabkan aliran ion Ca+ dan NA+ ke dalam sel, ion Ca+ intracellular akan meningkat, terjadi depolarisasi, menyebabkan eksitatori, dan memicu konvulsi (Gambar 3) (Cameron 2006; Garcia et al. 2010).
Reseptor GABAA Komfleks
BZ = Bezodiazepin ETOH = Etanol (alkohol) GABA = γ amino butiric acid di luar
sel
Gambar 3. Skema reseptor N-methyl D-aspartat (NMDA) komfleks
(Sumber: Uwe Rudolph dan Bernd Antkowiak 2004; Miller 2010) .
Reseptor GABA dan Glutamat adalah reseptor yang sebagaian besar terletak pada otak khususnya di hipotalamus yang merupakan target kerja anestetikum, yaitu di daerah tuberomammilary nucleous (TMN). Anestetikum umum akan terkonsentrasi untuk meningkatkan aktivitas reseptor GABAA (Cameron 2006;
Mashour 2006; Pretto 2002; Miller 2010). Konsentrasi rendah isofluran, enfluran, halotan, dan propofol mempengaruhi GABA dan induksi Cl-, pada dosis tinggi akan secara langsung mempengaruhi reseptor GABAA
Secara seluler, anestetika bekerja pada sel neuron melalui interaksi dengan kanal ion. Membran protein akan diaktivasi oleh rangsangan kimia atau karena adanya perubahan sebagai sinyal pada membran sel. Dengan adanya sinyal, terjadi aktivasi membran protein, kanal ion akan mempengaruhi elektrik neuron, terjadi perpindahan ion pada permukaan membran sel sehingga terjadi perubahan kondisi di dalam sel yang sangat negatif atau sangat positif. Kondisi di dalam sel yang sangat negatif menyebabkan hiperpolarisasi sel sehingga terjadi inhibitori, sedangkan kondisi yang sangat positif menyebabkan depolarisasi sel sehingga terjadi kondisi
menjadi terbuka (Henschel et al. 2008).
Skema subtipe reseptor N-methyl D-aspartat (NMDA)
ekstraseluler
eksitatori. Pada umumnya, anestesi umum bekerja dengan cara memperkuat (+) sinyal inhibitori atau menghambat (-) sinyal eksitatori. Secara klinis, anestetikum mempengaruhi fungsi kanal ion lebih dari satu pada sistem syaraf dan hal ini berdampak pada aktivitas neuron dengan drajat berbeda dan daerah berbeda, seperti disajikan pada Gambar 4 (Cameron 2006; Garcia et al. 2010).
Gambar 4 Anestesi umum bekerja dengan cara mempengaruhi aktivitas transmitter-gate ion channel dengan cara meningkatkan (+) sinyal inhibitori dan/atau menghambat (-) sinyal eksitatori neurotransmiter. GABA= γ amino butiric acid, NMDA= N-methyl D-aspartat, 5HT3 = 5-hydroxy tryptamine, AMPA = amino hydroxy methyl isoxazolepropionate. (sumber: Cameron J Weir 2006).
Anestetika umum yang sering digunakan saat ini sebagai induksi dan pemeliharaan anestesi ada lima jenis anestetika inhalasi dan lima jenis anestetika injeksi intravena. Anestetika inhalasi yaitu N2O, isofluran, sevofluran, desfluran, dan
xenon. Anestetika intravena yaitu propofol, etomidat, ketamine, metoheksital, dan tiopental. Ketamine, N2O, dan xenon bekerja dengan cara menghambat reseptor
glutamat dengan pengaruh yang sangat kuat menghambat reseptor subtipe NMDA dan berpengaruh sangat lemah pada reseptor lain seperti reseptor GABAA. Anestetika
sisanya bekerja pada reseptor GABAA dengan pengaruh utama meningkatkan fungsi
reseptor GABAA dan berpengaruh juga pada kanal ion lainnya seperti reseptor glisin,
Anestesi Umum
reseptor nikotin, reseptor 5HT3, reseptor glutamat, dan pompa ion kalium. Reseptor GABAA adalah reseptor inhibitori neurotransmiter yang sebagian besar terletak di
SSP (Garcia et al. 2010). Dengan demikian anestetikum secara umum bertindak sebagai sinyal yang akan merangsang reseptor GABAA
Anestetika umum injeksi, selain ketamine, bekerja meningkatkan pengaruh reseptor GABA
, menyebabkan hiperpolarisasi (inhibitori), mengganggu proses fisiologi dan menimbulkan perubahan klinis seperti hipnosis, depresi refleks spinal, dan amnesia (Cameron 2006; Garcia et al. 2010).
A pada otak khususnya subtipe ß3 menyebabkan kehilangan
kesadaran dan subtipe ß2 (50% pada SSP) menyebabkan sedasi. Sedangkan anestetikum ketamine, anestetika gas, N2O, Xenon dan sejenisnya bekerja sedikit
atau lemah pada reseptor GABAA atau Glisin, tetapi sangat kuat menghambat pada
reseptor glutamat subtipe NMDA sehingga akan menutup aliran Ca2+
Reseptor GABA
dan membuka saluran ion K yang menyebabkan terjadinya analgesik kuat (Miller 2010).
A adalah reseptor yang ditemukan di SSP dan reseptor inilah
merupakan target anestesi. Anestetika umum meningkatkan kerja GABA dan menginduksi saluran ion Cl. Pada dosis tinggi, anestetika dapat langsung mengaktivasi reseptor GABAA, tanpa GABA. Sedangkan anestetika apolar seperti
xenon atau cyclopropan mempunyai pengaruh yang sedikit atau tidak berpengaruh pada reseptor GABAA. Pengaruh fungsional anestetika pada reseptor GABAA
Franks (2008) dan Miller (2010) menerangkan bahwa anestetikum volatil bekerja pada reseptor GABA
sangat tergantung pada komposisi reseptor subunitnya, yaitu subunit α, β, atau subunit γ (Franks 2008; Miller 2010).
A subunit α pada transmembran (TM)2 dan TM3
bagian protein Ser270 (αS270). Propofol sebagai anestetikum intravena bekerja pada reseptor GABAA subunit ß TM2 dan TM3 bagian N265 (ßN265). Sedangkan
Mascia et al. (2000) menyebutkan bahwa alkohol dan anestetika mempengaruhi reseptor glisin dan reseptor GABAA melalui asam amino pada TM2 dan TM3 dari α subunit, yaitu pada reseptor glisin pada S267, A288, dan Ser270 sedangkan pada reseptor GABAA subunit β pada S270, A291, Asn 265, dan Met286. Propofol mirip dengan propanethiol bekerja pada reseptor Glisin TM2 α1 (S267C),
pada reseptor GABAA TM2 α2 (S270C) ß1, pada TM3 α1 (A288C), pada TM3 α2
(A291C)ß1, pada TM2 β2 (Tyr445). Asam amino pada TM2 adalah tempat terikatnya anestetika dan alkohol (Gambar 5) (Mascia et al. 2000; Franks 2008; Miller 2010).
Gambar 5. Anestetika volatil (isofluran) bekerja pada reseptor GABAA
dan anestetika intravena (propofol) bekerja pada reseptor GABA subunit α
A
(Sumber : Miller 2010).
subunit β.
Tinjauan Anestetikum Umum
Ketamine HCl
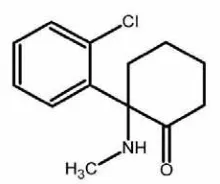
Gambar 6 Struktur kimia ketamine HCl
Ketamine HCl mempunyai sifat menghilangkan rasa sakit yang kuat serta reaksi anestesinya tidak menyebabkan ngantuk (Pathak et al.1982; Kul et al. 2001). Ketamine menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor N methyl D aspartate (NMDA). Ketamine diklasifikasikan sebagai antagonis reseptor NMDA, pada daerah tempat kerja PCP. Afinitas ketamine sangat tinggi pada reseptor NMDA, sehingga menghasilkan pengaruh analgesik yang sangat kuat (Stawicki 2007). Sebagai antagonis NMDA, ketamine menghambat refleks nosiseptik spinal, yaitu menghambat konduksi rasa nyeri ke talamus dan daerah kortek. Penghambatan reseptor NMDA dengan dosis ketamine yang rendah akan menghasilkan pengaruh analgesik yang baik (Intelisano et al. 2008). Ketamine juga menyebabkan gangguan fungsi pada beberapa tempat di otak seperti pada talamus dan kortek serebral menjadi tertekan. Ketamine juga memperpanjang kerja GABA (gamma amino butyric acid), suatu neurotransmiter penghambat di otak dengan cara menghambat pengikatannya di ujung syaraf (Cullen 1997). Reseptor GABA dapat merubah permiabilitas ion Cl
-Adams (2001) menyebutkan bahwa aktivitas ketamine dapat secara langsung menstimulasi pusat adrenergik dan secara tidak langsung menghambat pengambilan (uptake) catecholamine terutama norepineprin. Ketamine dapat mengubah aktivitas dan dapat menyebabkan pelepasan norepineprin pada syaraf simpatik (Adams 2001; Rudolph dan Antkoeiak 2004). Pengaruh klinis yang ditimbulkan ketamine sangat bervariasi seperti : analgesia, anestesi, halusinasi, neurotoksisitas, hipertensi arterial, dan bronkodilatasi. Ketamine juga menimbulkan agitasi (kehilangan orientasi, gelisah, dan menangis) yang sering disebut penomena