PEMANFAATAN BAKTERI KITINOLITIK DALAM
MENGHAMBAT PERTUMBUHAN
Curvularia
sp. PENYEBAB
PENYAKIT BERCAK DAUN PADA TANAMAN MENTIMUN
SKRIPSI
ANDINI HANIF
080805021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMANFAATAN BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT BERCAK DAUN
PADA TANAMAN MENTIMUN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ANDINI HANIF 080805021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PEMANFAATAN BAKTERI KITINOLITIK
DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT BERCAK DAUN PADA TANAMAN MENTIMUN
Kategori : SKRIPSI
Nama : ANDINI HANIF
Nomor Induk Mahasiswa : 080805021
Program Studi : SARJANA (S-1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Dra. Isnaini Nurwahyuni, M.Sc.
NIP. 19600523 198502 2 001 NIP. 19640409 199403 1 003 Prof. Dr. Dwi Suryanto,M.Sc
Diketahui/Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
PEMANFAATAN BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT BERCAK DAUN
PADA TANAMAN METIMUN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan,Januari 2013
PENGHARGAAN
Puji syukur serta sembah sujud penulis haturkan kepada sang Maha Pencipta Allah SWT. atas limpahan rahmat dan karuniaNya yang tiada henti mengalir dalam aliran darah dan hembusan nafas inisehingga penulis dapat menyelesaikan hasil penelitian yang berjudul “PEMANFAATAN BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT
BERCAK DAUN PADA TANAMAN MENTIMUN”yang merupakan syarat untuk
melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing I dan Ibu Dra. Isnaini Nurwahyuni, M.Sc selakuDosen Pembimbing II yang telah banyak memberikan bimbingan, masukan, dan ilmu dalam penyelesaian skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Dr. It Jamilah, M.Sc dan Ibu Dra. Elimasni, M.Si selaku Dosen Penguji yang telah banyak memberikan masukan serta saran dalam kesempurnaan penyelesaian skripsi ini.
Ucapkan terima kasih juga penulis sampaikan kepada Ibu Dra. Elimasni, M.Si selaku Dosen Pembimbing Akademik. Ibu Dr. Nursahara pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Bapak Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU. Ibu Dra. Nunuk Priyani, M.Sc selaku kepala laboratorium Mikrobiologi. Seluruh staf Pengajar Departemen Biologi FMIPA USU atas ilmu dan ajarannya. Ibu Mizarwati S.Si selaku Ketua Panitia Seminar Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Bang Erwin, dan Ibu Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU. Terima kasih untuk Bapak Utema Silan (selaku kepala lab. BPTPH), pak Norman, pak Novit, Kak Naiman, Kak Elvi, Bg Rasyid, serta seluruh staf BPTPH yang telah memperkenankan penulis menyelesaikan penelitian di lab BPTPH, dan atas bimbingannya selama penulis penelitian di BPTPH.
Teristimewa terima kasih penulis ucapkan kepada sahabat tertawa dan menangis dalam mengejar impian Arifda Ayu, Dewi Novina, Diah Sri Utami, dan Novi Malinda, terima kasih untuk persahabatan yang bewarna dan indah ini, semoga persabatan ini menjadi sebuah kisah klasik untuk masa depan. Terima kasih pada teman-teman ’08 Ira, Yuni, Sirma, Dame, Desy, Yanti, Sari, Nina, Frans, Albert, Jeckmal, Ina, Rildah, Riana, Maya, Santi, Nanin, Ahri, Ummi, Zulfi, Netty, Eka, Igun, Asmi, Arta, Indri, Sister, Agnes, Pesta, Mela, Sarah, Riana, Pinta, Oppy, Intan, Rini,Inur, Uya, Ika, Juju, Gilang, Tombak, Destri, Rohana, Rosima, Hanna, terima kasih untuk pertemanan yang menyenangkan sejak awal perkuliahan. Kepada kakak dan abang senior stambuk 2005, 2006, dan 2007 bg Affan, bg Asril, bg Mirza, Kak Ria Umeda, Kak Resti. Kepada kakak asuh penulis kakSiti Maimunah. Kepada adik junior 2009, 2010 dan 2011, kepada seluruh BFS crew, serta teman-teman lainnya yang turut mendukung dan menyemangati penulis dalam penyelesaian skripsi ini.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari kata sempurna. Oleh karena itu, penulis mengharapkan saran kritik serta masukkan yang membangun demi kesempurnaan penulisan skripsi ini. Penulis berharap goresan sederhana ini dapat bermanfaat bagi ilmu pengetahuan dan bagi kita semua.
Medan, Januari 2013
PEMANFAATAN BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT BERCAK DAUN
PADA TANAMAN MENTIMUN
ABSTRAK
Penelitian tentang pemanfaatan bakteri kitinolitik dalam menghambat pertumbuhan Curvularia sp. penyebab penyakit bercak daun pada tanaman mentimun telah dilakukan di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT-Balai Proteksi Tanaman dan Hortikultura Dinas Pertanian Provinsi Sumatera Utara Medan dan Laboratorium Mikrobiologi Departemen Biologi FMIPA USU, Medan. Enam isolat bakteri kitinolitik yang telah diuji secara in vitro memiliki kemampuan dalam menghambat pertumbuhan Curvularia sp.. Hasilnya menunjukkan Bacillus sp. BK13 dengan zona hambat paling besar yaitu 2,75 cm dan Enterobacter sp. BK15 dengan zona hambat 2,55 cm, sedangkan Enterobacter sp. PB17 menunjukkan penghambatan terendah dengan zona hambat 1,3 cm. Perlakuan perendaman benih mentimun pada suspensi bakteri kitinolitik mampu mengurangi persentase bercak daun. Enterobacter sp. BK15 memiliki kemampuan tertinggi dalam penghambatan serangan Curvularia sp. dengan penurunan serangan bercak daun hingga 50%.
UTILIZATION CHITINOLYTIC BACTERIA ISOLATES TO INHIBIT GROWTH OF Curvularia sp. THAT CAUSE LEAF SPOT DISEASE OF
CUCUMBER
ABSTRACT
A study about the utilization of chitinolytic bacteria isolates to inhibit growth of Curvularia sp. that cause leaf spot disease of cucumber has been done in Laboratoryof observation pest and disease, Medan Johor, UPT-Balai Protection Plant and Horticulture1 and Laboratory Microbiology Departement of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan. Six chitinolytic isolates were testedin vitro to inhibit growth of Curvularia sp.. The result showed that Bacillus sp. BK13 inhibit more with inhibition zone of 2,75 cm and Enterobacter sp. BK15 with inhibition zone of 2,55 cm, whereasEnterobacter sp. PB17 the lowest inhibit with inhibition zone by 1,3 cm. Soaking seeds treatment in chitinolytic bacteria suspension was able to reduce the percentage of leaf spot. Enterobacter sp. BK15 has the highest ability to inhibit leaf spotattack, by reducing 50%.
DAFTAR ISI
DAFTAR LAMPIRAN xii
BAB 1 PENDAHULUAN 1
2.2 Penyakit Bercak Daun Curvularia 5
2.3 Curvularia sp. 6
2.4 Senyawa Kitin 7
2.5 Bakteri Penghasil Enzim Kitinase 8
2.6 Potensi Bakteri Kitinolitik Sebagai Pengendali Hayati 9
BAB 3 BAHAN DAN METODE 11
3.1 Waktu dan Tempat 11
3.2 Alat dan Bahan 11
3.3 Isolasi Curvularia sp. 12
3.4 Uji Antagonis Bakteri Kitinolitik Terhadap Curvularia sp. 12
3.5 Pengamatan Struktur Hifa Abnormal 13
3.6 Uji Potensi Serangan Curvularia sp. 14
3.7 Penghambatan Serangan Curvularia sp. Pada Benih Mentimun 14
BAB 4 HASIL DAN PEMBAHASAN 16
4.1 Isolasi Curvularia sp. 16
4.2 Uji Antagonis Bakteri Kitinolitik Terhadap Curvularia sp. 17
4.3 Pengamatan Struktur Hifa Abnormal 19
4.4 Uji Potensi Serangan Curvularia sp. 20
BAB 5 KESIMPULAN DAN SARAN 28
5.1 Kesimpulan 28
5.2 Saran 28
DAFTAR PUSTAKA 29
DAFTAR GAMBAR
Halaman
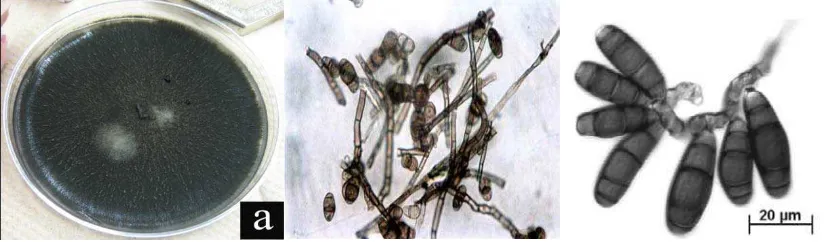
Gambar 2.2.1 Daun Mentimun yang Terserang Bercak 5 Gambar 2.3.1 (a) Koloni Curvularia sp. pada Media PDA, (b) Hifa dan
Konidia Curvularia sp., (c) Konidia Curvularia sp. 6 Gambar 3.4.1 Metode Pengukuran Zona Hambat Bakteri Kitinolitik
Terhadap Koloni Jamur 13
Gambar 4.1.1 (a) Koloni Curvularia sp. pada Media PDA, (b) Hifa dan
Konidia Curvularia sp. (Perbesaran 4x10) 16 Gambar 4.2.1 Hasil Uji Antagonis In Vitro Antara Curvularia sp.
dengan Isolat Bakteri Kitinolitik 17
Gambar 4.3.1 Hifa Normal dan Abnormal Curvularia sp. 20 Gambar 4.4.1 (a) Koloni Curvularia sp. pada Media PDA, (b) Bercak
Daun Mentimun pada Perlakuan Potensi Serangan Curvularia sp., (c) Reisolasi Bercak Daun, (d) Biakan
Murni Reisolasi 21
Gambar 4.5.1 (a) Daun Terserang Bercak, (b) Daun Tidak Terserang
Bercak Daun 22
Gambar 4.5.2 Persentase Serangan Bercak Daun 24
DAFTAR TABEL
Halaman
Tabel 4.2.1 Uji Antagonis In Vitro Antara Enam Isolat Bakteri Kitinolitik
DAFTAR LAMPIRAN
Halaman Lampiran 1 Isolasi Curvularia sp. dan Uji Antagonis Isolat Bakteri Kitinolitik
Terhadap Curvularia sp. 33
Lampiran 2 Pengamatan Struktur Hifa Abnormal dan Uji Potensi Serangan
Curvularia sp. 34
Lampiran 3 Penghambatan Serangan Curvularia sp. pada Benih Mentimun dan
Penyiapan Media Tanam 35
Lampiran 4 Data Tanaman yang Terserang Bercak Daun dan Data Persentase
Tanaman Yang Terserang Bercak Daun 36
Lampiran 5
Lampiran 6
Uji invivo Penghambatan Bakteri Kitinolitik terhadap Curvularia sp. pada Benih Mentimun
Isolat Bakteri Kitinolitik dan Suspensi Curvularia sp. pada media GYB
37
PEMANFAATAN BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Curvularia sp. PENYEBAB PENYAKIT BERCAK DAUN
PADA TANAMAN MENTIMUN
ABSTRAK
Penelitian tentang pemanfaatan bakteri kitinolitik dalam menghambat pertumbuhan Curvularia sp. penyebab penyakit bercak daun pada tanaman mentimun telah dilakukan di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT-Balai Proteksi Tanaman dan Hortikultura Dinas Pertanian Provinsi Sumatera Utara Medan dan Laboratorium Mikrobiologi Departemen Biologi FMIPA USU, Medan. Enam isolat bakteri kitinolitik yang telah diuji secara in vitro memiliki kemampuan dalam menghambat pertumbuhan Curvularia sp.. Hasilnya menunjukkan Bacillus sp. BK13 dengan zona hambat paling besar yaitu 2,75 cm dan Enterobacter sp. BK15 dengan zona hambat 2,55 cm, sedangkan Enterobacter sp. PB17 menunjukkan penghambatan terendah dengan zona hambat 1,3 cm. Perlakuan perendaman benih mentimun pada suspensi bakteri kitinolitik mampu mengurangi persentase bercak daun. Enterobacter sp. BK15 memiliki kemampuan tertinggi dalam penghambatan serangan Curvularia sp. dengan penurunan serangan bercak daun hingga 50%.
UTILIZATION CHITINOLYTIC BACTERIA ISOLATES TO INHIBIT GROWTH OF Curvularia sp. THAT CAUSE LEAF SPOT DISEASE OF
CUCUMBER
ABSTRACT
A study about the utilization of chitinolytic bacteria isolates to inhibit growth of Curvularia sp. that cause leaf spot disease of cucumber has been done in Laboratoryof observation pest and disease, Medan Johor, UPT-Balai Protection Plant and Horticulture1 and Laboratory Microbiology Departement of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan. Six chitinolytic isolates were testedin vitro to inhibit growth of Curvularia sp.. The result showed that Bacillus sp. BK13 inhibit more with inhibition zone of 2,75 cm and Enterobacter sp. BK15 with inhibition zone of 2,55 cm, whereasEnterobacter sp. PB17 the lowest inhibit with inhibition zone by 1,3 cm. Soaking seeds treatment in chitinolytic bacteria suspension was able to reduce the percentage of leaf spot. Enterobacter sp. BK15 has the highest ability to inhibit leaf spotattack, by reducing 50%.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Pengendalian hayati terhadap hama dan penyakit tanaman dengan menggunakan
mikroorganisme telah dimulai sejak lebih dari 70 tahun yang lalu (sekitar 1920-1930),
yaitu ketika pertama kali ditemukansenyawa antibiotik yang dihasilkan dari
mikroorganisme tanah. Sekarang sudah menjadi satu pengetahuan bahwa
pengendalian hayati mempunyai peranan penting dalam pertanian pada masa
mendatang, karena kekhawatiran terhadap bahaya penggunaan bahan kimia yang
terkandung pada pestisida dan fungisida (Hasanuddin, 2003). Hal inilah yang
mendorong para peneliti mencari alternatif lain dalam mengendalikan hama dan
penyakit tanaman dengan menggunakan mikroorganisme.
Sebagai salah satu negara yang memiliki biodiversitas sangat besar, Indonesia
memiliki banyak sumberdaya alam hayati yang tak ternilai, mulai dari bakteri hingga
jamur, tumbuhan, dan hewan. Pencarian isolat mikrorganisme yang potensial untuk
digunakan dalam bidang industri, pertanian, dan juga kesehatan merupakan pekerjaan
yang harus terus dilakukan (Suryanto, 2009). Enzim kitinase yang dihasilkan oleh
mikroorganisme kitinolitik mempunyai potensi tinggi untuk mendegradasi limbah
yang mengandung kitin.Pada bidang pertanian, bakteri kitinolitik berfungsi sebagai
agen biokontrol terhadap fungi patogen maupun serangan hama yang umumnya
memiliki komponen kitin pada dinding selnya (Muharni, 2009). Bakteri kitinolitik
adalah bakteri penghasil enzim kitinase yang berperan dalam mendegradasi kitin
menjadi N-asetilglukosamin. Organisme pendegradasi kitin umumnya berasal dari
mikroorganisme diantaranya adalah dari kelompok bakteri. Bakteri yang dilaporkan
memiliki aktivitas kitinase seperti, Vibrio furnissi, Serratia marcescens,
Bacilluscirculans, Bacillus thuringiensis, dan Pseudomonas aeruginosa (Muharni,
Sama halnya dengan sayuran lainnya, mentimun merupakan sayuran yang
rentan terhadap serangan hama dan penyakit tanaman. Serangan hama dan penyakit
tanaman merupakan salah satu penyebab gangguan pertumbuhan mentimun yang
perlu diwaspadai, karena selain menggangu pertumbuhan, serangan hama dan
penyakit juga dapat menurunkan produksi mentimun (Prabowo, 2009). Salah satu
penyakit yang menyerang tanaman mentimun adalah penyakit bercak daun yang
disebabkan oleh jamur patogen Curvularia sp.. Menurut Semangun (1996), kerusakan
pada daun dapat mengurangi fotosintesis, selain itu penyakit ini dapat juga
memperpendek umur produktif tanaman.
Gejala penyakit bercak daun Curvularia mirip dengan gejala bercak daun
Cercospora, hanya dapat dibedakan dengan pemeriksaan mikroskopis. Pada ujung
daun terdapat bercak dengan tepi yang tidak teratur, pusat berwarna coklat
keputih-putihan dan tepi coklat tua, dengan haloberwarna kuning. Bercak meluas ke arah
pangkal daun sehingga akhirnya seluruh daun mengering. Jamur Curvularia sp.
mempunyai konidiofor coklat tua, tidak bercabang, bersekat, pada ujungnya
berbengkok-bengkok. Konidium berwarna coklat, kebanyakan melekat pada ujung
konidiosfor, dan teratur bertingkat, berbentuk kumparan, pada ujungnya membulat,
bersekat tiga, sel kedua dari puncak mempunyai ukuran yang lebih besar dan bewarna
lebih gelap, dan pada sel ini konidium membengkok (Semangun, 2007).
1.2 Permasalahan
Serangan hama dan penyakit merupakan kendala utama yang sering kali
dihadapi oleh petani, salah satunya adalah penyakit bercak daun Curvularia. Hingga
saat ini para petani masih bergantung pada penggunaan fungisida sintetis berbahan
kimia dalam pengendalian hama dan penyakit tanaman. Namun penggunaan fungisida
sintesis berbahan kimia berdampak buruk pada lingkungan. Oleh karena itu perlu
dilakukan penelitian untuk mengetahui kemampuan isolat bakteri kitinolitik dalam
daun sebagai salah satu alternatif pengendalian hayati yang aman terhadap
lingkungan.
1.3Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuanisolat bakteri kitinolitik
dalam menghambat pertumbuhan jamur patogen Curvularia sp.penyebab penyakit
bercak daun pada tanaman mentimun.
1.4 Hipotesis
Bakteri kitinolitik yang digunakan mampu menghambat pertumbuhan jamur
patogen Curvularia sp. penyebab penyakit bercak daun pada tanaman mentimun.
1.5Manfaat
Manfaat dari penelitian ini adalah sebagai sumber informasi pengendalian
hayati terhadap penyakit tanaman yang aman terhadap lingkungan bagi masyarakat
BAB 2
TINJAUAN PUSTAKA
2.1 Mentimun
Mentimun merupakan salah satu jenis sayur yang cukup popular dan diminati oleh
masyarakat. Mentimun banyak mengandung mineral seperti kalsium, fosfor, kalium,
dan besi, serta vitamin A, B, dan C, dan juga serat, sehingga permintaan terhadap
mentimun sangat besar. Dari segi ekonomi, mentimun memiliki prospek yang cukup
baik, di bidang teknologi kecantikan mengungkap bahwa mentimun dapat
dimanfaatkan sebagai bahan kosmetika untuk perawatan kecantikan (Julisaniah,
2008), sedangkan untuk kesehatan menurut Prabowo (2009), mentimun memiliki
senyawa kukurbitasin yaitu senyawayang memiliki aktifitas antitumor. Selain itu biji
mentimun mengandung senyawayang bersifat antioksidan untukmencegah kerusakan
tubuh akibat radikal bebas, sementara kandungan mineral dalam mentimun dapat
menurunkan tekanan darah.
Mentimun merupakan tanaman setahun yang tumbuh menjalar, dengan sistem
perakaran dangkal. Batang tanaman mentimun memiliki panjang 1-3 m dengan sulur
yang tidak bercabang. Daun mentimun berbentuk bulat segitiga menyerupai bentuk
jantung dengan lebar daun 7-25 cm dan panjang tangkai daun 5-15 cm. Permukaan
daun kasar karena adanya rambut-rambut di permukaan daun. Bunga berwarna kuning
berbentuk lonceng (Rubatzky dan Yamaguchi, 1999). Buah mentimun muda berwarna
antara hijau, hijau gelap, hijau muda, dan hijau keputihan sampai putih, tergantung
kultivar, sementara buah mentimun tua berwarna coklat, coklat tua bersisik, atau
kuning tua. Diameter buah mentimun antara 12-25 cm (Sumpena, 2006). Sistematika
(taksonomi) tanaman mentimun adalah Kingdom: Plantae, Divisio: Spermatophyta,
Subdivisio: Angiospermae, Kelas: Dicotyledonae, Ordo: Cucurbitales, Famili:
2.2 Penyakit Bercak Daun Curvularia
Salah satu penyakit yang umum menyerang tanaman adalah serangan bercak daun
yang disebabkan oleh fungi patogen. Bercak daun banyak terdapat pada bagian daun
dewasa, serangannya tidak menimbulkan kerugian yang berarti. Warna bercak
bervariasi mulai dari kuning, coklat, hitam, dan ada yang memiliki
lingkaran-lingkaran yang memusat (Semangun, 2007). Menurut Parinthawong (2010), penyakit
yang dikelompokkan ke dalam bercak daun terutama disebabkan oleh fungi patogen
dari genus Curvularia, Alternaria, Helminthosporium, Cercosporadan
lain-lain.Curvularia sp. ditemukan sebagai agen bebas penyebab penyakit pada banyak
tanaman. Menurut Huang J. (2005), bercak daun Curvularia mempengaruhi banyak
spesies rumput di dunia, dan umumnya disebabkan oleh Curvularia eragrostidis, C.
geniculata, C. intermedia, C. inaequalis, C. lunata, C. pallescens, C. protuberate, C.
trifolii.
Gambar 2.2.1 Daun mentimun yang terserang bercak (Sumber: http://urbanext.illinois.edu)
Gejala awal penyakit bercak daun yang disebabkan oleh Culvularia sp. berupa
bercak kuning yang menginfeksi tajuk dan helai daun yang lama kelamaan menjadi
bercak kering berwarna coklat abu-abu, sehingga mengkerut dan mati (Daryani,
1995). Menurut Semangun (1996), jamur patogen dapat masuk ke dalam bagian
tumbuhan melalui luka, lubang alami, atau dengan langsung menembus permukaan
bagian tumbuhan yang utuh. Bagian-bagian tumbuhan tertutup oleh lapisan pelindung
seperti epidermis dan kutikula pada daun dan batang hijau, periderm dan sel gabus
pada bagian yang berkayu. Jika patogen tidak dapat menembus lapisan-lapisan
tersebut, maka patogen akan masuk melalui luka. Infeksi yang berat menyebabkan
mengering ini bercak-bercak Curvularia sp. tetap terlihat jelas sebagai bercak coklat
tua. Penyakit ini sangat menghambat pertumbuhan bibit meskipun bukan penyakit
yang mematikan tanaman. Siklus hidup Curvularia sp. terutama disebarkan dengan
konidiumnya, baik karena terbawa angin maupun karena percikan air hujan dan air
siraman, dan juga oleh serangga (Semangun, 2007).
2.3Curvularia sp.
Koloni Curvularia sp. berwarna coklat kehitaman dengan permukaan koloni
menyerupai beludru atau kapas. Konidiosfor Curvularia sp. biasanya tunggal atau
berkelompok memiliki cabang, bentuknya lurus atau merunduk, berwarna coklat
dengan ujung coklat muda. Konidiofor memiliki ukuran panjang umumnya 650 µm
dan lebar 5 – 9 µm. Konidia dari Curvularia sp. bersepta 3, membengkok pada sel ke
dua atau ke tiga yang lebih lebar dan berwarna lebih coklat dari pada sel yang lain,
berdinding tipis dan berukuran (20-30) x (9-15) µm (Gandjar, 1999), seperti pada
gambar Gambar 2.3.1.
Gambar 2.3.1 (a) KoloniCurvularia sp.pada PDA, (b) Hifa Curvulariasp., (c)
Konidia Curvularia sp. Sumber: Qureshi S. et al (2006), Pimentel
J. et al (2005)
Curvularia sp. digolongkan ke dalam Kingdom: Myceteae (Fungi), Divisi:
Ascomycetes, Kelas: Euasomycetes, Ordo: Pleosporales, Famili: Pleosporaceae,
Genus: Curvularia, Spesies: Curvularia sp.. Curvularia merupakan jamur imperfecti
yang tidak memiliki fase seksual yang dulunya dikelompokkan ke dalam divisi
Deuteromycetes, setelah ditemukan fase seksualnya maka Curvularia dikelompokkan
Deuteromycetes merupakan kelompok jamur yang tidak memiliki fase seksual atau
disebut fungi imperfect. Banyak spesies jamur yang tidak memiliki fase reproduksi
seksual di siklus hidupnya. Umumnya kebanyakan jamur dari kelompok
Deuteromycetes merupakan fase nonseksual atau anomorph dari kelompok jamur
yang memiliki fase seksual seperti Ascomycetes dan Basidiomycetes. Setelah fase
seksual ditemukan, kedua fase anomorph dan teleomorph, secara taksonomi
dikelompokkan ke dalam teleomorph atau fase seksualnya. Curvularia sp. dengan
genus Curvularia diklasifikasikan ke dalam kelompok Deuteromycetes karena
memiliki konidia yang khas untuk genus Curvularia. Fase teleomorph atau fase
seksualnya kemudian ditemukan, sehingga diklasifikasikan ke dalam kelompok
Ascomycetes dengan genus Cochliobolus. Sejak itu jamur tersebuttelah dianggap ke
dalam kelompok Ascomycetes dengan genus Cochliobolus dengan fase anamorph
atau fase konidia dari genus Curvularia.
Menurut Gilman (1972), berdasarkan bentuk konidianya Curvularia sp.terbagi
atas beberapa spesies yaitu Curvularia subulata memiliki konidia berbentukseperti
gada yang meruncing, C. tetramera dengan dua ujung konidianya runcing dan simetri
berwarna kuning gelap, C. interseminata dengan bagian basal dan apikal sel konidia
berwarna coklat transparan dengan ukuran konidia 15-23 X 5,5-7,5 µm, C. maculans
denganbagian basal dan apikal konidia coklat gelap dengan ukuran konidia 19-26 X
11-17 µm, C. geniculata dengankonidia melengkung dengan empat sekat, C. lunata
dengankonidia melengkung berwarna gelap dengan tiga sekat, dan C. pallescens
dengankonidia melengkung berwarna agak terang dengan tiga sekat. Habitat
Curvularia sp. banyak ditemukan di daerah tropis terutama pada tumbuh-tumbuhan,
sawah, tanah hutan, lumpur hutan bakau, serasah, dan bahan organik lainnya yang
mengandung keratin dan selulosa. Curvulariasp. hidup dengan suhu pertumbuhan
yang optimal antara 24º-30ºC (Gandjar, 1999).
2.4 Senyawa Kitin
Kitin merupakan polimer terbanyak kedua di alam, setelah selulosa. Secara luas, kitin
mollusca, serangga, arthropoda, cacing, dan dinding sel fungi (Emmawati et al.,
2007).Polisakarida yang mempunyai berat molekul tinggi ini merupakan polimer
berantai lurus dengan nama lain β–(1,4)-2-asetamida–2–dioksi-D-glukosa
(N-asetil-D-Glukosamin) (Suryanto et al., 2006).
Kitin (C6H9O4.NHCOCH3)n merupakan zat padat yang larut dalam
asam-asam mineral pekat, tetapi tidak larut dalam air, pelarut organik, alkali pekat, dan
asam mineral lemah. Dengan adanya ikatan hidrogen yang sangat kuat pada rantai
kitin, membuat kitin tidak dapat larut dalam air dan membentuk fibril (Dewi, 2008).
Menurut Prasetyaningrum et al(2007), sifat kitin umumnya tidak memiliki efek racun
dan mudah teruraisehingga kitin banyak dimanfaatkan dalam berbagai bidang salah
satunya bidang pertanian.
Kitin pada fungi berbentuk mikrofibril yang memiliki panjang yang berbeda,
tergantung pada spesies dan lokasi selnya. Mikrofibril merupakan struktur utama dari
sel fungi yang terdiri atas jalinan rantai polisakarida yang saling bersilangan
membentuk anyaman. Kandungan kitin pada fungi bervariasi dari 4-9% berat kering
sel (Rajarathanam et al., 1998). Pada bakteri, enzim kitinase diperlukan untuk
memenuhi kebutuhan nutrisi, sementara pada tanaman kitinase digunakan untuk
melawan jamur patogen maupun parasit. Degradasi kitin menjadi monomer
glukosamin memerlukan enzim endokitinase dan eksokitinase yang bekerja sinergistik
(Rahayu et al., 2003).
2.5 Bakteri Penghasil Enzim Kitinase
Mengingat pentingnya peranan enzim kitinase dalam industri, maka perlu dilakukan
berbagai usaha untuk mencariserta mengembangkan mikroorganisme yang memiliki
kemampuan memproduksi enzim kitinase serta menyeleksi strain mikroorganisme
penghasil kitinase yang tinggi (Muharni, 2009). Salah satunya adalah mikroorganisme
kitinolitik yang merupakan mikroorganisme yang mampu mendegradasi kitin dengan
menggunakan enzim kitinase. Mikroorganisme ini dapat diperoleh dari berbagai
seperti laut, danau, kolam, atau limbah udang dan sebagiannya (Herdyastuti et
al.,2009).
Bakteri kitinolitik merupakan jenis bakteri yang mampu memproduksi enzim
kitinase. Kitinase dimanfaatkan untuk asimilasi kitin sebagai sumber karbon dan
nitrogen (Wu et al.,2001). Bakteri kitinolitik dapat memecah dan mendegradasi kitin
penyusun dinding sel fungi sehingga bakteri ini sangat potensial untuk menghambat
pertumbuhan fungi patogen pada tanaman. Beberapa bakteri tanah dilaporkan
memiliki aktivitas kitinolitik. Kelompok bakteri tanah tersebut adalah Streptomyces,
Bacillus, Enterobacter, Aeromonas, Serratia, danVibrio (Ferniah et al., 2003).
Kitinase merupakan hidrolase glikolisis yang mengkatalisis degradasi kitin
yaitu senyawa polimer dari N-asetilglukosamin yang membentuk ikatan linier β-1,4.
Enzim ini ditemukan dalam berbagai organisme, termaksud organisme yang tidak
mengandung kitin dan mempunyai peran dalam fisiologi dan ekologi. Kitinase dapat
dihasilkan oleh bakteri dan jamur yang diperoleh dari berbagai sumber seperti tanah
atau perairan dengan cara menumbuhkan pada media yang mengandung kitin
koloidal. Enzim kitinase banyak dimanfaatkan sebagai agen biokontrol terutama bagi
tanaman yang terserang infeksi jamur. Hal ini dikarenakan kitin merupakan komponen
utama dinding sel fungi yang dapat didegradasi oleh enzim kitinase (Herdyastuti,
2009).
Mikroba kitinolitik dapat ditapis dengan menggunakan medium mengandung
senyawa kitin. Mikroba diisolasi dari sampel dengan menggunakan medium garam
koloidal kitin yang disesuaikan dengan kondisi lingkungan dari mana isolat berasal.
Pembentukkan halo atau zona bening di sekitar koloni merupakan hasil degradasi kitin
(Suryanto & Munir, 2006).
2.6 Potensi Bakteri Kitinolitik Sebagai Pengendali Hayati
Pengendalian hayati merupakan salah satu upaya dan usaha untuk mengendalikan
makhluk hidup yang disebut agen hayati. Cara mengendalikan penyakit tanaman
dengan menggunakan agen pengendali hayati muncul karena kekhawatiran
masyarakat dunia akan penggunaan pestisida atau bahan kimia sintetis yang
berdampak buruk bagi lingkungan maupun makhluk hidup (Soesanto, 2008).Beberapa
penelitian tentang pengendalian hayati jamur patogen tanaman dengan menggunakan
mikroorganisme kitinolitik telah banyak dilakukan, diantaranya melihat kemampuan
melisiskan kitin oleh Aeromonas caviae terhadap Penicillium citrinum dan jamur
lainnya, kemampuan melisiskan kitin dari Trichoderma koningii dan T. harzianum
terhadap Ganoderma boninense, serta T. viride terhadap Fusarium oxysporum
(Suryanto, 2011).
Pemanfaatan bakteri kitinolitik sebagai salah satu agen pengendali hayati perlu
diteliti secara intensif dalam rangka mendapatkan suatu sediaan atau formulasi
fungisida yang aman terhadap lingkungan karena tidak memberi dampak pencemaran
bagi lingkungan. Penyediaan pupuk hayati dan fungisida hayati merupakan bagian
dari strategi pengembangan teknologi pertanian berwawasan lingkungan (Ferniah et
al., 2003). Aktivitas enzim kitinase dari bakteri kitinolitik sangat potensial digunakan
sebagai agen pengendali hayati terhadap jamur patogen maupun serangga hama,
karena kedua organisme ini mempunyai komponen kitin pada dinding selnya
(Muharni et al.,2011). Pengendalian hayati jamur dengan menggunakan
mikroorganisme kitinolitik didasarkan pada kemampuan mikroorganisme
menghasilkan kitinaseyang mampu melisiskan dinding sel jamur (El-Katatany et al,
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai dari bulan Januari 2012 sampai dengan bulan
September 2012 yang bertempat di Laboratorium Pengamatan Hama dan Penyakit
Tanaman, Medan Johor, UPT-Balai Proteksi Tanaman dan Hortikultura 1 Dinas
Pertanian Provinsi Sumatera Utara Medan dan Laboratorium Mikrobiologi
Departemen Biologi FMIPA Universitas Sumatera Utara Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: cawan petri (petridish), tabung
reaksi, rak tabung reaksi, gelas beaker, gelas ukur, pipet serologi, karet penghisap,
spatula, jarum ose, autoklaf, oven, mikroskop, jangka sorong, nampan berukuran 38 x
30 x 7 cm, bunsen, erlenmeyer, inkubator, sprayer, hot plate, vortex, timbangan, pipet
tetes, gelas objek, gelas penutup, pinset, gunting, magnetic stirer, dan botol selai.
Bahan-bahan yang digunakan dalam penelitian ini antara lain: 6 isolat bakteri
kitinolitik Bacillus sp. BK13, Enterobacter sp. BK15, Bacillussp. BK17, Enterobacter
sp. KR05,Enterobactercloacae LK08, dan Enterobacter sp. PB17 yang diperoleh dari
koleksi Laboratorium Mikrobiologi Departemen Biologi Universitas Sumatera Utara
Medan, media Potato Dextrose Agar (PDA), yeast extract, blank disc (Oxoid),
ketokonazol, kloramfenikol, kertas saring, spritus, medium garam minimum kitin
(MGMK) dengan pH 6,8, media Glucose Yeast Broth (GYB), akuades, alkohol 70%,
aluminium foil, kapas, benih mentimun yang diperoleh dari pasar komersil, dan isolat
jamur. Isolat ditumbuhkan dalam media PDA dan diinkubasi pada suhu 28-30°C
3.3 Isolasi Curvularia sp.
Daun mentimun yang memperlihatkan gejala penyakit bercak daun Curvularia
dipotong. Selanjutnya potongan tanaman tersebut didesinfeksi dengan larutan 2%
NaClO kurang lebih selama 10 detik dan dicuci dengan akuades steril sebanyak tiga
kali kemudian ditanam pada media PDA. Setelah miselium tumbuh diinokulasikan
kembali pada media PDA baru untuk mendapatkan biakan murni. Pengamatan
dilakukan secara makroskopis dan mikrokopis untuk mengidentifikasi jamur (Skema
penelitian dapat dilihat pada lampiran 1 hlm 33).
3.4 Uji Antagonis Isolat Bakteri Kitinolitik Terhadap Curvularia sp.
Biakan fungi Curvularia sp. diinokulasi di tengah media MGMK (Medium Garam
Minimum Kitin) yang telah ditambah yeast extract 2% dengan jarak 3,5 cm dari
cakram tempat inokulum bakteri, kemudian biakan tersebut diinkubasi selama 72 jam
pada suhu 28-30oC. Selanjutnya suspensi bakteri kitinolitik sebanyak 10 μl dengan
konsentrasi ≈ 108 sel/ml (standart McFarland) diinokulasikan pada cakram
berdiameter 0,6 cm dan diletakkan di bagian tepi media, pengulangan dibuat sebanyak
dua kali, kemudian diinkubasi pada suhu 28-30oC. Media MGMK ditambah yeast
extract 2% yang diinokulasi fungi patogen digunakan sebagai kontrol. Akitivitas
penghambatan ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni.
Pengamatan dimulai dari hari ke-2 sampai hari ke-7 (Suryanto et al., 2011) (Skema
penelitian dapat dilihat pada lampiran 1 hlm 33).
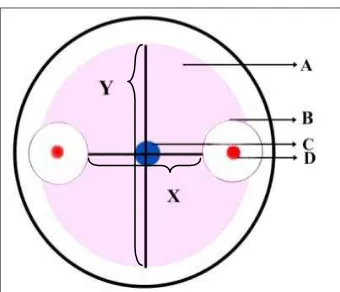
Gambar 3.4.1 Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur; A. Koloni jamur, B. Zona hambat bakteri kitinolitik terhadap koloni jamur, C. Titik tengah jamur diletakkan, D. Koloni bakteri kitinolitik, X. Diameter koloni jamur yang terhambat pertumbuhannya,Y. Diameter koloni jamur normal (Suryanto, 2001)
Pengukuran pertumbuhan Curvularia sp. dilakukan dengan cara mengukur
batas akhir pertumbuhan dari fungi patogen pada sumbu X dan batas akhir
pertumbuhan fungi patogen pada sumbu Y (Gambar 3.4.1), dilakukan setelah terjadi
penghambatan bakteri kitinase terhadap fungi patogen dengan rumus uji
antagonis Y-X
2
= hasil (Suryanto et al., 2011).
3.5 Pengamatan Struktur Hifa Abnormal
Pengamatan struktur hifa secara mikroskopis dilakukan dengan cara
mengamati ujung miselium pada daerah zona hambat fungi patogen. Ujung miselium
Curvularia sp. yang tumbuh pada permukaan media dipotong dengan bentuk block
square, kemudian diletakkan pada gelas objek. Selanjutnya diamati adanya
abnormalitas pada pertumbuhan miselium fungi patogen, abnormalitas miselium
berupa pembengkokan ujung miselium, miselium pecah, miselium berbelah, miselium
bercabang, miselium lisis, dan miselium tumbuh kerdil (Lorito et al., 1992).(Skema
3.6 Uji Potensi SeranganCurvularia sp.
Biakan Curvularia sp. diremajakan pada cawan petri selama kurang lebih 7
hari. Selanjutnya biakan Curvularia sp. tersebut diinokulasikan pada 120 ml media
GYB di dalam labu erlenmeyer 250 ml dan diinkubasi pada suhu 28-30oC selama
kurang lebih 10 hari. Suspensi biakan Curvularia sp. dihitung konidianya dengan
menggunakan hemositometer. Suspensi Curvularia sp. sebanyak 120 ml dicampurkan
dengan 600 g campuran tanah dan kompos steril (nisbah 3:1) di dalam nampan plastik
berukuran 30 cm x 38 cm x 7 cm. Benih mentimun masing-masing 30 benih ditanam
kedalam tiap nampan. Benih yang ditanam ke dalam media tanam yang tidak
dicampurkan dengan suspensi Curvularia sp. digunakan sebagai kontrol. Ulangan
dilakukan sebanyak 3 kali pada perlakuan uji potensi serangan Curvularia sp.. Peubah
yang diamati adalah tanaman yang terserang bercak daun selama masa persemaian 30
hari. Persentase bercak daun dihitung dari jumlah kecambah yang terserang bercak
daun dibagi jumlah seluruh kecambah yang tumbuh (Suryanto et al., 2010)
Reisolasi terhadap Curvularia sp. dilakukan dengan memotong jaringan pada
bagian daun yang menunjukkan gejala bercak daun. Jaringan tersebut kemudian
didesinfeksi dengan menggunakan larutan 2% NaClO selama kurang lebih 10 detik
dan dicuci dengan akuades steril sebanyak tiga kali lalu ditanam pada media PDA.
Isolat yang diperoleh kemudian dibandingkan dengan isolat jamur Curvularia sp.
yang diperoleh pada saat isolasi awal (Skema penelitian dapat dilihat pada lampiran 2
hlm 34).
3.7 Penghambatan Serangan Curvularia sp. Pada Benih Mentimun
Suspensi biakan Curvularia sp. sebanyak 120 ml dicampurkan dengan
600 g campuran tanah dan kompos steril (nisbah 3:1) ke dalam nampan plastik
berukuran 30 cm x 38 cm x 7 cm. Benih mentimun yang telah direndam dengan
suspensi bakteri kitinolitik dengan konsentrasi ≈ 108 sel/ml (standart McFarland)
selama 30 menit ditanam masing-masing 30 benih ke dalam tiap nampan kemudian
diinokulasi bakteri kitinolitik digunakan sebagai kontrol kemudian ditanam.Ulangan
dilakukan sebanyak tiga kali untuk masing-masing perlakuan. Parameter yang diamati
adalah tanaman yang terserang bercak daun, tinggi tanaman, dan jumlah daun selama
persemaian 30 hari Skema penelitian dapat dilihat pada lampiran 3 hlm 35). Menurut
Suryanto et al. (2010), pengurangan persentase bercak daun dihitung dengan rumus :
{Kontrol (+) – Kontrol (-)} – Perlakuan X 100%
Pengurangan bercak daun = {Kontrol (+) – Kontrol (-)
Keterangan:
Kontrol (+): Benih mentimun yang ditanam pada tanah steril yang diberi suspensi
Curvularia sp.
Kontrol (-): Benih mentimun yang ditanam pada tanah steril
Perlakuan : Benih mentimun yang telah direndam pada suspensi bakteri kitinolitik
selama 30 menit lalu ditanam pada tanah steril yang telah diberi
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Curvulariasp.
Berdasarkan pengamatan makroskopis dan mikroskopis isolat jamur yang didapat
memiliki karakteristik makroskopis berupa koloni berwarna coklat kehitaman,
permukaan koloni seperti beludru atau kapas, miselium teratur, pertumbuhan koloni
rata dan tebal sementara tepi koloni tidak rata dan berwarna putih kecoklatan.
Karakteristik mikroskopisnya berupa hifa bersekat, konidia tunggal ataulebih yang
terdapat pada ujung hifa, bersepta 3, bagian sel konidia kedua lebih besar dan
berwarna gelap daripada bagian sel yang lainnya, konidiofornya berwarna coklat tua,
tidak bercabang dan bersepta.Hasil isolasi sampel daun mentimun yang terkena bercak
daun setelah diisolasi pada media PDA selama kurang lebih 48 jam, diperoleh isolat
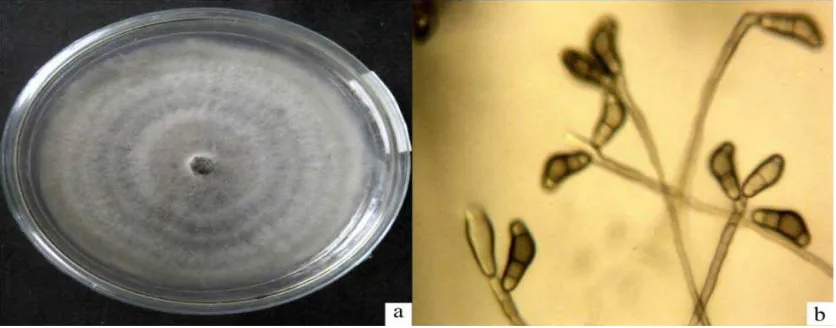
Curvularia sp. dapat dilihat pada Gambar 4.1.1.
Gambar 4.1.1 (a) Koloni Curvularia sp. pada media PDA, (b) Hifa dan konidia Curvularia sp. (Perbesaran 4 X 10)
Menurut Nurhasanah (2011), pada media PDA koloni Curvularia sp.
berwarnacoklat kehitamanan, biakan yang berumur 5-7hari memiliki diameter kurang
lebih 6 cm, dasarkoloni berwarna kecoklatan. Ciri mikroskopik dari Curvularia
konidia bersepta 2-3, membengkok dan membesar pada sel ketiga. Askomata
terbentuk setelah perkawinan dari hifa kolumnar. Askus memiliki bentuk silindris atau
gada dan bertunika tunggal.
4.2 Uji Antagonis Bakteri Kitinolitik Terhadap Curvularia sp.
Hasil uji antogonis enam isolat bakteri kitinolitik Bacillus sp. BK13, Enterobacter sp.
BK15, Bacillussp. BK17, Enterobacter sp. KR05, Enterobacter cloacae LK08, dan
Enterobacter sp. PB17, terhadap Curvularia sp. menunjukkan bahwa enam isolat
bakteri tersebut mampu menghambat pertumbuhan Curvularia sp.. Hal ini dapat
dilihat dari terbentuknya zona hambat pada pertumbuhan Curvularia sp. oleh bakteri
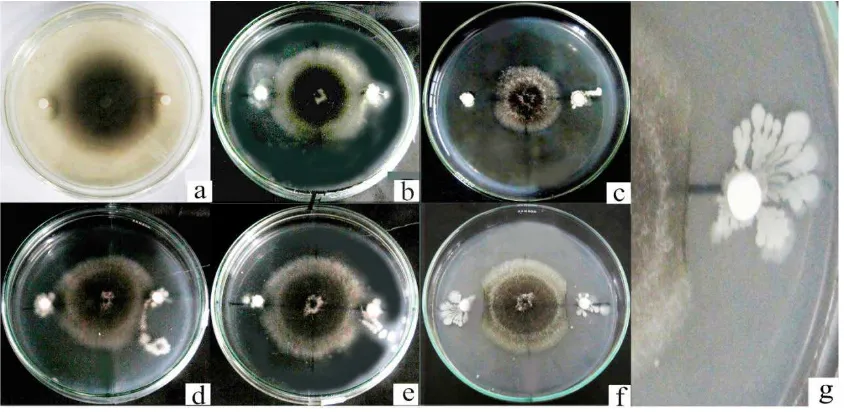
kitinolitik seperti pada Gambar 4.2.1. Zona hambat mulai terlihat pada hari keempat
dan jarak zona hambat terus bertambah hingga hari ketujuh.
Gambar 4.2.1 Hasil uji antagonisin vitro antara Curvularia sp. dengan isolat
bakteri kitinolitik (a)Enterobacter sp. KR05, (b) Enterobacter cloacae LK08, (c)Enterobacter sp. PB17, (d)Bacillussp. BK13, (e) Enterobacter sp. BK15 (f) Bacillussp. BK17, (g) Zona hambat
(Pengamatan hari ke-3)
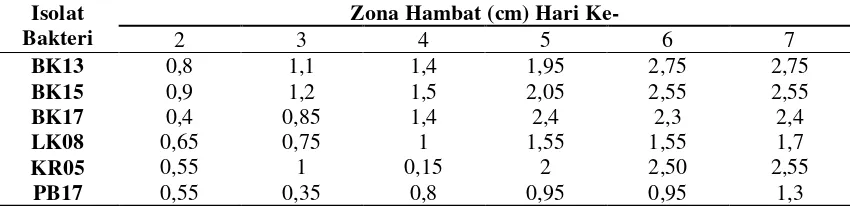
Pada hari ketujuh isolat bakteri kitinolitik yang memperlihatkan efektifitas
paling tinggi dalam menghambat pertumbuhan Curvularia sp. adalah Bacillus sp.
2,55 cm.Isolat bakteri kitinolitik yang memperlihatkan efektivitas paling rendah dalam
menghambat pertumbuhan Curvularia sp. adalah isolat Enterobacter sp. PB17 dengan
zona hambat 1,3 cm yang dapat dilihat pada Tabel 4.2.1. Pada penelitian Asril (2011),
isolat bakteri kitinolitik yang memilki efektivitas penghambatan tertinggi dalam
menghambat Fusarium oxysporum dan Ganoderma boninense secara in vitro
masing-masing adalah Enterobacter sp. BK 15 dengan zona hambat sebesar 20,45 mm dan
Bacillus sp. BK17 dengan zona hambat sebesar 22,74 mm. Perbedaan besarnya
efektifitas enam isolat bakteri kitinolitik dalam menghambat pertumbuhan jamur
menunjukkan adanya perbedaan tingkatkemampuan masing-masing isolat bakteri
kitinolitik dalam produksi dan aktivitas kitinaseyang dihasilkan.
Menurut Suryanto et al., (2011), perbedaan efektivitas penghambatan
pertumbuhan jamur disebabkan oleh adanya perbedaan komposisi dinding sel jamur,
keberadaan kitin pada miselium jamur, perbedaan laju pertumbuhan bakteri, dan
miselium jamur, sertaadanya senyawa metabolit selain kitinase.Kontrol biologis dari
beberapa jamur patogen tanah berhubungan dengan produksi kitinase. Bakteri
penghasil kitinase menunjukkan sifat antagonis in vitro dalam penghambatan
pertumbuhan jamur patogen. Zona hambat pertumbuhan jamur patogen dengan
kitinase adalah bukti cara pendegradasian dinding sel jamur oleh β-(1,
4)-N-asetilglukosamin (Herrera et al., 1999).
Tabel 4.2.1 Uji Antagonis in vitro antara enam isolat bakteri kitinolitik
terhadapCurvularia sp. Isolat
Bakteri
Zona Hambat (cm) Hari Ke-
2 3 4 5 6 7
Senyawa kitin pada yang tersedia pada media uji MGMK menyebabkan
produksi enzim kitinase pada enam isolat bakteri kitinolitik makin meningkat,
sehingga senyawa kitinase tersebut mempercepat proses degradasi dinding sel
mendegradasi kitin yang ada pada dinding sel fungi, sehingga menyebabkan
pertumbuhan Curvularia sp. akan terhambat dan lisis. Menurut Wang et al (2005),
polimer kitin yang merupakan salah satu komponen dinding sel hifa fungi dihidrolisis
oleh enzim kitinase, sehingga dapat menghambatpertumbuhan hifa fungi patogen.
Oleh sebab itu, kitinase merupakan salah satu protein anti jamur yang berpotensi
dimanfaatkan sebagai agen pengendali hayati.
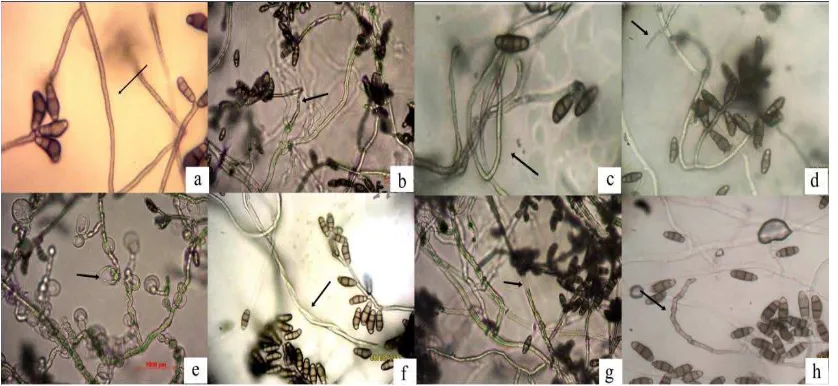
4.3 Pengamatan Struktur Hifa Abnormal
Pengamatan mikroskopik struktur hifa abnormal Curvularia sp. setelah diberi
perlakuan antagonis dengan enam isolat bakteri kitinolitik dilakukan setelah hari ke
tujuh. Aktivitas antagonis dari enam isolat bakteri kitinolitik memiliki penghambatan
yang hampir sama, menyebabkan hifa Curvularia sp. mengalami pertumbuhan hifa
yang abnormal diantaranya hifa lisis, hifa patah, hifa bengkok, hifa melilit, hifa
menggulung, dan hifa kerdil. Hasil dari pengamatan struktur hifa abnormal Curvularia
sp. menunjukkan bahwa isolat Bacillus sp. BK13 dan Enterobacter sp. BK15 lebih
banyak menyebabkan pertumbuhan hifa abnormal seperti lisis, patah, kerdil,
menggulung, dan melilit. Sementara isolat bakteri kitinolitik lainnya lebih sedikit
menyebabkan keadaan hifa abnormal, yaitu berupa hifa menggulung, hifa kerdil, dan
hifa melilit (Gambar 4.3.1). Pertumbuhan hifa abnormal memperlihatkan bahwa isolat
bakteri kitinolitik berpotensi sebagai agen pengendali hayati terhadap fungi patogen
tanaman. Enzim kitinase yang dihasilkan oleh isolat bakteri kitinolitik mampu
menyebabkan hifa jamur patogen mengalami keadaan abnormal hingga lisis.
Kemampuan isolat bakteri kitinolitik dalam menghambat pertumbuhan fungi patogen
Gambar 4.3.1 Hifa Curvularia sp. (a) Normal, (b) Lisis dan patahEnterobacter sp.
BK15, (c) MembengkokBacillus sp. BK13, (d) KerdilEnterobacter
sp. BK15, (e) MenggulungEnterobacter sp. BK15, (f)
MelilitBacillus sp.BK13, (g) Membengkak dan lisis, (h)
KeritingEnterobacter sp. KR05 (Perbesaran 4x10)
Aktivitas antagonis dari enamisolat bakteri kitinolitik terhadap Curvularia sp.
dengan mekanisme enzimatik dan hiperparasitisme, sehingga efektif dalam
menghambat pertumbuhan jamurpatogen pada tanaman. Aktifitas antagonis isolat
bakteri kitinolitik yang menyebabkan hifa lisis menunjukkan bahwa isolat bakteri
kitinolitik mampu mendegradasi dinding sel Curvularia sp.. Aktivitas antagonis yang
ditunjukkan dengan hifa menggulung diduga sebagai upaya pertahanan jamur patogen
terhadap serangan antagonis. Menurut Wijaya (2002), senyawa kitin yang merupakan
homopolimer ikatan β-1,4 dari N-asetilglukosamin adalah komponen terbesar dari
struktural dinding sel fungi patogen. Enzim kitinase yang dihasilkan dari bakteri
kitinolitik dapat mengkatalisis hidrolisis ikatan β-1,4 homopolimer
N-asetilglukosamin menjadi monomer N-N-asetilglukosamin, yang menyebabkan lisisnya
dinding sel fungi patogen.
4.4 Uji Potensi Serangan Curvularia sp.
Penyakit bercak daun Curvularia merupakan patogen tular tanah yang biasanya
menyerang pada kondisi lembab. Menurut Agrios (1996), kelembapan mempunyai
tabung kecambah. Kelembapan juga mengaktivasi bakteri, jamur, dan nematoda
patogen yang selanjutnya menginfeksi tanaman. Penyakit inimenyebabkan nekrotik
atau klorosis ringan berbentuk lingkaran berwarna terang. Bercak daun yang lama
kelamaan semakin membesar akan menyebabkan kerusakan yang signifikan hingga
60% karenahilangnya sebagian besar wilayah fotosintesis tanaman (Akinbode, 2010).
Gangguan patogen terhadap proses fotosintesis terlihat dari klorosis yang terjadi pada
tumbuhan yang terinfeksi dan luka nekrotik yang dihasilkan oleh patogen pada bagian
tumbuhan hijau dan dari menurunnya pertumbuhan dan jumlah buah yang dihasilkan
pada tumbuhan yang terinfeksi (Agrios, 1996). Reisolasi Curvularia sp. dilakukan
dengan mengisolasi bagian daun yang terserang bercak setelah diberi perlakuan
suspensi Curvularia sp.. Melalui pengamatan karakteristik makroskopis maupun
mikroskopis jamur hasil isolasi menunjukkan karakteristik yang sama dengan
Curvularia sp. yang diinfeksi sebelumnya (Gambar 4.4.1).
Gambar 4.4.1 (a) Koloni Curvulariasp. pada media PDA, (b) Bercak daun
mentimun pada perlakuan potensi serangan Curvulariasp. (a.
Bercak Curvularia),(c) Reisolasi bercak daun pada potensi
serangan Curvularia sp. (b. isolasi daun, c. Curvularia sp.), (d)
Biakan murniCurvulariasp. dari reisolasi
Serangan Curvularia sp. terhadap benih mentimun dari hasil uji potensi
serangan menimbulkan penyakit bercak daun dengan persentase serangan sebesar
66,02%. Hal ini menunjukkan bahwa Curvularia sp. bersifat patogen dan
menyebabkan penyakit bercak daun, meskipun tidak menyebabkan kematian.
Reisolasi dari bagian daun mentimun yang terserang bercak daun menunjukkan bahwa
serangan bercak daun pada mentimun disebabkan oleh jamur patogen Curvularia
pada Gambar 4.4.1 (b). Pada gejala lanjut bercak menjadi nekrosis, bercak menyatu
membentuk bercak besar tidak beraturan. Pada beberapa kasus bagian tengah bercak
mengering, rapuh, berwarna kelabu atau coklat muda.
4.5 Penghambatan Serangan Curvularia sp. Pada Benih Mentimun
Konidia Curvularia sp. menginfeksi jaringan daun inang masuk melalui stomata daun
dan berkembangbiak di jaringan daun seperti epidermis atau palisade, sehingga
menyebabkan bercak pada daun (Gambar 4.5.1). Kebanyakan konidia dalam kondisi
basah setelah satu sampai dua hari menginfeksi bagian daun. Produksi konidia terjadi
pada bagian jaringan daun yang hidup. Spora tersebar ke daun yang sehat melalui
angin, dan percikan air. Gejala bercak daun akan mulai terlihat 3 sampai 7 hari setelah
terinfeksi, tergantung pada kondisi kelembapan dan suhu lingkungan
Gambar 4.5.1 (a) Daun terserang bercak daun, (b) Daun tidak terserang bercak daun
Infeksi jamur biasanya terjadi dalam 12 jam ketika permukaan daun menjadi
lembab. Semakin lama kondisi daun lembab dan basah maka akan semakin besar
serangan bercak daun (Hagan, 2005). Pada serangan bercak daun, hawar daun, dan
berbagai jenis penyakit lainnya yang menyebabkan kerusakan jaringan daun atau
defoliasi, maka proses fotosintesis akan menurun, karena areal permukaan fotosintesis
pada tumbuhan menjadi berkurang. Kandungan klorofil daun akan menurun pada
serangan beberapa jamur, tetapi aktifitas fotosintesis tidak terganggu (Agrios, 1996).
melemah secara menyeluruh sehingga terjadi pengguguran daun (defoliasi), bahkan
bercak daun dapat mengurangi produksi buah hingga50%.
Dari hasil uji antagonis in vitro didapatkan hasil bahwa isolat bakteri kitinolik
yang paling mampu menghambat pertumbuhan Curvularia sp. adalah isolat bakteri
Bacillus sp.BK13 dan Enterobacter sp. BK15. Sebagai perlakuan adalah benih yang
telah direndam suspensi bakteri kitinolitik Bacillus sp. BK13 dan Enterobacter sp.
BK15, kemudian ditanam pada tanah steril yang telah diberi suspensi Curvularia sp..
Persentase bercak daun, tinggi tanaman, dan jumlah daun diamati dari minggu ke-0
minggu ke-4. Pada kontrol (+) yaitu benih yang tidak direndam suspensi bakteri
kitinolitik dan ditanam pada media tanam yang telah diberi suspensi Curvularia sp..
Tanaman mentimun rentan terkena serangan bercak daun, hal ini terlihat dari
perlakuan kontrol (+) yang terkena serangan bercak daun lebih dari setengah tanaman
yang tumbuh.
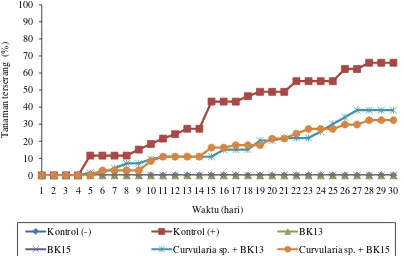
Benih mulai mengalami bercak pada daun kecambah pada hari ke-5 dan terus
meningkat jumlahnya hingga hari ke-30. Persentase bercak daun tertinggi yaitu pada
kontrol (+) mencapai 66,02% dari total kecambah yang tumbuh, sedangkan kontrol (-)
tidak terserang bercak daun. Perlakuan benih yang direndam dengan suspensi bakteri
kitinolitik lalu ditanam pada media tanam yang telah diberi suspensi Curvularia sp.
persentase serangan bercak daun yaitu untuk Bacillus sp. BK13 38,2% dari total
kecambah yang tumbuh, sedangkan untuk Enterobacter sp. BK15 persentase serangan
bercak daun 32,34% dari total kecambah yang tumbuh. Dari persentase serangan
bercak daun dapat diketahui bahwa pengurangan persentase bercak daun dengan
perlakuan bakteri kitinolitik Bacillus sp. BK13 ialah 43,75%, sedangkan dengan
perlakuan bakteri Enterobacter sp. BK15 ialah 50% (Gambar 4.5.2). Pada penelitian
Asril (2011), isolat bakteri kitinolitik yang memiliki kemampuan tertinggi dalam
penghambatan serangan rebah kecambah pada benih cabai dengan perlakuan
Enterobacter sp. BK15, yang memiliki kemampuan menurunkan rebah kecambah
Gambar 4.5.2 Persentase bercak daun yang telah diinokulasikan Curvularia sp.
dengan perlakuan bakteri kitinolitik Bacillus sp. BK13 dan Enterobacter sp. BK15
Keterangan:
Kontrol (+): Benih mentimun yang ditanam pada tanah steril yang diberi suspensi
Curvularia sp.
Kontrol (-): Benih mentimun yang ditanam pada tanah steril
Perlakuan : Benih mentimun yang telah direndam pada suspensi bakteri kitinolitik
selama 30 menit lalu ditanam pada tanah steril yang telah diberi
suspensi Curvularia sp.
Kitinase atau β-1,4 homopolimer N-asetilglukosamin, merupakan enzim yang
mendegradasi kitin menjadi monomer-monomernya yaitu N-asetilglukosamin. Enzim
kitinase memutuskan ikatan β-1,4-asetamido-2-deoksi-D-glikosida. Beberapa jenis
bakteri yang dapat menghasilkan enzim kitinase ialah Vibrio parahaemaluticus,
Flavobacteriumindolthecium, Serratia marcencen, Enterobacter liquefaciens, Bacillus
cereus, Klebsiella sp., Micrococcus colpogene. Menurut Oku (1994), peranan kitinase
dalam ketahanan tanaman terhadap serangan patogen melalui dua cara yaitu
menghambat pertumbuhan jamur patogen dengan cara langsung menghidrolisis
dinding sel jamur dan melalui pelepasan elisitor endogen oleh aktivitas kitinase yang 0
Kontrol (-) Kontrol (+) BK13
memicu ketahanan sistemik pada inang. Menurut Graham (1994), aktifitas kitinase
yang umumnya rendah pada jaringan tanaman sehat dapat diinduksi, sehingga
aktifitasnya menjadi tinggi dengan adanya infeksi jamur patogen.
Parameter yang diukur selama pengamatan 30 hari adalah adalah tinggi
tanaman dan jumlah daun. Pada pengamatan tinggi tanaman tidak terlihat perbedaan
rata-rata tinggi tanaman antara masing-masing perlakuan. Hal ini dikarenakan
penyakit bercak daun tidak memilikipengaruh yang besar terhadap pertumbuhan
tanaman. Serangan Curvularia sp. pada daun menyebabkan kerusakan pada jaringan
daun, sehingga luas permukaan fotosintesis daun akan berkurang, sementara pada
jaringan pengangkut tidak terganggu, sehingga tidak terjadi gangguan pertumbuhan
tanaman (Gambar 4.5.3).
Gambar 4.5.3 Perbedaan tinggi tanaman mentimun (a) kontrol (+), (b) kontrol (-), (c) perlakuan Bacillus sp. BK 13, (d) perlakuan Enterobacter
sp. BK 15
Pegukuran tinggi tanaman dilakukan setiap minggu. Tanaman diukur mulai
dari pangkal batang yaitu bagian batang tanaman yang berbatasan dengan tanah
sampai dengan tunas tertinggi pada tanaman. Pada pengamatan minggu ke-4 diperoleh
bahwa rata-rata tinggi tanaman yang tertinggi adalah pada perlakuan bakteri
Enterobacter sp. BK15 dengan rata-rata tinggi tanaman mencapai 46,06 cm,
sedangkan rata-rata tinggi tanaman yang terendah adalah pada kontrol (+) dengan
Gambar 4.5.4 Perbedaan rata-rata tinggi tanaman mentimun yang telah diinokulasiCurvularia sp. dengan perlakua bakteri kitinolitik Bacillus sp. BK13 dan Enterobacter BK15
Parameter jumlah daun dihitung setiap minggu selama empat minggu. Sama
halnya dengan pengamatan tinggi tanaman, pada pengamatan jumlah daun juga tidak
terdapat perbedaan rata jumlah daun hal ini dapat dilihat pada Gambar 4.5.3,
rata-rata jumlah daun pada setiap perlakuan mencapai 6 sampai 7 helai daun pada minggu
ke-4.
Gambar 4.5.5 Perbedaan rata-rata jumlah daun mentimun yang telah diinokulasi Curvularia sp. dengan perlakuan bakteri kitinolitik Bacillus sp. BK 13 dan Enterobacter BK 15
Kontrol (-) Kontrol (+) Curvularia sp. + BK13 Curvularia sp. + BK 15
1
Pertumbuhan apeks dan primodia daun dipengaruhi oleh hasil dari fotosintesis
dan penyebarannya ke seluruh bagian tanaman. Pertumbuhan apeks dan primodia
daun sangat memerlukan hasil asimilat sebagai substrat metabolisme yang
menghasilkan ATP. Serangan Curvularia sp. tidak mempengaruhi perbedaan jumlah
daun pada tanaman mentimun, karena kerusakan pada jaringan daun hanya
mengurangi luas permukaan fotosintesis dan tidak mengganggu proses
fotosintesis.Jumlah daun kotiledon tidak dihitung pada parameter jumlah daun, hal ini
dikarenakan daun kotiledon merupakan daun yang pertama kali tumbuh dan tidak
mengalami perkembangan lebih lanjut atau perubahan morfologi. Daun mentimun
adalah daun yang tumbuh setelah kotiledon. Daun ini mengalami perkembangan dan
perbedaan bentuk dengan daun kotiledon. Daun mentimun terdiri atas helaian daun
(lamina), tangkai daun, dan ibu tulang daun. Lamina mempunyai bangun dasar bulat
atau bagian ginjal dan bagian ujung daun runcing berganda. Pangkal daun berlekuk
dan tepi daun bergerigi ganda. Ukuran daun dewasa dapat mencapai 20 cm berwarna
hijau tua hingga hijau muda, permukaan daun berbulu halus dan berkerut (Imdad &
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang dilakukan diperoleh kesimpulan:
1. Isolat bekateri kitinolitik yang memiliki efektifitas tertinggi dalam menghambat
pertumbuhan Curvularia sp. secara in vitro ialah isolat Bacillus sp. BK13 dan
Enterobacter sp. BK15, sementara isolat dengan efektifitas penghambatan
terendah adalah isolat Enterobacter sp. PB17.
2. Isolat bakteri kitinolitik Bacillus sp. BK13 dan Enterobacter sp. BK15 mampu
menghambat serangan Curvularia sp. penyebab bercak daun mentimun secara in
vivo dengan penurunan serangan bercak daun mencapai 50% untuk Enterobacter
sp. BK15, sedangkan untuk isolat Bacillus sp. BK13 turun hingga 43,75%.
5.2 Saran
Perlu adanya penelitian lanjutan untuk mencari isolat-isolat bakteri lainnya
yang memiliki potensi kitinolitik dan dengan jamur patogen dan tanaman yang lebih
DAFTAR PUSTAKA
Agrios, G. 1996. Ilmu Penyakit Tumbuhan. Yogyakarta: Gajah Mada University Press. hlm: 148-149
Akinbode O, A. 2010. Evaluation of Antifungal Efficacy of Some Plant Extracts on Curvularia Lunata the Causal Organism Of Maize Leaf Spot. African Journal of Environmental Science and Technology4(11): 797-800
Asril M. 2011. Kemampuan Bakteri Tanah dalam Menghambat PertumbuhanGanoderma boninense danFusarium oxysporum SecaraIn Vitro dan Uji Penghambatab Penyakit Layu Fusariumpada Benih Cabai Merah. Skripsi. Medan. USU
Daryani, A. 1995. Uji Kisaran Inang Cendawan Curvularia lunata (Wakker) Boedijn dan Rhizoctonia Solani Kuhn Asal Rumput Bermuda Pada Berbagai Jenis Rumput Padang Golf. Laporan Makalah Khusus. Jurusan Hama dan Penyakit Tumbuhan. IPB. Bogor
Dewi, I. 2008. Isolasi bakteri Dan Uji Aktifitas Kitinase Termofilik Kasar Dari Sumber Air Panas Tinggi Raja, Simalungun Sumatera Utara. Tesis. USU. Medan
El-Katatny MH, Somitsch W, Robra K-H, El-Katatny MS & Gilbitz GM.2000. Production of Chitinase and β 1,3 - glucanase byTrichoderma harzianum for Control of the Phytopathogenic Fungus Sclerotium rolfsii. Food Technol Biotechnol. 38: 173–180.
Emmawati A, Jenie BS & Fawzya Y. 2007. Kombinasi Perendaman Dalam Natrium Hidroksida Dan Aplikasi Kitin Deasetilase Terhadap Kitin Kulit Udang Untuk Menghasilkan Kitosan Dengan Berat Molekul Rendah. Jurnal Teknologi Pertanian3(1) : 12-18
Ferniah R.S, Purwantisari S &Pujiyanto S. 2003. Uji Potensi Bakteri Kitinolitik Sebagai Pengendali Hayati Patogen Kapang Penyebab Penyakit Tanaman
Kentang (Solanum tuberosum). Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Diponegoro. Semarang
Gandjar I, Samson R. A, Karin V. A, Oetari & Iman S. 1999. Pengenalan Kapang Tropik Umum. Jakarta: Yayasan Obor Indonesia. hlm: 50-52
Graham LS & MB Sticlen. 1994. Plant Chitinases. Can. J. Bot. 72: 1057-1083.
Hagan A. 2005. Leaf Spot and Rust Diseases of Turfgrasses. Alabama A & Auburn Universities ARN 621
Hasanuddin. 2003. Peningkatan Peranan Mikroorganisme Dalam Sistem Pengendalian Penyakit Tumbuhan Secara Terpadu. Jurusan Hama dan Penyakit Tumbuhan. Fakultas Pertanian Universitas Sumatera Utara. Medan
Herdyastuti N, Raharjo, J.T, Mudasir & Matsjeh S. 2009. Kitinase dan Mikroorganisme Kitinolitik: Isolasi, Karakterisasi dan Manfaatnya. Indo. J. Chem. 9(1): 37-38.
Herrera A, Estrella & Chet Ilan. 1999. Chitinases in Biological Control. Chitin and Chitinases 171-181
Huang J, Zheng L &Hsiang T. 2005. First Report of Leaf Spot Caused by Curvularia verruculosa on Cynodonsp. in Hubei, China. Plant Pathology 54, 253
Imdad HP, Nawangsih AA. 2001. Sayuran Jepang. Ed ke-3. Jakarta: Penebar Swadaya
Julisaniah N, Sulistyowati L & Sugiharto A. 2008. Analisis Kekerabatan Mentimun (Cucumis sativus L.)menggunakan Metode RAPD-PCR dan Isozim. Biodiversitas9(2): 99-102
Lorito MG, Harman E, Hayes CK, Broadway RM, Tronsmo SL, Woo & Di Pietro A. 1992. Chitinolytic Enzymes Produced by Trichoderma harzianum: Antifungal Activity or Purified Endochitinase and Chitobiosidase. Phytopathol. 83:302-307.
Moore E & Landecker. 1996. Fundamentals of the Fungi. New Jersey: Prentice Hall International, inc. hlm: 213-214
Muharni. 2009. Isolasi dan Identifikasi Bakteri penghasil Kitinase dari Sumber Air Panas Danau Ranau Sumatera selatan. Jurnal Penelitian Sains. Edisi Khusus : 73-78
& Widjajanti H. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfir Tanaman Karet.Jurnal Penelitian Sains14 (1): 51-56
Nurhasanah & Sundari. 2011. Isolasi dan Identifikasi Kapang-Kapang Kontaminan Dari Biji Kenari Kering (Canarium ovatum). Ekologi Ternate 295-300
Oku H. 1994. Plant pathogenesis and disease control. London : Lewis Pulb.
Asian Agricultural Symposium and international symposium on agricultural technology. Faculty of Agricultural Technology. King Mongkut’s Institute of Technology Ladkrabang. Thailand
Pimentel D, et al. 2005. Peritonitis Due to Curvularia inaequalis in an Elderly PatientUndergoing Peritoneal Dialysis and a Review of Six Casesof Peritonitis Associated with Other Curvularia spp.. J. OF Clinical Microbiol. 43 (8): 4289
Prabowo D. 2009. Survei Hama dan Penyakit pada Pertanaman Mentimun (Cucumis semangunsativus Linn.) di Desa Ciherang, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat. Skripsi. Bogor. IPB
Prasetyaningrum A, Rokhati N, & Purwintasari S. 2007. Optimasi Derajat Deasetilasi Pada Proses Pembuatan Chitosan Dan Pengaruhnya Sebagai Pengawet Pangan. Riptek. 1 (1): 39-46
Qureshi S, Wani A, & Beg S. 2006. Curvularia Dermatomycosis In A Jersey Heifer: A Case Report. Pakistan Vet. J.26(3): 149-150.
Rajarathanam S, Shashrieka & Bano Z. 1998. Biodegradative and Biosynthetic Capacities of Mushrooms. Present and Future Strategies. Crit. Rev. Biotech. 18: 23 – 91.
Rahayu S, FM Suhartati, E.A Rimhawauto & N. Iriyanti. 2003. Isolasi dan Identifikasi Bakteri Kitinolitik Asal Rumen. Fakultas Peternakan Universitas Jenderal Soedirman. Purwookerto
Rubatzky V.E & Yamaguchi M. 1999. Sayuran Dunia: Prinsip, Produksi, dan Gizi Jilid Ketiga. Diterjemahkan oleh Catur Herison. Bandung: ITB.
Semangun H. 1996. Pengantar Ilmu Penyakit Tumbuhan. Cetakan pertama. Yogyakarta: Gadjah mada University Press. hlm: 109& 160
H. 2007. Penyakit-Penyakit Tanaman Hortikultira di Indonesia. Cetakan keenam. Yogyakarta: Gadjah mada University Press. hlm 227 & 656
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Edisi Pertama. Jakarta : PT Raja Gravindo Persada. hlm: 340.
Sumpena U. 2006. Pengaruh Dosis Pupuk Fosfor Terhadap Kualitas dan Kuantitas Benih Enam Kultivar Mentimun (Cucumis sativus L.). Bandung. Balai Penelitian Tanaman Sayuran Lembang.
. 2001. Selection and Characterization of Bacterial Isolates for Monocyclic Aromatic Degradation. Disertasi. Bogor: IPB.
, Munir E. & Yurnaliza. 2006. Eksplorasi Bakteri Kitinolitik: Keragaman
Genetik Gen Penyandi Kitinase Pada Berbagai Jenis Bakteri. Repository. Medan. USU Repository.
& Munir E. 2006. Potensi Pemanfaatan Isolat Kitinolitik Lokal Untuk Pengendalian Hayati Jamur. Prosiding Seminar Hasil-hasil Penelitian. Medan. FMIPA USU.
, Irawati N & Munir E. 2011.Isolation and Characterization of Chitinolytic Bacteria and Their Potential to Inhibit Plant Pathogenic Fungi. Microbiology Indonesia5(2) : 144 148
, Patonah S & Munir E. 2010. Control of Fusarium Wilt of Chili With Chitinolytic Bacteria. Hayati Journal of Biosciences17 (1) : 5-8.
Wang S, Wu J, Rao P, Ng TB, Ye X. 2005. A chitinase with antifungal activity from the mung bean. Protein Expr Pufif40: 230-236.
Wijaya, S. 2002. Isolasi Kitinase dari Scleroderma Columnare dan Thricoderma Harzianum. Jurnal Ilmu Dasar F. MIPA Universitas Jember. 3: 30-35
LAMPIRAN 1
Isolasi Curvularia sp.
Dipotong jaringan pada bagian daun yang terserang bercak daun
Didesinfeksi dengan larutan NaClO 2% Dicuci dengan air steril sebanyak 3 kali Ditumbuhkan pada media PDA
Diinkubasi selama 2 hari
Dibuat biakan murni Curvularia sp. Diamati
Uji Antagonis Isolat Bakteri Kitinolitik Terhadap Curvularia sp.
Diinokulasi di tengah media MGMK + 2% yeast pada jarak 3,5 cm dari cakram tempat inokulum bakteri.
Diinokulasi sebanyak 10 μl suspensi bakteri 108
Diletakkan kertas cakram yang berdiameter 0,6 cm di bagian pinggir media
sel/ ml pada kertas cakram
Dibuat 2 kali pengulangan Diinkubasi pada suhu 28-30o
LAMPIRAN 2
Pengamatan Struktur Hifa Abnormal
Diambil bagian hifa Curvularia sp. pada zona hambat Diamati struktur hifa abnormal di bawah mikroskop Dibandingkan dengan struktur hifa normal
Uji Potensi Serangan Curvularia sp.
Diambil sebanyak 120 ml
Dicampur dengan 600 g campuran tanah dan
kompos steril (3:1) dalam nampan plastik, tanah dan kompos steril (3:1) yang tidak dicampurkan suspensi Curvularia sp. dijadikan sebagai kontrol
Ditanam 30 buah benih mentimun dalam tiap nampan (3 nampan perlakuan dan 1 nampan kontrol)
Ditutup dengan plastik
Diamati tanaman yang terserang penyakit bercak daun selama 30 hari
Reisolasi bagian daun yang terserang bercak pada media PDA
Suspensi biakanCurvulari
Hasil
Uji invitro antagonisme
LAMPIRAN 3
Penghambatan Serangan Curvularia sp. pada Benih Mentimun
Diambil sebanyak 120 ml
Dicampur dengan 600 gram campuran tanah dan kompos steril (3:1) di dalam nampan plastik
Direndam benih mentimun selama 30 menit pada suspensi bakteri kitinolitik, benih yang direndam pada aquadest steril dijadikan sebagai kontrol (-)
Ditutup dengan plastik
Diamati tanaman yang terserang bercak daun selama 30 hari
Penyiapan Media Tanam
Disaring
Dimasukkan kedalam plastik tahan panas
Disterilkan dengan menggunakan autoklaf pada suhu 121oC selama 15 menit
Suspensi BiakanCurvularia sp.
Hasil
Tanah + Kompos 3:1
Lampiran 4
Data tanaman yang terserang bercak daun
Perlakuan Hari Ke-
12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Kontrol (-) 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Kontrol (+) 6 6 6 10 10 10 11 12 12 12 13 13 13 13 15 15 16 16 16
BK 13 2 2 2 2 3 3 3 5 5 5 5 5 6 7 8 9 9 9 9
BK 15 2 2 2 4 4 4 4 4 5 5 6 6 6 6 7 7 8 8 8
Data Persentase Tanaman Yang Terserang Bercak Daun
Perlakuan Hari Ke-
12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Kontrol (-) 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
LAMPIRAN 5
Uji invivo penghambatan bakteri kitinolitik terhadap Curvularia sp. pada benih
mentimun
(a) Kontrol (+), (b) Kontrol (-), (c) Perlakuan Bacillus sp BK13., (d)
LAMPIRAN 6
Isolat bakteri kitinolitik