TEDY KURNIAWAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
oleh HENNY PURWANINGSIH dan KOMAR SUTRIAH.
Penggunaan adsorben ekonomis telah dipelajari sebagai alternatif pengganti
arang aktif untuk menjerap limbah zat warna. Penelitian ini memanfaatkan limbah
padat tapioka, kaolin, bentonit, campuran limbah padat tapioka-kaolin dan limbah
padat tapioka-bentonit sebagai adsorben zat warna biru cibacron. Adsorben
terlebih dahulu diaktivasi dengan asam dan basa. Arang aktif komersial digunakan
sebagai pembanding. Adsorpsi dilakukan dengan ragam waktu adsorpsi dan bobot
adsorben. Dari semua ragam yang dilakukan, diperoleh adsorben yang terbaik
yaitu limbah padat tapioka teraktivasi asam. Kondisi optimum adsorpsi adsorben
limbah padat tapioka aktivasi asam adalah pada waktu 75 menit dan bobot
adsorben 1 g dengan penurunan konsentrasi dari 50 mg/L menjadi 11.12 mg/L,
sedangkan untuk adsorben arang aktif diperoleh kondisi optimum pada waktu 30
menit dan bobot adsorben 0.5 g dengan penurunan konsentrasi dari 50 mg/L
menjadi 19.44 mg/L. Dalam pengujian larutan tunggal biru cibacron, kapasitas
adsorpsi untuk limbah padat tapioka teraktivasi asam dan arang aktif
berturut-turut sebesar 1.94 mg/g dan 3.05 mg/g dengan efisiensi berberturut-turut-berturut-turut sebesar
77.75% dan 61.11%. Adsorben limbah padat tapioka aktivasi asam menunjukkan
model isoterm Freundlich.
ABSTRACT
TEDY KURNIAWAN. Tapioka Solid Waste Based Adsorbent. Supervised by
HENNY PURWANINGSIH and KOMAR SUTRIAH.
TEDY KURNIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Menyetujui
Pembimbing I,
Henny Purwaningsih, S.Si, M.Si.
NIP 19741201 200501 2 001
Pembimbing II,
Drs. Komar Sutriah, M.S.
NIP 19630705 199103 1 004
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
PRAKATA
Segala puji senantiasa penulis panjatkan kepada Allah SWT karena atas
rahmat, hidayah, dan ridho-Nya penulis dapat menyelesaikan karya ilmiah ini.
Shalawat serta salam selalu penulis curahkan kepada Nabi Muhammad saw,
keluarga, sahabat, serta pengikutnya hingga akhir zaman. Karya ilmiah ini disusun
berdasarkan penelitian yang dilaksanakan pada bulan April sampai November
2010 di Laboratorium Kimia Fisik, Departemen Kimia FMIPA IPB. Karya ilmiah
yang berjudul Adsorben Berbasis Limbah Padat Tapioka ini merupakan salah satu
syarat untuk memperoleh gelar sarjana sains pada Departemen Kimia FMIPA
IPB.
Penulis mengucapkan terima kasih kepada Ibu Henny Purwaningsih, S.Si,
M.Si. selaku pembimbing pertama, dan Bapak Drs. Komar Sutriah, M.S. selaku
pembimbing kedua yang telah memberikan arahan, saran, dan dorongan selama
pelaksanaan penelitian dan penulisan karya ilmiah ini. Ungkapan terima kasih
penulis berikan kepada keluarga tercinta, Bapak, Ibu, Nenek dan adik-adikku
(Adetya Mustofa dan M. Tri Amhari) yang selalu memberikan semangat, doa, dan
kasih sayang. Terima kasih juga kepada Bapak Nano, Ibu Ai, Bapak Ismail,
Bapak Sobur atas fasilitas dan bantuan yang diberikan selama penelitian. Ucapan
terima kasih juga disampaikan kepada Risal, Chandra, Nafiul, Anna, Wida, dan
teman-teman kimia 43 yang turut membantu, memberikan semangat dan
dukungannya dalam penyusunan karya ilmiah.
Semoga karya ilmiah ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, April 2011
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Limbah Padat Tapioka ...
1
Kaolin ...
2
Bentonit ...
3
Adsorpsi...
3
Isoterm Adsorpsi ...
3
Zat Warna ...
4
BAHAN DAN METODE
Bahan dan Alat...
4
Lingkup Kerja ...
5
HASIL DAN PEMBAHASAN
Aktivasi Limbah Padat Tapioka, Kaolin, dan Bentonit ...
6
Adsorpsi Biru Cibacron ...
7
Penentuan Nisbah Optimum Adsorben ...
7
Penentuan Waktu Optimum Adsorpsi ...
8
Penentuan Bobot Optimum Adsoben ...
8
Optimalisasi Adsorpsi Biru Cibacron pada AA ...
9
Perbandingan Adsorbsi Biru Cibacron pada Adsorben LPTA dan AA
9
Isoterm Adsorpsi ...
10
SIMPULAN DAN SARAN
Simpulan ...
12
Saran ...
12
DAFTAR PUSTAKA ...
12
DAFTAR TABEL
Halaman
1 Komposisi kimia limbah padat tapioka ...
2
2 Modifikasi contoh adsorben ...
5
3 Kapasitas adsorpsi dan efisiensi adsorpsi adsorben LPTA dan AA ...
10
4 Nilai konstanta n dan k dari persamaan Freundlich ...
11
5 Nilai konstanta
α
dan
β
dari persamaan Langmuir ...
11
DAFTAR GAMBAR
Halaman
1 Limbah padat tapioka ...
2
2 Serbuk kaolin ...
2
3 Struktur kaolin ...
2
4 Struktur bentonit ...
3
5 Struktur biru cibacron...
4
6 Skema interaksi proton dengan struktur kaolin ...
6
7 Skema interaksi proton dengan struktur bentonit ...
7
8 Penentuan nisbah optimum adsorpsi biru cibacron...
7
9 Perbandingan perlakuan adsorben limbah padat tapioka ...
7
10 Waktu optimum adsorpsi biru cibacron oleh LPTA ...
8
11 Bobot optimum adsorpsi biru cibacron oleh LPTA ...
8
12 Waktu optimum adsorpsi biru cibacron oleh AA ...
9
13 Bobot optimum adsorpsi biru cibacron oleh AA ...
9
14 Kapasitas adsorpsi dan efisiensi adsorpsi LPTA dan AA ...
10
15 Isoterm Freundlich adsorpsi biru cibacron oleh LPTA ...
10
16 Isoterm Langmuir adsorpsi biru cibacron oleh LPTA ...
10
17 Isoterm Freundlich adsorpsi biru cibacron oleh AA ...
11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ...
16
2 Data konsentrasi dan absorbans larutan biru cibacron pada pembuatan
kurva standar...
17
3 Data optimasi perlakuan adsorben terhadap biru cibacron 50 mg/L ...
18
4 Data optimasi waktu adsorpsi biru cibacron 50 mg/L...
20
5 Data optimasi bobot adsorben adsorpsi biru cibacron 50 mg/L ...
21
6 Data optimasi waktu adsorpsi biru cibacron 50 mg/L oleh arang aktif ...
22
7 Data optimasi bobot arang aktif terhadap biru cibacron 50 mg/L ...
23
8 Data isoterm Freundlich dan Langmuir untuk adorpsi biru cibacron ...
24
PENDAHULUAN
Kegiatan industri telah menjadi bagian yang tak terpisahkan dari kehidupan. Selain berdampak positif bagi manusia, kegiatan ini juga memberikan dampak negatif berupa kerusakan lingkungan akibat pengelolaan limbah yang tidak baik (Suwarsa 1998, Zubieta et al. 2007, Hartati et al. 2008). Limbah merupakan masalah utama dalam pengendalian dampak lingkungan industri. Salah satu jenis polutan yang terdapat dalam hampir semua limbah yang berasal dari industri, terutama industri tekstil dan makanan adalah zat warna. Sebagian besar zat warna tekstil merupakan zat warna sintetik.
Zat warna sintetik adalah salah satu jenis polutan yang termasuk limbah B3 sehingga limbah yang dihasilkannya berbahaya bagi kesehatan manusia. Tidak seperti zat warna alami, zat warna sintetik sulit dihilangkan menggunakan metode fisikokimia dan biologi konvensional (Bulutet al.2007, Pekkuzet al.
2007). Dalam proses pewarnaan tekstil sekitar 10-15% zat warna reaktif terbawa dalam aliran sungai (Dizge 2007). Hal ini menimbulkan masalah lingkungan perairan seperti mengganggu ekosistem perairan, memperlambat aktivitas fotosintesis, dan menghambat pertumbuhan biota perairan dengan menghalangi masuknya sinar matahari ke dalam air.
Proses adsorpsi merupakan metode yang paling efisien untuk pengelolaan limbah zat warna (Chou et al. 2000). Metode lainnya dalam pengelolaan limbah zat warna terdiri atas oksidasi-ozonisasi, flokulasi-koagulasi, dan penggunaan membran (Pekkuz et al.
2007). Metode-motode tersebut mempunyai kelebihan dan kekurangan, di antaranya pembentukan lumpur yang berlebihan dan penggunaanya yang kurang efisien.
Adsorben yang paling efisien dalam pengelolaan limbah zat warna adalah karbon aktif. Karbon aktif merupakan adsorben yang cukup mahal sehingga saat ini pembuatan adsorben difokuskan kepada pembuatan adsorben yang relatif murah yang bersumber dari produk samping pertanian seperti jerami dan kulit padi (Suwarsa 1998, Chou et al. 2000, Verma dan Mishra 2010), ampas teh (Retnowati 2005), tongkol jagung (Fahrizal 2008, Suryani 2009), serbuk gergaji (Pekkuz
et al.2007), dan ampas tebu (Raghuvanshiet al. 2004, Azhar et al. 2005, Karnitz et al.
2006, Gurgelet al.2008, Diapati 2009). Penelitian ini menggunakan limbah padat tapioka sebagai bahan baku untuk pembuatan
adsorben. Limbah padat tapioka mempunyai potensi menjadi adsorben karena mengandung bahan polisakarida yang cukup tinggi sehingga dapat dijadikan adsorben untuk menjerap zat warna. Ketersediaan limbah padat tapioka terus meningkat sejalan dengan meningkatnya produksi tapioka. Limbah padat tapioka diketahui sebagai bahan sumber energi yang memiliki kadar protein kasar rendah, tetapi kaya akan karbohidrat. Oleh karena itu, limbah padat tapioka dapat digunakan sebagai pakan ternak. Beberapa penelitian tentang pemanfaatan limbah padat tapioka telah dilakukan (Tjiptadi 1985, Rinaldy 1987, Ali 2008, dan Widiarto et al.
2008). Victoria (2010) mengadsorpsi zat warna biru metilena dengan campuran adsorben limbah padat tapioka-kaolin memperoleh kapasitas adsorpsi dan efisiensi adsorpsi yang baik dibandingkan dengan arang aktif. Hal ini menunjukkan bahwa campuran limbah padat tapioka-kaolin berpotensi sebagai adsorben.
Selain limbah hasil pertanian, kaolin dan bentonit dilaporkan dapat digunakan sebagai bahan baku pembuatan adsorben. Kaolin dan bentonit merupakan contoh adsorben yang termasuk jenis aluminasilikat. Ghosh dan Bhattacharyya (2002) dan Nandiet al.(2008) menunjukkan penggunaan kaolin dapat digunakan sebagai adsorben zat warna, sedangkan Lianet al.(2008) serta Benguella dan Yacouta-Nour (2008) menunjukkan bahwa bentonit dapat digunakan sebagai adsorben zat warna.
Penelitian ini bertujuan memanfaatkan campuran limbah padat tapioka-kaolin dan limbah padat tapioka-bentonit sebagai adsorben zat warna reaktif biru cibacron dengan aktivasi asam maupun basa. Kondisi optimum adsorpsi yang meliputi waktu adsorpsi dan nisbah bobot adsorben terhadap zat warna biru cibacron, serta isoterm adsorpsi dari adsorben tersebut ditentukan.
TINJAUAN PUSTAKA
Limbah Padat Tapioka
yang dapat mencapai 65,9% (Widiarto et al.
2008). Berdasarkan kandungan ini, limbah padat tapioka mempunyai potensi yang besar untuk dimanfaatkan sebagai sumber selulosa maupun untuk menghasilkan produk turunannya.
Gambar 1 Limbah padat tapioka.
Komponen penting yang terdapat dalam limbah padat tapioka adalah pati dan serat kasar. Komposisi kimia limbah padat tapioka sangat bervariasi tergantung pada mutu bahan baku, efisiensi proses ekstraksi pati dan penanganan limbah padat tapioka itu sendiri (Tjiptadi 1985). Komposisi kimia limbah padat tapioka berbeda untuk setiap daerah asal dan jenis ubi kayu, serta teknologi yang digunakan dan penanganan limbah padatnya. Komposisi kimia limbah padat tapioka dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia limbah padat tapioka
Komposisi Kadar (%)
Air 12.7
Abu 9.1
Serat Kasar 8.1
Protein 2.5
Lemak 1.0
Karbohidrat 65.9
Sumber : Rinaldy (1987)
Kaolin
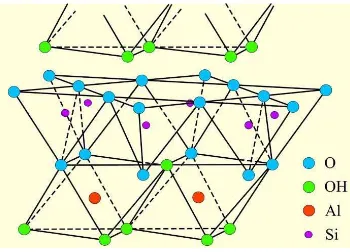
Kaolin dengan formula
Al2O3.2SiO2.2H2O, merupakan masa batuan
yang tersusun dari material lempung dengan kandungan besi yang rendah, dan umumnya berwarna putih atau agak keputihan (Gambar 2). Kelompok mineral kaolin meliputi kaolinit, nakrit, dikit, dan haloisit. Kaolinit, nakrit, dan dikit mempunyai komposisi kimia yang ideal, yaitu Al2Si205(OH)4.
Kaolinit, nakrit, dan dikit dibedakan oleh susunan lapisan 1:1. Pengertian lapisan 1:1 adalah untuk setiap satuan mineral terdiri atas satu lapisan oksida-Si (lapisan silikat) dan
satu lapisan hidroksioksida-Al (lapisan aluminat).
Gambar 2 Serbuk kaolin.
Satuan-satuan ini berikatan kuat sesamanya dengan ikatan hidrogen dan Van der Waals. Hal ini mengakibatkan kation atau anion dan molekul air tidak dapat masuk ke lapisan silikat maupun aluminat sehingga efektivitas penjerapannya terbatas hanya di permukaan saja. Sifat penukar kation atau anion hanya berasal dari bagian ujung mineral yang mengalami pemutusan (Muhdarina dan Linggawati 2003).
Dalam kelompok mineral kaolin, kaolinit ditemukan dalam jumlah yang paling banyak. Komposisi kimia dari kaolinit, yaitu SiO2
46.54%, Al2O3 39.50%, dan H2O 13.96%
(Sarapaa dan Al-Ani 2008). Molekul air dalam struktur kristal kaolinit dapat ditemukan pada ruang antarlapisannya. Struktur kaolin disajikan pada Gambar 3.
Gambar 3 Struktur kaolin.
Bentonit
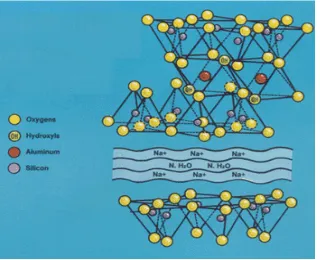
Bentonit adalah istilah yang digunakan di dalam dunia perdagangan untuk sejenis tanah lempung yang secara alami mempunyai kemampuan mengembang sampai 15 kali volume keringnya jika menyerap air. Mineral bentonit memiliki diameter kurang dari 2 µ m yang terdiri dari berbagai macam mineral filosilikat yang mengandung silika, alumunium oksida, dan hidroksida yang dapat mengikat air. Bentonit memiliki struktur tiga lapisan yang terdiri dari dua lapisan silika tetrahedron dan satu lapisan sentral octahedral (Syuhadaet al.2008).
Gambar 4 Struktur bentonit.
Bentonit dapat diklasifikasikan menjadi dua kelompok, yaitu natrium bentonit dan kalsium bentonit. Bentonit mengandung 85% montmorilonit yang mempunyai rumus kimia Al2O3.4SiO2xH2O, yaitu senyawa silikat
dalam alumina yang mengandung air terikat secara kimia. Molekul air dalam struktur kristal bentonit dapat ditemukan pada ruang antarlapisannya. Kandungan lain dalam bentonit merupakan pengotor dari beberapa jenis mineral seperti kwarsa, ilit, kalsit, mika,dan klorit. Struktur bentonit ditunjukkan pada Gambar 4.
Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan (Atkins 1999). Adsorpsi terjadi karena adanya gaya tarik menarik antar molekul adsorbat dengan tempat-tempat aktif di permukaan adsorben. Adsorbat adalah substansi yang terjerap atau substansi yang akan dipisahkan dari pelarutnya, sedangkan adsorben adalah merupakan suatu media penjerap. Menurut Reynolds yang diacu dalam Wijaya (2008), proses adsorpsi dapat
digambarkan sebagai proses saat molekul meninggalkan larutan dan menempel pada permukaan zat adsorben.
Mekanisme penjerapan tersebut dapat dibedakan menjadi dua yaitu, adsorpsi secara fisika (fisisorpsi) dan adsorpsi secara kimia (kimisorpsi). Pada proses fisisorpsi, gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya Van der Waals, sedangkan pada proses adsorpsi kimia terjadi interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia (Sukarta 2008). Kimisorpsi terjadi diawali dengan adsorpsi secara fisika (fisisorpsi), yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya Van der Waals atau melalui ikatan hidrogen, kemudian diikuti oleh adsorpsi kimia yang terjadi setelah adsorpsi fisika. Pada adsorpsi kimia, partikel yang melekat pada permukaan akan membentuk ikatan kimia (Atkins 1999).
Faktor-faktor yang mempengaruhi adsorpsi, yaitu sifat fisika dan kimia adsorben seperti luas permukaan, pori-pori, dan komposisi kimia. Selanjutnya juga dipengaruhi oleh sifat fisika dan kimia adsorbat seperti ukuran molekul, polaritas molekul, dan komposisi kimia, konsentrasi adsorbat dalam fase cair, sifat fase cair, serta lamanya proses adsorpsi tersebut berlangsung. Semakin kecil ukuran partikel, maka semakin besar luas permukaan padatan persatuan volume tertentu sehingga akan semakin banyak zat yang diadsorpsi (Atkins 1999). Adsorben yang baik memiliki kapasitas adsorpsi dan persentase efisiensi penjerapan yang tinggi.
Isoterm Adsorpsi
Isoterm adsorpsi merupakan fungsi konsentrasi zat terlarut yang terjerap pada padatan terhadap konsentrasi larutan. Tipe isoterm adsorpsi dapat digunakan untuk mempelajari mekanisme adsorpsi. Adsorpsi fase cair-padat pada umumnya mengikuti tipe isoterm Freundlich dan Langmuir (Atkins 1999).
Isoterm Adsorpsi Langmuir
ikatan kimia biasanya bersifat spesifik, sehingga permukaan adsorben dapat mengikat adsorbat dengan ikatan kimia. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi sebagai berikut :
c c m x 1
Kostantaαdanβ dapat ditemukan dari kurva hubungan
m x
c
/
terhadap c dengan
persamaan :
c
m
x
c
1
1
/
Keterangan:x/m = massa adsorbat yang teradsorpsi per gram adsorben
c = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm) α,β = konstanta empiris
Isoterm Adsorpsi Freundlich
Isoterm Freundlich merupakan proses adsorpsi yang terjadi secara fisisorpsi banyak lapisan. Fisisorpsi adalah adsorpsi yang hanya melibatkan gaya intermolekul dan ikatannya lemah. Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan monolayer dari molekul-molekul adsorbat pada permukaan adsorben. Pada adsorpsi Freundlich situs-situs aktif pada permukaan adsorben bersifat heterogen.
Menurut Atkins (1999), pada proses adsorpsi zat terlarut pada permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan bentuk persamaan :
n kc m
x 1/
Apabila dilogaritmakan, persamaan isoterm Freundlich dapat dituliskan sebagai berikut :
c n k m x log 1 log
log
Keterangan:
x/m = massa adsorbat yang teradsorpsi per gram adsorben
c = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k,n = konstanta empiris
Zat Warna
Zat warna tekstil merupakan senyawa organik yang keberadaannya dapat menggangu ekosistem perairan. Limbah cair yang berwarna ini akan diproses terlebih dahulu sampai konsentrasinya cukup aman jika berada di perairan.
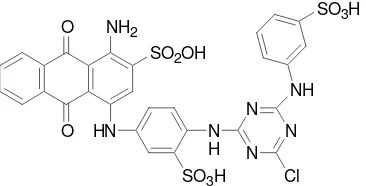
Biru cibacron merupakan salah satu jenis zat warna reaktif yang digunakan dalam industri tekstil. Zat warna ini memiliki sifat tidak berbau, berwujud padat pada suhu kamar, yaitu berupa serbuk berwarna biru kehitaman yang berwarna biru ketika dilarutkan dalam air, memiliki pH 6-7, dan kelarutan dalam air 1000 g/L. Biru cibacron dengan rumus molekul C30H24ClN7O10S3
termasuk zat warna bifungsional yang mengandung dua gugus reaktif, yaitu monoklorotriazin dan vinil sulfona. Struktur biru cibacron ditunjukkan pada Gambar 5.
O O
SO2OH
NH2
HN
SO3H
N H N N N Cl NH
SO3H
Gambar 5 Struktur biru cibacron.
BAHAN DAN METODE
Bahan dan Alat
Lingkup Kerja
Penelitian terdiri atas beberapa tahap. Tahap pertama adalah preparasi limbah padat tapioka, kaolin dan bentonit. Tahap kedua adalah aktivasi limbah padat tapioka, kaolin dan bentonit. Tahap ketiga adalah pembuatan campuran limbah padat tapioka-kaolin dan limbah padat tapioka-bentonit. Tahap keempat adalah optimasi waktu kontak dan bobot adsorben pada adsorpsi biru cibacron. Tahap kelima adalah penentuan jenis isoterm adsorpsi biru cibacron oleh adsorben terbaik. Diagram alir penelitian dapat dilihat pada lampiran 1
Metode
Preparasi Sampel
Semua sampel (limbah padat tapioka, kaolin, dan bentonit) dicuci dengan air suling lalu dikeringkan pada suhu 105 °C selama 3 jam dalam oven, kemudian dihancurkan dan diayak sehingga berukuran 200 mesh (Arikan et al.2009).
Aktivasi Limbah Padat Tapioka
Limbah padat tapioka yang telah dicuci diaktivasi dengan asam dan basa. Aktivasi dengan asam dilakukan dengan memasukkan limbah padat tapioka ke dalam labu Erlenmeyer dan ditambahkan sebanyak 50 mL H3PO4 30%. Campuran tersebut dipanaskan
sambil diaduk selama 6 jam, kemudian disaring dengan vakum. Limbah padat tapioka yang telah diaktivasi tersebut dicuci beberapa kali dengan air suling untuk mengeluarkan asam, setelah itu dikeringkan pada suhu 40 ºC selama 24 jam.
Aktivasi limbah padat tapioka dengan basa dilakukan dengan cara memasukkan limbah padat tapioka ke dalam labu Erlenmeyer dan ditambahkan NaOH 0.1 N. Campuran tersebut dipanaskan sambil diaduk selama 6 jam, kemudian disaring dengan vakum. Limbah padat tapioka yang telah diaktivasi tersebut dicuci beberapa kali dengan air suling untuk mengeluarkan basa, setelah itu dikeringkan pada suhu 40 ºC selama 24 jam.
Aktivasi Kaolin dan Bentonit
Kaolin ditimbang sebanyak 10 g ke dalam labu bulat dan ditambahkan sebanyak 250 ml larutan H2SO4 30%. Campuran tersebut
dipanaskan sambil diaduk dengan pengaduk magnet dan dipanaskan pada suhu 90-100 °C selama 6 jam, kemudian didinginkan dan
disaring dengan vakum. Kaolin lalu dicuci beberapa kali dengan air suling untuk mengeluarkan asam, dan keberadaan ion SO4
2-dideteksi menggunakan larutan BaCl2. Kaolin
yang telah dicuci tersebut dikeringkan pada suhu 105 °C selama 3 jam. Contoh kaolin kemudian disimpan dalam desikator untuk pemakaian selanjutnya. Aktivasi bentonit merujuk pada metode aktivasi kaolin yang dilaporkan Koyuncuet al.(2007).
Pembuatan Adsorben Limbah Padat
Tapioka-Kaolin dan Limbah Padat
Tapioka-Bentonit (Victoria 2009)
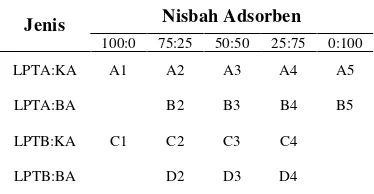
Limbah padat tapioka yang telah diaktivasi dicampur hingga merata dengan kaolin dan bentonit yang juga telah diaktivasi (Tabel 2). Komposisi campuran adsorben yaitu 25:75, 50:50, 75:25, dan 100:0. Setelah itu, adsorben diberi nama sebagai berikut, limbah padat tapioka aktivasi asam dan kaolin aktivasi asam (LPTA,KA), limbah padat tapioka aktivasi asam dan bentonit aktivasi asam (LPTA,BA), limbah padat tapioka basa dan kaolin aktivasi asam (LPTB,KA), limbah padat tapioka basa dan bentonit aktivasi asam (LPTB,BA).
Tabel 2 Modifikasi contoh adsorben
Adsorpsi Zat Warna
Pembuatan Larutan Zat Warna
Larutan stok zat warna 1000 mg/L dibuat dengan melarutkan 1000 mg serbuk biru cibacron dalam air suling dan diencerkan hingga 1 liter. Setelah itu dibuat kurva standar dari larutan hasil pengenceran larutan stok ini dengan konsentrasi 5, 10, 20, 30, 40, dan 50 mg/L (Lampiran 2).
Penentuan Panjang Gelombang Maksimum Panjang gelombang maksimum diukur dengan spektrofotometer spectronic 20 D+ pada rentang panjang gelombang 600-700 nm dengan larutan biru cibacron 5 mg/L.
Jenis Nisbah Adsorben
100:0 75:25 50:50 25:75 0:100
LPTA:KA A1 A2 A3 A4 A5
LPTA:BA B2 B3 B4 B5
LPTB:KA C1 C2 C3 C4
Penentuan Nisbah Optimum Adsorben Adsorben dengan nisbah tertentu ditimbang sebanyak 1.0 g dan dimasukkan ke dalam labu Erlenmeyer yang berisi 50 mL larutan biru cibacron 50 mg/L. Campuran dipanaskan sambil diaduk selama 30 menit. Setelah itu disaring dan diambil filtratnya, kemudian diukur dengan spektrofotometer spectronic 20D+ pada panjang gelombang maksimum.
Penentuan Waktu Optimum Adsorpsi Sebanyak 1 g adsorben dimasukkan ke dalam 50 mL larutan biru cibacron 50 mg/L, kemudian larutan dipanaskan sambil diaduk dengan alat gojok. Adsorpsi dilakukan dengan variasi waktu adsorpsi 15, 30, 45, 60, dan 75 menit. Campuran disaring dan absorbansi filtrat diukur pada panjang gelombang maksimum. Waktu optimum ditentukan dengan menghitung efisiensi dan kapasitas adsorpsi maksimum.
Penentuan Bobot Optimum Adsorben Variasi bobot adsorben yang digunakan adalah 0.5, 1.0, 1.5, 2.0, dan 2.5 g. Masing-masing dimasukkan ke dalam 50 mL larutan biru cibacron 50 mg/L, kemudian dipanaskan sambil diaduk selama waktu optimum. Campuran disaring dan absorbansi filtrat diukur pada panjang gelombang maksimum. Setelah itu, dihitung efisiensi dan kapasitas adsorpsi maksimum.
Penentuan Isoterm Adsorpsi (Modifikasi Victoria 2009)
Labu Erlenmeyer yang berisi 1.0 g adsorben dengan nisbah optimum ditambah dengan 50 mL zat warna pada berbagai konsentrasi, yaitu 20, 40, 60, 80, dan 100 mg/L, lalu dipanaskan sambil diaduk selama 75 menit. Setelah itu, disaring dan diambil filtratnya untuk diukur dengan spektrofotometer spectronic 20D+ pada panjang gelombang 617 nm. Persamaan regresi linier menggunakan persamaan Langmuir dan Freundlich dibuat untuk menentukan jenis isoterm yang sesuai.
Penentuan Waktu Optimum dan Bobot Optimum Adsorben Arang Aktif
Metode penentuan waktu optimum adsorpsi dan bobot optimum adsorben arang aktif dilakukan dengan merujuk pada metode penentuan waktu optimum adsorpsi dan bobot optimum adsorben.
Penentuan Isoterm Adsorpsi Arang Aktif Metode penentuan isoterm adsorpsi arang aktif dilakukan dengan merujuk pada metode penentuan isoterm adsorpsi adsorben.
HASIL DAN PEMBAHASAN
Aktivasi limbah padat tapioka, kaolin, dan bentonit
Penelitian ini menggabungkan limbah padat tapioka, kaolin, dan bentonit yang kemudian digunakan sebagai adsorben untuk zat warna biru cibacron. Limbah padat tapioka, kaolin, dan bentonit yang digunakan terlebih dahulu dicuci dengan aquades agar permukaan adsorben bersih dari bahan-bahan pengotor. Masing-masing diaktivasi sebelum dicampur menjadi homogen. Aktivasi limbah padat tapioka dengan H3PO430% dan NaOH
0,1 N bertujuan menghilangkan senyawa-senyawa selain polisakarida yang larut dalam asam dan basa, agar tidak ikut berperan dalam mekanisme adsorpsi zat warna. Dengan demikian kemampuan untuk menjerap adsorbat zat warna akan lebih maksimal. Aktivasi kaolin menggunakan H2SO4 30%
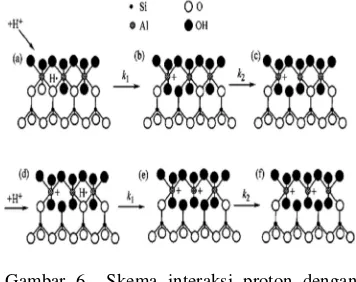
bertujuan melarutkan komponen-komponen seperti Fe2O3, Al2O3, CaO, dan MgO yang
mengisi ruang antarlapisan kaolin, sehingga menambah luas permukaan adsorben. Ion-ion Ca2+ dan Mg2+ yang berada pada permukaan kristal adsorben secara berangsur-angsur diganti oleh ion H+ dari H2SO4. Gambar
aktivasi H2SO4 terlihat pada Gambar 6 dan
Gambar 7. Diharapkan pergantian ini dapat meningkatkan kapasitas adsorpsi dan efisiensi adsorpsi.
Gambar 7 Skema interaksi proton dengan struktur bentonit.
Begitu juga halnya dalam aktivasi bentonit. Asam sulfat (H2SO430%) digunakan
untuk aktivasi bentonit, karena asam sulfat memiliki bilangan ekivalen H+ lebih tinggi dibanding asam klorida maupun asam nitrat. Dengan demikian, dapat menggantikan kation logam seperti Na+, Ca2+, dan Mg2+ dalam struktur bentonit.
Adsorpsi biru cibacron
Penjerapan zat warna oleh limbah padat tapioka berlangsung melalui interaksi antara gugus HO-polisakarida dalam limbah padat tapioka dan gugus-gugus tertentu pada zat warna tekstil. Interaksi antara limbah padat tapioka yang banyak mengandung polisakarida (HO-polisakarida) dengan zat warna reaktif biru cibacron adalah interaksi secara fisik. Interaksi ini terjadi karena adanya suatu ikatan hydrogen atau Van der Waals dari gugus HO-polisakarida dengan gugus N pada zat warna biru cibacron.
Penentuan nisbah optimum adsorben
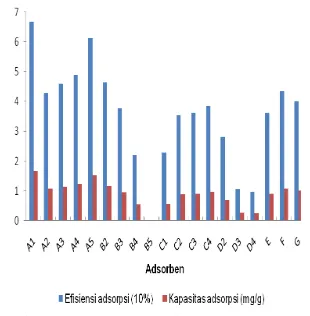
Adsorben yang digunakan pada tahap penentuan nisbah adalah campuran limbah padat tapioka-kaolin dan campuran limbah padat tapioka-bentonit. Adsorben campuran dari limbah padat tapioka, kaolin, dan bentonit dibuat dengan nisbah 25:75, 50:50, 75:25, dan 100:0. Pengaruh perlakuan adsorben dan nisbahnya terhadap kapasitas adsorpsi dan efisiensi adsorpsi dapat dilihat pada Gambar 8.
Hasil penelitian menunjukkan bahwa kapasitas adsorpsi dan efisiensi adsorpsi
terbesar dihasilkan oleh adsorben A1 yang terbuat dari limbah padat tapioka aktivasi asam (LPTA) saja. Pada nisbah optimum tersebut diperoleh kapasitas adsorpsi sebesar 1.66 mg/g dan efisiensi adsorpsi sebesar 66.63%. Data selengkapnya dapat dilihat pada Lampiran 3.
Gambar 8 Penentuan nisbah optimum adsorpsi biru cibacron.
Adsorben lainnya, yaitu limbah padat tapioka aktivasi basa (C1) memperoleh nilai kapasitas adsorpsi dan efisiensi adsorpsi yang jauh lebih rendah dibandingkan limbah padat tapioka aktivasi asam. Adsorben limbah padat tapioka (LPT) yang tidak melalui perlakuan memperoleh nilai kapasitas adsorpsi dan efisiensi adsorpsi yang lebih baik dibandingkan limbah padat tapioka aktivasi basa (LPTB), tetapi lebih rendah dibandingkan dengan limbah padat tapioka aktivasi asam (LPTA). Perbandingan perlakuan adsorben limbah padat tapioka terhadap kapasitas adsorpsi dan efisiensi adsorpsi dapat dilihat pada Gambar 9.
Gambar 9 Perbandingan perlakuan adsorben limbah padat tapioka A1 (LPTA), C1 (LPTB), G (LPT).
7 Ca2+
14+
[Al13O4(OH)24(H2O)12]14+
14 H+
Hasil perbandingan perlakuan adsorben limbah padat tapioka diperoleh nilai kapasitas adsorpsi dan efisiensi adsorpsi LPT awal sebesar 1.00 mg/g dan 40.10%, tetapi setelah mengalami aktivasi asam nilai kapasitas adsorpsi dan efisiensi adsorpsi meningkat menjadi 66.21% dan 66.17%. Hal ini menunjukkan bahwa proses aktivasi asam membantu menghilangkan senyawa-senyawa selain polisakarida yang larut dalam asam. Penurunan nilai kapasitas adsorpsi dan efisiensi adsorpsi terlihat pada limbah padat tapioka aktivasi basa (LPTB), yaitu sebesar 43.39% dan 43.30% yang ditunjukan pada Gambar 9. Hal ini diakibatkan perlakuan basa kurang baik dalam menghilangkan senyawa-senyawa selain polisakarida sehingga kurang mengadsorpsi zat warna reaktif biru cibacron.
Selanjutnya, adsorben limbah padat tapioka aktivasi asam (LPTA) ditentukan kondisi optimum adsorpsinya terhadap zat warna biru cibacron dengan mengukur dua parameter, yaitu waktu adsorpsi dan bobot adsorpsi. Setelah itu, jenis isoterm adsorpsinya ditentukan.
Penentuan waktu optimum adsorpsi
Kapasitas adsorpsi dan efisiensi adsorpsi meningkat dengan bertambah lamanya waktu adsorpsi (Gambar 10). Konsentrasi zat warna biru cibaron yang diadsorpsi sebesar 50 mg/L, dan mengalami penurunan menjadi 11.12 mg/L. Penurunan konsentrasi zat warna biru cibaron sebesar 77.75% ini terjadi pada waktu adsorpsi 75 menit dengan kapasitas adsorpsi 1.94 mg/g. Setelah 75 menit, kapasitas adsorpsi dan efisiensi adsorpsi cenderung tetap. Data selengkapnya dapat dilihat pada Lampiran 4.
Gambar 10 Waktu optimum adsorpsi biru cibacron oleh limbah padat tapioka aktivasi asam (LPTA).
Hal ini menunjukkan bahwa adsorben telah jenuh oleh zat warna biru cibacron. Jika proses dilanjutkan, maka kemungkinan tidak ada lagi zat warna yang diadsorpsi oleh adsorben, sampai akhirnya terjadi pelepasan kembali atau desorpsi.
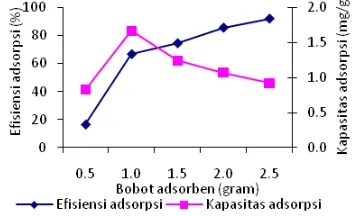
Penentuan bobot optimum adsorben
Penentuan bobot optimum adsorben dilakukan dengan meragamkan konsentrasi biru cibacron. Waktu adsorpsi yang digunakan merupakan waktu adsorpsi maksimum. Pengukuran dilakukan pada panjang gelombang maksimum adsorpsi yaitu 617 nm. Bobot adsorben berpengaruh terhadap kapasitas adsorpsi dan efisiensi adsorpsi zat warna biru cibacron dengan konsentrasi 50 mg/L (Gambar 11).
Gambar 11 Bobot optimum adsorpsi biru cibacron oleh limbah padat tapioka aktivasi asam (LPTA).
peningkatan bobot adsorben akan menurunkan kapasitas adsorpsi dan meningkatkan efisiensi adsorpsi.
Data hasil penelitian menunjukkan efisiensi adsorpsi biru cibacron meningkat dari 16.50% sampai 91.90% dengan variasi bobot dari 0.5 g sampai 2.5 g. Sebaliknya, kapasitas adsorpsi dengan bobot adsorben 1.0 g sebesar 1.66 mg/g turun menjadi 0.91 mg/g dengan bobot adsorben 2.5 g. Pada saat bobot 1.0 g hampir seluruh permukaan adsorben telah terikat dengan adsorbat, sedangkan pada bobot 2.5 g masih banyak sisi aktif yang belum berikatan dengan adsorbat.
Optimasi adsorpsi biru cibacron pada arang aktif
Waktu adsorpsi
Penentuan waktu adsorpsi arang aktif terhadap larutan biru cibacron dilakukan dengan meragamkan konsentrasi biru cibacron 50 mg/L dan bobot adsorben 1 g. Pengukuran dilakukan pada panjang gelombang maksimum, yaitu 617 nm. Lamanya adsorpsi ditentukan berdasarkan kapasitas adsorpsi dan efisiensi adsorpsi selama rentang waktu tertentu. Pengaruh waktu adsorpsi terhadap kapasitas adsorpsi dan efisiensi adsorpsi biru cibacron oleh arang aktif dapat dilihat pada Gambar 12.
Hasil penelitian menunjukkan bahwa konsentrasi zat warna biru cibacron menurun dari 50 mg/L menjadi 19.44 mg/L dalam waktu 30 menit. Waktu optimum adsorpsi adalah 30 menit, karena pada saat itu terjadi kapasitas adsorpsi 3.05 mg/g. Sebanyak 1 g adsorben mampu mengadsorpsi 3.05 mg zat warna biru cibacron dengan efisiensi 61.11%. Setelah melewati waktu 30 menit terjadi penurunan kapasitas adsorpsi dan efisiensi adsorpsi.
Gambar 12 Waktu optimum adsorpsi biru cibacron oleh arang aktif.
Hal ini sesuai dengan hasil penelitian Raghuvanshi et al. (2004) yang menyatakan bahwa efisiensi penjerapan berbanding lurus dengan waktu sampai pada titik tertentu, kemudian mengalami penurunan setelah melewati titik tersebut. Kapasitas adsorpsi dan efisiensi adsorpsi pada waktu 45, 60, dan 75 menit mengalami penurunan kembali karena telah melewati waktu optimumnya, hal dimungkinkan ada sejumlah zat warna yang terlepas kembali (desorpsi) akibat proses pemanasan sambil diaduk. Data selengkapnya tertera pada Lampiran 6.
Bobot adsorben
Bobot adsorben berpengaruh terhadap kapasitas adsorpsi dan efisiensi adsorpsi zat warna biru cibacron dengan konsentrasi 50 mg/L, dapat dilihat pada Gambar 13.
Gambar 13 Bobot optimum adsorpsi biru cibacron oleh arang aktif.
Perbandingan adsorpsi biru cibacron oleh adsorben limbah padat tapioka aktivasi
asam dan arang aktif
Perbandingan antara adsorben limbah padat tapioka asam (LPTA) dan adsorben arang aktif dilakukan pada konsentrasi zat warna biru cibacron sebesar 50 mg/L. Tabel 3 menunjukkan hasil kapasitas adsorpsi dan efisiensi adsorpsi yang tertinggi pada limbah padat tapioka aktivasi asam (LPTA) sebesar 1.94 mg/g dan 77.75%. Adsorben arang aktif diperoleh kapasitas adsorpsi dan efisiensi adsorpsi sebesar 3.05 mg/g dan 61.11%.
Tabel 3 Kapasitas adsorpsi dan efisiensi adsorpsi biru cibacron antara adsorben LPTA dan AA
Gambar 14 menunjukkan bahwa kapasitas adsorpsi arang aktif memperoleh kapasitas adsorpsi 36.34% lebih besar dalam adsorpsi zat warna biru cibacron 50 mg/L. Persen efisiensi adsorpsi arang aktif 21.39% lebih rendah dari limbah padat tapioka aktivasi asam (LPTA). Hasil ini memperlihatkan potensi limbah padat tapioka yang diaktivasi oleh asam sebagai adsorben alternatif dalam mengadsorpsi zat warna reaktif. Hal ini menambah informasi penelitian sebelumnya yang menggunakan campuran 25% limbah padat tapioka aktivasi asam-75% kaolin aktivasi dalam mengadsorpsi zat warna biru metilena yang dilakukan oleh Victoria (2010).
Gambar 14 Kapasitas adsorpsi dan efisiensi adsorpsi limbah padat tapioka aktivasi asam dan arang aktif.
Isoterm Adsorpsi
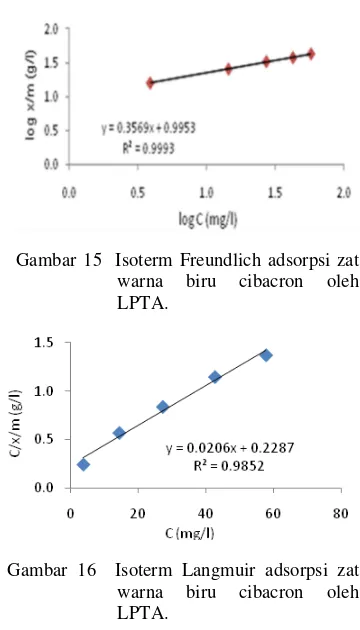
Tipe isoterm adsorpsi dapat digunakan untuk mengetahui mekanisme penjerapan zat warna biru cibacron dengan adsorben limbah padat tapioka aktivasi asam. Isoterm adsorpsi Langmuir dilakukan dengan cara membuat kurva hubungan c/(x/m) terhadap c, sedangkan isoterm adsorpsi Freundlich dilakukan dengan membuat kurva hubungan log (x/m) terhadap log c. Isoterm adsorpsi zat warna biru cibacron dapat dilihat pada Gambar 15 dan Gambar 16.
Berdasarkan gambar yang berasal dari pengolahan data pada Lampiran 8, adsorpsi biru cibacron oleh adsorben limbah padat tapioka aktivasi asam memberikan linieritas yang cukup tinggi untuk kedua tipe isoterm, yaitu sebesar 99.90% untuk isoterm Freundlich (Gambar 15) dan 98.50% untuk isoterm Langmuir (Gambar 16). Berdasarkan data tersebut dapat disimpulkan bahwa proses adsorpsi biru cibacron oleh adsorben limbah padat tapioka aktivasi asam mengikuti tipe isoterm Freundlich, karena nilai linieritas untuk tipe isoterm ini lebih besar.
Gambar 15 Isoterm Freundlich adsorpsi zat warna biru cibacron oleh LPTA.
Gambar 16 Isoterm Langmuir adsorpsi zat warna biru cibacron oleh LPTA.
Isoterm Freundlich hanya melibatkan gaya Van der Waals sehingga ikatan antara
Adsorben Waktu Bobot EP Q
(menit) (gram) (%) (mg/g)
LPTA 75 1.0012 77.7500 1.9435
adsorbat dengan adsorben bersifat lemah. Hal ini memungkinkan adsorbat bebas bergerak hingga akhirnya berlangsung proses adsorpsi banyak lapisan. Sama halnya dengan adsorben limbah padat tapioka aktivasi asam, isoterm adsorpsi biru cibacron oleh arang aktif juga mengikuti tipe isoterm Freundlich. Gambar 17 dan Gambar 18 yang berasal dari pengolahan data pada Lampiran 9 menunjukkan bahwa isoterm adsorpsi biru cibacron oleh arang aktif memiliki linieritas yang cukup tinggi untuk kedua tipe isoterm, yaitu 79.9% untuk isoterm Langmuir dan 94.7% untuk isoterm Freundlich. Walaupun keduanya memiliki linieritas yang cukup tinggi, proses adsorpsi lebih dominan mengikuti tipe isoterm Freundlich. Hal ini menunjukkan bahwa pada adsorpsi biru cibacron oleh arang aktif diperkirakan membentuk banyak lapisan sebagaimana adsorben limbah padat tapioka aktivasi asam.
Gambar 17 Isoterm Freundlich adsorpsi zat warna biru cibacron oleh AA.
Gambar 18 Isoterm Langmuir adsorpsi zat warna biru cibacron oleh AA.
Nilai konstanta n, k, α, dan β dapat dihitung dari persamaan regresi Freundlich dan Langmuir untuk zat warna biru cibacron dapat dilihat pada Tabel 4 dan 5. Nilai n dan k pada isoterm Freundlich tergantung dengan suhu, adsorben, dan unsur-unsur yang dijerap. Nilai n menggambarkan intensitas dari adsorpsi.
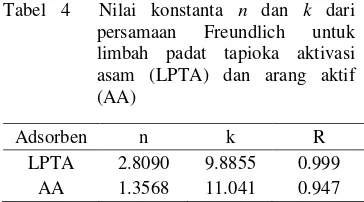
Tabel 4 Nilai konstanta n dan k dari persamaan Freundlich untuk limbah padat tapioka aktivasi asam (LPTA) dan arang aktif (AA)
Nilai n dari adsorben LPTA lebih besar daripada adsorben AA, artinya adsorpsi lebih baik saat menggunakan adsorben dari LPTA. Sedangkan nilai k menunjukkan kapasitas adsorpsi dari adsorben, terlihat berdasarkan tabel 4 nilai k AA lebih besar daripada LPTA. Artinya, kapasitas adsorben AA untuk menjerap biru cibacron lebih baik daripada adsorben LPTA.
Tabel 5 Nilai konstanta α dan β dari persamaan Langmuir untuk limbah padat tapioka aktivasi asam (LPTA) dan arang aktif (AA)
Nilai α menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada permukaan adsorben. Nilai β merupakankonstanta yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben.
Berdasarkan data penelitian sebelumnya yaitu Victoria (2010) yang menggunakan campuran limbah padat tapioka dan kaolin sebagai bahan dasar pembuatan adsorben memberikan hasil yang baik untuk penjerapan zat warna biru metilena. Namun dalam penelitian ini memberikan hasil yang kurang baik untuk campuran limbah padat tapioka-kaolin dan limbah padat tapioka-bentonit. Pada penelitian ini hanya adsorben dari limbah padat tapioka saja yang memberikan hasil yang baik dalam penjerapan zat warna biru cibacron. Adsorben berbasis polisakarida ini setelah diaktifkan oleh asam dapat berinteraksi lebih baik dengan sisi reaktif zat warna biru cibacron, dibandingkan dengan penambahan kaolin maupun bentonit. Pola interaksi setelah penambahan kaolin menurunkan kapasitas adsorpsi dan efisiensi adsorpsi. Sisi aktif dari kaolin maupun
Adsorben n k R
LPTA 2.8090 9.8855 0.999
AA 1.3568 11.041 0.947
Adsorben α β R
LPTA 4.3860 11.4000 0.985
bentonit tidak lebih banyak dibandingkan dengan sisi aktif limbah padat tapioka. Hal ini menunjukkan bahwa campuran limbah padat kaolin dan limbah padat tapioka-bentonit kurang baik digunakan sebagai mengadsorpsi zat warna reaktif seperti biru cibacron.
SIMPULAN DAN SARAN
Simpulan
Limbah padat tapioka dapat digunakan sebagai adsorben zat warna reaktif biru cibacron. Kapasitas adsorpsi dan efisiensi adsorpsi larutan tunggal zat warna reaktif biru cibacron diperoleh kondisi optimum adsorpi zat warna biru cibacron pada waktu 75menit dengan bobot 1 g. Isoterm adsorpsi limbah padat tapioka aktivasi asam, dan arang aktif, yaitu tipe isoterm Freundlich.
Saran
Perlu dilakukan penetapan entalpi adsorpsi untuk menyempurnakan mekanisme adsorpsi zat warna, dengan parameter ragam waktu kontak dan bobot adsorben optimum.
DAFTAR PUSTAKA
Ali U. 2008. Pengaruh penggunaan onggok dan isi rumen sapi komplit dalam pakan komplit terhadap penampilan kambing peranakan etawah. [skripsi]. Malang: Jurusan Nutrisi dan Makanan Ternak, Fakultas Peternakan, Universitas Islam Malang.
Arikan M, Sobolev K, Ertun T, Yeginobali A, Turker P. 2009. Properties of blended cements with thermally activated kaolin.
Construction and Building Materials
23:62–70.
Atkins PW. 1999. Kimia Fisik Jilid 1.
Kartohadiprojo I, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari:
Physical chemistry.
Azhar SS, Liew AG, Suhardy D, Hafiz KF, Hatim MD. 2005. Dye removal from aqueous solution by using adsorption on
treated sugarcane bagasse.Am J Appl Sci
11:1499-1503.
Benguella B dan A. Yacouta-Nour. 2008. Adsorption of bezanyl red and nylomine green from aqueous solutions by natural and acid-activated bentonite. Desalination
235:276–292.
Bulut E, Ozacar M, Sengil IA. 2007. Equilibrium and kinetic data and process design for adsorption of Congo Red onto bentonite. J Hazard Mat154:613-622.
Chou KS, Tsai JC, Lo CT. 2000. The adsorption of congo red and vacuum pump oil by rice hull ash.Biores Technol
78:217-219.
Diapati M. 2009. Ampas tebu sebagai adsorben zat warna reaktif cibarcon red. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengtahuan Alam, Institut Pertanian Bogor.
Dizge N, Aydiner C, Demirbas E, Kobya M, Kara S. 2007. Adsorption of reactive dyes from aqueous solutions by fly ash: kinetic and equilibrium studies. J Hazard Mat 150:737–746.
Fahrizal. 2008. Pemanfaatan tongkol jagung sebagai biosorben zat warna biru metilena [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengtahuan Alam, Institut Pertanian Bogor.
Faruqi FA, Okuda S, Williamson WO.1967. Chemisorption of methylene blue by kaolinite.Clay Minerals7(19).
Ghosh D, Bhattacharyya KG. 2002. Adsorption of methylene blue on kaolinite.App Clay Sci20:295-300.
Gurgel LVA, Rossimiriam Pereira de Freitas dan Laurent Frédéric Gil. 2008. Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by sugarcane bagasse and mercerized sugarcane bagasse chemically modified with succinic anhydride. Carbohydr Polym74: 922-929.
(Moringa oleifera) dan PAC (poly alumunium chloride). [makalah ilmiah]. Bandung: Jurusan Teknik Lingkungan, Institut Teknologi Nasional.
Karnitz O, Vinicius L, Cesar J, Botaro VR, Sacramento TM, Pereira R, Frederic R. 2006. Adsorption of heavy metal ion from aqueous single metal solution by chemically modified sugarcane bagasse.
Bioresource Technology 98:1291–1297. Koyuncu H, Kul AR, Yildiz N, Calimli A,
Ceylan H. 2007. Equilibrium and kinetic studies for the sorption of 3-methoxybenzaldehyde on activated kaolinites. Hazardous Materials 14:128-139.
Muhdarina, Linggawati A. 2003. Pilarisasi kaolinit alam untuk meningkatkan kapasitas tukar kation. Jurnal Natur Indonesia 6: 20-23
Nandi BK, Goswani A, Purkait MK. 2008. Adsorption characteristics of brilliant green dye on kaolin. J Hazard Mat
161:387-395.
Pekkuz H, Uzun I, dan Guzel F. 2007. Kinetics and thermodynamics of the adsorption of some dyestuffs from aqueous solution by poplar sawdust.
Bioresource Technology 99:2009–2017. Raghuvanshi SP, Singh R, Kaushik CP.
2004.Kinetics study of methylene blue dye bioadsorption on bagasse. Appl Ecol Environ Res2: 35-43.
Retnowati. 2005. Efektivitas ampas teh sebagai adsorben alternatif limbah cair industri tekstil. [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
Rinaldy W. 1987. Pemanfaatan onggok singkong (Manihot esculenta Crantz) sebagai bahan pembuatan etanol. [tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
Sarapaa O, Al-Ani T. 2008. Clay and Clay Mineralogy. Finland: GTK Espoo.
Sukarta N I. 2008. Adsorpsi ion Cr3+ oleh serbuk gergaji kayu albizia (Albizia falcata) : studi pengembangan bahan
alternatif penjerap limbah logam berat [tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
Suryani AM. 2009. Pemanfaatan tongkol jagung untuk pembuatan arang aktif sebagai adsorben pemurnian minyak goreng bekas. [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
Suwarsa S. 1998. Penyerapan zat warna tekstil BR Red HE 7B oleh jerami padi. JMS
3:32-40.
Syuhada, Wijaya R, Jayatin, Rohman S. 2008. Modifikasi bentonit (clay) menjadi organoclay dengan penambahan surfaktan. Nanosains dan Nanoteknologi 2: 1-4.
Tjiptadi W. 1985. Telaah kualitas dan kuantitas limbah industri tapioka serta cara pengendalian di daerah bogor dan sekitarnya [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Verma VK dan AK Mishra. 2010. Kinetic and isotherm modeling of adsorption of dyes onto rice husk carbon. Global NEST Journal10:1-7.
Victoria. 2009. Adsorpsi asam lemak bebas dan zat warna menggunakan campuran kaolin-limbah padat tapioka. [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
Widiarto S, Suka IG, Simanjuntak W. 2008. Pembuatan polimer peka lingkungan dengan polimerisasi grafing campuran n-isopropilakrilamida dan asam metakrilat (binary monomer) pada selulosa yang diekstraksi dari onggok. Prosiding Seminar Nasional Sains dan Teknologi-II; Lampung, 17-18 November 2008. Lampung: Jurusan Kimia FMIPA Universitas Lampung. hlm. 328-341.
Lampiran 1 Diagram alir penelitian
Limbah padat tapioka
Dicuci dengan aquades
Rendam dengan aquades
(90 menit dengan pergantian air 30 menit sekali)
Dikeringkan 40
0C-24 jam
Aktivasi asam
(asam fosfat 30%, 6 jam)
Aktivasi basa
(NaOH 0.1 N, 6 jam)
Kaolin teraktivasi
Bentonit teraktivasi
Kaolin teraktivasi
Bentonit teraktivasi
Nisbah 100:0; 75:25; 50:50; 25:75; dan 100:0
Penentuan
λmaksPenentuan nisbah optimum
Penentuan bobot dan waktu optimum adsorpsi
Lampiran 2 Konsentrasi dan absorbans larutan biru cibacon pada pembuatan kurva standar (Panjang gelombang maksimum 617 nm)
[biru cibacron] Absorbans (ppm)
5 0.0515
10 0.0746
20 0.1414
30 0.2175
40 0.2839
Lampiran 3 Data optimasi perlakuan adsorben terhadap biru cibacron 50 mg/L
Keterangan :
EP : Efisiensi adsorpsi
Q : Kapasitas adsorpsi
LPTA,KA : Campuran limbah padat tapioka asam dan kaolin aktivasi LPTA,BA : Campuran limbah padat tapioka asam dan bentonit aktivasi LPTB,KA : Campuran limbah padat tapioka basa dan kaolin aktivasi LPTB,BA : Campuran limbah padat tapioka basa dan bentonit aktivasi
K : Kaolin
B : Bentonit
LPT : Limbah padat tapioka
1 : Adsorben dengan nisbah 100:0
Adsorben Rasio Bobot A [biru cibacron] [biru cibacron] EP EP rata-rata Q Q rata-rata
(gram) (ppm) rerata (%) (%) (mg/g) (mg/g)
LPTA,KA A 1 1,0002 0,1090 16.5000 16.6833 67.0000 66.6333 1.6747 1.6655
1,0002 0,1112 16.8667 66.2667 1.6563
2 1.0008 0.1804 28.4000 28.6167 43.2000 42.7667 1.0791 1.0684
1.0007 0.1830 28.8333 42.3333 1.0576
3 1.0009 0.1726 27.1000 26.9917 45.8000 46.0167 1.1440 1.1495
1.0007 0.1713 26.8833 46.2333 1.1550
4 1.0009 0.1624 25.4000 25.5000 49.2000 49.0000 1.2289 1.2235
1.0015 0.1636 25.6000 48.8000 1.2182
5 1.0004 0.1249 19.1500 19.4417 61.7000 61.1167 1.5419 1.5270
1.0008 0.1284 19.7333 60.5333 1.5121
LPTA,BA B 2 1.0013 0.1687 26.4500 26.7550 47.1000 46.4500 1.1760 1.1596
1.0015 0.1726 27.1000 45.8000 1.1433
3 1.0012 0.1979 31.3167 31.2000 37.3667 37.6000 0.9330 0.9392
1.0005 0.1965 31.0833 37.8333 0.9454
4 1.0013 0.2441 39.0167 39.0167 21.9667 21.9667 0.5485 0.5484
1.0014 0.2441 39.0167 21.9667 0.5484
5 1.0005 0.3151 50.8500 51.3000 0.0000 0.0000 0.0000 0.0000
1.0002 0.3205 51.7500 0.0000 0.0000
LPTB,KA C 1 1.0030 0.2410 38.5000 38.6333 23.0000 22.7333 0.5733 0.5672
1.0010 0.2426 38.7667 22.4667 0.5611
2 1.0005 0.2020 32.0000 32.3500 36.0000 35.3000 0.8996 0.8821
1.0003 0.2062 32.7000 34.6000 0.8647
3 1.0007 0.2020 32.0000 31.8833 36.0000 36.2333 0.8994 0.9053
1.0004 0.2006 31.7667 36.4667 0.9113
4 1.0003 0.1938 30.6333 30.7417 38.7333 38.5167 0.9680 0.9625
1.0005 0.1951 30.8500 38.3000 0.9570
LPTB,BA D 2 1.0101 0.2247 35.7833 35.9083 28.4333 28.1833 0.7037 0.6994
1.0046 0.2262 36.0333 27.9333 0.6951
3 1.0008 0.2773 44.5500 44.6917 10.9000 10.6167 0.2723 0.2651
1.0015 0.2790 44.8333 10.3333 0.2579
4 1.0032 0.2790 44.8333 45.1083 10.3333 9.7833 0.2575 0.2440
1.0011 0.2823 45.3833 9.2333 0.2306
K 1.0002 0.2006 31.7667 31.8833 36.4667 36.2333 0.9115 0.9057
1.0001 0.2020 32.0000 36.0000 0.8999
B 1.0009 0.1804 28.4000 28.2917 43.2000 43.4167 1.0790 1.0841
1.0015 0.1791 28.1833 43.6333 1.0892
LPT 1.0002 0.1897 29.9500 29.9500 40.1000 40.1000 1.0023 1.0020
Lanjutan lampiran 3 Data optimasi perlakuan adsorben terhadap biru cibacron 50 mg/L
Lampiran 4 Data optimasi waktu adsorpsi biru cibacron 50 mg/L
Adsorben Waktu Bobot A [biru cibacron] [biru cibacron] EP EP rata-rata Q Q rata-rata
(menit) (gram) (ppm) rerata (%) (%) (mg/g) (mg/g)
Ab 15 1.0001 0.1844 29.0667 28.9500 41.8667 42.1000 1.0466 1.0522
1.0004 0.1830 28.8333 42.3333 1.0579
30 1.0004 0.1366 21.1000 21.2000 57.8000 57.6000 1.4444 1.4391
1.0008 0.1378 21.3000 57.4000 1.4339
45 1.0004 0.1045 15.7500 15.8417 68.5000 68.3167 1.7118 1.7071
1.0006 0.1056 15.9333 68.1333 1.7023
60 1.0002 0.0958 14.3000 14.2083 71.4000 71.5833 1.7846 1.7890
1.0004 0.0947 14.1167 71.7667 1.7934
75 1.0002 0.0778 11.3000 11.1250 77.4000 77.7500 1.9346 1.9435
1.0001 0.0757 10.9500 78.1000 1.9523
150 1.0006 0.0778 11.3000 11.1250 77.4000 77.7500 1.9338 1.9430
Lampiran 5 Data optimasi bobot adsorben terhadap biru cibacron 50 mg/L
Contoh perhitungan :
EP rata-rata = 16.2667 + 16.7333 = 16.5000 % 2
Q rata-rata = 0.8125 + 0.8360 = 0.8243 mg/g 2
Keterangan :
EP = efisiensi adsorpsi biru cibacron (%) Q = kapasitas adsorpsi biru cibacron (mg/g)
Adsorben Bobot A [biru cibacron] [biru cibacron] EP EP rata-rata Q Q rata-rata
(gram) (ppm) rerata (%) (%) (mg/g) (mg/g)
LPTA Aa 0.5005 0.2612 41.8667 41.7500 16.2667 16.5000 0.8125 0.8243
0.5004 0.2598 41.6333 16.7333 0.8360
Ab 1,0002 0,1090 16.5000 16.6833 67.0000 66.6333 1.6747 1.6655
1,0002 0,1112 16.8667 66.2667 1.6563
Ac 1.5003 0.0883 13.0500 12.7833 73.9000 74.4333 1.2314 1.2403
1.5004 0.0851 12.5167 74.9667 1.2491
Ad 2.0008 0.0535 7.2500 7.2500 85.5000 85.5000 1.0683 1.0685
2.0002 0.0535 7.2500 85.5000 1.0686
Ae 2.5004 0.0334 3.9000 4.0500 92.2000 91.9000 0.9219 0.9188
2.5006 0.0352 4.2000 91.6000 0.9158
Lampiran 6 Data optimasi waktu adsorpsi biru cibacron 50 mg/L oleh arang aktif
Adsorben Waktu Bobot A [biru cibacron] [biru cibacron] EP EP rata-rata Q Q rata-rata
(menit) (gram) (ppm) rerata (%) (%) (mg/g) (mg/g)
AAa 15 0.5006 0.1512 23.5333 23.6333 52.9333 52.7333 2.6435 2.6340
0.5004 0.1524 23.7333 52.5333 2.6246
30 0.5006 0.1284 19.7333 19.4417 60.5333 61.1167 3.0230 3.0528
0.5004 0.1249 19.1500 61.7000 3.0825
45 0.5003 0.1911 30.1833 30.2917 39.6333 39.4167 1.9805 1.9691
0.5006 0.1924 30.4000 39.2000 1.9577
60 0.5003 0.2189 34.8167 35.0583 30.3667 29.8833 1.5174 1.4925
0.5008 0.2218 35.3000 29.4000 1.4677
75 0.5005 0.2941 47.3500 47.6333 5.3000 4.7333 0.2647 0.2364
Lampiran 7 Data optimasi bobot arang aktif terhadap biru cibacron 50 mg/L
Contoh perhitungan :
EP rata-rata = 44.5000 + 41.4333 = 42.9667 % 2
Q rata-rata = 2.2232 + 2.0692 = 2.1462 mg/g 2
Keterangan :
EP = efisiensi adsorpsi biru cibacron (%) Q = kapasitas adsorpsi biru cibacron (mg/g)
Adsorben Bobot A [biru cibacron] [biru cibacron] EP EP rata-rata Q Q rata-rata
(gram) (ppm) rerata (%) (%) (mg/g) (mg/g)
AAa 0.5004 0.1765 27.7500 28.5167 44.5000 42.9667 2.2232 2.1462
0.5006 0.1857 29.2833 41.4333 2.0692
AAb 1.0002 0.1203 18.3833 18.3833 63.2333 63.2333 1.5805 1.5800
1.0009 0.1203 18.3833 63.2333 1.5794
AAc 1.5007 0.0767 11.1167 11.0333 77.7667 77.9333 1.2955 1.2982
1.5010 0.0757 10.9500 78.1000 1.3008
AAd 2.0001 0.0296 3.2667 3.3417 93.4667 93.3167 1.1683 1.1664
2.0002 0.0305 3.4167 93.1667 1.1645
AAe 2.5008 0.0278 2.9667 2.8750 94.0667 94.2500 0.9404 0.9422
2.5009 0.0267 2.7833 94.4333 0.9440
Lampiran 8 Data isoterm Freundlich dan Langmuir untuk adsorpsi biru cibacron
Persamaan garis isoterm Langmuir yang diperoleh y = 0.020 + 0.228x denganr2= 0.985 maka
dari persamaan C
m x
C
1 1
/
, diperoleh nilaiα= 4.3860 danβ=11.4000
Persamaan garis isoterm Freundlich yang diperoleh y = 0.995 + 0.356x dengan r2= 0.999maka dari persamaan log
m x
= logk+
n
1
log C, diperoleh nilai n = 2.8090 dan k = 9.8855
[biru cibacron] Bobot Langmuir Freundlich
awal adsorben A [biru cibacron]akhir x x/m C/x/m log log
(mg/l) (mg) (mg/l) (mg/l) (mg/g) (g/l) x/m C
20 1.0007 0.0334 3.9000 16.1000 16.0887 0.2424 1.2065 0.5911
40 1.0003 0.0969 14.4833 25.5167 25.50901 0.5678 1.4067 1.1609
60 1.0002 0.1739 27.3167 32.6833 32.6768 0.8360 1.5142 1.4364
80 1.0006 0.2660 42.6667 37.3333 37.31095 1.1435 1.5718 1.6301
Lampiran 9 Data isoterm Freundlich dan Langmuir untuk adsorpsi biru cibacron oleh arang aktif
Persamaan garis isoterm Langmuir yang diperoleh y = 0.007 + 0.856x denganr2= 0.799 maka
dari persamaan C
m x
C
1 1
/
, diperoleh nilaiα= 142.857 danβ= 0.0082
Persamaan garis isoterm Freundlich yang diperoleh y = 0.737x + 0.345 dengan r2= 0.947
maka dari persamaan log
m x
= logk+
n
1
log C, diperoleh nilai n = 1.3568 dan k = 11.041
[Biru cibacron] Bobot Langmuir Freundlich
awal adsorben A [biru cibacron]akhir x x/m C/x/m log log
(mg/l) (mg) (mg/l) (mg/l) (mg/g) (g/l) x/m C
40 0.5003 0.1765 27.7500 12.2500 24.4853 1.1333 1.3889 1.4433
60 0.5005 0.2612 41.8667 18.1333 36.2304 1.1556 1.5591 1.6219
80 0.5003 0.3487 56.4500 23.5500 47.0718 1.1992 1.6728 1.7517
Lampiran 10 Interaksi gugus polisakarida dengan gugus zat warna reaktif biru cibacron
O O
SO2OH NH2
HN
SO3H N H N
N N
Cl NH
SO3H
O O
SO2OH NH2
HN
SO3H N H N
N N
Cl NH
SO3H