IDENTIFIKASI BAKTERI ENTOMOPATOGENIK
TERHADAP WERENG BATANG COKELAT
YOHANA ARTDHI DAHLIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
YOHANA ARTDHI DAHLIANI. Identifikasi dan Ekstraksi Pigmen Bakteri Merah Patogenik terhadap Wereng Batang Cokelat. Dibimbing oleh IMAN RUSMANA dan TRI PUJI PRIYATNO. Wereng Batang Cokelat merupakan salah satu hama tanaman padi yang berbahaya dan sukar dikendalikan. Penemuan bakteri merah yang mampu menginfeksi wbc menjadi hal yang sangat penting, karena wbc dengan tipe mulut pencucuk penghisap sangat jarang terinfeksi oleh bakteri. Penelitian ini dilakukan untuk mengidentifikasi spesies bakteri merah yang patogenik terhadap wbc, serta mengekstraksi pigmen bakteri merah untuk diuji aktivitasnya. Pertama pengisolasian dan peremajaan bakteri, pengujian fenotipe dengan menggunakan kit GN MicroPlateTM Biolog kit, analisis sekuen nukleotida 16S rDNA dengan software BlastN yang terdapat dalam situs NCBI. Analisis filogenetika menggunakan program PHYLIP versi 3.6.Bakteri merah yang diidentifikasi adalah Serratia marcescens. S. marcescens sensitif terhadap streptomisin dengan konsentrasi 25 µg/ml hingga 50 µg/ml. Metabolit sekunder yang dihasilkan bakteri merah adalah prodigiosin dengan konsentrasi 150 µg/ml mampu menekan perkembangan penyakit kresek yang disebabkan oleh Xanthomonas oryzae pv. oryzae sebesar 30 %.
Kata kunci : Bakteri merah, Serratia marcescens, prodigiosin.
ABSTRACT
YOHANA ARTDHI DAHLIANI. Identification and extraction of Red Pigment of pathogenic bacteria to Stem Brown planthopper (wbc). Superviced by IMAN RUSMANA and TRI PUJI PRIYATNO.
Brown Planthopper Bar (BPH) is a dangerous and rebelliousness pests of rice. Discovery of red bacteria that can infect bph becomes very important, because the bph, as the piercing and sucking type insect mouth, was rarely infected by bacteria. This study was conducted to identify the bph red pathogenic bacteria, and to determine production and inhibition activity of red pigment. Bacterial phenotypes was perfomed using GN Microplate TM Biolog kit. Nukleotide sequence aligment of 16S rDNA was analyed with BlastN of the NCBI website. Phylogenetic Tree was contructed by PHYLIP version 3.6 program. The red bacterium was identified as Serratia marcescens . S. marcescens was sensitive to streptomycin with concentration of 25µg/ml and 50 µg/ml. Red pigment produced by S. marcescens was determined as prodigiosin. Prodigiosin in concentration of 150µg/ml able to suppress up to 30% the development a bacterial leaf blight caused by Xanthomonas oryzae pv. oryzae.
YOHANA ARTDHI DAHLIANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Yohana Artdhi Dahliani
NIM
: G34070084
Menyetujui:
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.S
NIP 196410021989031002
Tanggal Lulus:
Pembimbing I,
Dr. Ir. Iman Rusmana, M.Si
NIP 1965072019911031002
Pembimbing II,
dan karuniaNya sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema yang dipilih dalam penelitian ini adalah mengenai pigmen bakteri merah yang dihasilkan oleh bakteri Serratia marcescens dengan judul Identifikasi Bakteri Entomopatogenik terhadap Wereng Batang Cokelat yang dilaksanakan mulai bulan Desember 2010 hingga April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si. dan Bapak Dr. Tri Puji Priyatno selaku pembimbing atas arahan dan bimbingan yang diberikan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih yang sebesar-besarnya kepada Keluarga tercinta ayah, ibu, adik, Leonard Simbolon dan Keluarga Besar atas do’a, dukungan, dan kasih sayang yang diberikan. Terima kasih juga kepada Pak Made, Pak Yadi, Bu Alina, Bu Ntin, Pak Wawan,Bu Uum Kak Pipit, Kak Delly, Novia, Resti, Keluarga Besar Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, serta sahabat sahabat Rani, Ivan, Vita, Tira, Fitri, Nita, dan teman-teman seperjuangan di Biologi 44 atas semua kebersamaan dan motivasi yang telah diberikan.
Semoga karya ilmiah ini dapat bermanfaat
Bogor, 4 Juli 2011
Sarbani dan ibu Fransiska Elisabeth Murdiyanti. Penulis merupakan anak pertama dari dua bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 2 Pekalongan dan pada tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Penulis menjadi asisten praktikum mata kuliah Fisiologi Tumbuhan pada tahun ajaran 2010/2011.Pada tahun 2009, penulis melakukan studi lapang di Kawasan wana Wisata Cangkuang Sukabumi, dengan judul makalah “Laju Dentrifikasi dan Nitrifikasi Mikroba Tanah Hutan Cangkuang”. Pada tahun 2010, penulis melakukan praktik lapang di PT Perkebunan Nusantara IX Divisi Tanaman Tahunan (Kebun Blimbing) dari bulan Juni sampai bulan Juli dengan judul laporan “Budidaya Tanaman Karet dan Proses Pengolahan Karet di PT Perkebunan
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang... 1
Tujuan ... 1
Waktu dan Tempat ... 1
METODE ... 1
Isolasi Bakteri dan Peremajaan ... 1
Uji Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat... 1
Uji Fenotipe ... 2
Ekstraksi DNA Bakteri Merah ... 2
Sensitivitas Bakteri Merah terhadap Antibiotik ... 2
Amplifikasi 16S DNA Ribosomal ... 2
Sekuensing Fragmen DNA ... 2
Analisis Sekuen Nukelotida ... 3
Analisis Filogenetika ... 3
Produksi dan Ekstraksi Prodigiosin ... 3
Purifikasi Prodigiosin ... 3
Uji Antibakteri Prodigiosin ... 3
Uji Efikasi Prodigiosin terhadap Penyebab Penyakit Kresek pada Tanaman (Xanthomonas Oryzae pv. oryzae) ... 4
HASIL ... 4
Peremajaan Isolat ... 4
Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat ... 4
Karakteristik Fenotipe ... 4
Amplifikasi 16S rDNA Ribosomal ... 5
Analisis Sekuen Nukelotida 16S rDNA ... 5
Analisis Filogenetika ... 5
Ekstraksi dan Purifikasi Prodigiosin ... 6
Uji Antibakteri Prodigiosin ... 6
PEMBAHASAN ... 8
SIMPULAN ... 9
SARAN ... 9
DAFTAR PUSTAKA ... 9
2 Sensitifitas bakteri merah terhadap antibiotik ... 5 3 Hasil uji daya hambat prodigiosin dengan pengenceran ynag berbeda ... 7 4 Hasil uji daya hambat prodigiosin Escherichia coli dan layu ubi jalar ... 7
DAFTAR GAMBAR
Halaman
1 Biakan Serratia marcnesces (a) pada media LB agar, (b) pada media LB agar miring ...4 2 Grafik efektivitas bakteri merah terhadap wbc ...4 3 Elektriforesis agarose gel hasil ekstraksi DNA genom (a) produk PCR 16S rDNA bakteri merah (b) ...5 4 Pohon filogenetik bakteri merah ...6 5 Kultur bakteri merah yang berumur 5 hari (a), ekstraksi prodigiosin dalam pelarut etil
asetat (b) ...6 6 Hasil analisis prodigiosin dengan kromatografi lapis tipis silica gel (a), dan spektrofotometer 6 7 Daya hambat prodigiosin berdasarkan pengujian metode cawan petri (a), bioluminator pada lapis tipis silica gel ...7 8 Grafik efektivitas prodigiosin terhadap penyakit kresek ...7
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Wereng Batang Cokelat (wbc,
Nilaparvata lugens) merupakan salah satu hama utama tanaman padi yang paling berbahaya dan sukar dikendalikan. Wbc merusak tanaman dengan cara menghisap nutrisi dari tanaman sehingga pertumbuhan dan perkembangan tanaman menjadi terganggu, bahkan mati. Selain itu, wbc juga menjadi vektor virus yang menyebabkan penyakit kerdil rumput dan kerdil hampa (Alamendah 2004). Berbagai musuh alami wbc seperti predator, parasitoid dan patogen telah diidentifikasi dan banyak dimanfaatkan untuk mengendalikan populasi wbc. Salah satu patogen yang dilaporkan menginfeksi wbc adalah bakteri merah. Wereng batang cokelat yang mati terinfeksi bakteri merah sering dijumpai di tempat perbanyakan wbc di rumah kaca dan di lapang saat populasinya tinggi. Gejalanya ditunjukan oleh busuk basah dan warna merah pada tubuhnya.
Bakteri yang berhasil diisolasi juga menunjukkan pertumbuhan koloni berwarna merah pada media Lurial Bertani (LB) agar. Dalam uji postulat Koch, bakteri merah terbukti bersifat patogenik terhadap wbc (Baskoro et al. 2002). Bahkan bakteri tersebut juga patogenik terhadap Spodoptera exigua, Plutella xylotella, Crocidolomia binotallis, kutu daun mangga (Rastrococcus sp), dan belalang berkembar (Baskoro et al. 2002). Di New Zealand, dua bakteri entomopatogen non-sporing forming dari genus Serratia, yaitu S. entomophila dan S. proteamaculans, telah berhasil dikembang kan menjadi biopestisida yang efektif untuk mengendalikan grass grub (Costelytra zealandica). Hal ini menunjukkan bahwa bakteri merah mempunyai potensi untuk digunakan sebagai agensia pengendalian biologi wbc dan serangga hama lainnya.
Serratia yang diisolasi dari wereng coklat dicirikan oleh koloninya yang cembung dan menghasilkan pigmen merah pada media agar yang mengandung fosfat, karbonat dan besi (Giri et al.2004). Pigmen merah merupakan salah satu indikasi adanya produksi prodigiosin pada genus Serratia. Pigmen merah yang dihasilkan oleh Serratia
merupakan metabolit sekunder yang dikenal sebagai prodigiosin yang merupakan famili pigmen merah tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2 bipyrolle
(Giri et al. 2004). Prodigiosin adalah
metabolit sekunder multi aspek yang mempunyai aktivitas sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967, Perez-Tomás et al. 2003), antimalaria, antidiabetes ,obat-obatan anti-inflammatory nonsteroidal, antioksidan serta menjadi pewarna untuk sutera dan wol (Khanafari et al. 2006). Pemanfaatan bakteri merah untuk pengendalian wbc belum banyak dilakukan, hal ini disebabkan karena spesies bakteri tersebut belum diketahui. Oleh karena itu perlu dilakukan identifikasi bakteri patogenik terhadap wbc .
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi bakteri yang patogenik terhadap wbc dan mengkarakterisasi pigmen yang dihasilkannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Isolasi Bakteri dan Peremajaan
Bakteri entomopatogen merah diisolasi dari wbc koloni Jatisari yang mati dengan gejala warna merah pada tubuhnya.Wereng yang telah mati dimasukkan dalam tabung mikro yang telah diisi NaCl 0.85% 300 µ l , divorteks hingga larutan bewarna kemerahan. Koloni bakteri tumbuh setelah 24-48 jam inkubasi pada suhu ruangan. Koloni tunggal bakteri yang berwarna merah diisolasi dan dipelihara pada media Lurial Bertani Broth (triptose 1%, ekstrak khamir 0.5%, NaCl 1%, agar 1.5%). Koloni dilakukan peremajaan 2 minggu sekali pada agar miring di dalam tabung reaksi.
Uji Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
tanaman kontrol disemprot dengan akuades steril. Setelah penyemprotan dan diselubungi dengan plastik milar, sebanyak 20 ekor nimfa wbc diinfestasikan kedalam tanaman. Mortalitas wbc diamati setiap hari selama 15 hari.
Uji Fenotipe
Fenotipe bakteri merah diuji dengan kit GN MicroPlateTM Biolog. Bakteri dibiakan dalam 5 ml media LB cair di dalam tabung reaksi dan diinkubasikan dalam orbital shaker selama 16 jam pada suhu ruangan. Sel bakteri dipanen dengan cara disentrifugasi dan dicuci dengan 0.85% NaCl sebanyak tiga kali. Sel bakteri disuspensikan dalam 0.85% NaCl dan dibuat pengenceran hingga nilai OD600 mencapai 0.5. Selanjutnya suspensi bakteri diinokulasikan dalam kolom dari kit GN MicroPlateTM Biolog sebanyak 150 µ l per kolom. Fenotipe bakteri diamati setelah 24 jam inkubasi pada suhu 28°C. Reaksi positif ditunjukkan oleh perubahan warna biakan menjadi ungu.
Ekstraksi DNA Bakteri Merah
Bakteri merah dikulturkan dalam media LB selama 18 jam kemudian di shaker. Biakan bakteri diambil sebanyak 2 ml, kemudian disentrifuse 10000 rpm selama 5 menit, untuk didapatkan peletnya. Pelet disuspensikan dengan larutan buffer solution
I sebanyak 50 µ l, buffer solution II 150µl ke dalam suspensi bakteri, dicampur merata dengan digoyang lambat dan diinkubasi selama 5-20 menit pada suhu ruang (27°C). Sebanyak 250 µ l solution III ditambahkan dikocok kuat. Suspensi disentrifuse 10000 rpm selama 5 menit.Supernatan dipindahkan ke tabung mikro baru dan ditambah fenol dalam klorofom isoamil 100 µ l,disentrifuse 10000 rpm selama 10 menit. Supernatan diambil sebanyak 600 µ l, ditambahkan 600 µ l isopropanol. Disentrifuse kembali, supernatan dibuang, peletnya diambil dan ditambah aquades 20µ l.
Sensitivitas Bakteri Merah terhadap Antibiotik
Bakteri merah diujui sensitivitasnya terhadap beberapa antibiotik seperti kloramfenikol, kasugamisin, rimfamisi ,streptomisin, dan ampisilin dengan konsentrasi masing masing 25 µg/ml dan 50 µg/ml. Antibiotik ditambahkan ke dalam media LB sebanyak 25 µg/ml dan 50 µg/ml. Kemudian bakteri Serratia marcescens
ditumbuhkan dengan metode gores pada media tersebut dan diinkubasi pada suhu ruang selama 3 hari.
Amplifikasi 16S DNA Ribosomal
Identifikasi bakteri merah dilakukan berdasarkan sekuen nukleotida 16S rDNA . Amplifikasi fragmen DNA dilakukan dengan sepasang primer 63F (C A G G C C T A) dan 1387R (G G G C G G W G T G T A C A A G G C) menggunakan mesin PCR. Komposisi 20 µ l reaksi PCR terdiri dari 2 µ l 10X bufer PCR, 1.5 µ l 50 mM MgCl2, 0.5 µ l 4 mM dNTP, 1 µ l 20 mM primer forward, 1 µl 20 mM primer reverse, 0.5 µl 5U Taq Polimerase, dan 13.5 µ l air destilasi steril. Reaksi PCR diletakan dalam tabung PCR berukuran 0.2 ml. Templet DNA untuk PCR menggunakan koloni tunggal bakteri dari biakan yang berumur 18 jam pada media LB agar di dalam cawan petri. Mesin PCR dijalankan dengan program sebagai berikut, yaitu denaturasi awal DNA pada suhu 94°C selama 10 menit, denaturasi kedua 94°C 1 menit, annealing 50°C 45 detik, dan extension 72 °C 1 menit 30 detik dengan siklus sebanyak 35 kali. Produk PCR dicek pada gel agarose yang dielektroforesis dengan 90 volt selama 30 menit dalam bufer TAE.
Sekuensing Fragmen DNA
Analisis Sekuen Nukelotida
Hasil perunutan sekuen nukleotida 16S rDNA dianalisis dengan software BlastN yang terdapat dalam situs National Center for Biotechnology Information (NCBI, www.ncbi.nlm.nih.gov) untuk mengetahui tingkat kekerabatan terdekat dengan bakteri yang ada di dalam Database GeneBank (NCBI). Dalam menganalisis tingkat kemiripan runutan DNA antara strain dalam satu spesies dan antara spesies dalam satu genus digunakan program interaktif dengan mengirimkan urutan nukleotida DNA dalam format Fasta melalui internet dengan cara salin dan tempel pada kolom khusus yang telah disediakan oleh GeneBank. Selanjutnya sekuen 16S rDNA dalam GeneBank yang mempunyai kekerabatan dengan sekuen 16S rDNA dari bakteri merah diambil untuk analisis pohon filogenetika.
Analisis Filogenetika
Analisis filogenetika dilakukan menggunakan program PHYLIP versi 3.6 (University of Washington). Sebelum analisis, runutan nukleotida semua isolat yang terpilih dimodifikasi dengan software ClustalX 1.83 untuk menyamakan format runutannya. Matrik jarak genetika dihitung dengan menggunakan matrik parameter dalam program komputer DNAML. Analisis boostrap dengan 100 ulangan dilakukan menggunakan program SEQBOOT dan konsensus pohon filogenetikanya dibuat dengan program CONSENSE. Pohon filogenetikanya digambarkan dengan program MEGA4 dalam paket program PHYLIP.
Produksi dan Ekstraksi Prodigiosin
Prodigiosin diproduksi dalam 250 ml media LB cair ( triptose 1%, yeast ekstract
0.5%, NaCl 1% ). Media dimasukan dalam erlenmeyer (1 liter) dan diautoklaf pada suhu 121ºC dan tekanan 1 atm selama 20 menit. Setelah dingin, media diinokulasi dengan 1 ml biakan Serratia yang berumur 16 jam yang sebelumnya telah dibiakan di media LB cair dan diukur panjang gelombang 600 dengan nilai OD 0.5. Biakan diinkubasikan dalam orbital shaker (150 rpm) selama 5 hari pada suhu ruangan. Biakan disentrifugasi kecepatan 5000 rpm, 4 °C selama 20 menit untuk memisahkan supernatan dari pelet sel bakteri. Ekstraksi prodigiosin dari supernatan dilakukan dengan metanol-chloroform atau etil asetat
(Davaraj et al. 2009). Supernatan dimasukan kedalam tabung fraksi dan ditambahkan 100 ml etil asetat, dikocok kuat hingga larutan tercampur secara menyeluruh. Kemudian didiamkan selama beberapa menit untuk memisahkan fraksi air dari etil asetat yang bercampur prodigiosin. Etil asetat yang mengandung prodigiosin dievaporasi dengan
rotary evaporator pada suhu 35ºC selama kurang lebih 20 menit. Selanjutnya prodigiosin dilarutkan dalam DMSO.
Purifikasi Prodigiosin
Prodigiosin dimurnikan dengan menggunakan kolom silica gel dan kloroform sebagai pelarut. Ekstrak prodigiosin dalam pelarut metanol dialirkan melalui kolom silika. Prodigiosin yang terperangkap dalam kolom silika gel dilepaskan dan dilarutkan dengan kloroform. Tingkat kemurnian dianalisis dengan spektrofotometer dan kromatografi lapis tipis silika gel. Sebanyak 10 µl prodigiosin diteteskan pada lapisan silika di atas lempengan kaca dengan jarak 3cm dari bagian bawah dan dijalankan dengan pelarut amil asetat hingga pelarut mencapai batas 3 cm dari atas. Spot merah yang merupakan prodigiosin dihitung nilai RF dengan rumus jarak yang ditempuh sampel dibagi dengan jarak yang ditempuh pelarut. Analisis dengan spektrofotometer dilakukan dengan pelarut air yang bersifat asam dan basa . Sebanyak 20 µ l prodigiosin dimasukan dalam 200 µ l pelarut dan dicampur dengan merata. Prodigiosin dideteksi serapan panjang gelombangnya pada kisaran antara 400-600 nm.
Uji Antibakteri Prodigiosin
Uji daya hambat prodigiosin terhadap
Xanthomonas oryzae pv. oryzae, Eschericia coli dan Pseudomonas solanacearum ini dilakukan pada media LB agar ( triptose 1%,
dilakukan 24 - 48 jam setelah inkubasi pada suhu ruangan (27°C).
Uji Efikasi Prodigiosin terhadap Penyebab Penyakit Kresek pada Tanaman Padi (Xanthomonas Oryzae pv. oryzae)
Tanaman padi varietas Ciherang (umur 40 hari setelah tanam) yang ditanam dalam ember plastik (volume 1 liter) digunakan untuk uji kemampuan prodigiosin mengendalikan serangan Xanthomonas oryzae pv. oryzae. Daun padi dipotong pada jarak 5 cm dari ujung atas daun dan diinkokulasi dengan biakan bakteri dengan cara disemprot. Setiap satu rumpun padi (5 batang per rumpun) disemprot dengan 1 ml biakan bakteri yang berumur 48 jam setelah inkubasi. Strain X. oryzae pv. oryzae yang diinokulasikan, yaitu strain 1B yang mempunyai tingkat virulensi yang lebih tinggi. Prodigiosin dengan konsentrasi 100- 150µg disemprotkan sebanyak 1 ml setelah suspensi bakteri kering pada tanaman. Sebagai kontrol digunakan tanaman tanpa semprot prodigiosin. Pengamatan intensitas penyakit dilakukan setiap 3 hari sekali selama 2 minggu
.
HASIL
Peremajaan Isolat
Bakteri merah ditumbuhkan pada media
Lurial Bertani Broth (LB) dan diinkubasi pada suhu ruang selama 2-3 hari dengan metode kuadran untuk mendapatkan koloni tunggal (Gambar 1a). Koloni tunggal disubkultur pada medium LB agar miring dan diremajakan setiap 2 minggu sekali atau sesuai dengan kebutuhan (Gambar 1b).
Gambar 1 Biakan bakteri merah (a) pada media LB agar, (b) pada media LB agar miring.
Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
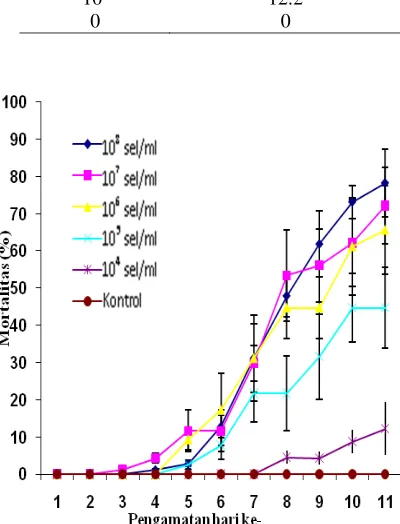
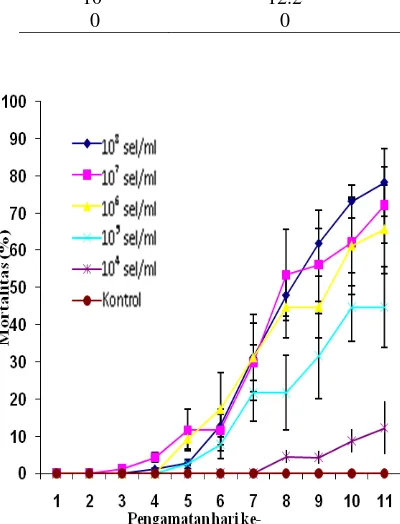
Hasil uji efikasi membuktikan bahwa bakteri merah efektif mengendalikan wbc.
Tingkat mortalitas wbc mencapai 65.6-78.2% pada aplikasi bakteri merah dengan konsentrasi antara 106 dan 107 sel/ml (Tabel 1). Kematian wbc mulai terjadi pada 4 hari setelah inokulasi (hsi), dan meningkat tajam pada 7 hsi (Gambar 2). Serangga yang mati ditujukkan oleh warna merah pada tubuhnya. Hasil reisolasi memastikan bahwa bakteri yang menginfeksi dan menyebabkan kematian wbc adalah bakteri merah. Hal ini menunjukkan bahwa bakteri merah bersifat patogenik terhadap wbc.
Tabel 1 Efektivitas bakteri merah terhadap wbc setelah 10 hari aplikasi
Konsentrasi
(sel/ml) Mortalitas (%)
108 78.2
107 72.1
106 65.6
105 44.7
104 12.2
0 0
Gambar 2 Grafik efektivitas bakteri merah terhadap wbc.
Karakteristik Fenotipe
Bakteri merah adalah bakteri gram negatif yang bersifat motil. Koloninya berbentuk cembung dan berukuran 1-3 mm pada biakan yang berumur 24 jam setelah inkubasi. Ukuran koloni menjadi lebih besar jika diinkubasikan lebih lama karena sifat
motilitasnya. Warna merah koloni sudah mulai terlihat pada biakan yang berumur 24 jam, dan semakin merah setelah diinkubasikan lebih 48 jam. Namun sering juga dijumpai koloni bakteri warna putih, terutama koloni tunggal yang terangsing jauh dari koloni lain (quorum sensing). Bakteri merah sensitif terhadap streptomisin serta tahan dengan kloramfenikol, kasugamisin dan rimfamisin (Tabel 2). Meskipun bakteri merah tahan terhadap kloramfenikol tetapi pigmentasinya terhambat, bahkan bakteri tidak mampu menghasilkan pigmen merah pada konsentrasi kloramfenikol 1 g/ml.
Tabel 2 Sensitivitas bakteri merah terhadap antibiotik
Antibiotik Kosentrasi ( g/ml) 25 50 Kloramfenikol R R Kasugamisin R R Rimfamisin R R Streptomisin S S
Ampisilin R R
Karakteristik fenotipe bakteri merah berdasarkan pengujian dengan Biolog GN MicroplateTM disajikan dalam lampiran 1. Bakteri merah menunjukkan 94 karakter positif dari 95 pengujian yang dilakukan. Karakter negatif hanya terdapat pada - keto butyric acid. Bakteri dapat memfermentasikan semua jenis karbohidrat yang meliputi fructose, L-fucose, D-galactose, Gentiobiose, m-inositol, - Maltose, Lactulose, D-lactose, D-mannitol, D-Manose, D-melibiose dan -D-glucose, serta semua jenis asam amino, termasuk L-ornithin. Berdasarkan analisis dengan Biolog GN database, bakteri merah termasuk dalam genus Serratia.
Amplifikasi 16S rDNA Ribosomal
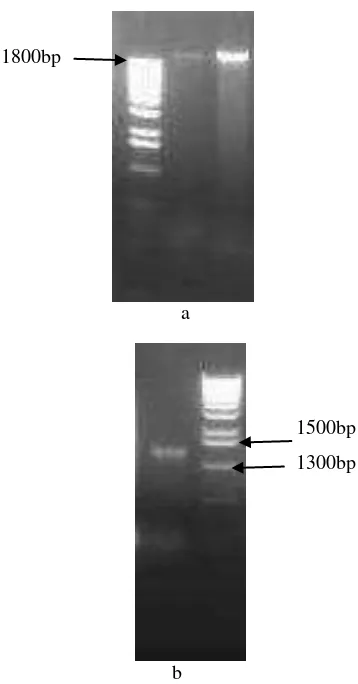
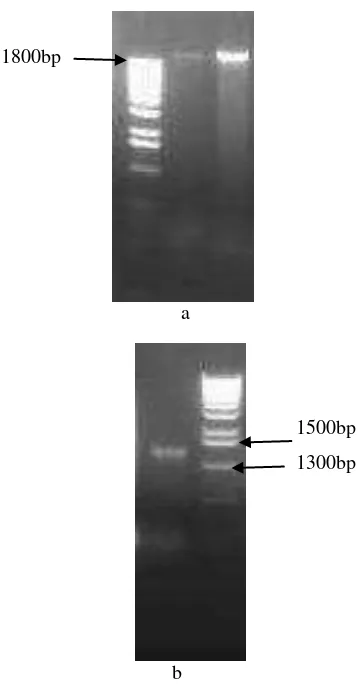
Kualitas DNA hasil ekstraksi ditampilkan pada gambar 3. Terdapat satu band tunggal yang tidak terkontaminasi dengan RNA. Pengukuran spektrofotometer juga menunjukan tidak ada kontaminasi protein. Hal ini ditunjukkan oleh nilai perbandingan absorbansi OD260/280 sekitar 1.8. Amplifikasi sekuen 16S rDNA dengan pasangan primer 63F dan 1387R menghasilkan band tunggal berukuran sekitar 1.4 kb yang sesuai dengan perkiraan (Gambar 3). Proses sekuensing, produk PCR dimurnikan dengan PCR purificatio kit
(Qiagen) dan disekuensing dengan primer yang sama secara dua arah.
1800bp
1500bp 1300bp
Gambar 3 Elektroforesis gel agarosel ekstrak DNA genom (a), produk PCR 16S rDNA bakteri merah (b).
Analisis Sekuen Nukelotida 16S rDNA
Urutan nukleotida 16S rDNA bakteri merah disekuen dari dua arah sebanyak dua kali. Hasil kedua sekuen dibandingkan untuk memastikan tidak ada kesalahan sekuensing. Kemudian kosensus sekuen sebesar 1294 bp dibandingkan dengan sekuen dari bakteri lain yang ada dalam database Gene Bank melalui analsis BLASTN. Sekuen bakteri merah mempunyai tingkat kesamaan 99% dengan
Serratia sp. endosimbion wbc (no. asesi GU124498) dan S. marcescens (no. asesi HQ154570) (lampiran 2). Hasil ini berkorelasi dengan analisis fenotipe menggunakan Biolog GN MicroplateTM yang mengklasifikasikan bakteri merah ke dalam genus Serratia.
Analisis Filogenetika
Berikut ini merupakan hasil dari analisi filogenitika mengunakan program PHYLIP
a
versi 3.6. Terlihat pada hasil bahwa bakteri merah yang diidentifikasi kekerabatannya, dekat dengan Serratia marcescens dan
Serratia sp yang berendosimbion dengan wbc.
Gambar 4 Pohon filogenetik bakteri merah.
Ekstraksi dan Purifikasi Prodigiosin
Prodigiosin diekstraksi dari kultur S. marcescens 5 hari setelah inkubasi dan menunjukkan warna merah (Gambar 5a). Ekstraksi dengan etil asetat berhasil memisahkan prodigiosin dari fraksi cair media (Gambar 5b). Prodigiosin dalam etil asetat dipekatkan dengan evaporator. Pada suhu 35oC dan kondisi vakum, etil asetat akan menguap tanpa membawa prodigiosin sehingga prodigisin dapat dikoleksi. Prodigiosin yang berhasil diekstrasi dilarutkan dalam DMSO.
Gambar 5 Kultur bakteri merah yang berumur 5 hari (a), ekstraksi prodigiosin dalam pelarut etil asetat (b).
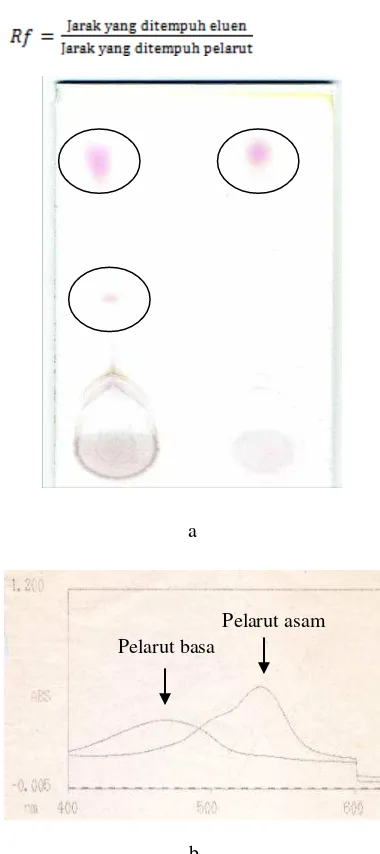
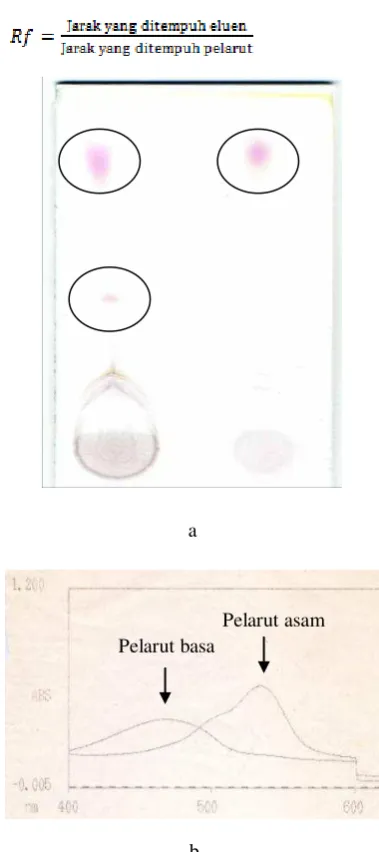
Hasil purifikasi dengan kromatografi kolom menggunakan silika gel masih belum mampu menghilangkan metabolit kontaminan. Hasil analisis dengan kromatografi lapis tipis mendeteksi 2 spot pada nilai Rf 0.82 untuk prodigiosin dan
0.24 untuk kontaminan (Gambar 6a). Pengukuran prodigiosin dengan spektrofotometer yang dilakukan dalam pelarut yang bersifat asam juga mendeteksi ada 2 titik puncak pada panjang gelombang 500 nm dan 540 nm (Gambar 6b). Serapan tertinggi prodigiosin dalam pelarut asam terjadi pada panjang gelombang 540 nm. Tetapi pada pelarut basa, metabolit kontaminan tidak terdeteksi. Titik puncak absorbansi terjadi pada panjang gelombang 460 nm untuk prodigiosin.
Gambar 6 Profil hasil analisis prodigiosin dengan kromatografi lapisi tipis silika gel (a) dan spektrofotometer (b).
Uji Antibakteri Prodigiosin
Kemampuan prodigiosin menghambat pertumbuhan bakteri telah diuji terhadap b
a
a
Pelarut asam Pelarut basa
Xanthomonas oryzae pv. oryzae penyebab penyakit kresek pada tanaman padi,
Escherichia coli dan Pseudomonas solanacearum penyebab penyakit layu pada tanaman ubi jalar. Pada assay di cawan petri, konsentrasi prodigiosin yang efektif menghambat pertumbuhan bakteri sekitar 100-150 g/ml. Pada konsentrasi yang lebih rendah daya hambatnya berkurang. Jenis bakteri yang berbeda akan menunjukkan perbedaan sensitivitasnya. X. Oryzae pv.
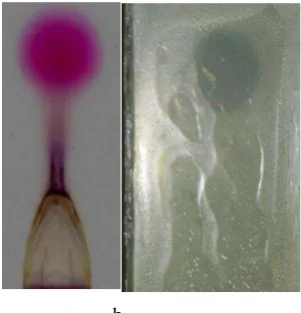
oryzae dan P. Solanacearum prodigiosin konsentrasi 10-15 g/ml masih sensitif dibandingkan dengan Escherichia coli (Tabel 4). Dalam uji bioautografi, spot merah prodigisoin juga efektif menghambat ketiga bakteri tersebut. Pada titik yang ada prodigiosin terbentuk zona bening yang menunjukkan tidak tumbuhnya bakteri (Gambar 7b). Hal ini menunjukkan bahwa prodigiosin bersifat bakterisida.
Prodigiosin juga efektif menghambat perkembangan penyakit kresek pada tanaman padi. Efikasi prodigiosin 150 g/ml mampu menekan serangan penyakit kresek hingga 30%. Pada tanaman tanpa aplikasi prodigiosin, serangan penyakit kresek mencapai 50%, tetapi bila diaplikasi prodigiosin, serangannya hanya mencapai 20% setelah 4 minggu aplikasi (Gambar 8). Gejala serangan kresek mulai terlihat pada 1 minggu setelah inokulasi (msi) dengan gejala coklat kekuningan yang berkembang dari ujung ke pangkal daun dan terus meningkat dengan bertambahnya umur tanaman. Perkembangan penyakit terlihat sangat lambat pada tanaman yang diaplikasi prodigiosin dibandingkan dengan tanaman tanpa aplikasi prodigiosin.
p3 p1
p2
Gambar 7 Daya hambat prodigiosin terhadap berdasarkan pengujian metode cawan petri (a) dan bioluminator pada lapis tipis silika gel (b).
Tabel 3 Hasil uji daya hambat prodigiosin dengan pengenceran yang berbeda (n=4) Pengenceran
prodigiosin Hasil
10-1 +
10-2 +
10-3 -
Tabel 4 Hasil positif uji daya hambat prodigiosin pada Escherichia coli, layu ubi jalar dan X.oryzae pv.Oryzae
Pengenceran
prodigiosin E. coli
P. solanace
arum
X. oryzae
pv.
Oryzae
10-1 10-2 10-3
+ - -
+ + -
+ + -
Gambar 8 Grafik efektivitas prodigiosin terhadap penghambatan penyakit kresek. a
PEMBAHASAN
Bakteri merah yang diidentifikasi sebagai S. marcescens berdasarkan uji fenotipe dengan Biolog GN Microplate TM dan analisis sekuen 16S rDNA terbukti bersifat patogenik terhadap wbc. Patogenisitas S. marcescens diduga terjadi bukan melalui infeksi integumen, tetapi melalui mulut dengan termakan ketika serangga mencucuk dan menghisap cairan tanaman. Mulut wbc bertipe pencucuk penghisap dan rostumnya muncul dari bagian posterior kepala digunakan sebagai pintu masuk pintu masuk sel bakteri S. marcescens yang berukuran 1 m. Pada uji patogenisitas terhadap larva Tenebrio molitor yang dilakukan melalui pakan, M. marcescens juga bersifat patogenik, bahkan protein yang diekstrak sel bakteri bersifat toksik (Data tidak ditampilkan). Hal ini menunjukkan bahwa patogenisitas S. marcescens bersifat oral dengan menghasilkan protein yang toksik.
Menurut Hurst et al. (2000), faktor virulensi S. entomophila and S. proteamaculans terletak dalam plasmid pADAP (amber disease-associated plasmid, 153 kb) yang membawa tiga gen penyandi komplek toksin, yaitu sepABC (untuk S.
entomophila pathogenicity). Produk protein dari sepABC mempunyai kesamaan sekuen asam aminonya dengan toksin insektisidal yang dihasilkan oleh Photorhabdus luminescens (Bowen et al. 1998),
Xenorhabdus nematophilus (Morgan et al. 2001), Yersinia pestis C092 (Parkhill et al. 2001), Pseudomonas syringae pv. tomato
DC3000 (Buell et al. 2003), Serratia sp. (Hurst et al. 2000; Dodd et al. 2006) dan
Chromobacterium violaceum ATCC 12472 (Vasconselos et al. 2003), yang dikenal dengan nama komplek toksin (Tc). Tetapi gen penyandi Tc berada dalam DNA genomnya. Komplek toksin memiliki berat molekul tinggi ( 1MDa) dan menunjukkan aktvitas insektisidal terhadap serangga dari ordo Coleoptera, Dictyoptera, Hymenoptera, and Lepidoptera (Bowen et al. 1998). Komplek toksin tersusun atas empat komplek toksin (Tca, Tcb, Tcc dan Tcd) yang masing-masing dikodekan oleh empat lokus gen, yaitu Tca, Tcb, Tcc dan Tcd. Komplek toksin Tca dan Tcd bersifat oral terhadap Mandusa sexta (Waterfield et al.
2001) serta Leptinotarsa decemlineata dan
Bemisia tabaci (Blackburn et al. 2005). Komplek toksin Tca dan Tcd potensial untuk menjadi salah satu kandidat pengganti toksin Bacillus thuringiensis (Bt) dalam pengembangan tanaman transgenik tahan serangga hama.
Bakteri patogen S. marcescens
yang menginfeksi wbc juga pernah dilaporkan di Korea (Kim et al.1998). Menurut Grimoet dan Grimoet (1978), strain pigmen merah dari S. marcescens sering dijumpai pada banyak ordo serangga baik yang sehat, berpenyakit, maupun mati. Umumnya, strain S. marcescens yang diisolasi dari manusia tidak berpigmen, sedangkan strain berpigmen yang diisolasi dari serangga dan lingkungan lainnya tidak pernah dilaporkan menjadi penyebab infkesi nosocomial pada manusia (Mohan et al. 2011). Dalam database GeneBank, sekuen nukleotida 16S rDNA bakteri merah memiliki tingkat kesamaan 99% dengan sekuen nukleotida 16S rDNA Serratia sp. endosimbion wbc (no. asesi GU124498) dan
S. marcescens (no. asesi HQ154570). Menurut Janda dan Abbott (2007), apabila terdapat persamaan sekuen nukleotida dari gen antara satu bakteri dengan bakteri yang lain dengan nilai lebih dari 90%, maka bakteri-bakteri tersebut merupakan spesies bakteri yang sama.
Serratia sp. endosimbion wbc tidak pernah dilaporkan sebagai patogen yang kuat. Pemanfaatnya untuk pengendalian wbc juga jarang dilakukan. Hal ini diduga disebabkan oleh beberapa faktor, yaitu pertama endosimbion Serratia adalah patogen lemah yang hanya akan bersifat patogenik ketika serangga dalam keadaan tertekan sehingga penggunaan untuk pengendalian wbc tidak akan efektif. Kedua
S. marcescens telah dilaporkan sebagai patogen oportunistik pada manusia sehingga pemanfaatan dikhawatirkan membahayakan organisme lain. Ketiga penelitian tentang faktor-faktor virulen S. marcescens terhadap wbc belum dilakukan.
Pigmen merah yang dihasilkan oleh S. marcescens isolat wbc adalah metabolit sekunder yang dikenal sebagai prodigiosin. Prodigiosin merupakan antibiotik multifungsi yang memiliki aktivitas sebagai antibakteria, antifungi, antiprotozoa, dan antikanker. Tetapi pengaruh prodigiosin terhadap serangga belum pernah dilaporkan. Asano et.al (1999) telah mencoba aplikasi kombinasi prodigiosin dengan kristal toksin
mengendalikan Spodoptera litura. Hasil penelitian menunjukkan bahwa aplikasi toksin Bt yang dikombinasikan dengan prodigiosin dapat menunda perkembangan resistensi serangga terhadap toksin Bt (Asano et al. 1999).
Aktivitas antibakteri prodigiosin terbukti mampu menghambat perkembangan
E. Coli, Xanthomonas, dan Pseudomonas
secara in vitro, tetapi dosis efektifnya sangat tinggi. Dalam pengujian secara in vivo, prodigiosin juga mampu menekan perkembangan penyakit kresek yang disebabkan oleh Xanthomonas hingga 30% dibandingkan kontrol. Sebenarnya S. marcescens sendiri tidak bersifat antagonis terhadap Xanthomonas dalam pengujian secara in vitro. Oleh karena itu, aplikasi langsung sel bakteri S. marcescena tidak mampu mengendalikan Xanthomonas. Pengendalian Xanthomonas yang efektif diperlukan prodigiosin pekat.
SIMPULAN
Berdasarkan uji fenotipe dengan Biolog GN Microplate TM dan analisis sekuen 16S rDNA, bakteri merah yang berendosimbion dengan wbc serta bersifat patogenik adalah
S. marcescens. Database GeneBank, sekuen nukleotida 16S rDNA bakteri merah memiliki tingkat kesamaan 99% dengan sekuen 16S rDNA Serratia sp endosimbion wbc. Prodigiosin merupakan metabolit sekunder dari S. marcescens yang mampu menghambat perkembangan E. coli,
Xanthomonas, dan Pseudomonas secara in vitro, dengan dosis efektif yang sangat tinggi. Secara in vivo, prodigiosin mampu menekan perkembangan penyakit kresek yang disebabkan oleh X. oryzae pv. oryzae
sebesar 30%.
SARAN
Perlu dilakukan penelitian lebih lanjut mengenai faktor-faktor virulensia S. marcescens terhadap serangga, sehingga dapat menjadi agen pengendali serangga yang lebih baik. Penelitian lebih lanjut untuk mendapatkan media yang baik untuk produksi prodigiosin.
DAFTAR PUSTAKA
Alamaendah. 2006. Hama padi yang sulit dibasmi. Natur Indonesia 6(2) : 84-86 Asano et al. 1999. Prodigiosin produced by
Serratia marcescens enhances the insectisidal activity of Bacillus
thuringiensis delta endotoxin against common cutworm, Spodoptera litura.J. Pesticide Sci. 24:381-385.
Baskoro et al. 2002.Pengendalian serangga hama dengan menggunakan bakteri merah. Laporan hasil penelitian, Balai pengamatan dan Peramalan Hama dan Penyakit Tanaman.
Blackburn M, Golubeva E, Bowen D, Effrench-Constant RH.1998. A novel insectisidal toxin form Photarhabdus luminescens, Toxin complex a (Tca) and it histopatological effects on the midgut of Manduca sexta. Environ Microbiol 64(8):36-41.
Bowen et al. 1998. Insecticidal toxins from the bacterium Photorhabdus luminescens. Sci 280:2129-2132. Buell CR. et al. 2003. The complete
genome sequence of the Arabidopsis and tomato pathogen Pseudomonas syringae pv tomato DC3000. Proc Natl Acad Sci USA 100: 10181-10186. Croft et al.2002. Antiprotozoal activities of
phospholipid analogues. Mol and Biochem Parsitology. 126:165-172. Davaraj Naveen Raj, Dharumaduari
Dhanasekaran, Nurdin Thajuadin and Annamalai Panneerselvam.2009. Production of prodigiosin from Serratia marcescens and its cytotoxicity activity.
J of Pharmacy Recearch. 2(4):590-593. Giri et al.2004. A novel medium for the
enhanced cell growth and production of prodigiosin from Serratia marcescens
isolated from soil. BMC Microbiol
4(11):1-10.
Grimont, P.A.D. and Grimont, F. 1978. The genus Serratia. Annu Rev Microbiol. 32:221-248.
Hurst MR, Glare TR, Jackson A, Ronson CW.2000. Plasmid located pathogenicity determinants of Serratia entomophila, the causal agent of amber disease of grass grub, show simililarity to the insectisidal to sans of
Photorhabdus lumisnescens. J Bacteriol.182:5127-5138.
Janda J.M and Abbott S.L. 2007. 16S rRNA gene sequencing for backterial identifications in the diagnostic laboratories : pluses, perils, and pitfalls.
J Clinic Microbiol. 45(9) : 2761-2761. Khanafari et al.2006.Review of prodigiosin,
Pigmentation in Serratia.Biological. Sci. 6(1):1-3.
sp.KH-95 and its cultural properties. Korea. J Biotechnol Bioeng.13:431-437. Mohan, M, Selvakumar, G, Sushil S.N,Bhatt, J.C,Gupta, H.S.2011. Entomopathogen of endophytic Serratia marcescens strain SRM against larvae of Helicoverpa armigera (Noctuidae: Lepidoptera). World J. Microbiol and Biotechnol. Published online: 07 April 2011.
Morgan. J.A, M.Sergent, D.Ellis, M. Ousley,and P. Jarret. 2001. Sequence analysis of insektisidal genes from Xenorhabdus nematophilus PMFI1296.
Appl Environ Microbiol 67:2062-2069. Nakashima T, Tamura T, Kurachi M,
Yamaguchi K, Oda T. 2005. Apoptosis like red pigment produced by ã-Proteobacterium and its multiple bioactivities. Biol Pharmacol Bull. 28:2289-2295.
Parkhill. J et al.2001.Genome sequence of
Yersinia pestis, the causative agent of plague. Nature 413:523-527.
Vasconcenlosn ATR et al. 2003. The complete genome sequence of
Chromabacterium violaceum reveals remarkable and exploitable bacterial adaptability. Proc Natl Acad Sci USA.100:11660-11665.
Lampiran 1. Karakteristik fenotipe bakteri merahberdasarkan pengujian dengan Biolog GN MicroplateTM
Uji Reaksi Uji Reaksi
Cyclodextrin + Itaconic acid [+]
Dextrin + -keto butyric acid -
Glycogen + -keto glutaric acid +
Tween 40 + -keto valeric acid +
Tween 80 + D,L-latic acid +
N-acetyl-D-galactosamine + Malonic acid + N-acetyl-D-glucosamine + Propionic acid +
Adonitol + Quinic acid +
L-arabinose + Saccharic acid +
D-arabitol + Sebacic acid +
Cellobiose + Succinic acid +
i-erythritol + Bromo succinic acid +
D-fructose + Succinamic acid +
L-fucose [+] Glucuronamide +
D-galactose + Alaninamide +
Gentiobiose [+] D-alanine +
-D-glucose + L-alanine +
m-inositol + L-alanyl-glycine +
-D-lactose + L-asparagine +
Lactulose + L-aspartic acid +
Maltose + L-glutamic acid +
D-mannitol + Glycyl-L-aspartic acid + D-Manose + Glycyl-Lglutamic acid +
D-melibiose [+] L-histidine +
-methyl-D-glucoside [+] Hydroxy L-proline +
D-psicose + L-leucine +
D-raffinose + L-ornithine +
L-rhamnose + L-phenylalanine +
D-sorbitol + L-proline +
Sucrose + L-pyroglutamic acid +
D-trehalose [+] D-serine +
Turanose + L-serine +
Xylitol + Lthreonine +
Methyl pyruvate [+] D,L-camitine + Mono-methyl succinate + -amino butyric acid +
Acetic acid [+] Urocanic acid +
Cis-aconitic acid + Inosine +
Citric acid + Uridine +
Formic acid + Thymidine +
D-galactonic acid + Phenyl ethylamine + D-galacturonic acid + Putrescine + D-gluconic acid + 2-amino ethanol + D-glucosaminic acid + 2,3-butanediol +
D-glucuronic acid + Glycerol +
-hydroxybutyric acid + D,L- -glycerol phosphate + - hydroxybutyric acid + Glucose-1-phosphate [+] - hydroxybutyric acid + Glucose-6-phosphate [+]
-hydroxy phenylacetic acid +
Lampiran 2. Perunutan sekuen nukleotida 16 S DNA hasil analisis software Blastn yang terdapat dalam situs National Center for Biotechnology Information.
Accesion Description Total
score
Query Covarage
∆ E
Value
Max Ident
GU124498.1 Serratia sp. Endosimbiont of Nilaparvata lugens clone M280 16S Ribosomal
2776 100 % 0.0 100%
HQ143657.1 Serratia marcescens strain YQH50 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
HQ538684.1 Serratia sp. bk_46 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
HQ154570.1 Serratia marcescens strain R9-8A 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
HM640277.1 Serratia sp. YF-2 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
EU876700.1 Serratia marcescens strain sls-1 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
FJ853424.1 Serratia marcescens strain MH6 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
FJ495145.1 Serratia sp. BSFC16 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
FJ360761.3 Serratia sp. PSB9 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
FJ360759.1 Serratia marcescens strain PSB19 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
FJ009445.1 Bacterium enrichment culture clone JC1 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
EU525929.1 Serratia marcescens strain SDLH-I 16S ribosomal RNA gene, partial sequence
2307 99 % 0.0 99 %
EF415649.1 Serratia marcescens 16S ribosomal RNA gene, partial sequence 2307 99 % 0.0 99 %
HQ917058.1 Serratia sp. NB2 16S ribosomal RNA gene, partial sequence 2302 99 % 0.0 98 %
JF206698.1 Uncultured bacterium clone ncd2365e07c2 16S ribosomal RNA gene, partial sequence
2302 99 % 0.0 98 %
JF138992.1 Uncultured bacterium clone ncd1613a08c1 16S ribosomal RNA gene, partial sequence 2302 99 % 0.0 98 %
HM240853.1 Serratia entomophila strain M6 16S ribosomal RNA gene, partial sequence
2302 99 % 0.0 98%
HM136578.1 Serratia sp. BL2 16S ribosomal RNA gene, partial sequence
2302 99 % 0.0 98 %
GQ465847.1 Serratia marcescens strain SB08 16S ribosomal RNA gene, partial sequence
2302 99 % 0.0 98 %
GQ417536.1 Uncultured Serratia sp. clone F3jan.3 16S ribosomal RNA gene, partial sequence
2302 99 % 0.0 98 %
GQ416504.1 Uncultured Serratia sp. clone F7may2.65 16S ribosomal RNA gene, partial sequence 2302 99 % 0.0 98 %
GQ165813.1 Serratia sp. XRK6 16S ribosomal RNA gene, partial sequence
ABSTRAK
YOHANA ARTDHI DAHLIANI. Identifikasi dan Ekstraksi Pigmen Bakteri Merah Patogenik terhadap Wereng Batang Cokelat. Dibimbing oleh IMAN RUSMANA dan TRI PUJI PRIYATNO. Wereng Batang Cokelat merupakan salah satu hama tanaman padi yang berbahaya dan sukar dikendalikan. Penemuan bakteri merah yang mampu menginfeksi wbc menjadi hal yang sangat penting, karena wbc dengan tipe mulut pencucuk penghisap sangat jarang terinfeksi oleh bakteri. Penelitian ini dilakukan untuk mengidentifikasi spesies bakteri merah yang patogenik terhadap wbc, serta mengekstraksi pigmen bakteri merah untuk diuji aktivitasnya. Pertama pengisolasian dan peremajaan bakteri, pengujian fenotipe dengan menggunakan kit GN MicroPlateTM Biolog kit, analisis sekuen nukleotida 16S rDNA dengan software BlastN yang terdapat dalam situs NCBI. Analisis filogenetika menggunakan program PHYLIP versi 3.6.Bakteri merah yang diidentifikasi adalah Serratia marcescens. S. marcescens sensitif terhadap streptomisin dengan konsentrasi 25 µg/ml hingga 50 µg/ml. Metabolit sekunder yang dihasilkan bakteri merah adalah prodigiosin dengan konsentrasi 150 µg/ml mampu menekan perkembangan penyakit kresek yang disebabkan oleh Xanthomonas oryzae pv. oryzae sebesar 30 %.
Kata kunci : Bakteri merah, Serratia marcescens, prodigiosin.
ABSTRACT
YOHANA ARTDHI DAHLIANI. Identification and extraction of Red Pigment of pathogenic bacteria to Stem Brown planthopper (wbc). Superviced by IMAN RUSMANA and TRI PUJI PRIYATNO.
Brown Planthopper Bar (BPH) is a dangerous and rebelliousness pests of rice. Discovery of red bacteria that can infect bph becomes very important, because the bph, as the piercing and sucking type insect mouth, was rarely infected by bacteria. This study was conducted to identify the bph red pathogenic bacteria, and to determine production and inhibition activity of red pigment. Bacterial phenotypes was perfomed using GN Microplate TM Biolog kit. Nukleotide sequence aligment of 16S rDNA was analyed with BlastN of the NCBI website. Phylogenetic Tree was contructed by PHYLIP version 3.6 program. The red bacterium was identified as Serratia marcescens . S. marcescens was sensitive to streptomycin with concentration of 25µg/ml and 50 µg/ml. Red pigment produced by S. marcescens was determined as prodigiosin. Prodigiosin in concentration of 150µg/ml able to suppress up to 30% the development a bacterial leaf blight caused by Xanthomonas oryzae pv. oryzae.
PENDAHULUAN
Latar Belakang
Wereng Batang Cokelat (wbc,
Nilaparvata lugens) merupakan salah satu hama utama tanaman padi yang paling berbahaya dan sukar dikendalikan. Wbc merusak tanaman dengan cara menghisap nutrisi dari tanaman sehingga pertumbuhan dan perkembangan tanaman menjadi terganggu, bahkan mati. Selain itu, wbc juga menjadi vektor virus yang menyebabkan penyakit kerdil rumput dan kerdil hampa (Alamendah 2004). Berbagai musuh alami wbc seperti predator, parasitoid dan patogen telah diidentifikasi dan banyak dimanfaatkan untuk mengendalikan populasi wbc. Salah satu patogen yang dilaporkan menginfeksi wbc adalah bakteri merah. Wereng batang cokelat yang mati terinfeksi bakteri merah sering dijumpai di tempat perbanyakan wbc di rumah kaca dan di lapang saat populasinya tinggi. Gejalanya ditunjukan oleh busuk basah dan warna merah pada tubuhnya.
Bakteri yang berhasil diisolasi juga menunjukkan pertumbuhan koloni berwarna merah pada media Lurial Bertani (LB) agar. Dalam uji postulat Koch, bakteri merah terbukti bersifat patogenik terhadap wbc (Baskoro et al. 2002). Bahkan bakteri tersebut juga patogenik terhadap Spodoptera exigua, Plutella xylotella, Crocidolomia binotallis, kutu daun mangga (Rastrococcus sp), dan belalang berkembar (Baskoro et al. 2002). Di New Zealand, dua bakteri entomopatogen non-sporing forming dari genus Serratia, yaitu S. entomophila dan S. proteamaculans, telah berhasil dikembang kan menjadi biopestisida yang efektif untuk mengendalikan grass grub (Costelytra zealandica). Hal ini menunjukkan bahwa bakteri merah mempunyai potensi untuk digunakan sebagai agensia pengendalian biologi wbc dan serangga hama lainnya.
Serratia yang diisolasi dari wereng coklat dicirikan oleh koloninya yang cembung dan menghasilkan pigmen merah pada media agar yang mengandung fosfat, karbonat dan besi (Giri et al.2004). Pigmen merah merupakan salah satu indikasi adanya produksi prodigiosin pada genus Serratia. Pigmen merah yang dihasilkan oleh Serratia
merupakan metabolit sekunder yang dikenal sebagai prodigiosin yang merupakan famili pigmen merah tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2 bipyrolle
(Giri et al. 2004). Prodigiosin adalah
metabolit sekunder multi aspek yang mempunyai aktivitas sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967, Perez-Tomás et al. 2003), antimalaria, antidiabetes ,obat-obatan anti-inflammatory nonsteroidal, antioksidan serta menjadi pewarna untuk sutera dan wol (Khanafari et al. 2006). Pemanfaatan bakteri merah untuk pengendalian wbc belum banyak dilakukan, hal ini disebabkan karena spesies bakteri tersebut belum diketahui. Oleh karena itu perlu dilakukan identifikasi bakteri patogenik terhadap wbc .
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi bakteri yang patogenik terhadap wbc dan mengkarakterisasi pigmen yang dihasilkannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Isolasi Bakteri dan Peremajaan
Bakteri entomopatogen merah diisolasi dari wbc koloni Jatisari yang mati dengan gejala warna merah pada tubuhnya.Wereng yang telah mati dimasukkan dalam tabung mikro yang telah diisi NaCl 0.85% 300 µ l , divorteks hingga larutan bewarna kemerahan. Koloni bakteri tumbuh setelah 24-48 jam inkubasi pada suhu ruangan. Koloni tunggal bakteri yang berwarna merah diisolasi dan dipelihara pada media Lurial Bertani Broth (triptose 1%, ekstrak khamir 0.5%, NaCl 1%, agar 1.5%). Koloni dilakukan peremajaan 2 minggu sekali pada agar miring di dalam tabung reaksi.
Uji Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
PENDAHULUAN
Latar Belakang
Wereng Batang Cokelat (wbc,
Nilaparvata lugens) merupakan salah satu hama utama tanaman padi yang paling berbahaya dan sukar dikendalikan. Wbc merusak tanaman dengan cara menghisap nutrisi dari tanaman sehingga pertumbuhan dan perkembangan tanaman menjadi terganggu, bahkan mati. Selain itu, wbc juga menjadi vektor virus yang menyebabkan penyakit kerdil rumput dan kerdil hampa (Alamendah 2004). Berbagai musuh alami wbc seperti predator, parasitoid dan patogen telah diidentifikasi dan banyak dimanfaatkan untuk mengendalikan populasi wbc. Salah satu patogen yang dilaporkan menginfeksi wbc adalah bakteri merah. Wereng batang cokelat yang mati terinfeksi bakteri merah sering dijumpai di tempat perbanyakan wbc di rumah kaca dan di lapang saat populasinya tinggi. Gejalanya ditunjukan oleh busuk basah dan warna merah pada tubuhnya.
Bakteri yang berhasil diisolasi juga menunjukkan pertumbuhan koloni berwarna merah pada media Lurial Bertani (LB) agar. Dalam uji postulat Koch, bakteri merah terbukti bersifat patogenik terhadap wbc (Baskoro et al. 2002). Bahkan bakteri tersebut juga patogenik terhadap Spodoptera exigua, Plutella xylotella, Crocidolomia binotallis, kutu daun mangga (Rastrococcus sp), dan belalang berkembar (Baskoro et al. 2002). Di New Zealand, dua bakteri entomopatogen non-sporing forming dari genus Serratia, yaitu S. entomophila dan S. proteamaculans, telah berhasil dikembang kan menjadi biopestisida yang efektif untuk mengendalikan grass grub (Costelytra zealandica). Hal ini menunjukkan bahwa bakteri merah mempunyai potensi untuk digunakan sebagai agensia pengendalian biologi wbc dan serangga hama lainnya.
Serratia yang diisolasi dari wereng coklat dicirikan oleh koloninya yang cembung dan menghasilkan pigmen merah pada media agar yang mengandung fosfat, karbonat dan besi (Giri et al.2004). Pigmen merah merupakan salah satu indikasi adanya produksi prodigiosin pada genus Serratia. Pigmen merah yang dihasilkan oleh Serratia
merupakan metabolit sekunder yang dikenal sebagai prodigiosin yang merupakan famili pigmen merah tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2 bipyrolle
(Giri et al. 2004). Prodigiosin adalah
metabolit sekunder multi aspek yang mempunyai aktivitas sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967, Perez-Tomás et al. 2003), antimalaria, antidiabetes ,obat-obatan anti-inflammatory nonsteroidal, antioksidan serta menjadi pewarna untuk sutera dan wol (Khanafari et al. 2006). Pemanfaatan bakteri merah untuk pengendalian wbc belum banyak dilakukan, hal ini disebabkan karena spesies bakteri tersebut belum diketahui. Oleh karena itu perlu dilakukan identifikasi bakteri patogenik terhadap wbc .
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi bakteri yang patogenik terhadap wbc dan mengkarakterisasi pigmen yang dihasilkannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Isolasi Bakteri dan Peremajaan
Bakteri entomopatogen merah diisolasi dari wbc koloni Jatisari yang mati dengan gejala warna merah pada tubuhnya.Wereng yang telah mati dimasukkan dalam tabung mikro yang telah diisi NaCl 0.85% 300 µ l , divorteks hingga larutan bewarna kemerahan. Koloni bakteri tumbuh setelah 24-48 jam inkubasi pada suhu ruangan. Koloni tunggal bakteri yang berwarna merah diisolasi dan dipelihara pada media Lurial Bertani Broth (triptose 1%, ekstrak khamir 0.5%, NaCl 1%, agar 1.5%). Koloni dilakukan peremajaan 2 minggu sekali pada agar miring di dalam tabung reaksi.
Uji Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
tanaman kontrol disemprot dengan akuades steril. Setelah penyemprotan dan diselubungi dengan plastik milar, sebanyak 20 ekor nimfa wbc diinfestasikan kedalam tanaman. Mortalitas wbc diamati setiap hari selama 15 hari.
Uji Fenotipe
Fenotipe bakteri merah diuji dengan kit GN MicroPlateTM Biolog. Bakteri dibiakan dalam 5 ml media LB cair di dalam tabung reaksi dan diinkubasikan dalam orbital shaker selama 16 jam pada suhu ruangan. Sel bakteri dipanen dengan cara disentrifugasi dan dicuci dengan 0.85% NaCl sebanyak tiga kali. Sel bakteri disuspensikan dalam 0.85% NaCl dan dibuat pengenceran hingga nilai OD600 mencapai 0.5. Selanjutnya suspensi bakteri diinokulasikan dalam kolom dari kit GN MicroPlateTM Biolog sebanyak 150 µ l per kolom. Fenotipe bakteri diamati setelah 24 jam inkubasi pada suhu 28°C. Reaksi positif ditunjukkan oleh perubahan warna biakan menjadi ungu.
Ekstraksi DNA Bakteri Merah
Bakteri merah dikulturkan dalam media LB selama 18 jam kemudian di shaker. Biakan bakteri diambil sebanyak 2 ml, kemudian disentrifuse 10000 rpm selama 5 menit, untuk didapatkan peletnya. Pelet disuspensikan dengan larutan buffer solution
I sebanyak 50 µ l, buffer solution II 150µl ke dalam suspensi bakteri, dicampur merata dengan digoyang lambat dan diinkubasi selama 5-20 menit pada suhu ruang (27°C). Sebanyak 250 µ l solution III ditambahkan dikocok kuat. Suspensi disentrifuse 10000 rpm selama 5 menit.Supernatan dipindahkan ke tabung mikro baru dan ditambah fenol dalam klorofom isoamil 100 µ l,disentrifuse 10000 rpm selama 10 menit. Supernatan diambil sebanyak 600 µ l, ditambahkan 600 µ l isopropanol. Disentrifuse kembali, supernatan dibuang, peletnya diambil dan ditambah aquades 20µ l.
Sensitivitas Bakteri Merah terhadap Antibiotik
Bakteri merah diujui sensitivitasnya terhadap beberapa antibiotik seperti kloramfenikol, kasugamisin, rimfamisi ,streptomisin, dan ampisilin dengan konsentrasi masing masing 25 µg/ml dan 50 µg/ml. Antibiotik ditambahkan ke dalam media LB sebanyak 25 µg/ml dan 50 µg/ml. Kemudian bakteri Serratia marcescens
ditumbuhkan dengan metode gores pada media tersebut dan diinkubasi pada suhu ruang selama 3 hari.
Amplifikasi 16S DNA Ribosomal
Identifikasi bakteri merah dilakukan berdasarkan sekuen nukleotida 16S rDNA . Amplifikasi fragmen DNA dilakukan dengan sepasang primer 63F (C A G G C C T A) dan 1387R (G G G C G G W G T G T A C A A G G C) menggunakan mesin PCR. Komposisi 20 µ l reaksi PCR terdiri dari 2 µ l 10X bufer PCR, 1.5 µ l 50 mM MgCl2, 0.5 µ l 4 mM dNTP, 1 µ l 20 mM primer forward, 1 µl 20 mM primer reverse, 0.5 µl 5U Taq Polimerase, dan 13.5 µ l air destilasi steril. Reaksi PCR diletakan dalam tabung PCR berukuran 0.2 ml. Templet DNA untuk PCR menggunakan koloni tunggal bakteri dari biakan yang berumur 18 jam pada media LB agar di dalam cawan petri. Mesin PCR dijalankan dengan program sebagai berikut, yaitu denaturasi awal DNA pada suhu 94°C selama 10 menit, denaturasi kedua 94°C 1 menit, annealing 50°C 45 detik, dan extension 72 °C 1 menit 30 detik dengan siklus sebanyak 35 kali. Produk PCR dicek pada gel agarose yang dielektroforesis dengan 90 volt selama 30 menit dalam bufer TAE.
Sekuensing Fragmen DNA
Analisis Sekuen Nukelotida
Hasil perunutan sekuen nukleotida 16S rDNA dianalisis dengan software BlastN yang terdapat dalam situs National Center for Biotechnology Information (NCBI, www.ncbi.nlm.nih.gov) untuk mengetahui tingkat kekerabatan terdekat dengan bakteri yang ada di dalam Database GeneBank (NCBI). Dalam menganalisis tingkat kemiripan runutan DNA antara strain dalam satu spesies dan antara spesies dalam satu genus digunakan program interaktif dengan mengirimkan urutan nukleotida DNA dalam format Fasta melalui internet dengan cara salin dan tempel pada kolom khusus yang telah disediakan oleh GeneBank. Selanjutnya sekuen 16S rDNA dalam GeneBank yang mempunyai kekerabatan dengan sekuen 16S rDNA dari bakteri merah diambil untuk analisis pohon filogenetika.
Analisis Filogenetika
Analisis filogenetika dilakukan menggunakan program PHYLIP versi 3.6 (University of Washington). Sebelum analisis, runutan nukleotida semua isolat yang terpilih dimodifikasi dengan software ClustalX 1.83 untuk menyamakan format runutannya. Matrik jarak genetika dihitung dengan menggunakan matrik parameter dalam program komputer DNAML. Analisis boostrap dengan 100 ulangan dilakukan menggunakan program SEQBOOT dan konsensus pohon filogenetikanya dibuat dengan program CONSENSE. Pohon filogenetikanya digambarkan dengan program MEGA4 dalam paket program PHYLIP.
Produksi dan Ekstraksi Prodigiosin
Prodigiosin diproduksi dalam 250 ml media LB cair ( triptose 1%, yeast ekstract
0.5%, NaCl 1% ). Media dimasukan dalam erlenmeyer (1 liter) dan diautoklaf pada suhu 121ºC dan tekanan 1 atm selama 20 menit. Setelah dingin, media diinokulasi dengan 1 ml biakan Serratia yang berumur 16 jam yang sebelumnya telah dibiakan di media LB cair dan diukur panjang gelombang 600 dengan nilai OD 0.5. Biakan diinkubasikan dalam orbital shaker (150 rpm) selama 5 hari pada suhu ruangan. Biakan disentrifugasi kecepatan 5000 rpm, 4 °C selama 20 menit untuk memisahkan supernatan dari pelet sel bakteri. Ekstraksi prodigiosin dari supernatan dilakukan dengan metanol-chloroform atau etil asetat
(Davaraj et al. 2009). Supernatan dimasukan kedalam tabung fraksi dan ditambahkan 100 ml etil asetat, dikocok kuat hingga larutan tercampur secara menyeluruh. Kemudian didiamkan selama beberapa menit untuk memisahkan fraksi air dari etil asetat yang bercampur prodigiosin. Etil asetat yang mengandung prodigiosin dievaporasi dengan
rotary evaporator pada suhu 35ºC selama kurang lebih 20 menit. Selanjutnya prodigiosin dilarutkan dalam DMSO.
Purifikasi Prodigiosin
Prodigiosin dimurnikan dengan menggunakan kolom silica gel dan kloroform sebagai pelarut. Ekstrak prodigiosin dalam pelarut metanol dialirkan melalui kolom silika. Prodigiosin yang terperangkap dalam kolom silika gel dilepaskan dan dilarutkan dengan kloroform. Tingkat kemurnian dianalisis dengan spektrofotometer dan kromatografi lapis tipis silika gel. Sebanyak 10 µl prodigiosin diteteskan pada lapisan silika di atas lempengan kaca dengan jarak 3cm dari bagian bawah dan dijalankan dengan pelarut amil asetat hingga pelarut mencapai batas 3 cm dari atas. Spot merah yang merupakan prodigiosin dihitung nilai RF dengan rumus jarak yang ditempuh sampel dibagi dengan jarak yang ditempuh pelarut. Analisis dengan spektrofotometer dilakukan dengan pelarut air yang bersifat asam dan basa . Sebanyak 20 µ l prodigiosin dimasukan dalam 200 µ l pelarut dan dicampur dengan merata. Prodigiosin dideteksi serapan panjang gelombangnya pada kisaran antara 400-600 nm.
Uji Antibakteri Prodigiosin
Uji daya hambat prodigiosin terhadap
Xanthomonas oryzae pv. oryzae, Eschericia coli dan Pseudomonas solanacearum ini dilakukan pada media LB agar ( triptose 1%,
dilakukan 24 - 48 jam setelah inkubasi pada suhu ruangan (27°C).
Uji Efikasi Prodigiosin terhadap Penyebab Penyakit Kresek pada Tanaman Padi (Xanthomonas Oryzae pv. oryzae)
Tanaman padi varietas Ciherang (umur 40 hari setelah tanam) yang ditanam dalam ember plastik (volume 1 liter) digunakan untuk uji kemampuan prodigiosin mengendalikan serangan Xanthomonas oryzae pv. oryzae. Daun padi dipotong pada jarak 5 cm dari ujung atas daun dan diinkokulasi dengan biakan bakteri dengan cara disemprot. Setiap satu rumpun padi (5 batang per rumpun) disemprot dengan 1 ml biakan bakteri yang berumur 48 jam setelah inkubasi. Strain X. oryzae pv. oryzae yang diinokulasikan, yaitu strain 1B yang mempunyai tingkat virulensi yang lebih tinggi. Prodigiosin dengan konsentrasi 100- 150µg disemprotkan sebanyak 1 ml setelah suspensi bakteri kering pada tanaman. Sebagai kontrol digunakan tanaman tanpa semprot prodigiosin. Pengamatan intensitas penyakit dilakukan setiap 3 hari sekali selama 2 minggu
.
HASIL
Peremajaan Isolat
Bakteri merah ditumbuhkan pada media
Lurial Bertani Broth (LB) dan diinkubasi pada suhu ruang selama 2-3 hari dengan metode kuadran untuk mendapatkan koloni tunggal (Gambar 1a). Koloni tunggal disubkultur pada medium LB agar miring dan diremajakan setiap 2 minggu sekali atau sesuai dengan kebutuhan (Gambar 1b).
Gambar 1 Biakan bakteri merah (a) pada media LB agar, (b) pada media LB agar miring.
Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
Hasil uji efikasi membuktikan bahwa bakteri merah efektif mengendalikan wbc.
Tingkat mortalitas wbc mencapai 65.6-78.2% pada aplikasi bakteri merah dengan konsentrasi antara 106 dan 107 sel/ml (Tabel 1). Kematian wbc mulai terjadi pada 4 hari setelah inokulasi (hsi), dan meningkat tajam pada 7 hsi (Gambar 2). Serangga yang mati ditujukkan oleh warna merah pada tubuhnya. Hasil reisolasi memastikan bahwa bakteri yang menginfeksi dan menyebabkan kematian wbc adalah bakteri merah. Hal ini menunjukkan bahwa bakteri merah bersifat patogenik terhadap wbc.
Tabel 1 Efektivitas bakteri merah terhadap wbc setelah 10 hari aplikasi
Konsentrasi
(sel/ml) Mortalitas (%)
108 78.2
107 72.1
106 65.6
105 44.7
104 12.2
0 0
Gambar 2 Grafik efektivitas bakteri merah terhadap wbc.
Karakteristik Fenotipe
Bakteri merah adalah bakteri gram negatif yang bersifat motil. Koloninya berbentuk cembung dan berukuran 1-3 mm pada biakan yang berumur 24 jam setelah inkubasi. Ukuran koloni menjadi lebih besar jika diinkubasikan lebih lama karena sifat
dilakukan 24 - 48 jam setelah inkubasi pada suhu ruangan (27°C).
Uji Efikasi Prodigiosin terhadap Penyebab Penyakit Kresek pada Tanaman Padi (Xanthomonas Oryzae pv. oryzae)
Tanaman padi varietas Ciherang (umur 40 hari setelah tanam) yang ditanam dalam ember plastik (volume 1 liter) digunakan untuk uji kemampuan prodigiosin mengendalikan serangan Xanthomonas oryzae pv. oryzae. Daun padi dipotong pada jarak 5 cm dari ujung atas daun dan diinkokulasi dengan biakan bakteri dengan cara disemprot. Setiap satu rumpun padi (5 batang per rumpun) disemprot dengan 1 ml biakan bakteri yang berumur 48 jam setelah inkubasi. Strain X. oryzae pv. oryzae yang diinokulasikan, yaitu strain 1B yang mempunyai tingkat virulensi yang lebih tinggi. Prodigiosin dengan konsentrasi 100- 150µg disemprotkan sebanyak 1 ml setelah suspensi bakteri kering pada tanaman. Sebagai kontrol digunakan tanaman tanpa semprot prodigiosin. Pengamatan intensitas penyakit dilakukan setiap 3 hari sekali selama 2 minggu
.
HASIL
Peremajaan Isolat
Bakteri merah ditumbuhkan pada media
Lurial Bertani Broth (LB) dan diinkubasi pada suhu ruang selama 2-3 hari dengan metode kuadran untuk mendapatkan koloni tunggal (Gambar 1a). Koloni tunggal disubkultur pada medium LB agar miring dan diremajakan setiap 2 minggu sekali atau sesuai dengan kebutuhan (Gambar 1b).
Gambar 1 Biakan bakteri merah (a) pada media LB agar, (b) pada media LB agar miring.
Patogenisitas Bakteri Merah terhadap Wereng Batang Cokelat
Hasil uji efikasi membuktikan bahwa bakteri merah efektif mengendalikan wbc.
Tingkat mortalitas wbc mencapai 65.6-78.2% pada aplikasi bakteri merah dengan konsentrasi antara 106 dan 107 sel/ml (Tabel 1). Kematian wbc mulai terjadi pada 4 hari setelah inokulasi (hsi), dan meningkat tajam pada 7 hsi (Gambar 2). Serangga yang mati ditujukkan oleh warna merah pada tubuhnya. Hasil reisolasi memastikan bahwa bakteri yang menginfeksi dan menyebabkan kematian wbc adalah bakteri merah. Hal ini menunjukkan bahwa bakteri merah bersifat patogenik terhadap wbc.
Tabel 1 Efektivitas bakteri merah terhadap wbc setelah 10 hari aplikasi
Konsentrasi
(sel/ml) Mortalitas (%)
108 78.2
107 72.1
106 65.6
105 44.7
104 12.2
0 0
Gambar 2 Grafik efektivitas bakteri merah terhadap wbc.
Karakteristik Fenotipe
Bakteri merah adalah bakteri gram negatif yang bersifat motil. Koloninya berbentuk cembung dan berukuran 1-3 mm pada biakan yang berumur 24 jam setelah inkubasi. Ukuran koloni menjadi lebih besar jika diinkubasikan lebih lama karena sifat
motilitasnya. Warna merah koloni sudah mulai terlihat pada biakan yang berumur 24 jam, dan semakin merah setelah diinkubasikan lebih 48 jam. Namun sering juga dijumpai koloni bakteri warna putih, terutama koloni tunggal yang terangsing jauh dari koloni lain (quorum sensing). Bakteri merah sensitif terhadap streptomisin serta tahan dengan kloramfenikol, kasugamisin dan rimfamisin (Tabel 2). Meskipun bakteri merah tahan terhadap kloramfenikol tetapi pigmentasinya terhambat, bahkan bakteri tidak mampu menghasilkan pigmen merah pada konsentrasi kloramfenikol 1 g/ml.
Tabel 2 Sensitivitas bakteri merah terhadap antibiotik
Antibiotik Kosentrasi ( g/ml) 25 50 Kloramfenikol R R Kasugamisin R R Rimfamisin R R Streptomisin S S
Ampisilin R R
Karakteristik fenotipe bakteri merah berdasarkan pengujian dengan Biolog GN MicroplateTM disajikan dalam lampiran 1. Bakteri merah menunjukkan 94 karakter positif dari 95 pengujian yang dilakukan. Karakter negatif hanya terdapat pada - keto butyric acid. Bakteri dapat memfermentasikan semua jenis karbohidrat yang meliputi fructose, L-fucose, D-galactose, Gentiobiose, m-inositol, - Maltose, Lactulose, D-lactose, D-mannitol, D-Manose, D-melibiose dan -D-glucose, serta semua jenis asam amino, termasuk L-ornithin. Berdasarkan analisis dengan Biolog GN database, bakteri merah termasuk da