ABSTRAK
IRMA CLORINDA. Pengklonan Kandidat Gen Resisten Terhadap Selenium Dari
Isolat Bakteri Termofilik (
sp20k). Dibimbing oleh I MADE ARTIKA
dan NOVIK NURHIDAYAT.
Bakteri termofilik yang resisten terhadap selenium memiliki mekanisme
tertentu sehingga dapat mengakumulasi selenium yang toksik menjadi tidak toksik
bagi bakteri itu sendiri. Mekanisme kerja tersebut diduga dengan adanya gen yang
berfungsi sebagai penyandi resisten terhadap Se (Selenium). Namun gen
penyandi resisten terhadap Se sendiri belum dibuktikan secara ilmiah
keberadaannya. Oleh karena itu perlu dilakukan penelitian terhadap bakteri
termofilik untuk mendapatkan isolat bakteri termofilik yang memiliki gen
penyandi resisten Se dan mengklon gen resisten selenium ke dalam sel bakteri
ABSTRACT
IRMA CLORINDA. Cloning Selenium Candidate Resistant Genes From
Thermophilic Bacteria (
sp20k). Under the direction of I MADE
ARTIKA and NOVIK NURHIDAYAT.
2
PENDAHULUAN
Mikroorganisme yang tumbuh di lingkungan ekstrim seperti kawah gunung berapi ataupun sumber air panas memiliki cara pertahanan diri agar dapat bertahan hidup. Cara yang dilakukan mikroorganisme antara lain dengan menahan masuknya senyawa anorganik toksik seperti selenium atau dengan mekanisme resistensi dalam sel mikroorganisme dengan mengubah senyawa toksik menjadi tidak toksik.
Bakteri yang hidup di tempat ekstrim seperti bakteri termofilik (tahan suhu tinggi) memiliki mekanisme resistensi senyawa logam berat seperti selenium toksik sehingga bakteri termofilik tetap dapat bertahan pada lingkungan mengandung selenium (Rosen 1996). Mekanisme resistensi disebabkan adanya gen yang menyandikan protein sehingga dapat berikatan dengan senyawa selenium dan diubah menjadi kompleks seleniumBprotein yang tidak toksik. Kompleks seleniumBprotein dapat digunakan sebagai komponen sisi aktif dari enzim glutation peroksidase. Enzim ini berperan sebagai enzim antioksidan dalam melindungi sel dari radikal bebas.
Radikal bebas adalah suatu molekul oksigen dengan atom pada orbit terluarnya memiliki elektron tidak berpasangan. Akibatnya radikal bebas selalu mencari pasangan elektron, tetapi dengan cara radikal yaitu mengambil elektron dari molekul lain, maka itu disebut & '( ! )
(ROS). Radikal bebas dalam jumlah berlebihan di dalam tubuh akan sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein, dan jaringan lemak. Radikal bebas dapat terbentuk akibat produk sampingan hasil metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernapasan (Dalimarta & Soedibyo 1998). Tubuh manusia meskipun mempunyai mekanisme antioksidan atau antiradikal bebas secara endogenik tetapi bila jumlah radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan dari luar tubuh. Senyawa antioksidan ini akan memberikan satu atau lebih elektronnya pada radikal bebas. Jika tidak, radikalBradikal bebas dapat menyebabkan kerusakan sel dan menimbulkan kanker.
Sejumlah penelitian menggunakan biakan sel kanker telah menunjukkan bahwa apoptosis adalah mekanisme utama sehubungan dengan efek antikanker dari selenium. Studi awal mengenai apoptosis
yang diinduksi selenium dilakukan menggunakan selenit dan menunjukkan adanya kerusakan oksidatif DNA sedangkan studi menggunakan selenium termetilasi membuktikan bahwa efek apoptosis dari selenium tidak berhubungan dengan efek toksiknya. HasilBhasil penelitian menunjukan bahwa struktur kimia senyawa selenium dan dosis pemberian merupakan penentu aktivitas biologiknya baik sebagai nutrien utama maupun senyawa bersifat kemopreventif untuk kanker, atau sebagai zat toksik (Sari 2007) .
Belum diteliti mengenai adanya kemungkinan gen resistensi selenium dari bakteri termofilik. Keberadaan gen resistensi selenium perlu diketahui maka dilakukan kloning gen. DNA bakteri termofilik dipotongBpotong secara spesifik dan diharapkan mewakili gen resistensi selenium. Selanjutnya fragmen DNA disisipkamkan ke dalam vektor sehingga menghasilkan vektor rekombinan. Hasil transformasi ditransfeksi ke dalam sel inang yaitu dan ditumbuhkan ke dalam media yang mengandung antibotik dan IPTG XBgal sehingga dapat diidentifikasi sel rekombinan hasil transformasi (Lampiran 1).
Penelitian ini bertujuan untuk mendapatkan isolat bakteri termofilik yang memiliki gen penyandi resistensi selenium (Se) dari sumber air panas dan mengklon gen resistensi selenium ke dalam sel bakteri sehingga dapat diperbanyak. Manfaat dilakukannya penelitian ini adalah diperolehnya informasi ilmiah tentang gen penyandi resistensi selenium. Hipotesis penelitian ini adalah gen resistensi selenium dapat diidentifikasi, diisolasi, dan diklon ke dalam sel
TINJAUAN PUSTAKA
Bakteri TermofilikBakteri termofilik merupakan salah satu bakteri yang unik karena dapat beradaptasi dengan kondisi lingkungan bersuhu tinggi. Kisaran suhu pertumbuhan bakteri yang ekstrim dibagi tiga yaitu termofilik 45B65 ºC, ekstrim termofil 65B85 ºC, dan hipertermofil 85B110 ºC. Mikroorganisme ini dapat dengan mudah ditemukan di daerah dengan aktivitas geotermal, seperti daerah pegunungan berapi, sumber air panas, dan juga tempata cadangan minyak bumi atau batubara (Van den Burg 2003).
2
PENDAHULUAN
Mikroorganisme yang tumbuh di lingkungan ekstrim seperti kawah gunung berapi ataupun sumber air panas memiliki cara pertahanan diri agar dapat bertahan hidup. Cara yang dilakukan mikroorganisme antara lain dengan menahan masuknya senyawa anorganik toksik seperti selenium atau dengan mekanisme resistensi dalam sel mikroorganisme dengan mengubah senyawa toksik menjadi tidak toksik.
Bakteri yang hidup di tempat ekstrim seperti bakteri termofilik (tahan suhu tinggi) memiliki mekanisme resistensi senyawa logam berat seperti selenium toksik sehingga bakteri termofilik tetap dapat bertahan pada lingkungan mengandung selenium (Rosen 1996). Mekanisme resistensi disebabkan adanya gen yang menyandikan protein sehingga dapat berikatan dengan senyawa selenium dan diubah menjadi kompleks seleniumBprotein yang tidak toksik. Kompleks seleniumBprotein dapat digunakan sebagai komponen sisi aktif dari enzim glutation peroksidase. Enzim ini berperan sebagai enzim antioksidan dalam melindungi sel dari radikal bebas.
Radikal bebas adalah suatu molekul oksigen dengan atom pada orbit terluarnya memiliki elektron tidak berpasangan. Akibatnya radikal bebas selalu mencari pasangan elektron, tetapi dengan cara radikal yaitu mengambil elektron dari molekul lain, maka itu disebut & '( ! )
(ROS). Radikal bebas dalam jumlah berlebihan di dalam tubuh akan sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein, dan jaringan lemak. Radikal bebas dapat terbentuk akibat produk sampingan hasil metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernapasan (Dalimarta & Soedibyo 1998). Tubuh manusia meskipun mempunyai mekanisme antioksidan atau antiradikal bebas secara endogenik tetapi bila jumlah radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan dari luar tubuh. Senyawa antioksidan ini akan memberikan satu atau lebih elektronnya pada radikal bebas. Jika tidak, radikalBradikal bebas dapat menyebabkan kerusakan sel dan menimbulkan kanker.
Sejumlah penelitian menggunakan biakan sel kanker telah menunjukkan bahwa apoptosis adalah mekanisme utama sehubungan dengan efek antikanker dari selenium. Studi awal mengenai apoptosis
yang diinduksi selenium dilakukan menggunakan selenit dan menunjukkan adanya kerusakan oksidatif DNA sedangkan studi menggunakan selenium termetilasi membuktikan bahwa efek apoptosis dari selenium tidak berhubungan dengan efek toksiknya. HasilBhasil penelitian menunjukan bahwa struktur kimia senyawa selenium dan dosis pemberian merupakan penentu aktivitas biologiknya baik sebagai nutrien utama maupun senyawa bersifat kemopreventif untuk kanker, atau sebagai zat toksik (Sari 2007) .
Belum diteliti mengenai adanya kemungkinan gen resistensi selenium dari bakteri termofilik. Keberadaan gen resistensi selenium perlu diketahui maka dilakukan kloning gen. DNA bakteri termofilik dipotongBpotong secara spesifik dan diharapkan mewakili gen resistensi selenium. Selanjutnya fragmen DNA disisipkamkan ke dalam vektor sehingga menghasilkan vektor rekombinan. Hasil transformasi ditransfeksi ke dalam sel inang yaitu dan ditumbuhkan ke dalam media yang mengandung antibotik dan IPTG XBgal sehingga dapat diidentifikasi sel rekombinan hasil transformasi (Lampiran 1).
Penelitian ini bertujuan untuk mendapatkan isolat bakteri termofilik yang memiliki gen penyandi resistensi selenium (Se) dari sumber air panas dan mengklon gen resistensi selenium ke dalam sel bakteri sehingga dapat diperbanyak. Manfaat dilakukannya penelitian ini adalah diperolehnya informasi ilmiah tentang gen penyandi resistensi selenium. Hipotesis penelitian ini adalah gen resistensi selenium dapat diidentifikasi, diisolasi, dan diklon ke dalam sel
TINJAUAN PUSTAKA
Bakteri TermofilikBakteri termofilik merupakan salah satu bakteri yang unik karena dapat beradaptasi dengan kondisi lingkungan bersuhu tinggi. Kisaran suhu pertumbuhan bakteri yang ekstrim dibagi tiga yaitu termofilik 45B65 ºC, ekstrim termofil 65B85 ºC, dan hipertermofil 85B110 ºC. Mikroorganisme ini dapat dengan mudah ditemukan di daerah dengan aktivitas geotermal, seperti daerah pegunungan berapi, sumber air panas, dan juga tempata cadangan minyak bumi atau batubara (Van den Burg 2003).
3
yang mampu berkembang pada suhu 72 ºC (Prasetyo 2006). Bakteri ini ditemukan pada tanah, debu, kotoran badan, tempat pembuangan limbah, dan lumpur sungai. Varietas bakteri termofil di tanah yang tumbuh subur pada temperatur tinggi tetapi tidak dapat tumbuh pada suhu kamar. Bakteri ini ditemukan di gurun pasir Sahara, tetapi tidak ditemukan di tanah pada hutan yang dingin (subtropis). Tanah perkebunan yang mengandung pupuk terdapat 1B10% bakteri termofilik (Prasetyo 2006), sedangkan tanah lapang yang luas hanya mengandung 0.25% atau kurang. Tanah yang tidak ditumbuhi tanaman kemungkinan sama sekali tidak terdapat bakteri termofilik.
Mikroorganisme mesofilik dan termofilik yang tersebar luas di alam umumnya terdapat pada bahanBbahan makanan, sampah dan pupuk. Temperatur optimum mesofilik untuk melakukan reproduksi meliputi suhu pada hewan berdarah panas yang mengeksresikan bakteri mesofilik dalam jumlah yang sangat banyak. Bakteri termofilik mampu bertahan dan berkembang biak pada suhu tinggi karena tiga faktor yaitu (1) kandungan enzim dan protein lainnya lebih stabil dan tahan terhadap panas daripada protein bakteri mesofilik yang berfungsi secara optimal pada suhu tinggi, (2) organelBorganel yang menyintesis protein (ribosom dan perangkat lainnya) stabil terhadap panas, dan (3) membran lipid sel termofil kaya akan asam lemak jenuh sehingga membentuk ikatan hidrofobik yang jauh lebih kuat (Brock 1986).
Keanekaragaman bakteri termofilik memberikan gambaran potensi yang dapat dimanfaatkan untuk berbagai tujuan. Bakteri termofilik dipelajari dan diteliti secara intensif karena alasan pengembangan penelitian dasar dan aplikasi bioteknologi. Bakteri termofilik berpotensi sebagai sumber enzim khas yang dapat digunakan pada proses pengolahan limbah maupun pelapukan mineral (Brock 1986). EnzimBenzim tersebut mampu bertahan dan aktif pada temperatur tinggi. Sifat seperti ini sangat dibutuhkan oleh industriBindustri berbasis enzim.
Pemahaman terhadap perbedaan perilaku bakteri antara yang hidup di lingkungan alami dengan lingkungan buatan (kultur laboratorium) dapat membantu untuk mengenali perbedaan perilaku hidupnya. Lingkungan ekstrim sangat disukai untuk studi ekologi karena keragaman spesies genetik yang hidup di dalamnya. Pada sumber air panas yang asam, bakteri ditemukan terutama hidup bebas di air, sedangkan pada
sumber air panas netral bakteri melekat pada dinding bersilika. BahanBbahan yang larut di dalam sumber air panas biasanya hidrogen sulfida, karbondioksida, senyawa karbon organik berberat molekul rendah seperti metana, hidrogen amonia, unsurBunsur mikro, dan anionBanion seperti klorida dan bikarbonat (Prasetyo 2006).
sp
merupakan genus bakteri yang mewakili lebih dari 25 jenis isolat GramB negatif dari berbagai daerah termofilik buatan manusia dan alam di seluruh dunia. Bakteri gram negatif dilihat dari dinding selnya. Dari hasil pengujian karakteristik bakteri dengan menggunakan pewarnaan gram, bakteri ini membentuk warna merah dari pewarna safranin. Hal ini disebabkan oleh kandungan lipid yang lebih tinggi pada dinding selnya dan lipid umumnya larut dalam alkohol. Larutnya lipid oleh pemucat (alkohol) diduga memperbesar poriBpori dinding sel dan inilah yang menyebabkan proses pemucatan pada selBsel gram negatif berlangsung cepat. Bakteri gram negatif yang telah kehilangan kompleks warna ungu dari kristal iodium akan terwarnai oleh safranin sehingga akan berwarna merah (Beishir 1991) (Gambar 1).
dari namanya dapat diketahui memiliki bentuk yang berarti batang. Oragnisme ini cenderung membentuk koloni berantai dan memiliki pH optimum 7.0 juga temperatur optimum 55B65ºC. Urutan parsial 16S rRNA dari organisme ini memiliki 97% kemiripan dengan
, salah satu kerabat terdekat genetiknya (Ren . 2009). Namun, uniknya di antara semua anggota ini,ada genus menghasilkan zat organik yang mudah menguap yang memiliki aktivitas antibiotik ampuh. Beberapa komponen yang lebih penting yaitu benzaldehida, asam asetat, butanal, asam 3B metilBbutanoat, asam 2BmetilBbutanoat, asam propanoat, dan asetil benzena.
4
Uji pada pengamatan organisme seperti
* ! ! , +
, + dan
menghasilkan total penghambatan pertumbuhan pada paparan 48 jam untuk sel tertentu dan membunuh pada 72 jam paparan pada konsentrasi yang lebih tinggi pada sel bakteri. Campuran sintetis dari senyawa atsiri yang tersedia, pada rasio yang terjadi di sp ini menirukan bioaktivitas organisme tersebut (Ren . 2009)
.
Selenium
Selenium (Se) merupakan elemen mikroesensial bagi manusia dan hewan. Selenium dapat ditemukan dalam bentuk organik maupun anorganik. Bentuk anorganik Se ditemukan sebagai selenat (SeO42B), selenit
(SeO43B) , dan selenium oksida (SeO2),
sedangkan bentuk organik Se berikatan dengan asam amino pembentuk protein menjadi selenometionin atau selenosistein (Dilaga 1992). Se berperan penting sebagai komponen pembentuk sisi aktif, seleno group (BSeH) dari Glutation Peroksidase (GPx), Thioredoksin Reduktase (TR) dan selenoenzim lain. Efek pencegahan kanker sangat nyata terdapat pada garam Se anorganik, seleno asam amino, dan berbagai organo selenium sintetik (Lobinski 2000). Sejak tahun 1980 banyak dilaporkan buktiBbukti bahwa asupan Se yang ideal berupa selenit, selenat dan selenometionin dalam tubuh dapat mencegah pertumbuhan sel kanker (Spallholz 2001).
Se merupakan unsur spesifik yang bersifat toksik pada tingkat asupan tinggi dan menyebabkan gejala defisiensi bila asupan terlalu rendah. Tiga penyakit spesifik yang berkaitan dengan defisiensi Se yaitu, # - (mengakibatkan turunnya fungsi hati dan jantung pada penderita anakBanak), Kashin Beck Disease (mengakibatkan osteoarthropaty), Myxedematous Endemic Cretinism (mengakibatkan lemah mental) (Cassaret 1986). Jumlah asupan Se disarankan rataBrata sebesar 40 Mg per hari untuk dewasa (Combs dalam Dummont 2006).
Kelebihan asupan Se akan berdampak buruk pada kesehatan yaitu menimbulkan kondisi yang disebut selenosis. Selenosis akan timbul pada penduduk di daerahBdaerah yang mengandung kadar Se tinggi dalam tanah (lebih dari 84 mg/kg) dan juga bila asupan per hari melebihi 400 Mg Se. GejalaBgejala selenosis diantaranya yaitu kerontokan
rambut, kuku lepas, bercakBbercak putih pada kuku, nafas bau bawang putih, kelelahan, iritabilitas, dan kerusakan syaraf ringan (Dumont 2006).
Genom Bakteri
Genom bakteri terdiri dari DNA kromosom dan DNA ekstrakromosom atau plasmid. Bakteri tidak mempunyai pemisahan antara inti dan sitoplasma, maka kromosom dan plasmid keduaBduanya terdapat dalam satu ruang sitoplasma. Plasmid mempunyai ukuran yang relatif sangat kecil dibandingkan dengan kromosom (Jusuf 2001).
DNA Kromosom. Selama hampir dua dekade diakui bahwa bakteri mempunyai satu kromosom yang disusun oleh satu molekul DNA berbentuk sirkular. Pada akhir dekade delapan puluhan berbagai hasil riset membuktikan adanya bakteri yang mempunyai kromosom linier, dan adanya bakteri yang mempunyai dua kromosom. Bakteri sebagian besar ditemukan mempunyai satu kromosom yang berbentuk sirkular (Jusuf 2001). Perkembangan teknik molekular telah memungkinkan untuk pemisahan molekul atau fragmen DNA berdasarkan berat molekul atau panjang rangkaian nukleotidanya. Teknik ini telah berhasil menetapkan bentuk serta ukuran kromosom berbagai spesies bakteri (Jusuf 2001).
Kromosom bakteri mempunyai ukuran sekitar 1 000 kali panjang selnya. Sebagai contoh yang panjang selnya sekitar 1 sampai 2 Mm, mempunyai kromosom berukuran sekitar 1360 Mm. Kromosom akan dikemas menjadi bentuk yang kompak yang disebut nukleoid, dan akan menempati sekitar 10 persen dari volume sel bakteri. Studi pada menunjukkan bahwa kromosom sirkular mengalami pelipatan membentuk sejumlah simpul atau domain lipatan. Setiap simpul mengandung sekitar 40 kilo (40 000) pasang basa, dan di dalam setiap simpul terjadi pembentukan superheliks negatif. Topoisomerase akan sangat berperan dalam pembentukan superkoil ini (Jusuf 2001).
5
Sifat plasmid yang terpenting yaitu adanya daerah yang berfungsi sebagai origin replikasi (titik ORI) yang memungkinkan plasmid memperbanyak diri tanpa bergantung pada proses replikasi DNA kromosom. Segmen DNA asing yang diselipkan pada plasmid maka segmen DNA asing tersebut juga turut diperbanyak pada saat plasmid memperbanyak diri sehingga plasmid dapat digunakan sebagai vektor untuk pengklonan gen. Keberadaan plasmid dalam sel tidak mutlak karena suatu sel dapat kehilangan plasmid tanpa mengganggu kemampuan hidupnya; sedangkan kromosom keberadaannya mutlak karena sel tidak akan hidup tanpa kromosom (Jusuf 2001).
Isolasi DNA
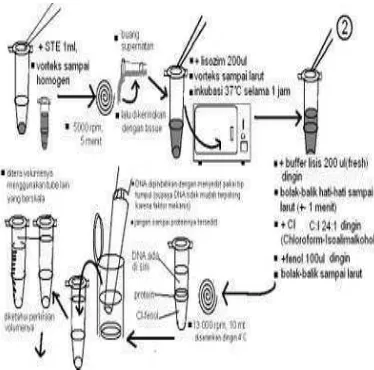
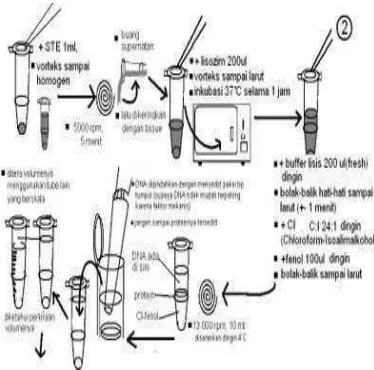
Penggunaan DNA untuk keperluan analisis atau manipulasi biasanya memerlukan proses isolasi dan pemurnian. DNA diperoleh dari sel yang sangat halus (Wilson &Walker 2000). Prosedur umum isolasi DNA dibagi menjadi tiga bagian yaitu; (1) merusak membran sel dan melepas DNA ke dalam media yang terlarut serta terlindung dari degradasi, (2) pemisahan kompleks proteinBDNA, dan (3) pemisahan DNA dari komponen seluler terlarut lainnya.
Prosedur isolasi yang dideksripsikan adalah penggunaan enzim lisozim untuk merusak membran sel. Lisozim mengkatalisis hidrolisis ikatan glikosidik dalam dinding sel karbohidrat, yang menyebabkan kerusakan membran luar dan melepas DNA dan komponen seluler lainnya. Media untuk larutan DNA adalah bufer, larutan garam yang mengandung EDTA. Keberadaan EDTA yaitu untuk mengkelat Mg2+ yang dibutuhkan oleh enzim pendegradasi DNA (Wilson &Walker 2000). DNA bersifat ionik, lebih larut, lebih stabil dalam larutan garam daripada air destilasi. Deterjen juga terkadang digunakan pada tahap ini untuk merusak interaksi ionik antara histon yang bermuatan positif dan tulang belakang DNA yang bermuatan negatif. Deterjen yang digunakan adalah sodium dedoxil sulfat (SDS) yang bersifat anionik. SDS akan mengikat protein dan memberikan karakter anionik yang ekstensif. Selain itu, SDS juga sebagai pendenaturasi deoksiribonuklease dan protein lainnya (Gambar 2).
Sebelum DNA diendapkan, larutan harus dihilangkan dari protein (deproteinasi). Hal ini dilakukan dengan penambahan kloroform/isoamilalkohol dan diikuti dengan
sentrifugasi. Setelah sentrifugasi, tiga lapisan dihasilkan. Fase cairan paling atas adalah fase yang mengandung asam nukleat, fase paling bawah adalah fase larutan organik, sedangkan lapisan tengah yang merupakan perbatasan antara fase cairan dan fase organik adalah protein yang terdenaturasi. Fase paling atas dipisahkan dan DNA diendapkan dengan penambahan etanol (Boyer& Rodney 1986) (Gambar 3).
Gambar 2 Skema pelepasan DNA dari sel.
Gambar 3 Skema pemisahan dan pemekatan DNA.
Pengklonan DNA
6
menjadi dasar pengembangan penelitian genetika seperti; pemetaan gen dan analisis posisi gen pada kromosom. Hasil penelitian telah berkembang baik dengan diketahuinya DNA sebagai material genetik, strukturnya, kodeBkode genetik serta proses transkripsi dan translasi yang dapat dijabarkan. Suatu penelitian yang merupakan revolusi dalam biologi modern adalah ditemukannya metode teknologi DNA rekombinasi atau rekayasa genetika yang inti prosesnya adalah pengklonan gen yaitu suatu prosedur untuk memperoleh replika dari sel atau organisme tunggal (Mizawarti 2003).
Pada prinsipnya pengklonan DNA adalah penggandaan jumlah DNA rekombinan melalui perkembangbiakan sel bakteri. Hal ini dilakukan dengan memasukkan DNA rekombinan yang dihasilkan dari penggabungan tersebut ke dalam sel . Selanjutnya sel ini diinkubasi pada suhu optimal sehingga sel dapat berkembang biak secara eksponensial (Muladno 2002). Pemasukan molekul DNA ke dalam sel inang di sebut transformasi. Sel yang digunakan dalam proses transformasi ini biasanya disebut dengan sel kompeten. Sel dibuat menjadi kompeten melalui perlakuan dengan garam kalsium klorida (CaCl2) (Gambar 4).
Dalam proses transformasi, sel kompeten yang dicampur dengan molekul DNA hasil penggabungan akan mengalami tiga kemungkinan, yaitu: (1) sel kompeten tidak kemasukan molekul DNA apapun (2) sel kompeten kemasukan DNA vektor yang tidak membawa gen X, dan (3) sel kompeten kemasukan DNA vektor yang membawa gen X (yaitu DNA rekombinan) (Muladno 2002). Ketiga kemungkinan dapat terjadi pada sel kompeten dapat diketahui. Tiga cawan yang berisi media padat disiapkan, yang masingB masing dilabeli A,B, dan C. Cawan A hanya berisi media padat, cawan B berisi media padat yang mengandung antibiotik, cawan C berisi media padat yang mengandung antibiotik, XBgal dan IPTG. MasingBmasing cawan digunakan untuk menumbuhkan sel kompeten hasil transformasi. Ketika sel ditumbuhkan pada ketiga cawan tersebut, jumlah koloni terbanyak didapat pada cawan A, karena semua sel kompeten dapat hidup semua. Pada cawan B, jumlah koloni jauh lebih sedikit daripada jumlah koloni pada cawan A karena semua sel kompeten kosong akan mati. Hanya koloni sel pembawa DNA plasmid yang dapat hidup karena pada plasmid mengandung gen” tahan terhadap antibiotik”. Pada cawan C, jumlah koloni
relatif sama dengan jumlah koloni pada cawan B tetapi ada dua macam warna koloni , yaitu putih dan biru. Adanya perbedaan warna koloni ini terjadi akibat adanya zat kimia XB gal dan IPTG yang bereaksi dengan produk gen Lac Z pada plasmid. Warna putih pada koloni diakibatkan adanya kerusakan pada sel kompeten DNA rekombinan (DNA plasmid + gen X). Adapun koloni berwarna biru berarti sel kompeten yang tumbuh di cawan ini membawa DNA plasmid saja (tidak disisipi gen X) (Muladno 2002).
Secara teoritis, koloni berwarna putih dapat dipastikan merupakan sel yang membawa DNA rekombinan. Langkah berikutnya meliputi isolasi DNA rekombinan dari sel
, pemotongan DNA dengan enzim restriksi yang digunakan dalam pembuatan DNA rekombinan, pemisahan DNA melalui gel elektroforesis dan visualisasi DNA (Muladno 2002).
Gambar 4 Skema kloning DNA ke dalam plasmid.
Elektroforesis Gel Agarosa
7
spektrometri massa, PCR ("
), pengklonan, sekuensing DNA, atau
. ! yang merupakan metodeB metode karakterisasi lebih lanjut (Wilson&Walker 2000).
Prinsip teknik elektroforesis gel agarosa adalah molekul DNA yang bermuatan negatif di dalam medan listrik akan bermigrasi melalui matriks gel menuju kutub positif (anode). Makin besar ukuran molekulnya, makin rendah laju migrasinya. Berat molekul suatu fragmen DNA dapat diperkirakan dengan membandingkan laju migrasinya dengan laju migrasi fragmenBfragmen molekul DNA standar (DNA marker) yang telah diketahui ukurannya (Wilson&Walker 2000). Pemisahan DNA atau RNA dilakukan dengan menggunakan elektroforesis gel agarosa. Agarosa berasal dari ekstrak rumput laut yang dimurnikan berupa polimer linier yang mengandung residu DB dan LB galaktosa yang digabung dengan ikatan α (1→ 3) dan β (1→ 4) glikosidik. Residu LBgalaktosa mempunyai jembatan anhidro antara posisi ketiga dan keenam. Rantai agarosa membentuk seratBserat helik yang bergabung menjadi struktur superkoil dengan jariBjari 20B 30 nm (Sambrook 1989). Konsentrasi gel agarosa yang digunakan dalam elektroforesis bervariasi antara 0.7%B1.5%. Konsentrasi gel 0.8%B1% sangat baik untuk memisahkan fragmen DNA atau RNA. Konsentrasi gel kurang dari 0.5% dapat meningkatkan daya pisah elektroforesis namun sangat rapuh dan sulit ditangani. Contoh sampel yang terdapat pada Gambar 1. Ethidium bromida dapat ditambahkan ke dalam suspensi DNA atau RNA untuk tujuan visualisasi hasil elektroforesis (Sambrook
1989). Ethidium Bromida (EtBr) adalah molekul planar siklik yang berikatan antara pasangan basa RNA yang tertumpuk. EtBr mengikat RNA dengan sedikit atau tidak pada sekuens pilihan. Pada kejenuhan larutan berkekuatan ionik tinggi, kiraBkira satu molekul ethidium disisipkan per 2.5 bp. Setelah penyisipan ke dalam heliks, pewarna terletak tegak lurus ke sumbu helikal dan membuat kontak van der waals dengan pasangan basa di atas dan di bawah (Sambrook 1989). Ethidium bromida dapat digunakan untuk mendeteksi asam nukleat baik yang berikatan tunggal maupun ganda.
Bufer yang dapat digunakan untuk elektroforesis adalah bufer TrisBAsetat EDTA (TAE). Jenis bufer lainnya yang dapat digunakan yaitu; TBE (TrisBBorat EDTA)
dan TPE (TrisBFosfat EDTA). Bufer elektroforesis biasanya dibuat sebagai larutan berkonsentrasi dan disimpan pada suhu ruang. TrisBAcetate EDTA (TAE) memiliki kapasitas bufer paling rendah dari bufer elektroforesis lainnya dan akan menjadi habis jika elektroforesis dilakukan untuk periode waktu yang diperpanjang(Sambrook 1989). Sampel sebelum dimasukkan ke dalam sumur gel dihomogenisasi dengan ! . !
. . ! dicampur dengan sampel sebelum dimasukkan ke dalam sumur gel. Bufer ini memiliki tiga tujuan yaitu; untuk meningkatkan densitas sampel supaya memastikan bahwa RNA tenggelam ke dalam sumur gel, menambahkan warna pada sampel dengan demikian menyederhanakan proses pemasukkan, dan menahan pencelup (EtBr) dalam medan listrik sehingga bergerak ke arah anoda pada tingkat yang telah ditentukan (Sambrook 1989).
BAHAN DAN METODE
Bahan dan AlatBahanBbahan yang digunakan dalam penelitian ini adalah bakteri termofilik sp20k dari sumber air panas di Pegunungan Kerinci, vektor plasmid, enzim ligase, enzim lisozim, enzim restriksi, bufer restriksi, etanol absolut, etanol 75%, gel agarosa, bufer TAE 1X, EtBr, media heterotrof cair, es, kalsium klorida dan akuades.
AlatBalat yang digunakan antara lain ! " " " # , alatBalat gelas, sudip, spatula, jarum ose, mikropipet, tip, autoklaf, inkubator, oven, neraca analitik, sentrifus /01/ dengan jariBjari rotor 4 cm+tabung Eppendorf, dan vorteks.
Metode
Produksi dan Peremajaan Bakteri Termofilik
Pembuatan Media Tumbuh. Media heterotrof padat dibuat dengan komposisi 3.18 gram , 0.78 gram , 1 gram NaCl, 0.5 gram K2HPO4, 3 gram agar,
7
spektrometri massa, PCR ("
), pengklonan, sekuensing DNA, atau
. ! yang merupakan metodeB metode karakterisasi lebih lanjut (Wilson&Walker 2000).
Prinsip teknik elektroforesis gel agarosa adalah molekul DNA yang bermuatan negatif di dalam medan listrik akan bermigrasi melalui matriks gel menuju kutub positif (anode). Makin besar ukuran molekulnya, makin rendah laju migrasinya. Berat molekul suatu fragmen DNA dapat diperkirakan dengan membandingkan laju migrasinya dengan laju migrasi fragmenBfragmen molekul DNA standar (DNA marker) yang telah diketahui ukurannya (Wilson&Walker 2000). Pemisahan DNA atau RNA dilakukan dengan menggunakan elektroforesis gel agarosa. Agarosa berasal dari ekstrak rumput laut yang dimurnikan berupa polimer linier yang mengandung residu DB dan LB galaktosa yang digabung dengan ikatan α (1→ 3) dan β (1→ 4) glikosidik. Residu LBgalaktosa mempunyai jembatan anhidro antara posisi ketiga dan keenam. Rantai agarosa membentuk seratBserat helik yang bergabung menjadi struktur superkoil dengan jariBjari 20B 30 nm (Sambrook 1989). Konsentrasi gel agarosa yang digunakan dalam elektroforesis bervariasi antara 0.7%B1.5%. Konsentrasi gel 0.8%B1% sangat baik untuk memisahkan fragmen DNA atau RNA. Konsentrasi gel kurang dari 0.5% dapat meningkatkan daya pisah elektroforesis namun sangat rapuh dan sulit ditangani. Contoh sampel yang terdapat pada Gambar 1. Ethidium bromida dapat ditambahkan ke dalam suspensi DNA atau RNA untuk tujuan visualisasi hasil elektroforesis (Sambrook
1989). Ethidium Bromida (EtBr) adalah molekul planar siklik yang berikatan antara pasangan basa RNA yang tertumpuk. EtBr mengikat RNA dengan sedikit atau tidak pada sekuens pilihan. Pada kejenuhan larutan berkekuatan ionik tinggi, kiraBkira satu molekul ethidium disisipkan per 2.5 bp. Setelah penyisipan ke dalam heliks, pewarna terletak tegak lurus ke sumbu helikal dan membuat kontak van der waals dengan pasangan basa di atas dan di bawah (Sambrook 1989). Ethidium bromida dapat digunakan untuk mendeteksi asam nukleat baik yang berikatan tunggal maupun ganda.
Bufer yang dapat digunakan untuk elektroforesis adalah bufer TrisBAsetat EDTA (TAE). Jenis bufer lainnya yang dapat digunakan yaitu; TBE (TrisBBorat EDTA)
dan TPE (TrisBFosfat EDTA). Bufer elektroforesis biasanya dibuat sebagai larutan berkonsentrasi dan disimpan pada suhu ruang. TrisBAcetate EDTA (TAE) memiliki kapasitas bufer paling rendah dari bufer elektroforesis lainnya dan akan menjadi habis jika elektroforesis dilakukan untuk periode waktu yang diperpanjang(Sambrook 1989). Sampel sebelum dimasukkan ke dalam sumur gel dihomogenisasi dengan ! . !
. . ! dicampur dengan sampel sebelum dimasukkan ke dalam sumur gel. Bufer ini memiliki tiga tujuan yaitu; untuk meningkatkan densitas sampel supaya memastikan bahwa RNA tenggelam ke dalam sumur gel, menambahkan warna pada sampel dengan demikian menyederhanakan proses pemasukkan, dan menahan pencelup (EtBr) dalam medan listrik sehingga bergerak ke arah anoda pada tingkat yang telah ditentukan (Sambrook 1989).
BAHAN DAN METODE
Bahan dan AlatBahanBbahan yang digunakan dalam penelitian ini adalah bakteri termofilik sp20k dari sumber air panas di Pegunungan Kerinci, vektor plasmid, enzim ligase, enzim lisozim, enzim restriksi, bufer restriksi, etanol absolut, etanol 75%, gel agarosa, bufer TAE 1X, EtBr, media heterotrof cair, es, kalsium klorida dan akuades.
AlatBalat yang digunakan antara lain ! " " " # , alatBalat gelas, sudip, spatula, jarum ose, mikropipet, tip, autoklaf, inkubator, oven, neraca analitik, sentrifus /01/ dengan jariBjari rotor 4 cm+tabung Eppendorf, dan vorteks.
Metode
Produksi dan Peremajaan Bakteri Termofilik
Pembuatan Media Tumbuh. Media heterotrof padat dibuat dengan komposisi 3.18 gram , 0.78 gram , 1 gram NaCl, 0.5 gram K2HPO4, 3 gram agar,
8
larutan masih hangat, dituangkan ke cawan Petri yang telah steril. Proses penuangan tersebut dilakukan di ruang laminar. Setelah larutan memadat, media tersebut siap digunakan.
Penumbuhan Bakteri. PertamaBtama isolat bakteri termofilik ditumbuhkan ke dalam media heterotrof padat lalu diinkubasi pada suhu 60 ºC selama 1 hari. Isolat yang tumbuh akan digunakan sesuai kebutuhan. Selanjutnya, dilakukan penyuburan isolat bakteri dengan memindahkan dua ose biakan dari biakan peremajaan ke media heterotrof cair dan diinkubasi selama 5 hari pada suhu 60 ºC.
Pemanenan Bakteri. Setelah sel bakteri dalam medium cair tumbuh maka kultur sel bakteri termofilik diperoleh dengan metode sentrifugasi 8000 g selama 10 menit. Pelet dan supernatan yang didapat dipisahkan. Supernatan lalu dibuang, pelet diambil.
Isolasi DNA Kromosom
Isolasi DNA kromosom dilakukan dengan
! " " " #
dari Roche secara & (Lampiran 2) Pengamatan DNA dilakukan menggunakan elektroforesis gel agarosa dengan konsentrasi gel 1%.
Pemotongan DNA Kromosom dan DNA Plasmid.
Enzim restriksi yang dipergunakan adalah enzim untuk memotong DNA plasmid dan DNA asing (Lampiran 3). Pemotongan DNA dengan enzim restriksi dilakukan dengan cara mencampurkan 7 ML DNA dengan 2 ML enzim restriksi, 2 ML buffer restriksi lalu ditambahkan akuades steril hingga 20 ML . Setelah DNA dicampur dengan enzim dalam larutan buffer,lalu campuran diinkubasi pada suhu 37 ºC. Setelah proses restriksi selesai perlu dilakukan inaktivasi enzim dengan pemanasan pada suhu 70 ºC. Hasil pemotongan DNA dengan enzim restriksi diamati dengan elektroforesis gel agarosa.
Kloning Kandidat Gen Resistensi Selenium Ligasi DNA Kromosom ke Dalam DNA Vektor (pGEM3zf). Ligasi fragmen DNA asing sebanyak 4 ML ke dalam 1 ML vektor plasmid pGEM3zf dilakukan menggunakan 1 unit enzim T4 ligase sebanyak 1 ML. Campuran diinkubasi pada suhu 15 ºC selama 24 jam. Hasil ligasi ini merupakan DNA
plasmid rekombinan yang siap untuk ditransformasikan kedalam coli (Lampiran 4) .
Transformasi ke dengan DNA Rekombinan. Transformasi sel kompeten dilakukan dengan cara mencampurkan DNA plasmid yang telah diligasi dengan 100 ML sel kompeten, lalu campuran diinkubasi di dalam es. Selanjutnya, campuran diberi kejut panas dengan cara diinkubasi pada suhu 42 ºC. Sel yang telah ditransformasi selanjutnya diinkubasikan dalam medium Luria Bertani(LB) pada suhu 37 ºC untuk memberi kesempatan bagi sel dalam mengekspresikan gen marka pada plasmid. Setelah itu, sel ditebarkan dalam medium selektif.
Seleksi & Identifikasi Sel Rekombinan.
Seleksi transforman dilakukan melalui pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah sel yang berhasil ditransformasi. Koloni yang tidak berhasil ditransformasi akan berwarna biru akibat adanya penambahan IPTGBX gal dan mati akibat penambahan antibiotik. Dua jenis koloni kemungkinan terbentuk pada cawan Petri. Koloni yang berwarna putih menunjukkan sel yang mengandung plasmid yang berhasil disisipi gen resistensi selenium namun koloni yang berwarna biru mengandung plasmid yang tidak berhasil disisipi gen resistensi selenium. Setiap koloni putih yang terbentuk diberi nomor dan ditandai. Identifikasi sel rekombinan dilakukan dengan mengisolasi koloni yang berwarna putih dan ditumbuhkan kembali dalam media yang mengandung selenium. Koloni yang resisten terhadap selenium akan tumbuh menjadi koloni berwarna merah. Koloni yang berwarna merah diambil agar dapat diisolasi DNA plasmidnya kembali dengan metode lisis alkali (Lampiran 3) kemudian dilanjutkan dengan pengamatan pada gel elektroforesis agarosa.
HASIL DAN PEMBAHASAN
Produksi dan Peremajaan BakteriTermofilik
8
larutan masih hangat, dituangkan ke cawan Petri yang telah steril. Proses penuangan tersebut dilakukan di ruang laminar. Setelah larutan memadat, media tersebut siap digunakan.
Penumbuhan Bakteri. PertamaBtama isolat bakteri termofilik ditumbuhkan ke dalam media heterotrof padat lalu diinkubasi pada suhu 60 ºC selama 1 hari. Isolat yang tumbuh akan digunakan sesuai kebutuhan. Selanjutnya, dilakukan penyuburan isolat bakteri dengan memindahkan dua ose biakan dari biakan peremajaan ke media heterotrof cair dan diinkubasi selama 5 hari pada suhu 60 ºC.
Pemanenan Bakteri. Setelah sel bakteri dalam medium cair tumbuh maka kultur sel bakteri termofilik diperoleh dengan metode sentrifugasi 8000 g selama 10 menit. Pelet dan supernatan yang didapat dipisahkan. Supernatan lalu dibuang, pelet diambil.
Isolasi DNA Kromosom
Isolasi DNA kromosom dilakukan dengan
! " " " #
dari Roche secara & (Lampiran 2) Pengamatan DNA dilakukan menggunakan elektroforesis gel agarosa dengan konsentrasi gel 1%.
Pemotongan DNA Kromosom dan DNA Plasmid.
Enzim restriksi yang dipergunakan adalah enzim untuk memotong DNA plasmid dan DNA asing (Lampiran 3). Pemotongan DNA dengan enzim restriksi dilakukan dengan cara mencampurkan 7 ML DNA dengan 2 ML enzim restriksi, 2 ML buffer restriksi lalu ditambahkan akuades steril hingga 20 ML . Setelah DNA dicampur dengan enzim dalam larutan buffer,lalu campuran diinkubasi pada suhu 37 ºC. Setelah proses restriksi selesai perlu dilakukan inaktivasi enzim dengan pemanasan pada suhu 70 ºC. Hasil pemotongan DNA dengan enzim restriksi diamati dengan elektroforesis gel agarosa.
Kloning Kandidat Gen Resistensi Selenium Ligasi DNA Kromosom ke Dalam DNA Vektor (pGEM3zf). Ligasi fragmen DNA asing sebanyak 4 ML ke dalam 1 ML vektor plasmid pGEM3zf dilakukan menggunakan 1 unit enzim T4 ligase sebanyak 1 ML. Campuran diinkubasi pada suhu 15 ºC selama 24 jam. Hasil ligasi ini merupakan DNA
plasmid rekombinan yang siap untuk ditransformasikan kedalam coli (Lampiran 4) .
Transformasi ke dengan DNA Rekombinan. Transformasi sel kompeten dilakukan dengan cara mencampurkan DNA plasmid yang telah diligasi dengan 100 ML sel kompeten, lalu campuran diinkubasi di dalam es. Selanjutnya, campuran diberi kejut panas dengan cara diinkubasi pada suhu 42 ºC. Sel yang telah ditransformasi selanjutnya diinkubasikan dalam medium Luria Bertani(LB) pada suhu 37 ºC untuk memberi kesempatan bagi sel dalam mengekspresikan gen marka pada plasmid. Setelah itu, sel ditebarkan dalam medium selektif.
Seleksi & Identifikasi Sel Rekombinan.
Seleksi transforman dilakukan melalui pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah sel yang berhasil ditransformasi. Koloni yang tidak berhasil ditransformasi akan berwarna biru akibat adanya penambahan IPTGBX gal dan mati akibat penambahan antibiotik. Dua jenis koloni kemungkinan terbentuk pada cawan Petri. Koloni yang berwarna putih menunjukkan sel yang mengandung plasmid yang berhasil disisipi gen resistensi selenium namun koloni yang berwarna biru mengandung plasmid yang tidak berhasil disisipi gen resistensi selenium. Setiap koloni putih yang terbentuk diberi nomor dan ditandai. Identifikasi sel rekombinan dilakukan dengan mengisolasi koloni yang berwarna putih dan ditumbuhkan kembali dalam media yang mengandung selenium. Koloni yang resisten terhadap selenium akan tumbuh menjadi koloni berwarna merah. Koloni yang berwarna merah diambil agar dapat diisolasi DNA plasmidnya kembali dengan metode lisis alkali (Lampiran 3) kemudian dilanjutkan dengan pengamatan pada gel elektroforesis agarosa.
HASIL DAN PEMBAHASAN
Produksi dan Peremajaan BakteriTermofilik
9
genusnya saja karena belum semua bakteri termofilik dapat dikulturkan secara keseluruhan sehingga hanya ditandai dengan angka 20k. Arti dari 20k adalah genus dengan jenis spesies ke 20 dari Pegunungan Kerinci (Gambar 5).
Penumbuhan bakteri termofilik dilakukan pada media padat. BahanBbahan yang dibutuhkan untuk membuat media heterotrof yang digunakan untuk menumbuhkan bakteri termofilik ditimbang terlebih dahulu sesuai dengan komposisinya untuk 200 mL. Bahan yang dibutuhkan dalam membuat media heterotrof meliputi selenium. Bakteri termofilik tidak hanya dapat hidup pada suhu tinggi (65B85ºC) (Brock 1986) tapi juga hidup di dalam sumber air panas yang mengandung selenium sebagai media tumbuh bagi bakteri termofilik.
Media heterotrof dibuat ke dalam cawan Petri dan diinkubasi selama 1 hari. Namun bakteri yang ditanam tidak tumbuh sebanyak dua kali. Hal ini terjadi karena stok kultur yang akan ditanam tidak mengandung bakteri termofilik yang murni lagi melainkan terkontaminasi dengan mikroorganisme lain dan saat ditanam bakteri yang diharapkan tidak tumbuh. Selain itu, cawan Petri yang berisi bakteri yang ditanam sebaiknya tidak direkatkan dengan perekat yang terlalu kencang karena ini kemungkinan juga sebagai penyebab bakteri tidak tumbuh jadi cukup direkatkan dengan selotip di sisi kiri dan kanannya. Setelah bakteri termofilik berhasil ditumbuhkan, bakteri diremajakan dengan cara ditanam dalam media heterotrof cair. Hal ini dilakukan dengan mengambil satu ose biakan dari media padat lalu dipindahkan ke media cair. Pemindahan biakan ke dalam media cair dimaksudkan agar bakteri yang diperoleh lebih banyak dan siap untuk proses isolasi DNA. Setelah ditanam dalam media cair, biakan kembali diinkubasi selama 2 hari dan siap digunakan untuk isolasi namun bila tidak segera dilakukan proses isolasi maka biakan bakteri dapat disimpan hingga 5 hari tanpa perlu peremajaan kembali. Inilah keuntungan dari bakteri termofilik yang belum melewati fase eksponensial sehingga umur bakteri belum tua dan masih baik untuk isolasi. Fase eksponensial adalah fase yang paling baik dalam pertumbuhan bakteri karena pada fase ini kerja metabolisme bakteri dalam tahap tertinggi.
Gambar 5 Bakteri termofilik 20k yang tumbuh dalam media heterotrof padat.
Isolasi dan Pemotongan DNA Bakteri dengan Enzim Restriksi
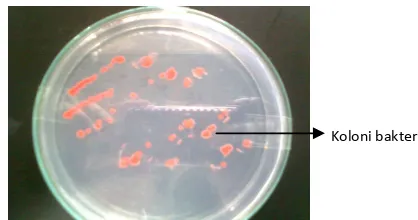
Hasil isolasi DNA bakteri
20 k telah didapat dengan menggunakan metode ! " "
" # . Hasil isolasi DNA berupa pelet berwarna putih jernih berisi asam nukleat dan dilarutkan dalam bufer elusi (Gambar 6). DNA hasil isolasi dipotong dengan menggunakan enzim RI kemudian diligasikan pada vektor pGEM3zf yang dilinierkan dengan enzim RI juga. Ukuran fragmen DNA genom seharusnya dapat ditentukan dari digesti DNA genom dengan menggunakan enzim RI selama 2 jam pada suhu 37ºC. Pita hasil restriksi tidak terlihat pada gel elektroforesis. Hasil terlihat buram dan tidak menunjukkan pita yang jelas (Gambar 7). Hal ini disebabkan DNA genom yang disolasi kemungkinan tingkat kemurniannya rendah. DNA genom yang terkandung pada bakteri termofilik memiliki situs restriksi yang banyak sehingga perbedaan ukuran fragmen yang satu dengan yang lain tidak besar (Faatih 2009).
Gambar 6 Hasil isolasi DNA genom berupa pelet keruh yang dilarutkan dalam bufer elusi.
10
Gambar 7 Hasil pemotongan (1) dari DNA genom Geobacillus sp20k dan marker DNA ladder 21.2 kb (M)
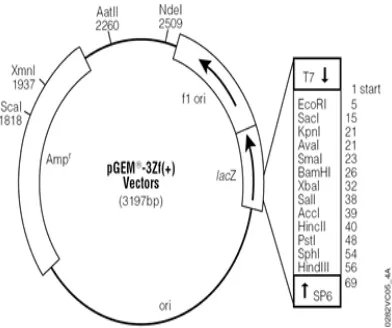
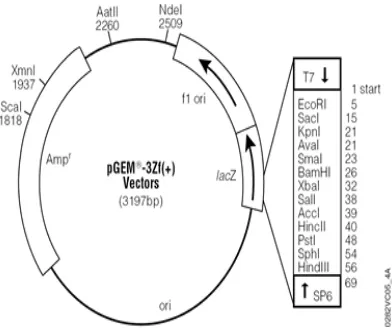
Konstruksi plasmid pembawa gen yang menyandikan resistensi terhadap selenium digunakan pGEM3zf berukuran 3 197 bp dan juga telah dipotong dengan enzim restriksi R1. Struktur pGEM3zf memiliki beberapa situs pengenalan sehingga dapat mengenali enzim restriksi yang memotong pada sekuenB sekuen pengenalannya. Enzim RI mempunyai sekuen 6 pasang basa 5’B G↓AATTCB3’(Brown 1997). pGEM3zf memiliki spesifikasi lainnya yaitu plasmid ini memiliki situs inisiasi T7 RNA polymerase dan S6 RNA polymerase juga promotornya, memiliki ! ! sehingga mampu digunakan untuk proses kloning, dan memiliki gen Z. Gen ini juga penting untuk proses kloning khususnya melakukan seleksi koloni yang membawa dan tidak membawa plasmid rekombinan (Gambar 8). Pengamatan melalui elektroforesis dilakukan setelah proses restriksi dilakukan. Plasmid yang belum dipotong dengan enzim restriksi memiliki dua pita saat dieletroforesis (Pita nomor 1). Pita bagian bawah merupakan plasmid berbentuk sirkuler sehingga kelihatan lebih tebal dibandingkan pita bagian atas sehingga ukurannya lebih pendek dibanding ukuran yang linier. Plasmid yang belum direstriksi masih dalam keadaan sirkuler sehingga ukurannya tidak bias dibandingkan dengan marker DNA (Faatih 2009). Plasmid yang sudah direstriksi (pita nomor 2) memiliki satu pita yang terlihat jelas berbentuk linier yang sudah terpotong oleh enzim EcoRI dan dapat ditentukan ukurannya sebesar 3 197 bp (Gambar 9).
Gambar 8 Struktur pGEM3zf(+).
Gambar 9 Perbandingan pGEM3zf utuh(1) dengan pGEM3zf yang sudah didigesti dengan enzim restriksi EcoRI (2).
Ligasi dan Transformasi pGEM3zf dan DNA Kandidat Gen Resistensi Selenium
Plasmid yang digabungkan dengan DNA dari bakteri perlu direstriksi terlebih dahulu agar plasmid yang sebelumnya berbentuk sirkular menjadi linier. Bentuk linier akan memudahkan DNA menyisip ke dalam plasmid. Reaksi dibiarkan selama semalam pada suhu 15ºC untuk membentuk ligasi.
Plasmid yang telah diligasikan dengan DNA sisipan kemudian ditransformasikan ke dalam sel XL1B yang sudah bersifat kompeten. Sel kompeten yang akan ditransformasikan harus dalam keadaan beku sebelum digunakan. Hal ini dimaksudkan supaya sel kompeten tidak berkurang kemampuannya dalam menyerap
3197 bp
21226 bp
5148 bp
2027 bp 1904 bp 1584 bp
947 bp
21226 bp
5148 bp
2027 bp 1904 bp 1584 bp
11
DNA plasmid. Hasil ditempatkan dalam es selama 10 menit. Campuran kemudian diberi kejut panas dengan cara diinkubasi pada suhu 42 ºC. Membran XL1B yang permeabilitasnya dikondisikan dengan konsentrasi Ca2+ (dari CaCl2) akan
membuka plasmid yang telah dikonstruksi diharapkan dapat masuk ke dalam sel (Snyder & Champness 2003). Hasil transformasi dapat diketahui dengan melakukan seleksi terhadap sel transforman dalam media yang mengandung antibiotik.
Seleksi Klon Rekombinan
Seleksi transforman dilakukan pada media LB (Luria Bertani) yang mengandung ampisilin 100 Ml/ml, tetrasiklin 12.5 Ml/ml, IPTG 80 MM, dan XBgal 70 Mg/ml. Jenis antibiotik yang umum digunakan adalah ampisilin. Sel yang tidak mengandung plasmid hasil transformasi tidak akan tumbuh karena tidak memiliki gen penyandi resistensi terhadap ampisilin. Pada penelitian ini, sel kompeten yang dipakai adalah jenis XL1B sehingga digunakan juga antibiotik tetrasiklin (Louis 1992). Penambahan tetrasiklin dilakukan agar sel yang tumbuh terseleksi dengan lebih spesifik.
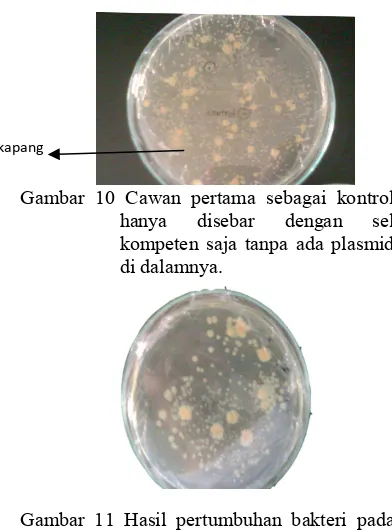
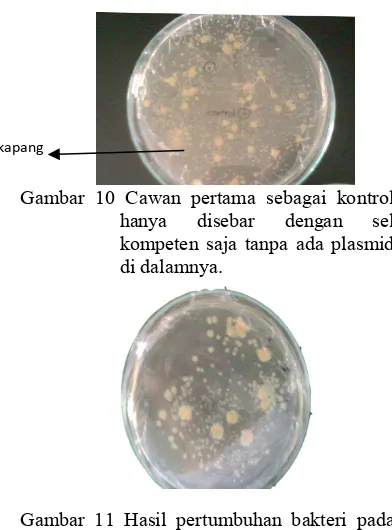
Media seleksi diperlakukan dengan tiga macam. Cawan pertama sebagai kontrol hanya disebar dengan sel kompeten saja tanpa ada plasmid di dalamnya. Setelah diinkubasi 24 jam, pada cawan terdapat koloni putih. Seharusnya pada cawan kontrol tidak tumbuh koloni karena tidak ada plasmid di dalamnya. Hal ini disebabkan adanya kontaminasi dari mikrrorganisme lain yaitu; kapang (Gambar 10).
Cawan kedua berisi plasmid hasil transformasi dengan volume sebaran 500 Ml sedangkan cawan ketiga berisi plasmid hasil transformasi dengan volume sebaran 100 Ml. Setelah diinkubasi 24 jam, cawan kedua tumbuh koloni biru dan putih sedangkan cawan ketiga belum tumbuh. Cawan ketiga baru tumbuh koloni putih setelah 7 hari (Gambar 11) .Hal ini disebabkan volume sebar pada cawan ketiga kurang banyak sehingga koloni tumbuh lebih lambat dibandingkan cawan kedua.
Gambar 10 Cawan pertama sebagai kontrol hanya disebar dengan sel kompeten saja tanpa ada plasmid di dalamnya.
Gambar 11 Hasil pertumbuhan bakteri pada cawan ketiga yang ditransformasikan pada media LB yang ditambahkan ampisilin, tetrasiklin, IPTG dan XBgal.
Koloni warna putih menandakan adanya vektor dengan DNA sisipan, sedangkan koloni warna biru menandakan tidak terdapatnya DNA sisipan pada vektor pGEM3zf. Adanya koloni biru dan putih disebabkan DNA sisipan dimasukkan pada daerah pengkode gen 2
yang merupakan daerah pengkode enzim β galaktosidase. Enzim ini dapat menguraikan senyawa mirip laktosa yaitu XBgal, dan adanya IPTG sebagai penginduksi dihasilkan senyawa galaktosa dan 5BbromoB4Bkloroindigo yang berwarna biru. DNA sisipan yang masuk pada daerah pengkode gen Z menyebabkan gen tersebut akan rusak dan sebagai hasilnya tidak ada aktivitas enzim yang dikode oleh gen 2. Enzim β galaktosidase tidak diproduksi dan dihasilkan koloni berwarna putih (Brown.,1997).
Koloni putih yang tumbuh pada media seleksi maka dilakukan penumbuhan kembali ke dalam media yang berisi LB, ampisilin, dan tetrasiklin tanpa penambahan IPTG dan XBgal. Hal ini dilakukan untuk memastikan koloni putih yang tumbuh adalah sel pembawa plasmid yang mengandung gen sisipan. Koloni putih yang tumbuh pada media seleksi tidak tumbuh kembali maka koloni tersebut mungkin tidak mengandung gen sisipan atau terjadi perubahan warna dari koloni biru tercampur sehingga terbawa menjadi koloni
13
SIMPULAN DAN SARAN
SIMPULANPengklonan yang dilakukan terhadap gen yang membawa resistensi selenium yang berasal dari bakteri termofilik
20k berhasil disisipkan pada plasmid (pGEM3zf). Hasil perbanyakan dengan menggunakan bakteri menjadikannya resisten terhadap Se.
SARAN
Restriksi perlu dilakukan kembali setelah proses isolasi plasmid rekombinan sehingga dapat diketahui ukuran gen resistensi selenium yang sebenarnya. Gen tersebut perlu disekuens untuk tujuan karakterisasi.
DAFTAR PUSTAKA
Ardiarini 1999. Kloning gen cry dari
! varietas kurstaki. BPPSBUGM 11(2C):165B174.
Beishir L.1991. 3 ! " 4
) . 5
. Ed keB5. New York: Harper Collins.
Boyer RF.1986. 3 (
Canada: The Benjamin/Cummings.
Brock TD. 1986. An overview of The Thermophiles. Dalam Brock TD.
4 + 3
* 3 ! . New York: J Wiley.
Brown TA. 1997. ! *
. Ed keB3. New York: Chapman & Hall.
Casarett LJ, John D. 1986. ( ! 4 ) " Ed keB3. Curtis DK, Mary OA, John D, editor. New York: McBMillan Publishing.
Clorinda I. 2009. Isolasi dan pemisahan spesies total RNA dari bakteri termofilik ( sp14k dan sp20k). [laporan praktik lapangan]. Bogor. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dilaga SH. 1992. 6 3
# 7 # 8
) . Jakarta: Akademika Presindo.
Dirnawan H. 1999. Isolasi bakteri termofil penghasil enzim hidrolitik ekstraselular dari sumber air panas Gunung Pancar [skripsi]. Bogor : Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dummont E. 2006. Hypernated techniques for speciation of Se in biological matrices. [Thesis]. Bellegem: Departement of Analytical Chemistry Universiteit Gent.
Edwards C.1990. 3 ! ( & . New York: Mc GrawB Hill Publishing Company.
Faatih M. 2009. Isolasi dan digesti DNA kromosom. 9 "
) : ! 101: 61B67. Girindra A. 2003. . Jakarta:
Gramedia Pustaka.
Jusuf M. 2001. - Bogor: IPB Press.
Kamali M, Manhouri H. 1969. A modified orcinol reaction for RNA determination. Clin Chem 15(5):390B 392.
Lobinski R, Edmonds JS, Suzuki KT, Uden PC. 2000. SpeciesBselective determination of selenium compounds in biological material.
" * . 72(3): 447B461. Louis M.1992. ) " 3
! . Ed keB2. New York: J Wiley.
Mangunwardoyo W. 2002. Transformasi gen DNA kromosom ;
ke dalam
9 3 ) 61: 21B24.
Mizawarti. 2003. Penerapan teknikBteknik kloning gen dalam kehidupan manusia. [thesis]. Medan. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Muladno. 2002. ) !
.Bogor: Pustaka Wirausaha Muda.
PENGKLONAN KANDIDAT GEN RESISTEN TERHADAP
SELENIUM DARI ISOLAT BAKTERI TERMOFILIK
sp20k
IRMA CLORINDA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
13
SIMPULAN DAN SARAN
SIMPULANPengklonan yang dilakukan terhadap gen yang membawa resistensi selenium yang berasal dari bakteri termofilik
20k berhasil disisipkan pada plasmid (pGEM3zf). Hasil perbanyakan dengan menggunakan bakteri menjadikannya resisten terhadap Se.
SARAN
Restriksi perlu dilakukan kembali setelah proses isolasi plasmid rekombinan sehingga dapat diketahui ukuran gen resistensi selenium yang sebenarnya. Gen tersebut perlu disekuens untuk tujuan karakterisasi.
DAFTAR PUSTAKA
Ardiarini 1999. Kloning gen cry dari
! varietas kurstaki. BPPSBUGM 11(2C):165B174.
Beishir L.1991. 3 ! " 4
) . 5
. Ed keB5. New York: Harper Collins.
Boyer RF.1986. 3 (
Canada: The Benjamin/Cummings.
Brock TD. 1986. An overview of The Thermophiles. Dalam Brock TD.
4 + 3
* 3 ! . New York: J Wiley.
Brown TA. 1997. ! *
. Ed keB3. New York: Chapman & Hall.
Casarett LJ, John D. 1986. ( ! 4 ) " Ed keB3. Curtis DK, Mary OA, John D, editor. New York: McBMillan Publishing.
Clorinda I. 2009. Isolasi dan pemisahan spesies total RNA dari bakteri termofilik ( sp14k dan sp20k). [laporan praktik lapangan]. Bogor. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dilaga SH. 1992. 6 3
# 7 # 8
) . Jakarta: Akademika Presindo.
Dirnawan H. 1999. Isolasi bakteri termofil penghasil enzim hidrolitik ekstraselular dari sumber air panas Gunung Pancar [skripsi]. Bogor : Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dummont E. 2006. Hypernated techniques for speciation of Se in biological matrices. [Thesis]. Bellegem: Departement of Analytical Chemistry Universiteit Gent.
Edwards C.1990. 3 ! ( & . New York: Mc GrawB Hill Publishing Company.
Faatih M. 2009. Isolasi dan digesti DNA kromosom. 9 "
) : ! 101: 61B67. Girindra A. 2003. . Jakarta:
Gramedia Pustaka.
Jusuf M. 2001. - Bogor: IPB Press.
Kamali M, Manhouri H. 1969. A modified orcinol reaction for RNA determination. Clin Chem 15(5):390B 392.
Lobinski R, Edmonds JS, Suzuki KT, Uden PC. 2000. SpeciesBselective determination of selenium compounds in biological material.
" * . 72(3): 447B461. Louis M.1992. ) " 3
! . Ed keB2. New York: J Wiley.
Mangunwardoyo W. 2002. Transformasi gen DNA kromosom ;
ke dalam
9 3 ) 61: 21B24.
Mizawarti. 2003. Penerapan teknikBteknik kloning gen dalam kehidupan manusia. [thesis]. Medan. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Muladno. 2002. ) !
.Bogor: Pustaka Wirausaha Muda.
14
Terjemahan dari:
3 !
Prasetyo, Heru. 2006. Kandungan selenium total dalam bakteri termofilik terseleksi dari sumber air panas.[skripsi]. Bogor. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Ren . 2009. sp., a
thermophilic soil bacterium producing volatile antibiotics. 9 3 60:130B136.
Rosen, Barry P.1996. Bacteria resistance to heavy metals and metalloids. 9
! !
1(4): 273B277.
Sambrook J et al.1989. 3 !4 5 3 . Ed keB1. New York: Cold Spring Harbor Lab Pr. Sari AP. 2007. Potensi herba kaya selenium
terhadap aktivitas glutation peroksidase dan hiperplasia ambing tikus. [skripsi]. Bogor. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Sitepoe M. 2001. " .
Jakarta: Grasindo.
Snyder L, Champness W. 2003. 3
. 2nd ed. Washington: ASM Press.
Spallholz JE.2001. Selenium and the prevention of cancer part 1&2.
) .
- & *
Surai PF. 2001. 6 * ( *&
6 .
Nottingham : Nottingham University Press.
Susanti E, Ariani SRD. 2004. Kloning gen penisilin V asilase dari sp BAC4 melalui pembuatan pustaka genom. 9 & 51:1B6. Tarigan D. 2008. Isolasi dan Kloning fragmen
gen penyandi aminocyclopropane carboxylic synthase (ACS) dari daun tanaman karet.[skripsi]. Bogor. Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Van den Burg. 2003. Extremophiles as a source for novel enzymes.
' 3 .6:213B218. Wilson K, Walker J. 2000. "
< "
Ed keB5. London: Cambridge Univ Pr.
PENGKLONAN KANDIDAT GEN RESISTEN TERHADAP
SELENIUM DARI ISOLAT BAKTERI TERMOFILIK
sp20k
IRMA CLORINDA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IRMA CLORINDA. Pengklonan Kandidat Gen Resisten Terhadap Selenium Dari
Isolat Bakteri Termofilik (
sp20k). Dibimbing oleh I MADE ARTIKA
dan NOVIK NURHIDAYAT.
Bakteri termofilik yang resisten terhadap selenium memiliki mekanisme
tertentu sehingga dapat mengakumulasi selenium yang toksik menjadi tidak toksik
bagi bakteri itu sendiri. Mekanisme kerja tersebut diduga dengan adanya gen yang
berfungsi sebagai penyandi resisten terhadap Se (Selenium). Namun gen
penyandi resisten terhadap Se sendiri belum dibuktikan secara ilmiah
keberadaannya. Oleh karena itu perlu dilakukan penelitian terhadap bakteri
termofilik untuk mendapatkan isolat bakteri termofilik yang memiliki gen
penyandi resisten Se dan mengklon gen resisten selenium ke dalam sel bakteri
ABSTRACT
IRMA CLORINDA. Cloning Selenium Candidate Resistant Genes From
Thermophilic Bacteria (
sp20k). Under the direction of I MADE
ARTIKA and NOVIK NURHIDAYAT.
PENGKLONAN KANDIDAT GEN RESISTEN TERHADAP
SELENIUM DARI ISOLAT BAKTERI TERMOFILIK
sp20k
IRMA CLORINDA
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengklonan Kandidat Gen Resisten Terhadap Selenium Dari
Isolat Bakteri Termofilik
sp20k
Nama
: Irma Clorinda
NIM
: G84061518
Disetujui,
Komisi Pembimbing
Dr. I Made Artika, M.App.Sc Dr. Novik Nurhidayat
Ketua
Anggota
Diketahui,
Dr. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa yang
telah memberikan berkat dan karuniaBNya sehingga penulis dapat menyelesaikan
dengan baik skripsi ini. Skripsi ini disusun berdasarkan penelitian yang
dilaksanakan pada tanggal 21 Juni – 20 Oktober 2010 di Laboratorium
Biosistematika dan Genetika Mikrob, Bidang Mikrobiologi, Pusat Penelitian
Biologi LIPIB Bogor dengan judul Pengklonan Kandidat Gen Resisten Terhadap
Selenium Dari Isolat Bakteri Termofilik
sp20k.
Penulis mengucapkan terima kasih kepada Dr.I Made Artika, M.App.Sc
selaku pembimbing dari Departemen Biokimia serta Dr. Novik Nurhidayat dari
LIPI Biologi Cibinong atas segala kesabaran dan keikhlasan dalam memberikan
bimbingan, arahan, dan masukan selama penulisan skripsi ini. Penulis juga
mengucapkan terima kasih pada Mbak Ratih, Pak Aswan, Pak Acun, Ibu Neli, Ibu
Erna dari Laboratorium Mikrobiologi LIPI yang telah banyak membantu
penulis.Ucapan terima kasih juga penulis sampaikan kepada papa dan mama atas
segala kasih sayang , dukungan, dan doa bagi penulis. Juga pada temanBtemanku
Valen, Joel, Renna, dan Silvia yang selalu memberi semangat dan dorongan moral
pada penulis. Penulis mengucapkan terima kasih banyak dan Tuhan memberkati.
Penulis mengharapkan skripsi ini bermanfaat bagi pihakBpihak yang
membutuhkan.
1
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 26 April 1988 dari ayahanda
Harjadi Tijono dan ibunda Lo Sen Moy. Penulis merupakan anak bungsu dari
empat bersaudara. Tahun 2006 penulis lulus dari SMU Kristen 7 BPK Penabur
Jakarta dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor
(IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Program
Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA).
Selama mengikuti perkuliahan, penulis pernah mengikuti kegiatan Praktik
Lapangan di Laboratorium Genetika Bidang Mikrobiologi Pusat Penelitian
Biologi, LIPI Cibinong selama periode Juli sampai dengan Agustus 2009 dengan
judul Isolasi dan Pemisahan Spesies RNA Total dari Isolat Bakteri Termofilik
(
sp14k dan
sp20k). Penulis juga terlibat aktif
dalam Program Kreativitas Mahasiswa Kewirausahaan (PKMK) yang berjudul
Prospek Roti Sukun dan Talas dalam Upaya Menunjang Diversifikasi Pangan.
Disamping itu, penulis aktif menjadi pengurus himpunan profesi (HIMPRO)
Biokimia,
(CREBs), pada
Departemen Keilmuan Bioanalisis periode 2007/2008 dan Staff Badan Pengawas
CREBs periode 2008/2009. Penulis juga pernah menjadi pengurus Unit Kegiatan
Mahasiswa Katolik (UKM KEMAKI) IPB pada Bidang Komunikasi .
2
DAFTAR ISI
Halaman
DAFTAR GAMBAR………..
ix
DAFTAR LAMPIRAN………...
x
PENDAHULUAN………..
1
TINJAUAN PUSTAKA
Bakteri Termofilik………...
1
sp………..
2
Selenium……….
3
Genom Bakteri………
3
Isolasi DNA……….
4
Pengklonan DNA……….
4
Elektroforesis Gel Agarosa………..
5
BAHAN DAN METODE
Bahan dan Alat……….
6
Metode……….
6
HASIL DAN PEMBAHASAN
Produksi& Peremajaan Bakteri Termofilik...
7
Isolasi dan Pemotongan DNA Bakteri
dengan
Enzim Restriksi………
8
Ligasi dan Transformasi pGEM3zf dan DNA Kandidat Gen Resistensi
Selenium………..
9
Seleksi Klon Rekombinan………...
10
Verifikasi Klon Rekombinan………...
11
SIMPULAN DAN SARAN………
12
DAFTAR PUSTAKA……….
12
3
DAFTAR GAMBAR
Halaman
1
Bakteri
sp dalam pengamatan mikroskopik………..
2
2
Skema pelepasan DNA dari sel……….
4
3
Skema pemisahan dan pemekatan DNA………
4
4
Skema kloning DNA ke dalam plasmid………
5
5
Bakteri termofilik 20k yang tumbuh dalam media heterotrof padat...
8
6
Hasil isolasi DNA genom berupa pelet keruh yang dilarutkan dalam
bufer elusi………..
8
7
Hasil pemotongan (1) dari DNA genom
sp20k dan marker
DNA ladder 21.2 kb (M)………...
9
8
Struktur pGEM3zf (+)………...
9
9
Perbandingan pGEM3zf utuh (1) dengan pGEM3zf yang sudah
didigesti dengan enzim restriksi EcoRI (2)………...
9
10
Cawan pertama sebagai kontrol hanya disebar dengan sel kompeten
saja tanpa ada plasmid di dalamnya………..
10
11 Hasil pertumbuhan bakteri yang ditransformasikan pada media LB yang
ditambahkan ampisilin, tetrasiklin, IPTG dan XBgal……….
10
12 Media LB + ampicilin + tetrasikliin sebagai media konfirmasi terhadap
koloni biru putih………....
11
13 Plasmid rekombinan dari koloni sel yang telah membawa gen resistensi
terhadap selenium berupa koloni merah. ………
11
14 Plasmid rekombinan hasil verifikasi dengan menggunakan metode lisis
4
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian………..
15
2 Standar Operational Procedure “
!
"
"
"
# $%%%%%%%%%%%%%%%%%%%%%%%%
16
3 Metode digesti DNA dengan enzim endonuklease………...
18
4 Metode ligasi DNA………
19
5 Metode transformasi DNA ke dalam sel………....
20
6 Isolasi plasmid dengan metode lisis alkali………
21
7 Komposisi media seleksi klon rekombinan……….
22
8 Perhitungan bobot molekul DNA rekombinan………
23
2
PENDAHULUAN
Mikroorganisme yang tumbuh di lingkungan ekstrim seperti kawah gunung berapi ataupun sumber air panas memiliki cara pertahanan diri agar dapat bertahan hidup. Cara yang dilakukan mikroorganisme antara lain dengan menahan masuknya senyawa anorganik toksik seperti selenium atau dengan mekanisme resistensi dalam sel mikroorganisme dengan mengubah senyawa toksik menjadi tidak toksik.
Bakteri yang hidup di tempat ekstrim seperti bakteri termofilik (tahan suhu tinggi) memiliki mekanisme resistensi senyawa logam berat seperti selenium toksik sehingga bakteri termofilik tetap dapat bertahan pada lingkungan mengandung selenium (Rosen 1996). Mekanisme resistensi disebabkan adanya gen yang menyandikan protein sehingga dapat berikatan dengan senyawa selenium dan diubah menjadi kompleks seleniumBprotein yang tidak toksik. Kompleks seleniumBprotein dapat digunakan sebagai komponen sisi aktif dari enzim glutation peroksidase. Enzim ini berperan sebagai enzim antioksidan dalam melindungi sel dari radikal bebas.
Radikal bebas adalah suatu molekul oksigen dengan atom pada orbit terluarnya memiliki elektron tidak berpasangan. Akibatnya radikal bebas selalu mencari pasangan elektron, tetapi dengan cara radikal yaitu mengambil elektron dari molekul lain, maka itu disebut & '( ! )
(ROS). Radikal bebas dalam jumlah berlebihan di dalam tubuh akan sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein, dan jaringan lemak. Radikal bebas dapat terbentuk akibat produk sampingan hasil metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernapasan (Dalimarta & Soedibyo 1998). Tubuh manusia meskipun mempunyai mekanisme antioksidan atau antiradikal bebas secara endogenik tetapi bila jumlah radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan dari luar tubuh. Senyawa antioksidan ini akan memberikan satu atau lebih elektronnya pada radikal bebas. Jika tidak, radikalBradikal bebas dapat menyebabkan kerusakan sel dan menimbulkan kanker.
Sejumlah penelitian menggunakan biakan sel kanker telah menunjukkan bahwa apoptosis adalah mekanisme utama sehubungan dengan efek antikanker dari selenium. Studi awal mengenai apoptosis
yang diinduksi selenium dilakukan menggunakan selenit dan menunjukkan adanya kerusakan oksidatif DNA sedangkan studi menggunakan selenium termetilasi membuktikan bahwa efek apoptosis dari selenium tidak berhubungan dengan efek toksiknya. HasilBhasil penelitian menunjukan bahwa struktur kimia senyawa selenium dan dosis pemberian merupakan penentu aktivitas biologiknya baik sebagai nutrien utama maupun senyawa be