PENGGANDAAN KROMOSOM JATI (
Tectona grandis
L.)
DENGAN ORYZALIN DALAM KULTUR
IN VITRO
DAN PENDUGAAN TINGKAT PLOIDI
IKRA NUGRAHA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IKRA NUGRAHA. Penggandaan Kromosom Jati (Tectona grandis L.) dengan Oryzalin dalam Kultur In Vitro dan Pendugaan Tingkat Ploidi. Dibimbing oleh ENCE DARMO JAYA SUPENA dan DORLY.
Jati (Tectona grandis L.) adalah salah satu tanaman kehutanan yang memiliki nilai ekonomi tinggi dan fungsi penting bagi penyerapan karbon. Penggandaan kromosom jati diharapkan akan menghasilkan tanaman jati yang lebih baik secara morfologi dan kualitas kayunya. Salah satu cara untuk menggandakan kromosom ialah menggunakan senyawa antimikrotubul seperti oryzalin. Penelitian ini bertujuan mengetahui konsentrasi oryzalin dan periode perlakuan yang efektif untuk menggandakan kromosom jati dalam kultur in vitro. Efektivitas perlakuan penggandaan ini diamati melalui perubahan jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata serta persentase tanaman yang bertahan hidup setelah perlakuan. Perlakuan oryzalin yang diduga paling efektif untuk menginduksi penggandaan kromosom jati dari diploid menjadi tetraploid, yaitu konsentrasi 5 µM dengan periode perendaman 3 hari. Kemampuan hidup tanaman setelah perlakuan ini mencapai 70%. Sebanyak 60% dari seluruh tanaman pada perlakuan ini mengalami peningkatan jumlah kloroplas pada sel penjaga stoma menjadi dua kali lipat dari rataan 6,0-11,9 menjadi 12,0-23,9 kloroplas per stoma dan mengalami penurunan kerapatan stomata.
Kata kunci: Tectona grandis, oryzalin, tetraploid, kloroplas, stomata
ABSTRACT
IKRA NUGRAHA. Chromosome Doubling of Teak (Tectona grandis L.) using Oryzalin Treatment in In Vitro Culture and Ploidy Level Estimation. Supervised by ENCE DARMO JAYA SUPENA and DORLY.
Teak (Tectona grandis L.) is one of the forestry plants that have a high economic value and an important role in carbon absorbing. Chromosome doubling in teak was intended to produce a better plant both morphologically and it’s wood quality. Antimicrotubule, such as oryzalin treatment is one of the chromosome doubling inducing method. This research was conducted to get the most effective concentration and treatment period to induce the chromosome doubling of teak through in vitro culture. It’s effectivity was measured by the changes of chloroplast number in the stomatal guard cell and stomatal density, also supported by the lowest lethal effect that was measured by it’s survival percentation. The most effective oryzalin treatment to induce chromosome doubling of teak from diploids into tetraploids was estimated at 5 µM concentration with 3 days treatment period. The survival at this treatment reached 70% of the treated plants. In which about 60% of the treated plants had a doubled chloroplast number in their guard cells from average 6,0-11,9 into 12,0-23,9 chloroplast per stoma along with the decreased of stomatal density.
PENGGANDAAN KROMOSOM JATI (
Tectona grandis
L.)
DENGAN ORYZALIN DALAM KULTUR
IN VITRO
DAN
PENDUGAAN TINGKAT PLOIDI
IKRA NUGRAHA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Penggandaan Kromosom Jati (
Tectona grandis
L.) dengan
Oryzalin dalam Kultur
In Vitro
dan Pendugaan Tingkat Ploidi
Nama
: Ikra Nugraha
NIM
: G34070087
Menyetujui,
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
Dr. Ir. Dorly, M.Si.
Pembimbing I
Pembimbing II
Mengetahui,
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
Ketua Departemen Biologi
PRAKATA
Puji serta syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan karya ilmiah ini.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Ence Darmo Jaya Supena, M.Si dan Ibu Dr. Ir. Dorly, M.Si selaku pembimbing yang telah banyak memberikan bimbingan dan arahan selama kegiatan penelitian hingga penyusunan karya ilmiah ini. Terima kasih juga kepada Bapak Jamaluddin, M.Si yang telah banyak memberikan bimbingan serta masukan kepada penulis, kepada rekan penelitian Asri Sahara yang telah memberikan banyak bantuan, dukungan, dan masukan kepada penulis, serta kepada mbak Rikeu dan mbak Opy dari PT General Green Innovation Bogor yang telah banyak membantu dalam pelaksanaan penelitian ini.
Penulis juga mengucapkan terimakasih kepada seluruh staf di Laboratorium Biologi Molekuler dan Kultur Jaringan PPSHB IPB, Laboratorium Biorin PPSHB IPB, dan Laboratorium Mikroteknik Departemen Biologi IPB. Terimakasih juga penulis ucapkan kepada teman-teman Biologi 44 IPB, dan kepada teman-teman yang tidak bisa disebutkan satu persatu yang telah banyak membantu penulis dalam pelaksanaan penelitian. Penghargaan setinggi-tingginya penulis sampaikan kepada orang tua Bapak Muchlis dan Ibu Euis Sumiati, kakak-kakak Galih dan Gamal atas perhatian, kasih sayang, dan doanya.
Semoga karya ilmiah ini bermanfaat bagi para pembaca dan bagi ilmu pengetahuan.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 Juni 1989 sebagai anak ke tiga dari tiga bersaudara dari pasangan Bapak Muchlis dan Ibu Euis Sumiati.
Tahun 2007 penulis lulus dari SMA Negeri 4 Bogor dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih mayor Biologi dan minor Komunikasi.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... Tujuan ... 1 1 BAHAN DAN METODE Waktu dan Tempat ... Bahan dan Alat ... Perlakuan Oryzalin ... ... Pengamatan Jumlah Kloroplas pada Sel Penjaga Stoma dan Kerapatan Stomata ... Analisis Data ... 1 1 1 2 2 HASIL Persentase Tanaman yang Hidup ... Jumlah Kloroplas dan Kerapatan Stomata ... Pendugaan Tingkat Ploidi ... 2 2 3 PEMBAHASAN ... ... 4
SIMPULAN ... 5
SARAN ... 5
DAFTAR PUSTAKA ... ... 5
DAFTAR TABEL
Halaman
1 Pengaruh konsentrasi oryzalin terhadap jumlah kloroplas dan kerapatan stomata ... 3 2 Pengelompokan perubahan pada jumlah kloroplas dalam sel penjaga stoma dan
kerapatan stomata akibat perlakuan oryzalin berdasarkan kontrol ... 4
DAFTAR GAMBAR
Halaman
1 Grafik pengaruh perlakuan oryzalin terhadap ketahanan hidup tanaman ... 2 2 Jumlah kloroplas pada stoma dan kerapatan stomata ... 3
DAFTAR LAMPIRAN
Halaman
3
PENDAHULUAN
Latar Belakang
Jati (Tectona grandis L.) merupakan tanaman berupa pohon berkayu anggota famili Verbenaceae yang memiliki nilai ekonomi tinggi dan banyak tumbuh di hutan tropis India, Myanmar, Laos, Thailand, dan Indonesia (Kertadikara dan Prat 1995). Kayu jati sangat kuat, tahan terhadap pembusukan meskipun dalam keadaan lembab, serta tahan rayap dan serangan serangga lainnya. Kayu jati banyak digunakan sebagai bahan konstruksi, kayu pertukangan, ukiran, dan berbagai fungsi kayu lainnya. Jati merupakan salah satu dari tiga tanaman yang paling banyak ditanam di seluruh dunia setelah
Eucalyptus spp. dan Acacia spp. karena kualitas kayunya (Krishnapillay 2000). Selain kayu, organ jati lainnya seperti daun, bunga, biji, dan kulit kayunya juga dapat dimanfaatkan dalam pengobatan. Jati sebagai tanaman hutan memiliki fungsi penting bagi lingkungan hidup karena memiliki kapasitas tinggi dalam menyerap karbon (Kraenzel et al. 2003).
Pengembangan potensi jati dapat dilakukan dengan cara rekayasa genetika guna mendapatkan genotipe baru yang lebih unggul. Salah satu cara yang potensial ialah melalui induksi penggandaan kromosom (poliploidisasi) (Sumarna 2003). Tanaman jati mempunyai jumlah kromosom diploid 2n=2x=36 (Gill et al. 1983). Menurut Allum
et al. (2007), individu tanaman Rosa rugosa
yang kromosomnya telah digandakan dari diploid menjadi tetraploid, secara morfologi memiliki ukuran yang lebih besar dibandingkan dengan asalnya yang diploid. Penggandaan kromosom pada tanaman berkayu juga pernah dilakukan pada
Eucalyptus globulus. Penggandaan kromosom pada E. globulus juga merubah morfologi, yaitu daun lebih tebal, besar, dan warna daun menjadi hijau tua (Lin et al. 2010). Oleh karena itu dengan induksi penggandaan kromosom tanaman jati menjadi tetraploid diharapkan dapat mempunyai ukuran morfologi yang lebih besar sehingga akan meningkatkan produktivitas atau kualitas kayu.
Penggandaan kromosom dapat dilakukan dengan memberikan senyawa antimikrotubul, salah satunya ialah oryzalin. Menurut Strachan dan Hess (1983) oryzalin dapat menghambat pembentukan mikrotubul pada sel sehingga mengganggu proses mitosis sel, akibatnya pembelahan sel menjadi terganggu.
DNA yang telah bereplikasi akan tetap berada dalam satu sel, sehingga sel tersebut memiliki jumlah kromosom dua kali lipat dari jumlah awalnya.
Tanaman hasil induksi penggandaan kromosom mengalami perubahan karakteristik, yaitu bertambahnya jumlah kloroplas pada sel penjaga stoma menjadi hampir dua kali kloroplas tanaman asalnya (Ewald et al. 2009) dan penurunan kerapatan stomata menjadi setengah dari kerapatan stomata awalnya (Thao et al. 2003). Kedua karakteristik tersebut dapat dijadikan sebagai indikator perubahan tingkat ploidi pada tanaman hasil induksi penggandaan kromosom karena penghitungan kromosom pada sel-sel ujung akar secara langsung relatif lebih sulit. Selain itu, penentuan tingkat ploidi sel juga dapat dilakukan dengan flow cytometri (Hanson et al. 2005).
Tujuan
Penelitian ini bertujuan mengetahui konsentrasi oryzalin dan periode perlakuan (waktu) yang efektif untuk menginduksi penggandaan kromosom jati dalam kultur in vitro serta pendugaan hasil penggandaan tersebut melalui identifikasi jumlah kloroplas dalam sel penjaga stoma dan kerapatan stomata.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Maret sampai Desember 2011 di Laborato-rium PT General Green Innovation Bogor dan Laboratorium Mikroteknik Departemen Biologi FMPA IPB.
Bahan dan Alat
Bahan tanaman yang digunakan ialah eksplan tunas aksilar jati yang berasal dari satu pohon jati varietas Solomon koleksi General Green Innovation Bogor. Bahan lain yang digunakan ialah media MS (Murashige dan Skoog 1962), kinetin, BAP (benzyl aminopurin), larutan oryzalin, EtOH 70%, dan larutan AgNO3 1%. Alat yang digunakan pada
percobaan antara lain autoklaf, laminar air flow, pinset, bunsen, botol kultur, silet, gelas objek, gelas penutup, mikroskop, kamera digital.
Perlakuan Oryzalin
3
faktor (4x4), yaitu mengacu pada penelitian Wan et al. (1991). Faktor pertama ialah konsentrasi oryzalin yang terdiri atas empat taraf (0, 5, 10, dan 20 µM). Faktor kedua ialah lama perendaman yang juga terdiri atas empat taraf (1, 2, 3, dan 7 hari). Perlakuan perendaman oryzalin terhadap eksplan berupa tunas dengan ruas satu buku dilakukan di atas media padat MS. Masing-masing perlakuan dilakukan dengan ulangan sebanyak sepuluh botol yang masing-masing botol berisi lima eksplan. Eksplan hasil perlakuan dipindahkan ke media tanpa larutan oryzalin, kemudian diinkubasi pada suhu 25±2°C dengan foto periode 16 jam per hari (intensitas cahaya=1000-3000 lux) sampai mencapai 4-5 ruas batang (sekitar delapan minggu). Pengamatan terhadap persentase hidup, jumlah kloroplas pada sel penjaga stoma, dan kerapatan stomata pada umur kultur 8 minggu.
Pengamatan Jumlah Kloroplas pada Sel Penjaga Stoma dan Kerapatan Stomata
Pengamatan stomata dan kloroplas dilakukan berdasarkan metode Kurtar et al. (2009). Daun pada posisi ruas ke tiga dari pangkal tanaman hasil perlakuan umur delapan minggu diambil dan difiksasi dalam EtOH 70%. Daun disayat dengan silet secara paradermal untuk mendapatkan sediaan epidermis sisi bawah daun (abaksial). Selanjutnya sayatan daun diletakkan pada gelas objek dan ditetesi larutan AgNO3 1%
kemudian ditutup dengan gelas penutup. Preparat dibuat untuk satu tanaman yang bertahan hidup dari setiap botol perlakuan. Preparat epidermis daun diamati di bawah mikroskop cahaya dengan perbesaran 1000x. Pengamatan jumlah kloroplas pada sel penjaga stoma dilakukan terhadap lima stoma pada lima bidang pandang berbeda. Pengamatan kerapatan stomata dilakukan pada lima ulangan bidang pandang.
Analisis Data
Analisis data menggunakan perangkat lunak statistik SPSS 16.0. Data yang dianalisis ialah pengaruh konsentrasi oryzalin, pengaruh waktu perendaman, serta pengaruh dari interaksi antara konsentrasi dan waktu perendaman terhadap kerapatan stomata dan jumlah kloroplas dengan uji anova (α=0,05). Data jumlah kloroplas per stoma dan kerapatan stomata diuji lebih lanjut dengan uji Duncan Multiple Range Test (DMRT) (α=0,05). Selain itu juga dianalisis korelasi antara kerapatan stomata dan jumlah kloroplas menggunakan uji korelasi Pearson.
HASIL
Persentase Tanaman yang Hidup
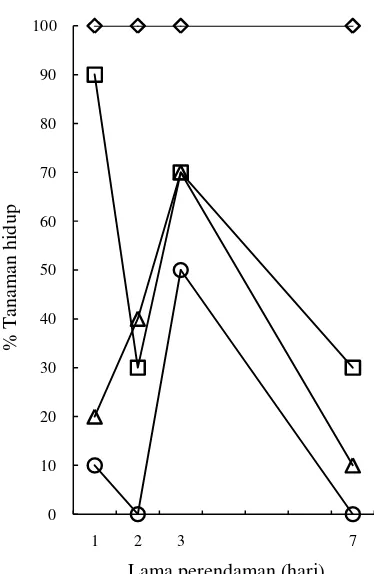
[image:10.595.327.514.282.569.2]Perlakuan oryzalin dapat mempengaruhi persentase tanaman hidup (Gambar 1). Semua tanaman (100%) pada kontrol dapat hidup sampai umur delapan minggu, sedangkan pada tanaman yang mendapat perlakuan oryzalin, persentase tanaman hidup berkisar 0-90%. Tanaman dengan lama perendaman 3 hari umumnya memiliki persentase hidup yang lebih tinggi dibandingkan dengan perlakuan 1, 2, dan 7 hari, yaitu 70% untuk konsentrasi 5 dan 10 µM, serta 50% untuk konsentrasi 20 µM.
Gambar 1 Grafik pengaruh perlakuan oryzalin terhadap ketahanan hidup tanaman. Kontrol ( ), 5 µM ( ), 10 µM ( ), dan 20 µM ( )
Jumlah Kloroplas dan Kerapatan Stomata Faktor konsentrasi oryzalin berpengaruh nyata terhadap jumlah kloroplas dalam sel penjaga stoma (P-value=0.0006) dan kerapatan stomata (P-value<0,0001) berdasarkan uji anova (α=0,05) (Tabel 1).
0 10 20 30 40 50 60 70 80 90 100
1 2 3 4 5 6 7
% T an am an h id u p
3
Tabel 1 Pengaruh konsentrasi oryzalin terhadap jumlah kloroplas dan kerapatan stomata
Konsentrasi Oryzalin (µM)
Jumlah Kloroplas (per Stoma)
Kerapatan Stomata (per mm2)
0 8,3a 674,0a
5 14,4b 471,4b
10 16,2b 433,4b
20 12,6b 516,6b
Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada taraf uji 5% (DMRT)
Perbedaan rataan jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata terjadi antara kontrol dengan perlakuan oryzalin sedangkan antar konsentrasi oryzalin (5, 10, dan 20 µM) tidak berbeda nyata.
Faktor perlakuan lama perendaman (1, 2, 3, dan 7 hari) tidak memberikan pengaruh nyata baik terhadap jumlah kloroplas pada sel penjaga stoma (P value=0,7002) maupun kerapatan stomata (P value=0,2693). Hal yang sama, yaitu interaksi antara faktor konsentrasi dan lama perendaman juga tidak berpengaruh nyata terhadap jumlah kloroplas pada sel penjaga stoma (P value=0,1844) dan kerapatan stomata (P value=0,2896).
Jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata berkorelasi negatif (-0,548) berdasarkan uji korelasi Pearson. Semakin banyak jumlah kloroplas pada sel penjaga stoma, semakin rendah nilai kerapatan stomata.
Pendugaan Tingkat Ploidi
Rataan jumlah kloroplas per stoma pada tanaman kontrol (diploid) adalah 6,0-11,9 dengan kisaran data contoh untuk masing-masing rataan dari 5-12 kloroplas per stoma. Oleh karenanya kriteria terjadinya perubahan tingkat ploidi dari diploid menjadi tetraploid berdasarkan jumlah kloroplas per stoma yang disesuaikan dengan penelitian Ewald et al.
(2009) yaitu bila rataan ≥12 dengan kisaran data contoh ada yang lebih dari 12 (Tabel 2, Gambar 2). Rataan kerapatan stomata pada kontrol (diploid) adalah 620-950 stomata per mm2. Oleh karenanya kriteria terjadinya perubahan dari diploid menjadi tetraploid mengacu pada penelitian Thao et al. (2003) bila rataan kerapatan di antara stomata 310-< 620 stomata per mm2 (Tabel 2, Gambar 2).
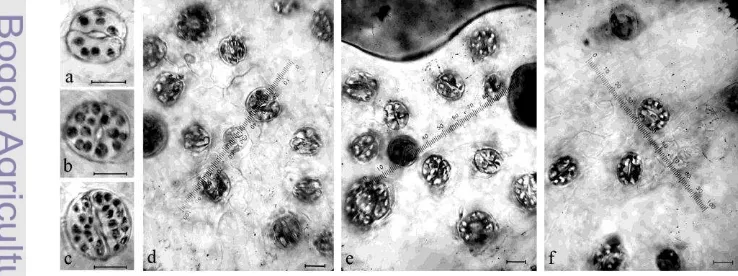
[image:11.595.113.482.574.712.2]Tanaman hasil perlakuan oryzalin memiliki variasi jumlah kloroplas pada sel penjaga stoma. Sebanyak 66,6% tanaman perlakuan memiliki 12,0-23,9 kloroplas per stoma sehingga diduga tetraploid, bahkan 4,7% tanaman memiliki ≥24 kloroplas per stoma sehingga kemungkinan ploidinya adalah lebih dari tetraploid, dan hanya 28,5% tanaman memiliki kloroplas yang sama dengan kontrol, yaitu 6,0-11,9 kloroplas per stoma sehingga diduga ploidinya tetap diploid. Variasi pada tanaman hasil perlakuan oryzalin ditunjukkan juga oleh kerapatan stomata, yaitu sekitar 61,9% tanaman perlakuan diduga tetraploid karena memiliki nilai kerapatan stomata 310-615 stomata per mm2, bahkan 19,0% tanaman berada pada selang <310 stomata per mm2 sehingga diduga ploidinya lebih dari tetraploid, dan hanya 19,0% diduga tetap diploid karena memiliki nilai kerapatan stomata yang sama dengan kontrol, yaitu 620-950 stomata per mm2 daun.
3
Tabel 2 Pengelompokan perubahan pada jumlah kloroplas dalam sel penjaga stoma dan kerapatan stomata akibat perlakuan oryzalin berdasarkan kontrol
Keterangan: * Satu botol terdiri dari lima tanaman
PEMBAHASAN
Pengaruh perlakuan oryzalin ditunjukkan secara nyata oleh konsentrasi oryzalin, sementara pengaruh lama perendaman tidak berbeda nyata terhadap perubahan jumlah kloroplas dalam sel penjaga stoma dan kerapatan stomata. Hal ini serupa dengan hasil yang dilaporkan Caperta et al. (2006) yang melakukan induksi poliploidisasi menggunakan senyawa antimikrotubul lain, yaitu kolkisin terhadap tanaman Secale sereale L.. Berbeda dengan laporan Lazareva (2003) yang menyatakan bahwa poliploidi terhadap tanaman Triticum aestivum diinduksi oleh faktor konsentrasi dan lama perendaman kolkisin yang saling berinteraksi.
Perlakuan oryzalin terbukti dapat mengakibatkan perubahan karakter anatomi, yaitu jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata (Tabel 1, Gambar 2). Namun oryzalin juga terbukti memberikan pengaruh letal pada kultur tanaman jati. Berdasarkan Gambar 1, peningkatan konsentrasi oryzalin pada setiap waktu perendaman secara umum menunjukkan peningkatan persen kematian kecuali pada lama perendaman 2 hari. Hal ini serupa dengan hasil yang dilaporkan Chalak dan Levage (1996), yaitu perlakuan konsentrasi oryzalin yang semakin tinggi pada tananaman
kiwi mengakibatkan penurunan daya hidupnya. Untuk dapat menggandakan kromosom dengan oryzalin selain diperlukan konsentrasi yang tepat juga perlu waktu perendaman yang tepat. Waktu yang diperlukan harus cukup untuk penetrasi oryzalin ke sel-sel meristem tunas, tetapi tidak berlebihan. Jika terlalu lama dapat menyebabkan kenaikan tingkat ploidi berlebih (Allum et al. 2007).
Konsentrasi dan atau lama perendaman yang berlebih juga dapat menyebabkan kematian, karena pada dasarnya oryzalin merupakan senyawa herbisida (Yamamoto et al. 1998). Oleh karenanya perlu ditentukan konsentrasi dan lama perendaman oryzalin yang diduga menggandakan jumlah kromosom tetapi tidak menyebabkan letalitas yang terlalu tinggi. Lama perendaman tidak berpengaruh nyata, tetapi hasil menunjukkan pola tertentu seperti pola adaptasi tanaman terhadap perlakuan oryzalin. (Gambar 1). Perendaman selama 3 hari secara konsisten menunjukkan hasil positif baik dalam hal persentase hidup maupun perubahan jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata yang diamati. Berdasarkan kriteria tersebut, perlakuan paling efektif adalah perlakuan konsentrasi oryzalin 5 µM dengan lama perendaman 3 hari.
Konsen- trasi Oryzalin (µM) Lama Perendaman (hari)
Jumlah Tanaman (Botol*) dengan:
Rataan Jumlah Kloroplas per Stoma Rataan Kerapatan Stomata per mm2 6,0-11,9 12,0-23,9 ≥24 <310 310-615 620-950
0
1 10 - - - - 10
2 10 - - - - 10
3 10 - - - - 10
7 10 - - - - 10
5
1 2 7 - 1 7 1
2 - 3 - 1 1 1
3 1 6 - 2 5 -
7 1 2 - - 1 2
10
1 - 2 - 1 1 -
2 1 2 1 2 2 -
3 3 3 1 1 4 2
7 1 - - - - 1
20
1 - 1 - - - 1
2 - - - -
3 3 2 - - 5 -
7 - - - -
6
Pada konsentrasi oryzalin 5 µM perendaman 3 hari, dari 70% tanaman bertahan hidup, 60% di antaranya (atau 42% dari tanaman hidup) mengalami peningkatan jumlah kloroplas pada sel penjaga stoma dua kali lipat dari 6,0-11,9 menjadi 12,0-23,9 kloroplas per stoma. Tanaman yang mengalami peningkatan jumlah kloroplas pada sel penjaga stoma juga mengalami penurunan kerapatan stomata dibandingkan dengan kontrol. Perubahan karakter anatomi tersebut mengindikasikan terjadinya perubahan tingkat ploidi dari diploid menjadi tetraploid atau lebih dari tetraploid. Grouh et al. (2011) menyatakan bahwa perubahan yang terjadi pada jumlah kloroplas pada sel penjaga stoma dan kerapatan stomata dapat menjadi indikator yang akurat, cepat, dan mudah untuk identifikasi berbagai tingkat ploidi tanaman. Jumlah kloroplas sel penjaga stoma tanaman tetraploid kurang lebih dua kali lebih banyak dibandingkan dengan tanaman asalnya yang diploid. Perubahan kerapatan stomata berkorelasi negatif dengan tingkat ploidinya, semakin tinggi tingkat ploidi, maka kerapatan stomata semakin rendah (Omidbaigi et al. 2010).
Tanaman hasil perlakuan oryzalin yang mengalami peningkatan jumlah kloroplas per stoma hingga dua kali lipat dibandingkan dengan kontrol sebanyak 71,43%, sedangkan tanaman hasil perlakuan oryzalin yang mengalami penurunan kerapatan stomata sebanyak 80,95%. Berdasarkan hasil ini menunjukkan bahwa tidak seluruh tanaman yang mengalami penurunan kerapatan stomata diikuti dengan peningkatan jumlah kloroplas per stoma. Berdasarkan fenomena ini, penggunaan penanda peningkatan jumlah kloroplas per stoma nampaknya akan lebih akurat daripada menggunakan hanya penanda kerapatan stomata. Kriteria terbaik adalah peningkatan jumlah kloroplas dalam sel penjaga stoma yang didukung penurunan kerapatan stomata. Hasil juga menunjukkan terdapatnya peningkatan jumlah kloroplas yang meningkat lebih dari dua kali lipat (4,76%) yang didukung penurunan kerapatan stomata yang drastis (19,05%). Hal ini mengindikasikan adanya perubahan ke arah tingkat ploidi yang lebih tinggi dari tetraploid (Wang 1998).
SIMPULAN
Konsentrasi oryzalin 5µM dan lama perendaman 3 hari paling efektif dalam menginduksi penggandaan kromosom jati
pada kultur in vitro dilihat dari perubahan anatomi dan persentase hidupnya. Perlakuan oryzalin dapat meningkatkan jumlah kloroplas sel penjaga sampai dua kali lipat dan menurunkan kerapatan stomata dibandingkan dengan kontrol.
SARAN
Perlu dilakukan uji lebih lanjut untuk mengetahui secara tepat keberhasilan induksi penggandaan kromosom jati menggunakan oryzalin, yaitu dengan menghitung langsung kromosom di dalam sel ujung akar. Selain itu, alternatif lain dapat dilakukan dengan mengetahui kandungan DNA inti sel menggunakan metode flow cytometri, tetapi perlu mencari buffer yang khusus untuk jati karena bermasalah dengan banyaknya senyawa fenolik dari jaringan daun atau menggunakan organ lain seperti akar.
DAFTAR PUSTAKA
Allum JF, Bringloe DH, Roberts AV. 2007. Chromosome doubling in a Rosa rugosa
Thunb. hybrid by exposure of in vitro
nodes to oryzalin: the effects of node length, oryzalin concentration and exposure time. Plant Cell Rep 26: 1977-1984.
Caperta AD, Delgado M, Ressurreicao F, Meister A, Jones RN, Viegas W, Houben A. 2006. Colchicine-induced polyploidi-zation depends on tubulin polymeripolyploidi-zation in c-metaphase cells. Protoplasma 227: 147-153
Chalak L, Levage JM. 1996. Oryzalin combine with adventitious regeneration for an efficient chromosome doubling of trihaploid kiwi fruit. Plant Cell Rep 16: 97-100.
Ewald D, Ulrich K, Naujoks G. 2009. Introduction of tetraploid poplar and black locust plants using colchicine: chloroplast number as an early marker for selecting polyploids in vitro. Plant Cell Tiss Org Cult 99: 353-357.
Gill BS, Bedi YS, Bir SS. 1983. Cytopalynological studies in woody members of family Verbenaceae from north-west and central India. J Ind Bot Soc
62: 235-244.
6
traits of recovered plants. J Med Plants Res 5: 4892-4898.
Hanson L, Boyd A, Johnson MAT, Bennett MD. 2005. First nuclear DNA C-values for 18 eudicot families. Ann Bot 96: 1315-1320.
Kertadikara AWS, Prat D. 1995. Genetic structure and mating system in teak (Tectona grandis L.) provenances. Silvae Genet 44: 2-3.
Kraenzel M, Castillo A, Moore T, Potvin C. 2003. Carbon storage of harvest-age teak (Tectona grandis) plantations, Panama.
For Ecol Man 173: 213-225.
Krishnapillay B. 2000. Silviculture and management of teak plantations. Unasylva
51: 14-21.
Kurtar ES, Balkaya A, Ozbakir M, Ofluoglu T. 2009. Induction of haploid embryo and plant regeneration via irradiated pollen technique in pumpkin (Cucurbita moschata Duchesne ex. Poir). African J Biotech 8: 5944-5951.
Lazareva EM, Polyakov VY, Chenstov YS, Smirnova EA. 2003. Time and cell cycle dependent formation of heterogeneous tubulin arrays induced by colchicine in
Triticum aestivum root meristem. Cell Biol Int 27: 633-646.
Lin H, Jian M, Liang LY, Pei WJ, Liu XZ, Zhang HY. 2010. Production of polyploids from cultured shoot tips of Eucalyptus globulus Labill by treatment with colchicines. African J Biotech. 9: 2252-2255.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue cultures. Plant Physiol
15: 473-497.
Omidbaigi R, Mirzaee M, Hassani ME, Moghadam MS. 2010. Induction and identification of polyploidy in basil (Ocimum basilicum L.) medicinal plant by colchicine treatment. Int J Plant Prod 4: 87-98.
Strachan SD, Hess FD. 1983. The biochemical mechanism of action of the dinitroaniline herbicide oryzalin. Pest Biochem Physiol
20: 141-150.
Sumarna Y. 2003. Budidaya Jati. Cetakan III. Jakarta: Penebar Swadaya.
Thao NTP, Ureshino K, Miyajima I, Ozaki Y, Okubo H. 2003. Induction of tetraploids in ornamental Alocasia through colchicines and oryzalin treatment. Plant Cell Tiss Org Cult 72: 19-25.
Wan Y, Duncan DR, Rayburn AL, Petolino JF, Widholm JM. 1991. The use of antimicrotubule herbicides for the production of doubled haploid plants from anther-derived maize callus. Theor Appl Genet 81: 205-211.
Wang S. 1998. Evaluation of various methods
for ploidy determination in Beta vulgaris
L. J Genet Breed 552: 83-87.
Yamamoto E, Zheng L, Baird WV. 1998. α -Tubulin missense mutations correlate with antimicrotubule drug resistance in
6
LAMPIRAN
-8
Lampiran 1 Komposisi Media MS (Murashige & Skoog 1962)
Komponen Konsentrasi (mg/l) Konsentrasi (mM)
Hara makro
NH4NO3 1650 20, 6
CaCl2.2H2O 332,2 2,3
MgSO4.7H2O 370 1,5
KNO3 1900 18,8
KH2PO4 170 1,3
Hara mikro
H3BO3 6,2 100
CoCl2. 6H2O 0,025 0,1
CuSO4.5H2O 0,025 0,1
Na2EDTA 37,3 100
FeSO4.7H2O 27,8 100
MnSO4.H2O 16,9 100
KI 0,83 5
NaMoO4.2H2O 0,25 1
ZnSO4.7H2O 8,6 30
Senyawa organik
Myo-inositol 100 550
Nicotimic acid 0,5 4,1
Pyridoxine HCl 0,5 2,4
Triamine HCl 0,1 0,3
Glycine 2 26, 6
9
Lampiran 2 Pembuatan larutan stok oryzalin 10 mM
Keterangan:
Untuk membuat oryzalin pada konsentrasi perlakuan, stok oryzalin ditambah dengan aquades steril sesuai volume yang ditentukan. Misal larutan oryzalin 5 µM dibuat dari 50 µl larutan stok oryzalin ditambah aquades steril hingga volume larutan 100 ml.
+
+
0,5 g oryzalin 2 ml NaOH 10 N
144,5 ml DMSO 0,5%
Disterilisasi dengan ultrafiltrasi 0,45 µm dalam laminar flow