VALIDASI SPESIES DENGAN MARKA MOLEKULER
CYTOCHROME OXIDASE SUBUNIT
I (COI) DAN
POTENSI PROTEIN ALBUMIN DARI
BEBERAPA SPESIES IKAN
! ! ! ! ! !
!
!
!
YUSTIN WIDYASTUTI
! ! ! ! ! ! ! !
SEKOLAH
PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Validasi Spesies dengan Marka Molekuler Cytochrome Oxidase Subunit I (COI) dan Potensi Protein Albumin dari Beberapa Spesies Ikan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
RINGKASAN
YUSTIN WIDYASTUTI. Validasi Spesies dengan Marka Molekuler Cytochrome Oxidase Subunit I (COI) dan Potensi Protein Albumin dari Beberapa Spesies Ikan. Dibimbing oleh TATI NURHAYATI, MALA NURILMALA dan NURLISA A. BUTET.
Metode berbasis molekuler telah banyak digunakan untuk menentukan spesies. Identifikasi molekuler dengan menggunakan marka COI dapat memberikan informasi kekerabatan antar spesies yang kemudian dapat digunakan untuk mengkonstruksi pohon filogeni. Albumin merupakan protein sarkoplasma yang larut air. Albumin memiliki fungsi penting bagi kesehatan sehingga dimanfaatkan sebagai produk farmasi. Fungsi penting albumin ini mendorong eksplorasi untuk menemukan sumber albumin lain selain HSA yang saat ini sudah dimanfaatkan di dunia medis. Albumin yang saat ini banyak dikembangkan adalah albumin dari ikan, salah satunya ikan gabus.
Metode yang digunakan untuk mengetahui data molekuler spesies adalah dengan Polymerase Chain Reaction berdasarkan marka gen Cytochrome c oxidase I (COI) DNA Mitokondria. Pada tahap analisis protein digunakan tiga metode, yakni metode Bradford, Bromocresol Green (BCG), dan SDS - PAGE. Metode Bradford untuk menghitung total protein; Bromocresol green (BCG) untuk menghitung kadar albumin; SDS-PAGE untuk mengetahui profil protein.
Hasil pengukuran morfometrik menunjukkan hasil yang bervariasi antar spesies. Identifikasi molekuler menunjukkan bahwa ikan dapat teridentifikasi dengan baik dengan nilai identiti 98-100% menggunakan referensi spesies dari GenBank dengan jarak genetik kurang dari 3%. Hasil penghitungan situs spesifik menunjukkan jumlah situs terbanyak pada ikan mas, patin, dan lele masing-masing 9, 9 dan 7 situs. Hasil tersebut diduga berkaitan dengan kandungan protein dan albumin pada sampel. Kadar protein semua sampel berada pada rentang 15,54±1,61 sampai 23,28±1,19 dengan kadar tertinggi pada ikan patin. Kadar albumin berada pada rentang 10,07±1,62 sampai 22±1 dengan kadar albumin tertinggi ditemukan pada ikan patin. Profil protein albumin menunjukkan nilai berat molekul antara 55-66 kDa. Hasil penelitian menunjukkan bahwa berat molekul toman, kakap dan baronang hampir sama dengan berat molekul Human Serum Albumin (HSA). Berdasarkan hasil tersebut ikan patin dapat digunakan sebagai alternatif bahan baku untuk produk albumin.
SUMMARY
YUSTIN WIDYASTUTI. Validations Spesies with Cytochrome Oxidase subunit I (COI) as Moleculer Marker and Albumin Protein Potential from Some Fish. Supervised by TATI NURHAYATI, MALA NURILMALA and NURLISA A. BUTET.
Molecular-based method has been widely used for determination of species. Molecular identification through Cytochrome oxidase subunit I (COI) marker gives information of genetic relationship in phylogenetic construction. Albumin is a water soluble of sarcoplasmic protein. Since albumin is necessary for human health, it has been used in pharmaceutical product. Albumin currently is widely used in accelerating the recovery of damaged tissue after surgery. The important function of albumin has been encouraged exploration to find other sources than usual.
The method used to determine the molecular data of species was by Polymerase Chain Reaction (PCR) based marker gene COI mitochondrial DNA. In thi study, protein analysis used were three methods, i.e. the method of Bradford, Bromocresol Green (BCG), and SDS - PAGE. Bradford method for calculating the total protein; Bromocresol green (BCG) to calculate the level of albumin; and SDS-PAGE to determine the protein profile.
Measurement morphometric result showed that variated between sample. Molecular identification showed that fish could well identified with 98-100% identity value using the reference species from GenBank with genetic distance less than 3%. Bioinfomatika analysis showed that the largest number of specific site on pangasius, carp and catfish were 9, 9, and 7 site respectively. These result were considered to be related to the content of protein and albumin. The protein content of all samples were in the range of 15.54 ± 1.61 to 23.28 ± 1.19 with the highest levels in catfish. Albumin levels were in the range of 10.07 ± 1.62 to 22 ± 1 with the highest albumin levels found in catfish. Protein profile of albumin showed the value of molecular weight between 55-66 kDA. The results of SDS-PAGE analysis showed that molecular weight of toman, red snapper and baronang almost equal to the molecular weight of Human Serum Albumin (HSA). Based on these results catfish can be used as an alternative raw material for albumin.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
VALIDASI SPESIES DENGAN MARKA MOLEKULER
CYTOCHROME OXIDASE SUBUNIT I
(COI) DAN POTENSI
PROTEIN ALBUMIN DARI BEBERAPA SPESIES IKAN
YUSTIN WIDYASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2014 sampai Desember 2015, dengan judul Validasi Spesies dengan Marka Molekuler Cytochrome Oxidase Subunit I (COI) dan Potensi Protein Albumin dari Beberapa Spesies Ikan. Oleh karena itu, Penulis mengucapkan terima kasih kepada:
1. Institut Pertanian Bogor (IPB) yang telah menyediakan berbagai fasilitas sehingga penelitian ini dapat diselesaikan.
2. Dr Wini Trilaksani, MSc selaku Ketua Program Studi THP yang telah membantu tahapan penyelesaian studi dan penelitian.
3. Dr Eng Uju, SPi MSi selaku Kepala Departemen THP yang telah membatu dalam penyelesaian studi.
4. Dr Tati Nurhayati SPi MSi, Dr Mala Nurilmala SPi MSi dan Dr Ir Nurlisa A. Butet MSc selaku dosen pembimbing yang telah memberikan arahan dan masukan kepada Penulis dari tahap awal pelaksanaan penelitian sampai pada tahap akhir penulisan karya ilmiah ini.
5. Dr Asadatun Abdullah, SPi MSM MSi selaku GKM/perwakilan program studi dan Prof Dr Ir Joko Santoso, MSi selaku dosen penguji luar komisi yang telah memberikan bimbingan, arahan, serta pelajaran sehingga penulis mampu menyelesaikan tesis ini.
6. Seluruh keluarga, terutama kedua orang tua dan adik atas doa dan dukungan yang tidak pernah putus sehingga tulisan ini berhasil diselesaikan.
7. Seluruh rekan THP 2013 serta teman-teman lainnya yang tidak dapat disebutkan satu per satu atas dukungan yang telah diberikan.
Bogor, November 2016
Yustin Widyastuti
DAFTAR ISI
Tujuan dan Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 METODE PENELITIAN 3
Waktu dan Tempat Penelitian 3
Bahan dan Alat 3
Bahan 3
Alat 3
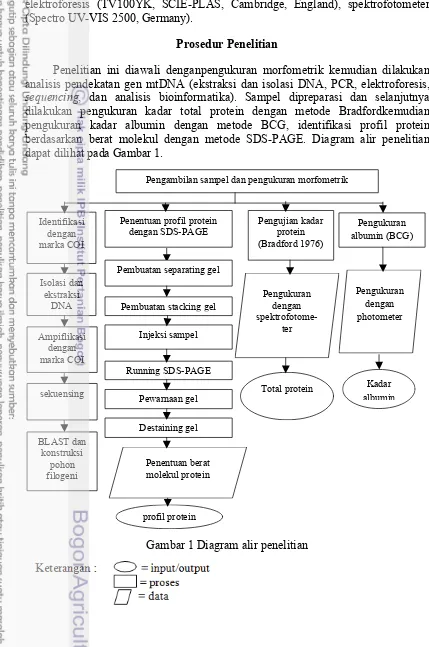
Prosedur Penelitian 4
Tahapan Penelitian 5
Penentuan Ciri Morfometrik 5
Isolasi dan Ekstraksi DNA 5
Amplifikasi DNA 6
Sekuensing DNA 6
Pensejajaran Nukleotida 6
Pohon Filogeni 6
Pengujian Kadar Protein 7
Analisis Kadar Serum Albumin 7
DAFTAR TABEL
Halaman
1 Karakter morfometrik ikan 5
2 Ukuran morfologi dan bobot ikan 8
3 Hasil Identifikasi menggunakan BLASTn 11
4 Polimorfisme situs nukleotida spesifik ikan 12
5 Jarak genetik metode Kimura 2-parameter sampel ikan pada gen COI 12 6 Prediksi berat molekul albumin dengan aplikasi photocap 18
7 Luas area pita albumin diukur dengan ImageJ 19!
DAFTAR GAMBAR
Halaman
1 Diagram alir penelitian 4
2 Berbagai ukuran pada tubuh ikan 5
3 Kualitas DNA 9
4 Visualisasi amplifikasi DNA fragmen gen COI 10
5 Konstruksi pohon filogenetik berdasarkan gen COI 14
6 Kadar protein total ikan air tawar dan ikan air laut. 15
7 Kadar albumin pada ekstrak daging segar ikan air laut dan ikan air. 16
8 Profil protein ikan 18
DAFTAR LAMPIRAN
Halaman
1 Spesies yang dipakai 24
2 Kurva Standar Uji Bradford 25
3 Komposisi larutan elektroforesis (SDS-PAGE) 26
4 Komposisi separating gel dan stacking gel SDS PAGE 26
1 PENDAHULUAN
Latar BelakangIdentifikasi spesies dapat dilakukan secara morfologi maupun molekuler. Identifikasi morfologi yang dilakukan saat ini terkadang sulit dilakukan karena banyaknya kemiripan antar spesies dan cirri khas yang penting untuk diagnosa menghilang sebagai akibat dari adaptasi terhadap lingkungan (Prehadi et al. 2015). Salah satu alternatif identifikasi yang dapat dipelajari selain identifikasi morfologi adalah dengan biologi molekuler. Biologi molekuler merupakan cabang ilmu pengetahuan yang mempelajari hubungan antara struktur dan fungsi molekul-molekul hayati serta kontribusi hubungan tersebut terhadap pelaksanaan dan pengendalian berbagai proses biokimia. Penemuan struktur DNA menjadi salah satu alasan pengembangan teknik identifikasi secara molekuler untuk mengatasi masalah identifikasi (Teletchea et al. 2005). Salah satu cara untuk mengetahui data molekuler spesies dengan tepat adalah menggunakan metode Polymerase Chain Reaction (PCR) berdasarkan marka gen Cytochrome oxidase I (COI) DNA mitokondria. COI telah banyak digunakan untuk identifikasi spesies dan berbagai hasil penelitian menunjukkan bahwa COI mengandung cukup variasi sehingga mampu mengidentifikasi secara akurat berbagai macam hewan (Herbert et al. 2003; Ward et al. 2005). DNA yang digunakan sebagai barcode harus memiliki ukuranpendek tapi memiliki variasiyang tinggi antarspesies, dan harus bisa mengakomodir 10-100 juta spesies (Hollingsworth 2011). Efektifitas COI telah divalidasi untuk bermacam kelompok fauna dan sebagian besar jenis fauna yang diteliti bisa dibedakan menggunakan DNA barcode. Efektifitas ini disebabkan oleh variasi intraspesifik rendah, tetapi variasi interspesifiknya tinggi terutama pada taksa yang berdekatan (Ward et al. 2005). Identifikasi molekuler dengan menggunakan marka COI dapat memberikan informasi kekerabatan antar spesies yang kemudian dapat digunakan untuk mengkonstruksi pohon filogeni.
Protein pada ikan memiliki kadar yang berbeda-beda, hal ini dipengaruhi oleh jenis ikan, makanan, umur, dan lingkungan. Steffens (2006) melaporkan adanya perbedaan nilai protein pada setiap spesies ikan. Protein dalam ikan dibagi menjadi tiga yaitu protein sarkoplasma, protein miofibril dan protein stroma. Ketiga protein tersebut memiliki sifat yang berbeda, contohnya protein sarkoplasma yang merupakan sebagai protein larut air. Albumin merupakan salah satu penyusun dalam protein sarkoplasma yang memiliki peranan penting. Albumin adalah protein terlarut air yang kaya akan asam aminomisalnya sistein, glutamat, leusin, tryptophan dan glisin (Peters 1995). Salah satu hal unik yang membuat albumin banyak dipelajari adalah tidak adanya karbohidrat di dalamnya. Albumin diproduksi dalam hati yang kemudian disebarkan ke seluruh tubuh. Albumin terdiri dari rantai polipeptida tunggal dengan berat molekul albumin plasma manusia 66 kDa, albumin telur 44 kDa dan di dalam daging mamalia 63 kDa (Muray et al. 2003). Albumin memiliki fungsi penting bagi tubuh organisme.
2
Meskipun fungsi albumin penting namun kadar albumin dalam setiap ikan berbeda. Hal ini disebabkan oleh lingkungan, bentuk tubuh, dan nutrisiyang tersedia.
Albumin selain memiliki fungsi penting bagi tubuh organisme juga memiliki fungsi bagi kesehatan manusia sehingga banyak dimanfaatkan sebagai produk farmasi. Ikan merupakan sumber albumin yang baik bagi penderita hipoalbumin (rendah albumin) dan luka, baik luka pasca operasi maupun luka bakar (Kusumaningrum et al. 2014). Penemuan ekstrak albumin ikan gabus kemudian dijadikan alternatif untuk mendapatkan albumin yang lebih murah (Kusumaningrum et al. 2014).
Ikan gabus dimasyarakat dikenal sebagai penyembuh luka, anti depresi dan penghilang rasa sakit (Shafri & Manan 2012). Firlianty et al. (2013) menyatakan bahwa ikan gabus (Channa striata) memiliki kandungan kadar albumin yang tinggi. Mustafa et al. (2012) menambahkan bahwa albumin pada ikan gabus memiliki kadar 27,1 mg/mL. Hasnain et al. (2004) menyebutkan bahwa ikan lele Afrika (Channa ghacua) memiliki berat molekul albumin sekitar 70 kDa. Menurut penelitian tersebut albumin ikan memiliki ciri khas yang mirip dengan Human Serum Albumin (HSA) sehingga dapat dimanfaatkan sebagai produk nutraseutikal. Penelitian lain melaporkan bahwa albumin ikan memiliki khasiat bioaktif untuk kesehatan kulit, antibakteri, antifungi dan penyeimbang agregasi trombosit (Susilowati et al. 2015). Untuk menjamin ketersediaan albumin secara berkelanjutan makan eksplorasi albumin dari ikan lain sangat diperlukan.
Rumusan Masalah
Harga serum albumin yang saat ini digunakan dalam bidang medis sangat mahal. Hal ini mendorong untuk menemukan sumber albumin yang murah dan banyak tersedia di alam, salah satunya adalah albumin yang berasal dari ikan. Penelitian tentang albumin dari ikan air tawar maupun ikan air laut masihterbatas. Ikan gabus saat ini telah dikenal sebagai alternatif sumber albumin. Namun seiring dengan kebutuhan albumin yang tinggi maka diperlukan alternatif lain selain ikan gabus. Kandungan protein yang berbeda pada tiap ikan mendorong perlunya metode identifikasi yang akurat sehingga dapat tepat sasaran dalam penggunaannya salah satunya dengan metode molekuler menggunakan marka COI. Validasi molekuler ini diharapkan dapat digunakan untuk mengetahui spesies yang memiliki kekerabatan terdekat dengan ikan gabus.
Tujuan dan Manfaat Penelitian
3
Ruang Lingkup Penelitian
Penelitian ini meliputi pengukuran morfometrik pada ikan air tawar (patin, lele, gabus, mas, dan toman) dan ikan air laut (kakap, tongkol, tuna, baronang dan tenggiri), identifikasi secara molekuler menggunakan marka gen COI pada semua sampelyang dilakukan untuk mengetahui kepastian spesies yang digunakan, uji protein meliputi penentuan profil protein, kandungan total proteindanujikadar albumin.
2 METODE PENELITIAN Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2014 sampai Desember 2015 di Laboratorium Biologi Molekuler Departemen Pengelolaan Sumberdaya Perairan, Laboratorium Karakteristik Bahan Baku, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan dan Alat Bahan
Bahan yang digunakan dalam penelitian ini adalah ikan air tawar (patin, lele, mas, gabus dan toman) dan ikan air laut (kakap, tongkol, tuna, baronang dan tenggiri).Sampel disimpan pada suhu -20°C sebelum digunakan.
Bahan-bahan kimia yang digunakan adalah kit isolasi komersial Dneasy Blood & Tissue Kit (Qiagen), gel agarose 1,2% (Vivantis Inc., US), buffer Tris Acetic EDTA (TAE) 1x (Vivantis Inc., US), COI universal (Ward et al. 2005), PCR mix Kapa Taq Extra HotStart ReadyMix PCR Kit (Kapa Biosystems), loading buffer dan marker DNA (Vivantis Inc., US), Separating gel (12.5%), stacking gel (3 %), reducing sample buffer (RSB), tetrametiletilendiamin (TEMED), akuabides, NaNO3, KCN, bufer potasium fosfat 1 N, SDS (Merck, Darmstadt, Germany), glisin (Merck, Darmstadt, Germany), gliserol (Merck, Darmstadt, Germany), ammonium persulfat (APS) (Sigma-Aldrich, Missouri, USA), β-merkaptoetanol (Merck, Darmstadt, Germany), coomassie brilliant blue (Merck, Darmstadt, Germany), metanol (Merck, Darmstadt, Germany), asam asetat glasial (Merck, Darmstadt, Germany), dan bromphenol blue (Merck, Darmstadt, Germany), buffer laemmli 2x (Bio-Rad Laboratories, Inc. US), marker protein 8,8-192 kDa (Nacalai tesque, Inc. Kyoto-Japan). Bahan software yang dipakai adalah CustalW program MEGA 5.05 (Molecular Evolutionary Genetic Analysis), BLASTn (Basic Local Alignment Search Tool nucleotide).
Alat
4
(NanoPhotometer P360, Implen GmbH, Schatzbogen, Germany), chamber elektroforesis (Mupid-Exu Submarine Electrophoresis System Advance, Tokyo), monitor UV (Ultraviolet Viewer Tipe UV-1 ExtraGene, Inc. Taiwan), mesin PCR Termocycler (Biometra T1, Biometra GmbH, Gottingen, Jerman), gelas ukur, stirrer,kuvet, eppendorf, mikropipet, timbangan analitik, tabung reaksi, elektroforesis (TV100YK, SCIE-PLAS, Cambridge, England), spektrofotometer (Spectro UV-VIS 2500, Germany).
Prosedur Penelitian
5
Tahapan Penelitian Penentuan Ciri Morfometrik(Brojo 1999)
Karakter morfometrik yang diukur dan karakter meristik yang dihitung disajikan pada Tabel 1 dan Gambar 2.
Tabel 1Karakter morfometrik ikan Karakter Morfometrik Penjelasan
Panjang total Jarak antara ujung bagian kepala terdepan dengan ujung sirip caudal yang paling belakang
Panjang baku Jarak antara ujung bagian kepala yang paling depan dengan pelipatan pangkal sirip caudal
Panjang kepala Jarak antara ujung terdepan dari hidung hingga ujung terbelakang dari keping tutup insang
Tinggi badan Diukur pada bagian ventral tertinggi antara bagian dorsal dengan bagian ventral
Panjang cagak (fork length)
diukur dari ujung kepala yang terdepan sampai ujung bagian luar lekukan cabang sirip ekor
Gambar 2 Berbagai ukuran pada tubuh ikan : panjang total (PT), panjang baku (PB), panjang cagak (PC), panjang kepala (PK), tinggi badan (TB).
Isolasi dan Ekstraksi DNA
6
dihancurkan kemudian dilisis menggunakan buffer lisis dan proteinase K 20 µL. Sampel ditambah 180 µL buffer ATL, kemudian divortex dan diinkubasi selama 30 menit. Sampel ditambah 200 µL buffer AL, kemudian divortex serta diinkubasi selama 20 menit. Ethanol 96% ditambah sebanyak 200 µL kemudian disimpan kedalam freezer selama 30 menit. Sampel dipipet dan dipindahkan ke DNeasy, sampel disentrifuse dengan kecepatan 8000 rpm, kemudian ditambah buffer AW1 500 µL. Sampel disentrifuse kembali dengan kecepatan 8000 rpm, kemudian ditambah buffer AW2 500 µL. Sampel disentrifuse dengan kecepatan 8000 rpm, kemudian ditambah 200 µL buffer AE. Keutuhan DNA total dianalisis dengan elektroforesis (Mupid-Exu Submarine Electrophoresis System Advance, Tokyo) selama 30 menit pada gel agarose 1,2 % di dalam larutan penyangga TAE 1x dan divisualisasi dibawah monitor UV (Ultraviolet Viewer Tipe UV-1 ExtraGene, Inc. Taiwan)
Amplifikasi DNA
Amplifikasi 655 bp fragmen cytochrome oxidase 1 (COI) menggunakan pasangan primer dari Ward et al. (2015) FishF1-5’ TCA ACC AAC CAC AAA GAC ATT GGC AC 3’,dan FishR1-5’ TAG ACT TCT GGG TGG CCA AAG AAT CA 3’. Komposisi PCR untuk amplifikasi menggunakan PCR mix Kapa Taq Extra HotStart ReadyMix PCR Kit (Kapa Biosystems) sebanyak 25 µL, ddH2O
sebanyak 9 µL, primer foward dan reverse masing-masing sebanyak 3 µL, dan DNA yang ditambahkan sebanyak 10 µL. Amplifikasi PCR menggunakan mesin PCR (Termocycler Biometra T1, Biometra GmbH, Gottingen, Jerman) dilakukan dengan kondisi predenaturasi 94°C selama 3 menit,diikuti dengan 35 siklus dari perusahaan jasa sekuensing. Semua urutan basa nukleotida yang diperoleh akan dicocokkan di GenBank.
Pensejajaran Nukleotida
Runutan nukleotida sampel disejajarkan (alignment) menggunakan program MEGA 5.05 (Molecular Evolutionary Genetic Analysis) (Tamura et al. 2011). Hasil pensejajaran dikomparasi menggunakan Basic Local Alignment Search Tool nucleotide (BLASTn).
Pohon Filogeni
7
sudah dihitung dengan menggunakan metode Neighbor-Joining (NJ) pada program MEGA 5.05.
Pengujian Kadar Protein (Bradford 1976)
Preparasi sampel dilakukan dengan cara mengambil daging sebanyak 100 g kemudian dihancurkan dengan pelarut akuades. Perbandingan daging dengan akuades adalah 1:2 (w/v) dan disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit. Filtrat kemudian digunakan untuk analisis Bradford. Penentuan konsentrasi protein dilakukan menggunakan metode Bradford dengan bovine serum albumin (BSA) sebagai standar. Uji Bradford menggunakan pereaksi coomassie blue yang terdapat dalam reagen Bradford. Coomassie blue tersebut mengikat protein membentuk kompleks berwarna biru. Persiapan reagen Bradford dilakukan dengan cara melarutkan 10 mg coomasive briliant blue G-250 dalam 5 mL etanol 95%, lalu ditambahkan dengan 10 mL asam fosfat 85% (b/v). Akuades ditambahkan hingga 250 mL jika telah larut sempurna dan disaring dengan kertas saring Whatmann no.1. Sampel dimasukkan dalam tabung reaksi sebanyak 20 µL, kemudian ditambahkan 200 µL reagen Bradford. Proses selanjutnya adalah dilakukan inkubasi selama 5-60 menit, kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 595 nm. Pengukuran untuk larutan standar dilakukan seperti larutan sampel. Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam kurva standar Bradford untuk menentukan konsentrasi protein yang terkandung dalam sampel.
Analisis Kadar Serum Albumin
Analisis kadar serum albumin dilakukan dengan bromocresol green (BCG)dengan bovine serum albumin (BSA) sebagai standar.Sampel yang diambil dari jaringan otot dihomogenkan dengan aquades 1:2 (w/v) dan disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit (Fatoni 2007). Filtrat digunakan untuk analisis BCG berdasarkan Harahap (2001). Reagen BCG yang dibutuhkan yaitu larutan BCG dengan konsentrasi 0,01% sehingga diperlukan pembuatan reagen stock BCG terlebih dahulu dengan konsentrasi 1%. Pembuatan Reagen stock BCG 1% dilakukan dengan menimbang BCG bubuk sebanyak 1 gram kemudian dilarutkan sampai 100 ml menggunakan larutan buffer pH 4 dan diaduk sampai homogen. Reagen BCG 0,01% dibuat dengan mengambil 1 ml reagen BCG stok kemudian dilakukan pengenceran menggunakan larutan buffer pH 4 sampai 100 ml. Semua pengenceran dilakukan menggunakan labu ukur. Albumin akan berikatan dengan bromocresol green dan membentuk kompleks warna hijau. Warna tersebut secara langsung berkaitan dengan kadar albumin.Sampel kemudian di ukur perubahan warnanya menggunakan photometer pada panjang gelombang 546 nm, faktor 005,0, program c/ST setelah sebelumnya diukur terlebih dahulu pada blanko dan standar.
SDS-PAGE (Laemmli 1970)
8
(w/v). Marker yang digunakan pada penelitian ini adalah marker dengan bobot molekul 192 kDa (BenchMark™ Protein Ladder, Invitrogen). Pewarnaan yang dilakukan adalah pewarnaan coomasie brilliant blue. Ekstrak daging dicampurkan dengan bufer sampel 1:1 (v/v). Sampel sebanyak 5 µL dimasukkan kedalam gel poliakrilamid. Elektroforesis dijalankan secara konstan pada arus 15 mA dan voltase 150 volt menggunakan Mini Protein (SCIE PLAST) selama 3 jam. Elektroforesis berakhir ketika pewarna sampel mencapai batas 0,5 cm dari bagian bawah gel. Pewarnaan gel menggunakan 0,125% (w/v) coomassie brilliant blue (CBB). Pewarna yang tidak terikat pada protein dihilangkan (destaining) dengan merendam gel pada larutan metanol dan asam asetat sehingga gel berwarna bening atau pita-pita protein yang telah terbentuk terlihat jelas. Zona protein akan membentuk pita berwarna biru. Pendeteksian bobot molekul dilakukan dengan mengukur jarak migrasi pada masing-masing pita protein. Pengukuran berat molekul dilakukan dengan software Photocapt dan luas area pita menggunakan software imageJ.
HASIL DAN PEMBAHASAN
Karakteristik Morfometrik
Karakter morfometrik dapat digunakan sebagai ciri taksonomik saat mengidentifikasi ikan.Setiap spesies ikan memiliki ukuran mutlak berbeda-beda yang dipengaruhi oleh faktor umur, jenis kelamin, dan lingkungan hidupnya. Menurut Turan (1998) karakter morfometrik dapt digunakan untuk menduga fase pertumbuhan ikan.Faktor lingkungan mempunyai pengaruh besar terhadap pertumbuhan ikan. Walaupun umur ikan dari suatu spesies sama, ukuran mutlaknya dapat berbeda. Oleh karena itu, standar dalam identifikasi ialah ukuran perbandingannya, seperti jarak antara panjang kepala (PK) dibandingkan dengan panjang total (PT).
Sampel ikan mas, lele, patin, toman, kakap, baronang, tongkol, tuna dan tenggiri dalam penelitian ini masing-masing berjumlah tiga ekor. Data morfometrik ikan yang meliputi berat total, panjang total, panjang baku, panjang cagak, tinggi badan, dan panjang kepala dapat dilihat pada Tabel 2.
Tabel&2&Ukuran&morfologi&dan&bobot&ikan tuna 2,62±0,14 48,03±1,29 41,50±1,51 13,33±1,23 30,13±1,31 12,13±1,27 baronang 0,68±0,14 25,37±2,15 21,37±2,04 10,90±2,14 14,83±2,10 5,27±1,24 tongkol 1,00±0,08 44,57±1,38 38,83±1,55 13,17±1,53 28,80±2,01 11,70±1,06 kakap 0,86±0,15 37,50±1,32 31,67±2,18 12,50±1,61 19,20±1,18 11,37±1,66 tenggiri 2,57±0,12 57,93±1,60 52,03±1,60 11,13±1,52 48,70±1,95 16,20±0,44
9
Tabel 2 memperlihatkan bahwa masing-masing ikan memilki ukuran yang bervariasi. Muthmainnah (2013) melaporkan bahwa ikan dengan ukuran bobot berbeda memiliki panjang tubuh serta proporsi tubuh yang berbeda, pertambahan berat tubuh ikan dan panjang ikan sangat berhubungan erat. Karakter morfologi ikan dapat digunakan untuk identifikasi jenis ikan. Pembatas utama dari karakter morfologi dalam tingkat intra species adalah variasi fenotip yang tidak selalu tepat dibawah kontrol genetik yang dipengaruhi oleh perubahan lingkungan.
Kadar protein dalam tubuh ikan dipengaruhi oleh tahap perkembangan ikan yang digambarkan melalui ukuran tubuh ikan. Berdasarkan penelitian Gam et al. (2006) menunjukkan bahwa ikan gabus dengan ukuran panjang tubuh 16 - 23 cm memiliki kadar protein yang lebih besar daripada ikan gabus yang berukuran 24 - 30 cm. Hal ini dikarenakan pada ikan gabus yang lebih kecil, berenang lebih aktif daripada ikan gabus yang besar sehingga sintesis protein berlangsung lebih cepat. Penelitian Mustafa (2012) menyebutkan panjang tubuh ikan mempengaruhi kandungan protein tubuh sehingga variasi panjang tubuh ikan akan berpengaruh terhadap kandungan protein termasuk kandungan albuminnya karena albumin merupakan komponen terbanyak dari total plasma darah yaitu sekitar 60%.
Validasi Spesies Kualitas DNA
Kualitas DNA genom dilakukan melalui pengujian terhadap sampel DNA genom yang dimigrasikan pada chamber elektroforesis menggunakan agarosa 1,2% pada larutan TAE 1x (Gambar 3). Gambar 3 menunjukkan bahwa ektraksi DNA berhasil dilakukan, hal ini dapat dilihat dari kualitas DNA pada semua sumur menunjukkan ketebalan pita DNA. Elektroforesis menunjukkan pita DNA pada sampel baronang (Sg) lebih tipis dibandingkan dengan pita DNA pada sampel lainnya. Adanya perbedaan pada ketebalan pita DNA tersebut terjadi karena perbedaan jumlah konsentrasi DNA hasil ekstraksi, hal ini berarti jumlah konsentrasi DNA pada sampel lain lebih tinggi dibanding konsetrasi DNA pada sampel baronang (Sg).
10
Restu et al. (2012) melaporkan bahwa produk ekstraksi DNA yang berkualitas baik ditunjukkan dengan pita DNA yang terlihat tebal dan bersih serta pita DNA yang menyala. DNA yang memiliki kualitas yang baik tersebut layak dijadikan sebagai template untuk amplifikasi gen COI dengan menggunakan teknik PCR.
Visualisasi Hasil PCR
Visualisasi produk PCR hasil amplifikasi gen COI dari sampel ikan yang diamplifikasi dengan primer universal FishF1 (forward) dan FishR1 (reverse) pada gel agarose. Hasil analisis elektroforesis gel menunjukkan bahwa primer berhasil mengamplifikasi gen COI dari sampel ditandai dengan adanya tampilan pita DNA (Gambar 4). Gen COI hasil amplifikasi dari masing-masing sampel ikan teramati muncul pada posisi antara 500 -750 bp, sesuai dengan yang dilaporkan dalam Ward et al. (2005) bahwa primer mampu mengamplifikasi pada ukuran 655 bp.
Gambar 4 Visualisasi amplifikasi DNA fragmen gen COI, gabus (Gab), toman (To), patin (P), lele (L), mas (M), tongkol (Tong), tenggiri (Tg), baronang (Sg), tuna (Tu), kakap (K)
Kekerabatan Spesies
Identifikasi spesies menggunakan Basic Local Alignment Search Tool nucleotide (BLASTn) (Tabel 3) untuk gen COI menunjukkan bahwa semua sampel teridentifikasi sebagai dengan tingkat identity (homologi) sebesar 98-100%. Menurut Hebert et al. (2003), perbedaan jarak genetik kurang atau sama dengan 3% menunjukkan spesies identik secara molekuler.
Jarak genetik yang dihitung berdasarkan metode Kimura 2-parameter disajikan pada Tabel 5. Jarak genetik berdasarkan gen COI pada masing-masing sampel dan referensi sekuen dari GenBank menunjukkan kesesuaian dengan hasil BLASTn, dengan jarak genetik antara sampel dan referensi sekuen pada sampel ikan menunjukkan nilai 0-0,025%, sedangkan jarak genetik antar sampel pada sampel ikan menunjukkan nilai yang berkisar antara 0,100-0,225%. Hasil penelitian ini menunjukkan bahwa jarak antar spesies dan sekuen referensi memiliki nilai yang
500 bp
11
lebih kecil dibandingkan jarak genetik antar spesies pada masing-masing sampel, yang artinya sampel dapat diindentifikasikan sebagai spesies referensi contohnya sampel kode P memiliki jarak genetik 0,000 dengan Pangasius hypothalamus. Hasil tersebut sesuai dengan hasil BLASTn antara sampel kode P dengan Pangasius hypophthalmus yang memiliki nilai identity 99%. Nilai jarak genetik (p-distance) yang semakin besar diantara populasi atau individu maka semakin terisolasi antara satu dengan lainnya, jarak genetik menunjukan kemungkinan adanya pengaruh geografis terhadap populasi (Laltanpuii et al. 2014)
Tabel 3 Hasil Identifikasi menggunakan BLASTn
Kode Kode akses sampel
Hasil identifikasi Identity Kode akses GenBank
Gab KX685195 Channa striata 99 % HM345931.1
To KX685196 Chana micropeltes 100% KM213040.1
P KX685193 Pangasianodon hypophthalmus 99% KR080263.1
L KX619412 Clarias gariepinus 99% JQ699203.1
M KX685192 Cyprinus carpio 99% JF915568.1
Tong KX685199 Euthynnus affinis 100% KM651783.1
Tg KX685197 Scomberomorus commerson 99% KP267578.1
Sg KX685194 Siganus guttatus 99% KJ420577.1
Tu KX691613 Thunnus albacares 99% JN086153.1
K KX685198 Lutjanu serythropterus 99% EU600114.1
Jarak genetik antar sampel yang lebih tinggi menunjukkan bahwa gen COI efektif untuk identifikasi pada tingkat spesies. COI telah banyak digunakan sebagai alat identifikasi spesies hewan.Menurut Ward et al. (2005) COI efektif digunakan sebagai alat identifikasi karena variasi intraspesifik rendah, tetapi memiliki nilai variasi interspesifik yang tinggi terutama pada taksa yang berdekatan.Semakin besar jarak genetik antar sampel, maka kesamaan basa nukleotidanya semakin kecil dan hubungan kekerabatannya semakin jauh (Nugroho & Rahayu 2015). Cawthorn et al. (2012) juga melaporkan jarak genetik intraspesies ikan komersial yang diteliti di Afrika Selatan memiliki jarak genetik antara 0%-0,60%, satu genus 0,8-3.24% berada dalam satu famili sebesar 5,10%-14,5%.
12
kecenderungan faktor genetik dapat dilihat dari jarak genetik dan kekerabatan pada masing-masing sampel. Hal ini diperkuat jug bahwa ikan patin dan ikan lele yang memiliki jarak genetik terkecil dibanding yang lainnya juga memiliki kadar albumin yang tidak berbeda jauh begitu pula dengan karakteristik profil protein albuminnya. Metcalf et al. (2007) melaporkan bahwa albumin pada ikan lungfish (Neoceratodus fosteri) memiliki karakterisasi yang sama dengan tetrapod dillihat dari hubungan kekerabatannya.
13
Tabel 5 Jarak genetik metode Kimura 2-parameter sampel ikan pada gen COI
Keterangan :
Tom = toman, P = patin, M = mas, L= lele, Sg = baronang, K =kakap, Tu = tuna, Tg = tenggiri, Tong = tongkol
14
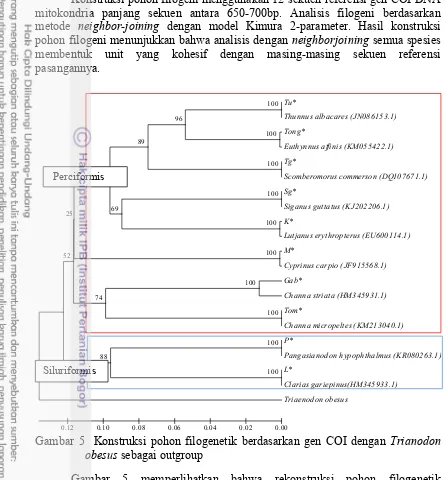
Konstruksi pohon filogeni menggunakan 12 sekuen referensi gen COI DNA mitokondria panjang sekuen antara 650-700bp. Analisis filogeni berdasarkan metode neighbor-joining dengan model Kimura 2-parameter. Hasil konstruksi pohon filogeni menunjukkan bahwa analisis dengan neighborjoining semua spesies membentuk unit yang kohesif dengan masing-masing sekuen referensi pasangannya.
Gambar 5 Konstruksi pohon filogenetik berdasarkan gen COI dengan Trianodon obesus sebagai outgroup
Gambar 5 memperlihatkan bahwa rekonstruksi pohon filogenetik membentuk 2 cabang besar dengan nilai boostrap 52. Nilai boostrap tersebut tidak terlalu kuat untuk menahan posisi apabila ada spesies baru yang masuk, tetapi cabang yang terbentuk tetap memperlihatkan perbedaan. Cabang pembagi terpisah pada tingkat ordo, yaitu perciformis dan siluriformis. Ikan pari (Triaenodon obesus)
merupakan merupakan outgroup yang dipakai. Pengelompokan tersebut
memberikan nilai boostrap tinggi, yaitu 100%. Menurut Nakano & Osawa (2004), bootstrap dilakukan untuk mengevaluasi kestabilan cabang. Nilai bootstrap pada pohon filogenetik di atas termasuk dalam kategori stabil karena suatu cabang
Perciformis
15
dikatakan stabil jika nilai bootstrap di atas 95% dan dikatakan tidak stabil jika nilai bootstrap berada di bawah 70%. Sampel dan sekuen referensinya masing-masing membentuk cabang yang stabil karena memiliki nilai boostrap 100% sehingga dapat diartikan bahwa setiap pengulangan dari konstruksi pohon filogeni akan membentuk hasil yang sama.
Kadar Protein
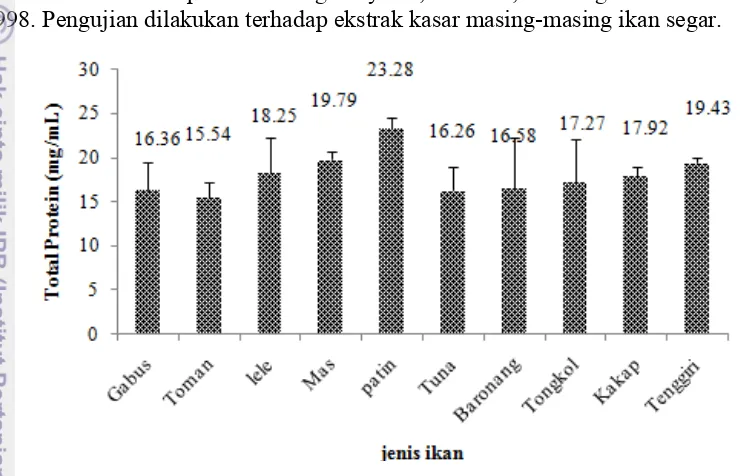
Pengujian kadar protein total dilakukan pada ekstrak daging pada semua sampel dilakukan dengan menggunakan metode Bradford (1976). Hasil pembacaan spektrofotometri larutan standar BSA pada metode Bradford menghasilkan kurva standar dan memiliki persamaan regresi y = 0,051x + 0,193 dengan nilai R2 sebesar 0,998. Pengujian dilakukan terhadap ekstrak kasar masing-masing ikan segar.
Gambar 6 Kadar protein total ikan air tawar dan ikan air laut.
16
Kadar Albumin
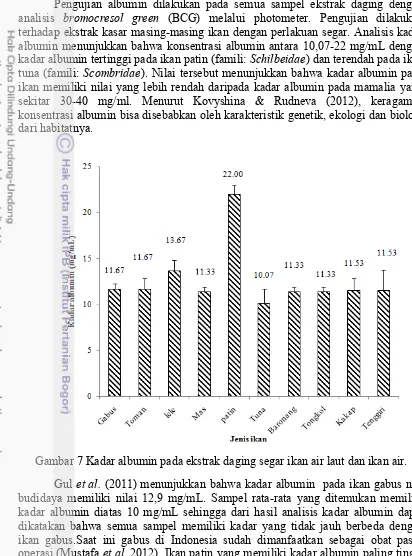
Pengujian albumin dilakukan pada semua sampel ekstrak daging dengan analisis bromocresol green (BCG) melalui photometer. Pengujian dilakukan terhadap ekstrak kasar masing-masing ikan dengan perlakuan segar. Analisis kadar albumin menunjukkan bahwa konsentrasi albumin antara 10,07-22 mg/mL dengan kadar albumin tertinggi pada ikan patin (famili: Schilbeidae) dan terendah pada ikan tuna (famili: Scombridae). Nilai tersebut menunjukkan bahwa kadar albumin pada ikan memiliki nilai yang lebih rendah daripada kadar albumin pada mamalia yaitu sekitar 30-40 mg/ml. Menurut Kovyshina & Rudneva (2012), keragaman konsentrasi albumin bisa disebabkan oleh karakteristik genetik, ekologi dan biologi dari habitatnya.
Gambar 7 Kadar albumin pada ekstrak daging segar ikan air laut dan ikan air.
17
kandungan protein sekitar 28% (Asmah et al. 2014). Kandungan protein
mempengaruhi kandungan albumin pada setiap ikan.Hal ini dibuktikan dari analisis regresi dengan albumin memberikan pengaruh nyata terhadap total protein sebesar sebesar 68%, nilai b memiliki nilai positif sebesar 0,52 yang berarti jika albumin tinggi maka nilai protein juga tinggi dengan persamaan regresi y= 1,140+0,52x. Keragaman konsentrasi albumin bisa disebabkan oleh karakteristik genetik, ekologi dan biologi dari habitatnya dan jenis daging dari ikan (Andreeva 2010; Kovyshina & Rudneva 2012).
Kadar albumin antara ikan laut dan ikan tawar pada penelitian ini secara umum memperlihatkan bahwa albumin ikan air tawar yaitu ikan patin dan lele memiliki konsentrasi yang lebih tinggi dibandingkan ikan air laut. Hasil kadar albumin berdasarkan standar deviasi didapatkan nilai tertinggi pada ikan patin dan lele. Susilowati et al. (2015) menyebutkan ikan lele dan gurame (telestoi) mempunyai konsentransi albumin yang tinggi sekitar 25-50% dari total protein. Keberadaan nilai albumin yang tinggi pada ikan ini diduga karena ikan memiliki peran fisiologis terkait dengan fungsi albumin dalam tubuh.
Albumin saat ini digunakan untuk kepentingan kesehatan manusia sehingga banyak dimanfaatkan sebagai produk farmasi (Nugroho 2012). Albumin saat ini banyak dimanfaatkan dalam mempercepat pemulihan jaringan sel yang rusak pasca operasi. Kadar albumin murni manusia pada kondisi normal berkisar antara 3,5-5,5 g/dL. Saat ini dunia medis masih banyak menggunakan HSA sebagai alternatif albumin 12,9 mg/mL, sedangkan pada penelitian ini rata-rata albumin dari beberapa ikan ini memiliki kadar antara 10-22 mg/mL. Hasil penelitian menunjukkan bahwa ikan pada penelitian terutama golongan ikan berkumis (patin, lele) dapat digunakan sebagai sumber albumin.
Profil Protein Albumin
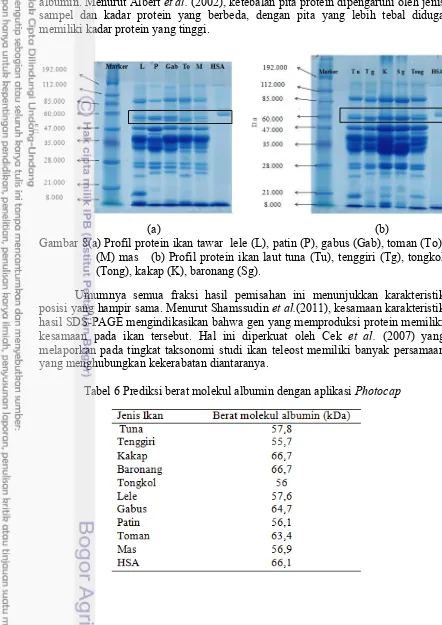
Analisis protein secara kualitatif pada daging ikan dilakukan dengan metode SDS-PAGE. Pemilihan metode ini bertujuan untuk menentukan jenis protein berdasarkan berat molekulnya. Prinsip pemisahannya yaitu berdasarkan perbedaan ukuran molekul. Sampel yang akan dianalisis jenis proteinnya merupakan sampel dari ekstrak daging segar ikan. Gel yang digunakan sebagai matriks penyangga pada penelitian ini adalah gel akrilamida 12,5%.
Secara umum sampel ikan air tawar (Gambar 8a) memiliki profil protein yang hampir sama, semua sampel memiliki 10-12 pita yang menunjukkan profil protein.Profil protein pada ikan lele terpisah menjadi 12 fraksi. Bila dibandingkan dengan HSA, lele tidak memiliki berat molekul yang sama pada level albumin. Sekitar 3 fraksi bisa dikatakan berada pada level antara ovalbumin (44 kDa) dan HAS (66 kDa). Metcalf et al.( 2005) melaporkan bahwa berat molekul 13 kDa pada
18
Ikan patin, toman dan mas memiliki karakteristik yang hampir sama, namun untuk patin dan ikan mas tidak memiliki berat molekul yang sama dengan HSA, sedangkan pada ikan toman memiliki berat molekul yang sama pada level albumin dengan HSA yaitu 69 kDa. Pada ikan patin memiliki fraksi yang tebal pada level albumin. Menurut Albert et al. (2002), ketebalan pita protein dipengaruhi oleh jenis sampel dan kadar protein yang berbeda, dengan pita yang lebih tebal diduga memiliki kadar protein yang tinggi.
(a) (b)
Gambar 8(a) Profil protein ikan tawar lele (L), patin (P), gabus (Gab), toman (To), (M) mas (b) Profil protein ikan laut tuna (Tu), tenggiri (Tg), tongkol (Tong), kakap (K), baronang (Sg).
Umumnya semua fraksi hasil pemisahan ini menunjukkan karakteristik posisi yang hampir sama. Menurut Shamssudin et al.(2011), kesamaan karakteristik hasil SDS-PAGE mengindikasikan bahwa gen yang memproduksi protein memiliki kesamaan pada ikan tersebut. Hal ini diperkuat oleh Cek et al. (2007) yang melaporkan pada tingkat taksonomi studi ikan teleost memiliki banyak persamaan yang menghubungkan kekerabatan diantaranya.
19
Hasil SDS PAGE diukur menggunakan aplikasi photocap, menunjukkan pada ikan
tuna dan ikan tongkol memiliki dua pita protein pada berat molekul sekitar 57 kDa. Kemiripan tersebut dimungkinkan karena kedua ikan memiliki karakteristik yang sama, ikan pelagis dan berasal dari famili yang sama yaitu Scombridae, sedangkan pada ikan kakap dan ikan kakap dan ikan baronang yang memiliki berat molekul yang sama dengan albumin pada manusia, kedua ikan tersebut merupakan ikan berdaging putih dan merupakan ikan golongan demersal. Menurut Silva et al.
(2015), keberadaan albumin pada ikan dipengaruhi oleh faktor internal dan eksternal, seperti tingkat salinitas, bentuk tubuh, dan makanan.
Tabel 7 Luas area pita albumin diukur dengan ImageJ
!
!
Hasil profil protein menunjukkan bahwa setiap pita memiliki ketebalan yang berbeda. Ketebalan pita protein dipengaruhi oleh jenis sampel dan kadar protein yang berbeda (Albert et al. 2002). Tebal tipisnya pita yang terbentuk dari pita protein menunjukkan kandungan atau volume protein yang mempunyai berat molekul yang sama yang berada pada posisi pita yang sama.Ketebalan pita dapat diukur mengunakan ImageJ. Hasil uji regresi statistika menunjukkan hubungan antara kadar albumin dan ketebalan/ luas area pita mengikuti persamaan regresi y = 6,92E-16+0,788x dengan R2 = 0,62. Berdasarkan tingkat korelasinya maka luas area pita berpengaruh terhadap kadar albumin ikan.Tabel 7 menunjukkan bahwa pada ikan patin, kakap dan baronang memilki ketebalan yang paling besar diantara yang lain, yang artinya kadar albumin dari ikan tersebut diduga memiliki kandungan yang tinggi.
!
4 SIMPULAN DAN SARAN
Simpulan
20
kadar albumin tertinggi terdapat pada ikan patin. Profil protein untuk albumin menunjukan berat molekul antara 55-66 kDa. Hasil SDS-PAGE menunjukkan bahwa toman, kakap dan baronang memiliki berat molekul yang mendekati berat
molekul Human Serum Albumin (HSA).
Saran
Perlu dilakukan penelitian lebih lanjut tentang albumin dari ikan terutama yang berasal dari Siluformis agar dapat dimanfaatkan lebih lanjut sebagai produk nutraseutikal. Selain hal tersebut perlu juga dilakukan metode untuk dapat mengindentifikasi albumin secara spesifik salah satunya dengan Western Blot. Metode ekstraksi yang tepat untuk menghasilkan ekstrak albumin ikan dengan kualitas yang sesuai untuk medis perlu dikaji lebih lanjut.
DAFTAR PUSTAKA
Alberts B, Johnsons A, Lewis J, Raff M, Roberts K, Walter P. 2002. Molecular Biology of The Cell. New York (USA): Garland Science
Andreeva AM. 2010. Structure of fish serum albumin. Journal of Evolution Biology and Physiology. 46:135-144.
Asmah R, Sumaiyah S, Nurul SR. 2014. Comparison of protein, total fat and omega-3 fatty acids content in yellowtail catfish (Pangasius pangasius) and long tail shad (Hilsa (clupea) macrura) in raw and pressurized fish.
International Food Research Journal. 21(6): 2146-2153.
Bradford MM. 1976. A rapid and sensitive mothod for quantification of microgram quantities of protein utilizing the principle of protein dye binding. Analysis Biochemistry. 72: 234-254.
Brojo M. 1999. Ciri-ciri morfometrik ikan nila (Oreochromis niloticus) strain chitralada dan strain gift. Jurnal Ilmu-Ilmu Perairan dan Perikanan Indonesia. 6 (2):21-38.
Cawthorn DM, Steinman HA, Witthuhn RC. 2012. DNA barcoding reveals a high incidence of fish species misrepresentation and substitution on the South African market. Food Research International. 46 (12):30-40
Cek S, Yilmaz E. 2007. Gonad development and sex ratio of sharptooth catfish (Clarias gariepinus Burchell, 1822) cultured under laboratory conditions.
Turkish Journal of Zoology. 31: 35-46.
David A. 1962. Brief taxonomic account of the Gangetic Pangasius pangasius
(Ham.) with description of a new sub-species from the Godavari.Proculer. Indian Academy Science. 34(3), 136-156.
Firlianty, Suprayitno E, Nursyam H, Hardoko, Mustafa A. 2013. Chemical composition and amino acid profile of channidae collected from Central Kalimantan, Indonesia. International Journal of Science and Technology.
21
Gul Y, Gao ZX, Qian XQ, Wang WM. 2011. Haematological and serum biochemical characterization and comparison of wild and cultured northern snakehead (Channaargus Cantor, 1842). Journal Application Ichthyology. 27:122–128.
Harahap JP, Soewoto H, Sadikin M, Kurniaty MMV, Wanadi SJ, Retno D, Abadi P Jusman SWA, Prijanti R. 2001. Biokimia Eksperimen Laboratorium. Jakarta (ID): Widya Medika.
Herbert PDN, Cywinska A, Ball SL, de Waard JR.2003. Biological identifications through DNA barcodes. Proceedings of the Royal Society of London Series B – Biological Sciences. 270: 313–321.
Hollingsworth PM. 2011. Refining the DNA barcode for land plants. Proceedings of the National Academy of Sciences. 108(49):19451-19452.
Jais Mat AM. 2007. Pharmacognosy and pharmacology of Haruan (Channa
striatus), amedicinal fish with wound healing properties. Review. Boletín Latino americano y del Caribe dePlantas Medicinales Aromáticas. 6(3): 52– 60.
Kekkonen M, Mutanen M, Kaila L, Nieminen M, Hebert PDN. 2015. Delineating spesies with DNA barcodes : a case of taxon dependent method performance in Moths. Plos One Jounal. 10(4):1-32
Kovyrshina TB, Rudneva II. 2012. Comparative study of serum albumin level in
round Gobyneobius Melanostomus form Black sea and Azov sea.
International Journal Advanced Biology. 2:203-208.
Kusumaningrum GA, Alamsyah MA, Masithah ED. 2014. Uji kadar albumin dan pertumbuhan ikan gabus (Channa striata) dengan kadar protein pakan komersial yang berbeda. Jurnal Ilmiah Perikanan dan Kelautan. 6(1):25-29 Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head
of bacterophage T4. Nature. 227: 680-685.
Laltanpuii, Kumar NS, Mathai MT. 2014. Molecular and phylogenetic analysis of the genus Orthetrum (Odonata: Anisoptera: Libellulidae) using mitochondrial COI gene. Science Vision. 14(3): 152-257
Metcalf VJ, Brennan S, Chambers G, George P. 1998. The albumins of chinook salmon (Oncorhynchus tshawytscha) and brown trout (Salmotrutta) appear to lack a propeptide. Archives Biochemical Biophysis. 350:239–244.
Metcalf VJ, Gemmell. 2005. Fatty acid transport in cartilaginous fish : absence of albumin and possible utilization of lipoproteins. Fish Physiology and Biochemistry. 31(10) : 55-64.
Metcalf VJ, Peter M, George, Brennan SO. 2007. Lungfish albumin is more similar to tetrapod than to teleost albumins: purification and characterization of albumin from the Australian lungfish, Neoceratodus fosteri. Comparative Biochemistry and Physology Part B. 147: 428-437.
Murray RK, Granner DK, Mayes PA dan Rodwell VW. 2003. Harper’s illustrated
biochemistry (26th edition). McGraw-Hill Companies, Inc.
22
Mustafa AS, Sujuti H, Permatasari N, Widodo MA. 2013. Determination of nutrient contents and amino acid composition of pasuruan Channa striata Extract.
International Journal of Science and Technology. 2(4):1-11.
Muthmainnah D. 2013. Hubungan panjang berat dan faktor kondisi ikan gabus (Channa striata Bloch, 1793) yang dibesarkan di Rawa Lebak, Provinsi Sumatera Selatan. Jurnal Depik. 2(3): 184-190.
Nakano T, Ozawa T. 2004. Phylogeny and historical biogeography oflimpets of the order Patellogastropoda based on mitochondrial DNA sequences. Journal Mollusca Study. 70: 31–41.
Nugroho M. 2012. Isolasi albumin dan karakteristik berat molekul hasil ekstraksi secara pengukusan ikan gabus (Ophiocephalusstriatus). Jurnal Teknologi Pangan. 4(1):1-18.
Nugroho ED, Rahayu DA. 2015. Status taksonomi ikan nomei dari perairan Tarakan Kalimantan Utara berdasarkan gen 16S rRNA sebagai upaya konservasi ikan laut lokal Indonesia. Jurnal Harpodon Borneo. 8(2):132-142. Peters T Jr. 1995. All about albumin. Academic Press. United States
Prehadi, Sembiring A, Kurniasih EM, Rahmad, Arafat D, Subhan B, Maduppa HH. 2015. DNA barcoding and phylogenetic reconstruction of shark landen in muncar fisheries landing site in comparision with south java fishing port.
Biodiversitas. 16(1):55-61
Putri AA, Yuliet, Jamaluddin. 2015. Analisis kadar albumin ikan sidat (Anguilla marmorata bicolor) dan uji aktivitas penyembuhan luka terbuka pada kelinci.
Journal of Pharmacy. 3(1):35-41
Restu M, Mukrimin, Gusmiaty. 2012. Optimalisasi teknik ekstraksi dan isolasi DNA tanaman suren (Toona sureni Merr) untuk analisis keragamn genetic berdasarkan random amplified polymorphic DNA (RAPD). Jurnal Nature Indonesia. 14(2):138-142
Romadhoni AR, Afrianto E, Pratama RI, Grandiosa R. 2016. Extraction of snakehead fish (Ophiocephalus striatus) into fish protein concentrate as albumin source using various solvent. Aquatic Procedia. 7(2):4-11
Shafri MMA, Manan MJ. 2012. Therapeutic potentialof the Haruan (Channa striatus): from food tomedicinal uses. Malaysian Journal of Nutrition. 18(1):125–136.
Shamsuddin S, Shaguffa JK, Gayasuddin M. 2011. Comparative study of serum proteins of man and four teleost : using polyacrilamide gel electrophoresis.
Advances in Biological Research. 5(3):170-173
Silva D, Cortez CM, Natalia P, Nogueira, Bastos FF. 2015. Purification and pshico-chemical study of serum albumin of two neotropical fish spesies from the Sao Fransisco river Bassin, Brazil. Biota Neotropica. 15(3):1-4
Steffens W. 2006. Freshwater fish wholesome food stuffs. Bulgarian Journal Agricultural Science.12 : 320-328.
Suprayitno E. 2003. Penyembuhan Luka dengan Ikan Gabus. FakultasPerikanan. Universitas Brawijaya. Malang
23
ikan. Jurnal pascapanen dan Bioteknologi Kelautan dan Perikanan. 15(1) : 37-44
Tamura K, Dudley J, Nei M, Kumar S. 2007. MEGA 4: Molecular Evolutionary Genetiks Analysis (MEGA) Software Version 4.0. Moleculer Biological Evolotion. 2(4): 1596.
Teletchea C Maudet, Hänni C. 2005. Food and forensic molecular identification: update and challenges. Trends Biotechnol. 23(7): 359-366.
24
LAMPIRAN
Lampiran 1 Spesies yang dipakai
!
!
!
Keterangan :
1 = ikan lele 5 = ikan kakap 9 = ikan tuna
2 = ikan mas 6 = ikan baronang 10 = ikan gabus
3 = ikan toman 7 = ikan tongkol
4 = ikan patin 8 = ikan tenggiri
! !
!
25
Lampiran 2 Kurva Standar Uji Bradford
!
!
!
!
!
!
!
!
!
!
!
!
26
Lampiran 3 Komposisi larutan elektroforesis (SDS-PAGE)
Larutan Komposisi Jumlah
Lampiran 4 Komposisi separating gel dan stacking gel SDS PAGE
Komponen Separating gel (12,5%) Stacking gel (3%)
27
28