PENGARUH PEMBERIAN EKSTRAK BUNGA PACAR AIR (Impatiens balsaminae Flos) TERHADAP HEPAR
MARMUT JANTAN
SKRIPSI
OLEH:
CHINDA RUMENTA SINAGA NIM: 081524017
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH PEMBERIAN EKSTRAK BUNGA PACAR AIR (Impatiens balsaminae Flos) TERHADAP HEPAR
MARMUT JANTAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar sarjana farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
CHINDA RUMENTA SINAGA NIM: 081524017
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENGARUH PEMBERIAN EKSTRAK BUNGA PACAR AIR (Impatiens balsaminae Flos) TERHADAP HEPAR
MARMUT JANTAN
OLEH:
CHINDA RUMENTA SINAGA NIM: 081524017
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: November 2010
Dekan,
(Prof. Dr. Sumadio Hadisahputra, Apt.) NIP 195311281983031002
Panitia Penguji,
Prof. Dr. Urip Harahap, Apt. NIP 195301011983031004
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Dr. Rosidah, M.Si., Apt. NIP 195103261978022001
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001 Disetujui Oleh :
Pembimbing I,
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Pembimbing II
KATA PENGANTAR
Puji dan syukur Kepada Tuhan Yang Maha Esa yang telah melimpahkan
rahmat dan karunianya sehingga penulis dapat menyelesaikan penelitian dan
penulisan skripsi yang berjudul “Pengaruh pemberian ekstrak bunga pacar air
(Impatiens balsaminae Flos) terhadap hepar marmut jantan” untuk memenuhi
syarat guna mencapai gelar sarjana farmasi pada Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terimakasih yang tak terhingga kepada Ayahanda L. Sinaga dan ibunda D. Br.
Silitonga serta kakak dan adik saya yang telah memberikan bantuan moril dan
materil serta dorongan dan doa yang sangat berarti selama proses penyusunan
skripsi ini.
Melalui tulisan ini ucapan terimakasih yang tulus dan ikhlas atas
bimbingan, petunjuk, pemberian fasilitas serta saran dan bantuan lainnya, sebelum
dan selama penelitian juga disampaikan kepada:
1. Ibu Dra. Aswita Hafni Lubis, M.Si., Apt. Dan Bapak Dr. Edy Suwarso,
SU., Apt., selaku dosen pembimbing yang telah membimbing penulis
dengan penuh kesabaran selama penelitian hingga selesainya skripsi ini.
2. Bapak Prof. Dr. Urip Harahap., Apt., Ibu Dr. Rosidah, M.Si., Apt., dan Ibu
Dra. Suwarti Aris, M.Si., Apt., selaku penguji yang telah menguji dan
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara yang telah mensyahkan dan
memberikan pengarahan dalam penyusunan skripsi ini.
4. Bapak Drs. Immanuel S. Meliala, M.Si., Apt. selaku dosen wali yang
selama ini telah banyak membina dan membimbing penulis selama masa
pendidikan.
5. Asisten Laboratorim Obat tradisional dan staf – staf farmasi yang banyak
memberikan dorongan dan bantuan selama penelitian
6. Semua mahasiswa/wi farmasi khususnya farmasi ekstensi 2008 yang tidak
disebutkan satu persatu, terimakasih untuk semangat dan do’a nya.
Semoga skripsi ini dapat menjadi sumbangan yang berarti bagi ilmu
pengetahuan khususnya pada ilmu farmasi. Penulis mengharapkan kritik dan saran
demi kesempurnaan skripsi ini.
Medan, November 2010
Penulis
PENGARUH PEMBERIAN EKSTRAK TUMBUHAN BUNGA PACAR AIR (Impatiens balsamina Linn)
TERHADAP HEPAR MARMUT JANTAN ABSTRAK
Tumbuhan bunga pacar air (Impatiens balsamina Linn) secara empiris digunakan untuk mengobati berbagai penyakit salah satunya adalah anti inflamasi biasanya digunakan dalam jangka waktu yang lama. Berdasarkan hal tersebut maka penelitian ini bertujuan untuk mengetahui keamanan pemberian sediaan tersebut dengan melihat pengaruhnya terhadap kerusakan pada hepar marmut jantan dosis tunggal selama 14 hari. Sebanyak 25 ekor marmut jantan (300-400 g) dibagi menjadi 5 kelompok, masing-masing kelompok 5 ekor. Kelompok 1 sebagai kontrol, kelompok 2, 3, 4 dan 5 masing-masing diberi ekstrak etanol tumbuhan bunga pacar air dosis 155 mg/kg BB, 310 mg/kg BB, 620 mg/kg BB, 1240 mg/kg BB. Ekstrak etanol tumbuhan bunga pacar air diberikan secara tunggal pada hari pertama penelitian kemudian selama 14 hari diamati keadaan marmut ada atau tidak kematian kemudian pada hari ke 15 marmut dibunuh untuk diamati histologik dari hepar marmut tersebut.
Ekstrak etanol tumbuhan bunga pacar air tidak menyebabkan perbedaan yang nyata diantara kelompok kontrol dan perlakuan 2, 3, 4 terhadap histologik hepar marmut, Tetapi pada perlakuan 5 dengan dosis 1240 mg/kg BB menunjukkan kelainan pada hepar marmut yaitu nekrosis dimana inti sel, sinusoid dan vena sentralis dari hepar marmut mulai tidak tampak jelas, Sehingga dapat disimpulkan bahwa pemberian ekstrak etanol tumbuhan bunga pacar air pada dosis 155mg/kg BB hingga 620 mg/kg BB aman terhadap hewan coba marmut.
EFFECT OF PLANT EXTRACT
FLOWER PACAR AIR (Impatiens balsamina Linn) ON MALE GUINEA PIG LIVER
ABSTRACT
Pacar air flower plant (Impatiens balsamina Linn) areempiically used to treat various diseases one of which is arthritic and anti-inflamatory usually used in a long time. Based on, this study aims to determine the safety of such stocks by looking at the effect on liver damage picture of male guinea pig and a single dose for 14 days. A total of 25 heads of male guinea pig (300-400 g) were devided into 5 groups, each group of 5 animal. Group 1 as control, group 2, 3, 4 and 5 each were given the ethanol extract of pacar air flower plant dose 155 mg/kg BW, 310 mg/kg BW, 620 mg/kg BW, 1240 mg/kg BW. Ethanol extract of pacar air flower plant given a single on the first day of research and then for 14 days were observed state of guinea pig if there is death and then on day 15 guinea pig were killed for histological picture observed liver.
Ethanol extract of pacar air plant do not cause significant differences between contol and treatment groups 2, 3, 4 againts guinea pig liver histological picture, but in the treatment of 5 doses 1240 mg/kg BW showed abnormalities in the guinea pig liver necrosis in which the nucleus of cells, sinusoids and central veins of guinea pig liver started to not seem abvious, so it can be concluded that administration of ethanol extract of pacar air flower plant at doses of 155 mg/kg BW to 620 mg/kg BW is safe to experimental animals and guinea pigs not safe for use on long-term treatment.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan masalah ... 2
1.3 Hipotesis Penelitian ... 2
1.4 Tujuan penelitian ... 2
1.5 Kerangka Konsep penelitian ... 3
BAB II TINJAUAN PUSTAKA 2.1 Uraian tumbuhan ... 4
2.1.1 Sistematika Tumbuhan ... 4
2.1.2 Sinonim ... 4
2.1.3 Nama daerah ... 4
2.1.4 Morfologi tanaman pacar air ... 4
2.2 Ekstraksi ... 5
2.3 Uraian kimia ... 7
2.3.1 Flavonoida ... 7
2.3.2 Antosianin ... 8
2.3.3 Glikosida ... 10
2.4 Fisiologi hati... 12
2.4.1 Struktur Hati ... 12
2.4.2 Aliran darah dan tekanan darah hati ... 12
2.4.3 Fungsi hati ... 13
2.4.4 pemeriksaan Fungsi hati ... 14
2.5 Patofisiologi hati... 15
2.5.1 Hipertensi porta ... 15
2.5.2 Splenomegali ... 15
2.5.3 Ikterus ... 16
2.5.4 Sirosis ... 16
2.5.5 Hepatitis ... 17
BAB III METODOLOGI PENELITIAN 3.1 Alat-alat yang digunakan……… ... 18
3.2 Bahan-bahan yang digunakan... ... 18
3.3 Hewan percobaan ... 19
3.4 Pengambilan dan pengolahan sampel ... 19
3.4.1 Identifikasi Sampel ... 19
3.4.2 Pengambilan Sampel ... 19
3.5 Karakterisasi Simplisia... ... 20
3.5.1 Pemeriksaan makroskopik ... 20
3.5.2 Pemeriksaan mikroskopik ... 20
3.5.3 Penetapan kadar air ... 20
3.5.4 Penetapan kadar sari larut dalam air... 21
3.55 Penetapan kadar sari yang larut dalam etanol ... 22
3.5. 6 Penetapan kadar abu total ... 22
3.5.7 Penetapan kadar abu yang tidak larut dalam asam... 22
3.6 Pembuatan ekstrak... 23
3.7 Uji farmakologi ... 23
3.7.1 Pembuatan suspensi CMC 0,5% ... 23
3.7.2 Pembuatan suspensi ekstrak etanol bunga pacar air ... 23
3.7.3 Prosedur uji pengaruh ekstrak etanol bunga pacar air Terhadap hepar marmut ... 24
3.7.4 Pembuatan preparat histopatologi ... 25
BAB IV. HASIL DAN PEMBAHASAN 4.1 Pemeriksaan tumbuhan ... 28
4.1.1 Identifikasi tumbuhan... 28
4.1.2 Karakterisasi tumbuhan... 28
4.1.3 Metode ekstraksi yang digunakan... 29
4.2 Uji farmakologi ... 30
4.2.1 Pengelompokka marmut dan pemberian dosis... 30
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Halaman
Tabel 1. Hasil Karakterisasi Simplisia bunga pacar air ... 28
Tabel 2. Hasil Jumlah marmut mati setelah pemberian ekstrak bunga
DAFTAR GAMBAR
Halaman
Gambar 1. Diagram kerangka konsep... 3
Gambar 2. Kerangka senyawa struktur ... 7
Gambar 3. Sistem penomoran pada struktur dasar flavonoida ... 8
Gambar 4. Struktur antosianin ... 9
Gambar 5. Struktur salisin ... 10
Gambar 6. Strukutur Sinirgin ... 10
Gambar 7. Strukutr krotonosida ... 11
Gambar 8. Strukutur barbaloin ... 11
Gambar 9. Penampang atau permukaan dari hepar manusia ... 13
Gambar 10.Histopatologi hepar marmut perlakuan 5 dengan dosis 1240 mg/kg bb perbesaran 10 X 40 ... 31
Gambar 11.Perlakuan 1 (kontrol) CMC perbesaran 10 X 40 ... 32
Gambar 12.Perlakuan 2 dosis 155 mg/kgbb perbesaran 10 X 40 ... 32
Gambar 13.Perlakuan 3 dosis 310 mg/kgbb perbesaran 10 X 40 ... 32
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Identifikasi Tumbuhan ... 36
Lampiran 2. Gambar tanaman dan bunga pacar air warna merah ... 37
Lampiran 3. Bagan pengolahan sampel ... 38
Lampiran 4. Gambar simplisia dan serbuk simplisia bunga pacar air ... 39
Lampiran 5. Gambar mikroskopik bunga pacar air ... 40
Lampiran 6 Hasil perhitungan karakteristik serbuk simplisia ... 41
Lampiran 7. Bagan pembuatan ekstrak bunga pacar air secara maserasi 46
Lampiran 8. Bagan alur pengujian ekstrak unga pacar air te Hepar marmut ... 47
Lampiran 9. Hepar marmut jantan setelah dibedah dan di fiksasi... 48
Lampiran 10.Contoh Perhitungan dosis ... 49
Lampiran 11.Volume maksimum larutan sediaan uji yang dapat diberikan Pada beberapa hewan uji ... 51
PENGARUH PEMBERIAN EKSTRAK TUMBUHAN BUNGA PACAR AIR (Impatiens balsamina Linn)
TERHADAP HEPAR MARMUT JANTAN ABSTRAK
Tumbuhan bunga pacar air (Impatiens balsamina Linn) secara empiris digunakan untuk mengobati berbagai penyakit salah satunya adalah anti inflamasi biasanya digunakan dalam jangka waktu yang lama. Berdasarkan hal tersebut maka penelitian ini bertujuan untuk mengetahui keamanan pemberian sediaan tersebut dengan melihat pengaruhnya terhadap kerusakan pada hepar marmut jantan dosis tunggal selama 14 hari. Sebanyak 25 ekor marmut jantan (300-400 g) dibagi menjadi 5 kelompok, masing-masing kelompok 5 ekor. Kelompok 1 sebagai kontrol, kelompok 2, 3, 4 dan 5 masing-masing diberi ekstrak etanol tumbuhan bunga pacar air dosis 155 mg/kg BB, 310 mg/kg BB, 620 mg/kg BB, 1240 mg/kg BB. Ekstrak etanol tumbuhan bunga pacar air diberikan secara tunggal pada hari pertama penelitian kemudian selama 14 hari diamati keadaan marmut ada atau tidak kematian kemudian pada hari ke 15 marmut dibunuh untuk diamati histologik dari hepar marmut tersebut.
Ekstrak etanol tumbuhan bunga pacar air tidak menyebabkan perbedaan yang nyata diantara kelompok kontrol dan perlakuan 2, 3, 4 terhadap histologik hepar marmut, Tetapi pada perlakuan 5 dengan dosis 1240 mg/kg BB menunjukkan kelainan pada hepar marmut yaitu nekrosis dimana inti sel, sinusoid dan vena sentralis dari hepar marmut mulai tidak tampak jelas, Sehingga dapat disimpulkan bahwa pemberian ekstrak etanol tumbuhan bunga pacar air pada dosis 155mg/kg BB hingga 620 mg/kg BB aman terhadap hewan coba marmut.
EFFECT OF PLANT EXTRACT
FLOWER PACAR AIR (Impatiens balsamina Linn) ON MALE GUINEA PIG LIVER
ABSTRACT
Pacar air flower plant (Impatiens balsamina Linn) areempiically used to treat various diseases one of which is arthritic and anti-inflamatory usually used in a long time. Based on, this study aims to determine the safety of such stocks by looking at the effect on liver damage picture of male guinea pig and a single dose for 14 days. A total of 25 heads of male guinea pig (300-400 g) were devided into 5 groups, each group of 5 animal. Group 1 as control, group 2, 3, 4 and 5 each were given the ethanol extract of pacar air flower plant dose 155 mg/kg BW, 310 mg/kg BW, 620 mg/kg BW, 1240 mg/kg BW. Ethanol extract of pacar air flower plant given a single on the first day of research and then for 14 days were observed state of guinea pig if there is death and then on day 15 guinea pig were killed for histological picture observed liver.
Ethanol extract of pacar air plant do not cause significant differences between contol and treatment groups 2, 3, 4 againts guinea pig liver histological picture, but in the treatment of 5 doses 1240 mg/kg BW showed abnormalities in the guinea pig liver necrosis in which the nucleus of cells, sinusoids and central veins of guinea pig liver started to not seem abvious, so it can be concluded that administration of ethanol extract of pacar air flower plant at doses of 155 mg/kg BW to 620 mg/kg BW is safe to experimental animals and guinea pigs not safe for use on long-term treatment.
BAB I PENDAHULUAN 1.1Latar Belakang
Pemanfaatan tanaman obat di Indonesia secara tradisional semakin diminati
karena efek samping lebih kecil dari obat yang dibuat secara sintesis. Mahalnya
obat sintetik membuat masyarakat beralih ke tanaman obat. Penggunaan tanaman
obat di masyarakat terutama untuk mencegah penyakit, menjaga kesegaran tubuh
maupun mengobati penyakit (Hernani dan Rahardjo, 2004). Seiring dengan
perkembangan dunia kedokteran, tidak dapat dipungkiri bahwa cara pengobatan
yang berkembang di masyarakat saat ini adalah dengan cara alami karena efek
sampingnya lebih kecil daripada pengobatan yang tidak alami. Penelitian ilmiah
yang berhasil mengungkapkan khasiat, manfaat terapi penyakit, mendorong
munculnya paradigma baru dalam dunia kedokteran modern, yaitu back to nature
(Mangan, 2003).
Tumbuhan yang digunakan pada penelitian ini adalah bunga dari tumbuhan
pacar air (Impatiens balsamina Linn), tumbuhan pacar air ini merupakan tanaman
hias yang mudah di dapat, warna bunga tumbuhan ini ada beberapa macam yaitu
merah, ungu merah jingga, putih, dll. Bunga yang digunakan pada penelitian ini
adalah berwarna merah karena zat warna merah pada bunga pacar air ini
merupakan antosianin, selain berwarna merah juga terdapat warna lembayung,
dan biru (Harborne, 1987). Pemanfaatan antosianin dalam bidang farmasi adalah
sebagai pewarna alami pada makanan, kosmetik, berpotensi sebagai antioksidan,
Berdasarkan uraian di atas maka dilakukan penelitian tentang karakterisasi
simplisia dari bunga pacar air (Impatiens balsaminae Flos) berwarna merah dan
belum ada didalam buku Materia Medika Indonesia, sehingga hasil penelitian ini
dapat digunakan sebagai acuan. Ekstraksi terhadap simplisia bunga pacar air ini
dilakukan secara maserasi, sehingga diperoleh ekstrak kental. Selanjutnya
dilakukan uji histopatologi untuk mengetahui pengaruh ekstrak tumbuhan bunga
pacar air terhadap hepar marmut jantan (cavia cobaya).
1.2Perumusan Masalah
Berdasarkan uraian diatas perumusan masalahnya adalah:
a. apakah dengan melakukan identifikasi tumbuhan bunga pacar air (Impatiens
balsamina Linn) dapat diketahui karakteristiknya?
b. apakah pemberian ekstrak etanol tumbuhan bunga pacar air (Impatiens
balsamina Linn) mempunyai pengaruh terhadap hepar marmut jantan?
1.3Hipotesis Penelitian
Hipotesis dari penelitian ini adalah:
a. karakterisitik simplisia dapat diketahui dengan melakukan karakterisasi
tumbuhan bunga pacar air (Impatiens balsamina Linn).
b. ekstrak etanol tumbuhan bunga pacar air (Impatiens balsamina Linn)
mempunyai pengaruh terhadap hepar marmut jantan.
1.4Tujuan Penelitian
Tujuan penelitian ini adalah:
a. untuk memperoleh data ilmiah karakterisasi tumbuhan bunga pacar air
b. untuk membuktikan adanya pengaruh pemberian ekstrak etanol tumbuhan
bunga pacar air pada hepar marmut jantan.
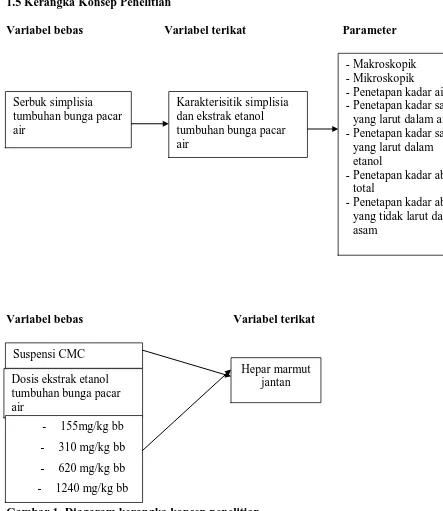
1.5Kerangka Konsep Penelitian
Variabel bebas Variabel terikat Parameter
Variabel bebas Variabel terikat
Gambar 1. Diagaram kerangka konsep penelitian.
Serbuk simplisia - Penetapan kadar air - Penetapan kadar sari
yang larut dalam air - Penetapan kadar sari
yang larut dalam etanol
- Penetapan kadar abu total
BAB II
TINJAUAN PUSTAKA 2.1. Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Sistematika dari tumbuhan bunga pacar air merah (Hutapea, dkk., 1994)
adalah sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta
Klass : Magnoliopsida
Ordo : Sapindales
Famili : Balsaminaceae
Genus : Impatiens
Spesies : Impatiens balsamina Linn
2.1.2 Sinonim
Sinonim tanaman pacar air adalah Impatiens cornuta Linn, Impatiens
hortensis Desf, Impatiens mutila D.C., Balsamina mutila DC
2.1.3. Nama Daerah
Nama daerah dari bunga pacar air merah adalah lahine (Nias), pacar
banyu (Jawa), pacar cai (Sunda), paru inai (Sumbar), pacar toya (Belitung)
(Hariana, Arief, 2007).
2.1.4 Morfologi Tanaman Pacar Air
Pacar air berasal dari India. Di Indonesia ditanam sebagai tanaman hias,
kadang-kadang ditemukan tumbuh liar. Terna berbatang basah dan tegak ini
Helaian daun bentuk lanset memanjang, ujung dan pangkal runcing, tepi bergerigi,
pertulangan menyirip, dan warnanya hijau muda. Bunga keluar dari ketiak daun
tanpa daun penumpu, Bunga bewarna cerah, ada beberapa macam warna. Seperti
merah, merah jingga, ungu, putih, dll. Ada yang “engkel” dan ada yang “dobel”.
Buahnya buah kendaga, bila masak akan membuka menjadi 5 bagian yang terpilin
(Anonim 2, 2010).
2.1.5 Kandungan Kimia dan Efek Farmakologis
Kandungan kimia Bunga yaitu antosianin, kaempherol, dan kuersetin. Efek
farmakologis bunga pacar air di antaranya peluruh haid, tekanan darah tinggi
(hipertensi), pembengkakkan akibat terpukul (hematoma), bisul (furunculus),
rematik sendi, gigitan ular tidak berbisa, dan radang kulit (dermatitis) (Hariana,
Arief, 2007).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam
golongan minyak atsiri, alkaloida, flavonoida, dan lain-lain. Dengan diketahuinya
senyawa aktif ysng dikandung simplisia akan mempermudah pemilihan pelarut
dan cara ekstraksi yang tepat (Ditjen POM, 2000).
Pembagian metode ekstraksi menurut Ditjen POM (2000) yaitu :
A. Cara dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan
ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam
rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan
kosentrasi larutan zat aktif didalam sel dan diluar sel maka larutan terpekat
didesak keluar. Proses ini berulang sehingga terjadi keseimbangan konsentrasi
antara larutan didalam dan diluar sel.
Maserasi adalah proses penyarian simplisia yang mengandung zat aktif yang
mudah larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa
air, etanol, metanol, etanol-air atau pelarut lainnya. Remaserasi berarti dilakukan
penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan
seterusnya.
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan
peralatan yang digunakan sederhana yang mudah diusahakan.
2. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan
penyari melalui serbuk simplisia yang telah dibasahi. Proses perkolasi terdiri dari
tahapan pengembang bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak
(perkolat).
B. Cara panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur tititk didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
2. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang pada umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dan dan jumlah
pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur
yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-500 C.
4. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai titik
didih air, yakni 30 menit pada suhu 90-1000 C.
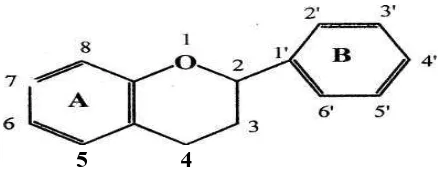
2.3 Uraian Kimia 2.3.1 Flavonoida
Senyawa flavonoida adalah senyawa polifenol yang mempunyai 15 atom
karbon, terdiri dari dua cincin benzen tersubstitusi yang dihubungkan oleh satu
rantai alifatik yang mengandung tiga atom karbon. Kerangka dasar dari struktur
flavonoida adalah sistem C6-C3-C6 (Manitto, 1981;Robinson, 1995;
Sastrohamidjojo, 1996). Gambar dapat dilihat pada gambar 1 dibawah ini.
Gambar 2. Kerangka dasar struktur flavonoid
Sistem penomoran pada struktur dasar flavonoida, gambar dapat dilihat
5 4
Gambar 3. Sistem penomoran pada struktur dasar flavonoida
Cincin A dan oksigen cincin tengah berdasarkan alur biosintesisnya terbentuk
melalui jalur poliketida. Sedangkan cincin B dan tiga atom karbon cincin tengah
menunjukkan flavonoida yang berasal dari jalur sikimat (Manitto, 1981 dan
Salisbury, 1992).
Aglikon flavonoida pada umumnya terdapat dalam berbagai bentuk
struktur molekul dengan beberapa bentuk kombinasi glikosida, sehingga dalam
menganalisis flavonoida lebih baik memeriksa aglikon yang telah dihidrolisis
dibanding dengan bentuk glikosida, karena stukturnya yang rumit dan kompleks.
Modifikasi flavonoida dapat terjadi dengan berbagai tahap dan menghasilkan
penambahan (pengurangan) hidroksilasi, metilasi gugus hidroksil atau inti
flavonoida, metilenasi gugus orto-dihidroksil, dimerisasi (pembentukan
biflavonoida), dan yang terpenting glikosilasi gugus hidroksil (pembentukan
flavonoida O-glikosida) atau inti flavonoida (pembentukan flavonoida
C-glikosida) (Harborne, 1987 dan Markham, 1988).
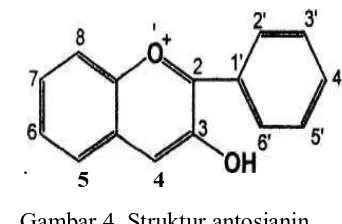
2.3.2. Antosianin
Antosianin adalah pigmen berwarna merah, ungu, dan biru yang terdapat
pada seluruh tumbuhan kecuali fungus. Sebagian besar antosianin dalam bentuk
glikosida, biasanya mengikat satu atau dua unit gula seperti glukosa, galaktosa,
ramnosa, dan silosa. Jika monoglikosida, maka bagian gula hanya terikat pada
aglikionnya disebut antosianidin. Sebagian besar antosianin berwarna kemerahan
dalam larutan asam, tetapi menjadi ungu dan biru dengan meningkatnya PH yang
akhirnya rusak dalam larutan alkali kuat (Sastrohamidjojo, 1996; Salisbury,
1992). Gambar dapat dilihat pada gambar 3 dibawah ini.
. .
Gambar 4. Struktur antosianin
Antosianin adalah zat penyebab warna merah, orange, ungu, dan biru.
Banyak terdapat pada bunga dan buah-buahan seperti bunga mawar, pacar air,
kembang sepatu, bunga tasbih atau kana, krsan, pelargonium, aster cina, dan buah
apel, chery, anggur, stoberi, buah manggis serta umbi ubi jalar. Penggunaan zat
pewarna alami, misalnya pigmen antosianin masih terbatas pada beberapa produk
makanan, seperti produk minuman (sari buah, juice, dan susu) (Saati, 2006).
Pigmen antosianin yang merupakan flavonoid merupakan pigmen yang
paling luas dan penting karena banyak tersebar pada berbagai organ tanaman,
terutama pada bunga (ditetukan hampir 30% terkandung dalam berat keringnya).
Pelarut yang sering digunakan untuk mengekstrak antosianin adalah alkohol,
etanol dan metanol, isopropanol, aseton atau dengan air (aquadest) yang
dikombinasikan dengan asam, seperti asam klorida (HCL), asam aserat, asam
format, atau asam askorbat (Saati, 2006).
2.3.3 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis akan
menghasilkan satu atau lebih gula yang disebut glikon dan bagian bukan gula
yang disebut aglikon. Gula yang paling sering dijumpai dalam glikosida ialah
glukosa (Lewis, 1977). Glikosida dihidrolisis dengan cara pendidihan dalam asam
encer dan secara kimia maupun fisiologi, glikosida alam cenderung dibedakan
berdasarkan bagian aglikonnya (Robinson, 1995).
Berdasarkan hubungan ikatan antara glikon dan aglikonnya, glikosida
dapat dibagi menjadi empat (Farnsworth, 1966), yaitu :
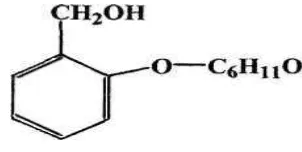
1 . O-glikosida, jika ikatan antara glikon dan aglikon dihubungkan oleh atom
O, contohnya salisin, gambar dapat dilihat pada gambar 4 dibawah ini.
Gambar 5. struktur salisin
2. S-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
S. contohnya sinigrin, gambar dapat dilihat pada gambar 4 dibawah ini.
Gambar 6. struktur sinigrin
3. N-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh
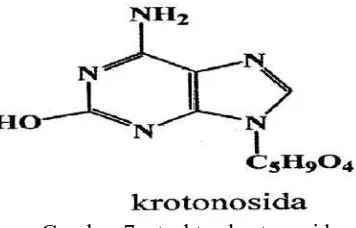
Gambar 7. struktur krotonosida
4. C-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
C, contohnya barbaloin. Gambar dapat dilihat pada gambar 7 dibawah ini.
Gambar 8. struktur barbaloin
Bentuk O-glikosida sangat mudah terurai oleh pengaruh asam, basa,
enzim, air, dan panas. Semakin pekat kadar asam atau basa maupun semakin
panas lingkungannya maka glikosida akan semakin mudah dan cepat terhidrolisis.
Gula yang sering berikatan pada glikosida adalah P-D-glukosa. Tetapi ada juga
mengandung gula lain misalnya galaktosa, ramnosa, digitoksosa, dan simarosa.
Glikosida berbentuk kristal atau amorf yang umumnya larut dalam air atau etanol
encer (kecuali pada glikosida resir). Oleh karena itu, umumnya sediaan farmasi
yang mengandung glikosida diberikan dalam bentuk eliksir, ekstrak, tingtur
dengan kadar etanol yang rendah. Secara umum, kegunaan glikosida dalam dunia
pengobatan diantaranya sebagai obat jantung, pencahar, pengiritasi lokal, dan
2.4 Fisiologis Hati
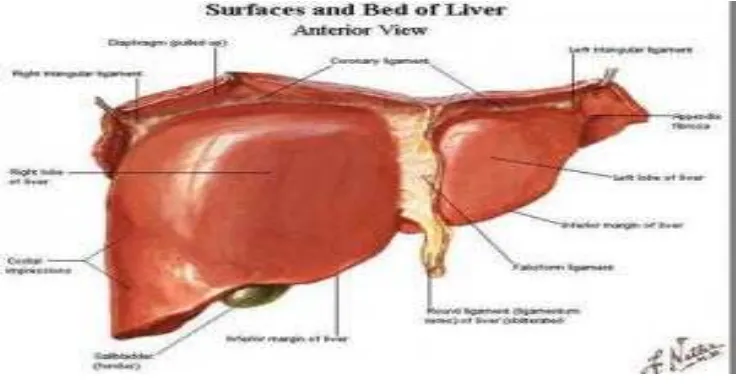
Hepar merupakan kelenjar yang terbesar dalam tubuh. Hati terletak di
dalam rongga abdomen sebelah kanan atas di bawah diafragma. Dalam keadan
normal hati berwarna coklat kemerahan dengan konsistensi padat kenyal
(Ganong, 1998).
2.4.1 Struktur Hati
Hati (hepar) terbungkus oleh sebuah kapsul fibrolastik yang diebut kapsul
Glisson dan secara makroskopik dipisahkan menjadi lobus kiri dan kanan. Kapsul
Glisson berisi pembuluh darah, pembuluh limfe, dan saraf. Kedua lobus hati
tersusun oleh unit-unit yang lebih kecil disebut lobulus. Lobulus terdiri atas sel-sel
hati (hepatosit) yang menyatu dalam sautu lempeng. Hepatosit dianggap sebagai
unit fungsiaonal hati. Sel-sel ahti dapat melakukan pembelahan sel dan mudah
diproduksi kembali saat dibutuhkan untuk mengganti jaringan yang rusak
(Ganong, 1998).
2.4.2 Aliran Darah dan Tekanan Darah Hati
Hati menerima uplai darah dari dua sumber yang berbeda. Sebagian beasar
aliran darah hati, sekitar 1000 ml per menit, adalah drah vena yang beraal dari
lambung, usus halus dan usus besar, pankreas, dan limpa. Darah ini mengalir ke
hati melalui vena porta. Darah vena kurang mengandung oksigen tetapi kaya
zat-zat gizi, termasuk glukosa, yang dapat diubah menjadi glikogen dan disimpan
dengan cepat. Darah tersebut juga mungkin mengandung bakteri usus, racun, dan
obat yang dicerna. Sumber darah hait yang lain adalah arteri hepatika yang
mengalirkan darah sekitar 500 ml per menit. Darah arteri ini memiliki saturasi
mengalir ke dalam kapiler hati yang disebut sinusoid, dari sinusoid darah mengalir
ke sebuah vena hepatika. Vena hepatika mengosongkan isisnya ke dalam vena
kava, memiliki tekanan hampir 0 mm Hg (Corwin J, 2008).
Gambar 9. Penampang atau permukaan dari hepar manusia
2.4.3 Fungsi Hati
Ada beberapa fungsi hati yaitu :
1. mengubah glukosa menjadi glikogen dan trigliserida
2. menyimapan glikogen danmengubah asam amino menjadi asam lemak atau
simpanan asam amino
3. membuat lipoprotein dari trigliserida dan kolesterol
4. menghasilkan glukosa dan glikogen (glikogenolisis) dan asam lemak srta
asam amino (glikogenelisis)
5. mengubah lemak menjadi keton (makin cepat jika puasa)
6. menghasilkan urea dari katabolisme protein
7. menyerap darah yang disaring
9. menghasilkan beberapa faktor pembekuaan yang berkaitan dengan koagulasi
darah seperti membentuk fibrinogen, protrombin, benda asing menusuk kena
pembuluh darah.
10. mensintesis albumin, protein plasma lain dan garam empedu
11. terlibat dalam aktivai vitamin D, menghasilkan angiotensin, mensekresi
faktor pertumbuhan seperti insulin (somatomedin) (Corwin J, 2008).
2.4.4 Pemeriksaan Fungsi Hati
Pemeriksaan fungsi hati serring dilakukan. Sebagian dari pemeriksaan
yang sering dilakukan adalah:
• pengukuran bilirubin total serta pengukuran terpisah kadar bilirubin
terkonjugasi dan tidak terkonjugasi. Kadar bilirubin meningkat pada berbagai
penyakit hati.
• pengukuran enzim-enzim hati, termasuk serum glutamat piruvat transaminase
(SGPT), serum glutamat oksaloasetat transaminase (SGOT), dan alkalin
fosfatase. Kadar meningkat bila terdapat penyakit hati.
• pengkuran konsentrasi protein plasma. Kadar meningkat pada penyakit hati.
• pengukuran masa protrombin (suatu pemeriksaan koagulasi), karena koagulasi
bergantung pada pembentukan faktor koagulasi di hati yang adekuat, masa
protrombin meningkat pada penyakit hati
• ultrasound, scan computed tomography (CT), dan magnetic rsonance imaging
(MRI) dapat menunjukkan cacat struktural atau batu dalam duktus biliaris atau
• biopsi hati dilakukan untuk mengamati jaringan secara langsung guna
memastikan adanya infeksi, infiltrasi atau fibrosis lemak dan kanker (Corwin J,
2008).
2.5 Patofisiologis Hati 2.5.1 Hipertensi Porta
Hipertensi porta adalah peningkatan berlebihan tekanan di vena porta.
Tekanan vena porta normal adalah 3 mm Hg. Tekanan di atas 9 sampai 10 mm Hg
di vena porta sudah dianggap sebagai hipetensi porta. Hipertensi porta terbentuk
saat reistensi terhadap aliran darah yang menuju dan dari hati tinggi. Selain itu,
aliran darah yang berlebihan menuju hati dapat menyebabkan hipertensi porta
(Junqeira. C & Carneiro J, 2007).
2.5.2 Pirau Vena Porta Sistemik
Sewaktu hipertensi porta mengurangi aliran darah yang melewati hati,
maka akan terbuka pembuluh-pembuluh kolateral, atau pirau (shunt) antara vena
porta dan vena-vena sistemik yang mengalirkan darah dari dinding abdomen,
esofagus, dan rektum. Pirau mengalirkan aliran darah dengan melintasi hati.
Pembuluh-pembuluh berdinding tipis ini kurang sempurna untuk menangani
aliran darah yang sedemikian deras dan mulai membentuk varises (vena yang
melebar dan berkelok-kelok). Varises mudah pecah terutama di esofagus dapat
menimbulkan pendarahan besar (Junqeira. L & Carneiro J, 2007).
2.5.3 Splenomegali
Splenomegali adalah perbesaran limpa. Pada hipertensi porta, aliran darah
dialihkan ke limpa melalui vena splenik. Sebagian darah ekstra (sampai beberapa
membesar. Darah yang tersempan di limpa tidak dapat digunakan oleh sikualsi
umum, maka dapat terjadi anemia (penurunan sel darah merah), trombositopenia
(penurunan trombosit) dan leukopenia (penurunan sel darah putih) (Corwin J,
2008).
2.5.4 Ikterus
Ikterus (jaundis) adalah kekuningan pada kulit dan sklera mata akibat
kelebihan bilirubin dalam darah (lebih dari 1,2 mg/dl). Bilirubin adalah produk
penguraian sel darah merah. Terdapat tiga jenis utama ikterus:
• ikterus hemolitik disebakan oleh lisis (penguraian) sel darah merah yang
berlebihan. Ikterus hemolitik merupakan penyebab ikterus pra hepatika karena
terjadi akibat faktor-faktor yang tidak harus berkaitan dengan hati.
• ikterus intrahepatik disebabkan oleh obstruksi kanalikus bilairis kecil dapat
terjadi bersama tumor atau batu intrahepatik atau dapat disebabkan oleh
inflamasi yang meluas.
• ikterus obstruksi ekstrahepatik dapat terjadi apabila duktus biliaris tersumbat
oleh batu empedu atau oleh tumor (Junqeira. L & Carneiro J, 2007).
2.5.5 Sirosis
Sirosis adalah kondisi fibrosi dan pembentukan jringan aprut yang
berdifusidi hati. Sirosis terjadi di hati sebagai respon terhadap cedera sel berulang
dan reaksi peradangan yang ditimbulkannya. Penyebab sirosis antara lain adalah
infeksi misalnya hepatitis, obstruksi kanalikulus dan pecahnya kanalikulus sera
2.5.6 Hepatitis
Hepatitis adalah peradangan hati. Penyakit ini dapat disebabkan oleh
infeksi atau toksin termasuk alkohol, dan di jumpai pada kanker hati. Gejala dan
tanda masing-masing hepatitis serupa namun penularan dan hasil akhirnya
berbeda (Corwin J, 2008).
BAB III
METODOLOGI PENELITIAN
Metode penelitian ini adalah metode eksperimental yang meliputi identifikasi
tumbuhan, pengumpulan bahan tumbuhan, pengolahan sampel, karakterisasi
simplisia secara gravimetri dan azoetropi, pembuatan ekstrak secara meserasi, dan
mengetahui pengaruh ekstrak terhadap hepar marmut melalui kematian dan
histopatologi.
3.1 Alat–alat yang digunakan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas
laboratorium, blender (National), oven listrik (Stork), neraca kasar (Ohaus),
neraca analitik (Mettler tolede), penangas air (Yenaco), krus tang, eksikator,
penguap vakum putar (Buchi 461), krus porselin, tanur (Gallenkamp), seperangkat
alat penetapan kadar air, bejana, pipa kapiler, hair dryer,kandang marmut, sonde
lambung, spuit, lumpang dan stamfer, dan stopwatch, pisau, block besi, mikrotom,
objek glass, deck glass, mikroskop cahaya.
3.2 Bahan-bahan yang digunakan
Bahan-bahan yang digunakan pada penelitian ini adalah tumbuhan bunga
pacar air dan semua bahan kimia yang digunakan berkualitas pro analisis kecuali
dinyatakan lain adalah etanol 96% (hasil destilasi), kloroform, toluen, formalin
5%, xylol, parafin, larutan hematoksilin, larutan eosin, balsam kanada, CMC
3.3 Hewan Percobaan
Hewan yang digunakan dalam penelitian ini adalah marmut jantan dengan
berat badan 300 g-400 g sebanyak 25 ekor dibagi dalam 5 kelompok yang
masing-masing terdiri dari 5 ekor marmot.
Sebelum pengujian, hewan coba dikarantina terlebih dahulu selama 7- 14 hari.
Karantina ini bertujuan untuk mengkondisikan hewan dengan suasana
laboratorium, dan untuk menghilangkan stres akibat transportasi. Hewan uji diberi
makanan rumput selama penelitian berlangsung.
3.4 Pengambilan dan pengolahan sampel 3.4.1 Identifikasi sampel
Identifikasi tumbuhan oleh Balai Penelitian dan Pengembangan Botani,
Puslibang Biologi – LIPI, Bogor. Hasil identifikasi tumbuhan yang diteliti adalah
Impatiens balsamina Linn, suku Balsaminaceae. Hasil identifikasi dapat dilihat
pada lampiran 1 halaman 36.
3.4.2 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkannya
dengan daerah lain. Sampel yang digunakan adalah bunga pacar air (Impatiens
balsaminae Flos) yang bewarna merah dan segar, diperoleh dari depan halaman
rumah masyarakat di jalan Palas Raya no. 1 simpang Simalingkar Medan.
Tanaman bunga pacar air dapat dilihat pada lampiran 2 halaman 37.
3.4.3 Pengolahan sampel
Bunga pacar air merah yang telah dikumpulkan dibersihkan dari pengotoran
dengan menggunakan air bersih, ditiriskan, ditimbang berat basahnya yaitu 7 kg
yaitu 2790 g. Sampel dianggap kering bila diremas rapuh, sampel selanjutnya
diserbuk dengan menggunakan blender. Bagan pengolahan dapat dilihat pada
lampiran 3 halaman 38.
3.5 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik, pemeriksaan
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total,
penetapan kadar abu yang tidak larut dalam asam (MMI, 1989, WHO, 1992).
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan untuk mengetahui ciri-ciri, bentuk, dan
ukuran dari simplisia tumbuhan bunga pacar air merah (Impatiens balsamina
Linn) secara organoleptis dengan cara mengamati warna, bau, dan rasa. Simpilsia
dan serbuk simplisia dapat dilihat pada lampiran 4 halaman 39.
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan cara
menaburkan diatas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutup
dengan kaca penutup, kemudian dilihat dibawah mikroskop. Hasil pemeriksaan
mikroskopik dapat dilihat pada lampiran 5 halaman 40 .
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
a. Penjenuhan Toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas
bulat, didestilasi selama 2 jam, kemudian toluen didinginkan selama 30 menit dan
volume air pada tabung penerima dibaca dengan ketelitian 0,05.
a. Penetapan Kadar Air
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama, dimasukkan
kedalam labu alas, labu dipanaskan hati-hati selama 15 menit. Setelah toluen
mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar
air terdestilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi,
bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5
menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah
air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml.
selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam
bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
Perhitungannya dapat dilihat pada lampiran 6 halaman 41.
3.5.4 Penetapan Kadar Sari Yang Larut Dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter)
dalam labu tersumbat sambil dikocok selama 6 jam pertama, dibiarkan selama 18
jam. Disaring, sejumlah 20 ml filtrat diuapkan sampai kering, dalam cawan
dangkal berdasarkan rata dan telah ditara dan sisa dipanaskan pada suhu 1050 C
sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah
dikeringkan (MMI, 1989). Perhitungannya dapat dilihat pada lampiran 6 lanjutan
3.5.5 Penetapan Kadar Sari Yang Larut Dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96% dalam labu tersumbat sambil dikocok sesekali
selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring
cepat untuk menghindari penguapan etanol, 20 ml filtrat diuapkan sampai kering
dalam cawan dangkal berdasar rata yang telah ditara dan dipanaskan pada suhu
1050 C sampai bobot tetap. Kadar sari dalam etanol dihitung terhadap bahan yang
telah dikeringkan (MMI, 1989). Perhitungannya dapat dilihat pada lampiran 6
lanjutan halaman 43.
3.5.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan
dalam krus porslen yang telah dipijar dan ditara, kemudian diratakan dan
dipijarkan pada suhu 6000 C sampai arang habis. Kemudian didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang
telah dikeringkan (WHO, 1992). Perhitungannya dapat dilihat pada lampiran 6
lanjutan halaman 44.
3.5.7 Penetapan Kadar Abu Yang Tidak Larut Asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml
asam klorida 2N selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci dengan
air panas. Residu dan kertas saring dipijarkan pada suhu 6000 C sampai bobot
tetap. Kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan (WHO, 1992). Pehitungannya dapat
3.6 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan secara maserasi dengan menggunakan pelarut
etanol yang mengandung HCl pekat (1% dari jumlah penyari/pelarut). Prosedur
pembuatan ekstrak sebagai berikut Sebanyak 200g simplisia direndam di dalam
wadah kaca dengan pelarut yang mengandung HCl pekat (1%. dari jumlah
penyari/pelarut), (2000 ml penyari ditambahkan dengan 20 ml HCl pekat).
Rendam selama 24 jam sambil sekali-kali diaduk, setelah 24 jam maserat disaring,
kemudian di maserasi lagi dengan penambahan pelarut yang mengandung HCl
pekat (1% dari jumlah penyari/pelarut), Ekstraksi telah sempurna ditandai dengan
hasil saringan maserat tidak bewarna lagi. Ekstrak yang diperoleh dikumpulkan
dan dipekatkan. Bagan pembuatan ekstrak secara maerasi dapat dilihat pada
lampiran 7 halaman 46 .
3.7 Uji Farmakologi
3.7.1 Pembuatan Suspensi CMC 0,5%
Sebanyak 500 mg Na-CMC ditaburkan merata ke dalam lumpang yang telah
berisi air suling panas sebanyak 10 ml. Didiamkan 15 menit hingga diperoleh
massa yang transparan, digerus hingga terbentuk gel kemudian di encerkan
dengan sedikit air, dimasukkan ke dalam labu tentukur 100 ml, lalu ditambahkan
air suling sampai garis tanda.
3.7.2 Pembuatan Suspensi Ekstrak Etanol Tumbuhan Bunga Pacar Air dosis155 mg/kg BB, Dosis 310 mg/kg BB, Dosis 620 mg/kg BB, Dosis
1240 mg/kg BB
Ekstrak etanol tumbuhan bunga pacar air masing-masing sebanyak 155 mg,
penambahan CMC 0,5% sampai homogen, dimasukkan dalam labu tentukur 100
ml, dicukupkan sampai garis tanda.
3.7.3 Prosedur Uji Pengaruh Ekstrak etanol Bunga Pacar Air Terhadap Hepar Marmut
Sebelum pengujian, marmot dipuasakan selama 18 jam dengan tetap diberi
air minum. Marmot dikelompokkan ke dalam 5 kelompok yaitu
a. kelompok perlakuan 1 (kontrol) : diberi suspensi CMC 0,5% dosis
26,87mg/kg bb
b.kelompok perlakuan 2 (P2) : diberi ekstrak bunga pacar air dosis 155
mg/kg bb
c. kelompok perlakuan 3 (P3) : diberi ekstrak bunga pacar air dosis 310
mg/kg bb
d.kelompok perlakuan 4 (P4) : diberi ekstrak bunga pacar air dosis 620
mg/kg bb
e. kelompok perlakuan 5 (P5) : diberi ekstrak bunga pacar air dosis 1240
mg/kg bb
Ekstrak etanol tumbuhan bunga pacar air dan suspensi CMC diberikan
secara orang pada marmut dengan dosis tunggal. Pengamatan hewan uji dilakukan
pada jam 1,2 dan 4 setelah pemberian dan setiap hari selama 7-14 hari. Dicatat
hewan yang mati selama 7-14 hari, mati dalam rentang ≤ 3 hari, berarti mati
karena faktor dosis langsung dan jika mati pada hari ke 4 atau lebih umumnya
mati karena kerusakan organ. Dilakukan pemeriksaan kasar terhadap hewan uji
yang mati dan beberapa hewan yang hidup terutama yang tampak sakit pada akhir
percobaan. Pemeriksaan dilakukan untuk menunjukkan kemungkinan adanya
organ utama yang diperiksa adalah hepar marmut. Untuk mengetahui target
ekstrak tersebut terhadap hepar marmut maka dilakukan uji histopatologi. Bagan
pengujian dapat dilihat pada lampiran 8 halaman 47.
3.7.4 Pembuatan Preparat Histopatologi
Tahap Fiksasi
- sampel dipotong sesuai dengan yang diinginkan dengan ketebalan
potongan 2-3 mm
- direndamkan dalam larutan formalin selama 2-4 jam gambar fiksasi dapat
dilihat pada lampiran 9 halaman 48.
Tahap Dehidrasi
Sampel direndamkan dalam larutan alkohol yang ditingkatkan.
- alkohol 70% direndam selama 2 jam
- alkohol 80% direndam selama 2 jam
- alkohol 96% direndam selama 2 jam
Tahap Clearing
Sampel direndamkan dalam larutan xylol 3 kali perendaman.
- pada xylol 1 sampel direndam selama 1 jam
- pada xylol 2 sampel direndam selama 1 jam
- pada xylol 3 sampel direndam selama 1 jam
Tahap embedding (pemendaman)
Tahap Pencetakan (blocking)
Sampel dicetak/diblok dengan menggunakan cetakan yang terbuat dari
besi/kuningan. Caranya sampel diletakkan di dalam cairan parafin, kemudian
setelah beku dilakukan pemotongan dengan menggunakan alat mikrotom.
Tahap Pemotongan Blok
Blok yang telah di dapat dipotong dengan menggunakan mikrotom ketebalan
2-3 mµ. Setelah lembaran potongan di dapat maka:
- lembaran potongan diletakkan dipermukaan air dengan suhu 25-300C.
- lembaran akan mengembang yang ditandai dengan tidak adanya lipatan
pada lembaran potongan kemudian diambil dengan objek glas.
- dikeringkan di dalam oven lebih kurang 1 menit pada suhu 60-700C.
Tahap staining (pewarnaan/pemulasan)
Pewarnaan dasr yang lazim digunakan pada sediaan histopatologi adalah
pewarnaan hematoksilin dan eosin (H&E).
Prosedur pewarnaan:
a. sampel direndam dalam larutan xylol (disebut diparafinsasi).
- pada xylol 1 sampel direndam selama 5-10 menit
- pada xylol2 sampel direndam selama 5-10 menit
- pada xylol 3 sampel direndam selama 5-10 menit
b.Sampel dikeringkan dalam oven lebih kurang 1 menit.
c. Sampel direndam ke dalam larutan:
- alkohol 96% selam 5-10 menit
- alkohol 80% selama 5-10 menit
d.sampel dicuci dalam air mengalir selama 1 menit.
e. sampel direndam dalam larutan hematoksilin 2-3 menit.
f.sampel direndam dalam air mengalir sampai mendapatkan warna biru.
g.sampel direndam ke dalam larutan eosin selama 2-3 menit.
h.sampel dicuci dalam alkohol bertingkat yaitu alkohol 70%, 80%, 96% selama
5-10 menit.
i.kemudian sampel dikeringkan dengan menggunakan kertas filter.
j.sampel yang terdapat diobjek glas ditutup dengan dek glas yang diberi zat
perekat kanada balsam.
k.preparat yang diperoleh kemudian diamati patologinya dengan menggunakan
mikroskop cahaya. Hasil pengamatan mikroskopik dapat dilihat pada lampiran
BAB IV
HASIL DAN PEMBAHASAN 4.1 Pemeriksaan Tumbuhan
4.1.1 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Pusat Penelitian dan Pengembangan
Biologi-LIPI Bogor terhadap tumbuhan yang diteliti menunjukkan bahwa bahan
uji adalah bunga pacar air (Impatiens balsamina Linn.) yang bewarna merah, suku
Balsaminaceae. Identifikasi bertujuan untuk memastikan kebenaran tumbuhan
yang akan digunakan sebagai bahan uji.
4.1.2 Karakterisasi Simplisia
Hasil pemeriksaan makroskopik untuk simplisia bunga pacar air bewarna
merah diperoleh bentuk mengkerut dan bergulung , warna merah keunguan, dan
berbau khas. Hasil pemeriksaan makroskopik serbuk simplisianya diperoleh
bentuk serbuk, warna merah keunguan, dan berbau khas.
Pada pemeriksaan mikroskopik terlihat adanya epidermis, berkas
pengangkut, papila, kristal kalsium oksalat rapida, rambut penutup multiseluler,
serbuk sari berbentuk oval yang mempunyai isi didalamnya.
Hasil karakterisasi simplisia bunga pacar air dapat dilihat pada tabel di
bawah ini.
Tabel 1. Hasil karakterisasi simplisia bunga pacar air
No Pemeriksaan Karakterisitik Simplisia Hasil
1 Penetapan kadar air 9,31%
2 Penetapan kadar sari yang larut dalam air 20,47%
Tabel 1. (sambungan)
4 Penetapan kadar abu total 1,14%
5 Penetapan kadar abu yang tidak larut asam 0,25%
Pada penetapan karakterisasi yang dilakukan adalah hanya untuk bunga pacar air
yang berwarna merah, karena untuk pemeriksaan karakterisasi bahan yang
digunakan adalah bentuk simplisia, dan simplisia itu kecuali dinyatakan lain
adalah bahan yang telah dikeringkan.
Kadar air ditetapkan berkaitan dengan proses penyimpanan simplisia.
Kadar air harus memenuhi ketentuan yaitu tidak lebih dari 10% agar tidak rusak
dalam penyimpanan karena ditumbuhi kapang dan mikroorganisme lainnya
(Depkes RI, 1995).
Kadar abu total dan kadar abu tidak larut asam ditetapkan untuk melihat
kandungan mineral dari simplisia. Kadar abu yang tinggi menunjukkan banyaknya
zat anorganik yang terdapat dalam simplisia.
Kadar sari ditetapkan untuk mengetahui jumlah kandungan senyawa yang
polar dan non polar yang terdapat dalam simplisia. Kadar sari yang larut dalam air
lebih tinggi dari pada kadar sari yang larut dalam etanol, hal ini menunjukkan
bahwa bunga pacar air lebih banyak tersari dalam air dibandingkan dalam etanol
ini berarti bunga pacar air lebih mudah larut dalam air dibandingkan dalam etanol.
4.1.3 Metode Ekstraksi Yang Digunakan
Ekstraksi dilakukan secara maserasi dengan menggunakan pelarut etanol
dan dengan penambahan HCl pekat (1% dari pelarut/penyari), pelarut
ditambahkan dengan HCl pekat 1% dari penyari karena antosianin tidak mantap
memudar perlahan-lahan. Karena itu antosianin harus diekstraksi dari tumbuhan
dengan pelarut yang mengandung HCl pekat 1% dari penyari.
4.2 Uji Farmakologi
4.2.1 Pengelompokkan Marmut dan Pemberian Dosis
Hewan coba yang digunakan adalah marmut dengan berat badan 300 – 400
gram. Marmut dikelompokkan menjadi 5 kelompok. Cara pemberian ekstrak
bunga pacar air berwarna merah adalah secara oral. Kelompok 1 adalah kontrol,
kelompok 2 adalah perlakuan pemberian ekstrak bunga pacar air yang berwarna
merah dengan dosis 155 mg/kgbb, kelompok 3 perlakuan dengan dosis 310 mg/kg
bb, kelompok 4 perlakuan dengan dosis 620 mg/kg bb, kelompok 5 perlakuan
dengan dosis 1240 mg/kg bb.
4.2.1 Pengamatan Kematian dan Hasil Histopatologi Hepar Marmut
Hasil pengamatan kuantitatif selama 14 hari berupa jumlah marmut mati,
ditunjukkan dalam tabel 2. Dibawah ini yaitu Jumlah marmut mati 14 hari setelah
pemberian ekstrak bunga pacar air yang berwarna merah dosis tunggal secara oral
kelompok perlakuan jumlah marmut.
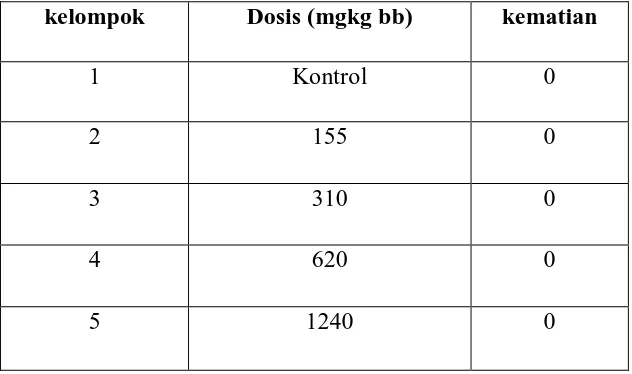
Tabel 2. Hasil jumlah marmut mati setelah pemberian ekstrak bunga pacar air dosis tunggal
kelompok Dosis (mgkg bb) kematian
1 Kontrol 0
2 155 0
3 310 0
4 620 0
Dari tabel diatas, tidak terdapat satupun marmut yang mati dari seluruh
kelompok. Setelah pengamatan selama 14 hari hewan coba tidak ada kematian
maka pada hari ke 15 marmut tersebut dibedah untuk dilakukan uji histopatologi.
Hepar marmut direndam dengan formalin 5% sebelum dilakukan uji tersebut.
Dapat diihat pada lampiran halaman .
Tujuan dari histopatologi tersebut adalah untuk mengetahui pengaruh
ekstrak tumbuhan bunga pacar air terhadap hepar marmut karena hati merupakan
kelenjar terbesar dan terberat yang terdapat di dalam tubuh yang memiliki fungsi
sebagai sintesis protein plasma, penyimpanan metabolit, sekresi empedu, fungsi
metabolit, detoksifikasi dan aktivasi (Junqeira. L & Carneiro J, 2007).
Dari hasil histopatologi yang dilakukan diFakultas Kedokteran Universitas
Sumatera menunjukkan:
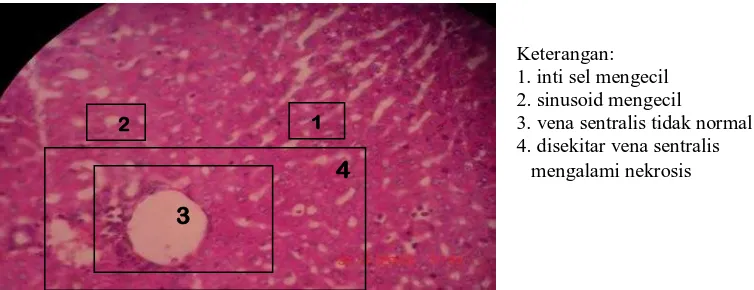
Gambar 10. Histopatologi hepar marmut perlakuan 5 dengan dosis 1240 mg/kg bb perbesaran 10 X 40
Hepar marmut pada dosis tinggi yaitu 1240 mg/kg bb menunjukkan inti sel
, sinusoid, vena sentralis mulai tidak terlihat jelas, terutama inti sel dari hepar dari
marmut terlihat kecil. Hepar marmut juga mengalami nekrosis disekitar vena
sentralis. Ini membuktikan bahwa dosis 1240 mg/kg bb ekstrak bunga pacar air
berwarna merah mulai menunjukkan gejala-gejala kerusakan yang ringan.
2 1
4
3
Keterangan: 1. inti sel mengecil 2. sinusoid mengecil
3. vena sentralis tidak normal 4. disekitar vena sentralis
Untuk preparat histopatologi perlakuan 1, 2 dan 3 tidak menunjukkan
gejala pada jaringan hepar marmut dan perbedaan dengan kontrol tidak begitu
berbeda.
Gambar 11. Perlakuan1 kontrol CMC perbe Gambar 12. Perlakuan 2 dosis 155 saran 10 X 40 mg/kg bb perbesaran
10 X 40
Gambar 13. Perlakuan 3 dosis 320 Gambar 14. Perlakuan 4 dosis 620 mg/kgbb perbesaran 10 X 40 mg/kgbb perbesaran
10 X 40
Dengan demikian dapat dinyatakan bahwa dosis tunggal oral 155 mg/kg
bb, 310 mg/kg bb, 620 mg/kg bb tidak menunjukkan pengaruh yang signifikan
terhadap hepar marmut, hingga pada dosis 1240 mg/kg bb menunjukkan gejala
ringan yang mempengaruhi morfologi dari hepar marmut yang ditunjukkan
dengan adanya kelainan pada hepar marmut yaitu nekrosis hepar (kematian sel
hepar).
2
3
1 2
1
3
1
2
3
3
1
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil karakterisasi simplisia diperoleh kadar air 9,31%, kadar sari yang larut
dalam air 20,47%, kadar sari yang larut dalam etanol 12,80%, kadar abu total
1,14% dan kadar abu yang tidak larut asam 0,25%.
Ekstrak etanol tumbuhan bunga pacar air memberikan pengaruh terhadap
hepar marmut pada dosis 1240 mg/kg bb ditandai dengan terjadinya nekrosis
disekitar vena sentralis dari hepar marmut.
5.2 Saran
Disarankan kepada peneliti selanjutnya yang ingin memeriksa dan
mengetahui kerusakan dari hepar akibat pemberian sediaan sebaiknya terlebih
dahulu meneliti dan mengukur kadar enzim GOT (Glutamat Oksaloasetat
Transaminase) dan GPT (Glutamat Piruvat Transaminase) untuk mengetahui lebih
jelas kerusakan yang terjadi pada hepar marmut kemudian dilanjutkan dengan
melakukan histopatologi organ hepar dan organ-organ lain yang merupakan target
sediaan tersebut guna memastikan adanya infeksi dan kerusakan lainnya.
Disarankan kepada peneliti selanjutnya untuk meneliti toksisitas akut, sub
DAFTAR PUSTAKA
Anonim 1. (2010). Bunga Pacar Air [on-line]. Diakses 2 Februari 2010.
Anonim 2. (2010). Pacar Air [on-line]. Diakses 24 Februari 2010.
Anggriani, R. (2010). Karakterisasi Simplisia Dan Isolasi Senyawa Antosianin Dari Bunga Pacar Air (Impatiens balsamina Linn) Berwarna Merah. Skripsi. Fakultas Farmasi USU Medan. Halaman 38, 42.
Corwin, J.E. (2009). Buku Saku Patofisiologi. Terjemahan Nike Budhi. S. Edisi III. Cetakan I. Jakarta. Buku kedokteran EGC. Halaman 647-660.
Departemen Kesehatan RI. (1989). Materia Medika Indonesia. Jilid IV. Jakarta: Depkes RI. Halaman. 516-522, 536-540.
Departemen Kesehatan RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 1030-1031.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama. Depkes RI. 10-13.
Farnsworth, N. (1996). Biological and Phytochemical Screening of Plant. Journal of Pharmaceutical Sciences. Volume 55. No.3. Chicago: Reheis Chemical Company. P.262-263.
Ganong, William.F. (1998). Buku Ajar Patofisiologi Kedokteran. Edisi 17. Jakarta. Buku Kedokteran EGC. Halaman 486-490.
Gunawan, D. dan S, Mulyani. (2004). Ilmu Obat Alam (Farmakognosi). Penebar Swadaya. Jakarta. P 139
Harborne, J.B. (1987). Metode Fitokimia. Penuntun Cara Modern Menganalisa Tumbuhan, Terjemahan K. Padmawinata. Edisi II. Bandung: ITB Press. Halaman.76, 78.
Heriana, Arief. (2007).Tumbuhan Obat dan Khasiatnya. Seri Agrisehat. Penebar Swadaya. Jakarta. 151-152.
Hernani dan Rahardjo. (2004). Gulma Berkhasiat Obat. Jakarta: Penebar Swadaya. Halaman.1-3.
Junqueira, Carlos L., dan Carneiro, J. (2007). Histologi Dasar. Edisi 10. Cetakan I. Jakarta. Buku Kedokteran – EGC. Halaman 1- 22.
Mangan, Y. (2003). Cara Bijak Menaklukkan Kanker. Jakarta : Agromedia Pustaka. Halaman 28 – 29.
Manitto, P. (1981). Biosintesis Produk Alami. Terjemahan Koesmardiyah. Cetakan Pertama. Penerbit IKIP. Semarang. 381-382.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoid. Terjemahan K.Padmawinata. ITB Press. Bandung . 23-24, 42-43.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi keenam. Terjemahan K. Padmawinata. ITB. Bandung. 191-192, 195-197.
Saati, Elfi. A. (2006). Membuat Pewarna Alami. Cetakan I. Surabaya. Trubus Agrisarana. Halaman 30-33.
Salisbury, F.B., C.W. Roos. (1992). Plant Physiology. Kuala Lumpur. 78-79.
Lampiran 2. Gambar tanaman dan bunga pacar air (Impatiens balsamina Linn.) berwarna merah
Tanaman Pacar Air (Impatiens balsamina Linn.)
Lampiarn 3. Bagan Pengolahan Sampel
Bunga pacar air
Dibersihkan dari pengotoran l i
Dicuci sampai bersih, ditiriskan
ditimbang
Berat basah 7000 gram
Dikeringkan pada suhu ± 40 0C
Ditimbang
Berat kering 2790 gram
Dihaluskan
Lampiran 4. Gambar simplisia dan serbuk simplisia bunga pacar air warna merah (Impatiens balsaminae Flos)
Simplisia bunga pacar air warna merah
Lampiran 5. Gambar mikroskopik bunga pacar air
mikroskopik serbuk simplisia bunga pacar air perbesaran 10X40
Keterangan: 1. Rambut penutup
2. Kristal kalsium oksalat bentuk rapida
3. Serbuk sari bentuk oval yang mempunyai isi di dalamnya
4. Papila
5. Berkas pengangkut
6. Sel epidermis
1
Lampiran 6.
Hasil perhitungan karakteristik serbuk simplisia 6.1 Penetapan Kadar Air
Lampiran 6 (Lanjutan)
6.2 Penetapan Kadar Sari yang Larut dalam Air
Lampiran 6 (lanjutan)
6.3 Kadar Sari Larut dalam Etanol
Lampiran 6 (lanjutan)
6.4 Penetapan Kadar Abu Total
Lampiran 6 (lanjutan)
6.5 Penetapan Kadar Abu yang Tidak Larut dalam Asam
Lampiran 7. Bagan pembuatan ekstrak bunga pacar air secara maserasi
200 g serbuk simplisia bunga pacar air (Impatiens balsaminae Flos)
di maserasi cairan penyari etanol (96%) dan ditambahkan HCl pekat 1% dari penyari atau pelarut
Filtrat Ampas
Diuapkan dengan penguap vakum putar pada suhu 500 C
dipekatkan
Lampiran 8. Bagan alur pengujian ekstrak bunga pacar air terhadap hepar marmut
Marmot dengan fisik yang sehat
aklimatisasi 2 minggu
Lampiran 9. Hepar marmut jantan setelah dibedah dan difiksasi
Hepar marmut jantan setelah dibedah
Hepar marmut jantan difiksasi dengn formalin 5% kontrol Dosis 155
mg/kg bb Dosis 310
mg/kgbb Dosis 620
mg/kgbb Dosis 1240
Lampiran 10. Contoh perhitungan dosis
Contoh perhitungan dois ekstrak tumbuhan bunga pacar air
Dosis penggunaan ekstrak tumbuhan bunga pacar air berwarna merah pada
manusia = 2000mg
Korelai dosis manusia dengan hewan marmut = 0,031
Korelasi dosis marmut X dosis manuusia = 0,031 X 2000 mg
= 62 mg
Maka dosis yang digunakan:
kgbb
Dosis ekstrak yang diberikan untuk marmut dengan berat badan 400g
1. X mg kgbb mg
Jumlah sediaan yang dibuat :
10% = 10 g/100 ml
= 100 mg/ml
Jumlah larutan yang diberikan :
Lampiran 11. Volume maksimum larutan sediaan uji yang dapat diberikan pada beberapa hewan uji
Jenis hewan uji
Volume maksimum (ml) sesuai jalur pemberian
i.v. i.m. i.p. s.c. p.o.
Mencit (20-30 g) 0,5 0,05 1,0 0,5-1,0 1,0
Tikus (200 g) 1,0 0,1 2-5 2-5 5,0
Hamster (50 g) - 0,1 1-2 2,5 2,5
Marmot (300 g) - 0,25 2-5 5,0 10,0
Kelinci (2,5 kg) 5-10 0,5 10-20 5-10 20,0
Kucing (3 kg) 5-10 1,0 10-20 5-10 50,0
Lampiran 12. Gambar dan keterrangan Histopatologi Hepar Marmut perlakuan 1, 2. 3. 4 dan 5 perbesaran 4X10 dan 10X40
a. perlakuan 1 (kontrol CMC) b. perlakuan 1 (kontrol CMC) perbesaran 10 X 40 perbesaran 4 X 10
c. perlakuan 2 (ekstrak bunga pacar air) d. perlakuan 2 (ekstrak bunga pacar air) dosis 155 mg/kgbb perbesaran 10x40 dosis 155 mg/kgbb perbesaran 4x10
keterangan gambar a:
1. inti sel normal 1. Inti sel normal keterangan gambar c:
2. sinusoid normal 2. Sinusoid normal
3. vena sentralis normal 3. Vena sentralis normal
2
1
3
2 1
Lampiran 12 (lanjutan)
e. perlakuan 3 (ekstrak bunga pacar air) f. perlakuan 3 (ekstrak bunga pacar air) dosis 310 mg/kgbb perbesaran 10x40 dosis 310 mg/kgbb perbesaran 4x10
g. perlakuan 4 (ekstrak bunga pacar air) h. perlakuan 4 (ekstrak bunga pacar air) dosis 620 mg/kgbb perbesaran 10x40 dosis 620 mg/kgbb perbesaran 4x10
i. perlakuan 5 (ekstrak bunga pacar air) j. perlakuan 5 (ekstrak bunga pacar air) dosis 1240 mg/kgbb perbesaran 10x40 dosis 1240 mg/kgbb perbesaran 4x10
3
1
2
3
1
2
3
2 1
1. inti sel hepar marmut normal tidak berbeda dengan kontrol Keterangan gambar e:
2. sinusoid hepar marmut normal tidak berbeda dengan kontrol
3. vena sentralis hepar marmut normal tidak berbeda dengan kontrol
1. inti sel hepar marmut normal tidak berbeda dengan kontrol Keterangan gambar g:
2. sinusoid hepar marmut normal tidak berbeda dengan kontrol
3. vena sentralis hepar marmut normal tidak berbeda dengan kontrol
1. inti sel hepar marmut tampak mengecil bebeda dengan kontrol dan perlakuan Keterangan gambar i:
2,3 dan 4.
2. sinusoid hepar marmut tampak mengecil bebeda dengan kontrol dan perlakuan
2,3 dan 4.
3. vena sentralis hepar marmut tidak normal berbeda dengan kontrol dan
perlakuan 2, 3 dan 4.