PEMBENTUKAN AKAR PLANLET TANAMAN HIAS
Cordyline fruticosa
‘Hawaian flag’
SECARA
EX VITRO
PUSPA PRATIWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pembentukan Akar Planlet Tanaman Hias Cordyline fruticosa ‘Hawaian flag’ Secara Ex vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2015
Puspa Pratiwi
ABSTRAK
PUSPA PRATIWI. Pembentukan Akar Planlet Tanaman Hias Cordyline fruticosa
‘Hawaian flag’ Secara Ex vitro. Dibimbing oleh DIAH RATNADEWI dan SUMARYONO.
Cordyline sp. merupakan tanaman hias berkayu monokotil termasuk dalam famili Asparagaceae. Penggunaan kultur in vitro dapat mendukung perbanyakan
Cordyline sp. untuk menghasilkan lebih banyak tanaman dalam waktu yang lebih singkat. Perakaran planlet Cordyline fruticosa ‘Hawaian flag’ biasanya sangat lemah dan mudah lepas pada waktu dicuci dengan air mengalir. Oleh karena itu, pengakaran dilakukan secara ex vitro pada saat periode aklimatisasi. Penelitian ini bertujuan untuk menentukan pengaruh beberapa jenis dan konsentrasi auksin pada pembentukan akar dan pertumbuhan planlet Cordyline fruticosa selama periode aklimatisasi. Jenis hormon auksin IAA, IBA, dan NAA dengan konsentrasi masing-masing 20 µM, 100 µM, dan 500 µM tidak secara nyata berpengaruh terhadap pembentukan dan pertumbuhan akar Cordyline fruticosa. Namun demikian, IAA 100 µM dinilai lebih baik untuk pembentukan akar secara ex vitro
dengan menghasilkan kualitas akar paling baik ditinjau dari perkembangan akar sekunder serta pertumbuhan bagian tajuk. Pengakaran secara ex vitro juga dapat dilakukan tanpa pemberian hormon dengan hasil yang sama baiknya dengan pemberian auksin yang digunakan pada penelitian ini.
Kata kunci: auksin, Cordyline fruticosa, pembentukan akar ex vitro, aklimatisasi
ABSTRACT
PUSPA PRATIWI. Ex vitro Rooting of Plantlets of Ornamental Plant Cordyline fruticosa 'Hawaiian flag'. Supervised by DIAH RATNADEWI and SUMARYONO.
Cordyline sp. is a woody ornamental monocot, belongs to Asparagaceae
family. The use of in vitro culture can support the propagation of Cordyline sp. to produce more planlets in a shorter time. In vitro root system of plantlets of
Cordyline fruticosa 'Hawaian flag' is usually very weak and easily removed when washed in running tap water. Therefore, planlets were grown without roots in vitro and rooting of planlets was conducted during acclimatization period. This research was aimed to determine the influence of various types and concentrations of auxin on rooting and growth of Cordyline fruticosa plantlets during the acclimatization period. Type of auxin hormones i.e. IAA, IBA and NAA and concentrations at 20 µM, 100 µM and 500 µM did not significantly affect the rooting and growth of Cordyline fruticosa. Having compared all the treatments, it can be concluded that IAA 100 µM was the better one in inducing roots of the planlets in term of numbers of secondary roots and the growth of the shoots. Ex vitro rooting can also be done without hormones with the same results as with auxins was used in this research.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
PEMBENTUKAN AKAR PLANLET TANAMAN HIAS
Cordyline fruticosa
‘Hawaian flag’
SECARA
EX VITRO
PUSPA PRATIWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Januari 2014 hingga September 2014 ini berjudul Pembentukan Akar Planlet Tanaman Hias Cordyline fruticosa ‘Hawaian flag’ Secara Ex vitro.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Diah Ratnadewi, DEA dan Bapak Ir Sumaryono, MSc selaku pembimbing atas waktu yang disediakan, segala bimbingan, dukungan, arahan, kesabaran, serta saran yang telah diberikan selama penelitian dan penulisan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Dr Sri Listiyowati, MSi selaku penguji skripsi atas semua saran, masukan, dan perbaikan yang telah diberikan. Terimakasih dan penghargaan penulis sampaikan kepada seluruh staf di Laboratorium Biak Sel & Mikropropagasi Tanaman, Balai Penelitian Bioteknologi Perkebunan Indonesia, khususnya kepada Mba Sinta, Mba Rizka, Pak Jajat dan Pak Iwan atas segala bantuan. Ucapan terimakasih juga penulis sampaikan kepada rekan-rekan seperjuangan S1 Zumarni, Nita, Hanin, dan Yuri. Penulis juga mengucapkan terima kasih kepada Bapak Dr Ir Irmansyah MSi selaku Kepala Asrama TPB IPB, sahabat-sahabat tercinta di Senior Resident Asrama TPB IPB angkatan 47, 48, 49 dan 50, Tim Pembinaan Mental Spiritual Asrama, teman-teman di Chlorophyl 47, Bengkel Hati, Mentari Jingga, Alumni MAN 10 angkatan 2007 serta teman-teman seperjuangan di Biologi 47 atas segala dukungan dan kebersamaan selama ini. Penghargaan terbesar penulis sampaikan kepada kedua orang tua Ibu Sukiyem dan Bapak Sumar, Mba Ike, Kak Tiyar, Mas Doyo, Mba Indri, serta seluruh keluarga
atas segala do’a, kasih sayang, semangat, dan dukungan yang diberikan. Semoga karya ilmiah ini bermanfaat.
Bogor, April 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 3
Pertumbuhan Bagian Tajuk 3
Pertumbuhan Akar 5
Bobot Biomassa 7
Persentase Planlet Hidup 8
SIMPULAN 9
SARAN 9
DAFTAR PUSTAKA 10
LAMPIRAN 102
RIWAYAT HIDUP 17
DAFTAR TABEL
1. Pengaruh interaksi jenis dan konsentrasi auksin terhadap pertumbuhan tanaman Cordyline fruticosa pada bagian tajuk umur 6 minggu 4 2. Pengaruh hormon auksin terhadap diameter batang pada umur 6 minggu 4 3. Pengaruh interaksi jenis dan konsentrasi auksin terhadap pertumbuhan akar
planlet Cordyline fruticosa secara ex vitro pada umur 6 minggu 5 4. Pengaruh konsentrasi hormon auksin terhadap akar sekunder pada umur 6
minggu 6
5. Pengaruh berbagai jenis dan konsentrasi auksin terhadap bobot basah dan bobot kering tanaman Cordyline fruticosa secara ex vitro pada umur 6 minggu
7 6. Presentase hidup planlet Cordyline fruticosa pada kondisi ex vitro pada
umur 6 minggu 8
DAFTAR GAMBAR
1. Perkembangan akar setelah umur 6 minggu: (a) kontrol, (b) pemberian IAA 100 µM, (c) pemberian IBA 100 µM, (d) pemberian NAA 100 µM 6
DAFTAR LAMPIRAN
1. Rekapitulasi sidik ragam peubah dari interaksi jenis hormon dengan
konsentrasi yang ditentukan 13
2. Rekapitulasi sidik ragam peubah berdasarkan jenis hormon 13 3. Rekapitulasi sidik ragam peubah berdasarkan konsentrasi hormon 13
4. Sidik ragam jumlah daun 14
5. Sidik ragam tinggi tanaman 14
6. Sidik ragam warna daun 14
7. Sidik ragam diameter batang 14
8. Sidik ragam jumlah akar primer 15
9. Sidik ragam jumlah akar sekunder 15
10. Sidik ragam panjang akar 15
11. Sidik ragam bobot basah 15
12. Sidik ragam bobot kering 15
13. Sidik ragam presentase jumlah pembentukan akar 16
PENDAHULUAN
Latar Belakang
Cordyline sp. merupakan tanaman hias berkayu monokotil termasuk dalam famili Asparagaceae. Masyarakat Hawaii mengenal Cordyline sp. sebagai tanaman hoki (keberuntungan). Cordyline sp. memiliki lebih dari 20 spesies tanaman dengan aneka macam warna helaian daun yang indah dan menarik, serta mudah dalam pembudidayaan. Cordyline sp. dapat digunakan sebagai tanaman hias di dalam ruangan (indoor), untuk rangkaian bunga dalam bentuk buket, dan pajangan di luar ruangan sebagai material taman. Ragam penggunaan tanaman ini telah memposisikannya sebagai tanaman hias yang penting sehingga bernilai ekonomi tinggi karena keindahan daunnya (Wediyanto et al. 2009). Keinginan untuk terus menciptakan warna-warni daun tanaman dalam desain interior mendorong peningkatan produksi tanaman hias daun (Ray et al. 2006).
Perbanyakan konvensional Cordyline sp. pada umumnya dilakukan dengan stek batang dan cangkok. Batang tanaman dipotong-potong sepanjang 1-2 ruas, kemudian ditanam pada campuran tanah di wadah atau bedengan. Tunas pada batang akan tumbuh menjadi tanaman baru. Namun, jumlah bibit yang dihasilkan masih belum dapat memenuhi permintaan dan membutuhkan waktu yang relatif lama. Penggunaan metode kultur in vitro dapat mendukung perbanyakan Cordyline sp. dengan menghasilkan lebih banyak tanaman dalam waktu yang lebih singkat (Khan et al. 2004).
Teknik kultur jaringan yang paling umum digunakan untuk perbanyakan klonal Cordyline sp. adalah melalui multiplikasi tunas samping. Sampai saat ini belum dilaporkan keberadaan kultur in vitro Cordyline sp. dengan teknik organogenesis atau embriogenesis somatik. Metode multiplikasi tunas samping dilakukan dengan menumbuhkan tunas pada media padat. Tunas yang tumbuh kemudian digandakan dahulu untuk memperoleh banyak tunas sebelum dibesarkan menjadi planlet. Planlet yang terbentuk selanjutnya disubkultur pada media pembentukan akar sebelum diaklimatisasi ke lingkungan ex vitro. Akar planlet Cordyline fruticosa ‘Hawaian flag’ yang terbentuk in vitro biasanya sangat lemah dan mudah lepas pada waktu dicuci dengan air mengalir (Hazarika 2006). Oleh karena itu, pembesaran planlet dilakukan tanpa melalui tahap pengakaran secara in vitro. Pengakaran dilakukan secara ex vitro pada waktu periode aklimatisasi.
Keuntungan pengakaran ex vitro adalah waktu yang digunakan lebih singkat karena tidak diperlukan tahap pembentukan akar in vitro. Selain itu, pencucian planlet sebelum aklimatisasi dan proses penanaman pada waktu aklimatisasi lebih mudah dan lebih singkat. Kelemahan dari pengakaran ex vitro
adalah tingkat transpirasi yang tinggi (Pospisilova et al. 2007). Aklimatisasi planlet tanpa akar akan menurunkan kemampuan planlet dalam menyerap air. Kelemahan ini dapat diatasi dengan menempatkan planlet dalam sungkup tertutup rapat untuk mengurangi kehilangan air melalui transpirasi dan menjaga kelembapan relatif mendekati 100% (Chinnu et al. 2012).
2
media yang hanya berisi tanah gambut dan media berisi tanah, kompos, arang sekam (1:1:1) tanpa menggunakan zat pengatur tumbuh auksin sebelum ditanam di media perakaran secara ex vitro. Pengakaran ex vitro perlu dilakukan dengan penambahan zat pengatur tumbuh auksin sebelum ditanam di media perakaran. Pengakaran ex vitro spesies berkayu biasanya menggunakan penambahan zat pengatur tumbuh auksin seperti auksin IAA acetic acid), IBA (indole-3-butyric acid) dan NAA (1-naphthalene-acetic acid) (Sumaryono dan Riyadi 2011). Zulkarnain (2009) menyatakan bahwa pada umumnya auksin berfungsi untuk meningkatkan pembelahan sel, pemanjangan sel, dan pembentukan akar adventif.
Tujuan Penelitian
Penelitian ini bertujuan menentukan pengaruh beberapa jenis dan konsentrasi auksin pada pembentukan akar dan pertumbuhan planlet Cordyline fruticosa ‘Hawaian flag’ selama periode aklimatisasi.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Januari hingga September 2014 bertempat di Laboratorium Biak Sel dan Mikropropagasi Tanaman, Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Metode Penelitian
Persiapan bahan tanaman
Penelitian ini menggunakan planlet yang diperbanyak secara in vitro dari tunas samping pada batang Cordyline fruticosa ‘Hawaian flag’. Tunas ditumbuhkan pada media Murashige & Skoog (MS) selama beberapa tahapan kultur. Planlet dipilih yang seragam dengan tinggi sekitar 7-8 cm tanpa akar (akar planlet yang tumbuh dipotong). Planlet terpilih diambil dengan hati-hati dari botol dan media agar yang tersisa dicuci bersih dengan air mengalir dan dikering-anginkan selama beberapa menit, kemudian bagian pangkal planlet direndam dalam larutan auksin selama 10 menit. Perlakuan yang diuji adalah jenis auksin (IAA, IBA, dan NAA) pada konsentrasi yang berbeda yaitu 0, 20 µM, 100 µM, dan 500 µM. Masing-masing perlakuan terdiri atas 10 planlet, dan diulang masing-masing sebanyak 3 kali.
Aklimatisasi
3 planlet tersebut kemudian ditempatkan dalam sungkup selama 6 minggu di bawah naungan tajuk pepohonan di persemaian. Sungkup dibuat dari plastik transparan dalam bentuk kubah dengan ukuran panjang 240 cm dan lebar 95 cm. Penyiraman hanya dilakukan jika media tanam terlihat kering. Teknik penyiraman dilakukan dengan menggunakan sprinkler, dan dihindari membuka sungkup terlalu lebar. Penyemprotan dengan menggunakan sprinkler juga dilakukan pada siang hari pada waktu bagian atas sungkup sangat panas, untuk menurunkan suhu dan mempertahankan kelembapan udara hingga 90-100%. Suhu di areal aklimatisasi harus diatur sedemikian rupa agar mendekati suhu in vitro. Intensitas cahaya sekitar 30% dari cahaya lingkungan. Pemberian naungan merupakan cara yang baik untuk menurunkan intensitas cahaya dan suhu dengan mempertahankan kelembapan agar tetap tinggi. Sungkup mulai dibuka secara bertahap setelah 4 minggu, lalu planlet dipelihara hingga 6 minggu.
Pengamatan dan pengukuran
Planlet dipanen dan dikeluarkan dari media setelah 6 minggu. Bagian yang diamati adalah persentase planlet hidup, tinggi planlet, jumlah daun, warna daun, diameter batang, akar primer, akar sekunder, persentase jumlah planlet berakar, panjang akar, dan biomassa (bobot basah dan bobot kering). Tinggi planlet ditentukan dari pangkal batang sampai ujung daun terpanjang. Warna daun diukur berdasarkan pedoman pada Bagan Warna Daun dengan nilai standar sebagai berikut: 1= hijau sangat muda; 2= hijau muda; 3= hijau; 4= hijau tua (Abdul 2003). Bobot basah ditimbang dengan neraca analitik setelah pengamatan selesai, selanjutnya dikeringkan di dalam oven pada suhu 60oC selama 2 x 24 jam atau hingga bobot tidak bertambah lagi, dan ditimbang kembali untuk menentukan bobot kering. Pengukuran akar dianggap sudah terbentuk akar bila panjangnya lebih dari 3 mm.
Analisis Statistik
Percobaan disusun menggunakan Rancangan Acak Kelompok (RAK). Data penelitian diolah dengan analisis keragaman (uji F) dengan menggunakan program SPSS. Perbedaan antar-perlakuan ditentukan dengan uji lanjut Duncan’s Multiple Range Test (DMRT) pada taraf uji α= 0.05.
HASIL DAN PEMBAHASAN
Pertumbuhan Bagian Tajuk
4
auksin yang nyata pada jumlah daun dan tinggi tanaman. Jenis hormon hanya berpengaruh pada diameter batang (Lampiran 2).
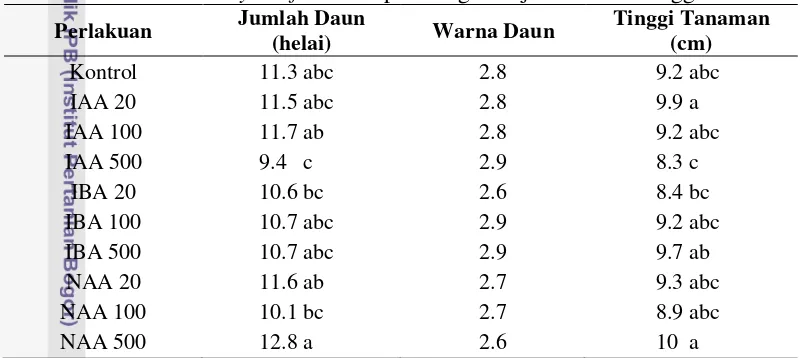
Pengaruh interaksi jenis dan konsentrasi hormon auksin (Tabel 1) menunjukkan jumlah daun paling banyak terdapat pada perlakuan NAA 500 µM dengan rata-rata 12.8, sedangkan jumlah daun paling sedikit terdapat pada perlakuan IAA 500 µM dengan rata-rata 9.4. Pengamatan tanaman paling tinggi terdapat pada perlakuan NAA 500 µM dengan rata-rata 10.0 cm, diikuti dengan IAA 20 µM dengan rata-rata 9.9 cm, sedangkan tinggi tanaman yang paling rendah terdapat pada perlakuan IAA 500 µM dengan rata-rata 8.3 cm. Berdasarkan hormon yang digunakan (Tabel 2) menunjukkan diameter batang terbesar terdapat pada perlakuan NAA dengan rata-rata 3.34 mm, sedangkan diameter batang yang terendah terdapat pada perlakuan IAA dengan rata-rata 3.03 mm.
Tabel 1 Pengaruh interaksi jenis dan konsentrasi auksin terhadap pertumbuhan tanaman Cordylinefruticosa pada bagian tajuk umur 6 minggu
Perlakuan Jumlah Daun
berbeda nyata berdasarkan DMRT pada taraf α 5%
Tabel 2 Pengaruh hormon auksin terhadap diameter batang pada umur 6 minggu
Hormon Diameter Batang (mm)
berbeda nyata berdasarkan DMRT pada taraf α 5%
5 tajuk diduga karena penyerapan hormon oleh tanaman yang lebih baik dibandingkan dengan pemberian hormon lainnya. De Klerk et al. (1997) menyatakan bahwa tingkat penyerapan auksin bervariasi. Menurut Peeters et al.
(1991), penyerapan NAA oleh tanaman enam kali lebih cepat dari IAA, dan Van der Krieken et al. (1993) juga menyatakan bahwa penyerapan IBA oleh tanaman empat kali lebih cepat dari IAA. IAA merupakan auksin yang disintesis secara alamiah di dalam tubuh tanaman, namun senyawa ini mudah mengalami degradasi akibat pengaruh cahaya dan oksidasi enzimatik. Sementara itu, NAA yang merupakan auksin sintetik, tidak mengalami oksidasi enzimatik seperti halnya IAA (Zulkarnain 2009).
Pertumbuhan Akar
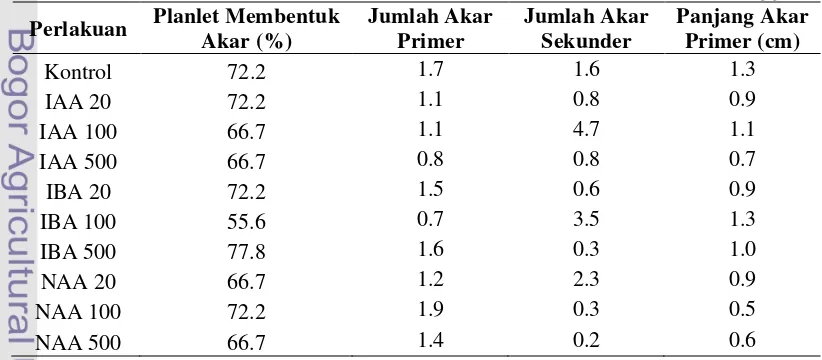
Pembentukan akar planlet dapat dilakukan pada kultur in vitro (in vitro rooting) atau selama periode aklimatisasi (ex vitro rooting). Hasil penelitian ini menunjukkan bahwa induksi akar planlet Cordyline fruticosa dapat dilakukan secara ex vitro. Pengamatan terhadap perakaran menunjukkan bahwa persentase jumlah planlet yang membentuk akar, jumlah akar primer dan sekunder serta panjang akar tidak berbeda nyata di antara semua perlakuan (Tabel 3). Perlakuan yang menunjukkan persentase planlet yang membentuk akar terbesar terdapat pada perlakuan IBA 500 µM dengan rata-rata 77.8% dan rata-rata jumlah akar primer 1.6, namun rata-rata jumlah akar sekunder rendah yaitu 0.3. Sebaliknya, perlakuan IBA 100 µM menghasilkan persentase planlet akar hanya 55.6% dengan rata-rata jumlah akar primer lebih sedikit dari akar sekunder yaitu akar primer 0.7 dan akar sekunder 3.5. Hasil tersebut menunjukkan konsentrasi hormon sangat mempengaruhi pertumbuhan akar. Hasil analisis pengaruh konsentrasi hormon auksin yang digunakan menunjukkan pembentukan jumlah akar sekunder yang berbeda nyata (Lampiran 9). Hormon dengan konsentrasi 500 µM memiliki pengaruh yang berbeda nyata dengan konsentrasi 100 µM dengan rata-rata jumlah akar sekunder terendah 0.43 pada konsentrasi 500 µM. Hasil penelitian juga menunjukkan bahwa hormon dengan konsentrasi 100 µM memiliki jumlah akar sekunder tertinggi dengan rata-rata 2.81 (Tabel 4).
Tabel 3 Pengaruh interaksi jenis dan konsentrasi auksin terhadap pertumbuhan akar planlet Cordylinefruticosa secara ex vitro pada umur enam minggu
6
Tabel 4 Pengaruh konsentrasi hormon auksin terhadap akar sekunder pada umur 6 minggu
Konsentrasi (µM) Jumlah akar sekunder
0 1.61 ab
20 1.24 ab
100 2.81 a
500 0.43 b
Keterangan: Nilai pada kolom yang sama yang diikuti oleh huruf yang sama
menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf α 5%
Penelitian Chinnu et al. (2012) memperlihatkan tidak ada perbedaan yang signifikan dalam persen perakaran oleh konsentrasi yang berbeda dari jenis auksin IBA pada media perakaran ex vitro, tetapi pengaruh konsentrasi IBA terlihat pada panjang akar. Hormon IBA merupakan jenis auksin yang paling sering digunakan dalam menginduksi akar dibandingkan jenis auksin lainnya, karena memiliki kemampuan yang tinggi dalam mengendalikan inisiasi akar. Hormon IBA juga lebih stabil dan tingkat toksisitas yang rendah dibandingkan NAA dan IAA (Weisman et al. 1988). Keberhasilan pertumbuhan tanaman pada tahap aklimatisasi sangat dipengaruhi oleh kualitas akar, khususnya jumlah akar dan kehadiran akar sekunder yang vigor. Jenis hormon terbaik yang tampak pada penelitian ini adalah IAA 100 µM, yaitu menghasilkan kualitas akar primer dan sekunder yang paling baik jika dibandingkan antara hormon auksin lainnya pada konsentrasi yang sama. (Gambar 1).
(a) (b) (c) (d)
7 kondisi ex vitro mempunyai morfologi yang lebih baik, misalnya mempunyai percabangan akar yang lebih banyak dengan rambut-rambutakar, dan mempunyai turgiditas lebih tinggi dibandingkan dengan akar yang terbentuk in vitro (Barry-Etienne et al. 2002).
Bobot Biomassa
Bobot basah tumbuhan dibangun oleh biomassa hasil fotosintesis yang disimpan sebelum digunakan untuk perkembangan tumbuhan. Bobot basah dan kering biomassa planlet Cordyline fruticosa menunjukkan ada pengaruh dari jenis dan konsentrasi auksin secara nyata (Lampiran 11 dan Lampiran 12). Bobot basah yang memiliki pengaruh yang nyata ada pada perlakuan IAA 500 µM dengan rata-rata bobot basah terendah yaitu 0.40 g. Bobot basah terbesar terdapat pada perlakuan IAA 20 µM dan IBA 500 µM dengan rata-rata yang sama yaitu 0.71 g (Tabel 5). Bobot kering yang memiliki pengaruh yang nyata terdapat pada perlakuan IBA 500 dengan rata-rata bobot kering terbesar yaitu 0.15 g, sedangkan yang terkecil terdapat pada perlakuan IAA 500 µM dengan rata-rata 0.07 g (Tabel 5).
Tabel 5 Pengaruh berbagai jenis dan konsentrasi auksin terhadap bobot basah dan bobot kering tanaman Cordyline fruticosa secara ex vitro pada umur enam minggu
Perlakuan Bobot Basah (g) Bobot Kering (g)
Kontrol 0.67 a 0.10 b
menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf α 5%
8
dengan rata-rata persentase planlet membentuk akar tertinggi yaitu 77.8% dan rata-rata jumlah akar primer 1.6. Namun rata-rata jumlah akar sekunder yang terbentuk hanya 0.3 (Tabel 3).
Persentase Planlet Hidup
Pertumbuhan tanaman Cordyline fruticosa menunjukkan persentase hidup hampir sama setelah enam minggu dalam kondisi aklimatisasi, sehingga hasil rata-rata tidak berbeda nyata antar perlakuan (Tabel 6). Walaupun demikian, persentase hidup tertinggi terdapat pada perlakuan IBA 500 µM dengan rata-rata 70%, sedangkan persentase hidup terendah terdapat pada perlakuan NAA 100 µM dengan rata-rata 50%.
Pengamatan menunjukkan tanaman Cordyline fruticosa dapat tumbuh dan menghasilkan akar cukup baik (72.2%) tanpa penambahan hormon auksin (Tabel 3), tetapi persentase hidupnya hanya 56.7%. Hal ini menunjukkan Cordyline sp tergolong tanaman yang mudah berakar, sehingga tanpa pemberian auksin pun sudah dapat berakar dan dapat diaklimatisasi dengan keberhasilan tinggi. Tanaman yang mudah berakar mengandung semua senyawa endogen yang diperlukan untuk inisiasi akar (rooting morphogens) dan auksin dalam jumlah mencukupi (Yusnita et al. 2013). Oleh karena itu, aklimatisasi dengan pengakaran ex vitro layak dipertimbangkan sebagai cara yang mudah, murah, dan efisien dalam produksi bibit tanaman Cordyline sp. melalui kultur jaringan. Tabel 6 Persentase hidup planlet Cordyline fruticosa pada kondisi ex vitro pada
Penggunaan auksin dalam pertumbuhan tanaman pada kondisi ex vitro
9 perakaran ex vitro tanaman hias Cordyline fruticosa adalah IAA 100 µM dengan pertumbuhan tajuk yang cukup baik dilihat dari jumlah daun (11.7), warna daun (2.8), dan tinggi tanaman (9.9 cm).
Perakaran secara ex vitro adalah metode yang tepat untuk mengurangi biaya dan efektifitas penggunaan auksin. Perakaran secara ex vitro juga dapat dilakukan untuk menghindari terbentuk perakaran in vitro karena akar yang terbentuk secara
in vitro biasanya sangat lemah dan mudah lepas pada waktu pencucian. Pencucian planlet sebelum aklimatisasi dan proses penanaman pada waktu aklimatisasi akan menjadi lebih mudah serta dapat mempersingkat waktu pemindahan dari laboratorium ke kondisi lapang atau media aklimatisasi, bahkan pengakaran secara ex vitro pada planlet Cordyline sp. dapat dilakukan tanpa pemberian hormon. Perlakuan tanpa pemberian hormon mampu memberikan hasil yang juga cukup baik dibandingkan dengan pemberian ZPT. Hasil percobaan Gonçalves dan Romano (2007) menunjukkan bahwa pengakaran ex vitro Drosophyllum lusitanicum meningkatkan daya hidup planlet pada waktu diaklimatisasi. Keberhasilan pengakaran ex vitro pada aklimatisasi planlet telah dilaporkan oleh beberapa peneliti, yaitu 95% pada Mentha piperita L (Sunandakumari et al. 2004), 95% pada jeruk (Rathore et al. 2007), dan 86.3% pada Malus zumi (Xu et al.
2008).
SIMPULAN
Pembentukan akar tanaman hias Cordyline fruticosa dapat terjadi tanpa pemberian hormon. Jenis auksin yang tepat untuk menghasilkan kualitas perakaran ex vitro yang baik adalah IAA 100 µM, dengan pembentukan akar sekunder yang banyak dan pertumbuhan tajuk yang cukup baik.
SARAN
10
DAFTAR PUSTAKA
Abdul SW. 2003. Peningkatan efisiensi pupuk nitrogen pada Padi sawah dengan Metode Bagan warna daun. J Litbang Pertan. 22(4):156-161.
Barry-Etienne D, Bertrand B, Vasquez N, Etienne H. 2002. Comparison of somatic embryogenesis-derived coffee (Coffea arabica L.) plantlets regenerated in vitro or ex vitro: morphological, mineral and water characteristics. Ann Bot. 90:77-85.
Chinnu JK, Mokashi AN, Hegde RV, Patil VS, Koti RV. 2012. In vitro shoot multiplication and ex vitro rooting of cordyline (Cordyline sp.). Karnataka J. Agric. Sci. 25(2):221-223.
De Klerk GJ, Brugge JT, Marinova S. 1997. Effectiveness of indoleacetic acid, indolebutyric acid and naphthaleneacetic acid during adventitious root
formation in vitro in Malus Jork 9. Plant Cell Tissue Organ Cult. 49:39–
44.
Gaspar TH, Kevers C, Faivre-Rampant O, Crevecoeur M, Penel C, Greppin H, and Dommes J. 2003. Changing concepts in plant hormone action. In Vitro Cell. Dev. Biol. – Plant 39(2):85-106.
Gonçalves S, Romano A. 2007. Ex vitro rooting of Drosophyllum lusitanicum
micropropagated shoots improves acclimatization. Acta Hort. 748:127-131.
Hasanah FN, Setiari N. 2007. Pembentukan akar pada stek batang nilam (Pogostemon cablin Benth.) setelah direndam IBA (Indol Butyric Acid) pada konsentrasi berbeda. Bul Anatomi dan Fisiologi. 15(2):5.
Hazarika BN. 2006. Morpho-physiological disorder in in vitro culture of plants. Sci. Hort. 108(2):105-120.
Himanen K, Boucheron E, Vannesse S, de Almeida-Engler J, Inze D, Beeckman T. 2002. Auksin-mediated cell cycle activation during early root initiation.
Plant Cell. 14:2339-2352.
Khan S, Naz S, Saeed B. 2004. In vitro production of Cordyline terminalis for commercialization. Pakistan J. Bot. 36(4):757-761.
Peeters AJM, Gerads W, Barendse GWM, Wullems GJ. 1991. In vitro flower bud
formation in tobacco: interaction of hormones. Plant Physiol. 97:402–408.
Pospisilova J, Synkova H, Haisel D, Semoradova S. 2007. Acclimation of plantlets to ex vitro condition: Effects of air humidity, irradiance, CO2 concentration and abscisic acid. Acta Hort. 748:29-38.
Rathore JS, Rathore MS, Singh M, Singh RP, Shekhawat NS. 2007. Micropropagation of mature tree of Citrus limon. Indian J. Biotechnol. 6:239-244.
Ray T, Saha P, Roy SC. 2006. Commercial production of Cordyline terminalis (L) Kunth from shoot apex meristem and assessment for genetic of somaclones by isoenzim markers. Scient Hort.108:289-294.
Salisbury FB, Ross CW. 1992. Fisiologi Tumbuhan. Bandung (ID): Penerbit ITB. Sumaryono, Riyadi I. 2011. Ex vitro rooting of oil palm (Elaeis guineensis Jacq.)
11 Sunandakumari C, Martin KP, Chithra M, Sini S, Madhusoodanan PV. 2004. Rapid axillary bud proliferation and ex vitro rooting of herbal spice, Mentha piperita L. Indian J. Biotechnol. 3:108-112.
Van der Krieken WM, Breteler H, Visser MHM, Mavridou D. 1993. The role of conversion of IBA into IAA on root regeneration in apple: introduction of
a test system. Plant Cell Rep 12:203–206.
Wediyanto A, Hilman Y, Sihombing D, Rochani A, Kastaredja N, Soesilo, Soemardjono, Budi RD, Supardi, Syukron. 2009. Standar Operasional Prosedur Budidaya Cordyline. Bandung (ID): Direktorat Budidaya Tanaman Hias. Direktorat Jenderal Hortikultura.
Weisman Z, Riov J, dan Epstein E. 1988. Comparisson of Movement and Metabolism of Indole-3-Acetic acid in Mung Bean Cuttings. Physiol Plant. (74):556-560.
Widyastuti N, Tjokrokusumo D. 2007. Peranan beberapa zat pengatur tumbuh (ZPT) tanaman pada kultur in vitro. J Sains dan Teknologi Indonesia. Jakarta. 3(5):55-63.
Xu J, Wang Y, Zhang Y, Chai T. 2008. Rapid in vitro multiplication and ex vitro
rooting of Malus zumi (Matsumura) Rehd. Acta Physiol Plant. 30:129-132. Yusnita, Wahyuningsih T, Sulistiana P, Hapsoro D. 2013. Perbanyakan in vitro
Sansevieria trifasciata ‘Lorentii’: regenerasi tunas, pengakaran, dan
aklimatisasi planlet. J Agron. Indonesia. 41(1):70-76.
12
13 Lampiran 1 Rekapitulasi sidik ragam peubah dari interaksi jenis hormon dengan
konsentrasi yang ditentukan
Peubah F Hitung Pr>F
Jumlah Daun 3.787* 0.006
Tinggi Tanaman 4.235* 0.003
Warna Daun 1.116tn 0.351
Diameter Batang 0.339tn 0.851
Jumlah % Pembentukan Akar 0.247tn 0.908
Jumlah Akar Primer 1.533tn 0.195
Jumlah Akar Sekunder 1.962tn 0.076
Panjang Akar 0.513tn 0.726
Bobot Basah 5.036* 0.001
Bobot Kering 1.562* 0.011
Persentase Hidup 0.247tn 0.908
Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%, tn tidak berpengaruh nyata
Lampiran 2 Rekapitulasi sidik ragam peubah berdasarkan jenis hormon
Peubah F Hitung Pr>F
Jumlah Daun 1.248tn 0.290
Tinggi Tanaman 0.658tn 0.519
Warna Daun 2.664tn 0.073
Diameter Batang 5.690* 0.004
Jumlah % Pembentukan Akar 0.000tn 1.000
Jumlah Akar Primer 1.704tn 0.185
Jumlah Akar Sekunder 0.753tn 0.473
Panjang Akar 1.222tn 0.297
Bobot Basah 0.305tn 0.738
Bobot Kering 1.568tn 0.211
Persentase Hidup 1.655tn 0.216
Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%, tn
tidak berpengaruh nyata
Lampiran 3 Rekapitulasi sidik ragam peubah berdasarkan konsentrasi hormon
Peubah F Hitung Pr>F
Jumlah Daun 0.280tn 0.756
Tinggi Tanaman 0.222tn 0.801
Warna Daun 0.936tn 0.394
Diameter Batang 2.315tn 0.102
Jumlah % Pembentukan Akar 0.123tn 0.885
Jumlah Akar Primer 0.003tn 0.997
Jumlah Akar Sekunder 3.350* 0.037
Panjang Akar 0.434tn 0.649
Bobot Basah 0.225tn 0.799
Bobot Kering 1.074tn 0.344
Persentase Hidup 0.159tn 0.854
Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%, tn
14
Lampiran 4 Sidik ragam jumlah daun
Sumber Keragaman Jumlah
R Squared = ,098 (Adjusted R Squared = ,050) Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%
Lampiran 5 Sidik ragam tinggi tanaman
Sumber Keragaman Jumlah
R Squared = ,099 (Adjusted R Squared = ,051) Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%
Lampiran 6 Sidik ragam warna daun
Sumber Keragaman Jumlah
R Squared = ,064 (Adjusted R Squared = ,015) Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%
Lampiran 7 Sidik ragam diameter batang
Sumber Keragaman Jumlah
15 Lampiran 8 Sidik ragam jumlah akar primer
Sumber Keragaman Jumlah
R Squared = ,063 (Adjusted R Squared = ,013)
Lampiran 9 Sidik ragam jumlah akar sekunder
Sumber Keragaman Jumlah
R Squared = ,086 (Adjusted R Squared = ,038) Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%
Lampiran 10 Sidik ragam panjang akar
Sumber Keragaman Jumlah
R Squared = ,042 (Adjusted R Squared = -,008)
Lampiran 11 Sidik ragam bobot basah
Sumber Keragaman Jumlah
R Squared = ,114 (Adjusted R Squared = ,068) Keterangan: * berpengaruh nyata pada taraf uji ≤ 5%
Lampiran 12 Sidik ragam bobot kering
Sumber Keragaman Jumlah
16
Lampiran 13 Sidik ragam presentase jumlah pembentukan akar
Sumber Keragaman Jumlah
Kuadrat
Derajat Bebas
Kuadrat Tengah
F-Hitung Nilai p
Hormon 0,000 2 0,000 0,000 1,000
Konsentrasi 0,667 2 0,333 0,123 0,885 Hormon* Konsentrasi 2,667 4 0,667 0,247 0,908
Galat 54,000 20 2,700
Total 570,000 30
R Squared = ,060 (Adjusted R Squared = -,363)
Lampiran 14 Sidik ragam presentase hidup
Sumber Keragaman Jumlah
Kuadrat
Derajat Bebas
Kuadrat Tengah
F-Hitung Nilai p
Hormon 540,741 2 270,370 1,655 0,216 Konsentrasi 51,852 2 25,926 0,159 0,854 Hormon* Konsentrasi 503,704 4 125,926 0,771 0,557 Galat 3266,667 20 163,333
Total 110000,00 30
17
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 29 Oktober 1992 sebagai anak ketiga dengan seorang kakak laki-laki dan seorang kakak perempuan dari pasangan Bapak H.Sumar dan Ibu Hj.Sukiyem. Pendidikan dasar diselesaikan pada tahun 2004 di SD Negeri 01 Larangan Selatan. Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2007 di SMP Negeri 11 Tangerang, kemudian melanjutkan pendidikan menengah atas di MAN 10 Jakarta dan lulus pada tahun 2010. Melalui jalur Undangan Seleksi Masuk IPB penulis melanjutkan pendidikan di Departemen Biologi, Fakultas Matematika dan Pengetahuan Alam, Insitut Pertanian Bogor pada tahun 2010.