1
KOMBINASI SELADA (
Lactuca sativa
L
.
) DAN BIOAKTIVATOR
DALAM PENGOLAHAN LIMBAH BUDIDAYA LOBSTER
AIR TAWAR (
Cherax quadricarinatus
)
DWI APRIANTI HANAFIAH
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Kombinasi Bioaktivator Dan Selada (Lactuca sativa L.) untuk Pengolahan Limbah Budidaya Lobster Air Tawar (Cherax quadricarinatus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
ABSTRAK
DWI APRIANTI HANAFIAH. Kombinasi Selada (Lactuca sativa L.) Dan Bioaktivator untuk Pengolahan Limbah Budidaya Lobster Air Tawar (Cherax quadricarinatus). Dibimbing oleh HEFNI EFFENDI.
Akuaponik adalah suatu kombinasi sistem akuakultur dan budidaya tanaman hidroponik. Lobster air tawar jenis Red Claw (Cherax quadricarinatus) dan selada tanah (Lactuca sativa L.) dijadikan sebagai bahan percobaan. Tujuan dari penelitian ini adalah mengolah air media pertumbuhan lobster air tawar yang mengandung bahan organik sisa pakan dan feses secara bioremediasi menggunakan sistem akuaponik dengan selada dan bioaktivator. Hasil penelitian menunjukkan bahwa penggunaan sistem akuaponik dan bioaktivator dapat mengurangi kadar amonia sampai 91,5%.
Kata kunci: Akuaponik, amonia, bioremediasi, lobster air tawar, selada
ABSTRACT
DWI APRIANTI HANAFIAH. Lettuce (Lactuca sativa L.) and Bio-activator Combination in Waste water Treatment of Freshwater Crayfish (Cherax quadricarinatus) Aquaculture. Supervise by HEFNI EFFENDI.
Aquaponic system is a combination of aquaculture and hydroponics cultivation. Freshwater crayfish Red Claw (Cherax quadricarinatus) and lettuce (Lactuca sativa L.) were used as experimental media. The objective of this study was to treat freshwater crayfish culture wastewater containing organic material of residual feed and feces by bioremediation using aquaponic with lettuce and bio-activator. The results showed that the use of aquaponic and bio-activator can reduce ammonia concentration up to 91,5%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Manajemen Sumber Daya Perairan
KOMBINASI SELADA (
Lactuca sativa
L
.
) DAN BIOAKTIVATOR
DALAM PENGOLAHAN LIMBAH BUDIDAYA LOBSTER
AIR TAWAR (
Cherax quadricarinatus
)
DWI APRIANTI HANAFIAH
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah subhanahu wa ta’ala yang atas segala rahmat dan karunia-Nya, penyusunan skripsi yang berjudul “Kombinasi Selada (Lactuca sativa L.) dan Bioaktivator dalam Pengolahan Limbah Budidaya Lobster Air Tawar (Cherax quadricarinatus)” dapat diselesaikan. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar sarjana perikanan pada departemen Manajemen Sumber Daya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada:
1. Institut Pertanian Bogor yang telah memberikan kesempatan studi kepada Penulis.
2. Penelitian yang pembiayaannya bersumber dari BOPTN.
3. Yayasan Supersemar yang telah membantu keuangan Penulis untuk menyelesaikan studi.
4. Dr Ir Hefni Effendi, MPhil sebagai ketua komisi pembimbing yang telah memberi arahan dan masukan dalam penulisan karya ilmiah ini.
5. Dr Ir Niken Tunjung Murti Pratiwi, MSi selaku pembimbing akademik yang telah memberikan motivasi selama perkuliahan.
6. Prof Dr Ir Ridwan Affandi, DEA selaku penguji tamu dan Dr Ir Nurlisa Alias Butet, MSc selaku komisi pendidikan Departemen Manajemen Sumber Daya Perairan atas saran dan masukan yang sangat berarti.
7. Keluarga penulis Bapak Sukenda Hanafiah, Ibu Siti Endang Nursidah dan Kakak Septiani Purwanti Hanafiah beserta keluarga besar Penulis yang telah memberikan banyak motivasi, doa, dan dukungan kepada Penulis baik moril maupun materil.
8. Teman seperjuangan penelitian: Nunuh, Bani, Mas Bagus, Mas Derry, Pak Hendrik, Pak Nata, Pak Deni, Mba Keke, dan semua yang telah membantu. 9. Teman-teman seperjuangan Serli, Hesvi, Rinrin, Noor, Kak Nia, Novi, Kiky,
Ernat dan teman-teman MSP angkatan 47 atas semangat, dukungan dan doa. Demikian skripsi ini disusun, semoga bermanfaat.
DAFTAR ISI
Analisis kualitas air di laboratorium 4
Analisis Data 5
Panjang rata-rata daun selada 20
DAFTAR TABEL
1 Parameter kualitas air yang dianalisis 5
2 Nilai perubahan (%) amonia dan nitrat 13
3 Persen perubahan kualitas air pada perbandingan pengamatan ke-0
dengan ke-1 21
4 Persen perubahan kualitas air pada perbandingan pengamatan ke-1
dengan ke-3 21
5 Persen perubahan pertumbuhan lobster pada perbandingan
pengamatan ke-0 dengan ke-1 21
6 Persen perubahan pertumbuhan lobster pada perbandingan
pengamatan ke-1 dengan ke-3 22
7 Nilai persen perubahan kelimpahan total bakteri pada perbandinganpengamatan ke-1 dengan ke-2 dan perbandingan
pengamatan ke-1 dengan ke-3 22
DAFTAR GAMBAR
1 Skema perumusan masalah penggunaan kombinasi bioaktivator dan selada (L. sativa L.) untuk pengolahan limbah budidaya lobster air
tawar (C. quadricarinatus) 2
2 Sketsa akuarium sistem resirkulasi dan rancangan akuarium
resirkulasi 4
3 Pengukuran panjang selada dan lobster 5
4 Nilai suhu pada akuarium kontrol dan perlakuan 7
5 Perubahan nilai suhu antar pengamatan dari akuarium kontrol dan
perlakuan 8
6 Nilai pH pada akuarium kontrol dan perlakuan 9
7 Perubahan nilai pH antar pengamatan pada akuarium kontrol dan
perlakuan 9
8 Nilai DO pada akuarium kontrol dan perlakuan 10
9 Perubahan nilai DO antar pengamatan pada akuarium kontrol dan
perlakuan 10
10 Nilai amonia pada akuarium kontrol dan perlakuan 11
11 Perubahan nilai amonia antar pengamatan pada akuarium kontrol dan
perlakuan 11
12 Nilai nitrat pada akuarium kontrol dan perlakuan 12
13 Perubahan nilai nitrat antar pengamatan pada akuarium kontrol dan
perlakuan 12
14 Nilai ortofosfat pada akuarium kontrol dan perlakuan 14
15 Perubahan nilai ortofosfat antar pengamatan pada akuarium kontrol
dan perlakuan 14
16 Nilai sulfida total pada akuarium kontrol dan perlakuan 15
17 Perubahan nilai total sulfida antar pengamatan pada akuarium kontrol
18 Nilai kelimpahan total bakteri pada akuarium perlakuan 16
19 Perubahan nilai kelimpahan total bakteri antar pengamatan 16 20 Nilai SR lobster pada akuarium kontrol dan perlakuan 17
21 Perubahan nilai SR antar pengamatan pada akuarium kontrol dan
perlakuan 17
22 Nilai panjang rata-rata lobster akuarium kontrol dan perlakuan 18
23 Perubahan nilai panjang rata-rata lobster antar pengamatan pada
akuarium kontrol dan perlakuan 18
24 Nilai bobot rata-rata lobster akuarium kontrol dan perlakuan 19
25 Perubahan nilai bobot rata-rata lobster antar pengamatan pada
akuarium kontrol dan perlakuan 19
26 Nilai panjang rata-rata daun selada 20
27 Perubahan nilai panjang rata-rata daun selada antar pengamatan 20
DAFTAR LAMPIRAN
1 Data kualitas air 28
2 Data jumlah, panjang dan bobot lobster 29
3 Data panjang daun selada dan kelimpahan bakteri 30
4 Data pengurangan konsentrasi amonia 30
PENDAHULUAN
Latar Belakang
Kegiatan budidaya perikanan menghasilkan limbah organik yang berasal dari sisa pakan dan feses biota. Keberadaan bahan organik yang tidak terdekomposisi dengan sempurna akan menghasilkan amonia dan sulfida, serta dapat menurunkan kadar oksigen terlarut di dalam media air budidaya. Amonia dan sulfida dalam sistem budidaya dapat menghambat pertumbuhan biota akuatik yang dipelihara. Ketersediaan oksigen di perairan sangat diperlukan dalam kelangsungan hidup biota akuatik yang dibudidayakan. Kualitas air yang memenuhi syarat bagi pertumbuhan biota akuatik yang dipelihara merupakan poin penting dalam budidaya. Upaya untuk membantu perbaikan kualitas air dapat dilakukan dengan introduksi bioaktivator berupa bakteri pengurai yang biasa digunakan pada proses pengolahan air limbah.
Penggunaan bakteri pengurai dalam pengolahan air limbah disebut juga dengan bioremediasi. Bioremediasi merupakan penggunaan mikroorganisme yang telah dipilih untuk ditumbuhkan pada polutan tertentu sebagai upaya untuk menurunkan kadar polutan tersebut. Pada saat proses bioremediasi berlangsung, enzim-enzim yang diproduksi oleh mikroorganisme memodifikasi struktur polutan beracun menjadi tidak kompleks sehingga menjadi metabolit yang tidak beracun dan berbahaya (Priadie 2012).
Bahan organik yang terkandung dalam air berasal dari lobster air tawar (Red Claw) yang dipelihara. Red Claw merupakan hewan asli perairan sungai di timur laut Australia dan Papua New Guinea. Lobster ini merupakan hewan endemik daerah tropis dari timur laut Australia (FAO 2011). Penggunaan lobster air tawar pada penelitian ini karena memiliki kelebihan, yaitu mudah dibudidayakan, tidak mudah terserang penyakit, pemakan tumbuhan sekaligus hewan (omnivora), pertumbuhannya relatif cepat, serta memiliki fekunditas yang tinggi (Sukmajaya dan Suharjo 2003). Selain menggunakan bakteri untuk pengolahan limbah organik, digunakan juga selada (Lactuca sativa L.) dengan menerapkan sistem akuaponik.
2
Perumusan Masalah
Salah satu upaya untuk mengurangi kandungan bahan organik yang terlarut dalam media air budidaya adalah dengan menggunakan metode biologi. Pengolahan air limbah dengan metode biologi (bioremediasi) adalah proses pengolahan dengan memanfaatkan kombinasi antara aktivitas mikroorganisme dan tumbuhan sebagai agen pengolah limbah. Limbah yang dihasilkan berupa feses dan sisa pakan akan diproses menjadi amonia, nitrat, sulfida total, dan ortofosfat oleh bakteri dan tumbuhan. Proses budidaya lobster ini tidak memerlukan pergantian air. Pada penelitian ini akan dicobakan kombinasi antara tumbuhan (selada) dengan bioaktivasi (bakteri) untuk mengolah air yang menjadi media tumbuh lobster. Skema perumusan masalah kombinasi bioaktivator dan tumbuhan disajikan pada Gambar 1.
Gambar 1 Skema perumusan masalah penggunaan kombinasi bioaktivator dan selada (L. sativa L.) untuk pengolahan limbah budidaya lobster air tawar (C. quadricarinatus).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengurangi dan memanfaatkan limbah cair organik budidaya lobster air tawar untuk pertumbuhan selada dan melihat efektivitas pertumbuhan lobster air tawar dan selada.
Manfaat Penelitian
3 pembudidaya lobster baik skala kecil maupun skala besar. Selain itu, tekonologi ini menggunakan siklus yang berbasis bebas residu.
METODOLOGI PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian dilakukan di Pusat Penelitian Lingkungan Hidup (PPLH), Institut Pertanian Bogor (IPB). Penelitian ini dibagi menjadi dua tahap, yaitu penelitian pendahuluan pada bulan Juni-Juli 2013 dan penelitian utama pada bulan Juli-September 2013. Analisis Fisika-Kimia dan Biologi dilakukan di Laboratorium Lingkungan, Pusat Penelitian Lingkungan Hidup, Institut Pertanian Bogor. Metode penelitian yang digunakan, yaitu percobaan laboratorium dengan jenis penelitian eksperimen.
Perancangan Pelaksanaan Penelitian
Penelitian dilakukan dua tahap; (1) penelitian pendahuluan dan (2) penelitian utama. Penelitian pendahuluan dilakukan untuk menyeleksi tumbuhan yang akan digunakan pada peneltian utama. Tumbuhan yang diseleksi berupa selada air (Nasturtium officinale) dan selada (Lactuca sativa L.). Hasil penelitian pendahuluan menunjukkan bahwa selada (Lactuca sativa L.) lebih cocok untuk akuaponik dibandingkan dengan selada air. Penelitian utama terdiri dari dua perlakuan, yaitu perlakuan selada tanpa bakteri dan perlakuan selada dengan bakteri.
Alat yang digunakan pada penelitian ini adalah akuarium dengan sistem resirkulasi yang terdiri dari akuarium tanpa sekat berukuran 80 x 40 x 40 cm3 dan drum yang dibagi menjadi dua bagian, serta serangkaian perlengkapan untuk resirkulasi. Bahan yang digunakan berupa lobster air tawar jenis Red Claw (Cherax quadricarinatus) berumur 2 bulan yang berasal dari kolam budidaya diploma IPB, diaklimatisasi selama 1 hari 1 malam. Sebanyak 30 ekor diberikan pada setiap akuarium untuk perlakuan 1 dan 2 dengan ukuran panjang sekitar 4-5 cm.
Selada tanah (L. sativa L.) yang digunakan dalam penelitian ini berasal dari perkebunan selada dibelakang kampus IPB sebanyak 5 buah dan ditanam dengan bantuan styrofoam agar daun selada tidak terendam air (hanya akar yang berada di air), dan bakteri komersial Microplus (Aerobacter sp., Nitrobacter sp., Nitrosomonas sp., Lactobacillus sp., Saccharomyces sp.) sebanyak 0,5 L.
4
Gambar 2 Sketsa akuarium sistem resirkulasi (A) dan rancangan akuarium resirkulasi (B)
Pengambilan contoh
Pengambilan contoh air dilakukan seminggu sekali selama jangka waktu penelitian (1 bulan) pada akuarium dan talang, begitu pula dengan pengambilan contoh selada dan lobster. Contoh air diambil dengan menggunakan botol contoh dan dibawa ke laboratorium untuk dianalisis. Selada dan lobster diukur panjang dan bobot dengan menggunakan alat ukur berupa penggaris dan timbangan. Analisis kualitas air di laboratorium
Analisis kualitas air dilakukan dengan menggunakan prosedur APHA (2008). Parameter yang diukur antara lain suhu, pH, oksigen terlarut (Dissolved Oxygen/DO), amonia, nitrat, ortofosfat, dan sulfida total. Parameter kualitas air yang dianalisis disajikan dalam Tabel 1.
Penghitungan parameter biologi yang digunakan adalah metode kelimpahan total bakteri (total count) (Cfu/ml) untuk bakteri serta pengukuran
5 manual untuk pertumbuhan selada (cm/minggu) dan lobster (cm/minggu dan gram/minggu). Pengukuran selada dilakukan dengan menggunakan alat ukur penggaris, mulai dari pangkal daun hingga ke ujung daun. Pengukuran lobster dimulai dari rostrum hingga ke ujung ekor, sedangkan untuk pengukuran bobot lobster dilakukan dengan menggunakan timbangan digital. Pengukuran panjang daun selada dan lobster disajikan pada Gambar 3.
Tabel 1 Parameter kualitas air yang dianalisis
Parameter Satuan Metode Alat
Fisika
Suhu 0C Pemuaian Termometer
Kimia
pH - Elektroda pH meter
DO mg/L Probe Elektroda DO meter
Amonia mg/L Phenate Spektrofotometer
Nitrat mg/L Reduksi kadmium Spektrofotometer
Ortofosfat mg/L Stanous klorida Spektrofotometer
Sulfida Total mg/L Titrimetrik Buret
Gambar 3 Pengukuran panjang daun selada dan lobster
Analisis Data
Survival rate
Survival rate (SR) atau tingkat kelangsungan hidup merupakan suatu ukuran yang menyatakan berapa banyak lobster yang bertahan hidup selama pengamatan dalam persen. Tingkat kelangsungan hidup lobster dapat dihitung dengan menggunakan persamaan berikut (Goddard 1996).
SR =
x 100
Keterangan:
SR : Survival rate
N0 : Jumlah lobster pada awal tebar
6
Laju pertumbuhan harian lobster
Laju pertumbuhan harian adalah laju persentase pertumbuhan bobot per hari. Laju pertumbuhan harian dihitung dengan menggunakan rumus sebagai berikut (Huisman 1987).
Keterangan:
α : Laju pertumbuhan harian (%) : Bobot rata-rata akhir (gram) : Bobot rata-rata awal (gram) t : Waktu pemeliharaan (hari) Pertumbuhan panjang mutlak
Ukuran panjang lobster adalah antara ujung rostrum hingga ujung telson lobster. Pertumbuhan panjang mutlak dihitung dengan menggunakan rumus berikut (Effendie 1979).
Keterangan :
Pm : Pertambahan panjang mutlak
Lt : Rata-rata panjang individu pada hari ke-t (cm) L0 : Rata-rata panjang individu pada hari ke-0 (cm) Pertumbuhan selada
Ukuran panjang pada lobster adalah antara ujung rostrum hingga ujung telson lobster dan pengamatan pertumbuhan selada dilakukan dengan cara mengukur pertumbuhan panjang daun selada. Laju pertumbuhan panjang harian dihitung dengan menggunakan rumus berikut (Huisman 1987).
Keterangan :
7 Persentase perubahan
Persentase perubahan dihitung dengan melihat selisih hasil pengamatan yang satu dengan yang lain kemudian dipersentasekan. Berikut merupakan cara menghitung persentase perubahan (Sukirno 1985):
Keterangan:
a : nilai awal parameter b : nila akhir parameter Uji T
Uji t dimaksudkan untuk mengetahui seberapa jauh pengaruh satu variabel independen terhadap variabel dependen secara parsial. Uji t yang digunakan dalam penelitian ini yaitu Paired T-Test atau uji t berpasangan menggunakan program SPSS 20. Interpretasi hasil uji Paired T-Test sebagai berikut:
1. Jika p value≤ 0,01 maka hasil uji dinyatakan sangat signifikan. 2. Jika p value > 0,01 tetapi < 0,05 maka hasil uji dinyatakan signifikan. 3. Jika p value > 0,05 maka hasil uji dinyatakan tidak signifikan.
HASIL DAN PEMBAHASAN
Hasil
Suhu
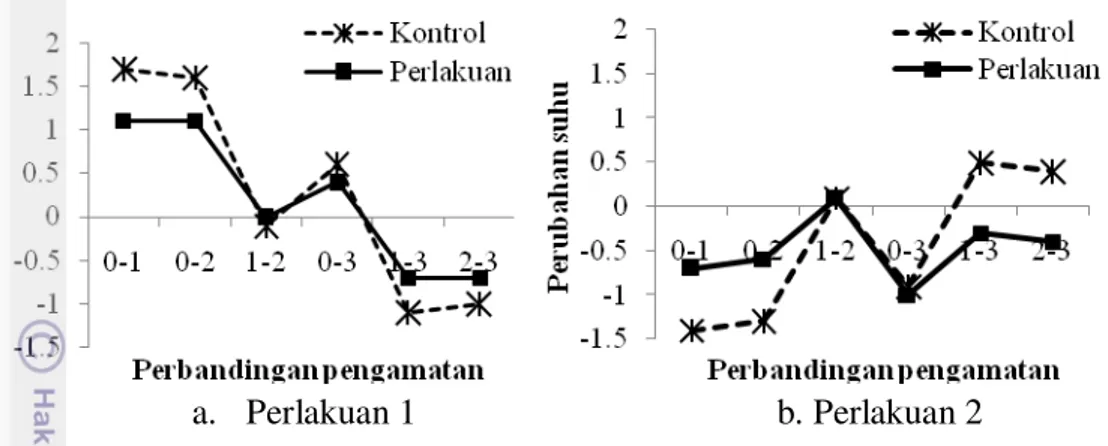
Suhu air merupakan parameter yang penting karena berpengaruh terhadap pertumbuhan dan kehidupan akuatik dan reaksi kimia dalam suatu perairan (Tchobanoglous et al. 2004). Nilai suhu disajikan pada Gambar 4 dan 5.
8
a. Perlakuan 1 b. Perlakuan 2
Gambar 5 Perubahan nilai suhu antar pengamatan pada akuarium kontrol dan perlakuan
Gambar 4 menunjukkan kondisi suhu akuarium kontrol dan perlakuan pada Perlakuan 1 dan 2. Pada Perlakuan 1, suhu akuarium kontrol cenderung lebih tinggi dibandingkan dengan suhu pada akuarium perlakuan. Hal yang sama juga terjadi pada pengamatan Perlakuan 2. Gambar 5 menunjukkan perbandingan nilai suhu antar pengamatan dari akuarium kontrol dan perlakuan pada Perlakuan 1 dan 2. Suhu pada Perlakuan 1 untuk akuarium kontrol terjadi penurunan tertinggi pada perbandingan pengamatan ke-1 dengan ke-3, demikian juga halnya pada akuarium perlakuan. Suhu pada Perlakuan 2 untuk akurium kontrol terjadi penurunan tertinggi pada perbandingan pengamatan ke-0 dengan ke-3, demikian halnya pada akuarium perlakuan.
Berdasarkan penelitian yang telah dilakukan, kisaran suhu dan pH selama pengamatan berada pada kondisi yang mendukung untuk pertumbuhan lobster. Suhu selama pengamatan berkisar antara 27-29 0C. Menurut Rouse (1997) in Budiardi et al. (2008) lobster air tawar jenis red claw akan mengalami pertumbuhan optimal pada suhu 24-29 0C.
pH
Nilai pH menggambarkan konsentrasi ion hidrogen dalam suatu perairan. Nilai pH pada suatu lingkungan berkaitan erat dengan kandungan karbondioksida dalam lingkungan tersebut. Perairan yang ideal bagi pertumbuhan organisme akuatik termasuk tumbuhan air adalah 6,8-8,5 (Pescod 1973). Nilai pH disajikan pada Gambar 6 dan 7.
9
a. Perlakuan 1 b. Perlakuan 2 Gambar 6 Nilai pH pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2 Gambar 7 Perubahan nilai pH antar pengamatan pada akuarium kontrol dan
perlakuan
Nilai pH akuarium kontrol relatif rendah dengan nilai pH terendah sebesar 6,46. Nilai pH yang sesuai untuk media tumbuh lobster berkisar antara 7-8 (Lukito dan Prayugo 2007). Nilai pH kurang dari 5 sangat buruk bagi kehidupan lobster karena dapat menyebabkan kematian, sedangkan pH lebih dari 9 dapat menyebabkan nafsu makan lobster menurun (Iskandar 2003 in Budiardi et al. 2008).
Dissolved Oxygen (DO)
10
a. Perlakuan 1 b. Perlakuan 2
Gambar 8 Nilai DO pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 9 Perubahan nilai DO antar pengamatan pada akuarium kontrol dan perlakuan
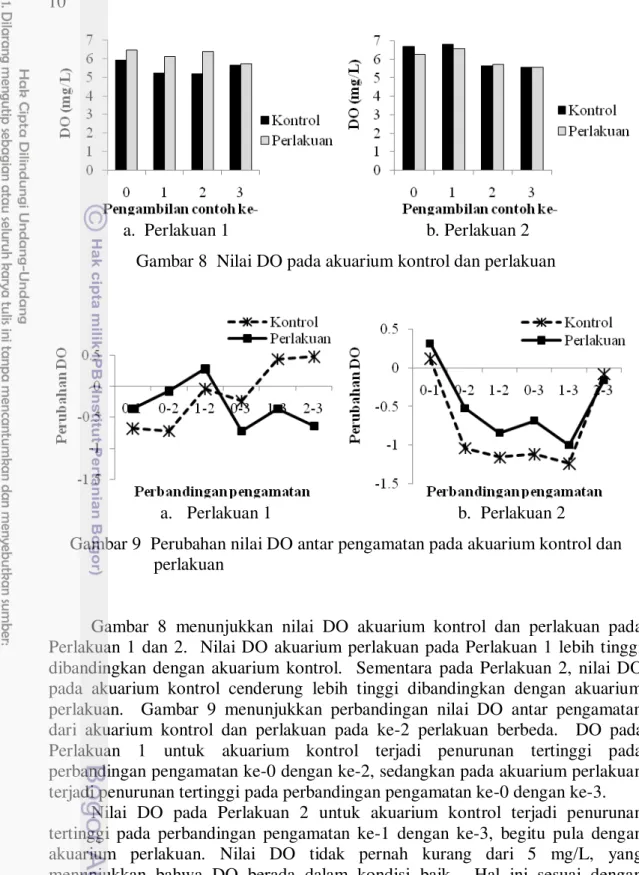
Gambar 8 menunjukkan nilai DO akuarium kontrol dan perlakuan pada Perlakuan 1 dan 2. Nilai DO akuarium perlakuan pada Perlakuan 1 lebih tinggi dibandingkan dengan akuarium kontrol. Sementara pada Perlakuan 2, nilai DO pada akuarium kontrol cenderung lebih tinggi dibandingkan dengan akuarium perlakuan. Gambar 9 menunjukkan perbandingan nilai DO antar pengamatan dari akuarium kontrol dan perlakuan pada ke-2 perlakuan berbeda. DO pada Perlakuan 1 untuk akuarium kontrol terjadi penurunan tertinggi pada perbandingan pengamatan ke-0 dengan ke-2, sedangkan pada akuarium perlakuan terjadi penurunan tertinggi pada perbandingan pengamatan ke-0 dengan ke-3.
Nilai DO pada Perlakuan 2 untuk akuarium kontrol terjadi penurunan tertinggi pada perbandingan pengamatan ke-1 dengan ke-3, begitu pula dengan akuarium perlakuan. Nilai DO tidak pernah kurang dari 5 mg/L, yang menunjukkan bahwa DO berada dalam kondisi baik. Hal ini sesuai dengan pernyataan Lukito dan Prayugo (2007) bahwa konsentrasi oksigen untuk mendukung pertumbuhan lobster adalah lebih dari 5 mg/L.
Amonia
11 dekomposisi bahan organik oleh mikroba dan jamur. Nilai amonia disajikan pada Gambar 10 dan 11.
a. Perlakuan 1 b. Perlakuan 2
Gambar 10 Nilai amonia pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 11 Perubahan nilai amonia antar pengamatan pada akuarium kontrol dan perlakuan
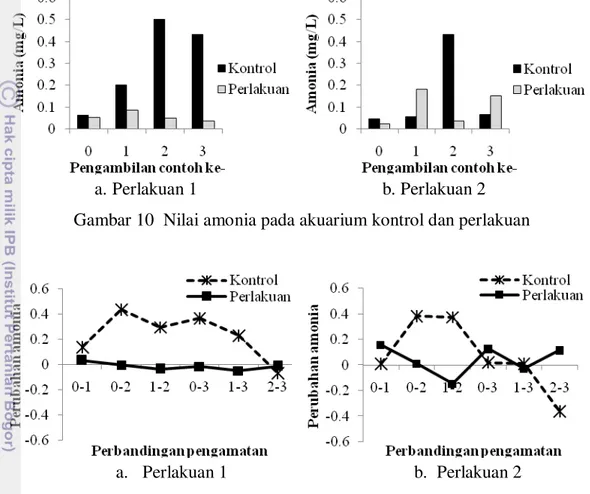
Gambar 10 menunjukkan nilai konsentrasi amonia akuarium kontrol dan perlakuan pada Perlakuan 1 dan 2. Nilai amonia pada akuarium kontrol, baik pada Perlakuan 1 dan 2 lebih tinggi jika dibandingkan dengan akuarium kontrol. Gambar 11 menunjukkan perbandingan nilai amonia antar pengamatan dari akuarium kontrol dan perlakuan pada ke-2 perlakuan berbeda. Konsentrasi amonia pada perbandingan pengamatan ke-3 dengan ke-2 terjadi penurunan yang cukup tajam, sedangkan pada akuarium perlakuan terjadi penurunan tertinggi pada perbandingan pengamatan ke-1 dengan ke-3. Konsentrasi amonia pada Perlakuan 2 untuk akuarium kontrol terjadi penurunan tertinggi pada perbandingan pengamatan ke-2 dengan ke-3, sedangkan akuarium perlakuan terjadi penurunan tertinggi pada perbandingan pengamatan ke-1 dengan ke-2.
12
dapat terjadi karena senyawa amonia menjadi nitrit dan nitrat melalui proses nitrifikasi. Selain itu nilai pH pada akuarium kontrol lebih rendah dibandingkan dengan akuarium perlakuan. Konsentrasi amonia di perairan untuk budidaya adalah 0,2-3 mg/L (Boyd 1990). Penurunan konsentrasi amonia berkurang hingga 80% untuk akuarium perlakuan. Hal ini sesuai dengan pernyataan Syafaat (2010) in Ika dan Rifa’i (2012), bahwa amonia yang berada di kolam akan terserap sampai 80% oleh tanaman.
Nitrat
Nitrat merupakan senyawa yang terbentuk dari hasil nitratasi atau proses oksidasi senyawa nitrit (NO2) menjadi nitrat (NO3) oleh bantuan bakteri Nitrobacter. Goldman dan Home (1983) menyatakan bahwa nitrat dalam perairan akan segera diubah ke dalam bentuk nitrat selama konsentrasi oksigen cukup, dan didalam air nitrat bersifat lebih stabil dibandingkan nitrit. Nilai nitrat disajikan pada Gambar 12 dan 13.
a. Perlakuan 1 b. Perlakuan 2
Gambar 12 Nilai nitrat pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 13 Perubahan nilai nitrat antar pengamatan pada akuarium kontrol dan perlakuan
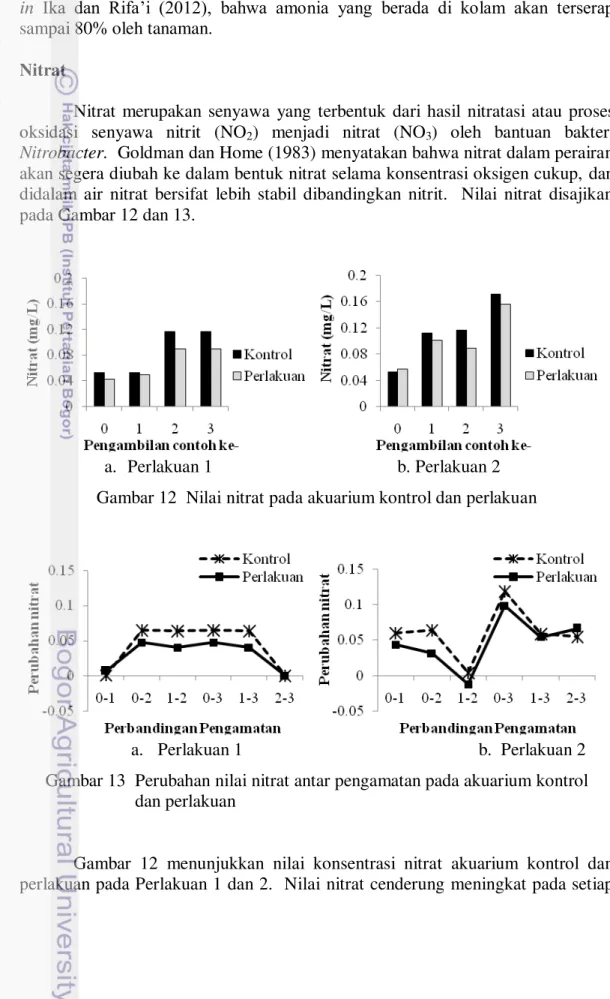
13 pengambilan contoh, baik pada Perlakuan 1 maupun 2 selama pengamatan. Nilai nitrat pada akuarium kontrol lebih tinggi dibandingkan dengan nilai nitrat pada akuarium perlakuan. Hal ini terjadi karena pada akuarium perlakuan sebagian nitrat dimanfaatkan oleh selada karena nitrat merupakan nutrien utama bagi pertumbuhnan tanaman dan alga (Kordi dan Tancung 2007).
Gambar 13 menunjukkan perbandingan nilai nitrat antar pengamatan dari akuarium kontrol dan perlakuan pada Perlakuan 1 dan 2. Konsentrasi nitrat pada Perlakuan 1 untuk akuarium kontrol menunjukkan terjadinya penurunan tertinggi pada perbandingan pengamatan ke-2 dengan ke-3. Hal yang sama juga terjadi untuk akuarium perlakuan. Konsentrasi nitrat pada Perlakuan 2 untuk akuarium kontrol menunjukkan penurunan tertinggi pada perbandingan pengamatan ke-1 dengan ke-2. Hal yang sama juga terjadi pada akuarium perlakuan. Nilai nitrat cenderung meningkat pada setiap pengambilan contoh, baik pada Perlakuan 1 maupun ke-2 selama pengamatan. Nilai perubahan konsentrasi amonia pada akuarium perlakuan dibandingkan dengan akuarium kontrol sebesar 91,5%. Nilai perubahan nitrat lebih rendah dibandingkan dengan nilai perubahan amonia. Konsentrasi nitrat yang aman dalam perairan untuk budidaya ikan berkisar antara 0-3 mg/L (Wedemeyer 1977 in Bansal et al. 2007). Nilai perubahan amonia dan nitrat disajikan pada Tabel 2.
Tabel 2 Nilai perubahan (%) amonia dan nitrat
Pengamatan Nilai perubahan (%) dan pada nitrat sebesar 23,3% pada pengamatan ke-2 dan ke-3. Tumbuhan darat, dalam hal ini selada menurunkan masing-masing 98% dan 94% dari total dan nitrogen anorganik. Selain itu juga, tanaman menurunkan 97% dan 97% dari total dan fosfor terlarut (Brown et al. 1999). Setelah ditambahkan perlakuan selama 120 hari, 30,6% total notrogen dan 18,2% total fosfor menurun dari total masukan nutrien dari 6 m2 kangkung air (Ipomea aquatic) (Li dan Li 2009). Tumbuhan air dapat mengurangi polutan secara signifikan dari limbah budidaya. Penurunan NH4-N berkisar antara 55,9-76%, NO2-N berkisar antara 49,6%-90,6%, NO3-N berkisar antara 34,5%-54,4%, dan PO4-P berkisar antara 64,5-76,8% (Snow dan Ghaly 2008). Penurunan total NO3-N berkisar antara 82,9-98,1%, NO2-N berkisar antara 95,9-99,5%, dan fosfat berkisar antara 54,5-93,6% (Ghaly et al. 2005). Ortofosfat
14
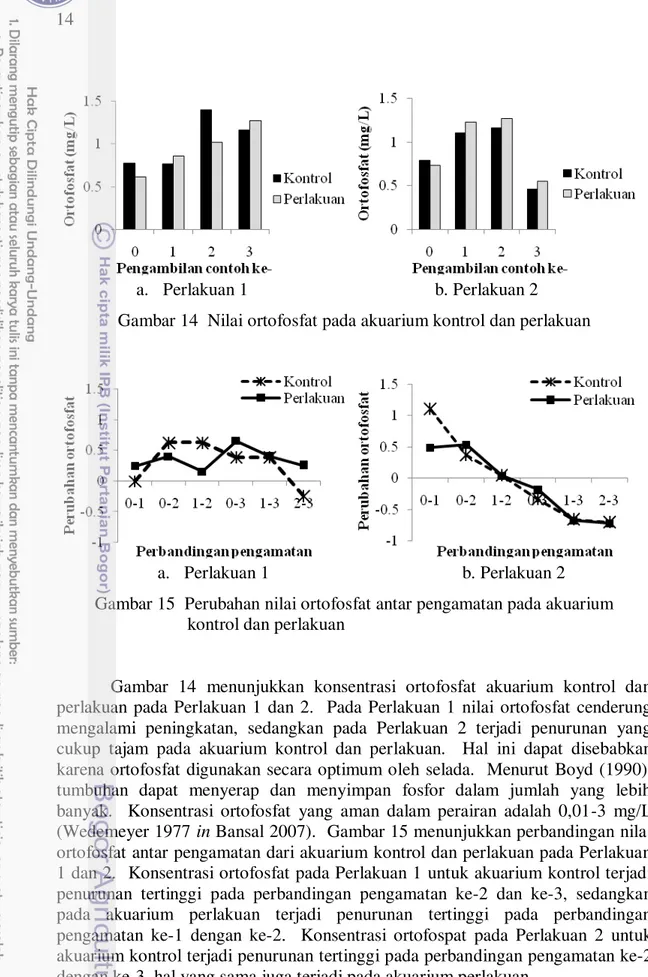
a. Perlakuan 1 b. Perlakuan 2
Gambar 14 Nilai ortofosfat pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2 Gambar 15 Perubahan nilai ortofosfat antar pengamatan pada akuarium
kontrol dan perlakuan
15 Sulfida total
Senyawa sulfur seperti sulfida dapat terkandung dalam air permukaan. Sulfida berasal dari penguraian senyawa organik, bisa pula dari limbah industri, tetapi terutama berasal dari reduksi senyawa sulfat (Greenberg et al. 1998 in Sugiarti et al. 2011). Nilai sulfida total disajikan pada Gambar 16 dan 17.
a. Perlakuan 1 b. Perlakuan 2
Gambar 16 Nilai sulfida total pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 17 Perubahan nilai sulfida total antar pengamatan pada akuarium kontrol dan perlakuan
16
Effendi (2003) kadar sulfida total (H2S, Hd, dan S2-) kurang dari 0,002 mg/L dianggap tidak membahayakan kelangsungan hidup organisme akuatik.
Kelimpahan total bakteri
Kegiatan bioremediasi erat kaitannya dengan penggunaan mikroorganisme, salah satunya adalah bakteri. Nilai kelimpahan total bakteri disajikan pada Gambar 18 dan 19.
Gambar 18 Nilai kelimpahan total bakteri pada akuarium perlakuan
Gambar 19 Perubahan nilai kelimpahan total bakteri antar pengamatan
Gambar 18 menunjukkan nilai kelimpahan total bakteri pada akuarium perlakuan. Pengukuran jumlah total bakteri hanya dilakukan pada Perlakuan 2 saja. Jumlah total bakteri mengalami fluktuasi. Pengambilan contoh ke-1, ke-2 dan ke-3 menunjukkan bakteri berada pada fase log growth, yaitu fase pertumbuhan cepat. Hal ini menunjukkan bahwa kandungan bahan organik pada air limbah masih mencukupi untuk kebutuhan bakteri berkembang biak sehingga tidak terjadi kompetisi untuk mendapatkan makanan (Ulfah 2009). Gambar 19 menunjukkan perbandingan nilai total bakteri antar pengambilan contoh dari akuarium perlakuan. Kelimpahan total bakteri mengalami peningkatan pada setiap perbandingan pengamatan. Hal ini disebabkan adanya kandungan bahan organik yang tinggi dalam air limbah awal yang kemudian dimanfaatkan bakteri (sebagai makanan yang menghasilkan energi) untuk membentuk sel baru dan memperbanyak diri (Tchobanoglous et al. 2004). Menurut Ahmad (1991) dan Rheinheimer (1985) dalam Badjoeri dan Widiyanto (2008), bakteri di perairan
17 dapat tumbuh optimal pada pH 6,5-8,5 dan fluktuasi pH di perairan merupakan proses alami karena aktivitas mikroorganisme (bakteri dan fungi) (Badjoeri dan Widiyanto 2008).
Survival Rate
Survival rate (SR) atau tingkat kelangsungan hidup merupakan suatu ukuran yang menyatakan berapa banyak lobster yang bertahan hidup selama pengamatan dalam persen. Nilai SR disajikan pada Gambar 20 dan 21.
a. Perlakuan 1 b. Perlakuan 2
Gambar 20 Nilai SR lobster pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 21 Perubahan nilai SR antar pengamatan pada akuarium kontrol dan perlakuan
18
Panjang rata-rata lobster
Makhluk hidup mengalami pertumbuhan setiap waktu, baik pertumbuhan bobot, panjang, maupun biomassa. Pertumbuhan dapat diartikan sebagai pertambahan ukuran panjang atau berat dalam suatu waktu, sedangkan pertumbuhan populasi adalah peningkatan biomassa suatu populasi yang dihasilkan oleh akumulasi bahan-bahan dari lingkungannya (Aziz 1989). Nilai pertumbuhan panjang disajikan pada Gambar 22 dan 23.
a. Perlakuan 1 b. Perlakuan 2
Gambar 22 Nilai panjang rata-rata lobster pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2
Gambar 23 Perubahan nilai panjang rata-rata lobster antar pengamatan pada akuarium kontrol dan perlakuan
19 Hasil penelitian menunjukkan pertumbuhan panjang mutlak lobster berkisar antara 0,86-1,42 cm/hari.
Bobot rata-rata lobster
Pertumbuhan yang terjadi pada lobster tidak hanya pertumbuhan panjang saja, tetapi juga pertumbuhan bobot. Pertumbuhan bobot dapat dilihat dari bobot lobster yang terus bertambah. Nilai pertumbuhan bobot disajikan pada Gambar 24 dan 25.
a. Perlakuan 1 b. Perlakuan 2
Gambar 24 Nilai bobot rata-rata lobster pada akuarium kontrol dan perlakuan
a. Perlakuan 1 b. Perlakuan 2 Gambar 25 Perubahan nilai bobot rata-rata lobster antar pengamatan pada
akuarium kontrol dan perlakuan
20
berkisar antara 0,3-0,5 gram/hari. Sementara Medley (1993) in Webster et al. (2004), menyatakan laju pertumbuhan bobot harian berkisar antara 0,4-0,5 gram/hari dan Webster et al. (2004) menyatakan laju pertumbuhan harian lobster berkisar antara 0,6-1,0 gram/hari.
Panjang rata-rata selada
Pertumbuhan tanaman diukur diketahui melaluai nilai Spesific Growth Rate (SGR). Spesific Growth Rate (SGR) atau laju pertumbuhan panjang harian pada tanaman dapat dikatakan sebagai peningkatan panjang/tinggi tanaman dalam suatu interval waktu. Nilai panjang daun selada disajikan pada Gambar 26 dan 27.
a. Perlakuan 1 b. Perlakuan 2 Gambar 26 Nilai panjang rata-rata daun selada
a. Perlakuan 1 b. Perlakuan 2
Gambar 27 Perubahan nilai panjang rata-rata daun selada antar pengamatan pada akuarium perlakuan
21 Selada ditanam dengan sistem akuaponik dan memiliki nilai SGR sebesar 1,02 cm/hari. Nilai pH untuk kegiatan akuaponik yang optimal adalah 5-6 (Gislerød et al. 2005 in Gjesteland 2013), pH 7 masih dapat digunakan untuk pertumbuhan (Roosta 2011 in Gjesteland 2013). Sistem akuaponik harus mengatur pH sekitar 7 karena efisiensi nitrifikasi menurun pada pH kurang dari 7 dan ketersediaan nutrien menurun pada pH lebih dari 7 (Rakocy et al. 1997 in Gjesteland 2013). Nilai persen perubahan tiap parameter disajikan pada Tabel 3, 4, 5, 6 dan 7.
Tabel 3 Persen perubahan kualitas air pada perbandingan pengamatan ke-0 dengan ke-1
Tabel 4 Persen perubahan kualitas air pada perbandingan pengamatan ke-1 dengan ke-3
22
Tabel 6 Persen perubahan pertumbuhan lobster pada perbandingan pengamatan ke-1 dengan ke-3
Tabel 7 Nilai persen perubahan kelimpahan total bakteri pada perbandingan pengamatan ke-0 dengan ke-1 dan perbandingan pengamatan ke-1 dengan ke-3
Tabel 3 dan 4 menunjukkan nilai persen perubahan parameter kualitas air. Nilai persen perubahan yang mengalami penurunan terendah terjadi pada perbandingan pengamatan ke-0 dengan ke-1 dan terdapat pada perlakuan selada dengan bakteri pada parameter suhu, begitu pula halnya dengan perbandingan pengamatan ke-1 dan ke-3. Tabel 5 dan 6 menunjukkan persen perubahan pertumbuhan lobster. Nilai persen perubahan yang mengalami penurunan terendah terjadi pada perbandingan pengamatan ke-1 dengan ke-3 dan terdapat pada perlakuan selada tanpa bakteri pada parameter SR. Tabel 7 menunjukkan nilai persen perubahan kelimpahan total bakteri. Nilai persen perubahan tidak menunjukkan penurunan baik pada perbandingan pengamatan ke-1 dengan ke-2 maupun perbandingan pengamatan ke-1 dengan ke-3. Hal ini terjadi karena kelimpahan total bakteri terus mengalami peningkatan.
Pembahasan
Bioremediasi adalah suatu proses biodegradasi yang produktif untuk menyingkirkan atau mendetoksifikasi polutan yang masuk ke lingkungan dan membahayakan kesehatan, biasanya menjadi kontaminan pada tanah, air, dan sedimen (Thapa et al. 2012). Bioremediasi erat kaitannya dengan aktivitas biologis mikroorganisme. Selain menggunakan peran mikroorganisme, bioremediasi juga dapat menggunakan tumbuhan. Prinsip bioremediasi oleh tumbuhan air adalah terjadinya proses penyaringan dan penyerapan oleh akar dan batang tumbuhan air, serta proses pertukaran dan penyerapan ion terlarut yang dimanfaatkan untuk pertumbuhan dari tumbuhan air itu sendiri (Reed 2005 in Yusuf 2008).
Berdasarkan penelitian yang telah dilakukan, kisaran suhu (27-28,90 C), pH (6,36-7,4), dan DO (5,18-6,70 mg/L) selama pengamatan berada pada kondisi
23 yang mendukung untuk pertumbuhan lobster. Kisaran suhu antara 25-29 0C membuat pH dan kandungan DO dalam air berada pada kondisi yang memadai. Jika terjadi penurunan suhu yang besar, maka nilai pH dan DO akan menurun. Hal ini akan menyebabkan kondisi air menjadi asam dan kurang oksigen, sehingga dapat menyebabkan pertumbuhan lobster tidak optimum. Oksigen terlarut dibutuhkan oleh jasad hidup untuk pernapasan, proses metabolisme, atau pertukaran zat yang kemudian menghasilkan energi untuk pertumbuhan dan pembiakan, serta dibutuhkan juga untuk mengoksidasi bahan-bahan organik dan anorganik dalam proses aerobik (Boyd 1990).
Toksisitas amonia terhadap organisme akuatik meningkat jika terjadi penurunan kadar oksigen terlarut serta peningkatan pH dan suhu air (Colt dan Armstrong 1981 in Kordi dan Tancung 2007). Amonia merupakan salah satu senyawa dari hasil proses dekomposisi bahan organik di perairan. Senyawa ini dapat dimanfaatkan tumbuhan air setelah diubah menjadi nitrit dan nitrat oleh bakteri dalam proses nitrifikasi (Kordi dan Tancung 2007).
Bakteri melakukan peran sebagai dekomposer bahan organik yang terkandung dalam air limbah. Pada proses ini bakteri membutuhkan oksigen yang memadai. Apabila ketersediaan oksigen dalam air limbah tidak mencukupi, maka yang terjadi adalah dekomposisi secara anaerob. Pada kondisi ini akan dihasilkan gas–gas toksik seperti H2S, NH3, dan CH4 yang berbahaya bagi kehidupan biota akuatik. Semakin tinggi bahan organik, maka semakin banyak pula oksigen yang dibutuhkan oleh bakteri (Ulfah 2009).
Selada menerima oksigen sebagai nutrien dari udara. Oksigen dalam media perakaran juga diperlukan untuk proses metabolisme yang terlibat dalam pembentukan akar dan pertumbuhan selanjutnya (Soffer dan Burger 1988). Nilai konsentrasi DO yang rendah dapat menurunkan penyerapan air oleh akar dan akan menyebabkan pertumbuhan selada terhambat (Yoshida et al. 1997). Selada (Lactuca sativa L) dapat tumbuh dengan baik selama pengamatan dilakukan. Pertumbuhan dari selada relatif cepat dengan nilai RGR sebesar 0,04 cm/hari. Hal ini menunjukkan bahwa kondisi media tumbuh selada dalam keadaan yang baik. Selada merupakan jenis sayuran daun yang harus terbebas dari kondisi water stress karena sangat sensitif terhadap kekeringan yang disebabkan sistem perakarannya yang dangkal (Tsabedze dan Wahome 2010). Water stress merupakan salah satu faktor yang sangat membatasi pertumbuhan tanaman, namun tidak terbatas pada daerah semi-kering dan kering (Imanishi et al. 2007 in Kizil et al. 2012). Selain ketersedian air yang memadai, keberadaan bahan organik juga mempengaruhi pertumbuhan dari selada itu sendiri. Kebutuhan akan nutrisi dipenuhi dari nutrien yang terkandung dalam air yang digunakan untuk media hidup lobster. Hal ini sesuai dengan pernyataan Tchobanoglous et al. (2004) bahwa unsur-unsur hara yang dihasilkan dari dekomposisi bahan organik akan dimanfaatkan oleh organisme autotrof, seperti tanaman air dan fitoplankton.
0,86-24
1,42 cm/hari. Laju pertumbuhan lobster menunjukkan bahwa padat penebaran tidak mempengaruhi pertumbuhan panjang mutlak, namun berpengaruh pada pertumbuhan bobot harian. Peningkatan padat penebaran menyebabkan laju pertumbuhan bobot harian dan laju pertumbuhan panjang harian menurun. Menurunnya laju pertumbuhan bobot harian dan panjang harian menggambarkan titik critical standing crop (CSC) telah terlewati.
CSC adalah biomassa ikan dalam wadah budidaya pada waktu pertumbuhan sudah mulai berkurang. Pada kondisi ini peningkatan padat penebaran ikan akan mengakibatkan penurunan laju pertumbuhan, tetapi selama penurunan tidak terlalu besar, hasil akan tetap meningkat. Jika penurunan laju pertumbuhan semakin besar, maka penurunan produksi akan terjadi hingga pertumbuhan nol. Hal ini menunjukkan bahwa biomassa ikan telah mencapai daya dukung maksimum (Hepher 1978 in Budiardi et al. 2008). Nilai pertumbuhan mutlak yang homogen dari semua perlakuan menandakan bahwa kebutuhan lobster terhadap pakan serta lingkungan cukup terpenuhi. Pertumbuhan lobster pada akuarium perlakuan lebih rendah diduga terjadi karena pada awal pemeliharaan, lobster pada akuarium kontrol ukuran panjang dan bobotnya lebih tinggi dibandingkan lobster pada akuarium perlakuan meski perbedaan ukuran tidak terlalu tinggi. Lobster akan tumbuh dan berkembang dengan optimal dalam lingkungan yang baik serta nutrisinya tercukupi. Hal ini sesuai dengan pernyataan Hepher (1978) in Budiardi et al. (2008), bahwa budidaya secara intensif berhasil apabila dapat mengontrol empat faktor yaitu temperatur air, pakan, oksigen terlarut serta buangan metabolit.
Berdasarkan hasil Uji T berpasangan (Lampiran 7), parameter kualitas air dan panjang daun selada memiliki signifikansi lebih dari 0,05 (sig.2-tailed > α) dan nilai t-hitung lebih kecil dari t-tabel yang berarti H0 ditolak. Hal ini menunjukkan bahwa parameter kualitas air dan panjang daun selada mengalami perbedaan yang tidak signifikan. Sementara untuk parameter pertumbuhan panjang dan bobot lobster, nilai signifikansi kurang dari 0,05 (sig.2-tailed < α) dan nilai t-hitung lebih besar dari t-tabel (panjang: -4,101 > 3,182 dan bobot: -13,739 > 3,182) yang berarti H0 gagal ditolak. Hal ini menunjukkan bahwa parameter panjang dan bobot lobster mengalami perbedaan yang signifikan. Nilai t-hitung negatif menunjukkan bahwa rata-rata panjang dan bobot lobster pada perlakuan selada tanpa bakteri lebih rendah dari perlakuan selada dengan bakteri.
KESIMPULAN DAN SARAN
Kesimpulan25
Saran
Saran yang dapat diberikan berdasarkan hasil penelitian ini adalah aplikasi akuaponik dengan sistem bioremediasi dapat diterapkan pada skala yang lebih besar. Untuk skala yang lebih besar diperlukan pemberian asupan nutrisi untuk selada dengan memberikan pupuk yang disemprotkan langsung ke daun agar hasil panen dapat lebih baik.
DAFTAR PUSTAKA
[APHA] American Public Health Association. 2008. Standard Method for The Examination of Water and Wastewater. Baltimore, Maryland (US): Water Pollution Control Federation. 1202p.
Aziz KA. 1989. Teknik Penarikan Contoh Populasi Biologis. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Ilmu Hayat. Bogor (ID): IPB Pr.
Badjoeri M, Widiyanto T. 2008. Penggunaan bakteri nitrifikasi untuk bioremediasi dan pengaruhnya terhadap konsentrasi amonia dan nitrit di tambak udang. Jurnal Oseanologi dan Limnologi di Indonesia. 34(2): 243-259. Bansal AK, Mitra A, Arora RP, Gupta T, Singhvi BSM. 2007. Biological
treatment of domestic wastewater for aquaculture. Journal of Agricultural and Biological Science. 2(1): 6-12.
Boyd CE. 1990. Water Quality Management In Pond Fish Culture. International center for aquaculture agricultural experiment station. Alabama (US): Auburn Univ.
[BRKP] Badan Riset Kelautan dan Perikanan. 2010. Uji multi lokasi pada budidaya ikan nila dengan sistem akuaponik. Bogor (ID): BRKP.
Brown JJ, Glenn EP, Fitzsimmons KM, Smith SE. 1999. Halophytes for the treatment of saline aquaculture effluent. Aquaculture 175:255-268.
Budardi T, Irawan DY, Wahjuningrum D. 2008. Pertumbuhan dan kelangsungan hidup lobster capit merah Cherax quadricarinatus dipelihara pada sistem resirkulasi dengan kepadatan yang berbeda. Jurnal Akuakultur Indonesia. 7(2): 109-114.
Eaton AD, Lenore SC, Eugene WR, Arnold EG, Mary HF. 2005. Standard methods for the examination of water & wastewater: centennial edition. 21st edition. Washington DC (US): American Public Health Association, American Water Works Association, Association and Water Pollution Control Federation.
Effendi H. 2003. Telaah Kualitas Air bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Yogyakarta (ID): Kanisius.
Effendie MI. 1979. Metode Biologi Perikanan. Bogor (ID): Yayasan Dewi Sri. [FAO] Food and Agricultural Organization. 2011. Cultured aquatic species
26
Ghaly AE, Kamal M, Mahmoud NS. 2005. Phytoremediation of aquaculture wastewater for water recycling and production of fish feed. Environment International. 31:1–13.
Gjesteland I. 2013. Study of water quality of resirculated water in aquaponic system [tesis]. Bergen (NO): Norwegian Univ.
Goddard S. 1996. Feed Management In Intensive Aquaculture. New York (US): Chapman and Hall.
Goldman CR, Horne AJ. 1983. Limnology. New York (US): McGraw-Hill.
Huisman EA.. 1987. The Principles of Fish Culture Production. Department of Aquaculture. Netherland (NL): Wageningen Univ.
Ika RP, Rifa’i M. 2012. Pemanfaatan photovolataik pada sistem otomasi akuaponik berbasis mikrokontroler atmega 8535. Jurnal ELTEK. 10(2): 22-32. Kizil U, Genc L, Inalpulat M, Sapolyo D, Mirik M. 2012. Lettuce (Lactuca sativa
L.) yield prediction under water stress using artificial network (ANN) model and vegetation indices. Journal of Agriculture. 99(4): 409-418.
Kordi MGHK, Tancung AB. 2005. Pengelolaan Kualitas Air Dalam Budidaya Perairan. Jakarta (ID): Penerbit Rineka Cipta.
Li W, Li Z. 2009. In situ nutrient removal from aquaculture wastewater by aquatic vegetable Ipomoea aquatica on floating beds. Water Science & Technology. 59(10): 1937–1943.
Lukito A, Prayugo S. 2007. Panduan Lengkap Lobster Air Tawar. Jakarta (ID): Penerbit Penebar Swadaya.
Mitchell DS. 1974. The development of excessive populations of aquatic plants. Paris (FR): Aquatic vegetation and its use and control, UNESCO.
Pescod MB. 1973. Investigation Of Rational Effluent Stream Standards For Tropical Countries. Bangkok (TH): AIT.
Priadie B. 2012. Teknik bioremediasi sebagai alternatif dalam upaya pengendalian pencemaran air. Jurnal Ilmu Lingkungan. 10(1): 38-48.
Rouse DB, Kahn BM. 1998. Production of Australian red claw Cherax quadricarinatus in polyculture with nile tilapia Oreochromis niloticus. Journal of The World Aquaculture Society. 29(3): 340-344.
Snow AM, Ghaly AE. 2008. A comparative study of the purification of aquaculture wastewater using water hyacinth, water lettuce and parrot’s feather. American Journal of Applied Sciences 5(4): 440-453.
Soffer H, Burger DW. 1988. Effects of dissolved oxygen concentrations in aero-hydroponics on the formation and growth of adventitious roots. Journals of The American Society for Horticultural Science. 113(2): 218-221.
Sugiarti, Sutamihardja RJM, Citroreksoko P. 2011. Distribusi spasial sulfida total di kolom air danau Maninjau Sumatera Barat. Jurnal Oseanologi dan Limnologi di Indonesia. 37(1): 139-154.
Sukirno S. 1985. Pengantar Teori Mikroekonomi. Jakarta (ID): Fakultas Ekonomi Universitas Indonesia dan Penerbit Bima Grafika.
Sukmajaya Y, Suharjo. 2003. Lobster Air Tawar Komoditas Perikanan Prospektif. Jakarta (ID): Agromedia Pustaka.
Tchobanoglous G, Burton FL, Stensel HD. 2004. Wastewater Engineering: Treatment And Reuse Fourth Edition. New York (US): Metcalf and Eddy.
27 Tsabedze MW, Wahome PK. 2010. Influence of different irigation regimes on production of lettuce (Lactuca sativa L.). American-Eurasian Journal Agriculture and Environment Science. 8(3): 233-238.
Ulfah WN. 2009. Pengolahan air limbah kantin secara biologi: suatu kajian terhadap efektivitas penggunaan Bacillus sp. Dan kangkung air (Ipomea aquatica) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Webster CD, Thompson KR, Muzinic LA, Yancey DH, Dasgupta S, Xiong YL, Rouse DB, Manomaitis L. 2004. A preliminary assessment of growth, survival, yield, and economic return of Australian red claw crayfish, Cherax quadricarinatus, stocked at three densities in earthen ponds in a cool, temperate climate. Journal of Applied Aquaculture. 15(3/4): 37-50.
Yoshida S, Ktano M, Eguchi H. 1997. Growth of lettuce plants (Lactuca sativa L.) under control of dissolved O2 concentratiom in hydroponics. Journal of Biotronics. 26: 39-45.
28
Selada tanpa bakteri 0,0532 0,0865 0,0496 0,0366
Kontrol 2 0,0463 0,0566 0,4316 0,0671
Selada dengan bakteri 0,0249 0,1830 0,0366 0,1532
Nitrat
Perlakuan
Pengambilan contoh ke-
0 1 2 3
Kontrol 1 0,0519 0,0526 0,1165 0,1165
Selada tanpa bakteri 0,0423 0,0491 0,0894 0,0894
Kontrol 2 0,0526 0,1123 0,1165 0,1713
29
Selada tanpa bakteri 0,6113 0,8582 1,0161 1,2691
Kontrol 2 0,7931 1,1084 1,1601 0,4590
Selada dengan bakteri 0,7346 1,2277 1,2691 0,5512
Sulfida Total
Perlakuan
Pengambilan contoh ke-
0 1 2 3
Kontrol 1 0,0019 0,0019 0,0019 0,0019
Selada tanpa bakteri 0,0019 0,0019 0,0019 0,0019
Kontrol 2 0,0019 0,0019 0,0019 0,0019
Selada dengan bakteri 0,0019 0,0019 0,0019 0,0019
30
Lampiran 3 Data Panjang Daun Selada dan Kelimpahan Bakteri Panjang daun selada
Perlakuan
Pengambilan contoh ke-
0 1 2 3
Selada tanpa bakteri 4,7 9,1 11,8 12
Selada dengan bakteri 6,3 8,0 8,8 8,9
Kelimpahan bakteri
Perlakuan
Pengambilan contoh ke-
1 2 3
Selada dengan bakteri 5100000 32000000 12000000
Lampiran 4 Data Pengurangan Konsentrasi Amonia
0-1 0-2 1-2 0-3 1-3 2-3
Kontrol -22,25% -832,18% -662,54% -44,92% -18,55% 84,45%
Perlakuan -634,94% -46,99% 80,00% -515,26% 16,28% -318,58%
Lampiran 5 Contoh Perhitungan Pengurangan Konsentrasi Amonia
31
Lampiran 7 Hasil Uji T pada pertumbuhan lobster dan selada Paired samples statistics
Parameters Mean N Std. Deviation Std. Error Mean
Suhu (tanpa bakteri) 27,8500 4 0,54467 0,27234
Suhu (dengan bakteri) 27,6250 4 0,41932 0,20966
pH (tanpa bakteri) 6,9825 4 0,30761 0,15381
pH (dengan bakteri) 6,8225 4 0,06850 0,03425
DO (tanpa bakteri) 6,1775 4 0,33470 0,16735
DO (dengan bakteri) 6,0400 4 0,46246 0,23123
Amonia (tanpa bakteri) 0,056475 4 0,0212486 0,0106243
Amonia (dengan bakteri) 0,099425 4 0,0803689 0,0401845
Nitrat (tanpa bakteri) 0,067775 4 0,0250863 0,0125432
Nitrat (dengan bakteri) 0,101125 4 0,0408856 0,0204428
Ortofosfat (tanpa bakteri) 0,938675 4 0,2761798 0,1380899
Ortofosfat (dengan bakteri) 0,945650 4 0,3579129 0,1789565
SR (tanpa bakteri) 97,5025 4 1,66500 0,83250
SR (dengan bakteri) 92,5000 4 6,45497 3,22749
Panjang lobster (tanpa bakteri) 4,4375 4 1,31746 0,65873
Panjang lobster (dengan bakteri) 6,9025 4 0,18733 0,09366
Bobot lobster (tanpa bakteri) 2,9375 4 1,04043 0,52021
Bobot lobster (dengan bakteri) 6,8200 4 1,12703 0,56352
Panjang daun selada (tanpa bakteri) 9,4000 4 3,40098 1,70049
Panjang daun selada (dengan bakteri) 8,0000 4 1,20277 0,60139
Paired samples correlations
Parameters N Correlation Sig.
Suhu (tanpa bakteri) & Suhu (dengan bakteri) 4 -0,489 0,511
pH (tanpa bakteri) & pH (dengan bakteri) 4 0,163 0,837
DO (tanpa bakteri) & DO (dengan bakteri) 4 0,360 0,640
Amonia (tanpa bakteri) & Amonia (dengan bakteri) 4 0,413 0,587
Nitrat (tanpa bakteri) & Nitrat (dengan bakteri) 4 0,647 0,353
Ortofosfat (tanpa bakteri) & Ortofosfat (dengan bakteri) 4 -0,199 0,801
SR (tanpa bakteri) & SR (dengan bakteri) 4 0,775 0,225
Panjang lobster (tanpa bakteri) & Panjang lobster (dengan
bakteri) 4 0,659 0,341
Bobot lobster (tanpa bakteri) & Bobot lobster (dengan bakteri) 4 0,867 0,133
Panjang daun selada (tanpa bakteri) & Panjang daun selada
33
RIWAYAT HIDUP
Penulis dilahirkan di Subang pada tanggal 6 April 1992 dari ayah Sukenda Hanafiah dan ibu Siti Endang Nursidah. Penulis adalah putri kedua dari dua bersaudara. Pendidikan formal ditempuh di TK Tunas Karya (1997), SD Negeri Wangunreja (1998), SMP Negeri 1 Subang (2004), dan SMA Negeri 1 Subang (2007). Pada tahun 2010 penulis lulus dari SMA Negeri 1 Subang dan pada tahun yang sama Penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.