INDUKSI MATURASI GONAD IKAN SIDAT (Anguilla bicolor
bicolor) SECARA HORMONAL DENGAN MENGGUNAKAN
PMSG, AD DAN rGH
HADRA FI AHLINA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Maturasi Gonad Ikan Sidat (Anguilla bicolor bicolor) secara Hormonal dengan menggunakan PMSG, AD dan rGH adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Hadra Fi Ahlina
RINGKASAN
HADRA FI AHLINA. Induksi Maturasi secara Hormonal pada Gonad Ikan Sidat
Anguilla bicolor bicolor) dengan menggunakan PMSG, AD dan rGH. Dibimbin goleh AGUS OMAN SUDRAJAT, TATAG BUDIARDI dan RIDWAN AFFANDI.
Ikan sidat (Anguilla bicolor bicolor) adalah ikan potensial bernilai ekonomis tinggi. Perkembangan budidaya ikan sidat sangat ditentukan oleh ketersediaan benih yang sampai saat ini masih merupakan hasil tangkapan di alam. Kondisi ini tidak akan dapat berlangsung lama, sehingga perlu upaya pembenihan ikan sidat. Sebagai tahap awal kegiatan pembenihan sangat diperlukan penyediaan induk matang gonad.
Reproduksi pada ikan seperti pada vertebrata tingkat tinggi diatur oleh sistem endokrin reproduksi yang terdiri dari otak (hipotalamus), kelenjar pituitari dan gonad. Perlakuan hormon merupakan salah satu solusi pada induk ikan yang sulit matang gonad pada lingkungan budidaya seperti halnya ikan sidat.
Penelitian ini bertujuan untuk mengevaluasi efek pemberian hormon
Pregnant Mare Serum Gonadothropin (PMSG), Anti Dopamin (AD) dan
recombinant Growth Hormon (rGH) melalui teknik penyuntikan terhadap perkembangan gonad ikan sidat.
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 5 perlakuan kombinasi hormon yaitu 10 IU PMSG + 10 ppm AD (P10A), 10 IU PMSG + 10 ppm AD + 10 µg rGH (P10B), 20 IU PMSG + 10 ppm AD (P20A), 20 IU PMSG + 10 ppm AD + 10 µg rGH (P20B), dan Kontrol (tanpa pemberian hormon). Ikan yang digunakan adalah ikan yang didapat dari pembudidaya ikan sidat di Gadog, Jawa Barat, dengan panjang rata-rata 40,6 ± 1,25 cm dan bobot rata-rata 149 ± 4,32 g sebanyak 24 ekor/perlakuan. Penyuntikan dilakukan secara intramuskular pada bagian otot dibawah sirip punggung satu kali seminggu.Pemeliharaan berlangsung selama 10 minggu.
Hasil penelitian menunjukkan bahwa perlakuan hormon merangsang perkembangan sperma, serta peningkatan nilai Faktor Kondisi (FK), Indeks Gonadosomatik (IGS), Indeks Hepatosomatik (IHS), Laju Pertumbuhan Spesifik (LPS) dan Indeks Mata (IM) pada minggu ke-4 hingga ke-6 setelah penyuntikan. Nilai GSI P20A (2.291%), P20B (2.134%), P10B (2.065%), P10A (2.037%) dan PK (1.937%). Nilai HSI pada perlakuan P20A lebih tinggi dibandingkan dengan perlakuan lainnya yakni sebesar 1.188%. Nilai SGR tertinggi P20B (0.514%) dan nilai IUM juga meningkat pada perlakuan P20B seiring dengan bertambahnya bobot tubuh dan terendah pada PK (kontrol).
Secara umum induksi kombinasi hormon PMSG, AD dan rGH dapat merangsang perkembangan testis ikan sidat bobot 149 ± 4,32 gram. Induksi hormon 20 IU PMSG + 10 ppm AD terbukti memacu pertumbuhan testis sebesar 0,266 g selama enam minggu masa pemeliharaan. Penambahan rGH pada premix PMSG dan AD lebih menginduksi pertumbuhan somatik dari pada pertumbuhan gonad, serta proses pematangan gonad pada ikan sidat mengindikasikan adanya keterlibatan hormon LH selain FSH
HADRA FI AHLINA. Hormonally induced gonadal maturation of eels (Anguilla bicolor bicolor) with the use of PMSG, AD and rGH. Supervised by AGUS OMAN SUDRAJAT, TATAG BUDIARDI and RIDWAN AFFANDI.
Eel (Anguilla bicolor bicolor) is fish with a potential high economic value. Eel culture development is largely determined by the availability of seeds from nature. This condition will not last long, so it is necessary to establish eel hatchery. Producing seed is an initial important step to provide mature.
Reproduction in fish as in higher vertebrates is regulated by reproductive endocrine system consists of brain (hypothalamus), pituitary gland, and gonads. Hormonal treatment is one effective solution to help fish which has maturity difficulties, like eel.
This study aimed to evaluate the effect of Pregnant Mare Serum hormone Gonadothropin (PMSG), Anti Dopamine (AD) and recombinant Growth Hormone (RGH) through injection technique for eel gonadal development.
This study used completely randomized design with 5 treatments of hormone combination, which were 10 IU PMSG + 10 ppm AD (P10A), 10 IU PMSG + 10 ppm AD + 10 ug RGH (P10B), 20 IU PMSG + 10 ppm AD (P20A), 20 IU PMSG + 10 ppm AD + 10 ug RGH (P20B), and control (without hormone) . The fish used is derived from eel farmers in Gadog, West Java, at average length of 40.6 ± 1.25 cm and average weight of 149 ± 4.32 g with 24 fish / treatment. Hormone was injected intramuscullarly below the dorsal fin once a week. Fish were reared for 10 weeks.
The result showed that hormone treatment has stimulated development of spermatogenesis, as well as an increase in the value of condition factor (CF), gonadosomatic index (IGS), hepatosomatic index (IHS), Specific Growth Rate (LPS) and Currency Index (IM) at week-4 to week-6 after injection. IGS value P20A (2,291 %), P20B (2,134 %), P10B (2,065 %), P10A (2,037 %) and PK (1,937 %). The highest IHS values was in treatment P20A of all treatments which was 1,188 %. P20B got the highest LPS value (0514 %) and also there was an increasing value of IM in treatment P20B as body weight increased and the lowest was in PK (control).
In general, induction of PMSG hormone combinations, AD, and RGH could stimulate the development of eel testis at weight 149 ± 4.32 g. Hormonal induction of 20 IU PMSG + 10 ppm AD has enhanced growth to 0,266 g for six-week rearing period. The addition of rGH into the premix PMSG and AD has induced more somatic growth than gonadic growths, and the process of gonadal maturation in eels has indicated the involvement of LH and FSH hormone.
©Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
INDUKSI MATURASI GONAD IKAN SIDAT (Anguilla bicolor
bicolor) SECARA HORMONAL DENGAN MENGGUNAKAN
PMSG, AD DAN rGH
HADRA FI AHLINA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Yang Maha Sempurna Allah
subhanahu wa ta’ala karena hanya dengan segala ridha dan karunia-Nya penulis dapat menyelesaikan studi, penelitian serta penulisan tesis yang berjudul Induksi Maturasi secara Hormonal pada Gonad Ikan Sidat (Anguilla bicolor bicolor)
dengan Menggunakan PMSG, AD dan rGH.
Ucapan terimakasih penulis sampaikan kepada Bapak Dr Ir Agus Oman Sudrajat, MSc, Bapak Dr Ir Tatag Budiardi, MSi dan Bapak Prof Dr Ir Ridwan Affandi, DEA selaku dosen pembimbing atas waktu, saran, masukan ilmu dan motivasi semangat untuk terus berjuang dan berusaha hingga penyusunan tesis ini dapat diselesaikan.
Penulis juga mengucapkan terimakasih yang tak terhingga kepada kedua orang tua, Ayahanda Drs M Husni Thamrin dan Ibunda Rahmawati, S.Pd atas do’a, keringat dan air mata serta mencurahkan seluruh kasih sayang, perhatian dan pengertiannya kepada penulis untuk terus maju menggapai cita-cita. Terimakasih untuk kakak adik tercinta Hadra Fi Magfirah, S.Sos, Hadra Fi Kharisma, S.Pd, Anugrah Ganda Putra, A.Md, Anugrah Firasat Putra dan Anugrah Qodrat Ramadhana Putra yang telah memberikan do’a, kasih sayang, perhatian, pengertian serta kesempatan kepada penulis untuk menyelesaikan studi S2 ini.
Terimakasih juga untuk teman seperjuangan, senasib dan sepenanggungan yang sudah rela direpotkan oleh proses penyelesaian studi ini Mahdaliana, Anita Prihatini Ilyas, Rodhi Firmansyah, Achmad Akmal, Nadia Mega Aryani dan Aprilia M Tomasoa, serta teman-teman Pascasarjana Ilmu Akuakultur 2012 atas motivasi yang tulus, serta sumbangan tenaga dan fikiran baik dalam penyelesaian studi, penelitian maupun penulisan tesis ini.
Akhirnya penulis berharap semoga tesis ini bermanfaat dan dapat memberikan tambahan ilmu dan informasi bagi pembaca.
Bogor, Januari 2015
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Kerangka Pemikiran 4
Tujuan 4
Manfaat 4
Hipotesis 4
2 METODE 5
Waktu dan Tempat Penelitian 5
Prosedur Penelitian 5
Parameter Penelitian 8
Analisis Data 10
3 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 19
4 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR TABEL
1. Kombinasi hormon perlakuan 5
2. Ciri-ciri perkembangan testis ikan Sidat 9
3. Hasil pengukuran kualitas air selama pemeliharaan 10 4. Nilai Laju pertumbuhan spesifik (LPS), Faktor Kondisi (FK) dan
Indeks Mata (IM) ikan Sidat pada setiap perlakuan selama
pemeliharaan 11
5. Nilai Indeks Hepatosomatik (IHS) dan Indeks Gonadosomatik (IGS)
ikan sidat pada setiap perlakuan selama pemeliharaan 13 6. Status kelamin dan ciri-ciri ikan sidat hasil induksi hormonal setiap
perlakuan selama pemeliharaan 18
DAFTAR GAMBAR
1 Laju pertumbuhan spesifik ikan sidat pada setiap perlakuan selama
pemeliharaan 11
2 Faktor kondisi ikan sidat pada setiap perlakuan selama pemeliharaan 12 3 Indeks mata ikan sidat pada setiap perlakuan selama pemeliharaan 12 4 Indeks hepatosomatik ikan sidat pada setiap perlakuan selama
pemeliharaan 13
5 Indeks gonadosomatik ikan sidat pada setiap perlakuan selama
pemeliharaan 14
6 Struktur anatomi gonad ikan sidat 14
7 Struktur gonad ikan sidat setiap perlakuan 15
8 Struktur histologis gonad ikan Sidat pada setiap perlakuan selama induksi hormon minggu ke-0 (M0), minggu ke-2 (M2) dan minggu
ke-6 (M6) 16
9 Konsentrasi Estradiol dalam darah ikan sidat pada setiap perlakuan
selama pemeliharaan (awal, tengah dan akhir) 17
10 Konsentrasi Folicle Stimulating Hormone (FSH) dalam darah ikan sidat pada setiap perlakuan selama pemeliharaan (awal, tengah dan
akhir) 17
11 Konsentrasi Luteinizing Hormone (LH) dalam darah ikan sidat pada
setiap perlakuan selama pemeliharaan (awal, tengah dan akhir) 17 12 Analisis proksimat daging ikan Sidat pada setiap perlakuan selama
masa pemeliharaan 19
DAFTAR LAMPIRAN
1 Dokumentasi persiapan wadah 30
2 Prosedur penyuntikan 31
3 Prosedur pembuatan histologis gonad 32
4 Prosedur pengukuran profil hormon dengan ELISA 33
1 PENDAHULUAN
Latar Belakang
Indonesia memiliki potensi sumberdaya perikanan dan kelautan yang sangat besar yang belum dimanfaatkan secara optimal. Ikan sidat (Anguilla bicolor bicolor) merupakan salah satu komoditas perikanan yang belum banyak dikenal masyarakat. Padahal ikan yang mirip dengan belut ini memiliki potensi luar biasa baik sebagai komoditas dalam negeri maupun internasional. Ikan yang bernilai ekonomis tinggi ini banyak dikonsumsi di negara-negara maju, seperti Jepang, Hongkong, Jerman dan Italia. Negara konsumen terbesar ikan sidat adalah Jepang. Negara tersebut mengkonsumsi rata-rata 120.000 ton ikan sidat per tahunnya (Kagawa et al. 2006). Ikan sidat memiliki nilai jual yang tinggi, untuk jenis
Anguilla bicolor bicolor ukuran konsumsi di pasar lokal harganya berkisar antara Rp 200.000 s.d Rp 300.000/kg, sedangkan di pasar internasional Rp 600.000 s.d Rp 1.000.000/kg. Indonesia merupakan salah satu negara yang berpeluang besar untuk menjadi pemasok ikan sidat ke pasar internasional. Hal ini disebabkan oleh banyaknya ikan sidat yang ditemukan di perairan Indonesia, baik ukuran konsumsi maupun ukuran benih.
Budidaya ikan sidat di Indonesia saat ini masih sangat terbatas, karena masyarakat belum menguasai teknologi budidayanya serta informasi pasarnya pun belum memadai. Benih untuk keperluan budidaya cukup tersedia, terutama di muara-muara sungai di pantai selatan Jawa, pantai barat Sumatera dan pantai di Sulawesi. Penangkapan benih ikan sidat dari alam secara terus menerus dan tanpa adanya pengendalian dapat menyebabkan masalah pada produksi, reproduksi dan populasi. Dengan demikian untuk menghindari terjadinya hal tersebut di masa yang akan datang, perlu dilakukan upaya untuk memproduksi benih secara terkontrol.
Dalam kegiatan pembenihan secara terkontrol, ketersediaan induk merupakan prasyarat utama. Pada usaha produksi benih ikan sidat penyediaan induk masih merupakan kendala, karena adanya perbedaan ukuran dewasa antara individu jantan dan betina. Disamping itu kegiatan pembesaran ikan sidat hanya terbatas pada target ukuran konsumsi saja, belum ada upaya lebih lanjut untuk menghasilkan calon induk untuk kegiatan restocking dan produksi benih ikan sidat di masa mendatang.
Untuk menopang pengembangan usaha budidaya ikan sidat tersebut, ketersediaan benih dengan kualitas yang baik dan kontinuitas jumlah merupakan hal yang harus diusahakan. Informasi dasar yang penting diketahui antara lain adalah aspek reproduksi (kematangan gonad, struktur ovarium, status seksual, fekunditas) yang berguna untuk kegiatan pembenihan. Berbagai teknologi telah dilakukan untuk menunjang penyediaan induk yang berkualitas agar siap bereproduksi, baik dengan manipulasi lingkungan, nutrisi maupun teknik seleksi. Demikian pula teknik manipulasi hormonal kedalam tubuh ikan baik secara oral, injeksi maupun implantasi untuk merangsang pematangan gonad.
2
kondisi budidaya gonad dan proses vitellogenesis ikan sidat sulit untuk berkembang (Ijiri et al. 1998).
Pematangan gonad secara buatan dengan rekayasa hormon telah banyak dilakukan. Berdasarkan beberapa penelitian yang telah dilakukan pada beberapa jenis Anguilla, menunjukkan bahwa pematangan gonad ikan sidat juga dapat diinduksi secara hormonal. Uji coba yang dilakukan oleh Fontaine (1964) dalam
Boetius & Boetius (1980) melakukan perlakuan dengan Carp Pituitary Extract
(CPE) memperoleh GSI maksimum sebesar 40%; dalam percobaan tersebut telur berhasil dikeluarkan akan tetapi tidak dilakukan fertilisasi. Selanjutnya Boetius & Boetius (1980) di Laboratorium Danish Institute of Fisheries Denmark telah melakukan penelitian tentang pematangan gonad pada ikan sidat Eropa, A. anguilla dengan menggunakan hormon hCG dan hormon gonad mamalia menghasilkan indeks kematangan gonad (IKG) / Gonado Somatic Index (GSI) maksimum sebesar 12,6% pada A. anguilla. Di Perancis, Polandia, Denmark dan Jepang, uji coba pematangan gonad ikan sidat melalui injeksi hormon dan hipofisasi telah berhasil mencapai kematangan penuh (Bieniarz dan Epler 1977).
Penelitian yang dilakukan oleh Ohta (1997) telah berhasil menginduksi ovulasi A. japonica dengan penyuntikan 17α,20β-dihydroxy-4-pregnen-3-one (DHP) yang dikombinasikan dengan ekstrak hipofisis salmon dan menghasilkan telur dengan derajat pembuahan (10,3%) dan derajat penetasan (50,6%). Kemudian Rovara (2007) telah berhasil menginduksi maturasi A. bicolor bicolor
dengan penyuntikan ekstrak hipofisis yang menghasilkan GSI 3,37% dan HSI 2,27%.
Metode yang digunakan untuk menginduksi pematangan atau maturasi oosit pada sidat mengacu pada penelitian yang dilakukan oleh Rovara (2007) yaitu menggunakan ekstrak hipofisa. Akhir-akhir ini banyak penelitian menggunakan
Pregnant Mare Serum Gonadothropin (PMSG) untuk menginduksi kematangan gonad. Misalnya penggunaan kombinasi hormon 20 IU PMSG dan 10 IU HCG per kg ikan serta penambahan vitamin mix sebesar 100 mg/kg ikan dapat merangsang rematurasi gonad ikan patin selama enam minggu (Febriana, 2010).
PMSG adalah hormon yang terdapat dalam serum bangsa equidae (kuda, kuldi dan zebra) yang sedang bunting dan memiliki cara kerja merangsang pertumbuhan sel-sel interstitial dan pembentukan sel-sel lutea. PMSG telah digunakan pada ikan lele dengan kombinasi hormon PMSG dan HCG terhadap ovulasinya (Basuki, 1990).
Antidopamin (AD) merupakan suatu zat kimia yang biasa digunakan untuk menyuntik ikan sebelum ditemukannya ovaprim. Chen dan Fernald (2008) menyatakan bahwa antidopamin adalah bahan kimia yang dapat menghentikan kerja dopamin. Dopamin merupakan neurotransmitter yang berperan dalam menghambat pematangan gonad. Dopamin menghambat pematangan gonad dengan menstimulasi sekresi hormon penghambat perkembangan gonad (GIH).
teknologi protein rGH untuk mempercepat pertumbuhan ikan sudah banyak dilakukan di daerah sub tropis pada beberapa spesies ikan yang berbeda. Pemberian rGH pada ikan rainbow trout dapat meningkatkan pertumbuhan sebesar 50% dibandingkan dengan ikan kontrol (Sekine et al. 1985). Pada ikan baronang pemberian rGH selama empat minggu dapat meningkatkan bobot tubuh sebesar 20% dibandingkan kontrol (Funkenstein et al. 2005). Pemberian rGH ikan mas sebesar 0,1 μg/g bobot tubuh pada benih ikan nila dapat meningkatkan bobot tubuh sebesar 53,1% dibandingkan dengan kontrol (Li et al. 2003). Penggunaan GH dapat dilakukan melalui beberapa metode, yaitu melalui oral, perendaman, dan penyuntikan. Metode perendaman dan oral merupakan metode yang relatif lebih mudah untuk diaplikasikan dalam budidaya. Alimuddin et al. (2010) telah berhasil membuat protein hormon pertumbuhan rekombinan (rGH) ikan gurame, ikan mas, dan ikan kerapu kertang. Acosta et al. (2007) melaporkan perendaman hormon pertumbuhan dapat meningkatkan bobot ikan nila sebesar 171%.
Pemberian rGH yang berbeda pada ikan nila melalui teknik penyuntikan atau induksi berhasil meningkatkan bobot sebesar 20,94% (rGH ikan kerapu kertang); 18,09% (rGH ikan mas); 16,99% (rGH ikan gurame) (Lesmana 2010). Penelitian pada ikan sidat yang dilakukan oleh Boyun (2012) menyatakan bahwa pemberian rGH melalui perendaman dan oral pada glass eel sebanyak 12 mg/l dapat meningkatkan pertumbuhan ikan sidat sebesar 37,4% lebih tinggi dibandingkan dengan kontrol. Dengan demikian perlakuan kombinasi hormon ini sangat diperlukan untuk menginduksi tahap perkembangan gonad ikan sidat. Usaha pemijahan buatan ikan sidat secara hormonal sampai saat ini masih terus dikembangkan pada ikan sidat Eropa (A. anguilla) sidat New Zealand (A. dieffenbachi, A. australis) dan terutama untuk sidat Jepang khususnya A. japonica
(Ohta et al. 1997, Kagawa et al. 1997), pemijahan buatan pada sidat lokal Indonesia sampai saat ini masih belum pernah dilakukan.
Penelitian ini bertujuan untuk mengevaluasi efek pemberian hormon PMSG, AD dan rGH melalui teknik induksi terhadap perkembangan gonad ikan sidat. Berbagai penelitian telah dilakukan namun belum mendapatkan hasil yang optimal baik melalui rangsangan internal maupun eksternal. Berdasarkan pertimbangan tersebut perlu dikembangkan teknologi sebagai jalan pintas untuk menghasilkan ikan sidat yang matang gonad. Teknologi yang berkembang saat ini telah memberikan peluang yang amat besar untuk merealisasikan tujuan tersebut.
Perumusan Masalah
Perkembangan budidaya ikan sidat sangat ditentukan oleh ketersediaan benih yang sampai saat ini masih merupakan hasil tangkapan di alam. Kondisi ini tidak akan dapat berlangsung lama, sehingga perlu upaya pembenihan ikan sidat. Sebagai tahap awal kegiatan pembenihan sangat diperlukan penyediaan induk matang gonad.
Manipulasi reproduksi induk ikan dapat dilakukan melalui manipulasi secara hormonal. Reproduksi pada ikan, seperti pada vertebrata tingkat tinggi diatur oleh sistem endrokin reproduksi yang terdiri dari otak (hypothalamus),
4
Dalam penelitian ini PMSG, AD dan rGH akan digunakan untuk menginduksi pematangan gonad ikan. Namun dosis kombinasi dan peran dari hormon tersebut dalam pematangan gonad ikan sidat belum diketahui. Oleh karena itu, penggunaan hormon PMSG, AD dan rGH dengan kombinasi ini diharapkan mampu menginduksi pematangan gonad pada ikan sidat, sehingga diperoleh induk matang gonad yang siap untuk dipijahkan.
Kerangka Pemikiran
Mekanisme hormonal untuk pematangan gonad melibatkan Gn-RH, gonadotropin, estradiol-17β, testosteron, dan 17α-20βdihidroksiprogesteron. Anti dopamin akan memblok dopamin yang disekresikan oleh hipotalamus. FSH eksogenous pada PMSG akan bekerja pada organ target (gonad) yang merangsang terjadinya lonjakan kadar GnRH sehingga mempengaruhi pituitary untuk memproduksi FSH, merangsang oosit untuk mensintesis testosteron pada lapisan teka dan mengubahnya menjadi estradiol 17β. Eestradiol 17β merangsang hati untuk mensintesis vitelogenin yang merupakan bakal kuning telur, setelah vitelogenin diserap oleh oosit sampai ukuran maksimum akan memberikan feedback positif ke hipotalamus untuk memproduksi GnRH dan merangsang pituitary memproduksi LH yang mengakibatkan ovulasi. Hormon pertumbuhan akan merangsang pituitary untuk mengatur beberapa aspek fisiologi seperti pertumbuhan, metabolisme, osmoregulasi, fungsi kekebalan tubuh, reproduksi, dan merangsang hati untuk menghasilkan insulin-like growth factor-1 / IGF-I. Dengan demikian hal ini dapat membantu proses pematangan ikan sidat.
Tujuan
Penelitian ini bertujuan untuk mengevaluasi efek pemberian hormon PMSG, AD dan rGH melalui teknik penyuntikan terhadap perkembangan gonad ikan sidat
(Anguilla bicolor bicolor).
Manfaat
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang reproduksi dan pematangan gonad ikan sidat sebagai salah satu teknik alternatif yang dapat diterapkan dalam upaya pengembangan usaha budidaya khususnya pembenihan ikan sidat serta dapat menambah khasanah ilmu pengetahuan dan teknologi, khususnya dibidang reproduksi ikan sidat.
Hipotesis
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan selama 5 bulan di Laboratorium Fisiologi Hewan Air, Departemen Manajemen Sumberdaya Perairan. Pembuatan preparat histologis dilakukan di Laboratorium Kesehatan Ikan. Analisis konsentrasi hormon estradiol, FSH dan LH dilakukan di Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Prosedur Penelitian
Rancangan Penelitian
Penelitian ini menggunakan metode eksperimen dengan Rancangan Acak Lengkap (RAL). Penelitian menggunakan perlakuan kombinasi hormon PMSG + Antidopamin (oodev) dan hormon pertumbuhan (rGH) dengan ulangan individu 24 ekor. Hormon dikombinasikan sesuai dosis perlakuan yang tercantum pada Tabel 1.
Tabel 1 Kombinasi hormon perlakuan
Perlakuan PMSG (IU) AD (ppm) rGH (µg) Kode Perlakuan
1 Larutan fisiologis (NaCl) PK (Kontrol)
2 10 10 - P10A
3 10 10 10 P10B
4 20 10 - P20A
5 20 10 10 P20B
Persiapan Wadah
Wadah yang akan digunakan pada pematangan gonad ikan sidat ini berupa bak berdinding keramik berukuran 1,7x1,7x1 m. Wadah dicuci bersih dan dikeringkan. Didalam bak tersebut ditempatkan 4 hapa untuk penebaran dengan ukuran masing-masing 85x85x100 cm3. Bak pemeliharaan dilengkapi dengan sistem aerasi dengan tambahan filter yang terbuat dari drum plastik berukuran kecil yang telah diisi dengan zeolit, karbon aktif, karang jahe dan kapas (Lampiran 1).
Persiapan Media
6
Persiapan Hewan Uji
Hewan uji yang digunakan adalah ikan sidat Anguilla bicolor bicolor
dengan bobot 149±4,32 g/ekor. Ikan ini adalah ikan yang diangkut dari pembudidaya menggunakan plastik yang sudah diisi oksigen dengan lama perjalanan 2 jam. Setelah berada di lokasi penelitian, dilakukan proses aklimatisasi.
Aklimatisasi
Penanganan terhadap ikan sidat setelah pengangkutan harus dilakukan dengan hati-hati agar ikan tidak stres. Kantong plastik berisi ikan sidat dimasukkan dan diapungkan ke dalam bak. Ikatan pada kantong plastik dibuka dan secara perlahan posisi kantong dimiringkan kearah mulut kantong. Air dalam bak dan air dalam kantong dibiarkan dengan sendirinya. Ikan sidat dibiarkan keluar sendiri dari kantong plastik tersebut. Selama 3 hari pertama, ikan tidak diberi pakan. Hari selanjutnya ikan dibiasakan dengan pakan buatan berkadar protein tinggi. Aklimatisasi di dalam bak penampungan ini dilakukan selama 2 minggu. Selama masa aklimatisasi di dalam bak penampungan tersebut, ikan sudah terbiasa dengan lingkungan baru dan pakan. Selanjutnya ikan dipindahkan ke dalam bak percobaan dan dilanjutkan dengan proses aklimatisasi air laut dan penebaran.
Proses aklimatisasi air laut dilakukan langsung di dalam bak percobaan. Bak diisi air tawar setinggi 15 cm yang dilengkapi dengan aerasi baik serta penutup lagi dengan air laut 10 cm, begitu seterusnya hingga kisaran salinitas mencapai 30 ppt dan diatur agar adaptasi ikan terhadap perubahan salinitas dapat berjalan dengan baik. Proses aklimatisasi air laut ini berlangsung sealama 3 hari dan selama proses ini, ikan tidak diberi pakan.
Pemeliharaan
Padat Tebar, Manajemen Air dan Pakan
Ikan sidat yang akan digunakan dalam percobaan ini diukur panjang dan ditimbang bobot tubuhnya untuk menentukan jumlah pakan yang akan diberikan. Selanjutnya ikan ditebar yang dibagi ke dalam 5 bak perlakuan masing-masing 24 ekor.
Proses perkembangan gonad ikan sidat dilakukan pada media yang bersalinitas. Setiap 2 hari sekali dilakukan penggantian air sebanyak 75% di pagi hari. Pada waktu penggantian air, bak disifon untuk membuang sisa pakan dan kotoran yang menumpuk di dasar.
2 minggu untuk membiasakan ikan kembali mempunyai nafsu makan yang baik dan stabil pada lingkungan bersalinitas.
Pembiusan dan Penyuntikan
Pembiusan dilakukan dengan menggunakan obat bius stabilizer dengan dosis 1 ml/0,5 L air selama tiga menit, kemudian dilakukan pengukuran panjang dan bobot tubuh ikan. Pengukuran panjang menggunakan mistar dengan ketelitian 1 mm, sedangkan penimbangan bobot menggunakan timbangan digital dengan ketelitian 0,01 g.
Penyuntikan dilakukan secara intramuskular dengan hormon perlakuan sesuai dengan dosis satu kali seminggu. Percobaan berlangsung selama 10 minggu. Ikan yang telah disuntik dimasukkan pada wadah dengan aerasi yang kuat selama 6 sampai 10 menit (Lampiran 2).
Pengambilan Sampel dan Pembuatan Preparat Histologis
Sampel yang diambil adalah berupa organ hati dan gonad ikan. Pengambilan sampel hati dan gonad dilakukan untuk penghitungan indeks hepatosomatik serta indeks gonadosomatik, sedangkan histologi gonad dilakukan untuk mengetahui status kelamin ikan sidat. Pengambilan sampel dilakukan sebanyak 5 kali selama penelitian dengan selang waktu dua minggu sekali. Ikan diambil 3 ekor/perlakuan untuk dibedah pada bagian anus hingga kepala, kemudian diambil bagian gonad dan hatinya dengan perlahan. Sampel ditimbang dan dimasukkan ke dalam botol film yang diberi buffered neutral formalin (BNF). Kemudian gonad dicuci dengan air bersih dan dihistologis menggunakan metode Gunarso (1989) dengan pemotongan spesimen setebal 6-7 µm (Lampiran 3).
Analisis Hormon
Fluktuasi hormon dalam tubuh ikan sidat diukur melalui pengambilan darah terhadap ikan dengan sampel 2 ekor/perlakuan pada awal, tengah dan akhir penelitian. Darah diambil dari arteri pada pangkal ekor sebanyak 1 ml menggunakan syringe bervolume 1 ml yang sebelumnya telah dibilas dengan anti koagulan agar darah yang diambil tidak membeku. Sampel darah selanjutnya disentrifus dengan kecepatan 5000 rpm selama 15 menit. Plasma darah diambil dan disimpan pada freezer bersuhu -20 0C selama 12 jam dan selanjutnya dilakukan pengukuran dengan menggunakan metode Vidas ELISA kit (Lampiran 4).
Analisis Proksimat
Analisis proksimat yang dilakukan dalam penelitian ini bertujuan untuk menganalisis kandungan energi yang dapat dimanfaatkan oleh ikan. Analisis proksimat yang dilakukan berdasarkan prosedur Takeuchi (1988) yang meliputi analisis pakan, kadar protein, lemak dan karbohidrat sebagai sumber energi bagi ikan (Lampiran 5).
Pengukuran Kualitas air
8
terlarut (DO) menggunakan alat DO-meter (mg/L), suhu air menggunakan termometer (°C), nilai pH menggunakan kertas lakmus, salinitas menggunakan salinometer (g/l) dan amoniak menggunakan spektrofotometer (mg/l). Penentuan kadar oksigen terlarut dan amoniak di lakukan di laboratorium dengan membawa sampel air media penelitian.
Parameter Penelitian
Laju Pertumbuhan Spesifik Ikan
Laju pertumbuhan spesifik atau Laju Pertumbuhan Spesifik (LPS) ikan akan dihitung dengan rumus :
LPS = ̅̅̅̅ ̅̅̅̅̅ Keterangan:
LPS : laju pertumbuhan spesifik (%)
̅t : bobot rata-rata ikan pada akhir penelitian (g) ̅o : bobot rata-rata ikan pada awal penelitian (g)
T : periode penelitian (hari)
Faktor Kondisi
Faktor kodisi merupakan perbandingan antara panjang dan bobot tubuh ikan selama masa pemeliharaan. Penentuan faktor kondisi ini menggunakan rumus (Shreck dan Moyle 1990):
FK = W / L³ x 100
Keterangan:
FK = Faktor Kondisi W = Bobot tubuh ikan (g) L = Panjang tubuh ikan (cm)
Indeks Mata
Indeks mata ditentukan berdasarkan rumus sebagai berikut (Pankhurst, 1982) :
[{(A+B) / 4}² x π / L ] x100 Keterangan:
A = diameter mata secara horizontal (cm) B = diameter mata secara vertikal (cm) L = panjang tubuh total (cm)
Indeks Hepatosomatik (IHS)
Indeks hepatosomatik merupakan parameter persentase antara bobot hepatik dengan bobot tubuh total. Pengamatan ini dilakukan pada awal (M0), tengah (M2, M4 dan M6) dan akhir penelitian (M8).
Keterangan:
IHS = indeks hepatosomatik (%) Wh = bobot hati (g)
Wi = bobot tubuh ikan (g)
Indeks Gonadosomatik (IGS)
Indeks gonadosomatik merupakan sebuah nilai perbandingan antara bobot gonad dengan keseluruhan bobot tubuh ikan. Pengamatan dilakukan pada awal, tengah dan akhir penelitian. Rumus yang digunakan dalam pengamatan parameter gonadosomatik indeks adalah sebagai berikut:
IGS =
Struktur anatomi dan histologi diamati untuk melihat perbedaan antara struktur anatomi dan histologi ikan sidat yang diberi perlakuan hormon dan tanpa perlakuan hormon yang diamati secara deskriptif.
Status Kelamin
Penentuan status kelamin dari ikan sidat dilakukan dengan cara pengamatan morfologi dari warna perut, warna gonad, tahap perkembangan dan status gonad. Pengamatan ini dilakukan pada akhir penelitian (minggu ke-8).
Tabel 2 Ciri-ciri perkembangan testis ikan Sidat (Miura et al. 2011) Tahap
perkembangan
Ciri-ciri TKG
Spermatogonia tipe A
Inti sel besar, diselimuti kapsul seminiferus, jumlah inti dalam 1 kapsul masih sedikit, jumlah kapsul jumlah inti dan kapsul semakin merata dipermukaan jaringan
I
Spermatosit Inti sel kecil, sebagian masih berada dalam kapsul, kapsul seminiferous transparan
II
Spermatid Inti sel kecil yang memenuhi permukaan jaringan, padat, merata
III
Spermatozoa Massa spermatozoa berwarna biru kehitaman dan mempunyai ekor
IV
Profil Hormon
Pada perkembangan gonad ikan sidat, hormon yang harus diketahui fluktuasinya antara lain adalah hormon Estradiol, folicle stimulating hormon
10
Analisis Proksimat
Dalam penelitian ini perlu diketahui kandungan energi yang dimanfaatkan oleh ikan, maka perlu dilakukan analisis proksimat pakan dan daging ikan sidat.
Kualitas Air
Kualitas air selama penelitian dijaga kestabilan kondisinya. Hasil pengukuran kualitas air pemeliharaan ikan sidat dapat dilihat pada Tabel 3.
Tabel 3 Hasil pengukuran kualitas air selama penelitian Parameter
Kualitas Air
Kisaran hasil
Pengukuran Satuan
Kualitas Air
Optimum Pustaka
DO 7,0-7,3 mg/l > 3,0 Marcel 1975
Ph 6,7-6,8 7-8
Suhu 27-28 °C 28-32 Hasbullah 1996
Salinitas 25-30 g/l
Nitrit 0,6-0,7 mg/l <0,7 Degani et al. 1985
TAN 0,1-0,2 mg/l <0,2
Analisis Data
Data yang diperoleh dari pengamatan kemudian dihitung untuk mendapatkan hasil parameter uji faktor kondisi, laju pertumbuhan spesifik, indeks hepatosomatik, indeks gonadosomatik dan indeks ukuran mata. Data tersebut dianalisis secara secara statistik menggunakan analisis ragam (ANOVA). Jika terdapat perbedaan yang nyata (P<0,05) maka dilanjutkan dengan uji Tuckey dengan selang kepercayaan 95%. Pengolahan pengujian data menggunakan bantuan program Microsoft Excel 2007 dan MINITAB 16 for windows. Hasil pengamatan struktur anatomi dan histologi, status kelamin, analisis hormon serta analisis proksimat dan kualitas air dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
Laju Pertumbuhan Spesifik, Faktor Kondisi dan Indeks Mata
Tabel 4 Nilai LPS, FK dan IM ikan Sidat pada setiap perlakuan selama
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Duncan)
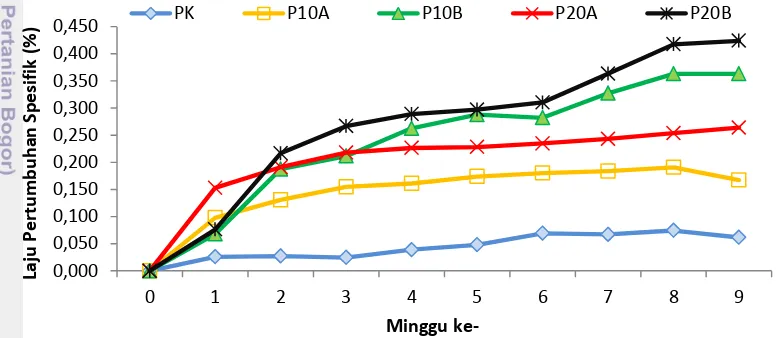
Tabel 4 menyatakan bahwa nilai laju pertumbuhan spesifik dan indeks mata terbaik ditunjukkan oleh P20B, yakni induksi kombinasi hormon 20 IU PMSG + 10 ppm AD + 10 µg rGH. Nilai LPS terbaik (0,266%) dan IM (10,599). Sedangkan FK terbaik ditunjukkan oleh P20A (0,214) pada selang kepercayaan 95 % (P<0,05).
Dari Gambar 1, terlihat bahwa adanya peningkatan nilai LPS setiap minggu. Peningkatan yang signifikan terlihat pada P20B dan P10B. Hal ini diduga oleh adanya penambahan 10 µg rGH. LPS pada P20B meningkatlebih tajam karena adanya perbedaan dosis PMSG, 10IU pada P10B dan 20IU pada P20B.
Gambar 1 Laju pertumbuhan spesifik ikan sidat pada setiap perlakuan selama pemeliharaan
Dari Gambar 2, nilai faktor kondisi tertinggi ditunjukkan oleh perlakuan P10A, P20A dan P20B dan tidak menunjukkan perbedaan nyata antar ketiga perlakuan tersebut. Pada P10B hasil yang ditunjukkan berbeda nyata dengan P10A, P20A dan P20B. P10B juga menunjukkan bahwa tingkat perbedaan dari nilai rata-rata adalah yang tertinggi. Hal ini menjelaskan bahwa induksi hormon berpengaruh pada nilai faktor kondisi ikan sidat.
12
Gambar 2 Faktor kondisi ikan sidat pada setiap perlakuan selama pemeliharaan
Dari Gambar 3, indeks mata pada P20B mengalami peningkatan setiap minggu seiring bertambahnya bobot tubuh ikan. semakin berat dan panjang ikan, maka semakin besar indeks mata. Analisis statistik menunjukkan perbedaan yang nyata antara P10A, P20A, P20B dengan P10B dan PK.
Gambar 3 Indeks mata ikan sidat pada setiap perlakuan selama pemeliharaan
Indeks Hepatosomatik (IHS) dan Indeks Gonadosomatik (IGS)
Hasil pengamatan IHS dan IGS disajikan pada tabel 4, peningkatan nilai IHS dan IGS ikan sidat perminggu disajikan pada gambar 4 dan 5.
Dari Tabel 5 dapat dilihat bahwa IHS tertinggi ditunjukkan oleh perlakuan P20A yakni induksi 20 IU PMSG + 10 ppm AD dengan nilai (1,188 ± 0,091), diikuti P20B (1,112 ± 0,074), P10A (1,071 ± 0,064) dan P10B (1,064 ± 0,040) serta terendah ditunjukkan PK dengan nilai (0,905 ± 0,029). Begitu juga dengan nilai IGS, yaitu rata-rata IGS tertinggi ditunjukkan oleh P20A dengan nilai (2,291 ± 0,278) kemudian diikuti oleh P20B (2,134 ± 0,265), P10B (2,065 ± 0,201), P10A (2,037 ± 0,105) dan terendah PK (1,937 ± 0,050). Pemberian 20 IU PMSG
+ 10 ppm AD (P20B) memberikan pengaruh yang nyata terhadap perkembangan IHS dan IGS ikan sidat ukuran 150-200 gram.
Tabel 5 Nilai IHS dan IGS ikan sidat pada setiap perlakuan selama pemeliharaan
Perlakuan IHS (%) IGS (%)
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Duncan)
Pada Gambar 4 dapat dilihat bahwa indeks hepatosomatik ikan sidat P20A dan P20B mengalami peningkatan pada minggu ke 4, namun pada minggu ke-6 mengalami penurunan. Hal ini dapat dikatakan bahwa hormon ini berpengaruh pada nilai IHS ikan sidat dalam waktu yang singkat yakni kurang dari 6 minggu pemeliharaan.
Gambar 4 Indeks hepatosomatik ikan sidat pada setiap perlakuan selama pemeliharaan
14
Gambar 5 Indeks Gonadosomatik ikan sidat pada setiap perlakuan selama pemeliharaan
Struktur Anatomi dan Histologis Ikan Sidat
Struktur anatomi dan struktur histologis gonad ikan sidat disajikan pada gambar 6a dan 6b, struktur gonad dan histologis gonad ikan sidat pada setiap perlakuan selama induksi hormon disajikan pada Gambar 7 dan 8.
Gambar 6 Struktur anatomis gonad ikan sidat.
Keterangan: a. Ikan sidat sebelum diberi perlakuan pada Minggu ke-0 (w. 146 gram); b. Ikan sidat setelah diberi perlakuan kombinasi hormon pada Minggu ke-6 (w. 187 gram); 1. Hati; 2. Permukaan perut bagian luar; 3. Dinding perut bagian dalam; 4. Lemak; 5. Gonad jantan; 6. Usus; 7. Lambung. ( 0,6 mm)
Gambaran anatomi ikan sidat menunjukkan perbedaan antara M0 dengan M6. Pada M0 gonad belum terlihat, hanya berupa benang tipis. Pada minggu ke-6,
0,00 0,50 1,00 1,50 2,00 2,50 3,00
0 2 4 6 8
In
d
e
ks
Go
n
ad
o
som
atik
(%
)
Minggu ke-
gonad sudah bisa dilihat dengan jelas pada sisi kiri dan kanan yang melekat pada dinding ventral bagian atas. Gonad terlihat berwarna putih kekuningan.
Gambar 7 Struktur gonad ikan sidat setiap perlakuan ( 0,4 mm)
MO
16
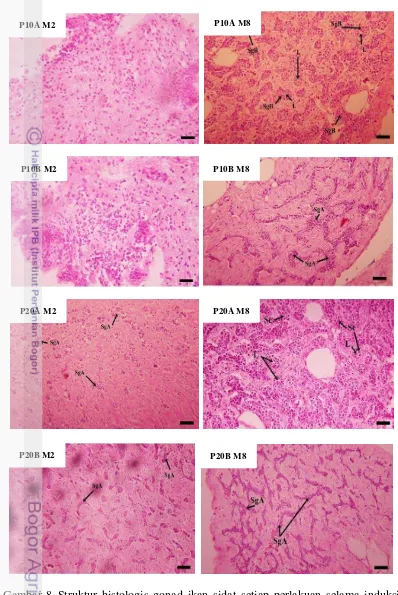
Gambar 8 Struktur histologis gonad ikan sidat setiap perlakuan selama induksi hormone pada minggu ke-0 (M0), minggu ke-2 (M2) dan minggu ke-6 (M6). Keterangan: AC, adiposit cell; SgA, spermatogonia type A; SgB, spermatogonia type B; L, lumen; Sc, spermatocyte. Pewarnaan Hematoksilin-Eosin ( 20µm).
P10A M2 P10A M8
P10B M2 P10B M8
P20A M2 P20A M8
Dari hasil pengamatan mikroskopis gonad minggu ke-6 pada P10A, P10B, P20A, P20B dan PK, terlihat perbedaan bentuk jaringan histologis pada masing-masing perlakuan.
Profil Hormon
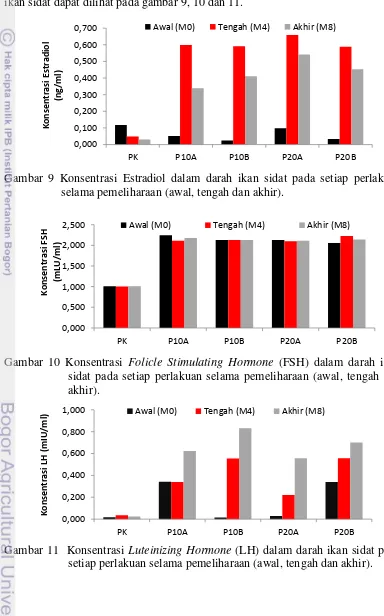
Hasil analisis konsentrasi hormon Estradiol, FSH dan LH dalam darah ikan sidat dapat dilihat pada gambar 9, 10 dan 11.
Gambar 9 Konsentrasi Estradiol dalam darah ikan sidat pada setiap perlakuan selama pemeliharaan (awal, tengah dan akhir).
Gambar 10 Konsentrasi Folicle Stimulating Hormone (FSH) dalam darah ikan sidat pada setiap perlakuan selama pemeliharaan (awal, tengah dan akhir).
Gambar 11 Konsentrasi Luteinizing Hormone (LH) dalam darah ikan sidat pada setiap perlakuan selama pemeliharaan (awal, tengah dan akhir).
0,000
18
Pada Gambar 10 dan 11, pola konsentrasi estradiol dan LH dalam plasma ikan sidat cenderung meningkat. Konsentrasi FSH dalama plasma darah ikan sidat cenderung stabil selama masa pemeliharaan. Namun nilainya di atas konsentrasi estradiol dan LH, yakni berkisar antara 2,1 sampai 2,3 ng/ml. Hal ini disebabkan hormon PMSG yang diinduksi ke tubuh ikan sudah mengandung FSH sehingga nilai konsentrasi FSH dalam darah ikan tinggi.
Status kelamin
Hasil pengamatan status kelamin dan ciri-ciri ikan sidat hasil induksi hormonal disajikan pada Tabel 6.
Spermatogonia Kekuningan Putih I
P10B Jantan Proses matang
Spermatogonia Kekuningan Putih I
P20A Jantan Proses
Spermatogonia Kekuningan Putih I
PK - Belum
matang
- Putih Putih
transparan 0
Tabel 6 menunjukkan status kelamin ikan sidat hasil induksi hormonal pada minggu ke-6 berdasarkan pengamatan status gonad, tahap perkembangan gonad, warna perut, gonad, dan didukung dengan pengamatan histologi gonad (gambar 8). Hasil pengamatan menunjukkan status kelamin dari ikan sidat dengan bobot tubuh 140 sampai 150 g adalah jantan. Hasil terbaik adalah perlakuan P20A dengan ciri-ciri status gonad dalam proses pematangan tahap akhir, warna perut kekuningan, warna gonad putih kekuningan. Ciri-ciri status kelamin ikan sidat hasil induksi hormonal dapat dilihat pada Gambar 6 dan 7.
Analisis Proksimat
Gambar 12 Analisis proksimat daging ikan sidat pada setiap perlakuan selama masa pemeliharaan
Pada gambar 12 terlihat bahwa kadar lemak pada daging awal lebih tinggi dibandingkan dengan kadar lemak daging ikan sidat yang telah diinduksi hormon. Hal ini diketahui bahwa hormon yang diinduksi ke tubuh ikan berpengaruh dalam penurunan kadar lemak.
Pembahasan
Ikan sidat termasuk kelompok teleostei yang gonokhoris indiferen (Yamamoto 1969 dalam Colombo dan Grandi 1995). Diferensiasi gonad terjadi melalui tahap yang ditandai dengan struktur semacam testis yang berisi oosit (Colombo dan Grandi 1995) dan dikenal dengan nama organ syrski. Kematangan gonad adalah tahapan tertentu perkembangan gonad sebelum dan sesudah memijah. Bobot gonad ikan akan mencapai maksimum sesaat ikan akan memijah kemudian akan menurun dengan cepat selama proses pemijahan berlangsung sampai selesai. Menurut Effendie (1997), umumnya pertambahan bobot gonad ikan betina pada saat stadium matang gonad dapat mencapai 10-25 persen dari bobot tubuh dan pada ikan jantan 5-10 persen. Menurut Putra (2012), penyuntikan PMSG dapat mempercepat kebuntingan dan pematangan gonad belut ukuran 5 sampai 12 g.
Parameter pada penelitian yang diuji meliputi, nilai IHS, IGS, konsentrasi estradiol-17β, LH dan FSH , histologi gonad, indeks mata, faktor kondisi, status kelamin dan analisis proksimat pada pakan dan daging ikan sidat. Pada beberapa parameter, hasil penelitian menunjukkan bahwa perlakuan 20 IU PMSG+10 ppm AD (P20A) merupakan perlakuan terbaik. Penyuntikan PMSG dapat mempercepat kebuntingan dan pematangan gonad pada ikan lele (Mayasari 2012), mempercepat pertumbuhan oosit baru dan meningkatkan frekuensi pemijahan pada ikan torsoro (Wahyuningsih 2012).
Berdasarkan penelitian dapat diketahui bobot spesifik ikan masing-masing perlakuan mengalami peningkatan hingga akhir pemeliharaan. Hal tersebut terlihat pada grafik peningkatan bobot spesifik ikan sidat menunjukkan hasil yang positif. Hal tersebut diduga adanya kelebihan energi dari pakan yang digunakan
20
untuk pertumbuhan. Kamil (2000) menjelaskan bahwa pertumbuhan ikan akan maksimal apabila kebutuhan nutrien dan kebutuhan energinya terpenuhi dengan baik. Peningkatan bobot spesifik ini juga diduga dipengaruhi oleh penambahan rGH pada kombinasi hormon P10B dan P20B. Hal ini terlihat pada Gambar 1 bahwa perlakuan yang ditambahkan hormon pertumbuhan mengalami peningkatan yang signifikan. Analisis statistik dengan uji Duncan juga menunjukkan perbedaan nyata. Peningkatan bobot juga dipengaruhi oleh proses perkembangan gonad yang berdampak pada konsumsi energi sehingga memerlukan energi yang lebih banyak untuk pembentukan gamet pada calon induk (Amin 1998).
Nilai IHS merupakan nilai kuantitatif yang dapat menggambarkan pertambahan bobot hati seiring dengan perkembangan gonad dan peningkatan IGS. Nilai IHS akan semakin meningkat seiring perkembangan gonad dan nilainya akan lebih rendah dari nilai IGS pada saat telah matang gonad. Dari hasil penelitian, ditemukan bahwa nilai IHS meningkat pada minggu ke 4. Hal ini disebabkan oleh pengaruh hormon yang disuntikkan memberikan pengaruh positif dari M0 sampai M4 yang dibuktikan adanya peningkatan IHS dari minggu ke minggu. Perlakuan hormon terbaik adalah P20A yakni pemberian 20 IU PMSG + 10 ppm AD dengan nilai rata-rata IHS tertinggi 1,188 ± 0,091 pada minggu ke-4. Indikasi fase vitelogenesis pada umumnya ditandai dengan naiknya nilai IHSikan. Tang dan Affandi (2000) menjelaskan bahwa, pengaruh induksi hormon estradiol-17β akan merangsang hati untuk mensintesis dan mensekresi vitelogenin. Ditambahkan oleh Siregar (1999), selama terjadi aktivitas produksi vitelogenin, akan menyebabkan penambahan bobot dan volume hati yang menyebabkan kenaikan IHS.
Nilai IGS merupakan nilai yang menggambarkan secara kuantitatif perubahan gonad pada saat terjadi perkembangan gonad dalam proses reproduksi dan akan mencapai nilai maksimum pada saat akan terjadinya pemijahan (Effendi 1997). Tabel menunjukkan bahwa nilai IGS yang dihasilkan berkisar antara 1,937 sampai 2,291 dengan kisaran bobot 150 sampai 200 gram. Penelitian serupa telah dilakukan Rovara (2007) yang medapatkan nilai IGS ikan sidat berkisar 1,07 sampai 3,375 dengan bobot rata-rata lebih dari 600 gram. Hal ini disebabkan oleh semakin lebar dan tebalnya gonad, maka nilai IGS nya akan semakin besar karena berat gonad akan bertambah. Pada proses reproduksi, sebelum terjadi pemijahan sebagian besar hasil metabolisme tertuju untuk perkembangan gonad. Gonad akan semakin bertambah bobotnya diimbangi dengan bertambah besar ukurannya (Effendie 2002).
Peningkatan IGS mengindikasikan terjadinya perkembangan sel sperma pada jantan. Aktivitas ini menyebabkan nilai IHS dan IGS ikan meningkat (Cerda
et al. 1996). Aktivitas metabolisme sebagian besar tertuju pada proses perkembangan gonad (Yulfiperius 2001). Wibisono (2012), menjelaskan bahwa penggunaan 15 IU PMSG + AD 0,05 mg/kg bobot tubuh belut sawah memberikan pengaruh positif pada nilai IGS sebesar 2,36 %, IHS berkisar 0,73 sampai 7,90 % dan memacu perkembangan gonad pada minggu ke-5.
Dari gambar 7b, dapat dilihat bahwa gonad ikan penelitian sebelah kiri lebih panjang daripada sebelah kanan. Hal ini sesuai pernyataan Tesch (1977) yaitu gonad kiri 2–3% lebih panjang. Matsui (1993) menambahkan selain lebih panjang, gonad sidat sebelah kiri lebih berat dan mengandung lebih banyak sel telur dibandingkan gonad kanan.
Histologi terhadap jaringan gonad telah mencapai tahap perkembangan fase spermatosit pada perlakuan P20A yakni induksi hormonal dengan menggunakan 20 IU PMSG + 10 ppm AD. Perkembangan testis pada minggu ke-2 P10A dan P10B masih pada fase pembentukan jaringan. P20A dan P20B masih pada fase spermatogonia tipe A yang ditandai dengan inti sel yang besar dalam kapsul berwarna merah yang terdiri dari jaringan otot halus dan pembuluh darah serta penyebarannya belum merata. Perkembangan testis pada minggu ke-6 P10A berada pada fase perkembangan spermatogonia tipe B yang ditandai dengan inti sel mulai mengecil namun masih banyak terdapat jaringan otot halus dan pembuluh darah, P10B berada pada fase perkembangan spermatogonia tipe A, sedangkan P20A termasuk pada fase perkembangan spermatosit yang ditandai dengan inti mengecil dengan sedikit sitoplasma dan sebagian masih terbungkus kapsul. P20B masih berada pada fase perkembangan spermatogonia tipe A. Pada perlakuan kontrol (PK), baik pada M2 maupun M6, tidak terlihat adanya perkembangan gonad.
Dilihat dari beberapa parameter seperti IHS, IGS dan struktur anatomi gonad serta hasil analisis histologi dapat disimpulkan bahwa status kelamin ikan penelitian yang diinduksi hormon yakni P10A, P10B, P20A dan P20B berjenis kelamin jantan (Tabel 5). Ciri-ciri ikan sidat hasil induksi hormon setiap perlakuan selama pemeliharaan dilihat dari hasil analisis histologi adalah P10A P10B dan P20B masih dalam proses matang, tahap perkembangan gonadnya adalah spermatogonia dengan warna gonad putih, hasil analisis menunjukkan bahwa ikan perlakuan berjenis kelamin jantan dengan TKG I. Pada P20A, status gonad adalah proses matang tahap akhir yang disebut dengan tahap perkembangan spermatosit dengan warna gonad putih kekuningan. Hasil analisis menunjukkan bahwa ikan perlakuan adalah jantan dengan TKG II, sedangkan pada kontrol (PK), belum terlihat adanya perkembangan dan warna gonad transparan sehingga jenis kelamin ikan pada perlakuan ini belum diketahui.
22
Pada saat ikan sidat menyiapkan diri untuk memijah dan bermigrasi dari perairan tawar menuju laut dalam yang jaraknya sekitar 3000-5000 km, terjadi perubahan pada tubuh antara lain diameter mata membesar, diikuti dengan perubahan komposisi sel pada retina, perubahan warna tubuh menjadi silver, sisik membesar, dermis menebal, densitas sel mukus meningkat terutama pada betina, bentuk kepala lebih pipih, adanya peningkatan panjang dan diameter kapiler pada gelembung renang, usus mengalami peningkatan bobot namun jumlah lipatannya menurun, serat otot tonnus meningkat, penumpukan glikogen dalam hati dan lain-lain. Mekanisme perubahan tubuh tersebut banyak melibatkan hormon-hormon dalam tubuh, karena perubahan lingkungan akan mempengaruhi hipotalamus, yang seterusnya mempengaruhi hipofisis dan organ-organ target di bawahnya. Membesarnya mata ketika akan memijah dapat mencapai empat kali lipat dari ukuran sebelumnya (Pankhurst 1982).
Pada penelitian ini, indeks mata yang diperoleh antara 0,6 sampai 1,4 (Gambar 3). Menurut Beullens (1997), indeks ukuran mata untuk yellow eel atau
immature adalah 7,2. Di atas nilai 7,2 maka ikan sidat sudah masuk ke tahap
silver eel (matang gonad). Karena dalam penelitian ini indeks ukuran mata yang diperoleh adalah 0,6 sampai 1,4 maka ikan penelitian ukuran 150 gram masih termasuk ke dalam fase yellow eel tahap awal perkembangan.
Hasil pengukuran konsentrasi hormon estradiol-17β pada plasma darah ikan uji selama penelitian memperlihatkan kenaikan konsentrasi hormon estradiol-17β terutama ikan uji yang disuntik dengan formulasi dosis yang mengandung PMSG. Konsentrasi hormon estradiol mengalami peningkatan pada minggu ke-4, kemudian kembali turun pada minggu ke-8. Konsentrasi tertinggi hormon estradiol-17β dicapai ikan uji pada formulasi dosis P20A yaitu sebesar (0,659
Ng/ml) dan berturut-turut menurun pada formulasi dosis P10A (0,599 Ng/ml), P10B (0,591 Ng/ml), P20B (0,588 Ng/ml), dan terendah pada kontrol.
FSH diketahui merupakan hormon gonadotropin sebagai pemicu diproduksinya hormon estradiol-17β. Alur mekanismenya sebagaimana dijelaskan oleh Nagahama (1983) bahwa, FSH yang terbawa oleh darah dan masuk ke dalam gonad selanjutnya akan menginduksi lapisan teka untuk memproduksi testosteron, dan secara parakrin testosterone akan masuk ke sel granulosa yang selanjutnya di konversi oleh enzym aromatase menjadi estradiol-17β. Hal ini sejalan dengan pernyataan Wahyuningsih (2012), kisaran konsentrasi hormon estradiol-17β ikan torsoro yang diberikan perlakuan hormon PMSG pada saat maturasi hingga siap memijah pada diameter telur maksimal sebesar 1.5 sampai 2.0 mm adalah berkisar 0.5 sampai 0.2 pg/ml.
Kombinasi hormon PMSG dan antidopamin mampu memberikan hasil yang optimal pada pematangan gonad ikan. Mekanisme PMSG sebagai FSH eksogeneous yang berasal dari luar merangsang gonad untuk pematangan awal melalui perangsangan pada sel teka dan antidopamin sebagai neurotransmitter berfungsi untuk menghambat kerja dopamin dan hormon lain yang ada pada hipotalamus, kemudian Gonadotropin Releasing Hormone (GnRH) merangsang hipofisa untuk menghasilkan gonadotropin yaitu FSH endogeneus yang memiliki fungsi yang sama yaitu pematangan awal atau vitelogenesis.
banyak aspek fisiologi seperti pertumbuhan, metabolisme, osmoregulasi, fungsi kekebalan tubuh, reproduksi, dan merangsang hati untuk menghasilkan insulin-like growth factor-1/ IGF-I (Moriyama et al. 1993, 2000; Li et al. 2003; Promdonkoy et al. 2004; Reinecke et al. 2005; Wong et al. 2006; Acosta. et al.
2007, 2009; Debnanth 2010). Penggunaan rGH juga merupakan prosedur yang relatif aman, karena yang dimodifikasi adalah bakteri yang memproduksi rGH saja, sehingga ikan yang diberikan rGH tidak dikategorikan sebagai organisme
genetically modified organism/GMO (Acosta et al. 2007). Hal tersebut karena rGH tidak ditransmisikan ke keturunan ikan selanjutnya.
Selama perlakuan hormon, terlihat bahwa nafsu makan ikan sidat menurun dibandingkan dengan sebelum diinduksi hormon. Hal ini diduga adanya pengaruh pemberian hormon perangsang pematangan gonad PMSG dan AD. Situasi ini menunjukkan adanya persamaan ikan perlakuan dengan kondisi alamiah ikan sidat di alam. Aida et al. (2003) menyatakan bahwa ikan sidat mulai mengadakan migrasi ketika berumur antara 9-12 tahun dan memijah dilaut dalam. Perjalanan dilakukan pada malam hari dan selama perjalanan sampai ke tempat pemijahan, ikan sidat tidak pernah makan sehingga terjadi perubahan pada tubuh antara lain menjadi kurus, mata semakin membesar sampai empat kali dari ukuran sebelumnya, hidung semakin lancip, warna kulit berubah menjadi warna perak dan bagian perut kelihatan membesar karena menyusutnya tubuh.
Dari hasil penelitian (Gambar 12) diketahui bahwa adanya peningkatan jumlah protein dan penurunan kadar lemak pada daging ikan sidat yang dianalisis. Hormon pertumbuhan berperan dalam meningkatkan transpor asam amino melalui membran atau mempercepat proses kimia sintesis protein sehingga protein jaringan bertambah. Dalam hal ini hormon pertumbuhan juga bekerja pada metabolisme lemak yang bertugas meingkatkan kecepatan pengeluaran lemak dari depot lemak, sehingga memungkinkan lemak tersedia sebagai energi. Hal ini selanjutnya akan mengurangi kecepatan oksidasi asam amino dan akibatnya meningkatkan jumlah asam amino jaringan yang disintesis menjadi protein.
Faktor penting yang mempengaruhi pertumbuhan dan reproduksi ikan selain pakan adalah kualitas air terutama suhu. Karena suhu dapat mempengaruhi pertumbuhan dan nafsu makan ikan. Suhu dapat mempengaruhi aktivitas penting ikan seperti pernapasan, pertumbuhan dan reproduksi. Suhu yang tinggi dapat mengurangi oksigen terlarut dan mempengaruhi selera makan ikan. Kisaran hasil kualitas air selama penelitian menunjukkan bahwa suhu, oksigen terlarut, salinitas, pH, nitrit dan TAN, masih berada pada kisaran optimum kualitas air ikan sidat yang berarti bahwa media pemeliharaan ikan sidat layak digunakan untuk proses perkembangan gonad (Tabel 6).
24
dengan menggunakan ikan sidat yang siap untuk dimatangkan yakni ikan sidat fase silver eel yang ditangkap langsung dari alam.
Hingga saat ini pasokan benih ikan sidat di Indonesia masih bergantung pada penangkapan di alam. Penyediaan benih yang tertangkap dari alam memiliki keterbatasan antara lain musim, kondisi lokal seperti banjir dan pasang surut. Hal tersebut sulit untuk memenuhi ketersediaan benih bila dilakukan usaha budidaya. Demikian pula, eksploitasi benih secara berlebihan secara bertahap dapat mengakibatkan berkurangnya populasi ikan sidat di masa mendatang. Apalagi bila mengingat bahwa semakin hari kualitas sungai semakin menurun yang dapat mengakibatkan jumlah benih ikan sidat yang masuk perairan tawar juga akan semakin menurun pula. Agar kelangsungan hidup ikan sidat di Indonesia tetap terjaga dari kepunahan, perlu dikembangkan usaha budidaya ikan sidat.
Kesulitan dalam budidaya ikan sidat adalah ketidakmampuan ikan tersebut untuk matang gonad hingga mengalami spermiasi dan ovulasi di bawah kondisi lingkungan budidaya. Dari beberapa penelitian yang telah dilakukan, perlakuan dengan hormon dianggap efektif dalam menginduksi tahapan perkembangan seksual ikan sidat. Dalam penelitian ini, ikan sidat sudah terlihat adanya perkembangan gonad, namun demikian tahap yang dicapai masih perkembangan tahap awal yakni TKG 1 dan 2, sehingga disarankan untuk melakukan penelitian lebih lanjut dengan waktu penelitian yang lebih lama, interval waktu sampling yang lebih baik serta dosis yang lebih tepat.
4 SIMPULAN DAN SARAN
Simpulan
Ikan sidat (149±4,32 g/ekor) yang diinduksi dengan 20 IU PMSG + 10 ppm AD (P20A) mengalami perkembangan gonad lebih cepat yakni pada minggu ke-6. Ikan sidat yang diinduksi dengan hormon 10 IU PMSG + 10 ppm AD (P10A), 10 IU PMSG + 10 ppm AD + 10 µg Rgh (P10B) dan 20 IU PMSG + 10 ppm AD + 10 µg Rgh (P20B) diketahui berjenis kelamin jantan dengan TKG I. Pada perlakuan 20 IU PMSG + 10 ppm AD (P20A) diketahui berjenis kelamin jantan dengan TKG II. Penambahan rGH pada premix 10 IU PMSG + 10 ppm AD + 10µg rGH (P10B) dan 20 IU PMSG + 10 ppm AD + 10 µg rGH (P20B) lebih menginduksi pertumbuhan somatik disbanding pertumbuhan gonadal. Proses pematangan gonad pada ikan sidat mengindikasikan adanya keterlibatan dari hormon FSH dan LH.
Saran
Induksi maturasi ikan sidat sebaiknya menggunakan ikan fase silver eel
yang ditangkap langsung dari alam. Sebaiknya penyuntikan dan sampling dilakukan dua minggu sekali untuk menghindari terjadinya stres pada ikan. Disarankan untuk melakukan penelitian lebih lanjut tentang peran FSH, LH dalam perkembangan gonad. Perlu adanya informasi mengenai kandungan energi yang digunakan ikan sidat selama proses perkembangan gonad dan jumlah dosis yang tepat dalam merangsang pematangan gonad serta penambahan waktu dalam menstimulasi perkembangan gonadnya.
DAFTAR PUSTAKA
Acosta JR, Morales R, Morales M, Alonso M, Estrada MP. 2007. Pichia pastoris
Expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnology Letter, 29:1671-1676.
Acosta JR, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herrera F. 2009. Tilapia somatotropin polypeptides : potent enhancers of fish growth and innate immunity. Biotechnologia Aplicada, 26:267-272.
Aida K, Katsumi T, Kohei Y. 2003. Eel Biology. Tokyo: Springer. 497p.
Affandi R. 2005. Strategi pemanfaatan sumberdaya ikan sidat (Anguilla spp.) di Indonesia. Jurnal lktiologi Indonesia, 5:77-81.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faizal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal, 5:11-16.
Amin M. 1998. Observation of Reproduction Techniques Applicable to the European Eel Anguilla anguilla. Alexandria (EG): National Institute of Oceanographyand Fisheries. (Zaragoza : Ciheam n . 34). 223-234p. Basuki F. 1990. Pengaruh Kombinasi Hormon PMSG dan HCG terhadap Ovulasi
Clarias gariepinus (Burcell). [Thesis]. Bogor. Sekolah Pascasarjana. Institut Pertanian Bogor.
Bieniarz K, Epler P. 1977. Investigation on inducing sexual maturity in tha male eel Anguilla anguilla L. J. Fish Biol. 10:555-559.
Beullens K, Eding EH, Gilson P, Oliver F, Komen J, Richter CJJ. 1997. Sex differentiation, change in length, weight and eye size before and after metamorphosis of European eel (Anguilla anguilla L) maintained in
Chen C, Fernald D. 2008. Review Paper.GnRH and GnRH receptors: distribution, function and evolution. Journal of Fish Biology. 73, 1099–1120. Colombo G, Grandi G. 1995. Sex differentiation in the European eel : histological
analysis of the effect of sex steroids on the gonad. J Fish Biol 47:394-413.
Debnanth S. 2010. A review on the physiology of insulin like growth factor-I (IGF-I) peptide in bony fishes and its phylogenetic correlation in 30 different taxa of 14 families of teleosts. Advances in Environmental Biology, 5:31-52.
Degani G, Horowitz A, Levanon D. 1985. Effect of protein level in purified diet and density ammonia and O2 on growth of juvenil european eels
Anguilla anguilla L. Aquaculture (46):193-200.
26
Febriana C, 2010. Rekayasa Maturasi Ikan Patin Siam (Pangasianodon hypopthalmus) dengan Kombinasi Penyuntikan Hormon PMSG dan HCG serta Penambahan Vitamin Mix 100 mg/kg pakan. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. [Skripsi].
Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG. 2005. Expression and purification of a biologically active recombinant rabbitfish (Siganus guttatus) growth hormone. Aquaculture, 250:504-515.
Gunarso W. 1989. Mikroteknik. PAU, Ilmu Hayat. Institut Pertanian Bogor, Bogor. Handoyo B. 2012. Response of Eel Fingerling on Recombinant Giant Grouper
Growth Hormone by immersion and oral administration. Pascasarjana IPB, Bogor. [Tesis].
Hasbullah 1996. Pengaruh tingkat salinitas (0, 3, 6 dan 9 %) dan suhu (23, 26, 29 dan 32 ˚C) terhadap kelangsungan hidup dan pertumbuhan benih ikan sidat (Anguilla bicolor McClelland) pada masa pemeliharaan 0-2 minggu setelah penangkapan dari alam. Institut Pertanian Bogor. 57 hal. [Skripsi].
Herianti I. 2005. Rekayasa lingkungan untuk memacu perkembangan gonad ikan sidat (Anguilla bicolor). Oseanologi dan Limnologi di Indonesia. 37:2-41.
Ijiri S, Kabaya T, Takeda N, Tachiki H, Adachi S, Yamauchi K. 1998. Pretreatment Reproductive Stage and Oocyte Development Induced by Salmon Pituitary Hormogenate in The Japanese Eel Anguilla Japonica. Fisheries Science. 64:531-537.
Kagawa H, Hideki T, Hiromi O, Koichi O, Keiji H. 1995. In vitro effects of 17α -hydroxyprogesterone and 17α,20β-dihydroxy-4-pregnen-3-one on final maturation of oocytes at various development stages in artificially matured Japanese eel Anguilla japonica. Fisheries science
61 (6) : 1012 – 1013.
Kagawa H, Tanaka H, Ohta H, Unuma T, Nomura K. 2006. The first success of glass eel production in the world: basic biology on fish reproduction advances new applied technology in aquaculture. Fish Phisyiol Biochem. 31:193-199.
Kamil MT. 2000. Pengaruh kadar asam Lemak n-6 yang berbeda pada kadar asam Lemak n-3 tetap pada pakan terhadap pertumbuhan ikan sidat Angilla bicolor. Pascasarjana IPB, Bogor. 55 hal. [Tesis].
Lesmana I. 2010. Produksi dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan Dari Tiga Jenis Ikan Budidaya. Pascasarjana IPB, Bogor. [Tesis].
Lie Y, Bai J, Jian Q, Ye X, Lao H, Li X, Luo J, Liang X. 2003. Expression of common carp growth hormone in the yeast Pichia pastoris and growth stimulation of juvenile tilapia (Oreochromis niloticus). Aquaculture,
216: 329-341.
Marcel H. 1975. Text book of fish culture. Breeding and cultivation of fish. Fishing News (Books) Ltd. England: 201 – 333.
Mayasari N. 2012. Pemacuan Kematangan Gonad Ikan Lele Dumbo (Clarias sp.) Betina dengan Kombinasi Hormon PMSG dan Spirulina. Pascasarjana IPB, Bogor. [Tesis].
Miura C, Shimizu Y, Uehara M, Ozaki Y, Young G, Miura T. 2011. GH is produced by the testis of Japanese eel and stimulates proliferation of spermatogonia. Society for Reproduction and Fertility. Reproduvtion
142: 869-877.
Moriyama S, Hiroshi Y, Seiji S, Toshio A, Tetsuya H, Hiroshi K. 1993. Oral administration of recombinant salmon growth hormone to rainbow trout, Oncorhynchus mykiss. Aquaculture, 112: 99-106.
Moriyama S, Felix GA, Hiroshi K. 2000. Growth regulation by insuline-like growth factor-1 in fish. Bioscience Biotechnology Biochemistry, 64:1553-1562.
Nagahama Y. 1983. The Functional Morphology of Teleost Gonads. P. 223-275. In W. S. Hoar, D.J. Randall dan E.M. Donaldson (Eds) Fish physiology.Volume IX B. Academic Press, Inc.
Ohta H, Kagawa H, Tanaka H, Okuzawa K, Linuma N, Hirose K. 1997. Artificial induction of maturation and fertilization in the Japanese eel, Anguilla japonica. Fish fisiol and Biochem 17:163 – 169.
Pankhurst NW. 1982. Relation of visual changes to the onset of sexual maturation in the european eel, Anguilla anguilla (L). Journal of Fish Biology
(21): 127 - 140.
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish (Pangasianodon gigas) in
Escherichia coli. Biotechnology Letter, 26:649-653.
Putra W. 2012. Induksi Maturasi Belut Sawah (Monopterus albus) secara Hormonal. [Thesis]. Pascasarjana IPB, Bogor. [Tesis].
Reinecke M, Björn T, Walton WD, Stephen DMC, Isabel N, Deborah MP, Joaquim G. 2005. Growth hormone and insulin-like growth factors in fish: where we are and where to go (Minireview). General and Comparative Endocrinology, 142:20–24.
Rovara O. 2007. Karakteristik reproduksi, upaya maskulinisasi dan pematangan gonad ikan sidat betina (Anguilla bicolor bicolor) melalui penyuntikan ekstrak hipofisis. Pascasarjana IPB, Bogor. 123 hal. [Disertasi].
Sekine S, Mizukami T, Nishi T, Kuwana Y, Saito A, Sato M, Itoh S, Kawauchi H. 1985. Cloning and expression of cDNA for salmon growth hormone in Escherichia coli. Proc. Natl. Acad. Sci. USA, 82:4306-4310.
Setiawan IE, Amarullah H, Mochioka N. 2003. Kehidupan awal dan waktu berpijah sidat tropik Anguilla sp. Prosiding Sumberdaya Perikanan Sidat tropik, UPT Baruna Jaya, BPPT. Hal 11-17.
Siregar M. 1999. Stimulasi pematangan gonad bakal induk betina ikan jambal siam Pangasius hypopthalmus F dengan hormon hCG. Pascasarjana IPB, Bogor. 41 hal. [Tesis].
Swanson P. 2008. Endocrine Regulation of Reproduction. http: // www . north west fishery sciense center . noaa . gov / research / divisions / reutd / phys_endo / endocrine . cfm [21 September 2013].
28
Tesch FW. 1977. The eel; Biology and Management of Anguillid Eels. Chapman and Hall.
Wahyuningsih H. 2012. Induksi Buatan pada Perkembangan Gonad Ikan Tor soro. Pascasarjana IPB, Bogor. [Thesis].
Yulfiperius. 2001. Pengaruh Kadar Vitamin E dalam Pakan Terhadap Kualitas Telur Ikan Patin (Pangasius hypopthalmus). Pascasarjana IPB, Bogor. [Tesis].
Wibison RW. 2012. Artificial Maturation Pada Ikan Belut Sawah Monopterus Albus Melalui Penggunaan Kombinasi Hormon Pregnant Mare Serum Gonadotropin Dosis 5,10 dan 15 IU dengan Antidopamin 5 ppm. Institut Pertanian Bogor. [Skripsi].
30
Lampiran 1. Dokumentasi Persiapan wadah
Keterangan:
a. Bak yang akan digunakan setelah dicuci bersih dan dikeringkan b. Pemasangan happa
c. Sambungan pipa d. Pembuatan bak filter e. Pemasangan pipa filter
f. Penyusunan isi filter (karang jahe, zeolit, pasir, kapas) g. Pemasangan saringan pada ujung pipa filter
h. Bentuk pipa dalam filter
Lampiran 2. Prosedur penyuntikan
Keterangan:
a. Pembiusan
b. Peralatan penyuntikan (Timbangan, syringe, kain lap, nampan, penggaris dan hormon)
c. Pengambilan hormon d. Penentuan dosis
e. Penimbangan bobot tubuh
f. Pengukuran panjang total tubuh ikan g. Pencatatan data
h. Penyuntikan