INDUKSI PEMATANGAN GONAD IKAN SIDAT (Anguilla
bicolor bicolor) UKURAN 200 g SECARA HORMONAL
MENGGUNAKAN PREGNANT MARE SERUM
GONADOTROPIN, ANTIDOPAMIN DAN ESTRADIOL-
17β
APRELIA MARTINA TOMASOA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Induksi Pematangan Gonad Ikan Sidat (Anguilla bicolor bicolor) Ukuran 200 g secara Hormonal Menggunakan Pregnant Mare Serum Gonadotropin, Antidopamin dan Estradiol-17β” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
RINGKASAN
APRELIA MARTINA TOMASOA. Induksi Pematangan Gonad Ikan Sidat (Anguilla bicolor bicolor) Ukuran 200 g secara Hormonal menggunakan Pregnant Mare Serum Gnadotropin, Antidopamin dan Estradiol-17β. Dibimbing oleh AGUS OMAN SUDRAJAT dan MUHAMMAD ZAIRIN JUNIOR.
Ikan sidat merupakan salah satu sumberdaya perikanan yang memiliki potensi untuk dikembangkan dan permintaan yang tinggi. Pemenuhan permintaan tersebut memerlukan ketersediaan benih dalam jumlah besar, induk matang gonad dan berkelanjutan. Dari segi ketersediaan benih dan induk matang gonad terdapat kendala yaitu benih ikan sidat di dunia masih berasal dari penangkapan alam dan perkembangan gonad ikan sidat yang lambat. Oleh sebab itu, perlu dilakukan induksi pada perkembangan gonad ikan sidat. Bahan yang digunakan dalam induksi perkembangan gonad ikan adalah menggunakan hormon. Dalam penelitian ini menggunakan hormon Pregnan Mare Serum Gonadotropin (PMSG), Antidopamin (AD) dan Estradiol-17β (E2).
Penelitian ini bertujuan untuk mengevaluasi pemberian PMSG, AD dan E2 terhadap induksi pematangan gonad ikan sidat secara hormonal, menentukan status kelamin dan tingkat kematangan gonad serta menentukan kombinasi hormon yang efektif untuk menginduksi pematangan gonad. Rancangan penelitian yang diterapkan adalah Rancangan Acak Lengkap terdapat lima kombinasi perlakuan dengan tiga ulangan secara individu. Perlakuan yang diberikan meliputi NaCl 0,95% (PK), 10 IU PMSG + 0,01 mg AD (P10A), 20 IU PMSG + 0,01 mg AD (P20A), 10 IU PMSG + 0,01 mg AD + 150 µg E2 (P10AE) dan 20 IU PMSG + 0,01 mg AD + 150 µg E2 (P20AE). Dosis yang digunakan adalah satu mL kg-1 ikan sidat. Ikan sidat yang digunakan dengan bobot tubuh 200±15 g dan panjang 43±5 cm sebanyak 24 ekor/perlakuan. Induksi dilakukan dengan teknik penyuntikan secara intramuscular pada otot di bawah sirip punggung satu kali seminggu selama delapan minggu.
Hasil penelitian menunjukkan bahwa ikan sidat yang diinduksi dengan perlakuan kombinasi hormon mengalami percepatan perkembangan gonad. Ikan sidat yang dinduksi dengan kombinasi hormon P10A, P20A, P10BE dan P20BE menghasilkan ikan sidat jantan. Gambaran histologi menunjukkan perlakuan P10BE efektif merangsang spermatogenesis sampai tahap spermatid dan meningkatkan nilai GSI, TKG III dan kadar lemak yang menunjukkan peran aktif pada proses pematangan gonad sidat. Perkembangan pematangan gonad ikan sidat ditandai dengan peningkatan hormon T, E2, FSH dan LH secara bersamaan yang dimulai dari minggu ke-4. Setelah minggu ke-4, kadar E2 dan FSH secara perlahan menurun sementara kadar T dan LH terus meningkat sampai minggu ke-8 yaitu 1,2 ng/mL dan 2,8 mIU/mL. Kadar hormon T meningkat secara paralel dengan LH. Perlakuan 10 IU PMSG + 0,01 mg AD + 150 µg E2 efektif menginduksi sidat 200 g menjadi jantan matang gonad dalam waktu delapan minggu. Hormon FSH dan LH terindikasi secara bersamaan terlibat dalam proses pematangan gonad ikan sidat.
SUMMARY
APRELIA MARTINA TOMASOA. Gonadal maturation of eel (Anguilla bicolor bicolor) size of 200 g by hormonal treatment using Pregnant Mare Serum Gonadotropin, Antidopamin and Estradiol-17β. Supervised by AGUS OMAN SUDRAJAT and MUHAMMAD ZAIRIN JUNIOR.
Eel is one of aquatic resources which is potential to develop and has high demand. Fulfilling the demand requires sustainability of larvae stock and mature broodstock. One of problems in eel culture is the limited stock of larvae because it mainly depends on nature catch and the slow process of broodstock maturation. Hormonal induction is one of solutions to enhance eel gonadal development. In present study hormonal induction was performed by using Pregnan Mare Serum Gonadotropin (PMSG), Antidopamine (AD) dan Estradiol-17β (E2).
This research was aimed to evaluate and to find out the most effective hormone combination of PMSG, AD and E2 on gonadal maturation and sex determination of eel. The experiment was carried out in complete random design with 5 treatments in triplicates. The treatments applied were NaCl 0.95% (PK), 10 IU PMSG + 0.01 mg AD (P10A), 20 IU PMSG + 0.01 mg AD (P20A), 10 IU PMSG + 0.01 mg AD + 150 µg E2 (P10AE) and 20 IU PMSG + 0.01 mg AD + 150 µg E2 (P20AE). Prior to treatment, eel was at initial weight of 200±15 g and at length of 43±5 cm, and at density of 24 ind/treatment. Hormone was given at dose of 1 mL/kg intramuscularly, once a week during 8 weeks of rearing period.
The results showed that the eels were induced by treatment with a combination of hormones experiencing gonadal development. Eel that induce with a combination of hormones P10A, P20A, P10AE and P20AE produce male eel. Histology showed P10AE effective treatment to stimulate spermatogenesis spermatid stage and increase GSI, gonadomaturation index III and fat content which showed active role on gonadal maturation process of eel. The development of gonadal maturation eels characterized by increased hormone T, E2, FSH and LH simultaneously starting from the 4th week. After week 4, E2 and FSH levels gradually decreased while levels of T and LH continues to increase until week 8, which is 1.2 ng/mL and 2.8 mIU/mL. T hormone levels increased in parallel with LH. 10 IU PMSG + 0.01 mg AD + 150 µg E2 effectively treatment induced eel at the weight of 200 g to become mature male fish within 8 weeks. FSH and LH were involved on gonadal maturation of eel.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
INDUKSI PEMATANGAN GONAD IKAN SIDAT (Anguilla
bicolor bicolor) UKURAN 200 g SECARA HORMONAL
MENGGUNAKAN PREGNANT MARE SERUM
GONADOTROPIN, ANTIDOPAMIN DAN ESTRADIOL-
17β
APRELIA MARTINA TOMASOA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa, karena atas berkat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan tesis dengan judul “Induksi Pematangan Gonad Ikan Sidat Ukuran 200 g secara Hormonal menggunakan Pregnant Mare Serum Gonadotropin, Antidopamin dan Estradiol-17β”. Penelitian ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains di Program Studi Ilmu Akuakultur Sekolah Pascasarjana, Institut Pertanian Bogor. Publikasi ilmiah sebagian tesis telah dilakukan pada Jurnal Akuakultur Indonesia Vol. 14 No. 2 Juli 2015
dengan judul “Induksi Pematangan Gonad Ikan Sidat menggunakan PMSG, Antidopamin dan Estradiol-17β”.
Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Agus Oman Sudrajat, MSc dan Prof. Dr. Ir. Muhammad Zairin Junior, MSc sebagai komisi pembimbing yang telah meluangkan waktu dan sabar mengajarkan banyak hal kepada penulis. Penulisan tesis ini tak lepas dari bantuan berbagai pihak. Penulis mengucapkan terima kasih kepada :
1. Dr. Ir. Eddy Supriyono, MSc sebagai penguji luar komisi dan Dr. Ir. Kukuh Nirmala, MSc sebagai ketua Program Studi Ilmu Akuakultur yang telah memberi banyak masukkan dalam melengkapi penulisan tesis; 2. Papa, Mama dan ke-2 adik (Nivea dan Valentino) atas doa, semangat dan
motivasi yang selalu diberikan selama ini;
3. Keluarga besar Tomasoa dan Rumalean di Ambon atas doa dan semangat yang diberikan kepada penulis;
4. Dosen, Staff Pegawai dan Teknisi Laboratorium Program Studi Ilmu Akuakultur yang telah membantu penulis selama menempuh pendidikan di IPB;
5. Rekan-rekan pascasarjana Ilmu Akuakultur (angkatan 2011 dan 2012) atas semangat dan dukungan; teman-teman seperjuangan Hadra, Ega, Vina, Rodhi, Hafif, Aulia dan Aziz atas bantuan, semangat dan kerjasama yang terjalin erat;
6. Frets Jonas Rieuwpassa atas doa, perhatian, semangat, motivasi dan kebersamaan;
7. Kakak Ucha Thenu, Kakak Leny Tapotubun, Kakak Lady Tetelepta, Kakak Meis Manery, Kakak Ona Latupeirissa, Usi Senly Wattimena atas doa, semangat dan kebersamaan selama di Bogor.
Semoga karya ilmiah ini dapat membantu dan berguna dalam perkembangan ilmu pengetahuan dan sebagai masukan untuk penelitian selanjutnya. Akhir kata, semoga Tuhan Yang Maha Esa memberkati segala usaha dan perjuangan kita.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
I PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Kerangka Pikir 3
Tujuan 4
Manfaat 4
II METODE 5
Waktu dan Tempat Penelitian 5
Bahan dan Alat 5
Rancangan Penelitian 5
Prosedur Penelitian 5
Parameter Uji 6
Analisis Data 10
III HASIL DAN PEMBAHASAN 11
Hasil 14
Pembahasan 20
IV SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 30
DAFTAR TABEL
1. Kombinasi perlakuan dan dosis hormon 5
2. Perkembangan ovari 9
3. Perkembangan testis 9
4. Hasil pengukuran kualitas air 10
5. Perkembangan gonad dan TKG ikan sidat 18
6. Status kelamin ikan sidat 19
7. Analisis proksimat pakan dan daging ikan 19
DAFTAR GAMBAR
1. Kerangka pikir penelitian induksi pematangan gonad ikan sidat
menggunakan PMSG, antidopamin dan estradiol-17β 4
2. Kadar testosteron plasma darah sidat 11
3. Kadar estradiol-17β plasma sidat 11
4. Kadar FSH plasma darah sidat 12
5. Kadar LH plasma darah sidat 13
6. Nilai GSI sidat 13
7. Nilai HSI sidat 14
8. Bobot tubuh ikan sidat 15
9. Panjang tubuh ikan sidat 15
10.Morfologi gonad ikan sidat 16
11.Histologi gonad ikan sidat 17
DAFTAR LAMPIRAN
1. Metode pengukuran kadar testosteron plasma darah ikan sidat 30 2. Metode pengukuran kadar estradiol-17β plasma darah ikan sidat 30 3. Metode histologi gonad pada ikan sidat 31
1
1 PENDAHULUAN
Latar Belakang
Sumberdaya perikanan dan kelautan Indonesia memiliki potensi yang sangat besar untuk dikembangkan. Salah satunya adalah ikan sidat (Anguilla sp.) atau yang lebih dikenal dengan eel. Di dunia ada 19 jenis ikan sidat (Inoue et al. 2010). Dari 19 jenis, tujuh diantaranya ada di perairan Indonesia dan diduga nenek moyang ikan sidat di dunia berasal dari Indonesia yaitu Anguilla borneensis yang mendiami di sepanjang sungai di Poso. Tujuh jenis yang terdapat di perairan Indonesia diantaranya A. borneensis, A. celebesensis, A. bicolor bicolor, A. bicolor pacifica, A. marmorata, A. nebulosus nebulosus dan A. interioris (Fahmi et al. 2013).
Ikan sidat memiliki potensi yang sangat besar sebagai komoditas ekonomi tinggi dalam negeri maupun luar negeri. Ikan ini memiliki rasa yang unik dan tinggi akan kandungan protein, lemak, vitamin A, B1, B2, C, D, E serta adanya kandungan mineral dalam daging (Rovara 2007) dan tulang. Beberapa tahun ini permintaan ekspor ikan sidat terus meningkat sehingga harga jualnya tinggi. Kebutuhan sidat di pasar dunia mencapai 300.000 ton/tahun dari total tersebut, pasar Jepang membutuhkan 60.000–120.000 ton/tahun (Kagawa et al. 2006).
Di Indonesia tingkat konsumsi ikan sidat masih rendah bahkan belum secara umum dikonsumsi, sedangkan di negara-negara maju ikan sidat menjadi makanan yang sangat primadona. Persaingan pasar internasional diantaranya; Jepang, Hongkong, Belanda, Jerman, Italia dan beberapa negara lainnya sangat besar dengan demikian ikan ini sebagai komoditas ekspor yang tinggi (Affandi 2005). Harga sidat di Eropa mencapai € 440–950/kg, sedangkan di Amerika harga tertinggi US$ 250/kg (Crook 2010). Harga jual ikan sidat hidup pasar domestik di Indonesia khususnya untuk Anguilla bicolor bicolor berkisar antara Rp 150.000– 180.000,-/kg. Harga jual benih sidat (glass eel) di pasar lokal berkisar antara Rp 300.000–600.000,-/kg. Pengolahan sidat (fillet) di pasar lokal seharga Rp 300.000,-/kg dan diekspor seharga Rp 500.000,-/kg. Hal ini menunjukkan bahwa Indonesia berpeluang menjadi negara pemasok sidat ke pasar internasional, baik untuk ukuran konsumsi, benih maupun olahan.
Salah satu masalah yang ditemui sampai saat ini adalah pasokan benih ikan sidat di dunia masih mengandalkan penangkapan dari alam (Tanaka 2006). Penyediaan benih memiliki keterbatasan yang disebabkan oleh musim, peredaran bulan dan kondisi lokal lainnya seperti kualitas air sungai. Menurut Rovara (2007), kualitas air sungai yang semakin menurun menyebabkan jumlah benih ikan sidat yang masuk ke perairan tawar semakin sedikit. Selain itu, penangkapan liar di alam dilakukan secara besar-besaran olah nelayan dan masyarakat tanpa memperhatikan keseimbangan populasi yang ada. Upaya yang dilakukan untuk menghindari kelangkaan benih dan kepunahan ikan sidat yaitu perlu diterapkan upaya memproduksi benih yang berkelanjutan secara tepat.
sehingga perlakuan hormon diperlukan untuk menginduksi perkembangan gonad pada tahap selanjutnya.
Penelitian yang dilakukan sebagai upaya untuk menginduksi kematangan gonad pada ikan-ikan lain telah banyak dilakukan. Penelitian untuk induksi kematangan gonad ikan sidat antara lain Boetius dan Boetius (1980) menggunakan hCG dan hormon gonad mamalia menghasilkan GSI maksimum sebesar 12,6% pada A. Anguilla. Ohta et al. (1996) menggunakan hCG pada A. japonica dengan perlakuan pengulangan injeksi hCG dosis 250 IU/ikan (1 IU/g) selama 10 minggu efektif digunakan untuk menghasilkan milt sebanyak 9,4 g. Setahun kemudian induksi ovulasi A. japonica dengan penyuntikan 17α, 20β -dihydroxy-4-pregnen-3-one (DPH) dengan kombinasi Carp Pituitary Extract memperoleh telur dengan tingkat fertilitas (10,3%), penetasan tinggi (50,6%) (Ohta et al. 1997). Penelitian yang dilakukan pada A. bicolor bicolor dengan menggunakan ekstrak hipofisis ikan mas efektif meningkatkan nilai GSI 3,37%, HSI 2,27% dan diameter folikel yang lebih besar (Rovara 2007). Gallego et al. (2012) melakukan perlakuan suhu yang efektif meningkatkan kualitas sperma pada A. anguilla.
Perumusan Masalah
Ikan sidat termasuk dalam famili Anguillidae yang bersidat katadromous, yaitu ikan sidat melakukan ruaya untuk melalukan pemijahan ke laut dalam dan akan bertumbuh dewasa di perairan tawar (Ijiri et al. 2011) dan merupakan ikan yang bersifat nokturnal, yaitu aktif pada malam hari. Wedemeyer (1996) menjelaskan perubahan kelamin yang mula-mula berjenis kelamin jantan kemudian berubah menjadi betina disebut hermaprodit protandi, maka ikan sidat termasuk dalam kategori tersebut. Perubahan jenis kelamin dapat dipengaruhi oleh kinerja hormon (aktifitas estrogen). Secara genetik, hormon mengatur hermaproditisme pada ikan tetapi kinerja hormon yang mempengaruhi pembentukan gonad biasanya dipengaruhi oleh berbagai faktor dari luar seperti kadar hormon dan kondisi lingkungan (Kalujnaia et al. 2007).
Perkembangan gonad ikan sidat terjadi setelah melalukan ruaya pemijahan, seiring dengan meningkatnya hormon steroid, terutama estradiol (E2) dan testosteron (T). Saat berenang menuju daerah pemijahan sidat memerlukan energi yang diperoleh terutama dari lemak yang disimpan dalam bentuk glikogen di bawah lapisan kulit dan hati (Durif et al. 2010). Hormon reproduksi yang meningkat akibat aktifitas renang sidat dalam hal ini E2, tetapi proses vitellogenesis tidak terinisiasi dengan rendahnya plasma vitellogenin berlawanan dengan spermatogenesis (Palstra et al. 2010).
3
Pemanfaatan Pregnant Mare Serum Gonadotropin (PMSG) mengandung hormon FSH (Follicle Stimulating Hormone) dan LH (Luteinizing Hormone) kedua hormon ini merupakan kontrol steroidogenesis dan gametogenesis (Kazeto et al. 2008) yang berperan dalam proses pematangan gonad pada vetebrata termasuk ikan. FSH menginisiasi gametogenesis dan vitellogenesis, sementara LH mengatur pematangan gonad akhir, spermiasi dan ovulasi (Aroura et al. 2012).
Dopamin dapat menghambat pematangan gonad dengan menstimulasi sekresi hormon penghambat perkembangan gonad (Fingerman 1997). Menurut Chen dan Fernald (2008), antidopamin adalah bahan kimia yang dapat menghentikan kinerja dopamin. Dopamin merupakan neurotransmitter yang berperan dalam menghambat pematangan gonad. Aktifitas dopamin yang dihambat akan menstimulasi sintesis dan pelepasan LH yang diinisiasi oleh GnRH (Rousseau et al. 2009). Oleh karena itu, dopamin perlu diblokir dengan zat antidopamin, agar otak melepaskan GnRH untuk merangsang produksi FSH dan LH di kelenjar pituitari. Produksi FSH dan LH secara terpisah akan dikirim ke gonad melalui plasma darah sebagai jalur transportasinya.
Kerangka Pikir
Perkembangan gonad ikan sidat relatif sangat lambat bahkan untuk mendapatkan induk ikan sidat yang matang gonad masih sulit. Umur ikan sidat mencapai matang gonad membutuhkan waktu bertahun-tahun yaitu 3 hingga 5 tahun. Dalam proses budidaya, percepatan perkembangan dan pematangan gonad ikan sidat sangat dibutuhkan untuk mempercepat waktu pemeliharaan induk sehingga dapat mengurangi biaya produksi. Salah satu hormon yang digunakan untuk memacu perkembangan dan pematangan gonad yaitu PMSG. Pada penelitian ini, PMGS dikombinasi dengan AD dan Estradiol-17β untuk menginduksi gonad ikan sidat secara hormonal.
PMSG mengandung bahan aktif FSH (20%) dan LH (80%) dengan konsentrasi yang berbeda. Kinerja FSH menginisiasi gametogenesis dan vitelogenesis, sementara LH mengatur pematangan akhir, spermiasi dan ovulasi. FSH dan LH bekerja silih berganti. Saat sekresi FSH ditekan, maka LH akan meningkat. Kadar FSH dan LH dalam plasma darah ikan sidat dapat ditentukan sebagai indikator fase pertumbuhan gonad ikan sidat. Faktor yang menentukan pendewasaan kelamin pada ikan sidat yaitu dopamin. Dopamin juga memberi kontribusi bagi gonad untuk menghambat fungsi estradiol, sehingga terjadi defeminisasi dan mengakibatkan maskulinisasi. Dopamin perlu dihambat dengan zat anti dopamin, agar merangsang produksi FSH dan LH di kelenjar hipofisis.
Gambar 1. Kerangka pikir penelitian induksi pematangan gonad ikan sidat menggunakan PMSG, antidopamin dan estradiol-17β
Tujuan Tujuan pada penelitian ini, adalah :
1. Menginduksi pematangan gonad ikan sidat ukuran 200g secara hormonal
2. Menentukan status kelamin dan tingkat kematangan gonad ikan sidat 3. Menentukan kombinasi hormon yang efektif untuk menginduksi
pematangan gonad ikan sidat.
Manfaat
5
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juni sampai Agustus 2014 di Laboratorium Fisiologi Hewan Air, Fakultas Perikanan dan Ilmu Kelautan, IPB. Pembuatan preparat histologi gonad dilakukan di Laboratorium Anatomi, Fakultas Kedokteran Hewan, IPB. Pengamatan histologi gonad dilakukan di Laboratorium Reproduksi dan Genetika Ikan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Analisis kosentrasi hormon estradiol-17β dan gonadotropin dalam darah ikan sidat di Laboratorium Hormon Unit Reproduksi dan Rehabilitasi, Fakultas Kedokteran Hewan, IPB. Analisis kosentrasi hormon testosteron dalam darah ikan sidat di Laboratorium Nutrisi, Balai Budidaya Ikan Hias, Depok dan analisis proksimat di Laboratorium Biologi Hewan, Pusat Antar Universitas, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah ikan sidat (Anguilla bicolor bicolor) dengan berat 200±15 g dan panjang 43±5 cm sebanyak 120 ekor yang didapat dari CV. Mitra Bina Usaha, Gadog, Bogor. Hormon yang digunakan untuk pematangan gonad ikan sidat adalah kombinasi PMSG, AD dan E2. Bahan-bahan lainnya berupa air laut, larutan fisiologis (NaCl 0,95%) dan larutan BNF (Neutral Buffer Formalin). Alat yang digunakan adalah bak keramik lima unit, hapa lima unit, syringe 1 ml, mikrotube, timbangan digital, botol film, sentrifuge dan penggaris.
Rancangan Penelitian
Penelitian ini menggunakan metode eksperimental. Rancangan penelitian yang diterapkan adalah rancangan acak lengkap (RAL) dimana terdapat lima kombinasi perlakuan dengan tiga ulangan secara individu. Informasi dosis dan perlakuan dapat dilihat pada Tabel 1.
Tabel 1. Kombinasi perlakuan dan dosis hormon
Perlakuan AD (mg) PMSG (IU) E2 (µg) Kode Perlakuan 1 Larutan Fisiologi (NaCl 0,95%) PK (Kontrol)
2 0,01 10 - P10A
3 0,01 20 - P20A
4 0,01 10 150 P10AE
5 0,01 20 150 P20AE
Keterangan: AD (Antidopamin), PMSG (Pregnant mare serum gonadotropin) dan E2
(Estradiol-17β).
Prosedur Penelitian Persiapan Wadah dan Ikan Uji
Ikan sidat yang telah diangkut dari pembudidaya menggunakan kantong plastik yang diisi sedikit air dan oksigen. Setelah sampai di tempat penelitian, kantong plastik tersebut dan ikan dimasukkan secara perlahan ke dalam bak penampungan yang berisi air tawar setinggi 50 cm untuk proses aklimatisasi awal. Selama proses ini berlangsung ikan dipuasakan selama tiga hari kemudian pakan diberikan secara at satiation. Proses aklimatisasi awal dalam bak penampungan dilakukan selama satu bulan dan ikan diberi pakan berupa pellet. Selanjutnya dilakukan sampling awal untuk pemilihan ikan uji sebanyak 120 ekor dengan kualifikasi bobot 200g. Ikan yang telah disampling, dibagi sebanyak 24 ekor/perlakuan.
Aklimatisasi selanjutnya dilakukan dengan menggunakan air laut dalam bak perlakuan yang telah berisi ikan sidat. Air laut dialirkan secara bertahap, awalnya bak diisi air tawar dengan perbandingan 50 : 0 (50 cm air tawar : 0 cm air laut). Setelah itu air laut dialirkan dengan perbandingan 40 : 10 (40 cm air tawar : 10 cm air laut), 30 : 20 (30 cm air tawar : 20 air laut), 20 : 30 (20 cm air tawar : 30 cm air laut), 10 : 40 (10 cm air tawar : 40 cm air laut) dan 0 : 50 (0 cm air tawar : 50 cm air laut). Untuk setiap perubahan tinggi air laut dilakukan setiap tiga hari sekali. Dalam proses aklimatisasi air laut, dilakukan pengukuran kualitas air khususnya parameter salinitas dan ikan dipuasakan selama proses ini berlangsung. Pada bagian atas hapa ditutup menggunakan plastik berwarna hitam dan dijepit setiap sudut hapa agar ikan tidak melompat ke luar bak dan cahaya di dalam bak agak gelap.
Pembiusan dan Penyuntikan Hormon
Sebelum diinduksi, ikan dibius terlebih dulu menggunakan stabilizer arowana dengan dosis 1 ml/0,5 L air selama tiga menit, sementara ikan pingsan dilakukan pengukuran panjang dan bobot tubuh, serta ikan disuntik secara intramuscular dengan hormon yang ditentukan sesuai perlakuan dan dosisnya. Ikan disuntik sebanyak satu kali dalam seminggu. Perlakuan penyuntikan ini dilakukan selama delapan minggu. Ikan yang telah disuntik dimasukkan ke dalam wadah dengan aerasi yang kuat selama 10 menit, setelah ikan sadar dimasukkan kembali ke dalam hapa.
Pemeliharaan Ikan Uji
Pemberian pakan diberikan sebanyak 3% dari bobot tubuh ikan sidat. Pakan yang digunakan adalah KPA 5 dengan kadar protein 45%. Pemberian pakan dilakukan pada masa adaptasi dan selama penelitian berlangsung. Pengukuran kualitas air dilakukan juga selama penelitian. Kualitas air yang diukur antara lain DO, suhu, pH dan salinitas.
Pengambilan Sampel Darah Ikan Sidat
7
supernatan plasma tidak dilakukan secara langsung, sampel bisa disimpan dalam freezer pada suhu -4 °C.
Pengambilan Sampel Gonad dan Hati Ikan Sidat
Ikan yang telah diambil darah selanjutnya akan dibedah untuk diambil gonad dan hati sebanyak tiga ekor/perlakuan. Ikan dibedah pada bagian anus hingga kepala, kemudian diambil bagian gonad dan hati secara perlahan. Sampel ditimbang berat dan diukur panjangnya, setelah itu dimasukkan ke dalam botol film yang diberi larutan BNF sampai seluruh bagian sampel terendam dan selanjutnya dibuat preparat histologi.
Parameter Uji
Parameter uji dalam penelitian ini meliputi kadar testosteron, kadar estradiol-17β, kadar gonadotropin (FSH dan LH) plasma darah sidat, Gonadosomatic Index, Hepatosomatic Index, morfologi gonad, histologi gonad, bobot dan panjang tubuh sidat, tingkat kematangan gonad, status kelamin dan komposisi pakan dan daging ikan sidat. Ikan sebanyak tiga ekor pada setiap perlakuan digunakan sebagai sampel analisis nilai GSI, HSI, bobot dan panjang tubuh dan komposisi daging ikan.
Kadar Testosteron plasma Darah Sidat
Pengukuran kadar testosteron plasma darah dilakukan pada awal penelitian minggu ke-0, minggu ke-4 dan ke-8. Pengukuran kadar hormon testosteron dilakukan dengan menggunakan metode Enzyme-linked Imunosorbent Assay (ELISA) dengan Vidas ELISA kit untuk testosteron (DGR EIA 1559). Sebelum melakukan uji kadar T semua reagen harus mencapai suhu kamar. Metode pengukuran kadar T dapat dilihat pada Lampiran 1.
Kadar Estradiol-17β plasma Darah Sidat
Pengukuran kadar E2 plasma darah dilakukan pada awal penelitian minggu ke-0, minggu ke-4 dan ke-8. Pengukuran kadar hormon E2 dilakukan dengan menggunakan metode ELISA dengan Vidas ELISA kit untuk estradiol-17β (DGR EIA 2693). Dalam menguji kadar E2 semua reagen harus mencapai suhu kamar sebelum digunakan. Selanjutnya, mempersiapkan terlebih dahulu larutan standar dengan kosentrasi 25, 50, 100, 250, 500, 1000 dan 2000 pg/ml dan larutan QC (quality control). Metode pengukuran kadar E2 dapat dilihat pada Lampiran 2.
Kadar Gonadotropin plasma Darah Sidat
Pengukuran kadar gonadotropin dalam plasma darah dilakukan pada awal penelitian minggu ke-0, minggu ke-4 dan ke-8. Pengukuran kadar hormon gonadotropin ikan sidat plasma darah terdiri atas dua hormon, yaitu FSH dan LH dilakukan dengan menggunakan metode ELISA dengan Vidas ELISA kit untuk Follicle Stimulation Hormone (DGR EIA 1288) dan untuk Luteinizing Hormone (DGR EIA 1289).
Gonadosomatic Index (GSI)
nilai persentasi yang dihitung berdasarkan perbandingan antara berat gonad dengan berat tubuh ikan (Ohta et al. 1996),dengan rumus ;
GSI =
x 100%
Keterangan : GSI = Gonadosomatic Index(%) Bg = Berat gonad (g)
Bt = Berat tubuh (g)
Hepatosomatic Index (HSI)
Pengukuran nilai HSI dilakukan pada awal penelitian minggu ke-0, ke-2, ke-4, ke-6 dan ke-8. Ikan sidat sebelum dibedah harus dilakukan penimbangan bobot tubuh terlebih dahulu, kemudian diambil hatinya dan ditimbang menggunakan timbangan digital (tingkat ketelitian 0,01g). Nilai HSI merupakan nilai persentasi yang dihitung berdasarkan perbandingan antara berat hati dengan berat tubuh ikan (Ohta et al. 1996), dengan rumus ;
HSI =
100%
Keterangan : HSI = Hepatosomatic Index (%) Bh = Berat hati (g)
Bt = Berat tubuh (g)
Bobot dan Panjang Tubuh Sidat
Ikan sidat dibius terlebih dahulu sebelum dilakukan penimbangan bobot dan pengukuran panjang tubuh. Pengukuran bobot tubuh dilakukan setiap minggu selama penelitian dengan menggunakan timbangan digital dengan tingkat ketelitian 0,01g. Panjang tubuh diukur dengan menggunakan penggaris. Pengukuran panjang dan bobot tubuh ikan sidat dilakukan sebelum penyuntikkan. Data pertambahan panjang dan bobot tubuh pada akhir penelitian dihitung dengan pengurangan data pada minggu ke-8 dengan minggu ke-0.
Morfologi Gonad
Morfologi gonad diamati untuk melihat perbedaan antara morfologi gonad ikan sidat yang diberi perlakuan dan tanpa diberi perlakuan yang diamati secara deskriptif. Pengamatan morfologi gonad dilakukan pada awal penelitian minggu ke-0 sampai akhir penelitian minggu ke-8. Pengamatan ini biasanya dengan mengukur berat dan panjang, bentuk dan warna gonad.
Histologi Gonad
9
Tingkat Kematangan Gonad (TKG)
Pengamatan tingkat kematangan gonad dilakukan pada awal penelitian minggu ke-0, ke-2, ke-4, ke-6 dan ke-8. Pengamatan ini berdasarkan hasil histologi gonad. Takashima dan Hibiya (1995) menyatakan fase perkembangan oosit ikan secara umum pada Tabel 2.
Tabel 2. Perkembangan ovari
Fase Keterangan
Fase kromatin nukleolus Nukleus terlihat kompak dengan satu nukleolus yang relatif besar, ukuran folikel relatif kecil dan sitoplasma terpulas zat warna dengan kuat mencirikan ovarium masih belum berkembang
Fase perinukleoler Terdapat nukleus dan beberapa nukleoli pada tepi nukleoplasma
Fase kortikal-alveoli Terdapat butir-butir lipid di sekitar vesikula germinalis. Ukuran oosit relatif lebih besar Fase vitelogenik Terdapat sitoplasma yang didominasi oleh
butiran-butiran lemak Maturasi
Ovulasi
Testis ikan sidat terdiri atas sepasang lobular yang berisi lobular-lobular. Tiap lobular dipisahkan oleh lapisan tipis yang disebut connective tissue. Pada umumnya, tahap perkembangan testikular ditentukan berdasarkan proporsi spermatosit (primer dan sekunder), spermatid dan spermatozoa. Blazer (2002), menjelaskan fase testikular ikan secara pada Tabel 3.
Tabel 3. Perkembangan testis
Fase Keterangan
Pre-spermatogenik (regresi testis) Lobular hanya berisi spermatogonia
Awal spermatogenik Spermatosit dan spermatid mendominasi
Mid-spermatogenik Proporsi yang sama anatara spermatosit, spermatid, dan spermatozoa
Akhir spermatogenik Adanya semua tingkatan, namun spermatozoa dominan
Pasca pemijahan
Status Kelamin
Komposisi Pakan dan Daging Ikan Sidat
Komposisi pakan dan daging ikan sidat diuji menggunakan pengujian proksimat untuk mengetahui kandungan energi yang dapat dimanfaatkan oleh ikan dalam tubuh. Analisis komposisi daging dilakukan pada awal penelitian minggu ke-0 sampai akhir penelitian minggu ke-8. Sampel yang dianalisis berupa pakan dan daging ikan sidat sebelum diberi perlakuan dan setelah perlakuan. Analisis proksimat dilakukan berdasarkan prosedur analisis kadar protein, lemak, karbohidrat, abu dan air (Takeuchi 1988) dapat dilihat pada Lampiran 4.
Pengukuran Kualitas Air
Pengukuran kualitas air yang dilakukan antara lain oksigen terlarut (DO), suhu, pH, salinitas, amoniak dan nitrit yang dilakukan setiap minggu penelitian. Pengukuran kandungan oksigen terlarut (DO) menggunakan alat DO meter (mg/L), suhu air menggunakan termometer (°C), nilai pH menggunakan pH meter dan salinitas menggunakan refraktometer. Hasil pengukuran kualitas air pemeliharaan ikan sidat dapat dilihat pada Tabel 4.
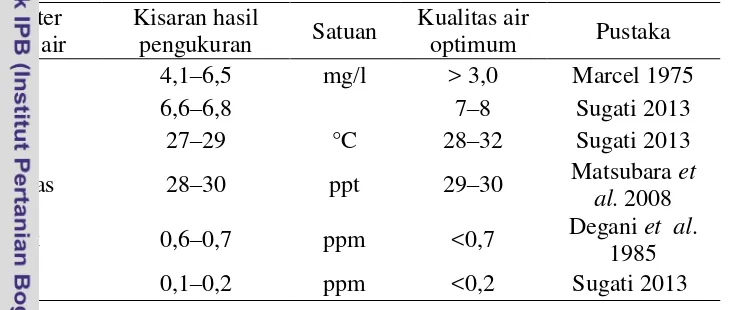
Tabel 4. Hasil pengukuran kualitas air
Parameter kualitas air
Kisaran hasil
pengukuran Satuan
Kualitas air
optimum Pustaka DO 4,1–6,5 mg/l > 3,0 Marcel 1975
pH 6,6–6,8 7–8 Sugati 2013
Suhu 27–29 °C 28–32 Sugati 2013
Salinitas 28–30 ppt 29–30 Matsubara et al. 2008
Nitrit 0,6–0,7 ppm <0,7 Degani et al. 1985 TAN 0,1–0,2 ppm <0,2 Sugati 2013
Analisis data
Data parameter uji penelitian nilai GSI, HSI, bobot dan panjang tubuh dan komposisi daging ikan sidat dianalisis secara ANOVA. Apabila hasil menunjukkan berbeda nyata maka akan dilanjutkan dengan Uji Duncan.
Pengolahan dan pengujian data menggunakan Microsoft Excel 2010 dan SPSS 16.
11
3 HASIL DAN PEMBAHASAN
Hasil
Kadar Testosteron plasma darah
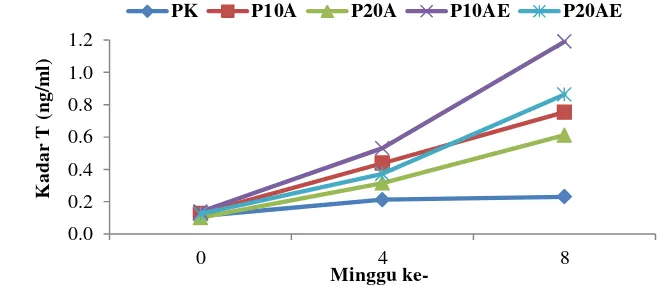
Kadar hormon testosteronplasma darah ikan sidat hasil induksi hormonal selama penelitian disajikan pada Gambar 2.
Hasil penelitian menunjukkan bahwa kadar testosteron mengalami peningkatan yang sangat nyata pada setiap minggu penelitian. Kadar tertinggi pada minggu ke-8 perlakuan P10AE (1,2 ng/ml) dan secara berturut-turut
Hasil penelitian menunjukkan bahwa kadar E2 selama penelitian mengalami peningkatan pada minggu ke-4 dan menurun pada minggu ke-8 untuk semua perlakuan kecuali perlakuan kontrol. Kadar E2 tertinggi terdapat pada perlakuan P10AE (0,43 ng/ml) dibandingkan dengan perlakuan P20AE (0,19 ng/ml), P20A (0,07 ng/ml), P10A (0,06 ng/ml) dan PK (0,02 ng/ml).
Kadar Follicle Stimulating Hormone plasmadarah
Kadar FSH plasma darah ikan sidat hasil induksi hormonal selama penelitian disajikan pada Gambar 4.
Gambar 4. Kadar FSH plasma darah sidat. PK (NaCl 0,95%), P10A (10 IU PMSG + 0,01 mg AD), P20A (20 IU PMSG + 0,01 mg AD), P10AE (10 IU PMSG + 0,01 mg AD + 150 µg E2) dan P20AE (20 IU PMSG + 0,01 mg AD + 150 µg E2). PMSG (Pregnant Mare Serum Gonadotropin), AD (Antidopamin) dan E2 (Estradiol-17β).
Hasil penelitian menunjukkan bahwa kadar FSH meningkat pada minggu ke-4 dan menurun pada minggu ke-8 untuk semua perlakuan kecuali perlakuan kontrol selama delapan minggu penelitian. Kadar FSH tertinggi pada perlakuan P10AE (2,68 mIU/ml) pada minggu ke-4 dibandingkan dengan perlakuan P10A (2,28 mIU/ml), P20A (2,19 mIU/ml), P20AE (2,51 mIU/ml) dan PK (0,63 mIU/ml).
Kadar Luteinizing Hormone plasmadarah
13
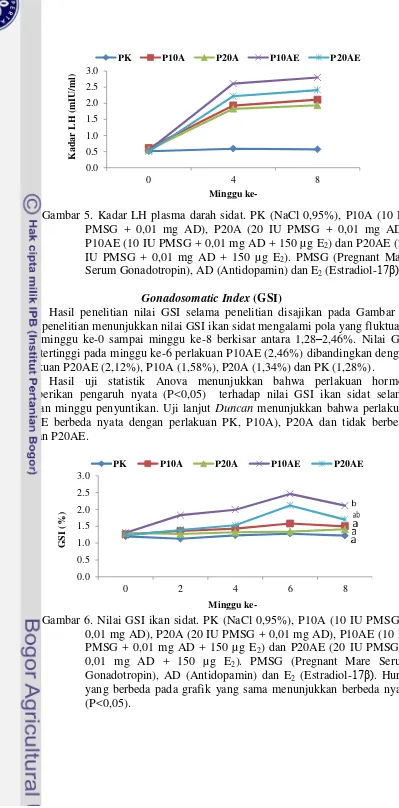
Gambar 5. Kadar LH plasma darah sidat. PK (NaCl 0,95%), P10A (10 IU PMSG + 0,01 mg AD), P20A (20 IU PMSG + 0,01 mg AD), P10AE (10 IU PMSG + 0,01 mg AD + 150 µg E2) dan P20AE (20 IU PMSG + 0,01 mg AD + 150 µg E2). PMSG (Pregnant Mare Serum Gonadotropin), AD (Antidopamin) dan E2 (Estradiol-17β).
Gonadosomatic Index (GSI)
Hasil penelitian nilai GSI selama penelitian disajikan pada Gambar 6. Hasil penelitian menunjukkan nilai GSI ikan sidat mengalami pola yang fluktuatif pada minggu ke-0 sampai minggu ke-8 berkisar antara 1,28–2,46%. Nilai GSI yang tertinggi pada minggu ke-6 perlakuan P10AE (2,46%) dibandingkan dengan perlakuan P20AE (2,12%), P10A (1,58%), P20A (1,34%) dan PK (1,28%).
Hepatosomatic Index (HSI)
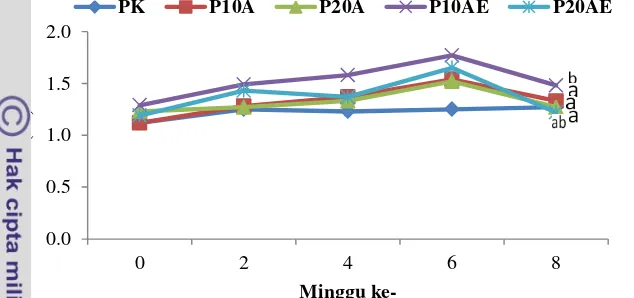
Hasil penelitian nilai HSI disajikan pada Gambar 7. Hasil penelitian menunjukkan nilai HSI ikan sidat mengalami penurunan pada minggu ke-8 berkisar antara 1,12–1,77%. Nilai GSI yang tertinggi pada minggu ke-6 perlakuan P10AE (1,77%) dibandingkan dengan perlakuan P20AE (1,65%), P10A (1,54%), P20A (1,52%) dan PK (1,25%).
Hasil uji statistik Anova menunjukkan bahwa perlakuan hormon memberikan pengaruh nyata (P<0,05) terhadap nilai HSI ikan sidat selama delapan minggu penyuntikan. Uji lanjut Duncan menunjukkan bahwa perlakuan P10AE berbeda nyata dengan perlakuan PK, P10A, P20A dan tidak berbeda dengan P20AE.
Bobot dan panjang tubuh sidat
Hasil penelitian bobot tubuh ikan sidat selama penelitian disajikan pada Gambar 8. Pada Gambar 8 hasil penelitian menunjukkan semua perlakuan hormon memberi pengaruh positif kecuali perlakuan PK terhadap pertambahan bobot tubuh sidat. Hal ini diduga ikan pada PK mengalami stress (kondisi fisiologi) sehingga mengganggu nafsu makan. Pertambahan bobot tubuh sidat yang tinggi terlihat pada perlakuan kombinasi dengan E2. Bobot tubuh tertinggi terdapat pada perlakuan P10AE (218,5 g) secara berturut-turut perlakuan P20AE (214,4 g), P10A (209,4 g), P20A (206,3 g) dan PK (199,3 g) pada minggu ke-8.
15
Gambar 8. Bobot tubuh ikan sidat. PK (NaCl 0,95%), P10A (10 IU PMSG + 0,01 mg AD), P20A (20 IU PMSG + 0,01 mg AD), P10AE (10 IU PMSG + 0,01 mg AD + 150 µg E2) dan P20AE (20 IU PMSG + 0,01 mg AD + 150 µg E2). PMSG (Pregnant Mare Serum Gonadotropin), AD (Antidopamin) dan E2 (Estradiol-17β). Huruf yang berbeda pada grafik yang sama menunjukkan berbeda nyata (P<0,05).
Gambar 9 menunjukkan hasil penelitian panjang tubuh ikan sidat membentuk pola yang beragam. Hasil uji statistik menunjukkan bahwa perlakuan hormon tidak memberikan pengaruh nyata (P>0,05) terhadap panjang ikan sidat selama delapan minggu penyuntikan. Namun secara deskriptif panjang tubuh perlakuan P10AE lebih tinggi dibandingkan dengan kontrol.
Morfologi Gonad
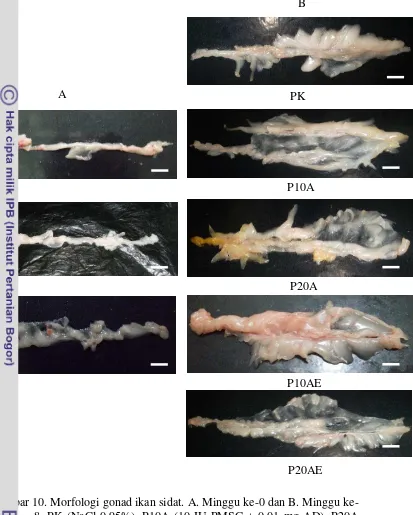
Hasil gambaran morfologi gonad ikan sidat berdasarkan kondisi gonad selama penelitian pada minggu ke-0 dan minggu ke-8 dapat sajikan Gambar 10.
Gambar 10. Morfologi gonad ikan sidat. A. Minggu 0 dan B. Minggu ke-8. PK (NaCl 0,95%), P10A (10 IU PMSG + 0,01 mg AD), P20A (20 IU PMSG + 0,01 mg AD), P10AE (10 IU PMSG + 0,01 mg AD + 150 µg E2) dan P20AE (20 IU PMSG + 0,01 mg AD + 150 µg E2). PMSG (Pregnant Mare Serum Gonadotropin), AD (Antidopamin) dan E2 (Estradiol-17β). Skala bar = 20 µm.
P10A
P20A PK
P20AE P10AE A
17
Gambaran morfologi gonad ikan sidat pada minggu ke-0 secara umum sudah mulai tampak, masih berupa benang tipis transparan yang diselimuti oleh lapisan lemak. Gonad ikan sidat minggu ke-8 menunjukkan gonad yang sudah terlihat jelas pada sisi kiri dan kanan yang biasanya melekat pada dinding ventral bagian atas. Gonad terlihat berwarna putih susu pekat, semakin tebal dan lebih mengglambir. Hal ini menunjukkan bahwa ada pengaruh kombinasi hormon yang diberikan sehingga adanya pertumbuhan dan perkembangan gonad ikan sidat sebelum dan sesudah penelitian.
Histologi Gonad
Histologi gonad ikan sidat selama penelitian pada minggu ke-0 dan minggu ke-8 dapat sajikan Gambar 11.
A. B.
Gambar 11. Histologi gonad ikan sidat: A. Minggu 0 dan B. Minggu ke-8. PK (NaCl 0,95%), P10A (10 IU PMSG + 0,01 mg AD), P20A (20 IU PMSG + 0,01 mg AD), P10AE (10 IU PMSG + 0,01 mg AD + 150 µg E2) dan P20AE (20 IU PMSG + 0,01 mg AD + 150 µg E2). PMSG (Pregnant Mare Serum Gonadotropin), AD (Antidopamin) dan E2 (Estradiol-17β). Pewarnaan Hematoksilin-Eosin. Skala bar = 20 µm. Pembesaran 100x.
Tingkat Kematangan Gonad
Hasil penelitian TKG ikan sidat dilakukan dengan pengamatan gambar histologi gonad berdasarkan fase perkembangan gonad. Hasil penelitian menunjukkan perkembangan gonad yang terjadi mengarah pada perkembangan gonad jantan (testis). Perkembangan gonad dan TKG ikan sidat pada penelitian ini disajikan pada Tabel 5.
Tabel 5. Perkembangan gonad dan TKG ikan sidat
Perlakuan Fase Ciri-ciri Status TKG
PK SgA Ukuran inti sel besar, diselimuti kapsul seminiferus, jumlah inti dalam 1 kapsul masih sedikit,
P20A SgB Ukuran inti sel mulai mengecil, masih di dalam kapsul, jumlah
(Spermatogonia tipe B), St (Spermatosit) dan Sd (Spermatid).
Status Kelamin
19
AD (Antidopamin) dan E2 (Estradiol-17β).♂ (Jantan).
Komposisi Pakan dan Daging Sidat
Hasil analisis proksimat pakan dan daging ikan sidat pada minggu ke-0 dan minggu ke-8 sajikan pada Tabel 7.
Tabel 7. Analisis Proksimat Pakan dan Daging Ikan
Perlakuan
Karbohidrat Kadar Air Kadar Abu
Pakan 44,97 9,44 3,28 12,50 10,48
AD (Antidopamin) dan E2 (Estradiol-17β). Huruf yang berbeda pada baris yang sama
menunjukkan berbeda nyata (P<0,05).
Hasil uji statistik Anova menunjukkan bahwa perlakuan hormon memberikan pengaruh nyata (P<0,05) terhadap kadar protein ikan sidat selama delapan minggu penyuntikan. Uji lanjut Duncan menunjukkan bahwa daging ikan sidat sebelum penyuntikkan berbeda nyata dengan perlakuan semua perlakuan. Perlakuan P10AE tidak berbeda nyata dengan P20AE. Perlakuan PK tidak berbeda nyata dengan P10A dan P20A. Hasil uji statistik Anova menunjukkan bahwa perlakuan hormon memberikan pengaruh nyata (P<0,05) terhadap kadar lemak ikan sidat selama delapan minggu penyuntikan. Uji lanjut Duncan menunjukkan bahwa P20A berbeda nyata dengan semua perlakuan.
delapan minggu penyuntikan. Uji lanjut Duncan menunjukkan bahwa perlakuan M0 tidak berbeda nyata dengan perlakuan PK dan P20AE. Perlakuan P20AE tidak berbeda nyata dengan perlakuan P10AE dan PK sedangkan perlakuan P20A berbeda nyata dengan semua perlakuan. Hasil uji statistik Anova menunjukkan bahwa perlakuan hormon memberikan pengaruh nyata (P<0,05) terhadap kadar abu ikan sidat selama delapan minggu penyuntikan. Uji lanjut Duncan menunjukkan bahwa perlakuan PK berbeda nyata dengan semua perlakuan. Hasil uji statistik Anova menunjukkan bahwa perlakuan hormon tidak memberikan pengaruh nyata (P>0,05) terhadap kadar karbohidrat ikan sidat selama delapan minggu penyuntikan.
Pembahasan
Kadar hormon Testosteron (T) plasma darah ikan sidat hasil induksi hormonal selama penelitian menunjukkan kadar yang semakin meningkat hingga akhir masa penelitian (Gambar 1). Peningkatan kadar T menunjukkan gonad ikan sidat mengarah pada perkembangan dan pematangan gonad jantan (testis). Kadar T hingga minggu ke-8 tidak menurun menandakan tidak ada konversi menjadi E2. Menurut Nakamura (2013), testosteron merupakan hormon utama yang berperan dalam sistem reproduksi jantan, umumnya hormon ini berfungsi untuk merangsang pertumbuhan spermatogonium, perkembangan spermatosit dan diferensiasi spermatosit menjadi sperma. Testosteron berperan utama dalam proses spermatogenesis. Secara alamiah T akan diubah menjadi E2. E2 juga berperan selama proses spermatogenesis pada A. japonica, yaitu dengan merangsang aktifitas sel Sertoli menyalurkan energi selama proses spermatogenesis (Miura et al. 2003) dan melindungi sel germinal (Higuchi et al. 2012). Hal ini dibuktikan dengan hasil penelitian yang menunjukkan bahwa semakin tinggi kadar T plasma darah maka status sel testis semakin matang dan diduga pematangan gonad sidat masih terus berkembang. Dalam penelitian ini dosis E2 yang diinduksi pada ikan sidat belum mampu untuk mengubah jenis kelamin sidat, sehingga jenis kelamin sidat tetap jantan dan berada dalam proses pematangan gonad. Proses berkembangnya gonad sidat terlihat jelas pada hasil histologi yang menunjukkan perubahan perkembangan gonad pada minggu awal sampai akhir penelitian.
Hasil kadar E2 selama penelitian mengalami peningkatan pada minggu ke-4 untuk semua perlakuan kecuali PK dan kemudian menurun pada minggu ke-8 (Gambar 3). Hal ini menunjukkan bahwa pada penyuntikkan ke-4, gonad ikan sidat mengalami perkembangan oleh rangsangan hormonal. Kadar E2 yang menurun disebabkan oleh proses clearance, yaitu pembersihan dari dalam tubuh. Secara fungsionalnya E2 merupakan hormon yang mengatur sifat feminisasi dan terekspresi secara morfologi pada betina dan memegang peranan penting untuk mengontrol estrogenik (Berg et al. 2004). Beberapa penelitian telah membuktikan E2 berperan merangsang vitelogenesis, namun dalam penelitian ini semua perlakuan tidak berpengaruh terhadap perubahan jenis kelamin ikan sidat menjadi betina. Perlakuan-perlakuan yang tidak berpengaruh terhadap perubahan kelamin tersebut diperkirakan oleh dosis hormon E2 yang rendah dan waktu penyuntikkan yang singkat.
21
penyuntikan ekstrak pituitari ikan mas dosis 0,5% selama sepuluh minggu menghasilkan ikan sidat matang gonad dengan nilai GSI 3,37%. Selanjutnya Zahri (2015) menggunakan sidat jenis yang sama dan ukuran 200g dengan kombinasi perlakuan 20 IU hCG + 300 µg E2 + 10 ppm AD selama 10 minggu penyuntikan menghasilkan sidat matang gonad dengan kadar serum E2 sebesar 1,5 ng/ml. Hal ini menandakan kadar serum E2 pada perlakuan yang dikombinasikan dengan atau tidak E2 menunjukkan kadar yang kecil dan dosis hormon E2 juga terlalu kecil.
Hasil kadar FSH dan LH menunjukkan bahwa kadar FSH dan LH secara jelas meningkat pada minggu keempat namun pada minggu kedelapan kadar FSH menurun; sedangkan kadar LH terus meningkat. FSH dan LH merupakan hormon gonadotropin yang bertugas untuk merangsang pertumbuhan dan aktivitas gonad. Proses pematangan gonad pada ikan melibatkan dua macam hormon gonadotropin yang dihasilkan oleh adhenohipofisis, yaitu FSH berperan merangsang perkembangan folikel melalui sekresi E2 dan LH berperan dalam pematangan akhir (Nagahama 1983).
Hormon FSH dan LH disekresikan oleh kelenjar hipofisis untuk mengatur reproduksi. Peningkatan kadar hormon ini dalam plasma darah mengindikasikan bahwa ikan sidat terinduksi untuk melakukan proses perkembangan dan pematangan gonad. FSH dan LH merupakan hormon yang disintesis di kelenjar hipofisis dengan organ target yaitu gonad. Di gonad, FSH akan merangsang dan meningkatkan aktivitas dari sel sertoli, mengatur nutrisi yang dibutuhkan gonad dan mendukung perkembangan sel germinal selama terjadinya proses gametogenesis. Setelah folikel berkembang dan mengaktifkan spermatogenesis, LH akan mengatur produksi steroid gonad guna mendukung perkembangan spermatogonia hingga spermiasi.
Hormon FSH dan LH meningkat secara nyata di minggu ke-4 dan efek dari meningkatnya hormon ini terjadi percepatan pertumbuhan folikel. Dengan terjadinya pertumbuhan folikel karena rangsangan FSH, maka gonad akan dirangsang untuk mensintesis E2 dan kadarnya juga meningkat pada minggu keempat (Gambar 3). Meningkatnya E2 memberikan umpan balik positif terhadap poros hypothalamus untuk mensintesis LH. Hal ini terbukti dengan semakin meningkatnya kadar LH dan T, namun berlawanan dengan kadar E2 dan FSH yang terus menurun setelah meningkat pada minggu ke-4. Dengan demikian dapat dikatakan kadar FSH yang menurun membuktikan bahwa fungsi FSH telah terpakai, sedangkan kadar LH yang terus meningkat membuktikan fungsi LH secara keseluruhan belum terpakai sehingga proses spermiasi belum mencapai fase pematangan akhir. Dalam penelitian ini diduga FSH dan LH turut membantu sintesis T endogenus ikan sidat. Menurut penelitian Wu et al. (2011), FSH berperan dalam proses perkembangan gonad sedangkan LH berperan pada proses pematangan dan ovulasi. Kadar FSH yang cenderung stabil dan tingginya LH berperan efektif merangsang spermiogenesis selama pertumbuhan gonad jantan. Hasil penelitian ini sesuai dengan yang kemukakan oleh Miura dan Miura (2011), yaitu LH lebih berperan untuk mengatur pematangan akhir dibandingkan dengan FSH.
selama penelitian. Yulfiperius (2001) menambahkan bahwa aktivitas metabolisme sebagian besar tertuju pada proses perkembangan gonad. Peningkatan nilai GSI mengindikasikan terjadinya proses perkembangan gonad selama penelitian. Proses perkembangan gonad sebagian besar tertuju oleh aktivitas metabolisme. Perkembangan bobot gonad pada stadium matang dapat mencapai 10–25% dari bobot tubuh. Seiring dengan pertambahan bobot tubuh maka bobot gonad juga meningkat, hal ini disebabkan oleh rangsangan hormon yang efektif pada perkembangan gonad. Nilai GSI dalam penelitian ini berkisar antara 1,13–2,46% dapat dikatakan masih kecil persentasenya. Hal ini dibuktikan dengan kadar testosteron yang tinggi mengakibatkan gonad ikan sidat menjadi testis matang. Penelitian yang membuktikan peningkatan nilai GSI dilakukan oleh Rovara et al. (2008) pada A. bicolor bicolorukuran ≥600g dengan penyuntikan Carp Pituitary Extract menghasilkan GSI sebesar 3,37%, pada sidat liar fase silver eel nilai GSI mencapai 2,88% (Rachmawati dan Susilo 2012) dan pada A. bicolor bicolor
ukuran ≥150g dengan penyuntikan PMSG 20 IU + AD 10 ppm mencapai 2,29% (Ahlina 2015). Nilai HSI dapat menunjukkan secara kuantitatif pertambahan bobot hati seiring dengan perkembangan gonad dan peningkatan GSI. Nilai HSI akan semakin meningkat seiring perkembangan gonad dan nilainya akan turun pada saat telah matang gonad. Dalam penelitian ini tidak ada korelasi antara nilai GSI dan HSI; namun nilai tertinggi HSI minggu ke-6 sebesar 1,77% terdapat pada perlakuan P10AE.
Morfologi gonad ikan sidat minggu ke-0 (Gambar 10A) menunjukkan bahwa gonad sudah mulai tampak, hanya berupa seperti benang tipis transparan yang diselimuti oleh lapisan lemak. Gonad ikan sidat minggu ke-8 (Gambar 10B) menunjukkan gonad sudah terlihat dengan jelas pada bagian sisi kiri dan kanan yang biasanya melekat pada dinding ventral bagian atas. Gonad ikan sidat minggu ke-8 terlihat berwarna putih susu pekat, semakin tebal dan lebih mengglambir. Gonad pada perlakuan lebih berkembang dan besar dibandingkan gonad kontrol. Hal ini menunjukkan bahwa ada pengaruh kombinasi hormon yang diberikan sehingga adanya pertumbuhan dan perkembangan gonad ikan sidat sebelum penyuntikan (minggu ke-0) dan sesudah penyuntikan (minggu ke-8). Perkembangan gonad ikan sidat secara morfologi sejalan dengan kadar testosteron yang semakin meningkat (Gambar 2).
Pada umumnya, hormon T akan dikonversi menjadi E2 dengan bantuan enzim aromatase. Dalam penelitian ini, hormon E2 eksogenus yang diberikan ke ikan sidat ternyata menekan E2 endogeneus ikan sidat; sehingga E2 tidak terbentuk. Oleh karena itu maka terjadi penumpukan pada T, sehingga ikan sidat menjadi jantan. Gambar 10 menunjukkan dengan jelas morfologi gonad jantan (testis) ikan sidat. Hal ini sejalan dengan hasil pengukuran kadar T (Gambar 2) yang terus meningkat sampai minggu akhir penelitian.
23
sebelah kiri lebih berat dan mengandung lebih banyak sel kelamin dibandingkan gonad sebelah kanan.
Dari hasil histologi yang ada pada Gambar 11 dapat dilihat bahwa gonad sidat berkelamin jantan (testis). Pada proses perkembangan testis (spermatogenesis) sangat berkaitan erat dengan kadar testosteron dalam darah. Hal ini sejalan dengan hasil penelitian yang menunjukkan bahwa semakin tinggi kadar testosteron plasma darah maka status sel testis semakin matang. Hasil histologi menunjukkan perbedaan antara gonad sidat sebelum penyuntikkan (Gambar 11A) dan setelah penyuntikkan (Gambar 11B). Hasil penelitian menunjukkan bahwa induksi hormonal menyebabkan gonad sidat minggu ke-8 lebih berkembang dibandingkan dengan gonad sidat minggu ke-0. Berdasarkan klasifikasi perkembangan gonad dan tingkat kematangan gonad menurut Miura dan Miura (2011), terlihat bahwa gonad sidat minggu ke-0 untuk semua kelompok perlakuan berada pada fase spermatogonia tipe A (TKG I), dimana terdapat perkembangan inti sel yang diselimuti oleh kapsul-kapsul atau tubulus seminiferous dan gonad sidat minggu ke-8 menunjukkan fase yang berbeda antara kelompok perlakuan. Pada PK tergolong fase spermatogonia tipe A, untuk histologi P10A dan P20AE menunjukkan fase spermatosit (TKG II). Pada fase spermatosit, tubulus seminiferous mulai melepaskan inti sel dan inti sel yang terdapat dalam tubulus mulai ada yang menyatu. Pada P20A terlihat fase spermatogonia tipe B (TKG I), dimana inti sel yang terdapat dalam tubulus seminiferus mulai mengecil, berwarna agak gelap dan semakin memadati ruang pada tubulus. Tubulus seminiferus pada tahap perkembangan spermatogonia berwarna merah muda dan masih banyak terdapat rongga atau seperti ruang kosong pada jaringannya. Pada P10AE menunjukkan fase spermatid (TKG III),
pada fase ini tubulus seminiferous berwarna transparan membentuk garis tipis yang di dalamnya terdapat inti sel yang mulai memadati permukaan jaringan dengan merata.
Hasil pengukuran bobot tubuh menunjukkan interaksi perlakuan hormon kepada sidat menyebabkan gonad berkembang sehingga bobot tubuh juga ikut meningkat. Menurut Kamil (2000), bahwa pertumbuhan ikan akan maksimal apabila kebutuhan nutrisi dan kebutuhan energinya terpenuhi dengan baik. Setelah dilakukan penyuntikan dan sampling, maka pertambahan bobot ikan sidat PK cenderung naik turun; tetapi pada perlakuan kombinasi hormon, bobot tubuh meningkat. Semua perlakuan hormon memberi pengaruh positif terhadap pertambahan bobot tubuh sidat kecuali perlakuan PK. Hal ini diduga ikan pada PK mengalami stress (kondisi fisiologi) sehingga mengganggu nafsu makan.
berpengaruh pada pertumbuhan bobot tubuh, tetapi tidak pada pertumbuhan panjang tubuh ikan sidat.
Hasil analisis proksimat menunjukkan bahwa kadar protein daging ikan sidat mengalami peningkatan dibandingkan dengan daging ikan sidat sebelum penyuntikan. Kadar protein tertinggi terdapat pada perlakuan P10AE (16,63%). Kadar protein ini diduga dipengaruhi oleh kadar protein pakan yang diberikan. Hasil kadar lemak menunjukkan penurunan pada perlakuan P10AE (20,49%) dan P20AE (19,22%) dibandingkan dengan perlakuan lainnya dan daging ikan sidat sebelum penyuntikan. Faktor penting yang mempengaruhi pertumbuhan dan reproduksi ikan selain pakan adalah kualitas air terutama suhu, karena suhu dapat mempengaruhi pertumbuhan dan nafsu makan ikan. Suhu dapat mempengaruhi aktivitas penting ikan seperti pernapasan, pertumbuhan dan reproduksi. Suhu yang tinggi dapat mengurangi oksigen terlarut dan mempengaruhi selera makan ikan. Kisaran hasil kualitas air selama penelitian menunjukkan bahwa suhu, oksigen terlarut, salinitas, pH, nitrit dan TAN masih berada pada kisaran optimum kualitas air ikan sidat.
Kesulitan dalam budidaya ikan sidat adalah ketidakmampuan ikan tersebut untuk matang gonad hingga mengalami spermiasi di dalam kondisi lingkungan budidaya. Dari beberapa penelitian yang telah dilakukan, perlakuan dengan hormon dianggap efektif dalam menginduksi tahapan perkembangan gonad ikan sidat. Dalam penelitian ini, ikan sidat terlihat sudah mengalami perkembangan gonad, namun tahap yang dicapai masih perkembangan TKG III, sehingga disarankan untuk melakukan penelitian lebih lanjut dengan waktu penelitian yang lebih lama, interval waktu sampling yang lebih baik serta dosis hormon yang lebih tepat.
4 SIMPULAN DAN SARAN
Simpulan
1. Kombinasi hormon PMSG 10 IU/kg bobot ikan + Antidopamin 0,01 mg bobot ikan dan Estradiol-17β 150 µg/kg bobot ikan menginduksi sidat 200 g menjadi jantan matang gonad fase TKG III
2. FSH dan LH terlibat dalam perkembangan awal gonad ikan sidat.
Saran
25
DAFTAR PUSTAKA
Adachi S, Ijiri S, Kazeto Y, Yamauchi K. 2003. Oogenesis in the Japanese eel, Anguilla japonica. In. Aida K, Tsukamoto K, Yamauchi K (Eds). Eel Biology. Spinger-Verlag Tokyo (JP). PP. 301–318.
Affandi R. 2005. Strategi pemanfaatan sumberdaya ikan sidat (Anguilla spp.) di Indonesia. Jurnal Iktiologi Indonesia, 5 : 77–81.
Ahlina H. 2015. Induksi maturasi gonad ikan sidat (Anguilla bicolor bicolor)
Arai T, Chino N, Zulkifli SZ, Ismail A. 2011. Age at maturation of a tropical eel Anguilla bicolor bicolor in Peninsular Malaysia, Malaysia. Malaysian Applied Biology, 40: 51–54.
Aroua S, Maugars G, Jeng SR, Chang CF, Weltzien FA, Rousseau K, Dufour S. 2012. Pituitary gonadotropins FSH and LH are oppositely regulated by the activin/follistatin system in a basal teleost, the eel. General and Comparative Endocrinology, 175: 82–91.
Berg H, Modig C, Olsson PE. 2004. 17β-estradiol induced vitellogenesis is inhibited by cortisol at the post-transcriptional level in Arctic char (Salvelinus alpinus). Reproductive Biology and Endocrinology, 2: 1–10. Beullens K, Eding EH, Gilson P, Oliver F, Komen J, Richter CJJ. 1997. Sex
differentiation, change in length, weight and eye size before and after metamorphosis of European eel (Anguilla anguilla L) maintained in captivity. Aquaculture, 153: 151–162.
Blazer V. S. 2002. Histopathological assesment of gonadal tissue in wild fishes. Fish Physiology and Biochemistry, 26: 85–101.
Boetius I, Boetius J. 1980. Experimental maturation of female silver eels, Anguilla anguilla – Estimates of fecundity and energy reserves for migration and spawning. Dana, 1: 1–28.
Chen C, Fernald D. 2008. GnRH and GnRH receptors: distribution, function and evolution. Review Paper Journal of Fish Biology, 73: 1099–1120.
Costa DDM, Neto FF, Costa MDM, Morais RN, Garcia JRE, Esquivel BM, Ribeiro CAO. 2010. Vitellogenesis and other physiological respons induced by 17β-estradiol in males of freshwater fish Rhamdia quelen. Comparative Biochemistry and Physiology, Part C 151: 248–257.
Crook V. 2010. Trade in Anguilla species, with a focus on recent trade in European eel A. anguilla. TRAFFIC report prepared for the European Commission.
Degani G. 1986. Effect of Combined Dietary 17β-Estradiol and 17α -Methyltestosterone on Growth and Body Composition of European Eels (Anguilla anguilla). Aquaculture, 59: 169–175.
Durif CMF, Van Ginneken V, Dufour S, Müller T, Elie P. 2009. Seasonal evolution and individual differences in silvering eel from different location. In: Van den Thillart, Dufour S, Rankin JC (Eds). Spawning Migration of the European Eel. Spinger Science. PP. 13–38.
Effendie MI. 2002. Biologi Perikanan. Yayasan Pustaka Nusantara, Yogyakarta. Halaman: 5.
Fahmi MR, Solihin DD, Soewardi K, Pouyaud L, Shao Z, Berrebi P. 2013. A Novel Semi-Multiplex PCR Assay for Identification of Tropical Eels of Genus Anguilla in Indonesian Waters. Fisheries Science, 79: 185–191. Fernandino JI, Hattori RS, Acosta ODM, Strussmann CA, Somoz GM. 2013.
Environmental stress-induced testis differentiation: androgen as a by-product of cortisol inactivation. General and Comparative Endocrinology, 192: 36–44.
Fingerman M. 1997. Roles of neurotransmitter in regulating reproductive hormone release and gonadal maturation in decapods crustacean. Invertebrate Reproduction Development, 31: 47–54.
Gallego V, Mazzeo I, Vilchez MC, Penaranda DS, Carneiro PCS, Perez L, Asturiano JF. 2012. Study of the effects of thermal regime and alternative hormonal treatment on the reproductive perfomance of european eel males (Anguilla anguilla) during induced sexual maturation. Aquaculture, 354-355: 7–16.
Higuchi M, Celino FT, Miura C, Miura T. 2012. The Synthesis and Role of Taurine in the Japanese eel testis. Amino Acids, 43: 773–781.
Ijiri S, Kabaya T, Takeda N, Tachiki H, Adachi S, Yamauchi K. 1998. Pretreatment reproductive stage and oocyte development induced by salmon pituitary homogenate in the Japanese eel Anguilla Japonica. Fisheries Science, 64: 531–537.
Ijiri S, Tsukamoto K, Chow S, Kurogi H, Adachi S, Tanaka H. 2011. Controlled reproduction in the japanese eel (Anguilla japonica), past and present. Aquaculture Europe, 36: 13–17.
Inoue JG, Miya M, Miller MJ, Sado T, Hanel R, Hatooka K, Aoyama J, Minegishi Y, Nishida M, Tsukamoto K. 2010. Deep-ocean origin of freshwater eels. Biology Letters, 6: 1–4.
Kagawa H, Tanaka H, Ohta H, Unuma T, Nomura K. 2006. The first success of glass eel production in the world: basic biology on fish reproduction advances new applied technology in aquaculture. Fish Physiology Biochemistry,31:193–199.
Kalujnaia S, McWilliam IS, Zaguinaiko VA, Feilen AL, Nicholson J, Hazon N, Cutler CP, Balment RJ, Cossins AR, Hughes M, Cramb G. 2007. Salinity Adaptation and Gene Profiling Analysis in the European Eel (Anguilla anguilla) Using Microarray Technology. General and Comparative Endocrinology, 152: 274–280.
Kamil MT. 2000. Pengaruh kadar asam Lemak n-6 yang berbeda pada kadar asam Lemak n-3 tetap pada pakan terhadap pertumbuhan ikan sidat Angilla bicolor [thesis]. Bogor (ID) : Institut Pertanian Bogor.
27
FSH and LH by drosophila S2 cells and their differential actions on the reproductive biology. Biology of Reproduction, 79: 938–946.
Kearney M, Jeffs A, Lee P. 2011. Development and early differentiation of male gonads in farmed New Zealand shortfin eel, Anguilla australis. New Zealand Natural Sciences, 36: 33–44.
Khara H, Bahram F, Bahman M, Mohaddeseh A, Iraj E, Samane P and Mina R. 2013. Effect of Dietary Estradiol-17β on Growth, Hematology and Biochemistry of Stellate Sturgeon Acipenser stellatus. World Journal of Fish and Marine Sciences, 5: 113–120.
Lowerre-Barbieri SK, Brown-Peterson NJ, Murua H, Tomkiewicz J, Wyanski DM, Saborido-Rey F. 2010. Emerging Issues and Methodological Advances in Fisheries Reproductive Biology. Marine and Coastal Fisheries, 3: 32–51.
Marcel H. 1975. Text book of fish culture. Breeding and cultivation of fish. Fishing News (Books) Ltd. England: 201–333.
Matsubara H, Tanaka H, Nomura K, Kobayashi T, Murashita K, Kurokawa T, Unuma T, Kim SK, Lokman MP, Matsubara T, Kagawa H, Ohta H. 2008. Occurrence of Spontaneously Spermiating Eels in Captivity. Cybium, 32: 174–175.
Matsui I. 1993. Theory and Practice of Eel Culture. Rotterdam: A. A. Balkema. Melia P, Bavacqua D, Crivelli AJ, Panvilli J, De Leo GA, Gatto M. 2006. Sex
Differentiation of the European Eel in Brackish and Freshwater environment: Comparative Analysis. Journal of Fish Biology. 69: 1228– 1235.
Miura C, Miura T. 2011. Analysis of Spermatogenesis Using an Eel Model. Aqua-BioScience Monographs (ABSM), 4: 105–129.
Miura T, Miura C, Yamauchi K. 2003. Spermatogenesis in the Japanese Eel, Anguilla japonica. In. Eel Biology. Eds. Aida K, Tsukamoto K, Yamauchi K. Springer-Verlag Tokyo (JP). 319–330.
Nagahama Y. 1983. The Functional Morphology of Teleost Gonads. PP. 223–275. In W. S. Hoar, D. J. Randall dan E. M. Donaldson (Eds) Fish physiology. Volume IX B. Academic Press, Inc.
Nakamura M. 2013. Morphological and Physiogical Studies on Gonadal Sex Differentiation in Teleost Fish. Aqua-BioScience Monographs, 6: 1–47. Ohta H , Kagawa H, Tanaka H, Okuzawa K. and Hirose K. 1996. Milt Production
in the Japanese Eel Anguilla Japonica Induced by Repeated Injections of Human Chorionic Gonadotropin. Fisheries Science,62: 44–49.
Ohta H, Kagawa H, Tanaka H, Okuzawa K, Linuma N, Hirose K. 1997. Artificial induction of maturation and fertilization in the Japanese eel, Anguilla japonica. Fish Physiology Biochemistry, 17: 163–169.
Palstra AP, Van den Thillart G. 2010. Swimming physiology of European silver eels (Anguilla anguilla L.): energetic costs and effects on sexual maturation and reproduction. Fish Physiology and Biochemistry, 36: 297– 322.
Rovara O. 2007. Karakterisasi reproduksi upaya maskulinisasi dan pematangan gonad ikan sidat betina (Anguilla bicolor bicolor) melalui penyuntikan ekstrak hipofisis [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Rovara O, Affandi R, Zairin MJr, Agungpriyono S, Toelihere MR. 2008. Pematangan Gonad Ikan Sidat Betina (Anguilla bicolor bicolor) melalui Induksi Ekstrak Hipofisis. Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia, 1: 69–76.
Rousseau K, Aroua S, Schmitz M, Elie P, Dufour S. 2009. Silvering: metamorphosis or puberty? In: Van den Thillart, Dufour S, Rankin JC (Eds). Spawning Migration of the European Eel. Springer Science. PP. 39– 63.
Singh V, Singh PB, Srivastava S. 2009. Testosterone and estradiol-17β dependent phospolipid biosynthesis in ovariectomized cathfish, Heteropneustes fossilis. Journal of Environmental Biology, 30: 633–640.
Sugati A. 2013. Induksi maturasi ikan sidat (Anguilla bicolor) dengan menggunakan kombinasi hormon berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Takashima F. and Hibiya T. 1995. An Atlas of Fish Histology: Normal and Pathological Fetaures. 2nd ed. Tokyo Kodansha; Stuttgart; New York. 195 p.
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients. In: Fish Nutrition and Mariculture (ed. by T. Watanabe), pp. 179-233. Kanagawa International Fisheries Training Center, Japan International Cooperation Agency, Kanagawa.
Tanaka H. 2006. Development of artificial fry production technology of Japanese eel (Special Articles). Farming Japan, 40: 26–30.
Tanja MN, Kofoed, Tomkiewicz J, Pedersen Jes S. 2010. Histological Study of Hormonally Induced Spermatogenesis in European eel (Anguilla anguilla). Proceedings of the 4th Workshop on Gonadal Histology of Fishes. American Fisheries Society 83–86.
Tesch FW. 1977. The Eel; Biology and Management of Anguillid Eels. London: Chapman and Hall.
Wedemeyer GA. 1996. Physiology of fish in intensive aquaculture system. Chapman and Hall. New York. PP. 232.
Wu Y, Zhi H, Lihong Z, He J, Weimin Z. 2011. Ontogeny of immunoreactive LH and FSH cells in relation to early ovarian differentiation and development in protogynous hermaphroditic ricefield eel Monopterus albus. Biology of Reproduction, 5: 1–22.
Yulfiperius, 2001. Pengaruh kadar vitamin E dalam pakan terhadap kualitas telur ikan patin, Pangasius hypophthalmus [thesis]. Bogor (ID): Institut Pertanian Bogor.
Zahri A. 2015. Rangsangan hormonal untuk memacu pertumbuhan dan pematangan gonad sidat (Anguilla bicolor bicolor) [thesis]. Bogor (ID): Institut Pertanian Bogor.
29
LAMPIRAN
Lampiran 1. Metode pengukuran kadar Testosteron plasma darah ikan sidat.
Prosedur pengukuran kadar T menggunakan metode ELISA adalah sebagai berikut :
1. Larutan testosteron_HRP conjugate dan wash buffer disiapkan terlebih dulu
2. Setelah itu disiapkan microwell yang dibutuhkan. Microwell yang tidak digunakan ditutup dan disimpan ke dalam lemari es
3. 50 µl larutan kalibrasi, kontrol dan contoh uji dimasukan ke dalam sumur yang telah ditandai dan dirangkap 2 (duplo)
4. 100 µl conjugate working solution ditambahkan ke dalam setiap sumur membalikkan sumur pada kertas penyerap air untuk menghilangkan sisa larutan pada sumur
9. 50 µl stopping solution ditambahkan ke dalam setiap sumur pada interval waktu yang sama seperti pada tahap 7
10.Hasil dibaca pada microwell plate reader pada 450 nm 20 menit setelah penambahan stopping solution.
Lampiran 2. Metode pengukuran kadar Estradiol-17β plasma darah ikan sidat.
Prosedur pengukuran kadar E2 menggunakan metode ELISA adalah sebagai berikut :
1. Larutan standar, sampel dan QC sebanyak 25 μl dimasukkan ke dalam masing-masing sumur pelat (microplate)
2. 200 μl konjugat enzim HRP Estradiol (Enzym Conjugate) ditambahkan ke dalam setiap sumur, kemudian dibuang perlahan selama kurang lebih 10 detik
3. Selama 2 jam diinkubasi pada suhu kamar
4. Setelah diinkubasi, larutan pada pelat dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 300 μl setiap sumur. Pencucian dilakukan sebanyak empat kali menggunakan alat Microplate Strip Washer Elx50TM. Setelah pencucian selesai, dikeringkan dengan cara dibanting secara perlahan pada kertas penyerap