ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL
ASETAT DAN HEKSANA BAKTERI ENDOFIT DARI AKAR
TANAMAN MENTIGI (Vaccinium varingaefolium)
TESIS
Oleh
WIDYA LESTARI
117030034/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL
ASETAT DAN HEKSANA BAKTERI ENDOFIT DARI AKAR
TANAMAN MENTIGI (Vaccinium varingaefolium)
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Magister
Sains dalam Program Studi Magister pada Program Pascasarjana
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Oleh
WIDYA LESTARI
117030034/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
M E D A N
2 0 1 3
PENGESAHAN TESIS
Judul Tesis : Isolasi dan Uji Antifungi Ekstrak Metanol, Etil Asetat dan Heksana Bakteri Endofit Dari Akar Tanaman Mentigi (Vaccinium varingaefolium)
Nama Mahasiswa : Widya Lestari Nomor Induk Mahasiswa : 117030034 Program Studi : Magister Biologi
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Menyetujui
Pembimbing I Pembimbing II
Prof. Dr. Dwi Suryanto, M.Sc
NIP . 19640409 199403 1 003 NIP . 19651101 199103 1 002 Prof. Dr. Erman Munir, M.Sc
Ketua Program Studi Dekan
Prof. Dr. Syafruddin Ilyas, M.Biomed
PERNYATAAN ORISINALITAS
ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL
ASETAT DAN HEKSANA BAKTERI ENDOFIT DARI AKAR
TANAMAN MENTIGI (Vaccinium varingaefolium)
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah di jelaskan sumbernya dengan benar.
Medan, 28 Agustus 2013
Widya Lestari 117030034
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Widya Lestari
NIM : 117030034
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty
Free Right) atas Tesis saya yang berjudul :
ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL ASETAT DAN HEKSANA BAKTERI ENDOFIT DARI AKAR TANAMAN MENTIGI
(Vaccinium varingaefolium)
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih data, menformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 28 Agustus 2013
Telah diuji pada
Tanggal : 28 Agustus 2013
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Dwi Suryanto, M.Sc
Anggota : 1. Prof. Dr. Erman Munir, M.Sc
2. Dr. It. Jamilah, M.Sc
3. Dr. Delvian, SP. MP
Lulus Pada Tanggal 28 Agustus 2013
RIWAYAT HIDUP
DATA PRIBADI
Nama : Widya Lestari, S.Si. M.Si
Tempat dan Tanggal Lahir : Porsea, 16 Juni 1988
Alamat Rumah : Jl. Sigura gura. Komplek PT TPL. Town Site C.
No.65 F Parmaksian. Toba Samosir.
Telepon : 081361020675/081370026459
e-mail : [email protected]
DATA PENDIDIKAN
SD : SD Yayasan Bonapasogit Tamat : 2000
SMP : SMP PGRI 3 Medan Marelan Tamat : 2003
SMA : SMU Negeri 3 Medan Tamat : 2006
Strata-1 : Biologi FMIPA USU Tamat : 2011
KATA PENGANTAR
Puji dan syukur penulis sampaikan ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia Nya, serta salawat beriring salam penulis sampaikan kepada Nabi Muhammad SAW, sehingga penulis dapat menyelesaikan penulisan hasil penelitian yang berjudul “Isolasi Dan Uji Antifungi Ekstrak Metanol, Etil Asetat Dan N- Heksana Bakteri Endofit Dari Akar Tanaman Mentigi (Vaccinium varingaefolium),” sebagai salah satu syarat untuk meraih gelar Magister Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
Dalam kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada: Bapak Prof. Dr. Dwi Suryanto, M.Sc sebagai Dosen Pembimbing 1, dan Bapak Prof. Dr. Erman Munir, M.Sc selaku Dosen Pembimbing 2. Dr. It Jamilah, M.Sc dan Bapak Dr. Delvian, SP, M.P selaku Dosen Penguji yang telah memberikan banyak saran dan arahan dalam penulisan tesis ini. Bapak Ketua Departemen Pascasarjana Biologi, Bapak Prof. Dr. Syafruddin Ilyas, M.Biomed. dan seluruh staf pengajar dan pegawai di Pascasarjana Biologi.
Penulis juga mengucapkan terimakasih Kepada Sekretaris Jenderal Kementerian Pendidikan dan Kebudayaan (SEKJEN DIKTI) yang telah memberikan beasiswa untuk melanjutkan dan menyelesaikan studi saya di Pascasarjana Biologi FMIPA Universitas Sumatera Utara, Medan.
Ungkapan terima kasih yang tak ternilai harganya penulis ucapkan kepada kepada Ayahanda tercinta Sigit Suharyanto dan Ibunda Sri Rita Hayati yang sudah memberikan semangat, kasih sayang yang tak ternilai harganya. Buat adikku tersayang adinda Febrina Tri Utami dan adinda Yulia Pratiwi kakak ucapkan terimakasih buat semangat dan dukungannya. Untuk kakek tercinta Alm H. Salekan dan nenek tersayang Hj. Siti Nurlela, atas doa dan semangat dari mereka sehingga saya dapat menyelesaikan studi ini dengan baik.
Terima kasih kepada sahabat baik Rahmiati, Hilda Sinaga, Kakak Netti Irawati, Mirza, Jati Panglipur dan Febrin yang telah banyak berbagi suka dan duka dalam menjalani studi dalam 2 tahun ini.
Semoga tesis ini bermanfaat untuk semua pihak dan semoga Allah SWT memberikan balasan atas apa yang telah diberikan. Amin ya Rabbal Alamin.
ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL ASETAT DAN N-HEKSANA BAKTERI ENDOFIT DARI AKAR TANAMAN MENTIGI
(Vaccinium varingaefolium) ABSTRAK
Penelitian mengenai bakteri endofit dalam mengendalikan hama dan penyakit tanaman serta meningkatkan pertumbuhan tanaman dengan menghasilkan metabolit sekunder telah banyak dilaporkan. Penelitian ini bertujuan untuk mengetahui kemampuan bakteri endofit dari akar tanaman mentigi dalam menghambat pertumbuhan fungi patogen. Isolasi bakteri endofit dilakukan dengan sterilisasi permukaan akar dan mengkulturnya pada media nutrien agar. Enam isolat bakteri endofit diperoleh dari tanaman mentigi masing-masing :AW1, AW2, AW3, AW5, AW6 dan AW7. Isolat bakteri diuji antagonis terhadap fungi patogen yaitu Fusarium
oxysporum, Ganoderma boninense, Rigidoporus microporus dan Saprolegnia sp. Dua
isolat bakteri, AW5 dan AW6 memiliki kemampuan yang baik dalam menghambat pertumbuhan patogen. Isolat bakteri AW5 dan AW6 diekstraksi dengan menggunakan 3 pelarut yaitu metanol, etil asetat dan n-heksana. Hasil essai ekstrak bakteri terhadap penghambatan pertumbuhan jamur patogen menunjukkan bahwa ekstrak metanol dari bakteri AW5 dan AW6 memiliki kemampuan dan kisaran yang luas dalam menghambat pertumbuhan fungi patogen.
Kata kunci: Bakteri endofit, Fusarium oxysporum, Ganoderma boninense,
Rigidoporus microporus, Saprolegnia sp., Vaccinium varingaefolium.
mmm
ISOLATION AND ANTIFUNGAL ESSAY OF METHANOL, ETIL ACETATE AND N-HEXANE ENDOPHYTIC BACTERIA ISOLATED FROM MENTIGI
ROOT (Vaccinium varingaefolium)
ABSTRACT
Research on the role of endophytic bacteria on protection mechanism against past and diseases of plant and promotion of plant growth by bacteria metabolite has been very midely reported. The research was aimed to know the ability of endophytic bacteria of mentigi plants in inhibition the growth of phatogenic fungi. Isolation of the endophytic bacteria from mentigi plant was done by sterilization the roots surface and cultured in nutrient agar media. Six isolates were obtained on the isolation. The growing colony was further purificated and tested againts phatogenic fungi (Fusarium
oxysporum, Ganoderma boninense, Rigidoporus microporus, Saprolegnia sp.). Cell
extraction was done for two selected isolates (AW5 and AW6) using methanol, etil asetate and n-hexane. Essay result extraction to phatogenic fungi showed that methanol extract of isolate AW5 and AW6 have biggest potential in inhibite phatogenic fungi.
Keyword: Bacteria endophyte, Fusarium oxysporum, Ganoderma boninense,
Rigidoporus microporus, Saprolegnia sp., Vaccinium varingaefolium.
DAFTAR ISI
2.1 Tumbuhan Vaccinium varingaefolium 4
2.2 Mikroorganisme Endofit 5
2.3 Beberapa Fungi Patogen Tanaman 6
BAB 3 BAHAN DAN METODE 9
3.1 Waktu dan Tempat 9
3.2 Alat dan Bahan 9
3.3 Isolasi Bakteri Endofit Tumbuhan Vaccinium varingaefolium 10 3.4 Karakterisasi Bakteri Endofit Akar Tumbuhan Vaccinium
varingaefolium
10
3.5 Uji Antifungal Bakteri Endofit Akar Tumbuhan Vaccinium varingaefolium
10
3.6 Ekstraksi Bahan Antifungal dari Isolat Bakteri Endofit 11 3.7
3.8
3.9
Uji Antifungal Ekstrak Bakteri Endofit dengan Berbagai Pelarut
Pengamatan Miselium Jamur Patogen Setelah Uji Antagonis Deteksi Kandungan Ekstrak Metanol, N-heksana dan Etil Asetat
Isolat Bakteri Endofit Potensial Akar Tumbuhan (Vaccinium
varingaefolium)
12
13
BAB 4 HASIL DAN PEMBAHASAN Halaman
4.1 Isolasi Bakteri Endofit 15
4.2 Kemampuan Antagonis Bakteri Endofit Terhadap Jamur Patogen Tanaman
16
4.3 Asai Ekstrak dengan pelarut Metanol, Etil Asetat dan N-heksana
17
4.4 Pengamatan Mikroskopik Hifa Abnormal 21 4.5 Deteksi kandungan Senyawa dari Ekstrak Bakteri Endofit 22
BAB 5 KESIMPULAN DAN SARAN 27
DAFTAR PUSTAKA 28
DAFTAR LAMPIRAN 34
DAFTAR TABEL
Halaman
Tabel 1.1. Metode Skrining Fitokimia menurut Harbone 14 Tabel 4.1.1. Karakterisasi Morfologi koloni dan Sel Isolat Bakteri Endofit 15 Tabel 4.1.2 Uji Biokimia Sederhana Isolat Bakteri Endofit 15 Tabel 4.2.1 Zona Hambat Uji Antagonis Sel Bakteri dengan Fungi Patogen 17 Tabel 4.2.2. Deskripsi Gejala Antagonis yang Terjadi Pada Jamur Patogen 19 Tabel 4.3.1. Asai Ekstrak Dengan Pelarut Metanol, N-Heksana dan Etil
Asetat
20
Tabel 4.5.1 Hasil skrining Senyawa Ekstrak Metanol Bakteri AW5 dan AW6
DAFTAR GAMBAR
Halaman Gambar 2.1. Tumbuhan Mentigi (Vaccinium varingaefolium) 5
Gambar 3.7.1. Metode Pengukuran Zona Hambat Bakteri Terhadap Fungi Patogen
12
Gambar 4.2.1. Kemampuan Antagonis Isolat Bakteri 16 Gambar 4.3.1. Kemampuan Ekstrak Metanol Dalam Menghambat
Pertumbuhan Fungi Patogen
20
Gambar 4.4.1. Hifa Abnormal Fungi Patogen Tanaman 24
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Isolasi Bakteri Endofit Pada Akar Tumbuhan Mentigi 34
Lampiran 2 Karakteristik Bakteri Endofit Pada Akar Tumbuhan Mentigi 35
Lampiran 3 Uji Antifungal Bakteri Endofit Akar Tumbuhan Mentigi 36
Lampiran 4 Ekstraksi Bahan Antifungal Dari Isolat Bakteri Endofit 37
Lampiran 5 Uji Antifungal Ekstrak Bakteri Endofit Berbagai Pelarut 38
Lampiran 6 Pengamatan Miselium Jamur Patogen Setelah Uji Antagonis 39
ISOLASI DAN UJI ANTIFUNGI EKSTRAK METANOL, ETIL ASETAT DAN N-HEKSANA BAKTERI ENDOFIT DARI AKAR TANAMAN MENTIGI
(Vaccinium varingaefolium) ABSTRAK
Penelitian mengenai bakteri endofit dalam mengendalikan hama dan penyakit tanaman serta meningkatkan pertumbuhan tanaman dengan menghasilkan metabolit sekunder telah banyak dilaporkan. Penelitian ini bertujuan untuk mengetahui kemampuan bakteri endofit dari akar tanaman mentigi dalam menghambat pertumbuhan fungi patogen. Isolasi bakteri endofit dilakukan dengan sterilisasi permukaan akar dan mengkulturnya pada media nutrien agar. Enam isolat bakteri endofit diperoleh dari tanaman mentigi masing-masing :AW1, AW2, AW3, AW5, AW6 dan AW7. Isolat bakteri diuji antagonis terhadap fungi patogen yaitu Fusarium
oxysporum, Ganoderma boninense, Rigidoporus microporus dan Saprolegnia sp. Dua
isolat bakteri, AW5 dan AW6 memiliki kemampuan yang baik dalam menghambat pertumbuhan patogen. Isolat bakteri AW5 dan AW6 diekstraksi dengan menggunakan 3 pelarut yaitu metanol, etil asetat dan n-heksana. Hasil essai ekstrak bakteri terhadap penghambatan pertumbuhan jamur patogen menunjukkan bahwa ekstrak metanol dari bakteri AW5 dan AW6 memiliki kemampuan dan kisaran yang luas dalam menghambat pertumbuhan fungi patogen.
Kata kunci: Bakteri endofit, Fusarium oxysporum, Ganoderma boninense,
Rigidoporus microporus, Saprolegnia sp., Vaccinium varingaefolium.
mmm
ISOLATION AND ANTIFUNGAL ESSAY OF METHANOL, ETIL ACETATE AND N-HEXANE ENDOPHYTIC BACTERIA ISOLATED FROM MENTIGI
ROOT (Vaccinium varingaefolium)
ABSTRACT
Research on the role of endophytic bacteria on protection mechanism against past and diseases of plant and promotion of plant growth by bacteria metabolite has been very midely reported. The research was aimed to know the ability of endophytic bacteria of mentigi plants in inhibition the growth of phatogenic fungi. Isolation of the endophytic bacteria from mentigi plant was done by sterilization the roots surface and cultured in nutrient agar media. Six isolates were obtained on the isolation. The growing colony was further purificated and tested againts phatogenic fungi (Fusarium
oxysporum, Ganoderma boninense, Rigidoporus microporus, Saprolegnia sp.). Cell
extraction was done for two selected isolates (AW5 and AW6) using methanol, etil asetate and n-hexane. Essay result extraction to phatogenic fungi showed that methanol extract of isolate AW5 and AW6 have biggest potential in inhibite phatogenic fungi.
Keyword: Bacteria endophyte, Fusarium oxysporum, Ganoderma boninense,
Rigidoporus microporus, Saprolegnia sp., Vaccinium varingaefolium.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Salah satu masalah utama dari budidaya tanaman pertanian di Indonesia ialah adanya serangan fungi patogen terhadap berbagai tanaman antara lain tanaman cabai, kacang kacangan, coklat, karet dan kelapa sawit. Serangan fungi patogen tersebut mengakibatkan kerugian yang sangat besar bagi para petani. Untuk itu diperlukannya suatu penanggulangan yang efektif. Selama ini telah banyak dilakukan pengendalian fungi patogen pada tanaman secara kimiawi, akan tetapi menimbulkan efek negatif terhadap lingkungan. Untuk itu perlu diupayakan suatu alternatif pengendalian secara biologi dengan menggunakan mikroba antagonis atau menggunakan metabolit antimikroba yang dihasilkan.
Menurut Cook & Baker (1983), usaha penanggulangan penyakit tanaman secara biologis mempunyai peluang yang cukup besar karena organismenya telah tersedia di alam dan aktivitasnya dapat distimulasi dengan memodifikasi lingkungan maupun tanaman inang. Keuntungan dalam menggunakan mikroorganisme antagonis
sebagai pengendalian biologis antara lain: aman terhadap lingkungan, tidak ada efek residu, aplikasinya bersifat berkelanjutan karena yang digunakan organisme hidup yang dapat memperbanyak diri sehingga dapat mengurangi aplikasi yang berulang-ulang.
pilihan yang baik bagi resistensi penyakit dan juga ramah lingkungan (Procopio et al., 2009).
Tanaman tingkat tinggi mengandung beberapa mikroba endofit yang menghasilkan metabolit sekunder sebagai bentuk pertahanan terhadap mikroba patogen (Radji, 2005). Mentigi (Vaccinium varingaefolium) merupakan tumbuhan yang dapat hidup pada kondisi lingkungan yang ekstrim seperti kadar belerang yang tinggi, temperatur yang tinggi dan pH yang rendah. Lingga (2013) telah mengisolasi jamur endofit dari tumbuhan mentigi. Telaah lebih lanjut diperlukan untuk mengetahui manfaat bakteri endofit yang ada pada tanaman tersebut seperti untuk pengendalian hayati.
1.1 Permasalahan
Tumbuhan mentigi (V. varingaefolium) hidup di kawah Gunung Sinabung yang memiliki kondisi lingkungan ekstrim, pH rendah, kadar belerang yang tinggi dan suhu
yang ekstrim. Oleh sebab kondisi pertumbuhan yang ekstrim, tumbuhan ini memproduksi metabolit yang unik yang boleh jadi dapat menghambat pertumbuhan mikroorganisme yang lain. Kemampuan dalam menghambat fungi patogen perlu diteliti untuk mengetahui potensi metabolit yang dihasilkan bakteri endofit yang diisolasi dari tumbuhan mentigi dalam menghambat fungi patogen.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui kemampuan isolat bakteri endofit dari akar tumbuhan V.
varingaefolium dalam menghambat pertumbuhan beberapa jamur patogen.
2. Mengetahui kemampuan ekstrak metanol, n-heksana dan etil asetat isolat bakteri endofit dari akar tumbuhan V. varingaefolium dalam menghambat beberapa fungi patogen.
3. Mengetahui kandungan ekstrak metanol isolat bakteri endofit dari akar tumbuhan V. varingaefolium.
1.3 Manfaat Penelitian
Sebagai bahan informasi beberapa jenis bakteri endofit dari akar tanaman
V. varingaefolium yang mempunyai potensi sebagai antifungi dalam menghambat
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Vaccinium varingaefolium
Genus Vaccinium terdiri dari 450 spesies yang berbeda yang tersebar di pegunungan tropis Asia dan Amerika Tengah Selatan, 92 spesies terdapat di China (51 jenis endemik). Tumbuhan dengan nama daerah mentigi dari suku Ericaceae ini mempunyai perawakan semak sampai pohon, tinggi dapat mencapai 10 m. Daunnya agak tebal, bentuk jorong sampai lanset. Daun mudanya berwarna kemerahan, kemudian akan berubah menjadi orange, kekuningan dan akhirnya hijau. Bunga influoressensia terminal atau aksilar. Braktea dan brakteola persisten dan caducous, bagian belakang kecil, basal, jarang apikal, tangkai bunga meluas ke arah ujung, articulata dan jarang bersambung. Jumlah bunga 5, jarang 4, kelopak bunga berlekuk
dan bergerigi. Korola urceolate atau tubular, berlekuk atau bergerigi. Buah dengan beberapa biji globose, biji berbentuk ovoid, kecil, testa dan keras. Buah mentigi dapat dikonsumsi sebagai obat penyegar tubuh (Cheng & Peter, 2009).
Vaccinium varingaefolium (Gambar 2.1) dapat tumbuh pada ketinggian 1.500
m dari atas permukaan laut. Di Gunung Papandayan mentigi ditemukan sampai pada puncak bukit tertinggi, bahkan mulai dari ketinggian 2.000 meter dpl. Di kawasan CA/TWA Kawah Ijen hanya ditemukan pada ketinggian di atas 2.000 m dpl. Di Gunung Papandayan, Tangkuban Perahu, Gede Pangrango mentigi tumbuh mendominasi tumbuhan lainnya di sekitar kawah. V. varingaefolium terdapat juga di Pegunungan Dieng. Tanaman ini dapat hidup pada kondisi lingkungan yang ekstrim, dengan toleransi yang tinggi dan penampilan habitus yang baik. Beberapa jenis tumbuhan lain seperti Ishaemum, Panicum dan Histiopteris, cukup dominan tumbuh di kawah gunung tetapi dengan penampilan habitus yang lebih buruk, seperti daun mengering kecoklatan, nekrotik atau tepi daunnya mengering (Nasir et al., 1994).
Gambar 2.1Tumbuhan Vaccinium varingaefolium
2.2 Mikroorganisme Endofit
Bakteri endofit merupakan mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer genetik (genetic
recombination) dari tanaman inangnya ke dalam mikroba endofit (Tan & Zou, 2001).
Bakteri endofit diisolasi dari jaringan tanaman atau diekstrak dari bagian dari jaringan tanaman yang sehat, proses kolonisasi jaringan tumbuhan oleh endofit melalui tahapan kompleks yang meliputi adaptasi, perkecambahan spora, penetrasi
dan kolonisasi. Endofit juga bisa masuk ke dalam jaringan tumbuhan melalui luka dan lubang alami. Luka pada tumbuhan yang disebabkan oleh nematoda juga menjadi
faktor utama masuknya bakteri endofit (Athman, 2006).
dengan menggunakan bakteri endofit merupakan salah satu alternatif pengendalian jamur parasit tanaman. Keunggulan bakteri ini sebagai agens pengendali hayati yaitu mampu meningkatkan ketersediaan nutrisi, menghasilkan hormon pertumbuhan dan mengendalikan penyakit tumbuhan (Kloepper et al., 1999) serta dapat menginduksi ketahanan tanaman (Hallmann, 2001).
Mikroorganisme dari kelompok bakteri banyak yang mempunyai peranan sebagai agen pengendali biologi secara potensial dalam menekan penyakit layu yang disebabkan oleh patogen tular tanah. Bakteri yang mempunyai potensi agen antagonis antara lain: Pseudomonas fluorescens dan Bacillus sp. Bakteri P. fluorescens merupakan komponen agen antagonis yang penting dalam rizosfer tanah. Bakteri agen antagonis tersebut dapat menekan cendawan atau bakteri lain dengan antibiosis, kompetisi nutrisi atau parasitisme langsung. Umumnya aktifitas organisme yang satu dengan organisme yang lain, akan saling bersaing terhadap tempat, udara, air dan bahan makanan (nutrient) (Susanna, 2000). Mikroba endofit menjanjikan dalam penemuan obat-obat baru, karena senyawa-senyawa bioaktif yang dikandungnya
(Strobel, 2003). Mikroba endofit mampu menghasilkan senyawa metabolit sekunder seperti alkaloid, terpen, steroid, flavonoid, kuinon, fenol dan lain sebagainya. Senyawa-senyawa ini sebagian besar mempunyai potensi yang besar sebagai senyawa bioaktif (Tan & Zou, 2001)
2.3 Beberapa Fungi Patogen
Fusarium oxysporum merupakan patogen tular tanah (soil borne) yang bersifat
penghuni tanah (soil inhabitant). Patogen ini dapat menimbulkan penyakit yang bersifat monosiklik sehingga strategi pengendalian yang efektif hingga kini belum ditemukan. Cendawan membentuk konidium pada suatu badan yang disebut sporodokium yang dibentuk pada permukaan tangkai atau daun sakit pada tangkai yang telah tua. Konidiofor bercabang dan rata-rata mempunyai panjang 70 μm, cabang-cabang samping biasanya bersel satu, panjang sampai 14 μm, konidium terbentuk pada ujung cabang utama dan pada cabang samping. Mikrokonidium bersel satu atau dua, hialin, jorong atau agak memanjang, berukuran 5-7 x 2,5-3 μm. Makrokonidium berbentuk sabit, bertangkai kecil, kebanyakan bersel 4, berukuran 22-36 x 4-5 μm. Klamidospora bersel satu, jorong atau bulat, berukuran 7-13 x 7-8 μm,
terbentuk di tengah hifa atau pada makrokonidium, seringkali berpasangan (Semangun, 1994). Konidianya biasanya mempunyai 3-5 septa dan sel apikal yang tipis serta sel dasarnya yang berbentuk kaki. Klamidosporanya dapat berbentuk tunggal atau berpasangan (Ploetz, 1994).
Fusarium oxysporum merupakan jamur patogen yang dapat menginfeksi
tanaman dengan kisaran inang sangat luas (Mess et al. 1999). Jamur ini menyerang jaringan bagian vaskuler dan mengakibatkan kelayuan pada tanaman inangnya dengan cara menghambat aliran air pada jaringan xylem (De Cal et al. 2000). Fusarium sangat merugikan pertanian. Layu Fusarium dapat menyerang cabai merah, tomat, kacang panjang, kentang, kubis dan mentimun. Famili Solanaceae (tomat, kentang, terong, cabai dan tanaman lainnya) diinfeksi oleh jamur yang dapat menyebabkan layu
Fusarium dan layu Verticillium. Organisme penyebab penyakit biasanya masuk
melalui akar muda dan kemudian tumbuh dan berkembang sehingga akan mengkonduksi bagian pembuluh dari akar dan batang. Di bagian pembuluh batang tersumbat dan gagal menyalurkan air ke daun (Miller et al. 2004).
Saprolegnia yang termasuk dalam Oomycetes merupakan patogen utama pada
ikan air tawar. Saprolegnia seperti S. parasitica dan S. polymorpha (Webster & Weber, telah banyak dilaporkan sebagai patogen pada ikan dan telur ikan. Saprolegnia terdapat terutama di tanah yang lembab dan air tawar, bersifat sebagai saprofit pada sisa tanaman dan hewan. 2007). Oomycetes merupakan patogen utama pada telur ikan (Noga, 2000). Saprolegnia menyerang ikan nila merah yang dikenal dengan penyakit
Saprolegniasis (Akbar, 2008). Oomycetes merupakan patogen utama pada telur ikan
baik pada telur yang hidup maupun telur yang sudah mati. Infeksi dimulai pada telur yang tidak difertilisasi atau dibuahi ataupun telur yang tidak hidup (Noga 2000). Infeksi menyebar kepada telur yang sehat melalui kemotaksis positif (Bruno & Wood 1999).
tanaman kelapa akan mendapat serangan yang lebih berat dari penyakit busuk pangkal batang. Kalau dulu dianggap sebagai penyakit kebun tua, sekarang penyakit ini terdapat juga di kebun yang masih muda (Semangun, 2000).
Di kalangan petani perkebunan kelapa sawit G. boninense merupakan musuh penting bagi tanaman kelapa sawit maupun kelapa. Jamur patogen ini dapat masuk ke dalam badan tumbuhan melalui luka, lubang alami seperti mulut kulit dan hidatoda, atau dengan menembus permukaan tumbuhan yang utuh. Banyak jamur yang melakukan infeksi secara langsung pada bagian tumbuhan yang masih muda dan lunak (Semangun, 1996). Ganoderma menular ke tanaman sehat bila akar tanaman sehat bersinggungan dengan tunggul-tunggul pohon yang sakit. Akar-akar tanaman kelapa sawit yang muda tertarik kepada tunggul yang membusuk karena kaya akan hara dan mempunyai kelembapan tinggi (Semangun, 2000).
Jamur akar putih (Rigidoporus microporus) merupakan organisme yang polifag, yaitu dapat menyerang bermacam-macam tanaman. Beberapa penelitian
menyebutkan kemampuan jamur ini menyerang tanaman lain selain karet, diantaranya: jambu mete (Anacardium occidentale) (Chatarina, 2012), teh (Camellia
sinensis) (Hastuti, 2000), akasia (Acacia mangium), jati (Azadirachta excelsa, dan
Tectona grandis) (Farid et al., 2009). Semangun (2008) menyatakan bahwa
R. microporus juga menyerang tanaman kopi, kelapa sawit, kakao, mangga, cengkeh,
sengon, meranti serta tanaman perkebunan lain. Jamur akar putih yang menyerang karet yang dibudidayakan semula berasal dari pohon-pohon hutan yang sakit. Dari sisa-sisa akar atau tunggul pohon-pohon hutan Rigidoporus dapat menginfeksi tanaman karet.
Berdasarkan konsep segitiga penyakit, penyebaran penyakit JAP ini tergantung pada tanaman contohnya pada karet (sebagai inang), Rigidoporus microporus (sebagai patogen) serta kondisi lingkungan. Jika ketiga faktor saling mendukung, maka tanaman akan terserang penyakit ini. Sampai saat ini belum ditemukan adanya karet yang resisten (tahan) terhadap serangan jamur akar putih. Chatarina (2012) menyebutkan bahwa, penyakit JAP dapat menyerang tanaman mulai dari pembibitan sampai dewasa. Penyakit ini dapat menyerang tanaman muda, usia 3-4 tahun sampai
tanaman menghasilkan atau produktif. Komponen lingkungan yang berperan meningkatkan penyebaran penyakit JAP ini adalah tanah. Sifat-sifat tanah sangat penting untuk menunjang perkembangan penyakit ini (Prasetyo et al., 2009).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai dengan Juli 2013 di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah akar mentigi
(V. varingaefolium) dari Gunung Sinabung. Fungi yang digunakan yaitu Rigidoporus
microporus dari Balai Penelitian Karet Sei Putih dan Fusarium oxysporum,
Ganoderma boninense, Saprolegnia sp., koleksi Laboratorium Mikrobiologi FMIPA
USU, media nutrient agar (NA), media potato dextrose agar (PDA), yeast ekstrak (YE), kloroks 1%, alkohol 70%, akuades, metanol, n-hexana, etilasetat, ketokonazole 200 mg, zat pewarna Gram, dimetil sulfoksida (DMSO), zat-zat uji biokimia, beberapa pereaksi yang digunakan dalam metode skrining fitokimia dan lain-lain.
Alat-alat yang digunakan antara lain adalah autoclave, vortex, pipet serologi, pipet mikro, pro pipet, cawan Petri, blank disc (oxoid), inkubator, hot plate, corkborer dan perlengkapan laboratorium lainnya.
3.3 Isolasi Bakteri Endofit Dari Akar Tanaman Mentigi
Isolasi bakteri endofit dari akar dan daun dilakukan dengan metode sterilisasi permukaan menurut metode Radu & Kqueen (2002). Sampel yang diambil dari lokasi dimasukkan ke dalam plastik diletakkan di dalam termos yang berisi es batu, kemudian sampel dibawa ke laboratorium mikrobiologi untuk isolasi bakteri endofit. Tahap awal yang dilakukan adalah mencuci akar dengan air mengalir selama 20 menit. Sterilisasi bagian permukaan akar dilakukan dengan cara merendamnya di dalam larutan secara berturut-turut: etanol 75% selama 2 menit, larutan sodium
hipoklorit 5,3% selama 5 menit dan etanol 75% selam 30 detik. Selanjutnya akar dibilas dengan akuades steril, setelah kering bagian ujung kiri dan kanan akar dipotong 1 cm, kemudian masing-masing akar dipotong membujur dan diletakkan di permukaan media NA yang telah dicampur dengan antibiotik ketokonazole (0,3 g/100 ml) dengan posisi bekas potongan ke arah media, kemudian diinkubasi pada suhu ruang selama 5 hari. Koloni yang muncul disubkultur ke media NA yang baru untuk dimurnikan.
3.4 Karakterisasi Bakteri Endofit Akar Tanaman Mentigi
Isolat bakteri yang diperoleh dari akar dikarakterisasi secara morfologi meliputi bentuk, warna, elevasi, tepi koloni dan uji biokimia mencakup uji sitrat, uji katabolisme gula, uji motilitas, uji gelatin, uji katalase, alur kerjanya dapat dilihat pada Lampiran 2.
3.5 Uji Antifungal Bakteri Endofit Akar Tanaman Mentigi
Uji antagonis dilakukan untuk melihat kemampuan bakteri endofit dalam menghambat
pertumbuhan fungi patogen seperti F. oxysporum, G. boninense, Saprolegnia sp. dan
R. microporus. Biakan kultur jamur patogen yang sudah diremajakan diambil dengan
cork borer, lalu diinokulasikan pada bagian tengah media modifikasi PDA + YE 1%
3.6 Ekstraksi Bahan Antifungi dari Isolat Bakteri Endofit
Ekstraksi metabolit sekunder bakteri endofit tanaman V. varingaefolium yang memiliki aktivitas antifungi dilakukan berdasarkan metode yang pernah dilakukan oleh Nofiani et al.(2009) dan Suryanto et al. (2012) yang dimodifikasi. Isolat bakteri antifungal yang paling potensial disebarkan pada media NA dan diinkubasi selama 5 hari. Media padat selanjutnya dipotong kecil-kecil dan direndam dengan metanol dalam erlenmeyer selama 72 jam dan dibungkus dengan kertas aluminium untuk mengindari kerusakan karena cahaya. Maserat diambil dengan cara disaring. Perendaman dilakukan sebanyak 3 kali. Semua maserat yang terkumpul disentrifugasi dengan kecepatan 3000 rpm selama 15 menit. Supernatan dipekatkan dengan menggunakan rotavorator dengan suhu tidak lebih dari 50oC untuk memperoleh ekstrak yang siap untuk digunakan. Metode yang sama dilakukan terhadap pelarut n-heksana dan etil asetat, alur kerjanya dapat dilihat pada Lampiran 4.
3.7 Uji Antifungi Ekstrak Bakteri Endofit Berbagai Pelarut
Uji antibiotik ekstrak metanol, n-heksana, etil asetat bakteri endofit tanaman V.
varingaefolium digunakan media PDA + YE 1%. Biakan kultur fungi patogen berupa
F. oxysporum, G. boninense, Saprolegnia sp. dan R. microporus diambil dengan cork
borer, lalu diinokulasikan di bagian tengah media modifikasi PDA + YE 1% dengan
jarak 3,5 cm dari cakram tempat inokulum bakteri, lalu diinkubasi pada suhu ruang selam 72 jam.
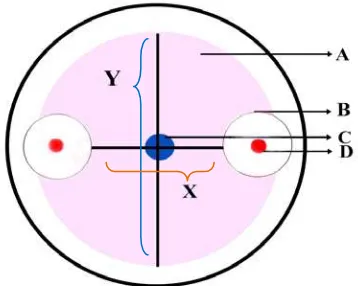
Gambar 3.7.1Metode pengukuran zona hambat bakteri endofit terhadap koloni fungi; A. Koloni fungi, B. Zona hambat bakteri endofit terhadap koloni fungi, C. Titik tengah jamur diletakkan, D. Koloni bakteri endofit , X. Diameter koloni fungi yang terhambat pertumbuhannya, Y. Diameter koloni fungi normal (Suryanto, 2006).
Pengukuran diameter zona hambat bakteri dilakukan dengan menggunakan jangka sorong. Zona hambat isolat bakteri endofit dihitung dengan rumus uji antagonis (Y-X)/2= hasil (Suryanto et al., 2006). Masing-masing ekstrak metanol, n-heksana dan etil asetat dilarutkan dengan dimetil sulfoksida (DMSO) dengan konsentrasi masing-masing 40, 60, 80 dan 100%. Pengujian daya hambat isolat terhadap jamur patogen menggunakan metode difusi cakram kertas sesuai dengan metode Kirby-Bauer (Drew et al., 1971; Mishra et al., 2006; Kulsuntiwong et al., 2008). Uji antagonis dilakukan dengan cara meletakkan cakram yang berisi dengan metabolit sekunder bakteri endofit tersebut, di tepi media PDA + YE 1% kemudian diinkubasi pada suhu ruang selama 7 hari. Aktivitas antifungal ditunjukkan dengan adanya zona hambatan pertunbuhan organisme uji di sekitar koloni penghasil antibiotik (Lechevalier, 2000). Pengujian dilakukan terhadap semua jamur patogen. Masing-masing perlakuan dilakukan dengan 2 kali pengulangan, alur kerjanya dapat dilihat pada Lampiran 5.
3.8 Pengamatan Miselium Jamur Patogen Setelah Uji Antagonis
Pengamatan dilakukan dengan 2 cara yaitu secara visual dan mikroskopis. Pengamatan secara visual dilakukan dengan cara melihat zona pertumbuhan. Pengamatan secara mikroskopis dilakukan dengan cara mengamati ujung miselium pada zona hambat beberapa jamur patogen. Ujung miselium fungi patogen yang tumbuh pada permukaan media PDA dipotong berbentuk block square, kemudian diletakkan pada objek gelas. Selanjutnya diamati adanya abnormalitas pertumbuhan miselium fungi patogen berupa pembengkokan ujung miselium dan miselium pecah, miselium berbelah, miselium bercabang, miselium lisis dan miselium tumbuh kerdil (Lorito et al., 1992). Alur kerjanya dapat dilihat pada Lampiran 6.
3.9Deteksi Kandungan Ekstrak Metanol, N-Heksana Dan Etil Asetat Isolat Bakteri Endofit Potensial Akar Tumbuhan Mentigi
dari prosedur sebelumnya dideteksi dengan menggunakan metode fitokimia untuk uji pendahuluan agar diketahui kandungan senyawa pada ekstrak bakteri endofit yang dibuat, misalnya alkaloid, terpenoid, fenolik, flavonoid, steroid atau saponin.
Tabel 1.1 Metode Skrining Fitokimia menurut Harbone (1987).
NO Uji Pereaksi Hasil Perubahan Warna
1. Fenolik FeCl3 1% Positif Terbentuk larutan warna
hijau, biru, hitam
2. Flavanoid Mg-HCl Positif Merah jambu
3. Alkaloid Wagner, Mayer dan Dragendroff.
Positif Terbentuk endapan
4. Steroid H2SO4(p) dan pereaksi Positif
LB
(Lieberman_Burchad).
Terbentuk warna hijau kebiruan
5. Saponin Akuades Positif Terbentuk busa
6. Tanin FeCl3 Positif Terbentuk warna hijau
kebiruan, dan terbentuk endapan
BAB 4
HASIL DAN PEMBAHASAN
4.1. Isolasi Mikroba Endofit
Dari hasil isolasi diperoleh sebanyak 6 isolat bakteri endofit dari akar tanaman mentigi
(Vaccinium varingaefolium) yaitu, AW1, AW2, AW3, AW5, AW6, AW7.
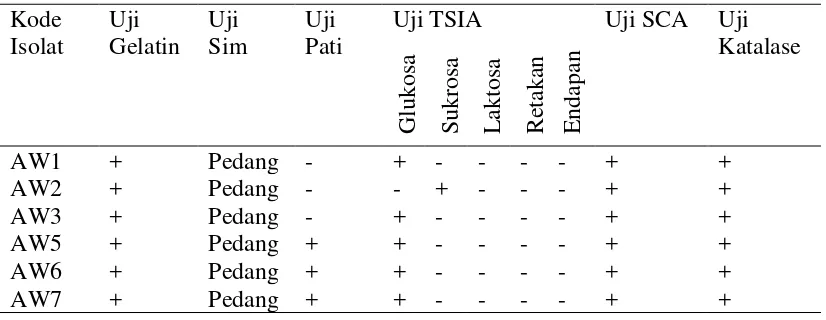
Selanjutnya dilakukan karakterisasi morfologi koloni bakteri. Berdasarkan pengamatan yang dilakukan dapat diketahui bahwa dari 6 isolat diperoleh 4 isolat Gram positif dan 2 isolat Gram negatif yang terlihat pada (Tabel 4.1.1 dan 4.1.2). Tabel 4.1.1. Karakterisasi morfologi koloni dan sel isolat bakteri endofit
Isolat Morfologi Koloni Morfologi Sel Pewrnaan
Gram Warna Bentuk Tepi Elevasi Bentuk Penataan
AW1 Krem Tidak
4.2. Kemampuan Antagonis Bakteri Endofit terhadap Fungi Patogen
Isolat bakteri AW1, AW2, AW3, AW5, AW6 dan AW7 digunakan pada asai antagonis. untuk melihat kemampuannya dalam menghambat pertumbuhan fungi patogen (Gambar 4.2.1). Fungi patogen yang digunakan F. oxysporum, G. boninense, R. microporus yang merupakan fungi patogen pada tanaman dan Saprolegnia sp. yang merupakan fungi patogen pada ikan.
Gambar 4.2.1. Uji antagonis isolat bakteri endofit terhadap fungi patogen (a) Isolat AW5 terhadap R. microporus, (b). Isolat AW6 terhadap R. microporus, (c). Isolat AW5 terhadap Saprolegnia sp., (d). Isolat AW5 terhadap F.
oxysporum dan (e). Isolat AW5 terhadap G. boninense.
Dari Gambar 4.2.1 dapat dilihat bahwa zona hambat dari hasil uji antagonis antara bakteri endofit dengan fungi patogen bervariasi. Pada Gambar 4.2.1 (a) merupakan zona hambat isolat bakteri endofit AW5 terhadap fungi R. microporus dengan zona hambat sebesar 40 mm. Pada Gambar 4.2.1(b) zona hambat bakteri endofit AW6 terhadap fungi
R. microporus dengan zona hambat sebesar 39 mm. Pada Gambar 4.2.1(c) merupakan
zona hambat isolat bakteri AW5 dalam menghambat Saprolegnia sp. dengan zona hambat sebesar 32 mm. Gambar 4.2.1 (d) merupakan zona hambat isolat bakteri AW5 dalam menghambat fungi F. oxysporum dengan zona hambat sebesar 22.5 mm dan Gambar (e) merupakan zona hambat isolat bakteri AW5 dalam menghambat fungi G. boninense dengan zona hambat sebesar 2.30 mm. Zona hambat yang dibentuk oleh masing masing isolat bakteri bervariasi dan memiliki zona hambat yang cukup besar terhadap fungi R.
micoporus, Saprolegnia sp. dan F. oxysporum yaitu berkisar antara 22.5 mm sampai
dengan 40 mm sedangkan zona hambat terhadap G. boninense sebesar 2.30 mm lebih kecil dibandingakan terhadap 3 fungi R. microporus, Saprolegnia sp. dan
F.oxysporum.(Tabel 4.2.1).
a
b
c
d
e
Tabel 4.2.1. Zona hambat uji antagonis sel bakteri dengan fungi patogen Isolat
bakteri
Fungi patogen Zona hambat (mm) hari ke
3 4 5 6
Dari Tabel 4.2.1 dapat dilihat bahwa zona hambat hasil uji antagonis dari masing masing isolat bakteri endofit terhadap fungi patogen bervariasi. Hal ini mungkin disebabkan karena bakteri endofit menghasilkan senyawa metabolit sekunder yang berbeda, selain itu juga konsentrasi zat bioaktif dan jenis zat yang dihasilkan berbeda
untuk pertahanan diri dan kompetisi dengan mikroba lain dalam mendapatkan nutrisi, habitat, oksigen dan lain-lain.
Mikroba khususnya bakteri memiliki kemampuan menghambat pertumbuhan mikroba lain disebabkan karena bakteri dapat menghasilkan senyawa metabolit sekunder seperti senyawa antibiotik (Wright et al., 2001), enzim pelisis (Zhang & Yuen, 2000; Kim
et al., 2008) dan protein penghambat lain (Berdy, 2005; Borodina et al., 2005; Lestari,
2001; Price et al., 1999). Pembentukan senyawa metabolit sekunder ini dikode oleh sejumlah gen yang terdapat pada DNA kromosom atau DNA plasmid (Demain, 1998). Ketika nutrisi mulai berkurang bakteri akan memasuki fase stasioner dan pada fase ini diduga terjadi pembentukan senyawa metabolit sekunder yang bersifat antifungi. Isolat bakteri yang diujikan menunjukkan kemampuan menghambat fungi patogen R.
microporus, Saprolegnia sp. dan F. oxysporum yang lebih besar dibandingkan dengan G.
boninense. Hal ini mungkin disebabkan karena pengaruh perbedaan dinding sel penyusun
dari fungi yang digunakan dalam uji antagonis.
Dinding sel fungi disusun dari komponen kitin. Kitin pada jamur berbentuk mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi selnya. Mikrofibril merupakan struktur utama dari struktur dinding sel jamur dan terdiri atas jalinan rantai-rantai polisakarida yang saling bersilangan membentuk anyaman. Jalinan ini kuat berikatan pada matriks. Kandungan kitin pada fungi bervariasi dari 4 – 9 % berat kering sel, tergantung spesies atau strain jamurnya (Rajarathnam et al., 1998). Kitin adalah komponen utama penyusun dinding sel jamur kelas Ascomycetes,
Basidiomycetes, dan Deuteromycetes. Pada dinding sel fungi Fusarium dari kelas
Deuteromycetes dijumpai sebanyak 39 % kitin dari berat kering sel (Griffin, 1981). Kitin
pada dinding sel jamur Fusarium sukar didegradasi karena dinding selnya dilapisi oleh protein dan lipid, yang menghalangi aktivitas enzim hidrolitik (Sivan & Chet, 1989).
Dari hasil uji antagonis bakteri endofit terhadap fungi patogen seperti yang terlihat pada tabel 4.2.1, bakteri yang memiliki zona hambat yang paling besar adalah bakteri
AW5 terhadap fungi Rigidoporus microporus sebesar 40 mm, dan bakteri AW6 memiliki zona hambat sebesar 39 mm. Zona hambat bakteri endofit terhadap Rigidoporus
microporus dapat terlihat mulai dari pengamatan hari ke-3, hal ini disebabkan oleh
adanya pertumbuhan hifa yang relatif cepat dari fungi tersebut. Pertumbuhan hifa yang cepat ini memicu isolat bakteri mensintesis metabolit sekunder, untuk bertahan terhadap infeksi fungi (Nofiani, 2008). Potensi bakteri endofit dalam menghambat pertumbuhan fungi telah banyak dilaporkan. Kasutjianingrat et al. (2001) melaporkan campuran dari dua rizobakteri (Bacillus subtilis SB3 dan Pseudomonas fluorecens ES32) yang dipalikasikan secara invitro pada planlet yang sudah berakar mampu menurunkan tingkat keparahan dari penyakit akibat dari fungi Fusarium oxysporum sampai kategori yang ringan. Isolat bakteri tersebut memiliki kemampuan antagonistik yang ditandai dengan adanya penghambatan miselium fungi patogen tanaman dan pada akhirnya pertumbuhan hifa menipis, mengering dan mengalami abnormalitas. (Tabel 4.2.1).
Tabel 4.2.2. Deskripsi gejala antagonis yang terjadi antara isolat fungi
Isolat Fungi Patogen Gejala Antagonis
AW1 R. microporus Pertumbuhan fungi patogen terhambat, hifa
bengkok
AW2 F. oxysporum Pertumbuhan fungi patogen terhambat,
kering, dan menipis
AW3 R. microporus Pertumbuhan fungi patogen terhambat
AW5 F. oxysporum
R. microporus G. boninense
Saprolegnia sp.
Pertumbuhan fungi patogen terhambat, hifa lisis, bengkok.
AW6 F. oxysporum
R. microporus G. boninense
Saprolegnia sp.
Pertumbuhan fungi patogen terhambat, hifa bengkok, menggulung dan lisis.
AW7 F. oxysporum Pertumbuhan fungi patogen terhambat, hifa
4.3. Asai Ekstrak Metanol, N-heksana dan Etil Asetat Bakteri Endofit
Dua isolat AW5 dan AW6 yang memiliki kemampuan menghambat paling besar selanjutnya digunakan untuk uji lanjut. Bakteri diekstrak dengan 3 jenis pelarut yang berbeda. Ekstraksi dilakukan dengan menggunakan pelarut metanol, etil asetat, dan n-heksana. Semua ekstrak bakteri menunjukkan kemampuan dalam menghambat pertumbuhan fungi patogen uji. Salah satu bentuk respon yang ditunjukkan bakteri adalah membentuk senyawa metabolit sekunder sebagai bentuk pertahanan terhadap serangan mikroba lain (Nofiani et al., 2009). Ekstrak sel dari isolat AW5 dan AW6 ini memiliki kemampuan dalam menghambat pertumbuhan fungi R. microporus, Saprolegnia sp., F.
oxysporum dan G. boninense dengan zona hambat yang berbeda beda dapat dilihat pada
Gambar 4.3.1.
Gambar 4.3.1 Kemampuan ekstrak metanol dalam menghambat pertumbuhan fungi patogen (a). Kontrol negatif G. boninense dengan DMSO (b). R.
microporus (c) Kontrol Positif Saprolegnia sp. dengan nistatin (d). F.
oxysporum
Aktivitas antifungi dari ekstrak bakteri menggunakan pelarut metanol, n-hexana dan etil
asetat tersebut menunjukkan hasil yang bervariasi dalam menghambat pertumbuhan beberapa fungi patogen, dapat dilihat pada Tabel 4.3.1.
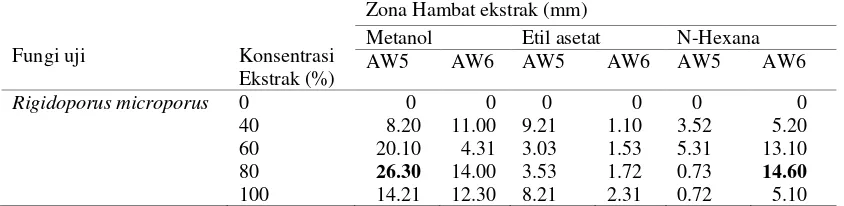
Tabel 4.3.1.Asai ekstrak dengan pelarut metanol, N-hexana dan Etil asetat
Fungi uji Konsentrasi
Ekstrak (%)
Zona Hambat ekstrak (mm)
Metanol Etil asetat N-Hexana
Saprolegnia sp. 0
Dari tabel di atas dapat dilihat bahwa ekstrak bakteri AW5 dan AW6 memiliki kemampuan dalam menghambat pertumbuhan fungi patogen tanaman. Kemampuan ekstrak bakteri bervariasi dalam membentuk zona hambat dari masing masing fungi patogen. Ekstrak metanol dari bakteri AW5 mampu menghambat R. microporus sebesar 26.30 mm pada konsentrasi 80% dan G. boninense 13.59 mm pada konsentrasi 40%. Ekstrak metanol dari bakteri AW6 mampu menghambat Saprolegnia sp. sebesar 21.21 mm pada konsentrasi 60% dan G. boninense sebesar 21.00 mm. Ekstrak etil asetat dari bakteri AW5 memiliki kemampuan dalam menghambat pertumbuhan fungi Saprolegnia sp. sebesar 12.30 mm pada konsentrasi 100% dan 11.20 mm pada konsentrasi 40%. Ekstrak etil asetat bakteri AW6 memiliki kemampuan menghambat fungi Saprolegnia sp. sebesar 13.10 mm pada konsentrasi 60% dan 14.60 mm pada konsentrasi 80%. Ekstrak n- heksana bakteri AW5 mampu menghambat Saprolegnia sp. sebesar 15.13 mm dan 10.20 mm pada konsentrasi 60% dan 80%. Ekstrak n-heksana bakteri AW6 memilki kemampuan menghambat fungi Saprolegnia sp. sebesar 19.71 mm pada konsentrasi 60%
dan R. microporus sebesar 14.60 mm pada konsentrasi 80%.
Koloni R. microporus mengalami penghambatan pertumbuhan yang ditandai dengan adanya cekungan di bagian tengah koloni fungi. Ekstrak metanol dari AW5 memiliki kemampuan yang besar dalam menghambat pertumbuhan R. microporus,
berturut-turut 26,30 mm, 13,77 mm, 12 mm dan 13,59 mm. Hal ini mungkin karena pelarut metanol dapat melarutkan senyawa polar dan non polar yang merupakan metabolit sekunder dari bakteri tersebut sehingga rendemen yan paling besar jika dibandingkan dengan pelarut etil asetat dan n-heksana. Hal ini dikarenakan kelarutan zat pada suatu pelarut sangat ditentukan oleh kemampuan zat tersebut membentuk ikatan (Lenny, 2006).
Koloni G. boninense mengalami penghambatan pertumbuhan disekitar cakram yang berisi ekstrak metanol fungi yang mengakibatkan koloni G. boninense bentuknya tidak bulat lagi seperti bentuk normal. Penghambatan pertumbuhan juga terjadi pada koloni F. oxysporum di sekitar cakram yang berisi ekstrak metanol fungi yang mengakibatkan bentuk koloni F. oxysporum berbentuk segi empat. Interaksi bakteri dengan F. oxysporum menyebabkan abnormalitas pada hifa fungi dibandingkan dengan hifa fungi yamg normal, seperti membengkok dan melilit. Abnormalitas ini disebabkan karena bakteri antifungi menghasilkan senyawa yang dapat menghambat atau merusak struktur dari dinding sel hifa fungi sehingga akan mempengaruhi pertumbuhan fungi patogen secara keseluruhan. Kondisi yang abnormal pada hifa F. oxysporum seperti hifa memiliki septa yang pendek, mengalami pembengkakan, percabangan, hifa yang transparan dan ada pembengkakan hifa yang tidak merata serta ujung hifa yang meruncing karena nekrosis karena terjadi kematian (Adriansyah, 2002).
Besarnya zona hambat melebihi kontrol positif dengan antibiotik nistatin yang merupakan antibiotik yang komersil menunjukkan adanya potensi dari isolat untuk diteliti dan dikembangkan lebih lanjut untuk diisolasi senyawa metabolit sekunder berupa antimikroba atau mungkin antibiotik yang dihasilkan sehingga diharapkan dapat memberikan solusi untuk masalah resistensi. Adanya variasi besar zona hambat yang diperoleh mungkin disebabkan oleh perbedaan sifat yang dimiliki bakteri uji yang digunakan baik secara morfologi dan fisiologi. Selain itu, juga disebabkan oleh senyawa metabolit sekunder yang dihasilkan oleh masing-masing isolat memiliki struktur kimia, komposisi dan kandungan/konsentrasi yang berbeda dengan antibiotik kontrol (Dharmawan et al., 2009).
Dari hasil pengujian terhadap perlakuan pelarut, isolat dan konsentrasi dapat dilihat bahwa dari ketiga jenis ekstrak memiliki kemampuan yang berbeda beda dalam menghambat pertumbuhan fungi patogen. Semua pengujian menggunakan ekstrak, metanol menunjukkan spektrum yang lebih luas dalam menghambat fungi uji dibandingakan etil asetat dan n-heksana. Dari semua mikroba uji yang digunakan, R.
microporus merupakan fungi yang paling peka terhadap semua jenis ekstrak. Perbedaan
efektifitas ekstrak dalam menghambat mikroba uji kemungkinan disebabkan oleh perbedaan kelarutan senyawa aktif yang terkandung terhadap ketiga jenis pelarut. Adanya perbedaan polaritas antara senyawa aktif yang terkandung dengan pelarut yang digunakan untuk mengekstrak senyawa tersebut menyebabkan perbedaan efektisitas ekstrak yang dihasilkan. Berdasarkan penelitian lain disebutkan bahwa metanol merupakan pelarut yang baik digunakan dalam metode ekstraksi suatu bahan, metanol juga menghasilkan rendemen yang lebih besar jumlahnya dibandingkan pelarut lain (Ahameethunisa & Hopper, 2010; Khyade & Vaikos, 2009). Di samping itu, penambahan atau penggunaan metanol pada saat maserasi akan menyebabkan pH ekstra sel menurun dan akan meningkatkan konsentrasi proton di dalam sel (Purwoko, 2007). Konsekuensinya terjadi
akumulasi proton di dalam sel yang dapat menyebabkan lisisnya sel sehingga senyawa metabolit yang ada berdifusi ke pelarut dan memperbesar kemungkinan ekstrak yang diperoleh lebih banyak.
4.4. Pengamatan Mikroskopik Hifa Abnormal Fungi Patogen
Pengaruh ekstrak bakteri terhadap pertumbuhan hifa fungi G. boninense F. oxysporum,
R. microporus dan Saprolegnia sp. diamati di bawah mikroskop dengan perbesaran
banyak (Getha & Vikineswary, 2002), dan penurunan produksi spora (Bivi et al., 2010; Bakri, 2009).
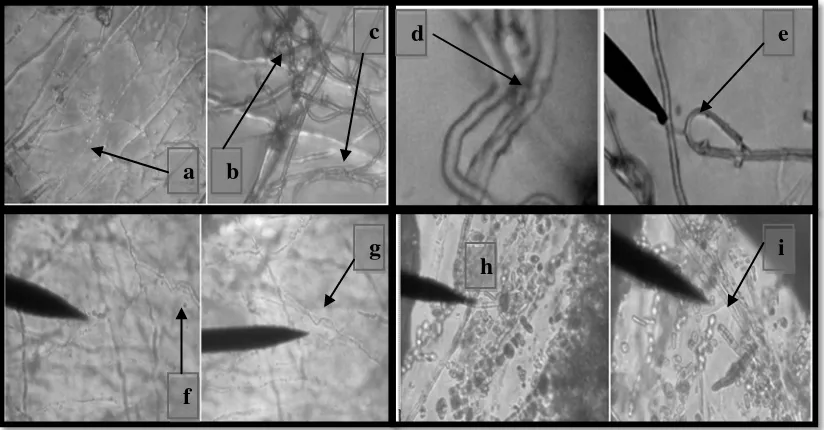
Gambar. 4.4.1. Hifa abnormal fungi R. microporus (a). Hifa lisis, (b). Hifa menggulung. Hifa abnormal fungi G. boninense, (c). Hifa bengkok, (d). Hifa menggulung. Hifa abnormal fungi F. oxysporum, (e). Hifa lisis, (f) dan (g) Hifa bengkok. Hifa fungi Saprolegnia sp., (h). Hifa mengecil dan (i). Hifa lisis.
Dari Gambar 4.4.1 dapat dilihat perubahan hifa R. microporus, G. boninense dan
F. oxysporum dan Saprolegnia sp. yang terjadi akibat interaksi antara ekstrak bakteri
dengan fungi patogen. Adanya aktivitas antagonisme yang kuat dari ekstrak bakteri dengan mekanisme hiperparasitisme dan antibiotik sehingga efektif menghambat pertumbuhan fungi patogen tanaman dengan mendegradasi dinding selnya. Hifa fungi patogen mengalami lisis, menggulung, mengecil dan bengok. Lisis pada hifa menunjukkan bahwa ekstrak bakteri mampu menghidrolisis dinding sel R.
microporus, F. oxysporum dan Saprolegnia sp. (Simbolon, 2008). Hifa fungi patogen
yang kerdil diduga sebagai mekanisme pertahanan dari patogen terhadap serangan isolat.
Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai
a b
c d e
h g
f
i
akibat koevolusi atau transfer genetik dari tanaman inangnya ke dalam mikroba endofit Taxol, suatu senyawa diterpenoid yang merupakan agen anti kanker merupakan salah satu contoh metabolit sekunder yang dihasilkan oleh bakteri endofit (Tan et al., 2001). Produksi senyawa bioaktif tertentu oleh mikroba endofit secara in situ mungkin memfasilitasi dominansinya dalam jaringan tanaman atau bahkan melindungi tanaman tersebut dari serangan patogen (Prasetyoputri & Atmosukarto, 2006).
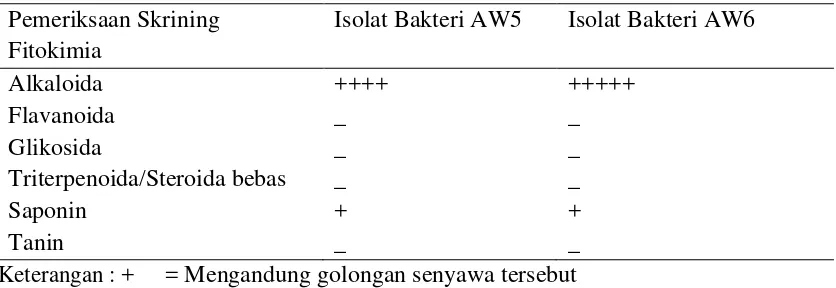
4.5. Deteksi Kandungan Senyawa Antifungi Dari Ekstrak Metanol Bakteri Endofit
Hasil analisis kandungan senyawa antifungi dari ekstrak metanol bakteri AW5 dan AW6 yang memiliki zona hambat terbesar menunjukkan bahwa bakteri AW5 dan AW6 menghasilkan senyawa alkaloid dan saponin (Tabel 4.4.1). Berbagai macam aktivitas fisiologi yang menarik ditunjukkan oleh beberapa senyawa alkaloid bekerja sebagai antifungi. Beberapa saponin bekerja sebagai antimikroba (Robinson, 1995). Bakteri endofit menghasilkan alkaloid dan mikotoksin sehingga memungkinkan digunakan untuk meningkatkan ketahanan tanaman terhadap penyakit (Sudhanta & Abadi, 2007). Bakteri endofit menghasilkan senyawa aktif biologis secara in-vitro antara lain alkaloid, paxillin, lolitrems dan tetranone steroid. Endofit dapat menjadi sumber berbagai metabolit sekunder baru yang berpotensi untuk dikembangkan dalam bidang medis, pertanian dan industri (Prasetyoputri & Atmosukarto, 2006).
Tabel 4.5.1. Hasil skrining senyawa ekstrak metanol bakteri AW5 dan AW6
Pemeriksaan Skrining Fitokimia
Isolat Bakteri AW5 Isolat Bakteri AW6
Alkaloida ++++ +++++
Flavanoida _ _
Glikosida _ _
Triterpenoida/Steroida bebas _ _
Saponin + +
Tanin _ _
Dari tabel di atas dapat dilihat bahwa hasil skrining senyawa ekstrak metanol bakteri mengandung positif uji alkaloid dan positif saponin. Saponin dapat merusak membran sitoplasma yang kemungkinan saponin mempunyai efek yang sinergis atau adiktif dengan golongan polifenol dalam merusak permeabilitas sel bakteri itu sendiri. Saponin adalah kemampuan pembetukan busa dari suatu ekstrak tanaman. Kadar saponin
yang tinggi dalam tanaman membuat ekstrak alkohol sukar pekat. Saponin merupakan zat aktif yang dapat meningkatkan permeabilitas membran sehingga terjadi hemolisis sel. Apabila saponin berinteraksi dengan sel bakteri, bakteri tersebut akan rusak atau lisis (Poeloengan et al., 2010).
Senyawa alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran. Darwis (2001), menyatakan bahwa Alkaloid adalah golongan senyawa basa bernitrogen yang kebanyakan heterosiklik yang banyak terdapat pada tanaman. Mekanisme bahan aktif antibakteri ini adalah merusak membran sel bakteri dengan meningkatkan permeabilitas dari dinding sel bakteri sehingga bakteri lisis (Kurniawati, 2006).Flavonoid merupakan kelompok senyawa fenol yang mempunyai kecenderungan untuk mengikat protein, sehingga mengganggu proses metabolisme.
Semua alkaloid mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa. Alkaloid biasanya dalam kadar kecil dan harus dipisahkan dari campuran senyawa yang rumit yang berasal dari bagian tanaman (Lenny, 2006). Alkaloid secara umum dikenal memiliki antimikrobial yang kuat, serta dapat sebagai antibakteri dan
antifungi. Beberapa studi melaporkan bahwa alkaloid setelah diuji memiliki peran sebagai anitimikroba terhadap mikroorganisme gram positif diantaranya Bacillus subtilis,
Streptococcus aureus, Mycobacterium smegmatits, Eischerecia colii, Pseudomonas
aeruginosa, Candida albicans dan Aspergilus niger (Aniszewski, 2007).
Alkaloid adalah senyawa nitrogen heterosiklik. Salah satu contoh alkaloid yang bermanfaat di bidang medis adalah morfin yang diisolasi tahun 1805. Alkaloid
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian yang telah dilakukan dapat disimpulkan sebagai berikut:
1. Diperoleh 6 isolat bakteri endofit yaitu AW1, AW2, AW3, AW5, AW6 dan AW7 dari tumbuhan mentigi (V. varingaefolium) yang memiliki potensi dalam menghambat 4 jenis jamur patogen tanaman.
2. Isolat AW5 dan AW6 memiliki kemampuan yang paling besar dalam menghambat
pertumbuhan jamur R. microporus, Saprolegnia sp., G. boninense dan F. oxysporum. 3. Ekstrak metanol dari bakteri AW5 dan AW6 memiliki kemampuan yang lebih besar
dan juga memiliki kisaran yang luas dalam menghambat jamur patogen dibandingkan estrak etil asetat dan n-heksana.
4. Kandungan senyawa kimia bakteri dalam pelarut metanol adalah alkaloid dan saponin.
5.2Saran
Perlu dilakukan identifikasi lebih lanjut mengenai kandungan senyawa metabolit sekunder yang terdapat pada ekstrak sehingga memiliki kemampuan antimikroba dan penggunakan pelarut lain untuk memperoleh ekstrak yang lebih baik lagi.
DAFTAR PUSTAKA
Adriansyah, A. 2002. Uji Metabolit Sekunder Trichoderma sp. sebagai Antimikrobia Patogen Tanaman (Fusarium oxysporum) secara In Vitro. Skripsi. ITB. Bandung.
Ahameethunisa, A.R dan Hopper, W. 2010. Antibacterial Activity of Artemisia nilagirica Leaf Extracts Against Clinical and Phytopathogenic Bacteria. Research Article.
Akbar, J. 2008. Pemanfaatan Ekstrak Bunga Kecombrang (Nicolaia spesiosa Horan) Terhadap Penyembuhan Infeksi Jamur Saprolegnia sp. Pada Ikan Nila Merah. 2008. Kalimantan Scientiae. 71: 26.
Aniszewski, T. 2007. Alkaloids Secret of Life Alkaloid Chemistry, Biological Significance, Apllication and Ecological Role. Ist Ed. Elseveir. UK. 155-156p. Athman, S.Y. 2006. Host Endophyte Pest Interactions of Endophytic Fusarium
Oxysporum Antagonistic to Radopholus similis in Banana (Musa spp.).
University of Pretoria : South Africa.
Baker, K.F dan Cook, R.J. 1974. The Nature dan Practice of Biological Control of Plant Pathogens. 3rd Edition: The American Phytopathology Society.
Bakri, M. 2009. Isolasi dan Uji Kemampuan Antifungal Fungi Endofit dari Tanaman Andaliman (Zanthoxylum acanthopodium DC.) Terhadap Fungi Perusak Makanan. Skripsi. USU. Medan.
Berdy, J. 2005. Bioactive Microbial Metabolites. Riview Article. J Antibiot 58: 1-26.
Bivi, M.R., Farhana, M.S.N., Khairulmazmi, A dan Idris, A. 2010. Control of Ganoderma
boninense: A causal Agent of Basal Stem Root Disease in Oil Palm with
EndophyteBacteria In Vitro. Int J Agric Biol 12: 833-839.
Borodina, I., Krabben, P dan Nielsen, J. 2005. Genome Scale Analysis of Streptomyces
coelicolor A3(2) Metabolism. Genome Research.15: 820-829.
Chatarina, T.S. 2012. Strategi Pengelolaan untuk Memperkecil Serangan Jamur Akar Putih (Rigidoporus microporus) pada Perkebunan Jambu Mente. Ganec Swara. 6: 69-73.
Cheng, F.R dan Peter, F.S. 2009. Vaccinium. Flora of China Vol. 14. Published by Science Press (Beijing) and Missouri Botanical Garden Press. 476 P.p.
Cook, R.J dan Baker, K.F. 1983. The Nature of Practice of Biological Control of Plant Pathogens. The APS Press, St. Paul, Minnesota. 53 Pp.
Darwis, D. 2001. Teknik Isolasi dan Karakterisasi Senyawa Metabolit Sekunder, Workshop Peningkatan Sumber Daya Manusia Untuk Pemanfaatan Sumber Daya Alam Hayati dan Rekayasa Bioteknologi, FMIPA Universitas Andalas Padang.
Dharmawan, I.W.E., Kawuri, R dan Parwanayoni, M.S. 2009. Isolasi Streptomyces spp. pada kawasan hutan Provinsi Bali serta uji daya hambatnya terhadap lima strain diarrheagenic Escherichia coli. Jurnal Biologi 13: 1-6.
De Cal A. Garcia Lepe R and Melgarejo P. 2000. Induced Resistance by Penicillium
oxalicum against F. oxysporum f.sp. lycopersici. Histological Studies of Infected
and Induced Tomato Stem. Phytopathol. 90: 260-268.
Demain, A.L. 1998. Induction of Microbial Secondary Metabolism. Review Article. Int
Microbiol 1: 259-264.
Farid, A.H., Lee, S.S., Maziah, Z dan Patanayah, M. 2009. Pathogenicity of Rigidoporus
microporus and Phellinus noxius againts four major plantation tree species in
Peninsular Malaysia. Journal of Tropical Forest Science. 21: 289-298.
Getha, K dan Vikineswary, S. 2002. Antagonistic Effects of Streptomyces violaceusniger Strain G10 on Fusarium oxysporum f.sp. cubense race 4: Indirect Evidence for the Role of Antibiosis in the Antagonistic Process. J Ind Microbiol Biotechnol 28: 303–310.
Griffin, D. H. 1981. Fungal Physiology. John Wiley and Sons, New York.
Hallmann, J., Quadt, A., Hallmann, W., Miller, G., Sikora, R.A dan Lindow, S.E. 2001. Endophytic Colonization of Plants by the Biocontrol Agent Rhizobium etli G12 in Relation to Meloidogyne incognita Infection. Phytopath. 91:415-422.
Harborne, J. 1996. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Cetakan kedua. Penerjemah: Padmawinata, K. dan Soediro, K. Bandung: Penerbit ITB.
Hastuti, A.E. 2000. Sebaran Penyakit Akar Putih (Rigidoporus microporus (Swatz) Van Ov.) pada Tanaman Teh (Camellia sinensis (L) O. Kuntze) di Lapangan dan Eksplorasi Beberapa Cendawan Antagonis. Skripsi. IPB. Jurusan hama dan penyakit tumbuhan.
Khyade, M.S dan Vaikos, N.P. 2009. Phytochemical and antibacterial properties of leaves
of Alstonia sholaris R. Br. Afr J Biotechnol 8: 6434-6436.
Kloepper, J.W., Rodriguez-Kabana., Zehnder, R., Murphy, G.W., Sikora, J dan Fernandez, C. 1999. Plant root -bacterial interactions in biological control of soilborne diseases and potential extension to systemic and foliar diseases.
Austral Plant Pathol 28: 27-33.
Kulsuntiwong, P., Chomvarin, C., Chaicumpar, K., Namwat, W., Kaewkes, W., Mairiang, P dan Sangchan, A. 2008. Antimicrobial Susceptibility Of Helicobacter Pylori Isolated From Gastric Biopsies In Dyspeptic Patients. S. J Trop Med Public
Health. 39: 1102-1109.
Kurniawati, D. 2006. Perbandingan Potensi Antibakteri Ekstrak Air dengan Ekstrak Etanol Daun Kelor (Moringa oleifera) terhadap Pertumbuhan Bakteri
Pseudomonas aeruginosa NN-1-PKH secara In Vitro.
2013.
Lechevalier, A. 2000. Screening for New Antibiotic Procedures: The selection of wild
strains. In The Future of Antibiotherapy and Antibiotic Research. Ed.
Academic Press. Sydney.
Lenny, S. 2006. Senyawa Flavonoida Fenilpropanoida dan Alkaloida, Karya Ilmiah. Dipublikasikan, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
Lestari, Y. 2001. Ekologi dan Keragaman Hayati Bakteri Penghasilnya. Pelatihan Mikrobiologi, Dosen-Dosen Perguruan Tinggi Negeri Se-Jawa dan Bali. Jurusan Biologi FMIPA IPB. Dirjen Perguruan Tinggi. Departemen Pendidikan Nasional.
Lingga, R. 2013. Keragaman Jamur Endofit Pada Mentigi (Vaccinium varingaefolium) Di Kawah Gunung Sinabung Sumatera Utara. Tesis Megister Biologi Departement Biologi FMIPA USU. Medan.
Mess, J.J, Wit R. Testerink, C.S, de Groot F, Haring, M.A and Cornelissen, B.J.B. 1999. Loss of Avirulent and Reduced Pathogenecity of a Gamma-irradiated Mutant of
Fusariumoxysporum f.sp. lycopersici. Phytopathol. 89: 1131-1137.
Miller, S.A, Rowe, R.C and Riedel, R.M. 2004. Fusarium and Verticillium Wilts of
Tomato,Potato, Pepper, and Eggplant. The Ohio State University Extention,
Plant Pathology.
Mishra, K.K., Srivastava, S., Garg, A dan Ayyagari, A. 2006. Antibiotic Susceptibility of
Helicobacter pylori Clinical isolates: Comparative Evaluation of
Disk-Diffusion and E-test Methods. Cur Microbiol 53: 329-334.
Naim, R, 2004. Senyawa Antimikroba dari Tanaman.
Nasir, A., Muhammad, P., Sudjino dan Purnomo. 1994. Pengaruh Gas Belerang dari kawah-kawah di Dataran Tinggi Dieng terhadap Struktur Vegetasi dan Fisiologi Tumbuhan Dominan di Sekitar Kawah. E- Journal. Universitas Gadjah Mada.
Nofiani, R., Nurbetty, S dan Sapar, A. 2008. Aktifitas Antimikroba Ekstrak Metanol Bakteri Berasosiasi Spons dari Pulau Lemukutan, Kalimantan Barat. E-Journal
dan Teknologi kelautan Tropis. 1: 33-41.
Noga, E.J. 2000. Fish Disease Diagnosis and Treatment. Iowa State Press. A Blackwell Publishing Company.
Ploetz, R.C. 1994. Banana: Compendium of Tropical Fruit Disease. Minnesota: The American Phytopathology Society Press.
Poeloengan, Masniari dan Praptiwi. 2010. Uji Aktivitas Antibakteri Ekstrak Kulit Buah Manggis (Garnicia mangostana Linn), http://digilib.litbang.depkes .go.id /files/disk1/74/jkpkbppk-gdl-grey-2011-masniaripo-3692-manggism-i.pdf.
Diakses 26 Juli 2013.
Price, B., Adamidis T., Kong., R dan Champness, W. 1999. Streptomyces coelicolor antibiotic regulatory gene, absB, encodes an RNase III homolog. J Bacteriol 181: 6142–6151.
Procopio, R.E.L., Araujo, W., Maccheroni, Jr dan Azevedo, J.L. 2009. Characterization of an Endophytic Bacterial Community Associated with Eucalyptus spp. Genet
Mol Res 8: 1408-1422.
Prasetyoputri, A dan Atmosukarto, I, 2006. Mikroba endofit. Bio Trends: Pusat penelitian
Bioteknologi – LIPI. Cibinong. 1: 13-15.
Prasetyo J, Aeny TN, Suharjo R. 2009. The correlations between white root (Rigidoporus
lignosus L.) incidence and soil characters of rubber ecosystem in Penumangan
Baru, Lampung. J HPT Tropika. 9: 149-157.
Purwoko, T. 2007. Fisiologi Mikroba. Edisi 1. Bumi Aksara, Jakarta.
Radji, M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian. 2: 118-121.
Rajarathanam, S., M. N. J. Shashirekha and Z. Bano. 1998. Biodegradative and Biosinthetic Capacities of Mushrooms : Present and Future Strategies. Crit.
Rev. in Biotechnol. 18 : 91 – 236.
Radu, S dan Kqueen, C.Y. 2002. Preliminary Screening of Endophytic Fungi from Medicinal Plants in Malaysia for Antimicrobial and Antitumor Activity.
Malaysian Journal of Medical Science, 9: 23-33.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Penerjemah: Padmawinata, K. Edisi IV.Bandung: ITB Press.
Semangun, H. 1994. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Yogyakarta: Gadjah Mada University Press.Yogyakarta.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Cetakan keempat. Gadjah Mada University Press. Yogyakarta.
Semangun, H. 2008. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Cetakan kelima. Gadjah Mada University Press. Yogyakarta.
Simbolon, D.N. 2008. Kemampuan Antifungi Bakteri Endofit Kelapa Sawit (Elaeis
guineensis jacq.) Terhadap Ganoderma boninenese pat. Skripsi. Departemen
Biologi FMIPA USU. Medan.
Sivan, A and I. Chet. 1989. Degradation of Fungal Cell Walls by Lytic Enzymes of
Trichoderma harzianum. J. Gen. Microbiol. 135 : 675 – 682.
Strobel, G.A and Daisy, B. 2003. Bioprospecting for Microbial Endophytes and their Natural Products. Microbiol and Mol Biol. 491-502.
Suryanto, D., Siti K.N. and Erman M. 2012. Antimicrobial Activity of Some Bacterial Isolates natural Recreational Park of North Sumatera, Indonesia. Bulletin of Envi
Phar and Life Sci.1: 1-7.
Suryanto, D dan Erman M. 2006. Potensi isolat bakteri kitinolitik lokal untuk pengendalian hayati jamur. Prosiding Seminar Hasil-Hasil Penelitian USU 2006. Medan : 15-25.
Soesanto, L, Rokhlani dan Nur P. 2008. Beberapa Mikroorganisme Antagonis Terhadap Penyakit Layu fusarium gladiol. Agrivita. 30:76-83.
Susanna. 2000. Analisis Keefektifan Mikroorganisme Antagonis dalam Mengendalikan
Fusarium oxysporum f.sp. cubense pada Pisang (Musa sapientum L.). Tesis.
Program Pascasarjana. Bogor: IPB.
P.S dan Purba
Tan, R.X dan Zou, W.X. 2001. Endophytes: A Rich of Functional Metabolites. Nat Prod Rep. 18: 448-459.
Webster, J dan Weber, R.W. S. 2007. Introduction to Fungi. Edisi ke-3. USA: Cambridge University Press.
Wright, S.A., Zumoff, C.H., Schneider, L dan Beer, S.V. 2001. Pantoea agglomerans strainn Eh318 Produces Two Antibiotics that Inhibit Erwinia amylovora in vitro.
ApplEnviron Microbiol 67: 284-292.
Zhang, Z and Yuen, G.Y. 2000. Effects of Culture Fluids and Preinduction of Chitinase Production on Biocontrol of Bipolaris lLeaf Spot by
Stenotrophomonas maltophilia C3. Biol Contr 18: 277–286.
Lampiran : 1
Isolasi Bakteri Endofit pada tanaman V. varingaefolium
Tanaman Vaccinium varingaefolium
Diambil bagian akar tanaman Dicuci (menghilangkan kotoran) Dimasukkan ke dalam plastik
Dimasukkan ke dalam termos yang berisi es
Sampel Akar
Dibawa ke laboratorium
Dicuci dengan air mengalir selama 20 menit
Disterilisasi permukaan akar dengan merendam dilarutan alkohol 75 % selama 2 menit
Direndam dengan larutan sodium hipoklorit 5,3% selama 5 menit
Direndam dengan larutan etanol 75 % selama 30 detik Dibilas dengan aquades steril
Akar steril
Dikeringkan dengan tisu
Dipotongkan ujung kanan dan kiri akar Dipotong membujur/dibelah
Diletakkan permukaan dalam akar ke permukaan media NA + Ketokonozal 0,3 g /100 ml
Diinkubasi selama 5 hari pada suhu ruang 30 °C
Koloni bakteri endofit
Disubkultur pada media NA untuk dimurnikan