Lampiran 1. Gambar bahan yang digunakan beserta kandungannya a. Intralipid20%
Intralipid20% mengandung minyak kedelai yang dimurnikan 20%, fosfolipid yang dimurnikan 1.2%, gliserin 2.2%, natrium hidroksida untuk mengatur pH ±8 dan air untuk injeksi.
b. Larutan natrium klorida 0,9% (PT. Widatra Bhakti)
Setiap 500 ml, larutan mengandung 4,5 g natrium klorida (NaCl) dan air untuk injeksi sampai 500 ml dengan osmolaritas 308 mOsm/L yang setara dengan ion natrium (Na+) 154 mEq/L dan klorida (Cl-) 154 mEq/L.
c. Larutan Ringer (PT. Widatra Bhakti)
Lampiran 2. Perhitungan laju tetes bahan yang digunakan a. Laju tetes Intralipid 20%
Menurut ISO Volume 48, dikatakan bahwa dosis injeksi intravena untuk Intralipid 20% adalah 2 g/kg BB/hari.
Dengan anggapan pasien yang menerima Intralipidmempunyai berat badan dewasa yang normal yaitu 70 kg dan dalam 100 mL sediaan mengandung 20 gram minyak kedelai, maka
Dosis = 2 g/kg BB/hari x 70 kg = 140 g/hari
=140 g
20 g x 100 mL/hari = 700 mL/ hari
= 700 mL/ (24 x 60) menit = 0.49 mL/menit
= 9.8 tetes/menit = 10 tetes/ menit
b. Dari perhitungan ini, perlu diketahui bahwa 1 tetes membutuhkan 0,1 menit atau 6 detik. Jadi, laju tetes dari Intralipid 20% adalah 1 tetes dalam 6 detik. c. Laju tetes larutan natrium klorida 0,9%
Menurut ISO Volume 48, dikatakan bahwa dosis injeksi intravena untuk larutan natrium klorida 0,9% adalah 60 tetes/70 kg BB/menit.
Dengan anggapan pasien yang menerima larutan natrium klorida 0,9% mempunyai berat badan dewasa yang normal yaitu 70 kg, maka
Lampiran 2 (Lanjutan) d. Laju tetes larutan Ringer
Menurut ISO Volume 48, dikatakan bahwa dosis injeksi intravena untuk larutan Ringer adalah 120-180 tetes/70 kg BB/menit.
Dengan anggapan pasien yang menerima larutan Ringer mempunyai berat badan dewasa yang normal yaitu 70 kg, maka
Dosis = 120-180 tetes/70 kg BB/menit x 70 kg = 120-180 tetes/menit
= 120-180 tetes/60 detik = 2-3 tetes/detik
e. Laju tetes sediaan campuran Intralipid20% dan larutan elektrolit
Lampiran 3. Flowsheet pencampuran Intralipid20% dan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) dalam satu wadah
12,5 mL Intralipid 20% 12,5 mL larutan elektrolit (larutan natrium klorida atau larutan ringer)
Sediaan campuran
Diuji stabilitas fisik (tipe emulsi, pH, pengamatan globul lemak secara visual, pengamatan globul lemak
secara mikroskopik dan ukuran globul lemak)
Dimasukkan ke dalam satu wadah
Lampiran 4. Flowsheet pencampuran Intralipid20% dan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) melalui
three-way stopcock
12,5 mL Intralipid20% 25 mL larutan elektrolit (infus larutan natrium klorida atau larutan
i )
Ditampung hasilnya dalam botol
Sediaan campuran
Diuji stabilitas fisik (tipe emulsi, pH, pengamatan globul lemak secara visual, pengamatan globul
lemak secara mikroskopik dan ukuran globul Larutan elektrolit yang
Lampiran 8. Data ukuran globul lemak Intralipid20% dan infus larutan natrium klorida 0,9% yang dicampurkan dalam satu wadah (0 jam)
Size (nm) Intensity
Lampiran 9. Data ukuran globul lemak Intralipid20% dan infus larutan natrium klorida 0,9% yang dicampurkan dalam satu wadah (12 jam)
Lampiran 10Data ukuran globul lemak Intralipid20% dan infus larutan natrium klorida 0,9% yang dicampurkan dalam satu wadah (24 jam)
Lampiran 11. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan dalam satu wadah (0 jam)
Size (nm) Intensity
Lampiran 12. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan dalam satu wadah (12 jam)
Lampiran 13. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan dalam satu wadah (24 jam)
Size (nm) Intensity
Lampiran 14. Data ukuran globul lemak Intralipid20% dan infus larutan natrium klorida 0,9% yang dicampurkan melalui three-waystopcock(0 jam)
Size (nm) Intensity
Lampiran 17. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan melalui three-waystopcock(0 jam)
Lampiran 18. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan melalui three-way stopcock (12 jam)
Size (nm) Intensity
Lampiran 19. Data ukuran globul lemak Intralipid20% dan larutan Ringer yang dicampurkan melalui three-way stopcock (24 jam)
Lampiran 20. Perhitungan kekuatan ionik
Kekuatan ionik dapat dihitung dengan menggunakan rumus berikut. �= 1
2 (�1 �1
2 + �2 �22+ �3�32+ … + � � ��2
Dimana µ adalah kekuatan ionik, C1 adalah konsentrasi dalam mol/L dari berbagai ion dan z1 adalah valensi.
a. Infus larutan natrium klorida 0,9%
Larutan ini mengandung Na+ 154 mEq/L dan Cl- 154 mEq/L. Perhitungan konsentrasi Na+
mg Na+ = mEq x BM/valensi = 154 x 23/1
= 3542 mg/L mg = n x BM 3542 = n x 23 n = 154 mmol/L n = 0,154 mol/L Perhitungan konsentrasi Cl -mg Cl- = mEq x BM/valensi
Lampiran 20. (Lanjutan)
Perhitungan kekuatan ionik infus larutan natrium klorida 0,9%
�= 1 2 (�1 �1
2 + �2 �22+ �3�32+ … + � � ��2
= ½ [(0,154 x 12) + (0,154 x 12)] = 0,154
b. Larutan Ringer
Larutan ini mengandung Na+ 147,1 mEq/L, K+ 4 mEq/L, Ca2+ 4,5 mEq/L dan Cl- 155,6 mEq/L.
Perhitungan konsentrasi Na+ mg Na+ = mEq x BM/valensi
= 147,1 x 23/1 = 3383,3 mg/L mg = n x BM 3383,3 = n x 23
n = 147,1 mmol/L n = 0,1471 mol/L Perhitungan konsentrasi K+ mg K+ = mEq x BM/valensi
Lampiran 20. (Lanjutan)
Perhitungan konsentrasi Ca2+ mg Ca2+ = mEq x BM/valensi
= 4,5 x 40/2 = 90 mg/L mg = n x BM 90 = n x 40 n = 2,25 mmol/L n = 0,00225 mol/L Perhitungan konsentrasi Cl -mg Cl- = mEq x BM/valensi
= 155,6 x 35,5/1 = 5523,8 mg/L mg = n x BM 5523,8 = n x 35,5 n = 155,6 mmol/L n = 0,1556 mol/L
Perhitungan kekuatan ionik larutan Ringer
�= 1 2 (�1 �1
2 + �2 �22+ �3�32+ … + � � ��2
Lampiran 21. Gambar pengukuran pH sediaan
a. pH awal
b. Pengukuran pH Intralipid20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah (P2)
Intralipid 20%
Infus larutan natrium
Lampiran 21. (Lanjutan)
c. Pengukuran pH Intralipid20% yang dicampur dengan larutan Ringer dalam satu wadah (P3)
Lampiran 21. (Lanjutan)
e. Pengukuran pH Intralipid20% yang dicampur dengan larutan Ringer melalui
Lampiran 22.Gambar alat a. Tiang infus
b. Infus set
c. Penggantung botol pada tiang infus
Lampiran 22. (Lanjutan) e. Jarum suntik (syringe)
f. Three-way stopcock
g. Vial
h. Kaca pembesar
Lampiran 22. (Lanjutan) j. Pipet tetes
k. Mikroskop digital
l. Particle size analyzer
DAFTAR PUSTAKA
Agoes, G. (2009). Sediaan Farmasi Steril. Bandung: Penerbit ITB. Halaman 193-194.
Akpan, U., Oshie,C., Akpan, J., dan Fidelis, A. (2013). Comparative Effect of Carbimazole, Glycine Max and Citrus Sinensis on Serum Electrolytes and Urea. Research Journal of Pharmaceutical, Biological and Chemical
Sciences. 4(2): 395-404.
Ansel, H.C., Allen, L.V., dan Popovich, N.G. (2011). Ansel’s Pharmaceutical
Dosage Forms and Drug Delivery Systems. Edisi 9. China: Lippincott
Williams & Wilkins. Halaman 394, 396-397 dan 403-404.
Ansel, H.C., dan Prince, S.J. (2004). Kalkulasi Farmasetik. Jakarta: EGC. Halaman 163.
Atkinson, M., dan Worthley, L.I.G. (2003). Nutrition in the Critically Ill Patient: Part I. Essential Physiology and Pathophysiology. Critical Care and
Resuscitation. 5: 109-120.
Bach, A.C., Storck, D., dan Meraihi, Z. (1988). Medium-Chain Triglyceride-Based Fat Emulsions: An Alternative Energy Supply in Stress and Sepsis. JPEN J Parenter Enteral Nutr.12(6): 82-88.
Baker, M.T., dan Naguib, M. (2005). Propofol-The Challenges of Formulation. American Society of Anesthesiologists. 103(4): 860-876.
Banaszkiewicz, T. (1997). Nutritional Value of Soybean Meal. Poland: Sieldce University. Halaman 5.
Banker, G.S., dan Rhodes, C.T. (2002). Modern Pharmaceutics. Edisi IV. USA: Marcel Dekker, Inc. Halaman 271.
Barret, K.E., Barman, S.M., Boitano, S., dan Brooks, H.L. (2010). Ganong’s
Review of Medical Physiology. Edisi XXIII. US: The McGraw-Hill
Companies, Inc. Halaman 2.
Bartlett, D. (2014). Intravenous Lipids : Antidotal Therapy for Drug Overdose and Toxic Effects of Local Anesthetics. Critical Care Nurse. 34(5): 62-66. Bentley, J., Heard, K., Collins, G., dan Chung, C. (2015). Mixing Medicines :
How to ensure patient safety. http://www.pharmaceutical-journal.com. (6
Maret 2016).
Bergman, H.D. (1977). Incompatibilities in Large Volume Parenterals. The Ann of
Bertsche, T., Mayer, Y., Stahl, R., Hoppe-Tichy, T., Enckle, J., dan Haefeli, W.E. (2008). Prevention of Intravenous Drug Incompatibilities in an Intensive Care Unit. AJHP. 65(19): 1834-1840.
Braun, B. (2016). Drug Incompatibility. http://www.bbraun.lv. (6 Maret 2016). Brust, M., Schaefer, C., Doerr, R., Pan, L., Garcia, M., Arratia, P.E., dan Wagner,
C. (2013). Rheology of Human Blood Plasma: Viscoelastic Versus Newtonian Behaviour. American Physical Society. 110(7): 1-5.
Burgess, D.J. (2005). Injectable Dispersed Systems. USA: Taylor & Francis Group. Halaman 101, 213, 223, 218-219.
Calder, P.C., Jensen, G.L., Koletzko, B.V., Singer, P., dan Wanten, G.J.A. (2010). Lipid Emulsions in Parenteral Nutrition of Intensive Care Patients : Current Thinking and Future Directions. Intensive Care Med. 36: 735-749.
Cannon, B.J, Shi, Y., dan Gupta, P. (2008). Emulsions, microemulsions, and lipid-based drug delivery systems for drug solubilization and delivery-Part I: parenteral applications. Dalam buku Water-Insoluble Drug Formulation. Editor Rong, L. New York : Taylor & Francisp. Halaman 195–197.
Carpentier, Y.A., dan Dupont, I.E. (2000). Advances in Intravenous Lipid Emulsion. Journal of Surgery. 24(12): 1493-1497.
Channon, H.J. (1926). The Biological Significance of the Unsaponifiable Matter
of Oils. London: University College. Halaman 400-408.
Chowdary, K.V.R., dan Reddy, P.N. (2010). Parenteral Nutrition : Revisited.
Indian J Anaesth. 54(2): 95-103.
Clayton, P.T., Bowron, A., Mills, K.A., Massoud, A., Casteels, M., dan Milla, P.J. (1993). Phytosterolemia in Children With Parenteral Nutrition-Associated Cholestatic Liver Disease. Gastroenterology. 105(6): 1806-1813.
Collins-Gold, L.C., Lyons, R.T., dan Et Bartholow, L.C. (1990). Parenteral Emulsions for Drug Delivery. Adv Drug Deliv Rev. 5(3): 189-208.
Cocchio, C., Geib, A.J., dan Rynn, K.O. (2014). Physiochemical Stability of Intravenous Fat Emulsion in Combination with Medications Used for Resuscitation. SOJ Pharm PharmSci. 1(1): 1-3.
DAA. (2011). Parenteral Nutrition Manual for Adults in Health Care Facilities. Australia: Dietitians Association of Australia. Halaman 9-13.
Duerksen, D., dan McCurdy, K. (2005). Essential Fatty Acid Deficiency in A Severely Malnourished Patient Receiving Parenteral Nutrition. Digestive
Diseases and Sciences. 50(12): 2386-2388.
Driscoll, D.F., Etzler, F., Barber, T.A., Nehne, J., Niemann, W., dan Bistrian, B.R. (2001). Physicochemical Assessments of Parenteral Lipid Emulsions : Light Obscuration versus Laser Diffraction. Int J Pharm. 219(1-2): 21-37.
Driscoll, D.F., Giampietro, K., Wichelhaus, D.P., Peterss, H., Nehne, J., Niemann, W., dan Bistrian, B.R. (2001). Physicochemical Stability Assessments of Lipid Emulsions of Varying Oil Composition. Clinical Nutrition. 20(2): 151-157.
ESPGHAN. (2005). Iron, Minerals and Trace Elements. Journal of Pediatric
Gastroenterology and Nutrition. 41: 39-46.
FDA. (2007). Intralipid®20%. http://www.accessdata.fda.gov. (11 April 2016).
Fell, G.L., Nandivada, P., Gura, K.M., dan Puder, M. (2015). Intravenous Lipid Emulsion in Parenteral Nutrition. Adv Nutr. 6: 600-610.
Felton, L.A. (2013). Remington Essentials of Pharmaceutics. USA: Pharmaceutical Press. Halaman 384, 847.
Filomeno, L.T., Carelli, C.R., Figueiredo da Silvia, N.C.L., Pessoa de Barros Filho, T.E., dan Amatuzzi, M.M. (2005). Fat Embolism: A review for Current Orthopaedics Practice. Acta Ortop Bras. 13(4): 196-208.
Florence, A.T., dan Gregoriadis, G. (1998). Submicron Emulsions in Drug
Targetting and Delivery. Singapore: Harwood Academic Publishers.
Halaman 123.
Floyd, A.G. (1999). Top Ten Considerations in The Development of Parenteral Emulsions. PSTT. 2(4): 134-143.
Foinard, A.M., Simon, N., Barthelemy, C., Lannoy, Decaudin, B., dan Odou, P. (2013). Drug Incompatibilities: A Problem in Clinical Practice. http://www.hospitalpharmacyeurope.com. (6 Maret 2016).
Fϋrst, P., dan Kuhn, K.S. (2000). Fish Oil Emulsions : What Benefits Can They Bring? Clinical Nutrition. 19(1): 7-14.
Gargasz, A. (2012). Neonatal and Pediatric Parenteral Nutrition. American
Association of Critical-Care Nurses. 23(4): 451-464.
Gikic, Di Paolo, E.R., Pannatier, A., dan Cotting, J. (2000). Evaluation of Physicochemical Incompatibilities During Parenteral Drug Administration in a Paediatric Intensive Care Unit. Pharm World Sci. 22(3): 88-91.
Goldburg, W.L. (1999). Dynamic Light Scattering. Am J Phys. 67(12): 1152-1160.
Green, J.H., dan Macdonald, I. (1981). The Influence of Intravenous Glucose on Body Temperature. Quaterly Journal of Experimental Physiology. 66: 465-473.
Hansrani, P.K., Davis, S.S., dan Groves, M.J. (1983). The Preparation and Properties of Sterile Intravenous Emulsions. J Parenter Sci Technol.
37(4): 145–50.
Herman, C.J., dan Groves, M.J. (1992). Hydrolysis Kinetics of Phospholipids in Thermally Stressed Intravenous Lipid Emulsion Formulations. J Pharm
Pharmacol. 44(7): 539-542.
Hippalgaonkar, K., Majumdar, S., dan Kansara,V. (2010). Injectable Lipid Emulsions-Advancements, Opportunities and Challenges. American
Association of Pharmaceutical Scientists PharmSciTech. 11(4):
1526-1540.
Holman, S.R. (1987). Essentials of Nutrition. Pennysylvania: J. B. Lippincott Company. Halaman 348-351.
Horiba. (2010). A Guidebook to Particle Size Analysis. http://www.horiba.com. (4 April 2016).
Innis, S.M. (2002). Lipids in Parenteral Nutrition. Neoreviews. 3(3): 48-55.
Innocente, N., Biasutti, M., Venir, E., Spaziani, M., dan Marchesini, G. (2009). Effect of High Pressure Homogenization on Droplet Size Distribution and Rheological Properties of Ice Cream Mixes. J Dairy Sci. 92(5): 1864– 1875.
Iriart, C.H., Cerimedo, M.S.A., Candal, R.J., dan Herrera, M.L. (2011). Structures and stability of lipid emulsions formulated with sodium caseinate. Curr.
Opin. Colloid Interface Sci. 16(5): 412–420.
Isaacs, J.W., Millikan, W.J., Stackhouse, J., Hersh, T., dan Rudman, D. (1977). Parenteral nutrition of adults with a 900 milliosmolar solution via peripheral veins. Am J Clin Nutr. 30: 552-559.
Jauch, K.W., Schregel, W., Stanga, Z., Bischoff, S.C., Braẞ, P., Hartl, W., Muehlebach, S., Pscheidi, E., Thul, P., dan Volk, O. (2009). Access technique and its problems in parenteral nutrition-Guidelines on Parenteral Nutrition, Chapter 9. German Medical Science. 7: 1-18.
Johnson, R.C., Young, S.K., Cotter, R., Lin, L., dan Rowe, W.B. (1990). Medium-Chain-Triglyceride Lipid Emulsion : Metabolism and Tissue Distribution.
Am J Clin Nutr. 52(3): 502-508.
Karasulu, H.Y., Karasulu, E., Bϋyϋkhelvacigil, M., Yildiz, M., Ertugrul, A., Bϋyϋkhelvacigil, K., Ustϋn, Z., dan Gazel, N. (2013). Soybean Oil :
Production Process, Benefits and Uses in Pharmaceutical Dosage Form.
Turkey: University of Ege. Halaman 283 dan 285.
Keenoy, B.M.Y., Nonneman, L., De Boscher, H., Vertommen, J., Schrans, S., Klϋtch, K., dan De Leeuw, I. (2002). Effects of intravenous supplementation with atocopherol in patients receiving total parenteral nutrition containing medium- and long-chain triglycerides. European
Journal of Clinical Nutrition. 56: 121-128.
Kemken, J., Ziegler, A., dan Mϋller, B.W. (1992). Influence of Supersaturation on the Pharmacodynamic Effect of Bupranolol After Dermal Administration Using Microemulsions as Vehicle. Pharm Res. 9(4): 554-558.
Kriwet, K., dan Müller-Goymann, C.C. (1995). Diclofenac Release from Phospho-lipid Drug Systems and Permeation Through Excised Human Stratum Corneum. Int J Pharm. 125: 231-242.
Krzywda, E.A., Andris, D.A., Edmiston, C.E., dan Wallace, J.R. (2001). Parenteral Access Devices. Dalam buku The Science and Practice of
Nutrition Support. Editor ASPEN. USA: American Society for Parenteral
and Enteral Nutrition. Halaman 257.
Kumpf, V.J. (2006). Parenteral Nutrition Associated Liver Disease in Adult and Pediatric Patients. Nutr Clin Pract. 21: 279–290.
Langley, C.A., dan Belcher, D. (2008). Pharmaceutical Compounding and
Dispensing. Great Britain: Pharmaceutical Press. Halaman 66.
Li, J., Wang, X., Zhang, T., Wang, C., Huang, Z., Luo, X., dan Deng, Y. (2015). A Review on Phospholipids and Their Main Applications in Drug Delivery Systems. Asian Journal of Pharmaceutical Sciences. 10: 81-98.
Martin, A.N. (2011). Martin’s Physical Pharmacy and Pharmaceutical Sciences. China: Lippincott Williams& Wilkins. Halaman 420-424, 427.
McClements, D.J., dan Rao, J. (2011). Food-grade nanoemulsions: formulation, fabrication, properties, performance, biological fate, and potential toxicity. Critical Reviews in Food Science and Nutrition. 51: 285-330.
McMurry, J. (2008). Organic Chemistry. Edisi VII. USA: Thomson Learning, Inc. Halaman 35-36, 57.
Medsafe. (2007). Product Information. http://www.medsafe.govt.nz. (11 April 2016).
Medsafe. (2014). Glucose Injection. http://www.medsafe.govt.nz. (11 April 2016).
Mestres, G.M., dan Nielloud, F. (2002). Emulsions in Health Care Applications-An Overview. Journal of Dispersion Science and Technology. 23(1-3): 419-439.
Miles, J.M. (1993). Lipid Fuel Metabolism in Health and Disease. Curr Opin Gen
Surg. 78–84.
Mirković, D., Ibrić, S., dan Antunović, M. (2013). Quality Assesessment of Total
Parenteral Nutrition Admixtures by the Use of Fractional Factorial Design.
Vojnosanit Pregl. 70(4): 374-379.
Mishra, R.J., Soni, G.C., dan Mishra, R.P. (2014). A Review Article : On Nanoemulsion. World Journal of Pharmacy and Pharmaceutical Sciences. 3(9): 258-274.
Moynihan, H.A., dan Crean, A.M. (2009). The Physicochemical Basis of
Pharmaceuticals. Italy: Oxford University Press. Halaman 163.
Nagaraju, A., Deepak, S., Aruna, C., Swathi, K., Reddy, P., Devi, S., dan Purushothaman, M. (2015). Assessment of Intravenous Admixtures Incompatibilities & The Incidence of Intravenous Drug Administration Errors. World Journal of Pharmacy and Pharmaceutical Sciences. 4(8): 1227-1236.
NCCU. (2011). Injectable Medication Guideline/ TPN and Lipid Compatibility
Information. http://www.kemh.health.wa.gov.au. (6 Maret 2016).
Payne-James, J.J., dan Khawaja, H.T. (1993). First choice for total parenteral nutrition: the peripheral route. J Parent Ent Nutrition, 17: 468.
Pravina, P., Sayaji, D., dan Avinash, M. (2013). Calcium and its Role in Human Body. International Journal of Research in Pharmaceutical and Biomedical
Sciences. 4(2): 659-667.
Radermacher, P., Santak, B., Strobach, H., Schror, K., dan Tarnow, J. (1992). Fat emulsions containing medium chain triglycerides in patients with sepsis syndrome: effects on pulmonary hemodynamics and gas exchange. Intensive Care Med. 18: 231-234.
Riskesdas. (2010). Laporan Hasil Riset Kesehatan Dasar. Jakarta: Badan Penelitian dan Pengembangan Kesehatan. Halaman 23.
Roland, I., Piel, G., Dellatre, L., dan Evrard, B. (2003). Systematic Characterization of Oil-in-Water Emulsions for Formulation Design.
International Journal of Pharmaceutics. 263(1-2): 85-94.
Rossi, J., dan Leroux, J.C. (2006). Principles in the Development of Intravenous Lipid Emulsions. Dalam buku Role of Lipid Excipients in Modifying Oral and Parenteral Drug Delivery. Editor Wasan, K.M. New York: Wiley. Halaman 88-123.
Rowe, R.C., Sheskey, P.J., dan Quinn, M.E. (2009). Handbook of Pharmaceutical
Excipients. Edisi VI. USA: Pharmaceutical Press. Halaman 385, 499 dan
501.
Sacks, G.S. (2004). Drug-Nutrient Considerations in Patients Receiving Parenteral and Enteral Nutrition. Practical Gastroenterology. 19: 39-48.
Scales, K. (2005). Vascular Access : A Guide to Peripheral Venous Cannulation. Nursing Standard. 19(49): 48-52.
Schuh, R.S., Bruxel, F., dan Teixera, H.F. (2014). Physicochemical Properties of Lecithin-Based Nanoemulsions Obtained by Spontaneous Emulsification or High-Pressure Homogenization. Quim. Nova. 37(7): 1193-1198.
Schroder, A.M. (2008). Total parenteral nutrition - Problems in compatibility and stability.Ejhp Practice. 14(1): 65-67.
Scoville, W.L. (2013). The Art of Compounding, A Textbook for Students and A
Reference Book for Pharmacists, At the Prescription Counter. Philadelphia:
P. Blakiston’s Son & Co. Halaman 273.
Seidner, D.L., Mascioli, E.A., Istfan, N.W., Porter, K.A., Selleck, K., Blackburn, G.L., Seleck, K., Blackburn, G.L., dan Bistrian, R.R. (1989). Effects of Long-Chain Triglyceride Emulsions on Reticulothelial System Function in Humans. JPEN J Parenter Enteral Nutr. 13(6): 614-9.
Singh, P.K., Iqubal, M.K., Shukla, V.K., dan Shuaib, M. (2014). Microemulsions : Current Trends in Novel Drug Delivery Systems. Journal of
Pharmaceutical, Chemical and Biological Sciences. 1(1): 39-51.
SPX. (2008). Intravenous Emulsions. http://www.spxflow.com/en/assets/pdf/PB-Intravenous_Emulsion_3052_US_tcm11-7630.pdf. (2 Januari 2016).
Sulastri, D., Keswani, R.R. (2009). Pengaruh Pemberian Isoflavon terhadap Jumlah Eritrosit dan Aktivitas Enzim Katalase Tikus yang Dipapar Sinar Ultraviolet. Majalah Kedokteran Andalas. 33(2): 171-178.
Tattrie, N.H. (1959). Positional Distribution of Saturated and Unsaturated Fatty Acids on Egg Lecithin. J. Lipid Research. 1(1): 60-65.
Templeton, A., Schlegel, M., Fleisch, F., Rottenmund, G., Schobi, B., Hens, S., dan Eich, G. (2008). Multilumen Central Venous Catheters Increase Risk for Catheter-Related Bloodstream Infection: Prospective Surveillance Study. Infection. 36(4): 322-327.
Trissel, L.A., Gilbert, D.L., Martinez, J.F., Baker, M.B., Walter, W.V., dan Mirtallo, J.M. (1999). Compatibility of Medications with 3-in-1 Parenteral Nutrition Admixtures. JPEN J Parenter Enteral Nutr. 23(2): 67-74.
Ulrich, H., Pastores, S.M., Katz, D.P., dan Kvetan, V. (1996). Parenteral Use of Medium-Chain Triglycerides: A Reappraisal. Nutrition. 12(4): 231-238. UNS/SCN. (2005). Nutrition Information inCrisis Situations Report n° 6
Summary. http://www.who.int. (11 April 2016).
USP. (2012). The United States Pharmacopeia. Edisi XXXVI. US: The United States Pharmacopeial Convention. Halaman 321-323; 4124-4125.
Vaessen, G.E.J., Vissachers, M., dan Stein, H.N. (1996). Predicting Catastrophic Phase Inversion on the Basis of Droplet Coalescence Kinetics. American
Chemical Society. 12(4): 875-882.
Verma, P., Thakur, A.S., Deshmukh, K., Jha, A.K., dan Verma, S. (2010). Routes of Administration. International Journal of Pharmaceutical Studies and
Research. 1(1): 54-59.
Waitzberg.D.L., Torrinhas, R.S., dan Jacintho, T.M. (2006). New Parenteral Emulsions for Clinical Use. Journal of Parenteral and Enteral Nutrition. 30(4): 351-367.
Washington, C., dan Davis, S. S. (1988). The Production of Parenteral Feeding Emulsions by Microfluidizer. Int J Pharm. 44(1-3): 169–176.
Wermuth, C.G., Aldous, D., Raboisson, P., dan Rognan, D. (2015). The Practise
of Medicinal Chemistry. Edisi IV. USA: Elsevier. Halaman 716.
Wiącek, A.E. (2015). Effect of Phospholipid and (Phospho)lipase Modification on Interfacial Properties of Oil/Water Emulsion. Umcschem. 52(1): 79-109.
BAB III
METODOLOGI PENELITIAN
3.1 Metode Penelitian
Metode penelitian ini dilakukan secara eksperimental yaitu melihat pengaruh larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) terhadap stabilitas fisik sediaan emulsi lemak intravena (Intralipid 20%). Penelitian ini meliputi pencampuran larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) dan sediaan emulsi lemak intravena (Intralipid 20%) dalam satu wadah atau melalui three-way stopcock, pengujian tipe emulsi, pemeriksaan pH, pemeriksaan globul lemak secara visual, pemeriksaan globul lemak secara mikroskopik dan pemeriksaan ukuran partikel. Penelitian ini dilaksanakan di laboratorium Farmasi Fisik dan laboratorium Farmakologi Fakultas Farmasi Universitas Sumatera Utara.
3.2 Alat
Alat-alat yang digunakanadalah vial, infus-set, botol kaca, three-way
stopcock, kaca pembesar, tiang infus, gelas objek, penunjuk waktu (stopwatch),
deck-glass, pipet tetes, batang pengaduk, spuit, mikroskop digital (Boeco), pH
meter (eco testr) dan particle size analyzer (Vascoγ).
3.3 Bahan
3.4 Penyiapan Tiang Infus
Tiang infus dibuat dari kayu dan penggantungnya berupa baut yang dapat mengait. Tiang infus ini dirancang identik dengan tiang infus yang terdapat pada rumah sakit dengan tujuan sediaan yang akan diberikan secara intravena dapat digantung.
Gambar 3.1 Sketsa pembuatan tiang infus 3.5 Prosedur Kerja
3.5.1 Pencampuran dalam satu wadah
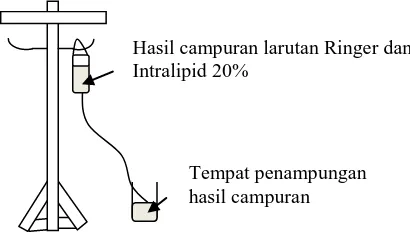
3.5.1.1 Pencampuran infus larutan natrium klorida 0,9% dan Intralipid 20% Infus larutan natrium klorida 0,9% dicampur ke dalam Intralipid 20% menggunakan rasio 1:1 (12,5 mL : 12,5 mL) pada suhu kamar. Hasil pencampuran dihubungkan dengan infus-set dan dijalankan dengan laju alir 1 tetes/ 6 detik (mengikuti laju tetes Intralipid 20%) dan ditampung pada botol kaca kemudian dievaluasi stabilitas fisik campuran berupa pengujian tipe emulsi, pemeriksaan pH, pemeriksaan globul lemak secara visual, pemeriksaan globul lemak secara mikroskopik dan pemeriksaan ukuran globul lemak sediaan campuran. Perhitungan laju tetes dapat dilihat pada Lampiran 2.
3.5.1.2 Pencampuran larutan Ringer dan Intralipid 20%
Gambar 3.2 Sketsa pencampuran infus larutan natrium klorida 0,9% dan Intralipid 20% dalam satu wadah
Gambar 3.3 Sketsa pencampuran larutan Ringer dan Intralipid 20% dalam satu wadah
3.5.2 Pencampuran melalui three-waystopcock
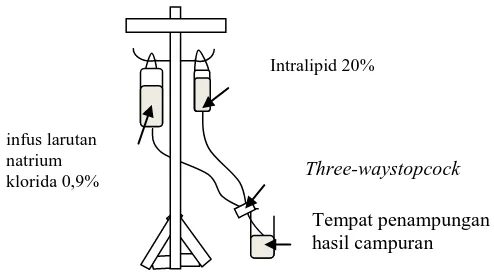
Pencampuran melalui three-waystopcock dilakukan orientasi dengan rasio 1:1 dan diamati bahwa laju tetesan infus larutan natrium klorida 0,9% (1 tetes/ detik) dan larutan Ringer (2 tetes/detik) lebih cepat daripada laju tetesan Intralipid 20% (1 tetes/ 6 detik) sehingga larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) dialirkan terlebih dahulu sehingga tidak dapat diamati interaksi intralipid 20% dan larutan elektrolit. Oleh sebab itu, volume larutan elektrolit dinaikkan sehingga perbandingan Intralipid 20% dan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) menjadi 1:2.
3.5.2.1 Pencampuran infus larutan natrium klorida 0,9% dan Intralipid 20% Intralipid 20% dicampur dengan infus larutan natrium klorida 0,9% melalui three-waystopcockdengan rasio 1:2 (12,5 ml : 25 ml) pada suhu kamar,
Hasil campuran infus larutan natrium klorida 0,9% dan Intralipid 20%
Tempat penampungan hasil campuran
Hasil campuran larutan Ringer dan Intralipid 20%
laju alir untuk infus natrium klorida 0,9% adalah 1 tetes/ detik sedangkan Intralipid 20% dijalankan dengan laju alir 1 tetes/ 6 detik. Kedua infus set kemudian dihubungkan pada three-waystopcockdan hasilnya ditampung pada botol kaca kemudian dievaluasi stabilitas fisik campuran berupa pengujian tipe emulsi, pemeriksaan pH, pemeriksaan globul lemak secara visual, pemeriksaan globul lemak secara mikroskopik dan pemeriksaan ukuran globul lemak sediaan campuran. Perhitungan laju tetesan dapat dilihat pada Lampiran 2.
3.5.2.2 Pencampuran larutan Ringer dan Intralipid 20%
Intralipid 20% dicampur dengan larutan Ringer melalui three-waystopcock dengan rasio dan cara yang sesuai dengan metode 3.5.2.1 diatas. Larutan Ringer dijalankan dengan laju 2 tetes/ detik.
Gambar 3.4 Sketsa pencampuran infus larutan natrium klorida 0,9% dan Intralipid 20% melalui three-way stopcock
Gambar 3.5 Sketsa pencampuran larutan Ringer dan Intralipid 20% melaluithree-way stopcock
Intralipid 20%
infus larutan natrium
klorida 0,9% Three-waystopcock
Three-waystopcock Larutan
ringer
Intralipid 20%
Tempat penampungan hasil campuran
3.5.3 Evaluasi stabilitas fisik hasil pencampuran larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) dengan Intralipid 20% dalam satu wadah atau melalui three-waystopcock
3.5.3.1 Pengujian tipe emulsi
Satu tetes emulsi hasil pencampuran diletakkan pada gelas objek kemudian ditambahkan satu tetes pewarna larut air seperti metilen biru. Setelah itu, campuran emulsi dan metilen biru dihomogenkan dengan batang pengaduk dan ditutupi dengan gelas objek lainnya. Jika air adalah fase luarnya (contoh tipe emulsi m/a), pewarna akan larut dan secara seragam berdifusi diseluruh air. Jika emulsi adalah tipe a/m, partikel dari pewarna akan menggumpal pada bagian permukaan (Martin, 2011).
3.5.3.2 Pemeriksaan pH
Penentuan pH campuran dilakukan dengan menggunakan alat pH meter. Alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar netral (pH 7,01) dan larutan dapar asam (pH 4,01) hingga alat menunjukkan harga pH tersebut. Kemudian elektroda dicuci dengan akuades, kemudian dikeringkan dengan kertas tisu. Setelah itu, elektroda dicelupkan ke dalam larutan yang akan diuji. Dibiarkan alat hingga menunjukkan nilai pH sampai konstan. Angka yang ditunjukkan merupakan pH sediaan. Pengujian pH sediaan campuran dilakukan sebanyak 3 kali kemudian dirata-ratakan.
3.5.3.3 Pemeriksaan globul lemak secara visual
Apabila globul lemak terbentuk sebelum redispersi dan setelah redispersi globul lemak tidak terbentuk lagi maka sediaan campuran dikatakan mengalami flokulasi.
3.5.3.4 Pemeriksaan globul lemak secara mikroskopik
Pemeriksaan globul lemak secara mikroskopik dilakukan dengan mikroskop digital. Sebelum mikroskop digital digunakan, lensa objektif dibersihkan terlebih dahulu dengan tisu lensa. Proses selanjutnya adalah menghubungkan mikroskop digital dan komputer pada sumber listrik. Salah satu lensa okuler mikroskop diganti dengan kamera digital untuk mikroskop. Untuk mengamati morfologi globul lemak, sampel yang terdapat pada vial diredispersi dan kemudian diambil satu tetes sediaan campuran untuk diletakkan pada gelas objek dan kemudian ditutupi dengan deck glass. Setelah persiapan sampel, gelas objek diletakkan diatas meja preparat dan diamati morfologi globul lemak dengan perbesaran 10x. Morfologi globul lemak juga diproyeksikan ke layar komputer dan untuk dokumentasi, dapat dilakukan pemotetran dari slide yang sudah disiapkan. Dari hasil ini, dapat diamati globul lemak secara mikroskopik setelah pencampuran selama waktu tertentu yaitu 0, 20, 40, 60 menit, 3, 6, 12 dan 24 jam. 3.5.3.5 Pemeriksaan ukuran globul lemak
Ukuran globul lemak hasil pencampuran diperiksa dengan particle size
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pencampuran Intralipid 20% dan Larutan Elektrolit (Infus Larutan Natrium Klorida 0,9% atau Larutan Ringer) dalam Satu Wadah
Intralipid 20% berupa emulsi berwarna putih seperti susu. Setelah dicampur dengan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) tidak terjadi perubahan warna.
4.2 Pencampuran Intralipid 20% dan Larutan Elektrolit (Infus Larutan Natrium Klorida 0,9% atau Larutan Ringer) melalui Three-wayStopcock
Hasil pencampuran Intralipid 20% dan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) melalui three-way stopcock juga berupa emulsi berwarna putih seperti susu.
4.3 Evaluasi Stabilitas Fisik Hasil Pencampuran Larutan Elektrolit (Infus Larutan Natrium Klorida 0,9% atau Larutan Ringer) dengan Intralipid 20% dalam Satu Wadah atau melalui Three-wayStopcock 4.3.1 Penentuan tipe emulsi
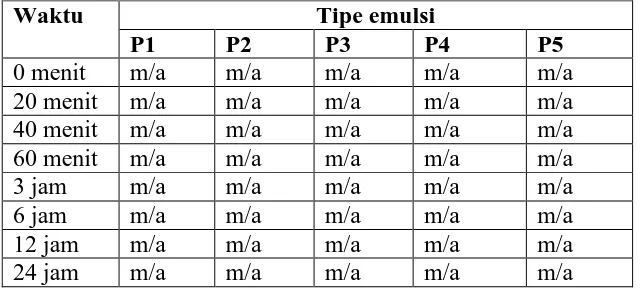
Hasil uji tipe emulsi dilakukan dengan menambahkan metilen biru pada emulsi yang dapat dilihat pada Gambar 4.1 dan Tabel 4.1.
Tabel 4.1 Hasil penentuan tipe emulsi sediaan campuran
Waktu Tipe emulsi
Gambar 4.1 Hasil penentuan tipe emulsi Keterangan:
P1 : Intralipid20%
P2 : Intralipid20% dicampur infus natrium klorida 0,9% (1:1) dalam 1 wadah P3 : Intralipid20% dicampur larutan Ringer (1:1) dalam 1 wadah
P4 : Intralipid 20% dicampur infus natrium klorida 0,9% (1:2) melalui three-way
stopcock
P5 : Intralipid 20% dicampur larutan Ringer (1:2) melalui three-way stopcock Dari pengujian yang dilakukan, sediaan campuran tidak mengalami perubahan fase. Tipe emulsi berupa tipe m/a karena sewaktu sediaan emulsi dicampur dengan metilen biru, pewarnanya larut dan secara seragam berdifusi diseluruh air. Emulsi tipe m/a umumnya digunakan untuk pemberian secara parenteralkarena darah mengandung suspensi sel-sel darah dalam larutan plasma yang banyak mengandung air sehingga sediaan emulsi parenteral tipe m/a lebih mudah larut dengan cairan yang terdapat di dalam darah (Mestres dan Nielloud, 2002; Verma, et al., 2010; Brust, et al., 2013).
Penampilan fisik menunjukkan bahwa selama 24 jam, Intralipid20% yang dicampur dengan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) menunjukkan proses koalesensi. Akan tetapi proses tersebut tidak menyebabkan inversi fase. Hal ini disebabkan oleh bahan pengemulsi terlarut didalam fase pendispersi yang menyebabkan inversi fase sulit terjadi untuk rasio volume yang tinggi (Vaessen, et al., 1996). Bahan pengemulsi yang digunakan
dalam Intralipid 20% adalah fosfolipid yang dimurnikan dimana sebagian besarnya mengandung lesitin yang bersifat larut dalam pelarut nonpolar. Akan tetapi, apabila lesitin dicampurkan dengan air, lesitin terhidrasi dan membentuk emulsi. Fosfolipid yang bercampur dengan air cenderung mengembang dan membentuk struktur bilayer (Rowe, et al., 2009). Dengan kata lain, bahan pengemulsi bersifat larut didalam air.
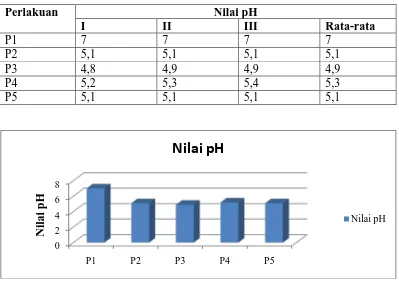
4.3.2 Penentuan pH sediaan campuran
Penentuan pH sediaan campurandilihat pada Tabel 4.2 dan Gambar 4.2a. Tabel 4.2 Hasil pengukuran pH sediaan campuran
Perlakuan Nilai pH
I II III Rata-rata
Gambar 4.2a Pengaruh infus larutan natrium klorida 0,9% ataularutan Ringer terhadap nilai pH intralipid20% dalam pencampuran satu wadah atau melalui three-way stopcock
Keterangan:
P1 : Intralipid20%
P2 : Intralipid20% dicampur infus natrium klorida 0,9% (1:1) dalam 1 wadah P3 : Intralipid20% dicampur larutan Ringer (1:1) dalam 1 wadah
P4 : Intralipid 20% dicampur infus natrium klorida 0,9% (1:2) melalui three-
way stopcock
P5 : Intralipid 20% dicampur larutan Ringer (1:2) melalui three- way stopcock
Dari Gambar 4.2a dapat diamati bahwa terjadi penurunan pH pada Intralipid20% yang dicampur dengan infus larutan natrium klorida 0,9% atau larutan Ringer dalam satu wadah atau melalui three-waystopcock. Penurunan pH yang lebih rendah terjadi pada pencampuran satu wadah dan pada campuran yang mengandung kalsium (P3 dan P5).
pH sediaan blanko P1 adalah 7 dan persyaratan pH emulsi lemak intravena pada USP XXXVI adalah 6-9. Oleh sebab itu, pH Intralipid 20% (P1) masih memasuki rentang yang tertera pada USP XXXVI. pH pada campuran P2, P3, P4 dan P5 mempunyai nilai lebih rendah daripada P1 dan nilai pH terendah ditunjukkan oleh P3 yaitu 4,9. Nilai pH yang rendah disebabkan oleh pengaruh elektronegativitas ion yang terdapat pada infus natrium klorida 0,9% (Na+ dan Cl-) serta larutan Ringer (Na+, K+, Ca2+ dan Cl-).Kation monovalen (Na+ dan K+) berikatan dengan gugus fosfat dari fosfatidilkolin dan kation multivalen (Ca2+) mengadsorbsi bagian hidrofilik dari molekul fosfolipid. Ikatan ion tersebut mengurangi potensial zeta (Wiącek, 2015). Ion lainnya yang tidak berinteraksi dengan droplet fosfolipid adalah Cl-. Menurut tabel periodik,elektronegativitas Cl -(3) lebih tinggi daripada elektronegativitas Na+ (0,9), K+ (0,8), Ca2+ (1). Semakin elektronegatif suatu ion, ion tersebut berperan sebagai aseptor elektron. Pengertian asam menurut teori Lewis adalah suatu zat yang menerima (aseptor) pasangan elektron (McMurry, 2008). Berdasarkan teori di atas, semakin banyak Cl- yang bebas pada larutan, semakin asam suatu larutan.
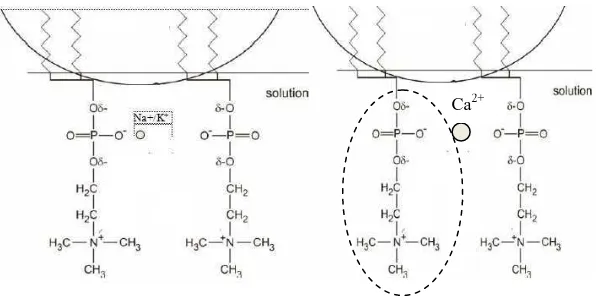
ionik menginduksi perubahan elektrik dari lapisan fosfolipid (Wiącek, 2015). Berdasarkan persamaan Debye-Hückel, kekuatan ionik larutan Ringer (0,158) lebih tinggi daripada larutan NaCl 0,9% (0,154) (Martin, 2011).
Gambar 4.2b Mekanisme ion natrium, kalium atau kalsium yang menyebabkan ketidakstabilan emulsi
4.3.3 Pengamatan globul lemak secara visual
Pengamatan globul lemak secara visual dari Intralipid 20% (sebagai blanko) dapat dilihat pada Gambar 4.3.
Gambar 4.3 Penampilan fisik Intralipid 20% selama 24 jam
Dari Gambar 4.3, dapat diamati bahwa penampilan fisik Intralipid 20% selama 24 jam tidak menunjukkan perubahan yaitu tetap berupa emulsi berwarna putih seperti susu sehingga dapat disimpulkan bahwa Intralipid 20% stabil dalam 24 jam selama pengujian.
Penampilan fisik Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah dapat dilihat pada Gambar 4.4a.
0 menit 20 menit 40 menit 60 menit 3 jam 6 jam 12 jam 24 jam
: Globul lemak
Gambar 4.4a Penampilan fisik Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah selama 24 jam Keterangan:
24 jam (1) : waktu pengamatan 24 jam sebelum redispersi 24 jam (2) : waktu pengamatan 24 jam setelah redispersi
Dari Gambar 4.4a dapat diamati bahwa penampilan fisik menunjukkan terjadinya koalesensi pada jam ke-24 yang ditandai dengan terbentuknya globul lemak secara visual sebelum redispersi dan setelah redispersi sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah mengalami ketidakstabilan pada jam ke-24.
Penampilan fisik Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah dapat dilihat pada Gambar 4.4b.
0 menit 3 jam
6 jam 12 jam 24 jam (1)
20 menit 40 menit 60 menit
24 jam (1)
24 jam (2)
: Globul lemak
Gambar 4.4b Penampilan fisik Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah selama 24 jam
Keterangan:
12 jam (1) : waktu pengamatan 12 jam sebelum redispersi 12 jam (2) : waktu pengamatan 12 jam setelah redispersi 24 jam (1) : waktu pengamatan 24 jam sebelum redispersi 24 jam (2) : waktu pengamatan 24 jam setelah redispersi
0 menit 20 menit 40 menit 60 menit 3 jam 6 jam
12 jam (1)
12 jam (2)
12 jam (1) 12 jam (2) 24 jam
(1)
24 jam (1) 24 jam (2) 24 jam
Dari Gambar 4.4b dapat diamati bahwa penampilan fisik menunjukkan terjadinya koalesensi pada jam ke-12 dan jam ke-24 yang ditandai dengan terbentuknya globul lemak secara visual sebelum dan setelah redispersi sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah mengalami ketidakstabilan pada jam ke-12 dan jam ke-24.
Penampilan fisik Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-waystopcockdapat dilihat pada Gambar 4.5a.
Gambar 4.5a Penampilan fisik Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-waystopcockselama 24 jam
Dari Gambar 4.5a dapat diamati bahwa penampilan fisik hasil pencampuran tidak mengalami perubahan selama 24 jam sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-way stopcockstabil selama 24 jam.
Penampilan fisik Intralipid 20% yang dicampur dengan larutan Ringer melalui three-waystopcockdapat dilihat pada Gambar 4.5b berikut.
0 menit 20 menit 40 menit 60 menit
: Globul lemak
Gambar 4.5b Penampilan fisik Intralipid 20% yang dicampur dengan larutanRinger melalui three-waystopcock selama 24 jam
Keterangan:
24 jam (1) : waktu pengamatan 24 jam sebelum redispersi 24 jam (2) : waktu pengamatan 24 jam setelah redispersi
Dari Gambar 4.5b dapat diamati bahwa penampilan fisik hasil pencampuran menunjukkan terjadinya flokulasi pada jam ke-24 sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan larutan Ringer melalui
three-waystopcockmengalami ketidakstabilan pada jam ke-24. 0 menit 20 menit 40 menit 60 menit 3 jam
6 jam 12 jam
24 jam (1)
24 jam (2)
Tabel 4.3 Hasil pengamatan stabilitas fisik sediaan campuran secara visual Waktu Pengamatan Stabilitas Fisik secara Visual
P1 P2 P3 P4 P5 12 jam Stabil Stabil Koalesensi Stabil Stabil 24 jam Stabil Koalesensi Koalesensi Stabil Flokulasi Keterangan:
P1 :Intralipid20%
P2 :Intralipid20% dicampur infusnatrium klorida 0,9% (1:1)dalam 1 wadah P3 :Intralipid20% dicampur larutan Ringer (1:1)dalam 1 wadah
P4 :Intralipid 20% dicampurinfusnatrium klorida 0,9% (1:2) melaluithree-
waystopcock
P5 : Intralipid 20% dicampur larutan Ringer (1:2) melalui three-waystopcock Dari Tabel 4.3, dapat dilihat bahwa pencampuran Intralipid20% dengan larutan Ringer lebih mempengaruhi stabilitas fisik Intralipid 20% dibandingkan dengan pencampuran dengan infus larutan natrium klorida 0,9% dalam satu wadah. Apabila dibandingkan dengan pencampuran Intralipid 20% dan larutan elektrolit (infus larutan natrium klorida 0,9% atau larutan Ringer) melalui
way stopcock, dapat dilihat bahwa stabilitas fisik pencampuran melalui
three-waystopcocktidak menunjukkan koalesensi tetapi terjadi flokulasi pada
pencampuran dengan larutan Ringer.
berair antara dua droplet yang berdekatan dapat pecah dan menyebabkan minyak dari dua droplet bergabung, membentuk droplet yang lebih besar tetapi masih dapat diemulsikan (Baker dan Naguib, 2005).
Kation divalen (kalsium) bersifat lebih mengganggu kestabilan daripada ion monovalen (natrium). Elektrolit yang bermuatan divalen seperti kalsium berikatan kuat dengan permukaan droplet lemak yang distabilkan lesitin (fosfolipid yang dimurnikan) membentuk kompleks ion-lemak 1:2 sehingga terbentuk muatan droplet yang berlawanan yaitu menjadi positif (Schroder, 2008; Martin, 2011). Oleh sebab itu, diamati bahwa Intralipid20% yang dicampur dengan larutan Ringer dalam 1 wadah lebih cepat menyebabkan ketidakstabilan fisik karena larutan Ringer mengandung Ca2+.
4.3.4 Pengamatan globul lemak secara mikroskopik
Globul lemak secara mikroskopik Intralipid 20% dapat dilihat pada Gambar 4.6 berikut.
Gambar 4.6 Morfologi globul lemak Intralipid 20%
Dari Gambar 4.6 dapat diamati bahwa Intralipid 20% tidak mengalami perubahan morfologi globul lemak selama 24 jam sehingga dapat disimpulkan bahwa Intralipid 20% stabil selama 24 jam.
Globul lemak secara mikroskopik Intralipid 20% yang dicampur dengan infus natrium klorida 0,9% dalam satu wadah dapat dilihat pada Gambar 4.7a.
0 menit 20 menit
60 menit 3 jam
40 menit
6 jam
Gambar 4.7a Morfologi globul lemak Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah
Dari Gambar 4.7a dapat diamati bahwa Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah mengalami perubahan globul lemak pada jam ke-24 yaitu terjadinya pembesaran globul lemak sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% dalam satu wadah mengalami ketidasktabilan pada jam ke-24.
Globul lemak secara mikroskopik dari Intralipid 20% yang dicampurkan dengan larutan Ringer dalam satu wadah dapat dilihat pada Gambar 4.7b berikut.
0 menit 20 menit 40 menit
60 menit 6 jam 3 jam
Gambar 4.7b Morfologi globul lemak Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah
Dari Gambar 4.7b dapat diamati bahwa Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah mengalami perubahan globul lemak pada jam ke-12 dan jam ke-24 yaitu terjadinya pembesaran globul lemak sehingga dapat disimpulkan bahwa Intralipid 20% yang dicampur dengan larutan Ringer dalam satu wadah mengalami ketidasktabilan pada jam ke-12 dan jam ke-24.
Globul lemak secara mikroskopik dari Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-waystopcockdapat dilihat pada Gambar 4.8a berikut.
0 menit 20 menit 40 menit
60 menit 3 jam 6 jam
Gambar 4.8a Morfologi globul lemak Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-way stopcock Dari Gambar 4.8a dapat diamati bahwa Intralipid 20% yang dicampur dengan infus larutan natrium klorida 0,9% melalui three-waystopcocktidak mengalami perubahan morfologi globul lemak selama 24 jam sehingga dapat disimpulkan bahwa sediaan campuran Intralipid 20% dengan infus larutan natrium klorida 0,9% melalui three-waystopcockstabil selama 24 jam.
Globul lemak secara mikroskopik dari Intralipid 20% yang dicampur dengan larutan Ringer melalui three-waystopcockdapat dilihat pada Gambar 4.8b berikut.
0 menit 20 menit 40 menit
60 menit 3 jam 6 jam
Gambar 4.8b Morfologi globul lemak Intralipid 20% yang dicampur dengan larutan Ringer melalui three-way stopcock
Dari Gambar 4.8b dapat diamati bahwa tidak terjadinya perubahan globul lemak. Akan tetapi, hasil penampilan fisik sediaan campuran ini menunjukkan bahwa telah terjadinya proses flokulasi. Hal ini disebabkan karena pengambilan gambar dilakukan setelah sediaan campuran diredispersi sehingga globul lemak yang terlihat secara visual terdispersi kembali secara homogen dan tidak menunjukkan pembesaran globul lemak ketika diamati dengan mikroskop digital.
Dari semua hasil pengamatan globul lemak sediaan campuran, dapat diamati bahwa globul lemak yang paling besar secara morfologi pada campuran
0 menit 20 menit 40 menit
60 menit
12 jam
3 jam 6 jam
yang mengandung larutan Ringer dalam satu wadah pada jam ke-24. Larutan Ringer mengandung ion divalen yaitu kalsium yang berperan dalam menyebabkan ketidakstabilan fisik sediaan emulsi. Pembesaran ukuran globul tersebut diakibatkan oleh proses koalesensi yang dapat diamati pada penampilan fisiknya. Koalesensi mengakibatkan globul-globul lemak kecil bergabung membentuk globul lemak besar dan mengurangi jumlah globul (Gennaro, 2001).
4.3.5 Pengamatan ukuran globul lemak
Infus larutan natrium klorida 0,9% dan larutan Ringer dapat mempengaruhi ukuran globul lemak Intralipid 20% seperti yang ditunjukkan pada hasil pengamatan globul lemak secara visual dan secara mikroskopik. Hasil ukuran globul lemak dapat diamati pada Tabel 4.4 dan Gambar 4.9 berikut.
Tabel 4.4 Hasil ukuran globul lemak sediaan campuran Waktu
(jam)
Ukuran Globul Lemak (D Mean Intensity) (nm)
P1 P2 P3 P4 P5
P2 : Intralipid20% dicampur infus natrium klorida 0,9% (1:1) dalam 1 wadah P3 : Intralipid20% dicampur larutan Ringer (1:1) dalam 1 wadah
P4 : Intralipid 20% dicampur infus natrium klorida 0,9% (1:2) melalui three-
way stopcock
mengalami ketidakstabilan karena ukuran globul lemak di atas 500 nm. Seperti yang dijelaskan di dalam USP 36, emulsi lemak intravena stabil apabila ukuran globul lemak dibawah 500 nm.
Gambar 4.9 Pengaruh infus larutan natrium klorida 0,9% dan larutan Ringer terhadap ukuran globul lemak Intralipid 20% dalam pencampuran satu wadah dan melalui three-waystopcock
Keterangan:
P1 : Intralipid20%
P2 : Intralipid20% dicampur infus natrium klorida 0,9% (1:1) dalam 1 wadah P3 : Intralipid20% dicampur larutan Ringer (1:1) dalam 1 wadah
P4 : Intralipid 20% dicampur infus natrium klorida 0,9% (1:2) melalui three-
waystopcock
P5 : Intralipid 20% dicampur larutan Ringer (1:2) melalui three-waystopcock Dari Gambar 4.9 dapat dilihat bahwa pencampuran dalam satu wadah menunjukkan ukuran globul lemak lebih besar daripada pencampuran melalui
three-waystopcock serta ukuran globul lemak bertambah lebih besar pada
pencampuran yang mengandung larutan Ringer. Dari Gambar 4.9 dapat diamati bahwa semakin lama waktu setelah pencampuran, semakin besar ukuran globul lemak. Hal ini disebabkan oleh kandungan kalsium pada larutan Ringer yang cenderung menetralkan muatan negatif fosfolipid sehingga mengurangi gaya
tolak-menolak antar partikel dan menyebabkan koalesensi globul lemak. Semakin lama waktu setelah pencampuran, semakin lama kontak antara ion positif dengan fosfolipid yang bermuatan negatif maka semakin banyak globul lemak menyatu menjadi globul besar (Sacks, 2004).
Tabel 4.5 Hasil rentang ukuran globul lemak sediaan campuran
Waktu (jam)
Rentang Ukuran Globul Lemak (nm)
P1 P2 P3 P4 P5
P2 : Intralipid20% dicampur infus natrium klorida 0,9% (1:1) dalam 1 wadah P3 : Intralipid20% dicampur larutan Ringer (1:1) dalam 1 wadah
P4 : Intralipid 20% dicampur infus natrium klorida 0,9% (1:2) melalui three-
way stopcock
Gambar 4.10 Distribusi ukuran globul lemak Intralipid 20% (0 jam)
Gambar 4.11 Distribusi ukuran globul lemak Intralipid 20% dan infus larutan natrium klorida 0,9% yang dicampurkan dalam satu wadah (24 jam)
Gambar 4.13 Distribusi ukuran globul lemak Intralipid 20% dan infus larutan natrium klorida 0,9% yang dicampurkan melalui
three-waystopcock(24 jam)
Gambar 4.14 Distribusi ukuran globul lemak Intralipid 20% dan larutan Ringer yang dicampurkan melalui three-waystopcock(24 jam)
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari penelitian ini adalah:
a. Pencampuran Intralipid 20% dengan infus larutan natrium klorida 0,9% atau larutan Ringer (dalam satu wadah atau melalui three-way stopcock) untuk pemberian nutrisi parenteral mempengaruhi stabilitas fisik Intralipid 20% yang ditunjukkan dengan terjadinya perubahan penampilan fisik, perubahan pH serta perubahan mikroskopik dan ukuran globul lemak pada jam ke-12 (untuk pencampuran yang menggunakan larutan Ringer dalam satu wadah) dan jam ke-24 (untuk pencampuran yang menggunakan infus larutan natrium klorida 0,9% dalam satu wadah dan larutan Ringer melaluithree-way stopcock).
b. Waktu setelah pencampuran dalam satu wadah atau melalui
three-waystopcockmempengaruhi stabilitas fisik Intralipid 20% yaitu semakin lama
waktu pencampuran, semakin besar ukuran globul lemak yang dihasilkan.
5.2 Saran
Dari penelitian ini, disarankan bahwa:
a. Dilakukan penelitian lebih lanjut mengenai analisis potensial zeta dan PFAT5 sediaan campuran Intralipid 20% dan larutan elektrolit dengan metode Light
Obscuration
BAB II
TINJAUAN PUSTAKA
2.1 Total Parenteral Nutrition (TPN)
Nutrisi parenteral adalah pemberian nutrien yang dibutuhkan secara parenteral (melalui intravena). Larutan nutrisi parenteral juga disebut Total
Parenteral Nutrition (TPN) atau hyperalimentation solution (hyperal). Nutrisi
parenteral digunakan untuk pasien yang tidak dapat menelan atau mengabsorbsi nutrien melalui saluran gastrointestinal. Nutrisi parenteral total menyuplai semua nutrien yang dibutuhkan, sedangkan nutrisi parenteral parsial memberikan tambahan kebutuhan nutrisi pasien jika kalori dalam jumlah yang cukup tidak dapat diberikan secara enteral (Ansel dan Prince, 2004). Pemberian nutrisi parenteral disesuaikan dengan kondisi pasien setelah menghitung energi basal dengan persamaan Harris-Benedict (Chowdary dan Reddy, 2010).
Infus dengan volume berlebihan menyebabkan edema paru dan konsentrasi tinggi glukosa menyebabkan trombofeblitis vena. Untuk mengatasi masalah ini, digunakan infus dari lemak yang merupakan emulsi minyak kacang kedelai yang distabilkan dengan fosfolipid kuning telur yang terbukti secara klinis aman dan efektif sebagai sumber kalori dan asam lemak esensial (Burgess, 2005). Emulsi tipe m/a dan a/m/a digunakan untuk rute intravena (Mestres dan Nielloud, 2002). Jenis nutrisi parenteral total terdiri atas dua yaitu nutrisi parenteral total periferal dan nutrisi parenteral total sentral.
2.1.1Nutrisi parenteral total periferal
memberi nutrisi kepada pasien dalam waktu yang singkat (7-10 hari). Apabila nutrisi parenteral total dibutuhkan dalam jangka waktu yang lebih panjang maka larutan lemak ditambahkan. Hal ini bertujuan untuk memberikan energi lebih dan mencegah kekurangan asam lemak esensial (Holman, 1987; Jauch, et al., 2009).
Vena perifer dapat menerima larutan injeksi ≤ 900 mOsm/L dan sesuai untuk diberikan emulsi lemak intravena yang isotonis dan larutan dekstrosa hipokalori (contoh, dekstrosa 10%) (Isaacs, et al., 1977). Vena akses perifer yang sering digunakan adalah vena metacarpal, dorsal venous arch, vena sefalik dan vena basilik (Scales, 2005).
Gambar 2.1 Vena akses perifer pada tangan (Scales, 2005)
2.1.2 Nutrisi Parenteral Total Sentral
Pemberian melalui vena sentral bersifat lebih permanen daripada pemberian secara perifer. Vena sentral dapat menerima larutan dengan osmolaritas tinggi dan volume larutan yang lebih banyak dapat diberikan pada satu waktu. Pemberian sentral menggunakan suatu tipe tube kateter yang dipasang pada vena dibawah tulang selangka (vena jugularis atau vena subklavian) setelah dioperasi. Apabila jarum suntik berada didalam tubuh, di bawah kulit, selalu terdapat resiko infeksi yang memasuki darah dan menyebabkan septisemia. Infeksi ini bersifat sangat serius. Jika infeksi terjadi, selang infus yang dipasang harus dikeluarkan dan nutrisi pasien dihentikan (Holman, 1987; Payne-James dan Khawaja, 1993).
2.2 Emulsi Lemak Intravena
Emulsi lemak intravena digunakan sebagai sumber lemak, nutrisi dan kalori, mencegah kekurangan asam lemak esensial (asam linoleat dan asam α-linolenat yang tidak dapat disintesis tubuh) yang terjadi ketika nutrisi parenteral diberikan selama tiga minggu tanpa lemak (Bartlett, 2014; Waitzberg, et al., 2006; Seidner, et al., 1989).
memprosesnya sedikit dapat menyebabkan hiperlipidemia dan kerusakan hati (Wanten dan Calder, 2007; Kumpf, 2006; Waitzberg, et al., 2006). Emulsi lemak intravena harus diberikan hati-hati kepada pasien sepsis dan kondisi klirens hati terhadap asam lemak terganggu (Kumpf, 2006; Miles, 1993).
Syarat emulsi lemak intravena dalam nutrisi parenteral menurut USP 36 adalah sediaan steril dengan kandungan lemak 10%, 20% atau 30% dalam pembawa berair. Fase air mengandung 0,6-1,8% fosfolipid telur parenteral, bahan osmotik seperti gliserin dengan jumlah 1,7-2,5% atau bahan penstabil yang lain seperti garam asam lemak dan emulsi ini mempunyai pH 6-9. Ukuran droplet menurut metode light scattering, data diinterpretasi dari intensity-wighted mean
droplet diameter (MDD) dimana ukurannya harus kurang dari 500 nm atau 0,5
µm. Globul lemak yang besar dari fase terdispersi dinyatakan sebagai persentase residu lemak dalam globul yang lebih besar dari 5 µm harus tidak lebih dari 0,05%. Pengukuran globul besar dilakukan dengan metode light obstruction atau
extinction, Menurut Burgess (2005), syarat emulsi lemak intravena adalah
diameter rata-rata dari droplet <1 µm, distribusi droplet yang homogen, tegangan permukaan yang rendah dan isotonis dengan osmolaritas 280-300 mOsm/Kg.
Apabila emulsi lemak intravena tidak stabil secara fisika selama penyimpanan akan menyebabkan agregasi dan koalesensi yang akan meningkatkan ukuran droplet lemak dan meningkatkan resiko terjadinya emboli akibat droplet lemak yang besar (Moynihan dan Crean, 2009). Ukuran droplet lemak diatas 5 µm menyebabkan emboli paru (Florence dan Gregoriadis, 1998).
trauma serta kondisi yang tidak sadar dalam waktu yang lama. Intralipid 20% mengandung minyak kedelai yang dimurnikan 20%, fosfolipid yang dimurnikan 1,2%, gliserin 2,2%, natrium hidroksida untuk mengatur pH ±8 dan air untuk injeksi. Dosis hariannya adalah 2g/ kgBB/ hari (ISO, 2014).
2.3 Emulsi
2.3.1 Pengertian emulsi
Emulsi adalah suatu sistem heterogen, campuran dari dua atau lebih cairan yang tidak tercampur dengan bahan pengemulsi yang digunakan untuk menstabilkan fase terdispersi. Untuk meningkatkan stabilitas sering ditambahkan zat ko-pengemulsi dan zat tambahan lain untuk mencegah terjadinya koalesensi dari tetesan terdispersi (Burgess, 2005; Agoes, 2009).
Gambar 2.3Emulsi minyak mineral dalam air (Ansel, 2011) 2.3.2Tipe emulsi
(a/m/a). Emulsi tipe ini disiapkan dengan mendispersikan emulsi a/m dalam larutan berair untuk membentuk emulsi a/m/a atau dengan mendispersikan emulsi m/a dalam minyak membentuk emulsi m/a/m (Burgess, 2005).
Terdapat beberapa cara untuk menentukan tipe emulsi :
1. Sejumlah kecil pewarna larut air seperti metilen biru atau biru brilian FCF dapat mewarnai emulsi. Jika air adalah fase luar (contoh tipe emulsi m/a), pewarna akan larut dan secara seragam berdifusi diseluruh air. Jika emulsi adalah tipe a/m, partikel dari pewarna akan menggumpal pada bagian permukaan.
2. Teknik kedua meliputi pengenceran emulsi dengan air. Jika emulsi bercampur dengan air, maka emulsi itu merupakan tipe m/a.
3. Menggunakan elektroda yang dihubungkan dengan sumber listrik dan dicelupkan ke dalam emulsi. Jika fase luarnya adalah air maka jarum voltmeter akan bergerak atau menyebabkan bola lampu menyala. Jika emulsi tersebut memiliki fase luar minyak, maka emulsi akan gagal menghantarkan arus listrik (Martin, 2011).
2.3.3 Jenis-jenis emulsi
Berdasarkan ukuran fase terdispersi, stabilitas dan kenampakannya, emulsi terdiri dari beberapa jenis yaitu:
1. Emulsi konvensional (Makroemulsi)
2. Mikroemulsi
Mikroemulsi bersifat stabil secara termodinamika, secara visual campuran bersifat transparan dari suatu sistem bifasik m/a yang distabilkan surfaktan (dalam jumlah banyak) yang biasanya dikombinasi dengan ko-surfaktan (alkohol rantai panjang). Diameter droplet pada mikroemulsi mempunyai jangkauan dari 100 Å (0,01 µm) sampai 1000 Å (0,1 µm) (Ansel, 2011; Singh, et al., 2014; Burgess, 2005; Kemken, et al., 1992). Mikroemulsi a/m dan m/a dapat terbentuk secara spontan dengan mengaduk fase minyak dan air dengan surfaktan yang dipilih secara hati-hati. Tipe emulsi yang dihasilkan tergantung sifat minyak dan surfaktan. Surfaktan hidrofilik dapat digunakan untuk menghasilkan emulsi m/a yang transparan dari banyak minyak, termasuk minyak yang beraroma dan minyak vitamin seperti vitamin A, D dan E. Surfaktan yang umumnya digunakan adalah polisorbat 60 dan polisorbat 80 (Ansel, 2011).
3. Nanoemulsi
Nanoemulsi adalah emulsi yang stabil secara kinetika, termodinamika dan secara visual jernih yang terdiri dari dua larutan yang tidak dapat bercampur (air dan minyak) untuk membentuk fase tunggal dengan menggunakan surfaktan dan ko-surfaktan yang sesuai dan memiliki diameter droplet dengan ukuran 0,5-100 nm (Shah, et al., 2010; Mishra, et al., 2014; McClements dan Rao, 2011).
2.3.4 Aplikasi emulsi melalui rute intravena
nonionik mempunyai klirens yang lebih lambat daripada droplet yang distabilkan dengan fosfolipid yang bermuatan negatif (Martin, 2011).
Penggunaan emulsi parenteral digunakan untuk berbagai tujuan, seperti : 1. Sediaan depot lepas lama yang diberikan secara intramuskular, contoh : Injeksi
vitamin K1.
2. Emulsi nutrien minyak dalam air (m/a) yang diberikan secara intravena, contoh : Intralipid 20% (Agoes,2009).
2.3.5 Teori emulsifikasi
Terdapat beberapa teori emulsifikasi yaitu: A.Adsorpsi monomolekuler
Surfaktan, atau amfifil, mengurangi tegangan antarmuka karena adsorpsinya pada antarmuka minyak-air membentuk selaput monomolekuler. Tetesan terdispersi dilapisi oleh lapisan tunggal yang koheren yang menghambat dua tetesan ketika satu sama lain berdekatan. Lapisan selaput tersebut bersifat fleksibel sehingga mampu terbentuk kembali dengan cepat jika pecah atau terganggu. Efek lain yang meningkatkan stabilitas adalah adanya muatan permukaan yang menyebabkan tolak-menolak antara partikel-partikel berdekatan. Hal ini menyebabkan secara praktek, lebih sering digunakan penggabungan bahan pengemulsi daripada bahan pengemulsi tunggal.
B.Adsorpsi multimolekuler dan pembentukan selaput
Dalam teori ini, contoh bahan pengemulsi adalah koloid liofilik terhidrasi. Penggunaannya sekarang telah menurun karena tersedia bahan pengemulsi sintetis. Koloid ini aktif pada permukaan karena tampak pada antarmuka minyak-air. Koloid ini berbeda dari bahan aktif permukaan sintetis, yaitu:
b. Zat ini membentuk suatu lapisan multimolekuler dan bukan lapisan monomolekuler pada antarmuka.
Kerja koloid ini sebagai bahan pengemulsi disebabkan oleh efek yang kedua karena selaput yang terbentuk kuat dan mencegah koalesensi. Efek pembantu dari koloid ini adalah meningkatkan viskositas medium dispersi yang signifikan. Karena bahan pengemulsi yang membentuk multilapisan disekitar tetesan selalu hidrofilik, bahan pengemulsi tersebut cenderung menyebabkan pembentukan emulsi m/a.
C.Adsorpsi partikel padat
Partikel padat yang terbagi halus yang dibasahi hingga derajat tertentu oleh minyak dan air dapat bekerja sebagai bahan pengemulsi. Hal ini disebabkan partikel padat tersebut terkonsentrasi pada antarmuka, tempat partikel tersebut menghasilkan suatu selaput partikulat di sekitar tetesan terdispersi sehingga mencegah koalesensi. Serbuk yang lebih mudah dibasahi dengan air membentuk emulsi m/a, sedangkan yang mudah dibasahi dengan minyak membentuk emulsi a/m (Martin, 2011).
2.3.6 Zat pengemulsi
Zat pengemulsi dapat digolongkan berdasarkan sumber sebagai berikut: a. Bahan karbohidrat, seperti gom, tragakan, agar dan pektin. Bahan-bahan ini
merupakan koloid hidrofilik yang ketika ditambahkan ke dalam air menghasilkan emulsi m/a.
b. Substansi protein, seperti gelatin, kuning telur dan kasein. Substansi-substansi ini menghasilkan emulsi m/a.
penstabil emulsi m/a dari beberapa lotion dan salep yang digunakan secara eksternal. Kolesterol dan derivat kolesterol dapat digunakan secara eksternal untuk menghasilkan emulsi a/m.
d. Bahan pembasah, dapat berupa anionik, kationik atau nonionik yang diadsorpsi pada permukaan minyak-air untuk membentuk selaput monomolekuler dan mengurangi tegangan antar muka.
e. Partikel padat yang terdistribusi halus, dimana bahan ini akan diadsorpsi pada bagian antarmuka antara dua fase cair yang tidak bercampur dan membentuk suatu selaput pada partikel disekeliling globul terdispersi. Contohnya adalah bentonit, magnesium hidroksida dan aluminium hidroksida (Ansel, 2011; Martin, 2011).
2.3.7 Stabilitas fisik emulsi
Faktor yang mempengaruhi stabilitas emulsi adalah pH, suhu, proses pembuatan, jumlah bahan pengemulsi yang digunakan untuk membuat emulsi, perbandingan minyak dan bahan pengemulsi, interaksi komponen emulsi pada bagian antarmuka dan aktivitas biologis (Iriart, et al., 2011). Secara umum, suatu emulsi dikatakan tidak stabil secara fisika apabila fase internal membentuk agregat globul bergerak ke bagian atas atau bawah emulsi untuk membentuk lapisan terkonsentrasi serta jika semua atau sebagian cairan dari fase internal memisah dan membentuk suatu lapisan yang berbeda pada bagian atas atau bawah emulsi (Ansel, 2011). Stabilitas emulsi ditandai dengan tidak berubahnya penampilan fisik, bau, warna dan sifat fisik lainnya (Martin, 2011).
2.3.7.1 Flokulasi (agregasi)