PENETAPAN KADAR SULFAMETOKSAZOL DAN
TRIMETOPRIM DALAM SEDIAAN TABLET DENGAN
NAMA DAGANG DAN GENERIK SECARA SIMULTAN
DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT)
SKRIPSI
Oleh :
FARAHDIBA ASSEWETH 040804068
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR SULFAMETOKSAZOL DAN
TRIMETOPRIM DALAM SEDIAAN TABLET DENGAN
NAMA DAGANG DAN GENERIK SECARA SIMULTAN
DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Diajukan Oleh :
FARAHDIBA ASSEWETH 040804068
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN SKRIPSI
PENETAPAN KADAR SULFAMETOKSAZOL DAN TRIMETOPRIM DALAM SEDIAAN TABLET DENGAN NAMA DAGANG DAN GENERIK
SECARA SIMULTAN DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Oleh :
FARAHDIBA ASSEWETH 040804068
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : November 2008
Disetujui Oleh:
Pembimbing I, Panitia Penguji
(Drs.FathurRahmanHarun,M.Si.,Apt) (Prof.Dr.rer.nat.EffendyDeLuxPutra,SU.,Apt)
NIP 130 872 281 NIP 131 283 723
Pembimbing II,
(Drs. Fathur Rahman Harun, M.Si., Apt) NIP 130 872 281
(Dra. Fat Aminah, M.Sc., Apt.) NIP 130 809 706
(Dra. Salbiah M.Si., Apt) NIP 131 653 994
(Drs. Agusmal Dalimunthe, M.Si., Apt) NIP 131 286 002
Dekan,
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah
memberikan rahmat dan hidayah-Nya, serta shalawat beriring salam kepada Nabi
Muhammad SAW sehingga penulis dapat menyelesaikan skripsi ini.
Penulis menyampaikan rasa hormat dan terima kasih yang
sebesar-besarnya kepada ayahanda H. Faisal Ali Asseweth dan ibunda Hj. Rahmawati,
serta adinda Fachriza Asseweth, M. Delfi Fadillah Asseweth dan Ahmad Rizki
Fadillah Asseweth atas doa tulus dan dukungan moril maupun materil serta cinta
dan kasih yang diberikan kepada penulis dalam menghantarkan penulis meraih
cita-cita.
Pada kesempatan ini, penulis juga menyampaikan terima kasih yang
sebesar-besarnya kepada :
1. Bapak Drs. Fathur Rahman Harun, M.Si., Apt dan Ibu Dra. Fat Aminah
M.Sc., Apt yang telah membimbing penulis dengan sabar sehingga
selesainya penulisan skripsi ini.
2. Bapak Dekan Fakultas Farmasi Prof. Dr.Sumadio Hadisahputra., Apt yang
telah memberikan fasilitas kepada penulis sehingga dapat menyelesaikan
pendidikan.
3. Ibu Dra. Sudarmi, M.Si., Apt selaku penasehat akademik yang telah
memberikan nasehat dan arahan kepada penulis serta seluruh staf pengajar
Fakultas Farmasi USU atas ilmu yang telah diberikan selama perkuliahan
dan juga staf tata usaha yang telah memberikan bantuan administrasinya.
4. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt, Bapak Drs.
tim penguji yang sangat banyak memberikan masukan dan saran atas
skripsi ini.
5. Emil Salim, ST., yang telah memberikan petunjuk dan membantu penulis
selama melakukan penelitian di LPPOM MUI kota Medan.
6. Teman baik penulis Anes, Linda, Yelni, Nizar, Ririn, dan seluruh
mahasiswa Farmasi stambuk 2004 serta kakak-kakak maupun adik-adik
mahasiswa Farmasi yang tidak dapat penulis sebutkan satu persatu atas
segala bantuan dan motivasinya.
Akhirnya penulis mengucapkan terima kasih yang sebesar-besarnya
kepada semua pihak yang telah turut membantu penulis dalam menyelesaikan
skripsi ini yang tidak bisa penulis sebutkan satu-persatu.
Medan, November 2008 Penulis
ABSTRAK
Telah dilakukan penetapan kadar sulfametoksazol dan trimetoprim dalam
sediaan tablet dengan nama dagang dan generik dengan menggunakan
kromatografi cair kinerja tinggi (KCKT) fase balik dengan kolom VP-ODS (4,6
mm x 25 cm), fase gerak campuran air : asetonitril : trietilamin, laju aliran 2
ml/menit, sensitivitas 0,01 AUFS pada panjang gelombang 270 nm.
Hasil uji identifikasi sulfametoksazol BPFI, trimetoprim BPFI, sediaan
tablet yang dibuat sendiri dan yang terdapat dalam perdagangan diperoleh waktu
retensi yang sama yaitu 10 menit untuk sulfametoksazol dan 3 menit untuk
trimetoprim.
Penentuan linieritas kurva kalibrasi menunjukkan hubungan yang linier
antara luas puncak dengan konsentrasi untuk sulfametoksazol pada konsentrasi 50
sampai 250 μg/ml dengan koefisien korelasi, r = 0,9997 dan dari hasil perhitungan
diperoleh persamaan regresi Y = 123057,9697 + 42046,8699X, untuk trimetoprim
pada konsentrasi 10 sampai 50 μg/ml dengan koefisien korelasi, r = 0,9998 dan
dari hasil perhitungan diperoleh persamaan regresi Y = 5460,4848 +
11816,2472X.
Uji validasi dari sediaan tablet yang dibuat sendiri, secara statistik
diperoleh kadar sulfametoksazol yang sebenarnya 96.35% ± 3.29 dengan persen
perolehan kembali = 96.35%, kesalahan relatif (KR) = 3.65%, koefisien variasi
(KV) = 2.0%, limit deteksi (LOD)= 5.19 mcg/ml dan limit kuantitasi (LOQ) =
17.32 mcg/ml, untuk trimetoprim diperoleh kadar yang sebenarnya 96.67% ± 3.16
koefisien variasi (KV)= 1.98%, limit deteksi (LOD) = 0.87 mcg/ml, limit
kuantitasi (LOQ) = 2.89 mcg/ml.
Dari hasil penelitian diperoleh kadar sulfametoksazol dan trimetoprim
dalam sediaan tablet dengan nama generik untuk produk PT. Indofarma,
sulfametoksazol = 98.33% ± 2.52, dan trimetoprim = 98.70% ± 1.53, PT. Phyto
Kemo Agung Farma, sulfametoksazol = 102.25% ± 2.46, trimetoprim = 100.93%
± 1.79, untuk sediaan dengan nama dagang yaitu produk PT. Roche (Bactrim),
sulfametoksazol = 101.64% ± 2.78, trimetoprim = 101.95% ± 2.66.
Semua sediaan tablet yang dianalisis memenuhi persyaratan kadar yang
tercantum dalam Farmakope Indonesia edisi IV (1995), yaitu mengandung
sulfametoksazol dan trimetoprim tidak kurang 93,0% dan tidak lebih dari 107,0%
ABSTRACT
The determination of sulfametoxazole and trimetoprim in tablet with
branded and generic names by reversed phase high performance liquid
chromatography (HPLC) had been carried out. The column used was
Octadesylsilane (4,6 mm x 25 cm), as stationary phase, solution water :
acetonitrile : trietilamine, as mobile phase, flow rate 2 ml/minute, sensitivity 0,01
AUFS, with UV detection at 270 nm wavelength.
Identification of trimetoprim BPFI, sulfametoxazole BPFI, tablets who
made by researcher and tablets with branded and generic names got the same
retention time namely 10 minutes for sulfametoxazole and 3 minutes for
trimetoprim.
The determination of calibration curve linearity gave a linear correlation
between the peak area versus concentration, for sulfametoxazole from 50 to 250
μg/ml with the correlation coefficient, r = 0,9997 and the calculated had got the
regression Y = 123057,9697 + 42046,8699X, for trimetoprim from 10 to 50 μg/ml
with the correlation coefficient, r = 0,9998 and the calculated had got the
regression Y = 5460,4848 + 11816,2472X,
The validation test of the tablet mixture who made by researcher showed
the concentration 96.35% ± 3.29 for sulfametoxazole with percent recovery =
96.35%, relative error = 3.65%, coefficient of variation = 2.0% , limit of detection
(LOD) = 5.19 mcg/ml, limit of quantitation (LOQ) = 17.32 mcg/ml, and for
trimetoprim showed the concentration 96.67% ± 3.16 with percent recovery =
96.67%, relative error = 3.33%, coefficient of variation = 1.98%, limit of
The result of the quantitation of sulfametoxazole and trimetoprim in
tablets with generic names showed concentration for PT. Indofarma,
sulfametoxazole = 98.33% ± 2.52, dan trimetoprim = 98.70% ± 1.53, for PT.
Phyto Kemo Agung Farma, sulfametoxazole = 102.25% ± 2.46, trimetoprim =
100.93% ± 1.79, and for tablets with branded name, PT. Roche (Bactrim),
sulfametoxazole = 101.64% ± 2.78, trimetoprim = 101.95% ± 2.66.
All samples fulfilled the requirement of the fourth edition Farmakope
Indonesia (1995) namely containing sulfametoxazole, C10H11N3O3S and
trimetoprim, C14H18N4O3, not less than 93,0% and not more than 107,0% from
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR... iv
ABSTRAK ... vi
ABSTRACT ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR... ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian... 4
BAB II TINJAUAN PUSTAKA... 5
2.1 Obat Generik dan Paten... . 5
2.2 Tablet Kotrimoksazol... . 6
2.2.1 Sifat Fisikokimia... . 6
2.2.1.1 Sulfametoksazol... . 6
2.2.1.2 Trimetoprim... 6
2.2.2 Mekanisme kerja... ... 7
2.2.3 Farmakokinetika... . 7
2.2.4 Efek samping... . 8
2.2.5 Dosis... . 8
2.3 Teori Kromatografi... . 8
2.3.1 Pembagian Kromatografi... . 9
2.3.2 Migrasi dan Retensi Solut... . 9
2.3.3 Pemisahan pada Kolom... . 10
2.4 Kromatografi Cair Kinerja Tinggi... 18
2.4.1 Jenis-jenis Kromatografi... . 19
2.4.2 Komponen Kromatografi Cair Kinerja Tinggi... . 22
2.4.2.1 Wadah fase gerak... . 22
2.4.2.2 Pompa... . 23
2.4.2.3 Injektor... . 23
2.4.2.4 Kolom... 24
2.4.2.5 Detektor... 25
2.4.2.6 Fase gerak... 25
2.5 Uji Validasi... 26
2.6 Uraian Bentuk Sediaan Tablet... 27
2.7 Bahan Tambahan dalam Sediaan Tablet... . 28
2.7.1 Bahan Pengisi... . 28
2.7.2 Bahan Pengikat... . 28
2.7.3 Bahan Pengembang... . 29
2.7.4 Bahan Pelicin... . 29
BAB III METODOLOGI PENELITIAN ... 30
3.1 Waktu dan Tempat Penelitian ... 30
3.2 Alat-alat ... 30
3.3 Bahan-bahan ... 30
3.4 Metode penelitian ... 31
3.4.1 Pembuatan tablet kotrimoksazol... 31
3.4.2 Uji Preformulasi ... 31
3.4.2.1 Uji sudut diam... ... 32
3.4.2.2 Uji laju alir/kecepatan alir... ... 32
3.4.2.3 Uji indeks tap... ... 32
3.4.3 Pembuatan fase gerak ... 33
3.4.4 Penentuan panjang gelombang maksimum ... 33
3.4.4.1 Pembuatan larutan induk baku BPFI ... 33
3.4.4.3 Penentuan panjang gelombang maksimum trimetoprim
BPFI ... 33
3.4.6 Penentuan panjang gelombang analisis... . 34
3.4.6 Penyiapan alat KCKT... . 34
3.4.7 Identifikasi... ... 34
3.4.8 Penentuan kuantitatif... 35
3.4.8.1 Pembuatan linieritas kurva kalibrasi... 35
3.4.8.1.1 Kurva kalibrasi sulfametoksazol BPFI... 35
3.4.8.1.2 Kurva kalibrasi trimetoprim BPFI... 35
3.4.8.2 Penetapan kehandalan metode analisis... 36
3.4.8.3 Penetapan Kadar Sampel... 36
3.4.8.4 Analisa Data Secara Statistik... 36
BAB IV HASIL DAN PEMBAHASAN... 38
BAB V KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 48
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Halaman Tabel 1. Hasil pengolahan data dari tablet yang dibuat sendiri ... 45
Tabel 2. Parameter- parameter uji validasi ... 45
Tabel 3. Hasil pengolahan data dari sediaan tablet kotrimoksazol ... 46
Tabel 4. Hasil penetapan kadar trimetoprim dan sulfametoksazol dalam
sediaan tablet dengan nama dagang dan generik yang ditentukan
berdasarkan luas puncak ... 47
Tabel 5. Data hasil penyuntikan larutan Sulfametoksazol BPFI berdasarkan
Luas Puncak ... 55
Tabel 6. Data hasil penyuntikan larutan trimetoprim BPFI berdasarkan Luas
DAFTAR GAMBAR
Halaman Gambar 1. Kurva serapan sulfametoksazol BPFI dengan konsentrasi 25
mcg/ml dalam fase gerak secara spektrofotometri ultraviolet...
. 39
Gambar 2. Kurva serapan trimetoprim BPFI dengan konsentrasi 20 mcg/ml dalam fase gerak secara spektrofotometri
ultraviolet... 39
Gambar 3. Kurva serapan trimetoprim BPFI (20 mcg/ml) dan sulfametoksazol (25 mcg/ml) dalam fase gerak secara spektrofotometri
ultraviolet...
. 40
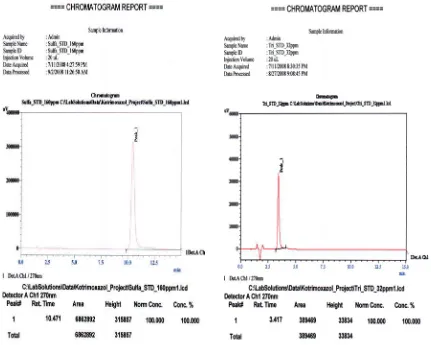
Gambar 4. a, b, c, d, e dan f merupakan kromatogram penyuntikan larutan sulfametoksazol BPFI (160 mcg/ml), larutan trimetoprim BPFI (32 mcg/ml), dan larutan sampel setara dengan sulfametoksazol 160 mcg/ml, kolom VP-ODS (3,9 mm x 30 cm), fase gerak air; asetonitril; trietilamin, volume penyuntikan 20 μl, laju aliran 2
ml/menit pada λ 270 nm... 43
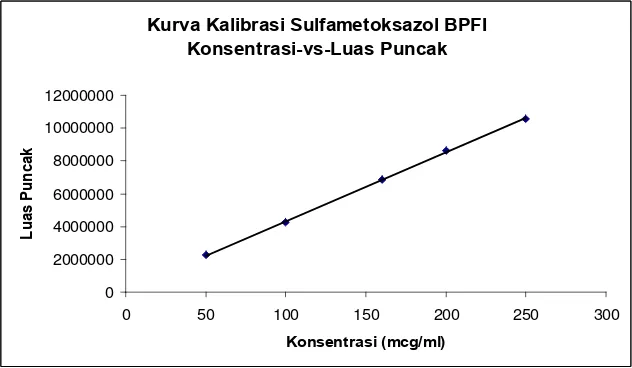
Gambar 5. Kurva kalibrasi sulfametoksazol BPFI ... 43
DAFTAR LAMPIRAN
Halaman Lampiran 1. Gambar alat KCKT ... 51
Lampiran 2. Gambar alat ultrasonic cleaner ... 52
Lampiran 3. Kromatogram dari larutan sulfametoksazol BPFI... 53
Lampiran 4. Perhitungan persamaan regresi dari kurva kalibrasi
sulfametoksazol BPFI yang diperoleh secara KCKT pada λ
270 nm... 55
Lampiran 5. Kromatogram dari larutan trimetoprim BPFI... 57
Lampiran 6. Perhitungan persamaan regresi dari kurva kalibrasi
trimetoprim BPFI yang diperoleh secara KCKT pada λ 270
nm... ... 59
Lampiran 7. Kromatogram dari larutan tablet yang dibuat sendiri
(PT.
Indofarma)... 61
Lampiran 8. Analisa data statistik untuk mencari kadar sebenarnya dari
penyuntikan larutan tablet yang dibuat sendiri (PT. Indofarma)
secara
KCKT... 63
Lampiran 9. Uji validasi dari tablet yang dibuat
sendiri... 65
Lampiran 10. Kromatogram dari larutan tablet Cotrimoksazole (PT. Phyto
Kemo Agung Farma) ... 68
Lampiran 11. Analisa data statistik untuk mencari kadar sebenarnya dari
penyuntikan larutan tablet Cotrimoksazole (PT. Phyto Kemo
Agung Farma) secara
KCKT... 70
Lampiran 12. Kromatogram dari larutan tablet Cotrimoksazole
(PT.Indofarma)...
Lampiran 13. Analisa data statistik untuk mencari kadar sebenarnya dari
penyuntikan larutan tablet Cotrimoksazole (PT.Indofarma)
secara KCKT... 75
Lampiran 14. Kromatogram dari larutan tablet bactrim (PT. Roche) ... 77
Lampiran 15. Analisa data statistik untuk mencari kadar sebenarnya dari penyuntikan larutan tablet bactrim (PT. Roche) secara KCKT... . 79
Lampiran 16. Uji preformulasi tablet ... 81
Lampiran 17. Perhitungan Penimbangan sampel ... 83
Lampiran 18. Contoh perhitungan untuk mencari kadar sulfametoksazol dan trimetoprim ... 84
Lampiran 19. Daftar spesifikasi sampel ... 85
Lampiran 20. Sertifikat pengujian trimetoprim BPFI ... 86
Lampiran 21. Sertifikat pengujian sulfametoksazol BPFI ... 87
Lampiran 22. Sertifikat pengujian trimetoprim baku ... 88
ABSTRAK
Telah dilakukan penetapan kadar sulfametoksazol dan trimetoprim dalam
sediaan tablet dengan nama dagang dan generik dengan menggunakan
kromatografi cair kinerja tinggi (KCKT) fase balik dengan kolom VP-ODS (4,6
mm x 25 cm), fase gerak campuran air : asetonitril : trietilamin, laju aliran 2
ml/menit, sensitivitas 0,01 AUFS pada panjang gelombang 270 nm.
Hasil uji identifikasi sulfametoksazol BPFI, trimetoprim BPFI, sediaan
tablet yang dibuat sendiri dan yang terdapat dalam perdagangan diperoleh waktu
retensi yang sama yaitu 10 menit untuk sulfametoksazol dan 3 menit untuk
trimetoprim.
Penentuan linieritas kurva kalibrasi menunjukkan hubungan yang linier
antara luas puncak dengan konsentrasi untuk sulfametoksazol pada konsentrasi 50
sampai 250 μg/ml dengan koefisien korelasi, r = 0,9997 dan dari hasil perhitungan
diperoleh persamaan regresi Y = 123057,9697 + 42046,8699X, untuk trimetoprim
pada konsentrasi 10 sampai 50 μg/ml dengan koefisien korelasi, r = 0,9998 dan
dari hasil perhitungan diperoleh persamaan regresi Y = 5460,4848 +
11816,2472X.
Uji validasi dari sediaan tablet yang dibuat sendiri, secara statistik
diperoleh kadar sulfametoksazol yang sebenarnya 96.35% ± 3.29 dengan persen
perolehan kembali = 96.35%, kesalahan relatif (KR) = 3.65%, koefisien variasi
(KV) = 2.0%, limit deteksi (LOD)= 5.19 mcg/ml dan limit kuantitasi (LOQ) =
17.32 mcg/ml, untuk trimetoprim diperoleh kadar yang sebenarnya 96.67% ± 3.16
koefisien variasi (KV)= 1.98%, limit deteksi (LOD) = 0.87 mcg/ml, limit
kuantitasi (LOQ) = 2.89 mcg/ml.
Dari hasil penelitian diperoleh kadar sulfametoksazol dan trimetoprim
dalam sediaan tablet dengan nama generik untuk produk PT. Indofarma,
sulfametoksazol = 98.33% ± 2.52, dan trimetoprim = 98.70% ± 1.53, PT. Phyto
Kemo Agung Farma, sulfametoksazol = 102.25% ± 2.46, trimetoprim = 100.93%
± 1.79, untuk sediaan dengan nama dagang yaitu produk PT. Roche (Bactrim),
sulfametoksazol = 101.64% ± 2.78, trimetoprim = 101.95% ± 2.66.
Semua sediaan tablet yang dianalisis memenuhi persyaratan kadar yang
tercantum dalam Farmakope Indonesia edisi IV (1995), yaitu mengandung
sulfametoksazol dan trimetoprim tidak kurang 93,0% dan tidak lebih dari 107,0%
ABSTRACT
The determination of sulfametoxazole and trimetoprim in tablet with
branded and generic names by reversed phase high performance liquid
chromatography (HPLC) had been carried out. The column used was
Octadesylsilane (4,6 mm x 25 cm), as stationary phase, solution water :
acetonitrile : trietilamine, as mobile phase, flow rate 2 ml/minute, sensitivity 0,01
AUFS, with UV detection at 270 nm wavelength.
Identification of trimetoprim BPFI, sulfametoxazole BPFI, tablets who
made by researcher and tablets with branded and generic names got the same
retention time namely 10 minutes for sulfametoxazole and 3 minutes for
trimetoprim.
The determination of calibration curve linearity gave a linear correlation
between the peak area versus concentration, for sulfametoxazole from 50 to 250
μg/ml with the correlation coefficient, r = 0,9997 and the calculated had got the
regression Y = 123057,9697 + 42046,8699X, for trimetoprim from 10 to 50 μg/ml
with the correlation coefficient, r = 0,9998 and the calculated had got the
regression Y = 5460,4848 + 11816,2472X,
The validation test of the tablet mixture who made by researcher showed
the concentration 96.35% ± 3.29 for sulfametoxazole with percent recovery =
96.35%, relative error = 3.65%, coefficient of variation = 2.0% , limit of detection
(LOD) = 5.19 mcg/ml, limit of quantitation (LOQ) = 17.32 mcg/ml, and for
trimetoprim showed the concentration 96.67% ± 3.16 with percent recovery =
96.67%, relative error = 3.33%, coefficient of variation = 1.98%, limit of
The result of the quantitation of sulfametoxazole and trimetoprim in
tablets with generic names showed concentration for PT. Indofarma,
sulfametoxazole = 98.33% ± 2.52, dan trimetoprim = 98.70% ± 1.53, for PT.
Phyto Kemo Agung Farma, sulfametoxazole = 102.25% ± 2.46, trimetoprim =
100.93% ± 1.79, and for tablets with branded name, PT. Roche (Bactrim),
sulfametoxazole = 101.64% ± 2.78, trimetoprim = 101.95% ± 2.66.
All samples fulfilled the requirement of the fourth edition Farmakope
Indonesia (1995) namely containing sulfametoxazole, C10H11N3O3S and
trimetoprim, C14H18N4O3, not less than 93,0% and not more than 107,0% from
BAB I PENDAHULUAN 1.1 Latar Belakang
Sulfonamida merupakan kelompok zat antibakteri dengan rumus dasar
yang sama, yaitu H2N SO2
Sulfonamida mempunyai spektrum antibakteri yang luas, baik terhadap
gram positif maupun gram negatif, meskipun potensinya kurang dari antibiotika.
Umumnya hanya bersifat bakteriostatik, hanya dalam keadaan tertentu dapat
bekerja bakterisid, misalnya pada kadar yang tinggi dalam urin (Tjay dan
Rahardja, 2002).
-NHR dimana R adalah bermacam-macam
substituen. Pada prinsipnya senyawa-senyawa ini dapat digunakan untuk
menghadapi berbagai infeksi (Mariana, 1995).
Kotrimoksazol merupakan kombinasi dari sulfametoksazol dan
trimetoprim dengan perbandingan 5:1, bersifat bakterisid dengan spektrum kerja
lebih lebar dibandingkan dengan sulfonamida. Trimetoprim dan sulfametoksazol
menghambat reaksi enzimatik obligat pada dua tahap yang berurutan pada bakteri
sehingga kombinasi kedua obat memberikan efek sinergistik. Spektrum
antibakteri trimetoprim sama dengan sulfametoksazol, meskipun daya
antibakterinya 20-100 kali lebih kuat dari sulfametoksazol (Mariana, 1995).
Obat selain diproduksi dan dipasarkan dengan nama dagang juga
menggunakan nama generik yang harganya jauh lebih murah daripada obat
dengan nama dagang. Selama ini masyarakat cenderung menilai kualitas obat
identik dengan harga yang tinggi sehingga obat yang lebih mahal lebih baik
Departemen Kesehatan telah menetapkan peningkatan penggunaan obat
generik yang didukung dengan Peraturan Menteri Kesehatan No.
085/Menkes/Per/1989 tanggal 28 Januari 1989 tentang kewajiban menuliskan
resep dan atau menggunakan obat generik di fasilitas pelayanan kesehatan
pemerintah. Dalam perdagangan kotrimoksazol dapat dijumpai dalam bentuk
sediaan tablet, kaplet dan sirop baik dengan nama dagang ataupun dengan nama
generik.
Menurut Farmakope Indonesia edisi IV (1995) dan USP XXX (2007)
tablet kotrimoksazol ditentukan kadarnya secara Kromatografi Cair Kinerja
Tinggi menggunakan kolom ODS (3,9 mm x 30 cm) dengan fase gerak campuran
1400 ml air, 400 ml asetonitril, dan 2 ml trietilamina, laju aliran (flow rate) 2
ml/menit, volume penyuntikan 20 µl dan deteksi dilakukan pada panjang
gelombang 254 nm.
Metode kromatografi cair kinerja tinggi memiliki banyak keuntungan
antara lain cepat, daya pisahnya baik, ideal untuk molekul besar dan ion, mudah
untuk memperoleh kembali cuplikan, kolom dapat dipakai berulang kali dan
perangkatnya dapat digunakan secara otomatis dan kuantitatif (Johnson and
Stevenson, 1991; Rohman, 2007).
Persyaratan kadar untuk sediaan tablet kotrimoksazol menurut Farmakope
Indonesia edisi IV tahun 1995 yaitu mengandung Sulfametoksazol, C10H11N3O3S
dan Trimetoprim, C14H18N4O3
Dalam penelitian ini, peneliti mencoba menggunakan kondisi kromatografi
yang berbeda dari prosedur yang terdapat di Farmakope Indonesia edisi IV (1995) , tidak kurang dari 93,0% dan tidak lebih dari
yaitu kolom Shimpac VP-ODS (4.6 mm x 25 cm) dan panjang gelombang 270 nm
sehingga perlu dilakukan uji validasi terhadap sediaan tablet yang dibuat sendiri
dengan bahan tambahan yang umumnya digunakan dalam pembuatan tablet.
Adapun parameter uji validasi yang dilakukan yaitu akurasi (kecermatan) dengan
parameter kesalahan relatif, presisi (keseksamaan) dengan parameter koefisien
variasi, sensitivitas dengan parameter limit deteksi dan limit kuantitasi
Berdasarkan hal tersebut di atas, penulis tertarik menggunakan metode
KCKT untuk menetapkan kadar sulfametoksazol dan trimetoprim dalam sediaan
tablet dengan nama dagang dan nama generik yang beredar di pasaran dengan
menggunakan kolom dan panjang gelombang yang berbeda dari yang ditetapkan
oleh Farmakope Indonesia edisi IV (1995) dan melihat apakah hasil yang
diperoleh memenuhi persyaratan yang tercantum dalam Farmakope Indonesia
edisi IV (1995).
1.2 Perumusan masalah
- Apakah metode KCKT yang digunakan memenuhi persyaratan uji validasi?
- Apakah kadar sulfametoksazol dan trimetoprim dalam sediaan tablet dengan
nama dagang dan nama generik yang ditetapkan secara KCKT dengan
menggunakan kondisi kromatografi yang berbeda dari Farmakope Indonesia
edisi IV (1995) memenuhi persyaratan yang ditetapkan Farmakope Indonesia
edisi IV (1995)?
1.3 Hipotesis
- Diduga metode KCKT yang dilakukan memenuhi persyaratan uji validasi yang
- Diduga kadar sulfametoksazol dan trimetoprim dalam sediaan tablet dengan
nama dagang dan nama generik yang ditetapkan secara KCKT dengan kondisi
kromatografi yang berbeda dari Farmakope Indonesia edisi IV (1995)
memenuhi persyaratan yang ditetapkan oleh Farmakope Indonesia edisi IV
(1995).
1.4 Tujuan penelitian
- Untuk mengetahui validitas dari metode KCKT yang digunakan pada
penetapan kadar sulfametoksazol dan trimetoprrim secara simultan.
- Untuk mengetahui kadar sulfametoksazol dan trimetoprim dalam sediaan
tablet dengan nama dagang dan nama generik secara KCKT dengan
menggunakan kolom dan panjang gelombang yang berbeda dari Farmakope
Indonesia edisi IV (1995) dan mengetahui hasil yang diperoleh sesuai atau
tidak dengan persyaratan yang tertera pada Farmakope Indonesia edisi IV
BAB II
TINJAUAN PUSTAKA 2.1 Obat Generik dan Paten
Obat adalah bahan atau paduan bahan yang digunakan untuk
mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam
rangka penetapan diagnosa, pencegahan penyakit, penyembuhan penyakit,
pemulihan, dan peningkatan kesehatan termasuk kontrasepsi dan sediaan biologis
(Depkes RI, 2005).
Obat generik adalah obat dengan nama resmi yang telah ditetapkan dalam
Farmakope Indonesia dan INN WHO (International Non-proprietary Names
World of Health Organization) untuk zat berkhasiat yang dikandungnya di mana
obat generik hanya menggunakan nama yang sesuai dengan zat berkhasiat yang
dikandungnya walaupun diproduksi oleh pabrik yang berlainan (Depkes RI,
1989).
Obat paten adalah obat baru yang ditemukan oleh peneliti yang
mempunyai hak penuh/hak paten yang dikeluarkan WHO untuk obat yang
dihasilkannya. Obat dengan nama dagang yaitu nama pemberian pabrik yang
membuatnya di mana obat paten menggunakan nama dagang yang
bermacam-macam, tergantung pabrik yang memproduksi walaupun jenis obatnya sama.
Kemasannya dibuat mewah untuk menarik pembeli dan tiap pabrik
mempromosikannya dengan nama dagang masing-masing secara gencar melalui
berbagai cara sehingga harganya lebih mahal dari pada obat generik karena
2.2 Tablet Kotrimoksazol
Tablet Kotrimoksazol merupakan campuran dari Sulfametoksazol dan
Trimetoprim. Tablet Kotrimoksazol mengandung Sulfametoksazol C10H11N3O3S
dan Trimetoprim, C14H18N4O3
2.2.1 Sifat Fisikokimia
, tidak kurang dari 93,0% dan tidak lebih dari
107,0% dari jumlah yang tertera pada etiket (DitJen POM, 1995).
2.2.1.1 Sulfametoksazol
Rumus struktur : H2N SO2
N NH
O CH3
Rumus molekul : C10H11N3O3
Berat molekul : 253,28
S
Pemerian : serbuk hablur, putih sampai hampir putih, praktis
tidak berbau
Kelarutan : praktis tidak larut dalam air, dalam eter dan dalam
kloroform, mudah larut dalam aseton dan dalam
larutan natrium hidroksida encer, agak sukar larut
dalam etanol.
2.2.1.2 Trimetoprim
Rumus struktur :
NH2 OCH3 N
H2N CH2 OCH N
3
OCH Rumus molekul : C
3 14H18N4O3
Pemerian : hablur atau serbuk hablur,putih sampai krem, tidak
berbau
Kelarutan : sangat sukar larut dalam air, larut dalam
benzilalkohol, agak sukar larut dalam kloroform dan
dalam methanol, sangat sukar larut dalam etanol dan
dalam aseton, praktis tidak larut dalam eter dan
dalam karbon tetraklorida.
2.2.2 Mekanisme kerja
Aktivitas antibakteri kombinasi sulfametoksazol dan trimetoprim
berdasarkan kerjanya pada dua tahap yang berurutan pada reaksi enzimatik untuk
pembentukan asam tetrahidrofolat. Sulfonamida manghambat masuknya PABA
ke dalam molekul asam folat dan trimetoprim menghambat terjadinya reaksi
reduksi dari dihidrofolat menjadi tetrahidrofolat. Tetrahidrofolat penting untuk
reaksi-reaksi pemindahan satu atom C, seperti pembentukan basa purin (adenine
dan guanine), timidin dan beberapa asam amino (metinin, glisin). Sel-sel mamalia
menggunakan folat jadi yang terdapat dalam makanan dan tidak mensintesis
senyawa tersebut. Trimetoprim menghambat enzim dihidrofolat reduktase
mikroba secara sangat selektif. Hal ini penting, karena enzim tersebut juga
terdapat pada sel mamalia (Mariana, 1995).
2.2.3 Farmakokinetika
Pada pemberian oral preparat kombinasi dengan dosis tunggal,
trimetoprim diabsorpsi lebih cepat daripada sulfametoksazol. Trimetoprim cepat
didistribusikan ke dalam jaringan dan relatif sedikit terikat pada protein plasma
mudah. Pemberian 400 mg sulfametoksazol dengan 80 mg trimetoprim tiga kali
sehari, kadar steady state minimal di dalam darah dari masing-masing obat
kira-kira 20 dan 1 μg/ml, yakni perbandingan optimal yang dicari (Mariana, 1995).
2.2.4 Efek samping
Biasanya berupa gangguan kulit dan gangguan lambung-usus,
stomatitis. Pada dosis tinggi efek sampingnya juga berupa demam dan gangguan
fungsi hati dan efek-efek darah (neutropenia, trombositopenia). Oleh karena itu,
penggunaan lebih dari dua minggu hendaknya disertai dengan pengawasan darah
(Tjay dan Rahardja, 2002).
2.2.5 Dosis
Dosis dewasa untuk sebagian besar penyakit infeksi adalah 2 tablet setiap
12 jam selama 10 sampai 14 hari. Pada tifus dan infeksi parah diberikan 3 tablet
setiap 12 jam selama maksimum 14 hari. Pemberian pada anak-anak di bawah 12
tahun tidak dianjurkan (Mariana, 1995).
2.3 Teori Kromatografi
Kromatografi merupakan suatu cara pemisahan berdasarkan partisi
cuplikan antara fase gerak dan fase diam. Fase gerak (mobile phase) dapat berupa
gas atau cairan dan fase diam (stationery phase) dapat berupa cairan atau padatan.
Kromatografi dapat juga didefinisikan sebagai suatu proses migrasi diferensial
dimana komponen-komponen cuplikan ditahan secara selektif oleh fase diam
(Sastrohamidjojo, 1985).
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia
tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang
berisi kalsium karbonat (CaCO3
2.3.1 Pembagian Kromatografi
). (Johnson dan Stevenson, 1991).
Kromatografi dapat dibedakan atas berbagai macam, tergantung pada
pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi
dibedakan menjadi : (a) kromatografi adsorbsi; (b) kromatografi partisi; (c)
kromatografi pasangan ion; (d) kromatografi penukar ion (e) kromatografi
eksklusi ukuran dan (f) kromatografi afinitas (Johnson dan Stevenson, 1991 dan
Rohman, 2007).
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: (a)
kromatografi kertas; (b) kromatografi lapis tipis, yang kedua sering disebut
kromatografi planar; (c) kromatografi cair kinerja tinggi (KCKT) dan (d)
kromatografi gas (KG) (Johnson dan Stevenson, 1991 dan Rohman, 2007).
2.3.2 Migrasi dan Retensi Solut
Kecepatan migrasi solut melalui fase diam ditentukan oleh perbandingan
distribusinya (D) dan besarnya D ditentukan oleh afinitas relatif solut pada kedua
fase (fase diam dan fase bergerak). Dalam konteks kromatorgafi, nilai D
didefinisikan sebagai perbandingan konsentrasi solut dalam fase diam (Cs) dan
dalam fase gerak (Cm).
D =
Cm Cs
Jadi semakin besar nilai D maka migrasi solut semakin lambat; dan semakin kecil
nilai D migrasi solut semakin cepat. Solut akan terelusi menurut perbandingan
distribusinya. Jika perbedaan perbandingan distribusi solut cukup besar maka
2.3.3 Pemisahan pada kolom
Kolom merupakan bagian terpenting dari keseluruhan peralatan
kromatografi karena proses pemisahan campuran komponen terjadi di dalamnya.
Kemampuan kolom untuk memisahkan suatu campuran komponen disebabkan
karena fase diam yang terdapat di dalamnya dapat mengadakan interaksi dengan
berbagai komponen dengan kekuatan yang cukup berbeda satu sama lain sehingga
masing-masing komponen akan keluar dari kolom dengan waktu retensi yang
berbeda juga.
Ukuran interaksi suatu senyawa dengan fase diam dinyatakan sebagai
faktor kapasitas (k’
k
) yang dinyatakan dengan persamaan :
’
o o r
t t
t −
=
dimana tr adalah waktu retensi komponen yang ditahan oleh kolom dan to
Faktor kapasitas yang relatif besar menunjukkan adanya interaksi yang
relatif kuat antara komponen dengan fase diam sehingga komponen tertahan kuat
di dalam kolom dan sebaliknya faktor kapasitas yang relatif kecil menunjukkan
interaksi yang relatif lemah atau komponen hanya sedikit tertahan di dalam
kolom.
adalah
waktu retensi komponen yang tidak ditahan oleh kolom (Lily Wati, 1997).
Suatu kolom dikatakan selektif apabila kolom tersebut mempunyai
kemampuan menahan berbagai komponen dengan kekuatan yang cukup berbeda
sehingga faktor kapasitas dari masing-masing komponen juga berbeda. Suatu
campuran komponen dapat dipisahkan dengan sempurna di dalam kolom yang
Faktor selektivitas (α) didefinisikan sebagai ukuran pemisahan dua
komponen yang dapat dinyatakan dengan persamaan :
α = m m t t t t t t k k − − = = 1 2 1 ' 2 ' 1 ' 2 '
dimana k’1 = faktor kapasitas komponen 1; k’2 = faktor kapasitas komponen 2; t’1
= waktu retensi yang disesuaikan untuk komponen 1; t’2 = waktu retensi yang
disesuaikan untuk komponen 2; t1 = waktu retensi komponen 1; t2 = waktu retensi
komponen 2 dan tm
Faktor selektivitas (α) sebaiknya mempunyai harga lebih dari satu karena
pada harga α = 1 berarti k
= waktu retensi komponen yang tidak ditahan (garis depan
pelarut).
’
1 = k’2
Lebar atau sempitnya puncak suatu komponen ditentukan oleh efisiensi
kolom yang digunakan yang merupakan ukuran kemampuan kolom untuk
mencegah atau mengurangi terjadinya pergantian puncak. Suatu kolom yang
efisien akan dapat menghasilkan puncak-puncak komponen yang relatif sempit
sehingga jumlah komponen yang dapat dipisahkan relatif banyak. Efesiensi suatu
kolom akan semakin tinggi jika jumlah pelat teori (N) yang dikandung semakin
banyak.
sehingga komponen 1 dan komponen 2 tidak
terpisahkan. Harga α hanya menunjukkan adanya pemisahan pada bagian atas
puncak kromatogram tanpa memperhitungkan kemungkinan terjadinya tumpang
tindih pada bagian bawah puncak. Untuk suatu harga α yang sama terdapat dua
kemungkinan yang berbeda jika dilihat dari puncak dimana pemisahan sempurna
jika dihasilkan puncak-puncak komponen yang relatif sempit dan sebaliknya jika
puncak-puncak komponen yang dihasilkan lebar maka kemungkinan akan terjadi
Efisiensi dinyatakan secara kuantitatif sebagai jumlah pelat teori (N) yang
dinyatakan dengan persamaan :
N = 2 2 1 2 2 5 , 5 16 = = W t W t
tr r r
σ
Dimana σ = simpangan baku puncak, tr = jarak antara titik nol dengan titik potong
kedua garis singgung pada kedua sisi puncak komponen (waktu retensi), W =
lebar puncak pada alasnya yang ditentukan dengan memperpanjang garis
singgung puncak sampai memotong garis alas dan W1/2
Jumlah pelat teori berbanding lurus dengan panjang kolom, di mana
umumnya kolom yang lebih panjang mempunyai jumlah pelat yang lebih banyak,
tetapi penurunan tekanannya juga lebih besar. Karena panjang kolom
bermacam-macam, maka diperlukan ukuran keefisienan kolom yang tidak tergantung pada
panjang kolom. Tinggi atau jarak yang setara dengan dengan pelat teori, H atau
HETP (Height Equivalent to a Theoritical Plate), merupakan ukuran keefisienan
kolom yang lebih disukai karena memungkinkan perbandingan antara kolom yang
panjangnya berlainan dimana kolom yang mempunyai H yang kecil lebih baik. H
berkaitan dengan jumlah pelat teori dengan persamaan berikut :
= lebar puncak pada
setengah tinggi.
H = HETP =
N L
dimana L adalah panjang kolom (mm) dan N adalah jumlah pelat teori .
Ketiga parameter di atas mempunyai keterkaitan yang dapat
menggambarkan keberhasilan suatu pemisahan berupa ketergantungan resolusi
Rs Ν − + α α 1 1 4 1 ' ' k k =
(a) (b) (c)
dimana a = faktor kapasitas, b = faktor selektivitas, c = faktor efisiensi (Lily Wati,
1997).
Jika resolusi atau daya pisah 0,4 atau lebih kecil maka puncak tidak
menunjukkan secara jelas adanya 2 komponen atau lebih dan sebaliknya jika daya
pisah 0,5 atau lebih maka jumlah komponen yang ada dapat diidentifikasikan
dengan jelas. Tetapi umumnya untuk pekerjaan kualitatif atau kuantitatif yang
baik diperlukan daya pisah 1,5 atau lebih besar (Johnson dan Stevenson, 1991).
Dari persamaan di atas nampak jelas bahwa faktor-faktor yang
menentukan resolusi yaitu : selektivitas (α), jumlah lempeng (N), dan faktor
kapasitas (k’). Selektivitas dapat diubah dengan mengubah susunan fase diam dan
fase gerak. Menaikkan selektivitas akan menghasilkan salah satu puncak relatif
terhadap lainnya. Efisiensi suatu pemisahan ditunjukkan dengan faktor N yang
akan berubah dengan mengubah panjang kolom (L) atau kecepatan alir fase gerak.
Menaikkan faktor N suatu kolom akan menyebabkan penyempitan dua puncak
sehingga W menjadi kecil dan resolusinya menjadi lebih besar. Faktor k’ berubah
dengan mengubah kekuatan fase gerak. Misalkan, suatu pemisahan awal
memberikan harga k’ pada daerah 0,5-2. Penurunan nilai k’ akan menghasilkan
pemisahan yang jelas dan waktu retensi yang pendek, sementara itu kenaikan k’
akan memberikan resolusi yang lebih baik. Meskipun demikian, jika nilai k’ ini
dinaikkan maka akan menyebabkan tinggi puncak kromatogram akan turun dan
2.3.4 Profil Puncak dan Pelebaran Puncak
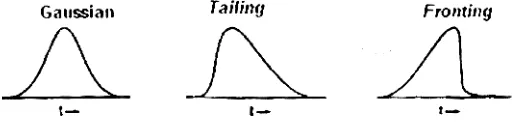
Selama pemisahan kromatografi, solut individual akan membentuk profil
konsentrasi yang simetris atau dikenal juga dengan profil Gaussian dalam arah
aliran fase gerak. Profil, dikenal juga dengan puncak atau pita, secara
perlahan-lahan akan melebar dan sering juga membentuk profil yang asimetrik karena
solut-solut melanjutkan migrasinya ke fase diam.
Adanya puncak, yang asimetris dapat disebabkan oleh hal –hal berikut:
• Ukuran sampel yang dianalisis terlalu besar. Jika sampel terlalu besar maka
fase gerak tidak mampu membawa solut dengan sempurna karenanya terjadi
pengekoran atau tailing.
• Interaksi yang kuat antara solut dengan fase diam dapat menyebabkan solut
sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang
mengekor.
• Adanya kontaminan dalam sampel yang dapat muncul terlebih dahulu
[image:34.595.184.442.519.583.2]sehingga menimbulkan puncak mendahului (fronting) (Rohman, 2007).
Gambar 2. Profil-profil puncak
2.3.5 Analisa Kualitatif dan Kuantitatif Analisis Kualitatif
Ada 3 pendekatan untuk analisa kualitatif yakni:
1. Perbandingan antara retensi solut yang tidak diketahui dengan data retensi
Untuk kromatografi yang menggunakan kolom (seperti KCKT dan KG),
waktu retensi (tR) atau volume retensi (VR
2. Dengan cara spiking.
) senyawa baku dan senyawa yang
tidak diketahui dibandingkan dengan cara kromatografi secara berurutan
dalam kondisi alat yang stabil dengan perbedaan waktu pengoperasian antara
keduanya sekecil mungkin.
Untuk kromatografi yang melibatkan kolom, spiking dilakukan dengan
menambah sampel yang mengandung senyawa tertentu yang akan diselidiki
dengan senyawa baku pada kondisi kromatografi yang sama. Hal ini dilakukan
dengan cara: pertama, dilakukan proses kromatografi sampel yang tidak di-
spiking. Kedua, sampel yang telah di-spiking dengan senyawa baku dilakukan
proses kromatografi. Jika pada puncak tertentu yang diduga mengandung
senyawa yang diselidiki terjadi peningkatan tinggi puncak/luas puncak setelah
di-spiking dibandingkan dengan tinggi puncak/luas puncak yang tidak
dilakukan spiking maka dapat diidentifikasi bahwa sampel mengandung
senyawa yang kita selidiki.
3. Menggabungkan alat kromatografi dengan spektrometer massa.
Pada pemisahan dengan menggunakan kolom kromatografi, cara ini akan
memberikan informasi data spektra massa solut dengan waktu retensi tertentu.
Spektra solut yang tidak diketahui dapat dibandingkan dengan spektra yang
ada di data base komputer yang diinterpretasi sendiri. Cara ini dapat dilakukan
Analisis Kuantitatif
Untuk menjamin kondisi yang digunakan dalam analisis kuantitatif stabil
dan reprodusibel, baik pada penyiapan sampel atau proses kromatografi, berikut
beberapa syarat yang harus dipenuhi dalam analisis kuantitatif:
• Analit (solut) harus telah diketahui dan terpisah sempurna dari
kompomen-komponen lain dalam kromatogram.
• Baku dengan kemurnian yang tinggi dan telah diketahui harus tersedia.
• Prosedur kalibrasi yang sudah diketahui harus digunakan.
Untuk kromatografi yang melibatkan kolom, kuantifikasi dapat dilakukan
dengan: luas puncak atau tinggi puncak. Tinggi puncak atau luas puncak
berbanding langsung dengan banyaknya solut yang dikromatografi, jika dilakukan
pada kisaran detektor yang linier.
1. Metode tinggi puncak
Metode yang paling sederhana untuk pengukuran kuantitatif adalah
dengan tinggi puncak. Tinggi puncak diukur sebagai jarak dari garis dasar ke
puncak maksimum seperti puncak 1, 2, dan 3 pada gambar 3. Penyimpangan garis
dasar diimbangi dengan interpolasi garis dasar antara awal dan akhir puncak.
Gambar 3. Pengukuran tinggi puncak
Metode tinggi puncak hanya digunakan jika perubahan tinggi puncak
pada puncak yang mengalami penyimpangan (asimetris) atau jika kolom
mengalami kelebihan muatan.
2. Metode luas puncak
Prosedur penentuan luas puncak serupa dengan tinggi puncak. Suatu
teknik untuk mengukur luas puncak adalah dengan mengukur luas puncak sebagai
hasil kali tinggi puncak dan lebar pada setengah tinggi (W1/2
Saat ini integrator elektronik telah banyak digunakan untuk mengukur luas
puncak pada kromatografi cair kinerja tinggi dan pada kromatografi gas.
Integrator digital mengukur luas puncak dan mengubahnya dalam bentuk angka
(Johnson Stevenson, 1991 dan Rohman, 2007).
). Tehnik ini hanya
dapat digunakan untuk kromatografi yang simetris atau yang mempunyai bentuk
serupa.
Baik tinggi puncak maupun luasnya dapat dihubungkan dengan
konsentrasi. Tinggi puncak mudah diukur, akan tetapi sangat dipengaruhi
perubahan waktu retensi yang disebabkan oleh variasi suhu dan komposisi
pelarut. Oleh karena itu, luas puncak dianggap merupakan parameter yang lebih
akurat untuk pengukuran kuantitatif (Ditjen POM, 1995).
Metode Kuantifikasi
1. Metode baku eksternal
Metode yang paling umum untuk menetapkan konsentrasi senyawa yang
tidak diketahui konsentrasinya dalam suatu sampel adalah dengan menggunakan
2. Metode baku internal
Baku internal merupakan senyawa yang berbeda dengan analit, meskipun
demikian senyawa ini harus terpisah dengan baik selama proses pemisahan.
Seringkali perlakuan sampel memerlukan tahapan-tahapan yang meliputi
derivatisasi, ekstraksi, filtrasi, dan sebagainya yang dapat mengakibatkan
berkurangnya sampel. Jika baku internal ditambahkan pada sampel sebelum
dilakukan preparasi sampel, maka baku internal dapat mengoreksi hilangnya
sampel-sampel ini.
Syarat-syarat suatu senyawa dapat digunakan sebagai baku internal adalah:
terpisah dengan baik dari senyawa yang dituju atau puncak-puncak lain;
mempunyai waktu retensi yang hampir sama dengan analit; tidak terdapat dalam
sampel; mempunyai kemiripan sifat-sifat dengan analit dalam tahapan-tahapan
penyiapan sampel; tidak mempunyai kemiripan secara kimiawi dengan analit;
tersedia dalam perdagangan dengan kemurnian tinggi; stabil dan tidak reaktif
dengan sampel atau dengan fase gerak; mempunyai respon detektor yang hampir
sama dengan analit pada konsentrasi yang digunakan (Johnson Stevenson, 1991
dan Rohman, 2007).
2.4 Kromatografi Cair Kinerja Tinggi
Kromatogarfi cair kinerja tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam
teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif
dan beragam sehingga mampu menganalisa berbagai cuplikan secara kualitatif
maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen
Kegunaan umum KCKT adalah untuk: pemisahan sejumlah senyawa
organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian
(impurities) dan analisis senyawa-senyawa yang tidak mudah menguap
(non-volatil). KCKT paling sering digunakan untuk: untuk menetapkan kadar
senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan
protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat
dan lain - lain.
2.4.1 Jenis-jenis Kromatografi
Menurut Johnson dan Stevenson (1991) dan Rohman (2007) jenis-jenis
kromatografi yaitu:
1. Kromatografi Cair-Padat (LSC)
Tehnik ini biasanya menggunakan fase diam silika gel atau alumina, meskipun
demikian sekitar 90% kromatografi ini memakai silika gel sebagai fase diamnya.
Fase geraknya berupa pelarut non polar yang ditambah dengan pelarut polar
seperti air atau alkohol rantai pendek untuk meningkatkan kemampuan elusinya
sehingga tidak timbul pengekoran puncak, seperti n-heksana ditambah metanol.
Jenis KCKT ini sesuai untuk pemisahan-pemisahan campuran isomer struktur dan
untuk pemisahan solut dengan gugus fungsional yang berbeda.
2. Kromatografi Partisi (LLC)
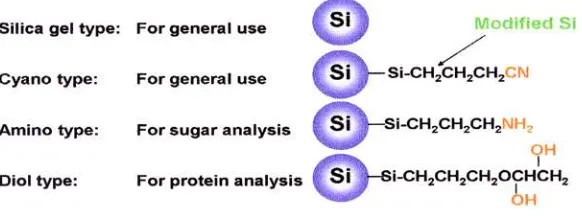
Kromatografi jenis ini disebut juga dengan kromatografi fase terikat.
Kebanyakan fase diamnya adalah silika yang dimodifikasi secara kimiawi atau
fase terikat. Sejauh ini yang digunakan untuk memodifikasi silika adalah
hidrokarbon-hidrokarbon non polar seperti oktadesilsilana, oktilsilana, atau
Fase diam yang paling populer digunakan adalah oktadesilsilana (ODS atau
C18
Kromatografi partisi (LLC), disebut “fase normal” bila fase diam lebih polar
dari fase gerak dan “fase terbalik” bila fase gerak lebih polar dari fase diam. ) dan kebanyakan pemisahannya adalah dengan fase terbalik. Sedangkan fase
geraknya adalah campuran asetonitril atau metanol dengan air atau dengan larutan
buffer.
a. Kromatografi fase normal
Kromatografi fase normal (fase diam lebih polar daripada fase gerak),
kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Fase
gerak ini biasanya tidak polar. Dietil eter, benzen, hidrokarbon lurus seperti
pentana, heksana, heptana maupun iso-oktana sering digunakan. Halida
alifatis seperti diklorometana, dikloroetana, butilklorida dan kloroform juga
digunakan. Umumnya gas terlarut tidak menimbulkan masalah pada fase
normal. (Munson, 1991 dan Rohman, 2007)
Fase diam yang digunakan dapat dilihat pada gambar dibawah ini:
[image:40.595.165.456.528.636.2]
Gambar 11. Jenis-jenis fase diam untuk tipe kromatografi fase normal
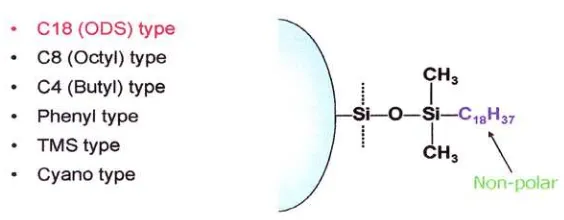
b. Kromatografi fase terbalik
Kromatografi fase terbalik (fase diam kurang polar daripada fase gerak),
Kandungan utama fase gerak fase terbalik adalah air. Pelarut yang dapat
campur dengan air seperti metanol, etanol, asetonitril, dioksan, tetrahidrofuran
dan dimetilformamida ditambahkan untuk mengatur kepolaran fase gerak.
Dapat ditambahkan pula asam, basa, dapar dan/atau surfaktan. Mutu air harus
tinggi baik air destilasi maupun awamineral.
[image:41.595.155.437.274.384.2]Fase diam yang digunakan dapat dilihat pada gambar dibawah ini :
Gambar 12. Jenis-jenis fase diam untuk tipe kromatografi fase terbalik
3. Kromatografi penukar ion
Tehnik ini tergantung pada penukaran (adsorpsi) ion-ion diantara fase gerak
dan tempat-tempat berion dari kemasan. Kebanyakan resin-resin berasal dari
polimer stiren divinilbenzen dimana gugus-gugus fungsinya telah ditambah.
Resin-resin tipe asam sulfonat dan amin kuarterner merupakan jenis resin
pilihan paling baik dan banyak digunakan. Keduanya, fase terikat dan resin
telah digunakan. Tehnik ini dipakai secara luas dalam life sciences dan dikenal
secara khas untuk pemisahan asam-asam amino. Tehnik ini dapat dipakai
untuk keduanya, kation-kation dan anion-anion.
4. Kromatografi eksklusi (EC)
Tehnik ini unik karena dalam pemisahan didasarkan pada ukuran molekul dari
sangat kecil yang inert. Molekul-molekul kecil dapat masuk ke dalam jaringan
dan ditahan dalam fase gerak yang menggenang. Molekul-molekul yang lebih
besar tidak dapat masuk ke dalam jaringan dan lewat melalui kolom tanpa
ditahan.
5. Kromatografi Pasangan Ion (IPC)
Kromatografi ini merupakan bentuk khusus dari kromatografi cair-cair yang
digunakan untuk pemisahan senyawa atau cuplikan yang mengandung
komponen ion dan non ion, seperti garam ammonium kuarterner, sulfonat,
asam amino dan aminofenol. Kromatografi pasangan ion dilakukan dengan
kondisi yang serupa dengan kondisi pada kromatografi fase balik yaitu dengan
sistem pelarut campuran air dengan metanol atau asetonitril dan kolom seperti
oktadesilsilana yang terikat pada silika.
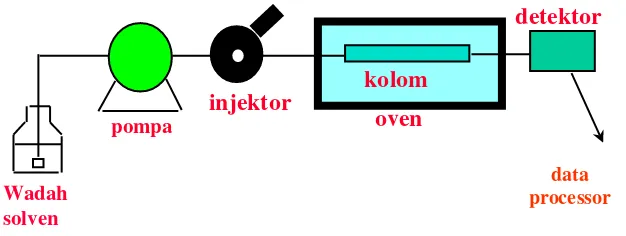
2.4.2 Komponen Kromatografi Cair Kinerja Tinggi
Gambar 5. Bagan alat KCKT 2.4.2.1 Wadah Fase gerak
Wadah fase gerak terbuat dari bahan yang inert terhadap fase gerak. Bahan
yang umum digunakan adalah gelas dan baja anti karat. Daya tampung tandon
harus lebih besar dari 500 ml, yang dapat digunakan selama 4 jam untuk
kecepatan alir yang umumnya 1-2 ml/menit.
pompa
injektor
kolom
oven
detektor
Wadah solven
[image:42.595.157.470.445.563.2]2.4.2.2 Pompa
Untuk menggerakkan fase gerak melalui kolom diperlukan pompa. Pompa
harus mampu menghasilkan tekanan 6000 Psi pada kecepatan alir 0,1 – 10
ml/menit. Pompa ada 2 jenis yaitu pompa volume konstan dan pompa tekanan
konstan. Pompa terbuat dari bahan yang inert terhadap semua pelarut. Bahan yang
umum digunakan adalah gelas baja antikarat dan teflon. Aliran pelarut dari pompa
harus tanpa denyut untuk menghindari hasil yang menyimpang pada detektor.
2.4.2.3 Injektor
Cuplikan harus dimasukkan ke dalam pangkal kolom (kepala kolom),
diusahakan agar sesedikit mungkin terjadi gangguan pada kemasan kolom.
Ada tiga jenis dasar injektor, yaitu:
a. Hentikan aliran/stop flow: Aliran dihentikan, injeksi dilakukan pada
kinerja atmosfer, sistem tertutup, dan aliran dilanjutkan lagi. Tehnik ini
bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak
dipengaruhi.
b. Septum: Injektor-injektor langsung ke aliran fase gerak umumnya sama
dengan yang digunakan pada kromatografi gas. Injektor ini dapat
digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak
tahan dengan semua pelarut-pelarut kromatografi cair. Disamping itu,
partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat
menyebabkan penyumbatan.
c. Katup putaran (loop valve): ditunjukkan secara skematik dalam Gambar 6,
tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih
(dengan adaptor khusus, volume-volume lebih kecil dapat diinjeksikan
secara manual). Pada posisi LOAD, sampel loop (cuplikan dalam putaran)
diisi pada tekanan atmosfer. Bila katup difungsikan, maka cuplikan di
dalam putaran akan bergerak ke dalam kolom.
Gambar 6. Tipe injektor katup putaran
2.4.2.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis
tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom
dapat dibagi menjadi dua kelompok:
• Kolom analitik: diameter khas adalah 2-6 mm. Panjang kolom tergantung
pada jenis kemasan. Untuk kemasan pelikular, panjang yang lumrah
adalah 50-100 cm. Untuk kemasan poros mikropartikulat, umumnya 10-30
cm. Dewasa ini ada yang 5 cm
• Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan
panjang kolom 25 -100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada
temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama
untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom
2.4.2.5 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan
dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki
sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang
luas, dan memberi tanggapan/respon untuk semua tipe senyawa.
Detektor yang paling banyak digunakan dalam kromatografi cair modern
kecepatan tinggi adalah detektor spektrofotometer UV 254 nm.
Bermacam-macam detektor dengan variasi panjang gelombang UV-Vis sekarang menjadi
populer karena mereka dapat digunakan untuk mendeteksi senyawa-senyawa
dalam rentang yang luas. Detektor indeks refraksi juga secara luas digunakan,
terutama dalam kromatografi eksklusi, tetapi umumnya kurang sensitif dari pada
detektor spektrofotometer UV. Detektor lainnya, antara lain: detektor fluorometer,
detektor ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan.
2.4.2.7Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel (Johnson dan Stevenson, 1991;
Munson, 1991 dan Rohman, 2007).
Dalam kromatografi cair komposisi pelarut atau fase gerak adalah satu
variabel yang mempengaruhi pemisahan. Terdapat keragaman yang luas dari
solven yang digunakan dalam semua mode kromatografi cair kinerja tinggi, tetapi
ada beberapa sifat-sifat yang diinginkan yang mana umumnya harus dipenuhi oleh
Fase gerak yang digunakan dalm KCKT harus murni, tidak ada
pencemar/kontaminan; tidak bereaksi dengan pengemas; sesuai dengan detektor;
melarutkan cuplikan; mempunyai viskositas rendah; mudah rekoveri cuplikan,
bila diinginkan; tersedia diperdagangan dengan harga yang pantas.
Umumnya, pelarut-pelarut dibuang setelah digunakan karena prosedur
pemurnian kembali membosankan dan mahal. Dari semua persyaratan di atas, 4
persyaratan pertama adalah yang paling penting.
Gelembung udara (degassing) yang ada harus dihilangkan dari pelarut,
karena udara yang terlarut keluar melewati detektor dapat menghasilkan banyak
noise sehingga data tidak dapat digunakan (Johnson dan Stevenson, 1991 dan
Rohman, 2007).
2.5Uji Validasi
Validasi metode dilakukan untuk menjamin bahwa metode analisis akurat,
spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Suatu
metode analisis harus divalidasi untuk melakukan verifikasi bahwa
parameter-parameter kinerjanya cukup mampu untuk mengatasi problem analisis.
Parameter-parameter uji validasi antara lain :
a. Akurasi (kecermatan)
Merupakan ketelitian metode analisis atau kedekatan antara nilai terukur
dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya, atau nilai
rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali
pada suatu pengukuran dengan melakukan spiking pada suatu sampel.
Untuk pengujian senyawa obat, akurasi diperoleh dengan membandingkan
b. Presisi (keseksamaan)
Merupakan ukuran keterulangan metode analisis dan biasanya dinyatakan
sebagai simpangan baku relatif dari sejumlah sampel yang berbeda
signifikan secara statistik.
c. Batas deteksi (Limit of detection, LOD)
Merupakan konsentrasi analit terkecil dalam sampel yang masih dapat
dideteksi, meskipun tidak selalu dapat dikuantifikasi.
d. Batas kuantitasi (Limit of Quantitation, LOQ)
Merupakan konsentrasi analit terendah dalam sampel yang dapat
ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi
operasional metode yang digunakan (Rohman, 2007).
2.6Uraian Bentuk Sediaan Tablet
Tablet merupakan sediaan padat kompak, dibuat secara kempa cetak,
dalam bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung,
mengandung satu jenis obat atau lebih dengan atau zat tambahan (Depkes RI,
1979).
ediaan tablet mempunyai keuntungan dibandingkan dengan bentuk
sediaan lainnya karena memberikan dosis yang tepat pada pemakaiannya, mudah
pemakaian, cara pembuatannya sederhana, mudah pengemasan dan distribusinya.
Pada pembuatan tablet biasanya diperlukan bahan-bahan lain sebagai
bahan tambahan, seperti bahan pengisi, bahan pengikat, bahan pelicin, dan bahan
Tablet dibuat dengan cara pengempaan campuran serbuk atau granul,
semakin kuat tekanan pengempaan maka tablet akan menjadi lebih kompak
karena permukaan partikel lebih rendah (Ansel, 1989).
2.7Bahan tambahan dalam sediaan tablet
Komposisi umum dari tablet adalah zat berkhasiat, bahan pengisi, bahan
pengikat dan bahan pelicin. Kadang-kadang dapat ditambahkan pewangi
(flavoring agent), bahan pewarna (coloring agent), bahan pemanis dan bahan
tambahan lain yang cocok (Ansel, 1989).
2.7.2Bahan pengisi
Bahan pengisi diperlukan bila dosis obat tidak cukup untuk membuat
sediaan. Pada bahan obat yang berdosis cukup tinggi, bahan pengisi tidak
diperlukan (misalnya aspirin, antibiotik tertentu). Bahan pengisi dapat juga
ditambah karena alasan kedua yaitu untuk memperbaiki daya kohesi sehingga
dapat dikempa langsung atau untuk memacu aliran. Bahan pengisi yang umumnya
digunakan adalah laktosa, sukrosa, mannitol, sorbitol, golongan amilum dan
avicel (Soekemi, dkk, 1987).
2.7.2 Bahan pengikat
Gunanya adalah untuk mengikat komponen-komponen tablet untuk
dijadikan granul dengan ukuran yang sama dan bentuk yang spheris setelah
dipaksakan melewati ayakan. Dengan adanya bahan pengikat, komponen tablet
akan mudah dibentuk menjadi granul, sehingga akan memudahkan pencetakan.
Bahan-bahan yang sering digunakan sebagai bahan pengikat yaitu amilum,
gelatin, akasia, Na alginat, sukrosa dan golongannya, CMC, Veegum dan lain-lain
2.7.3 Bahan pengembang
Ditambahkan untuk memecahkan tablet menjadi partikel-partikel kecil
sehingga luas permukaan diperbesar dan absorpsi dipermudah. Bahan-bahan yang
biasa digunakan sebagai pengembang yaitu amilum, gom, derivat sellulosa,
alginat, dan lain-lain.
2.7.4 Bahan pelicin
Ditambahkan dengan maksud meningkatkan daya alir granul-granul pada
corong pengisi, mencegah melekatnya massa pada punch dan die, mengurangi
pergesekan antara butir-butir granul, mempermudah pengeluaran tablet dari die.
Bahan pelicin yang umumnya digunakan adalah talkum dan metalik stearat seperti
BAB III
METODOLOGI PENELITIAN 3.1 Waktu dan tempat penelitian
Penelitian dilakuk an di laboratorium Kimia Farmasi Kuantitatif dan
laboratorium Teknologi Formulasi Resep Fakultas Farmasi Universitas Sumatera
Utara serta Lembaga Pengkajian Pangan Obat-obatan dan Kosmetik Majelis
Ulama Indonesia Kota Medan pada bulan Juni 2008 sampai Agustus 2008.
3.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat KCKT
(Shimadzu) yang terdiri dari vacuum degasser, pompa, UV/Vis detektor,
integrator, kolom Shimpac VP-ODS (3,9 mm x 30 cm), penyuntik mikroliter (100
μl), wadah fase gerak, pH meter (Hanna), spektrofotometer ultraviolet (Shimadzu
mini 1240), mesin pencetak tablet single punch (Atelier), strong cobb hardness
tester (Erweka), stopwatch, mortir, stamfer, oven, ayakan, dan alat-alat gelas
lainnya.
3.3 Bahan-bahan
Bahan-bahan yang digunakan jika tidak dinyatakan lain adalah kualitas p.a
produksi E.Merck yaitu asetonitril, metanol, trietilamina, asam asetat glasial,
natrium hidroksida, aquabidestilata (PT. Ikapharmindo Putramas), laktosa,
amilum manihot, talkum, magnesium stearat, Sulfametoksazol BPFI (PPOM
Jakarta), Trimetoprim BPFI (PPOM Jakarta), Sulfametoksazol baku (PT.
Indofarma), Trimetoprim baku (PT. Indofarma), tablet Cotrimoksazole (PT. Phyto
Kemo Agung Farma), tablet Cotrimoksazole (PT. Indofarma), tablet Bactrim (PT.
3.4 Metode penelitian
3.4.1 Pembuatan tablet kotrimoksazol R/ Sulfametoksazol 400 mg
Trimetoprim 80 mg
Amilum manihot 5%
Musilago amili 10% q.s.
Mg Stearat 1%
Talkum 1%
Laktosa q.s.
m.f.tab dtd no.C (Depkes RI, 1978)
Cara Pembuatan :
Ke dalam lumpang dimasukkan sulfametoksazol dan trimetoprim, lalu
ditambahkan amilum manihot sebagai pengembang dalam, ditambahkan laktosa
dan dicampurkan sampai homogen. Kemudian musilago amili ditambahkan
sedikit demi sedikit hingga diperoleh massa yang baik, kemudian diayak dengan
ayakan mesh 8. Granulat basah dikeringkan pada lemari pengering pada suhu
tidak lebih dari 40-60o
3.4.2 Uji preformulasi
C selama lebih kurang 6 jam. Setelah kering granulat
diayak kembali dengan ayakan mesh 12, ditambahkan amilum manihot sebagai
pengembang luar, talkum dan magnesium stearat dalam jumlah tertentu, diaduk
homogen lalu dicetak menjadi tablet dengan bobot 600 mg dan penampang 13
mm.
Uji preformulasi ini dilakukan terhadap massa granul yang telah ditambah
3.4.2.1 Uji Sudut Diam (Cartensen, 1977)
Ditimbang 50 gram granul kemudian dimasukkan ke dalam corong yang
telah dirangkai, permukaan granul diratakan, lalu penutup corong dibuka sehingga
granul mengalir sampai habis. Tinggi tumpukan granul yang terbentuk diukur.
Sudut diam dapat dihitung dengan menggunakan rumus :
Tg θ = 2 H / D
Dimana : θ = Sudut diam
H = Tinggi tumpukan granul (cm)
D = Diameter tumpukan granul (cm)
Granul yang bersifat free flowing akan mempunyai sudut diam lebih kecil dari
35o
3.4.2.2 Uji Laju Alir / Kecepatan Alir (Cartensen, 1977) .
50 gram granul dimasukkan ke dalam corong yang telah dirangkai
kemudian permukaannya diratakan. Penutup bawah dibuka bersamaan dengan
stopwatch dihidupkan. Stopwatch dihentikan tepat pada saat granul habis
melewati corong dan dicatat waktu alirnya. Syarat laju alir granul lebih kecil dari
10 detik.
3.4.2.3 Uji Indeks Tap (Cartensen, 1977)
Dimasukkan 50 ml granul ke dalam gelas ukur volume 100 ml sampai
garis tanda dan dinyatakan sebagai volume awal (V1), kemudian gelas ukur
dihentakkan sebanyak 20 kali sehingga diperoleh volume akhir (V2
Syarat dari indeks tap lebih kecil dari 20%.
3.4.3 Pembuatan Fase Gerak
Dicampurkan 1400 ml air, 400 ml asetonitril, dan 2,0 ml trietilamina
dalam labu tentukur 2000 ml, biarkan hingga suhu kamar dan atur pH hingga 5,9
± 0,1 dengan larutan asam asetat glasial (1 dalam 100). Encerkan dengan air
sampai garis tanda, saring melalui membran 0,45 μm. Sebelum digunakan, fase
gerak diawaudarakan selama lebih kurang 15 menit.
3.4.4 Penentuan Panjang Gelombang Maksimum 3.4.4.1 Pembuatan larutan induk baku BPFI
Ditimbang seksama sejumlah 50,0 mg sulfametoksazol BPFI dan
trimetoprim BPFI, masing-masing dimasukkan ke dalam labu tentukur 50 ml,
dilarutkan dan diencerkan dengan metanol hingga garis tanda sehingga diperoleh
larutan dengan konsentrasi 1000 mcg/ml, disaring, filtratnya digunakan sebagai
larutan induk.
3.4.4.2 Penentuan panjang gelombang maksimum Sulfametoksazol BPFI Dari larutan induk baku Sulfametoksazol BPFI dipipet sebanyak 1,25 ml,
dimasukkan ke dalam labu tentukur 50 ml, dicukupkan dengan fase gerak sampai
garis tanda. Dikocok sampai homogen sehingga diperoleh larutan dengan
konsentrasi 25 mcg/ml. Diukur dengan spektrofotometer UV-Vis, kemudian
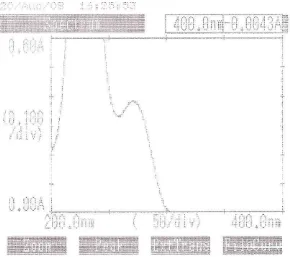
dibuat kurva serapannya pada panjang gelombang 200 – 400 nm. (Hasil
pengukuran dapat dilihat pada gambar 1 di halaman 39)
3.4.4.3 Penentuan panjang gelombang maksimum Trimetoprim BPFI
Dari larutan induk baku trimetoprim BPFI dipipet sebanyak 1 ml,
dimasukkan ke dalam labu tentukur 50 ml, dicukupkan dengan fase gerak sampai
konsentrasi 20 mcg/ml. Diukur dengan spektrofotometer UV-Vis, kemudian
dibuat kurva serapannya pada panjang gelombang 200 – 400 nm. (Hasil
pengukuran dapat dilihat pada gambar 2 di halaman 39)
3.4.5 Penentuan Panjang Gelombang Analisis
Panjang gelombang analisis ditentukan dengan cara membuat spektrum
serapan masing-masing dari sulfametoksazol dan trimetoprim dalam pelarut fase
gerak pada kerangka yang sama dan dipilih panjang gelombang yang sesuai, yaitu
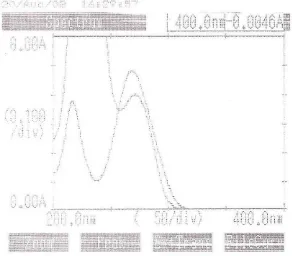
yang memberikan serapan yang optimum untuk sulfametoksazol dan trimetoprim.
(Hasil pengukuran dapat dilihat pada gambar 3 di halaman 40)
3.4.6 Penyiapan alat KCKT
Kolom yang digunakan Shimpac VP-ODS (4.6 mm x 25 cm), detektor
UV-Vis pada panjang gelombang 270 nm. Pompa yang digunakan mode aliran
tetap dengan laju aliran (flow rate) 2 ml/menit, sensitivitas 0,01 AUFS.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak
dibiarkan mengalir beberapa lama sampai diperoleh garis alas yang datar yang
menandakan sistem tersebut telah stabil.
3.4.7 Identifikasi
Sulfametoksazol BPFI konsentrasi 160 mcg/ml, trimetoprim BPFI
konsentrasi 32 mcg/ml, tablet kotrimoksazol yang dibuat sendiri dan
kotrimoksazol dalam sediaan tablet dengan nama dagang dan generik dengan
konsentrasi setara dengan sulfametoksazol 160 mcg/ml masing-masing
disuntikkan ke sistem KCKT dengan volume penyuntikan 20 µl pada kondisi
KCKT yang sama. Puncak yang ditunjukkan diperhatikan dan dicatat waktu
waktu retensi sulfametoksazol BPFI dan trimetoprim BPFI. (Hasil dapat dilihat
pada gambar 4 di halaman 41-42)
3.4.8 Penentuan kuantitatif
3.4.8.1 Pembuatan linieritas kurva kalibrasi 3.4.8.1.1 Kurva kalibrasi sulfametoksazol BPFI
Dipipet larutan induk baku sulfametoksazol sebanyak 0,5; 1,0; 1,6; 2,0;
dan 2,5 ml, masing-masing dimasukkan ke dalam labu tentukur 10 ml, diencerkan
dengan fase gerak hingga garis tanda sehingga diperoleh konsentrasi 50, 100, 160,
200 dan 250 mcg/ml, disaring, kemudian filtratnya masing-masing diinjeksikan ke
sistem KCKT dengan volume penyuntikan 20 µl dengan laju aliran (flow rate) 2
ml/menit, deteksi dilakukan pada panjang gelombang 270 nm. Selanjutnya dari
luas area kromatogram yang diperoleh dibuat kurva kalibrasi lalu hitung
persamaan regresinya. (Hasil dapat dilihat pada lampiran 3-4 di halaman 53-56)
3.4.8.1.2 Kurva kalibrasi trimetoprim BPFI
Dipipet larutan induk baku trimetoprim sebanyak 0,1; 0,2; 0,32; 0,4; dan
0,5 ml, masing-masing dimasukkan ke dalam labu tentukur 10 ml, diencerkan
dengan fase gerak hingga garis tanda sehingga diperoleh konsentrasi 10, 20, 32,
40 dan 50 mcg/ml, disaring, kemudian filtratnya masing-masing diinjeksikan ke
sistem KCKT dengan volume penyuntikan 20 µl dengan laju aliran (flow rate) 2
ml/menit, deteksi dilakukan pada panjang gelombang 270 nm. Selanjutnya dari
luas area kro