Bahan Seminar Hasil Penelitian Departemen Kimia
STUDI PENGARUH WAKTU PENGOMPOSAN TERHADAP KANDUNGAN KARBON DAN NITROGEN DI DALAM
KOMPOS HIDRILLA (Hydrilla verticilatta l.f.royle)
Oleh :
RUNGGU.D.SAMOSIR Nim : 030802015
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
STUDI PENGARUH WAKTU PENGOMPOSAN TERHADAP KANDUNGAN KARBON DAN NITROGEN DI DALAM
KOMPOS HIDRILLA (Hydrilla verticilatta.l.f.royle)
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
RUNGGU DOHAR SAMOSIR 030802015
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :STUDI PENGARUH WAKTU PENGOMPOS
TERHADAP KANDUNGAN KARBON DAN NITROGEN DI DALAM KOMPOS HIDRILLA (Hydrilla verticilatta.l.f.royle)
Kategori : SKRIPSI
AN
Nama : RUNGGU DOHAR SAMOSIR
Nim : 030802015
Program studi : SARJANA ( S1 ) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, November 2008 Komisi Pembimbing :
Dosen Pembimbing II Dosen Pembimbing I
Drs.Firman Sebayang.MS. Jamahir Gultom, Ph.D NIP. 131 459 468 NIP.130 610 761
Mengetahui, Ketua Departemen,
PERNYATAAN
STRUDI PENGARUH WAKTU PENGOMPOSAN TERHADAP KANDUNGAN KARBON DAN NITROGEN DI DALAM
KOMPOS HIDRILLA (Hydrilla verticilatta.l.f.royle)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, November 2008
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa berkat kasih dan karunia-Nya penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
ABSTRAK
Telah dilakukan penelitian tentang pengaruh waktu pengomposan terhadap kadar karbon ( C ) dan Nitrogen ( N ) pada kompos Hidrilla (Hydrilla verticilatta l.f.Royle.). Pengambilan sampel dilakukan secara acak dari pantai Parapat. Sampel terlebih dahulu dikeringkan sebelum pengomposan (0 hari), kemudian dikomposkan dengan bakteri EM4
STUDY EFFECT OF DECOMPOSITION TIME ON CONTAINED C – ORGANIK AND NITROGEN IN COMPOST HIDRILLA
(Hydrilla verticilatta l.f.royle)
ABSTRACT
DAFTAR ISI
2.6.1. Teknologi Pengomposan Aerobik 21 2.6.2. Teknologi Pengomposan Anaerobik 22 2.7. Effective Microorganism 4 ( EM4 ) 25
2.7.1. Fungsi Effective Microorganism ( EM ) 26 2.8. Penentuan Nitrogen Dengan Metode Kjeldahl 27 2.9. Penentuan Kadar C – Organik 27 3.3.4.1. Pembuatan Pereaksi Untuk Penentuan C – Organik 30 3.3.4.2. Pembuatan Pereaksi Untuk Penentuan Nitrogen 30
( Metode Kjeldahl )
3.3.4.3. Penentuan Kadar C – Organik Pada Sampel 32
3.3.4.4. Penentuan Nitrogen 32
3.4. Bagan Penelitian 34
3.4.1. Pembuatan Starter EM4 34
3.4.2. Penyediaan Sampel Dan Tahap Fermentasi dengan EM4 35
3.4.3. Bagan Penentuan Kadar Karbon Metode Walkley dan Black 36 3.4.4. Bagan Penentuan Nitrogen Metode Kjeldahl 37
BAB 4 HASIL DAN PEMBAHASAN 38
4.1. Hasil dan Pengolahan Data 38
BAB 5 KESIMPULAN DAN SARAN 47
5.1. Kesimpulan 47
5.2. Saran 47
DAFTAR PUSTAKA 48
DAFTAR TABEL
Halaman Tabel 2.3.4 Sumber Bahan Baku Pembuat Kompos dan Rasio C/N nya 11 Tabel 2.3.6.1 Kandungan Unsur Hara dalam Kompos 14 Tabel 2.3.6.2 Stadar Kualitas Pupuk Organik Menurut Departemen Pertanian 14 Tabel 4.3 Data Pengukuran C – Organik dengan Metode Walkley Black 50 Tabel 4.4 Data Pengukuran Nitrogen Metode Kjeldahl 50
DAFTAR GAMBAR
Halaman
n DAFTAR LAMPIRAN
Halama
Lampiran – 1 Data Pengukuran C – Organik dengan Metode Walkley dan Black 49
Lampiran – 2 Data pengukuran Nitrogen dengan Metode Kjeldahl 49
Lampiran – 3 Data Rasio C/N Daripada Kompos 50
Lampiran – 4 Standar Kualitas Kompos Menurut SNI 19 – 7030 – 2004 51
Lampiran – 5 Bakteri Effective Microorganism 4 ( EM4 ) 52
ABSTRAK
Telah dilakukan penelitian tentang pengaruh waktu pengomposan terhadap kadar karbon ( C ) dan Nitrogen ( N ) pada kompos Hidrilla (Hydrilla verticilatta l.f.Royle.). Pengambilan sampel dilakukan secara acak dari pantai Parapat. Sampel terlebih dahulu dikeringkan sebelum pengomposan (0 hari), kemudian dikomposkan dengan bakteri EM4
STUDY EFFECT OF DECOMPOSITION TIME ON CONTAINED C – ORGANIK AND NITROGEN IN COMPOST HIDRILLA
(Hydrilla verticilatta l.f.royle)
ABSTRACT
BAB I
PENDAHULUAN
1.1. Latar Belakang
Danau Toba merupakan danau terbesar dan terindah di Indonesia, disamping keindahannya, Danau Toba juga memiliki sumber daya dan kekayaan alam yang sangat potensial. Dengan alasan keindahannya banyak wisatawan yang datang berkunjung baik wisatawan domestik maupun mancanegara. Danau Toba juga dimanfaatkan masyarakat setempat untuk berbagai peruntukan yaitu sebagai sumber air minum, air mandi, air pencuci, dan juga sebagai medium budi daya ikan dan keperluan industri seperti PLTA Asahan. Namun dibalik keindahan panoramanya terdapat tumbuhan yang sangat merugikan ekosistem seperti, Hidrilla dan eceng gondok.
Perkembangan tumbuhan ini sangat pesat yang disebabkan pengayaan nutrien dan unsur hara yang masuk ke perairan Danau Toba baik dari pakan ikan maupun limbah domestik. Beberapa tahun terakhir ini, perkembangan tumbuhan hidrilla diperairan Danau Toba cukup pesat, terutama didaerah perairan yang dimanfaatkan sebagai media budidaya ikan keramba. Pertumbuhan hidrilla dan eceng gondok yang intensif dapat menyebabkan penutupan permukaan air yang signifikan sehingga jumlah oksigen terlarut di dalam air menjadi sangat rendah dan hal ini akan menyebabkan pertumbuhan mahluk hidup di dalam air akan terganggu dan akan menyebabkan penurunan kualitas lingkungan hidup di perairan Danau Toba.
Jika penyebaran tumbuhan ini tidak segera ditangani dengan baik, maka akan sangat merugikan bagi semua pihak, dan tentunya akan dibutuhkan biaya dan anggaran yang sangat besar untuk mengatasinya. Oleh karena itu penulis tertarik untuk ambil bagian dalam pemanfaatan tumbuhan ini untuk dijadikan sebagai bahan baku kompos.
Kompos merupakan hasil dari pelapukan bahan-bahan berupa dedaunan, jerami, alang-alang, kotoran hewan, sampah kota, dan sebagainya. Proses pelapukan bahan-bahan tersebut dapat dipercepat melalui bantuan manusia. Secara garis besar membuat kompos berarti merangsang perkembangan bakteri (mikroorganisme) untuk menghancurkan atau menguraikan bahan-bahan yang dikomposkan hingga terurai menjadi senyawa lain. Penguraian bahan-bahan tersebut dibantu oleh suhu . Proses penguraian tersebut mengubah unsur hara yang terikat dalam senyawa organik yang sukar larut menjadi senyawa organik yang mudah larut sehingga berguna bagi tanaman.
Pembuatan kompos sebenarnya mirip proses terbentuknya humus dialam. Melalui rekayasa kondisi lingkungan, kompos dapat dibuat serta dipercepat prosesnya hanya dalam beberapa minggu. Dengan kata lain, kecepatan pembentukan kompos melebihi kecepatan pembentukan humus secara alami. Oleh karena itu, kompos dapat tersedia dalam waktu yang relatif singkat. Pada umumnya kompos dibuat dengan dua cara yakni pengomposan dengan aerobik dan pengomposan anaerobik.
Kompos dikatakan bagus dan siap digunakan jika tingkat kematangannya sempurna. Kompos yang baik dapat dikenali dengan memperhatikan bentuk fisiknya, jika diraba, suhu tumpukan bahan yang dikomposkan sudah dingin, mendekati suhu ruang, tidak mengeluarkan bau busuk, bentuk fisiknya sudah menyerupai tanah yang berwarna hitam. Jika dianalisis dilaboratorium, kompos yang sudah matang akan memiliki ciri yakni, tingkat keasaman (pH) kompos antara 6,5 - 7,5, memiliki rasio C/N sebesar 10 – 20, kapasitas tukar kation (KTK) tinggi, mencapai 110 mek/100 gram, daya absorbsi (penyerapan) air tinggi. (Simamora. S, 2006)
1.2. Permasalahan
1.3. Pembatasan masalah
Penelitian ini dibatasi dan dititikberatkan pada pengomposan hidrilla dengan EM4 dan
menentukan rasio C/N sebelum dan sesudah pengomposan berlangsung 2, 4, 8, 12,16, dan 20 hari
1.4. Tujuan penelitian
Penelitian ini bertujuan untuk mengetahui waktu pengomposan yang optimum daripada hidrilla sehingga dapat digunakan sebagai pupuk organik
1.5. Manfaat penelitian
Hasil penelitian ini dapat dimanfaatkan sebagai sumber informasi yang berguna dalam upaya memanfaatkan tumbuhan hidrilla yang ada di perairan Danau Toba sehingga masyarakat setempat dapat mempergunakannya dan dengan demikian secara otomatis turut ambil bagian dalam upaya pembersihan Danau Toba
1.6. Lokasi penelitian
Penelititan ini dilakukan di Pusat Laboratorium Uji Mutu-Lembaga Penelitian Universitas Sumatera Utara.
1.7. Metodologi penelitian
1. Penelitian ini merupakan eksperimen laboratorium
2. Pengambilan tumbuhan hidrilla dilakukan secara acak disekitar Parapat 3. Dedak diambil dari Binjai
4. Sekam kayu diambil dari Jl.A.H. Nasution Medan
5. Penentuan kadar Nitrogen dilakukan dengan metode Kjeldahl
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Hidrilla
Tumbuhan hidrilla merupakan tumbuhan air yang berasal dari daerah Asia beriklim tropis. Tumbuhan hidrilla adalah tumbuhan yang mempunyai daya penyebaran yang sangat cepat dan merupakan tumbuhan liar. Dimanapun tumbuhan ini berada akan menyebabkan kerugian yang sangat besar,karena interferensinya terhadap penggunaan daerah perairan, menggantikan komunitas tumbuhan aquatik yang lainnya, dan memberikan dampak yang sangat merugikan terhadap ekosistem perairan.
Hidrilla merupakan tumbuhan yang memiliki bentuk yang bervariasi dan kelihatannya tergantung pada kondisi pertumbuhannya. Tanaman ini umumnya tumbuh didasar danau, walaupun terkadang bagian dari tumbuhan ini terputus namun akan dapat tetap bertahan dengan cara mengapung. Cabang dari tumbuhan ini sangat jarang pada masa pertumbuhan, dan akan bercabang ketika ujungnya telah sampai kepermukaan air, dan akan semakin bertambah banyak.
Daun hidrilla mempunyai lebar 2-4 mm, dan panjangnya 6-20 mm, dan tumbuhan ini biasanya tumbuh pada sedimen yang kaya akan bahan organik menyebabkan warna menjadi merah kecoklatan, dan dapat berubah warna menjadi hijau karena adanya sinar matahari yang menghasilkan zat hijau daun.
2.1.1. Penyebaran Tumbuhan Hidrilla
Pada 1988 Departemen Sumber Daya Alam Florida memperkirakan lebih dari 20.000 ha dari perairan diwilayah Florida terdapat tumbuhan hidrilla, hidrilla selanjutnya menyebar di Florida, dan pada tahun 1995 lebih dari 40.000 ha wilayah perairannya dipenuhi oleh tumbuhan ini, dimana perairan ini pada umumnya adalah perairan umum.
Habitat pertumbuhan dari hidrilla memungkinkan untuk berkompetensi secara efektif dengan adanya sinar matahari, hal ini dapat mempercepat petumbuhannya sampai kira-kira 1 inci perhari dan tumbuh sampai mendekati permukaan air. Pada permukaan air cabangnya tumbuh sangat banyak dan menghasilkan batang yang sangat kuat dibanding tumbuhan perairan lainnya. Hidrilla mampu menyerap cahaya matahari dan mampu bersaing dengan tumbuhan lainnya serta mampu juga menggunakan nutrisi secara efisien. Jaringan hidrilla terdiri dari 90% air, oleh karena itu tumbuhan ini dapat berkembang biak sekalipun dengan persediaan nutrisi esensial yang terbatas seperti karbon, nitrogen, dan fospor. Hidrilla mampu tumbuh dibawah kondisi range kimia yang sangat lebar. Hal ini pada umumnya di temukan pada danau yang rendah nutrisi hingga yang tinggi nutrisi. Tumbuhan ini juga dapat bertahan hidup pada salinitas 7% pada air laut dan dapat juga bertahan pada range pH yang lebar. Hidrilla dapat beradaptasi dengan level sinar matahari yang sangat rendah untuk fotosintesis, hal ini berarti hidrilla dapat melakukan fotosintesis lebih awal pada pagi hari sehingga berhasil bersaing dengan tumbuhan yang lainnya.
(http://plants.fas.u.f.l.edu/hydcric.html)
2.2. Unsur-Unsur Hara Penyusun Tanaman
Hasil penelitian para ahli telah menunjukkan bahwa tanaman terdiri dari air sebanyak 90% dan bahan kering sebesar 10%.
Bahan kering terdiri dari bahan-bahan organik dan anorganik yakni: - karbon sekitar 47%
Bahan anorganik yang terkandung didalamnya adalah mineral atau abu, dan berdasarkan hasil analisa terdiri dari sekitar 50 elemen atau unsur.
2.2.1. Unsur-Unsur Hara Makro
a. Karbon, Oksigen, dan Hidrogen. 1. Karbon
Penting sebagai pembangun bahan organik, karena sebagian besar bahan kering tanaman terdiri dari bahan organik, Karbon diambil tanaman berupa CO2, sumber karbon banyak
di udara.
2. Oksigen
Terdapat dalam bahan organik dan termasuk pembangun bahan organik, diambil dalam bentuk karbon dioksida dan air. Sumbernya tidak terbatas.
3. Hidrogen
Merupakan elemen pokok pembangun bahan organik, bersumber dari air, sumbernya tidak terbatas.
b. Nitrogen
Nitrogen merupakan unsur hara utama dari pertumbuhan tanaman, yang pada umumnya sangat diperlukan untuk pembentukan atau pertumbuhan bagian-bagian vegetatif tanaman, seperti daun, batang dan akar, tetapi kalau terlalu banyak dapat menghambat pembungaan dan pembuahan tanaman.
Fungsi Nitrogen yang selengkapnya bagi tanaman adalah sebagai berikut: 1. Untuk meningkatkan pertumbuhan tanaman
2. Dapat menyehatkan pertumbuhan daun, daun tanaman lebar dengan warna yang lebih hijau. Kekurangan Nitrogen menyebabkan klorosis (pada daun muda berwarna kuning pucat).
3. Meningkatkan kadar protein dalam tanaman.
5. Meningkatkan berkembangbiaknya mikroorganisme di dalam tanah.(Mulyadi.M, 2002)
Nitrogen merupakan unsur hara makro utama yang sangat penting untuk pertumbuhan tanaman. Nitrogen diserap oleh tanaman dalam bentuk ion NO3- dan NH4+ dari tanah.
Kadar nitrogen rata-rata dalam jaringan tanaman adalah 2%-4% berat kering. Dalam tanah, kadar nitrogen sangat bervariasi, tergantung pada pengelolaan penggunaan tanah tersebut. Ada dugaan bahwa senyawa organik, misalnya asam nukleat dan asam amino larut, dapat diserap langsung oleh tanaman. Tetapi keberadaan kedua senyawa tersebut dalam tanah dianggap kecil jika dibandingkan dengan keperluan tanaman. Menurut Mengel dan kirkby (1987), pada pH rendah, nitrat di serap lebih cepat dibanding dengan ammonium, sedangkan pada pH netral kemungkinan penyerapan keduanya seimbang. Hal ini mungkin disebabkan oleh adanya persaingan anion OH- dengan anion NO3-,
sehingga penyerapan nitrat sedikit terhambat.
Ammonium dalam kadar yang tinggi dapat meracuni tanaman. Hal ini disebabkan oleh adanya amoniak (NH3) yang terbentuk dari ammonium. Bagian tanaman yang
berwarna hijau mengandung N-protein terbanyak dan meliputi 70%-80% dari total N tanaman. Nitrogen asam nukleat terdapat sekitar 10% dan asam amino terlarut hanya sebanyak 5% dari total dalam tanaman.
Pemupukan dengan nitrogen akan menaikkan hasil produksi tanaman, kadar protein dan kadar sukrosa serta menaikkan patinya. Hasil assimilasi CO2 diubah menjadi
Pemberian nitrogen dibawah optimal menyebabkan naiknya assimilasi ammonia dan kadar protein didalam daun, tetapi sering dianggap menyebabkan pertumbuhan akar terhambat. Pemupukan nitrogen berpengaruh terhadap susunan kimia tanaman. Kenaikan dosis pupuk nitrogen menurunkan kadar karbohidrat dalam tanaman.(Rosmarkam.A, 2002).
Nitrogen dapat kembali ke tanah melalui pelapukan sisa mahluk hidup. Nitrogen yang berasal dari bahan organik ini dapat dimanfaatkan oleh tanaman setelah melalui tiga tahap reaksi yang melibatkan aktivitas mikroorganisme tanah. Tahap reaksi tersebut adalah sebagai berikut:
- Penguraian protein yang terdapat pada bahan organik menjadi asam amino, Tahap ini disebut aminisasi
- Perubahan asam amino menjadi senyawa-senyawa ammonia dan ammonium. Tahap ini disebut tahap ammonifikasi.
- Perubahan senyawa-senyawa ammonia menjadi nitrat yang disebabkan oleh bakteri nitrosomonas dan nitrosococcus.Tahap ini disebut tahap nitrifikasi. (Novizan,2002)
Proses penguraian protein secara enzimatik menjadi ammonium dilakukan oleh mikroba heterotropik. Ammonium merupakan ion tersedia sehingga jika tidak diakumulasi tanaman atau mikroba maka akan hilang melalui pencucian dan volatilisasi dalam bentuk gas ammonia, atau mengalami nitrifikasi yang menghasilkan nitrit (NO2-)
yang merupakan anion toksik, dilakukan oleh bakteri nitrosomonas sp, kemudian dilanjutkan ke nitratasi yang menghasilkan nitrat NO3- yang juga merupakan N tersedia
oleh bakteri nitrobacter sp. (Hanafiah,A.K,2005)
2.3. Humus dan Kompos
2.3.1. Humus
rekayasa manusia, akhirnya mengalami proses pembusukan oleh mikroorganisme sehingga menjadi senyawa yang halus berwarna coklat kehitaman dan disebut sebagai humus. Humus pada umumnya terletak pada bagian paling atas permukaan tanah dengan jumlah hanya 3-5% dari total seluruh tanah. Ketebalan humus yang ideal adalah sekitar 20-30 cm. Semakin kebawah lapisan tanah kandungan humusnya semakin sedikit.
Proses dekomposisi bahan organik secara liar berjalan pada suhu lebih dari 37oC dengan disertai perubahan pH. Hal ini akan melibatkan kerja sama beberapa jenis mikroorganisme di dalamnya, seperti sejumlah bakteri, aktinomisetes, jamur, protozoa, dan lain-lain.
Pada saat pertama bahan kompos tertumpuk, suhu dan pHnya masih sama dengan kondisi lingkungan yaitu pH +6 dan suhu rata-rata 18-25oC. Masing-masing bahan organik yang bertumpuk tersebut mengeluarkan panas. Seiring waktu berjalan, mikroorganisme sudah memulai aktivitasnya dalam bahan sehingga suhu meningkat dan pH turun.
Pengomposan secara liar atau pembentukan humus dialam berjalan dalam kondisi tidak terkendali. Mikroba aerobik dan anaerobik saling bergantian mengambil peran sesuai kondisi lingkungannya. Faktor utama yang menyebabkan pergantian peran kedua jenis bakteri tersebut adalah ada atau tidaknya oksigen. Hal inilah yang mengakibatkan jangka waktu pembentukan humus relatif lama.
2.3.2. Kompos
penguraian tersebut mengubah unsur hara yang terikat dalam senyawa organik sukar larut menjadi senyawa organik yang larut sehingga berguna bagi tanaman.
Pembuatan kompos sebenarnya meniru proses terbentuknya humus dialam. Melalui rekayasa kondisi lingkungan, kompos dapat dibuat serta dipercepat prosesnya hanya dalam beberapa minggu. Waktu melebihi kecepatan pembentukan humus secara alami. Oleh karena itu, kompos dapat tersedia dalam waktu yang relatif singkat.
Pengomposan juga bertujuan untuk menurunkan rasio C/N dan tergantung jenis tanamannya. Rasio C/N sisa tanaman yang masih segar umumnya tinggi sehingga tidak mendekati rasio C/N tanah. Bila rasio bahan organik yang memiliki rasio C/N tinggi tidak dikomposkan terlebih dahulu, maka proses penguraiannya akan terjadi di tanah . Ini tentu kurang baik karena proses penguraian bahan segar dalam tanah biasanya berjalan cepat karena kandungan air dan udaranya cukup. Akibatnya, CO2 dalam tanah akan meningkat
sehingga dapat berpengaruh buruk bagi pertumbuhan tanaman. Bahkan, untuk tanah ringan dapat mengakibatkan daya ikatnya terhadap air menjadi kecil serta struktur tanahnya menjadi kasar dan berserat. (Lingga, P, 2002)
2.3.3. Manfaat Kompos Bagi Tanaman
Kompos sangat berperan dalam proses pertumbuhan tanaman. Kompos tidak hanya menambah unsur hara, tetapi juga menjaga fungsi tanah sehingga tanaman dapat tumbuh dengan baik. Manfaat kompos bagi tanaman adalah:
1.Kompos memberikan nutrisi bagi tanaman
Berdasarkan jumlah yang dibutuhkan tanaman, unsur hara yang diperlukan tanaman dibagi menjadi dua golongan.
Unsur hara mikro yaitu unsur yang dibutuhkan dalam jumlah yang sedikit seperti Kalsium (Ca), Magnesium (Mg), Belerang (S), Besi (Fe), Mangan (Mn), Klor (Cl), Molibdenum (Mo), dan lain-lain.
2. Kompos memperbaiki struktur tanah
Kompos merupakan perekat pada butir-butir tanah dan mampu menjadi penyeimbang tingkat kerekatan tanah. Selain itu, kehadiran kompos pada tanah menjadi daya tarik bagi mikroorganisme untuk melakukan aktivitas pada tanah. Dengan demikian, tanah yang semula keras dan sulit ditembus air dan udara, kini dapat menjadi gembur akibat mikroorganisme. Struktur tanah yang gembur sangat baik bagi tanaman.
3. Kompos meningkatkan kapasitas tukar kation
Kapasitas tukar kation (KTK) adalah sifat kimia yang berkaitan erat dengan kesuburan tanah. Tanah dengan KTK tinggi lebih mampu menyediakan unsur hara dari pada tanah dengan KTK rendah.
4. Kompos menambah kemampuan tanah untuk menahan air
Tanah mempunyai pori-pori, yaitu suatu bagian yang tidak terisi bahan padat. Bagian yang tidak terisi ini akan diisi oleh air dan udara. Tanah yang bercampur dengan bahan organik seperti kompos mempunyai pori-pori dengan daya rekat yang lebih baik sehingga mampu mengikat serta menahan ketersediaan air didalam tanah. Kompos dapat menahan erosi secara langsung.
5. Kompos meningkatkan aktivitas biologi tanah
Kompos berisi mikroorganisme yang menguntungkan tanaman. Jika berada di dalam tanah, kompos akan membantu kehidupan mikroorganisme di dalam tanah. Selain berisi bakteri dan jamur dekomposer, keberadaan kompos akan membuat tanah menjadi sejuk, kondisi ini disenangi oleh mikroorganisme.
Unsur hara lebih mudah diserap oleh tanaman pada kondisi pH tanah netral , yaitu tujuh ( 7 ). Pada nilai ini, unsur hara menjadi mudah larut di dalam air. Jika tanah semakin asam maka dengan penambahan kompos pH tanah akan meningkat
7. Kompos meningkatkan unsur hara mikro
Disamping unsur hara makro, kompos juga menyediakan unsur hara mikro yang sangat penting bagi tanaman.
8. Kompos tidak menimbulkan masalah lingkungan
Pupuk kimia dapat menimbulkan masalah lingkungan yaitu dapat merusak keadaan tanah dan air, sedangkan kompos justru memperbaiki sifat tanah dan lingkungan. (Dipo Yuwono, 2007)
2.3.4. Bahan - Bahan Pembuat Kompos
Rasio C/N bahan baku kompos merupakan faktor terpenting dalam laju pengomposan. Proses pengomposan akan berjalan baik jika rasio C/N bahan organik yang dikomposkan antara 20-30. Setiap bahan organik memiliki rasio C/N yang berbeda. Rasio C/N limbah ternak umumnya lebih rendah dibandingkan dengan C/N dari tanaman. Karena itu penggunaannya sebagai bahan baku kompos harus dicampur dengan bahan organik yang memiliki rasio C/N tinggi sehingga dapat menghasilkan C/N yang cocok.
Tabel 2.3.4. Sumber bahan baku pembuat kompos dan rasio C/N nya
Darah 3 Tepung tulang 8 Urine manusia 0,8 Eceng gondok 17,6 Jerami gandum 80 – 130 Jerami padi 80 – 130 Ampas tebu 110 – 120 Tongkol Jagung 50 – 60 Sesbania sp. 17,9 Serbuk gergaji 500 Sisa Sayuran 11 – 27
Sumber: Gaur A.C., 1983
2.3.5. Faktor Yang Mempengaruhi Pengomposan
1. Rasio C/N
Kecepatan dekomposisi bahan organik ditunjukkan oleh perubahan rasio C/N. selama proses demineralisasi, rasio C/N bahan-bahan yang mengandung N akan berkurang menurut waktu. Kecepatan kehilangan C lebih besar daripada N sehingga diperoleh rasio C/N yang lebih rendah (10-20). Apabila rasio C/N sudah mencapai angka tersebut, artinya proses dekomposisi sudah mencapai tingkat akhir atau kompos sudah matang.
2. Suhu Pengomposan
3. Tingkat Keasaman (pH)
Salah satu faktor bagi pertumbuhan mikroorganisme yang terlibat dalam proses pengomposan adalah tingkat keasaman. Karena itu, pengaturan pH selama proses pengomposan perlu dilakukan. Pada awal pengomposan, reaksi cenderung agak asam karena bahan organik yang dirombak menghasilkan asam-asam organik sederhana. Namun pH akan mulai naik sejalan dengan waktu pengomposan dan akhirnya akan stabil pada pH sekitar netral.
4. Jenis Mikroorganisme yang terlibat
Proses pengomposan bila dipercepat dengan menambahkan starter atau aktivator yang kandungannya berupa mikroorganisme (kultur bakteri), enzim, dan asam humat. Mikroorganisme yang ada di dalam aktivator akan merangsang aktivitas mikroorganisme yang ada dalam bahan kompos sehingga cepat berkembang. Akibatnya, mikroorganisme yang terlibat dalam pengomposan semakin banyak dan proses dekomposisi akan semakin cepat.
5. Aerasi
Aerasi yang baik sangat dibutuhkan agar proses dekomposisi (pengomposan) bahan organik berjalan lancar. Pada umumnya pengaturan aerasi dilakukan dengan cara membalik-balikkan tumpukan bahan kompos secara teratur.
6. Kelembapan
Kelembapan optimum untuk proses pengomposan aerobik sekitar 50-60% setelah bahan organik dicampur. Selama proses pengomposan berlangsung, kelembapan dalam tumpukan bahan kompos harus terus dikontrol.
7. Ukuran Bahan Baku
Ukuran bahan baku kompos akan mempengaruhi kecepatan proses pengomposan. Semakin kecil ukuran bahan proses pengomposan akan semakin cepat berlangsung.
2.3.6. Standar Kualitas Kompos
Kompos dikatakan bagus dan siap digunakan jika tingkat kematangannya sempurna. Kompos yang baik dapat dikenali dengan memperhatikan bentuk fisiknya, sebagai berikut :
a. Jika diraba, suhu tumpukan bahan yang dikomposkan sudah dingin, mendekati suhu ruang.
b. Tidak mengeluarkan bau busuk.
c. Bentuk fisiknya sudah menyerupai tanah yang berwarna kehitaman. d. Jika dilarutkan kedalam air, kompos yang sudah matang tidak akan larut. e. Strukturnya remah, tidak menggumpal.
Jika dianalisis dilaboratorium, kompos yang sudah matang akan memiliki ciri sebagai berikut.
1. Tingkat keasaman (pH) kompos antara 6,5 - 7,5. 2. Memiliki C/N sebesar 10 - 20
3. Kapasitas tukar kation (KTK) tinggi, mencapai 110 me/100 gram. 4. Daya absorbsi (penyerapan) air tinggi.
Tabel 2.3.6.1 Kandungan unsur hara dalam kompos.
Unsur Hara Jumlah Nitrogen (N) 1,33% Fosfor (P2O5) 0,85%
Kalium (K2O) 0,36%
pH 7,2
Sumber : Nan Djuarni, Kristian dan Budi, 2005
Tabel 2.3.6.2 Standar kualitas pupuk organik menurut Departemen Pertanian
No Parameter Satuan Padat Cair
1 C-Organik % Minimum 15 > 4,5
2 Rasio C/N 12 – 25 -
3 Bahan ikutan (Kerikil, beling, plastik
% Maksimum 2 -
4 Kadar air % Minimum20 Maksimum 35
-
5 Pb (Timbal) ppm < 100 < 100 6 Cd (Cadmium) ppm < 20 < 20 7 Hg (Raksa) ppm < 2 < 2 8 As (Arsen) ppm < 20 < 20
9 pH 4-8 4-8
10 Kadar total (N + P2O5 +
K2O)
% Dicantumkan Dicantumkan
11 Kadar unsur mikro (Zn, Cu, Mn, Co, Fe)
ppm Dicantumkan Dicantumkan
12 Mikroba Patogen Sel/ml Dicantumkan dicantumkan Sumber : Soekirman, 2005, Direktorat Jendral Bina Sarana Pertanian, Departemen Pertanian
(Simamora. S, 2006)
2.4. Pupuk dan Manfaatnya
2.4.1. Pupuk
hara pada tanaman. Sedangkan pemupukan dimaksudkan sebagai pemberian zat makanan dengan memberikan berbagai jenis pupuk ke dalam tanah guna meningkatkan hasil pertanian. Jadi pemupukan bertujuan untuk merubah kesuburan, mengganti unsur-unsur hara yang hilang oleh adanya pengikisan oleh air, dan mengganti unsur-unsur hara yang terangkut oleh tanaman.
2.4.2. Manfaat Pupuk
Secara umum dapat dikatakan bahwa manfaat pupuk adalah menyediakan unsur hara yang kurang atau bahkan tidak tersedia di dalam tanah untuk mendukung pertumbuhan tanaman. Namun secara terperinci manfaat pupuk ini dapat dibagi dalam dua macam, yaitu yang berkaitan dengan perbaikan sifat fisika dan kimia tanah.
2.4.2.1. Manfaat Berkaitan Dengan Sifat Fisika Tanah.
Manfaat utama dari pupuk yang berkaitan dengan sifat fisika tanah, yaitu memperbaiki struktur tanah dari padat menjadi gembur. Pemberian pupuk organik, terutama dapat memperbaiki struktur tanah dengan menyediakan ruang pada tanah untuk udara dan air. Ruang dalam yang berisi udara akan mendukung pertumbuhan bakteri aerob yang berada diakar. Sementara air di dalam ruangan tanah yang remah juga memudahkan dalam pengolahan sehingga akan mengurangi biaya pengolahan. Manfaat lain pemberian pupuk adalah mengurangi erosi pada permukaan tanah. Dalam hal ini pupuk berfungsi sebagai penutup tanah dan memperkuat struktur tanah di bagian permukaan.
2.4.2.2. Manfaat Berkaitan Dengan Sifat Kimia Tanah.
pupuk, tetapi kemudian disadari bahwa unsur mikro ternyata juga mulai berkurang dan dimulailah penambahan unsur mikro dalam bentuk pupuk.
Selain menyediakan unsur hara, pemupukan juga membantu mencegah kehilangan unsur hara yang cepat hilang, seperti: N, P, K. Hara ini sangat mudah hilang oleh penguapan atau oleh air perkolasi. Bahan organik dalam pupuk dapat mengikat unsur-unsur hara yang mudah hilang dan menyediakannya bagi tanaman. (Marsono, 2001)
2.4.2.3. Manfaat Pupuk Organik Padat
Adapun manfaat pupuk organik padat adalah: 1. Menambah kesuburan pada tanaman
Pupuk organik termasuk pupuk majemuk karena mengandung unsur hara makro (N, P, K) dan unsur mikro (Ca, Mg, Fe, Mn, Bo, S, Zn, dan Co) yang dapat memperbaiki struktur kesuburan tanah. Pupuk organik dapat memperbaiki porositas tanah. Pada tanah tekstur jelek seperti tanah liat, dengan penambahan bahan organik akan mengurangi kelengketan sehingga mudah diolah. Sementara pada tanah berpasir, penambahan pupuk organik dapat meningkatkan daya tahan tanah terhadap air dan unsur hara.
2. Memperbaiki kondisi tanah
Pada tanah asam, ion-ion yang dibutuhkan tanaman cenderung dalam kondisi terikat. Dengan adanya pupuk organik akan terjadi sistem pengikatan dan pelepasan ion didalam tanah sehingga dapat mendukung pertumbuhan tanaman.
3. Memperbaiki kondisi biologi tanah
Pupuk organik merangsang mikroorganisme tanah yang menguntungkan seperti rhizobium, mikoriza, dan bakteri pengurai posfat atau kalium. Konsentrasi Oksigen dan karbondioksida dalam tanah berhubungan dengan aktivitas biologi tanah.
4. Memperbaiki kondisi tanah
5. Pemakaiannya aman bagi manusia
Pemakaian pupuk organik tidak meninggalkan residu pada hasil panen sehingga tidak menimbulkan efek negatif bagi kesehatan manusia.
6. Tidak mencemari lingkungan
Pupuk organik tidak mencemari lingkungan, sementara pupuk kimia terserap oleh tanaman sekitar 30-60% dan sisanya terserap dalam tanah atau hilang tercuci oleh air. Lahan pertanian yang berdekatan dengan pemukiman seperti lahan sawah yang aliran airnya juga dipakai untuk kebutuhan sehari-hari akan membahayakan kesehatan untuk jangka panjang. (Musnawar, 2003)
2.5. Limbah Organik
2.5.1. Limbah Tanaman Sebagai Pupuk Organik
Jerami padi, batang dan tongkol jagung, sekam padi, dan limbah pertanian lainnya apabila telah mengalami proses dekomposisi banyak mengandung unsur hara yang diperlukan pertumbuhan tanaman. Apabila tanaman mati, maka selanjutnya terjadi proses dekomposisi akibat kegiatan mikroorganisme. Hasil akhir proses perombakan disebut humus.
Bahan organik mengandung unsur karbon dan nitrogen dalam jumlah yang sangat bervariasi, dan rasio unsur tersebut sangat penting dalam mempertahankan kesuburan tanah.
2.5.2. Pengolahan Limbah Organik Untuk Kompos
1. Proses pengomposan
Kompos dibuat dari bahan organik yang berasal dari bermacam-macam sumber. Dengan demikian kompos merupakan sumber bahan organik dari nutrisi tanaman. Kemungkinan bahan dasar kompos mengandung sellulosa 15-60%, hemisellulosa 10-30%, lignin 5-10-30%, protein 5-40%, bahan mineral 3-5%, di samping itu terdapat bahan larut air panas dan dingin (gula, asam amino, urea, garam ammonium) sebanyak 2-30% dan 1-5% lemak yang larut eter dan alkohol. Komponen organik ini mengalami proses dekomposisi dibawah kondisi mesofilik dan termofilik. Pengomposan dengan metode timbunan dipermukaan tanah akan memakan waktu 3-4 bulan.
2. Proses mikrobiologis
Konversi biologi bahan organik dilaksanakan oleh bermacam-macam kelompok mikroorganisme heterotropik seperti bakteri, fungi, actinomicetes dan protozoa. Organisme tersebut mewakili jenis flora dan fauna.
Selama proses pengomposan berlangsung, perubahan secara kualitatif dan kuantitatif terjadi, pada tahap awal akibat perubahan lingkungan beberapa spesies flora menjadi aktif dan berkembang dalam waktu yang relatif singkat, dan kemudian hilang untuk memberikan kesempatan kepada jenis lain untuk berkembang. Pada minggu kedua dan ketiga, kelompok yang berperan aktif dalam proses pengomposan dapat diidentifikasi yakni; bakteri ammonifikasi, bakteri proteolitik, bakteri pektinolitik, dan bakteri penambat nitrogen. Mulai hari ke tujuh kelompok mikroba meningkat dan setelah hari keempat belas terjadi penurunan jumlah kelompok. Kemudian terjadi kenaikan populasi kembali selama minggu keempat. Mikroorganisme yang berperan adalah mikroorganisme sellulopatik, lignolitik dan fungi.(Sutanto,R.2002)
2.5.3.Dekomposisi Bahan Organik
anorganik. Karbohidrat dan protein dengan mudah terdekomposisi menjadi karbondioksida , air, ammoniak, nitrat, pospat, sulfat dan beberapa senyawa lainnya. Minyak dan lemak relatif lebih sukar terdekomposisi. Hasil akhir proses dekomposisi adalah bahan berukuran koloidal berwarna hitam yaitu humus. Humus mempunyai kapasitas yang tinggi dalam menyerap air di dalam tanah.
2.5.4. Pengaruh Bahan Organik
Sifat tanah sangat dipengaruhi oleh kandungan bahan organik, dan sering kali pengaruhnya sangat kompleks, sebagai contoh, humus membuat pasir dan tanah seakan menyatu. Tanah yang kaya akan bahan organik bersifat lebih terbuka sehingga aerasi tanah lebih baik dan tidak mudah mengalami pemadatan dari pada tanah yang mengandung bahan organik rendah. Tanah yang kaya bahan organik mempunyai warna yang agak gelap dan menyerap sinar lebih banyak. Apabila lebih banyak sinar yang diserap tanah maka akan lebih banyak hara dan air yang diserap tanaman melalui akar. Tanah yang kaya akan bahan organik relatif sedikit yang terfiksasi, sehingga yang tersedia bagi tanaman lebih besar. Hara yang digunakan oleh mikroorganisme tanah bermanfaat dalam mempercepat aktifitasnya, meningkatkan dekomposisi bahan organik dan mempercepat pelepasan hara. Sisa tanaman yang dikembalikan kedalam tanah juga berpengaruh dalam mengurangi masalah penyakit dan hama tanaman, menurunkan aktifitas mikroorganisme yang berpengaruh negatif. Residu tanaman seperti jerami, batang dan tongkol jagung, ampas tebu dan sekam padi jika dikembalikan kedalam tanah akan sangat baik bagi tanah. Pupuk kimia dapat ditambahkan untuk mempercepat dekomposisi, dan membuat hara lebih lengkap. Pada umumnya residu tanaman mengandung nitrogen yang rendah dan rasio C/N yang sangat tinggi.(Sutanto,R.2000)
2.6. Teknologi Pengomposan
Pengomposan adalah dekomoposisi bahan organik tanpa oksigen.Hasil metebolisme dari proses ini adalah metan, CO2, dan berbagai produk intermediet (metabolit) seperti
cara ini agak kurang diminati. Selain itu pada pengomposan aerobik sebagian energi yang dikeluarkan dalam bentuk limbah, yaitu panas pada timbunan kompos.
2.6.1. Teknologi Pengomposan Aerobik
Pengomposan aerobik adalah dekomposisi bahan organik dalam keberadaan oksigen. Produk metabolisme yang dihasilkan adalah CO2 dan panas. Itulah penyebab
pada proses aerobik suhu bisa meningkat sampai 80oC. Adapun proses aerobik secara kimia sebagai berikut.
C6H12O6 + 6 O2 6 H2O + 6 CO2
Mikroba yang berperan dalam perombakan bahan organik berasal dari kingdom protista, terutama bakteri dan fungi (jamur). Bakteri termasuk tipe dari kelompok sel prokariot (tidak memiliki membran). Selain bakteri dan jamur, ada jenis lain yang berperan penting dalam proses pengomposan yaitu actinomicetes. Jenis ini termasuk bakteri tetapi memiliki sifat transisi antara bakteri dan jamur. Actinomicetes berperan penting dalam degradasi bahan organik bermolekul tinggi. Bahan organik tidak dapat langsung dimanfaatkan atau digunakan oleh tanaman karena perbandingan C/N dalam bahan tersebut relatif tinggi atau tidak sama dengan C/N tanah, dimana nilai C/N tanah sekitar 10 sampai 12. Umumnya bahan organik segar mempunyai C/N yang tinggi, seperti jerami padi 50-70, cabang tanaman 15-60 (tergantung jenis tanamannya), kayu yang sudah tua dapat mencapai 400.
proses terjadinya humus dialam , dari bahan organik menjadi humus diperlukan waktu bertahun-tahun (humus merupakan hasil proses lebih lanjut dari pengomposan).
Selama proses dekomposisi bahan organik menjadi kompos akan terjadi berbagai perubahan hayati yang dilakukan oleh mikroorganisme sebagai aktivator. Adapun perubahannya sebagai berikut:
a. Penguraian karbohidrat, sellulosa, hemisellulosa, lemak, dan lilin menjadi CO2
dan H2O.
b. Protein menjadi ammonia, CO2 dan air.
c. Pembebasan unsur hara dari senyawa-senyawa organik menjadi senyawa yang dapat diserap oleh tanaman.
d. Terjadi pengikatan beberapa jenis unsur hara didalam sel mikroorganisme, terutama Nitrogen, Pospor dan Kalium.
Dengan perubahan tersebut maka kadar karbohidrat akan hilang atau turun dan senyawa nitrogen akan meningkat, dengan demikian C/N semakin mendekati C/N tanah.
2.6.2. Teknologi Pengomposan Anaerobik.
Pengomposan dengan proses anaerobik dihasilkan gas metana yang sangat bermanfaat. Adapun reaksi proses anaerobik sebagai berikut:
C6H12O6 3 CH4 + 3 CO2
Selain kompos, produk komesial yang diperoleh dari proses pengomposan anaerobik yaitu biogas. Biogas adalah campuran gas metan dengan gas-gas lain seperti CO2 dan
H2S yang dapat digunakan untuk berbagai tujuan pemanfaatan. Dengan pengomposan
prosesnya tertutup sehingga perlu perlakuan lanjutan seperti pengepresan dan proses pengeringan kompos yang sangat intensif untuk mengeluarkan air.
1. Prinsip proses
Dialam, proses anaerobik terjadi secara spontan ketika adanya timbunan bahan organik dengan suplai oksigen yang terbatas. Pada situasi tersebut kegiatan dekomposisi beralih dari proses aerobik menjadi anaerobik, seperti produksi metan di dasar danau dan sungai. Proses pengomposan anaerobik dapat dipercepat dengan mengatur berbagai kondisi proses yang bisa memacu dekomposisi bahan organik lebih cepat dan sempurna sehingga waktu lebih cepat, produksi metan lebih besar.
Proses pengomposan anaerobik berlangsung dalam 4 tahap sebagai berikut:
a. Proses hidrolisa, yaitu dekomposisi bahan organik polimer menjadi monomer yang mudah larut, dilakukan oleh sekelompok bakteri fakultatif. Pada proses hidrolisa, lemak diuraikan oleh enzim lipase yang diproduksi oleh bakteri lipolitik. Sementara karbohidrat diuraikan oleh enzim sellulase yang diproduksi oleh bakteri sellulolitik dan protein diuraikan oleh enzim protease yang diproduksi oleh bakteri proteolitik menjadi monomer yang mudah larut. Pada proses hidrolisa ini dihasilkan pula asam amino, asam volatil, gliserol, dan lain-lain.
b. Proses asidogenesis, yaitu dekomposisi monomer organik menjadi asam-asam organik (asam lemak) dan alkohol. Pada proses asidogenesis, monomer organik diuraikan lebih lanjut oleh bakteri asidogenik menjadi asam-asam organik seperti asam format, asetat, butirat, propionat, valeriat, serta dihasilkan juga CO2, H2O
dan metanol.
d. Proses metanogenesis, yaitu perubahan dari asam asetat menjadi metana. Pada proses ini asam asetat diuraikan oleh bakteri metanogenik menjadi CH4, CO2 dan
H2O.
3. Faktor yang berpengaruh\
Agar proses pengomposan anaerobik berlangsung optimal maka diperlukan pengetahuan tentang faktor yang berpengaruh dalam produktifitas serta kualitas biogas dan kompos yang dihasilkan. Faktor-faktor tersebut adalah sebagai berikut:
a. Jenis bahan
Kriteria penting yang biasa digunakan untuk menilai kelayakan bahan baku pada pengomposan anaerobik adalah nilai rasio C/N/P. rasio yang ideal adalah 150:50:1. Karbon diperlukan oleh bakteri untuk tenaga, sedangkan nitrogen untuk membangun protein sel. Kadar nitrogen yang terlalu tinggi akan meningkatkan produksi ammonia yang bersifat racun bagi bakteri. Kebutuhan P berkaitan dengan suplai nitrogen dan jarang menimbulkan masalah dalam proses anaerobik. Bila rasio bahan kurang bagus maka perlu dicampur dengan bahan lain sehingga rasio C/N/P mendekati nilai ideal.
b. Suhu.
Pada pengomposan anaerobik, proses dapat berlangsung pada variasi suhu yaitu 5-75oC. Aktivitas mikrobanya meningkat seiring dengan meningkatnya suhu. Namun umumnya bakteri aktif pada selang suhu mesofilik antara 30-35oC, sebagian lagi aktif pada suhu 50-55oC. Namun, bakteri metanogenik yang bekerja pada suhu termofilik hanya sedikit.
c. Derajat keasaman (pH)
d. Toksisitas
Keberadaan oksigen tidak begitu berpengaruh terhadap proses anaerobik karena oksigen yang terakumulasi akan segera dihabiskan oleh bakteri anaerobik yang fakultatif. Yang potensial merugikan adalah adanya logam berat yang masuk kedalam reaktor, ion alkali juga akan menghambat proses anaerobik, yang lebih berbahaya adalah bahan kimia seperti klor, ion sianida serta sulfat.(Sudrajat.H.R.2006)
2.7. Effective Microorganisme 4 (EM4)
Effective microorganisme 4 merupakan kultur campuran dari mikroorganisme yang menguntungkan yang bermafaat bagi kesuburan tanah maupun pertumbuhan dan produksi tanaman, serta ramah lingkungan. Mikroorganisme yang ditambahkan akan membantu memperbaiki kondisi biologi tanah dan dapat membantu penyerapan unsur hara. EM4 mengandung mikroorganisme fermentasi dan sintetik yang terdiri dari bakteri asam laktat (lactobasillus sp.), bakteri fotosintetik (Rhodopseudomonas sp.),
actinomycetes sp, streptomyces sp, dan ragi (yeast).
Efek EM4 bagi tanaman tidak terjadi secara langsung. Penggunaan EM4 akan lebih efisien bila terlebihdahulu ditambahkan bahan organik yang berupa pupuk organik kedalam tanah. EM4 akan mempercepat fermentasi bahan organik sehingga unsur hara yang tekandung akan cepat terserap dan tersedia bagi tanaman. Selain bermanfaat bagi peningkatan kesuburan tanah dan tanaman , EM4 juga sangat efektif digunakan sebagai pestisida hayati yang bermanfaat untuk meningkatkan kesehatan tanaman, EM4 juga bermanfaat untuk sektor perikanan dan peternakan.(Marsono.2005)
2.7.1. Fungsi Effective Microorganisme (EM)
1. Bakteri Fotosintetik
langsung oleh tanaman dan tersedia sebagai substrat untuk perkembangbiakan yang menguntungkan
2. Lactobacillus sp. (Bakteri asam laktat)
Bakteri yang memproduksi asam laktat sebagai hasil penguraian gula dan karbohidrat lain yang bekerjasama dengan bakteri fotosintesis dan ragi. Asam laktat ini merupakan bahan sterilisasi yang kuat yang dapat menekan mikroorganisme berbahaya dan dapat menguraikan bahan organik dengan cepat.
3. Sterptomyces sp.
Streptomyces sp. Mengeluarkan enzim streptomisin yang bersifat racun terhadap hama
dan penyakit yang merugikan.
4. Ragi/Yeast
Ragi memproduksi substansi yang berguna bagi tanaman dengan cara fermentasi. Substansi bioaktif yang dihasilkan oleh ragi berguna untuk pertumbuhan sel. Ragi ini juga berperan dalam perkembangbiakan atau pembelahan mikroorganisme.
5. Actinomycetes
Actinomycetes merupakan organisme peralihan antara bakteri dan jamur yang
mengambil asam amino dan zat serupa yang diproduksi bakteri fotosintesis dan mengubahnya menjadi antibiotik untuk mengendalikan patogen, menekan jamur dan bakteri berbahaya dengan cara menghancurkan khitin yaitu zat esensial untuk pertumbuhannya. Actinomycetes juga dapat menciptakan kondisi yang baik bagi perkembangan mikroorganisme lain. (Yovita, 2005)
2.8. Penentuan Nitrogen dengan metode Kjeldahl
organik yang mengandung N dirubah menjadi ammonia, nitrogen ammonia akan menjadi ammonium sulfat setelah pemanasan sampel didalam larutan asam sulfat. Zat organik tersebut berubah menjadi CO2 dan H2O serta melepaskan ammonia yang dalam suasana
asam kuat terikat menjadi ammonium sulfat. Kemudian tambahan basa serta zat pereduksi yaitu campuran NaOH dan Natrium tiosulfat akan melepaskan NH4+ sekaligus
mengubahnya sampai menjadi NH3. Seluruh ammonia tersebut dan air dapat didestilasi
dari sampel. Disamping ammonia yang berasal dari zat organik tersebut, air buangan juga mengandung ammonia bebas dan ammonia tersebut ikut tersuling bersama NH3 yang
dilepaskan oleh zat organik dan semuanya disebut N Kjeldahl. Jadi N kjeldahl adalah N organik dan N ammonia bebas. Setelah lenyap dari alat pendingin, NH3 tersebut diserap
oleh larutan asam borat H3BO3. (Alaerts,G.1984)
Penentuan Nitrogen dengan metode Kjeldahl merupakan hal yang sangat penting. Pada dasarnya, bahan dioksidasi dengan asam sulfat pekat panas hingga hancur. Tahap ini disebut tahap digestion. Disini Nitrogen diubah menjadi ion ammonium. Pada tahap berikutnya, larutan ditambah basa kuat sehingga bereaksi basa lalu didestilasi. Hasil destilasi ditampung dengan HCl baku yang tertentu jumlahnya untuk mengikat NH3
tersebut, kemudian destilat dititrasi dengan NaOH baku untuk menentukan kelebihan asam.
Selisih HCl yang ditambahkan dengan yang dititrasi merupakan jumlah yang diikat NH3 sehingga dapat dihitung sebagai NH3 yang terdestilasi dan dengan demikian N di
dalam analit dapat ditentukan. Reaksi – reaksi
a. Protein + oksidator katalis NH4+ + CO2 + H2O + lain – lain (destruksi )
b. NH4+ + OH- NH3 + H2O ( destilasi )
c. NH3 + HCl berlebih NH4Cl ( penampungan )
d. HCl sisa + NaOH NaCl + H2O ( titrasi )
atau :
e. NH3 + H3BO3 NH4H2BO3 ( penampungan )
f. NH4H2BO3 + HCl H3BO3 + NH4Cl ( titrasi )
2.9. Penentuan Kadar C-Organik dengan Metode Walkley dan Black
Material organik tanah merupakan sisa tumbuhan, hewan, dan organisme tanah, baik yang telah maupun yang sedang mengalami dekomposisi. Material organik tanah yang tidak terdekomposisi menjadi humus yang berwarna coklat sampai hitam dan bersifat koloidal. Pengukuran kandungan bahan organik tanah berdasarkan jumlah organik yang mudah teroksidasi akan mereduksi Cr2O72- yang diberikan secara berlebihan. Reaksi ini
terjadi karena adanya energi yang dihasilkan oleh reaksi H2SO4 pekat dan K2Cr2O7.
Keadaan ini menyebabkan Cr5+ direduksi oleh C-organik menjadi warna hijau dari Cr3+.(Nurdin, M.Suin, 2002)
Teknik penetapan C – organik yang paling standar adalah oksidasi bahan organik oleh dikromat yang mana metode ini lebih sering disebut metode Walkley dan Black. Dalam prosedurnya Kalium dikromat ( K2CrO7 ) dan asam sulfat pekat ( H2SO4 ) ditambahkan
kedalam bahan organik, dimana larutan tersebut harus didinginkan terlebih dahulu sebelum ditambahkan dengan air. Penambahan asam pospat ( H3PO4 ) kedalam larutan
tersebut berguna untuk mengurangi interferensi dari Fe3+ yang mungkin sering terjadi. Persamaan reaksinya adalah sebagai berikut :
2 Cr2O72- + 3 C + 16 H+ 4 Cr3+ + 3 CO2 + 8 H2O
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat-alat yang digunakan
Alat-alat yang dipergunakan dalam penelitian ini adalah:
- Buret 25 mL Pyrex
- Statif
- Klemp
- Alat destilasi Quickfit
- Labu Kjeldahl Pyrex
- Neraca analitis Mettler PM 400
- Labu Erlenmeyer Pyrex
- Gelas beaker 250 mL Pyrex - Pipet volumetri 10 mL Pyrex - Pipet volumetri 5 mL Pyrex - Labu takar 100 mL Pyrex - Pipet Skala 5 mL Pyrex
3.2. Bahan-bahan yang digunakan
Bahan-bahan yang dipergunakan dalam penelitian ini adalah: - Tumbuhan Hidrilla
- Sekam kayu - Dedak
- H2SO4 (p) p.a E. Merck
- (NH4)2Fe(SO4)2 .6H2O p.a E. Merck
- K2Cr2O7 p.a E. Merck
- NaOH p.a E. Merck
- Metil Biru p.a E.Merck - H2C2O4. 2H2O p.a E. Merck
- HCl p.a E. Merck
- H3BO3 p.a E. Merck
- H3PO4 p.a E. Merck
- Indikator difenilamin p.a E. Merck
- Selenium p.a E. Merck
- Akuades - Bakteri EM4
3.3. Prosedur Penelitian
3.3.1. Penyediaan sampel Hidrilla
Hidrilla yang diambil secara acak, dikeringkan dibawah sinar matahari selama 3 hari, kemudian dirajang menjadi potongan – potongan kecil.
3.3.2. Pembuatan Starter Effective Microorganism 4 (EM4)
Kedalam gelas beaker dimasukkan bakteri EM4 sebanyak 5 mL, kemudian ditambahkan
akuades sebanyak 1 L, selanjutnya ditambahkan gula pasir sebanyak ½ sendok makan, diaduk sampai homogen dan dibiarkan selama 24 jam.
3.3.3. Pembuatan kompos Hidrilla
Disediakan sebanyak 6 kg sampel (Hidrilla yang telah kering) dan dihaluskan,1 kg dedak, 0,1 kg sekam kayu, dimasukkan kedalam ember, ditentukan rasio C/N masing – masing sampel sebelum pengomposan, lalu dicampurkan, kemudian ditambahkan starter EM4
yang telah diencerkan ( 5 mL dalam 1000 mL akuades ), diaduk sampai rata, ditutup, dan dibiarkan selama 2 , 4, 8 , 12 , 16 dan 20 hari.
3.3.4. Pembuatan Pereaksi dan Larutan Standar
a. Larutan Kalium Dikromat (K2Cr2O7)1 N
Ditimbang secara kuantitatif kristal K2Cr2O7 sebanyak 4,90 g, dimasukkan kedalam
labu takar 100 mL lalu dilarutkan dengan akuades, diencerkan hingga garis tanda, kemudian dihomogenkan.
b. Larutan Ferro Amonium Sulfat (NH4)2Fe(SO4)2. 6 H2O 1 N
Ditimbang secara kuantitatif kristal (NH4)2Fe(SO4)2. 6H2O sebanyak 39,20 g lalu
dilarutkan dalam labu takar 100 mL dengan 80 mL akuades. Kedalam larutan itu ditambahkan 5 mL H2SO4(p) dan kemudian diencerkan sampai garis tanda.
c. Larutan Indikator Difenilamin 1 %
Ditimbang secara kuantitatif kristal difenilamin sebanyak 1,00 g lalu dilarutkan dengan H2SO4(p) dalam labu takar 100 mL sampai garis tanda, kemudian diaduk hingga larut
seluruhnya.
3.3.4.2. Pembuatan Pereaksi untuk Penentuan Nitrogen ( Metode Kjeldahl )
a. Larutan NaOH 40 %
Ditimbang secara kuantitatif kristal NaOH sebanyak 40,00 g, lalu dimasukkan kedalam labu takar 100 mL, kemudian dilarutkan dengan akuades, diaduk sampai homogen dan diencerkan sampai garis tanda sambil diaduk
b. Larutan indikator Fenolftalein 1 %
ditimbang secara kuantitatif kristal fenolftalein sebanyak 1,00 g lalu dimasukkan kedalam labu takar 100 mL, kemudian dilarutkan dengan akuades, diaduk sampai homogen dan diencerkan sampai garis tanda sambil diaduk
c. Larutan H3BO3 3 %
d. Larutan indikator campuran
Dicampurkan 2 bagian indikator metil biru 0,1 % (b/v) dan 1 bagian indikator metil merah 0,2 % (b/v) dalam etanol.
e. Larutan H2C2O4 0,01 N
Ditimbang secara kuantitatif kristal H2C2O4.2H2O sebanyak 0,63 g lalu dimasukkan
kedalam labu takar 1000 mL, kemudian dilarutkan dengan akuades, diaduk sampai homogen dan diencerkan sampai garis tanda sambil diaduk.
f. Larutan NaOH 0,01 N
Ditimbang secara kuantitatif kristal NaOH sebanyak 0,40 g lalu dimasukkan kedalam labu takar 1000 mL, kemudian dilarutkan dengan akuades, diaduk sampai homogen dan diencerkan sampai garis tanda sambil diaduk
g. Larutan HCl 0,01 N
Sebanyak 0,83 mL HCl 37 % dipipet ke dalam labu takar 1000 mL, diencerkan dengan akuades sampai garis tanda, kemudian dihomogenkan.
h. Standarisasi Larutan NaOH 0,01 N
- Dipipet 10 mL larutan H2C2O4 0,01 N di masukkan dalam gelas erlenmeyer
- Ditambah 3 tetes indikator fenolftalein
- Dtitrasi dengan NaOH hingga terjadi perubahan warna menjadi merah lembayung - Dilakukan hal yang sama sebanyak 3 kali
i. Standarisasi Larutan HCl 0,01 N
- Dipipet 10 mL larutan HCl 0,01 N lalu dimasukkan dalam gelas erlenmeyer - Ditambah 3 tetes indikator fenolftalein
- Dititrasi dengan NaOH yang telah distandarisasi hingga terjadi perubahan warna menjadi merah lembayung
3.3.4.3. Penentuan kadar C-Organik pada Sampel
- Ditimbang secara kuantitatif sebanyak 0,025 g sampel yang telah dihaluskan dan kering udara dimasukkan kedalam Erlenmeyer 250 mL
- Ditambahkan 10 mL K2Cr2O7 1 N
- Ditambahkan 10 mL H2SO4(p) secara perlahan
- Dikocok sampai homogen
- Didiamkan selama 30 menit agar proses oksidasi sempurna - Ditambah 100 mL akuades
- Ditambah 5 mL H3PO4 85 %
- Ditambah 3 tetes indikator difenilamin 1 % - Disaring dengan kertas whatman 41
- Dikocok, kemudian dititrasi dengan larutan ferro ammonium sulfat 1 N hingga warna berubah dari hijau kotor menjadi hijau terang
- Dicatat volume ferro ammonium sulfat yang terpakai - Dilakukan hal yang sama sebanyak 3 kali
3.3.4.4 Penentuan Nitrogen
- Ditimbang secara kuantitatif sebanyak 0,1 g sampel dan dimasukkan dalam labu Kjeldahl
- Ditambahkan 0,3 g selenium dan 25 mL H2SO4 pekat
- Sampel didestruksi dalam tabung reaksi menggunakan Kjeldahl term pada suhu 400oC, sehingga larutan yang ada dalam tabung menjadi kuning jernih
- Dipindahkan sampel tersebut ke dalam tabung destilasi, ditambah 50 mL akuades, ditambah 3 tetes indikator fenolftalein dan juga NaOH 40 % sehingga berwarna merah lembayung
- Disediakan penampung hasil destilat berupa gelas Erlenmeyer yang berisi 50 mL H3BO3 3 % dan 3 tetes indikator campuran
- Dipasang tabung destilasi pada alat destilasi, kemudian diletakkan penampung destilat pada ujung kondensor
- Destilat kemudian dititrasi dengan HCl 0,01 N sampai terbentuk warna merah lembayung
3.4. Bagan Penelitian
3.4.1. Pembuatan Starter EM4
dimasukkan kedalam gelas beaker 1 L
ditambahkan 1 L akuades ditambahkan ½ sendok makan gula pasir
diaduk sampai homogen dibiarkan selama 24 jam Starter EM4
3.4.2. Penyediaan Sampel dan Tahap Fermentasi dengan EM4
3.4.3. Bagan Penentuan kadar Karbon Metode Walkley dan Black
Catatan : Prosedur dilakukan untuk masing-masing sampel sebelum dan sesudah
pengomposan
Pengukuran dilakukan sebanyak 3 kali dan disajikan sebagai nilai rata-rata
Campuran homogen
Filtrat
0,025 g sampel kering
ditambahkan 10 ml K2Cr2O7
ditambah 10 ml H2SO4(p)
dihomogenkan
didiamkan selama 30 menit agar proses oksidasi sempurna
ditambah 100 ml akuades ditambah 5 ml H3PO4 85 %
ditambah 3 tetes indikator difenilamin 1 % disaring dengan kertas saring whatman 41
dikocok, kemudian di titrasi dengan larutan ferro ammonium sulfat 1 N hingga warna berubah dari hijau kotor menjadi hijau terang dicatat volume ferro ammonium sulfat yang terpakai
3.4.4. Bagan Penentuan Nitrogen Metode Kjeldahl
destilat
dititrasi dengan HCl 0,01 N 0,1 g sampel kering
ditambah 0,3 g selenium ditambah 25 ml H2SO4(p)
Larutan kuning
didestruksi pada suhu 400oC dengan kjeldahl term sampai larutan kuning jernih
dipindahkan kedalam labu destilasi ditambah 50 ml akuades
ditambah 3 tetes indikator fenolftalein ditambah NaOH 40% sampai
berwarna merah lembayung
ditampung dalam labu erlenmeyer yang berisi 50 ml asam boraks 3% dan 3 tetes indikator campuran
Larutan merah muda
Dicatat volume HCl 0,01 N yang terpakai didestilasi
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil dan Pengolahan Data
4.1.1. Hasil Penelitian
Data hasil penentuan C – Organik dengan metode Walkley Black dapat dilihat pada tabel 4.1, Penentuan Nitrogen dengan metode Kjeldahl dapat dilihat pada tabel 4.2
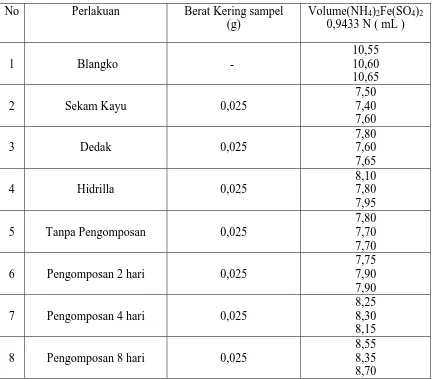
Tabel 4.1 Data Volume (NH4)2Fe(SO4)2 0,9433 N yang terpakai dalam Penentuan
C – Organik dengan Metode Walkley Black
No Perlakuan Berat Kering sampel (g)
5 Tanpa Pengomposan 0,025
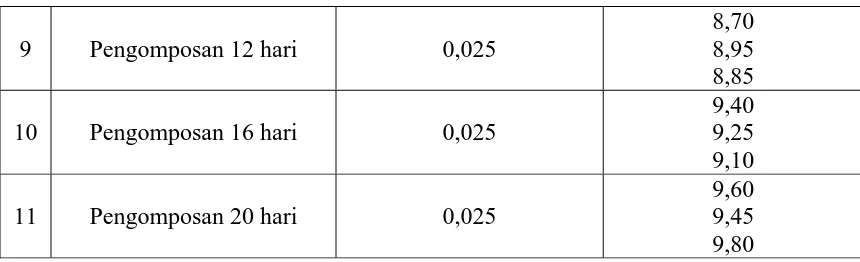
9 Pengomposan 12 hari 0,025
Tabel 4.2 Data Volume HCl 0,0112 N yang terpakai dalam Penentuan Nitrogen
10 Pengomposan 16 hari 0,1
Penentuan Normalitas (NH4)2Fe(SO4)2 standar yang digunakan untuk menentukan
% C – Organik :
Catatan : Nilai 0,33 menyatakan bahwa 1 grek K2Cr2O7 dapat mengoksidasi 3 grek
(NH4)2Fe(SO4)2 dan nilai 0,77 menyatakan bahwa sebanyak 77% senyawa organik yang dapat dioksidasi K2Cr2O7
Berdasarkan data volume (NH4)2Fe(SO4)2 0,9433 N yang terpakai dalam penentuan
C- Organik dengan metode Walkley Black ( tabel 4.1 ) maka dapat ditentukan % C- Organik pada sampel yaitu:
Untuk Hidrilla sebelum dikomposkan
Untuk data hasil pengukuran C – Organik II dan III pada Hidrilla sebelum dikomposkan ditunjukkan pada tabel 4.3 pada lampiran demikian juga untuk data hasil pengukuran C – Organik pada Dedak dan Sekam kayu sebelum dan setelah pengomposan dengan variasi pengomposan 2 sampai 20 hari dengan interval waktu 4 hari ( setiap pengukuran C – Organik masing-masing dilakukan sebanyak 3 kali ).
4.1.3. Penentuan % Nitrogen
Penentuan Normalitas HCl standar yang digunakan untuk menentukan % Nitrogen :
HCl
N NaOH = Normalitas NaOH standar
V NaOH = mL NaOH yang terpakai dalam standarisasi N HCl = Normalitas HCl
V HCl = mL HCl titrasi
N
Penentuan Nitrogen dalam sampel dapat dihitung dengan menggunakan rumus sebagai berikut :
V = mL larutan HCl standar yang terpakai mentitrasi sampel Vb = mL larutan HCl standar yang terpakai mentitrasi blangko N HCl = Normalitas HCl
Berdasarkan data Volume HCl 0,0112 yang terpakai dalam penentuan Nitrogen dengan metode Kjeldahl ( tabel 4.2 ) maka dapat ditentukan % Nitrogen pada sampel Yaitu : Untuk Hidrilla sebelum dikomposkan
4.1.4. Penentuan rasio C/N
Setelah % C – Organik dan % Nitrogen ditentukan maka C/N dari Hidrilla, Sekam kayu, danDedak dapat ditentukan dengan membandingkan nilai % C – Organik rata – rata ( Lampiran – 1 ) dengan % Nitrogen rata – rata.( Lampiran – 2 ).
Nitrogen Organik C
N C
% %
/
Maka nilai C/N dari Hidrilla sebelum pengomposan :
95 , 18 % 2,056
% 972 , 38
/N
C
4.2. Pembahasan
Didalam penelitian ini diperoleh bahwa % C – Organik pada Tumbuhan Hidrilla sebelum dikomposkan 38,972 %, Dedak sebelum dikomposkan 42,89 %, sekam kayu sebelum dikomposkan 45,594 % dan campuran sampel sebelum dikomposkan 42,158 %. Setelah pengomposan 2 hari % C – Organik adalah 40,44 %, setelah 4 hari 34,807 %, setelah 8 hari 30,397 %, setelah 12 hari 25,987 %, setelah 16 hari 19,861 %, dan setelah 20 hari14,471 %. Dari data tersebut dapat dilihat bahwa % C – Organik semakin menurun seiring bertambahnya waktu pengomposan. Hal ini disebabkan karena selama pengomposan bakteri memanfaatkan senyawa karbon sebagai sumber energi dalam metabolisme dan perbanyakan sel yang diubah menjadi asam – asam organik dan alkohol terlebih dahulu kemudian diubah menjadi CO2, CH4, dan H2O ( Dipo Yuwono, 2006 ).
campuran sampel Hidrilla, dedak dan sekam kayu sebelum dikomposkan 1,502 %. Setelah pengomposan 2 hari 1,492 %, setelah pengomposan 4 hari 1,472 %, setelah pengomposan 8 hari 1,408 %, setelah pengomposan 12 hari 1,382 %, setelah
pengomposan 16 hari 1,377 %, dan setelah pengomposan 20 hari 1,366 %. Dari data tersebut dapat dilihat bahwa % Nitrogen pada pengomposan semakin menurun seiring bertambahnya waktu pengomposan. Penurunan % Nitrogen tidak terlalu signifikan karena pada selama pengomposan Nitrogen dimanfaatkan sebagai sumber pembentuk Protoplasma dalam perbanyakan sel dan juga Nitrogen organik diuraikan terlebih dahulu menjadi amonia ( NH3 ) yang mudah menguap dan kemudian amonia dirombak menjadi
Nitrit ( NO2- ) dan nitrat ( NO3- ) yang merupakan Nitrogen yang lebih stabil
Harga rasio C/N pada tumbuhan Hidrilla sebelum pengomposan adalah 18,955 , rasio C/N pada dedak sebelum pengomposan adalah 54,09 , rasio C/N sekam kayu sebelum pengomposan adalah 407,09 dan rasio C/N pada campuran sampel Hidrilla, dedak dan sekam kayu sebelum dikomposkan adalah 28,394 . Setelah pengomposan 2 hari rasio C/N adalah 27,104, setelah pengomposan 4 hari rasio C/N adalah 23,662, setelah
adalah 18,80 , setelah pengomposan 16 hari rasio C/N adalah 14,423 , dan setelah pengomposan 20 hari rasio C/N adalah 10,593.
Dengan demikian dari hasil pengomposan yang dilakukan dengan variasi waktu, diperoleh bahwa pengomposan selama 20 hari telah mencapai pengomposan yang
optimum karena rasio C/N yang diperoleh adalah 10,59 karena telah mencapai C/N tanah yang ideal yakni 10 – 12 (Kemas Ali Hanafiah, 2006 ).
Rasio C/N yang diperoleh pada penelitian ini juga telah memenuhi syarat yang telah ditentukan didalam SNI 19 – 7030 – 2004 yaitu 10 – 20 ( Lampiran 4 ).
0 5 10 15 20 25 30
0 5 10 15 20 25
Waktu pengomposan (Hari)
Ra
s
io
C
/N
Series1
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian ini dapat diperoleh kesimpulan bahwa :
- Proses pengomposan Hidrilla dengan bakteri EM4 dapat mengurangi rasio C/N di
dalam kompos tersebut.
- Waktu pengomposan yang optimum adalah 20 hari dengan kandungan C – Organik sebesar 14,471 % dan N sebesar 1,366 % ( C/N = 10,59 ). Rasio C/N 10,59 telah memenuhi standar kompos sesuai dengan ketentuan yang ada pada SNI 19 – 7030 – 2004.( Lampiran – 4 ).
5.2 Saran
DAFTAR PUSTAKA
Affandie, R. 2002. Ilmu Kesuburan Tanah. Yogyakarta : Penerbit Kanisius Alaerts, G. 1984. Metode Penelitian Air. Surabaya :Penerbit Usaha Nasional Effendi, H. 2003. Telaah Kualitas Air. Yogyakarta : Penerbit Kanisius
Hanafiah, A.K. 2005. Dasar-Dasar Ilmu Tanah . Jakarta :Penerbit Raja Grafindo Perkasa.
Harjadi, W. 1993. Ilmu Kimia Analitik Dasar. Jakarta : PT. Gramedia Pustaka Utama (http://plants.fas.u.f.l.edu/hydcric.html) : 25 juli 2007.
Ismawati, M. 2003. Pupuk Organik Padat . Jakarta : Penebar Swadaya
Kartasapoetra, A.G. 2002. Pengantar Ilmu Tanah. Jakarta :Penerbit Rineka Cipta Marsono, P.S. 2001. Pupuk Akar, Jenis Dan Aplikasi. Jakarta : Penebar Swadaya Mulyadi, M. 2002. Pupuk Dan Cara Pemupukan. Jakarta :Penerbit Rineka Cipta Novizan, 2002. Petunjuk Pemupukan Yang Efektif. Jakarta : Agro Media Pustaka Pinus, L., Marsono. 2000. Petunjuk Penggunaan Pupuk. Jakarta : Penebar
Swadaya
Simamora, S. 2006. Meningkatkan Kualitas Kompos. Jakarta : Agro Media Pustaka Smith, Et.Al. 1983. Principles Of BioChemistry. General Aspect, Mc Graw
Hill Book Company. New York
Sudrajat, H.R. 2006. Mengelola Sampah Kota. Jakarta : Penebar Swadaya Suin, M.N.2002. Metode Ekologi. Padang : Universitas Andalas
Sutanto, R. 2002. Penerapan Pertanian Organik. Yogyakarta :Penerbit Kanisius Tejo, J. 1998. Tanah Dan Lingkungan. Jakarta : Dirjen Dikti Departemen
Pendidikan Dan Kebudayaan
Yovita, H.I. 2005. Membuat Kompos Secara Kilat, Jakarta : Penebar Swadaya Yuwono, D. 2007. Kompos. Jakarta : Penebar Swadaya
Zimmerman, C.F., J. Bashe. 1997. Determination of Carbon and Nitrogen in sediment and particular of Estuarine/coastal Water Using Element Analysis. U.S.
Lampiran – 1 Data Pengukuran C – Organik dengan Metode Walkley dan Black
% C – Organik No Perlakuan
C1 C2 C3 C
1 Hidrilla 38,237 39,708 38,972 38,972
2 Dedak 41,178 44,118 43,383 42,893
3 Sekam Kayu 45,60 47,065 44,118 45,594 4 Tanpa Pengomposan 42,648 42,648 41,178 42,158 5 Pengomposan 2 hari 41,913 39,708 39,708 40,44 6 Pengomposan 4 hari 34,562 33,827 36,032 34,807 7 Pengomposan 8 hari 30,152 33,092 27,947 30,397 8 Pengomposan 12 hari 27,947 24,272 25,742 25,987 9 Pengomposan 16 hari 17,656 19,862 22,596 19,861 10 Pengomposan 20 hari 14,716 16,921 11,776 14,471
Lampiran – 2 Data Pengukuran Nitrogen dengan Metode Kjeldahl
% Nitrogen No Perlakuan
N1 N2 N3 N
1 Hidrilla 2,054 2,03 2,069 2,056
2 Dedak 0,737 0,752 0,729 0,739
Lampiran – 3 Data Rasio C/N daripada kompos
No Perlakuan % C % N C/N
1 Hidrilla 38,972 2,056 18,955
2 Dedak 42,893 0,739 54,09
3 Sekam Kayu 45,594 0,112 407,09
Lampiran – 4 Standar kualitas kompos menurut SNI 19 – 7030 – 2004
No Parameter Satuan Minimum Maksimum
1 Kadar Air % - 50
Lampiran – 5 Bakteri Effective Microorganism 4 ( EM4 )