ABSTRACT
EFFECT OF THE TIME ADMINISTRATIONS OF PROBIOTIC ON NON-SPECIFIC IMMUNE RESPONSES OF THE COMMON CARP
(Cyprinus carpio L.) THAT INJECTED BY Aeromonas salmonicida
By
SEPTIARINI
Common carp is one of the consumption fish which has high economic value. The common carp has been culturing intensively in Indonesia. However, thr efforts to
increase carp production obstracted by diseases such as furunculosis by A. salmonicida. Generally, disease management in fish farming uses antibiotics
may have negative impacts. So that we have to consider the disease prevention method which safer such as probiotic. The aims of this research were to know effect of the time administrations of probiotic on non-specific immune responses and to know the best time administration of probiotic on non-specific immune responses of common carp injected by A. salmonicida. The research was conducted from August to October 2011, in the Laboratory of Aquaculture Department, Faculty of Agriculture, University of Lampung. The research used three treatments (without administration of probiotic, administration of probiotic once every day, and administration of probiotic once every five days) with four replications. Data from the calculation of total leukocyte and percentage of differential leukocyte were analyzed by using ANOVA at 95% confidence level, while RPS and water qualities were analyzed descriptively. The results showed that (1) the time administrations of probiotic showed a real impact on improving non-specific immune responses characterized by increased total leukocyte in carp, (2) administration of probiotic once every five days resulted better non-specific immune responses than the other time administrations, which had been seen from the highest total leukocyte and the highest RPS after being injected by A. salmonicida.
ABSTRAK
PENGARUH WAKTU PEMBERIAN PROBIOTIK YANG BERBEDA TERHADAP RESPON IMUN NON-SPESIFIK IKAN MAS (Cyprinus carpio L.) YANG DIUJI TANTANG DENGAN BAKTERI
Aeromonas salmonicida
Oleh
SEPTIARINI
yang lebih baik dilihat dari peningkatan total leukosit dan tingginya nilai RPS setelah diuji tantang dengan bakteri A. salmonicida.
PENGARUH WAKTU PEMBERIAN PROBIOTIK YANG BERBEDA TERHADAP RESPON IMUN NON-SPESIFIK IKAN MAS (Cyprinus carpio L.) YANG DIUJI TANTANG DENGAN BAKTERI
Aeromonas salmonicida
(Skripsi)
Oleh SEPTIARINI
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
ABSTRACT
EFFECT OF THE TIME ADMINISTRATIONS OF PROBIOTIC ON NON-SPECIFIC IMMUNE RESPONSES OF THE COMMON CARP
(Cyprinus carpio L.) THAT INJECTED BY Aeromonas salmonicida
By
SEPTIARINI
Common carp is one of the consumption fish which has high economic value. The common carp has been culturing intensively in Indonesia. However, thr efforts to
increase carp production obstracted by diseases such as furunculosis by A. salmonicida. Generally, disease management in fish farming uses antibiotics
may have negative impacts. So that we have to consider the disease prevention method which safer such as probiotic. The aims of this research were to know effect of the time administrations of probiotic on non-specific immune responses and to know the best time administration of probiotic on non-specific immune responses of common carp injected by A. salmonicida. The research was conducted from August to October 2011, in the Laboratory of Aquaculture Department, Faculty of Agriculture, University of Lampung. The research used three treatments (without administration of probiotic, administration of probiotic once every day, and administration of probiotic once every five days) with four replications. Data from the calculation of total leukocyte and percentage of differential leukocyte were analyzed by using ANOVA at 95% confidence level, while RPS and water qualities were analyzed descriptively. The results showed that (1) the time administrations of probiotic showed a real impact on improving non-specific immune responses characterized by increased total leukocyte in carp, (2) administration of probiotic once every five days resulted better non-specific immune responses than the other time administrations, which had been seen from the highest total leukocyte and the highest RPS after being injected by A. salmonicida.
ABSTRAK
PENGARUH WAKTU PEMBERIAN PROBIOTIK YANG BERBEDA TERHADAP RESPON IMUN NON-SPESIFIK IKAN MAS (Cyprinus carpio L.) YANG DIUJI TANTANG DENGAN BAKTERI
Aeromonas salmonicida
Oleh
SEPTIARINI
Ikan mas merupakan salah satu jenis ikan konsumsi bernilai ekonomis tinggi sehingga terus dibudidayakan secara intensif di Indonesia. Namun, usaha peningkatan produksi ikan mas tidak terlepas dari masalah penyakit yang diantaranya disebabkan oleh bakteri A. salmonicida penyebab penyakit furunculosis. Penanggulangan penyakit pada budidaya ikan umumnya masih menggunakan antibiotik yang mempunyai dampak negatif cukup tinggi, sehingga diupayakan metode pencegahan penyakit yang dinilai aman yaitu dengan penggunaan probiotik. Tujuan dari penelitian yaitu untuk mengetahui pengaruh waktu pemberian probiotik yang berbeda terhadap respon imun non-spesifik dan mendapatkan waktu pemberian probiotik terbaik untuk respon imun non-spesifik ikan mas yang diuji tantang dengan bakteri A. salmonicida. Penelitian telah dilaksanakan pada bulan Agustus sampai Oktober 2011, di Laboratorium Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas Lampung. Penelitian menggunakan 3 perlakuan (tanpa pemberian probiotik, pemberian probiotik setiap hari, dan pemberian probiotik setiap 5 hari sekali) dengan 4 kali ulangan. Data hasil perhitungan total leukosit dan persentase diferensial leukosit dianalisis dengan ANOVA pada selang kepercayaan 95%, sedangkan RPS dan kualitas air dianalisis secara deskriptif. Hasil penelitian menunjukkan bahwa (1) waktu pemberian probiotik yang berbeda berpengaruh nyata terhadap peningkatan respon imun non-spesifik yang ditandai dengan peningkatan total leukosit pada ikan mas, (2) pemberian probiotik setiap 5 hari sekali menghasilkan respon imun yang lebih baik dilihat dari peningkatan total leukosit dan tingginya nilai RPS setelah diuji tantang dengan bakteri A. salmonicida.
Judul Skripsi : PENGARUH WAKTU PEMBERIAN PROBIOTIK YANG BERBEDA TERHADAP RESPON IMUN NON-SPESIFIK IKAN MAS (Cyprinus carpio L.) YANG DIUJI TANTANG DENGAN BAKTERI Aeromonas salmonicida
Nama : Septiarini
NPM : 0714111058
Jurusan : Budidaya Perairan
Fakultas : Pertanian
MENYETUJUI
1. Komisi Pembimbing
Esti Harpeni, S.T., M.AppSc. Wardiyanto, S.Pi., M.P. NIP. 197911182002122001 NIP. 196907052001121001
2. Ketua Jurusan Budidaya Perairan
MENGESAHKAN
1. Tim Penguji
Ketua : Esti Harpeni, S.T., M.AppSc. ………
Sekretaris : Wardiyanto, S.Pi., M.P. ………
Penguji Utama : Moh. Muhaemin, S.Pi., M.Si. ………
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP. 196108261987021001
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal
2 September 1989, sebagai anak pertama dari tiga
bersaudara dari pasangan Bapak Sukardi dan Ibu
Tarwiyah.
Pendidikan formal penulis diawali dari Taman Kanak-kanak (TK) Citra Melati
pada tahun 1993-1995, dilanjutkan ke Sekolah Dasar (SD) Negeri 3 Gedong Air
pada tahun 1995-2001, Sekolah Menengah Pertama (SMP) Negeri 2 Bandar
Lampung pada tahun 2001-2004, dan Sekolah Menengah Atas (SMA) Negeri 9
Bandar Lampung pada tahun 2004-2007. Pada tahun 2007 penulis terdaftar
sebagai mahasiswa Program Studi Budidaya Perairan, Fakultas Pertanian,
Universitas Lampung melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama kuliah penulis aktif dalam organisasi HIDRILA (Himpunan Mahasiswa
Budidaya Perairan Unila) periode 2008/2009. Penulis juga pernah menjadi staff
DPMU KBM Unila periode 2008 dan panitia khusus sidang umum MPM KBM
Penulis melakukan Praktik Umum (PU) di Balai Riset Budidaya Ikan Hias
(BRBIH) Depok pada tahun 2010. Penulis menyelesaikan tugas akhir perkuliahan
dengan menulis skripsi yang berjudul “Pengaruh Waktu Pemberian Probiotik
Kita tidak harus berhasil pada upaya pertama.
Orang yang maunya harus berhasil pada upaya pertama, paling sesuai untuk olah raga terjun payung.
Banyak gagal itu biasa.
Satu keberhasilan yang baik bisa membayar semua kegagalan. Sabarlah.
Your time will come.
(Mario Teguh)
Para pemenang adalah pengambil resiko.
Seperti kita semua, mereka juga khawatir salah dan takut gagal. Tapi, mereka tidak membiarkan kekhawatiran dan rasa takut
menguasai mereka dan membatalkan yang bisa segera mereka laksanakan.
Mereka juga akan mengalami kesalahan dan kegagalan, tapi karena lebih banyak melaksanakan, mereka lebih sering berhasil.
Dengan penuh rasa syukur kepada Allah SWT, kupersembahkan
karya kecilku ini kepada Bapak dan Ibu yang selalu mendo
’
akan
dan memberi semangat di setiap langkahku,
Nenek yang senantiasa menyayangi dan mendo’akanku.
Adik-adikku, Rachmad Nugroho dan Fitri Azizah yang senantiasa
memberikan tawa dan semangat dalam hidupku,
Almamater tercinta ”Universitas Lampung”
Skripsi ini juga kupersembahkan kepada mereka yang dengan
ketulusan dan keceriaannya telah menemani hari-hari yang sangat
melelahkan ini
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi dengan
judul “Pengaruh Waktu Pemberian Probiotik yang Berbeda terhadap Respon Imun
Non-Spesifik Ikan Mas (Cyprinus carpio L.) yang diuji Tantang dengan Bakteri Aeromonas salmonicida” ini disusun sebagai salah satu syarat memperoleh gelar
Sarjana Perikanan di Universitas Lampung.
Dalam kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas
Pertanian Universitas Lampung.
2. Ibu Ir. Siti Hudaidah, M.Sc. selaku Ketua Program Studi Budidaya Perairan.
3. Ibu Esti Harpeni, S.T., M.AppSc. selaku pembimbing utama atas bimbingan,
kritik, dan saran dalam proses penyusunan skripsi ini.
4. Bapak Wardiyanto, S.Pi., M.P. selaku pembimbing kedua atas bimbingan,
kritik, dan saran dalam proses penyusunan skripsi ini.
5. Bapak Moh. Muhaemin, S.Pi., M.Si. selaku pembahas atas masukan, kritik,
dan saran dalam proses penyusunan skripsi ini.
6. Bapak Agus Setyawan, S.Pi., M.P. yang telah membantu banyak dalam
7. Bapak Qadar Hasani, S.Pi., Bapak Supono, S.Pi., M.Si., dan Bapak Limin
Santoso, S.Pi., M.Si. selaku pembimbing akademik yang telah memberikan
dukungan, nasehat, dan bimbingan selama kuliah.
8. Ibu, Bapak, Adik-adik, dan seluruh keluargaku yang selalu menjadi
penyemangat dalam hidupku.
9. Humeira P. Sofia, Devira Agustin, Yeni Elisdiana, Septa Indarti, Tutut
Yuniarsih, Dewi Sartika, Revy Maharani, Niken Puspita Dewi, Agung
Kurniawan, M. Hasyim Ashari, dan M. Farzuki atas kebersamaan
menghadapi suka-duka penelitian.
10. Teman-teman seperjuanganku 2007 yang selalu ceria, terima kasih atas
kebersamaan kita selama ini.
11. Kakak-kakakku angkatan 2004, 2005, 2006 dan adik-adikku angkatan 2008,
2009, 2010, 2011 serta semua pihak yang tidak dapat disebutkan satu persatu,
terima kasih atas sumbangan do’a dan kerja samanya selama ini.
Semoga Allah SWT memberikan berkah, rahmat, dan hidayah-Nya atas kebaikan
dan pengorbanan kita. Penulis berharap semoga skripsi ini dapat bermanfaat bagi
kita semua. Amin.
Bandar Lampung, Februari 2012
Penulis,
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka pikir penelitian ... 6 2. Ikan Mas ... 8 3. A. salmonicida ... 10 4. Gambaran mikroskopis leukosit ikan mas dengan pewarnaan Turk’s
(pembesaran 100x) ... 25 5. Total leukosit tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 27 6. Gambaran mikroskopis neutrofil ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 28 7. Persentase neutrofil tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 30 8. Gambaran mikroskopis monosit ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 31 9. Persentase monosit tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 32 10. Gambaran mikroskopis limfosit ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 33 11. Persentase limfosit tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 35 12. Nilai RPS (Relative Percent Survival), (B) pemberian probiotik setiap
DAFTAR ISI
1.3Pencampuran Pakan dengan Probiotik ... 19
2. Tahap Pelaksanaan ... 19
2.1Pemberian Pakan Berprobiotik ... 19
2.2Uji Tantang ... 20
3. Tahap Pengamatan ... 21
3.1Pemeriksaan Darah ... 21
3.2Perhitungan RPS (Relative Percent Survival) Ikan Mas ... 23
3.3Kualitas Air ... 23
E. Analisis Data ... 24
IV. HASIL DAN PEMBAHASAN A. Pemeriksaan Darah ... 25
1. Total Leukosit ... 25
2. Diferensial Leukosit ... 28
a. Neutrofil ... 28
b. Monosit ... 31
c. Limfosit ... 33
B. RPS (Relative Percent Survival) ... 35
C. Kualitas Air ... 36
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 38
B. Saran ... 38
DAFTAR PUSTAKA
i
1.3Pencampuran Pakan dengan Probiotik ... 19
2. Tahap Pelaksanaan ... 19
2.1Pemberian Pakan Berprobiotik ... 19
2.2Uji Tantang ... 20
ii
3. Tahap Pengamatan ... 21
3.1Pemeriksaan Darah ... 21
3.2Perhitungan RPS (Relative Percent Survival) Ikan Mas ... 23
3.3Kualitas Air ... 23
E. Analisis Data ... 24
IV. HASIL DAN PEMBAHASAN A. Pemeriksaan Darah ... 25
1. Total Leukosit ... 25
2. Diferensial Leukosit ... 28
a. Neutrofil ... 28
b. Monosit ... 31
c. Limfosit ... 33
B. RPS (Relative Percent Survival) ... 35
C. Kualitas Air ... 36
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 38
B. Saran ... 38
DAFTAR PUSTAKA
iii 4. Gambaran mikroskopis leukosit ikan mas dengan pewarnaan Turk’s
(pembesaran 100x) ... 25 5. Total leukosit tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 27 6. Gambaran mikroskopis neutrofil ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 28 7. Persentase neutrofil tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 30 8. Gambaran mikroskopis monosit ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 31 9. Persentase monosit tiap pengamatan pada tiap perlakuan, (A) tanpa
pemberian probiotik, (B) pemberian probiotik setiap hari, (C) pemberian probiotik setiap 5 hari sekali, (H0) hari ke-0 sebelum pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 32 10. Gambaran mikroskopis limfosit ikan mas dengan pewarnaan Giemsa
(pembesaran 400x) ... 33 11. Persentase limfosit tiap pengamatan pada tiap perlakuan, (A) tanpa
iv
pemberian probiotik, (H14) hari ke-14 setelah pemberian probiotik, (H21) hari ke-21 setelah pemberian probiotik, dan (H28) hari ke-28 setelah pemberian probiotik (6 hari setelah uji tantang) ... 35 12. Nilai RPS (Relative Percent Survival), (B) pemberian probiotik setiap
v
DAFTAR LAMPIRAN
Lampiran Halaman
DAFTAR PUSTAKA
Agustina, D.T., Marnani, S., dan Irianto, A. 2006. Pengaruh Pola Pemberian Probiotik A3-51 per Oral terhadap Kelangsungan Hidup Bawal Air Tawar (Collosoma macropomum Bry.) setelah Diuji Tantang dengan Bakteri Aeromonas hydrophila. (Skripsi). Universitas Jenderal Soedirman.
Alamanda, I.E., Handajani, N.S., dan Budiharjo, A. 2007. Penggunaan Metode Hematologi dan Pengamatan Endoparasit Darah untuk Penetapan Kesehatan Ikan Lele Dumbo (Clarias gariepinus) di Kolam Budidaya Desa Mangkubumen Boyolali. Jurnal Biodiversitas Vol.8 No.1:34-38.
Anonim. 2010. Aeromonas salmonicida. Dikutip dari
http://yco238labs.blogspot.com/2010/10/aeromonas-salmonicida.html.
Diakses pada tanggal 3 Februari 2012.
Anonim. nd. Reaksi Antigen-Antibodi dan Prinsip Pengobatan. Dikutip dari
http://directory.umm.ac.id/Data%20Elmu/pdf/minggu_4._baru.pdf. Diakses
pada tanggal 8 Februari 2012.
Bachtiar, Y. dan Tim Lentera. 2002. Pembesaran Ikan Mas di Kolam Pekarangan. Agromedia Pustaka. Jakarta.
Cholik, F., Jagatraya, A.G., Poernomo, R.P., dan Jauzi, A. 2005. Akuakultur Tumpuan Harapan Masa Depan Bangsa. Masyarakat Perikanan Nusantara dan Taman Akuarium Air Tawar, Taman Mini Indonesia Indah. Jakarta.
Darmono. 2007. Farmakologi dan Toksikologi Sistem Kekebalan: Pengaruh Penyebab dan Akibatnya pada Kekebalan Tubuh. UI-Press. Jakarta.
DKP. 2007. Penyakit Ikan Karantina Golongan Bakteri. Pusat Karantina Ikan.
Erika, Y. 2008. Gambaran Diferensiasi Leukosit pada Ikan Mujair (Oreochromis mossambica) di Daerah Ciampea Bogor. (Skripsi). Institut Pertanian Bogor.
Fitriani, M. 2010. Efektivitas Ekstrak Bawang Putih (Allium sativum) terhadap Ketahanan Tubuh Ikan Mas (Cyprinus carpio L.) yang Diinfeksi Aeromonas salmonicida. (Skripsi). Universitas Lampung.
Hastuti, S.D. dan Karoror, R.J. 2007. Pengaruh Pemberian LPS (Lipopolisacharida) terhadap Aktivitas Fagositosis dan Jumlah Eritrosit Darah Ikan Nila(Oreochromis sp.). Jurnal Protein Vol.15 No.1.
http://en.wikipedia.org/wiki/Aeromonas_salmonicida. Diakses pada tanggal
28 Oktober 2011 pukul 08.10 WIB.
Khasani, I. 2007. Aplikasi Probiotik Menuju Sistem Budidaya Perikanan Berkelanjutan. Media Akuakultur Vol.2 No.2.
KKP. 2010. Prospek Perikanan masih Cerah. Diakses dari: www.kkp.go.id pada tanggal 29 Januari 2012.
Kordi, K.M.G.H. 2004. Penanggulangan Hama dan Penyakit Ikan. Rineka Cipta dan Bina Adiaksara. Jakarta.
Kordi, K.M.G.H. 2010. Budidaya Ikan Nila di Kolam Terpal. Lily Publisher. Yogyakarta.
Lingga, P. 2007. Ikan Mas Kolam Air Deras. Penebar Swadaya. Jakarta.
Maulina, I., K. Haetami, dan Junianto. 2006. Pengaruh Meniran dalam Pakan
Mudjiutami, E., Ciptoroso, Zainun, Z., Sumarjo, dan Rahmat. 2007. Pemanfaatan Imunostimulan untuk Pengendalian Penyakit pada Ikan Mas. Jurnal Budidaya Air Tawar Vol.4 No.1:1-9.
Mulyana, D.Y. 2011. Kaya Raya dari Budidaya Ikan dengan Probiotik. Berlian Media. Yogyakarta.
Passarela, M.P. 2006. Uji Tantang pada Ikan Gurame (Osphronemus gouramy) yang Diimunisasi dengan Vaksin Inaktif Anti Aeromonas hydrophila Peroral melalui Pelet. (Skripsi). Institut Pertanian Bogor.
Setyawan, A. 2006. Uji Lapang Vaksin Polivalen Vibrio pada Ikan Kerapu Macan (Epinephelus fuscoguttatus) di Karamba Jaring Apung. (Skripsi). Universitas Gadjah Mada.
Sunartatie, T. 1986. Aeromonas sebagai Penyebab Septicemia pada Ikan. (Skripsi). Institut Pertanian Bogor.
Yuliawati, F. 2010. Efektivitas Ekstrak Meniran (Phyllanthus niruri) sebagai Antibakteri pada Ikan Patin (Pangasianodon hypophthalmus) yang Diinfeksi dengan Aeromonas hydrophila. (Skripsi). Universitas Lampung.
I. PENDAHULUAN
A.Latar Belakang
Ikan mas merupakan salah satu jenis ikan konsumsi yang bernilai ekonomis
tinggi. Budidaya ikan mas telah lama berkembang di Indonesia, karena selain
mudah, peluang usaha budidaya ikan mas juga cukup menjanjikan. Permintaan
pasar akan ikan mas baik di pasar dalam negeri maupun luar negeri cukup tinggi
(KKP, 2010). Hal tersebut yang membuat ikan mas terus dibudidayakan secara
intensif. Namun, usaha budidaya ikan mas tidak terlepas dari berbagai
permasalahan diantaranya adalah masalah penyakit.
Penyakit pada budidaya ikan dapat digolongkan menjadi dua macam yaitu
penyakit infeksi dan non-infeksi (Kordi, 2004). Salah satu penyakit infeksi adalah
penyakit akibat serangan bakteri patogen (bacterial disease) yang dapat mengakibatkan kematian ikan sebanyak 50-100% (Kordi, 2010), dan juga dapat
menurunkan mutu daging karena adanya borok atau luka pada daging ikan yang
terinfeksi sehingga bisa menurunkan minat konsumen (Maulina, 2006 dan Kordi,
2010).
Salah satu penyakit bakterial yang dapat menyerang ikan air tawar adalah
septicemia yaitu haemorraghe septicemia atau sering juga disebut Motil
Aeromonas Septicemia (MAS) yaitu penyakit yang disebabkan oleh jenis bakteri Aeromonas (Richards et al., 1978 dalam Sunartatie, 1986). A. salmonicida
merupakan jenis bakteri yang bersifat oportunis (memanfaatkan kondisi ikan yang
menurun), sehingga bakteri ini dapat menyerang ikan saat ketahanan tubuh ikan
menurun akibat stress yang disebabkan oleh penurunan kualitas air, kekurangan
pakan, dan padat tebar yang tinggi (Afrianto et al., 1992 dalam Anonim, 2010).
Furunculosis dilaporkan telah tersebar luas di dunia yaitu Amerika Serikat, Kanada, Perancis, Norwegia, Belgia, Austria, Swiss, Australia dan negara-negara
Asia termasuk Indonesia. Pada tahun 1989, di Skotlandia terjadi wabah
furunculosis sebanyak 15 kali pada ikan air tawar dan 127 kali pada
ikan-ikan air laut (DKP, 2007). Pada bulan Oktober tahun 1980, di Indonesia terutama
di daerah Jawa Barat dan sekitarnya terjadi kematian massal ikan baik ukuran
benih maupun induk yang disebabkan oleh mewabahnya bakteri Aeromonas sp.
Sebanyak 34,8% dari seluruh isolat yang dikumpulkan pada saat terjadi wabah
tersebut adalah A. salmonicida (Pramono et al., 1980 dalam Sunartatie, 1986). Kerugian yang ditimbulkannya sangat besar karena terjadi penurunan produksi
secara besar-besaran. Pada bulan Agustus tahun 2002, di perairan Waduk
Saguling juga terjadi kematian ikan secara massal, sebanyak 361 ton ikan yang
dipelihara dalam jaring apung mati akibat serangan bakteri Aeromonas sp. (Harian Pikiran Rakyat, 2003 dalam Maulina, 2006).
Selama ini, penanggulangan penyakit pada budidaya ikan umumnya
dapat menyebabkan terjadinya resistensi bakteri terhadap antibiotik tersebut dan
terdapatnya residu antibiotik dalam tubuh ikan (Mulyana, 2011). Selain itu,
produk perikanan yang mengandung residu antibiotik juga dapat menyebabkan
penolakan ekspor ke negara lain seperti Amerika Serikat dan Jepang (Khasani,
2007 dan Mulyana, 2011). Namun, penggunaan antibiotik tidak bisa dihindari jika
wabah penyakit sudah terjadi. Oleh karena itu diupayakan metode pencegahan
penyakit yang dinilai lebih aman yaitu dengan penggunaan probiotik untuk dapat
menciptakan budidaya perikanan yang berkelanjutan (sustainable).
Probiotik adalah makanan tambahan (suplemen) berupa sel-sel mikroba hidup
yang menguntungkan hewan inang yang mengonsumsinya melalui
penyeimbangan flora mikroba intestinalnya (Fuller, 1987 dalam Agustina, et al.,
2006). Namun beberapa penelitian telah melaporkan bahwa probiotik dapat
meningkatkan respon imun non-spesifik hewan inang, antara lain meningkatkan
jumlah makrofag, aktivitas lisozim, dan terbukti meningkatkan kelangsungan
hidup hewan inang (Irianto, 2002 dalam Agustina, et al., 2006). Lactobacillus sp. merupakan jenis bakteri pertama yang digunakan sebagai probiotik (Mulyana,
2011). Penggunaan probiotik pada budidaya perikanan telah dimulai belasan
tahun yang lalu, yang ditujukan untuk memperbaiki kualitas air, melancarkan
pencernaan ikan, meningkatkan sistem imun, laju pertumbuhan, dan survivalitas
ikan.
Pola pemberian probiotik yang baik perlu diperhatikan guna mempertahankan
efektifitasnya (Agustina et al., 2006). Pemberian imunostimulan seperti halnya
efektifitasnya karena sudah tidak dianggap lagi sebagai antigen (Affandi et al.,
2002 dalam Agustina et al., 2006), sehingga pemberian probiotik dengan waktu pemberian berselang diharapkan akan menghasilkan sistem imun yang lebih baik
karena setiap probiotik yang masuk ke dalam tubuh akan dikenal sebagai antigen
yang menguntungkan karena dapat merangsang aktifnya sistem imun dan tidak
menyebabkan penyakit (Raa, 1996 dalam Agustina et al., 2006).
Hasil penelitian yang telah dilakukan oleh Agustina et al. (2006) tentang pengaruh pola pemberian probiotik yang berbeda terhadap kelangsungan hidup bawal air
tawar yang diuji tantang dengan bakteri A. hydrophila menunjukkan bahwa pola
pemberian probiotik setiap 5 hari sekali menghasilkan respon imun yang lebih
baik dilihat dari jumlah leukosit dan makrofag. Tingkat kelangsungan hidup
setelah diuji tantang dengan A. hydrophila juga lebih baik dengan survivalitas mencapai 90%.
Peningkatan sistem imun pada ikan diharapkan dapat melindungi ikan dari
serangan bakteri patogen, dalam hal ini A. salmonicida. Manajemen budidaya
yang baik disertai penggunaan probiotik secara efektif diharapkan dapat
meningkatkan kesehatan ikan mas yang berujung pada hasil sintasan yang tinggi.
B.Tujuan Penelitian
Tujuan penelitian sebagai berikut:
1. mengetahui pengaruh waktu pemberian probiotik yang berbeda terhadap
respon imun non-spesifik ikan mas yang diuji tantang dengan bakteri
2. mengetahui waktu pemberian probiotik terbaik yang dapat meningkatkan
respon imun non-spesifik ikan mas yang diuji tantang dengan bakteri
A. salmonicida.
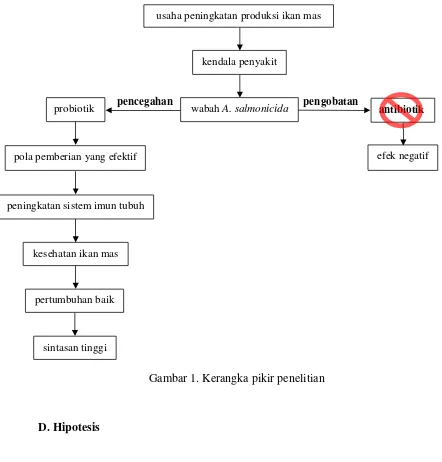
C.Kerangka Pemikiran
Usaha peningkatan produksi ikan mas tidak terlepas dari masalah penyakit yang
diantaranya disebabkan oleh bakteri A. salmonicida penyebab penyakit furunculosis. Penanggulangan penyakit pada budidaya ikan umumnya masih menggunakan antibiotik yang mempunyai dampak negatif cukup tinggi, baik bagi
ikan maupun manusia yang mengonsumsinya. Namun, penggunaan antibiotik
tidak bisa dihindari jika wabah penyakit sudah terjadi. Oleh karena itu,
diupayakan metode pencegahan penyakit yang dinilai lebih aman yaitu dengan
penggunaan probiotik. Mekanisme kerja probiotik diantaranya dapat sebagai
penstimulasi sistem imun non-spesifik pada ikan.
Namun, pemberian probiotik yang dilakukan secara terus menerus dapat
menurunkan keefektifannya, sehingga pemberian probiotik dengan waktu
berselang diharapkan akan lebih efektif dan dapat menghasilkan sistem imun yang
lebih baik karena setiap probiotik yang masuk ke dalam tubuh dapat langsung
merangsang aktifnya sistem imun.
Peningkatan sistem imun tersebut diharapkan dapat melindungi ikan dari serangan
bakteri A. salmonicida sehingga kesehatan ikan mas dapat meningkat dan didapatkan sintasan yang tinggi. Skema kerangka pikir penelitian dapat dilihat
Gambar 1. Kerangka pikir penelitian
D.Hipotesis
Hipotesis yang digunakan untuk menguji pengaruh perlakuan waktu pemberian
probiotik yang berbeda sebagai berikut:
H0 : σi = 0 Tidak ada pengaruh waktu pemberian probiotik yang berbeda
terhadap respon imun non-spesifik ikan mas yang diuji tantang dengan
bakteri A. salmonicida pada selang kepercayaan 95%.
H1 : σi ≠ 0 Ada pengaruh waktu pemberian probiotik yang berbeda terhadap
respon imun non-spesifik ikan mas yang diuji tantang dengan bakteri
A. salmonicida pada selang kepercayaan 95%. kesehatan ikan mas
sintasan tinggi pertumbuhan baik
usaha peningkatan produksi ikan mas
kendala penyakit
wabah A. salmonicida
probiotik pencegahan pengobatan antibiotik
efek negatif pola pemberian yang efektif
Selanjutnya jika hasil berbeda nyata dilakukan pengujian pengaruh antar
perlakuan menggunakan hipotesis sebagai berikut:
H0 : σi = σj = 0; untuk i≠j tidak ada pengaruh antar perlakuan waktu
pemberian probiotik yang berbeda terhadap respon imun non-spesifik ikan
mas yang diuji tantang dengan bakteri A. salmonicida pada selang kepercayaan 95%.
H1 : σi ≠ σj ≠ 0; untuk i≠j minimal ada sepasang perlakuan waktu pemberian
probiotik yang berbeda yang memberikan pengaruh yang nyata terhadap
respon imun non-spesifik ikan mas yang diuji tantang dengan bakteri
A. salmonicida pada selang kepercayaan 95%.
E.Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi tentang pemanfaatan
probiotik secara efektif untuk meningkatkan respon imun non-spesifik ikan mas
II. TINJAUAN PUSTAKA
A. Ikan Mas (Cyprinus carpio L.)
Klasifikasi ikan mas adalah sebagai berikut (Saanin, 1984 dalam Mones, 2008): Kingdom : Animalia
Filum : Chordata
Sub-filum : Pisces
Kelas : Teleostei
Ordo : Ostariophysi
Sub-ordo : Cyprinoidea
Famili : Cyprinidae
Sub-famili : Cyprininae
Genus : Cyprinus
Spesies : Cyprinus carpio Linn
Gambar 2. Ikan Mas sirip dorsal
mata
mulut
Ikan mas memiliki tubuh yang memanjang dan sedikit pipih ke samping
(Bachtiar, 2002). Mulutnya terletak di ujung tengah (terminal) dan dapat
disembulkan (protaktil), serta dilengkapi dengan dua pasang sungut pada mulut
bagian atas (Bachtiar, 2002; Cholik et al., 2005). Secara umum, hampir seluruh tubuh ikan mas ditutupi oleh sisik yang berukuran relatif besar dan digolongkan
dalam sisik tipe sikloid (Bachtiar, 2002). Sisik pada garis rusuk (linea lateralis)
sekitar 35-39 buah (Cholik et al., 2005). Garis rusuk terletak di pertengahan tubuh, melintang dari tutup insang sampai ke pangkal ekor (Bachtiar, 2002).
Habitat ikan mas adalah di perairan tawar yang airnya tidak terlalu dalam dan
alirannya tidak terlalu deras, seperti di sungai, danau, waduk, dan rawa. Ikan mas
dapat hidup di dataran rendah sampai tinggi (Cholik, et al., 2005). Ikan mas
termasuk jenis ikan yang bersifat termofil karena mampu beradaptasi dengan
perubahan suhu lingkungan yang ditempatinya dengan kisaran suhu antara
4-30oC, namun suhu perairan yang optimal untuk pertumbuhan ikan mas berkisar
antara 25-30oC (Bachtiar, 2002). pH perairan yang optimal yaitu berkisar 6,5-9
dan kandungan oksigen terlarut (DO) minimal 3 ppm (Lingga, 2007). Meskipun
tergolong ikan air tawar, ikan mas terkadang ditemukan di perairan payau atau
muara sungai yang bersalinitas 25-30 ppt (Bachtiar, 2002).
Ikan mas tergolong ikan omnivora yakni ikan yang memangsa berbagai jenis
makanan, baik hewan renik maupun tumbuhan (Bachtiar, 2002). Makanan
utamanya di alam adalah zooplankton, larva chironomus, cacing sutera, dan berbagai jenis moluska (Cholik et al., 2005). Ikan mas juga memakan berbagai
ikan mas dalam budidaya dipacu oleh pakan tambahan seperti pelet yang
mengandung protein antara 25-40% (Kordi, 2004; Lingga, 2007).
B. A. salmonicida
Buchanan et al. (1974) dalam Fitriani (2010) mengklasifikasikan A. salmonicida sebagai berikut:
Kingdom : Bacteria
Filum : Proteobacteria
Kelas : Gammaproteobacteria
Ordo : Aeromonadales
Famili : Aeromonadaceae
Genus : Aeromonas Spesies : A.salmonicida
Gambar 3. A. salmonicida
(dikutip dari http://en.wikipedia.org/wiki/Aeromonas_salmonicida)
A. salmonicida merupakan bakteri gram negatif, berbentuk batang pendek, non-
motil, menghasilkan pigmen berwarna coklat pada media agar (McDaniel, 1979
dalam Sunartatie, 1986), dan tidak dapat bertahan lama di luar tubuh inangnya
(Afrianto et al., 1992 dalam Anonim, 2010). Suhu optimum untuk
pertumbuhannya adalah 20-30oC dan pada suhu 37oC bakteri tersebut akan mati
(Amlacher, 1970 dalam Sunartatie, 1986), sedangkan pada suhu 35oC
pertumbuhannya terhenti (Hoffman, 1977 dalam Sunartatie, 1986).
A. salmonicida merupakan bakteri yang bersifat oportunis, yaitu memanfaatkan
kondisi ikan yang menurun sehingga bakteri ini dapat menginfeksi saat ketahanan
tubuh ikan menurun akibat stress yang disebabkan oleh penurunan kualitas air,
kekurangan pakan, dan populasi ikan yang sangat padat (Afrianto et al., 1992 dalam Anonim, 2010). Eidman et al. (1981) dalam Sunartatie (1986)
mengemukakan bahwa tanda-tanda klinis penyakit haemorraghe septicemia yang terjadi di Jawa Barat pada tahun 1980 berupa hilangnya nafsu makan, peradangan
kulit atau adanya borok, kulit ikan menjadi kesat karena lendir tubuh berkurang, sisik
lepas, sirip menjadi rapuh, tidak responsif, bergerak lamban, diam atau mengapung di
permukaan air. Kelainan lainnya adalah mata menonjol (exophthalmia), insang berwarna kelabu suram dan sebagian tertutup fibrin atau mengalami nekrosa, busung
perut (dropsy) (Lampiran 15), serta kematian ikan.
Gejala furunculosis hampir mirip dengan haemorraghe septicemia karena furunculosis termasuk salah satu dari sekelompok penyakit haemorraghe septicemia (Richards et al., 1978 dalam Sunartatie, 1986). McDaniel (1979) dalam
Sunartatie (1986) menjelaskan bahwa bentuk penyakit furunculosis ada empat, yaitu
bentuk perakut, akut, subakut, dan kronis. Bentuk perakut ditandai dengan terjadinya
kematian tanpa ada kerusakan. Bentuk akut ditandai dengan adanya perdarahan pada
insang. Sedangkan bentuk subakut ditandai dengan tubuh ikan yang menjadi gelap.
Bentuk kronis ditandai dengan terbentuknya lepuh-lepuh yang berisi cairan berwarna
Aeromonas dapat menular melalui air dan feces ikan yang terinfeksi, kontak fisik
antar ikan, kontak dengan peralatan yang telah tercemar, atau karena pemindahan
ikan yang terserang Aeromonas dari satu tempat ke tempat lain (Sunartatie, 1986; Afrianto et al., 1992 dalam Anonim, 2010). A. salmonicida yang telah
menginfeksi ikan dapat langsung diisolasi dari luka pada kulit, insang, darah,
ginjal, atau limpa ikan yang terinfeksi (Sunartatie, 1986).
C.Sistem Imun Tubuh Ikan
Sistem imun adalah suatu sistem dalam tubuh yang terdiri dari sel-sel serta produk
zat-zat yang dihasilkannya, yang bekerja sama untuk melawan benda asing
(antigen) seperti kuman-kuman penyakit yang masuk ke dalam tubuh suatu
organisme (Darmono, 2007).
Secara umum ikan memiliki dua macam sistem imun yaitu sistem imun spesifik
dan sistem imun non-spesifik (Kamiso et al., 1990 dalam Setyawan, 2006).
1. Sistem imun spesifik
Sistem imun (imunitas) spesifik dapat dibedakan menjadi dua, yaitu imunitas
humoral (humoral mediated immunity) dan imunitas seluler (cell mediated immunity) (Pastoret et al., 1998 dalam Setyawan, 2006). Imunitas humoral
bereaksi melalui produksi antibodi, yaitu suatu protein khusus yang mengarahkan
kepada suatu antigen spesifik. Antibodi akan beredar ke seluruh tubuh bersama
cairan darah dan limfa yang akan bereaksi apabila bertemu dengan antigen dengan
untuk mempertahankan tubuh dari serangan patogen yang telah menyerang selnya
sendiri (inang) dan juga terhadap sel tumor (Almendras, 2001 dalam Setyawan, 2006).
2. Sistem imun non-spesifik
Sistem imun non-spesifik pada ikan terdiri dari (Almendras, 2001 dalam Setyawan, 2006):
a. Sistem imun fisik, meliputi kulit dan termasuk juga sisik bagi ikan bersisik,
lendir yang berperan memerangkap patogen sebelum bisa menginfeksi,
keringat yang berperan menurunkan pH dan mempertahankan konsentrasi
garam tetap tinggi di kulit sehingga menghambat pertumbuhan bakteri.
b. Sistem imun terlarut, meliputi cairan tubuh ikan yang mengandung bahan atau
molekul yang berfungsi untuk menghancurkan patogen seperti enzim lysin,
lysozime, dan protease; dan yang berfungsi menutupi atau menghambat
pertumbuhan patogen yang masuk ke dalam tubuh seperti transferin, laktoferin,
ceruloplasmin, metallothionin, ceropins, dan marganins.
c. Sistem imun seluler, berupa leukosit dengan pertahanan melalui mekanisme
fagositosis oleh aktivitas fagositik sel makrofag, dengan penghancuran patogen
melalui proses kemotaksis, perlekatan, penelanan, dan pencernaan.
D. Parameter Hematologi
Perubahan fisik dan kimia darah baik secara kualitatif maupun kuantitatif dapat
menentukan kondisi ikan atau status kesehatannya. Wedemeyer et al. (1977)
memastikan diagnosa suatu penyakit. Parameter hematologi yang akan diukur
antara lain total leukosit dan diferensial leukosit.
Leukosit merupakan sel darah putih yang berfungsi sebagai pertahanan
non-spesifik yang akan melokalisasi dan mengeliminasi patogen melalui aktivitas
fagositosis (penelanan) oleh sel monosit dan neutrofil (Anderson, 1992 dalam Mudjiutami et al., 2007) dan sebagai penghasil antibodi untuk kekebalan tubuh
dari serangan penyakit oleh sel limfosit. Sel monosit akan menuju ke daerah
infeksi dan mengalami proses pematangan dalam perjalanannya menjadi
makrofag, sehingga makrofag merupakan bentuk matang dari monosit (Sanoesi,
2008). Neutrofil dalam darah akan meningkat bila terjadi infeksi dan berperan
sebagai pertahanan pertama dalam tubuh (Bastiawan et al., 2001 dalam Alamanda
et al., 2007). Tizard (1988) dalam Mudjiutami et al. (2007) mengungkapkan bahwa neutrofil bekerja secara aktif dan cepat namun keaktifannya tidak bertahan
lama, sedangkan monosit bekerja secara lambat namun dapat memfagosit
berulang-ulang.
Sel monosit dan neutrofil berfungsi untuk melakukan fagositosis terhadap benda
asing (patogen) yang masuk ke dalam tubuh inang ke dalam sitoplasma sel darah.
Penghancuran patogen oleh sel-sel fagosit, terjadi dalam beberapa tingkat yaitu
kemotaksis dimana sel-sel fagosit mendekati mikroorganisme, kemudian
menangkap, memakan, dan kemudian mencerna (Baratawijaya, 1991 dalam
E.Probiotik
Probiotik adalah makanan tambahan (suplemen) berupa sel-sel mikroba hidup
yang menguntungkan hewan inang yang mengonsumsinya melalui
penyeimbangan flora mikroba intestinalnya (Fuller, 1987 dalam Agustina, et al.,
2006). Feliatra (2002) dalam Feliatra et al. (2004) menjelaskan bahwa agen biologis dapat disebut sebagai probiotik apabila memenuhi karakter sebagai
berikut: 1) tidak bersifat patogen bagi inang dan konsumen inangnya (manusia),
2) tidak mengganggu keseimbangan ekosistem setempat, 3) dapat dengan mudah
dipelihara dan diperbanyak dalam skala besar (industri), 4) dapat hidup dan
bertahan serta berkembang biak di dalam usus ikan, 5) dapat dipelihara dalam
media yang memungkinkan untuk diintroduksikan ke dalam usus ikan, serta 6)
dapat hidup dan berkembang di dalam air wadah pemeliharaan ikan.
Mekanisme kerja probiotik dapat dikelompokkan menjadi empat (Irianto, 2003;
Thye, 2005 dalam Khasani, 2007), yaitu 1) menekan koloni bakteri patogen dengan memproduksi senyawa-senyawa antimikroba atau melalui kompetisi
nutrisi dan tempat pelekatan di dinding intestinum, 2) merubah metabolisme
mikrobial dengan meningkatkan atau menurunkan aktifitas enzim pengurai
(selulase, protease, amilase), 3) menguraikan senyawa toksik yang berada di
perairan seperti NH3, NO2, menguraikan bahan organik, menekan populasi alga
biru-hijau (blue-green algae), memproduksi vitamin yang bermanfaat bagi inang,
menetralisir senyawa toksik yang ada dalam makanan serta perlindungan secara
fisik inang dari patogen, 4) menstimulasi sistem imun melalui peningkatan kadar
III. METODE PENELITIAN
A.Waktu dan Tempat
Penelitian dilaksanakan pada bulan Agustus sampai Oktober 2011, di
Laboratorium Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas
Lampung.
B.Alat dan Bahan
Alat-alat yang digunakan dalam penelitian antara lain akuarium berukuran
60x40x40 cm3 sebanyak 12 buah, peralatan aerasi, selang sifon, scoopnet, ember, baskom, timbangan digital, alat semprot (sprayer), kertas label, nampan, jarum
suntik (spuit) 1 ml 23G, tabung eppendorf 1,5 ml, sarung tangan, masker, handuk bersih, mikropipet, tabung reaksi, labu erlenmeyer, cawan petri, jarum ose,
bunsen, hemositometer, kaca obyek, kaca penutup, spektrofotometer, vortex, hot
plate stirrer, mikroskop, autoclave, kertas kopi, plastik tahan panas, thermometer, pH meter, dan DO meter (Lampiran 2).
Sedangkan bahan-bahan yang digunakan antara lain ikan mas berukuran ± 10 cm
sebanyak 50 ekor untuk uji LD50 dan 120 ekor untuk perlakuan, pakan komersil
media TSA (Lampiran 3), media TSB (Lampiran 4), alkohol 70%, larutan EDTA
10%, methanol, larutan Turk’s, dan Giemsa (Lampiran 5).
C.Desain Penelitian
Penelitian dirancang menggunakan Rancangan Acak Lengkap (RAL) dengan 3
perlakuan yaitu perlakuan 1 (pakan tanpa penambahan probiotik), perlakuan 2
(pakan+probiotik diberikan setiap hari), dan perlakuan 3 (pakan+probiotik
diberikan setiap 5 hari sekali). Tiap perlakuan diulang sebanyak 4 kali ulangan,
dengan asumsi ukuran dan kondisi ikan, lingkungan, serta konsentrasi bakteri uji
tantang pada masing-masing perlakuan uji homogen.
D.Prosedur Penelitian
Pelaksanaan penelitian terbagi atas tiga tahap (Lampiran 1), yaitu:
1) Tahap persiapan, meliputi persiapan wadah dan ikan uji, uji LD50, serta
pencampuran pakan dengan probiotik.
2) Tahap pelaksanaan yaitu pemberian pakan probiotik, uji tantang dengan bakteri
A. salmonicida, dan pengambilan darah.
1. Tahap Persiapan
1.1 Persiapan Wadah dan Ikan Uji
Wadah yang digunakan berupa akuarium berukuran 60x40x40 cm3 sebanyak 12
buah, masing-masing akuarium digunakan untuk 10 ekor ikan. Wadah disusun
secara acak dan diberi label (Lampiran 6), kemudian diisi air yang telah
diendapkan selama 24 jam sampai ketinggian 25 cm atau ± 60 L air dan diaerasi.
Sebelum digunakan, akuarium dicuci dengan sabun dan didesinfeksi
menggunakan chlorin kemudian dibilas hingga bersih dan dikeringkan.
Ikan uji yang digunakan dalam perlakuan adalah ikan mas berukuran panjang
± 10 cm sebanyak 120 ekor. Sebelum dimasukkan ke dalam akuarium, ikan uji
direndam terlebih dahulu dalam larutan garam konsentrasi 5 ppm selama 5 menit
dengan tujuan untuk melepaskan ektoparasit yang menempel. Setelah itu ikan uji
ditebar ke dalam akuarium dan dilakukan adaptasi selama satu minggu dengan
pemberian pakan menggunakan pelet tanpa probiotik.
1.2 Uji LD50
Uji LD50 dilakukan untuk mengetahui konsentrasi bakteri yang dapat
menyebabkan kematian ikan uji sebanyak 50% dari populasi awal. Dari hasil uji
tersebut, dapat diketahui konsentrasi bakteri yang akan diinfeksikan pada ikan uji.
Uji LD50 dilakukan dengan menyuntikkan bakteri A. salmonicida pada ikan mas dengan konsentrasi berbeda yaitu 104, 105, 106, 107, dan 108 cfu/ml dengan
menggunakan 10 ekor ikan. Penyuntikan dilakukan sesuai perlakuan konsentrasi
secara intraperitoneal sebanyak 0,1 ml/ekor ikan. Pengamatan jumlah kematian ikan dilakukan selama 7 hari. Perhitungan LD50 sebagai berikut (Reed et al., 1938
dalam Yuliawati, 2010) (Lampiran 8):
Log negatif LD50 = Log negatif (konsentrasi di atas 50%) + selang proporsi
1.3 Pencampuran Pakan dengan Probiotik
Probiotik dicampurkan ke pakan yang sebelumnya telah diukur dosisnya yaitu
3,3 ml/kg pakan. Pengenceran probiotik menggunakan air dengan perbandingan
1:50. Pencampuran dilakukan dengan cara menyemprotkan larutan probiotik ke
pakan menggunakan sprayer dan kemudian dikeringanginkan selama ± 2 jam (Lampiran 9).
2. Tahap Pelaksanaan
2.1 Pemberian Pakan Berprobiotik
Penentuan waktu pemberian pakan berprobiotik berdasarkan penelitian Agustina
et al. (2006) yaitu:
P1 : pakan tanpa penambahan probiotik
P2 : pakan + probiotik diberikan setiap hari
Pakan berprobiotik diberikan sesuai waktu pemberian selama 28 hari waktu
pemeliharaan dengan frekuensi dua kali sehari yaitu pukul 09.00 dan 16.00 WIB
menggunakan FR 3% dari total bobot tubuh.
2.2 Uji Tantang
Uji tantang dilakukan pada hari ke-22 waktu pemeliharaan dengan metode injeksi
yaitu menyuntikkan patogen aktif A. salmonicida ke dalam tubuh ikan secara intraperitoneal dengan menggunakan konsentrasi bakteri sesuai hasil LD50 yaitu 106 cfu/ml ke semua ikan uji dalam perlakuan. Penyuntikan dilakukan pada
intraperitoneal dikarenakan pada intraperitoneal banyak terdapat makrofag sehingga bakteri yang disuntikkan dapat langsung direspon oleh makrofag.
2.3 Pengambilan Darah
Pengambilan sampel darah dilakukan pada hari ke- 0, 14, 21, dan 28. Sampel
darah diambil dari satu ekor ikan yang dipilih secara acak pada setiap akuarium.
Sebelum digunakan, jarum suntik dan tabung eppendorf dibilas dengan larutan EDTA 10% untuk mencegah pembekuan darah. Pengambilan darah dilakukan
melalui vena caudalis yang berada di pangkal ekor ikan menggunakan jarum suntik 1 ml. Ikan yang telah diambil darahnya kemudian dikembalikan ke
akuarium semula. Kemudian darah disimpan dalam tabung eppendorf untuk
3. Tahap Pengamatan
3.1 Pemeriksaan Darah
Pemeriksaan darah dilakukan untuk melihat pola peningkatan respon imun dengan
menghitung total leukosit dan diferensial leukosit dalam darah.
a. Pengamatan total leukosit (Anonim, 2008 dalam Yuliawati, 2010) sebagai
berikut (Lampiran 10):
1. Bilik hitung hemositometer dan kaca penutupnya dibersihkan dengan
alkohol 70%, kemudian kaca penutup dipasang pada hemositometer.
2. Sampel darah dihisap dengan pipet berskala sampai 0,5 dilanjutkan dengan
menghisap larutan Turk’s sampai skala 11 (pengenceran 1:20), kemudian
digoyangkan selama 3 menit agar bercampur homogen.
3. Empat tetesan pertama dibuang, tetesan berikutnya dimasukkan ke dalam
hemositometer dengan meletakkan ujung pipet pada bilik hitung tepat batas
kaca penutup dan dibiarkan hingga bilik hitung tersebut terisi cairan secara
perlahan.
4. Bilik hitung yang telah terisi dibiarkan selama 3 menit agar leukosit
mengendap dalam bilik hitung.
5. Bilik hitung tersebut diletakkan di bawah mikroskop menggunakan
perbesaran 100x.
6. Penghitungan dilakukan pada 4 kotak besar hemositometer dimana setiap
kotak besar terbagi menjadi 16 kotak kecil.
b. Pengamatan diferensial leukosit dalam penelitian meliputi pengamatan
neutrofil, monosit, dan limfosit. Eosinofil dan basofil yang juga termasuk
dalam leukosit, tidak dihitung karena eosinofil dan basofil sangat jarang
terlihat di dalam sirkulasi darah ikan (Erika, 2008). Eosinofil dan basofil
berperan dalam infeksi parasit dan respon alergi (Nabib et al., 1989 dalam Erika, 2008).
Pengamatan diferensial leukosit sebagai berikut (Lampiran 11):
Pembuatan sediaan apus darah
1. Kaca obyek dibersihkan dengan alkohol 70%. Kemudian diletakkan
setetes darah ikan uji kira-kira 1 cm dari ujung sebelah kiri kaca obyek.
2. Sisi kiri kaca obyek dipegang dengan ibu jari dan telunjuk tangan kiri.
Kaca pemulas dipegang dengan tangan kanan dan diletakkan di depan
tetesan darah membentuk sudut kira-kira 30o dari kaca obyek membuka
ke kanan.
3. Kaca pemulas disentuhkan pada tetesan darah kemudian digeser ke arah
kanan sehingga darah tersebut akan menyebar sepanjang sisi kaca
pemulas, selanjutnya dikeringanginkan.
Cara pewarnaan Giemsa
1. Sediaan apus darah diletakkan di baki dengan sediaan apus di sebelah
atas.
2. Sediaan tersebut digenangi dengan methanol secukupnya selama 5-10
menit, kemudian kelebihan methanol yang terdapat pada sediaan
dibuang, selanjutnya digenangi dengan Giemsa selama 25 menit.
Cara pemeriksaan
1. Minyak imersi diteteskan pada bagian sediaan yang leukositnya tidak
saling menumpuk, diamati dengan perbesaran 400x.
2. Macam-macam bentuk leukosit dihitung sepanjang sediaan apus darah.
Perhitungan dihentikan bila jumlahnya telah mencapai 100 sel leukosit.
Hasilnya dihitung dalam %.
3.2 Perhitungan RPS (Relative Percent Survival) Ikan Mas
Persentase perlindungan relatif yang menunjukkan tingkat keberhasilan probiotik
dalam melindungi ikan dari infeksi bakteri A. salmonicida pada masing-masing perlakuan dapat dihitung menggunakan rumus sebagai berikut (Amend, 1981
dalam Passarela, 2006):
[ ]
3.3 Kualitas Air
Parameter kualitas air yang diamati adalah suhu, pH, dan DO. Pengukuran suhu
menggunakan thermometer, pengukuran pH menggunakan pH meter, dan
pengukuran DO menggunakan DO meter. Pengamatan kualitas air dilakukan dua
kali sehari yaitu pukul 08.00 dan 15.00 WIB. Kualitas air yang baik dipertahankan
dengan penyifonan setiap pagi hari sebelum pemberian pakan dan penambahan air
E.Analisis Data
Data hasil penghitungan total leukosit (Lampiran 12) dan diferensial leukosit
(Lampiran 13) dianalisis dengan ANOVA (Analysis of Variance) menggunakan software SPSS 19 pada selang kepercayaan 95% dan jika hasil berbeda nyata
dilanjutkan dengan uji BNT pada selang kepercayaan 95% (Lampiran 14).
Kita tidak harus berhasil pada upaya pertama.
Orang yang maunya harus berhasil pada upaya pertama, paling sesuai untuk olah raga terjun payung.
Banyak gagal itu biasa.
Satu keberhasilan yang baik bisa membayar semua kegagalan. Sabarlah.
Your time will come.
(Mario Teguh)
Para pemenang adalah pengambil resiko.
Seperti kita semua, mereka juga khawatir salah dan takut gagal. Tapi, mereka tidak membiarkan kekhawatiran dan rasa takut
menguasai mereka dan membatalkan yang bisa segera mereka laksanakan.
Mereka juga akan mengalami kesalahan dan kegagalan, tapi karena lebih banyak melaksanakan, mereka lebih sering berhasil.
Judul Skripsi : PENGARUH WAKTU PEMBERIAN PROBIOTIK YANG BERBEDA TERHADAP RESPON IMUN NON-SPESIFIK IKAN MAS (Cyprinus carpio L.) YANG DIUJI TANTANG DENGAN BAKTERI Aeromonas salmonicida
Nama : Septiarini
NPM : 0714111058
Jurusan : Budidaya Perairan
Fakultas : Pertanian
MENYETUJUI
1. Komisi Pembimbing
Esti Harpeni, S.T., M.AppSc. Wardiyanto, S.Pi., M.P. NIP. 197911182002122001 NIP. 196907052001121001
2. Ketua Jurusan Budidaya Perairan
MENGESAHKAN
1. Tim Penguji
Ketua : Esti Harpeni, S.T., M.AppSc. ………
Sekretaris : Wardiyanto, S.Pi., M.P. ………
Penguji Utama : Moh. Muhaemin, S.Pi., M.Si. ………
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP. 196108261987021001
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal
2 September 1989, sebagai anak pertama dari tiga
bersaudara dari pasangan Bapak Sukardi dan Ibu
Tarwiyah.
Pendidikan formal penulis diawali dari Taman Kanak-kanak (TK) Citra Melati
pada tahun 1993-1995, dilanjutkan ke Sekolah Dasar (SD) Negeri 3 Gedong Air
pada tahun 1995-2001, Sekolah Menengah Pertama (SMP) Negeri 2 Bandar
Lampung pada tahun 2001-2004, dan Sekolah Menengah Atas (SMA) Negeri 9
Bandar Lampung pada tahun 2004-2007. Pada tahun 2007 penulis terdaftar
sebagai mahasiswa Program Studi Budidaya Perairan, Fakultas Pertanian,
Universitas Lampung melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama kuliah penulis aktif dalam organisasi HIDRILA (Himpunan Mahasiswa
Budidaya Perairan Unila) periode 2008/2009. Penulis juga pernah menjadi staff
DPMU KBM Unila periode 2008 dan panitia khusus sidang umum MPM KBM
Unila tahun 2008.
Penulis melakukan Praktik Umum (PU) di Balai Riset Budidaya Ikan Hias
(BRBIH) Depok pada tahun 2010. Penulis menyelesaikan tugas akhir perkuliahan
yang Berbeda terhadap Respon Imun Non-Spesifik Ikan Mas (Cyprinus carpio L.)
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi dengan
judul “Pengaruh Waktu Pemberian Probiotik yang Berbeda terhadap Respon Imun
Non-Spesifik Ikan Mas (Cyprinus carpio L.) yang diuji Tantang dengan Bakteri Aeromonas salmonicida” ini disusun sebagai salah satu syarat memperoleh gelar
Sarjana Perikanan di Universitas Lampung.
Dalam kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas
Pertanian Universitas Lampung.
2. Ibu Ir. Siti Hudaidah, M.Sc. selaku Ketua Program Studi Budidaya Perairan.
3. Ibu Esti Harpeni, S.T., M.AppSc. selaku pembimbing utama atas bimbingan,
kritik, dan saran dalam proses penyusunan skripsi ini.
4. Bapak Wardiyanto, S.Pi., M.P. selaku pembimbing kedua atas bimbingan,
kritik, dan saran dalam proses penyusunan skripsi ini.
5. Bapak Moh. Muhaemin, S.Pi., M.Si. selaku pembahas atas masukan, kritik,
dan saran dalam proses penyusunan skripsi ini.
6. Bapak Agus Setyawan, S.Pi., M.P. yang telah membantu banyak dalam
7. Bapak Qadar Hasani, S.Pi., Bapak Supono, S.Pi., M.Si., dan Bapak Limin
Santoso, S.Pi., M.Si. selaku pembimbing akademik yang telah memberikan
dukungan, nasehat, dan bimbingan selama kuliah.
8. Ibu, Bapak, Adik-adik, dan seluruh keluargaku yang selalu menjadi
penyemangat dalam hidupku.
9. Humeira P. Sofia, Devira Agustin, Yeni Elisdiana, Septa Indarti, Tutut
Yuniarsih, Dewi Sartika, Revy Maharani, Niken Puspita Dewi, Agung
Kurniawan, M. Hasyim Ashari, dan M. Farzuki atas kebersamaan
menghadapi suka-duka penelitian.
10. Teman-teman seperjuanganku 2007 yang selalu ceria, terima kasih atas
kebersamaan kita selama ini.
11. Kakak-kakakku angkatan 2004, 2005, 2006 dan adik-adikku angkatan 2008,
2009, 2010, 2011 serta semua pihak yang tidak dapat disebutkan satu persatu,
terima kasih atas sumbangan do’a dan kerja samanya selama ini.
Semoga Allah SWT memberikan berkah, rahmat, dan hidayah-Nya atas kebaikan
dan pengorbanan kita. Penulis berharap semoga skripsi ini dapat bermanfaat bagi
kita semua. Amin.
Bandar Lampung, Februari 2012
Penulis,
Dengan penuh rasa syukur kepada Allah SWT, kupersembahkan
karya kecilku ini kepada Bapak dan Ibu yang selalu mendo’akan
dan memberi semangat di setiap langkahku,
Nenek yang senantiasa menyayangi dan mendo’akanku.
Adik-adikku, Rachmad Nugroho dan Fitri Azizah yang senantiasa
memberikan tawa dan semangat dalam hidupku,
Almamater tercinta ”Universitas Lampung”
Skripsi ini juga kupersembahkan kepada mereka yang dengan
ketulusan dan keceriaannya telah menemani hari-hari yang sangat
melelahkan ini
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian dapat ditarik kesimpulan sebagai berikut:
1. Waktu pemberian probiotik yang berbeda berpengaruh terhadap peningkatan
respon imun non-spesifik yang ditandai dengan peningkatan total leukosit
pada ikan mas.
2. Pemberian probiotik setiap 5 hari sekali menghasilkan respon imun terbaik
dilihat dari peningkatan total leukosit dan tingginya nilai RPS setelah diuji
tantang dengan bakteri A. salmonicida.
B. Saran
Perlu dilakukan penelitian lanjutan dengan pengamatan histopatologi untuk
pengamatan respon imun pada jaringan serta penambahan perlakuan dengan
pemberian probiotik setiap 3 hari dan 7 hari sekali untuk menentukan waktu