TEST EFFECTIVENESS OF FERMENTATION CHITIN GRADUALLY WITHActinomycetesANL-4 ANDMucor mieheiISOLATES
FOR MAKING OF GLUCOSAMINE
By
Puji Mugiyanto
Chitin is biopolymer composed by units N-acetylglucosamine binds β-(1,4) which are abundant in nature after cellulose. Chitin can be hydrolyzed into glucosamine with enzymatic reaction. Specific enzyme was used to hydrolyze chitin into glucosamine was chitinase enzyme. Chitinase enzyme can be produced by
UJI EFEKTIVITAS FERMENTASI KITIN SECARA BERTAHAP DENGAN ISOLATActinomycetesANL-4 DANMucor miehei
UNTUK PEMBUATAN GLUKOSAMIN
Oleh
Puji Mugiyanto
Kitin adalah biopolimer tersusun oleh unit-unit N-asetilglukosamin berikatan
β-(1,4) yang terdapat berlimpah di alam setelah selulosa. Kitin dapat dihidrolisis menjadi glukosamin dengan reaksi enzimatis. Enzim spesifik yang digunakan untuk menghidrolisis kitin menjadi glukosamin adalah enzim kitinase. Enzim kitinase dapat dihasilkan oleh Actinomycetes ANL-4 dan
Mucor miehei selama fermentasi batch dengan substrat kitin. Penelitian ini bertujuan untuk mengetahui efektivitas fermentasi batch kitin secara bertahap dengan Actinomycetes ANL-4 dan Mucor miehei. Pada tahap pertama kitin difermentasikan dengan menggunakan Actinomycetes ANL-4. Substrat kitin pada fermentasi tahap pertama yang tidak terhidrolisis oleh Actinomycetes
ANL-4 difermentasikan lebih lanjut dengan menggunakan Mucor miehei.
Hasil spektrum IR glukosamin standar dengan glukosamin isolasi dari fermentasi tahap pertama dan kedua secara kualitatif mempunyai pita serapan yang relatif sama. Sampel dianalisis kemurniannya menggunakan HPLC-ELSD dengan kolom C18 dan fasa gerak asetonitril/H2O (65/35). Hasil kromatogram HPLC-ELSD menunjukkan bahwa produk degradasi kitin oleh Actinomycetes
ANL-4 dan Mucor miehei memberikan satu puncak dominan dengan waktu retensi masing-masing 2,1-3 menit dan 2-3 menit. Efektivitas fermentasibatch
I. PENDAHULUAN
A. Latar Belakang
Kitin adalah senyawa homopolisakarida berantai lurus yang terdiri dari monomer
N-asetilglukosamin yang dihubungkan oleh ikatan β-(1,4) glikosida. Di alam kitin terdistribusi luas baik sebagai komponen struktural dinding sel fungi maupun
eksoskeletonArthropoda, Nematoda,danMollusca(Patilet al., 2000; Gohelet al., 2004). Kitin dapat dihidrolisis menghasilkan monomernya dengan reaksi
enzimatis. Enzim spesifik yang digunakan untuk menghidrolisis kitin adalah enzim
kitinase (Howardet al., 2003).
Terdapat dua jalur degradasi kitin di alam oleh enzim kitinase. Jalur degradasi kitin yang pertama dimulai dengan hidrolisis ikatanβ-(1,4) glikosida oleh enzim
endokitinase sehingga terbentuk oligomer kitin. Kemudian oligomer kitin dipecah menjadi dimer N-asetilglukosamin oleh enzim kitobiosidase, hingga dihasilkan monomer N-asetilglukosamin oleh enzim N-asetilglukosaminidase (kitobiase).
Selanjutnya monomer N-asetilglukosamin mengalami deasetilasi menjadi
glukosamin oleh enzim N-asetil-glukosamin-deasetilase. Jalur degradasi kitin yang
kitosan akan didegradasi oleh enzim glukosaminidase menghasilkan glukosamin
(Dinteret al., 2000).
Enzim kitinase dapat dihasilkan oleh mikroorganisme kitinolitik, salah satunya adalahActinomycetes,karenaActinomycetesmampu mensintesis metabolit senyawa yang memiliki aktivitas biologis dan spora dariActinomycetessangat esensial untuk biokonversi (Xuet al., 1996). Enzim kitinase yang dihasilkan pada proses fermentasi secarabatchmenggunakanActinomycetesANL-4 mampu menghidrolisis kitin sebanyak 30% menghasilkan N-asetilglukosamin dan
glukosamin. Dimana glukosamin merupakan produk yang dominan (Sari, 2011).
Substrat kitin yang tidak terhidrolisis olehActinomycetesANL-4 perlu dilakukan fermentasi lebih lanjut menggunakan mikroorganisme kitinolitik lainnya sehingga dapat diperoleh produk berupa glukosamin yang lebih banyak. Mikroorganisme
yang memiliki peluang besar untuk dimanfaatkan adalah mikroorganisme dari golongan fungi.
Fungi merupakan organisme yang paling banyak menghasilkan enzim bersifat
degradatif (Mc-Kane, 1996). Fungi dari ordoMucoralesmampu menghasilkan enzim kitinase pada substrat kitin atau kulitCrustaseadan media cair yang mampu memberi nutrien yang dibutuhkan (Ratledge, 1994). Salah satu fungi dari ordo
MucoralesadalahMucor miehei(Schomburget al.,1991). Mucor mieheimampu menghasilkan enzim kitinase melalui proses fermentasi dengan substrat kitin
Dari pemaparan di atas, maka dalam penelitian ini dilakukan uji efektivitas
fermentasi kitin secara bertahap untuk pembuatan glukosamin. Pada tahap pertama kitin difermentasi denganActinomycetesANL-4. Pada tahap kedua, kitin sisa fermentasi pada tahap pertama difermentasi lebih lanjut denganMucor miehei. Glukosamin yang diperoleh dikarakterisasi menggunakanHigh Performance Liqiud Chromatography(HPLC) untuk menganalisis kemurniannya danFourier Tranform Infrared(FTIR) untuk menganalisis gugus fungsinya.
B. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Mengisolasi glukosamin dari kitin dengan bantuan enzim kitinase.
2. Menentukan keefektivitasan pembuatan glukosamin dengan fermentasi bertahap
secarabatchmenggunakanActinomycetesANL-4 danMucor miehei. 3. Mengkarakterisasi glukosamin yang diperoleh dengan HPLC dan FTIR.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang :
1. PotensiActinomycetesdanMucor mieheidalam menghasilkan enzim kitinase. 2. Potensi glukosamin hasil degradasi kitin dalam bidang farmasi.
3. Pemanfaatan limbah kulit udang untuk pembuatan glukosamin yang lebih
A. Udang
Udang merupakan hewanCrustaceayaitu hewan akuatik yang terdapat di air laut dan air tawar. Udang memiliki tubuh sedikit melengkung dan dibagi menjadi tiga bagian yaitu kepala, dada, dan perut (Darmono, 1995). Limbah
udang dalam suatu proses industri dapat berupa kepala dan kulit. Kedua limbah tersebut dihasilkan dari proses pembekuan atau pengalengan udang (Elsawati, 1994).
Kulit udang mengandung protein (25% - 40%), kalsium karbonat (45% - 50%),
dan kitin (15% - 20%), tetapi besarnya kandungan komponen tersebut tergantung pada jenis udangnya. Sedangkan kulit kepiting mengandung
protein (15,60% - 23,90%), kalsium karbonat (53,70%–78,40%), dan kitin (18,70% - 32,20%), hal ini juga tergantung pada jenis dan tempat hidup kepiting. Meskipun kandungan kitin dalam kulit udang lebih sedikit
B. Actinomycetes
Actinomycetesmerupakan organisme tanah yang memiliki sifat–sifat yang umum dimiliki oleh bakteri dan jamur. Terlihat dari luar seperti jamur (eukariotik), namun organisme ini sesuai dengan semua kriteria untuk sel
prokariotik, yaitu dinding selnya mengandung asam muramat, tidak mempunyai mitokondrion, mengandung ribosom 70s, tidak mempunyai pembungkus nukleus, garis tengah selnya berkisar dari 0,5-2,0 µm, dan dapat
dimatikan atau dihambat oleh banyak antibiotik bakteri (Wesley dan Wheeler, 1993; Rao, 1994).
Menurut Alexander (1997)Actinomycetesmemiliki dinding sel yang terdiri dari polimer gula, asam amino dan asam gula seperti dinding sel bakteri gram positif. Sedangkan dinding sel fungi terdiri dari selulosa dan kitin.
Actinomycetesmenyerupai fungi karena mempunyai hifa bercabang dengan membentuk miselium. Miselium tumbuh menjulang ke udara, dan memisah dalam fragmen–fragmen yang pendek sehingga terlihat seperti cabang pada bakteri (Sutedjoet al., 1991). Actinomycetesmempunyai kesamaan dengan bakteri yaitu struktur sel dan ukuran irisan melintang (Foth, 1991).
Menurut Rao (1994), pada lempeng agar,Actinomycetesdapat dibedakan dengan mudah dari bakteri, dimana koloni bakteri tumbuh dengan cepat dan
Actinomycetestidak toleran terhadap asam dan jumlahnya menurun pada pH 5,0. Rentang pH dan temperatur yang cocok untuk pertumbuhan
Actinomycetesini sekitar 6,5–8,0 dan 25–300C. Namun, ada beberapa
Actinomycetestermofilik yang dapat tumbuh pada temperatur sekitar 55–650C sepertiThermoactinomycetesdanStreptomyces.
Medium yang baik untuk menumbuhkanActinomycetesadalah medium yang mengandung glukosa, gliserol atau tepung sebagai sumber karbon; nitrat atau
kasein sebagai sumber nitrogen dan mineral–mineral tertentu seperti NaCl, K2HPO4, MgSO4.7H2O, CaCO3, dan FeSO4.7H2O. Inkubasi biasanya selama
2–7 hari (Jutono dalam Fithria, 2007). PopulasiActinomycetesdi alam
dipengaruhi oleh beberapa faktor seperti kandungan organik, pH, kelembapan, temperatur, musim, dan lain- lain (Suwandi, 1989).
C.Mucor meihei
Istilah jamur berasal dari bahasa Yunani, yaitu fungus yang berarti tumbuh
dengan subur. Istilah ini kemudian ditujukan kepada jamur yang memiliki tubuh buah serta tumbuh atau muncul di atas tanah atau pepohonan
(Tjitrosoepomo, 1991). Organisme yang disebut jamur bersifat heterotrof,
dinding sel spora mengandung kitin, tidak berplastid, tidak berfotosintesis, tidak bersifat fagotrof, umumnya memiliki hifa yang berdinding yang dapat
Mucor mieheimerupakan jamur dari ordoMucoralesyang merupakan kelompokZygomycetesdan terkadang disebut sebagai “jamur rendah”yang dicirikan dengan hifa tidak bersekat (coneocytic), dan berkembang biak dengan zigospora secara aseksual. Kebanyakan anggota kelompok ini adalah saprofit.
Mucor mieheiberkembang biak juga melalui hifa yang koneositik dan juga berkonjugasi dengan hifa lain. Mucor mieheijuga mempunyai sporangiospora. Ketika sporangium pecah, sporangiospora tersebar, dan jika mereka jatuh pada medium yang cocok akan berkecambah dan tumbuh menjadi individu baru. Spora seksual pada kelompok jamur ini disebut zigospora (Tortoraet al., 2001).
D. Enzim
Enzim merupakan produk protein sel hidup yang berperan sebagai
biokatalisator dalam proses biokimia, baik yang terjadi di dalam sel maupun di
luar sel (Poedjiadi, 1994). Enzim merupakan katalisator sejati yang meningkatkan kecepatan reaksi kimia spesifik dengan nyata, tanpa enzim, suatu reaksi kimia akan berlangsung sangat lambat. Enzim tidak dapat
mengubah titik keseimbangan reaksi yang dikatalisisnya, enzim juga tidak akan habis dipakai atau diubah secara permanen oleh reaksi-reaksi tersebut
(Lehninger, 1982).
katalis dan digunakan oleh sel hidup untuk mengkatalisis reaksi kimia spesifik
yang terjadi di dalam sel. Enzim yang diperoleh dari mikroorganisme lebih menguntungkan karena mikroorganisme dapat berkembang biak dengan cepat, tidak memerlukan lahan yang luas, biaya produksi relatif murah dan mudah
dikontrol (Maggy, 1989).
Fungsi terpenting dari enzim adalah kemampuannya menurunkan energi aktivasi suatu reaksi kimia. Kemampuan enzim mendegradasi substrat
dipengaruhi oleh beberapa faktor, antara lain konsentrasi enzim, konsentrasi substrat, pH, serta temperatur (Lehninger, 1982). Protein adalah bagian utama
enzim yang dihasilkan sel, maka semua yang dapat mempengaruhi protein dan sel akan berpengaruh terhadap reaksi enzimatik. Beberapa faktor penting yang mempengaruhi aktivitas enzim antara lain :
a). Substrat (reaktan)
Pada konsentrasi substrat rendah, kecepatan reaksi yang terjadi rendah.
Kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi
substrat. Akan tetapi setelah peningkatan substrat lebih lanjut akan tercapai suatu laju maksimum. Pada keadaan substrat yang berlebih akan terjadi
kejenuhan pembentukan kompleks enzim substrat sehingga sebagian besar substrat tidak diubah menjadi produk. Penambahan substrat lebih lanjut
tidak berakibat terhadap laju reaksi. b). Suhu
Seperti reaksi kimia pada umumnya, maka reaksi enzimatik dipengaruhi
proses enzim tidak aktif meningkat. Umumnya enzim mengalami
kerusakan (denaturasi) pada suhu di atas 50oC. c). Derajat keasaman ( pH )
Reaksi suatu enzim dipengaruhi oleh perubahan pH karena akan berakibat
langsung terhadap sifat ion dari gugus–gugus amino dan karboksilat, sehingga akan mempengaruhi bagian aktif enzim dan konformasi dari
enzim. pH yang terlalu rendah atau terlalu tinggi akan mengakibatkan denaturasi dari protein enzim.
d). Penghambat enzim (inhibitor)
Inhibitor dapat meminimalkan kerja enzim karena akan membentuk ikatan dengan sisi aktif enzim sehingga mengganggu proses pembentukan dan
kestabilan ikatan kompleks enzim substrat. Ada beberapa cara
penghambatan enzim, seperti penghambat secara bersaing (kompetitif), penghambat tidak bersaing (non–kompetitif ), penghambat umpan balik,
dan penghambat alosterik (Lehninger, 1982).
E. Kitin
Kitin merupakan zat padat yang tidak larut dalam air, pelarut organik, alkali pekat, asam mineral lemah tetapi larut dalam asam-asam mineral yang pekat
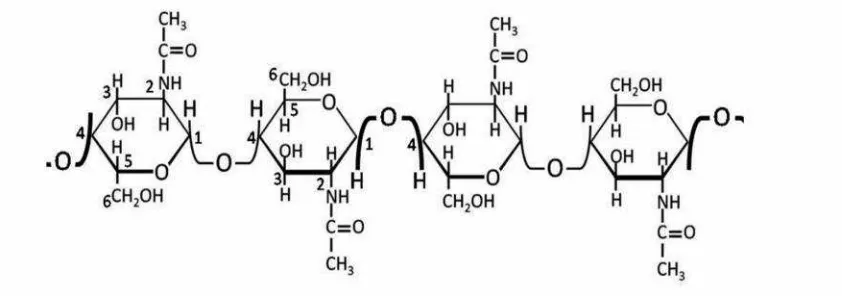
dan mempunyai rumus empiris (C6H9O4.NHCOCH3)n. Polisakarida ini mempunyai berat molekul tinggi dan merupakan polimer berantai lurus dengan nama lainβ-(1,4)-2-asetamida-2-dioksi-D-glukosa
Kitin memiliki struktur yang mirip selulosa. Selulosa tersusun atas monomer
glukosa, sedangkan kitin tersusun dari monomer N–asetilglukosamin. Keduanya memiliki kelarutan sangat rendah dalam air serta mengalami
biodegradasi melalui mekanisme yang hampir serupa dengan melibatkan komplek enzim.
Gambar 1. Struktur kitin
Kitin merupakan homopolimer dariβ-1,4 N-asetil-D-glukosamin dan
merupakan polimer kedua terbanyak di alam setelah selulosa. Senyawa ini dapat ditemukan pada cangkang udang, kepiting, moluska, seranggga, annelida, dan beberapa dinding sel jamur dan alga. Kitin dapat dihidrolisis
secara enzimatis oleh enzim kitinase, menghasilkan monomerβ -1,4-N-asetil-D-glukosamin (Yurnaliza, 2002).
Rantai kitin antara satu dengan yang lainnya berasosiasi dengan ikatan
larut dalam air dan membentuk formasi serabut (fibril) ((Cabib, (1987) dalam
Suryantoet al.,(2005)).
Adapun proses isolasi kitin dari kulit udang meliputi dua tahap, yaitu deproteinasi dan demineralisasi.
1. Deproteinasi
Deproteinasi merupakan proses pemisahan protein yang ada pada kulit udang dari kitin. Proses ini dapat dilakukan dengan dua metode, yaitu
secara kimia misal menggunakan NaOH atau KOH dan secara enzimatik menggunakan enzim proteolitik. Namun, deproteinasi menggunakan
natrium hidroksida lebih sering digunakan, karena lebih mudah dan efektif (Austinet al., 1981). Pada pemisahan protein menggunakan NaOH, protein diekstraksi sebagai Na-proteinat yang larut, dan jika menggunakan KOH
akan diperoleh K-proteinat yang mengendap (Knorr, 1984), sedangkan enzim proteolitik akan mendegradasi protein sehingga terpisah dari kitin
(Muzzarelli, 1984).
2. Demineralisasi
Demineralisasi merupakan proses pemisahan mineral atau senyawa anorganik yang ada pada kulit udang dari kitin. Mineral utama yang
terkandung dalam kulit udang adalah kalsium karbonat (CaCO3) dan kalsium fosfat (Ca3(PO4)2). Proses demineralisasi ini biasanya dilakukan
Menurut Shimahara (1988), asam klorida efektif untuk melarutkan kalsium
menjadi kalsium klorida, namun asam klorida juga menyebabkan kitin mengalami depolimerisasi. Hal ini yang menjadi alasan mengapa terkadang digunakan EDTA dalam proses demineralisasi. Hanya saja EDTA tidak dapat
mengeliminasi garam anorganik secara lengkap (Shimahara and Takiguci,1988).
F. Kitosan
Kitosan merupakan senyawa hasil deasetilasi kitin, terdiri dari unit
N-glukosamin (Muzzarelliet al., 1997; Shahidiet al., 1999). Kitosan atau ß-1,4-poli-D-glukosamin, merupakan biopolimer yang didapatkan melalui proses deasetilasi kitin, mengandung lebih dari 5000 unit glukosamin (Rabeaet al., 2003). Kitosan dibedakan dari kitin karena adanya gugus amino bebas. Kitin alami memiliki berat molekul 1-2 juta dan terdiri atas 6000-12000 unit
monosakarida. Sedangkan berat molekul kitosan relatif lebih rendah, sebab terjadi pemisahan rantai selama proses transformasi.
Adanya gugus amina menyebabkan kitosan bermuatan positif dan sangat mudah berikatan dengan permukaan yang bermuatan negatif seperti membran
mukosa. Kitosan bersifat biokompetibel dan biodegradabel, bahkan termasuk senyawa biodegradabel paling melimpah di bumi, hasil biodegradasinya
G. Kitinase
Kitinase merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin. Enzim ini dihasilkan oleh bakteri, fungi, tanaman, dan hewan. Harmanet al.,(1993) dan Sahaiet al.,(1993)dalamSuryantoet al.,(2005) membagi kitinase dalam tiga tipe yaitu :
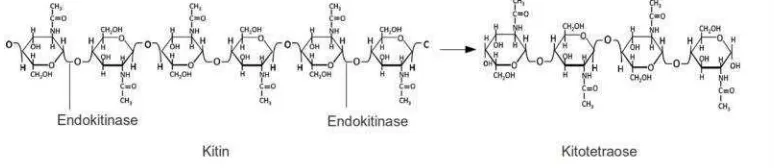
1. Endokitinase (EC 3.2.1.14) yaitu kitinase yang memotong secara acak
ikatan β-1,4 bagian internal mikrofibril kitin. Produk akhir yang terbentuk bersifat mudah larut berupa oligomer pendek N-asetilglukosamin (GIcNAc)
yang mempunyai berat molekul rendah seperti kitotetraose.
Gambar 2. Reaksi pemutusanikatan β-1,4 pada bagian internal mikrofibril kitin
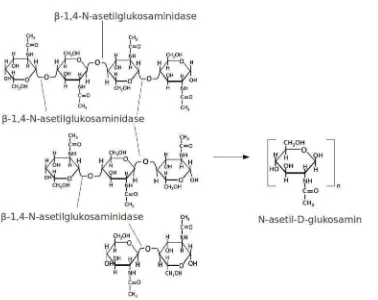
2. Eksokitinase (EC 3.2.1.14) dinamakan juga kitobiodase atau kitin 1,4-β
-kitobiodase, yaitu enzim yang mengatalisis secara aktif pembebasan unit-unit diasetilkitobiose tanpa ada unit-unit-unit-unit monosakarida atau polisakarida yang dibentuk. Pemotongan hanya terjadi pada ujung non reduksi
Gambar 3. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase
3. β-1,4-N-asetilglukosaminidase (EC 3.2.1.30) merupakan suatu kitinase yang bekerja pada pemutusan diasetilkitobiose, kitotriose dan kitotetraose dengan
menghasilkan monomer-monomer GIcNAc.
Kitinase berguna dalam produksi kitooligosakarida. Kitooligosakarida
berperan sebagai pertahanan tanaman, juga digunakan dalam kesehatan manusia. Sebagai contoh, kitoheksosa dan kitoheptosa memperlihatkan aktivitas anti tumor. N-asetilglukosamin berguna sebagai obat anti inflamasi.
Senyawa ini dalam tubuh manusia disintesis dari glukosa dan digabungkan dengan glikoprotein dan glikosaminoglikan ((Patilet al.,(2000)dalam
Suryantoet al.,(2005)). Kitinase juga berperan dalam produksi protein sel tunggal dari limbah kitin untuk makanan hewan ((Shaikhet al.,(1993)dalam
Suryantoet al.,(2005)). Kitinase juga dapat digunakan dalam pertanian sebagai pengendalian jamur patogen tanaman dan hama serangga. Kombinasi
σ-toksin dan kitinase dilaporkan lebih efektif dalam membunuh hama serangga
((Patilet al.,(2000)dalamSuryantoet al.,(2005)).
Berdasarkan homologi sekuen asam aminonya, kitinase dibedakan atas famili 18 dan 19. Famili 18 meliputi kitinase dari bakteri, fungi, serangga, tanaman
(kelas III dan V), hewan (Gijzenet al.,2001) dan satu kitinase dari
Streptomyces griseus(Ohnoet al., 1996). Kitinase tanaman kelas I tersusun atas sekuen yangconservedpada struktur utamanya, serta domain kaya sistein pada ujung N. Kitinase kelas II secara struktural homolog dengan kelas I, tetapi tidak memiliki domain kaya sistein. Sementara, kitinase kelas III dan V
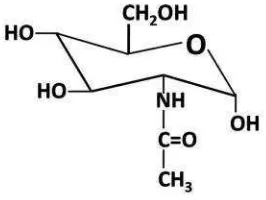
H. N-asetilglukosamin
N-asetilglukosamin adalah suatu bagian monosakarida dari glukosa. Secara kimia merupakan amida antara glukosamin dan asam asetat. Struktur molekulnya adalah C8H15NO6, massa molar 221,21 g/mol dan zat ini
merupakan bagian penting dalam sistem biologi.
Gambar 5. Struktur N-asetilglukosamin
N-asetilglukosamin merupakan gula amino dan di negara maju telah diproduksi secara komersial mengingat manfaatnya di berbagai industri, seperti bidang
kesehatan, farmasi, biokimia, bioteknologi, kosmetika, biomedika, pangan, tekstil, kertas, dan lain-lain. Pemanfaatan tersebut didasarkan atas sifat-sifatnya yang dapat digunakan sebagai pengemulsi, koagulasi, pengkhelat, dan
penebal emulsi. Berbeda dengan kitin, N-asetilglukosamin bersifat mudah larut dalam air, sedikit larut dalam methanol yang dipanaskan dan tidak larut
N-asetilglukosamin sering ditemukan sebagai komponen utama pada rangka
luarCrustacea,Arthropoda, dan cendawan (Horton, 1980).
I. Glukosamin
Glukosamin pertama kali diidentifikasi oleh Dr. Georg Ledderhose pada tahun 1876, tetapi struktur stereokimia tidak sepenuhnya diketahui sampai ditemukan
oleh Walter Haworth pada tahun 1939. Glukosamin (C6H13NO5) merupakan gula amino dan prekursor penting dalam sintesis biokimia dari protein glikosilasi dan lipid. Glukosamin ditemukan sebagai komponen utama dari
rangka luarCrustacea,Arthropoda, dan cendawan. Glukosamin merupakan salah satu monosakarida yang banyak dijumpai. Dalam industri, glukosamin
diproduksi dengan cara hidrolisis rangka luarCrustacea.
Gambar 6. Struktur D-glukosamin
Glukosamin terdapat pada golonganCrustaceaseperti rajungan, kepiting, udang dan cumi-cumi. Selain itu juga terdapat pada invertebrata seperti
glukosamin (D-glukosamin). Glukosamin dapat berfungsi sebagai pengemulsi,
koagulasi, pengkhelat dan penebal emulsi (Anonim, 2007).
J. Fermentasi
Fermentasi merupakan proses untuk menghasilkan berbagai produk yang melibatkan mikroorganisme. Produk yang dapat diperoleh dari proses fermentasi antara lain yaitu enzim, sel mikroorganisme, metabolit primer,
metabolit sekunder, dan senyawa kimia hasil proses biokonversi. Fermentasi juga merupakan suatu proses untuk menghasilkan energi dengan bantuan
senyawa organik yang bertindak sebagai pemberi dan penerima elektron. Dalam suatu fermentasi berlangsung aktivitas metabolisme mikroorganisme baik aerobik maupun anaerobik, sehingga substrat organik mengalami
perubahan secara kimiawi (Rachman, 1989).
K. Fermentasi Fase Cair Sistem Tertutup (Batch)
Fermentasi merupakan reaksi oksidasi reduksi yang menggunakan sumber energi dan sumber karbon, nitrogen dan pospor untuk membentuk senyawa bernilai ekonomi lebih tinggi serta terakumulasi dalam medium (Rao, 2009).
Fermentasi medium cair dapat dilakukan dengan tiga cara, yaitu fermentasi
tertutup (batch culture), fermentasifed batchdan fermentasi kontinu
(continuous batch). Pada fermentasi tertutup, setelah inokulasi tidak dilakukan lagi penambahan medium kedalamfermentor, kecuali pemberian oksigen (udara steril), antibuih dan asam atau basa yang mengatur pH. Karena itu pada sistem tertutup ini, dengan sekian lamanya waktu fermentasi, laju pertumbuhan
spesifik mikroorganisme semakin menurun sampai akhirnya pertumbuhan terhenti. Penurunan dan berhentinya pertumbuhan disebabkan karena dengan semakin bertambahnya waktu fermentasi nutrien-nutrien esensial dalam
medium semakin berkurang atau terjadi akumulasi autotoksin yang mempengaruhi laju pertumbuhan atau kombinasi dari keduanya. Dengan
demikian pada fermentasi tertutup jumlah sel pada fasestationermerupakan jumlah sel maksimum. Pada fermentasifed bacthsetelah inokulasi dilakukan penambahan medium baru tetapi tidak dilakukan pengambilan produk yang
dihasilkan.Yieldyang dihasilkan pada fermentasifed batchlebih besar dibandingkan pada fermentasibatch. Sedangkan fermentasicontinuous batch
merupakan suatu fermentasi dimana secara terus menerus dilakukan penambahan medium kultur dan pengambilan produk.
1. Proses Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Mitchelet al.(2006) tahapan–tahapan proses secara umum, antara lain :
disebut dengan pra-perawatan substrat untuk menambah ketersediaan
gizi.
2. Persiapan inokulum, tipe dan persiapan inokulum tergantung pada mikroorganisme yang digunakan. Banyak proses fermentasibatch
melibatkan bakteri, jamur dan salah satunyaActinomycetesmaka digunakan spora hasil inokulasi. Tujuan dari langkah ini untuk
mengembangkan sebuah inokulum dengan tingkat kelangsungan hidup mikoorganisme yang tinggi.
3. Persiapan wadah, dimana wadah harus dibersihkan setelah fermentasi
sebelumnya dan perlu disterilkan sebelum penambahan substrat. 4. Inokulasi dan pengerjaan, pengerjaan tahapan ini dengan menyebarkan
substrat pada media yang telah disterilkan secara hati–hati untuk menghindari kontaminasi dari mikroorganisme yang tidak diinginkan. 5. Proses fermentasibatch, pada proses ini banyak hal yang harus
diperhatikan antara lain pH medium, suhu, dan waktu inkubasi. Aerasi atau penambahan oksigen dapat dilakukan apabila diperlukan.
Actinomycetesmerupakan mikroorganisme fakultatif anaerobik, yaitu mikroorganisme yang dapat memanfaatkan oksigen disekitarnya jika tersedia.
6. Kultivasi, pada tahapan ini memerlukan bantuan mekanis untuk
memisahkan substrat padat dari medium. Penggunaan kertas saring dan
2. Keuntungan Fermentasi Fase Cair Sistem Tertutup (Batch)
Dibandingkan dengan medium padat, medium cair memiliki beberapa
kelebihan, yaitu (Weiteset al.,2001):
1. Jenis dan konsentrasi komponen-komponen dapat diatur sesuai dengan yang
diinginkan.
2. Dapat memberikan kondisi yang optimum untuk pertumbuhan. 3. Pemakaian medium lebih efisien.
3. Aplikasi Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Holkeret al.(2004) dan Pandey (2000) dapat menguraikan aplikasi dari fermentasibatchsecara tradisional, antara lain :
a). Bir, minuman beralkohol. Sari buah yang diberiSaccaromyces cereviciae
kemudian diinkubasikan didapatkan minuman beralkohol.
b).Yoghurt,diproduksi dengan cara memfermentasikan air susu dengan bakteri bukan khamir. Biasanya menggunakan campuranLactobacillus bulgaricus
danStreptococcus thermophillus. Bakteri mengubah laktosa (gula susu) pada kondisi anaerobik. Laktosa diubah menjadi asam laktat yang bersifat menggumpalkan kasein (protein susu).
c). Keju, berbagai jenis bakteri dapat digunakan untuk fermentasi susu menjadi keju, tergantung dari jenis keju yang dihasilkan. Biasanya digunakan
spesiesStreptococcus thermophillusdanLactobacillus bulgaricus. Enzim yang diperlukan untuk menghasilkan keju adalahrennetyang mengandung
Selain aplikasi di atas, kebanyakan dari aplikasi tersebut menghasilkan
produk-produk seperti enzim, pigmen, senyawa aromatik, senyawa kimia, antibiotik, dan agen pengontrol biologis.
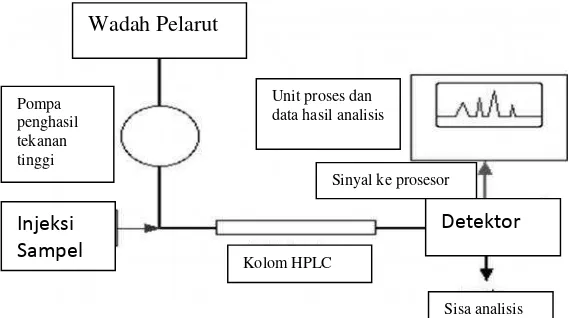
L.High Performance Liquid Chromatography(HPLC)
HPLC adalah suatu teknik kromatografi yang menggunakan fasa gerak cair. HPLC dapat digunakan untuk pemisahan sekaligus untuk analisis senyawa
berdasarkan kekuatan atau kepolaran fasa geraknya. Berdasarkan polaritas relatif fasa gerak dan fasa diamnya, HPLC dibagi menjadi dua, yaitu fasa
normal yang umum digunakan untuk identifikasi senyawa nonpolar dan fasa terbalik yang umum digunakan untuk identifikasi senyawa polar. Pada fasa normal, fasa gerak yang digunakan kurang polar dibandingkan fasa diam.
Sedangkan pada fase terbalik, fasa gerak lebih polar dibandingkan fasa diam (Gritteret al., 1991).
Prinsip pemisahan senyawa menggunakan HPLC adalah pebedaan distribusi
Gambar 7. Diagram Alir HPLC
Ada beberapa cara untuk mendeteksi substansi yang telah melewati kolom
HPLC. Metode yang dipakai untuk menganalisis N-asetilglukosamin adalah penggunaan evaporasi detektor hamburan cahaya (Mulja and Suharman, 1995). N-asetilglukosamin tidak dapat dianalisis dengan detektor UV secara langsung.
N-asetilglukosamin memiliki serapan sinar UV pada panjang gelombang
dibawah 205 nm, yang hampir sama dengan serapan pelarut polar seperti air dan metanol.
Cara yang praktis dan efisien untuk menganalisis N-asetilglukosamin adalah
dengan HPLC yang dilengkapi ELSD (Evaporative Light Scaterring
Detection). Detektor evaporasi hamburan cahaya ideal untuk mendeteksi analit tanpa gugus kromofor UV, karena analisis tidak bergantung pada sifat optik dari suatu senyawa. Prinsip kerja dari detektor evaporasi hamburan cahaya adalah sampel yang berasal dari HPLC dalam bentuk cair mengalami
mengalami evaporasi (penguapan) sehingga terpisah dari sampel. Sampel yang
telah terpisah ditembaki dengan sinar pada semua panjang gelombang (LS), kemudian jumlah cahaya yang dipantulkan kembali akan memberikan sinyal untuk detektor. Sinyal yang terdeteksi akan memberikan data output berupa
kromatogram.
Adapun keunggulan dari ELSD yaitu:
1. Sensitivitas tinggi memberikan respon yang luar biasa untuk semua
senyawa, sampai ke tingkat nanogram rendah.
2. Operasi Sub-ambien menggunakan tabung penguapan berpendinginPeltier
memberikan suhu rendah sampai 10°C, mencegah degradasi dari senyawa labil panas yang tidak terdeteksi oleh ELSD lain.
3. Real-timekontrol selama injeksi melalui Softwaredimensi yang diprogram untuk mempertahankan sensitivitas maksimum pada pengoperasian alat. 4. Real-timepemrograman gas yang menghilangkan efek peningkatan pelarut
selama elusi gradien, sangat baik untuk analisis kation.
5. Dispersi rendah dan kecepatan data output-tingkat tinggi adalah pasangan yang cocok untuk aplikasi LC Cepat.
6. Reprodusibilitassuper di bawah 2% memberikan hasil yang dapat diandalkan dan akurat.
Kondisi HPLC untuk identifikasi N-asetilglukosamin menggunakan kolom
C18 yang bersifat nonpolar, fasa gerak adalah asetonitril/H2O/H3PO4 (10/90/0,1) yang merupakan campuran pelarut polar, laju alir 1,5 mL/menit, dan waktu run 20 menit. Pada proses elusi, digunakan metode isokratik, yaitu
eluennya menggunakan perbandingan komponen yang tetap dari awal sampai dengan akhir pemeriksaan (Gritteret al.,1991).
M. Fourier Transform Infrared(FTIR)
Pada dasarnya Spektrofotometer FTIR adalah sama dengan Spektrofotometer
Infra Reddispersi, perbedaannya adalah pengembangan pada sistem optiknya sebelum berkas sinar infra merah melewati contoh. Dasar pemikiran dari Spektrofotometer FTIR adalah dari persamaan gelombang yang dirumuskan
oleh Jean Baptiste Joseph Fourier (1768-1830) seorang ahli matematika dari Perancis. Dari deret Fourier tersebut intensitas gelombang dapat digambarkan
sebagai daerah waktu atau daerah frekuensi. Perubahan gambaran intensitas gelombang radiasi elektromagnetik dari daerah waktu ke daerah frekwensi atau sebaliknya disebut Transformasi Fourier (Fourier Transform). Selanjutnya pada sistem optik peralatan instrumenFourier Transform Infra Reddipakai dasar daerah waktu yang non dispersif. Secara keseluruhan, analisis
menggunakan spektrofotometer ini memiliki dua kelebihan utama dibandingkan SpektrofotometerInfra Reddispersi yaitu :
1. Dapat digunakan pada semua frekuensi dari sumber cahaya secara simultan
2. Sensitifitas dari metoda Spektrofotometri FTIR lebih besar daripada cara
dispersi, sebab radiasi yang masuk ke sistem detektor lebih banyak karena tanpa harus melalui celah (Hsu, 1994).
Spektroskopi FTIR merupakan metode yang dapat digunakan untuk
mengidentifikasi gugus fungsi yang terdapat dalam senyawa organik, gugus fungsi ini dapat ditentukan berdasarkan ikatan dari tiap atom. Prinsip kerja
dari metode ini adalah sinar yang terserap menyebabkan molekul dari senyawa tervibrasi dan energi vibrasi diukur oleh detektor serta energi vibrasi dari gugus fungsi tertentu akan menghasilkan frekuensi yang spesifik. Radiasi infra
merah mempunyai spektrum elektromagnetik pada bilangan gelombang 13000-10 cm-1atau panjang gelombang dari 0,78-1000 µm. Penggunaan spektrum
infra merah untuk menentukan gugus fungsi suatu struktur senyawa organik biasanya antara 4000-400 cm-1(2.5 sampai 25 µm). Daerah di bawah
frekuensi 400 cm-1(25 µm) disebut daerah infra merah jauh, dan daerah di atas
4000 cm-1(2.5 µm) disebut daerah inframerah dekat (Silverstein et al.,1986).
Sebagai contoh senyawa kitinmemberikan data serapan IR : ν =3448,5 cm-1 yang menunjukan vibrasi ulur NH amida (NH amina) dan OH;ν =
2920-2873,7 cm-1yang menunjukan vibrasi ulur CH, CH2, dan CH3;ν =1450,4 cm -1
yang menunjukan Vibrasi tekuk NH;ν =1153,4 cm-1yang menunjukan
vibrasi ulur C-N;ν =1033,8 cm-1yang menunjukan vibrasi ulur C-O; danν =
A. Waktu dan Tempat
Penelitian ini telah dilaksanakan dari bulan April 2012 sampai dengan bulan September 2012, dengan tahapan kegiatan, yaitu: pengambilan sampel limbah kulit udang di Tambak udang PT. Central Pertiwi Bahari, Lampung Utara,
pembuatan serta karakterisasi kitin dan glukosamin dilakukan di Laboratorium Biomasa Terpadu, Universitas Lampung.
B. Alat dan Bahan
Dalam penelitian ini alat–alat yang digunakan adalah peralatan gelas,Orbital shaker,Heating Magnetic Stirer, pH meter, mikropipet,Laminar air flow, inkubator Memmert-Germany/INCO2,centrifugeHitachi/CF 16 RX II, digital
waterbathWiggen Hauser,autoclave,Freeze dryScanvac Coolsafe,Frezeer, neraca digital Wiggen Hauser, mortar, termometer, oven, HPLC (High
Adapun bahan–bahan yang digunakan adalah standar Glukosamin WAKO
Jepang, standar kitin produksi WAKO Jepang,phenyl isothiocyanate, yeast extract,malt exstract, dekstrosa, agar,cycloheximide,nalidixic acid, air laut, CH3COONa, (NH4)2SO4, NaCl, KH2PO4, K2HPO4, NaH2PO4.H2O ,
Na2HPO4.7H2O , H3PO4,MgSO4, CaCl2, NaOH, HCl, laktosa, bakto pepton, urea, asam sitrat, natrium sitrat, kertas saring, eter, metanol, akuabides,
indikator universal,ActinomycetesANL-4,Mucor miehei, asetonitril, akuades, dan kulit udang.
C. Prosedur Penelitian
1. Pembuatan Kitin
Proses isolasi kitin sendiri terdiri atas tiga tahap, yaitu: deproteinasi yang merupakan proses pemisahan protein dari kulit udang, demineralisasi yang
merupakan proses pemisahan mineral, dan depigmentasi yang merupakan tahap pemutihan kitin. Namun pada penelitian ini tidak dilakukan tahap
depigmentasi karena kitin yang dihasilkan tidak untuk dikomersilkan. Depigmentasi bertujuan untuk menghilangkan zat warna (pigmen) yang terdapat pada sampel (kulit udang) dari kitin. Proses depigmentasi
1.1. Deproteinasi
Sebanyak 50 gram sampel ditempatkan dalam bejana tahan asam dan basa yang dilengkapi pengaduk dan termometer, dan diletakkan dalam penangas air. Kemudian sampel ditambahkan 500 mL NaOH 20 % dan
didiamkan selama 1 jam pada suhu 90oC (Pareira, 2004). Setelah itu, dilakukan penyaringan sehingga diperoleh residu dan filtrat. Filtrat
diuji dengan CuSO4untuk membuktikan bahwa protein berhasil
dipisahkan dari kitin melalui deproteinasi. Protein dengan CuSO4akan membentuk senyawa kompleks berwarna ungu. Residunya dicuci
dengan akuades hingga pH netral. Pencucian ini dimaksudkan untuk mencegah terjadinya degradasi produk selama proses pengeringan (Sari,
2010). Kemudian residu dikeringakan dalam oven dengan suhu 60oC selam 24 jam.
1.2. Demineralisasi
Kitin kasar hasil deproteinasi dimasukkan dalam bejana tahan asam dan basa yang dilengkapi dengan pengaduk, termometer dan diletakkan dalam penangas air. Kemudian sampel ditambahkan HCl 1,25 N
dengan perbandingan 1:10 (w/v) selama 1 jam pada suhu 90oC
(Pareira, 2004). Setelah itu, dilakukan penyaringan sehingga diperoleh
amonium oksalat untuk membuktikan bahwa mineral kalsium berhasil
dipisahkan dari kitin melalui demineralisasi. Ion oksalat akan
membentuk endapan putih dengan kalsium. Residunya dicuci dengan
akuades sampai pH netral yang diukur dengan indikator universal. Pencucian dimaksudkan untuk mencegah terjadinya degradasi produk selama proses pengeringan (Sari, 2010). Kemudian residu dikeringkan
dalam oven pada suhu 60oC selama 24 jam, sehingga diperoleh kitin berwarna kuning kemerahan.
2. Karakterisasi Kitin dengan FTIR
Kitin murni yang diperoleh melalui dua tahap yaitu deproteinasi dan
demineralisasi dibaca dengan Spektrofotometer IR. Kitin dibuat pelet dengan KBr, kemudian dilakukanscanningpada daerah frekuensi antara 4000 cm-1 sampai dengan 400 cm-1. Hasil yang diperoleh dibandingkan dengan hasil
pembacaan kitin standar.
3. Pembuatan Media
3.1. Media ISP-2 (International Streptomyces Project-2)
3.2. Larutan Mineral GaramActinomycetesANL-4
Larutan ini terdiri dari 0,4% (NH4)2SO4, 0,6% NaCl, 0,1% K2HPO4,
0,01% MgSO4, 0,01% CaCl, dan 0,5% kitin. Larutan disterilkan dengan
autoclaveselama 20 menit pada suhu 121oC dan tekanan 2 atm.
3.3. Media FermentasiMucor miehei
Larutan ini terdiri dari laktosa 0,1 gram, bakto pepton 0,3 gram, (NH3)2SO41,4 gram, urea 0,3 gram, KH2SO42 gram, FeSO4.7H2O 0,3
gram, CaCl20,3 gram, ZnSO4.7H2O 0,287 gram, dan 1 gram kitin terakhir dilarutkan dalam buffer sitrat pH 4 sampai 100 mL. Selanjutnya campuran
dikocok dengan bantuan magnetik stirer sampai homogen lalu disterilisasi dalamautoclavedengan suhu 121oC dan tekanan 2 atm selama 20 menit.
3.4. MediaPotato dextrose Liquid(PDL)Mucor miehei
Sebanyak 200 gram kentang diiris halus lalu direbus dalam 500 ml akuades selama 1-1,5 jam serta disaring dengan kain tipis berlapis kapas,
sehingga diperoleh cairan ekstrak kentang yang bening. Kemudian ditambahkan dekstrosa 10 gram lalu panaskan dan aduk hingga homogen. Aquades ditambahkan lagi hingga diperoleh volume akhir 1000 ml
3.5. Larutan Buffer Pospat pH 7
Sebanyak 0,964 g NaH2PO4.H2O dan 0.8078 g Na2HPO4.7H2O dilarutkan
dalam 100 mL air kemudian dicek pH-nya. Ditambahkan NaOH atau H3PO4bila dibutuhkan. Ini merupakan buffer pospat pH 7 1 M.
3.6. Larutan Buffer Sitrat pH 4
Campurkan 33 mL larutan stok asam sitrat 0,1 M dan 17 mL larutan stok natrium sitrat 0,1 M dan encerkan dengan akuades sampai 100 ml untuk
mendapatkan larutan buffer pH 4.
4. PertumbuhanActinomycetesANL-4
StrainActinomycetesyang digunakan adalah ANL–4 yang telah berhasil diisolasi dari sedimen mangrove pantai, ciri–ciri strain ini memiliki miselium
aerialberwarna putih keabuan dan miselium substratnya berwarna krem keabuan. StrainActinomycetesditumbuhkan dalam media ISP-2. 25μg/mL
cycloheximidedan 25μg/mLnalidixic acidditambahkan untuk menghindari kontaminasi jamur dan bakteri (Margaveyet al., 2004).
5. Persiapan InokulumActinomycetesANL-4
Spora kultur 7–9 hari dipisahkan dan diinokulasikan ke dalam tabung
6. PertumbuhanMucor mieheipada Media PDL
Pada media PDL diinokulasikan 1 ose biakanMucor mieheikemudian diguncang denganshakerselama 4 hari dengan kecepatan 120 rpm.
7. Persiapan StarterMucor miehei
Starter dibuat dengan cara biakanMucor miehei yang telah tumbuh pada media PDL, dimasukkan dalam campuran media fermentasiMucor mieheisebanyak 100 mL, kemudian diguncang denganshakerselama 4 hari pada kecepatan 120 rpm.
8. Fermentasi Fase Cair Sistem Tertutup (Batch) Kitin Tahap I dengan ActinomycetesANL-4
Fermentasibatchdilakukan dengan menggunakanfermentordengan sistem tertutup. Substrat yang digunakan adalah kitin. Sebelum digunakan kitin direbus dengan 0,5% NaOH selama satu jam berdasarkan metode Grayet al
(1978). Selanjutnya kitin dibilas dengan akuades, lalu disaring dan
dikeringkan.
Sebanyak 10 g substrat kitin dimasukkan dalam Labu Duran 250 mL. Substrat kemudian direndam dengan 50 mL larutan mineral garam yang terdiri dari
0,4% (NH4)2SO4, 0,6% NaCl, 0,1% KH2PO4, 0,01% MgSO4, 0,01 % CaCl. pH larutan dikondisikan pada 7,0 dengan menggunakan buffer pospat pH 7
kitin dan difermentasi pada 30 °C denganshaking250 rpm selama 45 hari (Chahalet al., 1996).
Sejumlah hasil dari fermentasibatchdipanaskan denganwaterbathpada suhu 70oC selama 45 menit. Kemudian dicampurkan dengan 45 mL air destilasi
dengan membiarkan tabung padarotary shakerselama 1 jam pada 200 rpm. Campuran disaring menggunakan kain katun dan filtrat di sentrifugasi dengan
kecepatan 13.000 rpm selama 20 menit pada suhu 4oC. Semua filtrat yang diperoleh dibekukan di dalam pendinginfrezeerselama 24 jam, kemudian diliofilisasi dengan menggunakanfrezee dryersampai terbentuk kristal Glukosamin.
9. Fermentasi Fase Cair Sistem Tertutup (Batch) Kitin Tahap II dengan Mucor miehei
Substrat kitin pada fermentasi tahap I denganActinomycetesANL-4 yang tidak terdegradasi dibilas dengan akuades kemudian dimasukkan dalam Labu Duran 250 mL. Substrat kemudian direndam dengan 50 mL media
fermentasiMucor miehei yang terdiri dari laktosa 0,1 gram, bakto pepton 0,3 gram, (NH3)2SO41,4 gram, urea 0,3 gram, KH2SO42 gram, FeSO4.7H2O 0,3 gram, CaCl20,3 gram, ZnSO4.7H2O 0,287 gram,. pH larutan dikondisikan
pada 4,0 dengan menggunakan buffer sitrat pH 4 kemudian media disterilisasi denganautoclevepada 2 atm temperatur 121oC selama 20 menit. Sebanyak 50 mL starter diinokulasikan dalam media kitin dan difermentasi pada 30 °C
Sejumlah hasil dari fermentasibatchdipanaskan denganwaterbathpada suhu 70oC selama 45 menit. Kemudian dicampurkan dengan 45 mL air destilasi dengan membiarkan tabung padarotary shakerselama 1 jam pada 200 rpm. Campuran disaring menggunakan kain katun dan filtrat di sentrifugasi dengan kecepatan 13.000 rpm selama 20 menit pada suhu 4oC. Semua filtrat yang diperoleh dibekukan di dalam pendinginfrezeerselama 24 jam, kemudian diliofilisasi dengan menggunakanfrezee dryersampai terbentuk kristal glukosamin.
Sedangkan substrat hasil pemisahan dari filtrat kemudian dicampurkan
dengan asam asetat 5% dengan perbandingan 1:100 dengan membiarkan tabung padarotary shakerselama 1 jam pada 200 rpm. Campuran disaring menggunakan kain katun dan filtrat di sentrifugasi dengan kecepatan 13.000 rpm selama 20 menit pada suhu 4oC. Semua filtrat yang diperoleh dibekukan di dalam pendinginfrezeerselama 24 jam, kemudian diliofilisasi dengan menggunakanfrezee dryer sampai terbentuk kristal kitosan.
10. Karakterisasi Glukosamin
10.1. Analisis dengan HPLC
•Pembuatan Standar Glukosamin.
50 mg standar glukosamin dilarutkan dalam 25 mL akuabides.
•Pemeriksaan Sampel Glukosamin Hasil Isolasi.
Dibuat larutan stok yang terdiri dari 1 mLfenilisothiosianatedan 9 mL metanol dalam labu ukur 10 mL hingga batas ukur. Kemudian
dibuat sampel glukosamin dengan dilarutkan 10 mg sampel dalam larutan CH3COONa 0,1 M pada labu ukur 10 mL. Dimasukan 1 mL
sampel glukosamin hasil isolasi ke dalam labu ukur 10 mL, kemudian ditambahkan 80 μ L stokfenilisothiosianatedan 6 mL metanol serta akuades hingga tanda batas labu ukur. Selanjutnya diambil 5 mL,
dipanaskan selama ± 15 menit pada suhu 80°C lalu didinginkan pada suhu ruang. Larutan ini diekstraksi dengan 5 ml eter untuk
membebaskanfenilisohtiosianateyang tidak bereaksi. Lapisan air dibaca dengan HPLC-ELSD (Evaporative Light Scattering Detection) menggunakan kolom C18, fasa gerak adalah asetonitril/H2O (65/35)
yang merupakan campuran pelarut polar, laju alir 0,8 mL/menit, laju gas nitrogen 1,6 L/menit, suhu nebulisasi 40oC, suhu evaporasi 30oC,
dan waktu run 6 menit (Jacyno, 2004).
10.2. Analisis dengan FTIR
Glukosamin yang diperoleh dibaca dengan Spektrofotometer IR.
Sampel glukosamin dibuat pelet dengan KBr, kemudian dilakukan
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut :
1. Produk fermentasibatchkitin denganActinomycetesANL-4 danMucor miheipada spektrum FTIR secara kualitatif memiliki pita serapan pada bilangan gelombang yang relatif yang sama dengan glukosamin standar
WAKO Jepang.
2. Kromatogram HPLC produk fermentasibatchkitin denganActinomycetes
ANL-4 danMucor miheimempunyai puncak dengan rentang waktu retensi masing-masing 2,1-3 menit dan 2-3 menit. Glukosamin standar WAKO Jepang memiliki puncak dengan rentang waktu retensi 2-3 menit. 3. Fermentasibatchkitin secara bertahap denganActinomycetesANL-4 dan
Mucor miheicukup efektif untuk pembuatan glukosamin.
4. Efektivitas fermentasibatchkitin denganActinomycetesANL-4 sebesar 41,98 %, sedangkan denganMucor mieheisebesar 49,92 %.
5. Efektivitas Fermentasibatchkitin secara bertahap denganActinomycetes
B. Saran
Dari hasil penelitian yang diperoleh, maka disarankan untuk mempersiapkan sampel glukosamin lebih kering lagi atau bebas air sebelum dianalisis gugus fungsinya dengan menggunakan FTIR dan menggunakan kolom karbohidrat
(Skripsi)
Oleh
Puji Mugiyanto
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Oleh
Puji Mugiyanto
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
lapangkanlah niscaya Allah akan memberi kelapangan
untukmu. Dan apabila dikatakan: "Berdirilah kamu",
maka berdirilah, niscaya Allah akan meninggikan
orang yang beriman di antaramu dan
orang-orang yang diberi ilmu pengetahuan beberapa derajat.
Dan Allah Maha Mengetahui apa yang kamu kerjakan
(Al Mujaadilah : 11).
Hendaklah kamu semua mengusahakan ilmu
pengetahuan itu sebelum dilenyapkan. Lenyapnya
ilmu pengetahuan ialah dengan matinya orang-orang
yang memberikan atau mengajarkannya. Seorang itu
tidaklah dilahirkan langsung pandai, jadi ilmu
pengetahuan itu pastilah harus dengan belajar
(Ibnu Mas ud r.a).
Maka bersabarlah kamu dengan sabar yang baik
(Al Ma´aarij : 5).
Sebaik-baik manusia adalah orang yang paling banyak
manfaatnya untuk orang lain
(H.R. Bukhari).
Berbuat baiklah kepada kedua orangtua, karena itu
bukan hanya sebuah bakti anak kepada mereka, tetapi
jauh dari itu berbuat baik kepada kedua orang tua
merupakan pencerminan sikap ikhlas, rendah hati,
dan ketulusan kita sebagai anak
Mucor mieheiuntuk Pembuatan Glukosamin Nama Mahasiswa :
Puji Mugiyanto
Nomor Pokok Mahasiswa : 0817011008
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Dra. Aspita Laila, M.S. Prof. Dr. John Hendri, M.S.
NIP. 196009091988112001 NIP. 195810211987031001
2. Ketua Jurusan
yang sangat aku sayangi dan cintai :
Bapakku Sunaryo
yang telah menjadi penopang dalam hidupku,
Mamakku Marliyah (alm)
yang telah menjadi malaikat pelindungku,
Adikku Kuriya Ira Wati dan Kakakku Sumardi
yang telah menjadi motivator terhebatku,
Elianasari
yang selalu sabar dan setia menjadi teman hatiku,
Sahabat dan teman-teman
yang selalu belajar dan berjuang bersamaku,
Guru-guruku
yang senantiasa membimbing dan membagi
ilmunya,
1. Tim Penguji
Ketua :Dra. Aspita Laila, M.S. ………
Sekretaris :Prof. Dr. John Hendri, M.S. ………
Penguji
Bukan Pembimbing :Dra. Fifi Martasih, M.S. ………...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Dr. Suharso, Ph. D NIP 196905301995121001
Penulis dilahirkan di Kutoarjo, pada tanggal 05 Oktober 1990, yang merupakan
buah hati dari pasangan bapak Sunaryo dan ibu Marliyah (alm). Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 2 Kutoarjo pada tahun
2003, dan Sekolah Menengah Pertama di SMP Negeri 1 Gedong Tataan pada tahun 2006. Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 1 Gadingrejo pada tahun 2008. Pada tahun yang sama penulis diterima
sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui Penelusuran Kemampuan Akademik dan Bakat (PKAB). Selama menjadi mahasiswa penulis pernah menjadi asisten dosen
praktikum Kimia Dasar untuk Jurusan Biologi FMIPA Unila pada tahun 2011, asisten dosen praktikum Kimia Dasar untuk Jurusan Kimia FMIPA Unila pada
tahun 2012, asisten dosen praktikum Kimia Medik untuk Jurusan Pendidikan Dokter FK Unila pada tahun 2011, serta asisten dosen praktikum Sains Dasar Bidang Kimia dan asisten dosen tutorial Sains Dasar MIPA untuk Jurusan Ilmu
Komputer FMIPA Unila pada tahun 2012. Penulis pernah memperoleh Beasiswa Bantuan Mahasiswa (BBM) dan Beasiswa Bank Indonesia. Penulis aktif di
Assalamualaikum Wr. Wb.
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat, ridho, dan karunia-Nya penulis dapat menyelesaikan skripsi ini. Shalawat dan salam tidak lupa penulis haturkan kepada Nabi Muhammad SAW sebagai suri
tauladan.
Skripsi dengan judul“Uji Efektivitas Fermentasi Kitin secara Bertahap
dengan IsolatActinomycetesANL-4 danMucor mieheiuntuk Pembuatan Glukosamin”adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang
tulus kepada :
1. Dra. Apita Laila, M.S. selaku Pembimbing Utama yang telah membimbing
penulis dengan sabar, memberikan banyak ilmu pengetahuan, saran, arahan, dan motivasi selama penyusunan skripsi ini.
2. Prof. Dr. John Hendri M.S selaku pembimbing pembantu penulis atas
4. Dr. Suripto Dwi Yuwono, M.T. selaku pembimbing akademik atas
bimbingannya selama ini kepada penulis.
5. Andi Setiawan, Ph. D selaku ketua jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Prof. Dr. Suharso, Ph. D selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Seluruh dosen dan staf administrasi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
8. Bapakku Sunaryo atas kerja kerasnya yang tidak pernah lelah menuruti
mauku hingga saat ini, untuk pengorbanannya yang tidak terhitungkan. Sosoknya mengajarkanku tentang kegigihan dalam menjalani hidup.
Mamakku Marliyah (alm) atas kesediannya menjaga dan merawatku selama
dalam kandungan, mempertaruhkan nyawa saat melahirkanku, serta
waktunya yang selama 20 tahun telah menjagaku. Sosoknya mengajarkanku
arti kesetiaan dan ketegaraan.
9. Adikku Kuriya Irawati dan kakakku Sumardi, serta Mbak Noffa dan Si kecil Difa atasdo’a dan dukungannyaselama ini, untuk suka dukanya yang selalu
tertumpah dalam satu atap.
10. Elianasariatas do’a, saran, dan dukungannya selama masa-masa sulit kuliah
sahabat yang penuh dengan cerita, atasdo’a,dukungan, kebersamaan dan
persahabatannya selama ini. Raffel Stevano sahabat yang penuh dengan kepedulian, atasdo’a,bantuan, kebersamaan dan persahabatannya selama ini. Sukses untuk Kita semua. Jangan pernah lupakan kisah Kita.
12. Mychell Dendiko Pratangga, Ricardo Simarmata, Rizki Amalia, Idrus Sapto Wandiro, Putri Febriani Puspita, atas persahabatan,do’a,dukungan dan
bantuannya selama ini. Maju terus kawan, semangat dan jangan menyerah. 13. Mbak Lisa Eka Wahyuni, S.Si., Mbak Ika Purnama Sari, S.Si., Tante Sari
Handayani, S.Si., Mbak Ipung Miranti Sari, S.Si., Kak Sunardi Sutrisna
S.Si., yang selalu membantu dan memberikan arahan serta motivasi kepada penulis dalam menyelesaikan skripsi ini.
14. Teman-teman Laboraturium Biomasa Terpadu Universitas Lampung : Mbak
Peni S.Si., Mbak Reni S.Si., Kak Eko S.Si., Mbak Diah S.Si., Mbak Tri A.Md, Mas Idam dan Pak Mutaqin atas segala bantuannya terutama pada
saat penulis melakukan analisis penelitian. Mbak Tice S.Si., Mbak Cantik S.Si., Kak Mitra S.Si., Kak Rio, Kak Alex, Kak Septyan, Mbak Nova S.Si., Mbak Adel S.Si., Mbak Tutik S.Si, Mbak Lince S.Si., Kiki, Siti S.Si., Riki,
Raffel, Rizki, Yahya, Indah, Delvi, dan Paman Sumadi, atas segala bantuannya selama penulis melakukan penelitian.
16. Teman-teman kimia 2008 : Adek S.Si., Siti S.Si., Shoffa S.Si., Chandra,
Idrus, Ramdhan S.Si, Rudi, Robby, Ani S.Si., Eli S.Si, Sri S.Si., Putri, Ramli S.Si., Uni Mifta, Albert S.Si., Ria S.Si., Putu S.Si., Dewa, Nita, Ruzki, Majid, Novi, Ayu, Nanda, Eko, Subari, Kiki, Mychell, Nuro, Amin, Ricardo,
Vivi, Retno, Tb, Arif, Raffel, Riki, Leni S.Si., Eni S.Si., Wanti, Evi, Dewi, Diana, Aan, Rheina, Margareth, Eldes, Via, Arif RH, Dwi, Mutiara, dan
Dipa atas kekeluargaannya yang terjalin selama ini.
17. Keluarga Besar Banyuwangi, Bapak H. Heni Sudiman, Ibu Muslimah, Mbak Tuti, Mbak Lilis, Mbak Asri, Mas Muri, Mas Aris, Mas Yanto, Ferlin,
Dedek Faisal, Dinda, dan Ferdi, yang dengan senang hati menerima penulis selama melaksanakan Kuliah Keja Nyata (KKN) selama 40 hari. Terutama Ibu Muslimah yang sudah merawat penulis ketika sakit.
18. Teman-teman KKN Banyuwangi, Hafid, Alvo, Febri, Linda, Prili, dan Lizha atas kesempatan kebersamaan dan kekeluargaannya.
19. Eldes Ariyani Pariaman atas persabatannnya, mari membuat perjalanan yang lebih indah. Endah Pratiwi Gegek dan Redi Suwarno untuk semua
bantuannya. Mbak Nina Anggraini, S.Si., atas motivasinya. Anonim yang
telah menjadi penyelamatku. Mami Eka Eprianti atas nasehatnya.
20. Keluarga Kecilku 3A SMP Negeri 1 Gedong Tataan (2005-2006), terutama
Lia, Lina, Orin, dan Ayu.Its Jovial On.
22. Keluarga besar Kimia 2005, 2006, 2007, 2009, 2011, dan 2012 atas kebersamaan dan persaudaraan yang terjalin selama ini.
23. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara
tulus memberikan bantuan moril dan materil kepada penulis.
Bandar Lampung, 08 November 2012 Penulis