PENGARUH PENAMBAHAN KONSENTRASI INOKULUM DAN MEDIA TERHADAP EFEKTIVITAS FERMENTASI KITIN DENGAN ACTINOMYCETES ANL-4 UNTUK PEMBUATAN GLUKOSAMIN
Oleh Rizki Yuliandari
SKRIPSI
Sebagai salah satu syarat untuk mencapai gelar Sarjana Sains
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
EFFECT OF INOCULUM CONCENTRATION AND MEDIA ON FERMENTATION OF CHITIN USING ACTINOMYCETES ANL-4 FOR
GLUCOSAMINE PRODUCTION
By
Rizki Yuliandari
The main objective of the study is to examine the effect of the volume of fermentation system on the percent of conversion of chitin into glucosamine. This study was carried out to investigate conversion of chitin isolated from shrimp.shells into glucosamine using fermentation process with the aid of Actinomycetes ANL-4. Fermentation was carried out in a mixture of inoculums
and media with the ratio of 1:1, with different volumes of 125, 150, 175, and 200 mL. The results obtained indicated that the volume of the fermentation system affects the conversion quite significantly, in which the larger the volume, the higher the percent of conversion. It is also found that using the volume of 200 mL resulted in 99% conversion, which reflects that this condition is suitable for
ABSTRAK
PENGARUH PENAMBAHAN KONSENTRASI INOKULUM DAN MEDIA TERHADAP EFEKTIVITAS FERMENTASI KITIN DENGAN ACTINOMYCETES ANL-4 UNTUK PEMBUATAN GLUKOSAMIN
Oleh
Rizki Yuliandari
Tujuan utama dalam penelitian ini adalah untuk mempelajari pengaruh volume pada sistem fermentasi berdasarkan persen konversi kitin menjadi glukosamin. Penelitian ini dilakukan untuk mengonversi kitin yang telah diisolasi dari kulit udang menjadi glukosamin menggunakan proses fermentasi dengan bantuan Actinomycetes ANL-4. Proses fermentasi dilakukan dalam campuran inokulum
dan media dengan perbandingan 1:1, dengan volume yang berbeda, yakni 125, 150, 175, dan 200 mL. Hasil penelitian mengindikasikan bahwa volume
inokulum dan media fermentasi mempengaruhi persen konversi secara signifikan, dimana semakin besar volume, semakin tinggi pula persen konversinya.
Berdasarkan hasil yang diperoleh, dengan menggunakan volume 200 mL
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... v
DAFTAR TABEL ... vi
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA A. Udang ... 5
B. Actinomycetes ... 5
C. Enzim ... 8
D. Kitin ... 11
1. Deproteinasi ... 13
2. Demineralisasi ... 13
E. Kitinase ... 14
F. N-asetilglukosamin ... 18
G. Glukosamin ... 19
H. Fermentasi ... 21
I. Fermentasi Fase Cair Sistem Tertutup (Batch) ... 22
1. Proses Fase Cair Sistem Tertutup (Batch) ... 23
2. Keuntungan Fase Cair Sistem Tertutup (Batch) ... 24
3. Aplikasi Fase Cair Sistem Tertutup (Batch) ... 24
J. High Performance Liquid Chromatography (HPLC) ... 25
K. Fourier Transform Infrared (FTIR) ... 28
III. METODE PENELITIAN A. Waktu dan Tempat ... 31
B. Alat dan Bahan ... 31
C. Prosedur Penelitian ... 32
1. Persiapan Sampel ... 32
2. Isolasi Kitin ... 32
2.1.Deproteinasi ... 32
2.2.Demineralisasi ... 33
5. Pertumbuhan Actinomycetes ANL-4 ... 34
6. Pertumbuhan Inokulum ActinomycetesANL-4 ... 35
7. Fermentasi Fase Cair Sistem tertutup (Batch) dengan Actinomycetes ANL-4 ... 35
8. Karakterisasi Glukosamin ... 36
11.1. Analisis dengan HPLC ... 36
11.2. Analisis dengan FTIR ... 37
IV. HASIL DAN PEMBAHASAN A. Isolasi Kitin ... 38
1. Deproteinasi ... 38
2. Demineralisasi ... 40
B. Karakterisasi Kitin dengan FTIR ... 41
C. Variasi Konsentrasi Inokulum dan Media Selama Proses Fermentasi Fase Cair Sistem Tertututp (Batch) Kitin dengan Actinomycetes ANL-4 ...43
D. Karakterisasi Glukosamin dengan FTIR ... 45
E. Karakterisasi Glukosamin dengan HPLC-ELSD ... 46
V. SIMPULAN DAN SARAN A. Simpulan ... 48
B. Saran ... 49
DAFTAR PUSTAKA ... 50
I. PENDAHULUAN
A. Latar Belakang
Udang merupakan salah satu komoditas penting bagi hasil perikanan Indonesia. Pada umumnya udang diekspor dalam bentuk beku yang telah dihilangkan kepala, ekor dan kulitnya. Hasil samping pengolahan udang ini berupa limbah cangkang udang. Limbah ini dengan sedikit perlakuan dapat ditingkatkan nilai
ekonomisnya dengan mengolahnya menjadi kitin, karena kitin dapat diolah menjadi bahan baku untuk pembuatan glukosamin yang lebih menguntungkan.
Kitin ialah suatu polisakarida alami yang memilki banyak kegunaan dalam berbagai bidang misalnya biokimia, enzimologi, obat-obatan, pertanian, pangan gizi, mikrobiologi, tekstil, kosmetik dan lain-lain (Rattanakit et al, 2002). Sifat dari senyawa kitin yang mudah terdegradasi mendorong dilakukannya modifikasi kitin dengan tujuan untuk mengoptimalkan kegunaanya. Salah satu dari senyawa turunan dari kitin yang banyak dikembangkan ialah N-asetilglukosamin dan glukosamin, karena kedua senyawa ini sangat penting dalam bidang farmasi.
tidak larut dalam air, pelarut organik, alkali pekat, asam lemah tetapi larut dalam asam-asam mineral yang pekat dan mempunyai rumus empiris
(C6H9O4.NHCOCH3). Polisakarida ini mempunyai berat molekul tinggi dan merupakan polimer berantai lurus dengan nama lain β
-(1,4)-2-asetamida-2-dioksi-D-glukosa (N-asetil-D-Glukosamin) (Suryanto et al.,2005). Di alam kitin berfungsi sebagai komponen struktural dinding sel fungi maupun eksoskeleton Arthropoda, Nematoda, dan Mollusca .
Kitin dapat dihidrolisis menghasilkan monomernya dengan reaksi enzimatis. Enzim spesifik yang digunakan untuk menghidrolisis kitin adalah enzim kitinase (Howard et al.,2003). Terdapat dua jalur degradasi kitin di alam oleh enzim kitinase. Jalur degradasi kitin yang pertama dimulai dengan hidrolisis ikatan β -(1,4) glikosida oleh enzim endokitinase sehingga terbentuk oligomer kitin. Kemudian oligomer kitin dipecah menjadi dimer N-asetilglukosamin oleh enzim kitobiosidase, hingga dihasilkan monomer asetilglukosamin oleh enzim N-asetilglukosaminidase (kitobiase). Selanjutnya monomer N-asetilglukosamin mengalami deasetilasi menjadi glukosamin oleh enzim N-asetil-glukosamin-deasetilase. Jalur degradasi kitin yang kedua yaitu deasetilasi kitin menjadi kitosan oleh enzim kitin-deasetilase. Kitosan terdegradasi menjadi oligomer kitosan oleh enzim kitosanase. Setelah itu oligomer kitosan akan didegradasi oleh enzim glukosaminidase menghasilkan glukosamin (Dinter et al.,2000).
Actinomycetes ialah salah satu mikroorganisme kitinolitik yang dapat
essensial untuk biokonversi (Xu et al., 1996). Enzim kitinase yang dihasilkan pada proses fermentasi batch menggunakan Actinomycetes ANL-4 mampu menghidrolisis kitin sebanyak 41,98% menghasilkan glukosamin pada penelitian Mugianto (2012). Maka untuk menghasilkan glukosamin yang lebih dari
sebelumnya dilakukanlah variasi pada media dan inokulum yang digunakan.
Dari pemaparan di atas, maka dalam penelitian ini akan dilakukan fermentasi kitin secara enzimatik menggunakan Actinomycetes ANL-4 dengan variasi konsentrasi media dan inokulum untuk menghasilkan produk glukosamin yang lebih banyak dari penelitian yang sebelumnya. Pada tahap pertama kitin difermentasi
menggunakan Actinomycetes ANL-4 untuk menghasilkan glukosamin. Pada tahap selanjutnya yaitu glukosamin sebagai produk akhir akan dikarakterisasi menggunakan High Performance Liqiud Chromatography (HPLC) untuk menganalisis kemurniannya dan Fourier Tranform Infrared (FTIR) untuk menganalisis gugus fungsinya.
B. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Mengisolasi glukosamin dari kitin dengan bantuan enzim kitinase.
2. Menentukan pengaruh penambahan konsentrasi inokulum dan media dengan fermentasi secara batch menggunakan Actinomycetes ANL-4 untuk
pembuatan glukosamin.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang :
1. Potensi Actinomycetes dalam menghasilkan enzim kitinase.
2. Potensi penambahan konsentrasi inokulum dan media dalam menghasilkan glukosamin yang lebih banyak.
3. Potensi glukosamin hasil degradasi kitin dalam bidang farmasi.
II. TINJAUAN PUSTAKA
A. Udang
Udang termasuk hewan kelas Crustacea yang terdiri atas tiga bagian tubuh, yaitu kepala, dada, dan perut (Darmono, 1995). Sebagian besar udang yang dihasilkan, diekspor ke luar negeri dalam bentuk udang beku yang telah dihilangkan kulitnya. Selama ini kulit udang tersebut hanya dimanfaatkan sebagai pakan ternak
mengingat kandungan proteinnya masih cukup tinggi (Elsawati, 1994).
Kulit udang mengandung protein (25% - 40%), kalsium karbonat (45% - 50%), dan kitin (15% - 20%), tetapi besarnya kandungan komponen tersebut tergantung pada jenis udangnya (Foucher et al., 2009). Hal ini menyebabkan limbah kulit udang berpotensi sebagai bahan baku dalam memproduksi kitin. Selain itu, besarnya kandungan protein dan mineral ini dapat menurunkan kualitas dari kitin, sehingga dalam pemurnian kitin komponen tersebut perlu dihilangkan.
B. Actinomycetes
Actinomycetes merupakan organisme tanah yang memiliki sifat-sifat yang umum
dimiliki oleh jamur dan bakteri. Terlihat dari luar seperti jamur (eukoriotik), namun organisme ini sesuai dengan semua kriteria untuk sel prokariotik, yaitu dinding selnya mengandung asam muramat, tidak mempunyai mitokondrin, mengandung riboson 70s, tidak mempunyai pembungkus nukleus, garis tengah selnya berkisar dari 0,5-2,0 µm, dan dapat dimatikan atau dihambat oleh banyak antibiotik bakteri (Volk dan Wheeler, 1993; Rao, 1994).
Actinomycetes tersebar luas di lingkungan dan memegang peranan penting dalam
proses siklus karbon karena kemampuannya tumbuh pada konsentrasi senyawa berkarbon rendah (Rifaat, 2003). Actinomycetes memiliki habitat yang cukup luas antara lain ditemukan pada tanah, kompos, padang rumput, tanah hutan, sedimen, lumpur (Augustine et al., 2006; Lee dan Hwang, 2002; Xu et al., 1996; Badji et al., 2006)); pada daerah perakaran tanaman (Nishimura et al., 2002); atau di
perairan laut (Takizawa et al., 1993). Actinomycetes dapat berkembang biak dengan spora, khlamidospora, tunas, secara fragmentasi dan segmentasi. Cara hidupnya ada yang bersifat saprofit, simbiosis, dan beberapa sebagai parasit. Pada media agar, koloni Actinomycetes dapatdapat dibedakan dari koloni bakteri yang biasanya tumbuh cepat dan berlendir. Koloni Actinomycetes tumbuh lambat, berbubuk yang melekat pada permukaan agar dan penampakannya berbeda dari jamur yang berserabut seperti kapas. Pengamatan di bawah mikroskop
Actinomycetes memiliki dinding sel yang terdiri dari polimer gula, asam amino
dan asam gula seperti dinding sel bakteri Gram positif. Sedangkan dinding sel fungsi terdiri dari selulosa dan kitin. Walaupun Actinomycetes dikatakan sebagai mikroorganisme peralihan antara bakteri dan fungi, tetapi Actinomycetes
mempunyai ciri yang khas yang cukup membatasinya menjadi satu kelompok yang jelas berbeda. Pada medium cair, pertumbuhan Actinomycetes ditandai dengan keruhnya medium dan terbentuk lapisan tipis di permukaan medium (Alexander, 1997).
Actinomycetes menyerupai fungi karena mempunyai hifa bercabang dengan
membentuk miselium. Miselium tumbuh menjulang ke udara, dan memisah dalam fragmen-fragmen yang pendek sehingga terlihat cabang pada bakteri (Sutedjo et.al 1991). Actinomycetes mempunyai kesamaan dengan bakteri yaitu struktur sel dan ukuran irisan melintang (Foth, 1991).
Medium yang baik untuk menumbuhkan Actinomycetes adalah medium yang mengandung glukosa, gliserol atau tepung sebagai sumber karbon; nitrat atau kasein sebagai sumber nitrogen dan mineral-mineral tertentu seperti NaCl,
K2HPO4, MgSO4.7H2O, CaCO3, dan FeSO4.7H2O. Inkubasi biasanya selama 2-7 hari (Jutono, 1995). Populasi Actinomycetes di alam dipengaruhi oleh beberapa factor seperti kandungan organik, pH, kelembapan, temperatur, musim, dan lain-lain (Suwandi, 1989).
Menurut Sutedjo (1991), Actinomycetes dapat membentuk dua tipe miselium, yaitu:
1. Miselium vegetatif
Miselium vegetatif merupakan miselium yang tumbuh di atas medium. Pada beberapa spesies miselium vegetatif berbentuk lurus dan panjang, sedang pada spesies lain berbentuk pendek, bercabang, atau bengkok. Diameter miselium vegetatif antara 0,2-0,8 mikron. Miselium vegetatif juga dapat membentuk pigmen.
2. Miselium udara (aerial)
Miselium udara (aerial) merupakan miselium yang tumbuh pada permukaan medium dan terbentuk konidia. Banyak Actinomycetes khususnya yang termasuk dalam Streptomyces dapat membentuk miselium udara. Miselium udara
berbentuk pendek dan lurus, atau berulir–ulir (spiral) dan bercabang, dapat membentuk sporofora yang lurus, serta beberapa hifa udara bersifat steril.
Actinomycetes ialah salah satu mikroorganisme kitinolitik yang dapat
menghasilkan enzim kitinase. Enzim ini dapat menghidrolisis kitin menghasilkan monomernya dengan reaksi enzimatis. Penelitian Anggraini (2010) menguji isolat Actinomycetes yang memiliki indeks kitinolitik terbesar dari beberapa isolat
Actinomycetes yang lain (Tabel 1) ialah Actinomycetes ANL-4, ini ditentukan
berdasarkan rasio diameter zona bening yang dihasilkan terhadap diameter koloni. Berikut ini indeks kitinolitik isolat Actinomycetes yang memiliki aktivitas
kitinolitik :
Tabel 1. Indeks kitinolitik Actinomycetes yang diisolasi dari Lumpur Hutan Bakau asal Pantai Ringgung Perairan Teluk Lampung
Kode Isolat
Diameter Zona Bening (cm)
Diameter Koloni (cm)
Indeks Kitinolitik
ANL-12 2,3 1,2 1,9
ANL-9 1,0 0,5 2,0
ANLd-2b-3 0,7 0,3 2,3
ANL-4 0,5 0,1 5,0
C. Enzim
nutrien, reaksi yang menyimpan dan mengubah energi kimiawi, dan yang membuat makromolekul sel dari prekursor sederhana. Diantara sejumlah enzim yang berpartisipasi didalam metabolisme, terdapat sekelompok khusus yang dikenal sebagai enzim pengatur, yang dapat mengenali berbagai isyarat metabolik dan mengubah kecepatan katalitiknya sesuai dengan isyarat yang diterima.
Melalui aktivitasnya, sistem enzim terkoordinasi dengan baik, menghasilkan suatu hubungan yang harmonis di antara sejumlah aktivitas metabolik yang berbeda, yang diperlukan untuk menunjang kehidupan (Lehninger, 1982). Enzim akan terdenaturasi pada suhu tinggi dan kondisi ekstrim lainnya seperti tinggi rendahnya pH atau tekanan, (Suhartono, 1989).
Enzim berperan sebagai biokatalisator dalam proses biokimia, baik yang terjadi di dalam sel maupun di luar sel (Poedjiadi, 1994). Lehninger (1982) menambahkan bahwa enzim adalah katalisator sejati. Molekul ini meningkatkan dengan nyata kecepatan reaksi kimia spesifik yang tanpa enzim akan berlangsung amat lambat. Enzim tak dapat mengubah kesetimbangan reaksi yang dikatalisisnya; enzim juga tak akan habis dipakai atau diubah secara permanen oleh reaksi-reaksi ini. Menurut Manitto (1981), bahwa tiga sifat utama dari biokatalisator yaitu : dapat menaikkan kecepatan reaksi, memiliki kekhususan dalam reagen dan produk, dapat mengontrol kinetika reaksi.
Fungsi terpenting dari enzim adalah kemampuannya menurunkan energi aktivasi suatu reaksi kimia. Kemampuan enzim mendegradasi substrat dipengaruhi oleh beberapa faktor, antara lain konsentrasi enzim, konsentrasi substrat, pH, serta suhu (Lehninger, 1982).
Protein adalah bagian utama enzim yang dihasilkan sel, maka semua yang dapat mempengaruhi protein dan sel akan berpengaruh terhadap reaksi enzimatik. Beberapa faktor penting yang mempengaruhi aktivitas enzim antara lain :
a) Substrat (reaktan)
Pada konsentrasi substrat rendah, kecepatan reaksi yang terjadi rendah. Kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi substrat. Akan tetapi setelah peningkatan substrat lebih lanjut akan tercapai suatu laju maksimum. Pada keadaan substrat yang berlebih akan terjadi kejenuhan pembentukan kompleks enzim substrat sehingga sebagian besar substrat tidak diubah menjadi produk. Penambahan substrat lebih lanjut tidak berakibat terhadap laju reaksi.
b) Suhu
Seperti reaksi kimia pada umumnya, maka reaksi enzimatik dipengaruhi oleh suhu. Jika suhu meningkat, maka laju reaksi juga akan meningkat. Karena enzim adalah protein, maka semakin tinggi suhu mengakibatkan proses enzim tidak aktif meningkat. Umumnya enzim mengalami kerusakan (denaturasi) pada suhu di atas 50oC.
c) Derajat keasaman ( pH )
terlalu rendah atau terlalu tinggi akan mengakibatkan denaturasi dari protein enzim.
d) Penghambat enzim (inhibitor)
Inhibitor dapat meminimalkan kerja enzim karena akan membentuk ikatan dengan sisi aktif enzim sehingga mengganggu proses pembentukan dan kestabilan ikatan kompleks enzim substrat. Ada beberapa cara penghambatan enzim, seperti penghambat secara bersaing (kompetitif), penghambat tidak bersaing (non– kompetitif ), penghambat umpan balik (feed back inhibitor), dan penghambat alosterik (Lehninger, 1982).
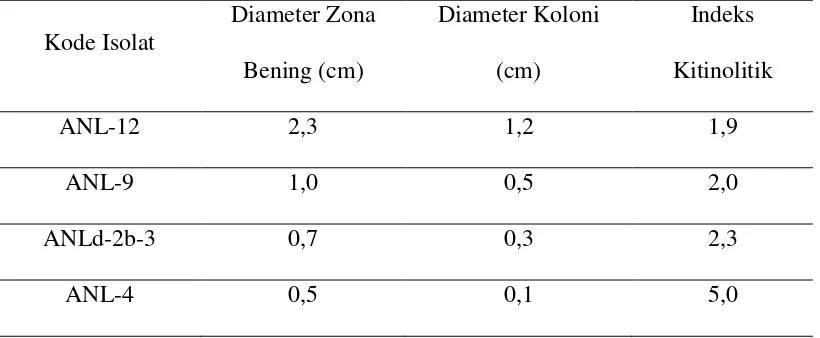
D. Kitin
Kitin merupakan senyawa biopolimer berantai panjang dan tidak bercabang. Tiap rantai polimer terdiri dari 2000 hingga 5000 unit monomer yang terpaut melalui ikatan β-1,4 glikosida. Unit monomer kitin mempunyai rumus molekul C18H12O5
dengan kadar C, H, N, O berturut-turut 47%, 6%, 7% dan 40% (Bastaman, 1989). Kitin mempunyai rumus empiris (C6H9O4.NHCOCH3)n dan merupakan zat padat yang tidak larut dalam air, pelarut organik, alkali pekat, asam mineral lemah tetapi larut dalam asam-asam mineral yang pekat. Polisakarida ini mempunyai berat molekul tinggi dan merupakan polimer berantai lurus dengan nama lain β
-(1,4)-2-asetamida-2-dioksi-D-glukosa (N-asetil-D-Glukosamin) (Suryanto et al., 2005).
Struktur kitin sama dengan selulosa, yaitu ikatan yang terjadi antara monomernya terangkai dengan glukosida pada posisi β-1,4. Perbedaannya dengan selulosa
digantikan dengan gugus asetamina (- COCH3), sehingga kitin dapat menjadi polimer berunit N-Asetil glukosamin.
Gambar 1. Struktur kitin (Murray et al., 2003)
Menurut Stephen (1995), kitin merupakan padatan amorf berwarna putih, dapat terurai secara hayati (biodegradable), terutama oleh bakteri penghasil enzim lisozim dan kitinase. Sifat kitin yang dapat terdegradasi secara ilmiah
menunjukkan bahwa kitin bersifat ramah lingkungan, dapat didaur ulang menjadi sumber nitrogen dan karbon, dan juga dalam produksinya sangat berguna sebagai pereaksi bahan kimia (Gooday et al. 1992).
Kitin merupakan homopolimer dari β-1,4 N-asetil-D-glukosamin dan merupakan polimer kedua terbanyak di alam setelah selulosa. Senyawa ini dapat ditemukan pada cangkang udang, kepiting, moluska, seranggga, annelida, dan beberapa dinding sel jamur dan alga. Kitin dapat dihidrolisis secara enzimatis oleh enzim kitinase menghasilkan monomer β-1,4-N-asetil-D-glukosamin (Yurnaliza, 2002).
yang berdekatan. Ikatan hidrogen menyebabkan kitin tidak dapat larut dalam air dan membentuk formasi serabut (fibril) (Cabib, (1987).
Adapun proses isolasi kitin dari kulit udang meliputi dua tahap, yaitu deproteinasi dan demineralisasi.
1. Deproteinasi
Deproteinasi merupakan proses pemisahan protein yang ada pada kulit udang dari kitin. Proses ini dapat dilakukan dengan dua metode, yaitu secara kimia misalnya menggunakan NaOH atau KOH dan secara enzimatik menggunakan enzim proteolitik. Namun, deproteinasi menggunakan natrium hidroksida lebih sering digunakan, karena lebih mudah dan efektif (Austin et al., 1981). Pada pemisahan protein menggunakan NaOH, protein diekstraksi sebagai Na-proteinat yang larut, dan jika menggunakan KOH akan diperoleh K-proteinat yang mengendap (Knorr, 1984), sedangkan enzim proteolitik akan mendegradasi protein sehingga terpisah dari kitin (Muzzarelli, 1984).
2. Demineralisasi
Demineralisasi merupakan proses pemisahan mineral atau senyawa anorganik yang ada pada kulit udang dari kitin. Mineral utama yang terkandung dalam kulit udang adalah kalsium karbonat (CaCO3) dan kalsium fosfat (Ca3(PO4)2). Proses demineralisasi ini biasanya dilakukan dengan merendam bahan hasil deproteinasi dalam larutan asam klorida.
mengalami depolimerisasi. Hal ini yang menjadi alasan mengapa terkadang digunakan EDTA dalam proses demineralisasi. Hanya saja, EDTA tidak dapat mengeliminasi garam anorganik secara lengkap (Shimahara and Takiguci,1988).
E. Kitinase
Kitinase merupakan glikosil hidrolase yang mengkatalisis degradasi kitin yaitu senyawa polimer dari N-asetilglukosamin yang membentuk ikatan linier β-1,4. Enzim ini ditemukan dalam berbagai organisme, termasuk organisme yang tidak mengandung kitin dan mempunyai peran penting dalam fisiologi dan ekologi. Berdasarkan kesamaan urutan asam amino, kitinase diklasifikasikan dalam famili 18 dan 19 glikosida hidrolase (Tomokazu et al, 2004). Kitinase merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau
monomer N-asetilglukosamin. Enzim ini dihasilkan oleh bakteri, fungi, tanaman, dan hewan. Salah satu mikroorganisme penghasil enzim kitinase ini ialah
Actinomycetes. Harman et al., (1993) dan Sahai et al., (1993) membagi kitinase
dalam tiga tipe yaitu :
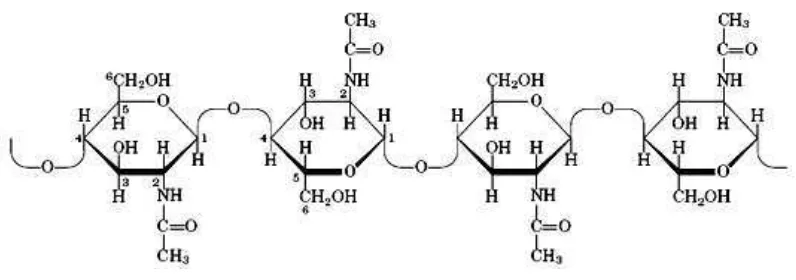
1. Endokitinase (EC 3.2.1.14) yaitu kitinase yang memotong secara acak ikatan β-1,4 bagian internal mikrofibril kitin. Produk akhir yang terbentuk bersifat
Gambar 2. Reaksi pemutusan ikatan β-1,4 pada bagian internal mikrofibril kitin
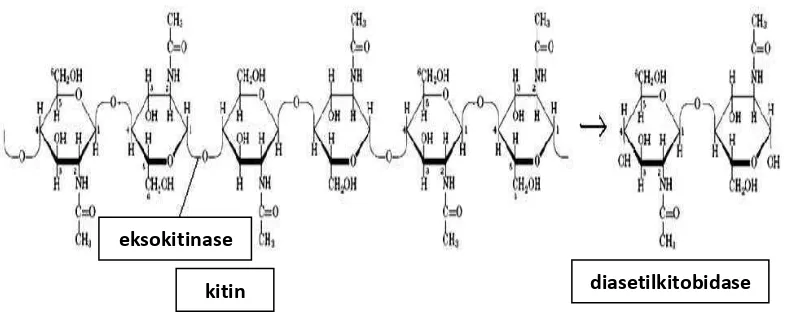
2. Eksokitinase (EC 3.2.1.14) dinamakan juga kitobiodase atau kitin 1,4-β -kitobiodase, yaitu enzim yang mengatalisis secara aktif pembebasan unit-unit diasetilkitobiose tanpa ada unit-unit monosakarida atau polisakarida yang dibentuk. Pemotongan hanya terjadi pada ujung non reduksi mikrofibril kitin dan tidak secara acak.
Gambar 3. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase
kitin endokitinase kitotetrase
kitin diasetilkitobidase
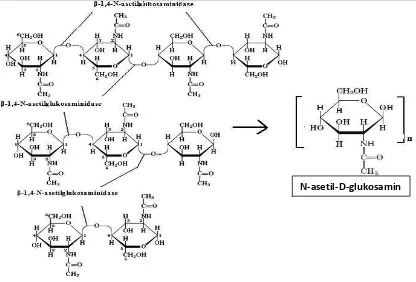
3. β-1,4-N-asetilglukosaminidase (EC 3.2.1.30) merupakan suatu kitinase yang bekerja pada pemutusan diasetilkitobiose, kitotriose dan kitotetraose dengan menghasilkan monomer-monomer N-asetilglukosamin.
Gambar 4. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose dan menghasilkan monomer-monomer N-asetilglukosamin.
Kitinase berguna dalam produksi kitooligosakarida. Kitooligosakarida berperan sebagai pertahanan tanaman, juga digunakan dalam kesehatan manusia. Sebagai contoh, kitoheksosa dan kitoheptosa memperlihatkan aktivitas anti tumor. N-asetilglukosamin berguna sebagai obat anti inflamasi. Senyawa ini dalam tubuh manusia disintesis dari glukosa dan digabungkan dengan glikoprotein dan glikosaminoglikan (Patil et al., (2000). Kitinase juga berperan dalam produksi protein sel tunggal dari limbah kitin untuk makanan hewan (Shaikh et al., 1993).
Kitinase juga dapat digunakan dalam pertanian sebagai pengendalian jamur
patogen tanaman dan hama serangga. Kombinasi σ-toksin dan kitinase dilaporkan lebih efektif dalam membunuh hama serangga (Patil et al., (2000).
Berdasarkan homologi sekuen asam aminonya, kitinase dibedakan atas famili 18 dan 19. Famili 18 meliputi kitinase dari bakteri, fungi, serangga, tanaman (kelas III dan V), hewan (Gijzen et al., 2001) dan satu kitinase dari Streptomyces griseus (Ohno et al., 1996). Kitinase tanaman kelas I tersusun atas sekuen yang
conserved pada struktur utamanya, serta domain kaya sistein pada ujung N.
Kitinase kelas II secara struktural homolog dengan kelas I, tetapi tidak memiliki domain kaya sistein. Sementara, kitinase kelas III dan V tidak memiliki homologi dengan kitinase kelas I, II dan IV (Fukamizo, 2000).
Pengukuran aktivitas kitinase dalam memecah kitin dapat dilakukan dengan beberapa cara seperti yang disebutkan dalam Cabib (1987) yaitu :
a). Berdasarkan pengurangan substrat
1. Metode viskosimetri yaitu aktivitas kitinase terhadap kitosan, glikol kitin atau karboksimetil kitin yang ditunjukkan oleh terjadinya pengurangan viskositas substrat.
endokitinase didefinisikan sebagai jumlah enzim yang dibutuhkan untuk mereduksi turbiditas suspensi kitin 5 %.
b).Berdasarkan pembentukan produk akhir yaitu N-asetilglukosamin. N-asetilglukosamin yang dibebaskan dari kitin ditentukan secara kolometrik dengan penambahan p-dimetilaminobenzaldehida. Satu unit aktivitas kitinase dinyatakan sebagai µmol N-asetilglukosamin yang dibebaskan selama 1 jam dalam kondisi yang ditetapkan.
c).Pengujian spektrofotometri yaitu menggunakan kromogen 3,4-dinitrophenil-tetra- N-asetilkitotetraose sebagai substrat.
d). Pengujian sensitifitas kitinase menggunakan radiometri yaitu substrat diberi label 14C atau 3H. Kadar produk diuji dengan radioaktifitasnya setelah
penghilangan kitin yang belum dipecah dengan penyaringan atau dengan cara disentrifugasi.
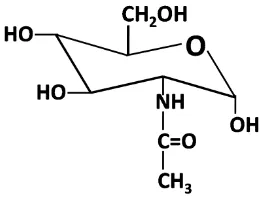
F. N-asetilglukosamin
Gambar 5. Struktur N-asetilglukosamin
N-asetilglukosamin (C6H13NO5) merupakan gula amino dan di negara maju telah diproduksi secara komersial mengingat manfaatnya di berbagai industri, seperti bidang kesehatan, farmasi, biokimia, bioteknologi, kosmetika, biomedika, pangan, tekstil, kertas, dan lain-lain. Pemanfaatan tersebut didasarkan atas sifat-sifatnya yang dapat digunakan sebagai pengemulsi, koagulasi, pengkhelat, dan penebal emulsi. Berbeda dengan kitin, N-asetilglukosamin bersifat mudah larut dalam air, sedikit larut dalam metanol yang dipanaskan dan tidak larut dalam dietileter. N-asetilglukosamin sering ditemukan sebagai komponen utama pada rangka luar Crustacea, Arthropoda, dan cendawan (Horton, 1980).
G. Glukosamin
yang sangat penting untuk kesehatan dan kelenturan sendi (EFSA 2009).
Glukosamin merupakan senyawa alami yang terdapat dalam tubuh manusia yang terdiri dari glukosa dan asam amino glutamin, selain itu glukosamin adalah unsur pokok dari GAG pada tulang rawan kartilago dan cairan sinovial. Fungsi
glukosamin dalam tubuh adalah untuk memproduksi cairan sinovial yang berfungsi sebagai pelumas pada tulang rawan, sehingga pergerakan tulang menjadi baik. Kekurangan cairan sinovial dalam tubuh akan menyebabkan terjadinya gangguan sendi, seperti gerakan sendi yang kaku sehingga akan berakibat terkena penyakit osteoarthritis (OA). Oleh karena itu, pemberian glukosamin sulfat secara oral dapat membantu produksi cairan sinovial sehingga dapat mencegah serta mengobati penyakit osteoarthritis (OA) (Williams, 2004). Glukosamin (C6H13NO5) merupakan gula amino dan prekursor penting dalam sintesis biokimia dari protein glikosilasi dan lipid. Glukosamin ditemukan
sebagai komponen utama dari rangka luar Crustacea, Arthropoda, dan cendawan. Glukosamin merupakan salah satu monosakarida yang banyak dijumpai. Dalam industri, glukosamin diproduksi dengan cara hidrolisis rangka luar Crustacea.
Gambar 6. Struktur D-glukosamin
Molusca, Coelenterata, dan Nematoda serta beberapa kelas serangga dan jamur.
Golongan hewan dan jamur tersebut tersusun atas kitin, dimana kitin merupakan prekusor kitosan, dan kitosan sendiri merupakan polimer dari glukosamin (D-glukosamin). Glukosamin dapat berfungsi sebagai pengemulsi, koagulasi, pengkhelat dan penebal emulsi (Anonim, 2007).
H. Fermentasi
Fermentasi merupakan reaksi oksidasi reduksi yang menggunakan sumber energi dan sumber karbon, nitrogen dan pospor untuk membentuk senyawa yang
mempunyai nilai ekonomi lebih tinggi serta terakumulasi dalam medium. Proses fermentasi disebabkan oleh organisme atau hasil metabolisme (Rao, 2009). Produk yang dapat dihasilkan dari proses fermentasi ialah enzim, sel
mikroorganisme, metabolit primer, metabolit sekunder, dan senyawa hasil proses biokonversi (Rahman, 1989).
Menurut Pujaningsih (2005) faktor-faktor yang mempengaruhi pemilihan substrat fermentasi, adalah :
a) Kontinyuitas ketersediaan, yaitu tersedia substrat sepanjang tahun sehingga dapat disimpan dalam beberapa bulan, mutu dan komposisi relatif tetap. b) Sifat fermentasi substrat harus dapat difermentasikan, contoh pada
Tichoderma viridae yang hanya tumbuh baik pada substrat selulosa (jerami
padi), tetapi tidak dapat tumbuh pada bungkil kelapa.
I. Fermentasi Fase cair Sistem Tertutup (Batch)
Fermentasi merupakan proses dimana komponen-komponen kimiawi dihasilkan sebagai akibat adanya pertumbuhan maupun metabolisme mikroba yang
mencakup proses aerob dan anaerob. Fermentasi dapat meningkatkan nilai gizi bahan yang berkualitas rendah sehingga berfungsi dalam pengawetan bahan dan merupakan suatu cara untuk menghilangkan zat antinutrisi atau racun yang terkandung dalam suatu bahan makanan. Fermentasi dapat dilakukan dengan metode kultur permukaan dan kultur terendam (submerged). Medium kultur permukaan dapat berupa medium padat maupun medium cair. Sedangkan kultur terendam dilakukan dalam media cair menggunakan bioreaktor yang dapat berupa labu yang diberi aerasi, labu yang digoyang dengan shaker atau fermentor.
Kondisi yang optimum untuk fermentasi tergantung pada jenis mikroorganisme yang digunakan. Pengendalian faktor-faktor fermentasi bertujuan untuk
menciptakan kondisi yang optimum bagi pertumbuhan dan produksi metabolit yang diinginkan dari suatu mikroorganisme tertentu. Fermentasi medium cair lebih memungkinkan adanya pengendalian faktor-faktor fisik dan kimia yang mempengaruhi proses fermentasi seperti suhu, pH, dan kebutuhan oksigen (Ton et al.,2001).
Fermentasi medium cair dapat dilakukan dengan dua cara, yaitu fermentasi tertutup (batch culture) dan fermentasi kontinyu (fed batch). Pada fermentasi tertutup, setelah inokulasi tidak dilakukan lagi penambahan medium kedalam fermentor, kecuali pemberian oksigen (udara steril), antibuih dan asam atau basa
waktu fermentasi, laju pertumbuhan spesifik mikroorganisme semakin menurun sampai akhirnya pertumbuhan terhenti. Penurunan dan berhentinya pertumbuhan disebabkan karena dengan semakin bertambahnya waktu fermentasi nutrien-nutrien esensial dalam medium semakin berkurang atau terjadi akumulasi
autotoksin yang mempengaruhi laju pertumbuhan atau kombinasi dari keduanya. Dengan demikian pada fermentasi tertutup jumlah sel pada fase stationer
merupakan jumlah sel maksimum.
1. Proses Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Mitchel et al., (2006) tahapan–tahapan proses secara umum, antara lain : 1. Persiapan substrat, dimana substrat harus dipotong, digiling, dipecahkan, atau
dibuat menjadi butiran kecil. Dengan penambahan air dan nutrisi disebut dengan pra-perawatan substrat untuk menambah ketersediaan gizi. 2. Persiapan inokulum, tipe dan persiapan inokulum tergantung pada
mikroorganisme yang digunakan. Banyak proses fermentasi batch
melibatkan bakteri, jamur dan salah satunya Actinomycetes maka digunakan spora hasil inokulasi. Tujuan dari langkah ini untuk mengembangkan sebuah inokulum dengan tingkat kelangsungan hidup mikoorganisme yang tinggi.
3. Persiapan wadah, dimana wadah harus dibersihkan setelah fermentasi sebelumnya dan perlu disterilkan sebelum penambahan substrat. 4. Inokulasi dan pengerjaan, pengerjaan tahapan ini dengan menyebarkan
5. Proses fermentasi batch, pada proses ini banyak hal yang harus diperhatikan antara lain pH medium, suhu, dan waktu inkubasi.
6. Kultivasi, pada tahapan ini memerlukan bantuan mekanis untuk memisahkan substrat padat dari medium. Penggunaan kertas saring dan sentrifugasi dapat dipakai untuk memisahkan substrat.
2. Keuntungan Fermentasi Fase Cair Sistem Tertutup (Batch)
Dibandingkan dengan medium padat, medium cair memiliki beberapa kelebihan, yaitu (Weites et al.,2001):
1. Jenis dan konsentrasi komponen-komponen dapat diatur sesuai dengan yang diinginkan.
2. Dapat memberikan kondisi yang optimum untuk pertumbuhan. 3. Pemakaian medium lebih efisien.
3. Aplikasi Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Holker et al. (2004) dan Pandey (2000) dapat menguraikan aplikasi dari fermentasi batch secara tradisional, antara lain :
a). Bir, minuman beralkohol. Sari buah yang diberi Saccaromyces cereviciae kemudian diinkubasikan didapatkan minuman beralkohol.
b). Yoghurt,diproduksi dengan cara memfermentasikan air susu dengan bakteri bukan khamir. Biasanya menggunakan campuran Lactobacillus bulgaricus dan Streptococcus thermophillus. Bakteri mengubah laktosa (gula susu) pada kondisi anaerobik. Laktosa diubah menjadi asam laktat yang bersifat
c). Keju, berbagai jenis bakteri dapat digunakan untuk fermentasi susu menjadi keju, tergantung dari jenis keju yang dihasilkan. Biasanya digunakan spesies Streptococcus thermophillus dan Lactobacillus bulgaricus. Enzim yang
diperlukan untuk menghasilkan keju adalah rennet yang mengandung cymosin yang bersifat menggumpalkan casein.
Selain aplikasi di atas, kebanyakan dari aplikasi tersebut menghasilkan produk-produk seperti enzim, pigmen, senyawa aromatik, senyawa kimia, antibiotik, dan agen pengontrol biologis serta banyak aplikasi penggunaan mikroorganisme dalam fermentasi batch sebagai bagian dari proses perantara, yaitu pewarnaan zat warna, biobleaching, biopulping, dan bioremediation.
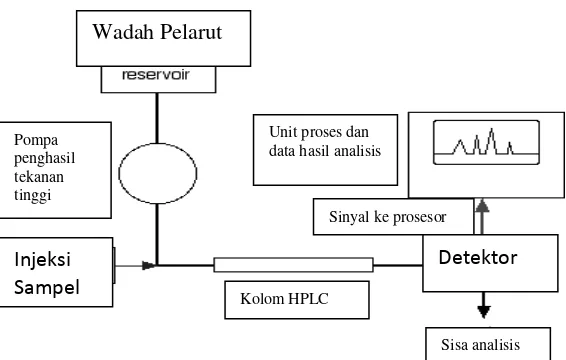
J. High Performance Liquid Chromatography (HPLC)
Prinsip pemisahan senyawa menggunakan HPLC adalah perbedaan distribusi komponen diantara fasa diam dan fasa geraknya. Semakin lama terdistribusi dalam fasa diam semakin lama waktu retensinya (Clark, 2007).
Gambar 7. Diagram Alir HPLC
Ada beberapa cara untuk mendeteksi substansi yang telah melewati kolom HPLC. Metode yang dipakai untuk menganalisis N-asetilglukosamin adalah penggunaan evaporasi detektor hamburan cahaya (ELSD) (Mulja and Suharman, 1995). N-asetilglukosamin tidak dapat dianalisis dengan detektor UV secara langsung. N-asetilglukosamin memiliki serapan sinar UV pada panjang gelombang dibawah 205 nm, yang hampir sama dengan serapan pelarut polar seperti air dan metanol.
Cara yang praktis dan efisien untuk menganalisis N-asetilglukosamin adalah dengan HPLC yang dilengkapi ELSD (Detektor Evaporasi Hamburan Cahaya). Detektor evaporasi hamburan cahaya ideal untuk mendeteksi analit tanpa gugus kromofor UV, karena analisis tidak bergantung pada sifat optik dari suatu
Pompa penghasil tekanan tinggi
Unit proses dan data hasil analisis
Sisa analisis Kolom HPLC
Sinyal ke prosesor Wadah Pelarut
Injeksi Sampel
senyawa. Prinsip kerja dari detektor evaporasi hamburan cahaya adalah sampel yang berasal dari HPLC dalam bentuk cair mengalami nebulisasi menjadi bentuk aerosolnya. Kemudian pelarut yang digunakan akan mengalami evaporasi
(penguapan) sehingga terpisah dari sampel. Sampel yang telah terpisah ditembaki dengan sinar pada semua panjang gelombang (LS), kemudian jumlah cahaya yang dipantulkan kembali akan memberikan sinyal untuk detektor. Sinyal yang
terdeteksi akan memberikan data output berupa kromatogram. Adapun keunggulan dari ELSD yaitu:
1. Sensitivitas tinggi memberikan respon yang luar biasa untuk semua senyawa, sampai ke tingkat nanogram rendah.
2. Operasi Sub-ambien menggunakan tabung penguapan berpendingin Peltier memberikan suhu rendah sampai 10°C, mencegah degradasi dari senyawa labil panas yang tidak terdeteksi oleh ELSD lain.
3. Real-time kontrol selama injeksi melalui Software dimensi yang diprogram untuk mempertahankan sensitivitas maksimum pada pengoperasian alat. 4. Real-time pemrograman gas yang menghilangkan efek peningkatan pelarut
selama elusi gradien, sangat baik untuk analisis kation.
5. Dispersi rendah dan kecepatan data output-tingkat tinggi adalah pasangan yang cocok untuk aplikasi LC Cepat.
6. Reprodusibilitas super di bawah 2% memberikan hasil yang dapat diandalkan dan akurat.
Kondisi HPLC untuk identifikasi N-asetilglukosamin menggunakan kolom C18 yang bersifat nonpolar, fasa gerak adalah asetonitril/H2O/H3PO4 (10/90/0,1) yang merupakan campuran pelarut polar, laju alir 1,5 mL/menit, dan waktu run 20 menit. Pada proses elusi, digunakan metode isokratik, yaitu eluennya
menggunakan perbandingan komponen yang tetap dari awal sampai dengan akhir pemeriksaan (Gritter et al., 1991).
K. Fourier Transform Infrared (FTIR)
Pada dasarnya Spektrofotometer FTIR adalah sama dengan Spektrofotometer Infra Red dispersi, perbedaannya adalah pengembangan pada sistem optiknya
sebelum berkas sinar infra merah melewati contoh. Dasar pemikiran dari
Spektrofotometer FTIR adalah dari persamaan gelombang yang dirumuskan oleh Jean Baptiste Joseph Fourier (1768-1830) seorang ahli matematika dari Perancis. Dari deret Fourier tersebut intensitas gelombang dapat digambarkan sebagai daerah waktu atau daerah frekwensi. Perubahan gambaran intensitas gelombang radiasi elektromagnetik dari daerah waktu ke daerah frekwensi atau sebaliknya disebut Transformasi Fourier (Fourier Transform). Selanjutnya pada sistem optik peralatan instrumen Fourier Transform Infra Red dipakai dasar daerah waktu yang non dispersif. Secara keseluruhan, analisis menggunakan spektrofotometer ini memiliki dua kelebihan utama dibandingkan Spektrofotometer Infra Red dispersi yaitu :
2. Sensitifitas dari metoda Spektrofotometri FTIR lebih besar daripada cara dispersi, sebab radiasi yang masuk ke sistem detektor lebih banyak karena tanpa harus melalui celah (Hsu, 1994).
Spektroskopi FTIR merupakan metode yang dapat digunakan untuk
mengidentifikasi gugus fungsi yang terdapat dalam senyawa organik, gugus fungsi ini dapat ditentukan berdasarkan ikatan dari tiap atom. Prinsip kerja dari metode ini adalah sinar yang terserap menyebabkan molekul dari senyawa tervibrasi dan energi vibrasi diukur oleh detektor serta energi vibrasi dari gugus fungsi tertentu akan menghasilkan frekuensi yang spesifik. Alat ini mempunyai kemampuan lebih sensitif dibanding dengan alat dispersi dan dapat digunakan pada daerah yang sangat sulit atau tidak mungkin dianalisis dengan alat dispersi. Radiasi infra merah mempunyai spektrum elektromagnetik pada bilangan
gelombang 13000-10 cm -1 atau panjang gelombang dari 0,78-1000 µm.
Penggunaan spektrum infra merah untuk menentukan gugus fungsi suatu struktur senyawa organik biasanya antara 4000-400 cm -1 (2,5 sampai 25 µm). Daerah di bawah frekuensi 400 cm-1 (25 µm) disebut daerah infra merah jauh, dan daerah di atas 4000 cm -1 (2,5 µm) disebut daerah inframerah dekat (Silverstein et al., 1986).
Sebagai contoh senyawa kitin memberikan data serapan IR : ν = 3448,5 cm-1 yang menunjukan vibrasi ulur NH amida (NH amina) dan OH; ν = 2920-2873,7 cm-1 yang menunjukan vibrasi ulur CH, CH2, dan CH3; ν = 1450,4 cm-1 yang
III. METODELOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini telah dilaksanakan dari bulan Maret 2013 sampai dengan bulan Agustus 2013, dengan tahapan kegiatan, yaitu: pengambilan sampel limbah kulit udang di Tambak udang Bratasena, Lampung Timur, pembuatan serta
karakterisasi kitin dan glukosamin dilakukan di Laboratorium Biomasa Terpadu, Universitas Lampung.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini adalah peralatan gelas, shaker, Heating Magnetic Strirer, pH meter, mikropipet, Laminar air flow, Inkubator
Memmer-Germany/INCO2, centrifuge Hitachi/ CF 16 RX II, digital waterbath Wiggen Houser, autoclave, Freze dry Scanvac Coolsafe, Frezeer, neraca digital Wiggen Houser, thermometer, mortar, oven, FTIR (Foureer Transform Infrared) Varian 2000 Scimiter series, Shaker Incubator, dan Penangas air.
KH2PO4, CaCI2, NaOH, HCI, kertas saring, indikator universal, Actinomycetes ANL-4, asetonitril, akuades, dan cangkang kulit udang.
C. Prosedur Penelitian
1. Persiapan Sampel
Cangkang kulit udang dibersihkan, direbus dan dikeringkan, kemudian dihaluskan menggunakan blender kering hingga ukuran 10-40 mesh yang selanjutnya disebut sampel.
2. Isolasi Kitin
Proses Isolasi kitin terdiri atas tiga tahap, yaitu: deproteinasi yang merupakan proses pemisahan protein dari sampel, demineralisasi yang merupakan proses pemisahan mineral, dan depigmentasi yang merupakan tahap pemutihan kitin. Depigmentasi ini bertujuan untuk menghilangkan zat warna (pigmen) yang terdapat pada sampel dari kitin. Karena kitin yang dihasilkan tidak untuk dikomersialkan maka tidak dilakukan tahap depigmentasi.
a. Deproteinasi
dengan akuades hingga pH netral yang diukur dengan indikator universal. Kemudian residu dikeringkan dalam oven dengan suhu 60oC selama 24 jam.
b. Demineralisasi
Kitin kasar hasil deproteinasi dimasukkan dalam bejana tahan asam dan tahan basa yang dilengkapi dengan pengaduk, termometer dan diletakkan dalam penangas air. Kemudian sempel ditambahkan HCI 1,25 N dengan perbandingan 1:10 (w/v) selama 1 jam pada suhu 90oC (Pareira, 2004). Setelah itu, dilakukan penyaringan sehingga diperoleh residu dan filtrat. Terjadinya pemisahan mineral ditunjukkan dengan terbentuknya gas CO2 yang berupa gelembung-gelembung udara pada saat larutan HCI ditambah kedalam sampel. Filtrat diuji dengan (NH4)2C2O4 untuk membuktikan bahwa mineral kalsium berhasil dipisahkan dari kitin melalui demineralisasi. Ion oksalat akan membentuk endapan putih dengan kalsium. Residunya dicuci dengan akuades sampai pH netral yang diukur dengan indikator universal. Kemudian residu dikeringkan dalam oven pada suhu 60oC selama 24 jam, sehingga diperoleh kitin kering.
D. Karakterisasi kitin dengan FTIR
E. Pembuatan Media
a. Media ISP-2
Media ISP-2 terdiri dari 4 g yeast exstract, 10 g malt exstract, 4 g dektrosa, dan 20 g agar dilarutkan dalam 1 L air laut steril kemudian disterilkan dengan autoclave pada suhu 121oC dan tekanan 2 atm. Setelah media sedikit dingin, ditambahkan cycloheximide (25 µg/mL) dan nalidixix acid (25 µg/ mL). Cycloheximide dan nalidixic acid ditambahkan untuk menghindari kontaminasi jamur dan bakteri (Margavey et al., 2004).
b. Larutan Mineral Garam Actinomycetes ANL-4
Larutan ini terdiri atas 0,4% (NH4)2SO4, 0,6% NaCl, 0,1% K2HPO4, 0,01%CaCI, dan 1% kitin. Larutan diseterilkan dengan autoclave selam 20 menit pada suhu 121oC dan tekanan 2 atm.
F. Peremajaan Actinomycetes ANL-4
G. Pertumbuhan Inokulum Actinomycetes ANL-4
Spora kultur 7-9 hari dipisahkan dan diinokulasi pada tabung erlenmayer 250 mL berisi 100 mL larutan mineral garam. Tabung diletakkan pada shaker dengan kecepatan 175 rpm pada suhu 30oC selama 7 hari.
H. Variasi Konsentrasi Inokulum dan Media Selama Proses Fermentasi Fase Cair Sistem Tertututp (Batch) Kitin dengan Actinomycetes ANL-4
Fermentasi batch dilakukan dengan menggunakan shaker incubator dengan sistem tertutup. Substrat yang digunakan adalah kitin. Sebelum digunakan kitin direbus dengan 0,5% NaOH selama 1 jam berdasarkan metode (Gray et al.
(1978)). Selanjutnnya kitin dibilas dengan akuades, lalu disaring dan dikeringkan.
Sebanyak 10 g substrat kitin dimasukkan dalam Labu Duran 250 mL. Substrat kemudian direndam dengan larutan mineral garam sebagai media kitin (Lampiran 6) dan pH larutan dikondisikan pada 7,0 dengan menggunakan buffer pospat pH 7 kemudian media disterilisasi dengan autoclave pada 2 atm temperatur 121oC selama 20 menit. Kultur awal diinokulasikan dalam media kitin dengan
Sejumlah hasil dari fermentasi batch dipanaskan dengan waterbatch pada suhu 70oC selama 45 menit. Kemudian dicampur dengan 45 mL air destilasi dengan membiarkan tabung pada rotary shaker selama 1 jam pada 200 rpm. Campuran disaring menggunakan kain katun dan filtrat disentrifugasi dengan kecepatan 13.000 rpm selama 20 menit pada suhu 4oC. Semua filtrat yang diperoleh dibekukan di dalam frizeer selama 24 jam, kemudian diliofilasi dengan menggunakan freezer dryer sampai terbentuk Kristal Glukosamin.
I. Karakterisasi Glukosamin a. Analisis dengan HPLC
Pembuatan Standar Glukosamin.
50 mg standar glukosamin dilarutkan dalam 25 mL akuabides. Kemudian didiamkan selama ±24 jam dan diperoleh konsentrasi akhir 2000 ppm. Pemeriksaan Sampel glukosamin Hasil Isolasi.
b. Analisis dengan FTIR
Glukosamin yang diperoleh dibaca dengan Spektrofotometer IR. Sampel
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut :
1. Spektrum hasil karakterisasi menggunakan FTIR pada sampel memiliki pita serapan yang relatif sama bila dibandingkan dengan glukosamin standar, hal ini menandakan bahwa sampel hasil isolasi merupakan glukosamin.
2. Kromatogram hasil analisis menggunakan HPLC pada sampel dibandingkan dengan glukosamin standar menunjukkan puncak yang relatif sama pada rentang waktu retensi 2-3, hal ini menandakan bahwa sampel hasil isolasi merupakan glukosamin.
3. Efektifitas variasi media dan inokulum pada fermentasi batch dengan Actinomycetes ANL-4 yang paling efektif untuk pembuatan glukosamin
B. Saran
DAFTAR PUSTAKA
Alexander, M. 1977 . Introduction to Soil Microbiology. 2nd Edition. John Wiley and Sons. New York.
Anggraini, W. 2010. Uji Aktivitas Enzim Kitinase dari Isolat Actinomycetes Selama Proses Solid State Fermentation Kitin dengan Metode Somogyl-Nelson. (Skripsi). Universitas Lampung. Bandar Lampung.
Anonim. 2007. Glukosamin Untuk Osteoartitis. http://www.halalguide.info. Diakses pada 10 Januari 2013.
Augustine, S.K., S.P. Bhavsar, dan B.P. Kapadnis. 2006. A Non-Polyene Antifungal Antibiotic from Streptomyces albidoflavus PU23. Journal of Bioscience, 30(2): 191-201.
Austin , P.A., C.J. Brine , J.E. Castle dan J.P. Zikakis. 1981. Chitin : New Face of Research. Journal of Science, 212 : 749.
Badji, B., A. Zitouni , F. Mathieu, A. Lebrihi dan N. Sabaou. 2006. Antimicrobial Compounds Produced by Actinomadura sp AC104 Isolated from an Algerian Sahara Soil. Canadian Journal of Microbiology, 55(4): 328-373. Bastaman, S. 1989. Studies on Degradation and Extraction of Chitin and Chitosan
from Prawn Shell (Nephrops norvegicus).(Thesis). The Queen’s University. Belfast.
Cabib, E. 1987. The Synthesis and Degradation of Chitin. A. Meister (Ed) Carbohydrates. Journal of Enzymology. 2(7):644 – 650.
Chahal, P.S., D.S. Chahal, and G.B.B. Lee. 1996. Production of Cellulase in Solid State Fermentation with Trichoderma reesi MCG80 on Wheat Straw. Journal of Applied Biochemistry and Biotechnology, 57(5): 433-441.
Clark, K. 2007. Kromatografi Cair Kinerja Tinggi (HPLC). http://www.chem-is-try.org. Diakses pada 28 Januari 2013.
Dinter, S., U. Bunger, and E. Siefert. 2000. Enzymatic Degradation of Chitin by Microorganisms. In: Advances in Chitin Science.Universitat Potsdam Druckhaus Schmergow. Germany.
EFSA [European Food Safety Authority]. 2009. Scientific Opinion on the
substantiation of a health claim related to glucosamine hydrochloride and reduced rate of cartilage degeneration and reduced risk of development of osteoarthritis pursuant. Parma, Italy. European Food Safety Authority, 7(10): 1358.
Elsawati, E. 1994. Limbah Udang Dibuang Sayang. Techner12. Bogor. Hlm. 19. Foth, D. 1991. Dasar-dasar Ilmu Tanah. Gajah Mada University Press.
Yogyakarta.
Foucher, J.P., G.K. Westbrook, A. Boetius, S. Ceramicola, S. Dupre, J. Mascle, J. Mienert, O. Pfannkuche, C. Pierre, and D. Praeg. 2009. Structure and Drivers of Cold Seep Ecosystems. Oceanography, 22: 92-109.
Fukamizo, T. 2000. Chitinolityc Enzymes: Catalysis, Substrate Binding, and Their Application.Current Proteinand Peptide Science,1: 105-124.
Gooday, G.W., W.Y. Zhu, and R.W. O'Donnell. 1992. What are the roles of chitinases in the growing fungus. Microbiology Letters, 100(3): 387-391. Gray, P., N. Hendy, dan W. Dunn. 1978. Digestion by cellulolytic enzymes of
alkali pretreated bagasse. Journal of Institut Agricultur Science,1: 210-212.
Gijzen, M., K. Kuflu,D. Qutob,and J.T. Chernys. 2001. A Class I Chitinase from Soybean Seed Coat. Journal of Experimental Botany, 52: 2283-2289. Gritter, R.J., J.M. Bobbitt, and A.E. Schwarting. 1991. Intoduction to
Chromatography. Halden Day Inc Oakland. USA.
Harman, G.E., Crown K.H., Mitchel L., Ray M.B., Alexander D.P., Candy P., and Andrew T.. 1993. Chitinolitic Enzyme of Trichoderma hazianum:
Purification of Chitobiosidase and Endochitinase Phytopathology, 2(83):313-318.
Holker, U., M. Hofer, and J. Lenz. 2004. Biotechnological Advantages of
Laboratory-Scale Solid State Fermentation with Fungi. Journal of Applied Microbiology and Biotechnology,64:175–186.
Howard, M.B., N.A. Ekborg, L.E. Taylor, R.M. Weiner, and S.W. Hutcheson. 2003. Genomic Analysis and Initial Characterization of the Chitinolytic System of Microbulbifer Degradans Strain 2-40. Journal of Bacteriology, 185: 3352-3360.
Hsu, C.P.S. 1994. Infrared Spectroscopy. Handbook of Instrumental Techniques for Analytical Chemistry. Hualingan. Shanghai.Hlm. 123-126.
Jacyno, M. and C.T. Dean. 2004. New High Sensitivity HPLC Assay For
Glucosamine Using ELSD. http://www.dongmyung.co.kr. Diakses pada
tanggal 22 Februari 2013.
Jutono, F. 1995. Enzim Pangan. Gramedia Pustaka Utama. Jakarta. Hlm.12-21. Knorr, D. 1984. Use of Chitinous Polymers in Food. A Challenge for food
research and development. Food Technology. 38: 85-97.
Lee, J.P. and B.Y. Hwang, 2002. Diversity of Antifungal Actinomycetes in Various Vegetative Soils of Korea. Canadian Journal of Microbiology, 48(5): 407–17.
Lehninger, A.L. 1982. Dasar-Dasar Biokimia. Erlangga. Jakarta. Hlm. 84-89. Maggy, L.T. 1990. Dasar-Dasar Biokimia. Erlangga. Jakarta.
Manitto, P. 1981. Biosintesis Produk Alami. Terjemahan Koensoemardiyah. Ellis Horwood Limited Publishers, Chichester.
Margavey, N.A., J. M. Keller, V. Bernan, M. Dworkin, and D. H. Sherman. 2004.Isolation and Characterization of Novel Marine-Derived
Actinomycetes Taxa Rich in Bioactive Metabolites. Journal of Applied and Environmental Microbiology, 12: 7520-7529.
Marganof. 2003. Potensi Limbah Udang sebagai Penyerap Logam Berat (Timbal, kadmium dan tembaga) di perairan.
http://www.prodiikelautanunirow.blogspot.com. Diakses pada 23 februari 2013.
Mitchel, D., N. Krieger, and M. Berovic. 2006. Solid-State Fermentation Bioreactors. Springer-Verlag Berlin. Heidelberg.
Mugianto, P. 2012. Uji Efektivitas Fermentasi Kitin Secara Bertahap dengan Isolat Actinomycetes ANL-4 dan Mucor Miehei untuk Pembuatan Glukosamin. (Skripsi). Universitas Lampung. Bandar Lampung.
Murray, A.T. and P.T. Sandford. 2003. Chitin and Chitosan: Sources, Chemistry, Biochemistry, Physical Properties and Applications. Journal of Elsevier Applied Science, 12(6): 561.
Muzzarelli, R.A.A. 1984. New Derivates of Chitin and Chitosan: Properties and Aplication. European Chitin Society. Grottamare. Hlm. 201-231.
Nishimura, T., A. Meguro, S. Hasegawa, Y. Nakagawa, M. Shimizu, and M. Hunoh. 2002. An Endophytic Actinomycete, Streptomyces sp. AOK-30, Isolated from Mountain Laurel and Its Antifungal Activity. Journal of Gen Plant Pathology, 68: 390–397.
Ohno, T., S. Armand, S. Hatta, N. Nikaidou,B. Henrissat,M. Mitsutomi, and T. Watanabe. 1996. A Modular Family 19 Chininase Found in the
Prokaryotic Organism Streptomyces GriceusHUT 6037. Journal of Bacteriology, 178: 5065-5070.
Pandey, A., C. Soccoll, and D. Mitchell. 2000. New Developments in Solid-State Fermentation: I – Bioprocesses and Products. Journal of Process
Biochemistry, 35: 1153–1169.
Pareira, B.M. 2004. Limbah Cangkang Udang Menjadi Kitosan. http://www.chem-is-try.org. Diakses pada 26 Januari 2013.
Patil, R.S., V. Ghormade, and M.V. Deshpande. 2000. Chitinolytic Enzymes: An Exploration. Journal of Enzyme and Microbial Technology, 26: 473-483.
Poedjiadi, A. 1994. Dasar-Dasar Biokimia. UI Press. Jakarta. Hlm. 472. Pujaningsih, R. 2005. Teknologi Fermentasi dan Peningkatan Kualitas
Pakan.(Skripsi). Universitas Diponogoro. Semarang.
Rahman, A. 1989. Pengantar Teknologi Fermentasi. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi Pusat Antar Universitas Pangan dan Gizi. Institut Pertanian Bogor. Bogor.
Rao, K. 2009. Fermentation Biotechnology. http://www.fbae.org. Diakses pada 26 Januari 2013.
Rao, N. 1994. Mikrooganisme Tanah dan Pertumbuhan Tanaman. UI press. Jakarta.
Rifaat, M.H. 2003. The Biodiversity of Actinomycetes in the River Nile
Exhibiting Antifungal Activity. Journal of Mediterranean Ecology, 4(3): 5–7.
Rohani, N. 2000. Deproteinasi Kulit Udang Windu Menggunakan Isolat Bakteri Bacillus sp. (Skripsi). Institut Pertanian Bogor. Bogor
Sahai, A.S. and S.M. Manocha. 1993. Chitinases of Fungi and Plants : Their Involvement in Morphogenesis and Host-Parasite Interaction. Journal of FEMS Microbiology, 3(11): 317–338.
Shaikh, L., K. Kender, A.D. Mukhi, W. Billy, and D.E. Ranfes. 1993. Production of bioenergy and biochemicals from industrial and agricultural
wastewater. Journal of Trends in Biotechnology, 5(22): 477–485. Shantosh, S., and P.T. Mathew. 2007. Preparation of glucosamine and
carboxymethylchitin from shrimp shell. Journal of Applied Polymer Science, 107: 280-285.
Shimahara, K. And Y, Takiguci.1988. Methods Enzymol. Nikaido. Yokohama. Hlm. 161.
Silverstein, R.M., G.C. Bassler, dan T.C. Morril. 1986. Penyelidikan Spektromerik Senyawa Organik. Edisi keempat. Alih bahasa A.J. Hartono dan Purba A.V. Erlangga. Jakarta. Hlm. 17-33.
Stephen, A. M. 1995. Food Polysacharides and Their Application. Marcel Dekker. New York.
Subbarao, N.S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi ke-2. UI-Press. Jakarta. Hlm. 38-40.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. Antar Universitas Bioteknologi. IPB. Bogor.
Suryanto, D. dan Yurnaliza. 2005. Eksplorasi Bakteri Kitinolitik : Keragaman Genetik Gen Penyandi Kitinase pada Berbagai Jenis Bakteri dan
Pemanfaatannya. [http:repository.usu.ac.id] diakses pada 25 februari 2013
Sutedjo, M.dan G. Kartasapoetra. 1991. Mikrobiologi Tanah. Ineka Cipta. Jakarta. Suwandi, U. 1989. Mikroorganisme Penghasil Antibiotik. Pusat Penelitian dan
Pengembangan PT. Kalbe Farma. Jakarta.
Takizawa, M., R.R. Colwell, and R.T. Hill, 1993. Isolation and Diversity of Actinomycetes in Chesapeake Bay. Journal of Applied Environmental Microbiology, 59: 997–1002.
Tomokazu, K., S. Saito, S. Sato, K. Kanai, F. Fujii, N. Nikaidou, and W. Watanabe. 2004. Distribution and Phylogenetic Analysis of Family 19 Chitinases in Actinobacteria. Journal of American Society for
Microbiology, 70(2) : 1135-1144.
Ton, N.M.N., M.D. Nguyen, T.T.H. Pham and V.V.M. Le. 2010. Influence of initial pH and sulfur dioxide content in must on wine fermentation by immobilized yeast in bacterial cellulose. International Food Research Journal, 6(3): 743-749.
Volk, W.A dan M.F. Wheeler. 1993. Mikrobiologi Dasar. Penerjemah Markham Edisi Kelima. Erlangga. Jakarta.
Williams, G.W. 2004. Osteoarthritis and Treatment: What You Need to Know. In The American Council of Science and Health. http://www.acsh.org/ publications/pubid.190/pub_detail.asp. Diakses pada 10 Januari 2013.
Weites, A.M., D.R. Gondim, and L.R.B. Gonçalves. 2001. Ethanol production by fermentation using immobilized cells of Saccharomyces cerevisiae in cashew apple bagasse. Journal of Biochemistry and Biotechnology, 1(8): 209–217.
Xu, L., Q. Li, and C. Jiang. 1996. Diversity of Soil Actinomycetes in Yunnan, China. Journal of Applied Environmental Microbiology, 62 (1): 244-248. Yurnaliza. 2002.Senyawa Kitin dan Kajian Aktivitas Enzim Mikrobial