TEST EFFECTIVITY OF GRADUALLY FERMENTATION CHITIN USE MUCOR MIEHEIANDACTINOMYCETESANL-4 FOR MAKING
GLUCOSAMINE
By
Siti Oktavia Rumapea
Chitin is a biopolymer formed by N-acetylglucosamine monomers binded by β-(1,4) glycoside. Chitin is abundant compound normaly founded from seafood waste industry such as : shrimps. Glucosamine was synthezided gradually fermentation technique using Mucor miehei and Actinomycetes ANL-4. The research was carried out into the effectiveness of glucosamine-making by using chitin fermentation gradually utilizing Mucor miehei and Actinomycetes ANL-4. Fermentation chitin were first conducted with the help of Mucor miehei which produces glucosamine at 5.5 g after the remaining substrate fermentation phase I continued on the two-stage fermentation is done with the help of Actinomycetes
UJI EFEKTIVITAS FERMENTASI KITIN BERTAHAP
MENGGUNAKANMUCOR MIEHEIDANACTINOMYCETESANL-4 UNTUK PEMBUATAN GLUKOSAMIN
Oleh
Siti Oktavia Rumapea
Kitin merupakan biopolimer yang terbentuk dari monomer N-asetilglukosamin yang dihubungkan oleh ikatan β-(1,4) glikosida. Kitin umumnya banyak ditemukan di limbah industri makanan laut seperti udang. Glukosamin dapat disintesis dari kitin secara fermentasi menggunakan Mucor miehei dan
Actinomycetes ANL-4. Penelitian ini dilakukan untuk melihat keefektifan pembuatan glukosamin dengan menggunakan fermentasi kitin secara bertahap yang memanfaatkan Mucor miehei dan Actinomycetes ANL-4. Fermentasi kitin yang pertama dilakukan dengan bantuan Mucor miehei yang menghasilkan glukosamin sebesar 5,5 g setelah itu substrat sisa hasil fermentasi tahap I dilanjutkan kembali pada fermentasi tahap dua yang dilakukan dengan bantuan
I. PENDAHULUAN
A. Latar Belakang
Kitin terdiri dari monomer N-asetilglukosamin yang dihubungkan oleh ikatan β-(1,4) glikosida dan memiliki sifat yang sukar larut dalam berbagai jenis pelarut. Karena sifat kitin yang sukar larut dalam berbagai jenis pelarut ini maka dibuatlah suatu senyawa turunan kitin yang terdeasetilasi sebagian yaitu kitosan. Selain itu monomer N-asetilglukosamin penyusun kitin juga dapat dideasetilasi
menghasilkan glukosamin (Peter, 1995).
Untuk mendegradasi kitin dapat dilakukan dengan dua metode yaitu metode konvensional atau secara kimia dan metode enzimatik (Gooday, 1994). Metode konvensional seringkali menyisakan limbah berbahaya, sedangkan metode enzimatik lebih aman dan efektif karena menggunakan enzim spesifik (misal: enzim kitindeasetilase dan enzim kitinase), sehingga tidak menyisakan limbah berbahaya (Jayanti, 2002).
biodegradasi dari suatu kitosan menghasilkan monomer penyusunnya yaitu glukosamin (Jayanti, 2002).
Glukosamin (C6H13NO5) atau gula amino merupakan bagian penting dalam
sintesis biokimia dari protein glikosilasi dan lipid. Untuk menghasilkan
glukosamin dari degradasi kitosan dan N-asetilgukosamin dapat dilakukan dengan bantuan enzim kitinase (Jayanti, 2002).
Menurut Schomburg dkk (1991), mikroorganisme yang dapat menghasilkan enzim kitinolitik adalahMucordanActinomycetes. Mucormerupakan fungi tipikal saprotrop pada tanah dan serasah tumbuhan yang mampu menghasilkan enzim kitindeasetilase pada substrat kitin atau kulitcrustaceadan media cair yang mengandung nutrien yang diperlukan (Ratledge, 1993). Sedangkan
Actinomycetesmerupakan mikroorganisme kitinolitik yang mampu menghasilkan enzim kitinolitik berupa kitinase untuk mensintesis metabolit senyawa yang memiliki aktivitas biologis dan spora dariActinomycetessangat esensial untuk biokonversi (Xuet al, 1996).
Pada penelitian sebelumnya telah dilakukan fermentasi kitin menggunakanMucor mieheiuntuk menghasilkan kitosan, kitosan ini diperoleh dari degradasi substrat kitin, tetapi kitosan yang diperoleh hanya 20 % dari substrat yang digunakan. Substrat kitin dalam penelitian ini tidak terdegradasi sepenuhnya
(Mardiana, 2002). Dalam penelitian tersebut juga adanya dugaanMucor miehei
Sari, I. P. (2011) menggunakanActinomycetesANL-4 dalam produksi
N-asetilglukosamin, justru lebih banyak menghasilkan glukosamin dibandingkan N-asetilglukosamin.
Berdasarkan penelitian tersebut maka dalam penelitian ini dilakukan pembuatan glukosamin secara enzimatik dari substrat kitin yang berasal dari kulit udang dan menggunakan fermentasibatchsecara bertahap yang memanfaatkan dua mikroba yaituMucor mieheidanActinomycetesANL-4, dengan harapan substrat kitin dapat terdegradasi sepenuhnya sehingga mendapatkan hasil yang lebih efektif. Tahapan pertama yang dilakukan yaitu mendegradasi kitin dengan bantuanMucor mieheipada fermentasi pertama,Mucor mieheiini diperkirakan mampu
menghasilkan enzim kitinase sehingga dihasilkan suatu senyawa yang
diperkirakan glukosamin dan substrat sisa hasil fermentasi. Substrat sisa hasil fermentasi yang pertama dilanjutkan kembali pada fermentasi yang kedua menggunakanActinomycetesANL-4 yang menghasilkan enzim kitinase untuk mendegradasi substrat menjadi glukosamin. Fermentasi kitin secara bertahap ini diharapkan mampu mendegradasi substrat sepenuhnya dan menghasilkan
B. Tujuan Penelitian
Tujuan dari penelitian ini yaitu mengetahui keefektifan pembuatan glukosamin dengan fermentasi kitin secara bertahap menggunakanMucor mieheidan
ActinomycetesANL-4, lalu mengkarakterisasi sampel yang diperoleh dengan HPLC dan FTIR.
C. Manfaat Penelitian
Penelitian ini diharapkan memberikan informasi tentang potensiMucor miehei
II. TINJAUAN PUSTAKA
A. Kitin dari Kulit Udang
Kulit udang mengandung protein sekitar 25% 40%, kalsium karbonat 45% -50% , dan kitin 15% - 20%, tetapi besarnya kandungan komponen tersebut
tergantung pada jenis udangnya. Kandungan kitin dalam kulit udang lebih rendah dari hewan segolongannya yaitu kulit kepiting, tetapi kulit udang tersedia dalam jumlah yang banyak dan lebih mudah didapat sebagai limbah
(Focheret al., 2009).
B. Kitin
Kitin merupakan polimer berantai lurus yang memiliki berat molekul tinggi dan rumus empiris (C6H9O4.NHCOCH3)n. Nama lain dari kitin adalah
β-(1,4)-2-asetamida-2-dioksi-D-glukosa (N-asetil-D-Glukosamin), kitin ini berbentuk padatan yang tidak larut dalam air, pelarut organik, alkali pekat, asam mineral lemah tetapi larut dalam asam-asam mineral yang pekat
(Suryantoet al.,2005).
Kitin memiliki persamaan dengan selulosa, dimana ikatan yang terjadi antar
atom karbon nomor 2, pada kitin digantikan oleh gugus asetamida (NHCOCH3)
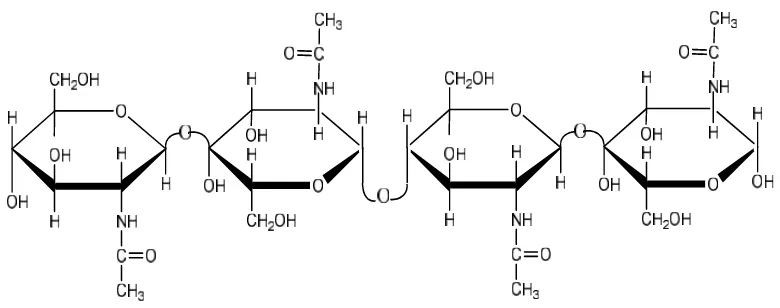
sehingga kitin menjadi sebuah polimer berunit N-asetilglukosamin. Struktur kitin dapat dilihat pada Gambar 1.
Gambar 1. Struktur kitin (Murrayet al.,2003).
Rantai kitin antara satu dengan yang lainnya yaitu antara gugus N-H dari satu rantai dan gugus C=O dari rantai yang berdekatan berasosiasi dengan ikatan hidrogen yang sangat kuat, ikatan hidrogen ini yang menyebabkan kitin tidak dapat larut dalam air (Cabib, (1987)dalamSuryanto aet al.,(2005)).
Adapun proses isolasi kitin meliputi dua tahap, yaitu deproteinasi dan demineralisasi.
1. Deproteinasi
NaOH berlangsung dengan proses protein diekstraksi sebagai Na-proteinat yang larut dalam air (Knorr, 1984), sedangkan pada enzim proteolitik akan
mendegradasi protein sehingga terpisah dari kitin (Muzzarelli, 1984).
2. Demineralisasi
Demineralisasi merupakan proses pemisahan mineral atau senyawa anorganik dari kitin. Mineral utama yang terkandung dalam kulit udang adalah kalsium fosfat (Ca3(PO4)2) dan kalsium karbonat (CaCO3). Proses demineralisasi ini biasanya
dilakukan menggunakan larutan asam klorida dengan merendam bahan hasil deproteinasi. Menurut Shimahara (1988), penggunaan asam klorida lebih efektif untuk melarutkan kalsium menjadi kalsium klorida, tetapi asam klorida juga menyebabkan kitin mengalami depolimerisasi. Agar tidak terjadi depolimerisasi terkadang digunakan EDTA dalam proses demineralisasi. Hanya saja EDTA tidak dapat mengeliminasi garam anorganik secara lengkap
(Shimahara and Takiguci, 1988).
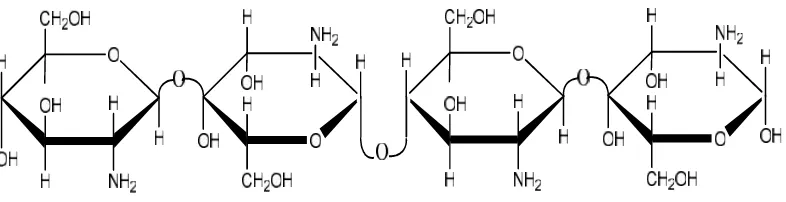
C. Kitosan
Kitosan disebut juga dengan β-1,4-2 amino-2-dioksi-D-glukosa, senyawa ini memiliki bentuk seperti lembaran tipis dan berserat, berwarna putih atau kuning, tidak berbau dan memiliki sifat tidak larut dalam air, sedikit larut dalam HCl, HNO3, dan H3PO4dan tidak larut dalam H2SO4. Kitosan memiliki struktur yang
basa kuat. Adanya gugus amina dan hidroksil pada kitosan menjadikan sifatnya lebih aktif dan bersifat polikationik (Murrayet al.,2003).
Gambar 2. Struktur kitosan (Murrayet al.,2003).
Banyak pemanfaatan kitosan yang dapat kita lihat diberbagai industri kimia, antara lain dipakai sebagai koagulan dalam pengolahan limbah air, pelapis benih yang akan ditanam, adsorben ion logam, bahan pelembab, komponen tambahan pakan ternak, sebagai lensa kontak, pelarut lemak, dan pengawet makanan (Hargono dan Djaeni, 2003).
Sedangkan pada metode enzimatik digunakan enzim spesifik misal: enzim kitosanase, sehingga tidak menyisakan limbah berbahaya. Jadi metode enzimatik ini lebih aman dan efektif dibandingkan metode konvensional. (Jayanti, 2002).
D. Glukosamin
Glukosamin (C6H13NO5) atau gula amino merupakan prekursor penting dalam
Golongancrustaceayang memiliki kandungan glukosamin yaitu seperti rajungan, kepiting, udang dan cumi-cumi. Tidak hanya itu, terdapat juga pada invertebrate sepertiArtopoda, Molusca, Coelenterata, danNematodaserta beberapa kelas serangga dan jamur. Rangka luar golongan hewan dan jamur tersebut tersusun atas kitin, kitin merupakan dasar pembentukan kitosan, dimana kitosan sendiri merupakan polimer dari glukosamin (D-glukosamin). Glukosamin berfungsi sebagai pengemulsi, koagulasi, pengkhelat dan penebal emulsi (Anonim, 2007).
Gambar 3. Struktur D-glukosamin (Anonim, 2007)
E. Enzim
Enzim merupakan protein sel hidup yang berperan sebagai biokatalisator dalam proses biokimia, baik yang terjadi di dalam sel maupun di-luar sel. Enzim merupakan katalisator sejati yang dapat meningkatkan kecepatan reaksi kimia spesifik dengan nyata, suatu reaksi kimia akan berlangsung sangat lambat tanpa adanya enzim. Enzim tidak mampu mengubah titik keseimbangan dari reaksi yang dikatalisisnya dan enzim juga tidak akan habis dipakai atau diubah secara permanen oleh reaksi-reaksi tersebut (Lehninger, 2005).
apabila reaksi yang diinginkan telah terjadi. Secara sederhana penguraian suatu senyawa atau substrat oleh suatu enzim dapat dilihat sebagai berikut:
E + S ES E + P
Keterangan: E = Enzim P = Produk
S = Substrat ES = Kompleks Enzim-Substrat
Fungsi terpenting dari suatu enzim yaitu kemampuannya menurunkan energi aktivasi dalam suatu reaksi kimia. Kemampuan enzim dalam mendegradasi substrat dipengaruhi oleh beberapa faktor, antara lain konsentrasi substrat, suhu, konsentrasi enzim, serta pH (Lehninger, 2005).
Beberapa faktor yang mempengaruhi aktivitas enzim antara lain : a) Substrat (reaktan)
Saat konsentrasi substrat rendah, kecepatan reaksi yang terjadi akan rendah. Sebaliknya kecepatan reaksi akan meningkat seiring dengan meningkatnya konsentrasi substrat. Tetapi peningkatan substrat lebih lanjut akan menghasilkan suatu laju maksimum dan keadaan substrat yang berlebih akan menyebabkan kejenuhan pembentukan kompleks enzim substrat sehingga sebagian besar substrat tidak dapat diubah menjadi produk. Penambahan substrat lebih lanjut tidak berakibat terhadap laju reaksi.
b) Suhu ( Temperatur )
proses enzim yang tidak aktif. Umumnya enzim akan mengalami kerusakan atau denaturasi pada suhu di atas 50oC.
c) Derajat keasaman ( pH )
Reaksi suatu enzim dipengaruhi oleh perubahan pH karena akan berakibat langsung terhadap sifat ion dari gugus–gugus amino dan karboksilat, sehingga akan mempengaruhi bagian aktif enzim dan konformasi dari enzim. pH yang terlalu rendah atau terlalu tinggi akan mengakibatkan denaturasi dari enzim.
d) Penghambat enzim ( inhibitor )
Inhibitor dapat menghambat kerja enzim karena akan mengganggu proses
pembentukan dan kestabilan ikatan kompleks enzim substrat dengan membentuk ikatan dengan sisi aktif enzim. Ada beberapa jenis penghambatan enzim yaitu penghambat secara bersaing (kompetitif), penghambat tidak bersaing
(non–kompetitif ), penghambat umpan balik (feed back inhibitor), dan penghambat alosterik (Lehninger, 2005).
F. Enzim Kitinolitik
Enzim kitinase merupakan enzim kitinolitik yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin, enzim ini dihasilkan oleh bakteri, fungi, tanaman, dan hewan (Harmanet al.,1993) dan menurut Suryantoet al.,(2005) membagi kitinase dalam tiga tipe yaitu :
berupa oligomer pendek N-asetilglukosamin (GIcNAc) yang mempunyai berat molekul rendah seperti kitotriose yang sifatnya mudah larut.
Gambar 4. Reaksi pemutusanikatan β-1,4 pada bagian internal mikrofibril kitin oleh endokitinase (Suryantoet al.,2005).
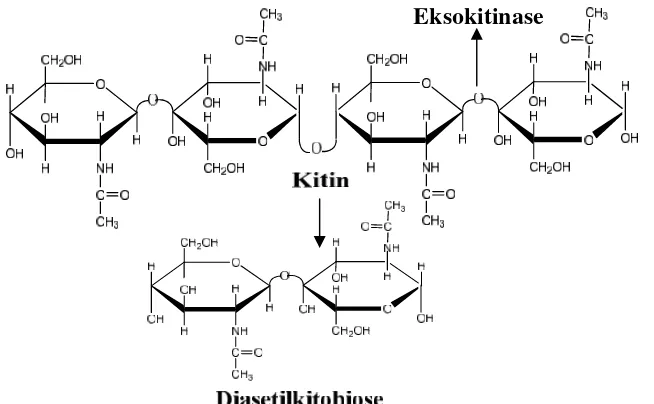
2. Eksokitinase (EC 3.2.1.14) disebut juga dengan kitobiodase atau kitin 1,4-β-kitobiodase, yaitu enzim yang mengkatalisis secara aktif dari
pembebasan unit-unit diasetilkitobiose tanpa adanya pembentukan unit-unit monosakarida atau polisakarida. Pemotongan hanya terjadi pada ujung non-reduksi mikrofibril kitin dan tidak secara acak.
Gambar 5. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase (Suryantoet al.,2005).
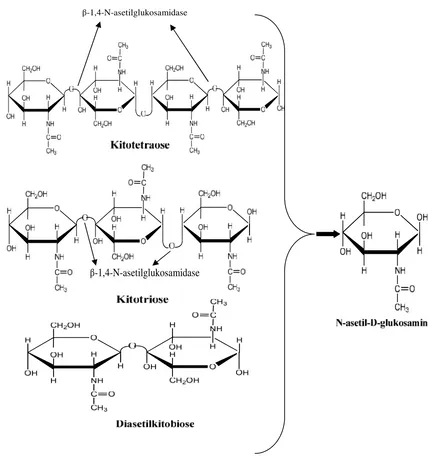
3. β-1,4-N-asetilglukosaminidase (EC 3.2.1.30) merupakan suatu enzim kitinase yang bekerja pada pemutusan diasetilkitobiose, kitotriose dan kitotetraose untuk menghasilkan monomer-monomer GIcNAc.
Gambar 6. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose dan menghasilkan monomer-monomer GicNAc (Suryantoet al.,2005).
β-1,4-N-asetilglukosamidase
Enzim kitinase berguna dalam produksi kitooligosakarida. Kitooligosakarida berperan sebagai pertahanan tanaman, juga digunakan dalam kesehatan manusia. Kitinase berperan dalam produksi protein sel tunggal dari limbah kitin untuk makanan hewan ((Shaikhet al.,(1993)dalamSuryantoet al.,(2005)). Selain itu kitinase juga dapat digunakan dalam bidang pertanian sebagai pengendalian jamur patogen tanaman dan hama serangga ((Patilet al.,(2000)dalam
Suryantoet al.,(2005)). Selain dengan kitinase, polimer kitin juga bisa didegradasi oleh enzim kitin deasetilase dan kitosanase. Kitin deasetilase menghilangkan gugus asetil dari kitin menghasilkan kitosan. Kitosan akan dipotong–potong oleh kitosanase menghasilkan oligomer kitosan. Oligomer kitosan kemudian dipotong-potong lagi olehβ–D-glukosaminidase menghasilkan monomer glukosamin.
G. JamurMucor
Jamur adalah sekelompok organisme yang digabungkan dalam takson Kingdom Fungi berdasarkan system Whittaker. Kingdom fungi mempunyai ciri khas yaitu bersifat heterotrof yang mengabsorbsi nutrient dan memiliki kitin pada dinding selnya. Jamur benang atau kapang adalah golongan fungi yang membentuk lapisan jaringan miselium dan spora yang tampak. Misseliumnya terdiri dari filamen tubular yang tumbuh yaitu hifa (Singleton dan Sainsbury, 2006).
Fungi mempunyai penggunaan kitin yang berbeda dengan hewan. Hewan hanya memproduksi kitin pada bagian tertentu, misalnya sebagai rangka luar, rambut atau kuku, sementara fungi memiliki kitin sebagai pembentuk dinding pada seluruh selnya. Adanya kitin juga membantu membedakan antara fungi dan eukariota lain, seperti protista (Purves dan Sadava, 2003).
Mucoradalah genus fungi yang berasal dari ordo Mucorales yang merupakan fungi tipikal saprotrop pada tanah dan serasah tumbuhan. Hifa vegetatifnya bercabang-cabang, bersifat coenositik dan tidak bersepta. Mucorberkembangbiak secara aseksual dengan membentuk sporangium yang ditunjang oleh batang yang disebur sporangiofor. Ciri khas padaMucoradalah memiliki sporangium yang berkolom-kolom atau kolumela (Singleton dan Sainsbury, 2006).
H. Actinomycetes
Actinomycetesmemiliki sifat–sifat yang umum dimiliki oleh bakteri dan jamur. Secara fisik terlihat seperti jamur (eukariotik), tetapi organisme ini juga memiliki semua kriteria untuk sel prokariotik, yaitu dinding selnya mengandung asam muramat, tidak mempunyai mitokondrion, mengandung ribosom 70s, tidak mempunyai pembungkus nukleus, garis tengah selnya berkisar dari 0,5-2,0 µm, dan dapat dimatikan atau dihambat oleh banyak antibiotik bakteri (Rao, 1994).
Actinomycetesmirip dengan fungi yang mempunyai hifa bercabang dengan
(Sutedjoet al., 1991). Actinomycetesjuga mempunyai kesamaan dengan bakteri yaitu struktur sel dan ukuran irisan yang melintang (Foth, 1991).
Menurut Rao (1994),Actinomycetesdapat dibedakan dari bakteri pada lempeng agar dengan mudah, koloni bakteri tumbuh dengan cepat dan berlendir, sedangkan
Actinomycetesmuncul perlahan dan berbubuk yang melekat erat pada permukaan agar. KoloniActinomycetesbiasanya keras, kasar, dan tumbuh tinggi di atas permukaan medium. Umumnya,Actinomycetestidak toleran terhadap asam dan jumlahnya menurun pada pH 5,0. Rentang pH dan temperatur yang cocok untuk pertumbuhanActinomycetesini sekitar 6,5–8,0 dan temperatur 25–300C.
Medium yang baik untuk menumbuhkanActinomycetesadalah medium yang mengandung sumber karbon seperti glukosa, gliserol atau tepung, sumber nitrogen seperti nitrat atau kasein dan mineral–mineral tertentu seperti NaCl, K2HPO4, MgSO4.7H2O, CaCO3, FeSO4.7H2O. Waktu inkubasi biasanya selama
2–7 hari (Jutono dalam Fithria, 2007). PopulasiActinomycetesdi alam
dipengaruhi oleh beberapa faktor seperti kandungan organik, pH, kelembapan, temperatur, musim, dan lain- lain (Suwandi, 1989).
I. Fermentasi
Nutrisi utama yang digunakan untuk pertumbuhan mikroba adalah karbon, nitrogen, hidrogen, oksigen dan pospor.
Faktor-faktor yang mempengaruhi pemilihan substrat untuk fermentasi adalah (Pujaningsih, 2005) :
a). Ketersediaan yang kontinyu, yaitu substrat tersedia sepanjang tahun sehingga saat disimpan dalam beberapa bulan, mutu dan komposisi relatif tetap.
b). Sifat substrat harus dapat difermentasikan, contoh padaTichoderma viridae
yang tumbuh baik hanya pada substrat selulosa (jerami padi), tetapi tidak dapat tumbuh pada bungkil kelapa.
c). Harga substrat ekonomis atau terjangkau dan dapat digunakan sesuai kebutuhan.
J. Fermentasi Fase Cair Sistem Tertutup (Batch)
Fermentasi dapat dilakukan dengan metode kultur permukaan yang berupa
medium padat, medium cair dan kultur terendam yang dilakukan dalam media cair menggunakan bioreaktor dapat berupa labu yang diberi aerasi atau labu yang digoyang denganshakerataufermentor(Tonet al.,2010).
Fermentasi medium cair dapat dilakukan dengan cara fermentasi tertutup (batch culture) dan fermentasi kontinyu (fed batch). Pada fermentasi tertutup, setelah inokulasi berjalan tidak dilakukan lagi penambahan medium kedalamfermentor, kecuali dalam pemberian oksigen (udara steril), antibuih dan asam atau basa yang mengatur pH. Oleh karena itu pada sistem tertutup ini dengan sekian lamanya waktu fermentasi yang ditentukan maka laju pertumbuhan spesifik
mikroorganisme semakin menurun sampai akhirnya pertumbuhan terhenti. Hal ini disebabkan karena dengan semakin bertambahnya waktu fermentasi nutrien-nutrien esensial dalam medium semakin berkurang dan terjadi akumulasi
autotoksin yang mempengaruhi laju pertumbuhan atau kombinasi dari keduanya. Dengan demikian pada fermentasi tertutup jumlah sel jumlah sel maksimum terletak pada saat fasestationer(Tonet al.,2010).
1. Proses Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Mitchelet al.(2006) tahapan proses secara umum dalam fermentasi batch ini antara lain :
1. Persiapan substrat, substrat dapat dibuat menjadi butiran kecil. Untuk menambah ketersediaan gizi dilakukan penambahan air dan nutrisi yang disebut dengan pra-perawatan substrat.
2. Persiapan inokulum, persiapan inokulum tergantung pada jenis mikroorganisme yang digunakan. Proses fermentasibatchini dapat
3. Persiapan wadah, wadah harus benar-benar bersih dan steril sebelum penambahan substrat.
4. Inokulasi, pengerjaan tahap ini dengan penyebaran substrat pada media yang telah steril secara hati–hati.
5. Proses fermentasibatch, sebelum memulai proses ini hal yang harus diperhatikan antara lain pH medium, suhu, dan waktu inkubasi.
6. Kultivasi, tahap ini merupakan tahap pemisahan substrat padat dari medium yang dapat dilakukan dengan menggunakan kertas saring dan sentrifugasi.
2. Keuntungan Fermentasi Fase Cair Sistem Tertutup (Batch)
Medium cair memiliki beberapa kelebihan dibandingkan dengan medium padat, yaitu (Weiteset al.,2001):
1. Jenis komponen dan konsentrasinya dapat diatur sesuai yang diinginkan. 2. Dapat memberikan kondisi optimum untuk pertumbuhan.
3. Pemakaian medium lebih efisien.
3. Pemanfaatan Fermentasi Fase Cair Sistem Tertutup (Batch)
Pemanfaatan fermentasibatchsecara tradisional antara lain (Holkeret al,2004) dan (Pandey, 2000) :
a). Pembuatan minuman beralkohol seperti Bir dengan cara sari buah yang diberi
b). PembuatanYoghurtdengan cara memfermentasikan air susu dengan bakteri bukan khamir. Biasanya menggunakan campuranLactobacillus bulgaricus
danStreptococcus thermophillus. Bakteri ini akan mengubah laktosa (gula susu) menjadi asam laktat pada kondisi anaerob yang bersifat menggumpalkan kasein.
c). Keju, biasanya menggunakan bakteri dengan spesiesStreptococcus
thermophillusdanLactobacillus bulgaricus. Enzim yang diperlukan untuk menghasilkan keju adalahrennetyang mengandungcymosinyang bersifat menggumpalkan casein.
Selain aplikasi di atas, masih banyak aplikasi yang menghasilkan produk-produk seperti enzim, pigmen, senyawa aromatik, senyawa kimia, antibiotik, agen pengontrol biologis dan banyak aplikasi penggunaan mikroorganisme dalam fermentasibatchsebagai bagian dari proses perantara, yaitu pewarnaan zat warna, biobleaching, biopulping,danbioremediation.
K. Fourier Transform Infrared(FTIR)
Spektroskopi FTIR merupakan metode yang digunakan untuk mengidentifikasi gugus fungsi yang terdapat dalam senyawa organik, gugus fungsi ini ditentukan berdasarkan ikatan dari tiap atom. Prinsip kerja dari metode ini adalah molekul organik yang disinari radiasi IR akan menyebabkan molekul dari senyawa tersebut tervibrasi dan energi vibrasi diukur oleh detektor serta energi vibrasi dari gugus fungsi tertentu akan menghasilkan frekuensi secara spesifik. Alat ini dapat
dispersi. Radiasi infra merah memiliki spektrum elektromagnetik pada bilangan gelombang 13000-10 cm-1atau panjang gelombang dari 0,78-1000 µm.
Spektrum infra merah digunakan untuk menentukan gugus fungsi suatu struktur senyawa organik biasanya antara 4000-400 cm-1(2.5 sampai 25 µm). Daerah di bawah frekuensi 400 cm-1(25 µm) disebut daerah infra merah jauh sedangkan daerah di atas 4000 cm-1(2.5 µm) disebut daerah inframerah dekat (Silversteinet al.,1986).
Spektrofotometer FTIR memiliki kesamaan dengan SpektrofotometerInfra Red
dispersi hanya saja pengembangan pada sistem optiknya sebelum berkas sinar infra merah melewati contoh. Spektrofotometer FTIR memiliki dasar pemikiran dari persamaan gelombang yang dirumuskan oleh seorang ahli matematika dari Perancis, Jean Baptiste Joseph Fourier (1768-1830). Dari deret Fourier tersebut intensitas gelombang digambarkan sebagai daerah frekwensi atau daerah waktu. Perubahan gambaran intensitas gelombang radiasi elektromagnetik dari daerah frekwensi ke daerah waktu atau sebaliknya disebut Transformasi Fourier (Fourier Transform). Pada sistem optik peralatan instrumenFourier Transform Infra Red
memakai dasar daerah waktu yang non dispersif. Secara keseluruhan, analisis menggunakan spektrofotometer ini lebih unggul dibandingkan Spektrofotometer
Infra Reddispersi yaitu :
1. Dapat digunakan untuk semua frekuensi dari sumber cahaya secara simultan sehingga dapat dilakukan analisis lebih cepat.
Sebagai contoh senyawa kitin memberikan data serapan IR :ῡ= 3448,5 cm-1yang menunjukan vibrasi ulur NH amida (NH amina) dan OH;ῡ= 2920-2873,7 cm-1 yang menunjukan vibrasi ulur CH, CH2, dan CH3;ῡ= 1450,4 cm-1yang
menunjukan Vibrasi tekuk NH;ῡ= 1153,4 cm-1yang menunjukan vibrasi ulur C N;ῡ= 1033,8 cm-1yang menunjukan vibrasi ulur C-O; danῡ= 871,8 cm-1yang menunjukan vibrasi tekuk ke luar bidang N-H (Syahmani and Sholahuddin, 2009).
L. High Performance Liquid Chromatography(HPLC)
HPLC merupakan suatu teknik kromatografi yang menggunakan fasa gerak cair untuk pemisahan sekaligus untuk analisis senyawa berdasarkan kekuatan atau kepolaran fasa geraknya. Berdasarkan polaritas relatif fasa gerak dan fasa
Gambar 7. Diagram Alat HPLC (Clark, 2007).
Ada beberapa cara untuk mendeteksi substansi yang telah melewati kolom HPLC. Metode yang dipakai untuk menganalisis glukosamin adalah penggunaan
evaporasi detektor hamburan cahaya (ELSD) (Mulja and Suharman, 1995). Glukosamin tidak dapat dianalisis dengan detektor UV secara langsung. Glukosamin memiliki serapan sinar UV pada panjang gelombang dibawah 205 nm yang hampir sama dengan serapan pelarut polar seperti air dan metanol. Pada detektor ini sampel yang akan dideteksi harus melalui 3 tahap yaitu:
a. Nebulisasi merupakan langkah pertama untuk mengubah seluruh fasa gerak yang mengalir dari kolom HPLC dengan bantuan gas Nitrogen menjadi butiran halus atau disebut dengan aerosol. Semakin besar ukuran aerosol, semakin tinggi suhu yang dibutuhkan untuk menguapkan fasa gerak.
b. Evaporasi ( penguapan) merupakan langkah kedua setelah fasa gerak diubah menjadi aerosol yang dibawa oleh aliran gas ke daerah panas yang terletak sebelum ruang deteksi. Pelarut akan diuapkan untuk menghasilkan partikel
c. Deteksi dimana partikel-partikel sampel melewati sebuah sel aliran akan ditembakkan dengan sumber cahaya, jumlah cahaya yang tersebar yang diukur dengan menggunakan photomultiplier dan perangkat elektronik.
Cara yang praktis dan efisien untuk menganalisis glukosamin adalah dengan HPLC yang dilengkapi ELSD (Evaporative Light Scattering Detection). Detektor evaporasi hamburan cahaya ideal untuk mendeteksi analit tanpa gugus kromofor UV, karena analisis tidak bergantung pada sifat optik dari suatu senyawa. Prinsip kerja dari detektor evaporasi hamburan cahaya adalah sampel yang berasal dari HPLC dalam bentuk cair mengalami nebulisasi menjadi bentuk aerosolnya. Kemudian pelarut yang digunakan akan mengalami evaporasi (penguapan)
sehingga terpisah dari sampel. Sampel yang telah terpisah ditembaki dengan sinar pada semua panjang gelombang, kemudian jumlah cahaya yang dipantulkan kembali akan memberikan sinyal untuk detektor. Sinyal yang terdeteksi akan memberikan data output berupa kromatogram.
Adapun keunggulan dari ELSD yaitu:
1. Sensitivitas tinggi memberikan respon yang luar biasa untuk semua senyawa, sampai ke tingkat nanogram rendah.
2. Operasi Sub-ambien menggunakan tabung penguapan berpendinginPeltier
memberikan suhu rendah sampai 10°C, mencegah degradasi dari senyawa labil panas yang tidak terdeteksi oleh ELSD lain.
3. Real-timekontrol selama injeksi melalui Softwaredimensi yang diprogram untuk mempertahankan sensitivitas maksimum pada pengoperasian alat. 4. Real-timepemrograman gas yang menghilangkan efek peningkatan pelarut
5. Dispersi rendah dan kecepatan data output-tingkat tinggi adalah pasangan yang cocok untuk aplikasi LC Cepat.
7. Reprodusibilitassuper di bawah 2% memberikan hasil yang dapat diandalkan dan akurat.
8. Pemanasan dan pendinginan tabungevaporatorcepat, meminimalkan waktu keseimbangan dan sampel yang lewat meningkat.
Kondisi HPLC-ELSD (Evaporative Light Scattering Detection) untuk identifikasi glukosamin menggunakan kolom C18, fasa gerak adalah asetonitril/H2O (65/35)
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini telah dilaksanakan dari bulan April sampai dengan bulan Agustus 2012 dengan tahapan kegiatan, yaitu: persiapan sampel kulit udang, pembuatan glukosamin di Laboratorium Biomasa Terpadu, Universitas Lampung.
B. Alat dan Bahan
Dalam penelitian ini alat–alat yang akan digunakan adalah peralatan gelas,
shaker-IncubatorBiosan/ES-20/60,Heating Magnetic Stirer, indikator universal, mikropipet,Laminar air flow, inkubator Memmert-Germany/INCO2,centrifuge
Hitachi/CF 16 RX II,digital waterbathWiggen Hauser,autoclave,Frezee dry Scanvac Coolsafe,Frezeer, neraca digital Wiggen Hauser, mortar, termometer,
oven,Foureer Transform Infrared(FTIR) Varian 2000 Scimitar series, HPLC (High Performance Liquid Chromatographic) Varian 940-LC, Detektor ELS Varian 385-LC, kolom C18 (125mm x 4,6mm) Variandan penangas air.
Adapun bahan–bahan yang akan digunakan adalah standar Kitin, kitosan, dan
Na2HPO4.7H2O , H3PO4,MgSO4, CaCl2,NaOH, HCl,laktosa, bakto pepton, urea,
asam sitrat, natrium sitrat, kertas saring, akuabides, asetonitril, akuades, TFA (Triflouroacetic acid), indikator universal, strainActinomycetesANL-4,Mucor miehei, dan kulit udang.
C. Prosedur Penelitian
1. Pembuatan Kitin
Proses pembuatan kitin dari serbuk kulit udang terdiri atas dua tahap, yaitu: deproteinasi dan demineralisasi (Sari, 2010).
1.1. Deproteinasi
Sebanyak 100 gram sampel ditempatkan dalam bejana tahan asam dan basa yang dilengkapi pengaduk dan termometer, lalu diletakkan dalam penangas air.
Kemudian sampel ditambahkan 1000 mL NaOH 20% dan didiamkan selama 1 jam pada suhu 900C (Pareira, 2004). Setelah itu, dilakukan penyaringan sehingga diperoleh residu dan filtrat. Untuk membuktikan bahwa protein yang ada pada kitin telah dipisahkan pada tahap deproteinasi maka filtrat diuji dengan CuSO4. Protein dengan CuSO4akan membentuk senyawa kompleks berwarna
1.2. Demineralisasi
Kitin hasil deproteinasi dimasukkan dalam bejana tahan asam dan basa yang dilengkapi dengan batang pengaduk dan termometer lalu diletakkan dalam penangas air. Kemudian sampel ditambahkan HCl 1,25 N dengan perbandingan 1:10 (w/v) dan dipanaskan pada penangas selama 1 jam pada suhu 900C. Pada saat penambahan HCl kedalam sampel, terbentuk gas CO2yang berupa
gelembung-gelembung udara, ini menunjukkan bahwa pemisahan mineral terjadi (Pareira, 2004). Setelah itu, dilakukan penyaringan sehingga diperoleh residu dan filtrat. Untuk membuktikan bahwa mineral kalsium berhasil dipisahkan dari kitin melalui demineralisasi, filtrat diuji dengan amonium oksalat. Ion oksalat akan membentuk endapan putih dengan kalsium. Kemudian residunya dicuci dengan akuades sampai pH akuades yaitu pH 5 yang diukur dengan indikator universal. Pencucian dimaksudkan untuk mencegah terjadinya degradasi produk selama proses pengeringan (Sari, 2010). Kemudian residu dikeringkan dalam oven pada suhu 600C selama 24 jam, sehingga diperoleh kitin berwarna kuning kemerahan.
2. Karakterisasi Kitin dengan FTIR
3. Pembuatan Media UntukMucor miehei
3.1 Media Potato Dextrose Agar (PDA) dan PertumbuhanMucor miehei Pada Media PDA
Sebanyak 4,5 g PDA siap pakai dilarutkan dalam 100 ml akuades, diaduk hingga homogen. Kemudian media PDA ini disterilisasi dengan autoclave pada suhu 1210C selama 15 menit. Setelah itu media PDA ini di UV selama 10 menit menggunakanlaminar air flow, maka mediapun siap pakai. Strain jamurMucor mieheiditumbuhkan pada media PDA dan ditunggu kurang lebih 5 hari sampai spora jamur ini tumbuh dan siap dipanen.
3.2 Media Potato Dextrose Liquid (PDL) dan PertumbuhanMucor miehei Pada Media PDL
3.3 Larutan Buffer Sitrat pH 4
Sebanyak 33 ml larutan stok A (asam sitrat 0,1 M) dan 17 ml larutan stok B (sodium sitrat 0,1 M) dilarutkan dalam 100 ml akuades kemudian dicek pH-nya. Ini merupakan buffer sitrat 1 M pH 4.
4. Pembuatan StarterMucor miehei
Substrat yang digunakan adalah kitin yang direbus terlebih dahulu dengan 0,5% NaOH selama satu jam berdasarkan metode Grayet al.(1978). Selanjutnya kitin dibilas dengan akuades, disaring dan dikeringkan.
Sebanyak 1 g substrat kitin dimasukkan dalam Labu Bundar 250 ml, kemudian ditambahkan 0,1gr laktosa, 0,3gr bakto pepton, 1,4gr amonium sulfat, 0,3gr urea, 2gr kalium dihidrogen sulfat, 0,3gr besi (II)sulfat heptahidrat, 0,3gr kalsium klorida dan 0,287gr seng sulfat hepta hidrat, terakhir dilarutkan dalam buffer sitrat pH 4 sampai 100 ml. Selanjutnya campuran diaduk sampai homogen lalu
disterilisasi dalam autoklaf dengan suhu 1210C dan tekanan 2 atm selama 15 menit. Sebanyak 5 ml kultur awal diinokulasikan dalam media kitin dan difermentasi pada 300C denganshaking250 rpm selama 3 - 4 hari (Chahalet al.,2001).
5. Fermentasi Cair Tertutup (Batch) Tahap I denganMucor miehei
2gr kalium dihidrogen sulfat, 0,3gr besi (II)sulfat heptahidrat, 0,3gr kalsium klorida dan 0,287gr seng sulfat hepta hidrat, lalu dilarutkan dalam buffer sitrat pH 4 sampai 50 ml. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalam autoklaf dengan suhu 1210C dan tekanan 2 atm selama 15 menit.
Sebanyak 50 ml starter diinokulasikan dalam media kitin dan difermentasi pada 300C denganshaking250 rpm selama 5 hari
(Chahalet al.,2001).
Sejumlah hasil dari fermentasibatchdipanaskan denganwaterbathpada suhu 700C selama 45 menit. Kemudian dicampurkan dengan 45 ml akuades dengan membiarkan tabung padarotary shakerselama 1 jam pada 200 rpm.
6. Pembuatan Media UntukActinomycetesANL-4
6.1 Media ISP–2
Media ISP–2 terdiri dari 0,4gyeast ekstrak, 0,1gmalt ekstrak, 0,4gdekstrosa, dan
0,2g agar dilarutkan dalam 100 ml air laut steril kemudian diautoklaf. Setelah media sedikit dingin, ditambahkancycloheximide(25μg/mL) dannalidixic acid
(25μg/mL) (Margavey et al., 2004).
6.2 PertumbuhanActinomycetesANL-4 pada Media ISP-2
StrainActinomycetesyang digunakan adalahActinomycetesANL–4 yang telah
berhasil diisolasi dari sedimen mangrove pantai, ciri–ciri strain ini memiliki
miseliumaerialberwarna putih keabuan dan miselium substratnya berwarna krem
keabuan. StrainActinomycetesANL-4 ditumbuhkan dalam media ISP-2. Untuk menghindari kontaminasi jamur dan bakteri ditambahkan 25μg/mL
cycloheximidedan 25μg/mLnalidixic(Amorso dan Clowell, 1998).
6.3 Larutan Mineral Garam
Larutan ini dibuat dari 0,4%(NH4)2SO4, 0,6% NaCl, 0,1%K2HPO4, 0,01% MgSO4, 0,01% CaCl2, dan 1% kitin dilarutkan dalam 100 ml air laut steril.
6.4 Larutan Buffer Pospat pH 7
Sebanyak 0,964g NaH2PO4.H2O dan 0.8078g Na2HPO4.7H2O dilarutkan dalam
100 ml akuades kemudian dicek pH-nya. Ditambahkan NaOH atau H3PO4bila
dibutuhkan. Ini merupakan buffer pospat pH 7 1 M.
7. Persiapan InokulumActinomycetesANL-4
Spora kultur 7–9 hari dipisahkan dan dimasukkan dalam tabung Erlenmayer
250 ml berisi 100 ml larutan mineral garam. Tabung diletakkan pada shaker dengan kecepatan 175 rpm pada suhu 300C selama 5 hari.
8. Fermentasi Cair Sistem Tertutup (Batch) Tahap II denganActinomycetes ANL-4
Substrat yang digunakan adalah substrat hasil sisa fermentasi pertama dari
fermentasi pertama denganMucor miehei. Sebelum digunakan substrat hasil sisa
fermentasi dibilas dengan aquades sampai pH netral, lalu disaring dan
dikeringkan.
Sebanyak substrat hasil sisa fermentasi dimasukkan dalam Erlenmayer250 mL. Kemudian dilembabkan dengan 50 mllarutan mineral garam yang terdiri dari 0,4%(NH4)2SO4, 0,6% NaCl, 0,1%KH2PO4, 0,01% MgSO4, 0,01 % CaCl2. pH
Sejumlah hasil dari fermentasibatchdipanaskan denganwaterbathpada suhu 700C selama 45 menit. Kemudian dicampurkan dengan 45 ml akuades dengan membiarkan tabung padarotary shakerselama 1 jam pada 200 rpm.
Campuran disaring menggunakan kain katun dan filtrat di sentrifugasi dengan kecepatan 10.000 rpm selama 20 menit pada suhu 40C. Semua filtrat yang diperoleh dibekukan di dalam pendinginfrezeerselama 24 jam, kemudian diliofilisasi dengan menggunakanfrezee dryersampai terbentuk kristal glukosamin.
9. Karakterisasi Glukosamin
9.1 Analisis dengan FTIR
Glukosamin dibuat pelet dengan KBr, kemudian dilakukanscanningpada daerah frekuensi antara 4000 cm-1sampai dengan 400 cm-1. Hasil yang didapat
dibandingkan dengan hasil pembacaan glukosamin standar.
9.2 Analisis dengan HPLC
9.2.1 Persiapan Standar dan Sampel Glukosamin
• Pembuatan Standar glukosamin
• Pembuatan Sampel Glukosamin
Dibuat larutan stok yang terdiri dari 1 mLfenilisothiosianatedan 9 mL metanol dalam labu ukur 10 mL hingga batas ukur. Kemudian dibuat sampel glukosamin dengan dilarutkan 10 mg sampel dalam larutan CH3COONa 0,1 M pada labu ukur
10 mL. Dimasukan 1 mL sampel glukosamin hasil isolasi ke dalam labu ukur 10 mL, kemudian ditambahkan 80 μ L stokfenilisothiosianatedan 6 mL metanol
serta akuades hingga tanda batas labu ukur. Selanjutnya diambil 5 mL,
dipanaskan selama ± 15 menit pada suhu 80°C lalu didinginkan pada suhu ruang. Larutan ini diekstraksi dengan 5 ml eter untuk membebaskanfenilisohtiosianate
yang tidak bereaksi. Lapisan air dibaca dengan HPLC-ELSD (Evaporative Light Scattering Detection) menggunakan kolom C18.
9.2.2 Pemeriksaan Sampel
Masukan 5 µL standar dan sampel glukosamin masing-masing ke dalam botol vial kemudian diletakkan dalam rak yang selanjutnya akan diinjeksi. Kondisi HPLC-ELSD (Evaporative Light Scattering Detection) menggunakan kolom C18, fasa gerak adalah asetonitril/H2O (65/35) yang merupakan campuran pelarut polar, laju
alir 0,8 mL/menit, laju gas Nitrogen 1,6 L/menit, suhu nebulisasi 400C, suhu evaporasi 300C, dan waktu run 6 menit. Pemeriksaan sampel dan standar glukosamin ini mengacu pada Jacyno (2004) yaitu menggunakan kolom
karbohidrat ES yang bersifat nonpolar, fasa gerak adalah asetonitril/H2O (65/35)
A. Simpulan
Berdasarkan hasil yang diperoleh dari penelitian ini, maka dapat disimpulkan bahwa : 1. Spektrum hasil karakterisasi menggunakan FTIR pada kedua sampel memiliki
pita serapan yang relatif sama dibandingkan dengan glukosamin standar, hal ini menandakan bahwa kedua sampel hasil isolasi merupakan glukosamin..
2. Kromatogram hasil analisis menggunakan HPLC pada kedua sampel dibandingkan dengan glukosamin standar menunjukkan puncak yang relatif sama pada rentang waktu retensi 2-4, hal ini menandakan bahwa kedua sampel hasil isolasi merupakan glukosamin.
3. Mucor miehei dan Actinomycetes ANL-4 memiliki potensi untuk mendegradasi kitin menjadi glukosamin dengan menggunakan fermentasi kitin secara bertahap, glukosamin yang dihasilkan dari fermentasi bertahap ini sebanyak 9,84 g atau sekitar 98 %.
B. Saran
Dari hasil penelitian yang diperoleh, maka disarankan :
1. Mencari kondisi optimum untuk fermentasi kitin sehingga dihasilkan glukosamin paling banyak.
2. Untuk mempertajam spektrum hasil karakterisasi FTIR pada sampel diusahakan sampel dalam keadaan benar-benar kering atau bebas dari kandungan air, hal ini dapat dilakukan denganfrezeedrysehari sebelum karakterisasi dan penyimpanan sampel didalam desikator.
ANL-4 UNTUK PEMBUATAN GLUKOSAMIN
Oleh
Siti Oktavia Rumapea
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar
SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
(Hasil Penelitian )
Oleh
Siti Oktavia Rumapea
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
PENDIDIKAN FORMAL (SD s.d S1)
PENGALAMAN ORGANISASI
BEASISWA YANG PERNAH DIDAPAT
PENGALAMAN KERJA
Tahun 1996–2002 : SDN 3 Bumi Agung, Pesawaran
Tahun 2002–2005 : SMPN 1 Natar, Lampung Selatan
Tahun 2005–2008 : SMAN 1 Natar, Lampung Selatan
Tahun 2008–2012 : Jurusan Kimia FMIPA, Universitas Lampung
-Tahun 2009-2010 : BI Tahun 2011-2012 : BBM
NAMA
: Siti Oktavia Rumapea
Tempat, Tanggal Lahir : Medan, 10 Oktober 1991
Jenis Kelamin : Perempuan
Agama : Khatolik
Status Penikahan : Belum menikah
Tinggi / Berat Badan : 150 cm/ 47 Kg
NPM : 0817011058
Nama Orang Tua : Viktor Rumapea
Kewarganegaraan : Indonesia
Alamat Rumah Telp.
: Jl. Lintas Sumatra Km.37 Kec. Tegineneng Kab. Pesawaran, Lampung
Alamat Saat Ini Telp.
: Jl. Lintas Sumatra Km.37 Kec. Tegineneng Kab. Pesawaran, Lampung
No. HP : 085841439188
Tgl. Wisuda : 19 Desember 2011
IPK : 3,
Nilai EPT (TOEFL) : 450
E-Mail : oktaviarumapea@yahoo.co.id
ASISTEN PRAKTIKUM YANG PERNAH DIJABAT
HOBI
PELATIHAN YANG PERNAH DIIKUTI
Uji Efektivitas Fermentasi Kitin Bertahap MenggunakanMucor mieheiDanActinomycetesANL-4 Untuk Pembuatan Glukosamin
Kimia Medic untuk Fakultas Kedokteran TA 2010/2011 Kimia Dasar I untuk Fakultas Pertanian TA 2010/2011 Sains Dasar untuk Fakultas MIPA TA 2011/2012
Kuliner
-Tgl. UP : 26 Maret 2012
Tgl. HP : 11 Oktober 2012
kita adalah untuk mencoba, karena didalam
mencoba itulah kita menemukan dan belajar
membangun kesempatan untuk berhasil
(Mario Teguh).
Banyak kegagalan dalam hidup
ini dikarenakan orang-orang tidak
menyadari betapa dekatnya
mereka dengan keberhasilan saat
mereka menyerah. (Thomas Alva
Edison)
Nama : Siti Oktavia Rumapea Nomor Pokok Mahasiswa : 0817011058
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Dra. Aspita Laila, M.S. Prof. Dr. John Hendri, M.S.
NIP 196009091988112001 NIP 195810211987031001
2. Ketua Jurusan
1. Tim Penguji
Ketua :Dra. Aspita Laila, M.S. ………
Sekretaris :Prof. Dr. John Hendri, M.S. ………
Penguji
Bukan Pembimbing :Heri Satria, M. Si. ………...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Dr. Suharso, Ph. D NIP 196905301995121001
Kupersembahkan karya kecil ini sebagai wujud tanda
cinta, kasih, bakti dan tanggung jawabku
Kepada
Orang-orang yang aku sayangi:
Bapak (Viktor Rumapea) dan Mama (Esmoin
Sinaga) yang telah berjuang dan selalu berdoa demi
keberhasilan ku.
Adik-adik ku ( Diego Rumapea, Rosa Rumapea,
Putri Rumapea, Petrus Rumapea, Roberto Rumapea,
dan Imanuel Rumapea ) yang selalu jadi pompa
semangat untukku.
Teman-teman yang selalu menemani, menguatkan dan
berjuang bersamaku,
Guru-guru ku yang senantiasa membimbing dan
membagi ilmunya untukku,
Penulis dilahirkan di Medan, pada tanggal 10 Oktober 1991, yang merupakan buah hati dari pasangan bapak Viktor Rumapea dan ibu Esmoin Sinaga.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 3 Bumi Agung pada tahun 2002, dan Sekolah Lanjutan Tingkat Pertama di SLTP Negeri 1 Natar pada tahun 2005. Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 1 Natar pada tahun 2008. Pada tahun yang sama penulis diterima sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui Seleksi Penerimaan Mahasiswa Baru (SPMB).
Puji dan Syukur Penulis panjatkan kehadirat Tuhan Yesus Kristus yang telah mencurahkan kasih dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul :
“UJI EFEKTIVITAS FERMENTASI BERTAHAP MENGGUNAKANMUCOR MIEHEIDANACTINOMYCETESANL-4 UNTUK PEMBUATAN
GLUKOSAMIN”
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang tulus kepada :
1. Dra. Aspita Laila, M.S. selaku pembimbing Utama yang telah membimbing penulis dengan sabar, memberikan banyak ilmu pengetahuan, saran, dan arahan selama penyusunan skripsi ini. Terutama untuk perhatiannya yang seperti ibu sendiri sehingga penulis dapat menyelesaikan skripsi ini.
2. Prof. Dr. John Hendri M.S selaku pembimbing Kedua yang telah membimbing penulis dengan sabar, memberikan banyak ilmu pengetahuan, saran, arahan, dan motivasi selama penyusunan skripsi ini. Terutama motivasi yang diberikan sehingga penulis dapat menyelesaikan skripsi ini.
3. Heri Satria, M. Si. selaku Pembahas yang telah memberikan banyak ilmu pengetahuan, arahan, dan saran demi terselesainya skripsi ini.
4. Prof. Dr. Tati Suhartati selaku pembimbing akademik atas saran dan dorongan semangat bagi penulis selama ini.
7. Seluruh dosen dan staf administrasi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung yang telah memberikan banyak ilmu pengetahuan dan motivasi sehingga penulis dapat menyelesaikan skripsi ini.
8. Bapak Viktor Rumapea dan Mama Esmoin Sinaga atas semua curahan cinta yang tak akan pernah kering untukku, keikhlasan merawat dan menjagaku, doa tulus yang tiada henti, dan perhatian yang takkan pernah habis. Selalu
memberikan yang terbaik untukku ditengah keterbatasannya. Perjuangannya adalah semangatku untuk selalu menjadi yang terbaik bagi mereka.
9. Adik-adikku yang selalu dihati, Diego, Rosa, Putri, Petrus, Roberto, Imanuel yang selalu menjadi pompa semangatku, inspirasiku dan aku akan menjaga kalian seumur hidupku.
10. Opung, Maktua, Paktua, Tulang, Nantulang, Amangboru, Namboru yang telah memberikan perhatian, semangat, nasihat, motivasi dan doanya untu ku.
11. Sepupuku, Kak Len, Kak Saur, Bang Bakti, Bang Chandra, Bang Ales, Juni atas canda, motivasi dan kebersamaanya selama ini.
12. Mba Ipung Miranti Sari, S.Si., Mba Ika Purnama Sari, S. Si, Mba Lisa Eka Wahyuni, S. Si., yang selalu membantu dan memberikan arahan pada penulis dalam menyelesaikan skripsi ini.
Kak Gunadi S. Si., Kak Rio, Kak Alex, Kak Septian, Kak Yanti S. Si., Mba Revi S. Si., Mba Tutik S. Si, Kak Lince S. Si., serta Paman dan Mas Nomo atas segala bantuannya kepada penulis selama penulis melakukan penelitian.
14. Sahabat terbaikku yang selalu menemaniku dan menerima semua kekurangan ku dari awal masuk perkuliahan, Qie-Qie doank(Rizki Amalia) dan Pupud (Putri Febriani).
15. Sahabat seperjuanganku, Riki yang selalu membantuku disaat-saat genting, Puji atas kerjasamanya selama penelitian, Raffel atas bantuannya
16. Sahabat-sahabat Shake And BC, Riki, Raffel, Puji, Ricardo, Michel, Qie-qie, atas kebersamaan, berbagi canda dan tawanya bersamaku.
17. Sahabat terbaik dimasa sekolahku, Dita, Uly, Mihi (Desti), Yulia, Nita, Melza atas kebersamaan dan semangat yang tiada henti.
18. Teman- teman kimia 08: Qie-qie, Pupud, Puji, Riki, Raffel, Richardo, Michel, Mba Sri, Ani S. Si., Eli S. Si., Albert S. Si., Ramli S. Si., Mifta, Dewa, Rudi, Robby, Shoffa, Adek, Ramdhan, Putu S. Si., Ria S. Si., Chandra, Idrus, Aan, Leny, Eny, Evi, Wanti, Dewi, Sobari, Nita, Nanda, Ayu, Ruzky, Majid, Novi, Amin, Nuro, Arif, TB, Retno, Vivi, Dipa, Margareth, Arif R H, Mutiara, Dwi, Reina, Diana, atas kebersamaan dan persaudaraan yang terjalin selama ini. 19. all chemist ’05, ’06, ’07,’09,’10, ’11 dan ‘12atas kebersamaan dan
persaudaraan yang terjalin selama ini.
22. Almamaterku tercinta.
Semoga Tuhan membalas segala budi baik yang telah diberikan. Akhir kata, Penulis sangat menyadari skripsi ini masih jauh dari kesempurnaan, namun Penulis berharap semoga skripsi ini dapat bermanfaat bagi diri Penulis secara pribadi maupun mereka yang telah menyediakan waktu dan sempat untuk membacanya.
Bandar Lampung, November 2012 Penulis