EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila
PADA IKAN LELE DUMBO Clarias sp.
EKA HIDAYATHUS SHOLIKHAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN
BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK
PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, November 2009
RINGKASAN
EKA HIDAYATHUS SHOLIKHAH. Efektivitas Campuran Meniran
Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo
Clarias sp. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan TATAG
BUDIARDI.
Ikan lele Clarias sp. merupakan ikan yang hidup di perairan tawar dan sudah dibudidayakan secara komersial oleh masyarakat Indonesia terutama di Pulau Jawa. Budidaya ikan lele berkembang pesat dikarenakan ikan ini mempunyai beberapa kelebihan, yaitu dapat dibudidayakan di lahan dan sumber air yang terbatas dengan padat tebar tinggi, mempunyai pertumbuhan yang cepat, teknologi budidaya relatif mudah dikuasai oleh masyarakat, pemasarannya relatif mudah dan mempunyai nilai ekonomis yang tinggi. Namun demikian pada budidaya ikan lele sering ditemukan penyakit MAS (Motile Aeromonad Septicaemia) yang disebabkan oleh bakteri Aeromonas hydrophila. Penggunaan bahan alami daun meniran Phyllanthus niruri dan bawang putih Allium sativum
diharapkan dapat menjadi alternatif pengganti antibiotik dalam mengobati penyakit yang disebabkan oleh bakteri. Oleh karena itu penelitian ini bertujuan untuk menganalisis efektivitas penggunaan campuran ekstrak daun meniran dan bawang putih dalam pakan untuk pengendalian infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo.
Penelitian ini terdiri dari dua tahap yaitu uji LD50 dan uji in vivo. Uji LD50 menghasilkan konsentrasi bakteri A. hydrophila 108 cfu/ml dapat mematikan 50% populasi ikan uji dalam waktu satu minggu. Dosis yang digunakan adalah meniran 5 ppt dan bawang putih 20 ppt untuk pencegahan, sedangkan dosis untuk pengobatan adalah meniran 10 ppt dan bawang putih 40 ppt.
Hasil uji in vivo menunjukkan respon makan perlakuan pencegahan yang lebih baik dibandingkan perlakuan pengobatan dan kontrol positif. Pertambahan bobot rata-rata perlakuan pencegahan sebesar 7,2995 ± 1,00% dan pengobatan sebesar 6,2303 ± 1,81%, kontrol positif sebesar 1,8732 ± 0,58. Rata-rata skor gejala klinis perlakuan pencegahan lebih kecil jika dibandingkan perlakuan pengobatan dan kontrol positif. Mortalitas perlakuan pencegahan sebesar 41,67 ± 21,52%, pengobatan sebesar 54,17 ± 20,97 dan kontrol positif sebesar 66,67 ± 23,57. Pengamatan organ dalam menunjukkan perlakuan pencegahan normal, mendekati kontrol negatif, sedangkan perlakuan pengobatan terjadi perubahan warna organ dalam, mendekati kontrol negatif. Kualitas air yang terukur sebelum dan setelah uji in vivo masih termasuk dalam kisaran toleransi ikan lele dumbo.
EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila
PADA IKAN LELE DUMBO Clarias sp.
EKA HIDAYATHUS SHOLIKHAH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Efektivitas Campuran Meniran Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp
Nama Mahasiswa : Eka Hidayathus Sholikhah Nomor Pokok : C14054257
Disetujui Komisi Pembimbing
Dr. Dinamella Wahjuningrum Dr. Tatag Budiardi NIP. 19700521 199903 2 001 NIP. 19631002 199702 1 001
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya NIP. 19610410 198601 1 002
KATA PENGANTAR
Puji dan syukur Penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Skripsi ini merupakan hasil penelitian yang dilaksanakan sejak bulan Maret 2009 sampai dengan
Agustus 2009, dengan judul “Efektivitas Campuran Meniran Phyllanthus niruri
dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Orangtua, adikku, dan keluarga besarku tercinta atas doa dan dukungannya selama penulis menyelesaikan skripsi ini
2. Ibu Dr. Dinamella Wahjuningrum dan Bapak Dr. Tatag Budiardi selaku pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis sampai penyelesaian skripsi
3. Ibu Ir. Mia Setiawati, M.Si selaku dosen tamu yang memberikan arahan untuk kesempurnaan skripsi ini
4. Pak Ranta, Bang Abe, Pak Aam, Pak Endang, Pak Henda, Mas Khotib, Pak Mar, Mbak Yuli, Kang Asep atas kerjasamanya yang baik dalam menyelesaikan skripsi
5. Temen-teman BDP’42, LKI Crews (Anet, Majek, Dewi, Mama Uy, Teteh, Tante, Icha, Tyas, Sopi, Evan, Arif dan Wika) terimakasih kalian selalu ada buatku, (Dindong, Nadew, Bunda, Jijah, Vika, Pay, Mb nita, Jeje, Angga, Dowe, Gawang) atas bantuan dan semangat yang telah kalian berikan.
BDP’41 (mb Ayu, mas Agung, mb Dewi, teh Windu, mas Dodi), BDP’43 dan
’44 (Tya, Ide, Hendar, Bachtiar), S2 dan S3 (Bu Sury, Bu Muly, Pak Narto,
Bu Ibar, Bu Ayu, Pak Henky) terimakasih atas bantuannya dan kerjasamanya. Ekyers (Ita, Iin, Danto, Arin, Vita, Vivi, Sabti, Itha, Betari, Bani, Ayu, Oci, Mbambel) keceriaan dan uluran tangan kalian selama ini membuatku semangat.
Semoga karya ilmiah ini bermanfaat khususnya bagi penulis dan juga semua pihak yang membutuhkan. Terima kasih.
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Rembang tanggal 3 Oktober 1986 dari Ayah Suroto dan Ibu Hamidah. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan formal yang dilalui penulis adalah TK Islam Bhakti Lasem dan lulus tahun 1993, kemudian penulis melanjutkan pendidikan di SDN Soditan 01 Lasem dan lulus tahun 1999. Penulis melanjutkan pendidikan di SMPN 1 Lasem dan lulus tahun 2002, serta melanjutkan pendidikan di SMAN 1 Rembang dan lulus pada tahun 2005. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
DAFTAR ISI
3.4.4 Gejala Klinis dan Pengukuran Diameter Klinis ... 21
3.4.5 Pengamatan Organ Dalam ... 22
3.4.6 Kualitas Air ... 22
IV. HASIL DAN PEMBAHASAN ... 23
4.1 Hasil ... 23
4.1.1 Identifikasi Bakteri Uji ... 23
4.1.3.5 Pemeriksaan Organ Dalam Ikan Uji... 33
4.1.3.6 Kualitas Air ... 34
4.2 Pembahasan ... 35
V. KESIMPULAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
1. Komposisi kimia bawang putih per 100 gram ... 6
2. Beberapa penelitian yang telah dilakukan untuk melihat efektifitas bawang putih ... 7
3. Efek pH terhadap organisme budidaya ... 13
4. Perhitungan skor kelainan klinis ... 21
5. Hasil identifikasi bakteri A. hydrophila ... 23
6. Pengamatan organ dalam ikan lele dumbo ... 33
EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila
PADA IKAN LELE DUMBO Clarias sp.
EKA HIDAYATHUS SHOLIKHAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN
BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK
PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, November 2009
RINGKASAN
EKA HIDAYATHUS SHOLIKHAH. Efektivitas Campuran Meniran
Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo
Clarias sp. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan TATAG
BUDIARDI.
Ikan lele Clarias sp. merupakan ikan yang hidup di perairan tawar dan sudah dibudidayakan secara komersial oleh masyarakat Indonesia terutama di Pulau Jawa. Budidaya ikan lele berkembang pesat dikarenakan ikan ini mempunyai beberapa kelebihan, yaitu dapat dibudidayakan di lahan dan sumber air yang terbatas dengan padat tebar tinggi, mempunyai pertumbuhan yang cepat, teknologi budidaya relatif mudah dikuasai oleh masyarakat, pemasarannya relatif mudah dan mempunyai nilai ekonomis yang tinggi. Namun demikian pada budidaya ikan lele sering ditemukan penyakit MAS (Motile Aeromonad Septicaemia) yang disebabkan oleh bakteri Aeromonas hydrophila. Penggunaan bahan alami daun meniran Phyllanthus niruri dan bawang putih Allium sativum
diharapkan dapat menjadi alternatif pengganti antibiotik dalam mengobati penyakit yang disebabkan oleh bakteri. Oleh karena itu penelitian ini bertujuan untuk menganalisis efektivitas penggunaan campuran ekstrak daun meniran dan bawang putih dalam pakan untuk pengendalian infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo.
Penelitian ini terdiri dari dua tahap yaitu uji LD50 dan uji in vivo. Uji LD50 menghasilkan konsentrasi bakteri A. hydrophila 108 cfu/ml dapat mematikan 50% populasi ikan uji dalam waktu satu minggu. Dosis yang digunakan adalah meniran 5 ppt dan bawang putih 20 ppt untuk pencegahan, sedangkan dosis untuk pengobatan adalah meniran 10 ppt dan bawang putih 40 ppt.
Hasil uji in vivo menunjukkan respon makan perlakuan pencegahan yang lebih baik dibandingkan perlakuan pengobatan dan kontrol positif. Pertambahan bobot rata-rata perlakuan pencegahan sebesar 7,2995 ± 1,00% dan pengobatan sebesar 6,2303 ± 1,81%, kontrol positif sebesar 1,8732 ± 0,58. Rata-rata skor gejala klinis perlakuan pencegahan lebih kecil jika dibandingkan perlakuan pengobatan dan kontrol positif. Mortalitas perlakuan pencegahan sebesar 41,67 ± 21,52%, pengobatan sebesar 54,17 ± 20,97 dan kontrol positif sebesar 66,67 ± 23,57. Pengamatan organ dalam menunjukkan perlakuan pencegahan normal, mendekati kontrol negatif, sedangkan perlakuan pengobatan terjadi perubahan warna organ dalam, mendekati kontrol negatif. Kualitas air yang terukur sebelum dan setelah uji in vivo masih termasuk dalam kisaran toleransi ikan lele dumbo.
EFEKTIVITAS CAMPURAN MENIRAN Phyllanthus niruri DAN BAWANG PUTIH Allium sativum DALAM PAKAN UNTUK PENGENDALIAN INFEKSI BAKTERI Aeromonas hydrophila
PADA IKAN LELE DUMBO Clarias sp.
EKA HIDAYATHUS SHOLIKHAH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Efektivitas Campuran Meniran Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp
Nama Mahasiswa : Eka Hidayathus Sholikhah Nomor Pokok : C14054257
Disetujui Komisi Pembimbing
Dr. Dinamella Wahjuningrum Dr. Tatag Budiardi NIP. 19700521 199903 2 001 NIP. 19631002 199702 1 001
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya NIP. 19610410 198601 1 002
KATA PENGANTAR
Puji dan syukur Penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Skripsi ini merupakan hasil penelitian yang dilaksanakan sejak bulan Maret 2009 sampai dengan
Agustus 2009, dengan judul “Efektivitas Campuran Meniran Phyllanthus niruri
dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Orangtua, adikku, dan keluarga besarku tercinta atas doa dan dukungannya selama penulis menyelesaikan skripsi ini
2. Ibu Dr. Dinamella Wahjuningrum dan Bapak Dr. Tatag Budiardi selaku pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis sampai penyelesaian skripsi
3. Ibu Ir. Mia Setiawati, M.Si selaku dosen tamu yang memberikan arahan untuk kesempurnaan skripsi ini
4. Pak Ranta, Bang Abe, Pak Aam, Pak Endang, Pak Henda, Mas Khotib, Pak Mar, Mbak Yuli, Kang Asep atas kerjasamanya yang baik dalam menyelesaikan skripsi
5. Temen-teman BDP’42, LKI Crews (Anet, Majek, Dewi, Mama Uy, Teteh, Tante, Icha, Tyas, Sopi, Evan, Arif dan Wika) terimakasih kalian selalu ada buatku, (Dindong, Nadew, Bunda, Jijah, Vika, Pay, Mb nita, Jeje, Angga, Dowe, Gawang) atas bantuan dan semangat yang telah kalian berikan.
BDP’41 (mb Ayu, mas Agung, mb Dewi, teh Windu, mas Dodi), BDP’43 dan
’44 (Tya, Ide, Hendar, Bachtiar), S2 dan S3 (Bu Sury, Bu Muly, Pak Narto,
Bu Ibar, Bu Ayu, Pak Henky) terimakasih atas bantuannya dan kerjasamanya. Ekyers (Ita, Iin, Danto, Arin, Vita, Vivi, Sabti, Itha, Betari, Bani, Ayu, Oci, Mbambel) keceriaan dan uluran tangan kalian selama ini membuatku semangat.
Semoga karya ilmiah ini bermanfaat khususnya bagi penulis dan juga semua pihak yang membutuhkan. Terima kasih.
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Rembang tanggal 3 Oktober 1986 dari Ayah Suroto dan Ibu Hamidah. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan formal yang dilalui penulis adalah TK Islam Bhakti Lasem dan lulus tahun 1993, kemudian penulis melanjutkan pendidikan di SDN Soditan 01 Lasem dan lulus tahun 1999. Penulis melanjutkan pendidikan di SMPN 1 Lasem dan lulus tahun 2002, serta melanjutkan pendidikan di SMAN 1 Rembang dan lulus pada tahun 2005. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
DAFTAR ISI
3.4.4 Gejala Klinis dan Pengukuran Diameter Klinis ... 21
3.4.5 Pengamatan Organ Dalam ... 22
3.4.6 Kualitas Air ... 22
IV. HASIL DAN PEMBAHASAN ... 23
4.1 Hasil ... 23
4.1.1 Identifikasi Bakteri Uji ... 23
4.1.3.5 Pemeriksaan Organ Dalam Ikan Uji... 33
4.1.3.6 Kualitas Air ... 34
4.2 Pembahasan ... 35
V. KESIMPULAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
1. Komposisi kimia bawang putih per 100 gram ... 6
2. Beberapa penelitian yang telah dilakukan untuk melihat efektifitas bawang putih ... 7
3. Efek pH terhadap organisme budidaya ... 13
4. Perhitungan skor kelainan klinis ... 21
5. Hasil identifikasi bakteri A. hydrophila ... 23
6. Pengamatan organ dalam ikan lele dumbo ... 33
DAFTAR GAMBAR
5. Respon makan ikan lele dumbo selama perlakuan... 24
6. Pertambahan bobot rata-rata ikan lele dumbo Clarias sp. (%) selama perlakuan... 25
7. Akumulasi mortalitas ikan lele dumbo Clarias sp. (%) setelah penginfeksian bakteri A. hydrophila selama perlakuan ... 26
8. Ikan lele perlakuan kontrol negatif tidak mengalami kelainan klinis hingga akhir perlakuan... 27
9. Ikan lele mengalami kelainan klinis berupa radang pada daerah bekas suntikan pada jam ke-7... 27
10. Ikan lele perlakuan kontrol positif mengalami kematian dengan kelainan klinis berupa radang, mata menonjol dan buta, sirip mengalami hiperemia pada hari ke-1 setelah penginfeksian bakteri A. hydrophila... 28
11. Ikan lele perlakuan kontrol positif mengalami kelainan klinis berupa hemoragi pada hari ke-1 setelah penginfeksian bakteri A. hydrophila... 28
12. Ikan lele perlakuan kontrol positif mengalami kelainan klinis berupa tukak pada hari ke-3 setelah penginfeksian bakteri A.hydrophila... 29
13. Ikan lele perlakuan kontrol positif mengalami kelainan klinis berupa tukak pada hari ke-6 setelah penginfeksian bakteri A.hydrophila... 29
14. Ikan lele perlakuan kontrol positif mengalami penyembuhan tukak pada hari ke-9 setelah penginfeksian bakteri A. hydrophila... 29
15. Ikan lele perlakuan pengobatan mengalami kelainan klinis berupa hemoragi pada hari ke-1 setelah penginfeksian bakteri A.hydrophila... 30
16. Ikan lele perlakuan pengobatan mengalami kelainan klinis berupa tukak pada hari ke-3 setelah penginfeksian bakteri A.hydrophila... 30
17. Ikan lele perlakuan pengobatan mengalami penyembuhan tukak pada hari ke-9 setelah penginfeksian bakteri A.hydrophila ...30
18. Ikan lele perlakuan pencegahan mengalami kelainan klinis berupa radang pada hari ke-1 setelah penginfeksian bakteri A.hydrophila... 31
19. Ikan lele perlakuan pencegahan mengalami kelainan klinis berupa tukak pada hari ke-3 setelah penginfeksian bakteri A.hydrophila... 31
DAFTAR LAMPIRAN
Halaman 1. Penyiapan media bakteri Aeromonas hydrophila ... 48 2. Perhitungan nilai LD50... 49 3. Bobot tubuh rata-rata ikan lele awal, tengah dan akhir perlakuan ... 50 4. Pertambahan bobot rata-rata ikan selama perlakuan ... 51 5. Mortalitas ikan lele selama perlakuan ... 52 6. Kualitas air selama perlakuan ... 53 7. Kelainan klinis dan diameter kelainan klinis ikan lele kontrol positif
setelah diinfeksi bakteri A. hydrophila……….. 55
8. Kelainan klinis dan diameter kelainan klinis ikan lele perlakuan
pencegahan setelah diinfeksi bakteri A. hydrophila……….. 56
9. Kelainan klinis dan diameter kelainan klinis ikan lele perlakuan
pengobatan setelah diinfeksi bakteri A. hydrophila………... 57 10. Skor rata-rata kelainan klinis ikan lele kontrol positif setelah diinfeksi
bakteri A. hydrophila………. 58 11. Skor rata-rata kelainan klinis ikan lele perlakuan pencegahan setelah
diinfeksi bakteri A. hydrophila……….. 59
12. Skor rata-rata kelainan klinis ikan lele perlakuan pengobatan setelah
I.PENDAHULUAN
1.1 Latar Belakang
Ikan lele Clarias sp. merupakan ikan yang hidup di perairan tawar yang sudah dibudidayakan secara komersial oleh masyarakat Indonesia terutama di Pulau Jawa. Budidaya lele berkembang pesat dikarenakan ikan lele mempunyai beberapa kelebihan, yaitu dapat dibudidayakan di lahan dan sumber air yang terbatas dengan padat tebar tinggi, mempunyai pertumbuhan yang cepat, teknologi budidaya relatif mudah dikuasai oleh masyarakat, pemasarannya relatif mudah dan modal usaha yang dibutuhkan relatif rendah serta mempunyai nilai ekonomis yang tinggi (Anonim, 2003). Menurut Mahyuddin (2007), produksi lele ukuran konsumsi secara nasional mengalami kenaikan sebesar 18,3% per tahun dari 24.991 ton (1999) menjadi 57.740 ton (2003). Revitalisasi lele sampai dengan akhir tahun 2009 ditargetkan mencapai produksi 175.000 ton atau meningkat rata-rata 21,64% per tahun. Untuk daerah Jabotabek, konsumsi ikan lele mencapai 100 ton lele per hari (Anonim, 2007). Hal ini mengakibatkan pemeliharaan ikan lele dikembangkan secara intensif.
Peningkatan produksi ikan lele secara intensif seringkali mengalami resiko, salah satunya adalah timbulnya penyakit. Penyakit yang biasanya menyerang ikan lele adalah penyakit MAS (Motile Aeromonad Septicemia). Penyakit ini, diakibatkan oleh infeksi bakteri Aeromonas hydrophila (Roberts, 1993 dalam Woo et al., 2002). Serangan bakteri ini mematikan ikan lele Clarias
sp. di Jawa Barat dan Jawa Timur, setelah 3 bulan penyakit ini muncul di Indonesia (Oswald dan Hulse, 1982) dengan jangka waktu antara 24-48 jam dalam kondisi akut (Paperna, 1996).
ikan dan akan membahayakan kesehatan konsumen apabila dikonsumsi. Oleh karena itu dibutuhkan alternatif penanggulangan penyakit MAS yang efektif dan tidak menimbulkan efek yang negatif bagi pembudidaya maupun konsumen serta ramah lingkungan.
Indonesia merupakan negara agraris yang memiliki iklim tropis dengan kekayaan alam yang luar biasa dan beragam jenis tanaman terdapat di negara ini. Salah satunya adalah tanaman jenis herba, yaitu tanaman yang berkhasiat obat. Contoh tanaman yang termasuk didalamnya adalah meniran dan bawang putih.
Meniran Phyllanthus niruri merupakan jenis tanaman obat yang dapat bermanfaat untuk menurunkan panas, obat batuk, radang, batu ginjal, susah buang air kecil, disentri, sakit ayan, hepatitis, rematik. Selain itu meniran dapat mencegah berbagai macam infeksi virus dan bakteri serta mendorong sistem kekebalan tubuh. Hal ini dikarenakan terdapat kandungan flavonoid, alkaloid, tanin, dan vitamin C (Triarsari, 2009).
Bawang putih mempunyai zat aktif yaitu alisin dan minyak atsiri yang diduga sebagai antibakteri untuk menekan bakteri yang merugikan, dengan demikian akan memberikan peluang pertumbuhan mikroorganisme yang menguntungkan di dalam saluran pencernaan secara optimum.
Berdasarkan hasil penelitian Ayuningtyas (2009), ekstrak daun meniran 5 ppt dan bawang putih 20 ppt dapat menghambat pertumbuhan bakteri A. hydrophila pada ikan lele dumbo dengan metode injeksi. Dalam penerapan di lapangan, metode tersebut kurang efisien. Untuk itu diperlukan penelitian untuk menguji keefektifan ekstrak daun meniran dan bawang putih sebagai bahan antibakteri yang diberikan dengan metode pencampuran lewat pakan.
1.2 Tujuan
II. TINJAUAN PUSTAKA
2.1 Ikan Lele Dumbo (Clarias sp.)
Ikan lele merupakan ikan yang hidup di perairan tawar. Klasifikasi ikan lele dumbo menurut Saanin (1989) adalah sebagai berikut
Kingdom : Animalia Filum : Chordata Kelas : Pisces Subkelas : Telestoi Ordo : Ostariophysi Subordo : Siluroidae Famili : Clariidae Genus : Clarias
Spesies : Clarias sp.
Gambar 1. Ikan lele Clarias sp.
Menurut Khairuman dan Amri (2002), kualitas air yang dianggap baik untuk kehidupan lele adalah perairan dengan suhu 20-30°C, oksigen terlarut (DO) minimum 3 mg/l, derajat keasaman (pH) 6,5-8, kandungan karbondioksida (CO2) kurang dari 15 ppm, NH3 sebesar 0,05 mg/l, NO2 sebesar 0,25 mg/l dan NO3 sebesar 250 mg/l, serta konsumsi ammonia total maksimum 1 mg/l.
Ikan lele bersifat nokturnal yaitu aktif pada malam hari atau lebih menyukai tempat yang gelap. Pada siang hari ikan lele lebih suka berdiam di dalam lubang-lubang atau tempat aliran air yang tenang. Oleh karena itu, ikan lele aktif mencari makan pada malam hari. Ikan lele bersifat karnivora (pemakan daging) ikan lele juga memakan sisa-sisa bahan organik yang membusuk dan kotoran manusia (Suyanto, 2006).
2.2 Bawang Putih (Allium sativum)
Bawang putih (Allium sativum) adalah tanaman rempah yang berasal dari Asia Tengah, diantaranya Cina dan Jepang yang beriklim subtropis. Kemudian bawang putih menyebar ke seluruh Asia, Eropa, dan akhirnya ke seluruh dunia. Di Indonesia bawang putih masuk melalui jalur perdagangan internasional sejak berabad-abad lampau, dimulai dari daerah pesisir dan semakin lama meluas ke daerah pedalaman (Palungkun dan Budiarti, 1992). Di beberapa daerah di Indonesia, bawang putih dikenal dengan nama lasun (Aceh), dasun (Minangkabau), lasuna (Batak), bawang bodas (Sunda), bawang ksihong (Dayak) dan incuna (Nusa Tenggara). Menurut Tjitrosoepoemo (1994), klasifikasi bawang putih adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Monocotyledonae Ordo : Liliflorae
Famili : Liliceae Genus : Allium
Gambar 2. Bawang putih Allium sativum
Bawang putih adalah tanaman berbentuk rumput, memiliki umbi berwarna putih yang aromanya sangat menyengat. Daunnya panjang berbentuk pipih (tidak berlubang). Helai daun seperti pita dan melipat kearah panjang dengan membuat sudut pada permukaan bawahnya. Kelopak daun kuat, tipis, dan membungkus kelopak daun yang lebih muda sehingga membentuk batang semua yang tersembul keluar. Bunganya hanya sebagian keluar atau sama sekali tidak keluar karena sudah gagal tumbuh pada waktu masih berupa tunas bunga (Palungkun dan Budiarti, 2001).
Bawang putih termasuk tanaman rempah yang bernilai ekonomis tinggi karena memiliki beragam kegunaan. Bawang putih tidak hanya dimanfaatkan sebagai bumbu masak, tetapi dapat dimanfaatkan sebagai tanaman apotek hidup. Secara tradisional, berbagai bangsa di dunia telah menggunakan bawang putih dalam beragam ramuan obat. Pemakaiannya sebagian besar masih bersifat empiris, artinya digunakan secara turun-temurun berdasarkan pengalaman belaka. Di zaman modern, khasiat bawang putih telah dibuktikan secara ilmiah.
Khasiat bawang putih berhubungan erat dengan zat kimia yang dikandungnya. Zat-zat kimia tersebut sebagian besar masuk dalam golongan minyak atsiri. Menurut Surahman (1984), minyak atsiri adalah suatu zat yang mudah menguap pada suhu kamar sehingga disebut terpenoid essential oils.
Minyak atsiri dapat digunakan sebagai pewangi, penyedap, antibakteri dan antijamur.
terkandung dalam tanaman bawang putih utuh adalah zat aliin. Ketika bawang putih dihancurkan, zat aliin akan terpecah menjadi alisin, amonia, dan piruvat. Selain sebagai antibakteri, dapat juga meningkatkan pertumbuhan dengan cara menekan bakteri yang merugikan dan memberikan peluang pertumbuhan mikroorganisme yang menguntungkan di dalam saluran pencernaan secara optimum sehingga pemanfaatan makanan untuk pertumbuhan dapat maksimum (Bidura, 1999 dalam Sunanti, 2007).
Allicin adalah salah satu zat aktif yang diduga dapat membunuh kuman-kuman penyakit (bersifat antibakteri). Allicin berperan ganda membunuh bakteri, yaitu bakteri Gram positif maupun Gram negatif karena mempunyai gugus amino para amino benzoat (Palungkun dan Budiarti, 2001). Menurut Barnes et al. (2002), hasil uji in vitro bawang putih terhadap beberapa bakteri yang sensitif telah menunjukkan hasil yang signifikan. Bakteri yang diujikan adalah
Staphylococcus aureus, S. faecalis, Escherichia coli, Proteus mirabilis, Salmonella typhi, Aeromonas, Vibrio cholerae dan Bacillus subtilis. Selain itu bawang putih juga mempunyai aktivitas sebagai anti fungi terhadap Microsporum, Epidermophyton, Trichophyton, Rhodotorula, Eryptococcus neoformans dan
Candida.
Allicin pertama kali ditemukan oleh C.V. Cacalito pada tahun 1944, zat ini berupa minyak tidak berwarna yang secara kimia tidak stabil dengan dayaguna antibiotik. Menurut Cavalito dalam Watanabe (2001), satu miligram allicin
mempunyai suatu daya kemampuan sebanding dengan 15 unit standar penisilin.
Tabel 1. Komposisi kimia bawang putih per 100 gram
Kandungan Jumlah (gram)
Air 66,2-71 gram
Energi 95-122 kal
Protein 4,5-7 gram
Lemak 0,2-0,3 gram
Karbohidrat 23,1-24,6 gram
Ca 26-42 mg
P 15-109 mg
K 346 mg
Sumber : Palungkun dan Budiarti (2001)
Berikut ini adalah penelitian yang telah dilakukan untuk melihat efektifitas bawang putih sebagai bahan antibakteri dan antivirus :
Tabel 2. Beberapa penelitian yang telah dilakukan untuk melihat efektifitas bawang putih
No
Konsentrasi bawang putih (g/l)
Obyek Metode
pemberian Pustaka
1 300 ikan mas penyuntikan Puspitaningtyas (2006)
2 6 dan 20 udang
2.3 Meniran Phyllanthus niruri
Meniran merupakan tanaman yang dapat tumbuh di daerah tropis yang tumbuh liar. Adapun klasifikasinya adalah sebagai berikut (Syamsuhidayat dan Hutapea, 1990):
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledonae Bangsa : Geraniales Suku : Euphorbiaceae Marga : Phyllanthus
Jenis : Phyllanthus niruri
Gambar 3. Meniran Phyllanthus niruri (inzet)
Meniran Phyllanthus niruri merupakan jenis tanaman obat yang dapat bermanfaat untuk menurunkan panas, obat batuk, radang, batu ginjal, susah buang air kecil, disentri, sakit ayan, hepatitis, rematik. Selain itu, meniran dapat mencegah berbagai macam infeksi virus dan bakteri serta mendorong sistem kekebalan tubuh. Hal ini dikarenakan terdapat kandungan flavonoid, alkaloid, saponin, tanin, dan vitamin C (Triarsari, 2009).
Flavonoid merupakan senyawa golongan polifenol yang larut dalam air. Flavonoid terdapat dalam semua tumbuhan hijau sehingga selalu ditemukan pada setiap ekstrak tumbuhan (Markham, 1988), misalnya terdapat pada bagian biji, kulit buah, daun dan daun bunga dari tanaman. Senyawa ini jarang ditemukan dalam bentuk tunggal pada tumbuhan melainkan dalam bentuk campuran. Senyawa fenol dari tumbuhan memiliki kemampuan untuk membentuk kompleks dengan protein melalui ikatan hidrogen, sehingga dapat merusak membran sel bakteri. Flavonoid bersifat antibakteri dan antioksidan serta mampu meningkatkan kerja sistem imun karena leukosit sebagai pemakan antigen lebih cepat dihasilkan dan sistem limfoid lebih cepat diaktifkan (Rahman, 2008).
Alkaloid merupakan senyawa metabolit sekunder terbesar yang terdapat dalam tumbuhan terutama pada bagian biji, daun, ranting dan kulit kayu (Herwig, 1979 dalam Ayuningtyas, 2009). Alkaloid bersifat toksik terhadap mikroba, sehingga efektif membunuh bakteri dan virus (Naim, 2004), namun dapat beracun bagi ikan. Pada jumlah tertentu alkaloid tidak selalu beracun bagi ikan karena dapat bekerja secara sinergis dengan senyawa lainnya. Alkaloid dapat berfungsi sebagai antibakteri yang dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif.
Tannin merupakan senyawa polifenol yang dapat larut dalam air, gliserol, methanol, hidroalkoholik, propilena glikol tetapi tidak larut dalam benzene, kloroform eter, petroleum eter dan karbon disulfide (Harborne, 1987). Selanjutnya dinyatakan bahwa tannin mempunyai sifat fisika dan kimia antara lain rasanya sepat dan berfungsi sebagai antibakteri dan astringent atau menciutkan dinding usus yang rusak karena asam atau bakteri.
merusak permeabilitas membran yang mengakibatkan dinding sel rusak atau hancur. Keberadaan saponin dalam tumbuhan dapat juga dimanfaatkan sebagai obat bagi manusia.
Menurut Mela (2007), hampir semua bagian dari tanaman meniran berkhasit obat. Hasil penelitian menyebutkan bahwa meniran memiliki aktivitas imunomodulator yang berperan membuat sistem imun lebih aktif dalam menjalankan fungsinya, menguatkan sistem imun tubuh (imunostimulator) atau menekan reaksi sistem imun yang berlebihan (imunosupresan). Dengan demikian, kekebalan atau daya tahan tubuh selalu optimal sehingga tetap sehat ketika diserang virus, bakteri, dan mikroba lainnya. Kandungan kimia yang bermanfaat dari meniran adalah flavonoid. Pada tanaman lainnya kandungan flavonoid sebenarnya juga ada, bedanya pada meniranaktivitas peningkatan sistem imunnya ternyata lebih baik. Sebagai imunomodulator, meniran tidak semata-mata berefek meningkatkan sistem imun, namun juga menekan sistem imun apabila aktivitasnya berlebihan. Jika aktivitas sistem imun berkurang, maka kandungan flavonoid dalam meniran akan mengirimkan sinyal intraseluler pada reseptor sel untuk meningkatkan aktivitasnya. Sebaliknya, jika sistem imun kerjanya berlebihan, maka meniran berkhasiat dalam mengurangi kerja sistem imun tersebut. Jadi, meniran berfungsi sebagai penyeimbang sistem imun.
Menurut Suprapto (2006), flavonoid pada meniran banyak ditemukan di bagian akar dan daun. Flavonoid pada meniran menempel pada sel imun dan memberikan sinyal intraseluler atau rangsangan untuk mengaktifkan kerja sel imun lebih baik. Selain itu, meniran berfungsi juga sebagai senyawa antioksidan yang mampu merangsang kekebalan tubuh.
Berdasarkan penelitian yang dilakukan oleh pihak BBAT (Balai Budidaya Air Tawar) Sukabumi, dengan pemberian ekstrak meniran 10 g/kg pakan terhadap ikan mas yang diinfeksi virus KHV dapat meningkatkan kelangsungan hidup. Hal ini disebabkan adanya peningkatan daya tahan tubuh ikan mas yang ditandai meningkatnya jumlah leukosit yang berfungsi sebagai pertahanan non spesifik (Ciptoroso et al., 2006). Penelitian Ayuningtyas (2009) juga diketahui bahwa ekstrak meniran 5 ppt mampu mencegah infeksi yang disebabkan oleh bakteri
2.4 Bakteri Aeromonas hydrophila
Bakteri Aeromonas hydrophila merupakan bakteri gram negatif, berbentuk batang pendek dengan ukuran 1,0-1,5 x 0,7-0,8 µm. Tumbuh baik pada perairan yang mengandung bahan organik tinggi. A. hydrophila tumbuh optimum pada suhu 20-30oC (Kabata, 1985). Berdasarkan Austin dan Austin (1986), bakteri ini mampu tumbuh pada suhu 37oC. Selain itu bakteri ini juga bersifat fakultatif aerobik (dapat hidup dengan atau tanpa oksigen) yang mengubah karbohidrat menjadi asam dan gas, tidak berspora, oksidatif fermentatif (mampu memanfaatkan karbohidrat atau glukosa, bersifat motil (bergerak aktif) karena memiliki flagel (Monotrichous flagella) yang keluar dari salah satu kutubnya, koloni bakteri ini pada media agar berwarna putih kekuningan, bentuk bulat cembung, oksidase sitokrom dan reaksi katalase positif (Skinner dan Carr, 1976). Bakteri ini senang hidup di lingkungan perairan bersuhu 15-30oC dan pH antara 5,5-9 (Ghufran dan Kordi, 2004).
Pada beberapa kasus, kematian ikan akibat infeksi A. hydrophila tidak ditandai dengan kerusakan pada organ eksternal. Kerusakan dapat terjadi sebagai akibat infeksi lokal pada tempat luka atau penempelan oleh parasit. Infeksi A. hydrophila dapat merupakan asosiasi dengan parasit, luka atau patogen lain. Akibatnya seperti dikemukakan oleh Austin dan Austin (1986), bahwa bakteri ini akan semakin patogen dan membahayakan sistem kekebalan ikan budidaya.
A. hydrophila merupakan bakteri penyebab penyakit MAS (Motile
Aeromonad Septicemia) (Irianto, 2005). Menurut Amlachler (1961) dalam Sniezko dan Axelrod (1971), serangan bakteri ini dapat terjadi dalam empat tingkat berbeda, sebagai berikut :
1. Laten, tidak memperlihatkan gejala penyakit, namun pada organ dalam terdapat bakteri penyebab penyakit.
2. Kronis, terlihat gejala tukak, bisul-bisul, dan abses yang perkembangannya berlangsung lama.
3. Sub akut, terlihat gejala dropsi, lepuh, dan pendarahan pada sisik.
Ikan yang terinfeksi A. hydrophila memperlihatkan tanda-tanda berupa tingkah laku ikan tidak normal, berenang lambat, megap-megap di permukaan air, dan nafsu makan menurun. Tanda lainnya seperti sirip rusak, kulit kering dan kasar, lesi kulit yang berkembang menjadi tukak, dan mata menonjol (exophthalmus), serta terkadang perut menggembung berisi cairan kemerahan. Penyakit ini bersifat musiman dan meningkat selama musim panas serta berhubungan dengan populasi ikan yang mengalami stres (Kabata, 1985). Kelainan klinis berupa hiperemia merupakan bentuk perlawanan terhadap adanya bakteri patogen sehingga terjadi mobilisasi sel darah putih. Sel darah putih tersebut berfungsi sebagai imun pertahanan non spesifik yang akan melokalisasi dan mengeliminasi patogen dengan cara fagositosis (Anderson, 1974). Menurut Suzuki dan Lida (1992) dalam Darmanto (2003), hiperemia akan diikuti oleh reaksi peradangan yaitu berupa tanda kemerahan di daerah sekitar luka yang merupakan reaksi mempertahankan diri pada daerah infeksi atau luka. Menurut Oliver et al. (1981) dalam Riyanto (1993), patogen A. hydrophila mendegradasi jaringan organ tubuh serta mengeluarkan toksik yang disebarkan ke seluruh tubuh melalui aliran darah sehingga menimbulkan warna kemerahan pada tubuh ikan.
Reaksi radang merupakan reaksi mencegah masuknya mikroorganisme di sekitar tempat infeksi. Peradangan terjadi di daerah sekitar masuknya patogen. Hal ini dikarenakan komponen yang lain berperan dalam proses pertahanan seluler seperti leukosit akan memfagositosis patogen tersebut (Anderson, 1974). Reaksi peradangan meliputi tiga tahap, yaitu : (1) terjadinya peningkatan suplai darah ke daerah sekitar luka atau infeksi; (2) bertambahnya sifat permeabilitas pipa kapiler darah; (3) terjadinya proses migrasi leukosit yang keluar dari kapiler dan masuk ke dalam jaringan secara merata.
berperan salam penentuan tingkat patogenitas bakteri (Brenden dan Huizinga, 1986 dalam Riyanto, 1993).
Karakteristik bakteri A. hydrophila di perairan sangat beragam yang disebabkan oleh perbedaan produksi endotoksin dan eksotoksin yang tidak sama untuk setiap galurnya (Angka, 2005). Munro (1992) dalam Hanafi (2006) mengatakan bahwa endotoksin atau lipopolisakarida (LPS) dari bakteri Gram negatif adalah toksik karena dapat menginduksi berbagai kondisi patologi, termasuk shock, hemoragik, fever, dan kematian.
2.5 Bahan Antibakteri
Bahan antibakteri adalah suatu senyawa kimia yang dapat menghambat pertumbuhan ataupun membunuh bakteri. Kualitas atau kemampuan daya antibakterial ini ditentukan oleh aktivitas dan spektrum zat tersebut terhadap bakteri (Agustian, 2007). Antibiotik yang bisa digunakan dengan baik, adalah antibiotik yang memiliki sifat toksisitas selektif setinggi mungkin. Sifat toksisitas selektif artinya zat antibakteri tersebut harus toksik untuk bakteri tetapi tidak toksik untuk inang (host). Bila ada zat antibakteri yang sangat toksik untuk bakteri tetapi membahayakan untuk inang bukan kriteria antibakteri yang baik, bahkan dianggap beracun. Karena dasar pengobatan terhadap suatu penyakit adalah usaha untuk menyembuhkan penyakit tersebut tanpa mengakibatkan adanya bahaya ataupun adanya efek samping yang merugikan pengguna suatu obat-obatan.
Kemampuan suatu zat antibakteri dalam menghambat pertumbuhan bakteri dipengaruhi oleh berbagai faktor, antara lain (1) Konsentrasi zat antibakteri, (2) Waktu kontak dengan zat antibakteri, (3) Suhu lingkungan, (4) Sifat-sifat bakteri (jenis, umur, konsentrasi, dan keadaan bakteri), (5) Sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, dan jenis senyawa di dalamnya (Davidson and Branen, 1993 dalam Agustian, 2007).
(Cowan, 1985). Salah satu jenis rempah-rempah yang telah diketahui mengandung zat antibakteri adalah bawang putih.
2.6 Kualitas Air
Kualitas air merupakan faktor penting untuk mendukung kehidupan ikan. Kualitas air yang kurang baik dapat menyebabkan ikan mudah terserang penyakit. Suhu dapat diartikan sebagai derajat panas suatu perairan. Suhu sangat berpengaruh terhadap organisme di perairan dengan perannya sebagai controlling
faktor bagi perairan. Suhu sangat berperan dalam mengendalikan kondisi ekosistem perairan. Suhu juga mempengaruhi kelarutan oksigen dalam perairan. Ikan tropis tumbuh dengan baik pada suhu air antar 25-32oC (Boyd, 1982). Suhu air media pemeliharaan yang optimal berada dalam kisaran 28-30oC. Menurut Taufik (1984) dalam Ayuningtyas (2009), pada temperatur yang tinggi, bakteri A. hydrophila dan Pseudomonas fluorescens akan lebih menyerang ikan, karena temperatur ini ikan mengalami stres sehingga daya tahan tubuhnya akan menurun. Oksigen terlarut merupakan faktor yang dibutuhkan oleh ikan. Kandungan oksigen terlarut kurang dari 1 mg/l akan mematikan ikan dan pada kandungan antara 1-5 mg/l cukup mendukung kehidupan ikan. Kandungan oksigen lebih dari 5 mg/l merupakan kandungan yang menyebabkan pertumbuhan normal ikan (Boyd, 1982). Bakteri A. hydrophila, A. salmonicida, dan P. fluorescens dapat menyerang ikan dengan kondisi air dengan kadar oksigen terlarut rendah (Taufik, 1984 dalam Ayuningtyas, 2009).
Tabel 3. Efek pH terhadap organisme budidaya
pH Efek Terhadap Organisme
<4 Mati
5 tidak bereproduksi, pertumbuhan terhambat 6 pertumbuhan terhambat
7 pertumbuhan baik 8 pertumbuhan baik 9 pertumbuhan terhambat
10 tidak bereproduksi, pertumbuhan terhambat >11 Mati
Sumber : Boyd (1982)
Perairan kolam yang produktif dan ideal bagi kehidupan ikan dan organisme lain adalah perairan dengan pH 6,5-9 (Boyd, 1982). Pada pH antara 4-6,5 dan pH antara 9-11 pertumbuhan ikan akan lambat. Kematian ikan akan terjadi umumnya ketika perairan berubah menjadi sangat asam (pH < 4) atau menjadi sangat basa (pH < 11). Menurut Boyd (1982), kisaran pH 6,5-9,0 merupakan kondisi yang baik untuk pertumbuhan ikan.
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan Maret – Agustus 2009. Tempat penelitian di
Laboratorium Kesehatan Ikan, Departemen Budidaya Perikanan, Fakultas Perikanan dan
Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini, meliputi akuarium sebanyak 12 buah,
peralatan aerasi, seser, kain lap, syringe, termometer, pH-meter, spektrofometer,
erlenmeyer, eppendorf, cawan petri, pipet volumetrik, mikropipet, tabung reaksi, jarum
ose, batang penyebar, penangas air, water shaker, sentrifus, kertas saring Whatman No.
42, alat bedah, mikroskop, inkubator, bunsen dan autoklaf.
Bahan yang digunakan adalah ikan lele dengan ukuran panjang 11-13 cm, pelet,
putih telur, isolat bakteri Aeromonas hydrophila, ekstrak bawang putih Allium sativum,
ekstrak daun meniran Phyllanthus niruri, TSA (Tripticase Soy Agar), LB (Luria Bertani),
larutan PBS (Phosphat Buffer Saline) steril dan akuades.
3.3 Metode Penelitian
3.3.1 Penyediaan Bakteri Uji
Bakteri uji yang digunakan adalah Aeromonas hydrophila. Bakteri tersebut
disuntikkan secara intramuskuler pada tiga ekor ikan lele untuk menguji virulensinya.
Setelah itu dilakukan reisolasi bakteri dengan menggoreskan jarum ose ke bagian ginjal
kemudian dibiakkan di media TSA dan diinkubasi selama 24 jam pada suhu kamar.
Koloni bakteri tunggal yang tumbuh, diisolasi di media TSA dengan teknik empat
kuadran kemudian diinkubasi selama 24 jam. Untuk mendapatkan biakan murni maka
setiap koloni bakteri yang tumbuh terpisah dan berlainan morfologinya diisolasi kembali
ke dalam media TSA miring dan diinkubasi pada suhu kamar selama 24 jam.
Karakterisasi yang dilakukan meliputi pengamatan morfologi koloni secara visual,
meliputi warna, elevasi dan tepian sel. Uji yang dilakukan meliputi pewarnaan Gram, uji
motilitas, uji oksidase dan fermentase, uji katalase, uji oksidase dan uji gelatinase.
Identifikasi yang digunakan berdasarkan Bergey’s Mannual of Determination
3.3.2 Regenerasi Bakteri Uji
Bakteri yang diuji diregenerasi terlebih dahulu sebelum digunakan. Bakteri stok
dari kultur primer dibiakkan dalam agar miring yaitu sebanyak satu ose digoreskan ke
agar miring dan diinkubasi selama 24 jam pada suhu 27oC. Sebanyak satu ose bakteri
diambil dari biakan terbaru berumur 24-48 jam dan diinokulasikan ke dalam Erlenmeyer
yang berisi 25 ml media LB, kemudian diinkubasi selama 24 jam dengan suhu 27oC pada
water shaker.
3.3.3 Uji LD50
Penentuan tingkat virulensi bakteri dilakukan dengan menghitung nilai LD50 nya.
Hal ini penting untuk mengetahui konsentrasi bakteri yang digunakan. Untuk uji LD50
digunakan akuarium yang disusun untuk empat perlakuan. Masing-masing dengan
kepadatan 105 sampai 109 cfu/ml secara intramuskuler sebanyak 0,1 ml/ekor pada seluruh
ikan sesuai dengan label kepadatan bekteri pada setiap akuarium. Pengamatan dilakukan
dengan label mengamati jumlah ikan yang masih hidup dan mati sampai hari ke tujuh.
Kemudian dilakukan perhitungan untuk mengetahui nilai LD50 yaitu konsentrasi pada saat
3.3.4 Penyediaan Bahan dan Ekstrak
Proses penyediaan daun meniran adalah sebagai berikut :
Daun meniran dibersihkan dari kotoran
Daun meniran dikeringkan di udara terbuka tanpa terkena sinar matahari
(Harbone, 1987 dalam Ayuningtyas, 2008).
Daun meniran diblender
Diayak dengan saringan halus
Bubuk daun meniran
Sedangkan untuk bawang putih adalah sebagai berikut :
Bawang putih dibersihkan dari kulitnya
Bawang putih diiris tipis
Bawang putih dikeringkan di udara terbuka tanpa terkena sinar matahari (± 3
hari)
Bawang putih dioven (suhu 60oC, ± 1 jam)
Bawang putih diblender
Diayak dengan saringan halus
Bubuk bawang putih
Berdasarkan penelitian Ayuningtyas (2008), dosis daun meniran yang efektif untuk
pencegahan adalah 5 ppt dan untuk pengobatan adalah 10 ppt. Cara pembuatannya yaitu
sebagai berikut, untuk pencegahan bubuk daun meniran sebanyak 50 g dilarutkan dengan
akuades steril sebanyak 10 ml, sehingga didapatkan konsentrasi 5 mg/ml sedangkan
untuk pengobatan bubuk daun meniran sebanyak 100 mg dilarutkan dengan akuades steril
meniran dan akuades tersebut direbus pada suhu 90oC selama 30 menit (Sopiana, 2005).
Ekstrak tersebut kemudian divortex supaya homogen dan disaring dengan kertas
Whatmann.
Dosis bawang putih yang efektif untuk pencegahan adalah 20 ppt dan untuk
pengobatan adalah 40 ppt. Cara pembuatan larutan, untuk pencegahan adalah dengan
melarutkan bubuk bawang putih sebanyak 200 mg kedalam akuades steril sebanyak 10
ml, sehingga didapatkan konsentrasi 20 mg/ml sedangkan untuk pengobatan adalah
dengan melarutkan bubuk bawang putih sebanyak 400 mg kedalam akuades steril
sebanyak 10 ml, sehingga didapatkan konsentrasi 40 mg/ml. Ekstrak tersebut kemudian
divortex supaya homogen disaring dengan kertas Whatman.
3.3.5 Persiapan Wadah dan Ikan Uji
Akuarium dicuci dengan sabun dan dibilas serta diisi air. Kemudian dimasukkan
larutan klorin 100 ppm ke dalam akuarium dan diaerasi kuat selama 24 jam. Setelah itu
dibilas lagi dengan air. Akuarium dilengkapi dengan penutup yang terbuat dari kain kasa
agar ikan tidak melompat ke luar serta ditutup dengan plastik hitam di sekeliling
akuarium agar ikan tidak stres. Tiap akuarium diisi 6 ekor ikan uji.
Ikan uji yang akan digunakan memiliki panjang 11-13 cm. Mula-mula ikan
direndam dengan konsentrasi 30 ppm larutan garam selama 5 menit untuk menghilangkan
ektoparasit. Setelah itu ikan diaklimatisasi terlebih dahulu agar ikan terbiasa hidup dalam
akuarium uji selama 3 hari dengan pemberian pakan berupa pelet apung berkadar protein
28%. Jumlah pakan yang diberikan sebanyak 3% dari berat badan ikan per hari dengan
frekuensi pemberian 2x sehari pada pagi dan sore hari.
3.3.6 Penyediaan Pelet Uji
Pelet yang diberikan ditimbang terlebih dahulu sesuai dengan biomassa
masing-masing ikan yang berada dalam akuarium. FR yang digunakan adalah 3% dari biomassa.
Rumus yang digunakan :
Biomassa = Nt Wt
Jumlah pakan = FR Biomassa
Keterangan : Nt = Jumlah ikan (ekor)
Wt = Berat rata-rata (gram)
Jumlah ekstrak yang diberikan, yaitu meniran : bawang putih = 1 : 2, sedangkan
pakan. Setelah ekstrak tercampur dengan pakan, pelet dibalut dengan putih telur sebagai
perekat, kemudian diangin-anginkan sebelum diberikan ke ikan.
3.3.7 Uji In Vivo
Pengujian in vivo dilakukan untuk mengetahui pengaruh pemberian ekstrak
meniran dan bawang putih lewat pakan terhadap respon kekebalan tubuh ikan lele setelah
diinfeksi A. hydrophila. Dari uji ini dapat dilihat potensi meniran dan bawang putih
sebagai imunostimulan. Perlakuan yang diberikan berupa :
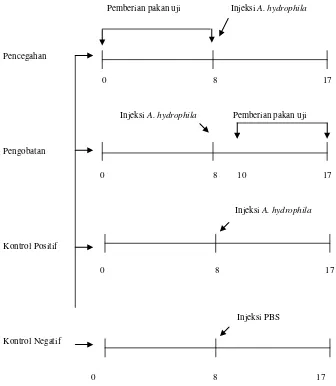
1. Kontrol negatif : disuntik dengan PBS pada hari ke-8
2. Kontrol positif : disuntik bakteri A. hydrophila sebanyak 0,1 ml/ekor
pada hari ke-8
3. Perlakuan pencegahan : diberikan pakan uji seminggu sebelum disuntik bakteri
A. hydrophila sebanyak 0,1 ml/ekor pada hari ke-8
4. Perlakuan pengobatan : disuntik bakteri A. hydrophila sebanyak 0,1 ml/ekor
pada hari ke-8, diberikan pakan uji pada hari ke-10 sampai hari ke-17
Masing-masing perlakuan dilakukan sebanyak empat kali ulangan dan diamati
selama 9 hari setelah uji tantang dengan parameter yang diamati meliputi respon makan
Pemberian pakan uji Injeksi A. hydrophila
Pencegahan
0 8 17
Injeksi A. hydrophila Pemberian pakan uji
Pengobatan
0 8 10 17
Injeksi A. hydrophila
Kontrol Positif
0 8 17
Injeksi PBS
Kontrol Negatif
0 8 17
Gambar 4. Skema metode penelitian (uji in vivo)
3.4 Parameter Yang Diamati 3.4.1 Respon Makan Ikan
Pengamatan respon makan ikan dilakukan setiap hari selama 16 hari dimulai pada
saat ikan diberi perlakuan sampai hari ke-16 setelah infeksi dengan melihat reaksi ikan uji
pada saat diberi makan dan sisa pakan yang tersisa.
3.4.2 Pertambahan Bobot Tubuh
Pengukuran bobot rata-rata dilakukan pada awal, tengah dan akhir perlakuan
dengan menggunakan timbangan digital dengan ketelitian 0,001. Ikan pada
masing-masing akuarium ditimbang biomassanya, kemudian dihitung nilai rataan bobot setiap
Pertambahan bobot ikan dihitung dengan rumus (Zonneveld et al., 1991 dalam
Keterangan : Wt = bobot rata-rata akhir (gram)
Wo = bobot rata-rata awal (gram)
3.4.3 Kematian Ikan
Pengamatan terhadap kematian ikan dilakukan setiap hari hingga akhir perlakuan
setelah penginfeksian dengan bakteri A. hydrophila. Tingkat kematian ikan uji dihitung
dengan rumus (Effendi, 1979 dalam Ayuningtyas, 2008 ) :
Mortalitas (%) = Jumlah ikan yang mati (ekor) x 100% Jumlah populasi (ekor)
3.4.4 Gejala Klinis dan Pengukuran Diameter Klinis
Pengamatan terhadap gejala klinis dilakukan setiap hari setelah ikan diinfeksi
dengan bakteri A. hydrophila. Pengukuran diameter klinis dilakukan dengan mengukur
luas kelainan klinis dengan menggunakan penggaris, kemudian data yang telah diperoleh
diberi skor.
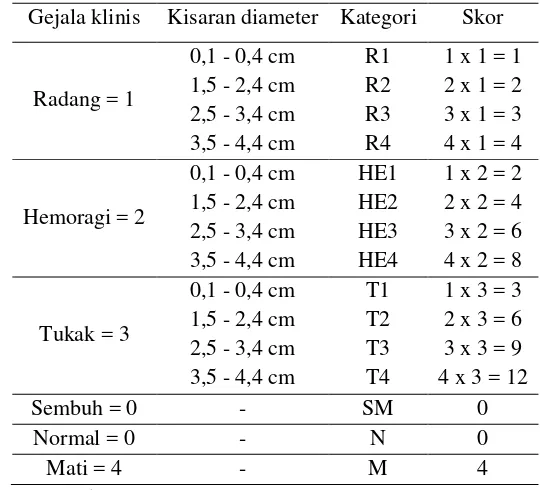
Nilai skor kelainan yang menunjukkan tingkat keparahan infeksi dilakukan dengan
ketentuan seperti tertera pada Tabel 4.
Tabel 4. Perhitungan skor kelainan klinis
Gejala klinis Kisaran diameter Kategori Skor
3.4.5 Pengamatan Organ Dalam
Pada akhir perlakuan dilakukan pengamatan organ dalam yang bertujuan untuk
mengetahui kelainan yang terjadi dengan cara membandingkan perubahan morfologi dan
warna organ dalam ikan perlakuan pencegahan, pengobatan dan kontrol positif dengan
perlakuan kontrol negatif. Satu ekor ikan uji diambil secara acak dari setiap perlakuan
kemudian dibedah dan diamati organ dalamnya.
3.4.6 Kualitas Air
Parameter kualitas air yang akan diamati meliput pengukuran suhu, pH, DO
(oksigen terlarut) dan TAN (total ammonium nitrogen). Pengukuran parameter kualitas
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Identifikasi Bakteri Uji
Hasil pengujian bakteri A. hydrophila asal laboratorium kesehatan menunjukkan bahwa bakteri tersebut virulen karena ikan uji mengalami gejala kelainan klinis yaitu radang sampai tukak. Hasil uji biokimia bakteri uji maupun bakteri reisolasi menunjukkan bahwa bakteri tersebut adalah bakteri A. hydrophila
(Tabel 5) (Aoki, 1999).
Tabel 5. Hasil identifikasi bakteri A. hydrophila
Isolat Morfologi koloni Uji biokimia
warna elevasi tepian Gram motilitas O/F katalase oksidase Gelatinase Murni krem cembung halus - + F + + + reisolasi krem cembung halus - + F + + +
4.1.2 Uji LD50
Hasil pengujian LD50 pada bakteri A. hydrophila yang disuntikkan ke ikan lele dumbo didapatkan konsentrasi bakteri sebanyak 108 cfu/ml (Lampiran 2). Konsentrasi tersebut dapat menyebabkan kematian populasi ikan lele dumbo sebanyak 50% dalam waktu 7 hari.
4.1.3 Uji In Vivo
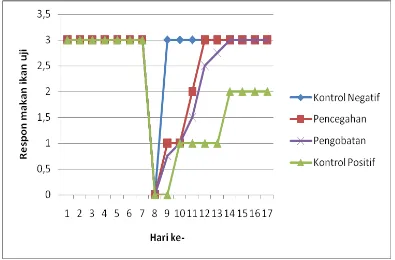
4.1.3.1 Respon Makan Ikan Uji
Pada kontrol negatif, nafsu makan ikan sangat baik sampai akhir perlakuan. Hanya saja pada saat setelah disuntik PBS, ikan tidak menunjukkan respon makan sama sekali. Namun pada keesokan harinya (hari ke-9) sampai pada akhir perlakuan, respon ikan kembali normal.
Pada perlakuan kontrol positif, ikan tidak menunjukkan nafsu makan setelah disuntik dengan bakteri A. hydrophila. Pada hari ke-9 paska penginfeksian, ikan uji tetap masih tidak menunjukkan respon makan. Kemudian pada hari ke-10 sampai hari ke-13, baru menunjukkan adanya respon makan namun hanya sedikit. Pada hari ke-14 sampai akhir perlakuan, nafsu makan ikan berangsur-angsur baik.
Pada perlakuan pencegahan, ikan uji juga tidak menunjukkan respon makan setelah disuntik (hari ke-8). Pada hari ke-9, ikan mulai menunjukkan respon makan namun hanya sedikit dan berlangsung sampai hari ke-10. Pada hari ke-11, respon makan mulai membaik. Respon makan mengalami peningkatan menjadi sangat baik pada hari ke-12 sampai akhir perlakuan.
Pada perlakuan pengobatan, ikan uji terlihat tidak nafsu makan pada hari ke-8 setelah penyuntikan. Pada hari ke-9, ikan mulai ada nafsu makan namun hanya sedikit sampai hari ke-11. Pada hari ke-12 sampai akhir perlakuan, nafsu makan ikan sangat baik.
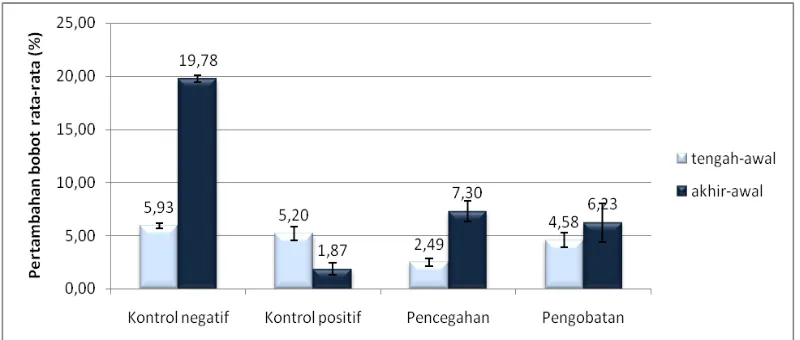
4.1.3.2 Pertambahan Bobot Ikan Uji
Pertambahan bobot ikan uji dapat dilihat pada Gambar 6. Dapat dilihat pada gambar tersebut, bahwa semua perlakuan (kontrol negatif, kontrol positif, perlakuan pencegahan, perlakuan pengobatan) rata-rata mengalami peningkatan bobot tubuh sampai pada tengah perlakuan (hari ke-8).
Pada perlakuan kontrol negatif, rata-rata bobot tubuh mengalami peningkatan paling tinggi yaitu sebesar 12,69 ± 0,87% dari rata-rata pada awal perlakuan sebesar 10,60 ± 0,59 gram. Sedangkan peningkatan dari awal perlakuan sampai tengah perlakuan sebesar 5,93 ± 0,24%.
Gambar 6. Pertambahan bobot rata-rata ikan lele dumbo Clarias sp. (%) selama perlakuan
Pada perlakuan kontrol positif, rata-rata bobot tubuh mengalami peningkatan sampai pada tengah perlakuan saja, yaitu sebesar 5,20 ± 0,64% dari bobot awalnya adalah 10,42 ± 0,67 gram. Setelah diinfeksi dengan bakteri A. hydrophila (hari ke-8), ikan mengalami penurunan bobot tubuh sampai akhir perlakuan. Rata-rata bobot tubuh menurun sebesar 1,87 ± 0,58%, dari bobot rata-rata sebelum penginfeksian yaitu sebesar 10,97 ± 0,15 gram.
perlakuan pencegahan mengalami peningkatan rata-rata bobot tubuh tertinggi kedua setelah perlakuan kontrol negatif.
Pada perlakuan pengobatan, ikan uji mengalami pertambahan bobot sebesar 4,58 ± 0,67%. Bobot rata-rata pada awal perlakuan adalah 9,92 ± 0,86 gram dan pada akhir perlakuan sebesar 10,54 ± 1,51 gram. Pertambahan bobot rata-rata sampai pada akhir perlakuan adalah sebesar 6,23 ± 1,81%. Pada perlakuan pencegahan dan pengobatan menunjukkan hasil bahwa ikan uji mengalami pertambahan bobot rata-rata walaupun telah diinfeksi dengan bakteri
A. hydrophila. Hal ini membuktikan bahwa pemberian campuran ekstrak meniran dan bawang putih dalam pakan dapat meningkatkan nafsu makan ikan uji.
4.1.3.3 Mortalitas Ikan Uji
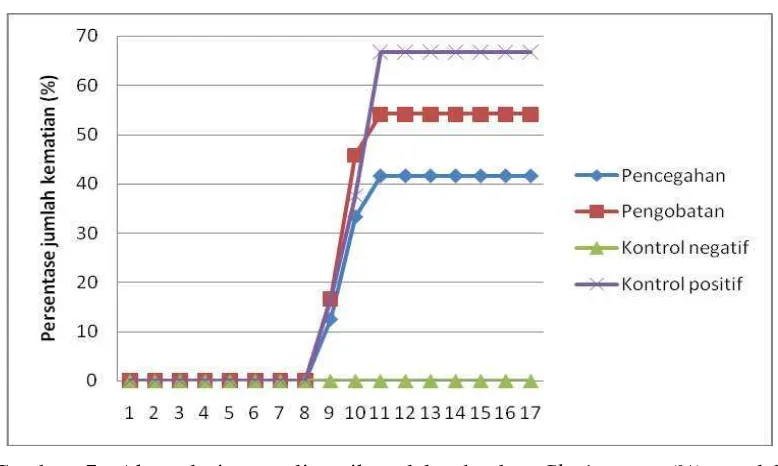
Gambar 7. Akumulasi mortalitas ikan lele dumbo Clarias sp. (%) setelah penginfeksian bakteri A. hydrophila selama perlakuan
kontrol positif kematian tertinggi terjadi pada hari ke-10 dan 11 yaitu sebesar 12,50%. Pada perlakuan pencegahan dan pengobatan, kematian rata-rata tertinggi terjadi pada hari ke-11 dan hari ke-9 yaitu sebesar 16,67% dan 20,83%. Ikan uji pada perlakuan pencegahan memiliki angka kematian yang paling rendah dan berbeda nyata jika dibandingkan dengan perlakuan kontrol positif.
4.1.3.4 Gejala Klinis Ikan Uji
Pada perlakuan kontrol negatif, ikan uji tidak menunjukkan adanya kelainan klinis atau kematian sampai akhir perlakuan (hari ke-17) setelah dilakukan penyuntikan dengan PBS 0,1 ml/ekor (Gambar 8).
Gambar 8. Ikan lele perlakuan kontrol negatif tidak megalami kelainan klinis hingga akhir perlakuan
Pada jam ke-15 setelah penginfeksian bakteri A. hydrophila 108 cfu/ml pada ikan, terjadi radang pada bagian bekas suntikan untuk perlakuan kontrol positif, pencegahan dan pengobatan (Gambar 9).
Gambar 9. Ikan lele mengalami kelainan klinis berupa radang pada daerah bekas suntikan pada jam ke-7
ikan uji mengalami gejala klinis berupa hemoragi. Pada hari ke-10, ikan uji mengalami gejala klinis berupa tukak dan 5 ekor ikan mati dengan gejala klinis berupa tukak. Kematian ikan terus meningkat, pada hari ke-11 yaitu sebanyak 7 ekor ikan mati dengan gejala klinis berupa tukak. Pada hari ke-12 sampai akhir perlakuan, tidak terdapat kematian pada ikan uji. Penyembuhan terjadi pada hari ke-12 sampai hari ke-17. Gambar 11 sampai 14 menunjukkan perkembangan gejala klinis pada ikan uji.
Gambar 10.Ikan lele perlakuan kontrol positif mengalami kematian dengan kelainan klinis berupa radang, mata menonjol dan buta, sirip mengalami hiperemia pada hari ke-9 setelah penginfeksian bakteri A. hydrophila
Gambar 12. Ikan lele perlakuan kontrol positif mengalami kelainan klinis berupa tukak pada hari ke-11 setelah penginfeksian bakteri A. hydrophila
Gambar 13. Ikan lele perlakuan kontrol positif mengalami kelainan klinis berupa tukak pada hari ke-14 setelah penginfeksian bakteri A. hydrophila
Gambar 14. Ikan lele perlakuan kontrol positif mengalami penyembuhan tukak pada hari ke-17 setelah penginfeksian bakteri A. hydrophila
Pada perlakuan pengobatan, pada hari ke-9 setelah penginfeksian bakteri
berupa tukak dan 11 ekor ikan mengalami perkembangan tukak. Ikan uji mengalami penyembuhan tukak mulai hari ke-13 setelah penginfeksian sampai akhir perlakuan. Terdapat 2 ekor ikan yang mengalami proses penyembuhan. Gambar 15-17 menunjukkan perkembangan gejala klinis pada ikan uji yang sama.
Gambar 15. Ikan lele perlakuan pengobatan mengalami kelainan klinis berupa hemoragi pada hari ke-9 setelah penginfeksian bakteri A. hydrophila
Gambar 16. Ikan lele perlakuan pengobatan mengalami kelainan klinis berupa tukak pada hari ke-11 setelah penginfeksian bakteri A. hydrophila
Pada perlakuan pencegahan, setelah 24 jam penginfeksian , terdapat 2 ekor ikan mati dengan kelainan klinis berupa radang, 1 ekor ikan mati dengan kelainan klinis berupa hemoragi, 1 ekor mengalami kelainan klinis yaitu radang, 1 ekor mengalami tukak dan lainnya mengalami hemoragi. Kematian paling banyak terjadi pada hari ke-10 setelah penginfeksian, sebanyak 4 ekor ikan mengalami kematian dengan kelainan klinis berupa tukak, dan 17 ekor ikan uji mengalami kelainan klinis berupa tukak. Pada hari ke-11, sebanyak 2 ekor ikan mengalami kematian dengan kelainan klinis berupa tukak, dan 15 ekor ikan mengalami kelainan klinis berupa tukak. Pada hari ke-12 sampai akhir perlakuan, ikan uji tidak mengalami kematian. Pada hari ke-16 dan 17, sebanyak 5 ekor ikan mengalami penyembuhan total. Skor gejala klinis tertinggi terjadi pada hari ke-12. Gambar 18 sampai 20 menunjukkan perkembangan gejala klinis pada ikan uji yang sama.
Gambar 18. Ikan lele perlakuan pencegahan mengalami kelainan klinis berupa radang pada hari ke-9 setelah penginfeksian bakteri A. hydrophila
Gambar 20. Ikan lele perlakuan pencegahan mengalami penyembuhan total pada hari ke-17 setelah penginfeksian bakteri A. hydrophila
Gejala klinis didapatkan dari pengukuran diameter tukak yang terdapat pada tubuh ikan, kemudian dilakukan skoring. Gejala klinis menunjukkan seberapa parah tubuh ikan terinfeksi bakteri. Pada Gambar 21 dapat dilihat hasil skoring ikan uji pada perlakuan kontrol positif, pencegahan, dan pengobatan. Pada perlakuan kontrol positif, ikan uji mengalami skor rata-rata tertinggi pada hari ke-10 setelah penginfeksian bakteri A. hydrophila yaitu sebesar 7, 14. Kemudian pada hari ke-11, skor rata-rata mengalami penurunan, hal ini dikarenakan banyaknya ikan uji yang mengalami kematian. Pada hari ke-12 skor rata-rata kembali mengalami kenaikan menjadi 7,11. Pada hari ke-13 skor rata-rata kembali menurun, sampai akhir perlakuan skor rata-rata mengalami nilai yang sama.
Pada perlakuan pengobatan, skor rata-rata tertinggi terjadi pada hari ke-12 setelah penginfeksian dengan bakteri A. hydrophila. Pada hari ke-11, skor rata-rata mengalami penurunan, dikarenakan banyaknya ikan uji yang mengalami kematian. Kemudian pada hari ke-13, skor mulai mengalami penurunan. Proses penyembuhan gejala klinis mulai terjadi pada hari ke-13 sampai akhir perlakuan.
Gambar 21. Skor gejala klinis ikan lele dumbo selama perlakuan setelah penginfeksian bakteri A. hydrophila
4.1.3.5 Pemeriksaan Organ Dalam Ikan Uji
Pemeriksaan organ dalam ikan uji, dilakukan dengan membedah ikan uji pada akhir perlakuan. Organ dalam yang diamati meliputi ginjal, hati, empedu, dan limpa (Tabel 6).
Pada perlakuan kontrol negatif, terlihat organ dalamnya dalam keadaan normal. Ginjal berwarna merah tua kecoklatan, hati berwarna merah kecoklatan, empedu berwarna hijau kebiruan, dan limpa berwarna merah tua. Berbeda keadaannya dengan organ dalam pada kontrol negatif dan pengobatan, pada organ hati mengalami pembengkakan dan berwarna pucat, empedu berwarna kekuningan. Sedangkan untuk perlakuan pencegahan, keadaan organ dalamnya hampir sama dengan kontrol negatif.
Tabel 6. Pengamatan organ dalam ikan lele dumbo
Organ Kontrol
Negatif Pencegahan Pengobatan
Kontrol Positif
Ginjal Merah tua kecoklatan
Merah tua
kecoklatan Merah tua Merah tua kehitaman Hati Merah
kecoklatan Merah gelap
Merah sedikit pucat dan membengkak
Merah pucat dan membengkak Empedu Hijau kebiruan Hijau kebiruan Hijau kekuningan Kuning
(a) Kontrol negatif (c) Pengobatan
(b) Pencegahan (d) Kontrol positif
Gambar 22. Organ dalam ikan lele pada setiap perlakuan. (keterangan :1= ginjal; 2 = hati; 3 = empedu; 4 = limpa)
4.1.3.6 Kualitas Air
Kualitas air merupakan faktor yang harus diperhatikan dalam pemeliharaan ikan. Ikan akan tumbuh optimal apabila parameter kualitas air di tempat hidupnya sesuai dengan kisaran toleransi yang dapat diterima oleh ikan tersebut. Ikan lele dumbo memiliki aborescent organ, sehingga bahkan dalam keadaan perairan yang minim oksigen ikan lele dumbo masih dapat bertahan hidup.
Tabel 7. Kisaran kualitas air selama uji in vivo
Perlakuan Suhu (0C) pH DO (mg/l) TAN (mg/l)
Kontrol Negatif 29 6,99-7,15 4,4-7,5 0.07-0,84
Kontrol Positif 29 7,06-7,41 5,2-7,6 0.07-0,69
Pencegahan 29 6,99-7,18 5,8-7,7 0.07-0,80
Pengobatan 29 6,3-7,11 5,8-7,6 0.07-0,68
a
c
b
d
1
1
1
1 2
2 2
2
3
3
3
3
4
4 4