AKTIVITAS KITOOLIGOMER HASIL REAKSI ENZIMATIK TERHADAP PROLIFERASI SEL LIMFOSIT DAN SEL KANKER
SRI WAHYUNI
SEKOLAH PASCASARJANA. INSTITUT PERTANIAN BOGOR
ii
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi saya yang berjudul
Aktivitas Kitooligomer Hasil Reaksi Enzimatik terhadap
Proliferasi Sel Limfosit dan Sel Kanker
merupakan gagasan atau hasil penelitian saya sendiri, dengan pembimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi manapun.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Februari 2006
iii
Upon Proliferation of Lymphocyte and Cancer cells. Under Direction of MAGGY
T. SUHARTONO, FRANSISKA R. ZAKARIA, DAHRUL SYAH, and ARIEF
BUDI WITARTO.
iv
SRI WAHYUNI
Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor Pada Program Studi : Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
v
dan Sel Kanker
Nama : Sri Wahyuni
NIM : F261020041
Program Studi : Ilmu Pangan
Menyetujui,
1. Komisi Pembimbing
Ketua Anggota
Prof. Dr. Ir. Maggy T. Suhartono Prof. Dr. Ir. Fransiska R. Zakaria,M.Sc
Anggota Anggota
Dr. Ir. Dahrul Syah, M.Sc Dr. Arief B. Witarto, M. Eng
Mengetahui,
2. Ketua Program Studi 3. Dekan Sekolah Pascasarjana, Ilmu Pangan
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
vi
Penulis dilahirkan di Raha, Sulawesi Tenggara pada tanggal 30 Mei 1968 sebagai anak kedua dari empat bersaudara dari pasangan H. Sudarman dan Hj. Nurul Ichsan. Penulis menikah dengan Dr. Ir. Andi Khaeruni R., M.Si pada tanggal 24 Juli 1996 dan telah dikaruniai seorang putra Andi Muhammad Hibatullah Ramadhan lahir tanggal 8 Januari 1998.
Pendidikan Sekolah Dasar diselesaikan di SDN 1 Bau-Bau, Buton tahun 1981, Sekolah Menengah Pertama diselesaikan di SMPN 1 Kendari tahun 1984 dan Sekolah Menengah Atas diselesaikan di SMAN 1 Kendari tahun 1987. Pendidikan sarjana di tempuh di Jurusan Pendidikan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Keguruan dan Ilmu Pendidikan Ujung Pandang dan lulus tahun 1992. Pada tahun 1995 penulis memperoleh beasiswa Asian Development Bank (ADB) kerjasama dengan Universitas Haluoleo dari Departemen Pendidikan Nasional Republik Indonesia untuk mengikuti pendidikan Program Magister Sains pada Program Studi Ilmu Pangan, Program Pascasarjana Institut Pertanian Bogor dan lulus tahun 1999. Pada tahun 2002 penulis mendapat Beasiswa Pendidikan Pascasarjana (BPPS) dari Departemen Pendidikan Nasional Republik Indonesia untuk melanjutkan Program Dokt or pada Program Studi dan Sekolah Pascasarjana yang sama. Sejak tahun 1993 hingga sekarang penulis bekerja sebagai staf pengajar di Program Studi Pendidikan Kimia Jurusan MIPA, Fakultas Keguruan dan Ilmu Pendidikan, Universitas Haluoleo Kendari.
Bidang kajian yang penulis tekuni selama mengikuti pendidikan doktor adalah bidang enzimologi dan imunologi. Berkaitan dengan topik penelitian disertasi tersebut di atas, penulis telah mempresentasikan hasil penelitian ini pada seminar nasional Perhimpunan Ahli Teknologi Pangan Indonesia (PATPI) di Jakarta pada tanggal 26 Desember 2004 dan seminar nasional Perhimpunan Alumni dari Jepang (PERSADA) di Bogor pada tanggal 23 Agustus 2005, serta seminar lokal pada pusat penelitian bioteknologi Departemen Kelautan dan Perikanan Jakarta pada tanggal 12 Desember 2005.
vii
Segala puji bagi Allah SWT yang telah memberi rahmat dan berkah-Nya sehingga penulisan disertasi yang berjudul “Aktivitas Kitooligomer Hasil Reaksi Enzimatik terhadap Proliferasi Sel limfosit dan Sel Kanker” dapat diselesaikan. Disertasi ini dibuat sebagai salah satu syarat mahasiswa pascasarjana program S3 untuk meraih gelar Doktor pada Sekolah Pascasarjana, Institut Pertanian Bogor.
Banyak pengalaman dan ide yang penulis peroleh sejak penyusunan proposal, pelaksanaan penelitian, hingga penulisan disertasi ini. Oleh karena itu melalui kesempatan ini penulis menyampaikan terima kasih kepada berbagai pihak atas bantuan intelektual dan teknisinya dalam penelitian ini. Ucapan terima kasih yang sebesar-besarnya penulis haturkan kepada :
1. Tim komisi pembimbing yang terdiri dari : (1) Ibu Prof Dr. Ir. Maggy T. Suhartono sebagai ketua komisi pembimbing yang telah banyak memberikan perhatian, bantuan, dan meluangkan waktu untuk membimbing, berdiskusi dan mendanai sebagian besar biaya penelitian ini. (2) Ibu Prof. Dr. Ir. Fransiska Zakaria,MSc sebagai anggota komisi pembimbing yang telah banyak meluangkan waktu untuk membimbing, memberikan saran dan koreksi yang sangat berarti serta banyak memberikan bantuan bahan-bahan penelitian kultur sel kepada penulis. (3) Bapak Dr. Ir. Dahrul Syah, M.Sc sebagai anggota komisi pembimbing yang telah bersedia meluangkan waktu di sela-sela kesibukan beliau sebagai ketua departemen ITP untuk memberikan saran dan bimbingan kepada penulis. (4) Bapak Dr. Arief Budi Witarto M.Eng, sebagai anggota komisi pembimbing yang telah banyak meluangkan waktu untuk diskusi dan telah memberi tambahan informasi serta menyediakan bahan untuk pengujian apoptosis. Peran semua komisi pembimbing sungguh sangat berarti sehingga penelitian ini dapat berjalan dengan lancar dan dapat diselesaikan dengan tepat waktu.
viii
penulis menjalani dan menyelesaikan pendidikan S3 .
4. Bapak Prof Dr. Ir. Antonius Suwanto, M.Sc sekeluarga dan Bapak Dr. Ir. Budi Tjahjono, M.Agr sekeluarga yang telah banyak memberikan bantuan, perhatian dan rasa kekeluargaan yang erat kepada penulis sekeluarga selama menempuh pendidikan S2 dan S3.
5. Departemen Ilmu dan Teknologi Pangan IPB atas pembiayaan penelitian ini melalui program Research Grant Hibah Kompetisi B tahun 2004.
6. Ibu Dra. Hilda Suwigno; bapak Drh. Bambang Pontjo Priosuryanto, PhD; bapak dr.Bambang Wispriyono, PhD; Bapak Drh. Ketut Mudite, MSV; Ibu Dr. Drh. Retno Soedjono dan Ibu Dr. Drh. Ita Djuwita, M.Phil, penulis menghaturkan terimakasih yang sangat dalam atas segala keramahan dan kerjasama yang telah dijalin baik dalam bentuk bantuan sarana dan pengetahuan teknis pengujian kultur sel yang sangat penting bagi terlaksananya penelitian ini.
7. Para sahabat di lab MB : Ibu Ika, Sherli, Meidina, Ibu Nita, Ibu Eko, Pak Aris, dan bu Tati terimakasih atas bantuan keterampilan dasar dalam penelitian
enzim. Juga kepada tim seperjuangan menyelesaikan penelitian program B, yaitu Yamin atas sumbangan darahnya, Emma Rochima, Yanti, bu Eni, serta Pudin dan Nopi, terimakasih atas bantuan yang tak kenal lelah dalam mengejar target program B. Begitupula kepada Rudi, Siti, Agnes, Lukie, Prasna, Eni Palupi, Boby, mba Bemby, Ibu Sri Rahayu dan mba Rika, terimakasih atas segala dorongan semangat dan saran yang sangat membantu terutama di saat-saat akhir menjelang ujian tertutup dan terbuka. 8. Para sahabatku di IPN, Ibu Asriani, Ibu Diana, Ibu Endang Prangdimurti, Ibu
Dede R. Adawiah, Ibu Sri Widowati, mba Rifda, mba Susi, mba Yuspi, mba Romsyah, Ibu Suliantari, Risma, Sista, Ria, Sevelin, dan Tahrir serta teman-teman yang tak sempat penulis sebutkan namanya satu persatu, Terimakasih atas persahabatan yang indah semasa menjadi mahasiswa IPN.
ix
10. Ibu Sri, Ibu Ros, Pak Takdir, dan teman-teman lain yang tak sempat penulis sebut satu persatu yang telah bersama saling membantu selama penelitian di lab FKH.
11. Teman-teman Sekolah Pascasarjana asal Sultra dan Sulsel penulis mengucapkan terimakasih atas bantuan dan kerjasama selama di Bogor. Begitu juga kepada teman seperjuangan saya Dr. Ir Gusti ayu kade Sutariati, terimakasih atas segala kerjasama selama kurang lebih 3,5 tahun bersama-sama berjuang menjalani pendidikan S3 dengan segala suka dan duka. 12. Pengelola Beasiswa Program Pascasarjana (BPPS) Direktorat Jenderal
Pendidikan Tinggi, Departemen Pendidikan Nasional atas pemberian beasiswa kepada penulis untuk menjalani pendidikan S3.
13. Dekan FKIP Unhalu dan Rektor Universitas Haluoleo Kendari, atas izin yang diberikan kepada penulis untuk mengikuti pendidikan S3 di program studi Ilmu Pangan SPs IPB.
14. Dekan Sekolah Pascasarjana IPB beserta staf pegawai Pascasarjana IPB, Ketua PS Ilmu Pangan IPB atas perkenaan menerima dan membantu penulis
selama menjalani pendidikan S3 di IPB.
15. Dosen-dosen IPB, terutama pada program studi Ilmu Pangan, Terimakasih atas sumbangan ilmu pengetahuan yang sangat bermanfaat bagi penulis. 16. Khusus kepada Ayahanda H. Sudarman dan Ibunda Hj. Nurul Ichsan, penulis
mengucapkan banyak terima kasih atas asuhan, didikan dan doanya serta bantuan moril dan materil sehingga menghasilkan dukungan yang luar biasa bagi penulis dalam menempuh pendidikan doktor ini.
17. Pamanda Ir. Nasser Iskandar sekeluarga dan pamanda Drs. Abdul Rahim sekeluarga, terimakasih atas segala perhatian, bantuan, dan kerelaan selalu menerima penulis sekeluarga dengan baik. Begitu juga kepada keluarga Besar penulis di Jakarta, makassar, Rappang, Kendari dan Bau-bau, penulis mengucapkan terimakasih atas segala bantuan dan dukungan kepada penulis selama menempuh pendidikan dari S1 sampai S3.
x
dan dengan setia mendampingi dengan penuh pengertian selama penulis mengikuti program S3 ini.
Akhirnya semua budi baik yang diberikan kepada penulis semoga diterima dan dibalas berlipat ganda oleh Allah SWT. Tak lupa permohonan maaf bila penulis melakukan kesalahan baik yang disengaja maupun tidak. Semoga disertasi ini bermanfaat bagi khasanah ilmu pengetahuan. Amin.
Bogor, Februari 2006
xi
DAFTAR TABEL………...…... xiii
DAFTAR GAMBAR………... xiv
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN A. Latar Belakang ....……...………... 1
B. Tujuan Penelitian ... 3
C. Hipotesis Penelitian...…... ... 3
TINJAUAN PUSTAKA A. Kitosan, Senyawa-senyawa kitooligomer, dan Kitosanase...…....…... 4
1. Kitosan dan aplikasinya ... 4
2. Kitosanase dan mikrob penghasil kitosanase... 8
B. Bahan Pangan sebagai Immunoenhancer dan anti kanker... 10
C. Limfosit dalam Sistem Imun ...……….. 12
1. Sel Limfosit ... ... 13
2. Pengujian Proliferasi Limfosit ... 15
3. Mitogen Sebagai Senyawa Pemacu Proliferasi Sel Limfosit ... 17
D. Kultur Sel ... 18
E. Siklus Sel. ... 20
E. Kanker dan Mekanismenya... 21
F. Mekanisme Anti Kanker... 23
1. Mekanisme anti kanker beberapa senyawa alami dan sintesis ... 23
2. Apoptosis ... 25
3. Anti Protease ... .... 26
BAHAN DAN METODE A. Tempat dan Waktu Penelitian...………... 28
B. Bahan dan Alat Penelitian ...……..……...………... 28
C. Diagram Alir Penelitian ... 29
D. Metode Penelitian ...………...………... 31
HASIL DAN PEMBAHASAN A. Produksi Senyawa-senyawa Kitooligomer Secara enzimatik ... 44
B. Fraksinasi Hidrolisat Senyawa -senyawa Kitooligomer... 51
C. Aktivitas Senyawa-senyawa Kitooligomer terhadap Proliferasi Sel Limfosit ... ... 54
D. Aplikasi Senyawa-senyawa kitooligomer terhadap Proliferasi Sel Kanker ... ... 64
E. Mekanisme Penghambatan Proliferasi sel kanker oleh Senyawa-senyawa Kitooligomer... 78
1. Mekanisme apoptosis dan Kerusakan Membran... 78
xii
F. Kaitan Beberapa Aktivitas Biologi dari Hidrolisat Senyawa-senyawa
Kitooligomer... 89
SIMPULAN DAN SARAN... 94
DAFTAR PUSTAKA ... 96
xiii
Nomor Halaman
1 Beberapa penelitian produksi senyawa-senyawa kitooligosakarida ... 7
2 Karakteristik enzim kitosanase dari Bacillus licheniformis MB2 ... 9
3 Beberapa karakteristik biokimia kitosanase ... 10
4 Nilai normal elemen-elemen selular pada darah manusia ... 13
5 Aktivitas beberapa preparat enzim ... 43
6 Konsentrasi enzim dari beberapa hidrolisat ... 54
7 Aktivitas senyawa-senyawa kitooligomer dalam hidrolisat terhadap proliferasi sel limfosit.. ... 56
8 Aktivitas hasil fraksinasi senyawa-senyawa kitooligomer terhadap proliferasi sel limfosit ... ... 60
9 Pengaruh inkubasi bersama hidrolisat kitooligomer dan mitogen terhadap proliferasi limfosit ... 62
10 Beberapa hasil penelitian proliferasi sel limfosit ... 63
xiv
Nomor Halaman
1 Jalur degradasi kitin ... ... 5
2 Struktur molekul kitin dan kitosan... ... 5
3 Mekanisme reaksi MTT menjadi MTT formazam ... 16
4 Siklus sel ... 20
5 Diagram alir proses produksi senyawa-senyawa kitooligomer ... 30
6 Diagram alir aplikasi dan telaah mekanismeanti kanker senyawa-senyawa kitooligomer ... 31
7 Hidrolisis kitosan tanpa enzim ... 45
8 Hidrolisis kitosan dengan konsentrasi enzim dan derajat deasetilasi (DD) kitosan yang berbeda... ... 45
9 Hidrolisis preparat enzim FBS 0.0085 dengan kitosan yang berbeda derajat deasetilasi (DD) ... 46
10. Hidrolisis preparat enzim murni dengan kitosan yang berbeda derajat deasetilasi (DD)... 47
11 Hidrolisis preparat enzim dengan perbedaan konsentrasi kitosan 1% dan 0.5% ... 47
12 konsentrasi glukosamin berbagai hidrolisat enzimatik ... 48
13 Hasil pemurnian enzim kitosanase menggunakan kromatografi kolom interaksi hidrofobik (HIC) ... 50
14 Hasil deteksi kemurnian enzim menggunakan silver staining ... 51
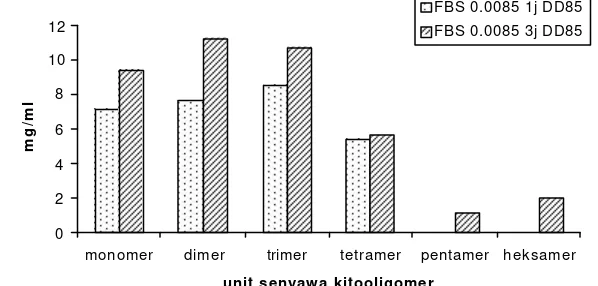
15 Komposisi senyawa-senyawa kitooligomer hasil reaksi preparat FBS 0.0085 DD 85 1j dan 3j ... ... 52
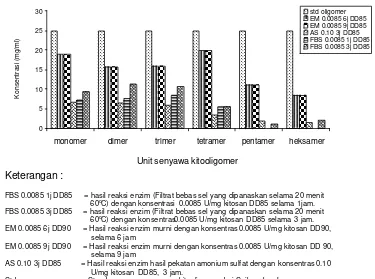
16 Komposisi senyawa-senyawa kitooligomer berbagai hidrolisat dengan konsentrasi enzim 0.0085, 0.10, dan 0.17 unit/mg kitosan ... 52
17 Komposisi dan konsentrasi senyawa-senyawa kitooligomer dalam berbagai hidrolisat ... 53
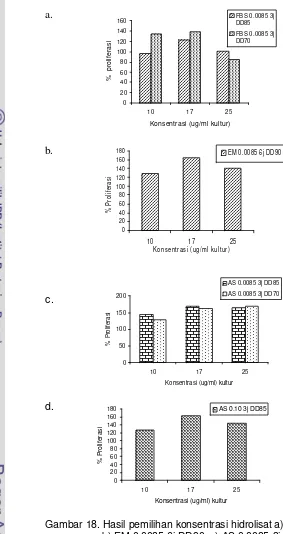
18 Hasil pemilihan konsentrasi hidrolisat ... 55
xv
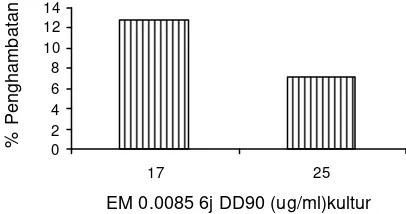
20 Pengujian konsentrasi efektif untuk uji penghambatan proliferasi ... 66
21 Pengaruh pemberian senyawa-senyawa kitooligomer dalam
hidrolisat terhadap penghambatan proliferasi sel KR-4 ... 66
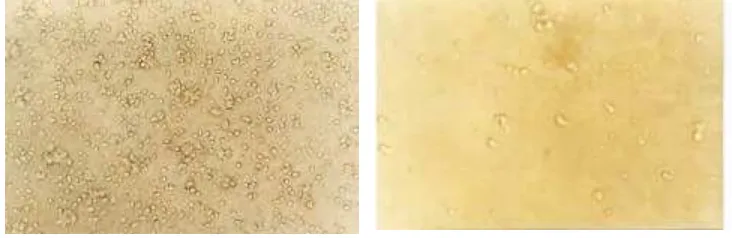
22 Profil sel KR-4 hasil perbesaran dengan lensa obyektif
inverted microscope sebesar 200 kal i... 67
23 Aktivitas senyawa-senyawa kitooligomer hasil fraksinasi sebagai penghambat proliferasi sel K562 ... 68
24 Aktivitas senyawa-senyawa kitooligomer dalam hidrolisat sebagai penghambat proliferasi sel K562 ... 69
25 Profil sel K562 hasil perbesaran lensa obyektif
inverted microscope sebesar 100 kali... 71
26 Aktivitas senyawa-senyawa kitooligomer hasil fraksinasi sebagai
penghambat proliferasi sel HeLa ... 72
27 Aktivitas senyawa-senyawa kitooligomer dalam hidrolisat enzimatik pada penghambatan proliferasi sel HeLa ... 73
28 Profil sel HeLa hasil perbesaran lensa obyektif
inverted microscope sebesar 100 kali... 74
29 Aktivitas senyawa-senyawa kitooligomer hasil fraksinasi sebagai penghambat proliferasi sel A549 ... 75
30 Aktivitas senyawa-senyawa kitooligomer hidrolisat dan senyawa
pembanding pada penghambatan proliferasi sel A549 ... 76
31 Profil sel A549 hasil perbesaran lensa obyektif
inverted microscope sebesar 100 kali... 77
32 Foto mikroskop elektron dari sel yang mengalami
kondensasi kromatin ... 80
33 Membran sel dengan reseptor karbohidrat pada permukaan sel dan hipotesis pengikatan glikoprotein dengan senyawa kitooligomer ... 81
xvi
35 Jumlah (%) sel apoptosis ... 84
36 Apoptosis sel K562 ... 85
37 Apoptosis sel HeLa ... 85
38 Apoptosis sel A549 ... 85
39 Kemampuan senyawa-senyawa kitooligomer dalam menghambat aktivitas enzim tripsin pada substrat kolagen (inkubasi 24 jam) ... 87
40 Kemampuan kitooligomer dalam hidrolisat enzimatik terhadap penghambatan aktivitas (inhibitor) enzim serin protease ... 88
41 Kemampuan kitooligomer dalam hidrolisat enzimatik terhadap aktivitas anti proliferasi sel KR4... 89
42 Kemampuan kitooligomer dalam hidrolisat enzimatik terhadap Aktivitas anti proliferasi sel K562... 90
43 Kemampuan kitooligomer dalam hidrolisat reaksi enzimatik terhadap aktivitas anti proliferasi sel HeLa ... 90
44 Kemampuan kitooligomer dalam hidrolisat enzimatik terhadap proliferasi sel limfosit ... 91
45 Hubungan antara kemampuan hidrolisat kitooligomer pada penghambatan proliferasi sel kanker dengan aktivitas inhibitor protease ... 92
46 Kromatogram HPLC hasil analisis dan fraksinasi kitooligomer ... 109
xvii
Nomor Halaman
1. Inform concern dari responden ... 107
2. Konsentrasi preparat hasil reaksi enzimatik ... 108
3. Kromatogram HPLC senyawa-senyawa kitooligomer ... 109
A. Latar Belakang
Banyak komponen bioaktif pangan saat ini diketahui mempunyai efek positif terhadap kesehatan, oleh karena itu penggunaan pangan yang diketahui mengandung senyawa bioaktif atau pangan fungsional merupakan hal yang sangat bermanfaat. Pangan yang kita konsumsi sehari-hari pada kenyataannya mengandung ribuan senyawa bioaktif, banyak diantaranya yang memiliki cukup potensi untuk meningkatkan kesehatan, contohnya adalah sulphoraphane, kurkumin, likopen, dan polifenol dalam teh yang merupakan agen chemopreventive yang telah terbukti (Elliot dan Ong 2002). Saat ini penggunaan pangan fungsional untuk kesehatan telah berkembang pesat, salah satu faktor pendukungnya adalah keinginan banyak orang untuk meningkatkan kesehatan dengan cara yang alami. Hal tersebut dilatarbelakangi oleh berbagai efek samping yang merugikan dari konsumsi obat-obatan kimiawi yang telah banyak terbukti, sehingga timbul keinginan untuk menggunakan bahan-bahan dari alam untuk meningkatkan kesehatan. Selain faktor tersebut, konsumsi makanan yang tidak seimbang juga telah terbukti menjadi kunci dari faktor eksternal yang berpengaruh pada kejadian penyakit kronis, termasuk terjadinya
penyakit-penyakit kanker. Upaya pencegahan terhadap berbagai jenis penyakit-penyakit termasuk penyakit kanker secara dini melalui pangan yang sehat meningkatkan konsumsi komponen bioaktif sebagai pangan fungsional. Disamping itu penggunaan komponen bioaktif dari bahan-bahan alami dengan tujuan untuk pengobatan penyakit dalam bentuk nutraceuticals kini sudah banyak dijumpai, termasuk senyawa -senyawa kitooligo mer yang berasal dari degradasi limbah bahan berkitin saat ini mulai digunakan sebagai bahan nutraceuticals. Senyawa kitooligomer ini telah menarik perhatian industri karena berbagai manfaatnya untuk pangan dan medis, sehingga memiliki nilai ekonomis cukup baik untuk dikembangkan saat ini, dengan harga jual di pasaran internasional yang telah mencapai US$ 60.000 per ton (Sandford 2003).
dipandang sangat penting dilakukan untuk usaha peningkatan nilai tambah limbah berkitin melalui usaha produksi senyawa bioaktif kitooligomer yang dapat diaplikasikan sebagai pangan fungsional dan nutraceutical.
Limbah berkitin di Indonesia pada tahun 2002 dihasilkan sekitar 112.208 ton (Anonim 2004). Limbah ini belum termanfaatkan secara baik dan berdaya guna, bahkan sebagian besar merupakan buangan yang juga turut mencemari lingkungan. Oleh karena itu perlu dilakukan berbagai usaha penggalian potensi lokal untuk memanfaatkan limbah berkitin menjadi bahan yang bermanfaat, antara lain mengolahnya menj adi kitosan dan oligomernya. Saat ini produk kitosan dan oligomernya telah banyak dijual dalam bentuk kapsul nutraceutical dan pharmaceutical dengan berbagai merek dagang yang umumnya berasal dari Korea dan Jepang.
Senyawa-senyawa kitooligomer dapat diproduksi secara enzimatik dari senyawa kitin dengan menggunakan enzim kitinase, kitin deasetilase dan kitosanase. Kitin deasetilase memodifikasi kitin menjadi kitosan. Kitosanase menguraikan kitosan menjadi senyawa-senyawa kitooligomer. Proses pengubahan kitin menjadi turunan oligosakarida secara kimiawi oleh asam cenderung dihindari karena proses ini tidak dapat dikontrol dan menghasilkan lebih banyak monomer D-glukosamin dan lebih sedikit oligomer, sedangkan yang memiliki aktivitas biologi penting adalah senyawa
oligomernya. Hidrolisis kitosan secara enzimatis adalah cara yang lebih baik untuk mendapatkan senyawa-senyawa kitooligomer dengan derajat polimerisasi yang lebih tinggi. Ukuran molekul produk akhir hidrolisis sangat penting diperhatikan karena sifat fungsional bergantung pada berat molekulnya.
dan pemurniannya (Suhartono 1994). Indonesia merupakan negara yang kaya diversitas sehingga peluang menemukan mikroba termofil penghasil enzim yang unik cukup realistik. Salah satu mikrob termofilik penghasil enzim kitosanase dari Indonesia yang telah berhasil dipilah dari sumber air panas di Tompaso Sulawesi Utara adalah
Bacillus licheniformis MB2. Diharapkan enzim dari mikroba ini dapat bermanfaat bagi proses industri dan bioteknologi, salah satunya adalah dapat digunakan untuk memproduksi senyawa bioaktif kitooligomer yang memiliki banyak manfaat.
Berdasar latar belakang tersebut, maka dalam penelitian ini dilakukan kajian produksi senyawa kitooligomer yang bersifat bioaktif dengan menggunakan enzim kitosanase yang dihasilkan oleh isolat Bacillus licheniformis MB2 yang telah dikarakterisasi sebelumnya secara menyeluruh oleh Chasanah (2004). Bakteri tersebut diketahui menghasilkan kitosanase pada pH optimum 6-7, stabil terhadap kisaran pH 4 – 6.8, tahan panas (suhu optimum 70oC) dan tahan senyawa denaturan ( terutama guanidin dan urea). Selanjutnya penelitian ini ditujukan untuk menghasilkan senyawa-senyawa kitooligomer yang memiliki aktivitas biologis sebagai anti kanker, sehingga senyawa-senyawa kitooligomer dapat dijadikan material anti kanker bagi pengobatan penyakit kanker di masa datang.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk: (1) Mengaplikasi enzim kitosanase termostabil dari
Bacillus licheniformis MB2 untuk memproduksi senyawa -senyawa kitooligomer yang memiliki aktivitas biologi khususnya terhadap sel limfosit dan sel kanker (2) Menganalisis potensi anti kanker dari senyawa-senyawa kitooligomer.
C. Hipotesis
Hipotesis dalam penelitian ini adalah :
1. Enzim kitosanase dari Bacillus licheniformis MB2 dapat digunakan untuk memproduksi senyawa-senyawa kitooligomer yang memiliki aktivitas biologi terhadap sel limfosit dan sel kanker.
A. KITOSAN, KITOOLIGOMER DAN KITOSANASE
1. Kitosan dan Aplikasinya.
Kitosan adalah biopolimer yang tersusun atas D-glukosamin dengan ikatan glikosidik â 1 4 yang dapat dihasilkan dari kitin, yaitu polimer linier â (1 4)-2-asetamido-2-deoxy-D-glukosa (N-asetilglukosamin). Kitin adalah komponen utama pada kulit kepiting dan udang atau kelompok kerang-kerangan (crustacea) (Goosen et al. 1997). Sebagian besar kitosan untuk penggunaan komersial dan penelitian diproduksi dari deasetilasi kitin yang berasal dari kulit udang dan kepiting, limbah utama pada industri pengolahan shellfish. Secara alami kitosan dapat dihasilkan dari fungi golongan zygomycetes (Miyoshi et al. 1992). Kitosan adalah polimer alami, sehingga tidak bersifat toksik, tidak larut dalam air yang bersifat basa tetapi larut baik dalam pelarut asam di bawah pH 6. Aplikasi polimer kitosan tidak sebanyak bentuk kitooligomernya, hal ini disebabkan karena kitosan memiliki berat molekul yang besar dan viskositas yang tinggi.
Untuk memperoleh kitosan dari kitin dapat dilakukan secara kimia dan enzimatis. Kedua reaksi tersebut bertujuan untuk menghilangkan gugus asetil yang terdapat pada kitin. Reaksi enzimatis menggunakan enzim kitin deasetilase, sedangkan untuk memperoleh kitosan secara kimia dari kitin dapat melalui kombinasi perlakuan panas (60 o
C – 140 o
C) dan larutan alkali (larutan NaOH 30% – 50%). Derajat deasetilasi kitosan biasanya berada antara 70% - 90% tergantung metoda yang digunakan (Goosen et al. 1997). Derajat deasetilasi dipengaruhi oleh konsentrasi basa, temperatur dan rasio kitin terlarut, derajat deasetilasi akan meningkat dengan meningkatnya temperatur atau konsentrasi NaOH (Chang et al. 1997). Proses deasetilasi secara termokimia tersebut dalam banyak hal tidak menguntungkan karena tidak ramah lingkungan, prosesnya tidak mudah dikendalikan, dan kitosan yang dihasilkan memiliki berat molekul dan derajat deasetilasi yang tidak seragam (Chang et al. 1997; Tsigos et al.
Kitin deasetilase (EC 3.5.1.4)
Kitin Kitosan Kitinase
(E.C 3.2.1.14)
Lysozyme Kitosanase (E.C 3.2.1.17) (EC 3.2.1.132)
Kitin oligosakarida Kitosan oligosakarida N-acetil-β-D-
glukosamidase D-glukosamidase
(EC 3.2.1.30)
N-Asetil – D- Glukosamin D-Glukosamin
Gambar 1 Jalur degradasi kitin (Goosen 1997)
Gambar 2 Struktur molekul kitin dan kitosan (Li et al. 1997)
lebih rendah, karena sifat fungsional bergantung pada berat molekulnya (Suzuki 1996, Kolodziejska et al. 2000).
Banyak studi yang telah dilakukan mengenai penggunaan enzim untuk mendegradasi kitosan. Aiba (1993,1994) menghidrolisis kitosan menggunakan enzim kitinase dan lisozim. Pantaleone et al. (1992) dan Brine et al. (1992) melaporkan penggunaan enzim glikanase, protease, lipase, dan tannase yang berasal dari bakteri, fungi, mamalia, dan tanaman untuk menghidrolisis kitosan. Muzarelli et al. (1995a, 1995b) telah menggunakan enzim papain dan lipase untuk depolimerisasi kitosan. Guo dan Hung (2002) melaporkan penggunaan enzim selulase untuk memperoleh senyawa -senyawa kitooligosakarida dari kitosan. Berbagai proses tersebut dikembangkan untuk menghasilkan proses hidrolisis yang efisien terhadap kitosan, akan tetapi penggunaan enzim-enzim tersebut membutuhkan konsentrasi yang relatif tinggi, sedangkan kitosanase menunjukkan aktivitas yang cukup baik pada konsentrasi yang kecil (Jeon dan Kim 2000).
Telah banyak dilaporkan adanya sifat fisiologis penting senyawa-senyawa kitooligo mer hasil degradasi kitin dan kitosan, yang memiliki daya antibakteri, antijamur, antitumor, penurun kolesterol, penurun tekanan darah tinggi, dan
kemampuannya dalam meningkatkan daya imunologis (Dalwoo 2004, Muzarelli 1996, Shahidi et al.1999, Suzuki et al. 1986, Suzuki 1996). Dalam bidang farmasi, kitooligomer mampu menurunkan kolesterol. Aktivitas hipokolesterolemik kitooligomer kemungkinan disebabkan karena penghambatan pembentukan
micelle yang mengandung kolesterol, asam lemak dan monogliserida, sehingga berperan aktif sebagai anti kolesterol (Goosen 1997, Dodane dan Vilivalam 1998). Cui dan Mumper (2001) meneliti tentang penggunaan kitosan dan oligomernya untuk berkompleks dengan CMC (Carboxyl Methyl Cellulose) guna membentuk kationik nano patrikel yang stabil untuk keperluan imunisasi genetik. Kemampuan kitosan dan senyawa-senyawa kitooligomer sebagai antimikroba telah diujikan pada organisme penghasil spora pada media laboratorium dan makanan, ternyata Kitooligomer yang lebih pendek lebih efektif berperan sebagai antimikroba daripada yang berantai panjang (Shahidi et al. 1999 ; Rhoades dan Roller 2000 ; Meidina 2005 ).
Tabel 1 Beberapa penelitian produksi senyawa-senyawa kitooligo mer
N o
Enzim Sumber Aktivitas Metode Substrat & konsentrasi
Hasil Referensi
1. Kitosanase Bacillus
pumilus
2. Kitosanase dan Mikroba Penghasil Kitosanase
Kitosanase (EC 3.2.1.132) merupakan enzim yang menghidrolisis ikatan glikosidik kitosan untuk menghasilkan kitooligomer (kitooligosakarida). Kitosan ( â-(1 4)-N-glukosamin) merupakan turunan dari kitin yang diperoleh melalui deasetilasi sempurna atau sebagian. Menurut Fukamizo dan Brzezinski (1997), kitosanase adalah enzim yang menghidrolisis kitosan, memotong pada ikatan â-1,4-glikosidik kecuali ikatan GlcNAc-GlcNAc. Kitosanase dibagi menjadi tiga klas berdasarkan spesifik pemotongannya yaitu klas 1, enzim memotong pada ikatan GlcN-GlcN dan GlcNAc-GlcN; klas 2, enzim yang memotong hanya pada ikatan GlcN; klas 3, enzim yang memotong pada ikatan GlcN dan GlcN-GlcNAc (Saito et al. 1999; Fukamizo dan Brzezinski 1997). Pada Tabel 2 disajikan beberapa karakteristik enzim kitosanase dari berbagai sumber.
Berdasarkan homologi sekuen asam amino, Yoon et al. (2000) mengkategorikan kitosanase ke dalam empat kelompok, kelompok I berhubungan erat dengan kitosanase dari B. circulans, B.ehemensis, dan
Burkholderia gladioli (similaritas sekitar 81-84%). Kelompok II termasuk
Amycolaptosis sp., Nocardioides sp. N 106, Streptomyces sp. N 174 (similaritas sekitar 73-76%). Bacillus sp. CK4 dan Bacillus subtilis termasuk dalam golongan kelompok III dengan similaritas sekitar 76.6%. Sedangkan Sphingobacterium dan
Matsuebacter digolongkan ke dalam kelompok IV dengan similaritas sekitar 75%.
Carbohydrate Active Enzyme (CAZY) mengklasifikasi kitosanase pada 3 (tiga) kelompok, yaitu family 46, 75 dan 80. Sebagian besar hasil studi kitosanase yang terdapat pada bakteri termasuk dalam anggota glikosida hidrolase family 46, dimana kitosanase dari fungi patogen tanaman seperti Fusarium solani
diklasifikasi sebagai glikosida hidrolase family 75. Chitosanotabidus dan
Sphingobacterium multivorum termasuk golongan glikosida hidrolase family 80 (Park et al. 1999). Diantara kitosanase yang telah diteliti tersebut hanya glikosida hidrolase family 46 yang telah ditentukan struktur tiga dimensinya dan hanya dua struktur kristal kitosanase, yaitu dari Streptomyces sp. N174 dan
sp. CK4 menunjukkan bahwa Glu-50 tidak mutlak esensial untuk aktivitas katalitik, tetapi mungkin memiliki peranan penting untuk menjaga struktur sisi katalitik kitosanase (Yoon et al. 2001).
Berbagai pertimbangan penggunaan mikroba sebagai sumber enzim kitosanase antara lain adalah mikrob a dapat tumbuh relatif cepat, bahan baku relatif murah, mudah diisolasi, dan terbuka peluang untuk meningkatkan mutu enzim melalui rekayasa genetika (Madigan et al. 2000). Informasi tentang mikroba penghasil enzim kitosanase telah dilaporkan oleh beberapa peneliti, antara lain kitosanase dari Bacillus sp P1-7S dilaporkan oleh Seino et al. (1991),
Matsuebacter chitosanotabidus 3001 oleh Park et al. (1999), Bacillus sp strain CK4 oleh Yoon et al. (2001), Burkholderia gladioli strain CHB101 oleh Shimosaka
et al. (2000), Streptomyces N174 oleh Somashekar dan Joseph (1996). Kitosanase yang berasal dari fungi dilaporkan oleh Shimosaka et al. (1993) yang mengisolasi kitosanase dari Fusarium solani f.sp. dan phaseoli, Cheng dan Li (2000) mengisolasi kitosanase dari Aspergillus Y2K. Kitosanase yang berasal dari tanaman Cucumis sativus, Citrus sinensis, dan Barley telah dilaporkan oleh Somashekar dan Joseph (1996).
Karakteristik enzim kitosanase yang berasal dari Bacillus licheniformis MB2
disajikan dalam Tabel 2. Beberapa karakteristik enzim kitosanase yang berasal dari berbagai sumber disajikan pada Tabel 3.
Tabel 2 Karateristik enzim kitosanase dari Bacillus licheniformis MB2 a)
No. Parameter Karakteristik
1.
Buffer phosphat 0.05 M pH 6 75 kDa
Mn
Kitosan terlarut
Tabel 3 Beberapa karakteristik biokimia kitosanase
Inhibitor substrat Produk Referensi
Matsuebacter
B. BAHAN PANGAN SEBAGAI IMMUNOENHANCER DAN ANTIKANKER
dan meningkatkan aktivitas sitotoksik dari sel NK. Selanjutnya Ogata et al.
(2000), melaporkan senyawa turunan asam nikotinat dan nikotinamida yaitu niasin (jenis vitamin larut air) ditemukan tidak membunuh sel limfosit, tetapi dapat menginduksi apoptosis pada sel K562.
Kelompok solanase (tomat, kentang, terung dan cabai) dan rempah-rempah (jahe, cengkeh, kunyit) juga merupakan kelompok bahan pangan yang mempunyai sifat anti karsinogenik. Menurut Yuana (1998), rempah-rempah seperti jahe, lempuyang, kencur dan pasak bumi mempunyai komponen-komponen yang dapat memberikan efek penghambatan terhadap sel kanker K562. Agustinisari (1998) melaporkan bahwa ekstrak air dan etanol jahe segar dapat menekan proliferasi sel leukimia (K562) secara in vitro. Ekstrak air dan etanol dari bawang putih dari hasil penelitian Lastari (1997) dapat menekan proliferasi sel-sel K562 secara in vitro dan menaikkan aktivitas sel NK manusia. Rusmarilin (2003) juga melaporkan aktivitas anti kanker dari ekstrak lengkuas lokal (Alpinia galanga (L) Sw) pada galur sel kanker manusia dan mencit.
Senyawa turunan flavonoid yang terkandung dalam bahan pangan antara lain quersetin memperlihatkan kemampuan menghambat proliferasi sel leukimia dan sel ovari manusia secara in vitro (Zakaria et al. 1997). Iwashita et al. (2000)
juga melaporkan aktivitas senyawa isoliquiritigenin dan butein turunan dari flavonoid mampu menghambat pertumbuhan sel dan menginduksi terjadinya apoptosis pada sel-sel B16 Melanoma 4A5. Damayanti (2002) melaporkan senyawa antioksidan dari bekatul padi (Oryza sativa) mampu menekan proliferasi sel kanker KR4 sebesar 30 %, K562 sebesar 12%, dan melanoma sebesar 23%. Beberapa ekstrak tanaman juga dilaporkan memiliki kemampuan memperbaiki sistem imun dan bersifat anti kanker, antara lain hasil penelitian dari Konishi et al. (1985) dan Noda et al. (1996) yang melaporkan aktivitas anti tumor dari chlorella vulgari. Senyawa fenol glikosida, neohankosida C, yang diisolasi dari tanaman Cynanhum hancockianum diketahui bersifat anti tumor dan mempunyai aktivitas imunomodulator (Konda et al. 1997). Eksktrak tanaman
Uncaria tomentosa dilaporkan tidak bersifat toksik (Maria et al; 1997), menginduksi proliferasi limfosit (Wurm et al. 1998) dan mampu menghambat proliferasi serta menginduksi apoptosis sel-sel leukimia K562 dan HL-60 (Sheng
sel HeLa. Ananta (2000) melaporkan ekstrak cincau hijau (Cyclea barbata L.
Miers) mampu menghambat proliferasi sel K562 sebesar 70% dan sel HeLa sebesar 30%. Puspaningrum (2003) melaporkan ekstrak air kayu secang (Caesalpinia sappan Linn) mampu memproliferasi sel limfosit limfa tikus dan menekan proliferasi sel K562 secara in vitro sebesar 20.8%.
Senyawa-senyawa anti kanker ternyata tidak hanya berasal dari daratan, Aoki et al. (2004) melaporkan aktivitas anti kanker dari smenospongine yaitu senyawa aminokuinon seskuiterpen yang diisolasi dari spong laut terhadap sel kanker K562 (chronic myelogenous leukemia) pada konsentrasi 3 – 15 µM. Senyawa kitin dan turunannya yang berasal dari hewan laut udang dan kepiting ternyata juga dilaporkan memiliki aktivitas anti kanker, laporan ini antara lain dikemukakan oleh Yeon (2004) bahwa heksa N-asetil kitoheksaose dan kitoheksaose memiliki pengaruh penghambat pertumbuhan dari sel tumor Meth A-solid. Semenuk et al. (2001) melaporkan aktivitas kitooligomer sebagai anti tumor. Pae et al. (2001) melaporkan terjadinya induksi granulositik pada sel
promyelocyticleukemia (HL-60) oleh water-soluble chitosan oligomer (WSCO). Shen (2002) juga melaporkan kitosan larut air (WSC) secara signifikan menghambat proliferasi sel kanker ASG.
B. LIMFOSIT DALAM SISTEM IMUN
Limfosit adalah sel darah putih (leukosit) yang mampu menghasilkan respon imun spesifik terhadap berbagai jenis antigen yang berbeda. Limfosit (leukosit) berukuran kecil, berbentuk bulat (diameter 7-15 µm), dan banyak terdapat pada organ limfoid seperti seperti limpa, kelenjar limfe dan timus. Terdapat dua kelas leukosit yaitu, yang mengandung granula dalam sitoplasmanya (granulosit) dan agranulosit yang tidak mengandung granula (Ganong 1990). Limfosit merupakan sel kunci dalam proses respons imun spesifik, mengenali antigen melalui reseptor antigen dan mampu membedakannya dari komponen tubuhnya sendiri (Kuby 1992).
Tabel 4 Nilai normal elemen-elemen selular pada darah manusiaa)
Elemen-elemen seluler
Rata-rata sel/ml
Kisaran normal Persen dari leukosit total
Sistem imun merupakan sistem interaktif kompleks dari beragam jenis sel imunokompeten yang bekerjasama dalam proses identifikasi dan eliminasi mikroorganisme patogen dan zat-zat berbahaya lainnya yang masuk ke dalam tubuh. Sistem imun dibedakan dalam dua kelas yaitu sistem imun non spesifik dan spesifik. Respon imun non spesifik timbul sebagai reaksi terhadap mikroorganisme patogen dan zat asing lainnya melalui fagositosis dan monosit (makrofag), barier kimia melalui sekresi internal dan eksternal, lisozim dalam mukus jaringan, air mata, laktoperoksidase dalam saliva, protein darah, interferon, sistem kinin dan komplemen, dan sel Natural Killer (NK) (Parslow 1997). Sistem imun spesifik meliputi sistem imun seluler dan humoral. Sistem imun seluler memberikan pertahanan terhadap serangan mikroorganisme intra dan ekstraseluler melalui sekresi limfokin seperti interferon dan interleukin. Sedangkan sistem imun humoral memberi pertahanan melalui produksi antibodi terhadap antigen spesifik (Roitt dan Delves 2001).
1. Sel Limfosit
B memiliki 105 B Cell Receptor (BCR), dan setiap BCR memiliki dua situs pengikatan antigen yang identik. Antigen yang umum bagi sel B adalah protein dengan struktur tiga dimensi. BCR dan antibodi mengikat antigen dalam bentuk aslinya. Hal ini membedakan sel B dengan sel T, yang mengikat antigen yang sudah terproses dalam sel (Kresno 1996).
Sel limfosit dapat mengenali suatu antigen secara spesifik dan menerima sinyal untuk berproliferasi. Setelah berikatan dengan antigen, limfosit B akan mengalami proses perkembangan melalui 2 jalur, yaitu (a) berdiferensiasi menjadi sel plasma yang menghasilkan imunoglobulin, dan (b) membelah lalu kembali dalam keadaan istirahat sebagai sel limfosit B memori. Sel limfosit mampu berproliferasi dan berdiferensiasi menjadi sebuah klon yang terdiri dari sel-sel efektor dengan spesifisitas antigen yang sama (Decker 2001).
Sel T merupakan bagian dari sel limfosit yang sebagian besar terdapat dalam sirkulasi darah, yaitu sebanyak 65-85% (Kresno 1996). Sel T terdiri dari tiga subset yaitu sel Tc atau sel T sitotoksik, sel Th atau sel T helper, dan sel Ts atau sel T supressor (Roitt dan Delves 2001). Sel Tc berfungsi untuk membunuh sel-sel yang terinfeksi patogen intraselular, dan sel Th berperan dalam stimulasi sintesis antibodi dan aktivasi makrofag dengan cara mensekresikan molekul
sinyal yang disebut sitokin. Sel Ts mampu menekan aktivitas sel imun. Sel T memiliki molekul T Cell Antigen Receptor (TCR) yang dapat mengenali epitop suatu antigen melalui kerjasama dengan molekul protein permukaan pada
Antigen Presenting Cells (APC). Sel T teraktivasi oleh antigen spesifik sehingga terstimulasi untuk berproliferasi dan berdiferensiasi menjadi sel T memori dan berbagai sel T efektor yang mensekresi berbagai limfokin. Limfokin tersebut berpengaruh pada aktivasi sel B, Tc, dan sel-sel fagositik,sel NK dan sel lain yang terlibat dalam sistim imun (Roitt dan Delves 2001).
Delves (2001), ketika sel terinfeksi virus atau berubah bentuk menjadi sel yang termutasi, molekul permukaannya berubah. Perubahan ini dikenali oleh sel NK, lalu sel NK membunuh sel tersebut. Sel NK secara fenotip berbeda dengan sel limfosit T maupun sel limfosit B, yaitu tidak memiliki CD3/TCR maupun sIg (surface immunoglobulin). Sel ini memiliki petanda CD56 dan CD16. Sel yang terinfeksi virus menghasilkan interferon yang dapat memberi isyarat ke sel pada jaringan yang berdekatan. Sel NK diduga dapat mengenali sel tumor atau sel yang terinfeksi virus karena sel sasaran tersebut mengekspresikan molekul glikoprotein pada permukaan sel yang membedakannya dari sel normal. Glikoprotein tersebut kemudian bertindak sebagai lektin yang dapat mengikat sel NK melalui reseptor yang terdapat pada permukaan sel NK sehingga terjadi ransangan (Kresno 1996). Sitolisis terhadap sel tumor dapat terjadi karena dilepaskannya faktor sitotoksik (perforin) yang berasal dari granula dalam sel NK. Disamping itu di dalam granula juga terdapat zat yang tahan terhadap faktor sitotoksik, yaitu kondroitin sulfat A, yang melindungi sel NK terhadap autolisis oleh substansinya sendiri (Kresno 1996).
2. Pengujian Proliferasi Limfosit
Proliferasi merupakan fungsi biologis mendasar pada sel limfosit, yaitu meliputi proses diferensiasi dan pembelahan sel. Aktivitas proliferasi limfosit merupakan salah satu parameter yang dapat digunakan untuk mengukur status imunitas karena proses proliferasi menunjukkan kemampuan dasar dari sistem imun (Roit dan Delves 2001). Limfosit merupakan sel tunggal yang bertahan baik saat dikultur dalam media sintetik lengkap. Respon proliferatif kultur limfosit dalam media sintetik dapat digunakan untuk menggambarkan fungsi limfosit dan status imun individu (Tejasari 2000). Zakaria et al. (1992) menyatakan bahwa kemampuan limfosit untuk berproliferasi atau membentuk klon menunjukkan secara tidak langsung kemampuan respon imunologik atau tingkat kekebalan.
mitogen, maka limfosit akan berproliferasi secara tidak spesifik. Begitupula, bila limfosit dikultur dengan antigen spesifik maka limfosit akan berproliferasi secara spesifik.
Metode yang lebih sederhana untuk penghitungan jumlah sel yang berproliferasi adalah metode pewarnaan MTT (3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide). Prinsip metode MTT adalah konversi MTT menjadi senyawa formazan yang berwarna ungu oleh aktivitas enzim suksinat dehidrogenase dari mitokondria sel hidup (Kubota et al. 2003). Reaksi yang terjadi digambarkan dalam Gambar 3. Jumlah senyawa formazan yang terbentuk adalah proporsional dengan jumlah sel limfosit yang hidup. Selain dengan metode MTT, perhitungan sel dapat dilakukan dengan metode pewarna trifan biru, yang hanya dapat mewarnai jika membran sel telah rusak, sehingga dapat digunakan untuk membedakan sel hidup dan mati atau rusak. Sel yang hidup tidak akan berwarna dan berbentuk bulat, sedangkan sel mati akan berwarna biru dan mengkerut (Bird dan Forrester 1981).
Gambar 3 Mekanisme reaksi MTT menjadi MTT formazan (Kubota et al. 2003)
Beberapa senyawa yang telah diketahui mampu meningkatkan proliferasi sel limfosit adalah : vitamin C dan E (Budiharto, 1997), ekstrak bawang putih (Lastari, 1998), ekstrak jahe (Zakaria et al., 1999), ekstrak tanaman cincau hijau (Pandoyo, 2000) ekstrak air kayu secang (Caesalpinia sappan Linn) (Puspaningrum 2003), teh daun dan serbuk gel cincau (Cyclea) (Setiawati 2003),
3. Mitogen sebagai Senyawa Pemacu Proliferasi Se l Limfosit
Mitogen adalah sumber ligan polipeptida yang dapat berikatan dengan reseptor yang terdapat pada permukaan sel. Beberapa mitogen merupakan faktor pertumbuhan yang mengaktivasi tirosin kinase. Aktivasi tersebut diawali oleh mitogen yang mengakibatkan adanya urut-urutan sinyal yang berpengaruh terhadap berbagai faktor transkripsi dan berpengaruh terhadap aktivitas gen di dalam sel (Decker 2001).
Beberapa molekul pada patogen mampu berikatan dengan molekul permukaan limfosit yang bukan merupakan reseptor antigen. Jika pengikatan ini mampu menginduksi limfosit untuk membelah (mitosis), maka molekul tersebut disebut mitogen. Mitogen menginduksi proliferasi limfosit pada frekuensi tinggi tanpa memerlukan adanya spesifisitas antigen, disebut dengan aktivasi poliklonal. Beberapa mitogen hanya mampu menginduksi proliferasi sel B, beberapa hanya berpengaruh pada sel T, dan ada juga yang mampu menginduksi keduanya. Beberapa mitogen disebut antigen T-independen, karena mampu menginduksi sel B untuk mensekresi antibodi tanpa ada bantuan dari sel Th (Decker 2001).
pembentukan DNA dan RNA, peningkatan metabolisme lemak dan lain-lain (Letwin dan Quimby 1987).
Lektin fitohemaglutinin (PHA) adalah protein non enzimatik, berikatan dengan karbohidrat secara reversibel. Fungsi biologis dari lektin adalah kemampuan mengenal dan berikatan dengan struktur karbohidrat spesifik, khususnya berikatan dengan oligosakarida. Lektin dapat berikatan dengan berbagai sel yang memiliki molekul permukaan berupa glikoprotein atau glikolipid. Beberapa gugus spesifik lektin telah diidentifikasi seperti mannose, galaktosa, asetilglukosamin, asetil galaktosamin, L-fruktosa, dan asam N-asetilneraminik. Sub unit lektin saling berhubungan satu dengan yang lain melalui ikatan non kovalen atau ikatan-ikatan disulfida. Beberapa lektin membutuhkan kation divalen seperti kalsium, magnesium dan mangan untuk berikatan dengan karbohidrat. Lektin terdiri dari enam famili yang telah dikenal yaitu : lektin legum, lektin sereal, lektin jenis P, C, S dan pentraxis (Letwin dan Quimby 1987).
D. KULTUR SEL
Kultur sel secara in vitro merupakan suatu cara untuk mengembangbiakkan atau menumbuhkan sel di luar tubuh hewan atau manusia. Lingkungan atau bahan makanan untuk pertumbuhan sel secara in vitro diusahakan menyerupai keadaan sel secara in vivo. Oleh karena itu, diperlukan suatu media pertumbuhan yang berisi asam-asam amino, vitamin, mineral, garam-garam anorganik, glukosa dan serum. Peranan serum dalam medium biakan sangat penting yaitu sebagai nutrien untuk pertumbuhan sel serta fungsinya dalam pelekatan sel. Serum memberikan hormon-hormon penting, faktor penempel sel ke matriks tempat sel tumbuh, protein, lipid serta mineral-mineral yang diperlukan sebagian besar jenis sel untuk tumbuh dan berkembang (Freshney 1994). Sel yang dikultur dapat berupa suatu galur sel, yaitu populasi sel yang berasal dari suatu sumber jaringan tertentu yang mengalami pengkulturan lebih lanjut, hingga mencapai sub kultur.
atau sel dari tumor malignant, sedangkan sel monolayer biasanya untuk sel-sel yang berasal dari jaringan (Freshney 1994).
Kultur galur sel kanker yang berasal dari manusia, seperti kultur galur KR-4 (lymphablastoid B) dan sel K562 (chronic myelogenous leukemia) merupakan jenis sel suspensi, sel HeLa (epithel carcinoma cervix) dan sel A549 (Lung carcinoma) merupakan jenis sel selapis (jaringan), dapat digunakan untuk menguji kemampuan bioaktivitas suatu senyawa sebagai anti kanker terhadap galur-galur sel kanker tersebut. Galur sel dapat dibentuk dari kultur sel langsung (primer) yang kemudian dikultur kembali (sub kultur). Sel yang dikultur ini dipelihara terus menerus sampai immortal (tidak bisa mati). Pembentukan sub kultur dapat menghasilkan sel-sel yang homogen dan tidak memiliki sifat-sifat diferensiasi. Menurut Freshney (1994) galur sel yang dihasilkan dari kultur sel primer akan mengalami perubahan antara lain : morfologi (sel lebih kecil, lebih bulat, kurang erat mel ekat, perbandingan inti dan sitoplasma lebih besar), cepat tumbuh karena waktu yang diperlukan untuk tumbuh menjadi lebih pendek, ketergantungan terhadap serum berkurang, dan mampu berproliferasi. Berikut ini beberapa deskripsi dari galur sel lestari yang digunakan dalam berbagai penelitian :
a). Sel K562 (ATCC CCL 243)
Berasal dari dari sel leukimia myelogenous. Memiliki morfologi seperti limfoblast, sel ini diisolasi oleh Lozzio dan Lozzio dari efusi pleural wanita berumur 53 tahun yang menderita leukimi a myelogenous kronik, sel ini memiliki sifat sangat sensitif terharap pengujian sel natural killer, mengepresikan enzim metabolik xenobiotik, dan tidak berdiferensiasi.
b). KR 4 (ATCC CRL 8658)
Sel KR 4 berasal dari sel lymphoblastoid B manusia (GM 1500 6TG A11; menghasilkan IgG). Sel ini diperoleh dengan membuat sel tersebut mutagen dengan perlakuan iradiasi ã tingkat rendah dan diseleksi dengan resistensi terhadap tioguanin (Kozbor et al.1982).
c). A549 (ATCC CCL 185)
d). HeLa (ATCC CCL 2.2)
Berasal dari kata Henrietta Lacks, yang berasal dari tumor serviks rahim Helen Lane atau Helen Larson wanita berumur 30 tahun, dengan morfologi menyerupai epitelial.
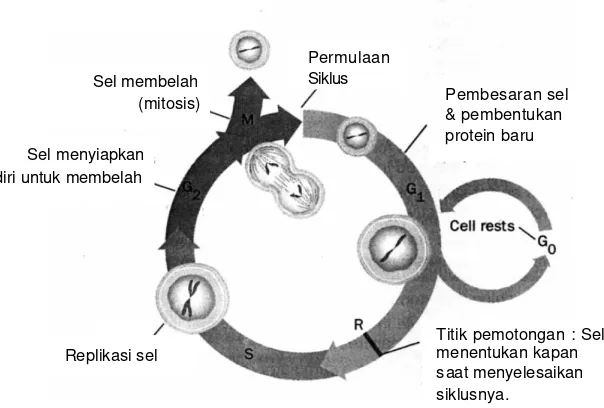
E. SIKLUS SEL
Siklus sel adalah perkembangan perubahan selular yang teratur sampai memasuki tahap pembelahan sel. Bagian yang penting dari siklus sel adalah enzim cyclin-dependent kinases (Cdk). Ketika Cdk ini diaktifkan maka sel berpindah fase dari satu fase ke berikutnya dalam siklus sel (G1 keS atau G2 ke M) (Schwartz 2005). Siklus sel normal dikendalikan oleh protein siklin, protein siklin ini adalah kinase yang bekerja mengkatalisis transfer gugus fosfat dari ATP kepada protein target. Aktivasi kebalikannnya atau defosforilasi protein dilakukan oleh enzim fosfatase. Proses fosforilasi dan defosforilasi merupakan mekanisme umum untuk mengatur aktivitas protein. Mekanisme inilah yang digunakan berulang kali untuk mengatur siklus sel (Becker et al. 2000). Cdk dalam siklus sel berperan penting dalam mengontrol siklus sel. Perubahan dalam pengontrolan terhadap proses siklus sel ditemukan pada mayoritas kanker
ganas, oleh karena itu Cdk menjadi target yang menjanjikan untuk terapi anti kanker (Pennati 2005). Tahapan siklus sel ditampilkan pada Gambar 4 berikut :
Gambar 4 Siklus sel ( Becker 2000)
Permulaan Siklus
Pembesaran sel & pembentukan protein baru
Titik pemotongan : Sel menentukan kapan saat menyelesaikan siklusnya.
Replikasi sel Sel menyiapkan diri untuk membelah
Ketika sel distimulasi untuk tumbuh, mereka meninggalkan keadaan diamnya (resting state) dan memasuki satu fase siklus sel yang disebut fase G1 (fase sintesis komponen seluler). Sel berada dalam fase ini kurang lebih 8 jam. Setelah itu, sel memasuki fase S (fase sintesis DNA), di dalam fase ini replikasi DNA dimulai dan terus berlan gsung sampai terbentuk dua DNA baru. Sintesis DNA berlangsung lebih kurang 6 jam. Fase selanjutnya adalah fase G2 yang berlangsung selama 4-5 jam. Fase ini merupakan fase persiapan sebelum sel membelah. Periode pembelahan disebut fase M atau mitosis, yang berlangsung selama 1-5 jam dan menghasilkan dua sel baru. Sel-sel kanker pada umumnya tumbuh secara eksponensial lebih cepat dari sel normal (Slingerland dan Tannock 1998).
F. KANKER DAN MEKANISMENYA
Kanker merupakan penyakit yang berawal dari kerusakan materi genetika atau DNA sel. Satu sel yang mengalami kerusakan genetika sudah cukup untuk menghasilkan jaringan kanker atau neoplasma, sehingga kanker disebut juga penyakit seluler. Perubahan pada materi genetika atau disebut juga mutasi gen dapat terjadi melalui berbagai mekanisme. Pertama disebabkan oleh kesalahan replikasi yang terjadi pada saat sel-sel yang aus digantikan oleh sel-sel baru. Pada saat pergantian satu sel, terjadi kopi DNA baru yang melibatkan 6 x 109 pasangan basa, yang memberikan peluang kesalahan replikasi. Penyebab kedua adalah mutasi pada galur sel yang mengalami kesalahan genetika yang diturunkan dari gen orang tua, sehingga menghasilkan gen yang termutasi. Mekanisme kerusakan materi genetika sel yang ketiga disebabkan oleh adanya faktor dari luar, atau faktor eksternal yang dapat mengubah struktur DNA, yaitu virus, infeksi berkelanjutan, polusi udara, radiasi dan bahan-bahan kimia asing yang tidak diperlukan oleh tubuh (Zakaria 2001). Beberapa karsinogen kimia, radiasi, virus dan hormon menginduksi terjadinya kanker, karena faktor-faktor tersebut dapat menyebabkan perubahan struktur DNA atau mutasi gen yang dapat menghasilkan sel kanker (Dalimartha 1999).
terjadi ketika kedua jenis gen di atas mengalami mutasi dan tidak berfungsi dengan benar (Michael dan Doherty 2005). Mekanisme yang mengatur pertumbuhan , differensiasi dan kematian sel adalah fosforilasi protein. Proses fosforilasi protein diatur oleh golongan enzim kinase. Mutasi pada kinase yang disandikan dalam onkogen antara lain dapat menyebabkan terjadinya pembelahan sel lebih cepat. Kinase dan fosfatase merupakan menjadi senyawa yang penting pada jalur metabolisme. Perubahan aktivitas enzim kinase yang tidak terkontrol berperan penting pada terbentuknya tumor (Michael dan Doherty 2005).
Setiap sel tumor dilengkapi dengan molekul permukaan yang aktif, berfungsi antara lain sebagai reseptor berbagai ligan, misalnya reseptor faktor pertumbuhan, reseptor sitokin, dan molekul adhesi sel (Zeromski 2002). Hasil interaksi ligan dan reseptor tersebut menghasilkan perubahan pada pertumbuhan sel tumor dan penyebarannya. Reseptor ini bertindak sebagai komponen kimia yang diketahui sebagai faktor pertumbuhan dan keberadaannya menyebabkan pembelahan sel. Gen yang termutasi akan menghasilkan banyak reseptor-reseptor pada membran sel yang menyebabkan faktor pertumbuhan semakin banyak, kondisi tersebut dapat menyebabkan terjadinya pembelahan sel lebih
cepat (Zeromski 2002).
Menurut Miller (2005), tahap-tahap penting pembentukan sel kanker adalah : a) inisiasi, yaitu terjadinya perubahan pada DNA atau mutasi gen yang sebabkan oleh berbagai faktor, b) promosi yang meliputi perkembangan sel dan perubahan menjadi sel tumor premalignant, c) progresi dan invasi (penyusupan ke jaringan sekitar), d) metastasis yaitu penyebaran melalui pembuluh darah dan pembuluh getah bening. Tahap penyebaran sel kanker dimulai ketika sel -sel individu dari lokasi asal memi sah dan memasuki aliran darah untuk menemukan tempat baru untuk berkembang di dalam tubuh.
Pada sel normal, sel hanya akan membelah diri bila tubuh membutuhkannya, seperti mengganti sel-sel yang rusak atau mati. Sebaliknya sel kanker akan membelah diri meskipun tidak dibutuhkan sehingga terjadi kelebihan sel-sel baru. Kanker dapat tumbuh di semua jaringan tubuh, seperti kulit, sel hati, sel darah, sel otak, sel lambung, sel usus, sel paru, sel saluran kencing, dan berbagai macam sel tubuh lainnya. Jenis kanker yang berbeda memiliki perbedaan bagian tubuh yang ditempati, tergantung tempat yang memiliki afinitas baik untuk ditempati. Oleh karena itu, dikenal bermacam-macam jenis sel kanker menurut sel atau jaringan asalnya. Secara umum kanker menyebabkan lemahnya tubuh karena nutrisi yang tersedia digunakan sel kanker untuk bermetastase. Secara spesifik, kanker dapat menyebabkan antara lain : a) malnutrisi, karena monopoli neoplasma terhadap zat gizi tertentu, b) kehilangan darah akibat erosi epitel atau permukaan-pemukaan lain sehingga terjadi pendarahan, c) nekrosis jaringan akibat defisiensi gizi, rusaknya organ dan inflamasi d) penyerangan tumor pada organ vital sehingga menurunkan fungsinya, e) gangguan saluran organ vital disertai menurunnya fungsi organ atau terjadinya infeksi, f) efek toksik, terutama pada sistem syaraf pusat atau periferal, g) efek sekresi, baik hormon yang sesuai maupun tidak (Braustein
1987).
G. MEKANISME ANTI KANKER
1. Beberapa Mekanisme Anti Kanker Senyawa Alami dan Sintesis
Beberapa mekanisme anti kanker dari bahan-bahan alami telah di laporkan oleh banyak peneliti. Berbagai mekanisme yang berbeda dari beberapa jenis sel kanker yang diteliti diuraikan berikut ini. Shunji et al. (2004) melaporkan mekanisme anti kanker dari senyawa smenospongin yang berasal dari spong laut terhadap sel K562. Hasil analisis terhadap siklus sel menunjukkan pemberian smenospongin selama 24 jam mampu menghambat fase G1 pada siklus sel, smenospongin juga ditemukan dapat menghambat fosforilasi substrat tirosin kinase.
dalam beberapa tahap siklus sel menunjukkan adanya peningkatan proporsi tahap G(0)/G(1). Hasil flow cytometry juga menunjukkan telah terjadi differensiasi sel HL-60 menjadi sel serupa granulosit. Shen (2002) juga melakukan analisis
flow cytometry untuk mengetahui persentasi fase S pada siklus sel yang sangat direduksi ketika sel sel kanker ASG diberikan kitosan larut air (WSC). Hasil penelitian ini juga menemukan protein pengatur metastasis (MMP-2 dan MMP-9) dapat dihambat pada sel-sel kanker ASG yang diberikan WSC.
Makkar (2002) melaporkan mekanisme anti kanker dari pektin sitrus termodifikasi (MCP), yang merupakan jenis serat berkarbohidrat larut air yang berasal dari buah sitrus. MCP ini spesifik menghambat protein galektin-3 yang berikatan dengan karbohidrat pada pertumbuhan tumor dan proses metastasis secara in vivo. Pengujian dilakukan pada uji penghambatan pembentukan pembuluh kapiler oleh human umbilical vein endothelial cells (HUVECs)di dalam Matrigel. Mekanisme anti kanker ditunjukkan dengan penghambatan terhadap karbohidrat yang memediasi pertumbuhan tumor, menghambat angiogenesis dan metastasis secara in vivo.
Quersetin merupakan jenis senyawa flavonoid yang banyak ditemukan pada buah-buahan dan sayuran. Hasil penelitian Yoshida et al. (2005)
menemukan bahwa quersetin memiliki aktivitas anti tumor terhadap sel HeLa. Fenomena anti tumor dilaporkan terjadi secara apoptosis pada sel hela yang dikultur bersama senyawa quersetin.
Pathya et al. (2004) melaporkan aktivitas anti tumor dari senyawa allisin yang terdapat pada bawang putih. Allisin ditemukan menginduksi aktivasi sinyal ekstraselular terhadap enzim kinase pada sel-sel mononuklir sehingga dapat mengaktivasi dan memperkuat sistim imun. Arditti et al. (2005) juga melaporkan aktivitas allisin sebagai anti kanker terhadap sel B chronic lymphocytic leukemia
dengan mekanisme apoptosis.
2. Apoptosis
Apoptosis adalah kematian sel terprogram, yaitu terjadinya kematian sel secara terorganisir. Beberapa ciri morfologi sel yang mengalami apoptosis antara lain mengalami lisut, kondensasi kromatin, dan fragmentasi DNA (Tyler et al. 1995). Proses apoptosis sel menunjukkan peristiwa degradasi kromatin menjadi fragmen-fragmen kecil yang terdiri atas beberapa pasang DNA. Fragmentasi DNA terjadi sebelum lisis dan diduga akibat endonuklease dalam nukleus sel sendiri, sehingga serupa dengan proses bunuh diri (Tyler et al. 1995). Apoptosis sangat berbeda dengan nekrosis jaringan yang disebabkan oleh adanya luka yang akut. Tahap yang dibutuhkan untuk apoptosis adalah : a) kondensasi inti sel dan pecah menjadi potongan-potongan, b) kondensasi dan fragmentasi sitoplasma menjadi membran yang mengikat badan apoptotik, dan c) pemecahan kromosom menjadi fragmen yang mengandung sejumlah nukleosom (Tyler et al.1995).
Secara alamiah sel mengalami apoptosis dengan tujuan untuk : a) memperbaiki organisme selama perkembangan embrio, b) metamorfosis dan atrophy jaringan, c) mengatur jumlah total sel, d) pertahanan dan mengeliminir sel yang tidak diinginkan atau berbahaya, misalnya sel-sel tumor, sel yang terinfeksi virus, atau sel-sel karena penyakit autoimun (Jakubowski 2000, Reed 1999). Apoptosis memerlukan sinyal-sinyal untuk menginduksi proses apoptosis. Sinyal-sinyal tersebut dapat berupa sinyal ekstraseluler seperti: hormon, sinyal faktor pertumbuhan, dan kontak antara sel. Sinyal juga dapat berupa sinyal intraseluler, yaitu : infeksi virus dan kerusakan oksidatif dari radikal bebas (Bannerji et al. 2003).
oleh sel-sel fagositik seperti makrofag (Bannerji 2003, Jakubowski 2000, Reed 1999).
3. Anti Protease
Protease memiliki banyak fungsi menguntungkan yang menunjukkan peran sangat esensial untuk kehidupan, tetapi protease yang tak terkontrol dapat berbahaya. Inhibitor protease di alam memiliki banyak bentuk, mereka tersebar luas di benih tanaman, umumnya pada legum. Inhibitor protease di benih bertindak sebagai penghambat sistim percernaan serangga. Beberapa bakteri memproduksi anti protease untuk membantu mereka agar mampu bertahan pada saluran pencernaan seperti ecotin pada Escherichia coli yang efektif bertahan terhadap berbagai protease pankreas. Inhibitor protease juga memiliki nilai nutrisi seperti Bowman-Birk inhibitor (BBI) dari kedelai yang juga memiliki peranan dalam pencegahan tumourigenesis (Dowall 2003). Menurut Wan et al. (1999) penghambatan protease dari BBI dapat terjadi melalui mekanisme pencegahan ekspresi protein neu dari sel yang premalignan dan malignan. Pencegahan ekspresi ini disebabkan terjadinya proses pemecahan protein neu yang ekspresikan oleh sel malignan pada permukaan selnya
A. Tempat dan Waktu
Penelitian ini dilaksanakan pada beberapa laboratorium, yaitu : laboratorium Mikrobiologi dan Biokimia pada Pusat Penelitian Ilmu Hayati dan Bioteknologi Institut Pertanian Bogor, laboratorium Imunologi, Kultur jaringan, Embriologi, Histologi serta laboratorium Terpadu Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penelitian penunjang dilaksanakan pada laboratorium Kimia Balai pasca panen Balitbio Bogor dan laboratorium Material Sains FMIPA Universitas Indonesia. Penelitian ini berlangsung mulai bulan Juni 2004 sampai dengan Juli 2005.
B. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah : Kitosan dengan derajat deasetilasi 85% (DD85) diperoleh dari Sigma Chemical Co.(C3646-25G 014K0674). Kitosan tersebut berasal dari kulit udang. Kitosan dengan derajat deasetilasi 70% (DD70), dalam bentuk terlarut (1%), merupakan produk hasil penelitian Rochima (2005). Kitosan dengan derajat deasetilasi 90% dan 100%
(DD90 dan DD 100), dalam bentuk terlarut (1%) diperoleh dari Seikagaku Co.(Tokyo, Jepang).
Isolat bakteri Bacillus licheniformis (MB2) yang berasal dari sumber air panas di Tompaso (Manado) Sulawesi Utara, telah dipilah sebagai penghasil enzim kitosanase ekstraseluler merupakan koleksi dari Laboratorium Mikrobiologi dan Biokimia Pusat Penelitian Ilmu Hayati dan Bioteknologi Institut Pertanian Bogor.
Presipitasi enzim dilakukan menggunakan amonium sulfat teknis. Pemurnian enzim kolom kromatografi hidrofobik dilakukan menggunakan matriks
Butyl Sepharose 4-Fast Flow yang diperoleh dari Sigma Chemical Co.
Oligomer kitosan (D-glukosamin, dimer sampai heksamer) yang digunakan sebagai standar dalam analisis dan fraksinasi HPLC diperoleh dari Seikagaku Co.(Tokyo, Jepang). Identifikasi komponen kitooligomer dilakukan menggunakan HPLC dengan detektor UV model 440 dual lamdha.
yang digunakan adalah : KR4 (lymphablastoid B) yang merupakan koleksi US NAMRU 2, K562 (chronic myelogenous leukimia), HeLa (epytheloid carcinoma cervix) dan galur sel A549 (lung carcinoma) yang merupakan koleksi laboratorium Kultur Jaringan FKH IPB.
Media untuk bakteri diperoleh dari Oxoid. Ltd. Media RPMI 1640 untuk kultur sel limfosit diperoleh dari Sigma Chemical Co dan Dulbecco’s modified eagle’s medium (DMEM) untuk medium kultur sel kanker diperoleh dari Gibco Ltd. HEPES, penicillin, streptomycin, MTT and Fetal bovine serum (FBS) diperoleh dari Sigma Chemical Co. Mitogen Concanavalin A dan Pokeweed diperoleh dari Sigma Chemical Co.
Sentrifus sel menggunakan alat sentrifus jenis swing dengan tipe CR412 dari Jouan. Perhitungan jumlah sel dengan metode trifan biru menggunakan mikroskop dari Zeiss ID03 (Germany) dengan pembesaran 100 kali. Pengamatan dan foto sel menggunakan inverted microscope tipe 1X70 dari Olympus dengan pembesaran lensa obyektif 100 kali. Pembacaan absorbansi jumlah sel menggunakan alat Microplate reader Benchmark dari Bio-Rad. Pengamatan
Scanning electron Microscope (SEM) menggunakan alat JSM-531OLV dari JEOL.
Fluorochrome-bis-benzimide trihydrochloride (Hoechst 33342) yang digunakan sebagai pewarna fluoresens untuk pengujian apoptosis sel diperoleh dari Biomedical Inc (Ohio). Pengamatan dan foto apoptosis menggunakan mikroskop fluoresens Nikon Eclipse E600 (Japan) dengan pembesaran lensa obyektif 400 kali.
Substrat kolagen dan enzim tripsin (EC 3.4.21.4) yang berasal dari pankreas sapi, digunakan untuk pengujian aktivitas enzim protease yang diperoleh dari Sigma Chemical Co.
C. Diagram Alir Penelitian
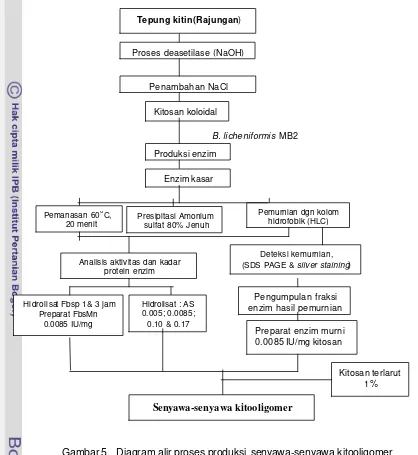
Gambar 5. Diagram alir proses produksi senyawa-senyawa kitooligomer
Hidrolisat Fbsp 1& 3 jam Preparat FbsMn
0.0085 IU/mg
Tepung kitin(Rajungan)
Proses deasetilase (NaOH)
Penambahan NaCl
Kitosan koloidal
Produksi enzim
Enzim kasar
B. licheniformis MB2
Pemanasan 60oC,
20 menit
Presipitasi Amonium sulfat 80% Jenuh
Pemurnian dgn kolom hidrofobik (HLC)
Analisis aktivitas dan kadar protein enzim
Hidrolisat : AS 0.005; 0.0085; 0.10 & 0.17
Deteksi kemurnian,
(SDS PAGE & silver staining)
Pengumpulan fraksi enzim hasil pemurnian
Preparat enzim murni 0.0085 IU/mg kitosan
Kitosan terlarut 1%
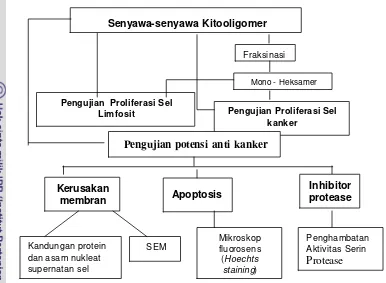
Gambar 6. Diagram alir aplikasi dan telaah mekanisme anti kanker senyawa-senyawa kitooligomer
D. Metode Penelitian
Penelitian ini terdiri dari 4 (empat) bagian utama yaitu :
1. Kajian Produksi senyawa-senyawa kitooligomer yang bersifat bioaktif secara enzimatik, pada kegiatan ini dilakukan produksi enzim kitosanase, dilanjutkan dengan studi kondisi produksi senyawa -senyawa kitooligomer dengan menggunakan metode inkubasi langsung enzim dan substrat. Preparat enzim kasar, pekatan amonium sulfat dan enzim murni, masing-masing pada berbagai konsentrasi enzim, derajat deasetilasi substrat dan waktu inkubasi digunakan sebagai preparat enzim dalam produksi senyawa-senyawa kitooligomer.
2. Fraksinasi senyawa-senyawa kitooligomer dalam hidrolisat hasil reaksi enzimatik dengan tujuan untuk memperoleh fraksi-fraksi kitooligomer tertentu (monomer sampai heksamer).
Kerusakan membran
Pengujian Proliferasi Sel kanker
Pengujian Proliferasi Sel Limfosit
Pengujian potensi anti kanker
Inhibitor protease Apoptosis
Senyawa-senyawa Kitooligomer
Fraksinasi
Mono - Heksamer
Kandungan protein dan asam nukleat supernatan sel
SEM
Mikroskop fluorosens (Hoechts
staining)
Penghambatan Aktivitas Serin
3. Kajian aktivitas senyawa-senyawa kitooligomer terhadap proliferasi sel limfosit dan sel kanker, melalui pengujian aktivitas proliferasi limfosit dan proliferasi sel-sel kanker secara in vitro.
4. Kajian potensi anti kanker melalui :
a. Analisis terjadinya kematian sel akibat apoptosis dengan metode - pewarnaan sel dengan agen fluorosens (Hoechts staining).
b. Analisis kerusakan membran sel melalui pengukuran konsentrasi protein (absorbansi 280 nm) dan asam nukleat (absorbansi 260 nm) pada supernatan kultur sel, kemudian konfirmasi dengan pengamatan Scanning Electron Mycroscop (SEM).
c. Analisis aktivitas penghambatan enzim serin protease (inhibitor serin protease)
1. Produksi Enzim Kitosanase
Enzim kitosanase dihasilkan melalui beberapa tahap yang meliputi : pembuatan tepung kitosan dari tepung kitin, pembuatan kitosan koloidal sebagai substrat, persiapan media, persiapan isolat B. Licheniformis yang digunakan sebagai starter, dan produksi enzim pada kondisi optimumnya. Enzim fraksi supernatan bebas sel diproses lebih lanjut dengan pemanasan pada 60o
C selama 20 menit. Enzim fraksi amonium sulfat diperoleh melalui proses pengendapan menggunakan garam amonium sulfat dengan konsentrasi 80% jenuh, sedangkan enzim murni dihasilkan melalui kolom kromatografi interaksi hidrofobik.
Pembuatan Tepung Kitosan dari Tepung Kitin. Pe mbuatan tepung
kitosan dilakukan secara kimia (Kolodziejska et al. 2000). Tepung kitin sebanyak 10 g dicampurkan dengan 100 ml larutan NaOH 50%, lalu dipanaskan 100o
C selama 60 menit. Setelah itu dilakukan pencucian dengan air sampai mencapai pH netral. Pengeringan dilakukan menggunakan oven suhu 60oC selama 48 jam sehingga diperoleh tepung kitosan.
Pembuatan Kitosan Koloidal. Tepung kitosan dicampurkan dengan 20
dingin, disentrifus kembali pada 7000 rpm selama 20 menit. Koloidal kitosan yang diperoleh disimpan pada suhu dingin (Arnold dan Solomon 1986).
Produksi En zim Fraksi Supernatan Bebas Sel (Fbs). Isolat bakteri
Bacillus licheniformis MB2 ditumbuhkan pada media cair yang mengandung kitosan terlarut 1%, MgSO4 0.5%, KH2PO4 0.3%, K2HPO4 0.7%, yeast extract 0.25%, dan casitone 0.25%. Biakan diinkubasi pada inkubator berpenggoyang (120 rpm) suhu 55oC selama tujuh hari (Chasanah 2004). Biakan disentrifugasi dingin pada kecepatan 10.000 rpm selama 15 menit. Supernatan mengandung enzim ekstrak kasar dipisahkan dari endapannya untuk digunakan dalam tahap selanjutya.
Produksi Enzim Fraksi Amonium Sulfat (AS 80). Enzimfraksi amonium
sulfat 80% jenuh diperoleh dengan menambahkan garam amonium sulfat teknis sebanyak 561 g ke dalam 1 liter enzim supernatan bebas sel sedikit demi sedikit sambil dilakukan pengadukan secara perlahan. Homogenat disimpan selama semalam dalam ruang berpendingin dengan suhu 4oC, kemudian disentrifus dingin (4oC) 10.000 rpm selama 15 menit. Bagian supernatan dibuang sedangkan endapan diambil dan dilarutkan ke dalam bufer fosfat 0.5 M (pH 6.0) sebanyak 10 ml yang dinyatakan sebagai pekatan enzim fraksi amonium sulfat.