TRANSPORTASI IKAN NILA (
Oreochromis niloticus
) HIDUP
SISTEM KERING DENGAN MENGGUNAKAN PEMBIUSAN
SUHU RENDAH SECARA LANGSUNG
DAN PRATISARI C34050814
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
DAN PRATISARI. C34050814. Transportasi Ikan Nila (Oreochromis niloticus) Hidup Sistem Kering dengan Menggunakan Pembiusan Suhu
Rendah secara Langsung. Dibawah bimbingan: DADI R. SUKARSA dan KOMARIAH TAMPUBOLON.
Penanganan ikan hidup saat ini mulai dikembangkan di masyarakat Indonesia sejalan dengan meningkatnya permintaan konsumen terhadap ikan hidup. Salah satu jenis ikan yang potensial untuk dipasarkan dalam keadaan hidup adalah ikan nila. Cara untuk menekan biaya transportasi ikan hidup dapat dilakukan dengan menggunakan metode pengangkutan sistem kering. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh suhu pembiusan secara langsung terhadap tingkat kelulusan hidup ikan nila (Oreochromis niloticus) dalam transportasi tanpa media air (sistem kering).
Penelitian ini terdiri dari beberapa tahap, yaitu persiapan penelitian, penelitian pendahuluan dan penelitian utama. Persiapan penelitian meliputi: 1) persiapan akuarium, 2) persiapan ikan nila, 3) persiapan media air yang terdiri dari air kolam asal ikan nila, air laboratorium yang belum diendapkan dan air laboratorium yang telah diendapkan selama 2 hari yang diukur kualitas airnya, 4) persiapan media bahan pengisi berupa serbuk gergaji dan 5) persiapan kemasan berupa styrofoam. Penelitian pendahuluan meliputi: 1) penentuan jumlah es untuk pembiusan ditentukan dengan cara melakukan percobaan perbandingan volume air pembius sebanyak 1 liter dengan jumlah es tertentu, 2) penentuan suhu pembiusan ikan nila secara bertahap untuk mengetahui suhu pembiusan dan fase imotil ikan nila. Penelitian utama terdiri dari pembiusan suhu rendah secara langsung pada fase pingsan ringan (9-10 oC), pingsan berat (7-9 oC) dan roboh (6-7 oC) selanjutnya dilakukan penyimpanan (transportasi) ikan nila yang terdiri dari 4 taraf waktu yaitu 0, 3, 6 dan 9 jam. Pada setiap perlakuan waktu penyimpanan terdiri dari 3 kali ulangan. Data yang diperoleh dianalisis secara deskriptif.
TRANSPORTASI IKAN NILA (
Oreochromis niloticus
) HIDUP
SISTEM KERING DENGAN MENGGUNAKAN PEMBIUSAN
SUHU RENDAH SECARA LANGSUNG
DAN PRATISARI C34050814
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : TRANSPORTASI IKAN NILA (Oreochromis niloticus)
HIDUP SISTEM KERING DENGAN
MENGGUNAKAN PEMBIUSAN SUHU RENDAH SECARA LANGSUNG
Nama : Dan Pratisari NRP : C34050814
Menyetujui,
Pembimbing I
Ir. Dadi R. Sukarsa NIP. 19460831 197402 1 001
Pembimbing II
Ir. Komariah Tampubolon, MS NIP. 19451110 197104 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., M.Phil NIP. 19580511 198503 1 002
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi Transportasi Ikan Nila (Oreochromis niloticus) Hidup Sistem Kering dengan Menggunakan Pembiusan Suhu Rendah secara Langsung adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2010
Dan Pratisari
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segenap limpahan karunia dan hidayah-Nya. Shalawat serta salam semoga tetap tercurah kepada Rasulullah SAW.
Penyusunan skripsi yang berjudul “Transportasi Ikan Nila (Oreochromis niloticus) Hidup Sistem Kering dengan Menggunakan Pembiusan Suhu
Rendah secara Langsung” merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
1. Bapak Ir. Dadi R. Sukarsa dan Ibu Ir. Komariah Tampubolon, MS selaku komisi pembimbing atas segala saran, kritik, arahan dan motivasi.
2. Ibu Ir. Winarti Zahiruddin, MS dan Bapak Uju, S.Pi, M.Si selaku dosen
penguji atas segala saran dan arahan.
3. Ibu Ir. Anna C. Erungan, MS selaku dosen pembimbing akademik atas
segala bimbingan dan motivasi yang telah diberikan.
4. Ayahku Muhammad Zainul Arifin, Ibuku Lathifah Hanim, Kakakku Gelar Pratama dan Mbabuk (nenekku tersayang) yang telah memberikan kasih sayang dan semangat yang luar biasa.
5. Seluruh staf dan dosen pengajar Departemen Teknologi Hasil Perairan atas bimbingannya selama ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, untuk itu penulis sangat mengharapkan kritik dan saran. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkannya.
Bogor, Januari 2010
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
6. Yulia Kusuma Wardhani, Inka Santika, Irma Soraya, A. Galih Hardita dan Safrina Dyah H. atas kasih sayang, perhatian serta persahabatan yang indah dan tak terlupakan .
7. Bapak Dr. Ir. Joko Santoso, M.Si, Ibu Dra. Pipih Suptijah, MBA, Ibu Ir. Nurjanah, MS, Bapak Ir. Djoko Poernomo dan Bapak Dr. Agoes M. Jacoeb, Dipl-Biol atas doa, kasih sayang dan perhatiannya.
8. Prof. Komar Sumantadinata selaku dosen penanggung jawab kolam percobaan babakan, Pak Wawan dan Pak Iwan.
9. Mokhammad Rifai yang telah memberikan semangat serta doa yang luar biasa.
10.Kakak kelasku THP 40: Mbak Wida, Mbak Dian, Aris dan Rama.
11.Kakak kelasku THP 41: Mas An’im, Kak Andi, Gilang, Windy, Anang,
Kak Yayan, Mbak Ika dan Dede.
12.Teman-temanku THP 42: Ary, Uut, Pur, Seno, Pus, Dewi, Ado, Anggi, Sugara, Ale, Fathu, Rodi, Rinto, Jamal, Rustam, Zen, Melda, Mirza, Ipang, Pril, Sena, Evi, Rizka, Tia, Adrian, Ika, Anne, Niken, Ita, Ifa dan Fuad.
13.Adik-adik kelasku THP 43: Deksu, Umi, Wati, Uu’ dan Joha. 14.Rekan-rekan kolam Babakan (BDP 41): Sahel, Dodi dan Firman.
15.Teman-teman IPB: Tejo (BDP 41), Adi dan Jijah (BDP 42), Faruq (BDP 43), Erys (MSP 42), Mbak Ting dan Ali (THH 41), Sapek (TEP 44), Mas Tio (ITK 40), Dedi dan Hafiz (STK 42 dan 43), Mega dan Januar (KIMIA 42), Nanda (ITP 42) dan Torik (TIN 42).
16.Pak Yus dan Pak Wawan yang baik hati. Mangkos, Batak, Rian, Away dan Ando yang telah bersedia membantu dalam penelitian saya.
18.Keluarga besar THP, staf dosen dan Tata Usaha (TU) serta teman-temanku THP 40, 41, 42, 43, dan 44 yang telah memberikan dorongan dan semangat serta persahabatan yang indah.
19.Keluarga besar “Kostan Kawah Kelud”, Pak Yok, Mas Aris dan keluarga,
Mas Alfa, Mbak Ulfa, Mbak Ila, Mbak Ika, Mbak Ting-ting, Mas Ali,
Fa’i, Eto’o, Dedy, Ulie, Tyas, Sapek, Yoga, Ikka, Jo, Herry dan Keluarga
besar Bapak Sugandhi atas kasih sayang, nasehat dan dukungannya. 20.TIM KELULUSAN THP 42 terima kasih atas persahabatan yang sangat
indah selama ini.
RIWAYAT HIDUP
Penulis dilahirkan di Gresik, pada tanggal 28 Januari 1987 dari pasangan Bapak Drs. Muhammad Zainul Arifin dan Ibu Lathifah Hanim sebagai anak ke dua dari dua bersaudara. Pendidikan formal dimulai di TK Bhakti I Gresik dan lulus pada tahun 1993. Pada tahun 1999, penulis lulus dari sekolah dasar di SD Muhammadyah I Gresik. Pada tahun 2002, penulis menyelesaikan pendidikan menengah pertama di SLTPN 2 Gresik. Pada tahun 2005, penulis menyelesaikan pendidikan menengah umum di SMUN 1 Manyar Gresik. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor (IPB) melalui Jalur Undangan Seleksi Masuk IPB (USMI) di Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama studi di Institut Pertanian Bogor, penulis masuk kepengurusan Himpunan Profesi HIMASILKAN periode 2006-2007 dan periode 2007-2008 divisi Pengembangan Sumber Daya Masyarakat (PSDM), Redaksi Majalah Peduli Pangan dan Gizi (EMULSI) IPB divisi Promosi dan Distribusi periode 2006-2007, dan Ketua kelulusan angkatan THP 42 . Penulis juga menjadi koordinator asisten mata kuliah Penanganan Hasil Perairan periode 2007-2008 dan 2008-2009 serta
asisten mata kuliah Teknologi Pengolahan Hasil Perairan tahun 2008-2009.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penulis melakukan penelitian dengan judul Transportasi Ikan Nila (Oreochromis niloticus) Hidup Sistem Kering dengan
DAFTAR ISI
4.1 Parameter Air sebagai Tempat Hidup Ikan Nila (Oreochromis niloticus) ... 26
4.2 Penelitian Pendahuluan ... 28
4.2.1 Penentuan jumlah es untuk pembiusan ... 28
4.2.2 Penetuan suhu pembiusan ikan nila ... 30
4.3 Penelitian Utama ... 32
4.3.1 Perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah ... 32
5. KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Nomor Teks Halaman
1.Perubahan perilaku udang windu akibat pembiusan penurunan suhu
bertahap ... 11
2. Respon aktivitas fisiologi lobster air tawar pada berbagai suhu ... 12
3. Tingkah laku ikan mas selama proses pemingsanan dengan suhu rendah 8 oC secara langsung... 13
4. Parameter kualitas air, alat dan cara peneraannya ... 19
5. Klasifikasi respon tingkah laku ikan selama pembiusan... 21
6. Data hasil pengamatan kualitas air ... 26
7. Hubungan suhu dengan tingkah laku ikan nila yang dibius dengan suhu rendah ... 32
8. Perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah 9-10 oC, 7-9 oC dan 6-7 oC ... 33
9. Persentase tingkat kelulusan hidup rata-rata ikan nila setelah penyimpanan ... 37
DAFTAR GAMBAR
Nomor Teks Halaman
1. Ikan nila (Oreochromis niloticus) ... 4 2. Penyusunan ikan nila (Oreochromis niloticus) dalam kemasan ... 20 3. Diagram alir penyimpanan ikan nila dalam serbuk gergaji dingin ... 24 4. Penentuan jumlah es pada media air pembius dan rata-rata
penurunan suhu ... 30 5. Grafik rata-rata waktu proses pembugaran ikan nila setelah
penyimpanan ... 36 6. Grafik persentase kelulusan hidup rata-rata ikan nila pada
DAFTAR LAMPIRAN
Nomor Halaman
1. Ukuran ikan nila (Oreochromis niloticus) ... 47
2. Pengukuran kualitas air ... 48
2a. Prosedur cara peneraan dari masing-masing parameter kualitas media air ... 48
2b. Gambar alat-alat analisis air ... 50
3. Penentuan jumlah es untuk pembiusan ... 51
3a. Fluktuasi suhu air dengan perbandingan air dan es 2:1 (1 liter air : 0,5 kg es) ... 51
3b. Fluktuasi suhu air dengan perbandingan air dan es 2:2 (1 liter air : 1 kg es) ... 52
3c. Fluktuasi suhu air dengan perbandingan air dan es 2:3 (1 liter air : 1,5 kg es) ... 53
3d. Fluktuasi suhu air dengan perbandingan air dan es 2:4 (1 liter air : 2 kg es) ... 54
4. Gambar penentuan perbandingan jumlah air dengan jumlah es untuk pembiusan ... 55
5. Penentuan suhu pembiusan ikan nila secara bertahap ... 56
6. Perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah... 57
7. Pembiusan ikan nila secara langsung ... 58
8. Data waktu proses pembugaran ikan nila setelah pembugaran ... 59
9. Data persentase kelulusan hidup ikan nila setelah penyimpanan... 60
1. PENDAHULUAN
1.1 Latar Belakang
Salah satu bentuk transportasi ikan hidup yang paling populer dan sederhana di Indonesia adalah cara pengangkutan ikan hidup dengan menggunakan media air (sistem basah). Tujuan kegiatan yang bersifat tradisional ini pada mulanya untuk mendukung kegiatan budi daya dalam pendistribusian benih ikan. Namun, dalam perkembangannya telah meluas untuk tujuan distribusi ikan konsumsi, misalnya ikan mas, gurame, lele, nila dan sebagainya.
Sistem transportasi lainnya yaitu transportasi tanpa media air (sistem kering). Saat ini transportasi ikan hidup sistem kering semakin berkembang terutama untuk crustacea, tetapi untuk ikan masih merupakan hal yang baru dan belum berkembang di masyarakat. Teknik ini perlu dikembangkan terutama untuk tujuan ekspor karena dapat mengurangi berat dan resiko kebocoran di pesawat. Faktor-faktor yang perlu diperhatikan dalam transportasi ikan hidup tanpa media air adalah jenis media pengemas, perlakuan ikan sebelum dikemas (imotilisasi atau hibernasi), suhu media selama pengangkutan dan kemungkinan penggunaan anti metabolit (zat anestesi).
Pada transportasi ikan hidup sistem kering perlu dilakukan proses
penanganan atau pemingsanan terlebih dahulu. Kondisi ikan yang tenang akan mengurangi stress, mengurangi kecepatan metabolisme dan konsumsi oksigen. Pada kondisi ini tingkat kematian selama transportasi rendah sehingga memungkinkan jarak transportasi dapat lebih jauh dan kapasitas angkut dapat meningkat. Metode pemingsanan ikan dapat dilakukan dengan cara menggunakan zat anestesi atau dapat juga menggunakan penurunan suhu.
Zat anestesi yang biasa digunakan untuk proses pemingsanan ikan yaitu, berupa bahan kimia seperti MS-222 (tricaine methane sulphonate), CO2 dan
aspek kesehatan. Metode pemingsanan menggunakan penurunan suhu menjadi salah satu pilihan yang aman karena tidak mengandung residu kimia di dalamnya.
Proses pemingsanan menggunakan suhu rendah memiliki dua metode yaitu pemingsanan dengan penurunan suhu bertahap dan pemingsanan dengan penurunan suhu langsung. Ada beberapa keuntungan dan kerugian metode pemingsanan dengan penurunan suhu langsung dan bertahap. Pemingsanan dengan penurunan suhu secara bertahap dapat menimbulkan stress pada ikan dan memerlukan waktu yang panjang hingga ikan pingsan, sedangkan dengan penurunan suhu secara langsung dapat mengurangi stress selama proses pemingsanan dan mempercepat proses pemingsanan (Nitibaskara et al. 2006). Teknologi transportasi ikan hidup sistem kering ini tidak dapat distandarkan untuk semua jenis ikan, karena tingkat kelulusan hidup (survival rate) ikan selama transportasi dipengaruhi oleh banyak faktor, sehingga setiap jenis ikan memerlukan perlakuan yang spesifik.
Salah satu jenis ikan yang potensial untuk dipasarkan dalam keadaan hidup adalah ikan nila. Cara yang biasa dilakukan dalam pengangkutan ikan nila hidup adalah dengan sistem basah. Cara ini untuk keperluan jarak dekat dan kurang efektif jika digunakan untuk jarak jauh, karena dibutuhkan tempat yang lebih besar sehingga menjadi berat. Transportasi ikan hidup sistem kering dapat
menjadi pilihan untuk distribusi ikan nila hidup dengan waktu pengangkutan yang relatif lebih lama.
Beberapa penelitian transportasi sistem kering untuk ikan nila hidup sudah dilakukan yaitu, ikan nila dipingsankan menggunakan arus listrik 120 volt selama 3 menit memiliki tingkat kelulusan hidup 100 % untuk waktu kemas 1 jam dan
memiliki tingkat kelulusan hidup 10 % untuk waktu kemas 4 jam (Achmadi 2005). Ikan nila yang dipingsankan menggunakan ekstrak Caulerpa
racemosa 48 % memiliki tingkat kelulusan hidup 100 % selama waktu kemas 2 jam (Pramono 2002), sedangkan pemingsanan menggunakan gas CO2 15 mmHg
ini akan dilakukan pembiusan menggunakan suhu rendah secara langsung pada sistem transportasi ikan nila (Oreochromis niloticus) hidup tanpa media air.
1.2 Tujuan
Tujuan penelitian ini adalah untuk mengetahui pengaruh suhu pembiusan
2. TINJAUAN PUSTAKA
2.1 Deskripsi Ikan Nila (Oreochromis niloticus)
Ikan nila sangat dikenal oleh masyarakat penggemar ikan air tawar, baik di negara berkembang maupun di negara maju. Di Asia Tenggara, ikan nila banyak dibudidayakan, terutama Filipina, Malaysia, Thailand dan Indonesia. Di Indonesia, ikan ini sudah tersebar hampir ke seluruh pelosok wilayah tanah air (Amri dan Khairuman 2003).
Ikan nila termasuk famili Cichlidae yang mempunyai sifat menyimpan telur dan larvanya di dalam mulut. Secara umum klasifikasi ikan nila menurut Trewavas (1980), diacu dalam Suyanto (2003) adalah sebagai berikut :
Filum : Chordata Sub filum : Vertebrata Kelas : Osteichthyes Sub kelas : Acanthoptherigii Ordo : Percomorphi Sub ordo : Percoidea Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus
Gambar 1. Ikan nila (Oreochromis niloticus) Sumber: Kuncoro (2009)
sirip perut, sirip anus dan sirip ekor. Pada sirip punggung, sirip dubur dan sirip perut terdapat jari-jari lemah dan jari-jari keras yang tajam seperti duri. Sirip punggung memiliki lima belas jari-jari keras dan sepuluh jari-jari lemah, sedangkan sirip ekor mempunyai dua buah jari-jari keras dan sepuluh jari-jari berbagai bangsa karena dagingnya enak dan tebal seperti daging ikan kakap merah (Syamsudin 2001).
Ikan nila dapat hidup pada kisaran suhu yang lebar yaitu 14-38 oC. Ikan nila dapat hidup pada lingkungan yang mempunyai kisaran pH 5-11 (Arie 2000). Kandungan oksigen air minimal 4 mg/l, kandungan karbondioksida maksimal 5 mg/l, kadar amoniak dalam air harus dalam batas yang tidak meracuni (lebih rendah 0,1 mg/l) dan tingkat alkalinitas air berkisar 50-300 mg/l (BPPAT DKP 2001).
2.2 Aspek Ekonomi Ikan Nila (Oreochromis niloticus)
Ikan nila merupakan salah satu komoditas ikan air tawar yang sangat populer karena ikan ini berasal dari luar Indonesia yang hampir mirip dengan ikan mujair. Usaha budi daya ikan nila dilakukan di kolam-kolam (tergenang atau mengalir), sawah dan karamba jaring apung. Usaha pembudidayaan ikan nila kini tidak hanya sebagai usaha sampingan, melainkan sudah pada tahap budi daya secara intensif. Pengembangan budi daya ikan nila di Indonesia mengalami
kemajuan yang sangat pesat dengan adanya penemuan-penemuan genetika yang baru seperti nila merah, nila gift dan nila TA (Pearson 2009).
dalam hal pertumbuhan karena nila merah mempunyai laju pertumbuhan yang cepat (Amri dan Khairuman 2003).
Nila gift merupakan hasil persilangan beberapa varietas ikan nila. Nila gift memiliki ukuran tubuh yang lebih pendek dan lebar dibandingkan dengan nila lokal. Tanda lainnya yang membedakan nila gift dengan nila lokal adalah warna tubuh. Warna tubuh nila gift hitam agak putih. Bagian bawah tutup insangnya berwarna putih. Nila TA tergolong baru sehingga belum banyak dikenal secara luas oleh masyarakat. Bentuk tubuhnya sangat mirip dengan nila gift. Namun, jumlah garis-garis vertikal di tubuh nila TA lebih sedikit dibandingkan nila gift (Amri dan Khairuman 2003).
Hal lain yang menyebabkan ikan nila sangat diminati oleh petani ikan adalah rendahnya biaya produksi, sehingga petani dengan modal kecil dapat mengusahakan kegiatan budi daya ikan nila ini. Kebutuhan pasar ikan nila ukuran konsumsi tidak hanya di pasar lokal, tetapi ikan ini mampu menembus pasar ekspor Singapura, Jepang, Hong Kong, Arab Saudi, Amerika dan negara-negara Eropa dalam bentuk fillet. Pada pasar lokal, minat konsumsi ikan masyarakat Indonesia terhadap ikan nila menempati posisi kedua setelah ikan mas. Hal ini disebabkan harga ikan nila cukup bersaing dengan harga ikan mas. Ikan untuk konsumsi lokal pada umumnya memiliki ukuran 200–250 gram/ekor atau ukuran
5–4 ekor/kg, sedangkan untuk pangsa pasar ekspor dibutuhkan ikan nila dengan ukuran minimal 500 gram/ekor. Hal ini dikarenakan ekspor ikan nila dalam bentuk fillet, sehingga untuk mendapatkan daging yang banyak dibutuhkan ukuran ikan yang lebih besar pula (Pearson 2009).
Penanganan pasca panen ikan nila dapat dilakukan dengan cara penanganan ikan hidup maupun ikan segar (Syamsudin 2001).
1)Penanganan ikan hidup
Adakalanya ikan konsumsi ini akan lebih mahal harganya bila dijual dalam keadaan hidup. Hal yang perlu diperhatikan agar ikan tersebut sampai ke konsumen dalam keadaan hidup, segar dan sehat antara lain:
a. Dalam pengangkutan menggunakan air yang bersuhu rendah sekitar 20 oC. b. Waktu pengangkutan hendaknya pada pagi hari atau sore hari.
2)Penanganan ikan segar
Ikan segar merupakan produk yang cepat turun kualitasnya. Hal yang perlu diperhatikan untuk mempertahankan kesegaran antara lain:
a. Penangkapan harus dilakukan hati-hati agar ikan-ikan tidak luka. b. Sebelum dikemas, ikan harus dicuci agar bersih dari lendir.
c. Wadah pengangkut harus bersih dan tertutup. Pengangkutan jarak dekat (2 jam perjalanan), dapat menggunakan keranjang yang dilapisi dengan daun pisang atau plastik. Pengangkutan jarak jauh menggunakan kotak dan seng atau fiberglass. Kapasitas kotak maksimum 50 kg dengan tinggi kotak maksimum 50 cm.
d. Ikan diletakkan di dalam wadah yang diberi es dengan suhu 6-7 oC. Gunakan es berupa potongan kecil-kecil (es curai) dengan perbandingan jumlah es dan ikan (1:1). Dasar kotak dilapisi es setebal 4-5 cm. Ikan disusun di atas lapisan es setebal 5-10 cm, lalu disusul lapisan es lagi dan seterusnya. Antara ikan dengan dinding kotak diberi es, demikian juga antara ikan dengan penutup kotak.
2.3 Penanganan Ikan Hidup
Prinsip dari penanganan ikan hidup adalah mempertahankan kelangsungan hidup ikan semaksimal mungkin sampai ikan tersebut diterima oleh konsumen. Terdapat beberapa tahap penanganan untuk mencapai maksud tersebut yaitu penanganan ikan sebelum diangkut, selama pengangkutan dan setelah pengangkutan (Junianto 2003).
Menurut Arie (2000), terdapat beberapa kegiatan penanganan ikan hidup setelah dilakukan pemanenan, yaitu: penyeleksian, penimbangan, pemberokan dan pengangkutan.
a. Penyeleksian, dilakukan karena dalam satu periode pemanenan biasanya ukuran ikan sangat beragam. Ikan perlu diseleksi dan dipisahkan menurut ukurannya. Ikan yang berukuran kecil sebaiknya dipelihara kembali dalam kolam pembesaran.
c. Pemberokan, dapat diartikan sebagai kegiatan penyimpanan sementara sebelum ikan dipasarkan dengan tujuan untuk membuang kotoran dalam tubuh ikan. Pemberokan dapat dilakukan dalam bak, selama pemberokan ikan tidak diberi pakan. Pemberokan dilakukan selama 24 jam untuk perjalanan yang lebih dari 12 jam (Mangunkusumo 2009). Pemberokan dilakukan 1-2 hari untuk ikan ukuran konsumsi (Junianto 2003).
d. Pengangkutan, untuk ikan konsumsi dapat diangkut dengan berbagai cara, tergantung tujuan pasar lokal, luar daerah ataupun ekspor. Angkutan lokal biasanya menggunakan sistem basah, sedangkan untuk luar daerah yang jauh dan ekspor dilakukan dengan sistem kering.
2.4 Transportasi Ikan Hidup
Transportasi ikan hidup pada dasarnya adalah memaksa menempatkan ikan dalam suatu lingkungan baru yang berlainan dengan lingkungan asalnya dan disertai perubahan-perubahan sifat lingkungan yang sangat mendadak (Hidayah 1998). Ada dua sistem transportasi yang digunakan untuk hasil perikanan hidup di lapangan. Sistem transportasi tersebut terdiri dari transportasi sistem basah dan transportasi sistem kering (Junianto 2003).
Menurut Jailani (2000), pada transportasi sistem basah, ikan diangkut di dalam wadah tertutup atau terbuka yang berisi air laut atau air tawar tergantung jenis dan asal ikan. Pada pengangkutan dengan wadah tertutup, ikan diangkut di dalam wadah tertutup dan suplai oksigen diberikan secara terbatas yang telah diperhitungkan sesuai dengan kebutuhan selama pengangkutan. Pada pengangkutan dalam wadah terbuka, ikan diangkut dengan wadah terbuka dengan suplai oksigen secara terus menerus dan aerasi selama perjalanan. Transportasi basah biasanya digunakan untuk transportasi hasil perikanan hidup selama
penangkapan di tambak, kolam dan pelabuhan ke tempat pengumpul atau dari satu pengumpul ke pengumpul lainnya.
dipingsankan (imotilisasi) terlebih dahulu sebelum dikemas dalam media tanpa air (Suryaningrum et al. 2007).
Pada transportasi ikan hidup sistem kering perlu dilakukan proses penenangan terlebih dahulu. Kondisi ikan yang tenang akan mengurangi stress, mengurangi kecepatan metabolisme dan konsumsi oksigen. Pada kondisi ini tingkat kematian selama transportasi akan rendah sehingga memungkinkan jarak transportasi dapat lebih jauh dan kapasitas angkut dapat ditingkatkan lagi. Metode penanganan ikan hidup dapat dilakukan dengan cara menurunkan suhu air atau dapat juga menggunakan zat anestesi. Perlu diperhatikan bahwa ikan yang akan dipingsankan ini nantinya akan dikonsumsi, sehingga pemilihan metode imotilisasi harus memperhatikan aspek kesehatan (Nitibaskara et al. 2006).
Syarat utama dalam pengangkutan ikan hidup adalah kesehatan ikan. Ikan harus dalam keadaan sehat, tidak berpenyakit dan dalam kondisi prima. Ikan yang sehat dan bugar biasanya sangat gesit, aktif, responsif sesuai dengan karakter masing-masing ikan (Nitibaskara et al. 2006). Menurut Achmadi (2005), ikan dalam keadaan hidup normal memiliki ciri-ciri reaktif terhadap rangsangan luar, keseimbangan dan kontraksi otot normal. Ikan yang kurang sehat atau lemah mempunyai daya tahan hidup yang rendah dan peluang untuk mati selama pemingsanan dan pengangkutan lebih besar (Sufianto 2008).
Menurut Achmadi (2005), ikan hidup yang akan dikirim dipersyaratkan dalam keadaan sehat dan tidak cacat. Pemeriksaan kondisi kesehatan ikan selalu dilakukan untuk mengurangi kemungkinan mortalitas yang tinggi, sedangkan adanya cacat seperti cacat sirip, mata, kulit rusak dan sebagainya dapat menurunkan harga.
2.5 Imotilisasi dengan Suhu Rendah
Imotilisasi berprinsip pada hibernasi, yaitu usaha menekan metabolisme suatu organisme hingga kondisi minimum untuk mempertahankan hidupnya lebih lama (Suryaningrum et al. 2004). Imotilisasi dapat dilakukan salah satunya
dengan menggunakan suhu rendah (Ikasari et al. 2008). Suhu air yang rendah dapat menurunkan aktifitas dan tingkat konsumsi oksigen ikan (Coyle et al. 2004). Pada imotilisasi ikan dengan suhu rendah, suhu diturunkan sedemikian rupa sehingga diperoleh kondisi ikan dengan aktivitas ikan seminimal mungkin akan tetapi masih dapat hidup dengan sehat setelah mengalami pembugaran kembali (Wibowo 1993).
Imotilisasi dengan suhu rendah merupakan cara yang paling efektif, ekonomis dan aman dalam mempersiapkan transportasi lobster air tawar (Suryaningrum et al. 2007). Es batu sering digunakan sebagai bahan pembius karena harganya yang relaif murah, mudah didapat dan aman karena tidak mengandung bahan kimia yang dapat membahayakan manusia. Penurunan suhu dapat dilakukan dengan merendam es batu dalam kantong plastik pada air bak pemingsanan (Nitibaskara et al. 2006). Suhu dingin merupakan salah satu kunci dalam transportasi ikan hidup, pada kondisi ini tingkat metabolisme dan respirasi sangat rendah sehingga ikan atau crustacea dapat diangkut dengan waktu yang lama dan tingkat kelulusan hidup yang tinggi (Berka 1986, diacu dalam Suryaningrum et al. 2007).
Imotilisasi dimaksudkan agar ikan berada dalam aktivitas metabolisme dan respirasi yang rendah sehingga ketahanan hidup di luar habitat hidupnya tinggi (Berka 1986, diacu dalam Suryaningrum et al. 2007). Imotilisasi menggunakan suhu rendah memiliki dua metode yaitu imotilisasi dengan penurunan suhu
bertahap dan imotilisasi dengan penurunan suhu langsung. Penurunan suhu sampai batas tertentu akan menurunkan tingkat metabolisme dan akhirnya akan menyebabkan ikan pingsan. Fase pingsan merupakan fase yang dianjurkan untuk pengangkutan ikan, karena pada fase ini aktivitas ikan relatif akan berhenti (Mc Farland 1959, diacu dalam Achmadi 2005).
menurunkan suhu air secara bertahap sampai suhu tertentu (Nitibaskara et al. 2006). Pada suhu tertentu yang dikehendaki, ikan
dipertahankan di dalam air selama waktu tertentu sampai ikan imotil. Pada penurunan suhu bertahap ini ikan secara bertahap direduksi aktivitas, respirasi dan
metabolismenya sampai mencapai titik imotil yang diperlukan (Nitibaskara et al. 2006). Selain itu, pada kondisi imotil tersebut aktivitas ikan
sudah cukup rendah atau bahkan sudah pingsan sehingga mudah ditangani untuk transportasi. Metode ini secara praktis agak merepotkan, terutama jika udang atau lobster yang akan dikemas banyak (Suryaningrum et al. 2004).
Perubahan perilaku udang windu akibat pembiusan penurunan suhu secara bertahap hingga mencapai suhu pembiusan terbaik 15 oC disajikan pada Tabel 1.
Tabel 1. Perubahan perilaku udang windu akibat pembiusan penurunan suhu bertahap
0 26,0 Udang normal, aktif dan berdiri kokoh 10 23,5 Udang masih berdiri, sebagian mulai lamban 19 20,0 Udang mulai tenang, tidak ada pergerakan 25 18,7 Udang melemah, respon mulai berkurang 29 17,5 Sebagian tenang dan lemah
37 16,3 Respon lemah, mulai limbung, sebagian miring 43 15,7 Udang mulai panik, kaki renang masih bergerak lemah 52 15,0 Udang merebah, semakin lemah, pingsan
Sumber: Gayatri (2000)
Hasil penelitian Wibowo et al. (2005), diacu dalam Suryaningrum
et al. (2007), memberikan informasi mengenai perubahan fisiologis lobster air tawar pada berbagai suhu. Informasi tersebut digunakan untuk menentukan suhu imotil dan suhu media selama transportasi. Menurut Suryaningrum dan Utomo
Tabel 2. Respon aktivitas fisiologis lobster air tawar pada berbagai suhu
No Suhu (oC) Perubahan aktivitas
1 30,4-25,4 Lobster bergerak aktif, kaki jalan, kaki renang dan kaki capit bergerak aktif, lobster cenderung bergerombol (normal)
2 25,4-19,4 Aktivitas lobster mulai berkurang, kaki jalan, kaki renang dan kaki capit bergerak perlahan-lahan, ekor melipat ke dalam, lobster cenderung diam (tenang)
3 19,4-15,4 Lobster gelisah, bergerak tidak beraturan dengan menyentak-nyentakkan tubuhnya mundur ke belakang, setelah panik lobster tenang kembali, respon terhadap rangsang lemah (panik)
4 15,4-12,9 Lobster mulai hilang keseimbangan, gerakan lobster lemah, respon terhadap rangsangan lemah, ketika posisi tubuh dibalik tidak dapat tegak kembali
5 12,9-10,4 Lobster hilang keseimbangan, posisi tubuh rebah atau terbalik, kaki jalan dan kaki renang diam
6 10,4-9,8 Keseimbangan lobster tidak ada, posisi tubuh terbalik, kaki jalan, kaki renang dan capit kaku tidak bergerak, ekor melipat kea rah abdomen, respon terhadap rangsangan tidak ada (pingsan)
Sumber: Wibowo et al. (2005), diacu dalam Suryaningrum et al. (2007)
Menurut Setiabudi et al. (1995), perubahan-perubahan tingkah laku tersebut disebabkan adanya perubahan suhu. Menurut Phillips et al. (1980), diacu dalam Suryaningrum et al. (1997), laju konsumsi oksigen hewan air akan menurun dengan menurunnya suhu media. Penurunan konsumsi oksigen pada lobster akan mengakibatkan jumlah oksigen yang terikat dalam darah semakin rendah. Keadaan ini akan mengakibatkan suplai oksigen ke jaringan syaraf juga berkurang sehingga menyebabkan berkurangnya aktivitas fisiologis dan lobster menjadi lebih tenang (Suryaningrum et al. 1997).
Metode imotilisasi dengan penurunan suhu secara langsung, yaitu dilakukan dengan cara memasukkan ikan hidup dalam media air dingin pada suhu tertentu selama waktu tertentu sampai ikan imotil. Waktu dan suhu imotilisasi dipengaruhi oleh ukuran, umur dan jenis ikan. Melalui imotilisasi dengan penurunan suhu secara langsung ini ikan akan mengalami shock dan langsung berada dalam tingkat aktivitas, respirasi dan metabolisme yang rendah. Selain itu, pada kondisi imotil tersebut aktivitas ikan sudah cukup rendah atau bahkan sudah pingsan sehingga mudah ditangani untuk transportasi (Nitibaskara et al. 2006).
Tabel 3. Tingkah laku ikan mas selama proses pemingsanan dengan suhu rendah
5 8 Ikan kelihatan panik, bergerak tidak beraturan
10 8 Ikan shock ditandai dengan gerakan tak terkendali, kemudian ikan mulai oleng
15 8 Ikan rebah disertai operkulum bergerak lambat. Ikan tidak bergerak jika disentuh
20 8 Tidak ada aktivitas, operkulum bergerak lemah disertai terjadinya kekejangan otot yang mulai kaku
Sumber: Jailani (2000)
Beberapa komoditas hasil perikanan yang dapat ditransportasikan dalam
keadaan hidup dan dikemas dalam media tanpa air (transportasi sistem kering) menggunakan metode pembiusan suhu rendah adalah ikan, lobster dan udang. Udang yang memiliki nilai jual yang tinggi di Jepang, yaitu Penaeus japonicas,
karena udang tersebut ditransportasikan hidup dengan pembiusan suhu rendah dalam kemasan serbuk gergaji dingin (Shigueno 1975, diacu dalam Salin 2005).
Beberapa Penaeid lainnya diantaranya adalah Penaeus esculentus (Haswell),
P. monodon (Fabricus), P. semisulcatus (De Haan) dan Melicertus (Penaeus) tawar hidup biasanya masih menggunakan media pengangkutan air yang kurang aman, beresiko tinggi dan kurang efisien. Transportasi dengan sistem kering dapat menjadi pilihan tepat, apabila kondisi optimalnya diketahui dan merupakan cara yang efisien dan aman meskipun beresiko tinggi.
Ikan mas yang dipingsankan dengan suhu rendah secara langsung pada suhu 8 oC dan dikemas dalam styrofoam berukuran 30x30x40 cm3 dengan kepadatan 5 ekor ikan selama 5 jam memiliki tingkat kelulusan hidup 40 % (Jailani 2000). Udang yang dipingsankan pada suhu 18 oC secara langsung selama 15 menit memiliki tingkat kelulusan hidup sebesar 40 % setelah dikemas selama 22 jam (Nitibaskara et al. 2006). Udang windu tambak yang dibius menggunakan suhu rendah secara langsung pada suhu 17-19 oC dapat dipertahankan kelangsungan hidupnya sebesar 93,75 % di dalam media serbuk gergaji dingin dalam uji transportasi selama 16 jam (Setiabudi et al. 1995). Lobster hijau pasir (Panulirus homarus) yang dibius menggunakan suhu rendah secara langsung pada suhu 14-15 oC selama 20 menit dapat bertahan hidup selama 20 jam dengan kelulusan hidup 100 % (Suryaningrum at al. 1994).
Lama pembiusan yang terjadi pada proses pembiusan berbeda-beda . Hal ini disebabkan fase panik yang terjadi saat proses pembiusan. Menurut Karnila dan Edison (2001), fase panik tersebut dipengaruhi oleh suhu pembiusan. Ikan sangat sensitif dengan adanya perubahan suhu air (Subasinghe 1997). Pada fase panik, respirasi akan meningkat dengan tajam kemudian turun sampai mencapai respirasi terendah yang menyebabkan ikan pingsan. Tingkat respirasi yang cukup rendah menyebabkan lobster terganggu keseimbangannya sehingga lobster tidak dapat
menyangga tubuhnya sendiri dan jatuh dengan posisi tubuh miring (Suryaningrum et al. 2008).
Pada kondisi shock, ikan banyak melakukan gerakan yang berlebihan pada saat proses pembiusan. Kondisi shock tersebut menyebabkan ikan cepat mengalami kematian karena ikan yang stres akan mengalami peningkatan asam laktat dalam darah. Jika asam laktat terakumulasi dalam darah cukup tinggi akan mempercepat terjadinya proses kematian (Afrianto dan Liviawaty 1989, diacu dalam Utomo 2001). Faktor lingkungan dapat menjadi salah satu faktor penyebab stress pada ikan (Lerner 2004).
Parameter penting dalam pembiusan pada suhu rendah yang cukup berpeluang dalam menunjang kelulusan hidup ikan adalah metode pembiusan,
diantaranya ekonomis karena es mudah didapat dan aman karena tidak terdapat residu bahan kimia (Suryaningrum et al. 1997).
Ada beberapa keuntungan dan kerugian metode imotilisasi dengan penurunan suhu langsung dan bertahap. Pemingsanan dengan penurunan suhu secara bertahap dapat menimbulkan stress pada ikan dan memerlukan waktu yang panjang hingga ikan pingsan, sedangkan dengan penurunan suhu secara langsung dapat mengurangi stress selama proses pemingsanan dan mempercepat proses pemingsanan (Nitibaskara et al. 2006).
Tingkat keberhasilan transportasi ikan hidup diukur dari besarnya nilai tingkat kelulusan hidupnya (survival) atau nilai kematiannya (mortalitas). Pada transportasi ikan hidup sistem kering, setelah ikan ditransportasikan kemudian ikan disadarkan kembali (proses pembugaran) dengan aerasi secara terus menerus untuk mengetahui tingkat kelulusan hidupnya. Penggunaan aerasi bertujuan untuk membantu penambahan udara ke dalam air sehingga kadar oksigen terlarut dalam
air menjadi cukup (Boyd 1982). Piper et al. (1982), diacu dalam Nitibaskara et al. (2006) menyatakan bahwa kandungan oksigen terlarut di atas 5 mg/l dapat menjamin ikan tidak akan mengalami stress. Proses pembugaran bertujuan untuk memulihkan kembali kondisi ikan. Suhu media pembugaran disesuaikan dengan habitat ikan (Achmadi 2005).
Pada proses pembugaran udang dan lobster yang hidup akan berenang, mula-mula udang atau lobster akan limbung tetapi kondisinya akan normal kembali setelah berada dalam air selama 30 menit (Suryaningrum et al. 2004). Menurut Achmadi (2005), ikan yang tidak menunjukkan adanya tanda-tanda pergerakan anggota tubuh setelah 10 menit waktu pembugaran dianggap tidak lulus hidup.
2.6 Pengemasan
Menurut Subasinghe (1997), kebanyakan eksportir mengemas udang atau lobster dalam satu kotak pengemas sebanyak empat sampai lima lapis yang masing-masing diselingi serbuk gergaji, setelah itu kotak pengemas disegel dengan lakban. Suhu kemasan yang berukuran 50x50x50 cm3 agar dapat dipertahankan sama dengan suhu pembiusan maka disarankan untuk menggunakan es seberat 0,5-1 kg yang dibungkus dengan plastik. Es ini diletakkan di bagian atas atau bawah kemasan. Cara lainnya adalah meletakkan es ini di sudut kemasan. Es ini dimasukkan ke dalam plastik kemudian dibungkus dengan kertas koran. Suhu kotak styrofoam yang berukuran 40x60x40 cm3 dapat dipertahankan sama dengan suhu pembiusan dengan menambahkan es seberat 0,5 kg sedangkan yang berukuran 30x30x40 cm3 dan 40x30x30 cm3 dengan menambahkan es seberat 0,3-1 kg dan 0,5 kg yang dibungkus dengan plastik. Es ini diletakkan di bagian bawah kemasan (Setiabudi et al. 1995; Jailani 2000; Suryaningrum et al. 2004; Handini 2008).
Pengangkutan ikan hidup sistem media bukan air menggunakan bahan pengisi atau media. Macam bahan pengisi yang dapat digunakan antara lain sekam padi, serutan kayu, serbuk gergaji dan rumput laut. Fungsi utama bahan pengisi dalam pengangkutan hidup media bukan air adalah untuk mencegah udang atau lobster hidup agar tidak bergeser dalam kemasan, menjaga lingkungan suhu
rendah agar udang tetap pingsan atau imotil dan memberi lingkungan udara yang memadai untuk kelangsungan hidup udang atau lobster. Bahan media kemasan yang digunakan harus memperhatikan kestabilan suhu media kemasan. Suhu media kemasan harus dapat dipertahankan serendah mungkin mendekati titik imotil. Hal ini disebabkan suhu media kemasan berperan dalam mempertahankan tingkat terbiusnya udang atau lobster selama pengangkutan sehingga ikut mempertahankan ketahanan hidup udang atau lobster dalam media bukan air (Junianto 2003). Menurut Suryaningrum et al. (1994), suhu akhir media ideal untuk transportasi sistem kering sebaiknya tidak lebih dari 20 oC.
sebagai pembungkus ikan dapat memberikan keuntungan yaitu kondisi ikan tetap bersih setelah ikan dibongkar dan mencegah serbuk gergaji masuk ke dalam insang (Nitibaskara at al. 2006).
Bahan pengisi yang paling efektif dan efisien dalam pengangkutan organisme hidup adalah serbuk gergaji karena teksturnya baik dan seragam. Serbuk gergaji yang akan digunakan diberi perlakuan terlebih dahulu untuk menghilangkan kotoran atau terpenten (bau) yaitu dengan pencucian dan perendaman (Junianto 2003).
Secara umum ketebalan serbuk gergaji yang digunakan berkisar antara 0,5 cm sampai 10 cm. Menurut Junianto (2003), pada dasar wadah diisi bahan pengisi yang disebar merata membentuk lapisan tipis dengan tebal 0,5-1 cm. Menurut Nitibaskara et al. (2006), lapisan dasar wadah ditaburkan serbuk gergaji dengan tebal 10-15 cm. Menurut Suryaningrum et al. (2004), di atas koran ditaburi serbuk gergaji dingin dengan ketebalan 5-10 cm, sehingga kontak langsung antara ikan dan es dapat dihindari.
Menurut Srikirishnadhas dan Kaleemur (1994), penggunaan serbuk gergaji sebagai media kemasan dapat dikombinasikan dengan jerami atau sisa potongan karung goni. Bahan-bahan tersebut sebelum digunakan didinginkan dalam freezer,
setelah bahan pengisi disiapkan maka perlu disiapkan es batu untuk membantu
3. METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2009 sampai Mei 2009. Penelitian dilakukan di Kolam Percobaan Babakan dan Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah timbangan, penggaris, aerator, akuarium untuk pembiusan berukuran 76x52x41 cm3, akuarium berukuran 21x15,5x15,5 cm3 untuk penentuan jumlah es untuk pembiusan dan ember plastik serta peralatan pengukuran kualitas air, yaitu termometer, pH-meter, DO-meter, spektrofotometer dan pengukur waktu.
Bahan percobaan yang digunakan dalam penelitian ini adalah ikan nila (Oreochromis niloticus) ukuran 5-6 ekor/kg atau ± 200 gram/ekor yang diperoleh dari kolam ikan di desa Situdaun, Bogor. Ukuran ikan nila yang digunakan disajikan pada Lampiran 1. Bahan pembantu yang digunakan adalah air tawar untuk aklimatisasi, media pemingsanan dan sebagai bahan pembuatan es batu (untuk pendingin dalam kemasan dan penurunan suhu media air saat pemingsanan), kertas koran untuk pembungkus es dan ikan dalam kemasan, kantong plastik ukuran 15x25 cm2 (berkapasitas 1000 gr) sebagai wadah untuk membungkus es batu, serbuk gergaji digunakan sebagai bahan pengisi dalam kemasan, kotak styrofoam ukuran 30x30x40 cm3 digunakan sebagai wadah pengemas, karet gelang dan lakban.
3.3 Prosedur dan Tahap Penelitian 3.3.1 Persiapan penelitian
a. Pengukuran kualitas air
Kualitas air yang digunakan dalam percobaan ini perlu diketahui dengan melakukan pengukuran suhu, kadar oksigen terlarut (DO), CO2, pH, amoniak dan
pengukuran kualitas air yaitu untuk memastikan bahwa kualitas air tersebut dalam kondisi yang layak untuk kelangsungan hidup ikan nila sehingga tidak mempengaruhi pada saat ikan nila dipelihara dan diadaptasikan serta diberi perlakuan dalam proses pembiusan maupun pembugaran. Alat dan cara peneraannya dalam pengukuran kualitas air disajikan pada Tabel 4. Prosedur cara peneraan dari masing-masing parameter kualitas media air tersebut dicantumkan pada Lampiran 2.
Tabel 4. Parameter kualitas air, alat dan cara peneraannya
No Parameter Alat Cara peneraan
1 Suhu air Termometer Pembacaan skala
2 DO DO-meter Pembacaan skala
3 CO2 Alat gelas Titrasi
4 pH pH-meter Pembacaan skala
5 Amoniak Spektrofotometer Pembacaan skala 6 Alkalinitas Alat gelas Titrasi
Sumber: Handini (2008)
b. Media serbuk gergaji dingin
Bahan pengisi yang digunakan dalam penelitian ini adalah serbuk gergaji. Serbuk gergaji sebelum digunakan dicuci dengan air tawar kemudian dijemur. Proses pencucian dan penjemuran ini dilakukan sebanyak tiga kali. Serbuk gergaji kering kemudian direndam dengan air tawar di dalam ember yang kemudian ditambahkan sejumlah es batu dan diaduk sampai suhu serbuk gergaji sesuai dengan suhu pembiusan ikan nila.
c. Ikan nila yang diuji
Ikan yang dipilih dalam kondisi yang sehat dan tidak cacat, gerakannya aktif dan responsif terhadap rangsangan. Ikan yang baru dibeli dalam keadaan hidup dari kolam dipindahkan pada akuarium yang diberi aerasi untuk dilakukan adaptasi (2x24 jam) kemudian dipuasakan (24 jam). Pada saat ikan baru dipindahkan pada akuarium, ikan tidak diberi pakan terlebih dahulu, karena ikan berada dalam lingkungan yang baru sehingga perlu penyesuaian diri terhadap lingkungannya tersebut.
d. Media kemasan
berlangsungnya proses pembiusan dengan penurunan suhu rendah terhadap ikan nila. Pada saat pembiusan ikan nila telah dilakukan, pengemas sudah disiapkan sesuai dengan teknik pengemasan sistem kering. Serbuk gergaji yang sudah siap digunakan dimasukkan ke dalam styrofoam yang pada bagian dasarnya diberi butiran es batu sebanyak kurang lebih 500 gram yang dibungkus dalam kantong plastik agar serbuk gergaji tetap dingin selama penyimpanan ikan (Subasinghe 1997).
Penyusunan ikan nila di dalam kemasan secara berurutan dengan melapisi bagian dasar dengan es batu sebanyak 500 gram yang dibungkus plastik yang di atasnya dilapisi kertas koran dan serbuk gergaji dengan ketebalan 3 cm kemudian ikan dibungkus dengan kertas koran diletakkan dengan posisi miring di atasnya kemudian ditaburi kembali dengan serbuk gergaji sampai tertutup semua. Penyusunan ikan dalam kemasan dapat dilihat pada Gambar 2.
Serbuk gergaji
Ikan nila 5 ekor dibungkus kertas koran
Serbuk gergaji
Kertas koran
Es batu yang dibungkus plastik
Gambar 2. Penyusunan ikan nila (Oreochromis niloticus) dalam kemasan
3.3.2 Metode Penelitian a. Penelitian pendahuluan
1) Penentuan jumlah es untuk pembiusan
terendah untuk pembiusan ikan nila akan digunakan pada penelitian tahap selanjutnya.
2) Penentuan suhu pembiusan ikan nila
Akuarium yang digunakan pada penentuan suhu pembiusan ikan nila memiliki ukuran 76x52x41 cm3. Perbandingan jumlah es sebanyak 2 kg dengan volume air sebanyak 1 liter berdasarkan hasil penelitian pendahuluan, maka diperlukan 40 kg es dengan 20 liter air dan ditambahkan 5 ekor ikan dilengkapi dengan aerasi. Penelitian ini bertujuan untuk mengetahui suhu pembiusan dan fase imotil ikan nila. Pada proses pembiusan, tingkah laku ikan diamati sampai ikan mengalami pingsan. Pada penelitian tahap ini akan diketahui suhu pembiusan dan fase imotil ikan nila yang akan digunakan pada penelitian utama. Klasifikasi respon tingkah laku ikan secara umum selama pembiusan disajikan pada Tabel 5.
Tabel 5. Klasifikasi respon tingkah laku ikan selama pembiusan
Fase Respon tingkah laku
Normal Reaktif terhadap rangsangan luar, keseimbangan dan kontraksi otot normal
Pingsan ringan Reaktivitas terhadap rangsangan luar lambat, gerak operkulum lambat dan gerak renang aktif
Pingsan berat Reaktivitas terhadap rangsangan luar tidak ada, kecuali dengan tekanan kuat, pergerakan operkulum lambat Roboh Gerak operkulum tidak ada atau sangat lemah, respon
terhadap rangsang luar tidak ada, gerak renang tidak ada
Sumber : Mc Farland (1959), diacu dalam Achmadi (2005)
b. Penelitian utama
1) Pembiusan ikan nila dengan suhu rendah secara langsung
Ikan nila yang akan dibius diseleksi terlebih dahulu kondisi fisik dan kesehatannya, karena akan mempengaruhi keberhasilan penerapan teknik pembiusan untuk ditransportasikan dalam keadaan hidup tanpa media air. Ikan nila dibius dengan penurunan suhu secara langsung sesuai dengan suhu pembiusan yang mencapai fase pingsan ringan, fase pingsan berat dan fase roboh pada penelitian pendahuluan.
mengatur suhu media air sesuai dengan suhu pembiusan ikan nila kemudian ikan nila dimasukkan setelah suhu media air telah mencapai suhu pembiusan. Hal ini bertujuan untuk mengetahui tingkat kelulusan hidup ikan jika dibius secara langsung dengan suhu sesuai dengan fase pingsan ikan nila. Pada tahap ini dilakukan pencatatan waktu, suhu dan pengamatan tingkah laku ikan nila selama proses pembiusan tersebut berlangsung.
2) Penyimpanan ikan nila (Oreochromis niloticus)
Kotak styrofoam kosong terlebih dahulu diberi es batu dalam kantong plastik sebanyak kurang lebih 0,5 kg yang kemudian ditutup kertas koran. Media serbuk gergaji lembab dan dingin sesuai dengan suhu pembiusan ikan nila, ditaburkan setebal 3 cm di atas kertas koran. Ikan yang telah imotil masing-masing dibungkus kertas koran dan disusun miring di atas serbuk gergaji kemudian ditaburi kembali dengan serbuk gergaji sampai tertutup semua. Tahap selanjutnya kotak ditutup rapat dan dilakban untuk menghindari pengaruh suhu lingkungan luar terhadap isi kemasan.
Pada saat proses penyimpanan tersebut dilakukan pengamatan dan pengukuran beberapa parameter yang berpengaruh terhadap tingkat mortalitas ikan nila, yaitu :
a. Interval lama penyimpanan
Lama penyimpanan ikan nila (Oreochromis niloticus) terdiri dari 4 taraf waktu, yaitu 0 jam, 3 jam, 6 jam dan 9 jam. Pada setiap perlakuan waktu penyimpanan terdiri dari 3 kali ulangan.
b. Pengukuran suhu media pengisi
Pengukuran suhu media serbuk gergaji dilakukan sebelum ikan dikemas dalam kemasan styrofoam dan sesudah dilakukan penyimpanan ikan dalam kemasan media serbuk gergaji dingin menggunakan termometer.
c. Kelulusan hidup ikan nila (Oreochromis niloticus)
dengan aerasi secara terus-menerus. Suhu media pembugaran disesuaikan dengan habitat ikan nila yaitu 27-28 oC. Tingkat kelulusan hidup ikan dihitung berdasarkan persentase ikan yang hidup setelah penyimpanan. Persamaan yang digunakan untuk perhitungan tingkat kelulusan hidup ikan adalah :
M = Ut/Uo x 100 % Keterangan :
M : Tingkat kelulusan hidup (%)
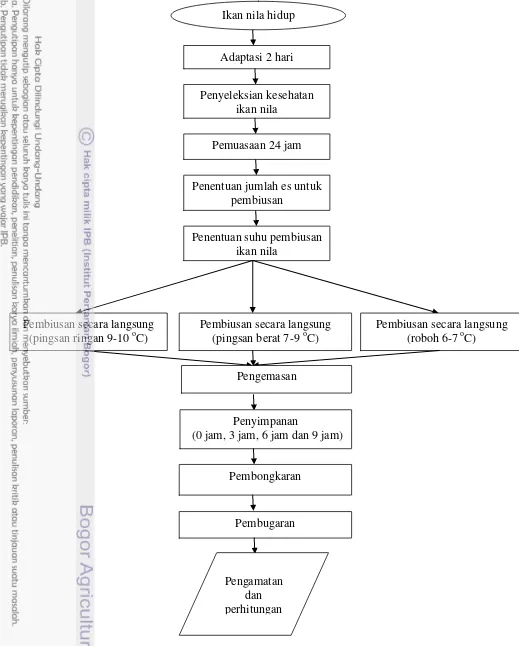
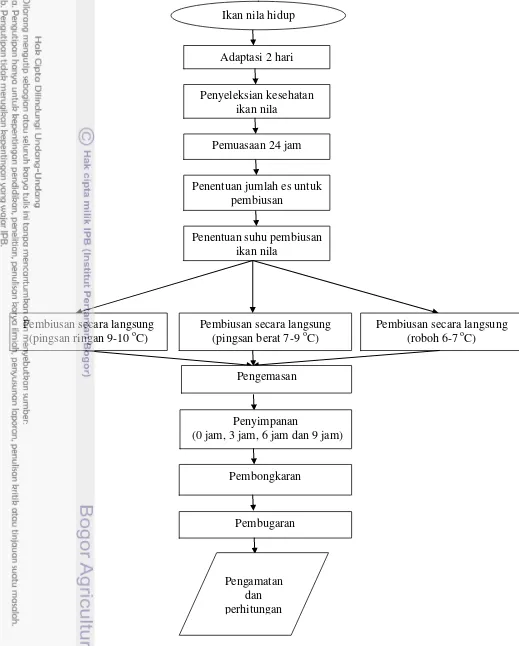
Gambar 3. Diagram alir penyimpanan ikan nila dalam serbuk gergaji dingin Adaptasi 2 hari
Ikan nila hidup
Penyeleksian kesehatan ikan nila
Penentuan suhu pembiusan ikan nila
Penentuan jumlah es untuk pembiusan
Pemuasaan 24 jam
Pembiusan secara langsung (pingsan berat 7-9 oC)
Pembiusan secara langsung (roboh 6-7 oC) Pembiusan secara langsung
(pingsan ringan 9-10 oC)
Pengemasan
Penyimpanan
(0 jam, 3 jam, 6 jam dan 9 jam)
Pembongkaran
Pembugaran
3.4 Analisis Data
4. HASIL DAN PEMBAHASAN
4.1 Parameter Air sebagai Tempat Hidup Ikan Nila (Oreochromis niloticus)
Kualitas air merupakan salah satu faktor penting yang berpengaruh terhadap kelangsungan hidup ikan nila. Kondisi lingkungan yang mendukung perkembangan ikan nila yaitu pH air, temperatur, oksigen terlarut, karbondioksida, amoniak dan alkalinitas (BPPAT DKP 2001).
Parameter kualitas air yang diamati meliputi pH air, suhu, DO, CO2, NH3
dan alkalinitas. Pengamatan kualitas air meliputi kualitas air kolam asal ikan, kualitas air laboratorium yang belum diendapkan dan kualitas air laboratorium yang telah diendapkan selama 2 hari. Hasil pengamatan kualitas air disajikan pada Tabel 6.
Tabel 6. Data hasil pengamatan kualitas air
Parameter kualitas air Sumber air
Air B = Air laboratorium yang belum diendapkan
Air C = Air laboratorium yang telah diendapkan selama 2 hari
Pada Tabel 6 tampak bahwa, air kolam asal ikan nila memiliki pH 7, suhu 29
o
C, DO 4 mg/l, CO2 4 mg/l, NH3 0,1 mg/l dan alkalinitas 137 mg/l. Kualitas air
laboratorium yang belum diendapkan memiliki pH 6, suhu 29 oC, DO 4 mg/l, CO2
5 mg/l, NH3 0,1 mg/l dan alkalinitas 155 mg/l, sedangkan kualitas air laboratorium
yang telah diendapkan selama 2 hari menunjukkan hasil yang tidak jauh berbeda yaitu pH 7, suhu 29 oC, DO 4 mg/l, CO2 5 mg/l, NH3 0,1 mg/l dan alkalinitas
Suhu merupakan salah satu parameter fisika yang digunakan untuk mengukur kualitas air. Hasil pengamatan kualitas air kolam asal ikan dan kualitas air laboratorium yang belum diendapkan dan air laboratorium yang telah diendapkan selama 2 hari memiliki kisaran suhu yang sama, yaitu 29 oC. Suhu tersebut baik untuk pertumbuhan ikan nila seperti yang dinyatakan Boyd (1982), bahwa kisaran suhu yang baik bagi ikan di daerah tropis adalah 25-32 oC.
Suhu sangat berpengaruh terhadap proses metabolisme dan kelarutan senyawa-senyawa di dalam air. Peningkatan suhu perairan dapat mengakibatkan penurunan kelarutan gas dalam air, misalnya O2, CO2 dan sebagainya
(Wulandari 2006, diacu dalam Irawan 2007). Peningkatan suhu juga dapat menyebabkan peningkatan kecepatan metabolisme dan respirasi organisme akuatik dan selanjutnya mengakibatkan peningkatan konsumsi oksigen. Peningkatan suhu sebesar 10 oC menyebabkan peningkatan konsumsi oksigen organisme akuatik sebesar 2-3 kali lipat (Effendi 2003). Hal ini berbanding terbalik dengan adanya penurunan suhu yang dapat mengurangi aktifitas dan proses metabolisme ikan. Kondisi tersebut dapat dimanfaatkan untuk tujuan transportasi ikan hidup sistem kering sehingga ikan dapat bertahan lebih lama di dalam lingkungan yang terbatas selama proses transportasi berlangsung.
Hasil pengamatan kualitas air kolam asal ikan nila, air laboratorium yang
belum diendapkan dan air laboratorium yang telah diendapakan selama 2 hari memiliki pH antara 6-7 yang berarti sesuai untuk kondisi lingkungan ikan hidup. Ikan mampu beradaptasi terhadap perubahan pH lingkungan dengan baik ketika perubahan yang terjadi tidak drastis (Nitibaskara et al. 2006). Nilai pH yang ideal untuk kehidupan ikan berkisar antara 6,5 sampai 8,5.
suhu, semakin tinggi suhu maka kelarutan oksigen semakin berkurang. Peningkatan suhu sebesar 1 oC akan meningkatkan konsumsi oksigen sekitar 10 % (Brown 1987, diacu dalam Effendi 2003).
Kemampuan ikan untuk menggunakan oksigen tergantung pada toleransi terhadap tekanan lingkungan, suhu air, pH, konsentrasi CO2 dan hasil
metabolisme seperti amoniak. Air kolam asal ikan, air laboratorium yang belum diendapkan dan air laboratorium yang telah diendapkan selama 2 hari memiliki kandungan CO2 berkisar 4-5 mg/l. Hal ini sesuai untuk kehidupan ikan nila,
karena menurut Effendi (2003) perairan yang diperuntukkan bagi kepentingan perikanan sebaiknya mengandung karbondioksida bebas < 5 mg/l. Kadar karbondioksida bebas sebesar 10 mg/l masih dapat ditolerir oleh organisme akuatik, dengan tetap disertai kadar oksigen yang cukup. Kadar alkalinitas dan amoniak yang diperoleh dari pengamatan kualitas air kolam asal ikan, air laboratorium yang belum diendapkan dan air laboratorium yang telah diendapkan selama 2 hari berkisar 137-166 mg/l dan 0,1 mg/l. Hal ini menunjukkan bahwa kadar alkalinitas dan amoniak masih layak digunakan untuk kehidupan ikan nila selama proses adaptasi dan pemuasaan ikan.
Hasil pengamatan kualitas air yang telah dilakukan baik untuk air kolam asal ikan, air laboratorium yang belum diendapkan dan air laboratorium yang telah
diendapkan selama 2 hari menunjukkan bahwa hasil kualitas air yang diperoleh masih memenuhi syarat kondisi lingkungan hidup bagi ikan nila. Hal ini menunjukkan bahwa kualitas air tersebut tidak mempengaruhi kondisi kesehatan dan proses pemeliharaan, pengadaptasian ikan nila serta pada saat diberi perlakuan dalam proses pembiusan maupun pembugaran.
4.2 Penelitian Pendahuluan
4.2.1 Penentuan jumlah es untuk pembiusan
Teknologi transportasi ikan hidup yang berkembang saat ini adalah transportasi sistem kering. Transportasi sistem kering ini biasanya menggunakan teknik pembiusan pada ikan atau ikan dipingsankan (imotilisasi) terlebih dahulu sebelum dikemas dalam media tanpa air (Suryaningrum et al. 2007).
Teknik pembiusan atau imotilisasi yang dilakukan dalam penelitian ini yaitu dengan suhu rendah. Imotilisasi dengan suhu rendah merupakan cara yang paling efektif, ekonomis dan aman (Suryaningrum et al. 2007). Es batu sering digunakan sebagai bahan pembius karena harganya yang relaif murah, mudah didapat dan aman karena tidak mengandung bahan kimia yang dapat membahayakan manusia. Penurunan suhu dapat dilakukan dengan merendam es batu dalam kantong plastik pada air bak pemingsanan (Nitibaskara et al. 2006). Suhu dingin merupakan salah satu kunci dalam transportasi ikan hidup, pada kondisi ini tingkat metabolisme dan respirasi sangat rendah sehingga ikan atau crustacea dapat diangkut dalam waktu yang lama dengan tingkat kelulusan hidup yang tinggi (Berka 1986, diacu dalam Suryaningrum et al. 2007).
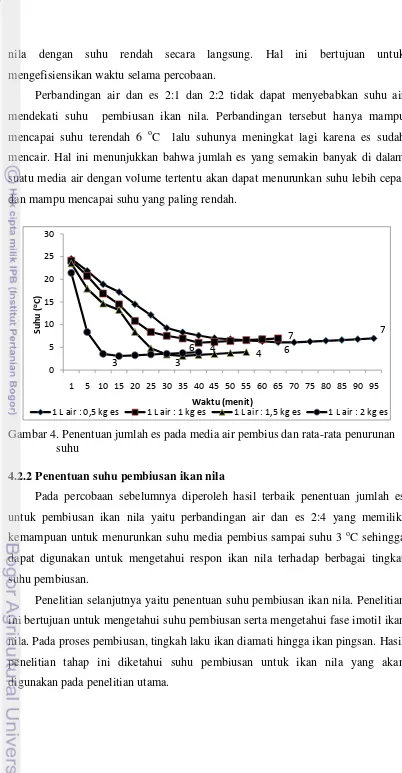
Jumlah es yang digunakan dalam teknik pembiusan ikan akan berpengaruh terhadap penurunan suhu. Penentuan jumlah es untuk pembiusan ditentukan dengan cara melakukan percobaan perbandingan volume air pembius sebanyak 1 liter dengan jumlah es tertentu. Penyebaran suhu pengesan di dalam akuarium
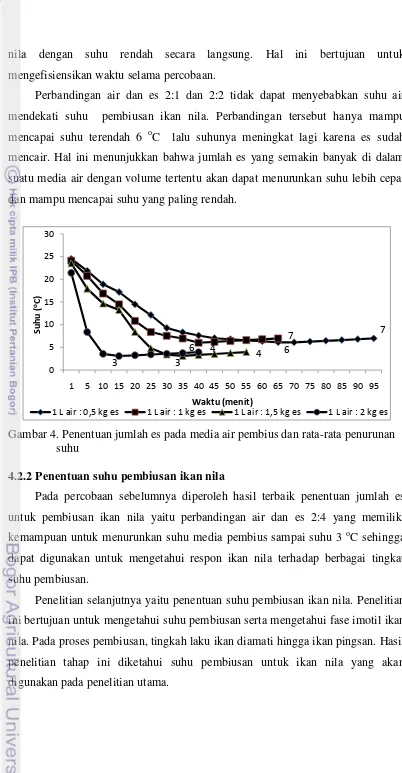
dibantu dengan adanya aerasi. Hasil percobaan tersebut disajikan pada Gambar 4 dan Lampiran 3.
Pada Gambar 4 dapat dilihat bahwa perbandingan 1 liter air dengan 0,5 kg es (2:1) dan 1 liter air dengan 1 kg es (2:2) hanya dapat mencapai suhu terendah 6
o
nila dengan suhu rendah secara langsung. Hal ini bertujuan untuk mengefisiensikan waktu selama percobaan.
Perbandingan air dan es 2:1 dan 2:2 tidak dapat menyebabkan suhu air mendekati suhu pembiusan ikan nila. Perbandingan tersebut hanya mampu mencapai suhu terendah 6 oC lalu suhunya meningkat lagi karena es sudah mencair. Hal ini menunjukkan bahwa jumlah es yang semakin banyak di dalam suatu media air dengan volume tertentu akan dapat menurunkan suhu lebih cepat dan mampu mencapai suhu yang paling rendah.
Gambar 4. Penentuan jumlah es pada media air pembius dan rata-rata penurunan suhu
4.2.2 Penentuan suhu pembiusan ikan nila
Pada percobaan sebelumnya diperoleh hasil terbaik penentuan jumlah es
untuk pembiusan ikan nila yaitu perbandingan air dan es 2:4 yang memiliki kemampuan untuk menurunkan suhu media pembius sampai suhu 3 oC sehingga dapat digunakan untuk mengetahui respon ikan nila terhadap berbagai tingkat suhu pembiusan.
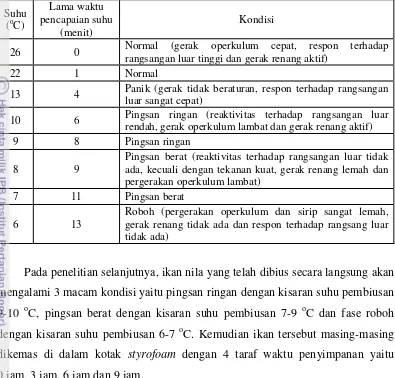
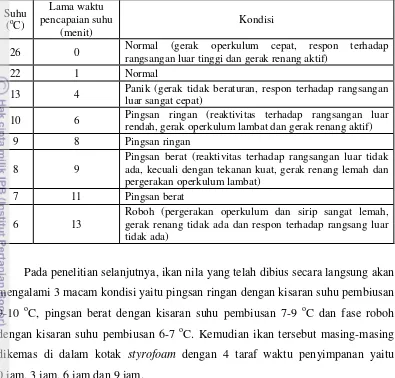
Berdasarkan hasil penelitian pendahuluan, maka diperlukan 40 kg es dengan 20 liter air agar suhu air mencapai 3 oC sehingga dapat digunakan untuk membius 5 ekor ikan. Penambahan 5 ekor ikan bertujuan untuk mempermudah pengamatan. Hasil penentuan suhu pembiusan ikan nila disajikan pada Tabel 7 dan Lampiran 5. Tabel 7 menunjukkan bahwa ikan nila mengalami beberapa fase imotil yaitu fase pingsan ringan, pingsan berat dan roboh. Ikan nila mengalami fase pingsan ringan pada kisaran suhu 9-10 oC, fase pingsan berat pada kisaran suhu 7-9 oC dan roboh pada kisaran suhu 6-7 oC.
Fase pingsan ringan ikan nila ditandai dengan kondisi reaktivitas terhadap rangsangan luar rendah, gerak operkulum lambat dan gerak renang aktif. Fase pingsan berat ikan nila ditandai dengan kondisi reaktivitas terhadap rangsangan luar tidak ada, kecuali dengan tekanan kuat, gerak renang lemah dan pergerakan operkulum lambat, sedangkan pada fase roboh ikan nila ditandai dengan kondisi pergerakan operkulum dan sirip sangat lemah, gerak renang tidak ada dan respon terhadap rangsangan dari luar tidak ada.
Hasil penelitian tersebut menunjukkan bahwa ikan nila merupakan ikan yang memiliki kemampuan adaptasi yang cukup tinggi terhadap perubahan lingkungan. Menurut Setiabudi et al. (1995), perubahan-perubahan tingkah laku tersebut disebabkan adanya perubahan suhu. Terganggunya keseimbangan ikan
Tabel 7. Hubungan suhu dengan tingkah laku ikan nila yang dibius dengan suhu rangsangan luar tinggi dan gerak renang aktif)
22 1 Normal
13 4 Panik (gerak tidak beraturan, respon terhadap rangsangan luar sangat cepat)
10 6 Pingsan ringan (reaktivitas terhadap rangsangan luar rendah, gerak operkulum lambat dan gerak renang aktif) 9 8 Pingsan ringan
8 9
Pingsan berat (reaktivitas terhadap rangsangan luar tidak ada, kecuali dengan tekanan kuat, gerak renang lemah dan pergerakan operkulum lambat)
7 11 Pingsan berat
6 13
Roboh (pergerakan operkulum dan sirip sangat lemah, gerak renang tidak ada dan respon terhadap rangsang luar tidak ada)
Pada penelitian selanjutnya, ikan nila yang telah dibius secara langsung akan mengalami 3 macam kondisi yaitu pingsan ringan dengan kisaran suhu pembiusan 9-10 oC, pingsan berat dengan kisaran suhu pembiusan 7-9 oC dan fase roboh dengan kisaran suhu pembiusan 6-7 oC. Kemudian ikan tersebut masing-masing dikemas di dalam kotak styrofoam dengan 4 taraf waktu penyimpanan yaitu 0 jam, 3 jam, 6 jam dan 9 jam.
4.3 Penelitian Utama
Penelitian utama yang dilakukan meliputi pengamatan perubahan perilaku ikan nila selama proses pembiusan secara langsung dengan suhu rendah dan kelulusan hidup ikan nila setelah penyimpanan. Suhu pembiusan yang digunakan pada penelitian utama ini merupakan hasil dari penelitian pendahuluan, yaitu 9-10 oC, 7-9 oC dan 6-7 oC.
4.3.1 Perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah
tahan hidup yang rendah dan peluang untuk mati selama pemingsanan dan pengangkutan lebih besar (Sufianto 2008). Pemeriksaan kondisi kesehatan ikan selalu dilakukan untuk mengurangi tingkat mortalitas yang tinggi.
Pada proses pembiusan ini dilakukan juga pengamatan terhadap perilaku ikan nila selama memasuki fase-fase imotil. Hasil pengamatan perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah 9-10 oC, 7-9 oC dan 6-7 oC disajikan pada Tabel 8 dan Lampiran 6.
Tabel 8 menunjukkan bahwa ikan nila yang dibius secara langsung dengan suhu antara 9-10 oC dapat menyebabkan ikan mengalami fase pingsan ringan pada menit ke-20. Perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu 9-10 oC pada menit ke-0 menunjukkan kondisi dan aktivitas
Tabel 8. Perubahan perilaku ikan nila selama proses pembiusan secara langsung menggunakan suhu rendah 9-10 oC, 7-9 oC dan 6-7 oC
5 Panik Pingsan ringan Pingsan berat
10 Respon terhadap tidak beraturan. Menit ke-10 kondisi ikan ditandai dengan gerak renang aktif dan respon terhadap rangsangan luar cepat. Pada menit ke-15 operkulum dan sirip ikan mulai melemah, sedangkan pada menit ke-20 ikan sudah mengalami fase pingsan ringan yang ditandai dengan gerak operkulum lambat, respon terhadap rangsangan luar rendah, gerak renang masih aktif. Hal ini menunjukkan ikan nila merupakan ikan yang memiliki daya tahan tubuh yang tinggi terhadap perubahan lingkungan yang baru.
Pembiusan ikan nila secara langsung menggunakan suhu rendah 7-9 oC menyebabkan ikan nila mengalami fase pingsan berat pada menit ke-15. Pada
Selanjutnya pada menit ke-5 gerak operkulum lambat, respon terhadap rangsangan luar rendah dan gerak renang aktif (pingsan ringan). Pada menit ke-10 ikan berada di dasar akuarium, sedangkan pada menit ke-15 ikan memasuki fase pingsan berat yang ditandai dengan gerak operkulum lambat, respon terhadap rangsangan luar tidak ada kecuali dengan tekanan kuat dan gerak renang lemah. Hal ini menunjukkan bahwa suhu 7-9 oC merupakan suhu ekstrim bagi ikan nila karena pada saat ikan nila dibius menunjukkan respon ikan mulai panik dan bergerak tidak beraturan pada menit ke-0 dan ikan sudah mengalami fase pingsan ringan pada menit ke-5.
Ikan nila yang dibius secara langsung dengan suhu rendah 6-7 oC dapat menyebabkan ikan mengalami fase roboh pada menit ke-10. Ikan nila pada menit ke-0 kondisinya panik dan bergerak tidak beraturan. Pada menit ke-5 ikan mengalami fase pingsan berat yang ditandai dengan gerak operkulum lambat, respon terhadap rangsangan luar tidak ada kecuali dengan tekanan kuat dan gerak renang lemah. Pada menit ke-10 ikan nila roboh yang ditandai dengan gerak operkulum sangat lemah, respon terhadap rangsangan luar tidak ada dan gerak renang tidak ada.
Ikan yang dibius pada suhu pembiusan 9-10 oC mengalami fase panik pada menit ke-5 sedangkan ikan yang dibius pada suhu pembiusan 7-9 oC dan 6-7 oC mengalami fase panik pada menit ke-0. Fase panik yang terjadi pada masing-masing perlakuan pembiusan dipengaruhi oleh suhu pembiusan yang digunakan (Lampiran 7). Hal ini sesuai dengan pernyataan Karnila dan Edison (2001), bahwa fase panik tersebut dipengaruhi oleh suhu pembiusan.
Lama pembiusan yang terjadi pada masing-masing fase pembiusan berkisar 10-20 menit. Hal ini disebabkan fase panik yang terjadi saat proses pembiusan berbeda-beda. Pada fase panik, respirasi akan meningkat dengan tajam kemudian turun sampai mencapai respirasi terendah yang menyebabkan ikan pingsan. Menurut Suryaningrum et al. (2008), tingkat respirasi yang cukup rendah menyebabkan lobster terganggu keseimbangannya sehingga lobster tidak dapat menyangga tubuhnya sendiri dan jatuh dengan posisi tubuh miring.
yang tinggi selama berada di luar lingkungan hidupnya. Ikan nila yang mengalami fase pingsan ringan, pingsan berat dan roboh memiliki tingkat respirasi dan metabolisme yang rendah.
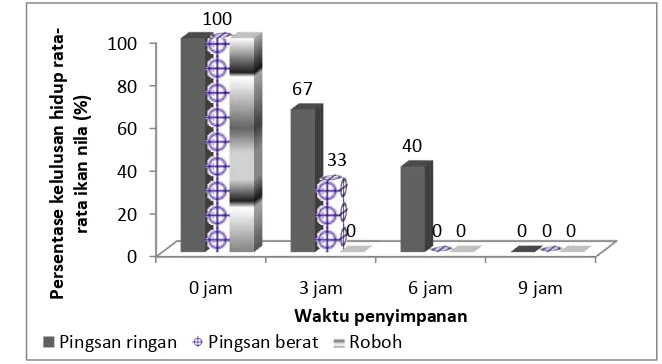
4.3.2 Kelulusan hidup ikan nila (Oreochromis niloticus) setelah penyimpanan
Proses penyimpanan ikan nila dalam kemasan styrofoam dilakukan setelah ikan mengalami pembiusan pada berbagai fase imotil (fase pingsan ringan, pingsan berat dan roboh). Pemingsanan ikan dilakukan dengan metode pembiusan menggunakan suhu rendah secara langsung, yaitu dilakukan dengan memasukkan ikan dalam media air yang suhunya diatur pada suhu pembiusan ikan nila (fase pingsan ringan, pingsan berat dan roboh). Fase pingsan merupakan fase yang dianjurkan untuk pengangkutan ikan, karena pada fase ini aktivitas ikan relatif akan berhenti (Mc Farland 1959, diacu dalam Achmadi 2005).
Ikan yang telah dibius dikemas di dalam kotak styrofoam. Pada bagian bawah kotak styrofoam diletakkan bongkahan-bongkahan es kecil yang dibungkus plastik seberat ± 0,5 kg kemudian dilapisi dengan kertas koran. Hal ini bertujuan untuk mempertahankan suhu kemasan sama seperti suhu pembiusan ikan nila.
Media pengisi kemasan yang sudah didinginkan sesuai dengan suhu pembiusan diletakkan di atas kertas koran. Ikan yang telah pingsan dibungkus dengan kertas koran untuk menghindari menempelnya serbuk gergaji dan
mempermudah proses pembugaran, kemudian dilapisi kembali dengan serbuk gergaji dan kemasan ditutup dengan penutup kemasan lalu direkatkan.