PENGGUNAAN MOLASE,
FISHMEAL
, DAN
SOYMEAL
SEBAGAI MEDIA PRODUKSI
Pseudomonas stutzeri
ASLT2
UNTUK PROBIOTIK DI TAMBAK UDANG
IMA RACHMAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IMA RACHMAWATI. Penggunaan Molase, Fishmeal, dan Soymeal sebagai Media Produksi
Pseudomonas stutzeri ASLT2 untuk Probiotik di Tambak Udang. Dibimbing oleh IMAN
RUSMANA dan ANJA MERYANDINI.
Salah satu faktor yang dapat mempengaruhi penurunan produksi udang adalah rendahnya mutu kualitas air sebagai akibat kandungan amonia, nitrat, nitrit dan bahan organik yang tinggi. Salah satu cara untuk menanggulangi masalah tersebut adalah dengan meningkatkan ketahanan udang melalui penggunaan probiotik. Bakteri probiotik yang digunakan dalam penelitian ini adalah Pseudomonas stutzeri ASLT2 yang diisolasi dari tambak udang. Media produksi yang digunakan sebagai sumber karbon adalah molase sedangkan sebagai sumber nitrogennya digunakan fishmeal atau soymeal.
Hasil pengamatan menunjukkan bahwa P. stutzeri ASLT2 dapat tumbuh lebih baik pada media kombinasi molase 0.625% dengan fishmeal perbandingan 1:1 daripada media kombinasi molase 0.625% dengan soymeal. Hal ini disebabkan oleh kandungan nutrisi pada fishmeal lebih lengkap daripada soymeal. Kombinasi media yang terbaik ini kemudian diujikan pada skala intermediat (10 l). Pseudomonas stutzeri ASLT2 tidak dapat mereduksi nitrat pada media dengan penambahan nitrat, nitrit, dan amonium tetapi memperlihatkan adanya aktivitas reduksi nitrit dan oksidasi amonium.
ABSTRACT
IMA RACHMAWATI. Use of Molases, Fishmeal, and Soymeal as Production Medium of
Pseudomonas stutzeri ASLT2 for Probiotic in Shrimp Ponds. Supervised by IMAN RUSMANA and ANJA MERYANDINI.
One factor that influences shrimp production is water quality. Decreasing of water quality can be caused by high content of ammonia, nitrate, nitrite, and organic substances. One alternative way to solve this problem is to maintain water quality using probiotic. Probiotic bacterium used in this study is Pseudomonas stutzeri ASLT2 isolated from shrimp ponds. Molase was used as a carbon source whereas fishmeal and soymeal were used as nitrogen sources in production media.
PENGGUNAAN MOLASE,
FISHMEAL
, DAN
SOYMEAL
SEBAGAI MEDIA PRODUKSI
Pseudomonas stutzeri
ASLT2
UNTUK PROBIOTIK DI TAMBAK UDANG
IMA RACHMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Penggunaan
Molase
,
Fishmeal
, dan
Soymeal
sebagai
Media Produksi
Pseudomonas stutzeri
ASLT2 untuk Probiotik di Tambak Udang
Nama
: Ima Rachmawati
NIM
: G34103016
Menyetujui
Pembimbing I Pembimbing II
Dr. Ir. Iman Rusmana, M.Si
Dr. Anja Meryandini, MS
NIP 131956713 NIP 131663016
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 131578806
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 30 Januari 1985. Penulis merupakan anak pertama dari pasangan Bapak Okay Iskandar dan Ibu Wiwin Winangsih.
Pada tahun 2003 penulis lulus dari SMU Negeri 1 Sumedang dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar tahun akademik 2005/2006 dan 2006/2007, asisten praktikum mata kuliah Mikrobiologi Dasar tahun akademik 2006/2007. Penulis juga pernah aktif di BIOWORLD periode 2004/2005.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang berjudul Penggunaan Molase, Fishmeal, dan Soymeal sebagai Media Produksi Pseudomonas stutzeri ASLT2 untuk Probiotik di Tambak Udang ini dilaksanakan sejak bulan Februari 2007 hingga Juli 2007 di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB).
Penulis mengucapkan terima kasih kepada Dr. Ir. Iman Rusmana, M.Si dan Dr. Anja Meryandini, MS selaku pembimbing yang telah membantu dalam penelitian dan penyusunan karya ilmiah serta Dr. Ir. Juliarni, MAgr. yang telah memberikan saran dan petunjuknya. Selain itu, penulis mengucapkan terima kasih kepada seluruh staf Departemen Biologi khususnya staf Laboratorium Mikrobiologi atas bantuannya. Ucapan terima kasih penulis ucapkan pula kepada Indra Budiman, Yulia Andriani, dan Hasep Sodikin atas bantuannya, teman seasrama (Imas Masitoh dan Ima Nurhikmawati), teman-teman Biologi 40 atas kebersamaannya dan teman-teman seperjuangan di Laboratorium Mikrobiologi atas pengertian dan semangatnya. Terima kasih tertinggi penulis persembahkan untuk Mama dan seluruh keluarga atas dukungan, do’a, dan kasih sayangnya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2007
DAFTAR ISI
Halaman
DAFTAR GAMBAR . ... . vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN . ... 1
BAHAN DAN METODE
Bahan ... 1
Metode ... 1
HASIL DAN PEMBAHASAN
HASIL
Peremajaan Isolat ... 3
Pertumbuhan pada Media Produksi ... 3
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit ... 3
Perbanyakan sel
P. stutzeri
ASLT2 pada Skala Laboratorium ... 4
Produksi Massal
P. stutzeri
ASLT2 pada Galon modifikasi dengan
Volume Kerja 10 l ... 4
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit pada Galon
Modifikasi dengan Volume Kerja 10 l ... 4
PEMBAHASAN ... 5
SIMPULAN ... 7
DAFTAR PUSTAKA ... 8
DAFTAR GAMBAR
Halaman
1 Galon modifikasi ... 3
2 Pertumbuhan
P. stutzeri
ASLT2 pada media kombinasi molase 0.625%
dengan
fishmea
l ... 3
3 Pertumbuhan
P. stutzeri
ASLT2 pada media kombinasi molase 0.625%
dengan
soymeal
... 3
4 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrat ... 4
5 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrit ... 4
6 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan amonium ... 4
7 Konsentrasi nitrat, nitrit, dan amonium pada kontrol ... 4
8 Pertumbuhan
P. stutzeri
ASLT2 pada skala laboratorium ... 4
9
Pertumbuhan
P. stutzeri
ASLT2 pada galon modifikasi dengan volume kerja
10 l ... 5
DAFTAR LAMPIRAN
Halaman
1 Komposisi kimia molase ...11
PENDAHULUAN
Latar Belakang
Udang merupakan komoditas ekspor perikanan utama yang berpotensi tinggi. Udang dapat dimanfaatkan sebagai bahan makanan yang memiliki nilai gizi tinggi. Permintaan dan kebutuhan udang semakin meningkat dari tahun ke tahun. Dalam rangka memenuhi permintaan dan kebutuhan tersebut, maka diperlukan peningkatan produksi udang.
Dalam produksi udang, terdapat salah satu faktor yang dapat mempengaruhi penurunan produksi yaitu rendahnya mutu kualitas air sebagai akibat kandungan amonia, nitrat, nitrit, dan bahan organik yang tinggi, baik yang berasal dari sisa pakan maupun kotoran udang (Widiyanto 2006). Salah satu cara untuk menanggulangi masalah tersebut adalah dengan memperbaiki kualitas air dan meningkatkan ketahanan udang melalui penggunaan probiotik.
Probiotik merupakan segala bentuk sel mikrob hidup yang memiliki pengaruh menguntungkan bagi kesehatan dan kehidupan inang (Salminen et al. 1999). Salah satu bakteri probiotik potensial untuk diaplikasikan dalam budidaya perairan adalah genus Pseudomonas. Pseudomonas stutzeri ASLT2 merupakan bakteri probiotik yang digunakan dengan sasaran utama untuk memperbaiki kualitas lingkungan perairan.
Isolat P. stutzeri ASLT2 merupakan hasil penelitian sebelumnya yang diisolasi pada medium nitrifikasi dan telah diuji kemampuan nitrifikasinya, yaitu memiliki kemampuan oksidasi amonium yang paling tinggi dibandingkan isolat-isolat bakteri nitrifikasi yang telah berhasil diisolasi. Isolat ini diisolasi dari lingkungan perairan tambak udang di Kendari (Widiyanto 2006). Selain itu, isolat ini memiliki kemampuan mereduksi nitrat menjadi nitrit dan diduga dapat menghasilkan gas N2 baik pada
kondisi aerob maupun anaerob dengan sumber karbon (C) asetat, glukosa, dan gliserol sedangkan dengan suksinat sebagai sumber C pada kondisi aerob tidak menghasilkan senyawa nitrit (Novita 2006).
Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Untuk menekan biaya produksi tersebut, maka perlu dicari media produksi yang murah. Media produksi yang umum digunakan sebagai sumber karbon adalah molase
sedangkan sebagai sumber nitrogennya dapat digunakan fishmeal atau soymeal. Molase merupakan hasil samping dari proses pembuatan gula tebu yang masih mengandung kadar gula sekitar 48-58% (Novita 2001). Fishmeal adalah bahan makanan dengan sumber protein tinggi sekitar 66-67%. Selain itu, fishmeal juga mengandung 9-12% lemak dan 10-25% mineral. Soymeal adalah bahan makanan yang terdapat dalam pakan unggas dengan kandungan lisin dan triptofan yang tinggi tetapi kandungan metionin dan sistein yang rendah (Miles & Jacob 2003). Oleh karena itu, perlu dicari komposisi media yang baik bagi pertumbuhan P. stutzeri ASLT2 dengan aktivitas oksidasi amonium dan reduksi nitrat dan nitrit yang tinggi.
Tujuan
Penelitian ini bertujuan mendapatkan komposisi media produksi yang baik bagi pertumbuhan P. stutzeri ASLT2 yang memiliki aktivitas oksidasi amonium dan reduksi nitrat dan nitrit yang tinggi.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah isolat P.
stutzeri ASLT2 koleksi Laboratorium
Mikrobiologi, Departemen Biologi FMIPA IPB.
Metode
Penyiapan media. Media yang digunakan adalah media yang berisi molase 0.625% yang dikombinasikan dengan ekstrak fishmeal atau soymeal dengan perbandingan (w/v) 1:1, 2:1, 3:1, dan 4:1. Uji aktivitas oksidasi amonium dan reduksi nitrat dan nitrit menggunakan media cair denitrifikasi steril tanpa nitrat dan amonium dengan komposisi (g/l) sebagai berikut 10 g Na-asetat, 0.2 g KH2PO4, 0.9 g K2HPO4, 0.1
g CaCl2.2H2O, 0.5 g MgSO4.7H2O, dan 0.2 g
EDTA (Rodina 1972) dengan salinitas 2%.
Peremajaan Isolat. Peremajaan isolat dilakukan dengan menumbuhkan isolat bakteri P. stutzeri ASLT2 pada media agar-agar Sea Water Complete (SWC) 50% dengan metode gores kuadran dan diinkubasi pada suhu ruang (28-31 °C) selama dua hari.
Pertumbuhan P. stutzeri ASLT2.
PENGGUNAAN MOLASE,
FISHMEAL
, DAN
SOYMEAL
SEBAGAI MEDIA PRODUKSI
Pseudomonas stutzeri
ASLT2
UNTUK PROBIOTIK DI TAMBAK UDANG
IMA RACHMAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IMA RACHMAWATI. Penggunaan Molase, Fishmeal, dan Soymeal sebagai Media Produksi
Pseudomonas stutzeri ASLT2 untuk Probiotik di Tambak Udang. Dibimbing oleh IMAN
RUSMANA dan ANJA MERYANDINI.
Salah satu faktor yang dapat mempengaruhi penurunan produksi udang adalah rendahnya mutu kualitas air sebagai akibat kandungan amonia, nitrat, nitrit dan bahan organik yang tinggi. Salah satu cara untuk menanggulangi masalah tersebut adalah dengan meningkatkan ketahanan udang melalui penggunaan probiotik. Bakteri probiotik yang digunakan dalam penelitian ini adalah Pseudomonas stutzeri ASLT2 yang diisolasi dari tambak udang. Media produksi yang digunakan sebagai sumber karbon adalah molase sedangkan sebagai sumber nitrogennya digunakan fishmeal atau soymeal.
Hasil pengamatan menunjukkan bahwa P. stutzeri ASLT2 dapat tumbuh lebih baik pada media kombinasi molase 0.625% dengan fishmeal perbandingan 1:1 daripada media kombinasi molase 0.625% dengan soymeal. Hal ini disebabkan oleh kandungan nutrisi pada fishmeal lebih lengkap daripada soymeal. Kombinasi media yang terbaik ini kemudian diujikan pada skala intermediat (10 l). Pseudomonas stutzeri ASLT2 tidak dapat mereduksi nitrat pada media dengan penambahan nitrat, nitrit, dan amonium tetapi memperlihatkan adanya aktivitas reduksi nitrit dan oksidasi amonium.
ABSTRACT
IMA RACHMAWATI. Use of Molases, Fishmeal, and Soymeal as Production Medium of
Pseudomonas stutzeri ASLT2 for Probiotic in Shrimp Ponds. Supervised by IMAN RUSMANA and ANJA MERYANDINI.
One factor that influences shrimp production is water quality. Decreasing of water quality can be caused by high content of ammonia, nitrate, nitrite, and organic substances. One alternative way to solve this problem is to maintain water quality using probiotic. Probiotic bacterium used in this study is Pseudomonas stutzeri ASLT2 isolated from shrimp ponds. Molase was used as a carbon source whereas fishmeal and soymeal were used as nitrogen sources in production media.
PENGGUNAAN MOLASE,
FISHMEAL
, DAN
SOYMEAL
SEBAGAI MEDIA PRODUKSI
Pseudomonas stutzeri
ASLT2
UNTUK PROBIOTIK DI TAMBAK UDANG
IMA RACHMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Penggunaan
Molase
,
Fishmeal
, dan
Soymeal
sebagai
Media Produksi
Pseudomonas stutzeri
ASLT2 untuk Probiotik di Tambak Udang
Nama
: Ima Rachmawati
NIM
: G34103016
Menyetujui
Pembimbing I Pembimbing II
Dr. Ir. Iman Rusmana, M.Si
Dr. Anja Meryandini, MS
NIP 131956713 NIP 131663016
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 131578806
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 30 Januari 1985. Penulis merupakan anak pertama dari pasangan Bapak Okay Iskandar dan Ibu Wiwin Winangsih.
Pada tahun 2003 penulis lulus dari SMU Negeri 1 Sumedang dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar tahun akademik 2005/2006 dan 2006/2007, asisten praktikum mata kuliah Mikrobiologi Dasar tahun akademik 2006/2007. Penulis juga pernah aktif di BIOWORLD periode 2004/2005.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang berjudul Penggunaan Molase, Fishmeal, dan Soymeal sebagai Media Produksi Pseudomonas stutzeri ASLT2 untuk Probiotik di Tambak Udang ini dilaksanakan sejak bulan Februari 2007 hingga Juli 2007 di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB).
Penulis mengucapkan terima kasih kepada Dr. Ir. Iman Rusmana, M.Si dan Dr. Anja Meryandini, MS selaku pembimbing yang telah membantu dalam penelitian dan penyusunan karya ilmiah serta Dr. Ir. Juliarni, MAgr. yang telah memberikan saran dan petunjuknya. Selain itu, penulis mengucapkan terima kasih kepada seluruh staf Departemen Biologi khususnya staf Laboratorium Mikrobiologi atas bantuannya. Ucapan terima kasih penulis ucapkan pula kepada Indra Budiman, Yulia Andriani, dan Hasep Sodikin atas bantuannya, teman seasrama (Imas Masitoh dan Ima Nurhikmawati), teman-teman Biologi 40 atas kebersamaannya dan teman-teman seperjuangan di Laboratorium Mikrobiologi atas pengertian dan semangatnya. Terima kasih tertinggi penulis persembahkan untuk Mama dan seluruh keluarga atas dukungan, do’a, dan kasih sayangnya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2007
DAFTAR ISI
Halaman
DAFTAR GAMBAR . ... . vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN . ... 1
BAHAN DAN METODE
Bahan ... 1
Metode ... 1
HASIL DAN PEMBAHASAN
HASIL
Peremajaan Isolat ... 3
Pertumbuhan pada Media Produksi ... 3
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit ... 3
Perbanyakan sel
P. stutzeri
ASLT2 pada Skala Laboratorium ... 4
Produksi Massal
P. stutzeri
ASLT2 pada Galon modifikasi dengan
Volume Kerja 10 l ... 4
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit pada Galon
Modifikasi dengan Volume Kerja 10 l ... 4
PEMBAHASAN ... 5
SIMPULAN ... 7
DAFTAR PUSTAKA ... 8
DAFTAR GAMBAR
Halaman
1 Galon modifikasi ... 3
2 Pertumbuhan
P. stutzeri
ASLT2 pada media kombinasi molase 0.625%
dengan
fishmea
l ... 3
3 Pertumbuhan
P. stutzeri
ASLT2 pada media kombinasi molase 0.625%
dengan
soymeal
... 3
4 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrat ... 4
5 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrit ... 4
6 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan amonium ... 4
7 Konsentrasi nitrat, nitrit, dan amonium pada kontrol ... 4
8 Pertumbuhan
P. stutzeri
ASLT2 pada skala laboratorium ... 4
9
Pertumbuhan
P. stutzeri
ASLT2 pada galon modifikasi dengan volume kerja
10 l ... 5
DAFTAR LAMPIRAN
Halaman
1 Komposisi kimia molase ...11
PENDAHULUAN
Latar Belakang
Udang merupakan komoditas ekspor perikanan utama yang berpotensi tinggi. Udang dapat dimanfaatkan sebagai bahan makanan yang memiliki nilai gizi tinggi. Permintaan dan kebutuhan udang semakin meningkat dari tahun ke tahun. Dalam rangka memenuhi permintaan dan kebutuhan tersebut, maka diperlukan peningkatan produksi udang.
Dalam produksi udang, terdapat salah satu faktor yang dapat mempengaruhi penurunan produksi yaitu rendahnya mutu kualitas air sebagai akibat kandungan amonia, nitrat, nitrit, dan bahan organik yang tinggi, baik yang berasal dari sisa pakan maupun kotoran udang (Widiyanto 2006). Salah satu cara untuk menanggulangi masalah tersebut adalah dengan memperbaiki kualitas air dan meningkatkan ketahanan udang melalui penggunaan probiotik.
Probiotik merupakan segala bentuk sel mikrob hidup yang memiliki pengaruh menguntungkan bagi kesehatan dan kehidupan inang (Salminen et al. 1999). Salah satu bakteri probiotik potensial untuk diaplikasikan dalam budidaya perairan adalah genus Pseudomonas. Pseudomonas stutzeri ASLT2 merupakan bakteri probiotik yang digunakan dengan sasaran utama untuk memperbaiki kualitas lingkungan perairan.
Isolat P. stutzeri ASLT2 merupakan hasil penelitian sebelumnya yang diisolasi pada medium nitrifikasi dan telah diuji kemampuan nitrifikasinya, yaitu memiliki kemampuan oksidasi amonium yang paling tinggi dibandingkan isolat-isolat bakteri nitrifikasi yang telah berhasil diisolasi. Isolat ini diisolasi dari lingkungan perairan tambak udang di Kendari (Widiyanto 2006). Selain itu, isolat ini memiliki kemampuan mereduksi nitrat menjadi nitrit dan diduga dapat menghasilkan gas N2 baik pada
kondisi aerob maupun anaerob dengan sumber karbon (C) asetat, glukosa, dan gliserol sedangkan dengan suksinat sebagai sumber C pada kondisi aerob tidak menghasilkan senyawa nitrit (Novita 2006).
Produksi bakteri probiotik secara massal memerlukan biaya yang cukup besar. Untuk menekan biaya produksi tersebut, maka perlu dicari media produksi yang murah. Media produksi yang umum digunakan sebagai sumber karbon adalah molase
sedangkan sebagai sumber nitrogennya dapat digunakan fishmeal atau soymeal. Molase merupakan hasil samping dari proses pembuatan gula tebu yang masih mengandung kadar gula sekitar 48-58% (Novita 2001). Fishmeal adalah bahan makanan dengan sumber protein tinggi sekitar 66-67%. Selain itu, fishmeal juga mengandung 9-12% lemak dan 10-25% mineral. Soymeal adalah bahan makanan yang terdapat dalam pakan unggas dengan kandungan lisin dan triptofan yang tinggi tetapi kandungan metionin dan sistein yang rendah (Miles & Jacob 2003). Oleh karena itu, perlu dicari komposisi media yang baik bagi pertumbuhan P. stutzeri ASLT2 dengan aktivitas oksidasi amonium dan reduksi nitrat dan nitrit yang tinggi.
Tujuan
Penelitian ini bertujuan mendapatkan komposisi media produksi yang baik bagi pertumbuhan P. stutzeri ASLT2 yang memiliki aktivitas oksidasi amonium dan reduksi nitrat dan nitrit yang tinggi.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah isolat P.
stutzeri ASLT2 koleksi Laboratorium
Mikrobiologi, Departemen Biologi FMIPA IPB.
Metode
Penyiapan media. Media yang digunakan adalah media yang berisi molase 0.625% yang dikombinasikan dengan ekstrak fishmeal atau soymeal dengan perbandingan (w/v) 1:1, 2:1, 3:1, dan 4:1. Uji aktivitas oksidasi amonium dan reduksi nitrat dan nitrit menggunakan media cair denitrifikasi steril tanpa nitrat dan amonium dengan komposisi (g/l) sebagai berikut 10 g Na-asetat, 0.2 g KH2PO4, 0.9 g K2HPO4, 0.1
g CaCl2.2H2O, 0.5 g MgSO4.7H2O, dan 0.2 g
EDTA (Rodina 1972) dengan salinitas 2%.
Peremajaan Isolat. Peremajaan isolat dilakukan dengan menumbuhkan isolat bakteri P. stutzeri ASLT2 pada media agar-agar Sea Water Complete (SWC) 50% dengan metode gores kuadran dan diinkubasi pada suhu ruang (28-31 °C) selama dua hari.
Pertumbuhan P. stutzeri ASLT2.
2
berpenggoyang pada suhu ruang (28-31 ºC) selama 2 hari. Sebanyak 1 ml kultur isolat ditumbuhkan pada media dengan kombinasi molase dan fishmeal atau molase dan
soymeal dengan masing-masing
perbandingan (w/v) 1:1, 2:1, 3:1, dan 4:1 kemudian diinkubasi selama 2 hari di atas inkubator berpenggoyang pada suhu ruang dan dilakukan pengukuran pertumbuhan selnya setiap 6 jam sekali selama 48 jam. Masing-masing perlakuan kombinasi media diulang sebanyak 2 kali.
Uji Aktivitas Oksidasi Amonium dan Reduksi Nitrat dan Nitrit. Uji aktivitas oksidasi amonium dan reduksi nitrat dan nitrit dilakukan pada media produksi optimum terpilih bagi pertumbuhan
P. stutzeri ASLT2, yaitu media kombinasi molase 0.625% dengan fishmeal pada perbandingan 1:1. Kultur bakteri dibuat pelet dengan cara sentrifugasi pada kecepatan 4500 x g selama 15 menit. Pelet yang terbentuk dicuci dan diresuspensi dengan media denitrifikasi steril tanpa amonium dan nitrat dan divorteks. Setelah itu, kultur bakteri disentrifugasi kembali sehingga terbentuk pelet dan dicuci serta diresuspensi dengan media denitrifikasi steril tanpa amonium dan nitrat kemudian divorteks dan dihasilkan suspensi sel. Sebanyak 1 ml dari suspensi sel tersebut dimasukkan masing-masing ke dalam 20 ml media denitrifikasi steril tanpa amonium dan nitrat yang telah mendapat perlakuan. Perlakuan pertama, yaitu kontrol dibuat dengan cara memasukkan 1 ml suspensi sel ke dalam 20 ml media denitrifikasi steril tanpa amonium dan nitrat. Perlakuan kedua dibuat dengan cara memasukkan 1 ml suspensi sel ke dalam 20 ml media denitrifikasi steril yang telah ditambahkan 0.2 ml NaNO3 1000 µM.
Perlakuan ketiga dan keempat dibuat dengan cara yang sama dengan perlakuan kedua, hanya pada perlakuan ketiga dilakukan penambahan 0.2 ml NH4Cl 1000 µM
sedangkan perlakuan keempat dilakukan penambahan 0.2 ml NaNO2 1000 µM ke
dalam masing-masing media denitrifikasi steril. Keempat perlakuan tersebut divorteks kemudian diinkubasi selama 3 jam. Pada akhir inkubasi, ditambahkan 2 tetes HgCl2
0.1% kemudian dilakukan analisis kadar amonium, nitrat, dan nitritnya.
Analisis Kadar Amonium. Sebanyak 5 ml sampel ditambah dengan 0.2 ml fenol alkohol 10%, 0.2 ml nitroprusid 0.5% dan 0.5 ml campuran hipoklorit teknis dengan natrium sitrat 20% (1:4). Setiap setelah
penambahan pereaksi dilakukan pengadukan dan didiamkan selama 1 jam. Setelah pemberian pereaksi akan menghasilkan warna biru dan kemudian diukur OD pada panjang gelombang 640 nm (Greenberg et al. 1992).
Analisis Kadar Nitrit. Sebanyak 5 ml sampel ditambah dengan 0.1 ml sulfanilamid 1% dan 0.1 ml Naftalena Etilena Diamina (NED) 0.1%. Setiap penambahan pereaksi dilakukan pengadukan dan didiamkan selama 10 menit. Setelah pemberian pereaksi akan menghasilkan warna merah muda dan diukur OD pada panjang gelombang 540 nm (Greenberg et al. 1992).
Analisis Kadar Nitrat. Sebanyak 5 ml sampel ditambah dengan 0.2 ml Brusin 0.5% dan 4 ml H2SO4 pekat. Setiap
penambahan pereaksi dilakukan pengadukan dan didiamkan selama 0.5 jam. Setelah pemberian pereaksi akan menghasilkan warna kuning dan diukur OD pada panjang gelombang 420 nm (Greenberg et al. 1992).
Biakan Pemula. Biakan pemula untuk perbanyakan P. stutzeri ASLT2 skala laboratorium dan pada galon dengan volume kerja 10 l dibuat dengan cara menginokulasikan 1 lup P. stutzeri ASLT2 ke dalam 100 ml media cair SWC 50% dan menginkubasikannya selama 48 jam pada inkubator berpenggoyang dengan suhu ruang 28-30 ºC.
Perbanyakan Sel P. stutzeri ASLT2 pada Skala Laboratorium. Sebanyak 2-3
lup P. stutzeri dari biakan pemula
diinokulasikan ke dalam 300 ml media kombinasi molase 0.625% dengan fishmeal
perbandingan 1:1 dalam erlenmeyer. Biakan diinkubasi dalam inkubator berpenggoyang pada suhu ruang selama 2 hari dan diukur jumlah selnya serta diuji aktivitasnya.
Produksi Massal P. stutzeri ASLT2 pada Galon dengan Volume Kerja 10 l.
Sebanyak 100 ml P. stutzeri ASLT2 dari biakan pemula diinokulasikan ke dalam 10 l media kombinasi molase 0.625% dengan
HASIL DAN PEMBAHASAN
Hasil
Peremajaan Isolat. Isolat murni ASLT2 diperoleh dengan cara menumbuhkannya pada media agar-agar Sea Water Complete (SWC)50% dengan waktu inkubasi selama 2 hari. Ciri morfologi koloni dari ASLT2 adalah berbentuk bulat, berwarna putih dengan diameter koloni ± 1 mm.
Pertumbuhan pada Media Produksi.
Pola pertumbuhan P. stutzeri ASLT2 pada media kombinasi molase 0.625% dengan
fishmeal pada perbandingan yang berbeda dapat dilihat pada gambar 2. Pertumbuhan P. stutzeri ASLT2 terbaik terdapat pada media kombinasi molase 0.625% dengan fishmeal
pada perbandingan 1:1 sedangkan pertumbuhan terendah terdapat pada media kombinasi molase 0.625% dengan fishmeal
pada perbandingan 4:1. Rasio C:N yang ada pada media kombinasi molase 0.625% dengan fishmeal pada perbandingan 1:1, 2:1, 3:1, dan 4:1 secara berurutan adalah berkisar 4-5, 2-2.5, 1.33-1.67, dan 1-1.25. Begitu pula pada media kombinasi molase 0.625% dengan soymeal, pertumbuhan P. stutzeri
ASLT2 terbaik terdapat pada media kombinasi molase 0.625% dengan soymeal
perbandingan 1:1 sedangkan pertumbuhan terendah terdapat pada perbandingan 4:1 (Gambar 3). Rasio C:N yang ada pada media
kombinasi molase 0.625% dengan soymeal
pada perbandingan 1:1, 2:1, 3:1, dan 4:1 secara berurutan adalah berkisar 6-8, 3-4, 2-2.67, dan 1.5-2. Berdasarkan hasil pengamatan, dapat dilihat bahwa P. stutzeri
ASLT2 dapat tumbuh lebih baik pada media kombinasi molase 0.625% dengan fishmeal
terutama pada perbandingan 1:1 jika dibandingkan dengan media kombinasi molase 0.625% dengan soymeal sebagai sumber nitrogennya.
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit. Pada perlakuan dengan penambahan nitrat, nitrit, dan amonium menunjukkan adanya penurunan amonium dan nitrit. Pada perlakuan penambahan nitrat, konsentrasi amonium relatif mengalami penurunan pada jam ke-24 dan jam ke-48, sedangkan konsentrasi nitrat meningkat, dan konsentrasi nitrit relatif sama (Gambar 4). Pada perlakuan penambahan nitrit, konsentrasi amonium dan nitrit mengalami penurunan tetapi konsentrasi nitrat meningkat (Gambar 5). Berbeda halnya pada perlakuan dengan penambahan amonium, konsentrasi
Gambar 3 Pertumbuhan P. stutzeri ASLT2 pada media
kombinasi molase 0.625% dengan soymeal
(MS = molase dan soymeal).
Gambar 2 Pertumbuhan P. stutzeri ASLT2 pada
media kombinasi molase 0.625% dengan fishmeal (MF = molase dan fishmeal). Gambar 1 Galon modifikasi.
0 0.2 0.4 0.6 0.8 1 1.2
0 6 12 18 24 30 36 42 48
Lamanya Inkubasi (Jam)
A b so rbansi 550 n m MS 1:1 MS 2:1 MS 3:1 MS 4:1 0 0.2 0.4 0.6 0.8 1 1.2
0 6 12 18 24 30 36 42 48
Lamanya Inkubasi (Jam)
4
amonium, nitrat, dan nitrit mengalami penurunan (Gambar 6). Adanya penurunan konsentrasi amonium menandakan bahwa P.
stutzeri mampu mengoksidasi amonium
pada substrat yang berbeda.
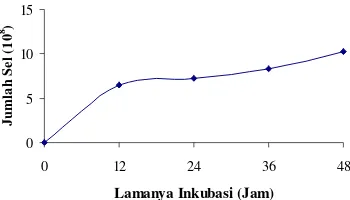
Perbanyakan sel P. stutzeri ASLT2 pada Skala Laboratorium. Perbanyakan sel P. stutzeri ASLT2 pada erlenmeyer goyang dalam media kombinasi molase 0.625% dengan fishmeal perbandingan 1:1 menunjukkan adanya peningkatan. Jumlah sel P. stutzeri mengalami peningkatan mulai dari jam ke-0 hingga jam ke-48 dengan jumlah sel sebesar 10.2 x 108 sel/ml. Hal ini menandakan bahwa bakteri ini telah memasuki fase eksponensial (Gambar 8).
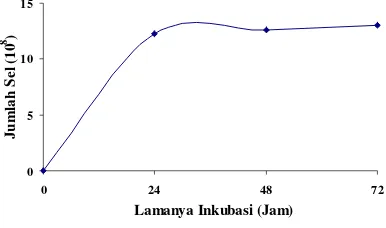
Produksi Massal P. Stutzeri ASLT2 pada Galon Modifikasi dengan Volume Kerja 10 l. Pertumbuhan P. stutzeri ASLT2 pada galon modifikasi dengan volume kerja 10 l menunjukkan peningkatan dari jam ke-0 hingga jam ke-24. Hal ini dapat ditunjukkan dari jumlah selnya yang semakin bertambah pada jam tersebut sebesar 12.3 x 108 sel/ml (Gambar 9). Pada akhir jam ke-24 hingga jam ke-72, pertumbuhan bakteri memasuki tahap stasioner.
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit pada Galon Modifikasi dengan Volume Kerja 10 l.
Pseudomonas stutzeri ASLT2 mampu
mengoksidasi amonium pada jam ke-24 hingga jam ke-72. Hal ini ditunjukkan dengan adanya penurunan konsentrasi
Gambar 4 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrat (bar menun- jukkan standar error dengan n = 2).
Gambar 8 Pertumbuhan P. stutzeri ASLT2 pada skala
laboratorium.
Gambar 6 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan amonium (bar menunjukkan standar error dengan n = 2).
Gambar 7 Konsentrasi nitrat, nitrit, dan amonium pada kontrol (bar menunjukkan standar error dengan n = 2).
Gambar 5 Konsentrasi nitrat, nitrit, dan amonium dengan penambahan nitrit (bar menun- jukkan standar error dengan n = 2).
0 5 10 15
0 12 24 36 48
Lamanya Inkubasi (Jam)
Ju ml a h S e l ( 1 0 8 ) 0 1000 2000 3000 4000 5000
0 12 24 36 48
Lamanya Inkubasi (Jam)
Ko n se n tr a si n itr a t (µ M ) 0 5 10 15 20 25 K o ns en tr as i am oni u m d a n ni tr it ( µ M )
nitrat nitrit amonium
0 1000 2000 3000 4000 5000
0 12 24 36 48
Lamanya Inkubasi (Jam)
K o n se n tra si n itra t (µ M ) 0 50 100 150 200 250 300 350 K o ns en tr as i a m oni u m dan ni tr it (µ M )
nitrat nitrit amonium
0 500 1000 1500 2000 2500 3000 3500 4000 4500 5000
0 12 24 36 48
Lamanya Inkubasi (Jam)
K o ns e n tr as i ni tr a t (µ M ) 0 5 10 15 20 25 K o ns ent ras i am o n iu m dan ni tr it ( µ M )
nitrat nitrit amonium
0 1000 2000 3000 4000 5000
0 12 24 36 48
Lamanya Inkubasi (Jam)
K o n se n tr a si ni tr a t da n am o n iu m (µ M ) 0 5 10 15 20 25 K o n se n tr a si n it r it ( µ M )
5
amonium pada selang waktu tersebut. Selain itu, konsentrasi nitrit juga mengalami penurunan dan konsentrasi nitrat relatif tetap pada selang waktu yang sama (Gambar 10).
Pembahasan
Peremajaan Isolat. Pseudomonas stutzeri ASLT2 merupakan bakteri yang diisolasi dari tambak udang di Kendari. Oleh karena itu, isolat murni P. stutzeri ASLT2 ini ditumbuhkan pada media Sea Water
Complete (SWC) 50% untuk
mengkondisikan seperti keadaan alamiahnya di tambak. Karakteristik dari P. stutzeri
secara umum ialah berbentuk batang, aerobik, gram negatif, mempunyai flagel polar tunggal, memiliki oksidase dan bersifat katalase positif (Lalucat et al. 2006).
Pertumbuhan pada Media Produksi.
Pola pertumbuhan P. stutzeri ASLT2 yang terbaik terdapat pada media kombinasi molase 0.625% dengan fishmeal pada perbandingan 1:1 sedangkan pada perbandingan 2:1, 3:1, dan 4:1 menunjukkan pertumbuhan yang lebih rendah (Gambar 2). Begitu pula pada media kombinasi molase 0.625% dengan soymeal, pertumbuhan P.
stutzeri ASLT2 terbaik terdapat pada
perbandingan 1:1 sedangkan yang terendah
terdapat pada perbandingan 4:1 (Gambar 3). Hal ini disebabkan oleh adanya perbedaan rasio C:N yang terdapat pada masing-masing kombinasi media. Pada media kombinasi molase 0.625% dengan fishmeal
perbandingan 1:1, rasio C:N yang ada lebih tinggi daripada perbandingan lainnya. Begitu pula pada media kombinasi molase 0.625% dengan soymeal, rasio C:N tertinggi terdapat pada perbandingan 1:1. Menurut Goldman dan Dennett (2000), rasio C:N yang ideal bagi pertumbuhan bakteri marine
bervariasi bergantung pada keterbatasan nutrisi (karbon dan nitrogen yang terbatas), tetapi pada semua kasus rasio C:N bakteri ini berkisar 4.5-7 dalam populasi alaminya. Oleh karena itu, baik pada media kombinasi molase 0.625% dengan fishmeal maupun media kombinasi molase 0.625% dengan
soymeal, rasio C:N pada perbandingan 1:1 merupakan rasio yang terbaik bagi pertumbuhan bakteri. Pada perbandingan 2:1, 3:1, dan 4:1, rasio C:N yang ada lebih rendah terutama pada kandungan nitrogennya yang semakin kecil. Nitrogen memainkan peranan penting dalam metabolisme seluler khususnya dalam pembelahan sel, sehingga apabila kandungan nitrogennya semakin sedikit, maka kemampuan bakteri untuk membelah menjadi semakin lambat. Akibatnya, pertumbuhannya pun menjadi rendah.
Bakteri dapat mengasimilasi senyawa nitrogen organik maupun anorganik untuk pertumbuhannya. Senyawa nitrogen dalam bentuk tersebut akan direduksi atau dikatabolisasi oleh bakteri menjadi amonia (White 1995). Bakteri akan mengasimilasi amonia tersebut melalui jalur glutamin sintetase dan glutamat sintase yang dikenal dengan jalur GS-GOGAT (Reitzer 2003). Jalur ini merupakan jalur yang efisien tetapi memerlukan pengeluaran energi berupa 1 molekul ATP untuk menghasilkan tiap molekul glutamin (Lim 1998).
Setiap bakteri memerlukan sumber karbon bagi pertumbuhannya dengan cara mengubah karbon tersebut menjadi material sel melalui proses asimilasi. Bakteri heterotrof menggunakan senyawa organik sebagai sumber karbonnya (Lim 1998). Sumber karbon yang dapat digunakan oleh bakteri ini diantaranya terdapat pada molase. Molase masih mengandung kadar gula sekitar 45-58% yang tersusun dari sukrosa, glukosa, fruktosa dan komponen lainnya (Lampiran 1) sehingga masih dapat digunakan sebagai sumber karbon yang baik
Gambar 9 Pertumbuhan P. stutzeri ASLT2 pada galon
modifikasi bervolume kerja 10 l.
Gambar 10 Konsentrasi nitrat, nitrit, dan amonium pada galon modifikasi bervolume kerja 10 l (bar menunjukkan standar error dengan n = 2).
Lamanya Inkubasi (Jam) 0
5 10 15
0 24 48 72
Lamanya Inkubasi (Jam)
Jum lah S el ( 1 0 8 ) 0 2000 4000 6000 8000 10000 12000
0 24 48 72
Lamanya Inkubasi (Jam)
K on se n tr a si am on iu m d a n n itr a t (µ M ) 0 5 10 15 20 25 K o n se n tr a si n itr it (µ M )
6
bagi pertumbuhan bakteri (Novita 2001; Paturau 1982).
Kemampuan mikroorganisme untuk memperoleh energi pada kondisi heterotrof bergantung pada kemampuan metabolismenya untuk mengoksidasi senyawa karbon (bahan organik) sebagai sumber energi utama. Senyawa karbon dalam metabolisme berperan penting untuk menghasilkan energi melalui oksidasi senyawa tersebut dan menyediakan unsur C untuk pembentukan material sel (Prescott et al. 2000).
Fishmeal dan soymeal dapat digunakan sebagai sumber nitrogen bagi pertumbuhan bakteri. Menurut Sukmadi (1996) diacu dalam Suryanti (1998), soymeal
mengandung 42% protein dan 19-20% lemak (Lampiran 2).
Fishmeal mengandung kadar protein tinggi, yaitu sekitar 66-67% (Lampiran 3). Selain itu, fishmeal juga mengandung 9-12% lemak dan 10-25% mineral terutama terdiri atas kalsium dan fosfor (Miles & Jacob 2003). Bakteri memerlukan kalsium terutama dalam bentuk ion Ca2+ sebagai kofaktor enzim tertentu dan fosfor terutama dalam bentuk fosfat yang diperlukan oleh bakteri sebagai komponen struktur sel dan sebagai simpanan energi (Volk & Wheeler 1984).
Fishmeal kaya akan asam amino
essensial terutama lisin dan asam amino yang mengandung sulfur, yaitu sistein dan metionin (Husein & Jordan 1991) sedangkan pada soymeal, kandungan asam amino berupa sistein dan metioninnya rendah. Hal inilah yang menyebabkan P. stutzeri ASLT2 dapat tumbuh lebih baik pada media kombinasi molase 0.625% dengan fishmeal
dibandingkan dengan media kombinasi molase 0.625% dengan soymeal. Asam amino merupakan faktor pertumbuhan bagi bakteri dan dapat dijadikan sebagai prekursor intermediat jalur metabolik. Asam amino ini disintesis oleh bakteri atau disediakan sebagai nutrisi eksogenous. Kebutuhan asam amino dapat disediakan sebagai asam amino bebas atau peptida kecil yang dapat didegradasi oleh bakteri protease sebelum atau setelah masuk ke dalam sel. Di dalam sel, asam amino pertama kali dideaminasi untuk menghasilkan asam organik yang akan masuk ke dalam siklus
Tricarboxylic Acid (TCA). Amonia yang dihasilkan dari deaminasi akan bertindak sebagai sumber nitrogen untuk biosintesis (Lim 1998).
Aktivitas Oksidasi Amonium, Reduksi Nitrat dan Nitrit pada Skala Laboratorium. Pseudomonas stutzeri
merupakan bakteri heterotrofik dan biasa dijadikan sebagai model dalam proses denitrifikasi (Lalucat et al. 2006). Denitrifikasi adalah proses dimana nitrat direduksi melalui nitrit menjadi nitrous oksida dan akhirnya menjadi gas nitrogen yang tidak berbahaya (Texeira & Oliveira 2002). Menurut Gregory et al. (2003), proses denitrifikasi lengkap membutuhkan 4 enzim, yaitu nitrat reduktase (Nar dan Nap), nitrit reduktase (Nir), nitrik oksida reduktase (Nor), dan nitrous oksida reduktase (Nos). Tiap enzim ini memiliki sensitivitas yang berbeda terhadap O2 dan ketersediannya pun
berbeda di antara spesies bakteri denitrifikasi yang lain (Rusmana 2003).
Pseudomonas stutzeri termasuk bakteri yang memiliki kelengkapan enzim denitrifikasi sehingga menghasilkan gas nitrogen sebagai produk akhirnya.
Setiap tahapan reaksi denitrifikasi dikatalisis oleh enzim yang berbeda. Reduksi nitrat menjadi nitrit dikatalisis oleh enzim nitrat reduktase yang terdiri atas nitrat reduktase periplasmik (Nap) dan nitrat reduktase terikat membran (Nar). Beberapa bakteri mengekspresikan kedua enzim tersebut yang keduanya memiliki peranan fisiologi yang berbeda. Nitrat reduktase terikat membran hanya diekspresikan di bawah kondisi anaerobik sedangkan nitrat reduktase periplasmik disintesis dan aktif dengan adanya oksigen. Peranan fisiologi Nap berhubungan dengan penghilangan kelebihan tenaga pereduksi (Zumft 1997) sedangkan Nar berperan dalam konservasi energi selama transfer elektron dari ubiquinol menjadi nitrat tanpa adanya oksigen sebagai akseptor elektron terminal (Ellington et al. 2002).
oleh enzim Nap (Richardson 2000). Pada kondisi anaerobik, Nar lebih berperan dalam mereduksi nitrat dengan tujuan konservasi energi.
Pseudomonas stutzeri ASLT2 pada
media dengan penambahan nitrat tidak memperlihatkan adanya kemampuan untuk mereduksi nitrat. Hal ini kemungkinan disebabkan oleh ketersediaan oksigen yang cukup sehingga proses denitrifikasi berjalan secara aerobik. Pada kondisi aerobik ini, ketersediaan Nap yang ada kemungkinan sedikit sehingga aktivitas Nap dalam mereduksi nitrat rendah sehingga tidak mampu untuk mereduksi nitrat menjadi nitrit. Begitu pula dengan Nar, enzim ini sangat sensitif terhadap oksigen. Menurut Knowles (1982), oksigen merupakan salah satu faktor yang mengontrol proses denitrifikasi dimana dengan adanya oksigen dapat menekan ekspresi enzim denitrifikasi diantaranya nitrat reduktase terikat membran (Nar). Apabila Nar tidak terekspresi, maka enzim yang berperan dalam pengubahan nitrat menjadi nitrit tidak ada sehingga nitrat tidak akan direduksi menjadi nitrit. Akibatnya, konsentrasi nitrat tetap ataupun bertambah dengan adanya penambahan nitrat. Ketersediaan nitrogen oksida (nitrat, nitrit, nitrous oksida) untuk sel dengan konsentrasi oksigen terbatas (anaerobik) dapat menstimulasi ekspresi enzim denitrifikasi. Konsentrasi Nar, Nir, dan Nos tertinggi terdapat pada nitrat sebagai efektor sedangkan nitrit sebagai substrat dapat menstimulasi ekspresi Nir secara selektif (Korner & Zumft 1989).
Pertumbuhan P. stutzeri ASLT2.
Pertumbuhan P.stutzeri ASLT2 mengalami peningkatan dari jam ke-0 hingga jam ke-48 (Gambar 7). Pada selang waktu tersebut, pertumbuhan sel P. stutzeri berada pada fase eksponensial. Pada fase tersebut ditandai dengan periode pembelahan yang cepat. Pada fase ini, waktu generasi suatu organisme dapat ditentukan. Waktu generasi tiap organisme berbeda-beda bergantung pada jenis organisme, kadar nutrien dalam medium, dan suhu inkubasi. Kondisi lain seperti pH, persediaan oksigen bagi bakteri aerobik mempengaruhi juga waktu generasi organisme (Volk & Wheeler 1984).
Produksi Massal P. stutzeri ASLT2 pada Galon Modifikasi dengan Volume Kerja 10 l. Pseudomonas stutzeri ASLT2 ditumbuhkan pada media kombinasi molase 0.625% dengan fishmeal perbandingan 1:1 yang berada dalam galon yang telah
dimodifikasi. Galon modifikasi tersebut dikondisikan seperti fermentor kecil yang telah diberi aerasi dengan memompakan udara steril dengan laju alir 1-2 l/menit. Aerasi berfungsi sebagai penyuplai oksigen untuk sel P. stutzeri ASLT2. Laju oksigen yang disuplai ke dalam galon modifikasi (fermentor kecil) dijaga stabil. Fluktuasi laju alir oksigen dapat menurunkan daya kerja fermentor karena laju transfer oksigen yang tidak tetap akan mengganggu metabolisme sel P. stutzeri ASLT2 karena oksigen terlarut yang tidak stabil. Selain aerasi, galon modifikasi juga dilengkapi dengan batu aerasi dan filter udara steril. Batu aerasi berfungsi sebagai pemecah gelembung-gelembung udara agar gelembung-gelembung udara yang terbentuk berukuran kecil sehingga laju difusi oksigen ke dalam larutan lebih cepat dan meningkatkan kadar oksigen terlarutnya sedangkan filter udara steril berfungsi sebagai penyaring udara dari luar yang masuk ke dalam galon yang berisi media sehingga terhindar dari kontaminan mikrob yang lain.
Tipe fermentasi yang digunakan dalam penelitian ini adalah sistem batch (sistem tertutup). Pada sistem batch ini, media hanya dimasukkan pada awal proses fermentasi sehingga tidak ada penambahan media baru. Pertumbuhan P. stutzeri ASLT2 mulai mengalami peningkatan dari jam ke-0 hingga jam ke- 24. Pada akhir jam ke-24 hingga jam ke-72, pertumbuhan bakteri telah memasuki fase stasioner. Fase stasioner merupakan fase dimana sel-sel mulai tidak tumbuh lagi. Hal ini disebabkan oleh menyusutnya nutrien dalam media, keterbatasan oksigen dan akumulasi produk metabolisme yang toksik bagi organisme. Akumulasi produk toksik ini seringkali menjadi masalah dalam fermentasi sel karena sebagian besar nutrisi tidak diubah menjadi bahan sel tetapi diekskresikan sebagai produk buangan (White 1995). Laju pertumbuhan bakteri pada fase ini melambat atau terhenti sedangkan jumlah mikrob yang hidup konstan.
SIMPULAN
Pertumbuhan P. stutzeri ASLT2 yang terbaik terdapat pada media kombinasi molase 0.625% dengan fishmeal pada perbandingan 1:1. Kemampuan P. stutzeri
secara berurutan adalah sebesar 100 µM, 2.16 µM, dan 3140 µM.
DAFTAR PUSTAKA
Ellington MJK, Bhakoo KK, Sawers G, Richardson DJ, Ferguson SJ. 2002. Hierarchy of carbon source selection in Paracoccus pantotrophus: strict correlation between reduction state of the carbon substrate and aerobic expression of the nap operon. J Bacteriol 184(17): 4767-4774.
Goldman JC, Dennett MR. 2000. Growth of marine bacteria in batch and continuous culture under carbon and nitrogen limitation. Limnol Oceanogr
45(4): 789-800
Greenberg AE, Clesceri LS, Eaton AD. Editor. 1992. Standard Methods fir Examination of Water and Wastewater. 18th Edition. Publication Office American Public Health Association: Washington DC.
Gregory LG, Bond PL, Richardson DJ, Spiro S. 2003. Characterization of a nitrate-respiring bacterial community using the nitrate reductase gene (narG) as a functional marker.
Microbiology 149: 229-237.
Hussein HS, Jordan RM. 1991. Fishmeal as protein supplement in ruminant diets : a review. J Anim Sci 69: 2147-2156. Korner H, Zumft WG. 1989. Expression of
denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continous culture of Pseudomonas stutzeri. Appl Environ Microbiol 55: 1670-1676. Knowles R. 1982. Denitrification. Microbiol
Rev 46: 43-70.
Lalucat et al. 2006. Biology of
Pseudomonas stutzeri. Microbiol Mol Biol Rev 70(2): 510-547.
Lim D. 1998. Microbiology. Ed ke-2. USA: McGraw-Hill Companies.
Miles RD, Jacob JP. 2003. Review of Fishmeal: Understanding Why This Feed Ingredient is so Valuable in Poultry Diets. Florida: IFAS.
Novita E. 2001. Optimasi proses koagulasi flokulasi pada limbah cair yang mengandung melanoidin. J. Ilmu Dasar 2(1): 61-67.
Novita L. 2006. Aktivitas oksidasi amonium dan reduksi nitrat Pseudomonas stutzeri ASLT2 pada sumber karbon
yang berbeda [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Paturau JM. 1982. By-Products of The Cane Sugar Industry. Amsterdam: Elsevier Scientific Publishing Company. Prescott LM, Harley JP, Klein DA. 2000.
Microbiology. Ed ke-5. USA:
McGraw-Hill Companies.
Reitzer L. 2003. Nitrogen assimilation and global regulation in Escherichia coli.
Annu Rev Microbiol 57: 155-176. Richardson DJ. 2000. Bacterial respiration: a
flexible process for a changing environment. Microbiology 146: 551-571.
Rodina G. A. 1972. Methods in Aquatic Microbiology. Rita RC, Machael S, editor. USA: University Park Press Baltimore.
Rusmana I. 2003. Komunikasi singkat nitrous oxide formation in bacteria. J Mikrobiol Indones 8(2): 63-66. Salminen S, Ouwehand A, Benno Y, Lee
YK. 1999. Probiotics: How should be defined?. Trends in FoodScience and Technology 10: 107-110.
Saraswati R, Syamsu K, Susilowati DN, Laila B, Andhayani RS. 2003. Produksi massal sel Rhizobium
dengan teknologi bioproses. J Mikrobiol Indones 8(2): 47-52. Suryanti H. 1998. Pengaruh tepung jagung
dalam medium molase-tepung kedelai terhadap kinerja Bacillus thuringiensis subsp. Aizawai [skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Texeira P, Oliveira R. 2002. Metabolism of
Alcaligenes denitrificans in biofilms vs planctonic cells. J Appl Microbiol
92: 256-260.
Volk WA, Wheeler MF. 1984. Mikrobiologi
Dasar .Ed ke-5. Markham,
penerjemah; Adisoemarto S, editor. USA: Harper & Row Publisher Inc. Terjemahan dari: Basic Microbiology
. Ed ke-5.
9
White D. 1995. The Phisiology and Biochemistry of Procaryotes. Oxford University Press: USA.
Zumft WG. 1997. Cell biology and molecular basis of denitrification.
10
11
Lampiran 1 Komposisi Kimia Molase (Paturau 1982)
Komponen Kisaran
(%)
Rata-rata
(%)
Air 17-25
20
Sukrosa 30-40
35
Glukosa 4-9
7
Fruktosa 5-12
9
Gula pereduksi
1-5
3
Karbohidrat lain
2-5
4
Abu 7-15
12
Komponen nitrogen
2-6
4.5
Asam bukan nitrogen
2-6
5
Lilin, steroid, dan fosfolipid
0.1-1
0.4
Lampiran 2 Komposisi
Soymeal
(Sukmadi 1996)
Komponen
Kadar komponen (%)
Protein 42.59
Nitrogen 6.81
Air 4.64
Lemak 19.74
Magnesium 0.15
Mangan 0.16
Besi 0.05
Seng 0.15
Fosfor 1.48
Kalsium 0.45
Lampiran 3 Komposisi
Fishmeal
(Miles & Jacob 2003)
Komponen
Kadar komponen (%)