NEMATODA SISTA KENTANG (Globodera spp.) INDONESIA
LISNAWITA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi ”Identifikasi, Kajian
Biologi dan Ketahanan Tanaman terhadap Nematoda Sista Kentang
(Globodera spp.) Indonesia” adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, September 2007
LISNAWITA. Identifikasi, Kajian Biologi dan Ketahanan Tanaman
terhadap Nematoda Sista Kentang (Globodera spp.) Indonesia”. Dibimbing
oleh MEITY SURADJI SINAGA, GUSTAF ADOLF WATTIMENA,
SUPRAMANA dan GEDE SUASTIKA.
Kentang (Solanum tuberosum L.) merupakan tanaman pangan utama dunia yang menempati urutan keempat sesudah padi, gandum dan jagung. Beberapa faktor pembatas produksi kentang adalah gangguan hama dan penyakit, iklim, teknik budidaya, pembibitan (mutu bibit) dan kesuburan tanah. Penyakit tanaman dapat disebabkan oleh berbagai bakteri, cendawan, fitoplasma, oomisetes, nematoda, viroids, and virus. Salah satu nematoda parasit yang saat ini sangat meresahkan petani kentang di Indonesia adalah potato cyst nematode atau nematoda sista kentang (Globodera spp./NSK). Di Indonesia, NSK merupakan patogen baru, dan pertama kali dilaporkan menyerang pertanaman kentang di dusun Sumber Brantas, Jawa Timur. Oleh karena itu pengetahuan tentang NSK Indonesia masih sangat terbatas. Informasi tentang spesies, patotipe, faktor biologis dan karakter molekuler belum pernah dilaporkan. Padahal informasi ini sangat diperlukan untuk dapat menyusun strategi pengendalian yang tepat dan efektif.
Berdasarkan hal itu dilakukan penelitian dengan tujuan : (1) mendapatkan sebaran geografi NSK di sentra pertanaman kentang di Pulau Jawa, (2) mendapatkan informasi spesies dan patotipe NSK Indonesia, (3) mempelajari biologi, pascaembriogenik dan siklus hidup NSK dan (4) mengevaluasi ketahanan tanaman kentang serta kisaran inang NSK .
Hasil survei menunjukkan bahwa NSK telah tersebar luas di beberapa wilayah di Jawa Timur, Jawa Tengah dan Jawa Barat dengan kepadatan populasi bervariasi dari rendah hingga tinggi. Kisaran populasi NSK di tiga lokasi di Desa Tulung Rejo (Kabupaten Kota Batu, Jawa Timur) adalah 21, 44 dan 675 sista per 100 ml tanah. Untuk Jawa Tengah, kisaran populasi dari yang tertinggi terdapat di Desa Pawuhan (Kabupaten Banjarnegara) yaitu 400 sista, diikuti berturut-turut oleh Desa Karangtengah (Kabupaten Banjarnegara), yaitu 270 sista, Desa Kepakisan (Kabupaten Banjarnegara) dengan 21 sista dan Desa Petak Bateng (Kabupaten Wonosobo) dengan 2 sista per 100 ml tanah. Sedangkan kepadatan populasi untuk Jawa Barat adalah 28 sista, 19 sista, 17 sista dan 2 sista per 100 ml tanah, berturut-turut untuk Desa Sukamanah (Kabupaten Bandung), Desa Sukamanah (Kabupaten Bandung), Desa Mekarsari Sindangkerta (Kabupaten Bandung) dan Desa Sukamanah (Kabupaten Bandung).
lain. Pengujian patotipe dengan klon diferensial menghasilkan populasi NSK Jawa Timur menujukkan G. rostochiensis dengan patotipe baru spesifik Indonesia, sedangkan populasi NSK Jawa Tengah merupakan G. rostochiensis patotipe Ro1.
Temperatur optimum untuk menghasilkan sista baru, faktor reproduksi, daya tahan hidup, keperidian dan perbanyakan NSK yang tinggi adalah 15-21ºC, dengan pola persamaan kuadratik. Setiap faktor biologi berkorelasi positif sangat nyata dengan faktor biologi yang lain. Nematoda sista kentang melengkapi siklus hidupnya dari sista hingga menghasilkan sista lagi dalam 30-35 hari .
Evaluasi ketahanan kultivar kentang terhadap isolat S1 yang dilakukan di rumah kassa, didapat tiga tipe ketahanan pada kultivar kentang uji yaitu : peka (Desiree, Atlantik, hps 7/67 klon 160 dan tps 340 klon 149), agak tahan (Astarte, Elkana, Granola dan Desiree transgenik 511.17) dan resisten (Solanum stoloniferum). Pada pengujian kisaran inang NSK di peroleh tomat varietas Dona, Money Maker, dan Maestro berpotensi sebagai tanaman perangkap NSK.
LISNAWITA. Ïdentification, Study of Biology and Plant Resistance for
Indonesian Potato Cyst Nematode (Globodera spp.)”. Supervised by MEITY
SURADJI SINAGA, GUSTAF ADOLF WATTIMENA, SUPRAMANA and GEDE SUASTIKA.
Potato (Solanum tuberosum L.) is the fourth most important crop in the world after rice, wheat and maize. Some factors that may constrain potato production in Indonesia are pests, diseases, climate, seed quality, soil fertility, and cultural methods. Plant diseases can be caused by bacteria, fungi, oomycetes, phytoplasma, nematodes, viroids, and virus. One parasite nematode, potato cyst nematode (PCN) (Globodera spp.), is a major threat to Indonesian potato production. In Indonesia, PCN was only first recognized in 2003 when it was found destroying a potato plantation in Sumber Brantas (East Java). Therefore, knowledge of PCN in Indonesia is limited and there has been no detail studied of species, pathotypes, biology and genetic diversity of Indonesian populations. This information is needed to develop appropriate and effective control strategies.
The objectives of this study were to (1) obtain geographical distribution of PCN in the centre of potato plantation in Java, (2) obtain information of Indonesian PCN’s species and pathotypes, (3) study biological aspects, postembryonic and life cycle of PCN and (4) evaluate potato cultivars resistance and host range of PCN, in Indonesia.
Survey in some areas in Java showed that PCN was already existed in East Java, Central Java and West Java, with population densities ranging from low to high. The population of PCN at three locations in Desa Tulung Rejo (Batu District, East Java) were 21, 44 and cysts per 100 ml soil. In Central Java, the highest population was found in Pawuhan (Banjarnegara District), with 400 cysts per 100 ml soil, followed by Desa Karangtengah (Banjarnegara District), Desa Kepakisan (Banjarnegara District), and Desa Petak Bateng (Wonosobo District) with 270, 21, and 2 cysts per 100 ml soil, respectively. Population densities of PCN in West Java were 28 cysts in Desa Sukamanah (Bandung District, 19 cysts in Desa Sukamanah (Bandung District), 17 cysts in Desa Mekarsari (Bandung District), and 2 cysts in Desa Sukamanah (Bandung District) per 100 ml soil.
Based on morphological characters, a single species, G. rostochiensis was identified from East Java, Central Java and West Java specimens. However, PCRs using specific primers for G. rostochiensis and G. pallida, showed mix species, were present in some samples from Central Java. Genetic character analysis with Clustal-W 1.83 program found that Indonesian isolates had low similarity compared to PCN species lodged in GeneBank. Indonesian population were separated into two groups, i.e. East Java population and Central Java population. Clone differential test showed that the PCN population from East Java was G. rostochiensis with Indonesian specific pathotype, while PCN population from Central Java was G. rostochiensis similar to Ro1 pathotype.
optimum temperature to produce new cysts with highest Rf, survival, fecundity, multiplication was 15-21ºC, with quadratic relationship. Every biological factor had a positive correlation with other biological factors. PCN completed its life cycle within 30-35 days.
Study of plant resistance and host range of Indonesian PCN on S1 isolates were carried out in a screen house. This study showed that there were three potato resistance types, i.e. susceptible (Desiree, Atlantic, hps 7/67 clone 160 and tps 340 clone 149), medium resistance (Astarte, Elkana, Granola and Desiree transgenic 511.17), and resistant (Solanum stoloniferum). The potential Solanaceae cultivars that might be used as PCN trap crops were tomato cultivars Dona, Money maker, and Maestro, because many second stage juveniles of PCN were found to invade these cultivars.
© Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tujuan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
IDENTIFIKASI, KAJIAN BIOLOGI DAN KETAHANAN
TANAMAN TERHADAP NEMATODA SISTA
KENTANG (
Globodera
spp.) INDONESIA
LISNAWITA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Lisnawita NIM : A461020041
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc Prof. Dr. Ir. G.A. Wattimena, M.Sc Ketua Anggota
Dr. Ir. Supramana, M.Si Dr. Ir. Gede Suastika, M.Sc Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi dan Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
Penguji pada Ujian Tertutup : Dr. Ir. Ika Mustika, SU, APU
Penguji pada Ujian Terbuka : 1. Dr. Ir. Muchjidin Rahmat, MS
Segala puji bagi Allah SWT yang telah memberikan rahmat dan karuniaNya kepada penulis, sehingga penulisan disertasi yang berjudul ”Identifikasi, Kajian Biologi dan Ketahanan Tanaman terhadap Nematoda Sista Kentang (Globodera spp.) Indonesia” dapat diselesaikan.
Penulis menyampaikan rasa terima kasih yang tidak terhingga kepada Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc, Prof. Dr. Ir. G.A. Wattimena, M.Sc, Dr. Ir. Supramana, M.Si, Dr. Ir. Gede Suastika, M.Sc, atas bimbingan, kesabaran, pengkayaan wawasan, kritik, saran dan dukungan moril yang sangat besar peranannya dalam penyelesaian penulisan disertasi ini.
Ucapan terima kasih juga disampaikan Dr. Ir. Ika Mustika, SU, APU yang bersedia menjadi Penguji Luar Komisi pada Ujian Tertutup. Dr. Ir. Muchjidin Rahmat, MS dan Dr. Ir. Abdul Munif, M.Si yang bersedia menjadi Penguji Luar Komisi pada Ujian Terbuka. Dr. Richard Janssen dari Plant Research International, Wageningen, The Netherlands atas bantuan satu set klon diferensial NSK. Rektor USU, Dekan Faperta USU dan Ketua Departemen Proteksi Tanaman Faperta USU yang telah memberi ijin untuk mengikuti program doktor di program studi Entomologi dan Fitopatologi Sekolah Pascasarjana IPB. Ucapan terima kasih juga penulis sampaikan kepada Rektor IPB, Dekan Sekolah Pascasarjana IPB, Ketua dan seluruh staf pengajar program studi Entomologi dan Fitopatologi, Ketua dan seluruh staf pengajar dan administrasi Departemen Proteksi Tanaman Faperta IPB atas kesempatan yang diberikan kepada penulis untuk mengikuti program doktor di IPB. Ucapan terima kasih juga penulis sampaikan kepada tim manajemen Beasiswa Program Pascasarjana (BPPS), Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional yang telah memberikan dukungan dana untuk mengikuti program doktor. Terima kasih juga penulis sampaikan kepada Research Grant Program Hibah Kompetisi-B, Departemen Proteksi Tanaman, Faperta, IPB, tahun anggaran 2005/2006 yang telah membantu sebagian dana penelitian Disertasi ini.
penulisan disertasi ini. Terima kasih kepada Dian dan keluarga dan mang Maman atas bantuan pemeliharaan tanaman di rumah kassa. Ucapan terima kasih juga penulis sampaikan kepada Nia, Sarah dan pak Asep atas bantuan perbanyakan tanaman kultur jaringan. Juga kepada sahabat-sahabat saya Dr. Ian Riley, Dr. Ir. Andi Khaeruni, M.Si dan keluarga, Dr. Ir. Muhammaad Taufik, M.Si, Dr. Ir. Eliza S. Rusli, M.Si, Dr. Ir. Noor Aidawati, M.Si, mbak Tuti, mbak Yunik, mbak Hiasinta J. Matulo, Pak Rai atas persahabatan dan kerjasamanya. Kepada teman-teman kos, tetangga kamar mbak Sukendah, Ria, mbak Niken, Yati, Diana dan Rafli atas kebersamaan dalam suka dan duka.
Terima kasih yang setulusnya penulis ucapan kepada teman-teman di Medan, Nissa dan keluarga, Kak Mida dan keluarga, Irda dan keluarga, Bu Cyccu, atas persahabatan, perhatian dan dorongan semangat selama ini.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua tercinta, ayahanda H. Abdul Muis (alm) dan ibunda Hj. Rohana Samin yang telah mencurahkan kasih sayang, bimbingan, doá, dan selalu memberikan yang terbaik buat putra-putrinya. Semoga Allah SWT selalu memberikan ampunan dan maghfirahNya, Amien. Ucapan terima kasih yang tidak terhingga juga penulis ucapkan kepada semua kakanda dan kakak ipar, Mayjend (inf) M. Noer Muis dan keluarga, M. Irawan Muis, BA dan keluarga, M. Arwien Muis, SE dan keluarga, M. Ramli Araby, SE dan keluarga, Nunu Hendrawanto, SE dan keluarga, M. Arman Muis, SE dan keluarga, dan M. Arnis Muis dan keluarga atas dorongan semangat, pengertian dan bantuan material selama ini.
Akhir kata terima kasih yang setinggi-tingginya penulis sampaikan kepada semua pihak yang tidak dapat penulis sebutkan satu persatu, semoga Allah SWT yang membalas semua kebaikan yang Bapak/Ibu dan teman-teman berikan kepada penulis. Amin.
Semoga hasil penelitian ini bermanfaat untuk kepentingan umat manusia dan ilmu pengetahuan.
Penulis dilahirkan di Kualasimpang, 5 Oktober 1969. Penulis merupakan anak ke delapan dari delapan bersaudara dari anak pasangan H. Abdul Muis (Alm) dan Hj. Rohana Samin.
Penulis menyelesaikan pendidikan dasar di Sekolah Dasar Negeri 7 Kualasimpang pada tahun 1982, pendidikan menengah di Sekolah Lanjutan Tingkat Pertama Negeri 1 Kualasimpang pada tahun 1985, dan Sekolah Lanjutan Tingkat Atas Negeri 1 Kualasimpang pada tahun 1988. Gelar Sarjana Strata 1 penulis raih dari Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara Medan pada tahun 1993 dan Sarjana Strata 2 dari Program Studi Entomologi dan Fitopatologi Program Pascasarjana Institut Pertanian Bogor pada tahun 1998. Sejak tahun 2002 penulis terdaftar sebagai mahasiswa Program Doktor (S3) pada Program Studi Entomologi dan Fitopatologi Sekolah Pascasarjana Institut Pertanian Bogor.
Sejak tahun 1994 penulis diangkat sebagai staf pengajar tetap Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara Medan.
xiii
DAFTAR ISI
Halaman
DAFTAR TABEL... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xviii
I PENDAHULUAN Latar Belakang ... 1
Sejarah NSK di Dunia dan di Indonesia... 2
Biologi dan Siklus Hidup NSK... 3
Identifikasi dan Pengujian Patotipe NSK... 5
Strategi Pengendalian... 7
Tujuan Penelitian ... 11
Manfaat Penelitian ... 11
II SURVEI DAN SEBARAN GEOGRAFI NEMATODA SISTA KENTANG INDONESIA Abstrak ... 13
Abstract ... 14
Pendahuluan ... 15
Tujuan Penelitian ... 16
Metode Penelitian ... 16
Hasil ... 17
Pembahasan... 20
III IDENTIFIKASI DAN KARAKTERISASI NEMATODA SISTA KENTANG INDONESIA MENGGUNAKAN KARAKTER MORFOLOGI, MOLEKULER DAN KLON DIFERENSIAL
Abstrak ... 24
Abstract ... 25
Pendahuluan ... 26
Tujuan Penelitian ... 28
Metode Penelitian ... 28
Hasil ... 35
Pembahasan... 45
Simpulan ... 50
IV KAJIAN BIOLOGI NEMATODA SISTA KENTANG INDONESIA Abstrak ... 52
Abstract ... 53
Pendahuluan ... 54
Tujuan Penelitian ... 55
Metode Penelitian ... 55
Hasil ... 58
Pembahasan... 69
Simpulan ... 72
V EVALUASI KETAHANAN TANAMAN DAN KISARAN INANG NEMATODA SISTA KENTANG INDONESIA Abstrak ... 73
Abstract ... 74
Pendahuluan ... 75
Tujuan Penelitian ... 77
Metode Penelitian ... 78
Hasil ... 81
Pembahasan... 83
Simpulan ... 87
VI PEMBAHASAN UMUM ... 88
VII SIMPULAN DAN SARAN ... 95
xv
DAFTAR TABEL
Halaman
2.1 Daerah sebar NSK dan kode isolat ... 19
3.1 Lokasi geografi, nomor asesi sekuen NSK pada GeneBank ... 33 3.2 Skema Internasional untuk patotipe G. rostochiensis (Kort et al. 1977;
Canto Saenz & de Scurrah 1977) dengan klon komersil ... 35
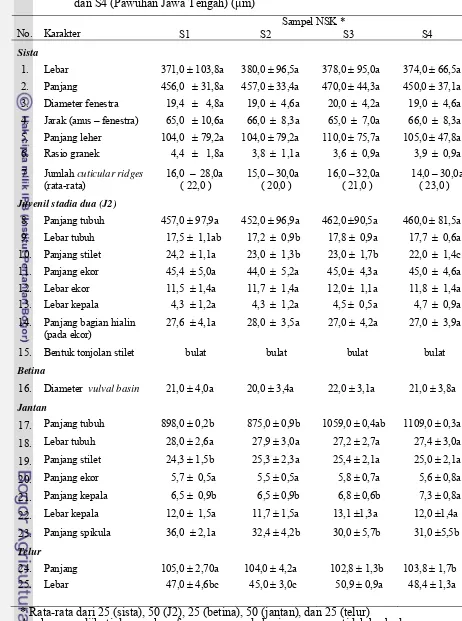
3.3 Ukuran sista, juvenil, betina, jantan dan telur NSK isolat S1 (Jawa Timur lokasi 1), S2 (Jawa Timur lokasi 2), S3 (Jawa Timur
lokasi 3) dan S4 (Pawuhan Jawa Tengah) (μm) ... 39
3.4 Ukuran sista, juvenil, betina, jantan dan telur NSK berdasarkan
wilayah Jawa Timur (S1, S2 dan S3) dan Jawa Tengah (S4) (μm)... 40
3.5 Analisis patotipe isolat S1, S2, S3 (Jawa Timur) dan S4 (Pawuhan
Jawa Tengah) pada klon diferensial komersil ... . 45
4.1 Korelasi antara jumlah sista, faktor reproduksi, daya tahan hidup,
keperidian dan perbanyakan NSK Indonesia... 66
5.1 Tipe ketahanan kultivar kentang... 79
5.2 Tipe ketahanan sembilan kultivar kentang terhadap infeksi nematoda
sista kentang... 82
DAFTAR GAMBAR
Halaman
1.1 Diagram alur penelitian... 12
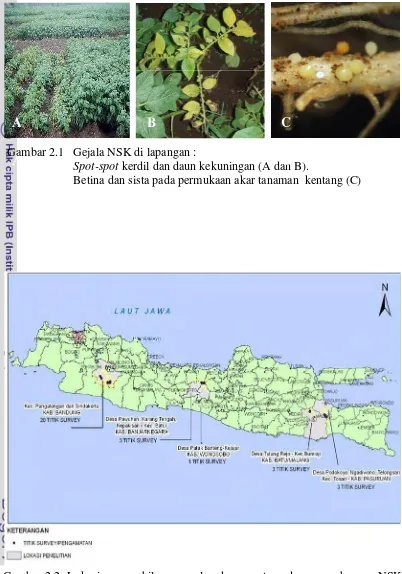
2.1 Gejala NSK di lapangan : Spot-spot kerdil dan daun kekuningan (a dan b), (c). Sista pada permukaan akar dan umbi
(tanda panah)... 18
2.2 Lokasi pengambilan sampel tanah pada pemetaan dan
penyebaran NSK di Jawa Timur, Jawa Tengah dan Jawa Barat ... 18
3.1 Daerah anterior (A-D) dan ekor (E-H) juvenile stadia-2 (J2) serta telur (I-L) nematoda sista kentang Indonesia. A, E, I). S1 (Jawa Timur lokasi 1). B, F, J). S2 (Jawa Timur lokasi 2). C, G, K). S3 (Jawa Timur lokasi 3). D, H, L).
S4 (Pawuhan Jawa Tengah (S4). ………... 36
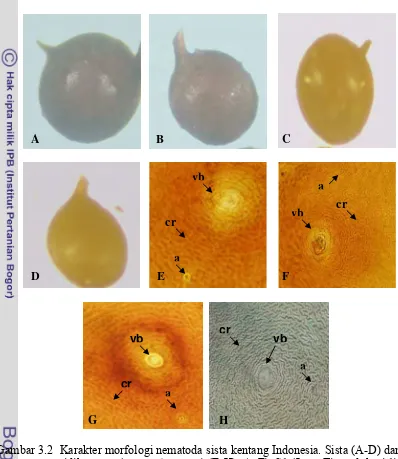
3.2 Karakter morfologi nematoda sista kentang Indonesia. Sista (A-D) dan sidik pantat (perineal pattern) (E-H). A, E). S1 (Jawa Timur lokasi 1). B, F). S2 (isolat Jawa Timur lokasi 2). C, G). S3 (Jawa Timur lokasi 3). D, H). S4 (Pawuhan Jawa Tengah). (vb = vulval basin,
cr = cutcular ridges, a=anus,GR besar dari 3,2)……... 37
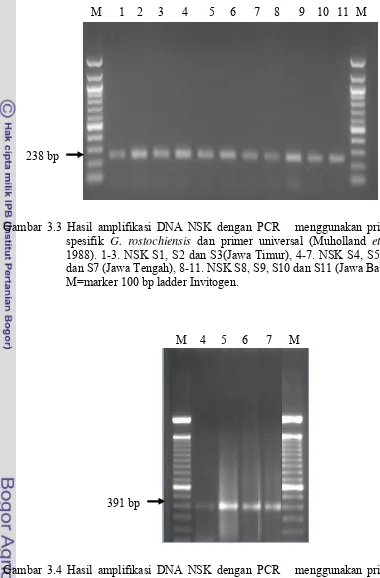
3.3 Hasil amplifikasi DNA beberapa isolat NSK dengan PCR
menggunakan primer spesifik G. rostochiensis dan primer universal (Muholland et al 1988).
M=marker 100 bp ladder Invitogen, 1-3. NSK S1, S2 dan S3 (Jawa Timur), 4-7. NSK S4, S5, S6 dan S7(Jawa Tengah),
8-11. NSK S8, S9, S10 dan S11(Jawa Barat). ... 42
3.4 Hasil amplifikasi DNA beberapa isolat NSK dengan PCR menggunakan primer spesifik G. pallida dan
primer universal (Muholland et al 1988). 4-7. NSK S4, S5, S6 dan S7 (Jawa Tengah) M=marker 100 bp ladder Invitogen ... 42
3.5 Perbandingan hasil perunutan nukleotida5 isolat `NSK spesies G. rostochiensis Indonesia. GR1-JT1 = S1, GR2-JT2 = S2, GR3-JT3 = S3, GR4-JTH = S4, dan GR6-JTH = S6.
*) Menunjukkan nukleotida yang sama. ... 43
3.6 Dendogram isolat-isolat NSK asal Indonesia terhadap NSK
dari lokasi geografi lain yang ada di GeneBank (AFO16873 ; AFO 16876 ; AFO 16875 ; AFO 16873 ; AFO 16877 ; AFO 16878 ; AFO 16874 ; AFO 16872)
xvii
4.1 Metode multiplikasi nematoda sista kentang di laboratorium A. tanaman kentang di dalam pot plastik
B. sista-sista NSK di sepanjang permukaan akar (tanda panah)... 58
4.2 Gejala tanaman yang terinfeksi NSK di growth chamber. A. Tanaman sehat,
B.15 setelah inokulasi (hsi), C. 25 hsi, D. Tanaman mati 50 hsi... 59
4. 3 Pengaruh temperatur terhadap jumlah sista NSK Indonesia A.S1 (Jawa Timur lokasi 1), B. S2 (Jawa Timur lokasi 2),
C. S3 (Jawa Timur lokasi 3) dan D. S4 (Pawuhan Jawa Tengah)... 61
4. 4 Pengaruh temperatur terhadap faktor reproduksi NSK Indonesia A. S1 (Jawa Timur lokasi 1), B. S2 (Jawa Timur lokasi 2),
C. S3 (Jawa Timur lokasi 3) dan D. S4 (Pawuhan Jawa Tengah)... 62
4. 5 Pengaruh temperatur terhadap daya tahan hidup NSK Indonesia A. S1 (Jawa Timur lokasi 1), B. S2 (Jawa Timur lokasi 2),
C. S3 (Jawa Timur lokasi 3) dan D. S4 (Pawuhan Jawa Tengah)... 63
4. 6 Pengaruh temperatur terhadap keperidian NSK Indonesia A. S1 (Jawa Timur lokasi 1), B. S2 (Jawa Timur lokasi 2),
C. S3 (Jawa Timur lokasi 3) dan D. S4 (Pawuhan Jawa Tengah)... 64 .
4.7 Pengaruh temperatur terhadap perbanyakan NSK Indonesia A. S1 (Jawa Timur lokasi 1), B. S2 (Jawa Timur lokasi 2),
C. S3 ( Jawa Timur lokasi 3) dan D. S4 (Pawuhan Jawa Tengah)... 65
4.8 Perkembangan pascaembriogenik nematoda sista kentang. A. Telur dan J1. (B). J2 menetas dari telur.
C. J2 di dalam jaringan akar. (D). Fase akhir J2... 67
4.9 Perkembangan pascaembriogenik nematoda sista kentang.
A. J3. (B). J4. (C). Betina. (D). Jantan. (E). Sista... 68
DAFTAR LAMPIRAN
Halaman
1 Media MS0 ... 107
2 Skema Internasional untuk patotipe G. rostochiensis dan G. pallida
pada klon diferensial ... 108 3 Tingkat kesamaan populasi G. rostochiensis yang berasal dari geogafi
yang berbeda berdasarkan sekuen gen ITS-1 ... 109
I. PENDAHULUAN
Latar Belakang
Kentang (Solanum tuberosum L.) merupakan tanaman pangan utama dunia yang menempati urutan keempat sesudah padi, gandum dan jagung (Rubatzky & Yamaguchi 1998 ; Tjitrosoepomo 1997). Kentang awalnya diintroduksi dari dataran tinggi Andes, Amerika Selatan ke Spanyol sekitar tahun 1570. Penerimaan masyarakat Spanyol menyebabkan pertumbuhan dan distribusi kentang meningkat dan mulai dibudidayakan secara besar-besaran (Hawkes 1994 ; Wattimena et al. 2002). Kentang dibawa ke sejumlah negara di Eropa dan dalam waktu kurang dari 100 tahun, tanaman ini telah ditanam cukup luas. Penyebaran di luar Eropa dimulai tahun 1620 ke India, tahun 1700 ke Cina dan ke berbagai wilayah di daerah Asia lainnya (Rubatzky & Yamaguchi 1998).
Di Indonesia, kentang pertama kali masuk di wilayah Kecamatan Cisarua, Kabupaten Bandung, Jawa Barat pada tahun 1794 dan mulai dibudidayakan di daerah dataran tinggi lainnya sejak tahun 1804 yaitu di Bukit Tinggi (Sumatera Barat), Tanah Karo (Sumatera Utara) sampai ke pegunungan Arfak (Irian Jaya) (Wattimena 2000). Saat ini kentang sudah dibudidayakan di 20 propinsi di Indonesia, yang tersebar di Sumatera, Jawa, Sulawesi, Maluku dan Papua (AVRDC1991 ; Daryanto 2003).
Kebutuhan kentang dari tahun ke tahun semakin bertambah sejalan dengan bertambahnya jumlah penduduk dan semakin tingginya kesadaran masyarakat akan gizi (Rukmana 1997). Perubahan pada konsumsi masyarakat Indonesia dewasa ini juga turut berperan dalam memacu peningkatan kebutuhan kentang. Di kota-kota besar mulai terlihat adanya pergeseran ke arah pemanfaatan kentang sebagai sumber alternatif karbohidrat.
2004 sebesar 65.420 Ha. Beberapa faktor yang menyebabkan penurunan produksi kentang adalah gangguan hama dan penyakit, iklim, teknik budidaya, pembibitan (mutu bibit) dan kesuburan tanah. Di antara faktor-faktor tersebut, gangguan hama dan penyakit merupakan penyebab utama penurunan produksi kentang di Indonesia.
Penyakit penting yang menyebabkan penurunan produksi kentang di Indonesia adalah penyakit tanaman yang disebabkan oleh berbagai bakteri, cendawan, fitoplasma, oomisetes, nematoda, viroids, dan virus dengan intensitas serangan yang sangat tinggi. Salah satu nematoda parasit yang saat ini sangat meresahkan petani kentang di Indonesia adalah potato cyst nematode (PCN) atau nematoda sista kentang (NSK) (Globodera spp.). Nematoda ini merupakan organisme pengganggu tanaman penting karena kemampuan merusak dan mematikan pada tanaman kentang yang sangat besar. Nematoda menyebar luas secara pasif melalui tanah atau umbi atau bahan pembiakan vegetatif yang lain.
Sejarah NSK di Dunia dan di Indonesia
Nematoda sista kentang berasal dari wilayah di sekitar Danau Titicaca pegunungan Andes Amerika Selatan, dekat perbatasan Peru dan Bolivia (Evans & Turner 1998). Impor tanaman kentang yang berasal dari Amerika Selatan oleh negara-negara di Eropa untuk keperluan pemuliaan demi menghasilkan varietas kentang resisten terhadap Phytophthora infestans, merupakan awal dari penyebaran NSK di Benua Eropa (Evans & Turner 1998). CABI (2002) telah mencatat daerah sebar NSK di Benua Eropa, Asia, Afrika, Amerika dan Kepulauan Oceania (Kepulauan Norfolk New Zealand Australia). Ternyata pola sebar NSK mengikuti pola sebar tanaman kentang dan hampir seluruh sentra pertanaman kentang di dunia telah dicemari oleh kehadiran NSK (Hadisoeganda 2004).
3
diganti menjadi Globodera rostochiensis (nematoda sista kuning atau golden potato cyts nematode) dan G. pallida (nematoda sista putih atau pale potato cyts nematode) (Stevenson et al. 2001).
Di Indonesia, NSK merupakan patogen baru, dan pertamakali dilaporkan menyerang pertanaman kentang di dusun Sumber Brantas Desa Tulung Rejo, Kecamatan Bumi Aji Kota Batu Jawa Timur (Daryanto 2003). Lebih lanjut Daryanto (2003) melaporkan, dari hasil wawancara langsung dengan petani kentang di Kecamatan Bumi Aji, Jawa Timur terjadi penurunan produksi kentang pada tanaman yang terserang ringan yaitu dari produksi normal 24 ton menjadi 14 ton bahkan ada yang hanya 7 ton pada lahan seluas 1,5 ha, yang berarti terjadi penurunan produksi antara 32-71%.
Awalnya nematoda tersebut termasuk Organisme Pengganggu Tanaman Karantina (OPTK) kelas A1 yang berarti OPT yang belum terdapat di Indonesia dan harus diawasi agar tidak masuk ke wilayah Republik Indonesia. Saat ini, berdasarkan Surat Keputusan Menteri Pertanian nomor 38/Kpts/HK.060/1/ 2006, tanggal 27 Januari 2006, tentang jenis-jenis organisme pengganggu tumbuhan karantina golongan I kategori A1 dan A2, golongan II kategori A1 dan A2, tanaman inang, media pembawa dan daerah sebarnya status NSK berubah, NSK termasuk sebagai OPTK kelas A2 yaitu OPTK yang sudah berada di dalam wilayah tertentu di Republik Indonesia, tetapi masih terbatas penyebarannya dan dalam pengendalian. Keberadaan nematoda ini selain dapat menimbulkan kerusakan tanaman kentang yang cukup besar, juga ekspor kentang dari suatu negara yang diketahui pertanaman kentangnya terinfeksi NSK akan terhambat (Brodie et al. 1993). Berdasarkan informasi tersebut, NSK berpotensi menjadi faktor pembatas utama pada produksi kentang di Indonesia pada masa-masa yang akan datang.
Biologi dan Siklus Hidup NSK
menetas secara alami untuk mengurangi kepadatan populasi, dan sebagian sista lagi akan tetap berada di dalam tanah untuk waktu yang lama tanpa inang. Kemampuan bertahan hidup, reproduksi dan dinamika populasi NSK sangat dipengaruhi oleh temperatur, kelembaban, panjang hari dan faktor lingkungan di sekitarnya.
Bagian yang aktif dari siklus hidup dimulai ketika juvenil stadia kedua (J2) menetas dari telur. Penetasan terjadi bila temperatur tanah cukup hangat (di atas 10°C) (Ferris 1959) dan ada rangsangan senyawa kimia yang dikeluarkan oleh ujung akar tanaman inang (Clark & Hennessy 1984 ; Rawsthorne & Brodie 1986). Rangsangan ini bersifat spesifik yaitu hanya terjadi pada tanaman dari famili Solanaceae seperti kentang, tomat, terung dan S. dulcamara (sejenis gulma). Menurut Devine & Jones (2000), sedikitnya ada sembilan senyawa kimia yang disebut faktor penetasan (hatching factors) yang berperan dalam penetasan telur NSK. Beberapa dari senyawa ini telah diidentifikasi dan dikarakterisasi, salah satunya adalah solanoeclepin A (Mulder et al. 1997).
Rangsangan eksudat akar menyebabkan 60 – 80% telur menetas, sekitar 5% penetasan terjadi di dalam air dan 30% penetasan terjadi secara spontan tanpa inang (Fenwick 1949). Bila kondisi lingkungan tidak mendukung dan tidak ada rangsangan untuk menetas, telur berada dalam kondisi dorman di dalam sista. Pada stadia dorman, nematoda lebih resisten terhadap nematisida (Spears 1968).
Nematoda mempunyai empat stadia juvenil dan stadia dewasa (jantan dan betina). J2 yang menetas dari telur, keluar dari sista, dan melakukan penetrasi pada ujung akar tanaman inang. Selanjutnya J2 masuk ke dalam akar di dekat titik tumbuh atau akar-akar lateral dengan menusukkan stiletnya pada sel epidermis, masuk dan bergerak dalam akar secara intraselluler dan akhirnya menetap dan memulai makan di perisikel, korteks atau endodermis. Tusukan stilet menyebabkan masuknya saliva ke dalam sel dan merangsang pembentukan sinsitium yang dikelilingi oleh satu lapisan sel hiperplastik yang berguna untuk mentransfer nutrisi ke nematoda (Jones & Nortconte 1972).
5
nutrisi cukup tersedia akan menghasilkam betina. Pada saat terjadi infeksi berat, NSK jantan menjadi lebih dominan, dan sebaliknya. Proses pelukaan terjadi pada saat NSK betina membengkak, memecah korteks akar, dan mengeluarkan bagian vulva, sedangkan bagian kepala dan leher masih tetap berada di dalam akar. Dalam perkembangannya, NSK jantan melingkar di dalam kutikula larva J4 dan memecah kutikula, kemudian keluar dari akar. Jantan dewasa berbentuk cacing (vermiform), keluar dari sinsitium dan masuk ke dalam tanah (Evans & Turner 1998).
Reproduksi NSK terjadi secara seksual. Nematoda betina menghasilkan feromon untuk memikat atau menarik jantan yang berada di dalam tanah. Perkawinan segera terjadi beberapa saat kemudian. Setelah kawin, setiap betina menghasilkan sekitar 200-500 telur, kemudian betina mati dan dinding tubuhnya akan membungkus telur dan membentuk sista. Perkembangan embrio terjadi di dalam telur hingga stadia kedua. Penetasan kembali terjadi bila ada rangsangan yang dihasilkan oleh akar tanaman inang dan kondisi lingkungan yang sesuai dan siklus hidup akan berulang kembali. NSK akan melengkapi siklus hidupnya selama 38-48 hari bergantung kepada temperatur tanah (Chitwood & Buhrer 1945).
Identifikasi dan Pengujian Patotipe NSK
ukuran lebih besar atau lebih panjang dib&ingkan G. rostochiensis (CABI 2002 ; Stone 1973a ; Stone 1973b).
Seiring dengan perkembangan bidang molekuler, maka telah dikembangkan pengujian yang didasari dengan perbedaan di dalam protein, lemak, karbohidrat dan asam deoksiribonukleat (DNA) untuk metode identifikasi NSK, yaitu metode PCR (polymerase chain reaction). Teknik PCR dapat mengatasi masalah jumlah DNA yang rendah per individu. Fragmen DNA genom nematoda yang menjadi sasaran analisa diamplifikasi terlebih dahulu dengan PCR. Dari analisis genom nematoda, diperoleh informasi bahwa bagian internal transcribed spacer (ITS) dari rDNA merupakan daerah variabel sebagai k&idat yang baik untuk studi taksonomi molekuler dan filogenik sehingga sering digunakan untuk analisa patotipe suatu populasi nematoda (Thiery & Mugniery 1996). Dalam bidang fitopatologi, teknik PCR banyak digunakan untuk tujuan deteksi patogen, identifikasi patogen, karekterisasi keanekaragaman patogen maupun untuk diferensiasi patogen tumbuhan. Dengan demikian bersama-sama dengan teknik konvensional, prosedur yang berdasarkan analisis DNA dan protein secara kontinyu dikembangkan untuk mengidentifikasi NSK sehingga dapat ditemukan metode pengendalian yang tepat.
7
dengan pengujian klon diferensial di pot, kemudian diinokulasi dengan 25 sista (Pi). Pada akhir penelitian jumlah sista baru (Pf) dib&ingkan dengan jumlah sista awal (Foot 1977). Patotipe dibagi menjadi virulen atau avirulen. Virulen jika Pf/Pi >1 atau avirulen jika Pf/Pi ≤ 1.
Strategi Pengendalian
NSK merupakan salah satu patogen tanaman yang sulit dikendalikan, karena kemampuannya bertahan hidup yang sangat tinggi. Pada populasi rendah kehadiran nematoda sulit dideteksi, sebaliknya pada tingkat populasi yang tinggi dapat menyebabkan kehilangan hasil yang sangat tinggi. Untuk itu perlu diupayakan pengelolaan secara terpadu, yaitu dengan pencegahan introduksi baru dari luar negeri, pembatasan penyebaran ke sentra-sentra produksi kentang yang masih bebas NSK, dan pengendalian di wilayah yang sudah terinfestasi.
Beberapa teknik pengendalian NSK yang mungkin dapat dilakukan adalah : (1) rotasi tanaman, (2) penggunaan kultivar kentang tahan, (3) tanaman perangkap, (4) pengendalian biologi, (5) penggunaan nematisida dan (6) pengendalian terpadu.
Penggunaan rotasi tanaman untuk mengendalikan NSK seringkali sulit dilakukan karena untuk memperoleh hasil yang nyata rotasi tanaman membutuhkan waktu yang lama, yaitu sekitar 6-7 tahun (Urwin et al. 2001). Selain itu umumnya tanaman yang digunakan untuk rotasi mempunyai nilai ekonomi yang lebih rendah dibandingkan kentang, sehingga petani tidak tertarik untuk melakukan rotasi tanaman, untuk itu perlu dicari strategi pengendalian lain (Schomaker & Been 1999).
Penggunaan varietas resisten merupakan cara yang efektif dan ekonomis dalam mengendalikan nematoda parasit tanaman. Walaupun demikian tidak mudah untuk mendapatkan varietas resisten NSK. Hal ini disebabkan karena NSK dikendalikan oleh beberapa gen virulen, dimana gen-gen virulen tersebut ada yang bersifat monogenik dan ada yang bersifak poligenik sehingga sulit untuk merakit varietas kentang dengan beberapa gen tahan sekaligus. Oleh karena itu walaupun pemuliaan tanaman telah berhasil mendapatkan beberapa varietas kentang resisten tetapi tidak menyelesaikan masalah NSK secara permanen.
merangsang penetasan telur dari sista dengan eksudat yang dikeluarkan akar, tetapi mencegah terjadinya siklus hidup lengkap sehingga dapat menurunkan populasi nematoda di lapangan (Anonimus 2007c). Halford et al. (1999) ; Lamondia & Brodie (1986) mengemukakan bahwa dengan penggunaan tanaman perangkap dapat menurunkan populasi NSK di lapangan lebih dari 87%. Scholte (2000a) melaporkan bahwa tanaman kentang sendiri dapat digunakan, tetapi tidak ideal sebagai tanaman perangkap.
Beberapa penelitian di Eropa menemukan bahwa penggunaan Solanaceae yang tidak menghasilkan umbi sebagai tanaman perangkap ternyata lebih efektif dibandingkan Solanaceae yang menghasilkan umbi. Hal ini disebabkan karena pada tanaman yang menghasilkan umbi, tanaman masih dapat tumbuh kembali walaupun umbi telah diambil. Setelah dilakukan skrining untuk waktu yang lama, didapat satu spesies Solanaceae yang efektif untuk mengendalikan NSK di Eropa yaitu Solanum sisymbriifolium (Lam.) (Scholte 2000b). S. sisymbriifolium mampu menurunkan populasi NSK sebesar 50-80% (Scholte 2000c ; Scholte & Vos 2000).
Walaupun beberapa cendawan telah berhasil diisolasi dari Globodera spp., tetapi keberhasilan pengendalian NSK secara biologi masih kecil. Khan (1988), melaporkan parasit telur Paecilomyces lilacinus mampu mengendalikan G. rostochiensis seefektif nematisida aldicard. Goswami & Rumpehorst (1978) berhasil mengisolasi cendawan dari telur NSK di Jerman dan efektif menginfeksi 70% telur G. rostochiensis dan G. pallida. Keberhasilan penggunaan agens biokontrol untuk pengendalian biologi sangat dipengaruhi oleh seleksi isolat agens biokontrol yang akan digunakan dan faktor-faktor yang mempengaruhi epidemiologi agens biokontrol dan nematoda itu sendiri (Stirling 1991).
9
nematoda parasit tanaman hingga 80%, sehingga memungkinkan mempersingkat waktu rotasi tanaman. Hal ini yang menyebabkan penggunaan fumigasi tanah menjadi komponen kunci dalam pengenadian NSK di Amerika hingga tahun 1984. Namun penggunaan fumigasi tanah harus benar-benar diperhatikan, karena fumigasi tanah dapat bersifat fitotoksik dan dapat membunuh semua organisme di dalam tanah termasuk nematoda, cendawan, bakteri dan serangga (Lebbink et al. 1989).
Nematisida yang bersifat non fumigasi digunakan untuk melindungi tanaman kentang dari kerusakan dan kehilangan hasil karena serangan nematoda. Nematisida non fumigasi seperti aldicarb [2-methyl-2-(methylthio) propionaldehyde O-(methylcarbamoyl) oxime] dan oxamyl {methyl N’,N’-dimethyl-N-[(methylcarbamoyl)oxy]-1-thiooxamimidate} efektif mengendalikan NSK. Nematisida ini diaplikasikan pada permukaan tanah sebelum kentang ditanam (Whitehead 1986) atau diaplikasikan pada bibit pada waktu tanam (Brodie 1984).
Walaupun nematisida efisien dan memberikan hasil dalam waktu yang cepat, tetapi penggunaan nematisida membutuhkan biaya yang sangat besar. Selain itu nematisida bersifat persisten sehingga dapat menyebabkan kontaminasi air tanah, lingkungan dan kesehatan (Brodie & Mai 1989). Beberapa peneliti melaporkan nematisida juga bersifat bioremediasi, yang berarti beberapa nematisida dapat menjadi sumber nutrisi bagi bakteri tanah sehingga pemberian nematisida tidak berefek apapun pada nematoda yang akan dikendalikan.
Keterbatasan dari setiap teknik pengendalian jika digunakan secara tunggal untuk mengendalikan NSK, menjadi dasar pemikiran untuk memadukan beberapa teknik pengendalian sekaligus. Aplikasi nematisida non fumigan yang dikombinasikan dengan penggunaan kultivar kentang resisten dan fumigasi tanah telah menghambat penyebaran G. rostochiensis di Amerika (Evans & Brodie 1980). Di Belanda, dichloropropene dan methyl sodium digunakan secara intensif pada pengendalian terpadu NSK (Trudgill et al. 1987). Pengendalian NSK dengan strategi pengendalian terpadu dapat menurunkan resiko seleksi patotipe yang virulen secara cepat.
11
Tujuan Penelitian
Berdasarkan permasalahan yang ada, perlu dilakukan penelitian ini yang bertujuan : (1) Mendapatkan sebaran geografi NSK di sentra-sentra pertanaman kentang di Pulau Jawa; (2) Mengetahui spesies dan patotipe NSK Indonesia dengan melakukan identifikasi berdasarkan karakter morfologi dan molekuler serta klon diferensial; (3) Mempelajari biologi NSK dengan mengamati perkembangan pascaembriogenik dan pengaruh temperatur terhadap faktor biologis; (4) Mengevaluasi ketahanan kultivar kentang dan kisaran inang NSK.
Untuk mencapai tujuan tersebut di atas, penelitian dilakukan melalui serangkaian percobaan sebagai berikut : (1) Survei nematoda sista kentang di sentra-sentra pertanaman kentang di Jawa Timur, Jawa Barat dan Jawa Tengah; (2a) Identifikasi spesies NSK berdasarkan karakter morfologi, yaitu dengan pengamatan dan pengukuran ciri-ciri morfologi (morfometri) dan karakter molekuler yaitu dengan menggunakan sidik jari DNA melalui teknik polymerase chain reaction (PCR); (2b) Pengujian klon diferensial untuk mengetahui patotipe NSK; (3). Mempelajari pengaruh temperatur terhadap faktor biologis dan mengamati perkembangan pascaembriogenik NSK; (4) Melakukan pengujian ketahanan kultivar kentang terhadap infeksi NSK dan uji kisaran inang untuk mendapatkan tanaman yang potensial sebagai tanaman perangkap NSK. Secara lengkap alur penelitian dapat dilihat pada Gambar 1.1.
Manfaat Penelitian
semua informasi yang didapat, dapat digunakan untuk menentukan strategi pengendalian NSK yang tepat dan efektif di masa yang akan datang.
Percobaan 1.
Survei sebaran geografi NSK di Jawa Timur, Jawa Tengah dan Jawa Barat
Sampel tanah
Sista
Percobaan 2.
Identifikasi spesies dan patotipe
Percobaan 3. Kajian biologi
Percobaan 4. Evaluasi ketahana kultivar kentang dan kisaran inang NSK
Karakter morfologi Karakter
molekuler a. Faktor biologi b. Pascaembriogenik c. Siklus hidup a. Morfologi
b. Morfometri
PCR
G. rostochiensis G. pallida G. rostochiensis
G. pallida Uji klon diferensial
Analisis susunan DNA
Analisis hubungan kekerabatan
Patotipe
Hasil : Informasi tentang : (1). Sebaran geografi NSK di Pulau Jawa, (2). spesies dan patotipe NSK, (3). temperatur optimum untuk faktor biologi, (4). pascaembriogenik dan siklus hidup, (5). kultivar kentang tahan dan (6). Solanaceae yang potensial sebagai tanaman perangkap
Strategi pengendalian yang tepat dan efektif
II. SURVEI DAN SEBARAN GEOGRAFI NEMATODA SISTA KENTANG INDONESIA
Abstrak
LISNAWITA. Survei dan Sebaran Geografi Nematoda Sista Kentang
Indonesia. Dibimbing oleh MEITY SURADJI SINAGA, GUSTAF ADOLF
WATTIMENA, SUPRAMANA dan GEDE SUASTIKA
Nematoda sista kentang (NSK) merupakan patogen utama yang menginfeksi tanaman kentang dan mempunyai daerah sebaran yang sangat luas di seluruh dunia. Di Indonesia, NSK merupakan patogen baru, yang dapat menjadi kendala utama pada produksi kentang. Melalui metode survei dilakukan penelitian untuk mengetahui sebaran geografi NSK di beberapa sentra pertanaman kentang yaitu Jawa Timur, Jawa Tengah dan Jawa Barat. Survei dilakukan pada 30 lokasi tanaman kentang masing-masing 6 lokasi di Jawa Timur (survei pada Desember 2004), 4 lokasi di Jawa Tengah (survei pada Oktober 2005) dan 20 lokasi di Jawa Barat (survei pada Pebruari 2006 dan 2007). Hasil survei menunjukkan bahwa NSK telah tersebar luas di beberapa wilayah di Jawa Timur, Jawa Tengah dan Jawa Barat dengan kepadatan populasi bervariasi dari rendah hingga tinggi. Kepadatan populasi NSK pada saat survei dilakukan untuk 3 lokasi di Desa Tulung Rejo (Kabupaten Kota Batu, Jawa Timur) berturut-turut adalah 21, 44 dan 675 sista per 100 ml tanah. Untuk Jawa Tengah, kepadatan populasi tertinggi terdapat pada Desa Pawuhan (Kabupaten Banjarnegara), yaitu 400 sista, diikuti dengan Desa Karangtengah (Kabupaten Banjarnegara), yaitu 270 sista, Desa Kepakisan (Kabupaten Banjarnegara) dengan 21 sista dan Desa Petak Bateng (Kabupaten Wonosobo) dengan 2 sista per 100 ml tanah. Sedangkan kepadatan populasi untuk Jawa Barat untuk 3 lokasi di Desa Sukamanah (Kabupaten B&ung) adalah 28 sista, 19 sista dan 2 sista per 100 ml tanah, dan satu lokasi Desa Mekarsari (Kabupaten B&ung) adalah 17 sista per 100 ml tanah
II. SURVEY & GEOGRAPHICAL DISTRIBUTION OF INDONESIAN POTATO CYST NEMATODE
Abstract
LISNAWITA. Survey and Geographical Distribution of Indonesian Potato
Cyst Nematode. Supervised by MEITY SURADJI SINAGA, GUSTAF ADOLF
WATTIMENA, SUPRAMANA and GEDE SUASTIKA
Potato cyst nematode (PCN) is a serious pathogen of potato and is found in most potato producing areas of the world. In Indonesia, PCN was only relatively recently discovered and new recognized as major constraint to potato production. A survey to determine the geographical distribution of PCN in Indonesia in 30 included potato production areas, i.e. 6 locations in East Java (survied in December 2004), 4 locations in Central Java (survied in October 2005) and 20 locations in West Java (survied in February 2006 and 2007). Based on this survey, PCN is widely established in East Java, Central Java and West Java, with population densities varying from low to high. In East Java, the highest population of PCN was found in Desa Tulung (Kota Batu District) with 675 cysts per 100 ml soil. However, two and three locations had only 44 and 21 cysts per 100 ml soil. In Central Java, PCN was detected in Pawuhan (Banjarnegara District) with the high population density 400 cysts per 100 ml soil. PCN was also found in Desa Karangtengah (Banjarnegara District), Desa Kepakisan (Banjarnegara District), and Desa Petak Bateng (Wonosobo District) with 270, 21 and 2 cysts per 100 ml soil, respectively. Populations of PCN were found in four locations in West Java, i.e. 3 locations in Desa Sukamanah (Bandung District) and one in Desa Mekarsari (Bandung District). The population densities from those four locations ranged from 2 to 28 cysts per 100 ml soil.
15
Pendahuluan
Nematoda sista kentang (NSK), Globodera spp. merupakan patogen penting pada pertanaman kentang yang menyebabkan kerusakan dan kehilangan hasil yang cukup besar di dunia (Evans & Turner 1998). Di Indonesia, keberadaan NSK pertama kali ditemukan menyerang pertanaman kentang di Dusun Sumber Brantas Desa Tulung Rejo Kecamatan Bumi Aji Kota Batu Jawa Timur. Daerah ini merupakan salah satu sentra penghasil kentang di Indonesia, sehingga budidaya kentang dilakukan secara besar-besaran. Oleh karena itu diperlukan ketersediaan bibit dalam jumlah yang besar. Untuk memenuhi kebutuhan bibit tersebut, banyak dilakukan impor bibit karena ketersediaan bibit di Indonesia belum memadai, baik secara kuantitas maupun kualitas.
Konsekuensi dari masuknya bibit kentang dari luar negeri ke wilayah Indonesia adalah masuknya organisme pengganggu tumbuhan yang belum ada di Indonesia, terutama yang bersifat tular bibit seperti NSK. NSK merupakan organisme pengganggu tanaman karantina (OPTK) karena potensi merusaknya yang sangat besar pada tanaman kentang, dan tersebar secara pasif bersama tanah atau umbi atau bahan pembiakan vegetatif yang lain. Selain itu, NSK merupakan salah satu patogen tanaman yang sulit dikendalikan, karena kemampuannya bertahan hidup yang sangat tinggi. Patogen ini mampu bertahan hidup di dalam tanah pada stadia dormansi yaitu berbentuk sista hingga mencapai 10 tahun (Taylor 1953 dalam Hamzah 2003) atau bahkan dapat mencapai lebih dari 20 tahun (Jones et al. 1998). Sifat dormansi sista NSK yang sangat panjang, juga dapat berimplikasi pada resistensi NSK di lahan-lahan yang telah terinfestasi.
Sebelum tahun 2003, NSK merupakan OPTK kategori A1, yang berarti tidak boleh masuk ke wilayah Indonesia, tetapi sejak tanggal 27 Januari 2006 berdasarkan Surat Keputusan Menteri Pertanian Nomor 38/Kpts/HK.060/1/ 2006, NSK masuk kategori A2 yaitu OPTK yang sudah berada di dalam Wilayah Negara Republik Indonesia dan dicegah pemencarannya ke daerah/pulau lain yang masih bebas.
Tengah. Di Jawa Timur saat ini petani tidak berani menanam kentang karena tanaman dapat mati pada umur satu bulan karena tingginya populasi NSK, sehingga terjadi penurunan luas pertanaman kentang dari 938,4 ha pada tahun 2003 menjadi 369 ha pada tahun 2006 (Anonimus 2007a). Di Jawa Tengah dilaporkan penyebaran NSK meluas dari 23 ha pada tahun 2003 menjadi 121 ha pada tahun 2006 (Suwardiwijaya et al. 2007).
Walaupun penyebaran NSK semakin luas, tetapi informasi tentang lokasi-lokasi penyebaran dan kepadatan populasi NSK masih sangat terbatas. Oleh karena itu perlu dilakukan survei ke lokasi-lokasi pertanaman kentang di Jawa Timur, Jawa Tengah dan Jawa Barat dan sehingga didapatkan pemetaan sebaran geografi NSK di Indonesia.
Tujuan Penelitian
Penelitian dengan metode survei ke sentra-sentra pertanaman kentang di Jawa Timur, Jawa Tengah dan Jawa Barat bertujuan untuk menentukan daerah sebar geografi NSK di Indonesia.
Metode Penelitian
Tempat dan Waktu
Survei dilaksanakan di sentra pertanaman kentang di di Jawa Timur (Kabupaten Pasuruan dan Kota Batu), Jawa Tengah (Kabupaten Banjarnegara dan Wonosobo) dan Jawa Barat (Kabupaten Bandung). Semua sampel tanah dan akar dibawa dan dianalisis di Laboratorium Nematologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Penelitian dilaksanakan pada bulan Desember 2004 sampai Maret 2007.
Pengumpulan Sampel Tanaman Kentang yang Terinfeksi
17
Barat (Kabupaten Bandung). Pengambilan sampel tanah dan akar tanaman dilakukan dengan mengambil 100 ml contoh tanah pada kedalaman 0-20 cm. Lokasi hamparan pengambilan contoh tanah ditandai dengan GPS (Geo Positioning System) untuk mengukur posisi geografis dan elevasi tanah. Pada setiap lokasi diambil 5 (lima) contoh tanah yang mewakili kondisi lahan pada hamparan tersebut. Pengambilan contoh tanah dilakukan pada 30 lokasi hamparan yang tersebar di 3 (tiga) Propinsi yaitu Jawa Timur (6 lokasi), Jawa Tengah (4 lokasi), dan Jawa Barat (20 lokasi) (Gambar 2.2). Sampel tanah dan akar tanaman dimasukkan ke dalam kantung plastik, diberi label lokasi dan dimasukkan dalam kotak pendingin, selanjutnya dibawa ke Laboratorium Nematologi Tumbuhan Departemen Proteksi Tanaman Fakultas Pertanian IPB. Sebagai informasi tambahan, dari setiap sampel dicatat kultivar kentang dan umur tanaman.
Setiap sampel tanah diekstraksi dengan metode penyaringan (Shepherd 1985), sedangkan contoh akar dicuci dengan hati-hati kemudian dikeringanginkan. Selanjutnya sista yang ada pada sampel tanah dan akar dikumpulkan dengan kuas kecil atau jarum preparat dan jumlah sista per 100 ml tanah dihitung.
Hasil
Survei dan Pengambilan Sampel di lapangan
B
A
C
G bar 2.1 Gejala NSK di lapangan :
Spot-spot kerdil dan daun kekuningan (A dan B).
Betina dan sista pada permukaan akar tanaman kentang (C) am
A
C
19
No. Lokasi Ketinggian tempat (m dpl)
Sista Umur tanaman
Kultivar Kode Tabel 2.1 Daerah sebar NSK di Pulau Jawa dan kode isolat
isolat 1. Desa Tulung Rejo
Kota Batu Jawa Timur (lokasi 1)
1.800 675 >100 Granola S1 kembang
2. Desa Tulung Rejo Kota Batu Jawa Timur (lokasi 2)
1.700 44 40 Granola S2 kembang
Gejala tanaman ya an yang
ng terinfeksi di lapangan sama seperti gejala pada tanam terinfeksi nematoda pada umumnya. Infeksi NSK pada tanaman
m tin b pertu uhan terh at,
tanam ingan, layu dan mati (Gambar 2.1A dan Gambar 2.1B), sedangkan infeksi yang terjadi pada masa generatif, tana kan bi tetapi an berukuran kecil, dan bila tanaman dicabut akan terlihat nematoda betina dan sista yang mene el pa ermu tan n kenta
ah dan sampel
menu K yang terendah (2 sista/100 ml tanah) sampai yang tertinggi (675 sista/100 ml tanah) dapat dilihat pada Tabel 2.1. Kepadatan populasi NSK tertinggi terdapat pada Desa Tulung Rejo (Kabupaten Kota Batu, Jawa ), yaitu 675 sista/100 ml tanah, dan yang terendah terdapat pada Desa Patak Banteng, (Kabupaten W sobo wa Tengah dan Desa Sukam dung, Jawa Barat) (lokasi 3) masing-masing (2
ista/100 ml tanah).
Pembahasan
Hasil survei menunjukkan NSK telah menyebar luas di beberapa wilayah pada p
ung ejo (Kabupaten Kota Batu, Jawa Timur) (lokasi 1), Desa P
menyatakan NSK merupakan nematoda utama yang menyebabkan kerusakan pada uda dengan populasi yang
an kekun
ggi menyeba kan mb tanaman amb
man masih dapat menghasil um umbi yang dihasilk
mp da p kaan akar ama ng (Gambar 2.1C).
Hasil ekstraksi tan njukkan kepadatan NS
akar yang diambil dari lapangan
Timur) (lokasi 1
ono , Ja anah (Kabupaten Ban
s
ertanaman kentang di Jawa Timur, Jawa Tengah dan Jawa Barat. Infeksi NSK dapat terjadi pada semua umur tanaman, mulai tanaman muda hingga tanaman siap panen. Infeksi yang terjadi pada masa vegetatif ditandai dengan gejala daun menguning, layu, pertumbuhan terhambat dan akhirnya tanaman mati muda, sedangkan infeksi pada tanaman yang telah memasuki fase generatif tanaman masih dapat menghasilkan, tetapi umbi yang dihasilkan kecil dengan produksi di bawah rata-rata produksi normal. Pada populasi NSK yang cukup tinggi seperti di Desa Tul R
21
pertanaman kentang di seluruh dunia dan mempunyai sebaran geografi yang sangat luas. Sampai saat ini NSK telah menyebar sedikitnya di 65 negara di seluruh dunia, meliputi negara-negara di seperti Eropa, Asia, Afrika, Amerika Utara, Amerika Tengah, Amerika Selatan dan negara-negara lain. Lebih lanjut Stevenson et al. (2001) menyatakan pada kepadatan populasi NSK yang tinggi gejala pada tanaman ditandai den an tanaman terhambat, tanaman kerdil, m
ebih luas, dibutuhkan monitoring kejadian penyakit secara intensif pada daerah-daerah yang
gan pertumbuh
enguning, layu dan mati muda. Pada akar tanaman yang terinfeksi dapat dijumpai nematoda betina yang berwarna putih hingga kekuningan dan sista yang berwarna coklat.
Terdeteksinya NSK di sentra-sentra pertanaman kentang di Jawa Timur, Jawa Tengah dan Jawa Barat diduga NSK sudah ada di daerah tersebut untuk waktu yang cukup lama. Seperti diketahui penggunaan bibit kentang impor di Jawa Timur sudah berlangsung dalam waktu yang sangat lama. Hal yang sama juga terjadi di Jawa Tengah. Di Jawa Tengah, petani telah menanam kentang sejak tahun 1985 dengan menggunakan bibit asal Jerman (Suwardiwijaya et al. 2007). Kondisi ini memungkinkan bagi NSK untuk mantap di daerah tersebut. Menurut Brodie (1984), untuk dapat terdeteksi dan menyebabkan endemik di suatu daerah, NSK memerlukan waktu sekitar 7 tahun. Hasil yang didapat dari survei ini, dapat menjadi ancaman serius bagi pertanaman kentang lain di Indonesia. Hal ini disebabkan karena NSK merupakan patogen yang sulit dikendalikan. Stevenson et al. (2001) menyatakan, sekali NSK terinfestasi pada suatu lahan, maka nematoda akan tetap ada di lahan tersebut dan tidak mungkin lahan tersebut dapat bersih dari NSK. Oleh karena itu, walaupun jumlah sista NSK di lokasi survei bervariasi dari rendah sampai tinggi, kondisi ini tidak menghalangi untuk terjadinya ledakan penyakit di lokasi tersebut. Di Inggris dilaporkan ambang ekonomi untuk G. rostochiensis adalah 15 telur/ gram tanah. Di Jerman dilaporkan infestasi G. rostochiensis menimbulkan kerugian 11, 27 dan 43% pada kepadatan populasi 100, 1.000 dan 10.000 larva/100 cm3 tanah (CABI 2002). Untuk mencegah penyebaran NSK yang l
vegetatif yang lain, maka masuknya bibit ke suatu daerah perlu pengawasan yang lebih ketat oleh Badan Karantina. Jika tidak ada pengawasan yang ketat, dikhawatirkan penyebaran NSK akan semakin luas.
Hasil survei menunjukkan bahwa semua kultivar kentang yaitu Granola, Granola Kembang dan Atlantik dapat terinfeksi NSK dengan berbagai ketinggian tempat. Hal ini menandakan bahwa sampai saat ini belum ada varietas kentang yang resisten NSK di Indonesia. Tingginya populasi NSK di Jawa Timur (lokasi 1) diduga disebabkan pola tanam petani kentang di daerah tersebut. Di Jawa Timur pola tanam yang digunakan petani adalah monokultur, tetapi lahan akan diberakan pada musim kemarau. Kondisi ini memungkinkan terputusnya siklus hidup patogen lain, tetapi NSK dapat berada dalam kondisi dorman di dalam tanah. Pada saat kentang ditanam kembali sista akan aktif dan menetas, kondisi ini akan meningkatkan populasi NSK. Di Jawa Tengah, petani menanam kentang di sepanjang tahun. Pola tanam seperti ini memungkinkan keberadaan patogen tanah yang lain berkembang baik, sehingga dapat menjadi kompetitor bagi NSK untuk mendapatkan nutrisi dan ruang untuk hidupnya. Kehadiran suatu spesies nematoda dapat mempengaruhi pertumbuhan spesies nematoda yang lain (Norton 1978). Secara umum, kompetisi yang lebih ketat terjadi antara spesies yang mempunyai kebiasaan makan yang sama. Miller & Wihrheim (1968) melaporkan infeksi yang disebabkan oleh Heterodera tabacum akan menurun bila di lokasi tersebut terdapat juga Pratylenchus penetrans atau Tylenchorhynchus claytoni. Esteros & Chen (1972) menemukan kepadatan P. penetrans dan Meloidogyne incognita lebih kecil bila mereka ditemukan bersama di dala akarm tanaman tomat dibandingkan jika mereka hidup secara tunggal. Kehadiran M. incognita dapat menghambat penetrasi P. penetrans jika kedua patogen ada bersama-sama pada akar tanaman.
23
Tengah sangat tinggi, sehingga menyebabkan pengaruh yang tidak baik bagi organisme tanah lainnya. Penggunaan pestisida tanpa aturan menyebabkan organisme bukan sasaran terutama organisme tanah yang menguntungkan ikut mati. Kondisi ini menyebabkan kompetitor maupun musuh alami NSK di daerah tersebut berkurang, sehingga menyebabkan NSK menyebar cepat.
Simpulan
Hasil survei yang dilakukan di lapangan, membuktikan bahwa NSK telah tersebar luas di beberapa wilayah di Jawa Timur, Jawa Tengah dan Jawa Barat, dengan kepadatan populasi rendah hingga tinggi.
Infeksi NSK dapat terjadi pada tanaman muda hingga tanaman menjelang panen, dari ketinggian tempat 1400 m dpl hingga 2100 m dpl. Kultivar kentang yang terinfeksi NSK pda saat survei dilakukan adalah Granola, Granola Kembang dan Atlantik.
MORFOLOGI, MOLEKULER DAN KLON DIFERENSIAL
Abstrak
LISNAWITA. Identifikasi dan Karakterisasi Nematoda Sista Kentang
Indonesia Menggunakan Karakter Morfologi, Molekuler dan Klon
Diferensial. Dibimbing oleh MEITY SURADJI SINAGA, GUSTAF ADOLF
WATTIMENA, SUPRAMANA dan GEDE SUASTIKA
Di Indonesia, NSK adalah patogen baru yang dapat menjadi faktor penghambat produksi kentang. Pengendalian NSK yang efektif memerlukan informasi tentang spesies dan patotipe yang ada, apakah Globodera rostochiensis (patotipe Ro1, Ro2, Ro3, Ro4, Ro5, Ra1, Ra2, Ra3 dan Rb1) atau G. pallida (patotipe Pa1, Pa2, Pa3, Pa1, Pa2, Pa3, Pa4, Pa5 dan Pb1). Penelitian ini bertujuan untuk mengetahui spesies dan patotipe NSK dengan menggunakan karakter morfologi, molekuler dan klon diferensial. Empat populasi NSK, masing-masing 3 populasi dari Jawa Timur dan satu populasi dari Jawa Tengah digunakan untuk pengujian menggunakan karakter morfologi dan klon diferensial. Pengamatan dan pengukuran dilakukan pada sista, juvenil stadia dua (J2), betina, jantan dan telur. Sedangkan pada pengujian teknik molekuler digunakan teknik polymerase chain reaction yang berdasarkan pada amplifikasi daerah internal transcribed spacer dengan menggunakan dua primer spesifik. Sebelas populasi NSK, masing-masing 3 populasi dari Jawa Timur, 4 populasi dari Jawa Tengah dan 4 populasi Jawa Barat digunakan dalam penelitian ini. Hasil analisis berdasarkan pengamatan karakter morfologi berhasil diidentifikasi spesies tunggal G. rostochiensis. Teknik PCR memberikan hasil yang lebih cermat dengan terdeteksinya campuran spesies G. rostochiensis (238 bp) dan G. pallida (391 bp) dari populasi NSK Jawa Tengah. Sedangkan populasi NSK Jawa Timur dan Jawa Barat hanya terdeteksi satu spesies yaitu G. rostochiensis (238 bp). Berdasarkan analisis keragaman genetik dengan program Clustal-W 1,83 didapat isolat Indonesia berada pada kelompok yang berbeda dengan isolat NSK negara lain yang ada di GeneBank. Isolat Indonesia terbagi dalam dua kelompok, yaitu satu kelompok isolat Jawa Timur, dan satu kelompok isolat Jawa Tengah. Pengujian patotipe dengan klon diferensial didapat populasi NSK Jawa Timur menujukkan G. rostochiensis dengan patotipe baru spesifik Indonesia, sedangkan populasi NSK Jawa Tengah merupakan G. rostochiensis patotipe Ro1.
Kata kunci : Nematoda sista kentang, Globodera rostochiensis, G. pallida, polymerase chain reaction, karakter morfologi
1. Bagian dari disertasi ini telah dipublikasikan dalam : 1). J. ISSAAS, Vol. 11, No. 3,
25
III. IDENTIFICATION AND CHARACTERIZATION OF INDONESIAN POTATO CYST NEMATODE USING MORPHOLOGICAL CHARACTERS, MOLECULAR
AND DIFFERENTIAL CLONES
Abstract
LISNAWITA. Identification and Characterization of Indonesian Potato Cyst
Nematode Using Morphological Characters, Molecular, and Differential
Clones. Supervised by MEITY SURADJI SINAGA, GUSTAF ADOLF
WATTIMENA, SUPRAMANA and GEDE SUASTIKA
Potato Cyst Nematode (PCN), a recently discovered a serious pathogen in some potato production areas in Indonesia, is a major constraint to production. To control PCN effectively, it is very important to identify its species and the pathotype in other countries too species with many pathotypes have been identified, Globodera rostochiensis (pathotypes Ro1, Ro2, Ro3, Ro4, Ro5, Ra1, Ra2, Ra3 and Rb1), and G. pallida (pathotypes Pa1, Pa2, Pa3, Pa1, Pa2, Pa3, Pa4, Pa5 and Pb1). Identification of PCN species was based on the morphological and molecular characters. Pathotype testing was conducted using differential clones. Four PCN populations were for morphology and host range, i.e. three populations from Sumber Brantas (Kota Batu District, East Java) and one from Karang Tengah (Banjarnegara District, Central Java). Observation and measurement were conducted on cysts, second stage juveniles (J2), females, and males. For molecular typing, 11 PCN populations from East Java, 4 populations from Central Java, and 4 populations from West Java were used. Polymerase Chain Reaction with specific structure (one for each Globodera species) used to amplify the internal transcribed spacer region of PCN ribosomal DNA. Based on morphological character, all specimens collected from research areas were identified as a single species of golden potato cyst nematode (G. rostochiensis). Whereas amplified DNA fragments, G. rostochiensis 238 bp and G. pallida 391 bp, indicated mixed populations occurred in Central Java. Only a single species, G. rostochiensis, indicated in samples from East Java and West Java by the molecular methods. Based on genetic character analysis with Clustal-W 1.83 program, it was found Indonesian populations had low similarity compared to PCN species lodged in GeneBank. Indonesian populations were separated into two groups, i.e. East Java and Central Java isolates. Clone differentials test showed that PCN population from East Java was G. rostochiensis of a previously undescribed Indonesian specific pathotype, while the population from Central Java was G. rostochiensis with pathotype similar to Ro1.
Key woards : Potato cyst nematode, Globodera rostochiensis, G. pallida, polymerase chain reaction, morphology character
1. Part of the dissertation has been publishes in 1). J. of ISSAAS, Vol. 11, No. 3,
December 2005 (Supplement), with title : Species Identification of Indonesian Potato Cyst Nematode Using Polymerase Chain Reaction (PCR), 2). J . of ISSAAS, Vol. 13, No. 1, June 2007, with title : Technique Identification of Potato Cyst Nematode Populations Prevailing in East and Central Java, Indonesia, Based on Morphometric
Pendahuluan
Spesies Globodera yang dilaporkan menyerang kentang, yaitu G. rostochiensis (nematoda sista kuning atau golden potato cyst nematode) dan G. pallida (nematoda sista putih atau pale potato cyst nematode) (Berg et al. 2000). Masing-masing spesies mempunyai patotipe-patotipe yang respon patologiknya
terhadap kultivar kentang berlainan. Sampai saat ini diketahui ada 8 patotipe yang
digunakan di Eropa, masing-masing 5 patotipe dari G. rostochiensis dan 3 patotipe dari G. pallida (Kort et al. 1977) dan 10 patotipe yang digunakan di Amerika Selatan, masing-masing 4 patotipe dari G. rostochiensis dan 6 patotipe dari G. pallida (Canto Saenz & Scurrah 1977).
Penanaman bibit kentang dari berbagai negara oleh petani kentang di
Indonesia menyebabkan peluang masuknya kedua spesies dengan beberapa
patotipe cukup besar. Sayangnya, informasi spesies dan patotipe serta
karakteristik patogenik dari nematoda sista kentang asal Indonesia sampai saat ini
belum dilaporkan. Informasi spesies dan patotipe dibutuhkan sebagai dasar di
dalam merancang strategi pengendalian yang tepat dan efektif.
Ada beberapa teknik yang dapat dilakukan untuk identifikasi spesies NSK,
yaitu secara konvensional, misalnya dengan pengamatan dan pengukuran ciri-ciri
morfologi (morfometri), uji serologi (Schots 1988) dan teknik molekuler misalnya
dengan menggunakan sidik jari DNA melalui PCR-RFLP (Fleming & Powers
1998). Sedangkan untuk mengetahui patotipe-patotipe NSK dapat dilakukan
dengan pengujian menggunakan klon diferensial.
Morfologi dan morfometri masih digunakan bersama-sama dengan teknik
molekuler untuk identifikasi spesies nematoda sista kentang (Baldwin &
Mundo-ocampo 1991). G. rostochiensis dan G. pallida secara morfologi dan morfometri hanya memiliki sedikit perbedaan (Stone 1973a & 1973b). Oleh karena itu
pengamatan beberapa karakter pada sista dan juvenil stadia dua (J2) merupakan
kegiatan yang paling penting yang direkomendasikan untuk identifikasi spesies
NSK secara konvensional. Kedua stadia ini selalu ditemukan pada sampel tanah
yang telah terinfestasi NSK, di samping itu juga dilakukan pengamatan terhadap
27
Klon diferensial atau tanaman indikator, merupakan salah satu cara untuk
mengkarakterisasi masing-masing isolat berdasarkan kesesuaian pada suatu inang.
Pada NSK klon diferensial mempunyai peranan yang sangat penting untuk
membedakan patotipe. Patotipe tertentu hanya mampu bermultiplikasi pada inang
tertentu, sehingga terdapat hubungan antara spesies yang resisten dengan patotipe
NSK. Gen resisten pada tanaman kentang ada yang bersifat monogenik (gen
major) atau poligenik (gen minor). Gen-gen monogenik tersebut adalah gen H1,
H2, H3, gen A, B, dan gen Fa, Fb. Kespesifikan tanaman inang NSK
menyebabkan pengujian klon diferensial sering dilakukan untuk karakterisasi
spesies yang belum diketahui (Fleming & Powers 1998 ; Hull 2002).
Saat ini untuk keperluan identifikasi lebih cepat dan akurat, telah
dikembangkan teknik identifikasi dengan menggunakan pendekatan biologi
molekuler. Metode ini menggunakan struktur asam nukleat sebagai dasar untuk
mengkarakterisasi dan mengidentifikasi patogen tanaman. Identifikasi nematoda
sista kentang banyak menggunakan teknik polymerase chain reaction (PCR). Polymerase chain reaction (PCR) adalah suatu metode in vitro untuk mensintesis asam nukleat berdasarkan cetakan DNA. Dengan teknik PCR masalah
jumlah DNA yang rendah per individu dapat teratasi. Fragmen DNA genom
nematoda yang menjadi sasaran analisa diamplifikasi terlebih dahulu dengan PCR.
Hasil analisis genom nematoda, adalah informasi bahwa bagian internal transcribed spacer (ITS) dari rDNA merupakan daerah yang sangat variabel sehingga dapat berfungsi sebagai penanda spesifik dalam studi taksonomi
molekuler dan pilogenik sehingga sering digunakan untuk analisa patotipe suatu
populasi nematoda (Thiery & Mugniery 1996).
Pengujian dengan teknik PCR memerlukan dua primer oligonukleotida
spesifik yang akan menginduksi pembentukan dan perbanyakan asam nukleat atau
untai DNA dengan bantuan enzim Taq polymerase dalam mesin PCR atau thermocycler (Saiki 1990). Pemilihan primer yang tepat sangat menentukan keberhasilan identifikasi suatu patogen. Dalam bidang fitopatologi, teknik PCR
banyak digunakan untuk tujuan deteksi patogen, identifikasi patogen,
karekterisasai keanekaragaman patogen, maupun untuk diferensiasi patogen
Tujuan Penelitian
Tujuan penelitian ini adalah mengidentifikasi dan mengkarakterisasi
spesies NSK dengan menggunakan karakter morfologi dan molekuler serta
mengetahui patotipe NSK dengan menggunakan klon diferensial.
Metode Penelitian
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Nematologi Tumbuhan dan
Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Fakultas
Pertanian IPB serta rumah kassa Kebun Percobaan desa Cipelang Cijeruk, dengan
ketinggian tempat 1250 m dpl. Penelitian dilaksanakan dari bulan Agustus 2005
sampai Maret 2007.
Identifikasi Spesies NSK berdasarkan Karakter Morfologi
Populasi nematoda sista kentang
Untuk identifikasi spesies dengan menggunakan karakter morfologi dan
morfometri tidak semua isolat NSK digunakan. Dari 11 isolat NSK yang ada,
hanya 4 isolat NSK yang digunakan pada percobaan ini, yaitu isolat-isolat yang
ditemukan pada survei tahun pertama (S1, S2, S3 dan S4). Sedangkan isolat-isolat
lainnya tidak diidentifikasi dengan karakter morfologi karena kepadatan populasi
yang rendah dan akan diidentifikasi dengan menggunakan karakter molekuler.
Dua puluh lima betina dan 25 sista dikumpulkan pada tempat terpisah.
Pembuatan preparat untuk betina dilakukan dengan memotong betina menjadi dua
bagian, kemudian masing-masing bagian diletakkan pada gelas objek yang telah
ditetesi dengan Hoyer (30 gram gum arabik, 200 gram kloral hidrat, 16 gram
gliserol dan 200 ml akuades) lalu ditutup dengan gelas penutup.
Pembuatan preparat untuk sista dilakukan dengan memotong bagian
29
potongan sista dipindahkan ke atas gelas objek yang telah ditetesi dengan Hoyer
dan ditutup dengan gelas penutup.
Pembuatan preparat untuk juvenil stadia 2 (J2), jantan dan telur dilakukan
dengan mengumpulkan masing-masing 50 J2, 50 jantan dan 50 telur pada tempat
terpisah, kemudian nematoda dimatikan dengan pemanasan lalu diletakkan pada
gelas objek yang telah ditetesi lactophenol cotton blue dan kemudian ditutup dengan gelas penutup.
Pengamatan
Pengukuran dilakukan dengan mengambil gambar setiap sampel di bawah
mikroskop Olympus BX 51 dengan perbesaran 40x (10 x 4) untuk sista dan betina.
Perbesaran 200x (10 x 20) untuk J2, jantan dan telur dengan menggunakan
kamera digital mikroskop Olympus DP 11. Selanjutnya foto ditransfer
menggunakan program morfometri tpsdig (Bennet & Hoffman 1998). Penentuan titik (digitasi) pada setiap gambar dilakukan dengan menentukan secara konsisten
titik-titik masing-masing variabel. Setiap titik dari gambar pemotretan digitasi
diubah dalam kordinat x dan y sehingga dapat diketahui jarak antar titiknya,
kemudian dimasukkan dalam persamaan jarak dengan menggunakan program
Microsoft Exel, sehingga diperolah jarak yang sesungguhnya, yaitu :
DV(mm) =
√
((X1 – X2)2 + (Y2 – Y2)2) (persamaan jarak-1)DS(mm) = DV / DP (persamaan jarak-2)
Dimana :
DV(mm) = jarak vektor,
DS(mm) = jarak sesungguhnya,
DP = jarak perbesaran mikroskop,
X1, X2, Y1, Y2 = titik-titik vektor pada sumbu X dan Y
Hasil digitasi setiap variabel berbentuk vektor yang kemudian dikonversi
dalam ukuran sesungguhnya dengan cara nilai vektor dibagi dengan 399,99. Nilai
ini diperoleh dari penentuan titik skala mikrometer (sepanjang 1 mm) pada