SKRIPSI
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
Oleh
RATNA BATARI
F24103120
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
RATNA BATARI
F24103120
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
RATNA BATARI
F24103120
Dilahirkan pada tanggal 9 Januari 1985 Di Jakarta
Tanggal lulus : Agustus 2007 Menyetujui:
Bogor, Agustus 2007
Dr. Ir. Nuri Andarwulan, MSi. Prof. Dr. Ir. C. Hanny Wijaya, MAgr.
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Jakarta, 9 Januari 1985 dan memiliki nama lengkap Ratna Batari. Penulis merupakan anak kedua dari tiga bersaudara. Penulis menempuh pendidikannya di TK Kristen 7 BPK Penabur, SD Kristen 3 BPK Penabur, SLTP Kristen 3 BPK Penabur, dan SMU Kristen 3 BPK Penabur, Jakarta. Melalui jalur masuk SPMB, penulis menempuh pendidikan terakhirnya di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Selama melakukan studi di Departemen Ilmu dan Teknologi Pangan, penulis juga aktif dalam berbagai kegiatan dan organisasi. Penulis pernah menjabat sebagai sekretaris di Persekutuan PMK dan KEMAKI Fakultas Teknologi Pertanian pada masa jabatan 2004-2005, dan sebagai bendahara pada masa jabatan 2005-2006. Penulis juga berperan serta sebagai panitia dalam kegiatan Konferensi HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia), BAUR 2005, dan LCTIP (Lomba Cepat Tepat Ilmu Pangan) 2005. Pada tahun 2005, penulis ikut ambil bagian dalam seminar dan pelatihan HACCP yang diselenggarakan oleh Departemen Ilmu dan Teknologi Pangan, IPB dan BPOM-RI. Penulis pernah menjadi asisten praktikum Analisis Pangan pada periode Januari-Juni 2007.
Ratna Batari. F24103120. Identifikasi Senyawa Flavonoid pada Sayuran Indigenous Jawa Barat. Di bawah bimbingan Dr. Ir. Nuri Andarwulan, MSi.
dan Prof. Dr. Ir. C. Hanny Wijaya, MAgr. (2007)
RINGKASAN
Indonesia memiliki tanaman lokal yang sangat berlimpah. Tanaman lokal di Indonesia banyak yang belum terjamah untuk dikonsumsi sebagai bahan pangan yang kaya akan zat-zat yang bermanfaat bagi tubuh dan kesehatan. Jenis sayuran lokal tersebutlah yang dikenal dengan sayuran indigenous. Salah satu daerah di Indonesia yang merupakan penghasil sayuran indigenous yang cukup berperan adalah daerah Jawa Barat. Komponen fenolik dalam bahan pangan memiliki peran yang sangat baik, yang salah satunya adalah sebagai antioksidan. Sayur-sayuran banyak mengandung senyawa fenolik yang berupa flavonoid. Penelitian-penelitian terdahulu telah membuktikan bahwa flavonoid dapat berfungsi sebagai antioksidan, antimutagenik, dan antikarsinogenik. Oleh karena itu, pemanfaatan sayuran indigenous sebagai sumber flavonoid akan dapat meningkatkan nilai tambah tanaman-tanaman tersebut.
Penelitian ini bertujuan mengidentifikasi senyawa flavonoid yang berupa flavonol dan flavone pada beberapa sayuran indigenous daerah Jawa Barat. Tanaman yang digunakan dalam penelitian ini adalah kenikir (Cosmos caudatus H.B.K.), beluntas (Pluchea indica Less.), mangkokan (Nothopanax scutellarium), kecombrang (Nicolaia speciosa Horan), kemangi (Ocimum sanctum Linn.), katuk (Sauropus androgynus), kedondong cina (Polyscias pinnata), antanan (Centella asiatica), pohpohan (Pilea trinervia), daun ginseng (Talinum paniculatum), dan krokot (Portulaca oleracea).Pembuatan ekstrak flavonoid dari sayuran dilakukan dengan menggunakan campuran pelarut air dan metanol. Selain itu, dilakukan pula pembuatan kurva standar flavonoid yang digunakan sebagai acuan dalam penentuan komponen tersebut pada sampel. Standar yang digunakan adalah quercetin, kaempferol, myricetin, apigenin, dan luteolin. Analisis yang dilakukan yaitu analisis kadar air, analisis total fenol, dan deteksi flavonoid dengan menggunakan HPLC column C-18 phase; Develosil ODS-UG-3.
KATA PENGANTAR
Puji Syukur kepada Tuhan Yesus Kristus karena atas berkat-Nya lah skripsi ini dapat saya selesaikan. Selama mengerjakan tugas akhir ini, penulis dibantu oleh banyak pihak, oleh karena itu penulis mengucapkan terima kasih kepada :
1. Dr. Ir. Nuri Andarwulan, MSi. selaku Dosen Pembimbing Akademik sekaligus Dosen Pembimbing Skripsi. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama ini.
2. Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku Dosen Pembimbing II. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama saya menyelesaikan tugas akhir saya.
3. Dr. Ir. Endang Prangdimurti, MSi. selaku dosen penguji. Terima kasih atas kesediaan Ibu sebagai penguji.
4. My family : Mama, Ci Indra, Brian, dan Diana. Terima kasih telah memberikan doa, semangat, dan dukungannya.
5. Ci Ingrid, yang telah sangat banyak mengajariku banyak hal dalam mengerjakan dan menyelesaikan penelitianku.
6. Sahabat-sahabatku : 6 Sense (Albo, CK, Mercon, Dina, Titi), JSMP (Olla, Bebe, Nat2, Pau2, Indi, Dei, Betsy, Fani), terima kasih atas semangat dan dukungan kalian.
7. Teman-teman satu bimbingan Bu Nuri : Olla, Dion, dan Ade. Semangat yah buat jeruk-jeruknya. Terima kasih atas dukungan dan kesediaan kalian yang selalu mau mendengarkan keluh kesahku. Terima kasih juga buat Papang, atas pemberian sampel-sampelnya. Auu, Lia, Anca, dan teman-teman ITP 42, terima kasih atas dukungan dan semangatnya.
8. Teman-teman satu bimbingan Bu Hanny : Bebe, Eko, Dei, Tuti, teman-teman ITP 39, 41 dan 42. Terima kasih atas semangat dan dukungannya selama ini. Terima kasih untuk sebuah perkumpulan bimbingan yang menyenangkan.
10.Teman-teman ITP 40 : Jeng2 (terima kasih atas pinjaman laptopnya), Aji, Rika, Tya, Agnes, Anas, Meiko, Agus, Andal, Steph, Babe, Martin, Wayan, Rina, Tathan, Arie, Adiput, Adie MR, Mardi, Hendy, Nooi, Idham, Lasty, dan semua teman-teman yang tidak dapat disebutkan satu persatu. Terima kasih untuk semua dukungan, semangat, dan persahabatan selama 4 tahun ini.
11.Teman-teman ITP 39, ITP 41, dan ITP 42, serta Fajar, Yeye, dan Fiona. Terima kasih untuk semua dukungan dan semangatnya.
12.Teman-teman di Perwira 52 : Chris, Echie, Ribka, Kezhia, Yola, Lele, dan yang lainnya. Terima kasih atas semangat, dukungan, dan kebersamaan yang indah.
13.Pak Soenar, Mba Nani, Mba Desi, Mba Nia, dan Mba Irin. Terima kasih telah membantu saya dalam mengajari tentang HPLC.
14.Para teknisi di Laboratorium ITP : Pak Sobirin, Pak Wahid, Pak Rojak, Mba Darsih, dan teknisi lainnya yang telah membantu saya dalam menyelesaikan penelitian saya.
15.Para pekerja di Seafast Center : Pak Ijul, Ibu Tri Susilowati, Ibu Tri Haryati, Pak Karna, Pak Denny, Ibu Ani, Pak Taufik, Mba Ari, dan lainnya. Terima kasih telah membantu saya dalam menyelesaikan penelitian saya.
16.Semua pihak yang telah membantu yang tidak dapat disebutkan satu-persatu.
Semoga skripsi ini bermanfaat bagi setiap pembacanya. Penulis memohon maaf bila ada kata-kata dan hal-hal yang kurang berkenan.
Bogor, Agustus 2007
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
C. IDENTIFIKASI SENYAWA FLAVONOID ... 30
III. BAHAN DAN METODE ... 33
A. BAHAN DAN ALAT ... 33
1. Bahan ... 33
2. Alat ... 33
B. METODE ... 34
1. Persiapan Sampel ... 34
2. Analisis Kadar Air ... 35
3. Analisis Total Fenol ... 36
4. Ekstraksi Senyawa Flavonoid dari Sayuran Indigenous ... 37
5. Analisis Flavonoid dengan HPLC ... 37
IV. HASIL DAN PEMBAHASAN ... 44
A. STANDAR FLAVONOID DAN LIMIT DETEKSI ... 44
1. Myricetin ... 44
2. Luteolin ... 45
3. Quercetin ... 46
4. Apigenin ... 58
6. Standar Campuran Senyawa Flavonoid ... 52
B. STANDAR ASAM GALAT ... 55
C. SENYAWA FLAVONOID PADA SAYURAN INDIGENOUS ... 56
1. Kenikir ... 62
2. Beluntas ... 65
3. Mangkokan ... 66
4. Kecombrang ... 69
5. Kemangi ... 70
6. Katuk ... 72
7. Kedondong Cina ... 78
8. Antanan ... 79
9. Pohpohan ... 81
10. Daun Ginseng ... 85
11. Krokot ... 89
D. SENYAWA YANG BELUM TERIDENTIFIKASI PADA SAYURAN INDIGENOUS ... 92
V. KESIMPULAN DAN SARAN ... 97
A. KESIMPULAN ... 97
B. SARAN ... 97
DAFTAR TABEL
Tabel 1. Komposisi kimia daun kemangi per 100 gram bagian yang dapat
dimakan ... 15
Tabel 2. Komposisi kimia daun katuk per 100 gram bagian yang dapat dimakan ... 18
Tabel 3. Spesifikasi HPLC ... 34
Tabel 4. Limit deteksi myricetin ... 45
Tabel 5. Limit deteksi luteolin ... 48
Tabel 6. Limit deteksi quercetin ... 48
Tabel 7. Limit deteksi apigenin ... 50
Tabel 8. Limit deteksi kaempferol ... 52
Tabel 9. Hasil perhitungan konsentrasi flavonoid pada sampel dengan menggunakan kurva standar ... 58
Tabel 10.Hasil perhitungan konsentrasi flavonoid pada sampel dengan menggunakan eksternal standar ... 59
Tabel 11.Rekapitulasi hasil kadar air, total flavonoid, dan total fenol pada sampel ... 60
Tabel 12. Perbandingan hasil analisis flavonol dan flavone dengan perhitungan kurva standar campuran dan eksternal standar campuran ... 61
Tabel 13. Perbandingan luasan area kromatografi ekstrak kenikir ... 65
Tabel 14. Perbandingan luasan area kromatografi ekstrak beluntas ... 66
Tabel 15. Perbandingan luasan area kromatografi ekstrak mangkokan ... 69
Tabel 16. Perbandingan luasan area kromatografi ekstrak kecombrang ... 70
Tabel 17. Perbandingan luasan area kromatografi ekstrak kemangi ... 71
Tabel 18. Perbandingan luasan area kromatografi ekstrak katuk ... 78
Tabel 19. Perbandingan luasan area kromatografi ekstrak kedondong cina ... 79
Tabel 20. Perbandingan luasan area kromatografi ekstrak antanan ... 81
Tabel 21. Perbandingan luasan area kromatografi ekstrak pohpohan ... 85
Tabel 22. Perbandingan luasan area kromatografi ekstrak daun ginseng ... 87
Tabel 23. Perbandingan luasan area kromatografi ekstrak krokot ... 90
Tabel 24. Rekapitulasi komponen yang terdeteksi pada sampel dengan menggunakan HPLC ... 95
SKRIPSI
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
Oleh
RATNA BATARI
F24103120
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
RATNA BATARI
F24103120
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
IDENTIFIKASI SENYAWA FLAVONOID PADA SAYURAN
INDIGENOUS JAWA BARAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
RATNA BATARI
F24103120
Dilahirkan pada tanggal 9 Januari 1985 Di Jakarta
Tanggal lulus : Agustus 2007 Menyetujui:
Bogor, Agustus 2007
Dr. Ir. Nuri Andarwulan, MSi. Prof. Dr. Ir. C. Hanny Wijaya, MAgr.
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Jakarta, 9 Januari 1985 dan memiliki nama lengkap Ratna Batari. Penulis merupakan anak kedua dari tiga bersaudara. Penulis menempuh pendidikannya di TK Kristen 7 BPK Penabur, SD Kristen 3 BPK Penabur, SLTP Kristen 3 BPK Penabur, dan SMU Kristen 3 BPK Penabur, Jakarta. Melalui jalur masuk SPMB, penulis menempuh pendidikan terakhirnya di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Selama melakukan studi di Departemen Ilmu dan Teknologi Pangan, penulis juga aktif dalam berbagai kegiatan dan organisasi. Penulis pernah menjabat sebagai sekretaris di Persekutuan PMK dan KEMAKI Fakultas Teknologi Pertanian pada masa jabatan 2004-2005, dan sebagai bendahara pada masa jabatan 2005-2006. Penulis juga berperan serta sebagai panitia dalam kegiatan Konferensi HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia), BAUR 2005, dan LCTIP (Lomba Cepat Tepat Ilmu Pangan) 2005. Pada tahun 2005, penulis ikut ambil bagian dalam seminar dan pelatihan HACCP yang diselenggarakan oleh Departemen Ilmu dan Teknologi Pangan, IPB dan BPOM-RI. Penulis pernah menjadi asisten praktikum Analisis Pangan pada periode Januari-Juni 2007.
Ratna Batari. F24103120. Identifikasi Senyawa Flavonoid pada Sayuran Indigenous Jawa Barat. Di bawah bimbingan Dr. Ir. Nuri Andarwulan, MSi.
dan Prof. Dr. Ir. C. Hanny Wijaya, MAgr. (2007)
RINGKASAN
Indonesia memiliki tanaman lokal yang sangat berlimpah. Tanaman lokal di Indonesia banyak yang belum terjamah untuk dikonsumsi sebagai bahan pangan yang kaya akan zat-zat yang bermanfaat bagi tubuh dan kesehatan. Jenis sayuran lokal tersebutlah yang dikenal dengan sayuran indigenous. Salah satu daerah di Indonesia yang merupakan penghasil sayuran indigenous yang cukup berperan adalah daerah Jawa Barat. Komponen fenolik dalam bahan pangan memiliki peran yang sangat baik, yang salah satunya adalah sebagai antioksidan. Sayur-sayuran banyak mengandung senyawa fenolik yang berupa flavonoid. Penelitian-penelitian terdahulu telah membuktikan bahwa flavonoid dapat berfungsi sebagai antioksidan, antimutagenik, dan antikarsinogenik. Oleh karena itu, pemanfaatan sayuran indigenous sebagai sumber flavonoid akan dapat meningkatkan nilai tambah tanaman-tanaman tersebut.
Penelitian ini bertujuan mengidentifikasi senyawa flavonoid yang berupa flavonol dan flavone pada beberapa sayuran indigenous daerah Jawa Barat. Tanaman yang digunakan dalam penelitian ini adalah kenikir (Cosmos caudatus H.B.K.), beluntas (Pluchea indica Less.), mangkokan (Nothopanax scutellarium), kecombrang (Nicolaia speciosa Horan), kemangi (Ocimum sanctum Linn.), katuk (Sauropus androgynus), kedondong cina (Polyscias pinnata), antanan (Centella asiatica), pohpohan (Pilea trinervia), daun ginseng (Talinum paniculatum), dan krokot (Portulaca oleracea).Pembuatan ekstrak flavonoid dari sayuran dilakukan dengan menggunakan campuran pelarut air dan metanol. Selain itu, dilakukan pula pembuatan kurva standar flavonoid yang digunakan sebagai acuan dalam penentuan komponen tersebut pada sampel. Standar yang digunakan adalah quercetin, kaempferol, myricetin, apigenin, dan luteolin. Analisis yang dilakukan yaitu analisis kadar air, analisis total fenol, dan deteksi flavonoid dengan menggunakan HPLC column C-18 phase; Develosil ODS-UG-3.
KATA PENGANTAR
Puji Syukur kepada Tuhan Yesus Kristus karena atas berkat-Nya lah skripsi ini dapat saya selesaikan. Selama mengerjakan tugas akhir ini, penulis dibantu oleh banyak pihak, oleh karena itu penulis mengucapkan terima kasih kepada :
1. Dr. Ir. Nuri Andarwulan, MSi. selaku Dosen Pembimbing Akademik sekaligus Dosen Pembimbing Skripsi. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama ini.
2. Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku Dosen Pembimbing II. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama saya menyelesaikan tugas akhir saya.
3. Dr. Ir. Endang Prangdimurti, MSi. selaku dosen penguji. Terima kasih atas kesediaan Ibu sebagai penguji.
4. My family : Mama, Ci Indra, Brian, dan Diana. Terima kasih telah memberikan doa, semangat, dan dukungannya.
5. Ci Ingrid, yang telah sangat banyak mengajariku banyak hal dalam mengerjakan dan menyelesaikan penelitianku.
6. Sahabat-sahabatku : 6 Sense (Albo, CK, Mercon, Dina, Titi), JSMP (Olla, Bebe, Nat2, Pau2, Indi, Dei, Betsy, Fani), terima kasih atas semangat dan dukungan kalian.
7. Teman-teman satu bimbingan Bu Nuri : Olla, Dion, dan Ade. Semangat yah buat jeruk-jeruknya. Terima kasih atas dukungan dan kesediaan kalian yang selalu mau mendengarkan keluh kesahku. Terima kasih juga buat Papang, atas pemberian sampel-sampelnya. Auu, Lia, Anca, dan teman-teman ITP 42, terima kasih atas dukungan dan semangatnya.
8. Teman-teman satu bimbingan Bu Hanny : Bebe, Eko, Dei, Tuti, teman-teman ITP 39, 41 dan 42. Terima kasih atas semangat dan dukungannya selama ini. Terima kasih untuk sebuah perkumpulan bimbingan yang menyenangkan.
10.Teman-teman ITP 40 : Jeng2 (terima kasih atas pinjaman laptopnya), Aji, Rika, Tya, Agnes, Anas, Meiko, Agus, Andal, Steph, Babe, Martin, Wayan, Rina, Tathan, Arie, Adiput, Adie MR, Mardi, Hendy, Nooi, Idham, Lasty, dan semua teman-teman yang tidak dapat disebutkan satu persatu. Terima kasih untuk semua dukungan, semangat, dan persahabatan selama 4 tahun ini.
11.Teman-teman ITP 39, ITP 41, dan ITP 42, serta Fajar, Yeye, dan Fiona. Terima kasih untuk semua dukungan dan semangatnya.
12.Teman-teman di Perwira 52 : Chris, Echie, Ribka, Kezhia, Yola, Lele, dan yang lainnya. Terima kasih atas semangat, dukungan, dan kebersamaan yang indah.
13.Pak Soenar, Mba Nani, Mba Desi, Mba Nia, dan Mba Irin. Terima kasih telah membantu saya dalam mengajari tentang HPLC.
14.Para teknisi di Laboratorium ITP : Pak Sobirin, Pak Wahid, Pak Rojak, Mba Darsih, dan teknisi lainnya yang telah membantu saya dalam menyelesaikan penelitian saya.
15.Para pekerja di Seafast Center : Pak Ijul, Ibu Tri Susilowati, Ibu Tri Haryati, Pak Karna, Pak Denny, Ibu Ani, Pak Taufik, Mba Ari, dan lainnya. Terima kasih telah membantu saya dalam menyelesaikan penelitian saya.
16.Semua pihak yang telah membantu yang tidak dapat disebutkan satu-persatu.
Semoga skripsi ini bermanfaat bagi setiap pembacanya. Penulis memohon maaf bila ada kata-kata dan hal-hal yang kurang berkenan.
Bogor, Agustus 2007
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
C. IDENTIFIKASI SENYAWA FLAVONOID ... 30
III. BAHAN DAN METODE ... 33
A. BAHAN DAN ALAT ... 33
1. Bahan ... 33
2. Alat ... 33
B. METODE ... 34
1. Persiapan Sampel ... 34
2. Analisis Kadar Air ... 35
3. Analisis Total Fenol ... 36
4. Ekstraksi Senyawa Flavonoid dari Sayuran Indigenous ... 37
5. Analisis Flavonoid dengan HPLC ... 37
IV. HASIL DAN PEMBAHASAN ... 44
A. STANDAR FLAVONOID DAN LIMIT DETEKSI ... 44
1. Myricetin ... 44
2. Luteolin ... 45
3. Quercetin ... 46
4. Apigenin ... 58
6. Standar Campuran Senyawa Flavonoid ... 52
B. STANDAR ASAM GALAT ... 55
C. SENYAWA FLAVONOID PADA SAYURAN INDIGENOUS ... 56
1. Kenikir ... 62
2. Beluntas ... 65
3. Mangkokan ... 66
4. Kecombrang ... 69
5. Kemangi ... 70
6. Katuk ... 72
7. Kedondong Cina ... 78
8. Antanan ... 79
9. Pohpohan ... 81
10. Daun Ginseng ... 85
11. Krokot ... 89
D. SENYAWA YANG BELUM TERIDENTIFIKASI PADA SAYURAN INDIGENOUS ... 92
V. KESIMPULAN DAN SARAN ... 97
A. KESIMPULAN ... 97
B. SARAN ... 97
DAFTAR TABEL
Tabel 1. Komposisi kimia daun kemangi per 100 gram bagian yang dapat
dimakan ... 15
Tabel 2. Komposisi kimia daun katuk per 100 gram bagian yang dapat dimakan ... 18
Tabel 3. Spesifikasi HPLC ... 34
Tabel 4. Limit deteksi myricetin ... 45
Tabel 5. Limit deteksi luteolin ... 48
Tabel 6. Limit deteksi quercetin ... 48
Tabel 7. Limit deteksi apigenin ... 50
Tabel 8. Limit deteksi kaempferol ... 52
Tabel 9. Hasil perhitungan konsentrasi flavonoid pada sampel dengan menggunakan kurva standar ... 58
Tabel 10.Hasil perhitungan konsentrasi flavonoid pada sampel dengan menggunakan eksternal standar ... 59
Tabel 11.Rekapitulasi hasil kadar air, total flavonoid, dan total fenol pada sampel ... 60
Tabel 12. Perbandingan hasil analisis flavonol dan flavone dengan perhitungan kurva standar campuran dan eksternal standar campuran ... 61
Tabel 13. Perbandingan luasan area kromatografi ekstrak kenikir ... 65
Tabel 14. Perbandingan luasan area kromatografi ekstrak beluntas ... 66
Tabel 15. Perbandingan luasan area kromatografi ekstrak mangkokan ... 69
Tabel 16. Perbandingan luasan area kromatografi ekstrak kecombrang ... 70
Tabel 17. Perbandingan luasan area kromatografi ekstrak kemangi ... 71
Tabel 18. Perbandingan luasan area kromatografi ekstrak katuk ... 78
Tabel 19. Perbandingan luasan area kromatografi ekstrak kedondong cina ... 79
Tabel 20. Perbandingan luasan area kromatografi ekstrak antanan ... 81
Tabel 21. Perbandingan luasan area kromatografi ekstrak pohpohan ... 85
Tabel 22. Perbandingan luasan area kromatografi ekstrak daun ginseng ... 87
Tabel 23. Perbandingan luasan area kromatografi ekstrak krokot ... 90
Tabel 24. Rekapitulasi komponen yang terdeteksi pada sampel dengan menggunakan HPLC ... 95
DAFTAR GAMBAR
Gambar 1. Kenikir (Cosmos caudatus H.B.K) ... 6
Gambar 2. Beluntas (Pluchea indica Less.) ... 8
Gambar 3. Mangkokan (Notophanax scutellarium) ... 10
Gambar 4. Tanaman kecombrang (Nicolaia speciosa Horan) ... 13
Gambar 5. Bunga kecombrang ... 13
Gambar 6. Kemangi (Ocimum sanctum Linn.) ... 16
Gambar 7. Katuk (Sauropus androgynus) ... 18
Gambar 8. Kedondong Cina (Polyscias pinnata) ... 19
Gambar 9. Antanan (Centella asiatica) ... 21
Gambar 10. Pohpohan (Pilea trinervia) ... 22
Gambar 11. Daun ginseng (Talinum paniculatum) ... 24
Gambar 12. Krokot (Portulaca oleracea) ... 26
Gambar 13. Struktur kimia flavonol dan flavone yang diidentifikasi... 27
Gambar 14. Persiapan sampel ... 40
Gambar 15. Prosedur analisis total fenol ... 41
Gambar 16. Proses pembuatan ekstrak flavonoid dari sayuran indigenous ... 42
Gambar 17. Pembuatan larutan standar flavonoid ... 43
Gambar 18. Kromatogram standar myricetin ... 44
Gambar 19. Kurva standar myricetin ... 45
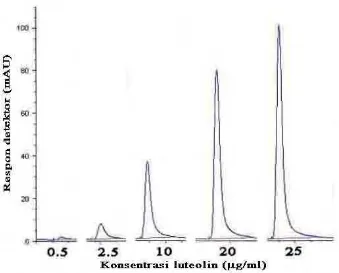
Gambar 20. Kromatogram standar luteolin... 46
Gambar 21. Kurva standar luteolin ... 46
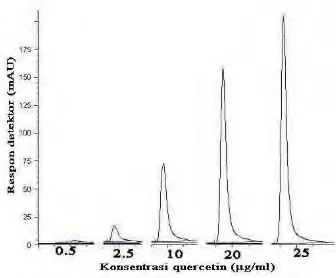
Gambar 22. Kromatogram standar quercetin ... 47
Gambar 23. Kurva standar quercetin ... 47
Gambar 24. Kromatogram standar apigenin ... 49
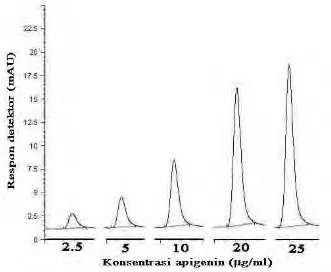
Gambar 25. Kurva standar apigenin ... 50
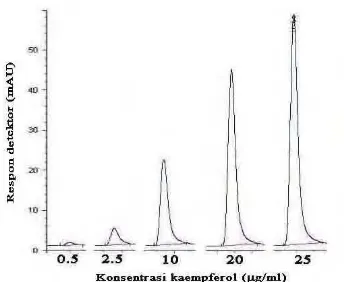
Gambar 26. Kromatogram standar kaempferol... 51
Gambar 27. Kurva standar kaempferol ... 51
Gambar 28. Kromatogram standar campuran ... 53
Gambar 29. Kurva standar campuran myricetin ... 54
Gambar 31. Kurva standar campuran quercetin... 54 Gambar 32. Kurva standar campuran apigenin ... 54 Gambar 33. Kurva standar campuran kaempferol ... 55 Gambar 34. Kurva standar asam galat (ulangan 1) ... 55 Gambar 35. Kurva standar asam galat (ulangan 2) ... 56 Gambar 36. Kurva standar asam galat (ulangan 3) ... 56 Gambar 37. Kromatogram ekstrak kenikir ... 64 Gambar 38. Ko-kromatogram ekstrak kenikir dengan standar campuran ... 64 Gambar 39. Kromatogram ekstrak beluntas ... 68 Gambar 40. Ko-kromatogram ekstrak beluntas dengan standar campuran ... 68 Gambar 41. Kromatogram ekstrak mangkokan ... 73 Gambar 42. Ko-kromatogram ekstrak mangkokan dengan standar campuran .... 73 Gambar 43. Kromatogram ekstrak kecombrang ... 74 Gambar 44. Ko-kromatogram ekstrak kecombrang dengan standar campuran ... 74 Gambar 45. Kromatogram ekstrak kemangi ... 75 Gambar 46. Ko-kromatogram ekstrak kemangi dengan standar campuran ... 75 Gambar 47. Kromatogram ekstrak katuk ... 77 Gambar 48. Ko-kromatogram ekstrak katuk dengan standar campuran ... 77 Gambar 49. Kromatogram ekstrak kedondong cina ... 82 Gambar 50. Ko-kromatogram ekstrak kedondong cina dengan standar
campuran ... 82 Gambar 51. Kromatogram ekstrak antanan ... 83
Gambar 52. Ko-kromatogram ekstrak antanan dengan standar campuran ... 83 Gambar 53. Kromatogram ekstrak pohpohan ... 86 Gambar 54. Ko-kromatogram ekstrak pohpohan dengan standar campuran ... 86 Gambar 55. Kromatogram ekstrak daun ginseng... 88 Gambar 56. Ko-kromatogram ekstrak daun ginseng dengan standar
campuran ... 88 Gambar 57. Kromatogram ekstrak krokot ... 91
DAFTAR LAMPIRAN
Lampiran 1. Total fenol sayuran indigenous ... 104 Lampiran 2. Kadar air sayuran indigenous ... 105 Lampiran 3. Hasil perhitungan jumlah flavonol dan flavone pada sayuran
indigenous dengan menggunakan kurva standar campuran ... 106 Lampiran 4. Hasil perhitungan jumlah flavonol dan flavone pada sayuran
I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia merupakan negara yang kaya akan tanaman-tanaman lokal yang memiliki potensi yang baik. Tanaman lokal di Indonesia banyak yang belum terjamah untuk dikonsumsi sebagai bahan pangan yang kaya akan zat-zat yang bermanfaat bagi tubuh dan kesehatan. Jenis sayuran lokal tersebut sering disebut dan dikenal dengan sayuran indigenous. Sayuran indigenous adalah sejenis sayuran, yang walaupun tanaman sayuran itu bukan berasal dari Indonesia, namun tanaman tersebut sudah beradaptasi dan sudah dikultivasi atau dimanfaatkan oleh penduduk setempat dari dahulu, sehingga sudah dianggap sebagai tanaman turun-temurun (Anonim, 2006j).
Seperti telah diketahui, komponen fenolik dalam bahan pangan memiliki peran yang sangat baik, yang salah satunya adalah sebagai antioksidan. Menurut Markham (1989) yang dikutip oleh Hertog et al. (a) (1992), sayur-sayuran memiliki potensi yang baik dalam kontribusi terhadap kandungan flavonoidnya. Tumbuh-tumbuhan banyak mengandung senyawa fenolik yang berupa flavonoid, yang terdistribusi secara luas pada bagian-bagiannya. Penelitian-penelitian terdahulu telah membuktikan bahwa flavonoid dapat berfungsi sebagai antioksidan, antimutagenik, dan antikarsinogenik (Hertog et al. (b), 1992). Oleh karena itu, dengan diketahuinya kandungan flavonoid pada tanaman-tanaman indigenous tersebut, diharapkan dapat tercipta peluang untuk meningkatkan nilai tambah dalam pemanfaatannya.
Flavonoid terutama terdiri atas antosianidin, flavonol, flavone, flavanol, flavanone, dan isoflavon (Spencer et al., 2003). Komponen flavonoid yang dianalisis pada penelitian kali ini adalah golongan flavonol dan flavone. Senyawa yang dianalisis dari golongan flavonol terdiri atas quercetin, kaempferol, dan myricetin, sedangkan dari golongan flavone terdiri atas apigenin dan luteolin. Pengidentifikasian dibatasi hanya pada kedua golongan ini, dikarenakan kedua golongan senyawa ini merupakan komponen flavonoid yang mayoritas (secara kualitatif) terdapat dalam sayuran (Lee, 2000). Selain itu, kedua golongan senyawa ini merupakan flavonoid yang paling banyak diteliti dalam studi antikarsinogenesis (Hertog et al. (b), 1992).
Analisis komponen fenolik pada bahan pangan dapat menggunakan berbagai macam cara, mulai dari cara yang sederhana; seperti uji kolorimetri, hingga penggunaan instrumen yang canggih dan mutakhir; untuk pemisahan, penghitungan kuantitas, dan pengkarakterisasian masing-masing komponen. Berbagai metode kromatografi cair (kromatografi kertas, kromatografi lapis tipis, kromatografi kolom, dan High Performance Liquid Chromatography) dapat digunakan untuk menganalisis komponen fenolik (Lee, 2000).
Chromatography (HPLC). Dibandingkan dengan metode kromatografi cair lainnya, HPLC merupakan metode yang paling mendekati untuk dapat menyediakan dan memberikan respon yang tepat, baik dalam hal sensitivitas yang tinggi maupun dalam hal efisiensi pemisahan karena menggunakan kolom berpartikel kecil yang terbungkus dengan ketat. Selain itu, deteksi komponen dengan penggunaan metode kromatografi lapis tipis dan kromatografi kertas, bila dibandingkan dengan menggunakan HPLC, membutuhkan konsentrasi yang lebih besar. Pada analisis dengan metode HPLC, tidak ada pembatasan dalam hal volatilitas sampel maupun derivatisasi, seperti yang diperlukan dalam kromatografi gas (Lee, 2000). Komponen flavonoid bukan merupakan komponen volatil, oleh karena itu, analisis yang tepat adalah dengan menggunakan metode HPLC.
B. TUJUAN
Penelitian ini bertujuan mendeteksi kandungan komponen-komponen flavonoid (flavonol dan flavone) pada beberapa sayuran indigenous daerah Jawa Barat.
C. MANFAAT
II. TINJAUAN PUSTAKA
A. SAYURAN INDIGENOUS
Indonesia terkenal dengan keragaman hayatinya. Keragaman hayati yang dimiliki Indonesia, seperti banyaknya jenis sayuran-sayuran lokal yang memiliki khasiat tertentu, sangat potensial untuk pengembangan penganekaragaman pangan yang bernilai tinggi. Sayuran lokal di Indonesia ini memiliki potensi yang cukup baik dalam kontribusi terhadap kandungan flavonoidnya. Jenis sayuran lokal tersebut sering disebut dan dikenal dengan sayuran indigenous. Sayuran indigenous adalah sejenis sayuran, yang walaupun tanaman sayuran itu bukan berasal dari Indonesia, namun tanaman tersebut sudah beradaptasi dan sudah dikultivasi atau dimanfaatkan oleh penduduk setempat dari dahulu, sehingga sudah dianggap sebagai tanaman turun-temurun (Anonim, 2006j). Bagian dari sayuran-sayuran indigenous yang digunakan dalam penelitian ini adalah bagian yang biasa dikonsumsi (dapat berupa batang, daun, bunga, atau seluruh bagian tanaman).
Jenis-jenis sayuran indigenous yang digunakan dalam penelitian ini adalah sayur-sayuran yang banyak dikonsumsi oleh masyarakat daerah dan banyak ditemukan tumbuh di daerah Jawa Barat. Sayuran tersebut diantaranya adalah kenikir, beluntas, mangkokan, kecombrang, kemangi, katuk, kedondong cina, antanan, pohpohan, daun ginseng, dan krokot.
1. Kenikir (Cosmos caudatus H.B.K)
Klasifikasi dari kenikir adalah :
Kingdom : Plantae
Division : Spermatophyta
Sub Division : Angiospermae
Class : Dicotyledone
Order : Asterales
Family : Asteraceae
Genus : Cosmos
Kenikir merupakan tumbuhan tropika asal Amerika Latin, namun telah tumbuh menyebar dan mudah didapati di Florida, Amerika Serikat, Malaysia, serta negara-negara di Asia Tenggara, termasuk Indonesia (Anonim, 2007i). Kenikir merupakan tanaman perdu dengan tinggi sekitar 75-100 cm. Tanaman kenikir dapat dilihat seperti pada Gambar 1.
Ciri-ciri daunnya adalah majemuk, bersilang berhadapan, berbagi menyirip, ujung runcing, tepi rata, panjang 15-25 cm, dan berwarna hijau. Bagian tanaman yang biasa dikonsumsi adalah daun mudanya. Daun sayuran kenikir memiliki kandungan saponin, flavonoid, dan polifenol. Khasiat daunnya adalah sebagai penambah nafsu makan, obat lemah lambung, dan untuk mengusir serangga (Anonim, 2006b). Kenikir telah digunakan secara tradisional untuk meningkatkan sirkulasi darah (Shui et al., 2005).
Hasil penelitian Ragasa et al. (1997), menunjukkan bahwa daun kenikir yang diekstrak dengan kloroform memiliki aktivitas antimikroba yang baik terhadap penghambatan Staphylococcus aureus, Saccharomyces cereviseae, dan Candida albicans. Pada penelitian yang dilakukan oleh Shui et al. (2005), dengan menggunakan uji “free radical spiking” (dengan menggunakan instrumen HPLC/MS), diketahui bahwa kenikir memiliki aktivitas antioksidan yang sangat tinggi, yaitu setara dengan sekitar 2400 mg asam askorbat per 100 gram sampel segar. Komponen antioksidan utama yang diidentifikasikan merupakan senyawa polar, yaitu golongan dari proantosianidin yang berbentuk sebagai dimer hingga heksamer, quercetin glikosida, klorogenik, neo-klorogenik, dan asam kripto-klorogenik.
Gambar 1. Kenikir (Cosmos caudatus H.B.K.)
2. Beluntas (Pluchea indica Less.)
Klasifikasi dari beluntas adalah :
Kingdom : Plantae
Division : Spermatophyta
Sub Division : Angiospermae
Class : Dicotyledone
Order : Asterales
Family : Asteraceae
Genus : Pluchea
Species : Pluchea indica Less.
Sayuran beluntas memiliki kandungan saponin, flavonoid, polifenol, tanin, asam klorogenik, natrium, kalium, aluminium, kalsium, magnesium, dan fosfor (Anonim, 2005a). Anonim (2003b) menambahkan bahwa daun dan bunga beluntas mengandung alkali yang bertindak sebagai antiseptik. Asam amino (leusin, isoleusin, triptofan, treonin), lemak, besi, vitamin A, dan vitamin C, juga terdapat dalam tanaman ini.
Bagian tanaman beluntas yang biasa dikonsumsi adalah daun mudanya. Daun dari tanaman ini memiliki khasiat sebagai obat penurun panas, obat batuk, dan penghilang bau keringat (Anonim, 2006 i). Daun beluntas juga berguna untuk menambah nafsu makan (stomakik) dan membantu pencernaan (Anonim, 2005 b).
Selain fungsi-fungsi yang telah disebutkan di atas, daun beluntas juga memiliki kemampuan menghilangkan bau mulut, sebagai obat radang (inflamasi), sebagai obat oles yang baik untuk mengobati rasa lemas akibat diare, dan sebagai bahan ramuan yang berbentuk oles dan bubur. Cairan dari daun yang ditumbuk dan dicampur dengan ramuan lain-lain (adas-pulasari, bawang merah, kunyit, temulawak, dan kemenyan) merupakan obat yang baik untuk penderita diare berdarah (Heyne, 1987). Khasiat daun beluntas sebagai obat radang (inflamasi) dan obat diare disebabkan karena kemampuannya dalam menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli (Ardiansyah, 2005).
Beluntas memiliki kemampuan lain, yaitu termasuk dalam salah satu tanaman yang tergolong dalam kelompok obat kontrasepsi. Komponen flavonoid yang terdapat di dalamnya akan menghambat enzim aromatase, yaitu enzim yang berfungsi mengkatalisis konversi androgen menjadi estrogen yang akan meningkatkan hormon testosteron. Tingginya konsentrasi testosteron akan berefek umpan balik negatif ke hipofisis, yaitu tidak melepaskan hormon FSH (Folikel Stimulating Hormone) dan LH (Luteinizing Hormone), sehingga akan menghambat spermatogenesis. Selain itu, senyawa tanin yang terkandung di dalamnya akan bekerja dalam menggumpalkan sperma (Susetyarini dan Wahyuni, 2003).
Gambar 2. Beluntas (Pluchea indica Less.)
3. Mangkokan (Nothopanax scutellarium)
Klasifikasi dari mangkokan adalah (Anonim, 2007j) :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Apiales
Family : Araliaceae
Genus : Nothopanax
Tumbuhan ini sering ditanam sebagai tanaman hias atau tanaman pagar, walaupun dapat ditemukan tumbuh liar di ladang dan tepi sungai. Mangkokan menyukai tempat terbuka yang terkena sinar matahari atau sedikit terlindung, dan dapat tumbuh pada ketinggian 1 - 200 meter di atas permukaan laut. Tanaman ini merupakan perdu tahunan yang tumbuh tegak dengan tinggi 1- 3 m. Batang berkayu, bercabang, bentuknya bulat, panjang, dan lurus. Bagian yang dikonsumsi dari tanaman ini adalah bagian daunnya, yang memiliki ciri-ciri yaitu berdaun tunggal, bertangkai, agak tebal, bentuknya bulat berlekuk seperti mangkok, pangkal berbentuk jantung, tepi bergerigi, diameter 6-12 cm, pertulangan menyirip, dan berwarna hijau tua (Anonim, 2005d). Gambar 3 menunjukkan gambar daun mangkokan.
Batang dan daun mangkokan mengandung kalsium-oksalat, peroksidase, amygdalin, fosfor, besi, lemak, protein, serta vitamin A, B1, dan C (Anonim, 2005d). Anonim (2005e) menambahkan bahwa daun mangkokan mengandung alkaloid, saponin, flavonoid, dan polifenol. Pada zaman dahulu, daun mangkokan digunakan sebagai tempat darurat pengganti mangkok atau piring untuk makan bubur sagu, sehingga dinamakan daun mangkok (Heyne, 1987). Daun muda dari tanaman ini dapat dimakan sebagai lalap, urapan mentah, atau direbus dan dibuat sayur (Anonim, 2005d).
Di daerah Jawa, bubur daun mangkokan digunakan untuk melumas kulit kepala terhadap kerontokan rambut. Di daerah Ternate, daun mudanya dimakan dengan cara direbus. Sedangkan daun tuanya oleh para wanita Ternate digunakan untuk menyembuhkan payudara yang bernanah (daun diremas dengan minyak kelapa dan sedikit curcuma, dipanaskan diatas api, lalu dioleskan pada payudara yang bernanah untuk menyusutkan pembengkakan dan mengalirkan habis air susu yang membusuk) (Heyne, 1987).
mangkokan. Hasil analisis yang diperoleh yaitu pemberian ekstrak dengan dosis 400 dan 800 mg/kg BB mencit, menunjukkan efek yang bermakna terhadap kontrol. Diduga bahwa senyawa tanin, polifenol, dan flavonoid merupakan senyawa aktif analgetika.
Gambar 3. Mangkokan (Nothopanax scutellarium)
4. Kecombrang (Nicolaia speciosa Horan)
Klasifikasi dari kecombrang adalah :
Kingdom : Plantae
Division : Spermatophyta
Sub Division : Angiospermae
Class : Monocotyledonae
Order : Zingiberales
Family : Zingiberaceae
Genus : Nicolaia
Species : Nicolaia speciosa Horan
menyirip, panjang 20-30 cm, lebar 5-15 cm, dan berwarna hijau. Bunga kecombrang berbentuk bongkol, majemuk, mahkota bertaju, berbulu jarang, berwarna merah jambu, dan panjang tangkai bunganya 80-220 cm. Bunga ini sering dipakai sebagai penganti buah asam (tamarin) dan kadang-kadang dibuat sebagai manisan (Anonim, 2006h). Gambar 4 menunjukkan tanaman kecombrang, sedangkan Gambar 5 adalah bunga kecombrang.
Kecombrang dapat dimanfaatkan dengan memasak daun muda dan bunganya dimakan sebagai teman makan nasi. Di daerah tertentu, kecombrang biasa dimasak sebagai sayur lodeh (Anonim, 2003b). Di Jawa, bunga kecombrang digunakan sebagai campuran untuk makan urap dan pecal. Bunga kecombrang juga sering dimanfaatkan sebagai lalapan dan teman sambal (Djuki, 2005). Orang-orang Sunda di daerah Bogor, memanfaatkan rimpangnya untuk mendapatkan warna kuning (Heyne, 1987).
Bagian tanaman kecombrang yang digunakan dalam penelitian ini adalah bagian bunganya. Bunga kecombrang memiliki kadar air sebesar 90.23%, dan nilai pH bunga kecombrang adalah 3.89 (Anggraeni, 2007). Khasiat dari bunga kecombrang adalah sebagai obat penghilang bau badan (sebanyak 100 gram bunga segar, dicuci dan dikukus sampai matang, lalu dimakan sebagai sayuran), untuk memperbanyak air susu ibu, dan sebagai pembersih darah (Anonim, 2006h). Zat aktif yang terkandung di dalamnya yang dapat menghilangkan bau badan adalah saponin, flavonoid, dan polifenol (Anonim, 2003b). Kecombrang juga kaya akan vitamin dan mineral (Djuki, 2005).
makanan. Antibakteri kedua ekstrak ini lebih kuat dibanding anti kapangnya. Bila dibandingkan, aktivitas antibakteri ekstrak etil asetat lebih tinggi dari ektraksi etanol. Bunga kecombang hasil ektraksi etil asetat dan etanol mampu menekan pertumbuhan Stapyllococcus aures, Listeria monocytogenes, Bacillus cereus, Salmonella typhimurium, Escherichia coli, Aeromonas hydrophila, dan Pseudomonas aeruginosa. Diantara semua bakteri itu, yang paling sensitif terhadap ekstrak etil asetat dan etanol ialah Pseudomonas aeruginosa. Stapyllococcus aureus merupakan bakteri yang paling resisten terhadap kedua ekstrak tersebut.
Aktivitas antibakteri ekstrak bunga kecombrang dipengaruhi oleh faktor-faktor seperti pH, NaCl (garam), dan pemanasan. Pada pH asam aktivitas anti bakteri ekstrak etil asetat dan etanol bunga kecombrang lebih tinggi dibanding pH basa (8-9). Penambahan NaCl hingga 4% ekstrak etil asetat menyebabkan peningkatan aktivitas antibakteri. Namun pada konsentrasi NaCl 5% aktivitas antibakteri cenderung menurun. Aktivitas antibakteri ini pun masih bertahan pada pemanasan suhu 80°C dan 100°C selama 10, 20, 30 menit, serta 121°C selama 10 menit (Naufalin, 2005).
Ekstrak etil asetat dan etanol bunga kecombrang dapat menghambat pertumbuhan miselia kapang Penicillium funiculosum, Aspergillus flavus, dan Rhizopus oligosporus. Kapang Aspergillus flavus dan Penicillium funiculosum lebih sensitif terhadap ekstrak etil asetat. Sedangkan kapang Rhizopus oligosporus lebih resisten terhadap ekstrak etil asetat (Naufalin, 2005).
Gambar 4. Tanaman kecombrang (Nicolaia speciosa Horan)
5. Kemangi (Ocimum sanctum Linn.)
Klasifikasi dari kemangi adalah :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Lamiales
Family : Lamiaceae
Genus : Ocimum
Species : Ocimum sanctum Linn.
Kemangi merupakan tumbuhan perdu yang bercabang banyak dan memiliki tinggi 0.3-1.5 meter. Tanaman kemangi adalah sejenis tumbuhan tropis yang terdapat di Malaysia dan Asia lainnya. Kemangi merupakan sejenis tanaman herba dan sering ditanam di kawasan sekitar rumah (Anonim, 2007f). Tanaman ini tersebar di seluruh Jawa dari dataran rendah hingga kurang lebih 600 meter di atas permukaan laut, terutama di daerah-daerah dengan musim kemarau yang kuat (Heyne, 1987).
Bagian yang dikonsumsi dari tanaman ini adalah daunnya. Daun kemangi memiliki ciri-ciri yaitu merupakan daun tunggal, berbentuk bulat telur, ujung runcing, pangkal tumpul, pertulangan menyirip, panjang 14-16 mm, lebar 3-6 mm, memiliki tangkai daun yang panjang (sekitar 1 cm), dan berwarna hijau (Anonim, 2005 f). Bentuk daun kemangi dapat dilihat seperti pada Gambar 6. Daun kemangi memiliki bau yang sangat khas. Menurut Novary (1999) yang dikutip oleh Kharisma (2002), daun kemangi banyak mengandung vitamin A dan C, serta mineral P, Ca, dan Fe. Komposisi kimia daun kemangi dapat dilihat pada Tabel 1.
menyusui. Jika daun kemangi diremas dengan cuka dapat pula berkhasiat sebagai obat gosok untuk mengobati encok (Heyne, 1987).
Daun Ocimum sanctum mengandung saponin, flavonoid, dan tanin. Sedangkan bijinya mengandung saponin, flavonoid, dan polifenol (Anonim, 2005f). Zat aktif yang terkandung dalam daun kemangi juga berfungsi sebagai antiseptik. Selain itu, daun kemangi juga dapat berkhasiat untuk menghilangkan bau badan dan dapat meningkatkan selera makan (Anonim, 2003b).
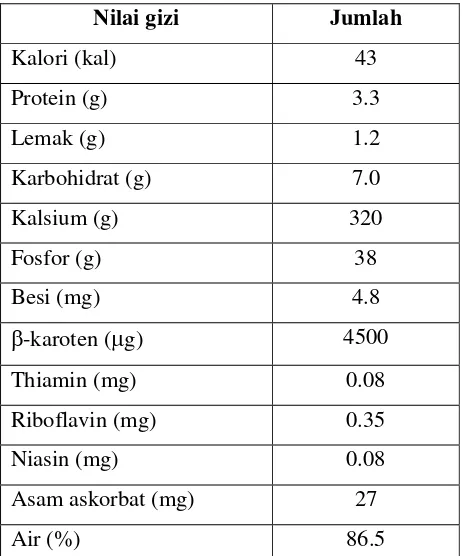
Tabel 1. Komposisi kimia daun kemangi per 100 gram bagian yang dapat dimakan
Nilai gizi Jumlah
Kalori (kal) 43
Protein (g) 3.3
Lemak (g) 1.2
Karbohidrat (g) 7.0
Kalsium (g) 320
Fosfor (g) 38
Besi (mg) 4.8
β-karoten (μg) 4500
Thiamin (mg) 0.08
Riboflavin (mg) 0.35
Niasin (mg) 0.08
Asam askorbat (mg) 27
Air (%) 86.5
Gambar 6. Kemangi (Ocimum sanctum Linn.)
6. Katuk (Sauropus androgynus)
Klasifikasi dari katuk adalah :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Malpighiales
Family : Phyllanthaceae
Tribe : Phyllantheae
Sub Tribe : Flueggeinae
Genus : Sauropus
Species : Sauropus androgynous
laut (Anonim, 2006f). Di daerah Jawa, tanaman katuk sering ditanam dan terdapat di sepanjang jalan pada pagar-pagar (Heyne, 1987).
Bagian tanaman yang biasa dikonsumsi adalah daunnya. Ciri-ciri dari daun katuk adalah daunnya majemuk, bulat telut, ujung runcing, pangkal tumpul, tepi rata, panjang 5-6 cm, pertulangan menyirip, dan berwarna hijau tua (Anonim, 2007p). Gambar 7 menunjukkan tanaman katuk.
Daun katuk memiliki kandungan kimia yaitu zat protein, lemak, kalsium, fosfor, besi, serta vitamin A, B1, dan C (Anonim, 2006f). Selain itu, Soedibyo (1998) menambahkan bahwa dalam daun katuk juga mengandung senyawa steroid dan polifenol. Komposisi kimia daun katuk dapat dilihat pada Tabel 2. Penelitian-penelitian terdahulu telah membuktikan bahwa khasiat dari daun katuk salah satunya adalah dapat meningkatkan produksi ASI (Soedibyo, 1998). Peningkatan produksi ASI ini diduga karena adanya efek hormonal dari kandungan kimia sterol pada daun katuk yang bersifat estrogenik (Anonim, 2004).
Anonim (2006 f) dan Soedibyo (1998) menyebutkan bahwa khasiat daun katuk selain untuk meningkatkan produksi ASI adalah dapat berkhasiat juga sebagai antipiretik atau obat penurun demam. Fungsi lain dari daun katuk adalah sebagai pewarna. Bila daunnya diremas-remas dengan tangan dapat memberikan warna hijau pada beberapa makanan (Heyne, 1987).
p-dodesilfenol sebagai komponen minor. Pada penelitian terdahulu telah disebutkan bahwa daun katuk juga mengandung efedrin (Anonim, 2004).
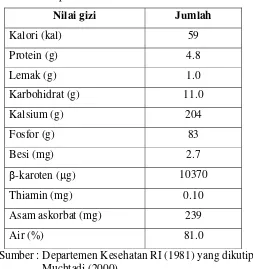
Tabel 2. Komposisi kimia daun katuk per 100 gram bagian yang dapat dimakan
Nilai gizi Jumlah
Kalori (kal) 59
Protein (g) 4.8
Lemak (g) 1.0
Karbohidrat (g) 11.0
Kalsium (g) 204
Fosfor (g) 83
Besi (mg) 2.7
β-karoten (μg) 10370
Thiamin (mg) 0.10
Asam askorbat (mg) 239
Air (%) 81.0
Sumber : Departemen Kesehatan RI (1981) yang dikutip oleh Muchtadi (2000)
7. Kedondong Cina (Polyscias pinnata)
Klasifikasi dari kedondong cina adalah (Anonim, 2007l):
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Apiales
Family : Araliaceae
Sub Family : Aralioideae
Genus : Polyscias
Species : Polyscias pinnata
Genus tanaman Polyscias merupakan tanaman semak dan pohon yang merupakan tanaman asli dari kawasan tropis Asia, Selandia Baru, dan Kepulauan Pasifik. Tumbuhan ini banyak digunakan sebagai tanaman hias di rumah pada daerah yang beriklim dingin, dan sebagai tanaman pagar di daerah yang beriklim tropis, seperti Indonesia (Anonim, 2007m). Tanaman kedondong cina merupakan tanaman yang tumbuh secara berkelompok. Tinggi tanamannya sekitar 90 cm. Ciri-ciri daunnya (seperti dapat dilihat pada Gambar 8) antara lain, ujung runcing, pangkal tumpul, tepinya bergerigi, dan berwarna hijau muda. Penyebaran tanaman kedondong cina berasal dari pulau Jawa (Anonim, 2005i).
8. Antanan (Centella asiatica)
Klasifikasi dari antanan adalah :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Apiales
Family : Apiaceae
Genus : Centella
Species : Centella asiatica
Antanan adalah tanaman herba tahunan yang kecil dari famili Apiaceae. Tanaman ini merupakan tanaman asli dari Australia, kepulauan Pasifik, New Guinea, Malanesia, Malesia, dan Asia. Jenis-jenis antanan yang terdapat di Malaysia adalah antanan Cina atau antanan nyonya yang berdaun kecil, antanan daun lebar, antanan kelantan, antanan renek, antanan salad, antanan gajah, dan antanan Brunei. Di Indonesia, jenis-jenis antanan yang ada adalah antanan, antanan daun kaki kuda, antanan tikusan, dan antanan pani gowang (Anonim, 2007k).
Antanan adalah tanaman kosmopolit di negara tropis. Di Jawa, terutama di bagian barat dari pulau ini, antanan dapat tumbuh dari dataran rendah hingga kurang lebih 2500 meter di atas permukaan laut. Tanaman ini seringkali tumbuh secara berkelompok dalam jumlah yang besar dan pada tempat-tempat yang agak rindang dan lembab (Heyne, 1987). Tanaman antanan dapat dilihat seperti pada Gambar 9.
ciri-ciri kecil, tipis, berupa stolon, berwarna hijau sampai hijau kemerah-merahan, dan saling terkait antar tanaman (Soedibyo, 1998).
Antanan jika dikonsumsi sebagai salad, dapat membantu menjaga supaya terlihat lebih awet muda. Jika antanan dibuat jus, dapat mengurangi tekanan darah tinggi dan dapat juga digunakan sebagai minuman tonikum untuk menjaga kesehatan agar tetap prima. Antanan juga memiliki khasiat untuk menyembuhkan luka yang terbuka (Anonim, 2007a). Tanaman ini juga mengandung tanin yang kemungkinan dapat membantu mengatasi radang usus dan sakit perut. Selain itu antanan bersifat manis, mendinginkan, membersihkan darah, dan melancarkan peredaran darah (Anonim, 2005g).
Menurut Heyne (1987), seduhan antanan memiliki khasiat sebagai obat pembersih darah, hermoroida, penyakit hati, batuk kering, radang cabang tenggorok, asma, radang usus, batu ginjal, dan sebagai obat kumur pada penyakit seperti sariawan. Antanan yang diremas-remas jika dioleskan pada radang kulit yang basah akan memberikan pengobatan yang cukup baik.
9. Pohpohan (Pilea trinervia)
Klasifikasi dari pohpohan adalah (Anonim, 2007h):
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Rosales
Family : Urticaceae
Genus : Pilea
Species : Pilea trinervia
Pohpohan merupakan salah satu tumbuhan yang penyebarannya berasal dari Jawa (Anonim, 2005i). Tanaman ini tumbuh secara umum di pegunungan dengan tinggi pohonnya sekitar dua meter. Bagian yang dikonsumsi dari pohpohan adalah daunnya. Daun tanaman pohpohan memiliki tekstur yang sangat lunak, berbau harum, dan dimakan sebagai lalap (Heyne, 1987). Gambar 10 menunjukkan tanaman pohpohan.
10.Daun ginseng (Talinum paniculatum)
Klasifikasi dari daun ginseng adalah :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Caryophyllales
Family : Portulacaceae
Genus : Talinum
Species : Talinum paniculatum
Daun ginseng (Talinum paniculatum) dikenal juga dengan nama kolesom Jawa. Daun ginseng merupakan tanaman herba menahun yang tumbuhnya semi menjalar dengan tinggi sekitar 30 - 60 cm, dengan batang bercabang di bagian bawah dan pangkalnya mengeras. Tumbuhan ini berasal dari Amerika tropis. Di Jawa tumbuh pada ketinggian 5 - 1250 meter di atas permukaan laut (Anonim, 2003a). Di Jawa Barat, tanaman ini banyak dibudidayakan sebagai tanaman hias (Heyne, 1987).
Tanaman ini sangat mudah dikembangbiakan, baik dengan biji maupun setek batang. Kolesom Jawa ditanam sebagai tanaman hias atau tanaman obat, kadang ditemukan tumbuh liar. Akarnya berdaging tebal, biasa digunakan sebagai pengganti kolesom. Daun dari tanaman ini merupakan daun tunggal, letaknya berhadapan, bertangkai pendek, berbentuk bulat telur sungsang, tepi rata, ujung dan pangkalnya runcing, panjang 3 - 10 cm, lebar 1,5 - 5 cm, dan berwarna hijau mengkilat. Bunganya majemuk dengan kelopak berwarna pink (Sutomo, 2006 dan Anonim, 2003a). Daun dan bunga kolesom jawa dapat dilihat seperti pada Gambar 11.
dengan tekstur lembut dan sedikit berlendir. Mengolah sayuran ini harus menggunakan api besar dan cepat karena warnanya akan berubah menjadi kehitaman jika terlalu lama dimasak (Sutomo, 2006).
Belum ada penelitian tentang manfaat kolesom, namun secara turun temurun akar dan daunnya dipercaya dapat meningkatkan stamina tubuh. Sejauh ini baru diketahui bahwa di dalam akar kolesom mengandung zat aktif seperti saponin, flavonoid dan tanin. Bagian daunnya mengandung vitamin A yang cukup tinggi, serat dan beragam mineral penting lainnya (Sutomo, 2006).
11.Krokot (Portulaca oleracea)
Klasifikasi dari krokot adalah :
Kingdom : Plantae
Division : Magnoliophyta
Class : Magnoliopsida
Order : Caryophyllales
Family : Portulacaceae
Genus : Portulaca
Species : Portulaca oleracea
Krokot merupakan tanaman tahunan dari famili Portulacaceae yang tingginya antara 5-50 cm. Batangnya tumbuh tegak atau sebagian/seluruhnya terletak di atas tanah tanpa membentuk akar. Di Jawa, tanaman ini tumbuh mulai dari dataran rendah sampai 1800 meter di atas permukaan laut. (Heyne, 1987). Daun tanaman krokot memiliki rasa yang agak asam dan asin. Konsumsi daun krokot dapat sebagai salad atau dimasak seperti bayam. Selain itu, karena sifatnya yang seperti pengental, maka cocok pula untuk campuran dalam sup atau masakan rebusan (Anonim, 2007n). Di daerah Jawa, krokot merupakan lalap yang sangat digemari (Heyne, 1987).
Bagian yang dikonsumsi dari tanaman ini adalah daun dan batangnya. Daun krokot memiliki ciri-ciri yaitu merupakan daun tunggal, berbentuk bulat telur, ujung dan pangkal tumpul, tepi rata, berdaging, panjang 1-3 cm, lebar 1-2 cm, dan berwarna hijau. Sedangkan batangnya berbentuk bulat, beruas, dan berwarna merah kecoklatan. Herba Portulaca oleracea berkhasiat sebagai obat mencret, obat penurun panas, dan obat radang lambung (Anonim, 2005h). Tanaman krokot dapat dilihat seperti pada Gambar 12.
mengandung vitamin (terutama vitamin C dan beberapa vitamin B, serta karotenoid) dan mineral yang dibutuhkan tubuh, seperti magnesium, kalsium, kalium, dan besi. Selain itu, di dalam tanaman ini juga terdapat dua tipe pigmen betalain alkaloid, yaitu pigmen betasianin yang kemerah-merahan (dapat terlihat pada warna batangnya) dan pigmen kuning betasantin (terlihat jelas pada bunganya dan tersamar pada daunnya). Kedua pigmen ini memiliki potensi sebagai antioksidan dan antimutagenik (Anonim, 2007n). Tanaman krokot juga mengandung saponin dan flavonoid (Anonim, 2005h).
Gambar 12. Krokot (Portulaca oleracea)
B. FLAVONOID
antioksidan, anti-peradangan, anti-alergi, dan dapat menghambat oksidasi dari LDL (Low Density Lipoprotein) (Anonim, 2006d).
Berdasarkan tatanama menurut IUPAC, flavonoid dapat diklasifikasikan kedalam (Anonim, 2007b):
1. Flavonoids, merupakan turunan dari struktur 2-phenylchromen-4-one (2-phenyl-1,4-benzopyrone);
2. Isoflavonoids, merupakan turunan dari struktur 3-phenylchromen-4-one (3-phenyl-1,4-benzopyrone);
3. Neoflavonoids, merupakan turunan dari struktur 4-phenylcoumarine (4-phenyl-1,2-benzopyrone).
Jenis utama flavonoid adalah antosianidin, flavonol, flavone, flavanol, flavonone, dan isoflavon (Spencer et al., 2003). Flavonol dan flavone merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning (Robinson, 1995). Flavonol dan flavone yang terdapat dalam tanaman, biasanya dalam bentuk O-glikosida. Perbedaan yang paling utama antara flavonol dan flavone yaitu pada flavonol terdapat gugus hidroksi pada C3. Kedua senyawa ini banyak terdapat pada bagian daun dan bagian luar dari tanaman, dan hanya sedikit sekali yang ditemukan pada bagian tanaman yang berada di bawah permukaan tanah (Hertog et al. (a), 1992). Perbedaan antara kedua senyawa ini dapat dilihat secara lebih jelas pada Gambar 13.
Gambar 13. Struktur kimia flavonol dan flavone yang diidentifikasi
Senyawa R1 R2 R3
Flavonol yang diidentifikasi
Myricetin OH OH OH Quercetin OH OH H Kaempferol OH H H
Flavone yang diidentifikasi
Luteolin H OH H
Dibandingkan dengan jenis flavonoid lain, jenis flavonol dan flavone merupakan dua dari jenis flavonoid yang paling banyak terdapat dalam tanaman sayur-sayuran (Robinson, 1995). Oleh karena itulah, pada penelitian ini, dilakukan identifikasi pada kedua jenis flavonoid tersebut. Selain karena alasan jumlah yang mayoritas, berdasarkan penelitian-penelitian yang telah dilakukan, kedua jenis flavonoid ini memiliki kemampuan yang baik,antara lain sebagai antioksidan.
Flavonol terdiri atas quercetin; yang umumnya merupakan komponen terbanyak dalam tanaman, kaempferol, dan myricetin. Flavone; yang terdiri atas apigenin dan luteolin, hanya ditemukan pada bahan pangan tertentu, contohnya seledri, lada (hanya luteolin), dan peterseli (hanya apigenin) (Lee, 2000). Dalam sayuran, quercertin glikosida merupakan komponen yang paling menonjol. Namun, terdapat pula glikosida dari kaempferol, luteolin, dan apigenin (Hertog et al. (a), 1992).
Flavonoid memiliki efek biologis dalam sistem sel mamalia yang berperan dalam kesehatan manusia. Beberapa flavonoid, terutama quercetin, merupakan antioksidan yang kuat. Sifat antioksidan dari quercetin meningkatkan kemungkinan untuk mengkonsumsi senyawa ini dan substansi yang terkait di dalamnya dapat mengurangi risiko kanker, penyakit jantung, dan stroke pada manusia (Anonim, 2006c). Senyawa quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan merupakan senyawa yang paling aktif dibandingkan senyawa lain dari golongan flavonol (Fuhrman dan Aviram, 2002). Banyak tanaman obat menunjukkan khasiatnya yang baik seiring dengan tingginya kandungan quercetin. Quercetin juga telah terbukti memiliki aktivitas sebagai anti peradangan, karena langsung menghambat penyebab utama dari proses peradangan tersebut (Anonim, 2007o).
menghambat oksidasi LDL dengan cara mengkelat ion tembaga, yang dapat menginduksi oksidasi dari LDL (Aviram dan Fuhrman, 2003).
Senyawa lain dari golongan flavonol yang memiliki peran penting pula adalah kaempferol. Senyawa kaempferol berbentuk padatan berwarna kuning, dengan titik leleh 276-278°C. Senyawa ini hanya sedikit larut dalam air, namun larut dalam etanol panas, metanol, dan dietil eter. Konsumsi kaempferol dalam teh dan brokoli menunjukkan adanya hubungan dengan penurunan risiko terhadap kanker dan gangguan jantung (Anonim, 2007d). Selain itu, kaempferol juga mampu menghambat oksidasi LDL dengan cara mengkelat ion tembaga, yang dapat menginduksi oksidasi dari LDL. Namun aktivitas dari kaempferol ini tidak seefektif seperti pada luteolin dan quercetin (Aviram dan Fuhrman, 2003).
Myricetin merupakan senyawa yang paling sedikit dijumpai di tanaman dibandingkan senyawa lain dari golongan flavonol. Namun demikian, myricetin juga memiliki khasiat sebagai antioksidan. Menurut Knekt et al. (2002) yang dikutip oleh Anonim (2006g), hasil studi in vitro menunjukkan bahwa dengan konsentrasi myricetin yang tinggi dapat memodifikasi penyerapan kolesterol LDL oleh sel darah putih menjadi lebih cepat. Selain itu, studi dari Finlandia juga menyatakan bahwa dengan tingginya konsumsi myricetin dapat menurunkan kemungkinan terkena kanker prostat.
Apigenin adalah senyawa lainnya dari golongan flavone yang akan diidentifikasi pada penelitian ini. Apigenin merupakan aglikon dari apiin, yang diisolasi dari daun tanaman peterseli dan seledri. Senyawa ini berbentuk padatan dan berwarna kuning, dan sering digunakan untuk pencelupan bulu domba (Anonim, 2006a). Senyawa apigenin memiliki kemampuan antara lain sebagai zat anti peradangan, antibakteri, dan untuk mengatasi permasalahan lambung (Cadenas dan Packer, 2002).
C. IDENTIFIKASI SENYAWA FLAVONOID
High Performance Liquid Chromatography (HPLC) merupakan alat yang penting dalam kimia analitik. HPLC memiliki kemampuan untuk memisahkan, mengidentifikasi, dan menghitung jumlah komponen yang terdapat dalam sampel apapun yang dapat dilarutkan dalam air. Dengan kemampuannya yang seperti ini, maka jumlah suatu komponen yang sangat sedikit pun (dalam part per trillion) dapat ditentukan secara mudah. HPLC dapat diaplikasikan untuk sampel apapun, seperti dalam bidang farmasi, pangan, nutraceuticals, kosmetik, lingkungan, forensik, dan industri kimia (Anonim, 2006e).
Komponen utama dari sistem HPLC adalah pompa (tekanan tetap dan volume tetap), penginjeksi, kolom (eksternal dan internal), detektor, dan rekorder atau sistem data yang terintegrasi (Rounds dan Gregor, 2003). Parameter-parameter yang akan mempengaruhi sistem kerja pada HPLC antara lain adalah diameter dalam dari kolom HPLC, ukuran partikel, ukuran lubang pada fase diam, dan tekanan pompa (Anonim, 2007c).
Lebih dari 70% teknik pemisahan dengan metode HPLC menggunakan tipe reversed phase. Beberapa contoh teknik pemisahan yang menggunakan metode RP-HPLC adalah analisis protein dari tanaman, protein dari biji-bijian, analisis vitamin larut air dan larut lemak, pemisahan karbohidrat, dan penentuan unsur-unsur pokok dari minuman ringan. Reversed phase HPLC dengan metode deteksi yang sangat bervariasi, digunakan untuk menganalisis lemak (Rounds dan Gregor, 2003).
Antioksidan, seperti butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT), dapat diekstrak dari bahan pangan kering dan dianalisis dengan menggunakan detektor UV dan fluoresens secara bersamaan. Bahan pangan basah, pigmen (seperti klorofil, karotenoid, dan antosianin), dan komponen fenolik (seperti vanili), dapat pula dianalisis dengan mengunakan metode RP-HPLC (Rounds dan Gregor, 2003).
Kolom reversed phase chromatography lebih sulit untuk rusak dibandingkan dengan kolom silika normal. Hal ini dikarenakan kolom RP-HPLC terdiri atas alkil turunan silika dan tidak pernah digunakan dengan larutan basa (karena larutan basa akan menghancurkan ikatan silika). Kolom RP-HPLC dapat digunakan dengan larutan asam tetapi tidak boleh kontak terlalu lama karena asam dapat menimbulkan korosi pada logam yang ada dalam peralatan HPLC. Kandungan logam pada kolom HPLC harus dijaga agar tetap rendah supaya dapat memberikan hasil terbaik pada pemisahan komponen. Salah satu cara untuk mengetahui kandungan logam di dalam kolom HPLC adalah dengan menginjeksikan campuran dari 2,2’- dan 4,4’-bipiridin. Bila terdapat ion logam di permukaan silika, maka senyawa 2,2’-bipiridin akan mengkelat logam tersebut dan peak dari senyawa yang akan diidentifikasi menjadi tidak teratur sehingga dapat memberikan hasil yang tidak sesuai (Anonim, 2007c).
pada panjang gelombang antara 240 dan 270 nm, dan antara 320 dan 380 nm. Untuk itulah, pada deteksi komponen fenolik, detektor yang digunakan pada komponen HPLC adalah detektor UV atau UV-Vis (Lee, 2000).
Fase gerak yang biasa digunakan dalam identifikasi senyawa fenolik dengan HPLC adalah metanol, acetonitril, dan tetrahidrofuran. Penggunaan tetrahidrofuran sebagai fase gerak dalam sistem HPLC, memberikan hasil pemisahan yang terbaik; diikuti oleh acetonitril, dan yang terakhir metanol. Namun, pada identifikasi senyawa flavonoid, fase gerak yang biasa digunakan adalah metanol dan acetonitril. Tetrahidrofuran akan memberikan hasil yang sangat signifikan berbeda bila digunakan untuk mengidentifikasi asam sinamat dalam jus jeruk (Lee, 2000).
Analisis flavonoid pada buah berry (raspberry merah, blueberry, cranberry, dan blackberry) telah banyak dilakukan (Rommel dan Wrolstad, 1993 dan Tandjung et al., 1994 yang dikutip oleh Lee, 2000). Senyawa flavonol aglikon (quercetin, myricetin, dan kaempferol) dapat dipisahkan dengan menggunakan fase gerak campuran antara acetonitril dan 1% asam asetat dalam air. Kolom yang digunakan adalah Partisil 5 ODS-3 column (250 x 4.6-mm ID), dengan laju aliran 1ml/menit. Deteksi flavonol dilakukan pada panjang gelombang UV 360 nm.
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan untuk membuat larutan standar, bahan untuk membuat ekstrak sayuran dan bahan untuk analisis. Bahan-bahan yang digunakan dalam pembuatan larutan standar adalah standar myricetin, luteolin, quercetin, apigenin, dan kaempferol; yang diperoleh dari Sigma Aldrich, melalui perantara PT. Intralab Ekatama, Bogor; metanol 62.5%, HCl 6M, dan TBHQ (Tertiary Butyl Hydroquinone). Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran adalah daun kenikir (Cosmos caudatus H.B.K.), daun beluntas (Pluchea indica Less.), daun mangkokan (Nothopanax scutellarium), bunga kecombrang (Nicolaia speciosa Horan), daun kemangi (Ocimum sanctum), daun katuk (Sauropus androgynus), daun kedondong Cina (Polyscias pinnata), seluruh bagian antanan (Centella asiatica), daun pohpohan (Pilea trinervia), daun dari tanaman daun ginseng (Talinum paniculatum) , dan daun dan batang krokot (Portulaca oleracea); yang diperoleh dari pasar lokal yang berada di daerah Bogor; metanol 62.5%, HCl 6M, dan TBHQ. Bahan-bahan yang digunakan untuk analisis adalah acetonitril, KH2PO4, water chromatography, Folin
Ciocalteu, Na2CO3, dan etanol 95%.
2. Alat
Chromatography (spesifikasi alat HPLC yang digunakan dapat dilihat pada Tabel 3), HPLC column C-18 phase; Develosil ODS-UG-3, alat injektor sampel HPLC, filter syringe, vial, oven, neraca analitik, desikator, alat vorteks, labu takar, gelas piala, tabung reaksi, spatula, gegep, dan cawan aluminium.
Tabel 3. Spesifikasi HPLC
Komponen HPLC Tipe
Solvent cabinet Hewlett Packard Series 1100 Degasser Agilent Technologies 1200 Series
Pump Hewlett Packard Series 1100
Detector UV-Vis Hewlett Packard Series 1100 Detector RID Agilent Technologies 1100 Series Manual injector Hewlett Packard Series 1100
Injector Rheodyne 20µL
Syringe Agilent Technologies, LC 50µL
Column C-18 phase; Develosil ODS-UG-3,
Nomura Chemical
Mobile phase 25% acetonitrile in 0.025 M KH2PO4
Flow rate 0.9 ml/min (isocratic)
B. METODE
Penelitian ini dilakukan dalam beberapa tahap. Tahapan yang dilakukan adalah persiapan sampel, analisis kadar air, analisis total fenol, ekstraksi sampel, dan analisis dengan HPLC. Analisis kadar air, analisis total fenol, dan analisis dengan HPLC dilakukan secara duplo untuk dua ulangan.
1. Persiapan Sampel
diindikasikan dari warna daun yang lebih hijau muda bila dibandingkan dengan daun pada bagian yang lainnya. Bagian tanaman krokot yang digunakan adalah daun dan batangnya, sedangkan bagian tanaman antanan yang digunakan dalam penelitian ini adalah seluruh bagiannya. Bunga kecombrang yang digunakan adalah bunga kecombrang yang telah mekar. Pemilihan bagian-bagian tanaman tersebut didasarkan pada bagian-bagian yang biasa dikonsumsi oleh masyarakat.
Sayuran-sayuran indigenous tersebut yang diperoleh dari pasar lokal yang berada di daerah Bogor, pertama-tama dicuci sampai bersih, kemudian ditiriskan. Setelah itu sayuran dibekukan di dalam freezer selama satu malam untuk memudahkan proses pengeringan vakum. Waktu pengeringan dengan freeze dryer dapat berlangsung selama satu sampai dua hari tergantung dari banyaknya sampel. Setelah sampel kering, dilakukan penghancuran menggunakan blender kering untuk mendapatkan bubuk sampel berukuran kurang lebih 30 mesh. Sampel yang telah diblender kemudian disimpan dalam freezer dan siap untuk digunakan dalam ekstraksi. Tahap persiapan sampel secara ringkas dapat dilihat pada Gambar 14.
2. Analisis Kadar Air (AOAC, 1984)
Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel sayuran segar (awal) dan pada sampel sayuran setelah freeze drying. Penentuan kadar air ini dilakukan dengan menggunakan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkan air yang terdapat dalam bahan pangan.
oven selama kurang lebih 6 jam. Setelah itu, didinginkan dalam desikator kemudian ditimbang. Contoh kembali dikeringkan dalam oven selama 30 menit lalu ditimbang kembali. Perlakuan terakhir ini diulangi terus hingga diperoleh berat sampel kering yang relatif konstan (berat dianggap konstan jika selisih berat sampel kering yang ditimbang ≤0,0003 gram).
W – ( W1 – W2 )
Kadar air (%) = x 100 % W
W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
3. Analisis Total Fenol (Shetty et al., 1995 yang dikutip oleh Ishartani,
2004)
Penentuan total fenol bertujuan mengetahui kandungan senyawa fenol pada sampel. Sampel kering beku bubuk mula-mula diambil sebanyak 50.0 mg dan dilarutkan dalam 2.5 ml etanol 95%, kemudian divorteks. Setelah itu dilakukan sentrifuse terhadap campuran tersebut selama 5 menit dengan kecepatan putaran 4000 rpm. Supernatan diambil sebanyak 0.5 ml dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 0.50 ml etanol 95%, 2.5 ml aquadest, dan 2.5 ml reagen Folin Ciocalteu 50%. Campuran tersebut didiamkan dahulu selama 5 menit, lalu ditambahkan 0.5 ml Na2CO3 5% dan divorteks. Setelah itu,
sampel disimpan dalam ruang gelap selama satu jam, lalu dilakukan pengukuran dengan spektrofotometer pada panjang gelombang 725 nm. Prosedur penetuan total fenol dapat dilihat secara ringkas pada Gambar 15.
4. Ekstraksi Senyawa Flavonoid dari Sayuran Indigenous (Hertog et al. (a), 1992)
Tahap ekstraksi sampel diawali dengan pelarutan sebanyak 0.500 atau 1.000 gram sampel kering beku ke dalam 40 ml metanol 62,5% dan 2 g/L TBHQ sebagai antioksidan. Kemudian ditambahkan 10 ml HCl 6M lalu direfluks selama satu jam pada suhu 50°C. Tujuan penambahan asam ini adalah untuk menjaga komponen agar tidak terdegradasi dan perefluksan untuk hidrolisis asam guna memotong gula. Gula yang menempel pada flavonoid dapat mengganggu pemisahan komponen, sehingga ikatan tersebut perlu dipotong. Setelah didinginkan ditambahkan kembali metanol sampai volume larutan menjadi 100 ml. Sebanyak dua mililiter larutan disaring dengan filter syringe berdiameter 0.45 µm, dan sampel tersebut telah siap untuk diinjeksikan ke kolom HPLC. Gambar 16 menunjukkan secara ringkas proses pembuatan ekstrak sampel.
5. Analisis Flavonoid dengan HPLC
a. Pembuatan larutan standar (Hertog et al. (a), 1992)