ABSTRAK
SELEKSI PLANLET ANGGREK BULAN (Phalaenopsis amabilis (L.) Bl.) DENGAN ASAM SALISILAT SECARA IN VITRO TERHADAP AKTIVITAS ENZIM PEROKSIDASE DAN KANDUNGAN KLOROFIL
Oleh Eka Susilowati
Anggrek bulan (Phalaenopsis amabilis (L.) Bl.) merupakan salah satu bunga nasional Indonesia yang ditetapkan sebagai puspa pesona.
P. amabilis memiliki bunga yang indah dan menarik serta bernilai ekonomi tinggi. Phalaenopsis amabilis, disamping keindahannya juga memiliki masalah dalam pertumbuhannya, yaitu penyakit layu Fusarium yang disebabkan oleh jamur Fusarium oxysporum (Fo). Salah satu cara yang efektif dan efisien untuk mengendalikan penyakit layu Fusarium adalah dengan menciptakan suatu kultivar yang tahan terhadap penyakit tersebut yaitu dengan menggunakan agens penyeleksi berupa asam salisilat. Asam salisilat merupakan salah satu senyawa yang berperan penting dalam ketahanan tanaman. Tujuan dari penelitian ini adalah: 1) Mengetahui kisaran konsentrasi asam salisilat yang toleran untuk seleksi planlet
P. amabilis secara in vitro. 2) Mengetahui dan menganalisis karakter ekspresi yang spesifik pada planlet P. amabilis yang tahan asam salisilat secara in vitro. Penelitian ini dilaksanakan pada bulan Februari-Maret 2015 di Laboratorium Botani (ruang penelitian in vitro), Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan satu faktor yaitu konsentrasi asam salisilat yang terdiri atas 5 taraf yaitu 0, 15, 30, 45 dan 60 ppm. Analisis ragam dan uji Beda Nyata Terkecil dilakukan pada taraf nyata 5 %. Hasil penelitian menunjukkan bahwa 1) Kisaran konsentrasi asam salisilat yang toleran untuk seleksi P. amabilis secara
in vitro adalah 15-60 ppm. 2) Karakter ekspresi spesifik pada planlet
P. amabilis yang diimbas asam salisilat 15, 30, 45 dan 60 ppm secara
in vitro adalah peningkatan kandungan klorofil a,b dan total, aktivitas enzim peroksidase dan indeks stomata.
SELEKSI PLANLET ANGGREK BULAN (Phalaenopsis amabilis (L.) Bl.) DENGAN ASAM SALISILAT SECARA IN VITRO TERHADAP AKTIVITAS ENZIM PEROKSIDASE DAN KANDUNGAN KLOROFIL
Oleh Eka Susilowati
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
iv
RIWAYAT HIDUP
Penulis merupakan anak perempuan pertama dari Bapak Akhmad Syafrudin Hadi Susilo dan Ibu Endang Sri Lestari yang terlahir di Tulang Bawang pada 24 september 1993 sebagai sulung dari empat bersaudara. Penulis memulai pendidikannya dengan bersekolah di TK Dharma Wanita Bangun Jaya pada tahun 1997-1999, jenjang selanjutnya SDN 1 Bangun Jaya pada tahun 1999-2005, Sekolah Menengah Pertama penulis tempuh di SMPN 1 Gunung Agung pada 2005-2008, dan jenjang sekolah terakhir penulis tempuh di SMA Tri Sukses Natar pada 2008-2011. Setelah mengenyam wajib belajar 9 tahun, penulis melanjutkan pendidikan strata satu di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung melalui Seleksi Nasional Masuk Perguruan Tinggi Negri (SNMPTN) jalur tertulis pada tahun 2011.
v
Dakwah tahun kepengurusan 2012-2013. Selain aktif di organisasi, penulis juga pernah menjadi asisten dosen pada mata kuliah Struktur perkembangan
Tumbuhan, Fisiologi Tumbuhan dan Pteridology.
Kupersembahkan karya sederhana ini kepada
Orang tuaku, adik-adikku dan
viii
SANWACANA
Rasa syukur tak terhingga tercurah kepada Alloh SWT atas nikmatnya sehingga penulis dapat menyelesaikan penelitian yang berjudul “Seleksi Planlet Anggrek Bulan (Phalaenopsis amabilis (L.) Bl.) dengan Asam Salisilat Secara In Vitro Terhadap Aktivitas Enzim Peroksidase dan Kandungan Klorofil” untuk meraih gelar Sarjana dari Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam penyelesaian karya sederhana ini penulis sangat berterima kasih kepada:
1. Ibu Dr. Endang Nurcahyani, M. Si., selaku pembimbing utama atas waktu, tenaga dan pikiran yang telah diberikan kepada penulis sebagai bentuk bimbingan selama penulis melaksanakan penelitian hingga meraih gelar sarjana.
ix
3. Bapak Ir. Zulkifli, M. Sc., selaku pembahas atas banyak saran yang telah diberikan kepada penulis demi baiknya laporan hasil penelitian penulis sehingga penulis dapat meraih gelar sarjana.
4. Bapak Dr. Sumardi, M. Si., selaku Pembimbing Akademik atas bimbingan serta nasehat yang selalu berharga bagi penulis.
5. Kepala Laboratorium Botani, staf dan karyawan Jurusan Biologi atas bantuan dan kemudahan yang diberikan kepada penulis selama penulis menempuh pendidikan strata satu.
6. Ketua Jurusan Biologi dan Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung atas kebijakannya yang
mempermudah penulis dan mahasiswa lain selama menempuh pendidikan strata satu.
7. Seluruh Dosen Jurusan Biologi, atas ilmu dan kesabarannya dalam mendidik penulis hingga penulis dapat meraih gelar sarjana.
8. Bapak dan Ibu tersayang (Akhmad Syafruddin Hadi Susilo dan Endang Sri Lestari) atas kasih sayang, dukungan moril dan materil yang tak pernah lekang kepada penulis.
9. Adik-adik penulis yang manis (Tika Dwiyanti, Almaas Tri Nada dan Izza Andalusia), berkat mereka penulis selalu termotivasi untuk bisa menjadi lebih baik.
10.Sahabatku terkasih Yuliani, Siti Marbiyah, Sa’adah Ratna Kusuma, Maria Dita Lumban Gaol, Mardhatillah dan Mery Kristianti Pasaribu atas
x
11.Teman diskusi penulis Mbak Sylvia Farantika yang tak pernah bosan mendengarkan dan memberikan solusi atas segala permasalahan penulis. 12.Patner seperjuanganku dalam penelitian Adi Irawan, Christiana Eka
Isharnani dan Muhamad Sobran Jamil, seniorku Mbak Linda Wati, Mbak Rita Asmara dan Mbak Gardis Andari atas perih, pedih, suka cita,
kegembiraan dan perjuangan bersama yang akan kekal menjadi salah satu kisah spesial dalam hidup penulis.
13.Rekan-rekanku angkatan 2011 yang tak dapat ku sebutkan satu persatu atas kebersamaan yang tak akan terlupa.
14.Kakak-kakak angkatan 2008, 2009 dan 2010 serta adik-adik angkatan 2012, 2013 dan 2014 atas segala hal yang tak akan pernah terlupa.
Karya ini tidak akan tercipta tanpa andil dari bapak, ibu dan rekan-rekan yang telah penulis sebutkan. Semoga karya ini bisa bermanfaat. Aamiiin.
Bandar Lampung, Juli 2015 Penulis
DAFTAR ISI
Halaman
ABSTRAK ... i
LEMBAR PERSETUJUAN ... ii
MENGESAHKAN ... iii
RIWAYAT HIDUP ... iv
PERSEMBAHAN ... vi
MOTO ... vii
SANWACANA ... viii
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
I. PENDAHULUAN ... 1
A.Latar Belakang ... 1
B. Tujuan ... 3
C.Manfaat ... 3
D.Kerangka Pikir ... 4
E. Hipotesis ... 5
II. TINJAUAN PUSTAKA ... 6
A. Tanaman Anggrek Bulan ... 6
1. Biologi ... 6
2. Nilai Ekonomi ... 9
B. Penyakit Layu Fusarium ... 9
xii
E. Pelaksanaan Penelitian ... 22
1. Persiapan medium tanam ... 22
2. Persiapan medium seleksi ... 22
3. Penanaman Planlet dalam Medium Seleksi Asam Salisilat ... 23
4. Pengamatan ... 23
5. a. Persentase Jumlah Planlet Hidup dan Visualisasi Planlet ... 23
b. Analisis Kandungan Klorofil ... 24
c. Aktivitas Enzim Peroksidase ... 25
d. Indeks Stomata ... 25
F. Analisis Data ... 26
IV. HASIL DAN PEMBAHASAN ... 27
A. Persentase Jumlah Planlet Hidup dan Visualisasi Planlet ... 27
B. Kandungan Klorofil ... 30
C. Aktivitas Enzim Peroksidase ... 34
DAFTAR TABEL
Halaman Tabel
1. Perbedaan Klorofi a dan Klorofil b ... 18
2. Tata Letak Satuan Percobaan ... 20
3. Persentase Jumlah Planlet Hidup dan Visualisasi Planlet P. amabilis dalam Medium VW Hasil Pengimbasan AS Secara In Vitro... 27
4. Kandungan Klorofil a pada Daun Planlet P. amabilis ... 30
5. Kandungan Klorofil b pada Daun Planlet P. amabilis. ... 31
6. Kandungan Klorofil Total Daun Planlet P. amabilis. ... 32
7. Aktivitas Enzim Peroksidase P. amabilis ... 34
8. Indeks Stomata Daun Planlet P. amabilis ... 37
9. Komposisi Medium VW ... 47
10.Jumlah Planlet Hidup dan Visualisasi Planlet ... 48
11.Analisis Data Kandungan Klorofil a ... 50
12.Analisis Data Kandungan Klorofil b ... 50
13.Analisis Data Kandungan Klorofil Total ... 50
14.Analisis Data Aktivitas Enzim Peroksidase ... 51
1
I. PENDAHULUAN
A.Latar Belakang
Anggrek bulan (Phalaenopsis amabilis (L.) Bl.) adalah salah satu bunga nasional Indonesia. Indonesia sendiri memiliki tiga bunga nasional yang ditetapkan melalui Keputusan Presiden Nomor 4/1993, yaitu bunga melati (Jasminum sambac L.) sebagai puspa bangsa, bunga padma raksasa (Rafflesia arnoldii R. Br.) sebagai puspa langka, dan bunga anggrek bulan (Phalaenopsis amabilis) sebagai puspa pesona (Puspitaningtyas & Mursidawati, 2010).
Sebagai puspa pesona dan salah satu bunga nasional Indonesia, species ini merupakan species pertama dalam Genus Phalaenopsis yang ditemukan oleh Dr. C. L. Blume. Sebagai anggrek yang sangat populer di seluruh dunia pada beberapa tahun terakhir, Phalaenopsis merupakan anggrek yang memiliki manfaat dan nilai ekonomi yang tinggi karena dapat digunakan sebagai induk persilangan, koleksi, bunga potong, dan penghias ruangan maupun taman (Lin & Hsu, 2004).
Tanaman anggrek, disamping keindahannya juga memiliki gangguan pada masa pertumbuhan, yakni penyakit layu Fusarium yang disebabkan oleh jamur
2
Fusarium oxysporummerupakan salah satu jamur tular tanah atau “soil-borne
pathogen”. Jamur ini menular melalui tanah atau bahan tanaman yang berasal dari tanaman sakit, dan menginfeksi tanaman melalui luka pada akar yang dapat menyebabkan penyakit layu pada tanaman. Patogen ini dapat bertahan hidup dalam tanah berupa klamidospora dalam jangka waktu yang lama
meskipun lahan tidak ditanami. Patogen ini juga dapat menyerang pada semua stadium. Tanaman muda yang terserang menjadi busuk pada bagian akar, daun-daun layu mengerut dan akhirnya mati (Semangun, 1989).
Berdasarkan permasalahan diatas, maka perlu dicari solusi untuk mengatasi tanaman anggrek khususnya P. amabilis dari penyakit layu Fusarium. Selama ini berbagai upaya telah dilakukan dalam pengendalian penyakit layu
Fusarium, diantaranya penggunaan benih sehat, rotasi tanaman, tumpang sari dan pestisida (fungisida), tetapi tidak selalu memberikan hasil yang
memuaskan, bahkan dengan menggunakan fungisida sangat merugikan bagi lingkungan (Freeman et al., 2002), oleh karena itu perlu dicari alternatif lain yaitu dengan memperoleh suatu kultivar yang tahan penyakit, salah satunya dengan menggunakan agens pengendali penyakit yaitu asam salisilat.
Asam salisilat merupakan salah satu bentuk ketahanan tumbuhan secara kimia. Asam salisilat lebih dominan untuk mengatasi serangan patogen biotrof
3
melalui jalur asam salisilat berhubungan dengan protein-protein yang terkait dengan patogenesis (Pathogenesis Related-protein/PR-protein) seperti kitinase, peroksidase, β-glukanase dan PR-1 (Corina et al., 2009; Rebecca et al., 2007).
Sejauh ini belum ada penelitian P. amabilis dengan menggunakan asam salisilat untuk mengendalikan penyakit layu Fusarium, oleh karena itu perlu dilakukan penelitian tentang aktivitas peroksidase dan kandungan klorofil anggrek bulan (P. amabilis) hasil seleksi asam salisilat secara in vitro.
B.Tujuan
Tujuan dari penelitian ini adalah:
1. Mengetahui kisaran konsentrasi asam salisilat yang toleran untuk seleksi planlet P. amabilis secara in vitro
2. Mengetahui dan menganalisis karakter ekspresi yang spesifik pada planlet
P. amabilis yang tahan asam salisilat secara in vitro
C.Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi untuk memperoleh planlet anggrek bulan yang tahan asam salisilat secara in vitro. Planlet yang insensitif terhadap asam salisilat diharapkan juga tahan terhadap
4
D.Kerangka Pikir
Anggrek merupakan tanaman yang memiliki daya tarik tinggi karena keindahan bunganya. Spesies–spesies anggrek yang disukai diantaranya anggrek vanda (Vanda sp.), anggrek dendrobium (Dendrobium sp.), anggrek tanah (Spathoglottis sp) dan anggrek bulan (Phalaenopsis sp.) (Soelistijono & Hartati, 2008).
Tanaman anggrek, disamping keindahannya juga memiliki masalah dalam pertumbuhannya yaitu penyakit layu Fusarium. Penyakit layu Fusarium
diakibatkan oleh jamur Fusarium oxysporum.
Pengendalian layu Fusarium belum berjalan dengan baik, hal ini disebabkan karena jamur F.oxysporum dapat bertahan didalam tanah meskipun tanpa inang dan juga layu Fusarium bersifat tular tanah. Pengendalian menggunakan fungisida menyebabkan datangnya patogen yang lebih kebal dan menyebabkan polusi lingkungan, oleh karena itu perlu adanya solusi lain untuk pengendalian penyakit layu Fusarium, salah satunya adalah dengan memperoleh suatu kultivar yang tahan terhadap penyakit tersebut, yaitu dengan seleksi asam salisilat secara in vitro.
5
salisilat berhubungan dengan protein-protein yang terkait dengan patogenesis (Pathogenesis Related-proteins/PR proteins) seperti kitinase, peroksidase, β -glukanase dan PR-1 (Corina et al., 2009; Rebecca et al., 2007). Tumbuhan yang telah mengalami pembentukan asam salisilat, maka akan membentuk ketahanan alami, meliputi produksi fitoaleksin dan penambahan sel lignin, peningkatan aktivitas enzim peroksidase dan kandungan klorofil (Soesanto, 2008).
Berdasarkan kerangka pikir diatas, maka dilakukan penelitian tentang seleksi
P. amabilis dengan asam salisilat secara in vitro terhadap kandungan klorofil dan aktivitas enzim peroksidase.
E.Hipotesis
Hipotesis dari penelitian ini adalah:
1. Terdapat kisaran konsentrasi asam salisilat yang toleran untuk seleksi planlet P. amabilis secara in vitro
II. TINJAUAN PUSTAKA
A.Tanaman Anggrek Bulan 1. Biologi
Menurut Tjitrosoepomo (2012), Phalaenopsis amabilis diklasifikasikan sebagai berikut.
Divisio : Spermatophyta Subdivisio : Angiospermae Classis : Monocotyledoneae Ordo : Orchidales
Familia : Orchidaceae Genus : Phalaenopsis
Species : Phalaenopsis amabilis
Salah satu jenis anggrek yang populer adalah genus Phalaenopsis atau lebih dikenal dengan anggrek bulan. Ciri khusus Phalaenopsis adalah bentuk bunganya yang lebih besar dengan warna yang bervariasi dan mekarnya bunga yang lebih lama dibandingkan jenis anggrek lain.
7
melestarikannya (Jenny & Rondonuwu, 2009). Gambar habitus dan bunga
P. amabilis disajikan pada Gambar 1.
Gambar 1. Phalaenopsis amabilis, A) Habitus P. amabilis, B) Bunga P. amabilis, keterangan: a = Tenda Bunga, b = Column, c = Labellum (Anonymous, 2008; Anonymous, 2009b)
Perbanyakan anggrek dapat dilakukan secara alami melalui perbanyakan vegetatif maupun generatif. Selain perbanyakan secara alami, dapat pula dilakukan perbanyakan dengan bantuan manusia (Mattjik, 2010). Anggrek bulan adalah salah satu species dari Phalaenopsis yang dianggap cukup penting karena peranannya sebagai induk dapat menghasilkan berbagai keturunan atau hibrida. Keistimewaan lainnya adalah mampu berbunga sepanjang tahun dengan masa rata-rata berbunga selama satu bulan (Iswanto, 2008).
Anggrek bulan termasuk anggrek epifit monopodial yang tumbuh
menjuntai. Batangnya sangat pendek dan terbungkus oleh seludang daun. Daunnya berjumlah kurang dari lima helai, berwarna hijau, tebal,
berdaging, berbentuk lonjong bulat telur sungsang atau jorong, melebar di
8
bagian ujungnya, berujung tumpul, atau sedikit meruncing, dengan panjang 20-30 cm dan lebar 5-8 cm (Tjitrosoepomo, 2012).
Bunga anggrek bulan tersusun dalam tandan dan kadang-kadang bercabang dengan panjang karangan bunga mencapai 50 cm yang tumbuh menjuntai. Setiap tangkai mendukung 10-12 kuntum bunga dengan daun penumpu 5 mm berbentuk segitiga, bunganya cukup harum dan waktu mekarnya lama. Perhiasan bunga tersusun membulat dengan diameter 6-10 cm atau lebih dan mahkotanya bertumpang tindih dengan kelopak tersusun membundar. Warna bunga putih bersih dengan sedikit variasi kuning dan bintik
kemerahan di bibir bunga. Bibir kedua cuping samping tegak melebar dan bagian tepi depannya berwarna kuning dengan garis kemerahan. Buah berbentuk bulat lonjong, berukuran 7,5 x 1,3 cm. Akar anggrek bulan berbentuk bulat memanjang serta berdaging, bercabang, berwarna putih dan hijau di bagian ujungnya (Puspitaningtyas & Mursidawati, 2010;
Tjitrosoepomo, 2012).
Anggrek bulan dapat tumbuh di dataran rendah sampai pegunungan dan umumnya hidup pada ketinggian 50-600 m dpl, juga dapat berkembang dengan baik pada ketinggian 700-1.100 m dpl. Anggrek ini tumbuh epifit atau menempel di pohon yang cukup rindang dan menyukai tempat yang teduh serta lembab, terutama di hutan basah dengan curah hujan 1.500-2.000 mm/tahun. Anggrek ini
9
terhadap kekeringan. Kelembaban udara yang diperlukan rata-rata 70-80% dengan suhu udara hangat di bawah 29oC (Puspitaningtyas & Mursidawati, 2010).
2. Nilai Ekonomi
Phalaenopsis merupakan tanaman hias anggota familia Orchidaceae yang sangat digemari konsumen di seluruh dunia dan bernilai ekonomi tinggi, baik sebagai bunga pot maupun bunga potong. Nilai ekonomi bunga anggrek ditentukan oleh keindahan, bentuk, warna, ukuran dan keseringannya berbunga, hal ini yang membuat anggrek menduduki
peringkat pertama dari 10 besar pasar bunga potong internasional (Martin & Madassery, 2006). Badan Statistik Nasional melaporkan bahwa di
Indonesia produksi tanaman anggrek setiap tahunnya meningkat dari tahun 2005 – 2009. Pada tahun 2005 kebutuhan anggrek sebesar 7.902.403, tahun 2006 sebesar 10.703.444, tahun 2007 sebesar 9.484.393, tahun 2008 sebesar 15.430.040 dan pada tahun 2009 sebesar 16.205.949
(Anonymous, 2009a).
B.Penyakit Layu Fusarium
Genus Fusarium sp adalah patogen tular tanah yang menghasilkan
10
forma-forma spesialis (f.sp) yang menyesuaikan diri pada tumbuhan inang tertentu yang diinfeksi (Akhsan, 1996).
Gambar 2. Koloni Fusarium oxysporum (Nurcahyani et al, 2012))
Layu fusarium umumnya terjadi pada pertengahan musim panas ketika
suhu tinggi. Awal terbentuknya penyakit tanaman ini adalah perubahan warna daun yang paling tua menjadi kekuningan (daun yang dekat dengan tanah). Seringkali perubahan warna menjadi kekuningan terjadi pada satu sisi tanaman atau pada daun yang sejajar dengan tangkai daun tanaman. Daun yang
terinfeksi akan layu dan mengering, tetapi tetap menempel pada tanaman. Kelayuan akan berlanjut ke bagian daun yang lebih muda dan tanaman akan segera mati (Cahyono, 2008).
11
Pengendalian penyakit layu Fusarium belum berhasil dengan baik karena patogen bersifat tular tanah dan dapat bertahan lama di dalam tanah tanpa adanya tanaman inang, sehingga rotasi tanaman menjadi tidak efektif. Pengendalian penyakit dengan mengaplikasikan fungisida sintetik ke dalam tanah hanya dapat menekan penyakit layu Fusarium untuk beberapa bulan saja (Alabouvette et al., 1996), selain itu penggunaan fungisida sintetis secara terus-menerus juga dapat menyebabkan munculnya populasi patogen yang lebih tahan dan juga akan mencemari lingkungan (Freeman et al., 2002).
C.Asam Salisilat
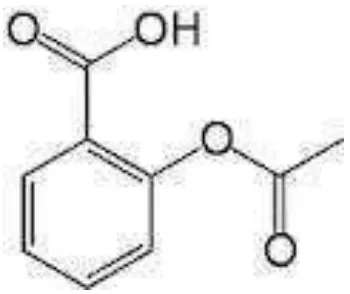
Asam salisilat termasuk dalam kelompok senyawa fenolik yang banyak berperan dalam respon tanaman terhadap penyakit dan juga mempengaruhi pertumbuhan dan perkembangan tanaman (Rivas & Plasencia, 2011). Struktur asam salisilat disajikan pada Gambar 1.
Gambar 3. Struktur kimia asam salisilat Sumber : Purnomo et al. (2007)
12
25 oC sebesar 1,443 g/mL (Purnomo et al., 2007). Asam salisilat atau asam benzoat orto-hidroksi dapat mempengaruhi berbagai proses fisiologis dan proses biokimia pada tanaman serta memiliki peran penting dalam proses pertumbuhan dan produktivitas tanaman (Hayat et al., 2010 cit Javaheri et al., 2012).
Asam salisilat merupakan komponen jalur sinyal transduksi yang menyebabkan ketahanan tanaman terhadap beberapa patogen (Ryals et al., 1996). Asam salisilat juga dikenal sebagai molekul sinyal pada ketahanan lokal dan sistemik (Shah, 2003). Tanaman yang terinfeksi patogen akan meningkatkan akumulasi asam salisilat dalam tubuhnya, Hersanti (2005) menyatakan bahwa aktivitas asam salisilat pada tanaman cabai merah meningkat setelah terjadi infeksi
Cucumber mosaic virus (CMV).
Faizah et al. (2012) juga melaporkan bahwa akumulasi asam salisilat pada tanaman cabai yang diinokulasi Begomovirus lebih tinggi dibandingkan dengan kontrol (tanaman cabai yang tidak diinokulasi Begomovirus. Chivasa et al. (1997) melaporkan bahwa perlakuan asam salisilat dapat menghambat genom replikasi tobacco mosaic virus (TMV) pada daun tembakau rentan yang diinokulasi, sehingga terjadi penundaan gejala sistemik pada semua bagian tanaman.
D.Kultur Jaringan
13
totipotensi adalah kemampuan tiap sel untuk tumbuh menjadi tanaman yang sempurna bila diletakkan di lingkungan yang sesuai (Suryowinoto, 1991).
Prinsip-prinsip dasar mengenai kultur jaringan diantaranya:
1. Teori totipotensi sel yang dikemukakan oleh Schwan dan Schleiden. 2. Konsep Skoog dan Miller yang mengemukakan bahwa regenerasi
tunas dan akar in vitro dikontrol secara hormonal oleh ZPT sitokinin dan auksin.
3. Sifat kompeten, dediferensiasi, dan determinasi sel atau jaringan eksplan (Yusnita, 2003).
Kultur jaringan dimulai dari potongan tubuh tanaman. Organ yang berukuran kecil ataupun potongan jaringan yang digunakan dalam kultur jaringan disebut eksplan. Bagian eksplan (baik itu pada tanaman stok atau tanaman induk) dari tiap eksplan yang diperoleh, bergantung pada (1) jenis kultur inisiasi, (2) tujuan pengkulturan, (3) species tanaman yang digunakan. Eksplan dapat
menghasilkan berbagai bentuk yang berbeda. Pemilihan bahan eksplan yang tepat merupakan hal yang penting untuk dapat mencapai kesuksesan dalam kultur jaringan (George et al., 2008).
E.Ketahanan Terimbas
Mekanisme ketahanan terimbas atau Induced Resistance adalah preinokulasi tanaman dengan berbagai agensia fisik, kimia, dan hayati, yang dapat
14
ketahanan terimbas adalah pengaktifan ketahanan alami tanaman seperti produksi fitoaleksin dan penambahan sel lignin, peningkatan aktivitas enzim peroksidase dan kandungan klorofil untuk pertahanan tanaman terhadap infeksi patogen. Reaksi biokimia yang terjadi di dalam sel atau jaringan mampu menghasilkan senyawa toksin terhadap patogen atau menciptakan kondisi yang menghambat pertumbuhan patogen di dalam tanaman (Agrios, 2005).
Ketahanan terimbas terhadap patogen ditunjukkan dengan ketahanan suatu tanaman terhadap infeksi patogen dengan cara dapat membatasi aktivitas patogen, sehingga patogen tidak dapat berkembang dan tidak dapat
menyebabkan kerusakan yang berarti (Agrios, 2005). Ketahanan terimbas secara kimia ditunjukkan dengan terbentuknya senyawa kimia yang mampu mencegah pertumbuhan dan perkembangan patogen, dapat berupa PR-protein (Pathogenesis Related Protein), metabolit sekunder berupa alkaloida, fenol, flavonida, glikosida, fitoaleksin dan sebagainya (Chairul, 2000 cit. Chairul, 2003). Tanaman tahan pada umumnya mengandung senyawa kimia tersebut dengan konsentrasi lebih tinggi dari pada tanaman tidak tahan (Mansfield, 2000; Agrios, 2005)
Tumbuhan yang terserang patogen akan merespons dengan membentuk suatu ketahanan yang disebut ketahanan terimbas. Tahap-tahap proses ketahanan terimbas adalah sebagai berikut.
1. Pengenalan gen untuk gen
15
memicu jalur tranduksi sinyal yang menyebabkan aktivasi respons-respons pertahanan, yang mencakup respons hipersensitif.
2. Respons hipersensutif
Respons hipersensitif merupakan respons pertahanan yang menyebabkan kematian sel dan jaringan didekat infeksi patogen untuk membatasi penyebaran patogen. Respons hipersensitif juga menginduksi produksi PR protein (Pathogenesis-related proteins), salah satunya adalah enzim peroksidase yang berperan penting dalam proses lignifikasi dan sebagian besar merupakan enzim yang menghidrolisis komponen dinding sel patogen.
3. Resistensi sistemik yang diperoleh
Sebelum sel-sel yang terisolasi (sel yang terinfeksi) mati, sel-sel tersebut mengirim sinyal berupa asam metil salisilat keseluruh tubuh tumbuhan, kenudian asam metil salisilat diubah menjadi asam salisilat dibagian yang jauh dari bagian yang terinfeksi, pada proses ini resistensi sistemik yang diperoleh teraktivasi. Asam salisilat dalam hal ini berperan menginfeksi jalur tranduksi sinyal untuk menginduksi produksi PR protein dan resistensi terhadap serangan patogen (Campbell & Jane, 2008).
16
peroksidase yang lebih tinggi dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa peningkatan kandungan asam salisilat pada tumbuhan sejalan dengan peningkatan enzim peroksidase.
Tumbuhan yang terserang patogen melakukan respons hipersensitif. Respons hipersensitif merupakan respons pertahanan tumbuhan terhadap patogen yang menyebabkan kematian sel-sel yang sudah terinfeksi dan sel-sel disekitar sel yang terinfeksi untuk membatasi penyebaran patogen. Respons hipersensitif tumbuhan, selain melakukan upaya tersebut juga mensintesis asam metil salisilat disekitar sel yang terinfeksi dan diangkut keseluruh bagian tumbuhan melalui floem, kemudian dibagian yang jauh dari sel yang terinfeksi, asam metil salisilat dirubah menjadi asam salisilat yang bertugas untuk menginduksi produksi protein-protein PR (Pathogenesis-related Protein) salah satunya enzim peroksidase. Enzim peroksidase merupakan enzim yang berperan penting dalam biosinesis lignin, agar tumbuhan resisten terhadap serangan patogen (Campbell & Jane, 2008). Enzim peroksidase merupakan salah satu kelompok PR-protein dari golongan PR-9 (Loon, 1994).
F. Biosintesis Klorofil
Molekul klorofil adalah suatu derivat porfirin yang mempunyai struktur
tetrapirol siklis dengan satu cincin pirol yang sebagian tereduksi. Inti tetrapirol mengandung atom Mg non-ionik yang diikat oleh dua ikatan kovalen, dan memiliki rantai samping. Sintesis klorofil terjadi melalui fotoreduksi
17
membentuk klorofil a yang dikatalisis enzim klorofilase. Perubahan protoklorofilid menjadi klorofilid a pada tumbuhan Angiospermae mutlak membutuhkan cahaya. Selanjutnya klorofil jenis yang lain disintesis dari klorofil a (Pandey dan Sinha, 1979 cit. Samenda et al., 2011).
Tahap–tahap dalam biosintesis klorofil adalah sebagai berikut: Tahap pertama adalah konversi asam glutamat menjadi 5-aminolevulinic acid (ALA).
Kemudian dua molekul ALA akan berkondensasi membentuk porphobilinogen (PGB), yang pada akhirnya membentuk cincin pirol dan klorofil. Selanjutnya adalah perakitan struktur porphyrin dari 4 molekul PGB, dalam tahap ini melibatkan enam reaksi enzimatis yang menghasilkan protophoryn IX (Taiz & Zeiger, 1998).
Tahap selanjutnya dalam biosintesis klorofil adalah pembentukan cincin kelima (cincin E) melalui siklisasi satu sisi rantai asam propionik menjadi
protoklorofil. Jalur ini meliputi reduksi salah satu ikatan ganda pada cincin D menggunakan NADPH. Pada Angiospermae, proses ini digerakkan oleh cahaya dan dikatalisis oleh protoklorofil oksidoreduktase (POR). Tahap akhir dalam biosintesis klorofil adalah penambahan gugus phytol yang dikatalisis oleh klorofil sintetase (Taiz & Zeiger, 1998).
18
Tabel 1. Perbedaan klorofil a dan klorofil b
Kategori Klorofil a Klorofil b
Rumus empiris C55H72O5N4Mg C55H70O6N4Mg
Warna Biru hijau Kuning hijau
Sifat molekul Kurang polar Polar
Absorpsi maksimum λ673 nm λ455-640 nm Peran dalam fotosintesis Paling banyak pada
fotosistem II
Paling banyak pada fotosistem I
(Anonymous, 2012)
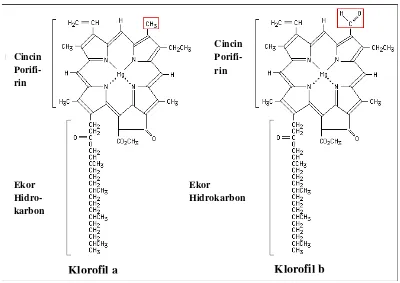
Berdasarkan rumus empiris klorofil a dan klorofil b terdapat perbedaan jumlah atom H dan atom O, hal tersebut jelas terlihat pada susunan struktur molekul klorofil a dan klorofil b yang disajikan pada Gambar 1 sebagai berikut.
Gambar 4. Struktur molekul klorofil a dan klorofil b (Anonymous, 2013)
Klorofil a Klorofil b
19 III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari sampai dengan bulan Maret 2015 di Laboratorium Botani (ruang penelitian in vitro), Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan Penelitian 1. Alat – alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah aluminium foil,
Autoclave,Laminar Air Flow Cabinet (LAF) ESCO, pinset, scalpel, mata pisau scalpel, kertas filter,Erlenmeyerberukuran 50 ml, cawan petri berdiameter 10 cm, corong, botol kultur berukuran 250 ml, gelas ukur bervolume 100 ml dan 500 ml, kertas label, mikroskop, mikropipet, pipet tip, spektrofotometer (Shimidzu UV 800), tabung reaksi, rak tabung reaksi, timbangan analitik, tisu, waterbatt, dan kamera Canon Ixus 951S.
2. Bahan – bahan penelitian
20
Acid (IAA), sukrosa, Plant Preservative Mixture (PPM), Kalium
Hidroksida (KOH), Asam Chlorida (HCl) dan bahan kimia medium VW (Vacint and Went) padat yang komposisinya disajikan dalam Lampiran 1.
C. Rancangan Percobaan
Rancangan penelitian ini disusun dengan pola dasar Rancangan Acak Lengkap (RAL) dengan satu faktor konsentrasi asam salisilat yang terdiri atas 5 taraf 0 ppm, 15 ppm, 30 ppm, 45 ppm, 60 ppm. Masing-masing konsentrasi
dilakukan 5 kali ulangan dan setiap ulangan terdiri dari 2 eksplan P. amabilis
dalam setiap botol kultur. Tata letak satuan percobaan seleksi planlet
P. amabilis dengan AS secara in vitro disajikan dalam Tabel 2. Tabel 2. Tata letak satuan percobaan
K3U1 K1U2 K4U3 K2U4 K3U5 K4U1 K2U2 K5U3 K1U4 K5U5 K1U1 K3U2 K2U3 K5U4 K4U5 K5U1 K4U2 K1U3 K3U4 K2U5 K2U1 K5U2 K3U3 K4U4 K1U5
Keterangan :
K1 : Konsentrasi 0 ppm (kontrol) K2 : Konsentrasi 15 ppm
21
D. Bagan Alir Penelitian
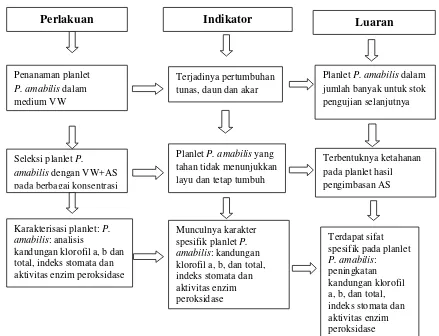
Penelitian terdiri atas beberapa tahap, yaitu: 1) Penanaman planlet P. amabilis
umur 4 bulan ke dalam medium VW yang sudah ditambahkan asam salisilat (AS) sesuai konsentrasi, 2) Penentuan kisaran konsentrasi AS toleran untuk seleksi planlet P. amabilis secara in vitro, 3) Analisis karakter ekspresi yang spesifik pada planlet P. amabilis meliputi persentase jumlah planlet yang hidup dan visualisasi planlet, analisis kandungan klorofil a, klorofil b, dan klorofil total, analisis aktivitas enzim peroksidase dan analisis indeks stomata. Tahap penelitian ini disajikan dalam bentuk bagan alir seperti tercantum pada Gambar 5.
Gamabar 5. Bagan alir penelitian Karakterisasi planlet: P.
amabilis: analisis
kandungan klorofil a, b dan total, indeks stomata dan aktivitas enzim peroksidase
Munculnya karakter spesifik planlet P. amabilis: kandungan klorofil a, b, dan total, indeks stomata dan Seleksi planlet P.
amabilis dengan VW+AS pada berbagai konsentrasi
Planlet P. amabilis yang tahan tidak menunjukkan layu dan tetap tumbuh Penanaman planlet
P. amabilis dalam medium VW
Terjadinya pertumbuhan tunas, daun dan akar
Luaran
Planlet P. amabilis dalam jumlah banyak untuk stok pengujian selanjutnya Indikator
22
E. Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa langkah sebagai berikut. 1. Persiapan Medium Tanam
Medium yang digunakan dalam penelitian ini adalah VW padat. Pembuatan medium tanam VW sebanyak 1 liter adalah dengan cara memipet sejumlah larutan stok (Lampiran 1), kemudian dimasukkan
kedalam labu takar 1 liter. Akuades ditambahkan sampai tanda (1 liter) dan pH diatur sampai 5,5. Untuk mendapatkan pH 5,5 dilakukan penambahan KOH 1 N atau HCl 1 N. Larutan tersebut kemudian dipindahkan ke dalam wadah yang lebih besar kemudian ditambahkan agar-agar sebanyak 7 g/l, sukrosa 30 g/l, dan PPM 0,5 ml/l. Larutan medium dipanaskan untuk melarutkan agar-agar (sambil diaduk) sampai mendidih. Penambahan ZPT dilakukan setelah larutan medium diangkat, kemudian dituangkan ke dalam botol kultur sebanyak 20 ml/botol. Sterilisasi medium dengan
menggunakan autoclave dengan tekanan 17,5 psi, 121 0C selama 15 menit.
2. Persiapan Medium Seleksi
23
kamar (25 0C) untuk memastikan bahwa AS telah tersaring dengan baik. Apabila dalam waktu 7 hari tidak terjadi kontaminasi pada medium, maka medium dapat digunakan.
3. Penanaman Planlet Dalam Medium Seleksi Asam Salisilat
Eksplan yang digunakan berupa planlet steril. Planlet-planlet dari botol kultur dikeluarkan dengan pinset steril dan satu-persatu diletakkan di atas cawan petri berdiameter 10 cm, kemudian planlet dipilah satu-satu, setelah itu ditanam pada masing-masing botol kultur yang berisi medium perlakuan yang telah ditentukan seperti pada butir 2 di atas. Masing-masing
konsentrasi terdiri dari 5 kali ulangan dan setiap ulangan terdiri dari 2 planlet P. amabilis dalam setiap botol kultur.
4. Pengamatan
Pengamatan dilakukan pada akhir minggu ke 4 dan dievaluasi untuk mengetahui konsentrasi AS yang toleran untuk seleksi planlet P.amabilis
secara in vitro. Setelah 4 minggu inkubasi, planlet yang masih hidup di dalam botol kemudian dikarakterisasi dengan parameter sabagai berikut.
a. Persentase Jumlah Planlet Hidup dan Visualisasi Planlet
24
Visualisasi planlet meliputi warna tunas yang terbentuk dengan
klasifikasi sebagai berikut: hijau, hijau dengan bagian tertentu berwarna cokelat dan cokelat. Data visualisasi planlet disajikan dalam bentuk persentase, yang dihitung dengan rumus sebagai berikut.
c. Analisis Kandungan Klorofil
Bahan untuk analisis kandungan klorofil menggunakan daun planlet
P. amabilis yang sudah diimbas dengan AS, menggunakan metode Harbourne (1987) dengan spektrofotometer. Adapun langkah kerjanya sebagai berikut. Daun planlet P. amabilis yang seragam sebanyak 0,1 g dihilangkan ibu tulang daunnya, kemudian digerus dengan mortar (pestle) dan ditambahkan 10 ml aseton 80%. Setelah itu larutan disaring dengan kertas Whatmann No. 1, dan dimasukkan ke dalam flakon serta ditutup rapat. Larutan sampel dan larutan standar (aseton 80%) di ambil sebanyak 1 ml, kemudian dimasukkan dalam kuvet. Setelah itu dilakukan pembacaan serapan dengan spektrofotometer pada panjang gelombang (λ) 646 nm dan 663 nm, dengan ulangan tiap sampel
sebanyak 3 kali. Kandungan klorofil dihitung dengan menggunakan rumus sebagai berikut.
Jumlah Planlet Keseluruhan Jumlah Planlet Hidup
x 100
Jumlah Planlet Berwarna Hijau/ Hijau Cokelat/ Cokelat Jumlah Planlet Keseluruhan
25
Klorofil total = 17,3 λ646 + 7,18 λ663 mg/l Klorofil a = 12,21 λ663 –2,81 λ646 mg/l
Klorofil b = 20,13 λ646 –5,03 λ663 mg/l (Harbourne , 1987)
d. Aktivitas Enzim Peroksidase
Aktivitas enzim peroksidase dianalisis dengan metode Saravanan et al. (2004). Dibuat campuran 1,5 ml 0,05 M pirogalol, 0,5 ml ekstrak enzim dari daun planlet P. amabilis dan 0,5 ml 1% H2O2. Campuran diendapkan dalam suhu kamar dan dimasukkan kedalam kuvet
berukuran 0,5 ml. Spektrofotometer diatur dengan panjang gelombang 420 nm dan dibaca dari nol. Aktivitas enzim dihitung dalam U/mg/min. Satu unit adalah aktivitas berubahnya OD 420 nm pada
spektrofotometer per menit.
e. Analisis Indeks Stomata
Pembuatan preparat stomata dengan metode Ruzin (1999) sebagai berikut: Dibuat potongan-potongan segi empat dari daun planlet
P.amabilis dengan sisi ±5 mm dan dimasukkan ke dalam tabung berisi larutan kloralhidrat dalam air (5:1). Tabung dipanasi dalam waterbath
selama ±10-15 menit hingga potongan daun tersebut transparan.
26
stomata (S) ditandai dengan (O). Indeks stomata dihitung dengan rumus sebagai berikut.
S E+S
Hasil akhir adalah rata-rata dari 5 buah pengamatan (Ruzin, 1999).
f. Analisis Data
Data yang diperoleh dari pertumbuhan planlet P. amabilis selama seleksi dengan AS berupa data kualitatif dan data kuantitatif. Data kualitatif disajikan dalam bentuk deskriptif komparatif dan di dukung foto. Data kuantitatif dari setiap parameter dianalisis dengan
menggunakan Analysis of Variance dan uji lanjut dengan uji BNT pada taraf nyata 5%.
V. SIMPULAN DAN SARAN
A.SIMPULAN
Berdasarkan hasil dan pembahasan dapat disimpulkan sebagai berikut. 1. Kisaran konsentrasi asam salisilat yang toleran untuk seleksi P. amabilis
secara in vitro adalah 15-60 ppm.
2. Karakter ekspresi spesifik pada planlet P. amabilis yang diimbas asam salisilat 15, 30, 45 dan 60 ppm secara in vitro adalah peningkatan kandungan klorofil a,b dan total, aktivitas enzim peroksidase dan indeks stomata.
B.SARAN
41
DAFTAR PUSTAKA
Amilah dan Yuni A. 2006. Pengaruh Konsentrasi Ekstrak Taoge dan Kacang Hijau pada Media Vacin and Went (VW) terhadap Pertumbuhan Kecambah Anggrek Bulan (Phalaenopsis amabilis L.). Bulletin Penelitian. No. 09.
Agrios, G.N. 2005. Plant Pathology, 5thed. Elsevier Academic Press. California. Akhsan, N. 1996. Studi Keberadaan Populasi Fusarium (Fusarium oxysporum
f.sp. licopersici (Sacc) Snyd & Hans) di Palaran, Loa Jaran dan Tanah Merah. Bul. Budidaya Pert 2 (1):11-15.
Alabouvette, R., Lemanceau P., & Steinberg C. 1996. Biological Control of Fusarium Wilts: Opportunities for Developing A Comercial Product. Anonymous. 2008. Phalaenopsis Photos: Phalaenopsis amabilis(4N).
http://www.phalaenopsiscare.net/Phalaenopsis_Orchid_Photos_amabil is.html. Diakses pada 27 Juni 2015 pukul 21.58 WIB.
Anonymous. 2009a. Produksi Tanaman Anggrek Tahun 2005 – 2009. Badan Pusat Statistik. Indonesia. Diakses pada 2 November 2014 pukul 05.49 WIB.
Anonymous, 2009b. 2015. Flower of Phalaenopsis amabilis.
https://www.flickr.com/ photos/21117187@N06/2187783191. Diakses pada 27 Juni 2015 pukul 21.49 WIB.
Anonymous. 2012. Pewarna Alami Untuk pangan Hijau Klorofil.
http://www.seafast.ipb.ac.id.hijau-klorofil.pdf. Diakses pada 27 Juni 2015 pukul 20.56 WIB.
Anonymous. 2013. Struktur Molekul Klorofil a dan Klorofil b. http: //nurul. kimia.upi.edu/arsipkuliah/web2013/1106598/penelitian.html. Diakses pada 27 Juli 2015 pukul 20.23 WIB.
42
Physiological Responses of Arabidopsis Thaliana Cells to Fusaric Acid:Toxic and Signalling Effects. New Phytologist 169:209-218. Cahyono, B. 2008. Tomat Usaha Tani & Penanganan Pasca Panen. Kanisius.
Yogyakarta.
Campbell, N. A & Jane B. R. 2008. BIOLOGI Jilid 2 Edisi Kedelapan. Erlangga. Jakarta.
Chairul. 2003. Identifikasi Secara Cepat Bahan Bioaktif Pada Tumbuhan di Lapangan. Berita Biologi 6 (4): 621-628.
Chivasa S, Murphy A.M., Naylor M, & Carr J.P. 1997. Salicylic acid interferes with tobacco mosaic virus replication via a novel salicylhydroxamic acid-sensitve mechanism. Plant Cell 9: 547-557.
Corina V. A., Dempsey D. A., & Klessig D. F. 2009. Salicylic Acid, a
Multifaceted Hormone to Combat Disease. Annu. Rev. Phythopathol
Vol. 47:177-206.
Czerpak, R., Dobrzyn P., Krotke A., & Kicinska, E. 2002. The Effect of Auxins and salicylic acid on chlorophyll and Carotenoid Contents in Wolffia Arrhiza (L.) Wimm.(Lemnaceae) Growing on Media of Various Trophicities. Polish Journal of Environmetal Studies 11 (3): 231. Djatnika, I. 2012. Seleksi Bakteri Antagonis Untuk Mengendalikan Layu
Fusarium pada Tanaman Phalaenopsis. J. Hort 22 (3): 276-284. Do, H.M., Hong J.K., Jung H.W., Kim S.H., Ham J.H., & Hwang B.K. 2003.
Expression of peroxidase-like genes, H2O2 production, and peroxidase activity during the hypersensitive response to Xanthomonas
campestris pv. Vesicatoria in Capsicum annuum. Mol. Plant Microbe Interact. 16:196-205.
Faizah, R., Sujiprihati S, Syukur M., Hendrastuti S., & Hidayat. 2012. Ketahanan Biokimia Tanaman Cabai terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning. Jurnal Fitopatologi Indonesia ISSN: 0215-7950. 8 (5): 138-144.
Freeman S., Veibel A. Z., Vintal H., & Maymon M. (2002). Isolation of nonpatogenic mutants of Fusarium oxysporum f.sp. melonis for biological kontrol of Fusarium wilts in cucurbits. Phytopathology
92:164-168.
43
Ghosh, M. 2006. Antifungal properties of haem peroxidase from Acorus calamus.
Ann. Bot. 98:1145-1153.
Harbourne J.B. 1987. Metode Fitokimia. Terjemahan: Padmawinata K & Sudiro I. Penerbit ITB Bandung.
Harni, R, Supramana M. Surya S., Giyanto & Supriadi. 2012. Mekanisme Bakteri Endofit Mengendalikan Nematoda Pratylenchus brachyurus Pada Tanaman Nilam. Bul. Littro 23 (1): 102-114.
Hersanti. 2005. Analisis Aktivitas Enzim Peroksidase dan Kandungan Asam Salisilat dalam Tanaman Cabai Merah yang Diinduksi Ketahanannya terhadap Cucumber Mosaic Virus Oleh Ekstrak Daun Nanangkaan (Euphorbia hirta).Laporan Penelitian.
Hidayat EB & Suradinata, TS. 1990. Penuntun praktikum anatomi tumbuhan. FMIPA ITB. Bandung
Iswanto, H. 2008. Petunjuk Perawtan Anggrek. Agromedia Pustaka. Jakarta Javaheri M, Mashayekhi K, Dadkhah A, dan Tavallaee F Z. 2012. Effects of
salicylic acid on yield and quality characters of tomato fruit (Lycopersicum esculentum Mill.). International Journal of Agriculture and Crop Sciences. IJACS.
Jenny, J., Rondonuwu, & Pioh D.D. 2009. Kebutuhan hara tanaman hias anggrek.
Soil environment 7 (1): 73-79.
Lestari, N.K.D., Astarini, I.A., & Nurjaya,I.G.M.O. 2012. Perubahan Anatomi Stomata Daun Lili Trumpet (Lilium Longiflorum) Setelah Pemaparan Radiasi Sinar X. Jurnal Metamorfosa 1 (1): 1-5.
Lin, M.J. & Hsu, B.D. 2004. Photosynthetic plasticity of Phalaenopsis in
response to different light environments. Journal of Plant Physiology. 161: 1259—1268.
Loon, L.C.V., W.S. Pierpoint, Th. Broller, & Conejero. 1994. Recommendations for Naming Plant Pathogenesis-related Proteins. Plant Molecular Biology Report. 12:245-264.
Martin KP & Madassery J (2006) Rapid in vitro propagation of Dendrobium hybrids through direct shoot formation from foliar explants, and protocorm like bodies. Sci Hort 108: 95-99
44
Mansfield, J.W. 2000. Antimikrobial Compounds and Resistance. In: A.J. Slusarenko, R.S.S. Fraser, and L.C. van Loon (eds), Mechanisms of Resistance to Plant Disease. Kluwer Academic Publiser. London. Misaghi, I.J. 1982. Physiology and Biochemistry of Plant-Pathogen Interaction.
Plenum Press, New York.
Nurcahyani, E., Issirep S., Bambang H., & Suharyanto. 2012. Penekanan
Perkembangan Penyakit Busuk Batang Vanili (Fusarium oxysporum
f.sp. vanillae) Melalui Seleksi Asam Fusarat Secara In Vitro. J. HPT Tropika. ISSN 1411-7525 Vol. 12, No. 1: 12 – 22.
Nurcahyani, E. 2013. Karakterisasi Planlet Vanili (Vanilla planifolia Andrews) Hasil Seleksi In Vitro dengan Asam Fusarat Terhadap Fusarium oxysporum f. sp. vanillae. Disertasi. Universitas Gadjah Mada. Yogyakarta.
Nurcahyani, E. Bambang H., Issirep S., & Suharyanto. 2014. Identifikasi Galur Planlet Vanili ( Vanilla planifolia Andrews) Resisten Terhadap Infeksi
Fusarium oxysporum F.sp. vanillaeHasil Seleksi Secara In Vitro
dengan Asam Fusarat. Prosiding Seminar Nasional: “Pengendalian
Penyakit pada anaman Pertanian Ramah Lingkungan”. Perhimpunan
Fitopatologi Indonesia Komda Joglosemar-Fakultas Pertanian UGM. ISBN 978-602-7184-0-3: 272-279
Ozyigit, I.I., Kahraman M.V, & Ercan O. 2007. Relation between explant age, total phenols and regeneration response in tissue cultured cotton (Gossypium hirsutum L.). African J. Biotechnol. Vol. 6 No. 1: 003-008.
Phabiola, T.A., & Khalimi, K. 2012. Pengaruh Aplikasi Formula Pantoea
agglomerans Terhadap Aktivitas Antioksidan dan Kandungan Klorofil Daun Tanaman Strowberi. Jurnal Agrotrop. Vol. 2 No. 2: 125-131. Purnomo, T.W.S., Kristian R., & Amitra P.S. 2007. AsamSalisilat dari Phenol.
Universitas Sultan Ageng Tirtayasa. Banten.
Puspitaningtyas, D.M. & S. Mursidawati.2010. Koleksi Anggrek Kebun Raya Bogor. Vol. 1, No. 2 Bogor: UPT Balai Pengembangan Kebun Raya LIPI.
Quiroga, M., C. Guerrero, M.A. Botella, A. Barcelo´, I. Amaya, M.I. Medina, F.J. Alonso, S.M., De F., Tigier H., Valpuesta V. 2000. A tomato
45
Radwan, D.E.M, & Soltan D.M. 2012. The Negative Effects of Clethodim in Photosyntesis and Gas Exchange Status of Maize Plants are
Ameliorated by Salicylic Acid Pretreatment. Photosynthetica 50 (2) 171-179.
Rebeca, L., Larson B., & Jacobsen B.J. 2007. Biocontrol elicited systemic resistance in sugarbeet is salicylic acid independent and NPR1 dependent. J. Sugarbeet Res 44: 1-2.
Ryals, J. A, Neuenschwander U. H, Willits M. G, Molina A, Steiner H. Y, & Hunt M. D. 1996. Systemic Acquired Resistance. Plant Cell. 8:1809-1819. Rivas, M. & Plasencia J. 2011. Salicylic Acid Beyond Defence: its Role in Plant
Growth and Development. Journal of Experimental Botany 62 (10): 3321–3338.
Ruzin SE. 1999. Plant Microtechnique and Microscopy. Oxford University Press.
New York.
Samenda, Lusia, Henny L. Rampe dan Feky R. Mantiri. 2011. Analisis Kandungan Klorofil Daun Mangga (Mangifera indica L.) pada Tingkat Perkembangan Daun yang Berbeda. Universitas Sam Ratulangi. Manado.
Saravanan T, Bhaskaran R, & Muthusamy M. 2004. Pseudomonas fluorescens Induced Enzymological Changes in Banana Roots (cv. Rasthali)
against Fusarium Wilt Disease. Plant Pathology Journal.3: 72-80.
Semangun, H. 1989. Penyakit-Penyakit Tanaman Hortikultura Di Indonesia. Gadjah Mada University Press. Yogyakarta.
Shah, J. 2003. The salicylic acid loop in plant defense. Curr. Opin. Plant Biol.
6:365-371.
Soelistijono & Hartati, S. 2008. Perbaikan Genetik Anggrek melalui Persilangan Intergenerik dan Perbanyakan secara In Vitro dalam mendukung perkembangan Anggrek di Indonesia. Laporan Penelitian Hibah Bersaing, LP2M UTP, Surat Kontrak Ditjen Dikti No: 198/ SP2H/PP /DP2M/III/2008.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. PT Raja Grafindo Persada. Jakarta.
Sujatmiko, B, Sulistyaningsih E., dan Murti, H. R. 2012. Ilmu Pertanian 15: 1–18. Suryowinoto, M. 1991. Pemuliaan Tanaman secaraIn Vitro. Kanisius.
46
Taiz, L. & E. Zeiger. 1998. Plant Physiology. Sunderland: Sinauer Associates, Inc. Publishers.
Tjitrosoepomo, G. 2012. Taksonomi Tumbuhan (Spermatophyta). Gadjah Mada University Press. Yogyakarta.
Vlot, A.C., D.F. Klessig & S.W. Park. 2008. Systemic acquired resistance: the elusive signal(s). Curr. Opin. Plant Biol 1 (1): 436-442.
Yanti, Y. 2011. Aktivitas Peroksidase Mutan Pisang Kepok dengan Ethyl Methane Sulphonate (EMS) secara In Vitro. Jurnal Natur Indonesia
14 (1): 32-36. ISSN 1410-9379, Keputusan Akreditasi No 65a/DIKTI/Kep./ 2008.