DINAMIKA TRANSFER ENERGI PADA PROTEIN
α
-HELIKS
BERDASARKAN ANSATZ I MODEL DAVYDOV DENGAN
VARIASI KOPLING ANTAR PEPTIDA
ZULIYATIN
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
Zuliyatin. Dinamika Transfer Energi Pada Protein α-Heliks Berdasarkan Ansatz I Model Davydov Dengan Variasi Kopling Antar Peptida. Dibimbing oleh: Faozan Ahmad, S.Si, M.Si (Pembimbing I) dan Dr. Husin Alatas (Pembimbing II).
Pokok permasalahan dari proses biologi dalam tingkat molekuler adalah mekanisme transfer bioenergi yang dihasilkan oleh hidrolisis ATP pada protein. Model Davydov adalah suatu model yang berusaha menjelaskan mekanisme tersebut. Model yang digunakan dalam penelitian ini adalah model Davydov dengan menggunakan ansatz dan variasi kopling dipol-dipol antar unit terdekat dalam bentuk fungsi konstan, fungsi gaussian, fungsi garis lurus dengan kemiringan negatif dan kemiringan positif. Kami menemukan tiga dinamika soliton travelling soliton, bending soliton dan breathing soliton. Ketiga dinamika ini berhubungan dengan transfer energi di dalam protein dan pembelokan soliton. Dinamika travelling soliton, bending soliton dan breathing soliton
dapat dikendalikan oleh kekuatan kopling dipol-dipol antar unit terdekat (kopling ), kopling eksiton-fonon (), dan kondisi awal.
Kata kunci: protein α-heliks, soliton, Davydov, distribusi energi
ABSTRACT
A basic problem of many biological processes at biomolecular level is mechanism of transfer of bioenergy released by ATP hydrolysis in protein. Davydov’sModel is a model that could describe that mechanism. The Davydov’s model adopted in this research use ansatz as trial function with the variation of dipole-dipole coupling between nearest unit of peptides in the form of a constant function, gaussian function, gradient-line function. We found three dynamical cases that are travelling soliton, bending soliton and
breathing soliton. The dynamics are related to the energy transfer in the protein and deflection of soliton that can be controlled by strength of dipole-dipole coupling ( ), coupling of exciton-phonon (), and initial condition.
ii
DINAMIKA TRANSFER ENERGI PADA PROTEIN
α
-HELIKS
BERDASARKAN ANSATZ I MODEL DAVYDOV DENGAN
VARIASI KOPLING ANTAR PEPTIDA
ZULIYATIN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Fisika
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Dinamika Transfer Energi Pada Protein α-Heliks Berdasarkan Ansatz I Model Davydov Dengan Variasi Kopling Antar Peptida
Nama : Zuliyatin NIM : G74080005
Disetujui,
Pembimbing I Pembimbing II
Faozan Ahmad, S.Si, M.Si Dr. HusinAlatas
NIP : 19790923 200701 1 001 NIP : 19710604199802 1 001
Diketahui, Ketua Departemen
Dr. Akhiruddin Maddu
NIP : 19660907 199802 1 006
iv
PRAKATA
Segala puji syukur penulis panjatkan kepada Allah SWT dan shalawat serta salam semoga tercurah kepada Nabi Muhammad SAW. Atas rahmat dan hidayah Allah SWT, akhirnya penulis dapat menyelesaikan skripsi dengan judul ”Dinamika Transfer Energi Pada Protein α-Heliks Berdasarkan Ansatz I Model Davydov Dengan Variasi Kopling Antar Peptida”. Dalam skripsi ini membahas berbagai formula matematis yang cukup kompleks dalam menyusun solusi ini sehingga membutuhkan waktu yang tidak sebentar dalam menyelesaikannya, namun dengan perjuangan yang terus dilakukan penulis akhirnya bisa juga menyelesaikan skripsi ini walaupun melebihi target penulis.
Tak lupa juga penulis menyampaikan banyak terima kasih dan penghargaan yang sebesar-besarnya kepada pihak-pihak yang telah membantu penulis dalam penyelesaian penelitian skripsi yaitu kepada:
1. Ayahanda (Bapak Ach. Nasir) dan Ibunda (Ibu Mari’ah) tercinta yang tidak pernah habis kasih sayang menjaga, merawat, dan memberi pendampingan moril maupun materiil selama penulis hidup serta mas Aris, mbak Dewi, mbak Nana, mas Kaspan, mbak Rohmah, mas Didik (Alm), mas Ali, dik Lilik dan habibialbi di rumah terima kasih atas dukungan, semangat dan doanya yang tidak pernah berhenti mendokan penulis agar penulis selalu berhasil.
2. Bapak Faozan Ahmad, S.Si, M.Si dan Bapak Dr. Husin Alatas selaku dosen pembimbing yang telah memberikan bimbingan, masukan dan semangat kepada penulis sehingga penulis tidak pantang menyerah dalam memecahkan semua rumus-rumus persamaan.
3. Bapak Dr. Akhiruddin Maddu dan Bapak Drs. M. N. Indro, M.Sc selaku dosen penguji yang telah memberikan kritik, saran, semangat dan masukan yang sangat berharga untuk penulis khususnya.
4. Bapak Drs. M. N. Indro, M.Sc dengan kesabaran dan ketelitiannya membantu penulis dalam merampungkan penyusunan skripsi ini.
5. Seluruh Dosen bagian fisika teori yang telah membuat penulis senang terhadap bidang ini yaitu Bapak Dr. Agus Kartono, Bapak Abdul Djamil Husin, M.Si, Bapak Hendradi Hardhienata, M.Si.
6. Seluruh Dosen Fisika dan Staf Karyawan/Karyawati Departemen Fisika yang telah memberikan kontribusi yang besar dalam pelaksanaan akademis.
7. Seluruh Laboran Laboratorium yang telah membantu penulis dalam pelaksanaan sarana dan prasarana selama perkuliahan.
8. Program beasiswa PPA tahun 2008-2011, LAZ tahun 2008-2009, BBM tahun 20011-2012 berupa bantuan material sehingga penulis dapat menyelesaikan studi di IPB.
9. Teman-teman satu lab Fisika Teori terutama Adietya Landras Pratama, Firmansyah Cassandra Mutiara Cen, Nurul Huda N.A terima kasih atas semua masukan kepada penulis dan kebersamaanya selama berada di dalam lab teori serta canda tawanya saat belajar bersama dalam menyelesaikan penelitian ini.
10. Seluruh teman-teman seperjuangan fisika angkatan 45 serta angkatan 43, 44, 46, 47. 11. Seluruh kakak-kakak dan adik-adik Ikatan keluarga Madrasah Raudlatul Ulum
(IKAMARU), Ikatan Keluarga Mahasiswa Pati (IKMP), Himpunan Mahasiswa Fisika (Himafi) yang telah memberikan bantuan dan semangat dalam pelaksanaan yang tidak bisa disebutkan satu-persatu.
Akhir kata, semoga kelak nantinya penelitian ini dapat bermanfaat dan menjadi terobosan baru bagi perkembangan sains di Indonesia.
Bogor, April 2013
vi
RIWAYAT HIDUP
Penulis dilahirkan di Pati pada tanggal 28 Agustus 1990 dari pasangan ayahanda tercinta Ach. Nasir dan Ibunda tersayang Mari’ah. Penulis merupakan anak kelima dari enam bersaudara. Penulis menyelesaikan pendidikan Taman Kanak-Kanak (TK) dari TK Aisyah Bustanul Athfal (ABA), pendidikan dasar dari SDN Jepuro-Juwana pada tahun 2002 dan pada tahun 2005, menyelesaikan pendidikan tingkat pertama dari Madrasah Tsanawiyah (MTs) Raudlatul Ulum Guyangan Trangkil Pati yang dilanjutkan dengan pendidikan atas di Madrasah Aliyah (MA) Raudlatul Ulum Guyangan Trangkil Pati. Selama di MTs dan MA, penulis aktif dalam organisasi diantaranya yaitu Lembaga Peningkatan Pembelajaran Bahasa Arab (LPPBA) tahun 2002-2008, English Conversation Club (ECC) tahun 2002-2007, Organisasi Daerah Wilayah Juwana (Nirwana), Club basket dan badminton tahun 2005.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 1
1.3 Perumusan Masalah ... 1
1.4 Hipotesis ... 2
BAB 2 TINJAUAN PUSTAKA ... 2
2.1 Protein, Fungsi, dan Strukturnya ... 2
2.2 Protein α-Heliks ... 3
2.3 Hidrolisis Adenosine triphosphat (ATP) ... 3
2.4 Model Davydov Pada Struktur Protein α-Heliks ... 4
BAB 3 BAHAN DAN METODE ... 5
3.1 Waktu dan Tempat Penelitian ... 5
3.2 Peralatan Penelitian ... 6
3.3 Metode Penelitian ... 6
BAB 4 HASIL DAN PEMBAHASAN ... 7
4.1 Model Matematika dan Persamaan Gerak ... 7
4.2 Dinamika Energi Pada Rantai Protein α-Heliks ... 8
4.2.1 Kopling Konstan... 9
4.2.2 Kopling Bervariasi Dalam Bentuk Fungsi Gaussian ... 10
4.2.2.1 Gaussian Landai ... 10
4.2.2.2 Gaussian Curam ... 11
4.2.3 Kopling Bervariasi Dalam Bentuk Garis Lurus Dengan Kemiringan Positif ... 13
4.2.4 Kopling Bervariasi Dalam Bentuk Garis Lurus Dengan Kemiringan Negatif ... 15
BAB 5 KESIMPULAN DAN SARAN ... 17
5.1 Kesimpulan ... 17
5.2 Saran ... 18
DAFTAR PUSTAKA ... 18
viii
DAFTAR GAMBAR
Halaman
Gambar 1. Reaksi kondensasi dua asam amino membentuk ikatan peptida ... 2
Gambar 2. Struktur protein secara umum ... 3
Gambar 3. Struktur protein α-heliks ... 3
Gambar 4. Model davydov pada struktur protein α-heliks ... 4
Gambar 5. Dinamika soliton dengan kopling dalam bentuk konstan (view: 90°) 9 Gambar 6. Kurva Gaussian landai ... 10
Gambar 7. Dinamika soliton dengan kopling dalam bentuk fungsi Gaussian landai (view:90°) ... 11
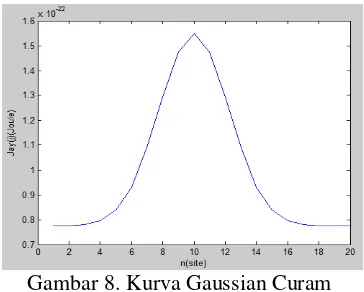
Gambar 8. Kurva Gaussian curam... 11
Gambar 9. Dinamika soliton dengan kopling dalam bentuk fungsi Gaussian curam (view:90°) ... 12
Gambar 10. Kurva Gaussian lebih curam ... 13
Gambar 11. Dinamika soliton dengan kopling dalam bentuk fungsi Gaussian lebih curam (view:90°) ... 13
Gambar 12. Kurva kemiringan positif ... 13
Gambar 13. Dinamika soliton dengan kopling dalam bentuk garis lurusdengan kemiringan positif dengan eksitasi site ke-19 (view:90°) ... 14
Gambar 14. Dinamika soliton dengan kopling dalam bentuk garis lurus dengan kemiringan positif dengan eksitasi site ke-2 (view: 90°) ... 15
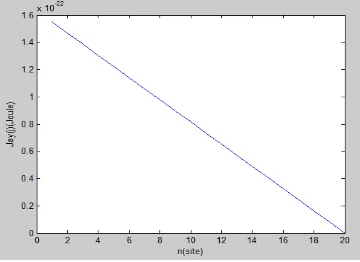
Gambar 15. Kurva kemiringan negatif ... 15
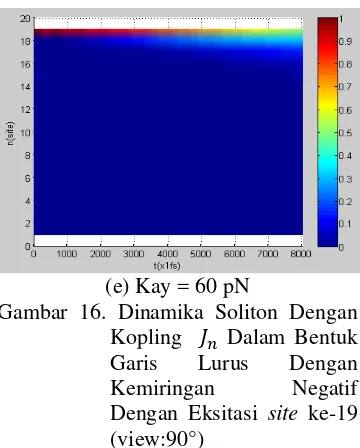
Gambar 16. Dinamika soliton dengan kopling dalam bentuk garis lurus dengan kemiringan negatif dengan eksitasi site ke-19 (view: 90°)... 16
DAFTAR LAMPIRAN
Halaman
LAMPIRAN A. Diagram Alir Penelitian ... 21 LAMPIRAN B. Penurunan Solusi Eksak Persamaan Nonlinier Schrödinger-
Davydov ... 22 LAMPIRAN C. Penurunan Hamiltonian Davydov Dari Representasi Pertama ke
BAB 1
PENDAHULUAN
1.1.
Latar Belakang
Munculnya model Davydov berawal dari upaya menjelaskan mekanisme transfer energi dalam makromolekul biologi khususnya protein. Telah diketahui bahwa dalam melakukan fungsinya, protein selalu melibatkan proses transfer bioenergi yang dihasilkan dari proses hidrolisis Adenosine Triphosphate (ATP).1
Protein mempunyai peran penting dalam sistem kehidupan biologi. Salah satunya, proses kimia dalam tubuh dapat berlangsung dengan baik karena adanya enzim yaitu suatu protein yang berfungsi sebagai biokatalis. Di dalam sistem biologi, protein α-heliks merupakan salah satu bentuk struktur sekunder dari protein yaitu struktur tiga dimensi rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen. Protein α-heliks berupa pilinan rantai asam-asam amino berbentuk seperti spiral.2,3
Davydov berusaha menjelaskan mekanisme transfer dan penyimpanan bioenergi melalui stabilitas energi eksitasi amida-I (C=O) di sepanjang rantai molekul protein α-heliks. Ide ini berawal dari energi yang dihasilkan oleh hidrolisis Adenosine Triphosphate (ATP) melalui eksitasi vibrasi C=O pada protein yang menghasilkan energi sebesar 0.205 eV. Kenyataannya eksitasi energi pada ikatan amida-I sebesar 0.42 eV.4,5
Model tersebut merupakan model satu dimensi yang di dalamnya mencakup interaksi nonlinier antara eksiton dan fonon serta memprediksi kestabilan energi eksitasi amida-I dalam bentuk gelombang soliton. Dalam model Davydov, protein dapat dipandang sebagai kumpulan osilator C=O yang digandeng oleh ikatan hidrogen. Melalui gandengan antara C=O dan ikatan hidrogen ini, bioenergi disimpan dalam ikatan C=O dengan fenomena lokalisasi diri (self localization) dan ditransfer antar C=O dalam bentuk gelombang soliton berjalan.4,5
Sampai saat ini, isu terkait model Davydov diantaranya yaitu mengenai optimasi model dengan berbagai ansatz, stabilitas soliton dan pengaruh lingkungan itu sendiri masih diperbincangkan. Salah satu model Davydov yaitu model Yomosa. Pada tahun 1984, Yomosa menjelaskan sebuah model dengan bentuk energi ditransfer oleh kisi soliton dan digandeng oleh ikatan hidrogen yang bersifat nonlinier dengan massa yang sama. Model ini hanya melibatkan ikatan hidrogen dalam transfer energi. Sementara ikatan peptida tidak termasuk di dalam transfer energi. Dalam perhitungannya, model ini menggunakan pendekatan kuasikontinyu.6
Pada penelitian yang dilakukan oleh Lomdahl dan Kerr telah dijelaskan bahwa stabilitas soliton atau waktu hidup soliton itu dipengaruhi oleh temperatur. Artinya, soliton dapat bertahan pada temperatur yang lebih rendah (T = 0 K) daripada temperatur yang tinggi atau temperatur fisiologis (T = 300 K). Hal ini menunjukkan soliton dapat dipengaruhi oleh lingkungan itu sendiri.7
Pada penelitian ini ditetapkan dari model Davydov pada protein α-heliks dengan kondisi temperaturnya rendah (T = 0 K) dan memakai ansatz atau fungsi gelombang . Dalam hal ini, kopling dipol-dipol antar unit terdekat atau antar peptida bergantung pada n (molekul peptida ke-n).
1.2.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan persamaan gerak nonlinier Davydov dengan variasi kopling dipol-dipol antar peptida secara analitik serta menjelaskan dinamikanya secara numerik. Simulasi dari persamaan gerak nonlinier tersebut menggunakan software MATLAB dengan metode Runge-Kutta Orde 4.
1.3.
Perumusan Masalah
penelitian ini dirumuskan dalam bentuk pertanyaan sebagai berikut:
a. Bagaimana menentukan persamaan gerak nonlinier Davydov dengan variasi kopling antar peptida?
b. Bagaimana dinamika molekuler yang terjadi pada makromolekul protein?
1.4.
Hipotesis
Hipotesis pada penelitian ini sebagai berikut:
a. Solusi persamaan nonlinier Davydov dapat berupa soliton untuk parameter fisis tertentu yang tepat.
b. Dinamika terjadi pada protein akan dipengaruhi oleh variasi kekuatan kopling.
BAB 2
TINJAUAN PUSTAKA
2.1
Protein,
Fungsi
dan
Strukturnya
Protein ditemukan oleh Jöns Jakob Berzelius pada tahun 1838. Kata protein berasal dari “protos atau proteos” yang
berarti pertama atau utama yaitu senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino dan dihubungkan satu sama lain dengan ikatan peptida. Protein merupakan makromolekul yang mempunyai fungsi sangat penting pada sel hewan atau manusia. Protein yang terdapat di dalam makanan berfungsi sebagai zat utama dalam pembentukan dan pertumbuhan tubuh.2
Banyak dari proses pertumbuhan tubuh manusia dipengaruhi oleh protein yang terkandung ada di dalam tubuh kita. Fungsi protein yaitu sebagai enzim atau katalisator reaksi-reaksi biokimia dalam sel, sebagai alat pengangkut dan penyimpan molekul-molekul kecil dan ion, sebagai penunjang mekanis atau keomponen pendukung kekuatan regang, sebagai media perambatan impuls saraf, sebagai pengendalian pertumbuhan, sebagai komponen sistem kekebalan tubuh, sebagai pengatur ekspresi genetik.4
Fungsi Protein tidak hanya dijelaskan dengan bahan-bahan kimia pada molekul yang membentuk protein tetapi juga pada dinamika fisika pada protein. Sekarang protein dilihat sebagai dinamika objek di samping objek-objek yang lain. Protein dapat disebut juga sebagai biomekanika, artinya secara efisien dapat mengubah energi kimia menjadi energi mekanik. Energi kimia pada protein adalah hasil reaksi dari hidrolisis ATP.9
Protein merupakan polimerisasi dari 20 jenis asam amino L-α oleh ikatan peptida seperti pada Gambar 1. Setiap asam amino terdiri dari grup amino (NH2) yaitu sebuah grup karboksil (COOH) dan grup radikal (R) yang terkait pada α-karbon (Cα). Grup radikal merupakan ciri yang membedakan antar jenis asam amino. Polimerisasi asam amino melalui ikatan peptida disebut juga sebagai polipeptida karena tampak seperti pengulangan grup peptida (N-H-C=O) atau disebut juga grup amida.
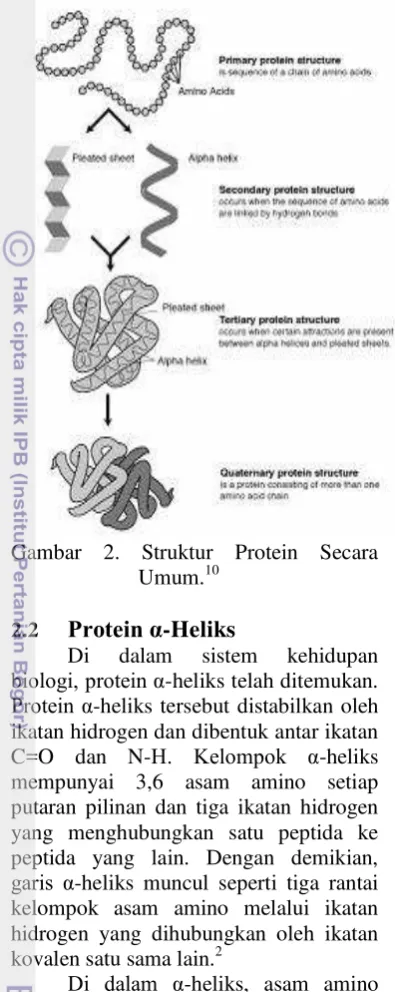
Struktur protein dapat dilihat sebagai hirarki, yaitu berupa struktur primer (tingkat satu), sekunder (tingkat dua), tersier (tingkat tiga), dan kuarterner (tingkat empat)4 seperti yang terlihat pada Gambar 2. Pada struktur sekunder protein, protein dapat terbentuk menjadi α-heliks atau bentuk lainnya. Protein alpha-helix (α-helix, “puntiran alfa”)
yaitu protein berupa pilinan rantai asam amino berbentuk seperti spiral.
3
Gambar 2. Struktur Protein Secara Umum.10
2.2
Protein α
-Heliks
Di dalam sistem kehidupan biologi, protein α-heliks telah ditemukan. Protein α-heliks tersebut distabilkan oleh ikatan hidrogen dan dibentuk antar ikatan C=O dan N-H. Kelompok α-heliks mempunyai 3,6 asam amino setiap putaran pilinan dan tiga ikatan hidrogen yang menghubungkan satu peptida ke peptida yang lain. Dengan demikian, garis α-heliks muncul seperti tiga rantai kelompok asam amino melalui ikatan hidrogen yang dihubungkan oleh ikatan kovalen satu sama lain.2
Di dalam α-heliks, asam amino kelompok R terlihat seperti bentuk polipeptida menggulung. Permukaan dari suatu α-heliks sebagian besar terdiri dari asam amino kelompok R. Prinsip dasar struktur protein mencakup struktur sekunder. Jenis struktur sekunder yang paling umum di dalam protein adalah α -heliks. Salah satu faktor utama di dalam stabilisasi yaitu membentuk suatu ikatan hidrogen. Struktur sekunder di dalam protein terbentuk karena suatu ikatan hidrogen untuk dibentuk dua elektronegatif atom dari α-heliks amida N
Gambar 3. Struktur Protein α-Heliks.11
dan gugus karbonil O harus saling berhubungan dengan hidrogen yang sama. Hidrogen dihubungkan dengan salah satu atom ikatan hidrogen itu secara kovalen tetapi saling berhubungan secara elektrostatik dengan lain (penerima ikatan hidrogen). Di dalam protein hampir semua kelompok yang mampu mengikat hidrogen.12,13. Struktur protein α-heliks dapat dilihat pada Gambar 3.
2.3
Hidrolisis
Adenosine
Triphosphat
(ATP
)Adenosine Triphosphat (ATP) adalah suatu nukleotida yang dalam biokimia dikenal sebagai "satuan molekular" pertukaran energi intraselular. Artinya, ATP dapat digunakan untuk menyimpan dan menyalurkan energi kimia dalam sel. ATP juga berperan penting dalam sintesis asam nukleat. Molekul ATP juga digunakan untuk menyimpan energi yang dihasilkan tumbuhan dalam respirasi selular.12
lemak. Mula-mula, glukosa dipecah menjadi asam piruvat di dalam sitosol dalam reaksi glikolisis. Dari satu molekul glukosa akan dihasilkan dua molekul ATP. Tahap akhir dari sintesis ATP terjadi dalam mitokondria dan menghasilkan total 36 ATP. Peran ATP yang paling banyak dikenali orang adalah sebagai pembawa energi dalam bentuk yang tertukar sebagai ATP dan ADP. Fungsi ini berlangsung di berbagai kompartemen sel, tetapi kebanyakan terjadi pada sitosol (ruang di dalam sitoplasma yang berisi cairan kental). Sebagai pembawa energi, ATP juga banyak dijumpai pada mitokondria. ATP dan nukleosida trifosfat lainnya dapat berada di luar sel menempati matriks ekstraselular.14
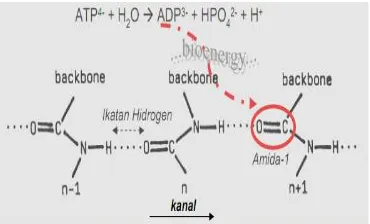
Proses energi dihidrolisis oleh adenosine triphosphate (ATP) dalam adenosine diphosphate (ADP) adalah sebagai berikut.5
ATP4- + H2O ADP3- + HPO2-4 + H+
2.4
Model
Davydov
Pada
Struktur Protein α
-Heliks
Model Davydov merupakan model yang diusulkan oleh A.S. Davydov untuk menjelaskan mekanisme transfer dan penyimpanan energi pada makromolekul biologi dengan menggunakan teori zat padat.5
Pendekatan model ini berdasarkan eksperimen yang menunjukan adanya struktur periodik pada molekul-molekul biologi khususnya protein dan DNA. Teori zat padat digunakan terutama untuk menjelaskan masalah penting dalam bioenergetika yaitu tingginya efisiensi transfer energi yang terjadi dalam makromolekul biologi. Dalam menjelaskan transfer energi pada struktur protein, konsep elektron pada kristal molekul sering diadopsi, dalam hal ini menggunakan konsep eksiton. Konsep eksiton pertama kali diperkenalkan oleh Frenkel (1931) untuk menjelaskan konversi cahaya menjadi panas dalam zat padat.6
Gambar 4.Model Davydov Pada Struktur Protein α-Heliks.3
Model transfer energi pada protein yang diusulkan oleh Davydov adalah bioenergi yang terlibat disimpan sebagai energi vibrasi dari mode Amida-I (peregangan C=O). Hal ini dikarenakan energi yang dihasilkan dari hidrolisis ATP yaitu sekitar 0.42 eV adalah dua kali kuanta energi vibrasi C=O, dimana satu kuanta vibrasi C=O berenergi sebesar 0.205 eV sehingga energi bebas yang dihasilkan dari hidrolisis ATP dapat mengeksitasi keadaan vibrasi internal protein (Amida I) sebesar dua kuanta energi. Mode vibrasi Amida-I terkopling dengan fonon kisi. Interaksi eksiton dengan fonon melalui kopling menyebabkan deformasi kisi yang mengakibatkan energi vibrasi Amida-I dapat terlokalisasi pada struktur heliks dan terjaga dari dispersi, sehingga memunculkan fenomena “ self-localization”.5,6
Dalam hal ini, eksiton dapat dipandang sebagai soliton yang merambat sepanjang rantai molekular dengan tetap menjaga bentuk, energi dan momentum. Seperti yang ditunjukkan oleh Gambar 4, daerah α-heliks protein merupakan suatu rantai asam amino yang berpilin dan digandeng oleh ikatan hidrogen. Terdapat tiga kanal sepanjang heliks dengan struktur sebagai berikut:5
5
Operator energi eksiton didefinisikan sebagai:
dimana indeks n menunjukan molekul peptida ke-n dalam satu kanal protein. dan adalah operator kreasi dan anihilasi boson untuk osilator Amida-I (C=O). E0 adalah energi eksiton, adalah kopling dipol-dipol antar unit terdekat (antar peptida) dalam satu kanal pada molekul peptida ke-n. merupakan operator jumlah (number operator) yang akan menghitung jumlah eksitasi pada setiap molekul. menyatakan transfer eksiton dari molekul peptida ke-n ke n±1. Sementara itu, operator energi fonon dinyatakan sebagai:
dengan dan masing-masing menunjukan operator momentum dan posisi asam amino, M adalah massa asam amino dan w adalah konstanta pegas dari ikatan hidrogen. Terakhir, operator interaksi eksiton-fonon dinyatakan sebagai:
dimana adalah parameter kopling eksiton-fonon yang menentukan tingkat nonlinieritas.
Dalam representasi kuantisasi kedua operator posisi dan momentum dinyatakan dalam bentuk operator kreasi dan anihilasi fonon. Metode ini umumnya digunakan untuk menyederhanakan dan mempermudah penanganan kasus partikel banyak pada mekanika kuantum.5,6,17
dimana dan adalah operator kreasi dan anihilasi fonon dengan bilangan gelombang k. Dengan hubungan operator
pada persamaan (5) dan (6), Hamiltonian Davydov dalam representasi kuantisasi kedua dapat dituliskan sebagai berikut:
dengan
dan adalah frekuensi fonon yang dapat diperoleh dari relasi dispersi berikut:
Dengan adalah jarak kisi. Untuk mengetahui perubahan Hamiltonian Davydov representasi kuantisasi pertama menjadi representasi kuantisasi kedua dapat dilihat di lampiran C.
Model ansatz yang digunakan dalam penelitian ini yaitu:
Akan tetapi dalam penelitian ini persamaan-persamaan di atas dapat diselesaikan dengan menggunakan ansatz , dimana adalah operator transformasi uniter yang mentransformasi keadaan dasar atau vakum ke keadaan quasi-klasik atau keadaan koheren .5,18
BAB 3
BAHAN DAN METODE
3.1
Waktu dan Tempat Penelitian
Komputasi, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB), dengan kegiatan meliputi penelusuran literatur melalui buku-buku dan internet, penelitian pendahuluan, pembuatan program, analisis output, pengolahan data dan penyusunan laporan.
3.2
Peralatan Penelitian
Pada penelitian kali ini alat-alat yang digunakan berupa alat tulis (kertas/buku tulis, pena, pensil), laptop/komputer milik pribadi dengan processor Intel (R) Atom (TM) CPU N270 dengan memori 1GB dan menggunakan Windows 7 Ultimate. Laptop tersebut dilengkapi dengan
software Matlab R2008b dari Mathwork, Inc. guna pembuatan program simulasi. Selain PC, peralatan yang digunakan berupa bahan rujukan dan pustaka yang peneliti dapatkan dari internet, perpustakaan dan buku catatan.
3.3
Metode Penelitian
Metode penelitian ini dimulai dari studi pustaka. Studi pustaka dilakukan untuk memahami proses dinamika molekuler protein sehingga mempermudah perancangan program simulasi. Selain itu studi pustaka akan mempermudah analisis hasil yang diperoleh dari program simulasi serta mengaitkannya dengan penurunan persamaan Davydov yang menggunakan
Hamiltonian system. Langkah selanjutnya setelah melakukan studi pustaka dari berbagai literatur yaitu penurunan sistem persamaan gerak secara analitik. Proses ini dilakukan untuk mengetahui sistem persamaan gerak nonlinier vibrasi C=O pada biomolekul protein secara analitik menggunakan trial wave atau ansatz dengan Hamiltonian system. Penurunan solusi eksak persamaan nonlinier Schrödinger-Davydov dapat dilihat di lampiran B. Setelah melakukan penurunan sistem persamaan gerak secara analitik, proses selanjutnya yaitu melakukan pemecahan persamaan gerak Davydov secara numerik. Perhitungan numerik bertujuan memecahkan persamaan gerak Davydov dan menganalisa dinamika energi pada protein. Adapun solusi eksak didapat secara manual. Solusi numerik dari persamaan differensial orde satu dan dua yang saling terkopel diselesaikan dengan bantuan metode Runge-Kutta orde-4. Dari solusi tersebut akan diperoleh grafik yang bisa menggambarkan distribusi energi pada protein α-heliks kemudian output tersebut dianalisis secara fisis. Program untuk mencari solusi numerik dapat dilihat di Lampiran E.
Selanjutnya, untuk mendukung pemrograman digunakan besaran-besaran yang mengacu pada nilai yang sebelumnya didapat oleh Davydov5yang disajikan pada Tabel 1.
Tabel 1 Konstanta Yang Mengacu Model Davydov5
Parameter Deskripsi Nilai Satuan
W M J
L
Konstanta pegas ikatan hidrogen Massa asam amino
Kopling dipol-dipol terdekat Kopling eksiton-fonon Konstanta kisi
Kopling dipol-dipol antar kanal
13-40 5,7 x 10-25 1,55 x 10-22
20-60 4,5 x 10-10 2,46 x 10-22
7
BAB 4
HASIL DAN PEMBAHASAN
4.1
Model
Matematika
dan
Persamaan Gerak
Model matematika pada model Davydov dapat diturunkan dengan menggunakan ansatz pada persamaan (12). Ansatz tersebut merupakan sebuah
trial function sebagai uji coba untuk menyelesaikan fungsi gelombang Davydov. Pada ansatz tersebut fungsi gelombang fonon bergantung indeks n, artinya fungsi gelombang fonon berbeda untuk setiap unit amida ke-n. Setelah itu, dapat dicari persamaan gerak dengan menggunakan persamaan euler-Lagrange yaitu Dengan bentuk Lagrangian untuk persamaan Schrödinger dapat diberikan oleh:
Persamaan gerak Ansatz dapat diperoleh dengan mensubstitusikan persamaan (12) dan persamaan (7), (8), (9) ke dalam persamaan (15). Dengan demikian diperoleh bentuk Lagrangian sebagai berikut:
Untuk memperoleh persamaan gerak dari , maka yang dipilih adalah dan untuk memperoleh persamaan gerak , maka yang dipilih adalah . Begitu juga untuk persamaan gerak dari , maka yang dipilih adalah dan untuk memperoleh persamaan gerak , maka yang dipilih adalah .
Dengan cara demikian maka diperoleh persamaan gerak untuk :
dan persamaan untuk yaitu:
Persamaan nonlinier Davydov terdiri dari dua persamaan nonlinier terkopel eksiton dan deformasi kisi (fonon). Dengan sistem persamaan nonlinier ini dapat diamati tentang penyimpanan energi dan dinamika transfer yang dilakukan oleh protein atau biomolekul pada umumnya. Harga ekspektasi hamiltonian pada persamaan (4) dan (5) dapat diuraikan sebagai berikut:
Dengan mensubstitusikan persamaan (3) terhadap persamaan (2) maka diperoleh persamaan nonlinier untuk dinamika eksiton adalah sebagai berikut:
dan diperoleh persamaan nonlinier untuk dinamika fonon sebagai berikut:
dengan merupakan harga ekspektasi operator uniter dan dapat dirumuskan sebagai berikut:
Dengan menerapkan transformasi tera (gauge) pada persamaan (8) dan (9), maka diperoleh:
Persamaan (24) dan (25) tersebut merupakan persamaan diferensial yang kemudian akan dicari fenomena dinamikanya.
4.2
Dinamika
Energi
Pada
Rantai Protein α
-Heliks
9
distribusi energinya berbeda-beda mengingat fungsi yang berbeda juga. Perbedaan tersebut dapat juga dilihat dengan melakukan berbagai variasi kondisi awal dan parameter di tiap fungsi tersebut. Hasil dan pembahasan akan dibahas satu persatu mulai dari kopling yang berbentuk konstan, fungsi gaussian landai dan curam, fungsi garis lurus dengan kemiringan positif dan kemiringan negatif.
4.2.1
Kopling
konstan
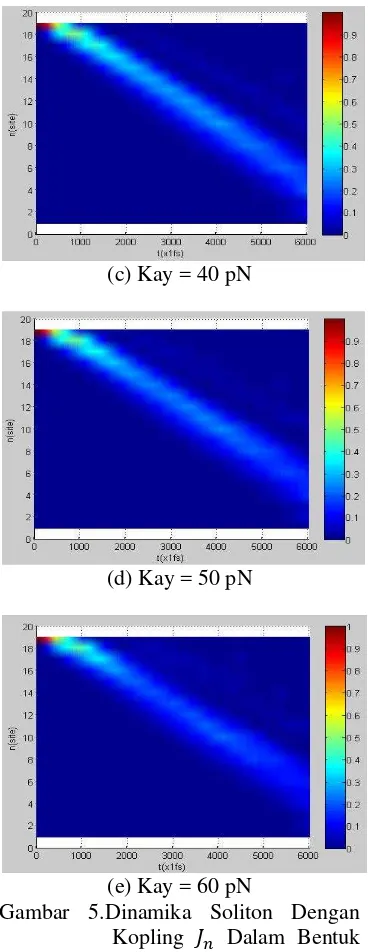
Kondisi awal yang ditentukan pada kasus ini yaitu konstanta pegas ikatan hidrogen sebesar 13 N/m, massa asam amino sebesar 5,7 x 10-25 kg, kopling sebesar 1,55 x 10-22 J, kopling dari 20 pN sampai 60 pN dengan site
molekulnya sebanyak 20. Iterasi dilakukan sebanyak 6000 dan eksitasi
site molekulnya dari site ke-19. Dinamika soliton yang terjadi pada kopling dipol antar unit terdekatdalam bentuk konstan yaitu travelling soliton. Dinamika ini dapat dilihat pada gambar 5 di bawah ini.
(a) Kay = 20 pN
(b) Kay = 30 pN
(c) Kay = 40 pN
(d) Kay = 50 pN
(e) Kay = 60 pN
Gambar 5.Dinamika Soliton Dengan Kopling Dalam Bentuk Konstan(view:90°).
Dari gambar 5 tampak bahwa
lintasan eksiton itu sendiri. Ini disebabkan oleh kopling dalam bentuk konstan. Dispersi terjadi ketika eksiton bergerak semakin cepat. Jadi, dalam hal ini dinamika travelling soliton
dapat diatur melalui kopling eksiton-fonon.
4.2.2
Kopling
bervariasi dalam
bentuk fungsi gaussian
4.2.2.1 Gaussian landai
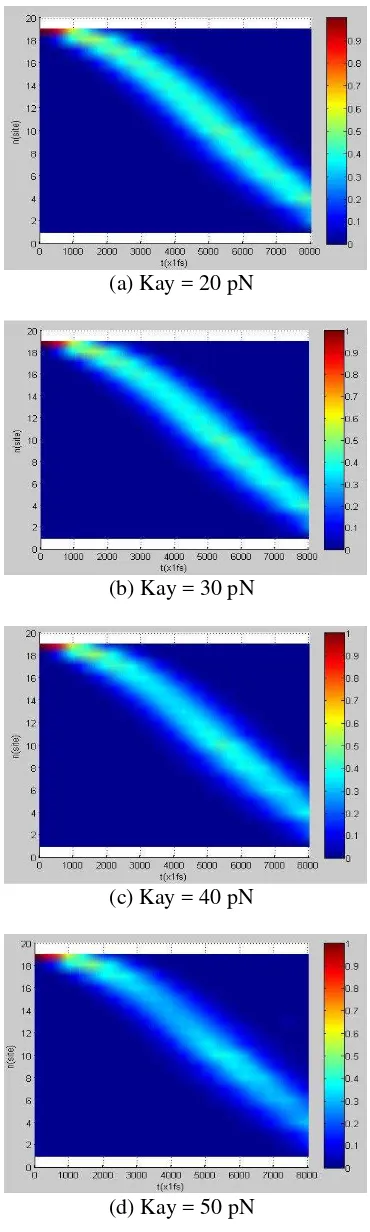
Kondisi awal yang ditentukan pada kasus ini yaitu konstanta pegas ikatan hidrogen sebesar 13 N/m, massa asam amino sebesar 5,7 x 10-25 kg, kopling dari 20 pN sampai 60 pN dengan site molekulnya sebanyak 20. Iterasi dilakukan sebanyak 8000 dan eksitasi site molekulnya dari site ke-19. Dinamika soliton yang terjadi yaitu
travelling soliton dan bending soliton. Kopling dalam bentuk fungsi gaussian landai dapat dilihat dalam gambar 6 yaitu hubungan antara kopling dengan n (site molekul). Dinamika
travelling soliton dan bending soliton
dapat dilihat pada gambar 7. Travelling soliton terjadi akibat tidak seimbangnya antara faktor dispersi dan nonlinieritas, dimana faktor dispersi lebih dominan.
Dinamika travelling soliton dapat diatur melalui kopling eksiton-fonon. Sementara itu, bending soliton terjadi akibat adanya perubahan kecepatan rambat eksiton. Bending soliton pada kasus initerjadi karena merupakan turunan dari kopling yang berbentuk fungsi gaussian itu sendiri sehingga gaya dapat berubah dan kecepatan konstan. Jadi, kecepatan rambat eksiton dapat diatur melalui fungsi kopling .
Gambar 6. Kurva Gaussian Landai
(a) Kay = 20 pN
(b) Kay = 30 pN
(c) Kay = 40 pN
11
(e) Kay = 60 pN
Gambar 7. Dinamika Soliton Dengan Kopling Dalam Bentuk Fungsi Gaussian Landai (view:90°)
Dari gambar 7 tampak bahwa perbedaannya, semakin besar kopling maka intensitas semakin bekurang dan terjadi dispersi. Eksiton bergerak semakin cepat yang ditunjukkan dengan kemiringan dari lintasan eksiton ketika dieksitasi dari site molekul ke-19. Semakin kecil kopling maka soliton akan semakin stabil dan sedikit terdispersi. Artinya, travelling soliton
dan bending soliton dapat berbelok dan kemudian terlokalisasi dalam suatu unit amida. Dinamika ini dapat menunjukkan mekanisme bagaimana transfer energi dan pembelokan eksiton, dimana energi yang diterima oleh unit amida tertentu dapat ditransfer ke unit amida lain. Transfer energi dan pembelokan eksiton terlihat masih tetap dan utuh sehingga sangat sedikit mengalami dispersi.
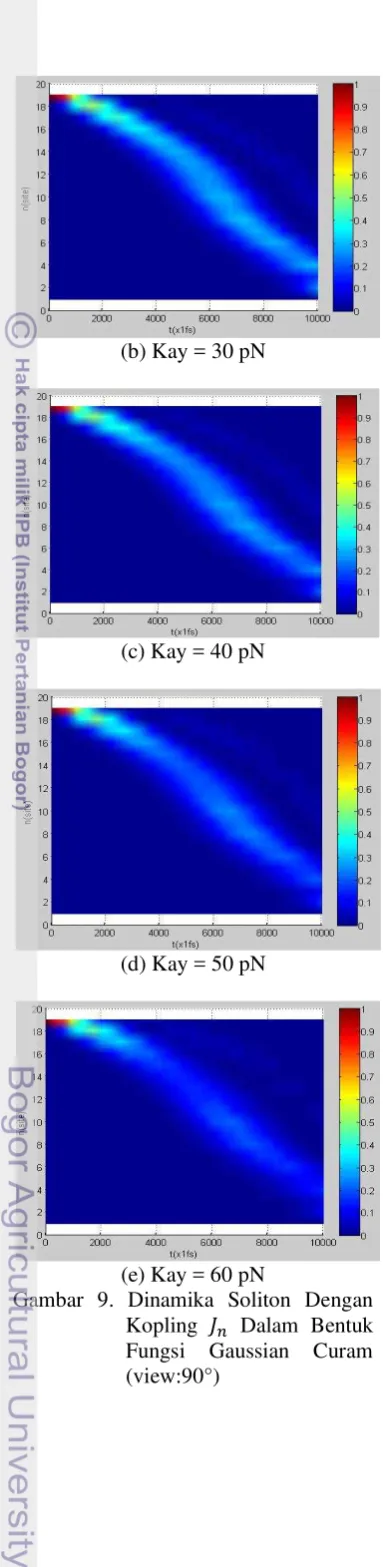
4.2.2.2 Gaussian curam
Kondisi awal yang ditentukan pada kasus ini yaitu konstanta pegas ikatan hidrogen sebesar 13 N/m, massa asam amino sebesar 5,7 x 10-25 kg, kopling dari 20 pN sampai 60 pN dengan site molekulnya sebanyak 20. Iterasi dilakukan sebanyak 10000 dan eksitasi site molekulnya dari site ke-19. Dinamika soliton yang terjadi yaitu
travelling soliton dan bending soliton. Kopling dalam bentuk fungsi gaussian curam dapat dilihat pada gambar 8 yaitu hubungan antara kopling dengan n (site molekul). Dinamika
travelling soliton dan bending soliton
dapat dilihat pada gambar 9.
Gambar 8. Kurva Gaussian Curam
Travelling soliton terjadi akibat tidak seimbangnya antara faktor dispersi dan nonlinieritas, dimana faktor dispersi lebih dominan sehingga dinamika
travelling soliton ini dapat diatur melalui kopling eksiton-fonon. Sementara itu,
bending soliton terjadi akibat adanya perubahan kecepatan rambat eksiton.
Bending soliton pada kasus initerjadi karena merupakan turunan dari fungsi gaussian itu sendiri sehingga gaya dapat berubah dan kecepatan konstan. Terlihat bahwa peluang eksiton membelok lebih ekstrim di tengah daripada pada saat kopling dalam bentuk fungsi gaussian landai. Hal ini dikarenakan fungsi dari kopling terlihat lebih curam. Semakin curam kopling maka semakin mendekati tidak adanya transfer energi protein karena nilai dari parameter kopling tersebut adalah nol. Jadi, kecepatan rambat eksiton dapat diatur melalui fungsi kopling .
(b) Kay = 30 pN
(c) Kay = 40 pN
(d) Kay = 50 pN
(e) Kay = 60 pN
Gambar 9. Dinamika Soliton Dengan Kopling Dalam Bentuk Fungsi Gaussian Curam (view:90°)
Dari gambar 9 tampak bahwa perbedaannya, semakin besar kopling maka travelling soliton dan bending soliton mengalami dispersi. Ini ditandai dengan adanya intensitas semakin bekurang dan mengalami dispersi, eksiton bergerak semakin cepat yang ditunjukkan dengan kemiringan dari lintasan eksiton. Artinya, travelling soliton dan bending soliton dapat berbelok dan kemudian terlokalisasi dalam suatu unit amida. Dinamika ini dapat menunjukkan bagaimana mekanisme transfer energi dan pembelokan eksiton, dimana energi yang diterima oleh unit amida tertentu dapat ditransfer ke unit amida lain.
Dinamika soliton yang menarik dari kopling dalam bentuk gaussian yang lebih curam lagi yaitu dinamika
13
Gambar 10. Kurva Gaussian Lebih Curam
.
Gambar 11. Dinamika Soliton Dengan Kopling Dalam Bentuk Fungsi Gaussian Lebih Curam (view:90°)
4.2.3
Kopling
bervariasi dalam
bentuk garis lurus dengan
kemiringan positif
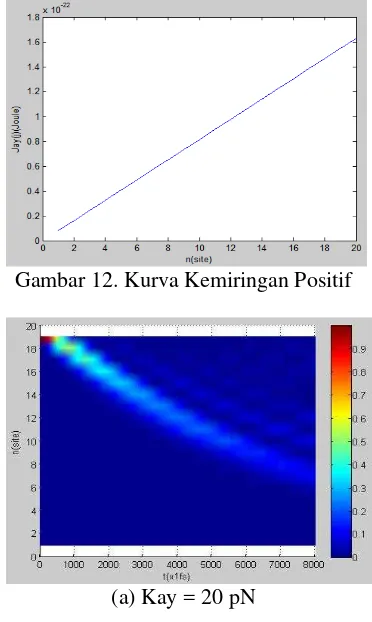
Kondisi awal yang ditentukan pada kasus ini yaitu konstanta pegas ikatan hidrogen sebesar 13 N/m, massa asam amino sebesar 5,7 x 10-25 kg, kopling dari 20 pN sampai 60 pN dengan site molekulnya sebanyak 20. Iterasi dilakukan sebanyak 8000 dan eksitasi site molekulnya dari site ke-19. Kopling dalam bentuk fungsi garis lurus dengan kemiringan positif dapat dilihat pada gambar 12 yaitu hubungan antara kopling dengan n (site
molekul). Dinamika soliton yang terjadi pada kopling dipol antar unit terdekatdalam bentuk fungsi garis lurus dengan kemiringan positif yaitu
travelling soliton dan bending soliton. Dinamika ini dapat dilihat pada gambar 13. Terlihat bahwa dinamika travelling
soliton dan bending soliton terjadi ketika kopling = 20 pN sampai dengan 60 pN dan eksitasi site molekulnya ditetapkan dari site ke-19. Travelling soliton terjadi akibat tidak seimbangnya antara faktor dispersi dan nonlinieritas, dimana faktor dispersi lebih dominan dan dapat diatur melalui kopling eksiton-fonon. Sementara itu, bending soliton terjadi akibat adanya perubahan kecepatan rambat eksiton. Dari gambar 13 tampak bahwa perbedaannya, semakin besar kopling maka dinamika travelling soliton dan bending soliton semakin terdispersi. Dispersi muncul ketika eksiton bergerak semakin cepat.
Gambar 12. Kurva Kemiringan Positif
(b) Kay = 30 pN
(c) Kay = 40 pN
(d) Kay = 50 pN
(e) Kay = 60 pN
Gambar 13. Dinamika Soliton Dengan Kopling Dalam Bentuk Garis Lurus Dengan Kemiringan Positif Dengan Eksitasi site ke- 19 (view:90°)
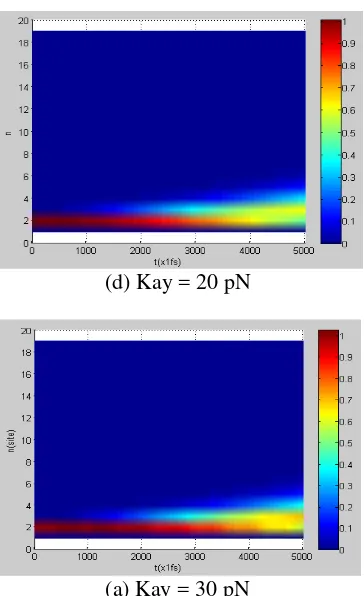
Pada gambar 13 terlihat bahwa pada saat eksitasi site ke-19, transfer energi dapat terjadi karena kopling dalam kasus ini dimulai dari yang besar ke yang kecil. Sebaliknya, ketika eksitasi dilakukan dari site ke-2, ternyata tidak mengalami adanya travelling soliton dan bending soliton. Dinamika ini dapat dilihat pada gambar 14. Eksiton tidak dapat bergerak dan tidak melakukan transfer energi. Eksiton hanya terjebak pada site ke-2 atau disebut dengan istilah (self-trapping). Hal ini menunjukkan terdapat sifat penyearah pada rantai proein alfa heliks yaitu hanya bisa dilakukan transfer energi dari kopling yang energinya besar ke kopling yang energinya kecil. Perbedaan kopling dapat mencirikan dinamika soliton tersebut yaitu semakin besar kopling maka semakin banyak terjadi dispersi dalam transfer energi dan pembelokan eksiton bergerak semakin cepat yang ditunjukkan dengan kemiringan dari lintasan eksiton itu sendiri.
(d) Kay = 20 pN
15
(b) Kay = 40 pN
(c) Kay = 50 pN
(e) Kay = 60 pN
Gambar 14. Dinamika Soliton Dengan Kopling Dalam Bentuk Garis Lurus Dengan Kemiringan Positif Dengan Eksitasi site ke-2 (view:90°)
4.2.4
Kopling
bervariasi dalam
bentuk garis lurus dengan
kemiringan negatif
Kondisi awal yang ditentukan pada kasus ini yaitu konstanta pegas ikatan hidrogen sebesar 13 N/m, massa asam amino sebesar 5,7 x 10-25 kg, kopling dari 20 pN sampai 60 pN dengan site molekulnya sebanyak 20. Iterasi dilakukan sebanyak 8000 dan eksitasi site molekulnya dari site ke-19. Kopling dalam bentuk fungsi garis lurus dengan kemiringan negatif dapat dilihat dalam gambar 15 yaitu hubungan antara kopling dengan n (site
molekul). Dinamika soliton yang terjadi tetap yaitu travelling soliton dan
bending soliton.
Berbeda kasus ketika kopling dengan fungsi garis lurus dengan kemiringan negatif. Ketika eksitasi site
dilakukan pada site ke-19, ternyata eksiton terjebak di dalamnya sehingga protein tidak dapat melakukan transfer energi pada saat itu karena energi pada kopling dari kecil ke besar. Hal ini dapat dilihat pada gambar 16. Perbedaan kopling dapat membedakan fenomena tersebut karena semakin besar kopling maka dinamika ini tetap sama, tidak mengalami perubahan apapun.
(a) Kay = 20 pN
(b) Kay = 30 pN
(c) Kay = 40 pN
(d) Kay = 50 pN
(e) Kay = 60 pN
Gambar 16. Dinamika Soliton Dengan Kopling Dalam Bentuk Garis Lurus Dengan Kemiringan Negatif Dengan Eksitasi site ke-19 (view:90°)
Sebaliknya, pada saat eksitasi dilakukan dari site ke-2, muncul dinamika travelling soliton dan bending soliton. Hal ini dapat dilihat pada gambar 17. Travelling soliton ditandai dengan adanya proses transfer energi oleh protein. Sementara itu, bending soliton ditandai dengan adanya perubahan kecepatan rambat eksiton yaitu pembelokan eksiton.Proses
travelling soliton dan bending soliton
dapat dikontrol dengan kondisi awal dan besar parameter kopling yang digunakan, baik kopling maupun kopling . Hal ini menunjukkan adanya sifat penyearah pada rantai protein alfa heliks. Artinya, energi dapat ditransfer hanya ketika energi dari kopling tersebut dari yang besar ke yang kecil.
17
(a) Kay = 20 pN
(b) Kay = 30 pN
(c) Kay = 40 pN
(d) Kay = 50 pN
(e) Kay = 60 pN
Gambar 17. Dinamika Soliton Dengan Kopling Dalam Bentuk Garis Lurus Dengan Kemiringan Negatif Dengan Eksitasi site ke-2 (view:90°)
BAB 5
KESIMPULAN DAN SARAN
5.1
Kesimpulan
Ada tiga kasus dinamika soliton yang terjadi pada protein α-heliks yaitu
travelling soliton, bending soliton dan
breathing soliton. Dinamika travelling soliton berhubungan langsung dengan fenomena transfer energi pada protein yaitu terjadi ketika kopling dibentuk dalam fungsi konstan, fungsi gaussian landai, fungsi garis lurus dengan kemiringan positif ketika site ke-19 dan negatif ketika site ke-2. Sementara itu dinamika bending soliton berkaitan dengan perubahan kecepatan rambat eksiton yang ditandai dengan adanya pembelokan eksiton. Bending soliton
terjadi ketika kopling dibentuk dalam fungsi gaussian landai dan curam, fungsi garis lurus dengan kemiringan positif ketika site ke-19 dan negatif ketika site
solitonhanya terjadi ketika kopling dibentuk dalam fungsi gaussian lebih curam, eksitasi site molekul dari site
yang tengah dan konstanta pegas ikatan hidrogen (w) dinaikkan sebesar 20 N/m. Ketiga dinamika ini dapat dikontrol dengan mengatur besar parameter kopling baik kopling eksiton-fonon ( ) maupun fungsi dari kopling dipol-dipol ( ) atau dengan mengatur dinamika energi pada unit amida dan eksitasi ditentukan pada site ke-2, 10 dan 19.
5.2
SaranPada penelitian ini, pemilihan kondisi awal yang tepat sangat berperan untuk mendapatkan output yang lebih optimal. Faktor iterasi juga ikut menentukan galat error dari output yang diperoleh. Maka dari itu diperlukan komputer dengan kemampuan numerik yang lebih baik. Untuk penelitian selanjutnya, kondisi awal dan faktor iterasi ditentukan dengan lebih tepat lagi, penentuan kopling dipol-dipol antar peptida dengan fungsi yang lain dan eksitasi site molekul tidak hanya dibatasi pada titik tertentu saja. Dengan site
molekul yang lebih banyak diharapkan bisa diperoleh dinamika energi protein yang lebih optimal.
DAFTAR PUSTAKA
1. Cottingham, J. P. dan Schweitzer, J. W. (1989). Calculation of the lifetime of a Davydov soliton at finite temperature. Phys. Rev. E 62, 15.
2. Wirahadikusumah, M. (1977).
Biokimia: Protein, Enzim, dan Asam Nukleat. Penerbit ITB: Bandung. 3. Forner, W. (1991). Quantum and
disorder effects in Davydov soliton theory. Phys. Rev. A 44, 4.
4. Yuwono, T. (2008). Biologi Molekular. Penerbit Erlangga: Jakarta.
5. Scott, A. (1992). Davydov’s soliton. Launcing the soliton, Physics Reports (Review Setion of Physics Letters) 217, No.1, 1-67.
6. Davydov, A. S. (1982). Biology and Quantum Mechanics, Pergamon Press, New York.
7. Hochstrasser, D., Mertens, F. G. dan Buttner, H. (1989). Energy transport by lattice solitons in α-helical proteins. Phys. Rev. A 40, 5.
8. Kapor, D. V., Skrinjar, M. J. dan Stojanovic, S. D. (1990). Variational approach to Davydov’s soliton theory for real phonons. Phys. Rev. A 41, 10.
9. Walker, J. M dan Rapley, R. (2002).
Molecular Biology and Biotechnology. University of Hertfordshire, Hatfield, UK: United Kingdom.
10. Harris, R. “Evaluating Internet Research Sources.” Soliton dan DNA. 20 Juni 2011. Web. 20 Apr. 2009. <http://www.wikipedia.org> 11. Mardanih. (2008). Distribusi Energi
Stasioner Dalam Tiga Kanal Protein Alfa Heliks Berdasarkan Persamaan Nonlinear Schrödinger-Davydov Diskrit. Skripsi. Departemen Fisika-FMIPA IPB.
12. Bresler, S. E. (1997). Introduction to Molecular Biology. Academic Press, Inc.: New York.
13. Smith and Wood. (1991). Molecular Biology and Biotechnology. London, NY, Tokyo. Melbourne Madvas, First Edition.
14. Daniel, M dan Vasumathi, V. “Perturbed Soliton Excitations in DNA Molecular Chain”. 20 Juni 2011. Web. 17 Feb. 2006. <http://www.biophysics.org/educati on/galia.pdf>
15. Zhang, Q., Romero-Rochin, V. dan Silbey, R. (1998). Variational approach to the Davydov soliton.
Phys. Rev. A 38, 12.
16. Schweitzer, J. W. (1997). Lifetime of the davydov soliton. The American Physical Society.Vol. 45, No.12, 52242-1479.
19
protein molecular systems”. Phys. Rev. E 73, 013901.
18. Cruizero-Hannson, L. dan Shozo, T. (1997). Davydov model: The quantum, mixed quantum-classical, and full classical systems. Phys. Rev. E 56, 1.
21
Lampiran A. Diagram Alir Penelitian
Penyusunan Literatur
Sudah siap
Analisa Persamaan Euler Lagrange
Solusi Eksak Persamaan Gerak Eksiton
Solusi Eksak Persamaan Gerak Fonon
Solusi Eksak Persamaan Gerak
Interaksi
Penyesuaian Dengan Literatur
Pembuatan dan Pengujian Program
Lampiran B. Penurunan Solusi Eksak Persamaan Nonlinier Schrödinger-Davydov a. Model Davydov
Hamiltonian sistem total:
Fungsi gelombang trial (ansatz) Davydov:
a. Persamaan Gerak
Persamaan Euler Lagrange dinyatakan sebagai berikut:
Dengan bentuk Lagrangian untuk persamaan Schrödinger, dapat diberikan oleh:
Sehingga persamaan (4) menjadi:
Karena
, maka
Pemakaian Ansatz I pada T = 0 yaitu:
Suku Ltuntuk ansatz I pada Lagrangian persamaan (5) yaitu diganti dengan ansatz ,
maka persamaannya menjadi:
Dengan menggunakan formulasi Glauber, turunan parsial terhadap waktu operator uniter dapat dinyatakan:
23
Dengan demikian persamaan (7) menjadi
Sedangkan suku Hamiltonian pada persamaan (6) diberikan oleh:
Harga ekspektasi yaitu:
Harga ekspektasi yaitu:
Harga ekspektasi yaitu:
Sehingga harga ekspektasi Hamiltonian sistem total berbentuk sebagai berikut:
Persamaan gerak eksiton diperoleh dengan menggunakan persamaan euler (persamaan (4)):
dengan memilih
Suku pada ruas kanan diperoleh dengan mensubstitusikan Hamiltonian pada persamaan (14):
Sehingga diperoleh:
Dengan
Glauber formula:
dengan
Sehingga
Dengan demikian menjadi:
25
Sama halnya dengan persamaan gerak eksiton, persamaan gerak untuk fonon diperoleh dengan menggunakan persamaan euler (persamaan (4))dengan memilih
Suku-suku pada ruas kanan dapat diuraikan sebagai berikut:
Suku pertama dapat diperoleh dengan mensubstitusikan persamaan (16):
Sedangkan suku kedua diperoleh dengan mensubtitusikan persamaan (13):
Masalah berikutnya adalah menghitung
Sehingga diperoleh persamaan gerak fonon:
Dengan mensubstitusikan persamaan
(persamaan (21))
27
Sehingga persamaan gerak fonon didapat sebagai berikut:
Lampiran C. Penurunan Hamiltonian Davydov Dari Representasi Pertama ke Representasi Kedua
Hamiltonian pada representasi pertama sebagai berikut:
Untuk Hamiltonian eksiton, representasi pertama ke representasi kedua tidak berubah bentuk persamaanya. Representasi pertama untuk Hamiltonian fonon sebagai berikut:
Persamaan (4) dapat diubah menjadi:
Dengan substitusi persamaan (6), maka:
Dengan substitusi persamaan (6), (7), (8) Hamiltonian fonon dapat diubah menjadi:
Maka, Hamiltonian fonon pada representasi kedua dapat dituliskan sebagai berikut:
Selanjutnya, representasi pertama untuk Hamiltonian interaksi sebagai berikut:
Diketahui bahwa:
Dengan substitusi persamaan (14), maka:
29
Sehingga Hamiltonian interaksi dapat ditulis sebagai:
Diketahui bahwa:
Lampiran D.19 Metode Rungge-Kutta Orde 4 (RK-4)
Jika terdapat suatu persamaan differensial biasa (PDB) dengan variabel perubahan x
terhadap waktu t.
Dengan mendiskritkan persamaan 1 saat limit dt→0 maka,
Dengan mengganggap bahwa dt merupakan suatu increament h.maka,
Untuk metode Runga-Kutta Orde 4, dilakukan ketelitian hingga orde 4 pada deret Taylor.
Dengan mengkoreksi penambahan fungsi hf(x,t) yaitu sebagai berikut.
Sehingga persamaan (4) menjadi
31
Lampiran E. Program Untuk Mencari Solusi Numerik
clear; for p=1:1
hbar=6.626e-34/(2*pi); img = complex(0,1); ws = 13;
Kay =20e-12; M=5.7e-25; n=19; h=1e-15; lgth=4.5e-10; for j=1:n+1 for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2)); end
end
for i=2:t for j=2:n for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2)); Suma1=Suma1+(a1(j)*(bdot(k)*conj(b1(j,k))-b1(j,k)*conj(bdot(k))));
Suma2=Suma2+((a1(j)*hbar*omega(k))*(conj(b1(j,k))*b1(j,k))); Suma3=Suma3+(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j*
lgth)/(2*n*M*omega(k))^(1/2))*(b1(j,k)+conj(b1(j,k)))*a1(j); end
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2)); Unplus1=Unplus1*exp((-1)*(abs(b1(j,k)- b1(j+1,k))^2*(0.5)+(b1(j,k)*conj(b1(j+1,k))-conj(b1(j,k))*b1(j+1,k))/2));
Unmin1=Unmin1*exp((-1)*(abs(b1(j,k)-b1(j-1,k))^2
*(0.5)+(b1(j,k)*conj(b1(j-1,k))-conj(b1(j,k))*b1(j-1,k))/2));
Unxplus1=Unxplus1*exp((-1)*(abs(b1(j+1,k)-
b1(j,k))^2*(0.5)+(b1(j+1,k)*conj(b1(j,k))-conj(b1(j+1,k))*b1(j,k))/2));
Unxmin1=Unxmin1*exp((-1)*(abs(b1(j-1,k)- b1(j,k))^2*(0.5)+(b1(j-1,k)*conj(b1(j,k))-conj(b1(j-1,k))*b1(j,k))/2));
B=(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j*lgth))/(2* n*M*omega(k))^(1/2);
ba1(j,k)=h*Jay(j)/hbar*(1/(img))*((-1)*((b1(j+1,k)-b1(j,k))*((1)*(a1(j+1)/a1(j))*Unplus1+0*conj((a1(j+1)/a1(j))
)*Unxplus1)+(b1(j-1,k)-b1(j,k))*((1)*(a1(j-
1)/a1(j))*Unmin1+0*conj((a1(j-1)/a1(j)))*Unxmin1))+(a1(j)*conj(a1(j))*2*hbar*omega(k)*(con j(b1(j,k))*b1(j,k)))/Jay(j)+hbar*omega(k)*b1(j,k)/Jay(j)+ B/Jay(j));
aa1(j)=h*Jay(j)/hbar*(1/(img))*((- img*hbar/2)*Suma1/Jay(j)-1*(a1(j+1)*Unplus1+a1(j-1)*Unmin1)+(Suma2+Suma3)/Jay(j));
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2)); Suma1=Suma1+((a1(j)+0.5*aa1(j))*(bdot(k)*conj((b1(j,k)+0.5*b a1(j,k)))-(b1(j,k)+0.5*ba1(j,k))*conj(bdot(k)))); Suma2=Suma2+(((a1(j)+0.5*aa1(j))*hbar*omega(k))*(conj((b1(j, k)+0.5*ba1(j,k)))*(b1(j,k)+0.5*ba1(j,k))));
Suma3=Suma3+(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j* lgth)/(2*n*M*omega(k))^(1/2))*((b1(j,k)+0.5*ba1(j,k))+conj(( b1(j,k)+0.5*ba1(j,k))))*(a1(j)+0.5*aa1(j));
end
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2));
Unplus1=Unplus1*exp((-
1)*(abs((b1(j,k)+0.5*ba1(j,k))-(b1(j+1,k)+0.5*ba1(j+1,k)))^2*(0.5)+((b1(j,k)+0.5*ba1(j,k))*
conj((b1(j+1,k)+0.5*ba1(j+1,k)))-conj((b1(j,k)+0.5*ba1(j,k)))*(b1(j+1,k)+0.5*ba1(j+1,k)))/2)) ;
Unmin1=Unmin1*exp((-1)*(abs((b1(j,k)+0.5*ba1(j,k))-
(b1(j-1,k)+0.5*ba1(j-
1,k)))^2*(0.5)+((b1(j,k)+0.5*ba1(j,k))*conj((b1(j- 1,k)+0.5*ba1(j-1,k)))-conj((b1(j,k)+0.5*ba1(j,k)))*(b1(j-1,k)+0.5*ba1(j-1,k)))/2));
Unxplus1=Unxplus1*exp((-1)*(abs((b1(j+1,k)+0.5*ba1(j+1,k))-(b1(j,k)+0.5*ba1(j,k)))^2*(0.5)+((b1(j+1,k)+0.5*ba1(j+1,k))*
conj((b1(j,k)+0.5*ba1(j,k)))-conj((b1(j+1,k)+0.5*ba1(j+1,k)))*(b1(j,k)+0.5*ba1(j,k)))/2)) ;
Unxmin1=Unxmin1*exp((-1)*(abs((b1(j-1,k)+0.5*ba1(j- 1,k))-(b1(j,k)+0.5*ba1(j,k)))^2*(0.5)+((b1(j-1,k)+0.5*ba1(j-
1,k))*conj((b1(j,k)+0.5*ba1(j,k)))-conj((b1(j-1,k)+0.5*ba1(j-1,k)))*(b1(j,k)+0.5*ba1(j,k)))/2)); B=(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j*lgth))/(2* n*M*omega(k))^(1/2);
ba2(j,k)=h*Jay(j)/hbar*(1/(img))*((1)*(((b1(j+1,k)+0.5*ba1(j
+1,k))-(b1(j,k)+0.5*ba1(j,k)))*((1)*((a1(j+1)+0.5*aa1(j+1))/(a1(j)+ 0.5*aa1(j)))*Unplus1+0*conj(((a1(j+1)+0.5*aa1(j+1))/(a1(j)+0
.5*aa1(j))))*Unxplus1)+((b1(j-1,k)+0.5*ba1(j-1,k))-
(b1(j,k)+0.5*ba1(j,k)))*((1)*((a1(j-1)+0.5*aa1(j- 1))/(a1(j)+0.5*aa1(j)))*Unmin1+0*conj(((a1(j-1)+0.5*aa1(j-1))/(a1(j)+0.5*aa1(j))))*Unxmin1))+((a1(j)+0.5*aa1(j))*(conj (a1(j))+0.5*aa1(j))*2*hbar*omega(k)*(conj(b1(j,k)+0.5*ba1(j, k)))*(b1(j,k)+0.5*ba1(j,k)))/Jay(j)+hbar*omega(k)*(b1(j,k)+0 .5*ba1(j,k))/Jay(j)+ B/Jay(j));
33
aa2(j)=h*Jay(j)/hbar*(1/(img))*((-
img*hbar/2)*Suma1/Jay(j)- 1*((a1(j+1)+0.5*aa1(j+1))*Unplus1+(a1(j-1)+0.5*aa1(j-1))*Unmin1)+(Suma2+Suma3)/Jay(j));
for k=1:n-1
Suma1=Suma1+((a1(j)+0.5*aa2(j))*(bdot(k)*conj((b1(j,k)+0.5*b a2(j,k)))-(b1(j,k)+0.5*ba2(j,k))*conj(bdot(k)))); Suma2=Suma2+(((a1(j)+0.5*aa2(j))*hbar*omega(k))*(conj((b1(j, k)+0.5*ba2(j,k)))*(b1(j,k)+0.5*ba2(j,k))));
Suma3=Suma3+(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j* lgth)/(2*n*M*omega(k))^(1/2))*((b1(j,k)+0.5*ba2(j,k))+conj(( b1(j,k)+0.5*ba2(j,k))))*(a1(j)+0.5*aa2(j));
end
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2));
Unplus1=Unplus1*exp((-
1)*(abs((b1(j,k)+0.5*ba2(j,k))-(b1(j+1,k)+0.5*ba2(j+1,k)))^2*(0.5)+((b1(j,k)+0.5*ba2(j,k))*
conj((b1(j+1,k)+0.5*ba2(j+1,k)))-conj((b1(j,k)+0.5*ba2(j,k)))*(b1(j+1,k)+0.5*ba2(j+1,k)))/2)) ;
Unmin1=Unmin1*exp((-1)*(abs((b1(j,k)+0.5*ba2(j,k))-
(b1(j-1,k)+0.5*ba2(j-
1,k)))^2*(0.5)+((b1(j,k)+0.5*ba2(j,k))*conj((b1(j- 1,k)+0.5*ba2(j-1,k)))-conj((b1(j,k)+0.5*ba2(j,k)))*(b1(j-1,k)+0.5*ba2(j-1,k)))/2)); Unxplus1=Unxplus1*exp((-1)*(abs((b1(j+1,k)+0.5*ba2(j+1,k))-(b1(j,k)+0.5*ba2(j,k)))^2 *(0.5)+((b1(j+1,k)+0.5*ba2(j+1,k))*conj((b1(j,k)+0.5*ba2(j,k
))-conj((b1(j+1,k)+0.5*ba2(j+1,k)))*(b1(j,k)+0.5*ba2(j,k)))/2)) ;
Unxmin1=Unxmin1*exp((-1)*(abs((b1(j-1,k)+0.5*ba2(j- 1,k))-(b1(j,k)+0.5*ba2(j,k)))^2*(0.5)+((b1(j-1,k)+0.5*ba2(j-
1,k))*conj((b1(j,k)+0.5*ba2(j,k)))-conj((b1(j-1,k)+0.5*ba2(j-1,k)))*(b1(j,k)+0.5*ba2(j,k)))/2));
B=(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j*lgth))/(2* n*M*omega(k))^(1/2);
ba3(j,k)=h*Jay(j)/hbar*(1/(img))*((-1)*(((b1(j+1,k)+0.5*ba2(j+1,k))(b1(j,k)+0.5*ba2(j,k)))*((1)* ((a1(j+1)+0.5*aa2(j+1))/(a1(j)+0.5*aa2(j)))*Unplus1+0*conj(( (a1(j+1)+0.5*aa2(j+1))/(a1(j)+0.5*aa2(j))))*Unxplus1)+((b1(j -1,k)+0.5*ba2(j-1,k))-(b1(j,k)+0.5*ba2(j,k)))*((1)*((a1(j- 1))/(a1(j)+0.5*aa2(j)))*Unmin1+0*conj(((a1(j-
1)+0.5*aa2(j-1))/(a1(j)+0.5*aa2(j))))*Unxmin1))+((a1(j)+0.5*aa2(j))*(conj (a1(j))+0.5*aa2(j))*2*hbar*omega(k)*(conj(b1(j,k)+0.5*ba2(j, k)))*(b1(j,k)+0.5*ba2(j,k)))/Jay(j)+hbar*omega(k)*(b1(j,k)+0 .5*ba2(j,k))/Jay(j)+ B/Jay(j));
aa3(j)=h*Jay(j)/hbar*(1/(img))*((-
img*hbar/2)*Suma1/Jay(j)- 1*((a1(j+1)+0.5*aa2(j+1))*Unplus1+(a1(j-1)+0.5*aa2(j-1))*Unmin1)+(Suma2+Suma3)/Jay(j));
fork=1:n-1
Suma1=Suma1+((a1(j)+aa3(j))*(bdot(k)*conj((b1(j,k)+ba3(j,k)) )-(b1(j,k)+ba3(j,k))*conj(bdot(k))));
Suma2=Suma2+(((a1(j)+aa3(j))*hbar*omega(k))*(conj((b1(j,k)+b a3(j,k)))*(b1(j,k)+ba3(j,k))));
Suma3=Suma3+(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j* lgth)/(2*n*M*omega(k))^(1/2))*((b1(j,k)+ba3(j,k))+conj((b1(j ,k)+ba3(j,k))))*(a1(j)+aa3(j));
end
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2));
Unplus1=Unplus1*exp((-1)*(abs((b1(j,k)+ba3(j,k))-(b1(j+1,k)+ba3(j+1,k)))^2*(0.5)+
((b1(j,k)+ba3(j,k))*conj((b1(j+1,k)+ba3(j+1,k)))-conj((b1(j,k)+ba3(j,k)))*(b1(j+1,k)+ba3(j+1,k)))/2));
Unmin1=Unmin1*exp((-1)*(abs((b1(j,k)+ba3(j,k))-(b1(j-1,k)+ba3(j-1,k)))^2 *(0.5)+
((b1(j,k)+ba3(j,k))*conj((b1(j-1,k)+ba3(j-1,k)))-conj((b1(j,k)+ba3(j,k)))*(b1(j-1,k)+ba3(j-1,k)))/2));
Unxplus1=Unxplus1*exp((-1)*(abs((b1(j+1,k)+ba3(j+1,k))-(b1(j,k)+ba3(j,k)))^2 *(0.5)+
((b1(j+1,k)+ba3(j+1,k))*conj((b1(j,k)+ba3(j,k)))-conj((b1(j+1,k)+ba3(j+1,k)))*(b1(j,k)+ba3(j,k)))/2));
Unxmin1=Unxmin1*exp((-1)*(abs((b1(j-1,k)+ba3(j- 1,k))-(b1(j,k)+ba3(j,k)))^2*(0.5)+((b1(j-1,k)+ba3(j- 1,k))*conj((b1(j,k)+ba3(j,k)))-conj((b1(j-1,k)+ba3(j-1,k)))*(b1(j,k)+ba3(j,k)))/2));
B=(2*img)*Kay*(hbar^0.5*sin(wn*lgth)*exp(img*wn*j*lgth))/(2* n*M*omega(k))^(1/2);
ba4(j,k)=h*Jay(j)/hbar*(1/(img))*((-
1)*(((b1(j+1,k)+ba3(j+1,k))-(b1(j,k)+ba3(j,k)))*((1)*((a1(j+1)+aa3(j+1))/(a1(j)+aa3(j))) *Unplus1+0*conj(((a1(j+1)+aa3(j+1))/(a1(j)+aa3(j))))*Unxplus 1)+((b1(j-1,k)+ba3(j-1,k))-(b1(j,k)+ba3(j,k)))*((1)*((a1(j- 1)+aa3(j-1))/(a1(j)+aa3(j)))*Unmin1+0*conj(((a1(j-1)+aa3(j-1))/(a1(j)+aa3(j))))*Unxmin1))+((a1(j)+aa3(j))*(conj(a1(j))+ aa3(j))*2*hbar*omega(k)*(conj(b1(j,k)+ba3(j,k)))*(b1(j,k)+ba 3(j,k)))/Jay(j)+hbar*omega(k)*(b1(j,k)+ba3(j,k))/Jay(j)+ B/Jay(j));
end
img*hbar/2)*Suma1/Jay(j)-35
1*((a1(j+1)+aa3(j+1))*Unplus1+(a1(j-1)+aa3(j-1))*Unmin1)+(Suma2+Suma3)/Jay(j));
a1(j)=a1(j)+(aa1(j)+2*aa2(j)+2*aa3(j)+aa4(j))/6; asq1(j,i)=abs(a1(j))^2;
for k=1:n-1
wn=2*pi*(n/2-k)/(n*lgth);
omega(k)=2*sqrt(ws/M)*abs(sin(wn*lgth/2));
Unplus1=Unplus1*exp((-1)*(abs(b1(j,k)-b1(j+1,k))^2
*(0.5)+(b1(j,k)*conj(b1(j+1,k))-conj(b1(j,k))*b1(j+1,k))/2));
Unmin1=Unmin1*exp((-1)*(abs(b1(j,k)-b1(j-1,k))^2 *(0.5)+(b1(j,k)*conj(b1(j-1,k))-conj(b1(j,k))*b1(j-1,k))/2));
Unxplus1=Unxplus1*exp((-1)*(abs(b1(j+1,k)-
b1(j,k))^2*(0.5)+(b1(j+1,k)*conj(b1(j,k))-conj(b1(j+1,k))*b1(j,k))/2));
Unxmin1=Unxmin1*exp((-1)*(abs(b1(j-1,k)-b1(j,k))^2
*(0.5)+(b1(j-1,k)*conj(b1(j,k))-conj(b1(j-1,k))*b1(j,k))/2));
b1(j,k)=b1(j,k)+(ba1(j)+2*ba2(j)+2*ba3(j)+ba4(j))/6; asp1(j,i)=abs(b1(j,k))^2;
bdot(k)=Jay(j)/hbar*(1/(img))*((-1)*((b1(j+1,k)-b1(j,k))*((1)*(a1(j+1)/a1(j))*Unplus1*+0*conj((a1(j+1)/a1(j)
))*Unxplus1)+(b1(j-1,k)-b1(j,k))*((1)*(a1(j-
1)/a1(j))*Unmin1+0*conj((a1(j-1)/a1(j)))*Unxmin1))+(a1(j)*conj(a1(j))*2*hbar*omega(k)*(con j(b1(j,k))*b1(j,k)))/Jay(j)+hbar*omega(k)*b1(j,k)/Jay(j)+ B/Jay(j));
end end end
[image:45.595.80.503.35.822.2]