LAMPIRAN A
DATA HASIL PENELITIAN
L. A. 1 PROSES PENCUCIAN ADSORBEN PASIR PUTIH Tabel A.1 Data Proses Pencucian Adsorben Pasir Putih
Pencucian pH
L. A. 2 PROSES PENGERINGAN ADSORBEN PASIR PUTIH Tabel A.2 Data Proses Pengeringan Pasir Putih
Waktu
3
16 0,5684 12,0500
20 0,4543 12,0778
LAMPIRAN B
CONTOH PERHITUNGAN
B.1 Pembuatan Larutan (Stock Solution)
Contoh pembuatan larutan multi-sistem dari (Cd(CH3COO)2.2H2O) dengan kondisi sebagai berikut :
Konsentrasi Cd(II) : 50 ppm
Volume : 5 liter
Mr. Cd(CH3COO)2.2H2O : 266.529 g/mol
Ar. Cd : 112.411 g/mol
Untuk membuat larutan Cd(II) 50 ppm maka diperlukan massa masing-masing senyawa sebesar :
Massa Cd (50 mg/L), m = 50 mg/L x 5 Liter m = 250 mg
Massa Cd(CH3COO)2.2H2O yang diperlukan,
m2 = 592,755 mg m2 = 0,593 g
B.2 Perhitungan Kapasitas Adsorpsi
Untuk pH 4,5 dan konsentrasi larutan 50 ppm (Konsentrasi Cd aktual, C0 = 49,2983 mg/L), pada waktu t = 24 jam diperoleh konsentrasi Ct = 11,5166 mg/L dengan volume sampel Cd(II) 50 ppm = 1000 mL dan massa adsorben pasir = 1000g. Sehingga dapat dihitung kapasitas adsorpsi Cd dengan persamaan sebagai berikut :
qt = 37,7817 mg/kg
Kapasitas Cd(II) teradsorpsi di pasir = qt = 37,7817 mg/kg
Maka, Kapasitas Cd(II) teradsorpsi di pasir pada setiap 13 gram sampel(q13) =
= 0,4911 mg
Kapasitas adsorpsi residual, dengan vr = 70ml dan massa sampel 13 gram:
qr =
=
= 0,2034mg
Kapasitas adsorpsi total pasir kontaminasi dengan pengeringan menggunakan oven:
+
= 0,4911 mg+0,2034mg = 0,6945
4.1.1 Perhitungan pore volume pada molom remediasi
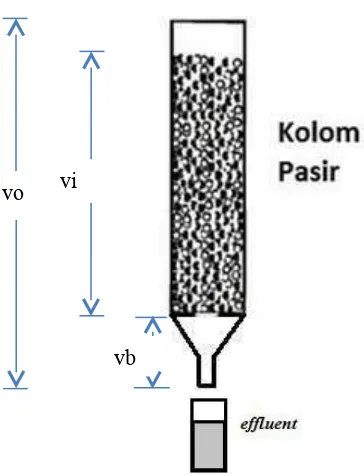
Kalibrasi volume pori molom
Kolom diisi dengan aquadest 10 ml dan diukur sebagai Vo. Kolom diisi dengan aquadest setinggi batas kawat dan diukur volumenya sebagai, V batas bawah kolom (Vb) = 1 ml.
Gambar 4.4 Ilustrasi Perhitungan Pore Volume
A. Perhitungan monsentrasi SDS(cmc)
CMC SDS = 8,2 mmol
Berat molekul SDS = 288,372
1 cmc SDS =
Maka 1 cmc SDS adalah sebesar : 2,364 gr/L Jika 0,5 x cmc = 0,5 x 2,364= 1,182 gr/L 2x cmc = 2 x 2,364 = 4,728 gr/ L
B. Perhitungan persen removal efisiensi - remediasi
1. Konsentrasi aktual hasil analisa AAS Cd(II) yang berhasil ter-remove atau terlepas = 1,5666 ppm (1,5666 mg/L)dengan volume sampel yang ditampung = 50 ml maka dapat dihitung kapasitas desorpsi Cd dengan persamaan sebagai berikut :
qr = 0,078330 mg maka, persen removal efisiensi :
vo vi
LAMPIRAN C
DOKUMENTASI PERCOBAAN
C.1 Hasil Pencucian Adsorben Pasir Putih
Gambar C.3 Kaliberasi Laju Alir SDS
Gambar C.4 Proses Pencucian Adsorben Pasir Putih - Adanya Channeling Effect
Gambar C.5 Proses Pencucian Adsorben Pasir Putih - Tanpa Channeling Effect
C.6 Eksperimen
Gambar C.6
Eksperimen
DAFTAR PUSTAKA
[1] Y. Hala “Kajian Mekanisme Penjerapan Ion ni2+, cu2+, zn2+, cd2+, dan pb2+ pada Nannochloropsis Salina dalam Medium Conwy.” Disertasi,Sekolah Doktorali Universitas Hassanudin, Makassar, 2013,hal. 6.
[2] Patut Surbakti, 2013. “Analisis Logam Berat cadmium (cd), cuprum (cu), cromium (cr), ferrum (fe), nikel (ni), zinkum (zn) pada Sedimen Muara Sungai Asahan di
Tanjung Balai dengan Metode Spektrofotometri Serapan atom (SSA).”Tesis, Sekolah Magister i Universitas Sumatera Utara, 2011, hal. 6.
[3] C.N.N Muligan, R.N.Yong, dan B.F.Gibbs “Remediation Technologies for Metal-Contaminated Soils and Groundwater : an evaluation.”Jurnal engineering geology (2001) vol.60 . department of building, civil and environmental engineering, concordia university, quebec, canada.
[4] Bode Haryanto and Chien-Hsiang Chang, “Removing Adsorbed Heavy Metal Ions from Sand Surfaces via Appying Interfacial Properties of Rhamnolipid”, Journal of Oleo Science Aaaaaa00(2015) 1-8.
[5] Xuhui Mao et al.,. Use of Surfactants for the Remediation of Contaminated soils.” Journal of Hazardous Materials (2014). School of Resource and Environmental Science, Wuhan University, Wuhan 430072, China, hal. 6
[6] Widaningrum, Miskiyah dan Suismono. “Bahaya Kontaminasi Logam Berat dalam Sayuran dan Alternatif Pencegahan Cemarannya.” Buletin Teknologi Pascapanen Pertanian Vol. 3 2007 (2013)
[7] Rochyatun, E dan Rozak, A. “Pemantauan Kadar Logam Berat Dalam Sedimen Di Perairan Teluk Jakarta”. Jurnal Makara Sains (2007). Vol. 11 No. 1 April 2007i 28-36.
[9] Hasrianti, “Adsorpsi Ion Cd2+ dan Cr2+ pada Limbah Cair menggunakan Kulit Singkong”, Tesis, Program Pasca Sarjana Universitas Hasanuddin. Makassar, 2012. [10] Palar, H. Pencemaran dan Toksikologi Logam Berat. Rineka Cipta (2008)i Jakarta. [11] Lahuddin. “Aspek Unsur Mikro dalam Kesuburan Tanah.” Pidato Pengukuhan
Jabatan Guru Besar Tetap dalam Bidang Ilmu Kesuburan Tanah (2007).Fakultas Pertanian. Universitas Sumatera Utara
[12] Widowati, W., dkk. “Efek Toksik Logam (2008)”. Yogyakartai Penerbit Andi. Hal. 109- 110, 119-120, 125-126.
[13] Lenny Sri Nopriani. “Teknik Uji Cepat untuk Identifikasi Pencemaran Logam Berat Tanah di Lahan Apel Batu.” Disertasi, Program Doktoral,Fakultas Pertanian Universitas Brawijaya 2011. hal.12
[14] Julhim S. Tangio. “Adsorpsi Logam Timbal (Pb) Dengan Menggunakan Biomassa Enceng Gondok (Eichhorniacrassipes).” Jurnal Entropi, Volume VIII, Nomor 1, Inovasi Penelitian, Pendidikan dan Pembelajaran Sains, Pendidikan Kimia, FMIPA Universitas Negeri Gorontalo, 2013.
[15] Endang Widjajanti Laksono. “Analisis Daya Adsorpsi Suatu Adsorben.”Makalah PPM (2002)., Jurusan Pendidikan Kimia FMIPA Univ. Negeri Yogyakarta.
[16] Reynold, T. D, “Unit Operations and Process in Environmental
Engineering”,(Californiai Brooks/ Cole Engineering Division Monterey, 1982). [17] Khasanah, “ Adsorpsi Logam Berat. Oseana”, (Jakartai Pewarta Oseanaa, 2009). [18] Castellan, G. W., 1982. Physical Chemistry, Second Edition. McGraw Hill, New
York.
[19] Oscik, J, “Adsorbtion, Edition Cooper”, (New Yorki John Wiley and Sons, 1991). [20] Adamson, A.W, “Physical Chemistry of Surface”, 5th ed. (New Yorki John Wiley
and Sons,1990).
[21] Elliott, H.A, Liberati, M.R, and Huang, C.P, “Competitive Adsorption oh Heavy Metal by Soils”. Journal of Enviromental Quality. 15, (1986), hal 214-219. [22] Mukesh K. Raikwar,et al., “Toxic Effect of Heavy Metals in Livestock Health.”
[23] Elham Farouk Mohamed. “Removal of Organic Compounds form Water by Adsorption and Photocatalytic Oxidation”. Institut National Polytechnique de Toulouse (INP Toulouse) ( 2011).
[24] Reza Ansari*, Ali Mohammad-khah and Mansoureh Nazmi, “Application of chemically modified beach sand as low cost efficient adsorbent for dye removal”, Current Chemistry Letters 2 (2013) 215–223.
[25] Dr. Kamar Shah Ariffin (2004)” What is Silica?” Makalah Mineral Perindustrian -EBS 425 .
[26]Dr. Ed McCoy “Golf Course Soil and Water Science” Ohio State University (2011) . [24] Reza Ansari*, Ali Mohammad-khah and Mansoureh Nazmi, “Application of
chemically modified beach sand as low cost efficient adsorbent for dye removal”, Current Chemistry Letters 2 (2013) 215–223.
[25] Bode Haryanto, Jo-Shu Chang and Chien-Hsiang Chang, “Application of
Biosurfactant Surfactin on Coper Ion Removal from Sand Surfaces with Continuous
Flushing Technique”, Carl Hanser Publisher, Munich (2014) 1-5.
[26] Bode Haryanto and Chien-Hsiang Chang, “Foam-Enhanced Removal of Adsorbed Metal Ions from Packed Sands with Biosurfactant Solution Flushing”, Journal of The Taiwan Institute Of Chemical Engineers (2014) 2170-2175.
[27] Hao Wang, Jiajun Chen, “Enhanced Flushing of Polychlorinated Biphenyls Contaminated Sands Using Surfactant Foam: Effect of Partition Coefficient and
Sweep Efficiency”, Journal of Environmental Sciences 2012, 24(7) 1270–1277.
[28] Anhua Long a,b, Hui Zhang a,⇑, Yang Lei a “Surfactant Flushing Remediation of
Toluene Contaminated soil: Optimization with Response Surface Methodology
[29] Catherine N. Mulligan ⁎, Suiling Wang “Remediation of a Heavy
Metal-Contaminated Soil by a Rhamnolipid Foam” Engineering Geology 85 (2006) 75– 81.
[30] Guangping Fan a,b, Long Cang a, Guodong Fang a, Dongmei Zhou a,⇑ “Surfactant
and Oxidant Enhanced Electrokinetic Remediation of a PCBs Polluted Soil”, Separation and Purification Technology 123 (2014) 106–113.
[31] Venkatesh Chaturvedi, Ashok Kumar” Toxicity of Sodium Dodecyl Sulfate in Fishes and Animals. A Review ” Volumei Ii Issue-2 (2010) School of
Biotechnology, Banaras Hindu University, Varanasi-221 005.
[32] CIR publication (1983). "Final Report on the Safety Assessment of Sodium Lauryl Sulfate and Ammonium Lauryl Sulfate". International Journal of Toxicology.
[33] Marrakchi S, Maibach HI (2006). "Sodium lauryl sulfate-induced irritation in the human face: regional and age-related differences". Skin Pharmacol Physiol.
[34] Dr. Meenu Mangal1*, Dr. Mala Agarwal2 and Davika Bhargava3 ” Effect of Cadmium and Zinc on growth and Biochemical Parameters of Selected Vegetables.” Journal of Pharmacognosy and Phytochemistry Vol. 2 No. 1 2013
[35] A. Da˛browski “Adsorption _ from theory to practice” Advances in Colloid and Interface Science 93 Ž (2001). 135-224
[36] Mulligan, Catherine N. 2004. Environmental Applications for Biosurfactants. Department Building, Civil and Environmental Engineering, Concordia University, Canada.
BABBIII
METODOLOMIBPENELITIAN
3.1 LOKASIBDANBWAKTUBPENELITIAN
Penelitian dilakukan di Laboratorium Proses Industri Kimia dan Laboratorium
Operasi Teknik Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas
Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 3 bulan.
3.2 BAHAN
Pada penelitian ini bahan yang digunakan antara lain:
1. SDS
2. Pasir putih terkontaminasi ion logam Cd
3. Aquades
plastik, shaker, saringan mesh 20, pH meter, gelas ukur, beaker glass 1 Liter, corong,
erlenmeyer, neraca analitik, cawan, termometer, pipet tetes, cutter, statif dan klem.
Atomic Adsorption Spectroscopy (AAS) adalah alat analisa yang berfungsi untuk
mengukur kandungan logam dan Peristaltic pump digunakan sebagai pengatur laju
alir pada kolom pencuci.
B3.4BBBProsedurBPenelitian
3.4.1BProsedurBPreparasiBPasirB(Adsorben)
a. PencucianBAdsorbenBPasirB
2. Setiap 1000 gr pasir putih dicuci dengan 1,2 L air deionisasi sambil
diaduk dengan propeller 100 rpm selama 1 jam
3. Effluent cucian dibuang dan ditambahkan air pencuci baru. Dilakukan
sebanyak 3-4 kali sampai pH air pencuci sama dengan pH effluent
Gambar 3.1 Flowchart Persiapan Adsorben Pasir Putih
b. PengeringanBAdsorbenBPasirB
1. Oven dinyalakan dan ditunggu hingga mencapai suhu 55oC [15]
2. Pasir putih yang telah dicuci yang masih basah ditimbang dan dicatat
massanya lalu diletakkan dan diratakan diatas tray oven dialasi
aluminium foil.
3. Setiap 20 menit waktu pengeringan, pasir putih yang dialasi aluminium
foil ditimbang sampai massanya konstan.
4. Dibiarkan hingga suhu kamar.
5. Kemudian pasir putih diayak dengan ayakan berukuran 20 mesh. Selesai
Mulai
Setiap 1000 gr pasir putih dicuci dengan 1,2 L air deionisasi sambil diaduk
dengan propeller 100 rpm selama 1 jam
Pasir putih diperoleh dari Pantai Wisata di Kecamatan Pantai Cermin,
Kabupaten Serdang Berdagai, Sumatera Utara, Indonesia.
Effluent cucian dibuang dan ditambahkan air pencuci baru dan diaduk
kembali. Dilakukan sebanyak 3-4 kali sampai pH air pencuci sama dengan
Gambar 3.2 Flowchart Pengeringan Adsorben Pasir Putih
c. ProsedurBPembuatanBLarutan
Larutan yang perlu disediakan yaitu larutan asam serta larutan basa yaitu
larutan 0,1 M HCl 3 Liter dan 0,1 M NaOH 3 Liter. Kedua larutan tersebut
digunakan sebagai pelarut logam yang pH-nya 4,5 sebanyak 5 L dari larutan logam
Cd2+ dengan konsentrasi 50 ppm dari senyawa Cd(CH
3COO)2.2H2O.
PembuatanBLarutanBPengontrolBpHB:BHClB0,1BMB(1BL)
1. Larutan HCl 37% dipipet sebanyak 8,36 mL
2. Larutan dimasukkan ke dalam beaker glass 1000 mL
3. Larutan diencerkan dengan aquadest sampai batas 1000 mL Selesai
Kemudian pasir putih diayak dengan ayakan berukuran 20 mesh
Setiap 20 menit waktu pengeringan, pasir putih yang dialasi
aluminium foil ditimbang sampai massanya konstan.
Mulai
Oven dinyalakan dan ditunggu hingga mencapai suhu 55°C
Ditimbang dan dicatat massanya lalu diletakkan diatas tray
oven dan dikeringkan.
Gambar 3.3 Flowchart Pembuatan Larutan HCl 0,1 M
d. PembuatanBLarutanBPengontrolBpH:BNaOHB0,1BMB(1BL)
1. Padatan NaOH ditimbang sebanyak 4gr
2. Padatan NaOH dimasukkan ke dalam beaker glass 1000 mL
3. Padatan NaOH diencerkan dengan aquadest sampai batas 1000 mL
Gambar 3.4 Flowchart Pembuatan Larutan NaOH 0,1 M
e. PembuatanBLarutanBPelarutBdenganBpHB4,5
1. Aquadest sebanyak 5 L dimasukkan ke dalam botol steril
2. Kemudian ke dalam aquadest ditambahkan HCl dan NaOH hingga pH
larutan 4,5
Mulai
Larutan HCl 37% dipipet sebanyak 8,36 mL
Selesai
Larutan dimasukkan ke dalam beaker glass 1000 mL
Larutan diencerkan dengan aquadest sampai batas 1000 mL
Mulai
Padatan NaOH ditimbang sebanyak 4gr
Selesai
Padatan NaOH dimasukkan ke dalam beaker glass 1000 mL
Gambar 3.5 Flowchart Pembuatan Larutan Pelarut
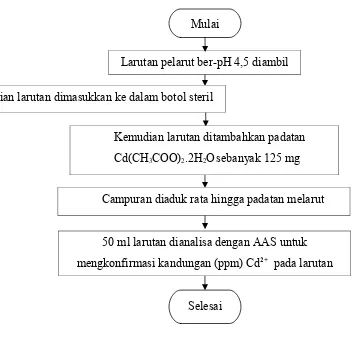
f. BPembuatanBLarutanBCd2+
B50Bppm
1. Larutan pelarut ber-pH 4,5 diambil sebanyak 2,5 L
2. Kemudian larutan dimasukkan ke dalam botol steril
3. Kemudian larutan ditambahkan padatan Cd(CH3COO)2.2H2Osebanyak
125 mg
4. Campuran diaduk rata hingga padatan melarut
5. Diambi; 50 ml larutan untuk dianalisa dengan AAS untuk
mengkonfirmasi kandungan (ppm) Cd2+BBpada larutan
Mulai
Aquadest sebanyak 5 L dimasukkan ke dalam botol steril
Selesai
Kemudian ke dalam aquadest ditambahkan HCl dan NaOH
Gambar 3.6 Flowchart Pembuatan Larutan Standar Cd2+ (50 ppm)
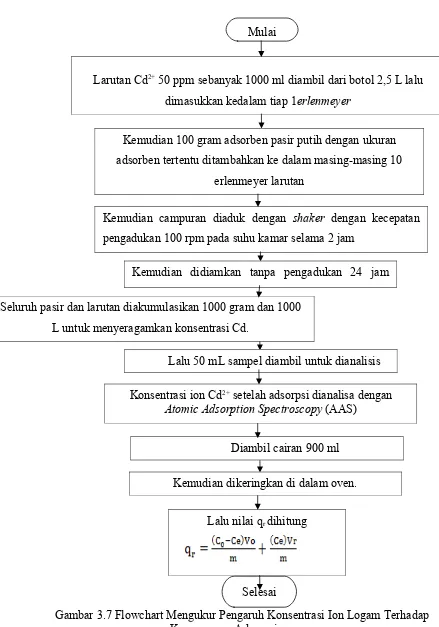
g. MengukurBPengaruhBKonsentrasiBIonBLogamBTerhadapBKemampuan
Adsorpsi
1. Larutan Cd2+ 50 ppm sebanyak 100 ml diambil dari botol 2,5 L lalu
dimasukkan kedalam tiap 10 erlenmeyer.
2. Kemudian 100 gram adsorben pasir putih dengan ukuran adsorben
tertentu ditambahkan kedalam masing-masing 10 erlenmeyer larutan.
3. Kemudian campuran diaduk dengan shaker dengan kecepatan
pengadukan 100 rpm pada suhu kamar selama 2 jam.
4. Kemudian didiamkan tanpa pengadukan 24 jam untuk mencapai
kesetimbangan adsorpsi Cd(CH3COO)2.2H2Oterhadap pasir.
5. Seluruh pasir dan larutan diakumulasikan 1000 gram pasir 1000 L
larutan untuk menyeragamkan konsentrasi Cd.
6. Lalu 50 mL sampel diambil untuk dianalisis. Selesai
50 ml larutan dianalisa dengan AAS untuk
mengkonfirmasi kandungan (ppm) Cd2+
Kemudian larutan dimasukkan ke dalam botol steril
7. Konsentrasi ion Cd2+ pada larutan setelah adsorpsi dianalisis dengan
Atomic Adsorption Spectroscopy (AAS).
8. Kemudian diambil cairan 900ml.
9. Kemudian dikeringkan di dalam oven.
10. Lalu dihitung konsentrasi(ppm) Cd2+ yang terdapat pada pasir :
[2]
qr = jumlah ion logam yang teradsorpsi (mg/g)
C0 = konsentrasi ion logam sebelum teradsorpsi (mg/L)
Ce = konsentrasi ion logam setelah adsorpsi (mg/L)
V = volume larutan ion logam (L)
Gambar 3.7 Flowchart Mengukur Pengaruh Konsentrasi Ion Logam Terhadap Kemampuan AdsorpsiBBBBBBBBBBBB
BBBB
Mulai
Larutan Cd2+ 50 ppm sebanyak 1000 ml diambil dari botol 2,5 L lalu
dimasukkan kedalam tiap 1erlenmeyer
Kemudian campuran diaduk dengan shaker dengan kecepatan
pengadukan 100 rpm pada suhu kamar selama 2 jam
Kemudian 100 gram adsorben pasir putih dengan ukuran
adsorben tertentu ditambahkan ke dalam masing-masing 10
erlenmeyer larutan
Kemudian didiamkan tanpa pengadukan 24 jam
Konsentrasi ion Cd2+ setelah adsorpsi dianalisa dengan
Atomic Adsorption Spectroscopy (AAS)
Lalu nilai qr dihitung
Selesai
Lalu 50 mL sampel diambil untuk dianalisis Seluruh pasir dan larutan diakumulasikan 1000 gram dan 1000
L untuk menyeragamkan konsentrasi Cd.
Diambil cairan 900 ml
h. BProsedurBPengukuranBPoreBVolume
1. Kolom diisi dengan aquadest 10 ml dan diukur sebagai Vo. Kolom diisi
dengan aquadest setinggi batas kawat dan diukur volumenya sebagai, V
batas bawah kolom (Vb) = 1 ml.
2. Kolom diisi dengan 13 gr pasir, kemudian ditambahkan aquadest
sebanyak 7ml sampai semua pasir terbasahi, volumenya diukur sebagai
volume isian (Vi). Maka didapat volume pada setiap pori pasir (volume
pore pasir = Vp)
Vp (pore volume) = Vo-Vi – Vb
Gambar 3.8 Flowchart Mengukur Pore Volume
3.4.2 MengukurBRemovalBEfisiensiBterhadapBVariasiBKonsentrasi SDS
1. Sampel Pasir yang terkontaminasi Cd2+ sebanyak 13 gr dimasukkan
kedalam kolom pencuci
2. Kemudian dicuci dengan 0,5 cmc surfaktan dengan pengontrolan laju alir Mulai
Selesai
Kolom diisi dengan aquadest 10 ml dan dukur sebagai V
o.
Kolom diisi dengan aquadest setinggi batas kawat dan diukur
volumenya sebagai, V batas bawah kolom (V
b) = 1 ml.
Diukur vol Maka didapat volume pada setiap pori pasir
= V
p (pore volume) = Vo-Vi – Vb
V
p (pore volume) = Vo-Vi – Vb
Kolom diisi dengan 13 gr pasir, kemudian ditambahkan aquadest
sebanyak 7ml sampai semua pasir terbasahi, volumenya diukur sebagai volume isian (V
4. Lalu sampel diambil hingga 24 pore volume
5. Konsentrasi ion Cd2+ pada effluent dianalisa dengan Atomic Adsorption
Spectroscopy (AAS).
6. Lalu nilai Removal Efisiensi(RE)dihitung
%RE = Persentasi penghapusan logam (%)
qr = Kapasitas adsorpsi ion Cd (II) pada setiap 13 gr pasir (gr/L)
qt = Kapasitas desorpsi ion Cd (II) pada masing-masing variasi (gr/L)
7. Kemudian percobaan diulang untuk variasi Konsentrasi SDS(0; 1; 2; 5
cmc)
Gambar 3.9 Flowchart Mengukur Removal Efisiensi terhadap Variasi
Konsentrasi SDS
3.4.3 B Mengukur B Akumulasi B Removal B Efisiensi B terhadap B Variasi LajuBAlirBSDS
1. Sampel Pasir yang terkontaminasi Cd2+ sebanyak 13 gr dimasukkan
kedalam kolom pencuci
2. Kemudian 2 cmc surfaktan dialirkan dengan pengontrolan variasi laju Mulai
Sampel Pasir yang terkontaminasi Cd2+ sebanyak 13 gr dimasukkan
kedalam kolom pencuci
Kemudian effluent surfaktan ditampung pada beaker glass Kemudian dicuci dengan 0,5 cmc surfaktan dengan pengontrolan
laju alir 2ml/menit kedalam larutan.
Lalu sampel diambil hingga 24 PV
Konsentrasi ion Cd2+ pada effluent dianalisa dengan Atomic
4. Lalu sampel diambil hingga 24 pore volume.
5. Konsentrasi ion Cd2+ pada effluent setelah dianalisa dengan Atomic
Adsorption Spectroscopy (AAS)
6. Lalu nilai Removal Efisiensi(RE) dihitung
[2]
7. Kemudian percobaan diulang untuk variasi Laju Alir SDS.
8. Percobaan dilakukan 2 kali.
Sampel Pasir yang terkontaminasi Cd2+ sebanyak 13 gr dimasukkan
kedalam kolom pencuci
Lalu sampel diambil hingga 24 pore volume. Kemudian 2 cmc surfaktan dialirkan dengan pengontrolan laju
alir 2ml/menit ditambahkan kedalam larutan
Konsentrasi ion Cd2+ pada effluent dianalisa dengan Atomic
Adsorption Spectroscopy (AAS)
Gambar 3.10 Flowchart Mengukur Removal Efisiensi terhadap Laju Alir
SDS
3.4.4 BMenghitungBEfisiensiBterhadapBKinetikaBPengambianBSampelBSetiapB4 PoreBVolume
1. Sampel Pasir yang terkontaminasi Cd2+ sebanyak 13 gr dimasukkan kedalam
kolom pencuci.
2. Kemudian 2 cmc surfaktan dialirkan dengan pengontrolan laju alir 2ml/menit
ditambahkan ke dalam larutan.
3. Kemudian effluent surfaktan ditampung pada beaker glass.
4. Lalu sampel diambil setiap 4 pore volume hingga 24 pore volume
5. Konsentrasi ion Cd2+ pada effluent setelah dianalisa dengan Atomic
Adsorption Spectroscopy (AAS)
6. Lalu nilai Removal Efisiensi(RE) dihitung
[2]
%RE = Persentasi penghapusan logam (%)
qr = Kapasitas adsorpsi ion Cd (II) pada setiap 13 gr pasir (gr/L)
Gambar 3.11 Flowchart Menghitung Efisiensi terhadap Kinetika Pengambian Sampel Setiap 4 Pore Volume
3.5 B Rangkaian B Peralatan BRemediasi B Pasir B Terkontaminasi B dengan B Metode
Kolom
Kemudian effluent surfaktan ditampung pada beaker glass Kemudian dicuci dengan 2 cmc surfaktan dengan pengontrolan
laju alir 2ml/menit kedalam larutan.
Lalu sampel diambil setiap 4 pore volume hingga 24 PV
Konsentrasi ion Cd2+ pada effluent dianalisa dengan Atomic
Adsorption Spectroscopy (AAS)
Selesai
Gambar 3.12 Rangkaian Peralatan Remediasi Pasir Terkontaminasi dengan Metode
Kolom
Keterangan Gambar:
Sejumlah surfaktan X cmc dipompakan dengan pompa peristaltik dengan laju
alir X ml/menit ke kolom pasir yang berisi pasir terkontaminasi. Kemudian effluent
hasil cucian ditampung dan dianalisa dengan AAS untuk meninjau seberapa banyak
logam Cd2+ yang tersisihkan dan kemampuan surfaktan dalam menyisihkan logam
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pretreatment Adsorben Pasir Putih
Penelitian ini menggunakan pasir putih sebagai penjerap (adsorben)
diperoleh dari pantai wisata di Kecamatan Pantai Cermin, Kabupaten Serdang
Bedagai. Pasir putih terlebih dahulu dikeringkan di bawah sinar matahari dan
dipisahkan menurut ukuran (mesh) 40 mesh. Setelah kering, pasir putih dicuci
dengan aquadest dan dibilas sampai bersih.
Tujuan dari proses pencucian adsorben pasir putih adalah untuk
menghilangkan mineral-mineral garam serta kontaminan yang masih melekat
pada pasir putih tersebut. Indikator pencucian adalah apabila telah mendapatkan
pH air cucian sama dengan pH aquadest sebelum digunakan untuk mencuci.
Gambar 4.1 Proses Pencucian Adsorben Pasir Putih
Gambar 4.1 menunjukkan kondisi konstan pH terhadap banyaknya
pencucian. Dari proses pencucian diperoleh bahwa untuk dapat menghilangkan
kandungan mineral-mineral garam dan kotoran-kotaran yang ada pada pasir putih
dibutuhkan 7 kali pencucian sampai pH pencucian menjadi konstan yaitu 6,9. pH
Gambar 4.2 Pengeringan Adsorben Pasir Putih
Setelah proses pencucian selesai, pasir putih yang telah dipisahkan menurut
ukurannya dikeringkan di dalam oven dengan kondisi operasi pada suhu 60oC. Menurut Revlisia, 2012, pengeringan adalah proses pemindahan panas dan uap air
secara simultan, yang memerlukan energi untuk menguapkan kandungan air yang
dipindahkan dari permukaan bahan. Pengeringan juga disebut dengan
penghidratan atau penghilangan sebagian atau keseluruhan uap air dari suatu
bahan sampai pada tingkat kadar air tertentu. Dari proses pengeringan diperoleh
hasil untuk sampel dengan ukuran 40 mesh yang membutuhkan waktu
pengeringan selama 4 jam.
4.2 Penentuan Kapasitas Adsorpsi.
Ukuran adsorben yang ada pada penelitian ini adalah 40 mesh. Proses
adsorpsi berlangsung selama 2 jam pengadukan dan didiamkan selama 24 jam
pada sistem batch. Tujuan penentuan kapasitas adsorpsi untuk mengetahui
besarnya penjerapan ion logam Cd2+ oleh adsorben pasir putih dengan ukuran 40 mesh.
+
[25] (4.1)Keterangan :
qe = massa logam teradsorpsi pada kesetimbangan (mg/g) qt = massa logam teradsorpsi pada waktu t (mg/g)
C0 = konsentrasi awal logam (mg/L)
Ce = konsentrasi logam kesetimbangan (mg/L) V = volume larutan (L)
Vr = volume residu larutan pada pasir (L)
w = massa adsorben (g)
.
Dari hasil analisa di atas dapat dilihat bahwa saat ukuran adsorben 40 mesh
memiliki kapasitas adsorpsi pada waktu 2 jam pengadukan dan 24 jam waktu
adsorpsi yaitu sebesar 0,694602 pada setiap 13 gram sampelnya serta persentase
adsorpsi 23,36%.
Pasir di Indonesia memiliki luas permukaan yang cukup besar. Hal ini dapat
dilihat dari hasil analisa penentuan besarnya luas permukaan pasir putih yang
dilakukan di Laboratorium Analisa Instrumental, PT. Indonesia Asahan
Aluminium (PT. INALUM), diperoleh bahwa luas permukaan spesifik dari
adsorben pasir putih adalah sebesar 0,622 m2/gram. Luas permukaan pasir putih di Indonesia lebih besar daripada luas permukaan pasir putih yang terdapat di negara
lain. Hal ini dapat dilihat dari luas permukaan spesifik pasir di Taiwan yang
diperoleh Haryanto (2015), sebesar 0,17 m2/gram.
Tabel 4.1 Konfirmasi Data Analisa BET Pasir Indonesia
Pasir Analisa AAS (ppm) Analisa BET (m2/gr) Sebelum Terkontaminasi 0 0,6220
Setelah Terkontaminasi 37,718 0,368
Tabel 4.1 menunjukkan adanya Cd (II) yang teradsorpsi dengan didukung
oleh konfirmasi analisa BET (Brunaeur Emmet Teller). Dimana terjadi perubahan
luas permukaan antara pasir sebelum terkontaminasi Cd (II) dan sesudah
Keberadaan atau adsorpsi Cd (II) pada pasir juga dikonfirmasi dengan data
analisa FTIR (Fourier Transform Infrared) :
`
Gambar 4.3 (b) konfirmasi analisa FTIR pasir sesudah terkontaminasi
Adanya perubahan gugus fungsi pada permukaan pasir sebelum dan sesudah
terkontaminasi ditunjukkan pada gambar 4.3 (a) dan (b). Hal ini didukung oleh
konfirmasi analisa FTIR pasir dan tabel FTIR oleh Skoog, Hooler dan Nieaman
bahwa ikatan kuat dan kompleks terjadi pada skala gugus 500-1000. Dari hasil
konfirmasi analisa ini menunjukkan adanya perubahan panjang gelombang gugus
pada skala 500-1000. Hal ini membuktikan bahwa terdapat ion Cd(II) pada pasir
4.3 Penentuan Pore Volume, Loading Time dan Channeling Effect
4.3.1 Perhitungan pore volume pada kolom remediasi
Kalibrasi volume pori kolom
Kolom diisi dengan aquadest 10 ml dan diukur sebagai Vo. Kolom diisi
dengan aquadest setinggi batas kawat dan diukur volumenya sebagai, V batas
bawah kolom (Vb) = 1 ml.
Kolom diisi dengan 13 gr pasir, kemudian ditambahkan aquadest sebanyak
7ml sampai semua pasir terbasahi, volumenya diukur sebagai volume isian (Vi).
Maka didapat volume pada setiap pori pasir (volume pore pasir = Vp) Vp(pore volume) = Vo-Vi– Vb
= 10 ml – 7 ml – 1 ml = 2ml
Gambar 4.4 Ilustrasi Perhitungan Pore Volume vo vi
4.3.2 Loading time
Loading Time atau T loading adalah waktu yang diperlukan SDS untuk
menembus pori pasir keluar kolom pencuci.
Gambar 4.5 Pengaruh Konsentrasi SDS dan laju alir SDS 4ml/menit terhadap
Loading Time
Dari Gambar 4.5 dapat dilihat pengaruh konsentrasi SDS terhadap laju alir
SDS 4 ml/menit dan diperoleh hasil perbandingan antara pencucian dengan air (0
cmc) dan pencucian menggunakan surfaktan. Pengaruh dari sifat permukaan
surfaktan yang dapat menurunkan tegangan permukaan air sampai 29 nm/m
memiliki loading time yang lebih singkat dibandingkan dengan air yang
mempunyai tegangan permukaan 72 nm/m.
Larutan surfaktan dengan konsentrasi misell 5x cmc cenderung langsung
mengalir keluar tanpa berinteraksi dengan permukaan pasir yang kemudian
menghasilkan channelling effect. Molekul air yang mungkin membasahi
permukaan pasir kemudian berinteraksi dengan komponen kimia pada permukaan
pasir cenderung akan menghambat loading time [26].
Dari hasil analisa dapat dilihat bahwa semakin besar loading time maka
semakin banyak ion Cd (II) yang ter-remove atau tercuci. Hal ini disebabkan
semakin besar juga waktu kontak antara ion Cd (II) dan SDS berinteraksi. Hal ini
4.3.3 Channeling Effect
Adanya channeling effect pada aliran larutan pencuci pada medium pasir
yang dimampatkan pada kolom pencuci menyebabkan rendahnya area kontak
antara larutan pencuci dan permukaan pasir. Akibatnya, kelompok misel hanya
dapat berinteraksi dengan beberapa ion Cd (II) yang teradsorpsi dan
menghasilkan persentasi removal atau persentasi pencucian yang kecil [25].
4.4 Penentuan Removal Efisiensi Cd2+ dengan Variasi Konsentrasi Surfaktan (SDS)
Data Removal Efisiensi pada variasi konsentrasi Variasi Konsentrasi
Surfaktan (SDS) dapat dilihat pada Tabel A.4 (Lampiran A) dan pada Gambar 4.6
dan 4.7
Gambar 4.6 Nilai Removal Efisiensi dengan Variasi Konsentrasi Surfaktan
Gambar 4.7 Nilai Removal Efisiensi dengan Variasi Konsentrasi Surfaktan (SDS)
Gambar 4.6 dan 4.7 merupakan grafik hubungan removal efisiensi terhadap
konsentrasi larutan SDS. Pada konsentrasi larutan Cd2+ 50 ppm pada saat, t0 = 0 menit dan ts= 2 jam hingga tads = 24 jam memiliki kapasitas Cd(II) teradsorpsi di pasir = qt = 37, 7817 mg/kg.
Untuk Kapasitas Cd (II) teradsorpsi di pasir pada setiap 13 gram sampel
(q13)= 0,4911 mg. Kapasitas Cd (II) teradsorpsi residu pada setiap 13 gr sampel = 0,2034 mg. Maka, Kapasitas adsorpsi total pasir kontaminasi pada setiap 13 gram
pasir dengan pengeringan menggunakan oven:
+
= 0,4911 mg + 0,2034mg
= 0,6945
Dengan kapasitas total adsorpsi pada setiap 13 gram pasir yang dicuci
tersebut maka diperoleh hasil pencucian untuk setiap variasi laju alir dan
konsentrasi SDS tertentu. Data removal efisiensi logam Cd (II) pada pasir putih
dengan variasi Konsentrasi SDS dapat dilihat pada Tabel A.5 (Lampiran A).
Dari hasil analisa di atas dapat dilihat pengaruh konsentrasi SDS dan laju
pencucian dengan air dan pencucian menggunakan surfaktan. Dapat dilihat bahwa
pencucian dengan air (0cmc) dengan peningkatan laju air SDS juga meningkatkan
removal efisiensi.
Pada saat 0,5 cmc diperoleh data yang fluktuatif. Hal ini disebabkan adanya
penambahan jumlah molekul SDS pada permukaan air sehingga mengakibatkan
interaksi terhadap pasir semakin rendah. Karena kelompok yang mengandung
sulfur dalam molekul SDS, SDS dapat mengikat dengan logam berat dan
memfasilitasi dan menginisiasikan desorpsi logam berat dari tanah [28].
Konsentrasi surfaktan merupakan faktor penting yang mempengaruhi efisiensi
desorpsi cadmium. Sistem kolom biasanya lebih kompleks karena transportasi
kimia meliputi proses fisik dan kimia secara bersamaan [30].
Tetapi pada saat 1 cmc atau misel sudah terbentuk, maka cukup untuk
menambah kemampuannya berinteraksi dengan ion logam pada permukaan pasir.
Ketika molekul surfaktan meningkat, ellipsoidal atau bola misel, konsentrasi
ambang batas surfaktan dimana misel mulai terbentuk disebut konsentrasi kritis
misel (CMC). Interaksi misel dengan permukaan hidrofilik dan lapisan inti
lipofilik dapat dengan mudah mendesorpsi kontaminan dan secara bersamaan
meningkatkan kelarutannya dalam fase air, sehingga lebih meningkatkan desorpsi
kontaminan dari pasir [5].
Pada saat 2 cmc, jumlah misel yang berinteraksi dengan ion logam Cd(II)
bertambah. Sehingga dapat lebih meningkatkan desorpsi ion logam Cd(II)
kontaminan dalam pasir. Tetapi didapat hasil yang fluktuatif terhadap peningkatan
laju alir. Hal ini disebabkan oleh adanya channeling effect yang tidak dapat
dikontrol pada laju alir SDS tertentu. Channeling effect pada aliran larutan
pencuci menyebabkan rendahnya area kontak antara larutan pencuci dan
permukaan pasir. Channeling effect merupakan faktor kunci yang membatasi
tercapainya efisiensi removal atau pencucian dalam teknik pencucian tanpa busa
[26].
Pada saat larutan surfaktan dengan konsentrasi misell 5x cmc jumlah misel
akan terus bertambah tetapi ukuran mereka akan hampir tetap konstan [36]. SDS
cenderung langsung mengalir keluar tanpa berinteraksi dengan permukaan pasir
yang kemudian menghasilkan channelling effect [25]. Menurut Ramamhurti
(2013), pada saat konsentrasi SDS melewati CMC menunjukkan pelepasan ion
logam yang tidak signifikan.
Menurut Xue Li, dkk (2011), peningkatan surfaktan tidak menyebabkan
peningkatan pengikatan yang efisien terhadap ion logam cadmium karena
fenomena yang terjadi hanya perubahan bentuk misel dan penambahan jumlah
agregat misel. Adanya peningkatan konsentrasi SDS, tolakan kuat terjadi antara
permukaan pasir dan molekul surfaktan karena grup/agregat kepala negatif dari
surfaktan SDS. Oleh karena itu sebelum mencapai CMC, terjadi peningkatan
adsorpsi dengan meningkatnya konsentrasi surfaktan [36]. Sistem kolom biasanya
lebih kompleks karena transportasi kimia meliputi proses fisik dan kimia terjadi
secara bersamaan.
Molekul air yang mungkin membasahi permukaan pasir kemudian
berinteraksi dengan komponen kimia pada permukaan pasir cenderung akan
menghambat loading time [25]. Channeling effect merupakan faktor kunci yang
membatasi tercapainya efisiensi removal atau pencucian dalam teknik pencucian
tanpa busa [26].
Hasil percobaan di atas menunjukkan bahwa removal efisiensi fluktuatif
terhadap konsentrasi SDS. Hal ini disebabkan adanya Channeling effect pada
aliran larutan pencuci menyebabkan rendahnya area kontak antara larutan pencuci
dan permukaan pasir. Akibatnya, kelompok misel hanya dapat berinteraksi dengan
beberapa ion Cd (II) yang teradsorpsi dan menghasilkan persentasi removal atau
persentasi pencucian yang kecil [25].
Fakta-fakta ini menyatakan bahwa pada pH rendah, SDS memiliki
kapasitas adsorpsi pasir yang tinggi karena sifat asam dari larutan yang membuat
permukaan pasir yang lebih positif dan menyebabkan interaksi permukaan pasir
dengan surfaktan anionik (seperti: SDS) tinggi sehingga kapasitas adsorpsi tinggi.
Dengan peningkatan konsentrasi surfaktan, adsorpsi pada permukaan partikel
Keberhasilan penerapan remediasi pasir terkontaminasi dengan metode
pencucian surfaktan dipengaruhi oleh dua faktor ilmiah, seperti: potensi molekul
surfaktan berinteraksi dan mendesorpsi ion logam pada permukaan pasir dan
kemampuan surfaktan terdispersi ke target kontaminan pada area pori [5].
Interaksi antara ion logam dan permukaan pasir akan mempengaruhi karakteristik
desorpsi ion logam dalam proses remediasi [4].
4.5 Penentuan Kinetika Desorpsi
Data kinetika desorpsi logam Cd (II) pada pasir putih pada kumulatif pore
volume pada tiap 4 pore volume dapat dilihat pada Tabel A.5 (Lampiran A) dan
Gambar 4.8.
Gambar 4.9 Data kinetika Removal Efisiensi pada setiap 4 pore volume
Gambar 4.9 menunjukkan bahwa kenaikan removal efisiensi yang signifikan
terjadi 4 pore volume awal sampai 12 pore volume kemudian menurun pada 16
pore volume dan kemudian mencapai konstan. Hal ini disebabkan oleh adanya
channeling effect yang lebih dominan terjadi setelah 12 pore volume, sehingga
menurunkan interaksi antara misel dengan ion logam Cd(II) pada pasir dan
menyebabkan tidak ada lagi logam yang terdesorpsi. Channeling effect pada aliran
larutan pencuci menyebabkan rendahnya area kontak antara larutan pencuci dan
permukaan pasir.
Misel surfaktan yang semakin lama semakin kaku membuat misel lebih sulit
terdispersi di pasir dan berinteraksi dengan ion logam. Hal ini akan menghasilkan
aliran channeling effect yang menyebabkan rendahnya area kontak antara larutan
pencuci dengan permukaan pasir [25]. Sistem kolom biasanya lebih kompleks
BABBV
KESIMPULANBDANBSARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diperoleh antara lain sebagai berikut :
1. Dari hasil analisa diperoleh hasil removal logam terbesar terdapat pada
saat konsentrasi SDS 2 cmc sebesar 11,27%. Hasil removal logam
terkecil terdapat pada saat konsentrasi SDS 0,5 cmc sebesar 5,64%.
Konsentrasi surfaktan merupakan faktor penting yang mempengaruhi
efisiensi desorpsi ion logam cadmium.
2. Dari hasil analisa dapat dilihat bahwa persen removal emisiesi terbesar
terdapat pada saat loading time terbesar yaitu 37s dengan nilai 11,27%.
Semakin besar loading time maka waktu kontak antara ion Cd (II) dan
SDS berinteraksi akan semakin lama.
3. Pada konsenterasi SDS 0,5 cmc memiliki persen removal terkecil yaitu
5,6 % dengan loading time 19s. Adanya channeling emmect yang dominan
pada laju alir larutan SDS tertentu akan menghasilkan loading time yang
juga fluktuatif. Channeling emmect pada aliran larutan pencuci pada kolom
pencuci menyebabkan rendahnya area kontak antara larutan pencuci dan
permukaan pasir.
5.2 SARAN
Adapun saran yang perlu dilakukan penelitian lanjutan seperti:
1. Disarankan untuk penelitian lebih lanjut menggunakan busa (moam) untuk
mendapatkan efisiensi removal yang lebih baik pada proses remediasi/
pencucian.
2. Disarankan untuk terlebih dahulu melakukan studi eksperimental tentang
RTD (Residence Time Distribution) agar tidak terjadi channeling emmect
pada aliran.
3. Disarankan untuk menggunakan jenis surfaktan yang lain untuk
BAB II
TINJAUAN PUSTAKA
2.1 Pencemaran Logam Berat
Pencemaran logam berat di lingkungan merupakan masalah serius karena
kelarutan dan mobilitasnya menimbulkan toksisitas dan ancaman bagi kehidupan
makhluk hidup, termasuk manusia [6]. Logam-logam berat tersebut berasal dari aktifitas
manusia seperti buangan rumah tangga, buangan sisa industri yang tidak terkontrol yang
mengalir ke perairan dan pembakaran hidrokarbon dan batu bara diantaranya ada yang
melepaskan senyawa logam berat ke udara kemudian bercampur dengan air hujan dan
mengalir juga ke perairan. Logam berat merupakan istilah yang digunakan untuk
unsur-unsur transisi yang mempunyai massa jenis atom lebih besar dari 6 g/cm3 . Merkuri
(Hg), timbal (Pb), tembaga (Cu), kadmium (Cd) dan stronsium (Sr) adalah contoh logam
berat yang berupa kontaminan yang berasal dari luar tanah dan sangat diperhatikan
karena berhubungan erat dengan kesehatan manusia, pertanian dan ekotoksikologinya
[7].
Penumpukan logam berbahaya pada tumbuhan juga beresiko pada manusia dan
hewan [8]. Biota air yang hidup dalam perairan tercemar logam berat, dapat
mengakumulasi logam berat tersebut dalam jaringan tubuhnya. Biota air yang hidup
dalam perairan tercemar logam berat, dapat mengakumulasi logam berat tersebut dalam
jaringan tubuhnya. Makin tinggi kandungan logam dalam perairan akan menyebabkan
semakin tinggi pula kandungan logam berat yang terakumulasi dalam tubuh hewan
tersebut [9].
Adapun dampak negatif logam Cd dalam tubuh manusia yaitu dapat menghambat
kerja paru-paru, bahkan mengakibatkan kanker paru-paru, mual, muntah, diare, kram,
anemia, kerusakan ginjal dan hati [10]. Oleh karena itu, logam berat berbahaya ini dapat
mengganggu kehidupan organisme di lingkungan jika keberadaannya melampaui
Penyebab utama logam berat menjadi bahan pencemar berbahaya yaitu logam
berat tidak dapat dihancurkan (non degradable) oleh organisme hidup di lingkungan dan
terakumulasi ke lingkungan, terutama mengendap di dasar perairan membentuk senyawa
komplek bersama bahan organik dan anorganik secara adsorbsi dan kombinasi [11]
Logam berat berdasarkan sifat racunnya dapat dikelompokkan menjadi empat
golongan [12] yaitu :
a. Sangat beracun, dapat mengakibatkan kematian ataupun gangguan kesehatan
yang pulih dalam waktu yang lama. logam-logam tersebut adalah Hg, Pb, Cd,
Cr dan As.
b. Moderat. yaitu mengakibatkan gangguan kesehatan baik dalam waktu yang
relatif lama. logam-logam tersebut adalah Ba, Be, Cu, Au, Li, Mn, Se, Te, Co
dan Rb.
c. Kurang beracun. logam ini dalam jumlah besar menimbulkan gangguan
kesehatan. logam-logam tersebut adalah Al, Bi, Co, Fe, Ca, Mg, Ni, K, Ag, Ti
dan Zn.
d. Tidak beracun. yaitu tidak menimbulkan gangguan kesehatan. Logam-logam
tersebut adalah Na, Al, Sr dan Ca.
Logam berat dapat diklasifikasikan menjadi empat kelompok berdasarkan
kegunaannya bagi kesehatan [13], yaitu:
Esensial : Cu, Zn, Co, Cr, Mn dan Fe, logam ini juga disebut mikronutrien
(zat yang diperlukan tubuh tetapi dalam jumlah yang sangat
kecil) dan beracun jika diminum melebihi persyaratan.
Non esensial : Ba dan Zr.
Rendah racun : Sn dan Al.
2.1.1 Logam Berat Pencemar
a. Kadmium (Cd)
Kadmium murni merupakan logam lembut berwarna perak keputih-putihan.
Ciri-ciri fisik dari kadmium adalah nomor atom 48, atom berat 112.411, elektronegatif 1.5
kristal ionik radius (kepala negara valence) 0,97, potensi ionisasi 8.993, pada keadaan
oksidasi +2, elektron konfigurasi Kr 4d1 5S2, densitas 8,64 g/cm3, titik leleh 320.9 °C
dan titik didih 765 °C pada 100 kPa. Biasanya ditemukan dalam bentuk mineral yang
dikombinasikan dengan unsur-unsur lain seperti oksigen (kadmium oksida), klorin
(kadmium klorida) atau belerang (kadmium sulfat, kadmium sulfida) [14]. Logam
kadmium adalah bahan yang bersifat karsinogen. Organ tubuh yang menjadi sasaran
keracunan Cd adalah ginjal dan hati.
Kadmium lebih mudah diakumulasi oleh tanaman dibandingkan dengan ion
logam berat lainnya seperti timbal. Menurut badan dunia FAO/ WHO, konsumsi per
minggu yang ditoleransikan bagi manusia adalah 400-500 g per orang atau 7 mg per kg
berat badan. Kadmium yang terdapat dalam tubuh manusia sebagian besar diperoleh
melalui makanan olahan, makanan yang berasal dari perairan, pipa air, kopi, teh,
pembakaran batubara dan rokok merupakan sumber Cd yang utama., hanya sejumlah
kecil berasal dari air minum dan polusi udara[15]. Menurut penelitian yang dilakukan
oleh Laegreid (1999) dalam Charlene (2004), pemasukan Cd melalui makanan adalah
10-40 mg/ hari, sedikitnya 50% diserap oleh tubuh.
Penambahan kadmium (Cd) pada tanah terjadi melalui penggunaan pupuk fosfat,
pupuk kandang, dari buangan industri yang menggunakan bahan bakar batubara dan
minyak dan buangan inkineratur (tanur) [16]. Toksisitas Cd ini dipengaruhi karena
adanya interaksi antara Cd dan gugus sulfhidril(-SH) dari protein yang menyebabkan
Tabel 2.1 Ambang Batas Racun Yang Ditoleransi / Asupan Aman Logam Berat
Logam
Berat Batas Beracun Asupan yang Disarankan / Asupan Aman
Arsen 3 mg/hari selama 2-3 minggu 15 - 25 μg/hari (dewasa)
Kadmium 200 μg/kg berat basah 15 -50 μg/hari dewasa, 2 -25 μg/hari anak
Timbal >= 500 μg/L (Darah) 20 - 280 μg/hari dewasa, 10 - 275 μg/hari anak
Seng 150 μg/hari 15 μg/hari
2.2 Adsorpsi
Adsorpsi (penyerapan) merupakan suatu proses pemisahan dimana komponen
dari suatu fase fluida berpindah ke permukaan zat padat yang menyerap (adsorben).
Biasanya partikel-partikel kecil zat penyerap dilepaskan pada adsorpsi kimia yang
merupakan ikatan kuat antara penyerap dan zat yang diserap sehingga tidak mungkin
terjadi proses yang bolak-balik. Interaksi yang terjadi akan menyebabkan sifat- sifat
logam mengalami modifikasi atau perubahan. Menurut kekuatan interaksinya, ada 2 tipe
adsorpsi yaitu adsorpsi fisik (phisisorpsi) dan adsorpsi kimia (khemisorpsi). Dalam
adsorpsi fisik kekuatan ikatan antara molekul yang diadsorpsi dan permukaan sangat
lemah, atau tipe Van der Waals. Energi yang berasosiasi dengan ikatan tersebut relatif
lemah. Sebaliknya dalam adsorpsi kimia ikatan sangat berperan dan merupakan resultan
dari suatu transfer atau suatu penempatan elektron dalam reaksi antara adsorbat dan
adsorben . Kekuatan ikatan dalam khemisorpsi menjadi lebih penting dibandingkan pada
phisisorpsi. Keadaan molekul dari adsorbat akan berbeda dari keadaan awalnya. Atom
permukaan mempunyai suatu karakter elektronik tidak jenuh dengan kehadiran beberapa
kekosongan (valensi bebas). Pembentukan lapisan sempurna dari molekul yang
diadsorpsi secara kimia memungkinkan menjenuhkan secara sempurna pada daerah
kekosongan.
yang diadsopsi terurai menjadi molekul lain yang lebih kecil. Sebaliknya dikatakan
adsorpsi molekuler bila molekul yang diadsorpsi tidak mengalami disosiasi [17].
Adsorpsi merupakan metode yang paling umum dipakai karena memiliki konsep yang
lebih sederhana dan juga ekonomis. Proses adsorpsi yang paling berperan adalah
adsorben [18].
2.3 Faktor-faktor yang mempengaruhi Adsorpsi
Faktor-faktor yang mempengaruhi mekanisme adsorpsi adalah agitasi,
karakteristik adsorbat, ukuran molekul adsorbat, pH larutan, temperatur dan waktu
kontak [19].
1. Agitasi
Jika agitasi yang terjadi antara partikel karbon dengan cairan relatif kecil,
permukaan film dari liquid sekitar partikel akan menjadi tebal dan difusi film akan
terbatas. Kecepatan pengadukan juga merupakan salah satu faktor penting yang dapat
mempengaruhi kemampuan dan kapasitas adsorpsi dari suatu adsorben. Semakin besar
kecepatan pengadukan, maka akan semakin besar juga konstanta adsorpsinya. Hal ini
disebabkan oleh lapisan film pada adsorben mengalami penipisan maka adsorban akan
dapat menembus lapisan filmnya (Drastinawati dan Zultiniar, 2013).
Dalam proses adsorpsi, apabila kecepatan pengadukan kecil, maka adsorban akan
sulit menembus lapisan film yang berada di antara permukaan adsorben dan difusi
filmnya. Apabila kecepatan pengadukan sesuai, maka akan menaikkan film difusinya
sampai ke titik pori difusi (Asip, dkk., 2008).
2. Karakteristik adsorban
Ukuran partikel dan luas permukaan merupakan karakteristik terpenting dari
adsorban. Ukuran partikel adsorban mempengaruhi tingkat adsorpsi yang terjadi.
Tingkat adsorpsi meningkat seiring mengecilnya ukuran partikel. Total kapasitas
adsorpsi tergantung pada total luas permukaan dimana ukuran partikel adsorban tidak
3. Ukuran molekul adsorbat
Ukuran molekul merupakan bagian yang penting dalam adsorpsi karena
molekul harus memasuki micropore dari partikel adsorban untuk diadsorpsi. Tingkat
adsorpsi biasanya meningkat seiring dengan semakin besarnya ukuran molekul dari
adsorbat. Kebanyakan limbah terdiri dari bahan-bahan campuran sehingga ukuran
molekulnya berbeda-beda. Pada situasi ini akan memperburuk penyaringan molekul
karena molekul yang lebih besar akan menutup pori sehingga mencegah jalan masuknya
molekul yang lebih kecil.
4. Waktu Kontak
Waktu yang diperlukan untuk mencapai keadaan setimbang pada proses
penyerapan ion logam oleh adsorban hanya beberapa menit saja [20]. Jumlah zat yang
diadsorpsi pada permukaan adsorban merupakan proses untuk mencapai kesetimbangan
karena laju adsorpsi juga diikuti dengan proses desorpsi. Pada saat mula-mula reaksi,
proses adsorpsi lebih dominan daripada proses desorpsi sehingga proses adsorpsi
berlangsung cepat.
Pada akhir-akhir mencapai keadaan setimbang, peristiwa adsorpsi juga
cenderung mengalami perlambatan proses penyerapan pada keadaan setimbang namun
hal ini tidak terlihat secara makroskopis. Pada setiap jenis adsorban yang digunakan,
waktu untuk mencapai saat setimbang berbeda-beda. Perbedaan waktu untuk mencapai
keadaan setimbang dikarenakan jenis interaksi yang terjadi antara adsorban dan
adsorbat. Secara umum, waktu untuk mencapai kesetimbangan melalui mekanisme
secara fisika (physisorption) lebih cepat bila dibandingkan dengan mekanisme secara
kimia (chemisorption) [21].
Adsorpsi secara fisika, interaksi antara adsorban dan adsorbat terjadi melalui
pembentukan ikatan yang lebih kuat bila dibandingkan dengan mekanisme secara kimia.
Mekanisme secara kimia diawali dahulu dengan mekanise fisika, yaitu pada
partikel-partikel adsorbat mendekat ke permukaan adsorban melalui gaya Van der waals atau
5. Keasaman (pH)
Tingkat keasaman atau pH mempunyai pengaruh dalam proses adsorpsi. Untuk
mencapai pH optimum dalam proses adsorpsi ditandai dengan jumlah maksimum yang
dapat diserap adsorban adalah ditetapkan melalui uji laboratorium. Keasaman (pH) akan
mempengaruhi sisi aktif biomassa serta berpengaruh pada mekanisme adsorpsi ion
logam. Pada pH yang rendah, proses adsorpsi ion logam juga semakin rendah atau
lambat. Hal ini dikarenakan pada kondisi asam, gugus fungsi yang terdapat pada
adsorban terprotonasi sehingga terjadi pengikatan ion hidrogen (H+) dan ion hidronium
[20]. Sementara itu ion-ion logam dalam larutan sebelum teradsorpsi oleh adsorban
terlebih dahulu mengalami hidrolisis dan menghasilkan proton [23].
Dalam kondisi pH rendah (<7) permukaan adsorban akan bermuatan positif
sehingga mengalami tolakan antara pemukaan adsorban dengan ion logam akibatnya
proses adsorpsi menjadi lambat dan rendah. Sementara itu pada pH tinggi (>7), maka
proses adsorpsi relatif tinggi, hal ini dikarenakan komplek hidrokso logam (MOH+) yang
akan terbentuk di dalam larutan lebih banyak, demikian juga permukaan adsorban akan
bermuatan negatif sehingga melepaskan proton sehingga melalui gaya elektrostatik akan
terjadi tarik menarik yang menyebabkan peningkatan adsorpsi [24].
2.4 Mekanisme Adsorpsi
Proses adsorpsi molekul adsorbat dari fasa cair ke permukaan adsorben
melibatkan tahapan sebagai berikut:
∑ Transfer massa molekul adsorbat ke seluruh lapisan batas eksternal dari partikel padat.
∑ Transportasi molekul adsorbat dari permukaan partikel ke dalam bagian aktif dengan difusi dalam pori berisi cairan dan berpindah keseluruh permukaan padat
dari pori-pori.
∑ Adsorpsi molekul terlarut pada bagian aktif pada permukaan bagian dalam dari pori-pori.
2.5 Kinetika Adsorpsi
Jumlah adsorbat yang diserap dalam mg/g pada waktu t dihitung dengan
menggunakan persamaan berikut:
[24]
Dimana Co dan Ct masing-masing adalah konsentrasi adsorbat mula-mula dan
pada waktu t tertentu dalam mg/L. V adalah volume larutan adsorbat dalam ml dan m
adalah massa adsorben dalam mg .
2.6 Pasir
Partikel pasir dibentuk dari pecahan kristal magma beku dan batuan metamorf
atau dari batu pasir yang sudah ada. Berdasarkan kandungan mineralnya, pasir umumnya
terdiri dari kuarsa, Feldspar, Mika dan kapur (kalsit, dolomit dll). Klasifikasi dari
mineral partikel dapat disebut pasir berdasarkan ukurannya. Menurut skema klasifikasi
United States Department of Agriculture (USDA), partikel pasir berada pada rentang
diameter antara 0,05-2.0 mm. Dengan demikian, bahan mineral yang disebut pasir dapat
bervariasi tergantung pada skema klasifikasi yang digunakan [25].
Juga ada, subkategori partikel pasir terutama untuk skema USDA, yaitu pasir
sangat halus berkisar 0,05-0,1 mm, pasir halus berkisar dari 0,1-0.25 mm, pasir sedang
(medium) berkisar 0.25-0.5 mm, pasir kasar berkisar dari 0,5-1,0 mm, dan pasir sangat
kasar berkisar 1.0-2,0 mm. Untuk memahami tentang tren adsorpsi logam dengan
menggunakan pasir, pertimbangan hubungan antara jenis ion logam yang akan diserap
dengan silika dan feldspar (komponen pasir) akan sangat membantu. Silika (SiO2)
memiliki struktur yang terdiri dari tiga rangkaian dimensi tetrahedron yang tidak
terbatas. Setiap atom silikon membentuk empat ikatan tunggal dengan empat atom
oksigen yang terletak di empat penjuru tetrahedron [26].
fungsional pada permukaan, yang tidak melibatkan fase atau air cair molekul antara ion
dan permukaan . Pasir alam mungkin memiliki pori makro dan mesopori, dan porositas
sebagian besar dipengaruhi oleh ukuran partikel, bentuk biji-bijian, dan bentuk batuan
[5].
Porositas dapat diklasifikasikan menjadi porositas antar-partikel dan porositas
intraparticle. Pori-pori menyebabkan tidak hanya luas permukaan yang besar, tetapi juga
tingginya selektivitas adsorpsi [5]. Interaksi antara ion logam dan permukaan pasir akan
mempengaruhi karakteristik desorpsi ion logam dalam proses remediasi [5]. Pasir
dengan ion logam teradsorpsi disusun oleh proses adsorpsi dan kemudian dikeringkan
untuk memungkinkan ion logam untuk berinteraksi dengan permukaan pasir terutama
melalui interaksi inner-sphere.
Permukaan kelompok fungsional dari silikat memainkan peran penting dalam
proses adsorpsi. Pada bagian ini atom oksigen terikat pada lapisan silika tetrahedral dan
kelompok hidroksil berkaitan pada tepi tiap unit dari struktur silikat. Kelompok
fungsional ini menyediakan bagian permukaan untuk penyerapan logam transisi dan
logam berat secara kimiawi. Permukaan kelompok fungsional ini dapat
direpresentasikan sebagai berikut:
[12].
Dimana S merupakan atom pusat (Si atau Al) pada penyerapan yang dilakukan
oleh permukaan silikat. Permukaan kelompok hidroksil berdisosiasi dalam air dan
berfungsi sebagai basa Lewis terhadap kation logam (Mn+). Seperti bagian
terdeprotonasinya (satu atau mungkin dua) yang membentuk senyawa kompleks dengan
2.7 Surfaktan
Surfaktan adalah molekul amphiphilic memiliki kedua ekor hidrofobik dan
kepala hidrofilik. Ketika dilarutkan dalam air pada konsentrasi rendah, molekul
surfaktan ada, yang berperan sebagai monomer [27]. Sebagai jenis senyawa amfifilik
memiliki konstanta dielektrik rendah dan viskositas lebih tinggi dari air, surfaktan dapat
meningkatkan kelarutan senyawa organik dengan menurunkan tegangan antarmuka serta
oleh solubilisasi misel [28]. Struktur molekul yang unik dari surfaktan memungkinkan
untuk meningkatkan kelarutan kontaminan dalam tanah, terutama untuk senyawa
organik hidrofobik[5].
Surfaktan dapat meningkatkan desorpsi polutan dari tanah, dan memacu proses
bioremediasi organik dengan meningkatkan bioavailabilitas polutan [5]. Selain
kemampuan yang tinggi untuk desorb kontaminan, surfaktan harus memiliki CMC lebih
rendah dan aktif dengan dosis kecil sebagai larutan pencuci, untuk mengurangi biaya
proses perbaikan dan selanjutnya memastikan ekonomi dari proses keseluruhan [5] .
Struktur molekul surfaktan, yang mengatur sifat-sifat surfaktan, adalah faktor
dominan untuk karakteristik adsorpsi. Pada konsentrasi yang lebih tinggi, monomer akan
dikelompokkan ke dalam kelompok, yang disebut '' misel ''. Konsentrasi pada saat
pengelompokkan '' misel '' ini dikenal sebagai CMC [5].
Menurut (Mulligan, 2004), Jika surfaktan ditambah melebihi CMC, maka jumlah
misel akan terus bertambah tetapi ukuran mereka akan hampir tetap konstan. Untuk
perubahan konsentrasi dibawah CMC, maka sifat fisik seperti: tegangan permukaan,
tegangan antar muka, adsorpsi, dan daya bersih akan terjadi perubahan.
2.7.1 SDS
Sodium lauril sulfat (SLS), natrium laurilsulfate atau natrium dodesil sulfat (SDS
rendah dibandingkan dengan kationik dan nonionic [30]. Molekul ini memiliki ekor 12
atom karbon, yang melekat pada kelompok sulfat, memberikan sifat molekul amfifilik
diperlukan dari deterjen. SLS adalah surfaktan yang sangat efektif dan digunakan dalam
setiap tugas yang memerlukan penghilangan noda berminyak dan residu [31].
Misalnya, ditemukan dalam konsentrasi yang lebih tinggi dengan produk industri
termasuk minyak pelumas mesin, pembersih lantai, dan sabun cuci mobil. Hal ini
digunakan dalam konsentrasi yang lebih rendah dengan pasta gigi, shampoo, dan busa
cukur.Natrium dodesil sulfat (SDS, CH3(CH2)11SO4Na), surfaktan anionik dengan
konsentrasi kritis misel (CMC) dari 8 mM, adalah tingkat nutrisi yang baik dan mudah
terurai oleh tanah atau mikroorganisme air.
Seperti semua surfaktan deterjen (termasuk sabun), natrium lauril sulfat
menghilangkan minyak dari kulit, dan dapat menyebabkan kulit dan iritasi mata.
Konsentrasi misel kritis (CMC) dalam air murni pada 25 ° C adalah 0,0082 M, dan
jumlah agregasi pada konsentrasi ini biasanya dianggap menjadi sekitar 62. Fraksi misel
ionisasi (α) adalah sekitar 0,3 ( atau 30%) [32].
2.8 Remediasi Logam Berat pada Pasir terkontaminasi
Remediasi/pencucian pasir dapat digunakan sebagai metode untuk
menghilangkan kontaminan [29]. Dalam praktis remediasi, karena kontaminan melekat
pada permukaan partikel pasir dan biasanya memiliki kelarutan dalam air yang rendah
juga bersifat aditif seperti asam, surfaktan dan agen chelating sering ditambahkan ke
dalam cairan pencuci untuk melarutkan kontaminan dari pasir.
Interaksi antara ion logam dan permukaan pasir akan mempengaruhi karakteristik
desorpsi ion logam dalam proses remediasi [4]. Efisiensi removal diperoleh dengan
menggunakan surfaktan anionik populer, natrium dodesilsulfat (SDS), larutan SDS.
Keberhasilan penerapan remediasi pasir terkontaminasi dengan metode pencucian
surfaktan dipengaruhi oleh beberapa faktor ilmiah, seperti: potensi molekul surfaktan
berinteraksi dan mendesorpsi ion logam pada permukaan pasir dan kemampuan
Potensi misel surfaktan dalam menghilangkan ion logam pada permukaan media pasir
yang terkontaminasi (Mulligan, 2005).
Gambar 2.1 Interaksi Sodium Dodecyl Sulfatedengan Ion Logam (Mulligan, 2005).
Kontaminan pasir dimobilisasi, oleh larutan pencuci (misalnya pembentukan
misel dengan bantuan larutan pencuci) atau melalui interaksi kimia [5]. Kekhawatiran
tentang toksisitas surfaktan terutama timbul dari surfaktan sisa dalam tanah setelah
mencuci tanah jika mereka tidak mudah terurai. Kehadiran berlebihan surfaktan dalam
sistem air dan tanah dapat mempengaruhi ekosistem merugikan karena aktivitas biologis
surfaktan. Surfaktan anionik dapat mengikat makromolekul bioaktif seperti peptida,
enzim, dan DNA, mengubah fungsi biologis mikroorganisme [32].
Teknik pencucian dapat dicapai dengan sangat baik dengan menggunakan agen
yang bisa meningkatkan batas desorpsi antara pasir- logam. Sebuah teknik remediasi
yang efektif untuk situasi tersebut adalah metode pencucian larutan surfaktan (Martel
dan Gelinas, 1996;. Lee et al, 2002, 2005). Beberapa kelebihan dan keuntungan
sedikit energi untuk mencapai remediasi. Namun, remediasi dengan surfaktan
membutuhkan konsumsi besar surfaktan dengan efisiensi penyisihan rendah.
2.9 Rangkaian Percobaan Remediasi Logam Berat pada Pasir Terkontaminasi
dengan Kolom
Gambar 2.2 Rangkaian Percobaan Remediasi Logam Berat pada Pasir Terkontaminasi dengan Kolom
Keterangan Gambar:
Sejumlah surfaktan X cmc dipompakan dengan pompa peristaltik dengan laju
alir X ml/menit ke kolom pasir yang berisi pasir terkontaminasi. Kemudian effluent hasil
cucian ditampung dan dianalisa dengan AAS untuk meninjau seberapa banyak logam
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Pencemaran logam berat di lingkungan merupakan masalah serius karena kelarutan
dan mobilitasnya menimbulkan toksisitas dan ancaman bagi kehidupan makhluk hidup,
termasuk manusia [1]. Logam-logam berat tersebut berasal dari aktifitas manusia seperti
buangan rumah tangga, buangan sisa industri yang tidak terkontrol yang mengalir ke
perairan dan pembakaran hidrokarbon dan batu bara diantaranya ada yang melepaskan
senyawa logam berat ke udara kemudian bercampur dengan air hujan dan mengalir juga
ke perairan.
Adanya logam berat di perairan, berdampak negatif dan berbahaya, baik secara
langsung terhadap kehidupan organisme, maupun efeknya secara tidak langsung
terhadap kesehatan manusia. Hal ini berkaitan dengan sifat-sifat logam berat
(PPLH-IPB, 1997) yaitu:
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan
keberadaannya secara alami sulit terurai (dihilangkan).
2. Dapat terakumulasi dalam organisme, termasuk kerang dan ikan, serta akan
membahayakan kesehatan manusia yang mengkonsumsi organisme tersebut.
3. Mudah terakumulasi pada sedimen, sehingga konsentrasinya selalu lebih tinggi dari
konsentrasi logam dalam air. Selain itu sedimen mudah tersuspensi karena
pergerakan massa air yang akan melarutkan kembali logam yang dikandungnya ke
dalam air, sehingga sedimen berpotensi menjadi sumber pencemar sekunder dalam
rentang waktu tertentu.
Hembusan angin yang kuat juga dapat mengangkat debu, pasir, bahkan material
yang lebih besar ke muara. Makin kuat hembusan angin maka daya angkutnya akan
Remediasi/pencucian pasir dapat digunakan sebagai metode untuk menghilangkan
kontaminan [3]. Dalam praktis remediasi, karena kontaminan melekat pada permukaan
partikel pasir dan biasanya memiliki kelarutan air rendah juga bersifat aditif seperti
asam, surfaktan dan agen chelating sering ditambahkan ke dalam cairan pencuci untuk
melarutkan kontaminan dari pasir.
Keberhasilan penerapan remediasi pasir terkontaminasi dengan metode pencucian
surfaktan dipengaruhi oleh beberapa faktor ilmiah, seperti: potensi molekul surfaktan
berinteraksi dan mendesorpsi ion logam pada permukaan pasir dan kemampuan
surfaktan terdispersi ke target kontaminan pada area pori [4].
Adanya larutan SDS, memungkinkan tipe interaksi inner-sphere menjadi interaksi
tipe outer-sphere dan logam terdesorpsi ke larutan surfaktan karena adanya pengaruh
mekanik dari aliran. Ion logam yang terdesorpsi kemudian berinteraksi dengan misel
surfaktan pada area interpartikel pori.
Surfaktan adalah kelompok bahan kimia amfifilik yang mengandung kedua hidrofilik
dan bagian hidrofobik dalam struktur molekul secara bersamaan. Struktur molekul yang
unik dari surfaktan memungkinkan untuk meningkatkan kelarutan kontaminan dalam
Beberapa Penelitian Remediasi Pasir Terkontaminasi Dengan Surfaktan
yang telah dilakukan disajikan pada tabel 1.1 :
Tabel 1.1 Penelitian Terdahulu Remediasi Pasir Terkontaminasi Dengan Surfaktan
No. Peneliti Judul Hasil
Hasil beberapa penelitian terdahulu yang telah dilakukan menunjukkan logam berat