PROD
DANSy
DUKSI BI
SITUD
ynechococ
IODISEL
DARI MIK
ccus sp. Y
SEKOL
INSTITU
L SECAR
KROALG
YANG DIK
TEKN
PATMAW
LAH PASC
UT PERTA
BOGO
2013
RA TRAN
GAChlam
KULTIVA
NIS
WATI
CASARJA
ANIAN BO
OR
3
NSESTER
mydomona
ASI DEN
ANA
OGOR
RIFIKASI
as sp.
NGAN ME
I IN
EDIA
iii
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Produksi Biodisel Secara Transesterifikasi In Situdari Mikroalga Chlamydomonas sp. danSynechococcus sp. yang Dikultivasi dengan Media Teknisadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli2013
Patmawati
iv
RINGKASAN
PATMAWATI. Produksi Biodisel Secara Transesterifikasi In Situ dari Mikroalga
Chlamydomonas sp. dan Synechococcus sp.yang Dikultivasi dengan Media Teknis. Dibimbing oleh BUSTAMI IBRAHIM, IRIANI SETYANINGSIH dan UNTUNG SUDADI.
Cadangan minyak dunia semakin turun.Di sisi lain, polusi lingkungan oleh emisi gas buang hasil pembakaran bahan bakar minyak terus meningkat. Indonesia memiliki total cadangan minyak bumi sebesar 9 milyar barel yang akan habis dalam waktu 23 tahun. Oleh karena itu, perlu dicari bahan bakar alternatif yang bersifat terbarukan.Salah satu diantaranya adalahbiodisel.Mikroalga berpotensi untuk dikembangkan sebagai sumber biodiesel. Pengembangan biodisel umumnya membutuhkan biaya produksi yangsangat mahal. Oleh sebab itu, perlu dicari alternatif proses produksi biodesel yang lebih efisien, yaitu menggunakan media kulturtechnical grade dan teknik proses transesterifikasi in situ.
Penelitian ini terdiri dari tiga tahap.Tahap pertama berupa peremajaan dan penyediaan stok empat isolat mikroalga dalam media BG 11. Tahap kedua yaitu kultivasi pada skala lab, skala lapang pada akuariumdalam media N2P1, N2P2 atau N3P3 dan analisis kadar lipid, kadar air, rendemen, asam lemak bebas dan komposisi asam lemak. Tahap ketiga adalah produksi biodisel dengan proses transesterifikasi in situ dan dilakukan perhitungan rendemenserta karakterisasi biodisel sesuai dengan SNI.
Chlamydomonas sp. ICBB 9114 menghasilkan rendemen biomassa tertinggi (0.44 g/L) dan kadar air yang rendah, sedangkan Chlamydomonas sp. ICBB 9112 menghasilkan rendemen biomassa terendah (0.19 g/L) dengan kadar kadar air dan asam lemak bebas tertinggi. Synechococcus sp. ICBB 9111 memiliki kadar abu tertinggi, sedangkanChlamydomonas sp. ICBB 9113 memiliki kadar abu dan asam lemak bebas terendah.
Asam lemak C18:3 dominan terdapat pada Synechococcussp. ICBB 9111 (47.03%),Chlamydomonas sp. ICBB 9113 (42.57%) dan Chlamydomonas sp. ICBB 9114 (34.42%), sedangkan Chlamydomonas sp. ICBB 9112 dominan mengandung jenis asam lemak terbaik (C16:0, 47.38%)sehingga dapat digunakan sebagai bahan baku pembuatan biodisel karena memiliki titik leleh (melting point) yang rendah, bilangan setan yang tinggi dan cenderung tidak mudah teroksidasi.
Produksi biodiesel dari mikroalga diawali dengan proses ekstraksi lipid dari biomassa dan dilanjutkan dengan konversi lipid menjadi fatty acid metyl ester
(FAMEs) melalui proses transesterfikasi. Chlamydomonas sp. ICBB 9114 menghasilkan FAMEs tertinggi (3523.20mg/100g), sedangkan kadar FAMEs terendah dihasilkan oleh Synechococcus sp. ICBB 9111 (2181.10 mg/100 g). Hasil karakterisasi biodisel dari Chlamydomonas sp. ICBB 9114 sesuai dengan SNI kecuali untuk bilangan asam.
v
SUMMARY
PATMAWATI. Biodiesel Production by In Situ Transesterification of Microalgae
Chlamydomonas sp., and Synechococcus sp. Cultivated in a Technical Grade Media. Supervised by BUSTAMI IBRAHIM, IRIANI SETYANINGSIH and UNTUNG SUDADI.
During the time being, the world’s oil supply is going to be less. In the other side, enviroment pollution derived from fosil fuel combustion is going tobe more extensive. Indonesia has 9 billion barrel of oil reserve which will be run out in 23 years. Therefore, alternative source of energy should be developed, such as biodiesel. Microalgae have a high productivity and potential to be developed as biodiesel. This development need a high cost. This study is intended to find an alternativeof biodiesel production from microalgae which is more cost efficient. We developed a new improvement by using technical grade culture nutrient and in situtransesterification process.
The study consisted of three stages. The first was regeneration and providing four isolates in BG 11 medium. The second was cultivation in lab scale, aquarium scale using N2P1, N2P2 or N3P3 medium, and analyses of lipid, water, ash, yield, free fatty acid (FFA), and characterization of the fatty acid. The last was biodiesel production byin situtransesterification process,yield measurement and characterization of the biodiesel.
Isolate Chlamydomonas sp. ICBB 9114 produced the highest yield of biomass (0.44 g/L) with low water content, whileChlamydomonas sp. ICBB 9112 produced the lowest biomass (0.19 g/L) with the highest water and FFA content.
Synechococcus sp. ICBB 9111 had the highest ash content, whileChlamydomonas
sp. ICBB 9113 had the lowest ash and FFA content.
Fatty acid content with C18:3 type was dominant in Synechococcus sp. ICBB 9111 (47.03%), Chlamydomonas sp. ICBB 9113 (42.57%), and
Chlamydomonas sp. ICBB 9114 (34.42%). While, C16:0 type was dominant in
Chlamydomonas sp. ICBB 9112. It marked that Chlamydomonas sp. ICBB 9112 had a good quality of FA which could be used as biodiesel needing a low melting point, high cetan number, and unoxidizable.
After lipid extraction, the process was continued with convertion to fatty acid metyl ester (FAMEs) through transesterification process. Chlamydomonas sp. ICBB 9114 produced the highest FAMEs (3523.20 mg/100 g). The characteristics of the biodiesel originated fromChlamydomonas sp. ICBB 9114 producedby in situ
transesterficationwere suitable with SNI biodiesel criteria except for the acid value.
Keywords: FAME, in situ transesterification, microalgae, technical grade media.
vi
©Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apapun tanpa izin IPB
vii
PRODUKSI BIODISEL SECARA TRANSESTERIFIKASI IN
SITUDARI MIKROALGAChlamydomonas sp.
DANSynechococcus sp. YANG DIKULTIVASI DENGAN MEDIA
TEKNIS
PATMAWATI
Tesis
Sebagai salah satu syarat untuk memperolehgelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
viii
Penguji Luar Komisi pada Ujian Tesis: Dr Eng Uju Sadi, SPiMSi
ix
Judul Penelitian : Produksi Biodisel Secara Transesterifikasi In Situ dari Mikroalga Chlamydomonas sp. dan Synechococcus sp. yang Dikultivasi dengan Media Teknis
Nama : Patmawati
NIM : C351110111
Disetujui oleh
Komisi Pembimbing
Dr Ir Bustami Ibrahim, MSc Ketua
Dr IrIriani Setyaningsih, MS Anggota
DrIrUntung Sudadi, MSc Anggota
Tanggal Ujian: 4 Juli 2013 Tanggal Lulus: Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dekan Sekolah Pascasarjana
x
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat rahmat dan karunianya penulis dapat menyelesaikan tesis dengan judul Produksi Biodisel Secara Transesterifikasi In Situdari Mikroalga Chlamydomonas sp. danSynechococcus sp. yang Dikultivasi dengan Media Teknis.
Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis, terutama kepadaDr. Ir. Bustami Ibrahim, M.Sc, Dr. Ir. Iriani Setyaningsih, MSdan Dr. Ir. Untung Sudadi, M.Sc sebagai dosen pembimbing tesis yang senantiasa memberikan arahan serta bimbingan selama penyusunan tesis ini.Keluarga besar Indonesian Center for Biodiversity and Biotechnology (ICBB) yang menyediakan fasilitas untuk penelitian.Keluarga terutama Ayah, Ibu, Kakak dan Adik-adik yang telah memberikan doa, kasih sayang dan semangat kepada penulis dalam menyelesaikan tesis ini.Aidil Fadli Ilhamdy selaku rekan penelitian yang selalu bekerjasama dalam menyelesaikan penelitian dan semua pihak yang tidak bisa disebutkan satu persatu.
Semoga tulisan ini bermanfaat bagi pengembangan ilmu dan praktik produksi bahan bakar alternatif, khususnya biodisel dari biomass mikroalga.
Bogor, Juli 2013
Patmawati
xi
DAFTAR ISI
Halaman
DAFTAR GAMBAR ix
DAFTAR TABEL x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
2 METODE 3
Lokasi dan Waktu Penelitian 3
Bahan dan Alat 3
Pelaksanaan Penelitian 4
Prosedur Pengujian 6
Rancangan Percobaan 10
3 HASIL DAN PEMBAHASAN 11
Pertumbuhan Empat Jenis Mikroalga 11
Karakteristik Kimia Biomassa Empat Jenis Mikroalga 13
Komposisi Asam Lemak Empat Jenis Mikroalga 16
Produksi Fatty Acid Metyl Ester (FAMEs) Empat Jenis Mikroalga 20 Karakterisasi Biodisel Chlamydomonas sp. ICBB 9114 yang Diproduksi secara Transesterfikasi In situ
21
4 KESIMPULAN DAN SARAN 23
Kesimpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 27
RIWAYAT HIDUP 29
DAFTAR GAMBAR
Halaman
1 Peremajaan empat jenis mikroalga 4
2 Produksi biomassa mikroalga 5
xii
4 Kurva Pertumbuhan empat jenis mikroalga pada media BG 11 (a)
Synechococcus sp. ICBB 911; (b) Chlamydomonas sp. ICBB 9112; (c)
Chlamydomonas sp. ICBB 9113; (d) Chlamydomonas sp. ICBB 9114
12
5 Kurva Pertumbuhan empat jenis mikroalga pada media teknis (a)
Synechococcus sp. ICBB 911; (b) Chlamydomonas sp. ICBB 9112; (c)
Chlamydomonas sp. ICBB 9113; (d) Chlamydomonas sp. ICBB 9114
12
6 Morfologi mikroalga 14
7 Diagram persentasi komposisi asam lemak
Synechococcus sp. ICBB 9111
18
8 Diagram persentasi komposisi asam lemak
Chlamydomonas sp. ICBB 9112
18
9 Diagram persentasi komposisi asam lemak
Chlamydomonas sp. ICBB 9113
19
10 Diagram persentasi komposisi asam lemak
Chlamydomonas sp. ICBB 9114
19
DAFTAR TABEL
Halaman
1 Komposisi media kultur 3
2 Karakterisasi biomassa mikroalga 15
3 Hasil karakterisasi komposisi asam lemak 4 jenis mikroalga 17 4 Komposisi asam lemak jenuh dan tak jenuh empat jenis mikroalga 20 5 Hasil Fatty acid metyl ester (FAMEs) empat jenis mikroalga 21 6 Karakterisasi biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi
secara transesterifikasi in situ
21
DAFTAR LAMPIRAN
Halaman
1 Contoh perhitungan asam lemak 27
1 PENDAHULUAN
Latar Belakang
Cadangan minyak dunia menipis dan polusi lingkungan akibat emisi karbondioksida dari sisa pembakaran bahan bakar fosil meningkat (Demirbas 2009).Krisis energi,khususnya yang dihadapi Indonesia semakin berat. Harga minyak telah mencapai 100-an US$ per barrel pada awal tahun 2008, sehingga memperberat beban anggaran subsidi, baik subsidi bahan bakar langsung (sektor rumah tangga dan transportasi) maupun subsidi listrik akibat ketergantungan terhadap bahan bakar fosil. Total cadangan minyak bumi Indonesia 86,9 milyar barel dengan cadangan terbukti hanya 9 milyar barel. Jika kapasitas produksi per tahun400 juta barel, maka cadangan minyak bumi Indonesia akan habis dalam tenggang waktu 23 tahun (KESDM 2011). Hal ini mendorongperlunya pengembangan bahan bakar alternatif terbarukan dan ramah lingkungan, salah satunya adalah biodiesel.
Biodieseladalah bahan bakar cair berupa ester alkil dari asam lemak yang dihasilkan melalui proses transesterifikasi (SNI 2006). Produksi biodieseldari bahan nabati telah banyak dilakukan. Di sisi lain, pengkajian pengembangan biodiesel dari biomassa mikroalga belum optimal meskipun produktivitasnya tinggi (Tian et al.2010). Dengan kandungan 30-70% minyak, mikroalga dapat menghasilkan 58.700 - 136.900 liter biodiesel/ha, lebih besar dibandingkan produktivitas bahanbaku lain seperti jagung (172 L/ha), kedelai (446 L/ha), canola (1.190 L/ha), jarak (1.892 L/ha), kelapa (2.689 L/ha) dan kelapa sawit (5.950 L/ha). Budidaya mikroalga juga tidak memerlukan lahan yang luas seperti bahan baku biodiesel yang lain (Demirbas 2011), sehingga lahan yang produktif untuk produksi bahan pangan tidak perlu dikonversi untuk produksi bahan bakar. Oleh sebab itu, penggunaan mikroalga sebagai bahan baku biodiesel sangat menjanjikan.
Chlamydomonas sp. dan Synechococcus sp. adalah mikroalga yang berpotensi untuk dikembangkan sebagai bahan baku biodiesel. Arisanti (2011) melaporkan tiga isolat Chlamydomonas sp. yang memiliki kandungan lipid 31,25, 32 dan 25% (berat kering) serta satu isolat Synechococcus sp. dengan kandungan lipid 25% (berat kering).Pengembangan biodisel umumnya membutuhkan biaya produksi yangsangat mahal. Menurut Krawczyk (1996) biaya produksi yang utama adalah untuk biaya bahan baku (minyak dan lemak) dan biaya proses produksi. Biaya bahan baku mencapai 60-70% dari total biaya produksi. Alternatif proses produksi biodesel dari biomassa mikroalga yang dapat dikembangkan dan efisien yaitu menggunakan media kultur technical grade dan teknik proses transesterifikasi in situ. Penelitian ini bertujuan mengkaji produksi biodisel secara transesterifikasi in situdari biomassa mikroalga Chlamydomonas sp. danSynechococcus sp. dengan media kultur yang murah.
Perumusan Masalah
2
sangat mahal. Alternatif proses produksi yang dapat dikembangkan yaitu menggunakan kultur dengan biaya yang murah sehingga dapat bersaing dengan bahan bakar fosil yaitu dengan mengkultivasi mikroalga Chlamydomonas sp. danSynechococcus sp. dengan menggunakan media teknis dan proses konversi minyak secara langsung dari biomassa mikroalga tanpa melewati proses ekstraksi lipid.
Tujuan Penelitian
Penelitian ini bertujuan mengkaji produksi biodisel secara transesterifikasi
3
2 METODE
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan pada Juli 2012 sampai Mei 2013 bertempat di
Indonesian Center for Biodiversity and Biotechnology (ICBB), Cilubang Nagrak, Situgede, Kabupaten Bogor; Laboratorium Bikomia Hasil Perairan, Departeman Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; dan Laboratorium Manajeman Mutu, Departeman Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB.
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian adalah tiga isolat mikroalga
Chlamydomonas sp. dan satu isolat Synechococcus sp., media biakan standar Blue green (BG11)dan media N2P1, N2P2 atau N3P3 (Tabel 1) serta bahan kimia lain untuk analisis.
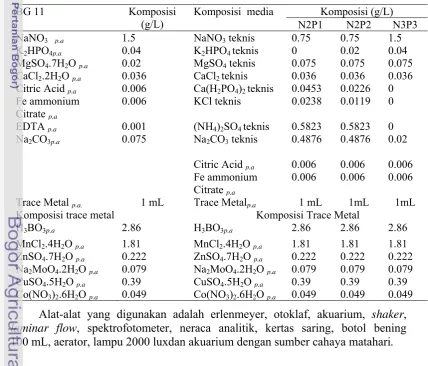
Tabel 1Komposisi media kultur
BG 11 Komposisi
(g/L)
Komposisi media Komposisi (g/L) N2P1 N2P2 N3P3 NaNO3 p.a 1.5 NaNO3 teknis 0.75 0.75 1.5
K2HPO4p.a 0.04 K2HPO4 teknis 0 0.02 0.04 MgSO4.7H2O p.a 0.02 MgSO4 teknis 0.075 0.075 0.075
CaCl2.2H2O p.a 0.036 CaCl2 teknis 0.036 0.036 0.036 Citric Acid p.a 0.006 Ca(H2PO4)2 teknis 0.0453 0.0226 0
Fe ammonium Citrate p.a
0.006 KCl teknis 0.0238 0.0119 0
EDTA p.a 0.001 (NH4)2SO4 teknis 0.5823 0.5823 0 Na2CO3p.a 0.075 Na2CO3 teknis 0.4876 0.4876 0.02
Citric Acid p.a 0.006 0.006 0.006
Fe ammonium
Citrate p.a
0.006 0.006 0.006
Trace Metal p.a. 1 mL Trace Metalp.a 1 mL 1mL 1mL
Komposisi trace metal Komposisi Trace Metal
H3BO3p.a 2.86 H3BO3p.a 2.86 2.86 2.86
MnCl2.4H2O p.a 1.81 MnCl2.4H2O p.a 1.81 1.81 1.81
ZnSO4.7H2O p.a 0.222 ZnSO4.7H2O p.a 0.222 0.222 0.222
Na2MoO4.2H2O p.a 0.079 Na2MoO4.2H2O p.a 0.079 0.079 0.079
CuSO4.5H2O p.a 0.39 CuSO4.5H2O p.a 0.39 0.39 0.39
Co(NO3)2.6H2O p.a 0.049 Co(NO3)2.6H2O p.a 0.049 0.049 0.049
Alat-alat yang digunakan adalah erlenmeyer, otoklaf, akuarium, shaker,
4
Pelaksanaan Penelitian
Penelitian terdiri dari tiga tahapan. Tahap pertama, peremajaan dan penyediaan stok empat isolat dalam media BG 11. Tahap kedua, kultivasi pada skala lab danpada skala lapang menggunakanakuariumdenganmedia N2P1, N2P2 atau N3P3, dilanjutkan analisis kadar lipid, kadar air, rendemen, kadar asam lemak bebas dan komposisi asam lemak. Tahap ketiga,produksi biodisel secara transesterfikasi in situ terhadap biomassa mikroalga terseleksi pada tahap dua menggunakan metode Kartika et al. (2013) yang dimodifikasi, dilanjutkan dengan perhitungan rendemen, pengukuran menggunakan GC FID, dan dianalisis sesuai dengan SNI biodisel.
Peremajaan isolat
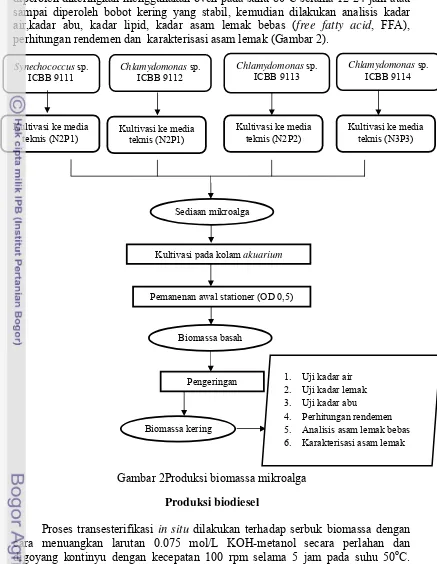
Tahapan peremajaan diawali dengan mempersiapkan media Blue Green 11 (BG11) yang merupakan media khusus untuk blue green algae. Sebanyak dua ml isolat mikroalga diinokulasikan ke dalam 50 ml media BG11 dalam botol bening ±100 ml, digoyang menggunakan shaker, suhu dikondisikan 29oC dan digunakan sumber cahaya yang berasal dari lampu 2000 lux selama tiga minggu atau hingga mencapai nilai OD(Optical Density) 0.5. Proses peremjaan dengan volume minimal 500 mL diberikan aerasi udara (Gambar 1).
Gambar 1Peremajaan empat jenis mikroalga
Produksi biomassa
Produksi biomassa pada skala lapang dilakukan diluar ruangan menggunakan akuarium dan matahari sebagai sumber cahaya. Kultivasi dilakukan dengan memindahkan 20% kultur segar mikroalga ke dalam 80 liter media (N2P1, N2P2 atau N3P3) menggunakan matahari sebagai sumber cahayadengan suhu antara 30-38oC.Synechococcus sp. ICBB 9111 dikultivasi pada media N2P1,
Chlamydomonas sp. ICBB 9112 dikultivasi pada media N2P1, Chlamydomonas
sp. ICBB 9113 dikultivasi pada media N2P2, Chlamydomonas sp. ICBB 9114 dikultivasi pada media N3P3.Pertumbuhan setiap isolat mikroalga diukur setiap hari berdasarkan kerapatan optik pada panjang gelombang620 nm hingga mencapai nilai OD ≥0.5 (Arisanti 2011). Pemanenan dilakukan pada saat tercapai nilai OD0.5 dengan cara menambahkan tawas dengan konsentrasi 0.3 g/L untuk
Chlamydomonas sp.
ICBB 9113
Chlamydomonas sp.
ICBB 9114
Synechococcus sp.
ICBB 9111
Chlamydomonas sp.
ICBB 9112
Sediaan mikroalga
5
mengendapkan biomassa mikroalga dan kemudian disaring. Biomassa yang diperoleh dikeringkan menggunakan oven pada suhu 80oC selama 12-24 jam atau sampai diperoleh bobot kering yang stabil, kemudian dilakukan analisis kadar air,kadar abu, kadar lipid, kadar asam lemak bebas (free fatty acid, FFA), perhitungan rendemen dan karakterisasi asam lemak (Gambar 2).
Gambar 2Produksi biomassa mikroalga
Produksi biodiesel
Proses transesterifikasi in situ dilakukan terhadap serbuk biomassa dengan cara menuangkan larutan 0.075 mol/L KOH-metanol secara perlahan dan digoyang kontinyu dengan kecepatan 100 rpm selama 5 jam pada suhu 50oC. Proses ini untuk mengkonversi secara langsung trigliserida yang terkandung dalam biomassa mikroalga menjadi biodisel (fatty acid metil ester, FAMEs). Larutan 0.075 mol/L KOH-metanol sebelum digunakan diaduk selama 10 menit dan ditambahkan n-heksan (100 % bahan).Rasio larutan KOH-metanol dengan serbuk biomassa yang digunakan sebesar 6:1.Proses reaksi setelah tercapai, campuran dibiarkan sampai dingin (suhu ruang), kemudian filtrat dipisahkan dari
Kultivasi ke media teknis (N2P1)
Kultivasi ke media teknis (N2P1)
Kultivasi ke media teknis (N2P2)
Kultivasi ke media teknis (N3P3)
Sediaan mikroalga
Kultivasi pada kolamakuarium
Pemanenan awal stationer (OD 0,5)
Pengeringan
Biomassa kering
1. Uji kadar air
2. Uji kadar lemak
3. Uji kadar abu
4. Perhitungan rendemen
5. Analisis asam lemak bebas
6. Karakterisasi asam lemak
Chlamydomonas sp.
ICBB 9113
Chlamydomonas sp.
ICBB 9114
Synechococcus sp.
ICBB 9111
Chlamydomonas sp.
ICBB 9112
6
ampas. Filtrat yang terpisah selanjutnya dievaporasi dan didekantasi untuk memisahkan gliserol dari biodisel.Lapisan gliserol berada di bagian bawah dan berwujud semi padat.Biodisel yang sudah dipisahkan kemudian dilakukan pencucian biodisel dengan aquadest hingga pHnya netral (Gambar 3).
Gambar 3Produksi biodisel secara transesterifikasi in situ
Prosedur Pengujian
Pengujian yang dilakukan berupa pengujian terhadap biomassa, hasil ekstraksi lipid dan hasil esterifikasi lipid yang menghasilkan Fatty acid metyl ester (FAMEs).
Analisis biokimia mikroalga
Biomassa yang telah kering selanjutnya dianalisis komposisi kimia berupa kadar lemak, kadar air dan kadar abu. Berikut penjelasan metode yang digunakan dalam analisis :
1)Analisis kadar lipid (AOAC 1999)
Sampel sebanyak 3 gram ditimbang dan ditambahkan pelarut kloform-metanol dengan perbandingan 2:1 sebanyak 25 ml. Proses maserasi dilakukan selama 3 jam. Tahapan selanjutnya, dilakukan penyaringan dengan menggunakan kertas saring whatman no. 41 untuk memisahkan filtrat dan supernatan. Supernatan yang sudah terpisah diekstrak kembali dengan kloroform-metanol
Biodisel Biomassa kering
mikroalga
Transesterifikasi dengan menambahkan
KOH-metano dan n-heksan pada suhu 50 oC, kecepatan
pengadukan 100 rpm selama 5 jam
Dekantasi dan evaporasi
Pencucian dan pengeringan 1. Perhitungan rendemen
2. Pengukuran dengan GC FID
3. Uji densitas
4. Uji bilangan asam
5. Uji bilangan iod
6. Uji bilangan penyabunan
7
sebanyak dua kali ulangan dan hasil filtratnya disatukan dalam wadah yang sama dengan filtrat yang sama. Filtrat yang sudah terkumpul, ditambahkan NaCl 0.88% sebanyak 5 ml dan divorteks. Hasil vorteks terdiri dari dua lapisan. Lapisan atas terdiri dari komponen pengotor seperti protein dan lapisan bawah merupakan lemak. Lapisan atas dibuang dengan menggunakan pipet dan lapisan bawah disaring dengan menggunakan saringan yang dilapisi natrium sulfat anhidrous yang berfungsi menyerap air. Filtrat diuapkan pelarutnya dengan gas nitrogen.Lemak yang sudah dikeringkan kemudian disimpan dalam desikator selama20-30 menit dan ditimbang. Kadar lemak dihitung berdasarkan rumus:
2) Analisis kadar air (AOAC 2007)
Cawan kosong yang akan digunakan dikeringkan terlebih dahulu pada suhu 105-110oC selama 15 menit atau sampai berat konstan, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang. Sampel kira-kira sebanyak 2 gram ditimbang dan diletakkan dalam cawan kemudian dipanaskan dalam oven selama 3-4 jam pada suhu 105-110oC. Cawan kemudian didinginkan dalam desikator dan setelah dingin ditimbang kembali. Persentase kadar air (berat basah) dihitung dengan rumus sebagai berikut:
Keterangan:
B = Berat sampel (gram)
B1 = Berat (sampel + cawan) sebelum dikeringkan B2 = Berat (sampel + cawan) setelah dikeringkan
3) Analisis kadar abu (AOAC 2007)
Sampel sebanyak dua gram ditempatkan dalam wadah porselin kemudian dimasukkan dalam oven dengan suhu 60-105oC selama delapan jam. Kemudian sampel yang sudah kering dibakar menggunakan hotplate sampai tidak berasap selama ± 20 menit. Tahapan berikutnya yaitu diabukan dalam tanur bersuhu 600oC selama tiga jam lalu ditimbang. Kadar abu dapat dihitung dengan rumus berikut:
% Lemak = 100%
(g) sampel Berat
) ( lemak Berat
x g
Berat lemak = (berat labu + lemak) – berat labu
% kadar air = B ‐BB %
Kadar abu =
100
%
sampel
Berat
abu
Berat
8
Analisis kualitas lipidmikrolaga
Lipid yang sudah diesktraksi dari keempat jenis mikrolaga kemudian dianalisis komposisi asam lemak dan dianalisis asam lemak bebas (FFA). Berikut penjelasan metode yang digunakan dalam analisis :
1) Analisis asam lemak
Minyak alga yang telah diperoleh dari hasil ekstraksi kemudian dianalisis kualitasnya. Analisis yang dilakukan berupa analisis total asam lemak dengan gas chromatography(AOCS 1990)
Sebanyak 25 mg sampel ditambah dengan 1 mL larutan standar internal C17:0 1 mg/ml. Heksan dalam campuran diuapkan dengan N2 kemudian ditambah 1.5 ml NaOH-metanol 0.5 N dan diisi dengan N2, ditutup rapat, divorteks dan dipanaskan dalam penangas air suhu 100oC selama 5 menit. Sampel setelah diinginkan, ditambahkan 2 ml BF3-metanol (14% b/v), diisi N2 ditutup rapat dan dipanaskan selama 30 menit. Sampel setelah didinginkan pada suhu ruang, ditambahkan 1 ml heksan dan dilakukan pengadukan dengan vorteks.Tahap selanjutnya yaitu penambahan 5 ml larutan NaCl jenuh dan divorteks. Lapisan heksan yang terpisah diberi Na2SO4 dan siap diinjeksi ke dalam alat GC FID.
Sebanyak 1µl sampel disuntikan pada GC dengan suhu injector 55 oC sampai 340 oC, pada suhu 200 oC min -1dan dipertahankan 340 oC selama 35 menit.Suhu detector yang digunakan 365 oC. Temperatur GC disetting dari 55 oC sampai 360 oC,pada suhu45 oC min -1sampai 80 oC, dinaikkan hingga suhu 10 oC min -1, dan dipertahankan pada suhu 360 oC selama 15menit.Gas helium digunakan sebagai gas pembawa dan sampel yang diinjeksi diseparasi menggunakan kolom (15 m x 0.32 mm).Identifikasi asam lemak dalam sampeldigunakan asam lemak standar sebagai pembanding.Jenis asam lemak ditentukan dengan membandingkan RRT (Relative Retention Time) asam lemak pada sampel dengan RRT asam lemak pada standar eksternal.
Asam lemak (mg/g) = area asam lemak sampel
area asam lemak standar X
berat sampel mg X RF X 1000 berat SI (mg)
RF = area SI pada standar ekstrem
area ALX pada standar ekternal X
berat SI pada standar eksternal berat ALX pada standar eksternal
Keterangan :
SI : standar internal ALX : asam lemak X RF : rentention factor
2) Analisis asam lemak bebas (SNI 01-2891-1992)
Sebanyak 2–5 gram contoh ditimbang dan dimasukkan ke dalam Erlenmeyer 250 ml, kemudian ditambahkan dengan 50 ml etanol 95% netral. Larutan dikocok lalu ditambahkan 3-5 tetes indikator PP dan dititer dengan larutan standard NaOH 0,1 N hingga warna merah muda tetap (tidak berubah selama 15 detik). Prosedur ini juga dilakukan untuk blanko. Perhitungan asam lemak bebas sebagai berikut:
9
Keterangan :
V = volume NaOH yang diperlukan dalam peniteran (ml) T = normalitas NaOH
m = bobot contoh (gram) M = bobot molekul asam lemak
Analisis biodiesel
Biodiesel yang telah diperoleh melalui proses transesterikasi, kemudian dihitung jumlah rendemen, uji densitas, uji bilangan asam dan pengukuran menggunkan GC-FID. Berikut penjelasan metode yang digunakan dalam analisis :
1) Perhitungan rendemen
Rendemen (%) = X 100
2) Uji densitas (SNI 04-7182-2006)
Pengukuran densitas dilakukan dengan menghitung selisih berat dengan cara menimbang volume tertentu dari biodisel di dalam gelas piknometer dan berat gelas piknometernya sendiri pada suhu 40 oC.
Densitas (g/mL) =
3) Uji bilangan asam(SNI 04-7182-2006)
Sampel ditimbang sebanyak 0.2 gram di dalam Erlenmeyer, kemudian ditambahkan 25 ml etanol netral 95% dan dipanaskan selama 10 menit dalam penangas air sambil diaduk.Larutan kemudian dititrasi dengan KOH 0.1 N dengan indikator larutan Phenolptalin 1% dalam etanol, sampai tepat terlihat warna merah jambu. Bilangan asam sampel dihitung sebagai berikut:
Bilangan asam = K H K H ,
4) Uji bilangan iod (SNI 04-7182-2006)
Sampel ditimbang sebanyak 0.1 gram di dalam erlenmeyer lalu ditambahkan 20 ml kloroform dan 25 ml larutan Wijs, dan diaduk hingga homogen. Selanjutnya sampel dan pelarut tersebut direaksikan di dalam ruangan gelap selama 1 jam.Kedalam campuran, selanjutnya ditambahkan 20 ml larutan KI 15% dan 100 ml aquades hingga campuran berwarna gelap. Setelah itu campuran dititrasi dengan menggunakan Na2SO3 0,1 N dengan indikator pati hingga didapatkan warna titrat yang bening.
Bilangan iod = .
Keterangan:
10
C: Volume larutan untuk Na2S2O3 sampel (mL) N: normalitas larutan Na2S2O3
W: bobot sampel (g)
5) Uji bilangan penyabunan (SNI 04-7182-2006)
Sampel ditimbang sebanyak 0.1gram di dalam erlenmeyer bertutup. Perlahan ditambahkan 25 ml KOH 0.5 N beralkohol dengan pipet.Labu erlenmeyer dihubungkan dengan pendingin tegak dan contoh didinginkan dengan hati-hati sampai contoh tersabunkan dengan sempurna. Larutan didinginkan dan bagian dalam dari pendingin tegak dibilas dengan sedikit air. Selanjutnya larutan tersebut ditambahkan 1 ml larutan indikator Phenolptalin, kemudian dititrasi dengan HCl 0.5 N sampai warna merah jambu menghilang. Titrasi juga dilakukan untuk blanko, yaitu pelarut KOH 0.5 N. Bilangan penyabunan sampel dihitung sebagai berikut :
SV = [(VHCl blanko-VHCLsampel) x 28.5]/Wsampel
6) Uji bilangan ester
Bilangan ester dihitung sebagai selisih antara bilangan penyabunan dan bilangan asam :
EV = SV- AV
7) Perhitungan bilangan setana
Bilangan setana menunjukkan seberapa cepat bahan bakar mesin disel yang diinjeksikan ke ruang bakar secara spontan. Azam et al. (2005) membuat persamaan untuk menentukan bilangan setana sebagai fungsi dari angka iodin (IV) dan saponifikasi (SN) sebagai berikut:
CN = 46.3 + 5458/SN – 0.255 X IV
Keterangan:
CN: bilangan setana SN: bilangan penyabunan IV: bilangan iod
Rancangan Percobaan
11
3 HASIL DAN PEMBAHASAN
Pertumbuhan Empat Jenis Mikroalga
Pertumbuhan keempat mikroalgadiukur berdasarkan nilai OD(Optical Density) yang diukur setiap hari pada masing-masing media kultur. Pada saat peremajaan dikulturdalam media BG 11 dan pada saat skala lapang dikultur menggunakan media teknis yang berbeda setiap mikroalga. Synechococcus sp. ICBB 9111 dikultivasi pada media N2P1, Chlamydomonas sp. ICBB 9112 dikultivasi pada media N2P1, Chlamydomonas sp. ICBB 9113 dikultivasi pada media N2P2, Chlamydomonas sp. ICBB 9114 dikultivasi pada media N3P3.
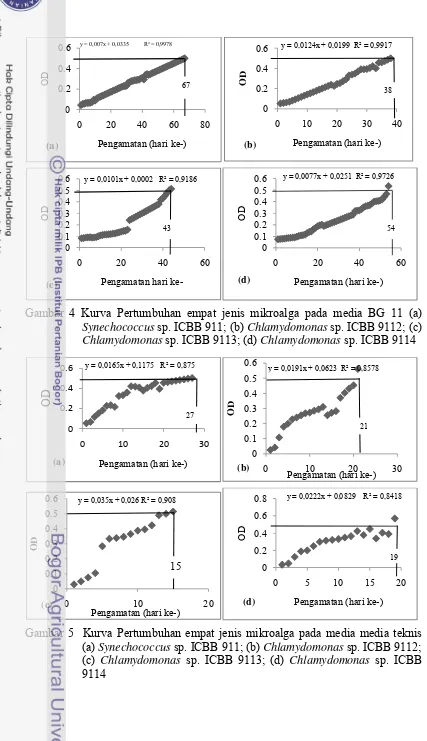
Synechococcus sp. ICBB 9111, Chlamydomonas sp. ICBB 9112,
Chlamydomonas sp. ICBB 9113 dan Chlamydomonas sp. ICBB 9114 yang ditumbuhkanpada media BG 11 mencapai OD 0.5 pada hari ke- 67, 38, 43 dan 54 (Gambar 4). Pertumbuhan keempat jenis mikroalga pada media BG 11 membutuhkan waktu yang lama untuk mencapai OD 0.5 karena merupakan masa adaptasi pertumbuhan/peremejaan. Mikroalga pada tahap ini menghasilkan makromolekul dan regenerasi sel yang cukup lambat, hal ini dapat disebabkan karena sumber cahaya berupa lampu 2000 lux sehingga proses fotosintesis kurang optimum.
12
Gambar 4 Kurva Pertumbuhan empat jenis mikroalga pada media BG 11 (a)
Synechococcus sp. ICBB 911; (b) Chlamydomonas sp. ICBB 9112; (c)
Chlamydomonas sp. ICBB 9113; (d) Chlamydomonas sp. ICBB 9114
Gambar 5 Kurva Pertumbuhan empat jenis mikroalga pada media media teknis (a) Synechococcus sp. ICBB 911; (b) Chlamydomonas sp. ICBB 9112; (c) Chlamydomonas sp. ICBB 9113; (d) Chlamydomonas sp. ICBB 9114 0 0.2 0.4 0.6
0 20 40 60 80
OD
Pengamatan (hari ke-)
y = 0,007x + 0,0335 R² = 0,9978
(a)
0 0.2 0.4 0.6
0 10 20 30 40
OD
Pengamatan (hari ke-) y = 0,0124x + 0,0199 R² = 0,9917
38 (b) 0 0.1 0.2 0.3 0.4 0.5 0.6
0 20 40 60
OD
Pengamatan hari ke-y = 0,0101x + 0,0002 R² = 0,9186
(c) 0 0.1 0.2 0.3 0.4 0.5 0.6
0 20 40 60
OD
Pengamatan (hari ke-) y = 0,0077x + 0,0251 R² = 0,9726
(d)
0 0.2 0.4 0.6
0 10 20 30
OD
Pengamatan (hari ke-) y = 0,0165x + 0,1175 R² = 0,875
27 (a) 0 0.1 0.2 0.3 0.4 0.5 0.6
0 10 20 30
OD
Pengamatan (hari ke-) y = 0,0191x + 0,0623 R² = 0,8578
21 (b) 0 0.1 0.2 0.3 0.4 0.5 0.6
0 10 20
OD
Pengamatan (hari ke-) y = 0,035x + 0,026 R² = 0,908
15 (c) 0 0.2 0.4 0.6 0.8
0 5 10 15 20
OD
Pengamatan (hari ke-) y = 0,0222x + 0,0829 R² = 0,8418
19
(d) 67
13
Karakteristik Kimia Biomassa Empat Jenis Mikroalga
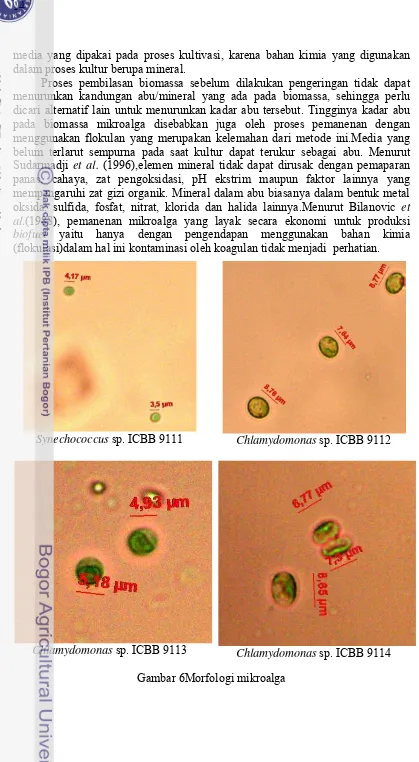
Mikroalga dipanen pada saat mencapai OD 0.5. Pemanenan dilakukan dengan cara menambahkan tawas sebanyak 0.3 g/L (hasil desk study). Biomassa mikroalga yang telah mengendap kemudian disaring menggunakan kertas saring dan dibilas dengan air, selanjutnya biomassa dikeringkan pada oven selama 24 -48 jam dengan suhu 80oC. Biomassa yang telah kering dianalisis kadar air, kadar abu, dan kadar asam lemak bebas (FFA). Hasil karakterisasi biomassa mikroalga dapat dilihat pada Tabel 2.
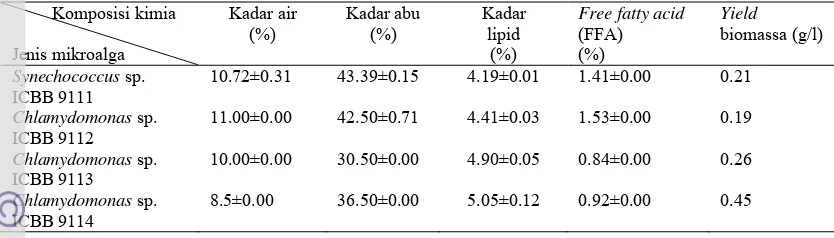
Yield biomassa kering mikroalga berkisar antara 0.19-0.45 g/L (Tabel 2).
Yield biomassa tertinggi dihasilkan oleh Chlamydomonas sp. ICBB 9114 dan yield
biomassa terendah dihasilkan oleh Chlamydomonas sp. ICBB 9112. Hal ini berbeda dengan hasil Arisanti (2011) yang menunjukkan bahwa biomassa tertinggidihasilkan oleh Synechococcus sp. ICBB 9111 dengan rataan 0.439 g/L dan biomassa terendah dihasilkan oleh Chlamydomonas sp.ICBB 9113 sebesar 0.188 g/L. Tinggi rendahnya jumlah biomassa yang dihasilkan tergantung kemampuan sel mikroalga untuk tumbuh dan membelah diri yang dipengaruhi oleh jenis mikroalga, media pertumbuhan dan faktor lingkungan. Menurut Kersey dan Munger (2009), produksi biomassa mikroalga merupakan faktor penting, karena dengan biomassa dapat menghasilkan karbohidrat, protein dan lipid. Keberhasilan teknik kultur bergantung pada kesesuaian antara jenis mikroalga yang dibudidayakan dan beberapa faktor lingkungan seperti cahaya, suhu dan pH. Kadar air merupakan kandungan air yang terdapat dalam bahan makanan dengan derajat keterikatan berbeda-beda dalam bahan (Winarno 2008).Kadar air keempat jenis mikroalga berkisar antara 8.5-11%. Kadar air tertinggi yaitu
Chlamydomonas sp. ICBB 9112 dan kadar air terendah Chlamydomonas sp. ICBB 9114 (Tabel 2). Kandungan air yang tinggi pada biomassa mikroalga akan berpengaruh terhadap jumlah pelarut yang akan dipakai pada saat proses ekstraksi. Semakin tinggi kadar air maka pelarut yang digunakan akan semakin banyak. Selain itu, kadar air yang tinggi pada bahan akan mempengaruhi proses penyimpanan. Kandungan air yang relatif tinggi akan mempercepat kemunduran kualitas bahan, dalam hal ini, kualitas lipid yang dihasilkan. Kandungan air yang tinggi pada bahan akan mempercepat kerusakan lipid terutama reaksi hidrolisis. Semakin tinggi kadar air yang ada pada mikroalga kandungan asam lemak bebas yang terukur semakin tinggi. Ketaren (1986) menyatakan bahwa hidrolisis adalah reaksi air dengan minyak/lemak yangmenyebabkan putusnya beberapa ikatan ester dari minyak/lemak, sehingga menghasilkangliserol dan asam lemak bebas. Reaksi hidrolisis dapat dipercepat oleh suhu dan tekanan tinggi dengan sejumlah air berlebih.Menurut Daramola et al. (2007), asam lemak bebas dapat dihasilkan dari proses oksidasi poly unsaturated fatty acids (PUFA) yang terkandung dalam bahan.
Bahan pangan sebagian besar yaitu 96% terdiri dari bahan organik dan air, sisanya terdiri dari unsur mineral. Unsur mineral juga dikenal sebagai zat organik atau kadar abu. Bahan-bahan organik terbakar dalam proses pembakaran tetapi zat anorganiknya tidak terbakar, karena itulah disebut abu (Winarno 2008).Kadar abu keempat jenis mikroalga berkisar antara 30.50-43.39%. Kadar abu tertinggi yaitu
14
media yang dipakai pada proses kultivasi, karena bahan kimia yang digunakan dalam proses kultur berupa mineral.
Proses pembilasan biomassa sebelum dilakukan pengeringan tidak dapat menurunkan kandungan abu/mineral yang ada pada biomassa, sehingga perlu dicari alternatif lain untuk menurunkan kadar abu tersebut. Tingginya kadar abu pada biomassa mikroalga disebabkan juga oleh proses pemanenan dengan menggunakan flokulan yang merupakan kelemahan dari metode ini.Media yang belum terlarut sempurna pada saat kultur dapat terukur sebagai abu. Menurut Sudarmadji et al. (1996),elemen mineral tidak dapat dirusak dengan pemaparan panas, cahaya, zat pengoksidasi, pH ekstrim maupun faktor lainnya yang mempengaruhi zat gizi organik. Mineral dalam abu biasanya dalam bentuk metal oksida, sulfida, fosfat, nitrat, klorida dan halida lainnya.Menurut Bilanovic et al.(1988), pemanenan mikroalga yang layak secara ekonomi untuk produksi
biofuel yaitu hanya dengan pengendapan menggunakan bahan kimia (flokulasi)dalam hal ini kontaminasi oleh koagulan tidak menjadi perhatian.
Synechococcus sp. ICBB 9111 Chlamydomonas sp. ICBB 9112
Chlamydomonas sp. ICBB 9113 Chlamydomonas sp. ICBB 9114
15
Tabel 2Hasil karakterisasi biomassa mikroalga.
Komposisi kimia Jenis mikroalga Kadar air (%) Kadar abu (%) Kadar lipid (%)
Free fatty acid (FFA) (%)
Yield biomassa (g/l)
Synechococcus sp.
ICBB 9111
10.72±0.31 43.39±0.15 4.19±0.01 1.41±0.00 0.21
Chlamydomonas sp.
ICBB 9112
11.00±0.00 42.50±0.71 4.41±0.03 1.53±0.00 0.19
Chlamydomonas sp.
ICBB 9113
10.00±0.00 30.50±0.00 4.90±0.05 0.84±0.00 0.26
Chlamydomonas sp.
ICBB 9114
8.5±0.00 36.50±0.00 5.05±0.12 0.92±0.00 0.45
Kadar abu menunjukkan kandungan senyawa organologam (Cu, Fe, Mg) maupun mineral dalam bahan.Kadar abu yang tinggi pada bahan baku akan mempengaruhi terhadap kualitas minyak/biodiesel yang dihasilkan. Kandungan abu yang tinggi pada bahan akan berdampak pada kandungan abu pada minyak yang dihasilkan. Kadar abu yang tinggi akan berbahaya jika digunakan pada sebagai bahan bakar, karena senyawa organologam atau mineral tersebut akan mengendap dan menyebabkan karat pada mesin (Edlund et al. 2002). Untuk meningkatkan kinerja motor pada mesin diesel, kadar abu bahan bakar nabati harus serendah mungkin, karena abu dapat mengikis unit-unit injektor pada motor. Berdasarkan SNI 04-7182-2006 mengenai mutu biodiesel,kadar abu yang memenuhi syarat mutu biodiesel maksimum 0,02%.
Mineral Ca, Co, Cu, Fe, Mg, Mn, dan Ni dapat menyebabkan oksidasi dan berpengaruh terhadap kualitas serta pemelihaaran minyak dan lemak secara langsung (Gonzalves et al. 2010). Mineral Cu, Pb, and Zn merupakan katalis oksidasi pada biodiesel (Lepri et al. 2011). Agencia Nacional do Petroleo (ANP), Gas Natural Biocombustiveis Bazil mensyaratkan kandungan mineral maksimum dalam biodiesel untuk Na, K, Ca and Mg (5 mg kg-1), P (10 mg kg-1), dan S (50 mg kg-1), akan tetapi peraturan ini masih dalam proses (Resolucao ANP 2008). Menurut Soares et al.(2012) komponen utama dan trace elements (Al, As, Ba, Ca, Cd, Co,Cr, Cu, Fe, K, La, Mg, Mn, Mo, Na, Ni, P, Pb, S, Se, Sn, Sr, Ti, Tl, U, V, and Zn), terukur pada fatty acid methyl esters (FAMEs). Komponen tersebut berasal dari mikroalga yang segar, residu biomassa, lipid, FAMEs kasar, fraksi terlarut dan FAMEs murni pada mikroalga Chlorella sp.
Kadar lipid keempat isolat mikroalga berkisar 4.19-5.05%.Synechococcus
16
lingkungan yang komplek seperti kondisi cuaca (terutama fluktuasi suhu dan radiasi cahaya) dan teknik manajemen budidaya.
Kadar asam lemak bebas (FFA) keempat jenis mikroalga berkisar antara 0.84-1.53%. Kadar FFA tertinggi yaitu Chlamydomonas sp. ICBB 9112 dan kadar FFA terrendah yaitu Chlamydomonas sp. ICBB 9113. Tinggi rendahnya kadar FFA yang dihasilkan berpengaruh terhadap proses pembuatan biodiesel. Kadar FFA yang terukur kurang 2% persen, sehingga proses pembuatan biodiesel dapat dilakukan dengan satu tahapan yaitu transesterifikasi menggunakan katalist basa. Menurut Canacki dan Van Gerpen (2001) terbentuknya sabun pada proses produksi biodiesel dari minyak yang mempunyai kadar air dan asam lemak bebas tinggi akan menyulitkan proses pencucian dan rendahnya rendeman biodiesel. Alternatif yang bisa dilakukan jika kadar asam lemak bebas tinggi yaitu dengan dua tahap proses yaitu menggunakan katalis asam (esterifikasi) dan katalis basa (transesterifikasi), akan tetapi akan berpengaruh terhadap biaya produksi yang dibutuhkan akan lebih tinggi. Menurut Tyson (2004), minyak yang mengandung asam lemak bebas 10% akan kehilangan rendeman biodiesel sebesar 30% apabila diproses menjadi biodiesel dengan cara transesterifikasi.
Komposisi Asam Lemak Empat Jenis Mikroalga
Asam lemak penyusun minyak dan lemak terdiri dari asam lemak jenuh (saturated fatty acid) dan asam lemak tak jenuh (monounsaturated fatty acid dan
polyunsaturated fatty acid). Jumlah dan komposisi asam-asam lemak jenuh dan tak jenuh dalam minyak dan lemak tergantung pada jenis minyak dan lemak tersebut (Martin et al. 2010).
Ekstraksi lipid untuk karakterisasi asam lemak menggunakan pelarut kloroform-metanol. Sheng et al.(2011), menyatakan bahwa kombinasi pelarut kloroform-metanol dapat menembus sampai bagian tilakoid, karboksisom sel mikroalga Synechocystis. Kemampuan penetrasi yang baik dan kerusakan membran intraseluler merupakan indikasi bahwa ektraksi lipid dengan metode berbasis kombinasi kloroform-metanol dapat menghasilkan lipid yang maksimum.Meskipun metode ini dikembangkan untuk mengekstraksi lipid netral seperti triacylgliserol (TAG), tetapi juga cocok untuk mengekstraksi lipid polar. Hal ini terjadi karena metode inimemiliki tingkat efisiensi yang tertinggi, namun toksisitas kloroform dan metanol membuat pelarut ini tidak cocok untuk dipakai pada ekstraksi skala besar.Hasil karakterisasi komposisi asam lemak 4 jenis mikrolaga yang di ekstraksi dengan kloroform-metanol dapat dilihat pada Tabel 3.
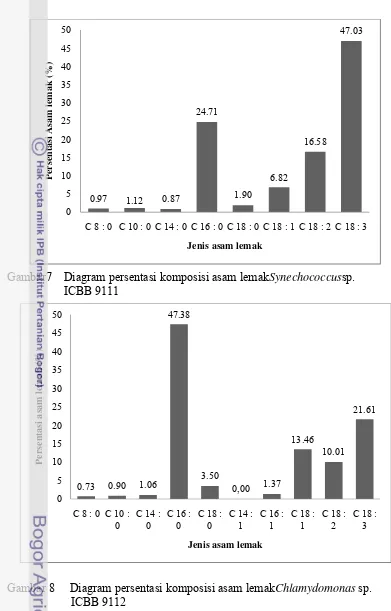
Komposisi asam lemak Synechococcussp. ICBB 9111 mempunyai nilai dominan asam lemak tertinggi berupa asam lemak C18:3 (47.03%), tertinggi kedua C16:0 (24.71%), dan yang terendah C8:0 (0.9%) (Gambar 7). Hasil penelitian Sahu et al. 2013 menunjukkan bahwa Synechococcussp. mempunyai asam lemak C16:1 (82.12 ± 0.62%), C16:0 (8.74 ± 0.13%) dan C18:2 (5.45 ± 0.17%). Perbedaan komposisi asam lemak tersebut karena setiap mikroalga mempunyai kemampuan mensintesis yang berbeda tergantung jenis isolat dan kondisi kultur mikroalga.
17
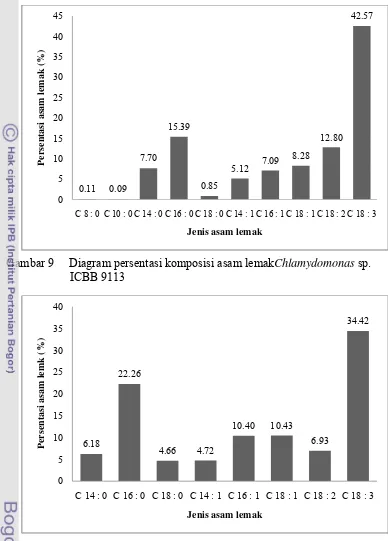
sp. ICBB 9113 mempunyai nilai dominan asam lemak yaitu C18:3 (42.57%), tertinggi kedua C16:0 (15.39%), dan yang terendah C10:0 (0.09%) (Gambar 9). Menurut Canacki (2007), produksi bahan bakar disel memerlukan asam lemak rantai pendek dan asam lemak jenuh, karena mempunyai titik leleh (melting point) yang rendah, bilangan setan yang tinggi dan cenderung tidak mudah teroksidasi.
Chlamydomonas sp. ICBB 9112 memiliki C16:0 yang dominan sehingga dapat digunakan untuk bahan baku pembuatan bahan bakar disel.Komposisi asam lemak
Chlamydomonas sp. ICBB 9114 mempunyai nilai dominan asam lemak tertinggi yaitu C18:3 (34.42%), tertinggi kedua C16:0 (22.26%), dan yang terendah C18:0 (4.66%). Chlamydomonas sp. ICBB 9114 tidak teridentifikasi asama lemak rantai C8:0, C10:0 dan C12:0 (Gambar 10). Berdasarkan hasil penelitian Poerschmann
et al. (2004) komposisi asam lemak Chlamydomonas sp. yang di tanam pada pH 7 fotoautotrof : C:14 (1,37%), C16:0 (33,3%), C18:0 (1,9%), C18:1ω9c (4,13%), C18:1ω7c (2,78%), C18:2 ω6,9cc (0,37%), C18:3ω3,6,9ccc (35,43%), C20:1 ω9c (0,41%).
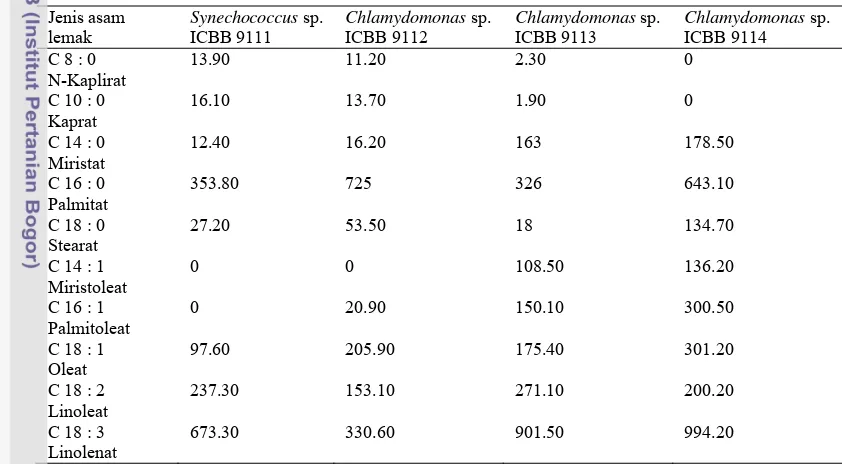
Tabel 3Hasil karakterisasi komposisi asam lemak 4 jenis mikrolaga
Jenis asam lemak
Synechococcus sp.
ICBB 9111
Chlamydomonas sp.
ICBB 9112
Chlamydomonas sp.
ICBB 9113
Chlamydomonas sp.
ICBB 9114 C 8 : 0
N-Kaplirat
13.90 11.20 2.30 0
C 10 : 0 Kaprat
16.10 13.70 1.90 0
C 14 : 0 Miristat
12.40 16.20 163 178.50
C 16 : 0 Palmitat
353.80 725 326 643.10
C 18 : 0 Stearat
27.20 53.50 18 134.70
C 14 : 1 Miristoleat
0 0 108.50 136.20
C 16 : 1 Palmitoleat
0 20.90 150.10 300.50
C 18 : 1 Oleat
97.60 205.90 175.40 301.20
C 18 : 2 Linoleat
237.30 153.10 271.10 200.20
C 18 : 3 Linolenat
673.30 330.60 901.50 994.20
Hasil karaktersiasi komposisi asam lemak (Tabel 4) menunjukkan bahwa
Chlamydomonas sp. ICBB 9114 mempunyai nilai C16:0 (643.10 mg/100g) dan C18:0
(134.70 mg/100g) yang tinggi dibandingkan denganjenis mikroalga yang lain. Asam lemak C16:0 dan C18:0 merupakan asam lemak tak jenuh yang akan berpengaruh terhadap bilangan setana pada biodisel yang hasilkan. Knothe et al.
18
Gambar7 Diagram persentasi komposisi asam lemakSynechococcussp. ICBB 9111
Gambar 8 Diagram persentasi komposisi asam lemakChlamydomonas sp.
ICBB 9112
0.97 1.12 0.87
24.71 1.90 6.82 16.58 47.03 0 5 10 15 20 25 30 35 40 45 50
C 8 : 0 C 10 : 0 C 14 : 0 C 16 : 0 C 18 : 0 C 18 : 1 C 18 : 2 C 18 : 3
Persentasi Asam
lemak
(%
)
Jenis asam lemak
0.73 0.90 1.06
47.38 3.50 0,00 1.37 13.46 10.01 21.61 0 5 10 15 20 25 30 35 40 45 50
C 8 : 0 C 10 : 0
C 14 : 0
C 16 : 0
C 18 : 0
C 14 : 1
C 16 : 1
C 18 : 1
C 18 : 2
C 18 : 3
Persentasi asam
lemak
(%
)
19
Gambar 9 Diagram persentasi komposisi asam lemakChlamydomonas sp.
ICBB 9113
Gambar 10 Diagram persentasi komposisi asam lemakChlamydomonas sp.
ICBB 9114
Jenis asam lemak terdiri dari asam lemak jenuh (saturated) dan asam lemak tak jenuh (unsaturated) serta asam lemak tak jenuh terdiri dari
monounsaturateddan polyunsaturated. Hasil pengujian asam lemak jenuh untuk keempat jenis mikroalga berkisar antara 423.3-956.3 mg/100g, asam lemak tak jenuh berkisar antara 710.5-1932.3. Chlamydomonas sp. ICBB 9114 mempunyai komposisi asam lemak jenuh, asam lemak tidak jenuh dan asam lemak tidak jenuh
0.11 0.09
7.70 15.39
0.85
5.12 7.09
8.28 12.80
42.57
0 5 10 15 20 25 30 35 40 45
C 8 : 0 C 10 : 0 C 14 : 0 C 16 : 0 C 18 : 0 C 14 : 1 C 16 : 1 C 18 : 1 C 18 : 2 C 18 : 3
Persentasi asam
lemak
(%
)
Jenis asam lemak
6.18
22.26
4.66 4.72
10.40 10.43
6.93
34.42
0 5 10 15 20 25 30 35 40
C 14 : 0 C 16 : 0 C 18 : 0 C 14 : 1 C 16 : 1 C 18 : 1 C 18 : 2 C 18 : 3
Persentasi asam
lemk
(%
)
20
tunggal atau ganda paling tinggi dibandingkan jenis mikroalga lainnya.
Chlamydomonas sp. ICBB 9114 juga mempunyai komposisi asam lemak tak jenuh paling tinggi dibandingkan dengan komposisi jenis asam lemak lainnya. Menurut Ramos et al. (2009), bilangan setana mempunyai hubungan yang linear dengan jumlahasam lemak tidak jenuh. Knothe et al. (2003) menyatakan bahwa bilangan setana yang rendah disebabkan oleh kandungan asam lemak tak jenuh yang tinggi seperti C18:2 dan C18:3 ,akan tetapi jika asam lemak jenuh tinggi seperti C16:0 dan C18:0 akan menghasilkan bilangan setana yang tinggi. Minyak mikroalga dikenal mempunyai PUFAs yang tinggi dengan tiga atau lebih ikatan rangkap, akan tetapi terdapat spesies yang memiliki jumlah asam lemak jenuh (SFAs) yang tinggi (Chisti 2007).Komposisi asam lemak jenuh dan tak jenuh empat jenis mikroalga dapat dilihat pada Tabel 4.
Tabel 4Komposisi asam lemak jenuh dan tak jenuh empat jenis mikroalga
Jenis mikroalga Saturated (mg/100g)
Unsaturated (mg/100g)
Monounsaturated (mg/100g)
Poliunsaturated (mg/100g) Chlamydomonas sp.
ICBB 9113
511.30 1606.70 434 1172.60
Synechococcus sp. ICBB 9111
423.30 1008.20 97.60 910.60
Chlamydomonas sp. ICBB 9112
819.60 710.50 226.80 483.70
Chlamydomonas sp. ICBB 9114
956.30 1932.30 737.90 1194.40
Produksi Fatty Acid Metyl Ester (FAMEs) Empat Jenis Mikroalga
Produksi biodiesel dari mikroalga melalui proses ekstraksi lipid dari biomassa dan dilanjutkan dengan konversi lipid menjadi Fatty Acid Metyl Ester
(FAMEs) melalui proses transesterfikasi (D’Oca et al. 2011).Proses pembuatan biodiesel ada 2 cara yaitu esterifikasi (katalis asam) dan transesterifikasi (katalis basa). Pada proses pembuatan biodiesel yang dilakukan pada keempat jenis mikroalgamenggunakan proses transesterifikasi karena kandungan asam lemak bebas pada lipid mikroalga kurang dari 2 % (Tabel 2).Katalist yang digunakan pada proses transesterifikasi yaitu NaOH dan menggunakan pelarut metanol. Menurut Van Gerpen et al.(2004), katalis basa digunakan karena reaksinya sangat cepat, sempurna dan dapat dilakukan pada suhu rendah. Transesterifikasi dengan katalist basa berlangsung antara metanol dan trigliserida melalui pembentukan berturut-turut digliserida dan monogliserida menghasilkan metil ester pada setiap tahapnya.
Jumlah FAMEs yang dihasilkan melalui kuantifikasi menunjukkan bahwa
21
Tabel 5Hasil Fatty acid metyl ester (FAMEs) empat jenis mikroalga
Jenis mikroalga FAMEs (mg/100g)
Synechococcus sp. ICBB 9111 2181.10
Chlamydomonas sp. ICBB 9112 2237.90
Chlamydomonas sp. ICBB 9113 3129.60
Chlamydomonas sp. ICBB 9114 3523.20
Menurut Cheng et al. (2004) reaksi transesterifikasi dipengaruhi oleh faktor internal misalnya kandungan air, kandungan asam lemak bebas, kandungan zat terlarut maupun tak terlarut dan faktor eksternal seperti suhu, waktu, kecepatan pengadukan,jenis dan konsentrasi katalis serta jumlah nisbah molar metanol terhadap minyak. Canacki dan Van Gerpen (2001), menyatakan bahwa reaksi transesterifikasi mempunyai syarat yaitu minyak harus bersih, tanpa air dan netral, kandungan asam lemak bebas yang rendah. Kandungan asam lemak bebas yang tinggi akan mengurangi kebasaan katalist dan membentuk lapisan gel yang akan mempersulit pemisahan dan pengendapan gliserol.
Karakterisasi Biodisel Chlamydomonas sp. ICBB 9114 yang Diproduksi secara Transesterfikasi In situ
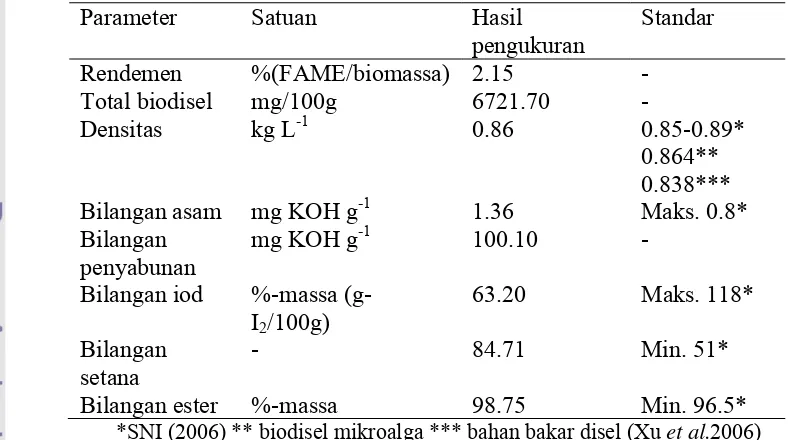
Proses transesterfikasi in situ dilakukan untuk mengkonversi secara langsung trigliserida yang terkandung dalam mikroalga menjadi biodiesel. Hasil karakterisasi biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterfikasi in situdapat dilihat pada Tabel 6.
Tabel 6Karakterisasi biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterfikasi in situ
Parameter Satuan Hasil
pengukuran
Standar
Rendemen %(FAME/biomassa) 2.15 -
Total biodisel mg/100g 6721.70 -
Densitas kg L-1 0.86 0.85-0.89*
0.864** 0.838***
Bilangan asam mg KOH g-1 1.36 Maks. 0.8*
Bilangan penyabunan
mg KOH g-1 100.10 -
Bilangan iod %-massa (g-I2/100g)
63.20 Maks. 118*
Bilangan setana
- 84.71 Min. 51*
Bilangan ester %-massa 98.75 Min. 96.5* *SNI (2006) ** biodisel mikroalga *** bahan bakar disel (Xu et al.2006)
[image:33.595.123.517.481.701.2]22
rendemen biodisel yang terukur dengan GC FID (6,72%) (Tabel 6). Hal ini menunjukkan bahwa proses pencucian dan pengeringan biodisel dapat menyebabkan kehilangan rendemen biodisel. Menurut Mustafa dan Havva (2010), beberapa faktor yang mempengaruhi rendemen ester antara lain rasio molar antara trigliserida dan alkohol, jenis katalis, suhu reaksi, waktu reaksi, kandungan air dan asam lemak bebas yang dapat menghambat reaksi.
Keberhasilan proses transesterifikasiberdasarkan parameter penurunan viskositas minyak, penurunan densitas minyak dan peningkatan kandungan metil ester (Sahirman 2009). Al Widyan dan Al Shyoukh (2002) mengukur keberhasilan proses transesterifikasi berdasarkan penurunan spesific grafity (massa jenis), sedangkan Cheng et al. (2004) menggunakan parameter penurunan kadar gliserida dan peningkatan metil ester (ME) untuk mengukur keberhasilan proses transesterifikasi.Hasil analisis menunjukkan densitas biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterfikasi in situsudah sesuai dengan SNI biodisel (2006) maupun biodisel mikrolaga (Xu et al. 2006) sebesar 0.86 kg/L.
Bilangan asam merupakan salah satu parameter standar biodiesel, menunjukkan jumlah miligram KOH yang digunakan untuk menetralkan asam lemak bebas yang terkandung dalam minyak/lemak (Ketaren 2008). Hasil analisis menunjukkan bilangan asam biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterifikasi in situtidak sesuai dengan SNI biodisel (2006) yaitu lebih besar dari 0.8 mg KOH g-1. Hal ini terjadi karena hidrolisis asam lemak yang terdapat pada biodisel pada saat proses pengeringan setelah pencucian danmengindikasikan bahwa selama proses transesterifikasi asam lemak bebas tidak sepenuhnya terkonversi menjadi metil ester. Menurut Tyson (2004),bilangan asam yang tinggi tidak diinginkan dalam produk biodiesel, dimana bilangan asam lebih dari 0.8 dapat menjadi deposit sistem bahan bakar dan mengurangi umur pompa dan filter.
Bilangan penyabunan menunjukkan jumlah miligram KOH yang dibutuhkan untuk menyabunkan 1 gram minyak/lemak (Ketaren 2008), dipengaruhi oleh senyawa-senyawa sepertitriacylglieserol (TAG),diacylglisero (TAG), dan
monoacylgilserol (MAG) yang terbentuk selama proses transesterifikasi.Bilangan penyabunan juga menunjukkan berat molekul dari suatu biodiesel. Semakin banyak DAG dan MAG yang terbentuk, semakin banyak yang terkonversi sehingga semakin menurunkan berat molekul dan meningkatkan bilangan penyabunan ME. Hasil pengkuran menunjukkan bahwa bilangan penyabunan dari biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterifikasi
in situsebesar 100.10 mg KOH g-1.
Bilangan ester merupakan selisih antara bilangan penyabunan dan bilangan asam sehingga semakin tinggi bilangan ester ME yang terukur menunjukkan tingkat kemurnian biodiesel yang dihasilkan. Hasil perhitungan menunjukkan bahwa biodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterifikasi in situsudah sesuai dengan SNI biodisel (2006) dengan nilai 98.75 %-massa.
(g-23
I2/100g). Menurut Mittelbach dan Remschmidt(2004), bilangan iod berkaitan dengan derajat ketidakjenuhan minyak/lemak. Semakin tinggi bilangan iod maka terjadi penurunan stabilitas oksidasi yang berakibat pada rendahnya kualitas produk (biodisel).Bilangan iod memiliki korelasi dengan viskositas kinematik dan bilangan setana.Penurunan nilai dari bilangan iod dan viskositas kinematik menyebabkan meningkatnya ketidakjenuhan minyak Pembatasan nilai bilangan iod dimaksudkan untuk menghindari kandungan asam lemak tak jenuh ganda yang tinggi dalam biodiesel. Menurut Martin et al. (2010), kandungan asam lemak tidak jenuh ganda yang tinggi sangat mudah mengalami oksidasi dan polimerisasi sehingga membentuk gum ketika digunakan sebagai bahan bakar dalam mesin.
Panas pembakaran merupakan kemampuan biodiesel untuk menghasilkan kalor ketika dilakukan pembakaran, berkaitan dengan konsumsi bahan bakar yang digunakan mesin kendaraan setiap satuan waktu.Semakin pendek rantai karbon dalam ME, panas pembakaran menjadi semakin menurun.Penurunan kalor pembakaran pada ME sejalan dengan peningkatan bilangan penyabunan yang menunjukkan semakin banyak senyawa DAG, MAG dan ME yang terkonversi.Hasil perhitungan bilangan setanabiodisel Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterfikasi in situsudah sesuai dengan SNI biodisel (2006) dengan nilai 84.71 dengan minimun yang dipersyaratkan 51.
4 KESIMPULAN DAN SARAN
Kesimpulan
Synechococcus sp. ICBB 9111 mempunyai kadar lipid terendah (4.19±0.01%) dan Chlamydomonas sp. ICBB 9114 mempunyai kadar lipid tertinggi (5.05±0.12%). FAMEs tertinggi dihasilkan oleh Chlamydomonas sp. ICBB 9114 (3523.2 mg/100g) dan terendah dihasilkan oleh Synechococcus sp. ICBB 9111 (2181.1 mg/100g). Keempatmikroalga yang ditumbuhkan dalam media teknis memiliki asam lemak tertinggiC18:3 dan C16: 0sehingga dapat digunakan sebagai bahan baku biodisel. Asam lemak tertinggi dihasilkan olehChlamydomonas sp. ICBB 9114.Hasil karakterisasi beberapa parameter biodisel dari Chlamydomonas sp. ICBB 9114 yang diproduksi secara transesterfikasi in situ sudah sesuai dengan SNI bioidisel kecuali bilangan asam.
Saran
24
DAFTAR PUSTAKA
Al-Widyan MI, Al Shyoukh AO. 2002. Experimental evaluation of the transesterification of waste palm oil into biodiesel. BioreTechnol 85: 253-256.
[ANP] Agencia Nacional do Petroleo. 2008. Resolucao ANP No 7 Gas Natural Biocombustiveis. http://nxt.anp.gov. [4 Juli 2013].
[AOAC] Association of Official Analytical Chemistry. 2007. Official Methods of Analysis. 18th ed. Marylan: Association of Official Analytical Chemists inc. [AOCS] American Oil Chemist’ Society. 1990. Official methods and
recommended practices of the American Oil Chemists’ Society. AOCS Champaign, Illionois, USA.
Arisanti D. 2011.Produksi karbohidrat, protein, dan lipid mikroalga terseleksi
pada kolam sistem raceway: penggunaan kombinasi Za-NaNO3 dan SP-36-K2HPO4 sebagai unsur Hara N dan P [tesis]. Institut Pertanian Bogor.
Bilanovic D, Shelef G, Sukenik A. 1988. Flocculation of microalgae with cationic polymers --effects of medium salinity. Biomass 17 : 65-76.
Bligh EG, Dyer WJ. 1959. A rapid method of total lipid extraction
andpurification. Canadian Journal of Biochemistry and Physiology 37:
911−917.
[BSN] Badan Standardisasi Nasional. 2006. SNI 04-7182-2006. Biodiesel.Jakarta : Badan Standardisasi Nasional.
CanackiM. 2007. The potential of restaurant waste lipids as biodiesel feedstocks.BioresTechnol 98: 183-190.
Canacki M, Gerven VJ. 2001. Biodiesel from oils and fats with high free fatty acid feedstocks. Trans ASAE 44:1203-1210.
Cheng SF, Choo VM, Ma AN, Chuah CH. 2004. Kinetics study on transesterification of palm oil. JournalOil Palm Res 16: 19-29.
Chisti Y. 2007. Biodiesel from microalgae.Biotechnology Advances25(3): 294-306.
Daramola JA, Fasakin EA, Adeparusi EO. 2007. Changes in physicochemical and sensory characteristics of smoke-dried fish species stored at ambient temperature. African Journal of Food Agriculture Nutrition and Development 7(6): 1-12.
Demirbas AH. 2009. Inexpensive oil and fats feedstocks for production of biodiesel. Energy Educ Sci Technol Part A 23:1–13.
25
D’Oca MGM, Viêgas CV, Lemoes JS, Miyasaki EK, Moron-Villarreyes JA, Primel EG, Abreu PC, 2011. Production of FAMEs from several microalgallipidic extracts and direct transesterification of the Chlorella pyrenoidosa. Biomass Bioenergy 35: 1533–1538.
Edlund M, Visser H, Heitland P. 2002. Analysis of biodiesel by argon-oxygenmixed-gas inductively coupled plasma optical emission spectrometry. J. Anal.At. Spectrom 17:232–235.
Gonzalves A, Ghanjaoui ME, El Rhazi M, de la Guardia M. 2010. Inductively coupled plasma optical emission spectroscopy determination of trace element composition of argan oil. Food Sci. Technol. Int. 16: 61–75.
Halim R, Danquah MK, Webley PA. 2011. Extraction of oil from microalgae for biodisel production: A review. Biotechnology Advances 30:709-732.
Hossain ABMS, Salleh A, Boyce AN, Chowdhury P, Naqiuddin M. 2008. Biodiesel fuelproduction from algae as renewable energy. American Journal of Biochemistry and Biotechnology 4(3): 250-254.
Huang G, Chen F, Wei D, Zhang X, Chen G. 2010. Biodiesel production by microalgal biotechnology. Applied Enegy 87: 38-46.
Hu Q, Sommerfeld M, Jarvis E, Ghirardi M, Posewitz M, Seibert M, Darzins A.2008. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances. Plant Journal 54 (4): 621–639.
[KESDM] Kementrian Energi dan Sumber Daya Mineral. 2011. Kajian Teknis Bioenergi. [Laporan akhir]. Jakarta
Kersey WT, Munger SP. 2009.Marine Phytoplankton. New York: Nova Science Pub.
Ketaren S. 1986. Minyak dan Lemak Pangan. Jakarta : UI-Press.
Krawczyk T. 1996. Biodiesel-alternative fuel makes inroads but hurdles remain.
Inform 7(8): 1-29
Lepri FG, Chaves ES, Vieira MA, Ribeiro AS, Curtius AJ, Oliveira LCC,Campos RC. 2011. Determination of trace elements in vegetable oils andbiodiesel by atomic spectrometric techniques – a review. Appl. Spectrosc 46: 175–206. Mata TM , Martins AA, Caetano NS. 2010. Microalgae for biodiesel production
and other applications: A review. Renewable and Sustainable Energy Reviews 14:217–232.
Martin C, Moure A, Martin G, Carrillo E, Dominguez H, Parajo JC. 2010. Fractional characterisation of jatropha, neem, moringa,trisperma, castor and candlenut seeds as potential feedstocksfor biodiesel production in Cuba.
Biomass and bioenergy 3 4: 533 – 538.
Mittelbach M, Remschmidt C. 2004. Biodiesel. Boersedruck ges.m.b.H., Viena Austria.
26
Poerschmann J, Spijkerman E, Langer U. 2004. Fatty acid patterns in
Chlamydomonas sp. as a marker for nutritional regimes and temperature under extremely acidic conditions. Microbial ecology 48: 78-89.
Sahirman. 2009. Perancangan Proses Produksi Biodiesel dari Minyak BijiNyamplung (Calophyllum inophyllum L.)[disertasi]. Bogor:ProgramPascasarjana, Institut Pertanian Bogor.
Schafer K.1998. Accelerated solvent extraction of lipids for determining the fatty acid composition of biological material. Analytica Chimica Acta 358(1): 69– 77.
Sheng J, Vannela R, Rittmann BE. 2011. Evaluation of methods to extract and quantify lipids from Synechocystis PCC 6803. Bioresource Technology
102:1697–1703.
Soares BM, Vieira AA, Lemoes JS, Santos CMM, Mesko MF, Primel EG, D’Oca MGM, Duarte FA. 2012. Investigation of major and trace element distribution in the extraction–transesterification process of fatty acid methyl esters from microalgae Chlorella sp. Bioresource Technology 110:730–734. Steel RGD, Torrie JH. 1991. Prinsip dan Prosedur Statistika. Penerbit
PT.Gramedia Utama, Jakarta.
Sudarmadji S, Haryono B, Suhardi. 1997. Prosedur analitik untuk bahan makanan dan pertanian. Liberty 4: 99-100.
Sugiyono, Amini S, Puspita K. 2010. Kultivasi dan ekstraksi minyak nabati mikroalga laut jenis Botryococcus braunii dan Tetraselmis sp. Di dalam: Sudradjat A, Supriyadi H, Hanafi A, Kristanto AH, Chumaidi, Mustafa A, Imron, Insan I, editor. Global warming dalam persfektif kelautan: tantangan dan peluang. Prosiding seminar nasional VI Forum inovasi teknologi aquakultur; Surabaya 22 April 2010.Jakarta : Pusat Penelitian dan Pengembangan Perikanan Budidaya Badan Penelitian dan Pengembangan Kelautan dan Perikanan.
Sahu A, Pancha I, Jain D, Paliwal C, Ghosh T,Patidar S, Bhattacharya S, Mishra S. 2013. Fatty acids as biomarkers of microalgae. Phytochemistry 89: 53– 58.
Tian Y, Zhao L, Meng H, Sun L, Yan J. 2010.Estimation of un-used land potential for biofuels development in (the) People’s Republic of China.Appl Energy
86:77–85.
Tyson SK. 2004. Biodiesel Handling and Use Guidelines. National Renewable EnergyLaboratory, U.S. Department of Commerce.
Winarno FG. 2008. Kimia Pangan dan Gizi.Bogor : M-Brio Pres.
Lampiran As
RF
Keteranga SI : st ALX : a RF : re
Mg Asam
Lampiran
n 1 Contoh sam lemak (
F =
an :
tandar inter sam lemak
entention fa
Lemak C1
n 2 Hasil p
Kr
Kro
h perhitung (mg/g) =
rnal X
actor
8: 0 =
= 0.02 m
pengukuran
romatogram
omatogram
LAMPIR gan asam le
mg/100 g bi
nasam lema
m Synechoco
Chlamydom
RAN emak
iomassa
ak menggu
occus sp. IC
monas sp. IC
unakan GC
CBB 9111
CBB 9112 -FID
28
Kroomatogram
Kromatog
Kromatog
biodisel Ch
gram Chlam
gram Chlam
hlamydomo
transeste
mydomonas
mydomonas
nas sp. ICB erifikasi in s
sp. ICBB 9
sp. ICBB 9
BB 9114 yan
situ
9113
9114
29
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya, pada tanggal 21Maret 1988 dari pasangan Bapak Wahyudin dan Ibu Hasaroh sebagai anak kedua dari empat bersaudara.Pada tahun 2006, penulis menyelesaikan pendidikan menengah atas di SMAN 2 Tasikmalaya dan diterima di Institut Pertanian Bogor (IPB) melalui Jalur Undangan Seleksi Masuk IPB (USMI). Pendidikan sarjana ditempuh di Jurusan Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB, lulus pada tahun 2011. Kesempatan untuk melanjutkan ke program Magister pada program studi danpada perguruan tinggi yang sama diperoleh pada tahun 2011. Beasiswa pendidikan pascasarjana diperoleh dari Dinas Pedidikan Tinggi berupa beasiswa unggulan (BU).
Selama mengikuti program S-2, penulis pernah menyajikan karya ilmiah yang berjudul Biodiesel production from biomass of Chlamydomonas sp. ICBB 9113 cultivated in a cheap culture media: effectivity of different extraction methods, dipersentasikan pada International Conference on Marine Science (ICMS2013) di Bogor pada bulan Juni 2013.Penulis jugamenjadi pemakalah dalam acara Seminar Nasional dan Pertemuan Ilmiah ke-3 Masyarakat Pengolahan Hasil Perikanan Indonesia pada bulan Oktober 2012 dengan judul ‘Pengembangan Dessert Berbasis Isolat Protein Basah Ikan Lele (Clarias sp.) dengan Pewarna Alami’.Abstrak yang berjudul Biodiesel production from biomass of Chlamydomonas sp. ICBB 9113 using different lipid extraction methods telah diterima pada International Biomass Conference & Expo di Minneapolis, Minnesota, USA pada bulan April 2013 untuk dipersentasikan dalam bentuk poster. Artikel lain yang berjudul Produksi biodisel dari biomassa