SINTESIS NANOPARTIKEL EKSTRAK KULIT MANGGIS
MERAH (
Garcinia forbesii
) DAN KAJIAN SIFAT
FUNGSIONAL PRODUK ENKAPSULASINYA
NURMALIA NINGSIH
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Nanopartikel Ekstrak Kulit Manggis Merah (Garcinia forbesii) dan Kajian Sifat Fungsional Produk Enkapsulasinya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NURMALIA NINGSIH. Sintesis Nanopartikel Ekstrak Kulit Manggis Merah (Garcinia forbesii) dan Kajian Sifat Fungsional Produk Enkapsulasinya. Dibimbing oleh SEDARNAWATI YASNI dan SRI YULIANI.
Kulit manggis merupakan bagian dari buah manggis yang termasuk dalam limbah. Studi sifat fungsional kulit manggis dapat memberikan manfaat bagi kesehatan. Tetapi aplikasi ke dalam produk belum banyak dikaji. Enkapsulasi berbasis nanopartikel merupakan pendekatan yang efektif dalam memasukkan zat aktif kulit manggis ke dalam produk pangan. Tujuan penelitian ini adalah menghasilkan nanopartikel ekstrak kulit manggis merah Garcinia forbesii (GF) dan kulit manggis mangostana atau Garcinia mangostana (GM), menghasilkan produk enkapsulasinya, dan mengetahui sifat fungsionalnya. Metode penelitian meliputi ekstraksi, sintesis nanopartikel, dan spray drying. Dalam ekstraksi kulit manggis digunakan metode maserasi dan refluks dengan pelarut etanol 70%. Pada tahap sintesis nanopartikel digunakan dua konsentrasi kitosan yaitu 0.2% dan 1% dengan dua konsentrasi STPP 0.2% dan 0.1%. Selanjutnya dilakukan spray drying dengan bahan penyalut kombinasi antara maltodekstrin dan isolat protein kedelai (MISP), dan kombinasi antara maltodekstrin dan Na-kaseinat (MK). Hasil penelitian menunjukkan bahwa ekstraksi kulit manggis merah Garcinia forbesii (GF) dan kulit manggis mangostana atau Garcinia mangostana (GM) menggunakan metode refluks memberikan hasil yang lebih baik dibandingkan dengan metode maserasi, yaitu berturut-turut nilai rendemen 41.60±1.780% dan 41.67±0.248%, aktivitas antioksidan 13425.00±82.916 AEAC μg/mL dan 12425.00±86.603 AEAC μg/mL, kadar total fenol 785.87±4.612 GAE μg/mL dan 5105.98±218.120 GAE μg/mL, warna merah dan kuning kemerahan. Formula nanopartikel yang terbaik yaitu dengan konsentrasi kitosan 0.2% dan STPP 0.1% pada (GF) dan (GM), berturut-turut memiliki ukuran partikel 214.40±3.505 nm dan 285.20±5.990 nm, nilai indeks polidispersitas 0.36±0.026 dan 0.46±0.019, zeta potensial 15.40±0.432 mV dan 33.40±0.732 mV, aktivitas antioksidan 5729.17±198.742 AEAC μg/mL dan 4562.50±198.737 AEAC μg/mL, dan kadar total fenol 1714.67±16.304 GAE
μg/mL dan 2711.96±13.587 GAE μg/mL. Pada hasil enkapsulasi menggunakan
bahan penyalut MK memberikan nilai sifat fungsional yang lebih baik dibandingkan dengan bahan penyalut MISP, dengan nilai aktivitas antioksidan (GF) dan (GM) sebesar 5550.00±223.611 AEAC μg/mL dan 5766.67±317.984 serta nilai total fenol 2896.74±84.333 GAE μg/mL dan 2958.70±168.248 GAE μg/mL. Bentuk morfologi enkapsulat MISP dan MK berbentuk bulat keriput, permukaan kasar, terjadi pengerutan dan bentuk yang tidak seragam. Hasil kajian sifat-sifat fungsional produk enkapsulasi ekstrak kulit manggis merah Garcinia forbesii (GF) dan kulit manggis mangostana atau Garcinia mangostana (GM) dapat menjadi acuan dalam pengembangan dan pemanfaatan kulit manggis merah dengan teknologi nano dalam upaya diversifikasi pangan yang bermanfaat bagi kesehatan.
ABSTRACT
NURMALIA NINGSIH. Nanoparticle Synthesis of Red Mangosteen Peel Extract (Garcinia forbesii) and Fungtional Behaviour of Its Product Encapsulation. Supervised by SEDARNAWATI YASNI and SRI YULIANI.
Mangosteen skin is a part of mangosteen fruit which known as waste. A functional characteristic study of mangosteen skin could give benefit for health. However, it application into a product has not been widely studied. Encapsulation based nanoparticle is an effective approach on inserting active compounds of mangosteen skin into food products. The purpose of this research are to produces nanoparticle of red mangosteen extract Garcinia forbesii (GF) and common mangosteen skin Garcinia mangostana (GM), produces it encapsulation products, and discovers it functional characters. Research methods involve extraction, nanoparticle synthesis and spray drying. Extraction of mangosteen skin used maceration methods and refluxs with solvent ethanol 70%. The second phase of nanoparticle synthesis used two concentration of chitosan that is 0.2% and 1% with two concertation of STPP that is 0.2% and 0.1%. The third phase is spray drying with coating materials a combination between maltodextrin and soy protein isolate (MSPI), and a combination between maltodextrin and casein (MC). The result of this research shows that extractions of Garcinia forbesii (GF) dan Garcinia mangostana (GM) using refluxs methods give a better result than with maceration methods, that is (GF) and (GM) consecutive with rendement value 41.60±1.780% and 41.67±0.248%, antioxidant activity 13425.00±82.916 AEAC μg/mL and 12425.00±86.603 AEAC μg/mL, total phenol levels 785.87±4.612 GAE μg/mL and 5105.98±218.120 GAE μg/mL, red and redish yellow colours. The best nanoparticle formula is at concentration of chitosan 0.2% and STPP 0.1% in both (GF) and (GM), consecutive have partikel size 214.00±3.505nm and 285.20±5.990 nm, polydispersity index value 0.36±0.026 and 0.46±0.019, potensial zeta 15.40±0.432 mV and 33.40±0.732 mV, antioxidant activity 5729.17±198.742
AEAC μg/mL dan 4562.50±198.737 AEAC μg/mL, and total phenol levels
1714.67±16.304 GAE μg/mL and 2711.96±13.587 GAE μg/mL. On results of encapsulation using coating materials MC give functional behaviour value better than coating materials MSPI, with antioxidant activity value (GF) dan (GM) 5550.00±223.611 AEAC μg/mL and 5766.67±317.984 with total phenol value 2896.74±84.333 GAE μg/mL and 2958.70±168.248 GAE μg/mL. Morphology form of MSPI and MC encapsulate shaped round wrinkles, rough surface and not uniform. This research expected could be a reference materials for development functional food in product developments based red mangosteen skin Garcinia forbesii (GF) and common mangosteen mangostana or Garcinia mangostana (GM) with nano technology for food diversification and which gives human healthy body.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
SINTESIS NANOPARTIKEL EKSTRAK KULIT MANGGIS
MERAH (
Garcinia forbesii
) DAN KAJIAN SIFAT
FUNGSIONAL PRODUK ENKAPSULASINYA
NURMALIA NINGSIH
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulisan karya ilmiah berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April sampai dengan September 2016 ini ialah sintesis nanopartikel Garcinia forbesii, dengan judul Sintesis Nanopartikel Ekstrak Garcinia forbesii (Garcinia forbesii) dan Kajian Sifat Fungsional Produk Enkapsulasinya.
Ucapan terima kasih penulis sampaikan kepada Ibu Prof. Dr. Ir Sedarnawati Yasni, M.Agr dan Ibu Dr. Ir. Sri Yuliani, MT selaku pembimbing yang telah meluangkan waktu untuk membimbing penulis selama melakukan penelitian serta Dr. Ir. Sukarno, M.Sc selaku penguji yang telah banyak memberikan saran yang konstruktif. Selain itu, ucapan terima kasih penulis sampaikan kepada Ira Mulyawanti, S.TP, M.Si, Kun Tanti Dewandari, STP, M.Si, teknisi dan laboran di Balai Besar Litbang Pascapanen Pertanian, diantaranya Bu Citra, Pak Afdan, Bu Emma, Pak Idris, Pak Tri, Pak Asep, teknisi dan laboran di laboratorium Ilmu dan Teknologi Pangan IPB, diantaranya Bapak Yahya, Mba Yane, Bu Antin, Bu Sri, Pak Rojak, Pak Sobirin, Pak Gatot, Mba Rizka, Mba Irin, Mba Yuli, teman-teman ITP angkatan 49, teman sebimbingan Octarina Indah Setyowati dan Wulan Sadat Wati, teman-teman asrama APD IPB, teman-teman TPB dan lainnya yang tidak dapat disebutkan satu persatu yang telah membantu selama pelaksanaan penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya yang tiada putus.
Penulis telah berupaya menyajikan karya ilmiah ini dengan baik, walaupun masih dirasa banyak kekurangan bagi pembaca dan yang mencermatinya. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 2
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE PENELITIAN 3
Bahan 3
Alat 4
Metode Penelitian 4
Ekstraksi Kulit Manggis 4
Sintesis Nanopartikel Ekstrak Kulit Manggis 5
Karakterisasi Nanopartikel Ekstrak Kulit Manggis 5
Enkapsulasi Nanopartikel Ekstrak Kulit Manggis 5
Karakterisasi Enkapsulat Nanopartikel Ekstrak Kulit Manggis 5
HASIL DAN PEMBAHASAN 12
Karakteristik Buah Manggis 12
Ekastraksi Kulit Manggis 13
Sintesis Nanopartikel Kulit Manggis 17
Spray Drying Nanopartikel Ekstrak Kulit Manggis 22
SIMPULAN DAN SARAN 27
Simpulan 27
Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 32
DAFTAR TABEL
1 Deskripsi warna berdasarkan ohue 8
2 Hasil analisis proksimat tepung kulit manggis 12
3 Hasil eksraksi tepung kulit manggis 16
4 Hasil chromameter ekstrak kulit manggis dari berbagai metode 14
5 Hasil analisis karakterisasi nanopartikel 18
6 Karakterisasi nanopartikel formula terpilih 18
7 Hasil analisis sifat fungsional enkapsulat nanopartikel 26
DAFTAR GAMBAR
1 Tepung Garcinia mangostana dan tepung Garcinia forbesii 1
2 Bola imaginer Munsell 7
3 Ekstrak Garcinia forbesii dan Garcinia mangostana 16
4 Interaksi kitosan dengan TPP 17
5 Larutan nanopartikel ekstrak kulit manggis 19
6 Hasil analisis TEM nanopartikel ekstrak Garcinia forbesii (GF) 21 7 Hasil analisis TEM nanopartikel ekstrak Garcinia mangostana (GM) 21 8 Enkapsulat nanopartikel bahan penyalut kombinasi maltodekstrin 60%
dan ISP 40% (MISP) dan maltodekstrin 60% dengan Na-kaseinat 40%
(MK) 22
9 Hasil analisis SEM enkapsulat nanopartikel ekstrak GF 24 10 Hasil analisis SEM enkapsulat nanopartikel ekstrak GM 25
DAFTAR LAMPIRAN
1 Diagram alir penelitian 32
2 Diagram alir persiapan bahan kulit manggis 33
3 Diagram alir pembuatan ekstrak tepung kulit manggis 34 4 Hasil analisis proksimat tepung kulit manggis 35 5 Rendemen hasil ekstraksi tepung kulit manggis 36 6 Hasil analisis anova rendemen ekstrak GF dan GM 37 7 Hasil analisis aktivitas antioksidan ekstrak kulit manggis 38
8 Kurva standar asam askorbat 39
9 Hasil analisis total fenol ekstrak kulit manggis 40
10 Kurva standar asam galat 41
11 Hasil analisis anova aktivitas antioksidan, aktivitas antioksidan, total
fenol, dan pH ekstrak Garcinia forbesii (GF) 42
18 Uji anova nanopartikel GF ukuran partikel dan indeks polidispersitas 54 19 Uji anova nanopartikel GM ukuran partikel dan indeks polidispersitas 55
20 Hasil analisis PSA F1 GF 56
21 Hasil analisis PSA F2 GF 57
22 Hasil analisis PSA F3 GF 58
23 Hasil analisis PSA F4 GF 59
24 Hasil analisis PSA F1 GM 60
25 Hasil analisis PSA F2 GM 61
26 Hasil analisis PSA F3 GM 62
27 Hasil analisis PSA F4 GM 63
28 Karakterisasi nanopartikel terpilih F2 GF dan GM 64 29 Hasil analisis zeta potensial nanopartikel terpilih F2 GF 65 30 Hasil analisis zeta potensial nanopartikel terpilih F2 GM 66 31 Hasil analisis akivitas antioksidan enkapsulat nanopartikel GF dan GM 67 32 Hasil analisis total fenol enkapsulat nanopartikel GF dan GM 68 33 Analisis anova antioksidan dan total fenol enkapsulat nanopartikel 69
PENDAHULUAN
Latar Belakang
Kondisi lingkungan dan pola konsumsi yang tidak seimbang serta paparan radikal bebas sudah banyak terjadi di masyarakat, sehingga menyebabkan bermunculan berbagai jenis penyakit degeneratif, seperti obesitas, penyakit jantung koroner, hipertensi, diabetes mellitus, maupun kanker. Oleh karena itu, penting adanya kesadaran terhadap pola konsumsi dan pola hidup yang seimbang. Kebutuhan antioksidan semakin meningkat seiring dengan meningkatnya kesadaran masyarakat terhadap pentingnya kesehatan. Antioksidan memiliki pengaruh positif bagi kesehatan karena antioksidan merupakan senyawa anti radikal bebas yang dapat mencegah dan mengurangi kerusakan oksidatif sel.
(a) (b)
Gambar 1. (a) Tepung Garcinia mangostana (b) Tepung Garcinia forbesii Salah satu potensi buah-buahan Indonesia yang berkhasiat bagi kesehatan adalah buah manggis. Walaupun kulit buah manggis tergolong dalam limbah, namun mengandung senyawa aktif yang berkhasiat bagi kesehatan. Buah manggis ada berbagai jenis, salah satunya manggis merah (Garcinia forbesii) atau dikenal dengan nama mundar dan manggis mangostana (Garcinia mangostana). Perbedaan dengan manggis mangostana adalah buah manggis merah Garcinia forbesii berwarna merah cerah, berbentuk bundar, kulit buahnya tipis dan lunak, sedangkan dagingnya berwarna putih (Saleh 2003). Kulit manggis merah (Garcinia forbesii) memiliki kandungan air yang lebih tinggi dan daging buahnya lebih berasa asam dibandingkan dengan manggis mangostana (Garcinia mangostana). Pada umumnya, rasa asam pada buah disebabkan oleh akumulasi asam organik yang tinggi, seperti asam sitrat, asam malat, asam asetat, asam askorbat, dan lainnya (Ong 2007). Menurut Saleh (2003), kulit buah manggis merah (Garcinia forbesii) banyak dimanfaatkan sebagai pengganti asam jawa atau jeruk asam dalam memasak di Brunei Darussalam.
2
senyawa fenolik lainnya. Zat aktif tersebut termasuk ke dalam antioksidan dan bermanfaat bagi kesehatan tubuh, diantaranya sebagai antibakteri, antiinflamasi, dan antifungal (Matsumoto et al. 2003). Selain itu, dapat bertindak sebagai pencegah penyakit degeneratif seperti jantung koroner, kanker, diabetes, hipertensi, struk (Lako et al. 2007). Penelitian Mranani (2015), menunjukkan bahwa kulit manggis merah (Garcinia forbesii) yang memiliki kandungan asam lebih tinggi dibandingkan dengan manggis mangostana (Garcinia mangostana). Kandungan asam tersebut memiliki kemampuan untuk menghambat pertumbuhan dan aktivitas mikroba, sehingga dapat memperpanjang umur simpan dari bahaya mikroba patogen dan perusak pangan, seperti Escherichia coli, Salmonella Typhimurium, Psedomonas aeruginosa, Sthaphylococcus aureus, Bacillus subtilis, dan Bacillis cereus. Pada penelitian Randy (2014) dan Mranani (2015) telah dilakukan pembuatan minuman fungsional berbasis Garcinia forbesii dan kajiannya sebagai pengawet alami. Kulit buah manggis merah memiliki aktivitas antioksidan yang tinggi sebesar 2216.6 ± 1.06 AAE (μg/mL). Buah manggis merah (Garcinia forbesii) lebih jarang dijumpai karena mulai punah, sehingga dibutuhkan pengembangan terhadap pembudidayaannya, pemanfaatan potensinya, peningkatan nilai ekonomisnya, dan kajian pengembangan produk yang bermanfaat bagi kesehatan.
Pemanfaatan kulit manggis mulai berkembang dalam berbagai produk baik sebagai obat, makanan, maupun minuman. Namun, terdapat beberapa kendala dalam aplikasinya, seperti kurang praktis, ketidakstabilan terhadap warna, kelarutan yang rendah, rasa pahit yang kurang disukai, dan mudah mengalami penurunan sifat fungsional. Hal inilah yang perlu diperhatikan agar proses dan desain formulasi khusus terhadap zat aktif kulit manggis dapat mengoptimalkan sifat fungsionalnya. Saat ini teknologi nano banyak dikembangkan dan menjadi tren dalam pengembangan dan peningkatan kualitas produk pangan fungsional. Nanoteknologi sangat berkembang karena memiliki banyak keunggulan seperti ukuran partikel yang lebih kecil meningkatkan aktivitas antioksidannya. Pada nanopartikel secara visual menghasilkan dispersi yang relatif transparan, perpanjangan lama pengendapan karena resultan gaya kebawah akibat gravitasi berkurang, hal ini disebabkan massa partikel berkurang dan luas permukaan partikel bertambah sehingga menghasilkan interaksi tolak-menolak antar partikel (Gupta dan Kompella 2006). Kelebihan lainnya adalah kemampuan dalam menembus ruang membran sel (Buzea et al. 2007) yang dapat meningkatkan penyerapan, dapat mengurangi rasa organoleptik seperti sepat dan pahit karena senyawa aktif tersalut membentuk kompleks pada sistem nanopartikel yang tersalutkan sehingga dapat menutupi rasa tersebut, dan fleksibel dikombinasikan dengan teknologi lain sehingga dapat dikembangkan untuk berbagai keperluan. Teknologi nano banyak dikembangkan sebagai penghantar zat aktif dalam suatu produk pangan maupun obat untuk mengatur laju pelepasan senyawa zat aktif, meningkatkan kelarutan, dan meningkatkan penyerapan dalam tubuh.
3 produk makanan, dan meningkatkan bioavailabilitas serta mengontrol penyerapannya dalam saluran pencernaan.
Perumusan Masalah
Permasalahan yang terjadi dalam pemanfaatan limbah buah kulit manggis adalah kandungan zat aktifnya sebagai sumber antioksidan alami cenderung kurang praktis, memiliki ketidakstabilan terhadap warna, kelarutan yang rendah, rasa pahit yang kurang diharapkan, mengalami penurunan sifat fungsional selama pengolahan maupun penyimpanan, serta bagaimana melindungi zat aktif kulit buah manggis agar optimum sifat fungsionalnya ketika diaplikasikan dalam produk pangan.
Tujuan Penelitian
Tujuan penelitian ini adalah menghasilkan formula nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana, menghasilkan produk enkapsulasinya, dan mengetahui sifat fungsionalnya.
Manfaat Penelitian
Manfaat dari penelitian ini adalah kajian formulasi nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana yang efisien, efektif, dan berkualitas dalam upaya meningkatkan dispersi senyawa bioaktif, melindungi terhadap degradasi mutu, mengurangi dampak organoleptik yang tidak diharapkan, meningkatkan bioavailabilitas, serta mengontrol penyerapannya dalam saluran pencernaan. Dengan demikian diharapkan dapat menjadi bahan referensi untuk pengembangan produk pangan fungsional berbasis kulit manggis dengan teknologi nano yang bermanfaat bagi kesehatan.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Pangan, Laboratorium Biokimia Pangan Departemen Ilmu dan Teknologi Pangan IPB, dan Laboratorium Nanoteknologi Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian Bogor. Penelitian berlangsung selama 6 bulan dari bulan April sampai September 2016.
Bahan
Bahan yang digunakan dalam penelitian ini terdiri dari Garcinia forbesii, Garcinia mangostana (yang diperoleh dari konsultan buah-buahan tropis di Bogor), kitosan dengan derajat deasetilasi (DD) 85%, STPP (Sodium tripolifosfat), asam asetat, aquades, maltodekstrin, isolat protein kedelai, dan Na-kaseinat.
4
folin ciaucalteau, air destilata, buffer KCl, buffer natrium asetat, larutan DPPH, larutan buffer Na-asetat, dan asam askorbat.
Alat
Alat yang digunakan dalam penelitian ini terdiri dari alat untuk ekstraksi kulit manggis, sintesis nanopartikel, enkapsulasi, dan analisis karakterisasinya. Alat yang dipakai diantaranya cabinet dyer, pin disc mill, refluks, shaker, rotary vacuum evaporator, pengaduk magnetik, stirrer plate, chromameter CR-310 (konica Minolta, Jepang), pH meter model pH 700 (Eutech Instruments, Singapura),spray dryer (LabPlant SD-05), particle size analyzer (PSA) (Malvern Zetasizer Nano series Nano-ZS), homogenizer (T25 digital Ultra Turrax), Scanning Electro Microscopy (ZEISS EVO MA 10), Transmission Electron Microscopy (FEI Tenchai G2 Spirit 120 KV), spektrofotometer double beam model UV-1800 (Shimadzu, Jepang). Peralatan pendukung lainnya seperti termometer, neraca analitik, peralatan gelas (gelas ukur, gelas piala, tabung reaktif, gelas pengaduk, dan lain-lain), refraktometer, dan peralatan pendukung lainnya.
Metode Penelitian
Penelitian ini terdiri dari tiga tahapan, yaitu (1) tahap ekstraksi, (2) tahap sintesis nanopartikel, dan (3) tahap enkapsulasi. Tahap ekstraksi kulit Garcinia forbesii dan Garcinia mangostana dilakukan dengan dua metode, yaitu maserasi dan refluks dengan tujuan untuk mendapatkan cara ekstraksi kulit manggis dengan hasil yang optimal. Pada ekstraksi dilakukan analisis warna, rendemen, aktivitas antioksidan, dan total fenol. Pada tahap sintesis nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana digunakan metode gelasi ionik dengan dua perlakukan konsentrasi kitosan dan dua perlakuan konsentrasi STPP. Pada hasil nanopartikel yang dihasilkan dilakukan analisis ukuran partikel, indeks polidispersitas, nilai zeta potensial, (Transmission Electron Microscopy) TEM, aktivitas antioksidan, dan total fenol. Selanjutnya, pada formula nanopartikel terpilih dilakukan enkapsulasi menggunakan spray dryer dengan dua perlakuan bahan pengisi yaitu kombinasi antara maltodekstrin dan isolat protein kedelai, dan kombinasi antara maltodekstin dan Na-kaseinat. Hasil produk enkapsulasi dilakukan analisis dengan (Scanning Electron Microscopy) SEM, aktivitas antioksidan, dan total fenol. Diagram alir tahapan penelitian lebih lengkap dapat dilihat pada Lampiran 1.
Ekstraksi Kulit Manggis (Modifikasi Dewandari et al. 2013)
5 shaker. Pada masing-masing proses ekstraksi dilakukan penyaringan dan filtrat dikumpulkan. Pada ampas dilakukan penambahan pelarut dengan perbandingan 1:3. Filtrat dari masing-masing cara dicampurkan dan dipekatkan dengan rotary vaccum evaporator pada suhu 40-45 oC sampai tercapai nilai total padatan terlarut (TPT) sebesar 20 obrix.
Penentuan metode ekstraksi dari kedua cara tersebut yang terbaik dilakukan analisis warna ekstrak, rendemen, aktivitas antioksidan, dan total fenol. Diagram alir persiapan bahan kulit manggis dapat dilihat lengkap pada Lampiran 2.
Sintesis Nanopartikel Ekstrak Kulit Manggis (Modifikasi Rismana et al. 2003) Sintesis nanopartikel dilakukan dengan metode gelasi ionik. Nanopartikel kitosan sebagai penyalut ekstrak kulit manggis dibuat dengan mencampurkan STPP, larutan kitosan, dan ekstrak kulit manggis. Konsentrasi kitosan dibuat dengan konsentrasi 0.2% dan 1%. Pembuatan larutan kitosan dengan konsentrasi 0.2% dilakukan dengan melarutkan 0.2 g kitosan ke dalam 100 mL asam asetat 1%. Sementra itu, larutan STPP 0.2% dibuat dengan mencampurkan 0.2 g natrium tripolifosfat ke dalam 100 mL aquades, begitu pula dengan konsentrasi STPP 0.1%. Pada sintesis nanopartikel, ekstrak kulit manggis dicampurkan sebanyak 10% dalam larutan kitosan yang telah dibuat, lalu diaduk dengan pengaduk megnetik pada kecepatan 750 rpm sampai homogen. Penambahan larutan STPP dilakukan dengan perbandingan antara kitosan dan STPP (1:0.5) dengan cara setetes demi tetes hingga ekstrak tercampur sempurna dan pengadukan dilanjutkan selama 60 menit untuk mendapatkan larutan yang homogen. Dari masing-masing konsentrasi dilakukan karakterisasi fisik dan fungsional meliputi ukurnan partikel, indeks polidispersitas, nilai zeta potensial dengan PSA, morfologi dengan TEM, aktivitas antioksidan, dan kadar total fenol.
Karakterisasi Nanopartikel Ekstrak Kulit Manggis
Karakterisasi nanopartikel meliputi pengukuran distribusi ukuran partikel, indeks polidispersitas, nilai zeta potensial, Transmision Electron Microscopy (TEM), aktivitas antioksidan, dan kadar total fenol.
Enkapsulasi Nanopartikel Ekstrak Kulit Manggis (Modifikasi Desai dan Park 2005)
6
Karakterisasi Enkapsulat Nanopartikel Ekstrak Kulit Manggis
Karakterisasi sifat fisik produk enkapsulasi nanopartikel meliputi pengamatan morfologi permukaan sampel dan pengukuran ukuran partikel hasil rekonstitusi. Proses rekonstitusi dilakukan untuk mendapatkan kembali nanopartikel dalam bentuk cairan yang dilakukan dengan penambahan aquades sejumlah tertentu sehingga dihasilkan kembali larutan dengan kandungan total padatan terlarut sebesar 20%, yaitu sama dengan kondisi sebelum dilakukan pengeringan, setelah itu dilakukan pengukuran terhadap partikel yang terbentuk. Pengukuran distribusi ukuran partikel dilakukan dengan menggunakan alat PSA, sedangkan pengamatan morfologi produk enkapsulasi nanopartikel dilakukan menggunakan alat Scanning Electron Microscopy (SEM). Karakterisasi sifat fungsional dilakukan dengan pengukuran aktivitas antioksidan dan total fenol.
Metode Analisis
Analisis Aktivitas Antioksidan Metode DPPH (Kubo et al. 2002)
Analisis aktivitas antioksidan dilakukan dengan membuat terlebih dahulu kurva standar menggunakan asam askorbat pada konsentrasi 100, 200, 300, 400, 500, dan 600 ppm. Prosedur pembuatan larutan standar sama dengan pengujian dengan sampel, yaitu dengan memasukkan sebanyak 2 mL larutan buffer asetat (pH 5.5) dicampurkan dengan 3.75 mL metanol dan 200 μL DPPH (1mM) kemudian divortex. Setelah itu dimasukkan larutan standar atau sampel sebanyak 50 μL dan divortex kembali selanjutnya baik larutan sampel maupun larutan standar diinkubasi pada suhu ruang di tempat gelap selama 20 menit. Selanjutnya dilakukan pengukuran absorbansi dengan spektrofotometer pada panjeng gelombang 517 nm. Larutan blanko dibuat sesuai tahapan diatas, namun mengganti 100 μL larutan sampel dengan 50 μL metanol. Perhitungan aktivitas antioksidan dapat dinyatakan dalam % aktivitas antioksidan dan AEAC (Ascorbic Equivalen Antioxidant Capacity) dalam satuan mg/mL kurva standar. Rumus yang digunakan adalah sebagai berikut:
% Kapasitas antioksidan =Abs kontrol − Abs sampelAbs Kontrol � %
AEAC (mg as. askorbatg sampel ) = C x VW x FP
Keterangan:
C = Konsentrasi sampel yang didapat dari kurva standar (mg/L) FP = Faktor pengenceran
W = Berat sampel yang digunakan (mg)
Analisis Total Fenol (Strycharz dan Shetty 2002)
7 sampel dalam 2.5 mL aquades dan 0.5 mL etanol, lalu dihomogenisasi dan ditambahkan 2.5 mL larutan reagen. Larutan tersebut didiamkan selama 5 menit dalam ruang gelap, lalu ditambahkan 0.5 mL Na2CO3 5% (agar kondisi basa dan folin bekerja optimum) dan didiamkan kembali dalam ruang gelap selama 1 jam setelah itu diukur nilai absorbansinya pada panjang gelombang 725 nm.
Keterangan :
C = Konsentrasi sampel yang didapat dari kurva standar (mg/L) FP = Faktor pengenceran
W = Berat sampel yang digunakan (mg) FK = Faktor konversi satuan
Analisis Warna (Hutching JB 1999)
Pengukuran warna ekstrak dilakukan dengan alat chromameter. Sebelum dianalisis, ekstrak terlebih dahulu dikemas ke dalam plastik bening kemudian ditempelkan pada detektor digital lalu angka hasil pengukuran akan terbaca pada layar. Pada alat ini angka yang terukur berupa nilai-nilai L, a, b, dan ho (hue), dimana:
L = nilai yang menunjukkan kecerahan berkisar 0-100 a = merupakan warna campuran merah-hijau
a positif (+) antara 0 – 100 untuk warna merah a negatif (-) antara 0 – (-80) untuk warna hijau b = merupakan warna campuran biru-kuning
b positif (+) antara 0 – 70 untuk warna kuning b negatif (-) antara 0 – (-80) untuk warna biru
Nilai ohue kemudian dihitung menggunanakan nilai L, a, b yang telah didapatkan sebelumnya dengan rumus di bawah ini.
h = arc (ba)
Nilai hue yang didapatkan kemudian dicocokkan dengan nilai hue yang ada pada bola imajiner Munsel (Gambar 10), sehingga diperoleh data warna secara objektif. Nilai hue yang diperoleh dari metode Hunter harus berada dalam bentuk nilai derajat radian agar dapat diinterpretasikan kedalam bola imajiner Munsell.
8
Interpretasi warna hue pada bola imajiner Munsell juga dipengaruhi oleh nilai a dan b-nya. Jika nilai hue yang diperoleh pada metode Hunter bernilai negatif maka untuk mengintrepetasikan warnannya pada diagram Munsell, nilai negatifnya dihilangkan terlebih dahulu kemudian diukur pada kuadran yang paling tepat atau sesuai dengan nilai a dan b-nya. Pada kuadran dua nilai a bernilai negatif dan b bernlai positif. Pada kuadran ketiga a dan b sama bernilai negatif. Sedangkan pada kuadran empat, nilai a bernilai positif dan b bernilai negatif. Setelah didapatkan interpretasi warna pada diagram Munsell maka data ini dapat dibandingkan dengan data visual yang tampak.
Tabel 1. Deskripsi warna berdasarkan ohue
oHue Warna sampel
Sebelum dilakukan pengukuran, pH meter dinyalakan dan distabilkan terlebih dahulu selama 10 menit. Selanjutnya pH-meter dikalibrasi menggunakan larutan buffer pH 4 dan pH 7. Elektroda dibilas dengan air destilata dan dikeringkan dengan tisu. Sebanyak 20 mL sampel dimasukkan ke dalam gelas piala 100 mL. Elektroda pH-meter dibilas dengan air destilata, dikeringkan, dan dicelupkan ke dalam sampel. Angka yang tertera pada layar menunjukkan nilai pH pada sampel. Selanjutnya elektroda dibilas kembali dengan air destilata, dikeringkan dan dapat digunakan kembali untuk pengukuran pH sampel. Pengukuran sampel dilakukan dua kali ulangan untuk setiap sampelnya.
Kadar Air (AOAC 2012)
9
% Air = (kehilangan bobot setelah dikeringkan g ) x bobot sampel sebelum dikeringkan g %
Kadar Lemak (AOAC 2012)
Metode yang digunakan adalah metode soxhlet dengan prinsip mengekstrak lemak bebas dengan pelarut non polar. Sebanyak 1 gram sampel dimasukkan ke dalam selongsong kertas yang dialasi dengan kapas. Sumbat selongsong kertas berisi sampel dengan kapas lalu keringkan dalam oven dengan suhu maksimal 80oC selama 1 jam. Selongsong selanjutnya dimasukkan ke dalam alat soxhlet yang telah dihubungkan dengan labu lemak berisi batu didih yang telah dikeringkan dan ditimbang. Sampel diekstraksi dengan pelarut heksana atau pelarut lemak lainnya selama 6 jam lalu heksana disulingkan dan ekstrak dikeringkan dalam oven pada suhu 105oC. Setelah dingin dilakukan penimbangan hingga tercapai bobot tetap. Kadar lemak dinyatakan sebagai persentase basis basah melalui perhitungan dengan rumus berikut:
% Lemak = (W − WW ) x %
Keterangan: W = berat sampel (gram)
W1 = berat lemak sebelum ekstraksi (gram) W2 = berat lemak setelah estraksi (gram) Kadar Protein (AOAC 2012)
Metode yang diggunakan adalah metode Kjedahl dengan prinsip perhitungan jumlah nitrogen total yang kemudian dikali dengan faktor konversi. Sebanyak 250 mg sampel ditempatkan ke dalam labu Kjedahl selanjutnya ditambahkan 1.9 gram K2SO4, 40 mg HgO, 2 mL H2SO4 pekat dan beberapa butir batu didih untuk mencegah bumping. Sampel kemudian dipanaskan secara bertahap hingga memperoleh larutan jernih. Setelah dingin sampel dipindahkan ke labu destilat kemudian ditambahkan 8-10 mL larutan 60% NaOH – 5% Na2S2O3. Pada tabung elenmeyer ditempatkan 5 mL H3BO3 dan beberapa tetes indikator merah metal – biru metil. Labu elenmeyer kemudian ditempatkan di bawah kondensor dengan ujung kondensor terendam di dalam larutan. Proses destilasi dilakukan hingga diperoleh destilat sebanyak 15 mL. Destilat yang didapatkan kemudian diencerkan sampai 50mL dengan akuades, selanjutnya dititrasi dengan larutan HCl 0.02N standar hingga terbentuk warna abu – abu, volume HCl yang terpakai untuk titrasi dicatat. Hal yang sama dilakukan pada larutan blanko. Kadar protein dinyatakan sebagai persentase basis basah melalui perhitungan dengan rumus berikut:
% N = V − V x N HCl x .Berat sampel g x
% Protein = % Nitrogen x .
10
Kadar Abu (AOAC 2012)
Prinsip dari pengujian kadar abu adalah dengan menguraikan zat organik menjadi air dan CO2 sehingga hanya tersisa bahan anorganik. Sebanyak 2 gram sampel ditempatkan ke dalam cawan porselen kemudian dilakukan pengabuan dalam tanur listrik pada suhu maksimal 550oC. Sampel didinginkan di dalam desikator kemudian ditimbang hingga diperoleh bobot tetap. Kadar abu dinyatakan sebagai persentase basis basah melalui perhitungan berikut:
% Abu = (W − WW ) x %
Keterangan: W = berat sampel sebelum diabukan (gram) W1 = berat sampel dan cawan setelah diabukan (gram) W2 = berat cawan kosong (gram)
Kadar Karbohidrat (AOAC 2012)
Perhitungan kadar karbohidrat dilakukan berdasarkan selisih dari kadar air, abu, lemak, dan protein (by difference) karena diasumsikan sebagai bobot sampel selain air, abu, lemak, dan protein. Perhitungan kadar karbohidrat metode by
Rancangan percobaan yang dilakukan terbagi menjadi tiga, yaitu rancangan blok atau kelompok untuk tahap ekstraksi, serta rancangan acak lengkap untuk tahap sintesis nanopartikel dan tahap enkapsulasi nanopartikel. Pada tahap ekstraksi digunakan rancangan blok, yaitu faktor perlakuan (maserasi dan refluks) dengan taraf rasio lama ekstraksi (6 jam dan 24 jam) untuk maserasi dan (1 jam dan 3 jam) untuk refluks. Pada tahap sintesis nanopartikel digunakan rancangan acak lengkap 2x2, yaitu faktor konsentrasi kitosan (0.2% dan 1%) dan taraf rasio konsentrasi STPP (0.1% dan 0.2%). Pada tahap enkapsulasi digunakan rancangan acak lengkap 1x2, yaitu faktor kombinasi antara maltodekstrin (M) dan isolat protein (ISP) atau MISP (60% (M) dan 40% (ISP)) dan maltodekstrin (M) dan Na-kaseinat (K) atau MK (60% (M) dan 40% (K)).
Model matematika adalah sebagai berikut: Yijk = µ + Ai + Bj + ABij+ Ɛijk
11 µ : rata-rata
Ai : efek taraf ke-i faktor A Bj : efek taraf ke-j faktor B
ABij : efek interaksi taraf ke-i faktor A dan taraf ke-j faktor B
Ɛijk : galat percobaan pada taraf ke-i faktor A dan taraf ke-j faktor B serta ulangan ke-k
12
HASIL DAN PEMBAHASAN
Karakteristik Buah Manggis
Salah satu buah yang kulitnya tergolong ke dalam limbah adalah manggis, walaupun kulit buah manggis memiliki khasiat bagi kesehatan. Kulit buah manggis yang digunakan dalam penelitian ini, diproses menjadi tepung dan diekstrak untuk dilakukan lebih lanjut. Analisis proksimat tepung kulit manggis perlu dilakukan untuk mengetahui karakteristiknya. Hasil analisis proksimat yang telah dilakukan dapat dilihat pada Tabel 2.
Tabel 2. Hasil analisis proksimat tepung kulit manggis (%bk) Jenis Analisis Metode Tepung Garcinia
forbesii
Tepung Garcinia mangostana Kadar air Gravimetri 10.49±0.223 10.26±0.134 Kadar abu Gravimetri 4.16±0.033 4.23±0.040
Lemak Soxhlet 11.82±0.130 9.40±0.210
Protein Kjedahl 3.81±0.030 2.83±0.060
Karbohidrat By Different 69.27 73.28
Keterangan : Data merupakan nilai rata-rata±SD (n=2) basis kering, huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada taraf signifikan 0.05
13 karena kandungan asam organik yang lebih tinggi pada Garcinia forbesii dibandingkan dengan Garcinia mangostana memiliki nilai aktivitas antioksidan yang lebih tinggi pula (Randy M 2014). Selain itu, tingginya kandungkan karbohidrat pada tepung Garcinia mangostana dan Garcinia forbesii mengindikasikan bahwa tepung kulit manggis tersebut dapat larut dengan baik di air dan dapat dimanfaatkan dalam industri minuman, seperti jus dan minuman instan.
Ekstraksi Kulit Manggis
Ekstraksi merupakan suatu proses pemisahan campuran beberapa zat menjadi komponen-komponen yang terpisah. Zat-zat yang polar hanya larut dalam pelarut polar, sedangkan zat-zat yang non polar hanya larut di dalam pelarut non polar. Tingkat kepolaran pelarut yang digunakan sangat menentukan jumlah zat
aktif karena pada proses ekstraksi berlaku prinsip “like dissolve like” dimana zat hanya akan terlarut dengan baik dan terekstrak apabila pelarut yang digunakan memiliki tingkat kepolaran yang sama. Prinsip ekstraksi suatu bahan berdasarkan prinsip kesetimbangan massa, yaitu yang melibatkan dua fasa yang berbeda, kemudian solut atau komponen tersebut ditransfer ke salah satu fasa yang lain sehingga interaksi akibat tingkat kepolaran yang sama mengakibatkan proses ekstraksi dapat terjadi secara terus menerus sampai diperoleh suatu kesetimbangan massa antara fasa satu dengan yang lain (Wijaya LA 2010). Metode ekstraksi yang sering digunakan antara lain perkolasi, maserasi, soklet, refluks, dan kromatografi. Cara ekstraksi dengan maserasi (metode dingin) dan refluks (metode panas) sering digunakan karena lebih mudah dan praktis. Pada proses ekstraksi dalam penelitian ini digunakan metode maserasi dan refluks yang diikuti dengan penyaringan.
14
Garcinia forbesii. Dengan demikian, metode ekstraksi yang dilakukan mengacu pada penelitian Wijaya LA (2010) dan Dewandari et al. (2013) menggunakan dua metode, yaitu maserasi dan refluks dengan pelarut etanol 70%. Pelarut etanol 70% digunakan karena selain merupakan pelarut yang universal digunakan, dasar pemilihan lainnya adalah memiliki tingkat toksisitas yang lebih rendah dibandingkan dengan pelarut semi polar lainnya, dan juga memiliki aktivitas antimikroba. Hasil ekstraksi tepung Garcinia forbesii dan tepung Garcinia mangostana pada metode maserasi dan refluks dapat dilihat pada Tabel 3.
Tabel 3. Hasil eksraksi tepung kulit manggis
Parameter Sampel Maserasi Refluks
6 jam 24 jam 1 jam 3 jam
GF : Garcinia forbesii (Kulit manggis merah)
GM : Garcinia mangostana (Kulit manggis mangostana)
Data merupakan nilai rata-rata±SD (n=2), huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada taraf signifikan 0.05
15 karena suhu panas yang dibutuhkan oleh pelarut etanol 70% untuk mencapai titik didih yang dapat malarutkan komponen zat aktif yang tidak terekstrak pada metode maserasi (metode tanpa panas) (Dewandari 20013).
Aktivitas antioksidan merupakan nilai yang menunjukkan kemampuan senyawa dalam sampel dalam menangkal radikal bebas dan mencegah terjadinya oksidasi. Nilai aktivitas antioksidan diukur berdasarkan perhitungan dengan standar asam askorbat. Hasil pengukuran aktivitas antioksidan ekstrak Garcinia forbesii dengan metode refluks 1 jam dan 3 jam serta maserasi 6 jam dan 24 jam berturut-turut adalah 13425(μg/mL), 13100(μg/mL), 2550(μg/mL), dan 5550(μg/mL). Sementara itu, hasil pengukuran aktivitas antioksidan ekstrak Garcinia mangostana dengan metode refluks 1 jam dan 3 jam serta maserasi 6 jam dan 24 jam berturut-turut adalah 12425(μg/mL), 10200 (μg/mL), 2375(μg/mL), dan 4975(μg/mL). Hal ini menunjukkan nilai aktivitas antioksidan tertinggi pada Garcinia forbesii serta Garcinia mangostana diperoleh menggunakan metode refluks 1 jam lebih baik dibandingkan dengan metode refluks 3 jam maupun maserasi. Hasil aktivitas antioksidan dengan metode refluks lebih tinggi dibandingkan maserasi karena dengan refluks (metode panas) dapat meningkatkan jumlah rendemen karena suhu panas yang dibutuhkan oleh pelarut etanol 70% untuk mencapai titik didih yang dapat malarutkan komponen zat aktif yang tidak terekstrak pada metode maserasi (metode tanpa panas) (Dewandari 2013). Selain itu, nilai aktivitas antioksidan pada metode refluks 3 jam lebih rendah dibandingkan dengan metode refluks 1 jam, hal ini dapat disebabkan walaupun panas dan pelarut etanol yang digunakan dapat mengoptimalkan ektraksi senyawa aktif, namun semakin lama waktu dan panas yang digunakan dalam ekstraksi dapat merusak antioksidan senyawa aktifnya. Salah satu antioksidan dalam kulit manggis yaitu flavonoid yang merupakan golongan fenol memiliki sistem konjugasi dapat mudah rusak pada suhu tinggi yang terlalu lama.
16
forbesii yang lebih rendah dari Garcinia mangostana, memberikan nilai aktivitas antioksidan yang lebih tinggi dan tidak terlalu berbeda dengan nilai aktivitas antioksidan Garcinia mangostana. Menurut Randy (2014), kandungan air yang lebih tinggi pada kulit manggis merah Garcinia forbesii memberikan pH yang asam yang lebih tinggi karena kandungan asam organik yang sangat kuat seperti asam malat, asam tartarat, asam sitrat, dan asam asetat. Kandungan asam yang tinggi tersebut sangat berperan dalan mempengaruhi nilai aktivitas antioksidannya karena kandungan asam organik yang lebih tinggi pada Garcinia forbesii dibandingkan dengan Garcinia mangostana, sehingga Garcinia forbesii memiliki nilai aktivitas antioksidan yang lebih tinggi (Randy M 2014).
Tabel 4. Hasil chromameter ekstrak kulit manggis dari berbagai metode
Parameter Sampel Maserasi Refluks
6 jam 24 jam 1 jam 3 jam
L GF 30.83 ± 0.000
a 30.93 ± 0.054a 31.19 ± 0.042b 25.12 ± 0.029c GM 49.87 ± 0.021d 52.13 ± 0.022e 45.80 ± 0.049f 43.78 ± 0.017g
a GF 33.42 ± 0.029a 32.84 ± 0.074b 28.34 ± 0.028c 16.00 ± 0.068d
GM 5.05 ± 0.008e -0.06 ± 0.025f 3.63 ± 0.017g 2.22 ± 0.012h
b GF 12.98 ± 0.009
a 13.03 ± 0.019b 12.69 ± 0.012c 5.20 ± 0.017d GM 19.60 ± 0.012e 14.92 ± 0.034f 16.23 ± 0.016g 9.31 ± 0.016h
Hue (h o) GM GF 21.22 75.16 21.64 89.77 24.12 77.39 18.00 76.59
GF Merah Merah Merah Merah
Warna GM Kuning Kuning Kuning Kuning
kemerahan kemerahan kemerahan kemerahan
Data merupakan nilai rata-rata±SD (n=2), huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada taraf signifikan 0.05
Gambar 3. Ekstrak Garcinia forbesii (atas) dan Garcinia mangostana (bawah) Maserasi 6 jam Maserasi 24 jam Refluks 1 jam Refluks 3 jam
17 Secara visual, hasil ekstraksi dengan metode maserasi dan refluks menghasilkan tingkat warna dan kekentalan yang berbeda. Terlihat pada gambar bahwa Garcinia forbesii menghasilkan warna merah gelap. Namun, pada ekstrak Garcinia mangostana yang dihasilkan lebih berwarna kuning kemerahan. Pada hasil Garcinia mangostana dengan metode refluks 3 jam menghasilkan warna yang lebih gelap dan lebih pekat dibandingkan dengan metode refluks 1 jam, begitu pula dengan metode maserasi. Sementara itu, pada kulit manggis merah dengan metode refluks dan maserasi menghasilkan ekstrak Garcinia forbesii yang berwarna merah tua. Namun pada metode refluks ekstrak Garcinia forbesii lebih pekat dibandingkan dengan maserasi. Berdasarkan hasil analisis rendemen, aktivitas antioksidan, total fenol, dan warna maka dipilih metode refluks 1 jam untuk digunakan pada tahap selanjutnya yaitu sintesis nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana.
Sintesis Nanopartikel Kulit Manggis
Nanopartikel merupakan salah satu formulasi suatu partikel yang terdispersi pada ukuran nanometer. Kitosan merupakan polimer yang cukup populer sering digunakan dalam sistem nanopartikel. Kitosan lebih banyak dipilih karena memiliki sifat yang khas dibandingkan polimer yang lain. Kitosan dilaporkan memiliki kemampuan untuk membuka kait antar sel (tight junction) pada membran usus secara sementara (Bhardwaj dan Kumar 2004; Martien et al. 2008) sehingga sangat potensial dikembangkan sebagai bahan untuk pembuatan nanopartikel dalam aplikasi penghantar terkontrol suatu zat aktif. Selain itu, kitosan yang memiliki muatan positif pada gugus amonium dapat berinteraksi ionik dengan asam sialat pada membran intestinal saluran cerna (Vllasaliu et al. 2010). Kitosan juga bersifat biodegradable dan biokompatibel karena kitosan merupakan polimer yang diperoleh dari hidrolisis polimer kitin yang berasal dari sumber alam pada cangkang hewan laut, bersifat food grade, memiliki toksisitas yang rendah, dan metode preparasi yang sederhana (Tiyaboonchai 2003). Kemampuan kitosan dalam pembuatan nanopartikel sudah banyak diteliti, diantaranya nanopartikel paclitaxel suatu obat antikanker dengan ukuran 116 nm (Li et al. 2012), ampisilin trihidrat (Saha et al. 2010); kombinasi 5-fluorourasil dan leucovorin suatu obat anti kanker
18
kolon dengan ukuran partikel 40.73-78.53 nm (Li et al. 2012), deksametason, natrium fosfat suatu obat antiinflamasi dengan ukuran partikel 250-350 nm (Dustgani et al. 2008).
Metode pembuatan nanopartikel kitosan sederhana, yaitu dengan metode gelasi ionik. Gelasi ionik merupakan sifat interaksi kation kitosan dengan polianion khusus. Kitosan memiliki gugus asam amino dengan pKa 6.2-7 yang bersifat basa (Kumar 2000). Kitosan dapat larut dalam pH asam dibawah pH 6, seperti asam asetat, asam format, dan asam laktat. Kitosan yang dilarutkan dalam pH asam mengubah gugus amin (-NH2) menjadi (-NH3+). Gugus yang terionisasi positif tersebut dapat berinteraksi secara ionik dengan zat yang bermuatan negatif (Bhumkar dan Pokharkar 2006). Gugus amonium yang bebas akan saling tolak menolak sehingga dapat melemahkan kompleks nanopartikel yang terbentuk. Sehingga, diperlukan adanya pengikat silang (crosslinker) yang mampu menstabilkan muatan positif tersebut. Pengikat silang yang diperlukan harus berupa polianion, sehingga dapat membentuk interaksi ionik. Sodium Tripolifosfat (STPP) merupakan salah satu poliaion yang banyak digunakan, dimana larut dalam air mengion membentuk ion hidroksil dan ion tripolifosfat (Bhumkar dan Pokharkar 2006; Kafshgari et al. 2011). Reaksi sambung silang secara ionik terjadi antara ion tripolifosfat (polianion) dan gugus amin -NH3+ (kation) (Ko et al. 2010; Bhumkar dan Pokharkar 2006). (Gambar 3). Semakin banyak terjadi reaksi sambung silang ionik antara kitosan dan STPP, maka semakin banyak molekul nanopartikel zat aktif yang terbentuk dan terjerap. Pada penelitian Yu Sin Lin et al. (2008) melaporkan bahwa STPP sebagai polianion berinteraksi membentuk ikatan silang dengan kitosan yang bersifat kation akan membentuk nanopartikel yang lebih stabil dan memiliki penembusan membran yang lebih baik.
Nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana disintesis menggunakan metode gelasi ionik dengan magnetik strirrer tanpa panas. Hasil pengujian nanopartikel Garcinia forbesii dan Garcinia mangostana terhadap karakteristik sifat fisik dan fungsional pada beberapa formula konsentrasi kitosan dan STPP dapat dilihat pada Tabel 5. Data lengkap dapat dilihat pada Lampiran 16. Table 5. Hasil analisis karakterisasi nanopartikel
Formula Keterangan : Data merupakan nilai rata-rata±SD (n=2), huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada taraf signifikan 0.05. GF: Garcinia forbesii, GM: Garcinia mangostana, F1: 0.2% kitosan dan 0.2% STPP,
19 Hasil analisis pada Tabel 5 menunjukkan formula F2 yaitu konsentrasi kitosan 0.2% dan STPP 0.1% memiliki ukuran partikel terbaik karena paling kecil dibandingkan formula lainnya baik pada Garcinia forbesii maupun Garcinia mangostana. Pada konsentrasi kitosan yang berbeda (0.2% dan 1%) dengan konsentrasi STPP yang sama menunjukkan semakin tinggi konsentrasi kitosan terjadi peningkatan ukuran partikel. Menurut (Wahyono 2010) semakin tinggi konsentrasi kitosan dengan jumlah STPP yang sama menyebabkan peningkatan ukuran partikel disebabkan aglomerasi pada molekul kitosan, karena partikel yang terbentuk karena interaksi kitosan dan STPP lebih banyak dan semakin padat, sehingga partikel cenderung bergerombol dan beraglomerasi membentuk agregat menjadi partikel yang lebih besar berukuran mikro. Peningkatan ukuran partikel juga bisa dipengaruhi oleh kondisi pH, volume, dan kecepatan pengadukkan stirrer. Variasi pH akan mempengaruhi ionisasi kitosan yang akan mempengaruhi pada kekuatan ikatan pada kompleks nanopartikel yang terbentuk (Lopez-Leon et al. 2005). Pada pH rendah tripolifosfat banyak terionisasi ke dalam bentuk ion tripolifosfat dibandingkan dengan ion hidroksil, sedangkan pada pH basa sebaliknya, sehingga pada pH basa terbentukknya ikatan silang semakin rendah dan menyebabkan ukuran partikel menjadi lebih besar. Ukuran partikel nanopartikel yang disepakati secara umum memiliki ukuran di bawah 1 mikron (Tiyaboonchai 2003; Buzea et al. 2007), namun ukuran dibawah 500 nm memiliki karakteristik yang lebih baik. Berdasarkan nilai ukuran partikel dipilih formula F2 dengan konsentrasi kitosan 0.2% dan STPP 0.1%.
Nilai indeks polidispersitas menunjukkan keseragaman ukuran partikel. Menurut Yuan et al. (2008), semakin kecil nilai indeks polidispersitas maka ukuran partikel semakin homogen. Menurut Avadi et al. (2010), nilai indeks polidispersitas lebih besar dari 0.5 menunjukkan heterogenitas yang tinggi, dan sebaliknya jika mendekati nilai 0 menunjukkan ukuran partikel yang seragam. Hasil pengujian indeks polidispersitas formula terpilih F2 pada Garcinia forbesii maupun Garcinia mangostana memiliki nilai indeks polidispersitas kurang dari 0.5, hal ini menunjukkan ukuran partikel nanopartikel sampel formula F2 tersebut masih seragam. Ukuran partikel yang tidak seragam dapat disebabkan karena kecenderungan partikel untuk beraglomerasi membentuk agregat partikel yang lebih besar. Faktor yang menyebabkan hal tersebut dapat terjadi diantaranya adalah formula kombinasi kitosan dan STPP, pH larutan, kecepatan pengadukan stirrer, volume saat pengadukan dengan strirrer.
F1 F2 F3 F4
F1 F2 F3 F4
(A) (B)
20
Pengukuran aktivitas antioksidan dan total fenol diperlukan untuk mengetahui pengaruh proses sintesis nanopartikel terhadap perubahan sifat fungsionalnya. Aktivitas antioksidan yang terukur dapat diartikan sebagai kemampuan sampel yang mengandung zat aktif yang memiliki aktivitas antioksidan dalam menahan atau memperlambat reaksi oksidasi dengan mereduksi seyawa radikal bebas yang dipengaruhi oleh banyaknya kandungan zat antioksidan yang terkandung didalamnya. Pengukuran aktivitas antioksidan diukur dengan menggunakan metode DPPH. Prinsipnya adalah senyawa DPPH sebagai senyawa radikal akan tereduksi oleh senyawa antioksidan yang ditunjukkan oleh perubahan warna larutan reaksi yang semakin pudar. Semakin tinggi kandungan zat antioksidan dalam sampel, maka semakin besar nilai aktivitas antioksidannya. Nilai total fenol menunjukkan seberapa banyak kandungan senyawa fenolik dalam sampel. Senyawa fenolik juga memiliki aktivitas antioksidan karena memiliki gugus hidroksil fenolik yang mempu mereduksi senyawa radikal, namun tidak semua senyawa yang memiliki nilai aktivitas antioksidan merupakan senyawa fenolik. Senyawa lain yang memiliki aktivitas antioksidan selain senyawa fenolik, yaitu vitamin C, vitamin B, protein, dan lainnya. Nilai aktivitas antioksidan dihitung berdasarkan jumlah asam askorbat sebagai standar, sedangkan nilai total fenol dihitung berdasarkan jumlah asam galat sebagai standar.
Hasil analisis sifat fungsional tersebut dilakukan berdasarkan jumlah ekstrak sebesar 10% dari total larutan nanopartikel karena merupakan jumlah optimal dalam penerapan zat aktif dalam nanopartikel kulit manggis (Rismana et al. 2003). Hasil pengujian aktivitas antioksidan, menunjukkan formula F2 (konsentrasi kitosan 0.2% dan STPP 0.1%) baik pada sampel nanopartikel GF dan GM memberikan nilai aktivitas antioksidan tertinggi, yaitu 5729.17±198.742 AEAC
μg/mL dan 4562.50±198.737 AEAC μg/mL. Hasil analisis total fenol juga menunjukkan nilai yang tinggi, yaitu sebesar 1714.67±16.304 GAE μg/mL dan 2711.96±13.587 GAE μg/mL. Berdasarkan jumlah ekstrak dalam larutan nanopartikel, nilai sifat fungsional nanopartikel mengalami peningkatan. Hal ini menunjukkan bahwa sintesis nanopartikel yang membuat ukuran partikel semakin kecil (berukuran nanometer) akan meningkatkan luas permukaan partikel sehingga permeabilitasnya meningkat, hal ini mengakibatkan aktivitas antioksidannya juga meningkat. Selain itu, semakin tinggi kandungan senyawa fenolik dalam sampel juga meningkatkan aktivitas antioksidannya karena kamampuan senyawa fenolik dalam mereduksi senyawa radikal bebas berkorelasi dalam memiliki sifat aktivitas antioksidan.
21 permukaan sehingga kekuatan elestrostatik antar partikel semakin kuat menimbulkan ketidakstabilan. Menurut Alishashi et al. (2011) nilai positif pada zeta potensial menunjukkan adanya gugus amino dari kitosan pada permukaan partikel. Berdasarkan hasil analisis karakterisasi sifat fisik dengan PSA dan sifat fungsionalnya maka dipilih formula F2 (konsentrasi kitosan 0.2% dan STPP 0.1%) untuk tahapan selanjutnya. Hasil pengamatan nanopartikel GF dan GM dapat dilihat pada Gambar 6. dan Gambar 7.
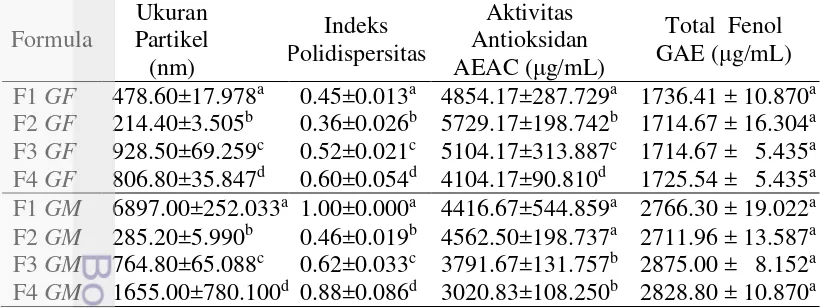
Karakterisasi morfologi nanopartikel dilakukan dengan menggunakan TEM (Transmission Electron Microscopy) sehingga penglihatan pada perbesaran dapat dilakukan secara tembus permukaan partikel. Karakterisasi menggunakan TEM dapat meningkatkan kualitas gambar sehingga jika terjadi penumpukkan pada perbesaran sampel tetap dapat dilihat ukuran dan bentuknya. Hasil analisis menunjukka bahwa bentuk nanopartikel kurang seragam, selain itu pada perbesaran 9700 x maupun 5000 x terlihat ukuran partikel nanopartikel GF terlihat lebih kecil kurang dari 1μm dibandingkan dengan nanopartikel GM. Hal ini dapat disebabkan karena pengaruh pH pada sampel, dimana pH nanopartikel GM lebih tinggi dibandingkan dengan nanopartikel GF. Hal ini menyebabkan kekuatan ikatan ionik semakin rendah dan mengakibatkan kecenderungan unruk beraglomerasi membentuk agregat partikel yang lebih besar sehingga ukuran partikel menjadi lebih besar. Berdasarkan hasil terbaik karakteristik sifat fisik dan fungsional dari beberapa formula nanopartikel tersebut adalah kitosan dengan konsentrasi 0.2% dan STPP 0.1%. Formula ini selanjutnya dilakukan spray drying dengan bahan penyalut kombinasi antara MISP (maltodekstrin 60% dan isolat protein kedelai 40%) dan MK (maltodekstrin 60% dan Na-kaseinat 40%).
Gambar 6. Hasil analisis TEM nanopartikel ekstrak Garcinia forbesii GF
Gambar 7. Hasil analisis TEM nanopartikel ekstrak Garcinia mangostana GM 5000 x
9700 x
9700 x 5000 x
500 nm
500 nm 1 um
22
Spray Drying Nanopartikel Ekstrak Kulit Manggis
Enkapsulasi nanopartikel juga dapat meningkatkan kelarutan karena luas permukaannya yang besar, mengontrol pelepasan zat bioaktif dalam tubuh, serta melindungi dari interaksi dengan zat lain dalam bahan pangan (Ahmed et al. 2012). Metode enkapsualasi yang paling umum digunakan adalah metode pengering semprot (spray dryer), dengan alasan lebih sederhana penggunaannya. Bahan penyalut yang umumnya digunakan adalah maltodekstrin. Maltodekstrin dipilih karena memiliki kelarutan yang tinggi. Penggunaan kombinasi bahan penyalut bertujuan untuk mendapatkan nanopartikel sebagai sistem penghantar zat aktif terkontrol yang lebih optimal. Selain maltodekstrin, menurut Gunasekaran et al. (2007) bahan penyalut seperti protein juga dapat digunakan karena sifat yang dapat membentuk gel sehingga memungkinkan sebagai bahan enkapsulasi zat aktif baik lipofilik maupun hidrofilik. Selain itu, menurut Chen et al. (2006) protein juga melindungi senyawa aktif yang sensitif terhadap kondisi di saluran pencernaan, sehingga dapat menjadi penghantar zat aktif secara terkontrol. Na-kaseinat dan isolat protein kedelai dipilih sebagai kombinasi bahan penyalut karena ketersediaannya yang melimpah dan murah.
Spray drying adalah metode untuk memperoleh serbuk dari suatu campuran atau larutan atau suspensi. Metode ini didasarkan pada pengeringan tetesan atomisasi pada aliran udara panas. Atomisasi dari penyemprotan melewati nozzle kecil membuat adanya tetsan kecil, lalu pelarut akan terevaporasi karena aliran udara panas secara cepat sehingga terbentuk partikel kering. Ukuran partikel tergantung pada ukuran nozzle, laju alir, tekanan atomisasi, suhu udara. Pengamatan morfologi dari bubuk partikel dilakukan dengan alat SEM (Scanning Electron Microscopy). Hasil pengamatan bubuk enkapsulat nanopartikel GF dan GM dengan bahan penyalut kombinasi antara maltodekstrin dengan isolat protein (MISP) dan maltodekstrin dengan Na-kaseinat (MK) dapat dilihat pada (Gambar 8), (Gambar 9), dan (Gambar 10).
A B
23
Pada nanopartikel dengan formula terpilih berdasarkan karakteristik fisik dan sifat fungsionalnya adalah formula dengan konsentrasi kitosan 0.2% dan STPP 0.1% selanjutnya telah dilakukan spray drying dengan bahan penyalut kombinasi antara MISP (maltodekstrin 60% dan isolat protein kedelai 40%) dan MK (maltodekstrin 60% dan Na-kaseinat 40%). Hasil dari proses spray drying dengan bahan penyalut MISP dan MK masing-masing memberikan rendemen dengan kualitas A (rendemen tertampung pada wadah spray dryer utama) berturut turut sebesar 18.67% dan 13.54%, sedangkan total rendemen seluruhnya atau penjumlahan rendemen dengan kualitas A dan kualitas B (rendemen menempel sebagian di dinding spray dryer), yaitu berturut-turut sebesar 27.63% dan 16.56%. Perbedaan rendemen yang dihasilkan pada masing-masing perlakuan bahan penyalut berbeda. Perlakuan bahan penyalut MK memiliki nilai total rendemen yang lebih kecil dibandingkan dengan bahan penyalut MISP. Rendemen yang berbeda tersebut dapat dipengaruhi oleh perbedaan nilai DE (Dextrose Equivalent), artinya nilai DE yang lebih tinggi menimbulkan kecenderungan terjadinya karamelisasi yang semakin tinggi saat dilakukan spray dryer dengan suhu tinggi, sehingga banyak yang menempel di dinding tabung spray dryer yang mengakibatkan penurunan rendemen (Richana et al. 2007).
24
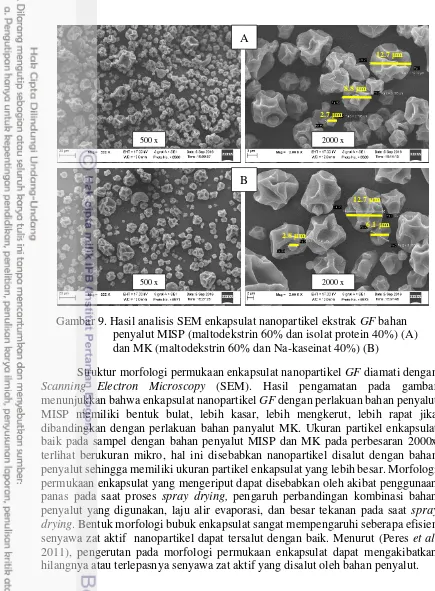
Struktur morfologi permukaan enkapsulat nanopartikel GF diamati dengan Scanning Electron Microscopy (SEM). Hasil pengamatan pada gambar menunjukkan bahwa enkapsulat nanopartikel GF dengan perlakuan bahan penyalut MISP memiliki bentuk bulat, lebih kasar, lebih mengkerut, lebih rapat jika dibandingkan dengan perlakuan bahan panyalut MK. Ukuran partikel enkapsulat baik pada sampel dengan bahan penyalut MISP dan MK pada perbesaran 2000x terlihat berukuran mikro, hal ini disebabkan nanopartikel disalut dengan bahan penyalut sehingga memiliki ukuran partikel enkapsulat yang lebih besar. Morfologi permukaan enkapsulat yang mengeriput dapat disebabkan oleh akibat penggunaan panas pada saat proses spray drying, pengaruh perbandingan kombinasi bahan penyalut yang digunakan, laju alir evaporasi, dan besar tekanan pada saat spray drying. Bentuk morfologi bubuk enkapsulat sangat mempengaruhi seberapa efisien senyawa zat aktif nanopartikel dapat tersalut dengan baik. Menurut (Peres et al. 2011), pengerutan pada morfologi permukaan enkapsulat dapat mengakibatkan hilangnya atau terlepasnya senyawa zat aktif yang disalut oleh bahan penyalut.
A
B
Gambar 9. Hasil analisis SEM enkapsulat nanopartikel ekstrak GF bahan penyalut MISP (maltodekstrin 60% dan isolat protein 40%) (A) dan MK (maltodekstrin 60% dan Na-kaseinat 40%) (B)
500 x 2000 x
500 x 2000 x
8.8 μm
12.7 μm
2.7 μm
12.7 μm
2.8 μm
25
Hasil pengamatan pada gambar morfologi permukaan enkapsulat nanopartikel GM dengan bahan penyalut MISP maupun MK terlihat morfologi permukaannya bulat, mengalami pengerutan, permukaan kasar, dan bentuknya cenderung tidak seragam. Hal ini juga dapat disebabkan oleh adanya pengaruh panas pada saat proses spray drying, pengaruh perbandingan kombinasi bahan penyalut yang digunakan, laju alir evaporasi, dan besar tekanan pada saat spray drying. Hal ini juga dapat menyebabkan senyawa zat aktif dari nanopartikel GM dapat hilang karena tidak terperangkap dengan baik. Faktor yang mempengaruhi bentuk morfologi bubuk enkapsulat menurut Harris et al. (2011) adalah suhu inlet dan laju evaporasi pelarut saat proses spray drying. Menurut Deladino et al. (2008), suhu pemanasan yang tinggi pada spray drying juga dapat menyebabkan hilangnya senyawa aktif sehingga permukaan menjadi lebih kasar, mengkerut, dan padat. Bentuk morfologi produk enkapsulasi yang optimal adalah berbentuk bola dengan permukaan halus, yang menunjukkan nanopartikel zat aktif dapat terperangkap dengan baik. Pengerutan yang terjadi pada morfologi permukaan partikel keempat sampel enkapsulat tersebut mempengaruhi banyaknya senyawa zat aktif nanopartikel yang tersalut. Hal ini berkorelasi dengan nilai sifat fungsionalnya, yaitu hasil analisis aktivitas antioksidan dan total fenol keempat sampel bubuk enkapsulat tersebut. Hasil analisis sifat fungsional bubuk enkapsulat keempat sampel dapat dilihat pada Tabel 7.
A
B
500 x 2000 x
500 x 2000 x
Gambar 10. Hasil analisis SEM enkapsulat nanopartikel ekstrak GM bahan penyalut MISP (maltodekstrin 60% dan isolat protein 40%) (A) dan MK (maltodekstrin 60% dan Na-kaseinat 40%) (B)
7.03 μm
19.82 μm
3.05 μm
19.82 μm
26
Tabel 7. Hasil analisis sifat fungsional enkapsulat nanopartikel GF dan GM Sampel Metode Perlakuan Keterangan : Data merupakan nilai rata-rata±SD (n=2), huruf yang sama pada kolom menunjukkan tidak berbeda nyata pada taraf signifikan 0.05
M : Maltodekstrin ISP: Isolat protein K : Na-kaseinat
Nanopartikel yang telah dienkapsulasi oleh bahan penyalut MISP dan MK dilakukan pengukuran nilai sifat fungsionalnya. Pengujian sifat fungsional yang diukur meliputi aktivitas antioksidan dan total fenol dilakukan untuk mengetahui apakah terjadi perubahan sifat fungsional selama proses spray drying. Nilai aktivitas antioksidan menunjukkan kemampuan suatu senyawa antioksidan dalam menghambat oksidasi suatu senyawa lain dengan mereduksi senyawa radikal bebas. Nilai total fenol menunjukkan seberapa banyak kandungan senyawa fenolik dalam sampel. Senyawa fenolik juga memiliki aktivitas antioksidan karena memiliki gugus hidroksil fenolik yang mempu mereduksi senyawa radikal, namun tidak semua senyawa yang memiliki nilai aktivitas antioksidan merupakan senyawa fenolik. Senyawa lain yang memiliki aktivitas antioksidan selain senyawa fenolik, yaitu vitamin C, vitamin B, protein, dan lainnya. Nilai aktivitas antioksidan dihitung berdasarkan jumlah asam askorbat sebagai standar, sedangkan nilai total fenol dihitung berdasarkan jumlah asam galat sebagai standar.
27
SIMPULAN
Ekstrak Garcinia forbesii maupun Garcinia mangostana diketahui mengandung senyawa fenolik seperti xanthon, tanin, antosianin. Ekstraksi dengan menggunakan metode refluks 1 jam memberikan hasil yang lebih baik dibandingkan dengan maserasi berdasarkan parameter rendemen dan sifat fungsionalnya. Formula nanopartikel ekstrak Garcinia forbesii dan Garcinia mangostana yang terpilih yaitu pada konsentrasi kitosan 0.2% dan STPP 0.1% memberikan hasil sifat fisik dan fungsional yang terbaik dengan nilai ukuran partikel 214.4 ± 3.505 nm dan 285.2 ± 5.990 nm. Pengeringan dengan spray drying menggunakan bahan penyalut kombinasi antara maltodekstrin 60% dengan isolat protein kedelai 40% (MISP) dan maltodekstrin 60% dengan Na-kaseinat 40% (MK) menunjukkan bentuk morfologi bulat keriput, dengan permukaan kasar, mengalami pengerutan, dan bentuk tidak seragam. Hasil uji rekonstitusi enkapsulat memberikan peningkatan ukuran nanopartikel. Hasil analisis sifat fungsional masing-masing enkapsulat dengan bahan penyalut MK memberikan ukuran partikel hasil rekonstitusi yang lebih kecil, nilai akivitas antioksidan dan total fenol yang lebih tinggi dibandingkan dengan bahan panyalut MISP, hal ini menunjukkan zat aktif nanopartikel dapat terlindungi dengan baik dengan bahan penyalut MK. Penggunaan dosis nanopartikel yang kecil dapat diterapkan dalam aplikasinya ke dalam pangan, karena dengan dosis yang kecil dapat memberikan nilai aktivitas antioksidan yang tinggi.
SARAN
28
DAFTAR PUSTAKA
Ahmed K, Yan L, Davd JM, Hang X. 2012. Nanoparticle and emulsion based delivery system for curcumin : Encapsulation and release properties. Journal of Food Chemistry (132) : 799-807.
Alishasi A, Mirvaghefi A, Tehrani MR, Farahmand H, Shojaosadati SA, Dorkoosh FA, Elsabee MZ. 2011. Shelf life and delivery enhancement of vitmin C using chitosan nanoparticle. Journal of Food Chemistry 126 : 953-940. [AOAC] Association of Official Analytical Chemists. 2012. Official Methods of
Analysis 16th Ed. Arlington (US): Virginia A.
Avadi MR, Assal MMS, Nasser M, Saidah A, Fatemeh A, Rassoul D, and Morteza R. 2010. Preparation and characterization of insulin nanoparticle using chitosan and arabic gum with ionic gelation method. Journal of Nanomedicine: Nanotechnology Biology and Medicine 6 : 58-63.
Bhardwaj MR, Ghassemi AH, Sadeghi AMM, Erfan M, Akbarzadeh A, Moghimi HR, and Tehrani MR. 2004. Preparation and Characterization of Theophylline-Chitosan Beads as an Approach to Colon Delivery, Iran. Journal of Pharmaceutic 2: 73-80.
Bhumkar DR, and Pokharkar VB. 2006. Studies on effect of pH on cross-linking of chitosan with sodium tripolyphosphate: A Technical Note. Journal of Pharmaceutica Technology 7 (2): E1-E6.
Buzea C, Blandino IIP, and Robbie K. 2007. Nanomaterial and nanoparticle: sources and toxicity, Biointerphase 2: MR170-MR172.
Chen L, Gabriel EM, Murie S. 2006. Food protein-based materials as nutraceutical delivery systems. Trends in Food Science and Technology 7 : 272-283. Deladino L, Anbinder PS, Navarro AS, and Martino MN. 2008. Encapsulation of
natural antioxidants extract from Ilex paraguariesnsis. Journal of Carbohydr Polym 1 (1) : 126-134.
Dewandari KK, Yuliani S, Yasni S. 2013. Ekstraksi dan Karakterisasi Nanopartikel Eksrak Sirih Merah (Piper crocatum). Jurnal Pascapanen 10(2) : 65-71. Desai GH, Park HJ. 2005. Recent development in microencapsulation of food
ingredients. Journal of Dry Technology 23: 1361-1394.
29 Dustgani A, Ebrahim V, Mohammad I. 2008. Preparation of chitosan nanoparticles loaded by dexamethasone phosphat. Journal of Pharmaceutical Science 4(2) : 111-114.
Gulseren I, Yuan Fang, Milena C. 2007. Zinc incorporation capacity of whey protein nanoparticles prepared with desolvation with ethanol. Journal of Food Chemistry 135 (2): 770-774.
Gunasekaran S, Sanghoon Ko, Lan Xiao. 2007. Use of whey protein foe encapsulation and controlled delivery applications. Journal of Food Engineering 83 : 31-40.
Gupta RB, and Kompella UB. 2006. Nanoparticle Technology Of Drug Delivery. New York (US): Taylor and Francis Grup.
Harris R, Lecumberri E, Mateos A, Mengibar M, Heras A. 2011. Chitosan nanoparticles and microsphere for the encapsulation of natural antioxidants extracted from Ilex paraguariensis. Journal of Carbohydrate Polymers 84 : 803-806.
Hutching JB. 1999. Food Colour And Appearance 2nd Edition. Gaithersburg (US) : Aspen publisher.
Kafshgari MH, Khorram M, Khodadoost M, Khavari S. 2011. Reinforcement of chitosan nanoparticles obtained by an ionic cross-linking process. Iran. Journal of Polymers 20 (5): 445-456.
Ko S, and Lee SC. 2010. Effect of nanoliposomes on the stabilization of incorporated retinol. African Journal of Biotechnology 9 (37): 6158-6161. Kubo I, Masuoka N, Xiao P, Haraguchi H. 2002. Antioxidant activity of dodecyl
gallate. Journal of Agricultural Food Chemistry (50) : 3533-3539.
Kumar M, Bakowsky U, and Lehr C. 204. Preparation and characterizaton of catonic PLGA nanospheres as dna carriers. Journal of Biomaterial 25 : 1771-1777.
Lako et al. 2007. Phytochemical flavonols, carotenoids and the oxidant properties of a wide selection of fijian fruit, vegetables and other readily available foods. Journal of Food Chemistry (101) : 1727-1741.
Li J and Qingrong Y. 2012. Rheological properties of chitosan–tripolyphosphate complexes: From suspensions to microgels. Journal of Carbohydrate Polymers 87: 1670– 1677.